| Барий | |
|---|---|
| Мягкий, вязкий серебристо-белый металл | |

Барий в пробирке |
|
| Название, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) |
137,327(7) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | +2 |
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Уд. теплота плавления | 7,66 кДж/моль |
| Уд. теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1 Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,020 Å |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
| Номер CAS | 7440-39-3 |
Барий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Типы месторождений
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 8 Качественный и количественный анализ
- 9 Применение
- 10 Цены
- 11 Биологическая роль и токсичность
История
Барий был открыт в виде оксида BaO в 1774 году Карлом Шееле и Юханом Ганом. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/л. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Основная статья: Изотопы бария
Известны изотопы бария с массовыми числами от 114 до 153, и 10 ядерных изомеров. Природный барий состоит из смеси шести стабильных изотопов (132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba) и одного изотопа с огромным периодом полураспада, много больше возраста Вселенной (130Ba).
Получение
Основное сырьё для получения бария — баритовый концентрат (80—95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
- BaSO4 + 4C → BaS + 4CO
- BaSO4 + 2CH4 → BaS + 2C + 4H2O
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
- BaS + 2H2O → Ba(OH)2 + H2S↑
- BaS + H2O + CO2 → BaCO3 + H2S↑
- BaCO3 → BaO + CO2
Получают металлический барий электролизом безводного расплава хлорида бария:
- BaCl2 → Ba + Cl2
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объёмно-центрированной решёткой (а = 0,501 нм), выше устойчив β-Ba.
Твёрдость по шкале Мооса 1,25.
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
- Ba + 2H2O → Ba(OH)2 + H2↑
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который, в свою очередь, с гидридом лития LiH даёт комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
- 6Ba + 2NH3 → 3BaH2 + Ba3N2
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
- Ba3N2 + 2CO → Ba(CN)2 + 2BaO
С жидким аммиаком даёт тёмно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
- [Ba(NH3)6] → Ba(NH2)2 + 4NH3 + H2
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углём.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора.
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
- Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
- Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
- Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
- Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
- Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
- Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
- Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов, а также купрат бария, применяются для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
- Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
- Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
- Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, фторид, йодид, бромид, сульфид, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2—0,5 г солей бария, смертельная доза 0,8—0,9 г.
Для оказании первой помощи необходимо промыть желудок 1 % раствором сульфата натрия или магния. Клизмы из 10 % растворов тех же солей. Приём внутрь раствора тех же солей (20,0 частей соли на 150,0 частей воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3 % раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
Not to be confused with Baryon.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (BAIR-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery gray; with a pale yellow tint[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ba) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1000 K (727 °C, 1341 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2118 K (1845 °C, 3353 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 3.51 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 3.338 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 7.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 142 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 28.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +1, +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 215±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of barium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 1620 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 20.6 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 18.4 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 332 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +20.6×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 9.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of barium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Barium is a chemical element with the symbol Ba and atomic number 56. It is the fifth element in group 2 and is a soft, silvery alkaline earth metal. Because of its high chemical reactivity, barium is never found in nature as a free element.
The most common minerals of barium are baryte (barium sulfate, BaSO4) and witherite (barium carbonate, BaCO3). The name barium originates from the alchemical derivative «baryta», from Greek βαρὺς (barys), meaning ‘heavy’. Baric is the adjectival form of barium. Barium was identified as a new element in 1772, but not reduced to a metal until 1808 with the advent of electrolysis.
Barium has few industrial applications. Historically, it was used as a getter for vacuum tubes and in oxide form as the emissive coating on indirectly heated cathodes. It is a component of YBCO (high-temperature superconductors) and electroceramics, and is added to steel and cast iron to reduce the size of carbon grains within the microstructure. Barium compounds are added to fireworks to impart a green color. Barium sulfate is used as an insoluble additive to oil well drilling fluid. In a purer form it is used as X-ray radiocontrast agents for imaging the human gastrointestinal tract. Water-soluble barium compounds are poisonous and have been used as rodenticides.
Characteristics[edit]
Physical properties[edit]
Barium is a soft, silvery-white metal, with a slight golden shade when ultrapure.[5]: 2 The silvery-white color of barium metal rapidly vanishes upon oxidation in air yielding a dark gray layer containing the oxide. Barium has a medium specific weight and high electrical conductivity. Because barium is difficult to purify, many of its properties have not been accurately determined.[5]: 2
At room temperature and pressure, barium metal adopts a body-centered cubic structure, with a barium–barium distance of 503 picometers, expanding with heating at a rate of approximately 1.8×10−5/°C.[5]: 2 It is a very soft metal with a Mohs hardness of 1.25.[5]: 2 Its melting temperature of 1,000 K (730 °C; 1,340 °F)[6]: 4–43 is intermediate between those of the lighter strontium (1,050 K or 780 °C or 1,430 °F)[6]: 4–86 and heavier radium (973 K or 700 °C or 1,292 °F);[6]: 4–78 however, its boiling point of 2,170 K (1,900 °C; 3,450 °F) exceeds that of strontium (1,655 K or 1,382 °C or 2,519 °F).[6]: 4–86 The density (3.62 g/cm3)[6]: 4–43 is again intermediate between those of strontium (2.36 g/cm3)[6]: 4–86 and radium (≈5 g/cm3).[6]: 4–78
Chemical reactivity[edit]
Barium is chemically similar to magnesium, calcium, and strontium, but even more reactive. It is usually found in the +2 oxidation state. Most exceptions are in a few rare and unstable molecular species that are only characterised in the gas phase such as BaF,[5]: 2 but in 2018 a barium(I) species was reported in a graphite intercalation compound.[7] Reactions with chalcogens are highly exothermic (release energy); the reaction with oxygen or air occurs at room temperature. For this reason, metallic barium is often stored under oil or in an inert atmosphere.[5]: 2 Reactions with other nonmetals, such as carbon, nitrogen, phosphorus, silicon, and hydrogen, are generally exothermic and proceed upon heating.[5]: 2–3 Reactions with water and alcohols are very exothermic and release hydrogen gas:[5]: 3
- Ba + 2 ROH → Ba(OR)2 + H2↑ (R is an alkyl group or a hydrogen atom)
Barium reacts with ammonia to form complexes such as Ba(NH3)6.[5]: 3
The metal is readily attacked by acids. Sulfuric acid is a notable exception because passivation stops the reaction by forming the insoluble barium sulfate on the surface.[8] Barium combines with several other metals, including aluminium, zinc, lead, and tin, forming intermetallic phases and alloys.[9]
Compounds[edit]
| O2− |
S2− |
F− |
Cl− |
SO2− 4 |
CO2− 3 |
O2− 2 |
H− |
|
|---|---|---|---|---|---|---|---|---|
| Ca2+ [6]: 4–48–50 |
3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2.9 | 1.7 |
| Sr2+ [6]: 4–86–88 |
5.1 | 3.7 | 4.24 | 3.05 | 3.96 | 3.5 | 4.78 | 3.26 |
| Ba2+ [6]: 4–43–45 |
5.72 | 4.3 | 4.89 | 3.89 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn2+ [6]: 4–95–96 |
5.6 | 4.09 | 4.95 | 2.09 | 3.54 | 4.4 | 1.57 | — |
Barium salts are typically white when solid and colorless when dissolved.[10] They are denser than the strontium or calcium analogs, except for the halides (see table; zinc is given for comparison).
Barium hydroxide («baryta») was known to alchemists, who produced it by heating barium carbonate. Unlike calcium hydroxide, it absorbs very little CO2 in aqueous solutions and is therefore insensitive to atmospheric fluctuations. This property is used in calibrating pH equipment.
Volatile barium compounds burn with a green to pale green flame, which is an efficient test to detect a barium compound. The color results from spectral lines at 455.4, 493.4, 553.6, and 611.1 nm.[5]: 3
Organobarium compounds are a growing field of knowledge: recently discovered are dialkylbariums and alkylhalobariums.[5]: 3
Isotopes[edit]
Barium found in the Earth’s crust is a mixture of seven primordial nuclides, barium-130, 132, and 134 through 138.[11] Barium-130 undergoes very slow radioactive decay to xenon-130 by double beta plus decay, with a half-life of (0.5–2.7)×1021 years (about 1011 times the age of the universe). Its abundance is ≈0.1% that of natural barium.[11] Theoretically, barium-132 can similarly undergo double beta decay to xenon-132; this decay has not been detected.[12] The radioactivity of these isotopes is so weak that they pose no danger to life.
Of the stable isotopes, barium-138 composes 71.7% of all barium; other isotopes have decreasing abundance with decreasing mass number.[11]
In total, barium has 40 known isotopes, ranging in mass between 114 and 153. The most stable artificial radioisotope is barium-133 with a half-life of approximately 10.51 years. Five other isotopes have half-lives longer than a day.[12] Barium also has 10 meta states, of which barium-133m1 is the most stable with a half-life of about 39 hours.[12]
History[edit]
Alchemists in the early Middle Ages knew about some barium minerals. Smooth pebble-like stones of mineral baryte were found in volcanic rock near Bologna, Italy, and so were called «Bologna stones». Alchemists were attracted to them because after exposure to light they would glow for years.[13] The phosphorescent properties of baryte heated with organics were described by V. Casciorolus in 1602.[5]: 5
Carl Scheele determined that baryte contained a new element in 1772, but could not isolate barium, only barium oxide. Johan Gottlieb Gahn also isolated barium oxide two years later in similar studies. Oxidized barium was at first called «barote» by Guyton de Morveau, a name that was changed by Antoine Lavoisier to baryte (in French) or baryta (in Latin). Also in the 18th century, English mineralogist William Withering noted a heavy mineral in the lead mines of Cumberland, now known to be witherite. Barium was first isolated by electrolysis of molten barium salts in 1808 by Sir Humphry Davy in England.[14] Davy, by analogy with calcium, named «barium» after baryta, with the «-ium» ending signifying a metallic element.[13] Robert Bunsen and Augustus Matthiessen obtained pure barium by electrolysis of a molten mixture of barium chloride and ammonium chloride.[15][16]
The production of pure oxygen in the Brin process was a large-scale application of barium peroxide in the 1880s, before it was replaced by electrolysis and fractional distillation of liquefied air in the early 1900s. In this process barium oxide reacts at 500–600 °C (932–1,112 °F) with air to form barium peroxide, which decomposes above 700 °C (1,292 °F) by releasing oxygen:[17][18]
- 2 BaO + O2 ⇌ 2 BaO2
Barium sulfate was first applied as a radiocontrast agent in X-ray imaging of the digestive system in 1908.[19]
Occurrence and production[edit]
The abundance of barium is 0.0425% in the Earth’s crust and 13 μg/L in sea water. The primary commercial source of barium is baryte (also called barytes or heavy spar), a barium sulfate mineral.[5]: 5 with deposits in many parts of the world. Another commercial source, far less important than baryte, is witherite, barium carbonate. The main deposits are located in Britain, Romania, and the former USSR.[5]: 5
Barite, left to right: appearance, graph showing trends in production over time, and the map showing shares of the most important producer countries in 2010.
The baryte reserves are estimated between 0.7 and 2 billion tonnes. The maximum production, 8.3 million tonnes, was produced in 1981, but only 7–8% was used for barium metal or compounds.[5]: 5 Baryte production has risen since the second half of the 1990s from 5.6 million tonnes in 1996 to 7.6 in 2005 and 7.8 in 2011. China accounts for more than 50% of this output, followed by India (14% in 2011), Morocco (8.3%), US (8.2%), Turkey (2.5%), Iran and Kazakhstan (2.6% each).[20]
The mined ore is washed, crushed, classified, and separated from quartz. If the quartz penetrates too deeply into the ore, or the iron, zinc, or lead content is abnormally high, then froth flotation is used. The product is a 98% pure baryte (by mass); the purity should be no less than 95%, with a minimal content of iron and silicon dioxide.[5]: 7 It is then reduced by carbon to barium sulfide:[5]: 6
- BaSO4 + 2 C → BaS + 2 CO2
The water-soluble barium sulfide is the starting point for other compounds: treating BaS with oxygen produces the sulfate, with nitric acid the nitrate, with aqueous carbon dioxide the carbonate, and so on.[5]: 6 The nitrate can be thermally decomposed to yield the oxide.[5]: 6 Barium metal is produced by reduction with aluminium at 1,100 °C (2,010 °F). The intermetallic compound BaAl4 is produced first:[5]: 3
- 3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4 is an intermediate reacted with barium oxide to produce the metal. Note that not all barium is reduced.[5]: 3
- 8 BaO + BaAl4 → Ba↓ + 7 BaAl2O4
The remaining barium oxide reacts with the formed aluminium oxide:[5]: 3
- BaO + Al2O3 → BaAl2O4
and the overall reaction is[5]: 3
- 4 BaO + 2 Al → 3 Ba↓ + BaAl2O4
Barium vapor is condensed and packed into molds in an atmosphere of argon.[5]: 3 This method is used commercially, yielding ultrapure barium.[5]: 3 Commonly sold barium is about 99% pure, with main impurities being strontium and calcium (up to 0.8% and 0.25%) and other contaminants contributing less than 0.1%.[5]: 4
A similar reaction with silicon at 1,200 °C (2,190 °F) yields barium and barium metasilicate.[5]: 3 Electrolysis is not used because barium readily dissolves in molten halides and the product is rather impure.[5]: 3
Gemstone[edit]
The barium mineral, benitoite (barium titanium silicate), occurs as a very rare blue fluorescent gemstone, and is the official state gem of California.
Barium in seawater
Barium exists in seawater as the Ba2+ ion with an average oceanic concentration of 109 nmol/kg.[21] Barium also exists in the ocean as BaSO4, or barite.[22] Barium has a nutrient-like profile[23] with a residence time of 10,000 years.[21]
Barium shows a relatively consistent concentration in upper ocean seawater, excepting regions of high river inputs and regions with strong upwelling.[24] There’s little depletion of barium concentrations in the upper ocean for an ion with a nutrient-like profile, thus lateral mixing is important.[24] Barium isotopic values show basin-scale balances instead of local or short-term processes.[24]
Applications[edit]
Metal and alloys[edit]
Barium, as a metal or when alloyed with aluminium, is used to remove unwanted gases (gettering) from vacuum tubes, such as TV picture tubes.[5]: 4 Barium is suitable for this purpose because of its low vapor pressure and reactivity towards oxygen, nitrogen, carbon dioxide, and water; it can even partly remove noble gases by dissolving them in the crystal lattice. This application is gradually disappearing due to the rising popularity of the tubeless LCD, LED, and plasma sets.[5]: 4
Other uses of elemental barium are minor and include an additive to silumin (aluminium–silicon alloys) that refines their structure, as well as[5]: 4
- bearing alloys;
- lead–tin soldering alloys – to increase the creep resistance;
- alloy with nickel for spark plugs;
- additive to steel and cast iron as an inoculant;
- alloys with calcium, manganese, silicon, and aluminium as high-grade steel deoxidizers.
Barium sulfate and baryte[edit]
Amoebiasis as seen in a radiograph of a barium-filled colon
Barium sulfate (the mineral baryte, BaSO4) is important to the petroleum industry as a drilling fluid in oil and gas wells.[6]: 4–5 The precipitate of the compound (called «blanc fixe», from the French for «permanent white») is used in paints and varnishes; as a filler in ringing ink, plastics, and rubbers; as a paper coating pigment; and in nanoparticles, to improve physical properties of some polymers, such as epoxies.[5]: 9
Barium sulfate has a low toxicity and relatively high density of ca. 4.5 g/cm3 (and thus opacity to X-rays). For this reason it is used as a radiocontrast agent in X-ray imaging of the digestive system («barium meals» and «barium enemas»).[6]: 4–5 Lithopone, a pigment that contains barium sulfate and zinc sulfide, is a permanent white with good covering power that does not darken when exposed to sulfides.[25]
Other barium compounds[edit]
Other compounds of barium find only niche applications, limited by the toxicity of Ba2+ ions (barium carbonate is a rat poison), which is not a problem for the insoluble BaSO4.
- Barium oxide coating on the electrodes of fluorescent lamps facilitates the release of electrons.
- By its great atomic density, barium carbonate increases the refractive index and luster of glass[6]: 4–5 and reduces leaks of X-rays from cathode ray tubes (CRT) TV sets.[5]: 12–13
- Barium, typically as barium nitrate imparts a yellow or «apple» green color to fireworks;[26] for brilliant green barium monochloride is used.
- Barium peroxide is a catalyst in the aluminothermic reaction (thermite) for welding rail tracks. It is also a green flare in tracer ammunition and a bleaching agent.[27]
- Barium titanate is a promising electroceramic.[28]
- Barium fluoride is used for optics in infrared applications because of its wide transparency range of 0.15–12 micrometers.[29]
- YBCO was the first high-temperature superconductor cooled by liquid nitrogen, with a transition temperature of 93 K (−180.2 °C; −292.3 °F) that exceeded the boiling point of nitrogen (77 K or −196.2 °C or −321.1 °F).[30]
- Ferrite, a type of sintered ceramic composed of iron oxide (Fe2O3) and barium oxide (BaO), is both electrically nonconductive and ferrimagnetic, and can be temporarily or permanently magnetized.
Palaeoceanography
The lateral mixing of barium is caused by water mass mixing and ocean circulation.[31] Global ocean circulation reveals a strong correlation between dissolved barium and silicic acid.[31] The large-scale ocean circulation combined with remineralization of barium show a similar correlation between dissolved barium and ocean alkalinity.[31]
Dissolved barium’s correlation with silicic acid can be seen both vertically and spatially.[32] Particulate barium shows a strong correlation with particulate organic carbon or POC.[32] Barium is becoming more popular to be used a base for palaeoceanographic proxies.[32] With both dissolved and particulate barium’s links with silicic acid and POC, it can be used to determine historical variations in the biological pump, carbon cycle, and global climate.[32]
The barium particulate barite (BaSO4), as one of many proxies, can be used to provide a host of historical information on processes in different oceanic settings (water column, sediments, and hydrothermal sites).[22] In each setting there are differences in isotopic and elemental composition of the barite particulate.[22] Barite in the water column, known as marine or pelagic barite, reveals information on seawater chemistry variation over time.[22] Barite in sediments, known as diagenetic or cold seeps barite, gives information about sedimentary redox processes.[22] Barite formed via hydrothermal activity at hydrothermal vents, known as hydrothermal barite, reveals alterations in the condition of the earth’s crust around those vents.[22]
Toxicity[edit]
| Hazards | |
|---|---|
| GHS labelling:[33] | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H228, H260, H301, H314 |
|
Precautionary statements |
P210, P231+P232, P260, P280, P303+P361+P353, P304+P340+P310, P305+P351+P338 |
| NFPA 704 (fire diamond) |
0 3 1
|
Because of the high reactivity of the metal, toxicological data are available only for compounds.[34] Soluble barium compounds are poisonous. In low doses, barium ions act as a muscle stimulant, and higher doses affect the nervous system, causing cardiac irregularities, tremors, weakness, anxiety, shortness of breath, and paralysis. This toxicity may be caused by Ba2+ blocking potassium ion channels, which are critical to the proper function of the nervous system.[35] Other organs damaged by water-soluble barium compounds (i.e., barium ions) are the eyes, immune system, heart, respiratory system, and skin[34] causing, for example, blindness and sensitization.[34]
Barium is not carcinogenic[34] and does not bioaccumulate.[36][37] Inhaled dust containing insoluble barium compounds can accumulate in the lungs, causing a benign condition called baritosis.[38] The insoluble sulfate is nontoxic and is not classified as a dangerous goods in transport regulations.[5]: 9
To avoid a potentially vigorous chemical reaction, barium metal is kept in an argon atmosphere or under mineral oils. Contact with air is dangerous and may cause ignition. Moisture, friction, heat, sparks, flames, shocks, static electricity, and exposure to oxidizers and acids should be avoided. Anything that may contact with barium should be electrically grounded. Anyone who works with the metal should wear pre-cleaned non-sparking shoes, flame-resistant rubber clothes, rubber gloves, apron, goggles, and a gas mask. Smoking in the working area is typically forbidden. Thorough washing is required after handling barium.[34]
See also[edit]
- Han purple and Han blue – synthetic barium copper silicate pigments developed and used in ancient and imperial China
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 112. ISBN 978-0-08-037941-8.
- ^ «Standard Atomic Weights: Barium». CIAAW. 1985.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe. «Barium and Barium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_325.pub2.
- ^ a b c d e f g h i j k l m n Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2.
- ^ W. Xu and M. Lerner, «A New and Facile Route Using Electride Solutions To Intercalate Alkaline Earth Ions into Graphite»
Chemistry of Materials 2018 30 (19), 6930-6935
https://DOI.org/10.1021/acs.chemmater.8b03421 - ^ Müller, Hermann. «Sulfuric Acid and Sulfur Trioxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_635.
- ^ Ferro, Riccardo & Saccone, Adriana (2008). Intermetallic Chemistry. Elsevier. p. 355. ISBN 978-0-08-044099-6.
- ^ Slowinski, Emil J.; Masterton, William L. (1990). Qualitative analysis and the properties of ions in aqueous solution (2nd ed.). Saunders. p. 87. ISBN 978-0-03-031234-2.
- ^ a b c de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. (2003). «Atomic weights of the elements. Review 2000 (IUPAC Technical Report)». Pure and Applied Chemistry. 75 (6): 683–800. doi:10.1351/pac200375060683.
- ^ a b c Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide. Greenwood Publishing Group. p. 80. ISBN 978-0-313-33438-2.
- ^ Davy, H (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–370. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023. S2CID 96364168.
- ^ «Masthead». Annalen der Chemie und Pharmacie. 93 (3): fmi. 1855. doi:10.1002/jlac.18550930301.
- ^ Wagner, Rud; Neubauer, C.; Deville, H. Sainte-Claire; Sorel; Wagenmann, L.; Techniker; Girard, Aimé (1856). «Notizen». Journal für Praktische Chemie. 67: 490–508. doi:10.1002/prac.18560670194.
- ^ Jensen, William B. (2009). «The Origin of the Brin Process for the Manufacture of Oxygen». Journal of Chemical Education. 86 (11): 1266. Bibcode:2009JChEd..86.1266J. doi:10.1021/ed086p1266.
- ^ Ihde, Aaron John (1984-04-01). The development of modern chemistry. p. 681. ISBN 978-0-486-64235-2.
- ^ Schott, G. D. (1974). «Some Observations on the History of the Use of Barium Salts in Medicine». Med. Hist. 18 (1): 9–21. doi:10.1017/S0025727300019190. PMC 1081520. PMID 4618587.
- ^ Miller, M. M. Barite. USGS.gov
- ^ a b «Barium». www.mbari.org. Retrieved 2020-11-24.
- ^ a b c d e f Griffith, Elizabeth M.; Paytan, Adina (2012). «Barite in the ocean – occurrence, geochemistry and palaeoceanographic applications». Sedimentology. 59 (6): 1817–1835. Bibcode:2012Sedim..59.1817G. doi:10.1111/j.1365-3091.2012.01327.x. ISSN 1365-3091. S2CID 28056031.
- ^ «Graph». www.mbari.org. Retrieved 2020-11-24.
- ^ a b c Hsieh, Yu-Te; Henderson, Gideon M. (2017). «Barium stable isotopes in the global ocean: Tracer of Ba inputs and utilization». Earth and Planetary Science Letters. 473: 269–278. Bibcode:2017E&PSL.473..269H. doi:10.1016/j.epsl.2017.06.024.
- ^ Jones, Chris J. & Thornback, John (2007). Medicinal applications of coordination chemistry. Royal Society of Chemistry. p. 102. ISBN 978-0-85404-596-9.
- ^ Russell, Michael S. & Svrcula, Kurt (2008). Chemistry of Fireworks. Royal Society of Chemistry. p. 110. ISBN 978-0-85404-127-5.
- ^ Brent, G. F.; Harding, M. D. (1995). «Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions». Propellants, Explosives, Pyrotechnics. 20 (6): 300. doi:10.1002/prep.19950200604.
- ^ Wadhawan, Vinod K. (2000). Introduction to ferroic materials. CRC Press. p. 740. ISBN 978-90-5699-286-6.
- ^ «Crystran Ltd. Optical Component Materials». crystran.co.uk. Retrieved 2010-12-29.
- ^ Wu, M.; Ashburn, J.; Torng, C.; Hor, P.; Meng, R.; Gao, L.; Huang, Z.; Wang, Y.; Chu, C. (1987). «Superconductivity at 93 K in a New Mixed-Phase Y-Ba-Cu-O Compound System at Ambient Pressure». Physical Review Letters. 58 (9): 908–910. Bibcode:1987PhRvL..58..908W. doi:10.1103/PhysRevLett.58.908. PMID 10035069.
- ^ a b c Pyle, Kimberley M.; Hendry, Katharine R.; Sherrell, Robert M.; Legge, Oliver; Hind, Andrew J.; Bakker, Dorothee; Venables, Hugh; Meredith, Michael P. (2018-08-20). «Oceanic fronts control the distribution of dissolved barium in the Southern Ocean». Marine Chemistry. 204: 95–106. doi:10.1016/j.marchem.2018.07.002. ISSN 0304-4203. S2CID 104170533.
- ^ a b c d Bates, Stephanie L.; Hendry, Katharine R.; Pryer, Helena V.; Kinsley, Christopher W.; Pyle, Kimberley M.; Woodward, E. Malcolm S.; Horner, Tristan J. (2017-05-01). «Barium isotopes reveal role of ocean circulation on barium cycling in the Atlantic». Geochimica et Cosmochimica Acta. 204: 286–299. Bibcode:2017GeCoA.204..286B. doi:10.1016/j.gca.2017.01.043. hdl:1912/8676. ISSN 0016-7037. S2CID 55559902.
- ^ «Barium 237094». Sigma-Aldrich. 2021-10-28. Retrieved 2021-12-21.
- ^ a b c d e Barium. ESPI Metals. Retrieved 2012-06-11.
- ^ Patnaik, Pradyot (2003). Handbook of inorganic chemicals. McGraw-Hill. pp. 77–78. ISBN 978-0-07-049439-8.
- ^ «Toxicity Profiles, Ecological Risk Assessment». US EPA. Archived from the original on 2010-01-10. Retrieved 2012-06-16.
- ^ Moore, J. W. (1991). Inorganic Contaminants of Surface Waters, Research and Monitoring Priorities. New York: Springer-Verlag.
- ^ Doig, A. T. (1976). «Baritosis: a benign pneumoconiosis». Thorax. 31 (1): 30–9. doi:10.1136/thx.31.1.30. PMC 470358. PMID 1257935.
External links[edit]
- Barium at The Periodic Table of Videos (University of Nottingham)
- Elementymology & Elements Multidict
- 3-D Holographic Display Using Strontium Barium Niobate
Not to be confused with Baryon.
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | (BAIR-ee-əm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | silvery gray; with a pale yellow tint[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standard atomic weight Ar°(Ba) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Barium in the periodic table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic number (Z) | 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | group 2 (alkaline earth metals) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | s-block | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 18, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | solid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 1000 K (727 °C, 1341 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 2118 K (1845 °C, 3353 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (near r.t.) | 3.51 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at m.p.) | 3.338 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 7.12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 142 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 28.07 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | +1, +2 (a strongly basic oxide) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 0.89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic radius | empirical: 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 215±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Spectral lines of barium |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | primordial | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | body-centered cubic (bcc)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Speed of sound thin rod | 1620 m/s (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal expansion | 20.6 µm/(m⋅K) (at 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 18.4 W/(m⋅K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrical resistivity | 332 nΩ⋅m (at 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | paramagnetic[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar magnetic susceptibility | +20.6×10−6 cm3/mol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Young’s modulus | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 4.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bulk modulus | 9.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardness | 1.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Isotopes of barium
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| references |
Barium is a chemical element with the symbol Ba and atomic number 56. It is the fifth element in group 2 and is a soft, silvery alkaline earth metal. Because of its high chemical reactivity, barium is never found in nature as a free element.
The most common minerals of barium are baryte (barium sulfate, BaSO4) and witherite (barium carbonate, BaCO3). The name barium originates from the alchemical derivative «baryta», from Greek βαρὺς (barys), meaning ‘heavy’. Baric is the adjectival form of barium. Barium was identified as a new element in 1772, but not reduced to a metal until 1808 with the advent of electrolysis.
Barium has few industrial applications. Historically, it was used as a getter for vacuum tubes and in oxide form as the emissive coating on indirectly heated cathodes. It is a component of YBCO (high-temperature superconductors) and electroceramics, and is added to steel and cast iron to reduce the size of carbon grains within the microstructure. Barium compounds are added to fireworks to impart a green color. Barium sulfate is used as an insoluble additive to oil well drilling fluid. In a purer form it is used as X-ray radiocontrast agents for imaging the human gastrointestinal tract. Water-soluble barium compounds are poisonous and have been used as rodenticides.
Characteristics[edit]
Physical properties[edit]
Barium is a soft, silvery-white metal, with a slight golden shade when ultrapure.[5]: 2 The silvery-white color of barium metal rapidly vanishes upon oxidation in air yielding a dark gray layer containing the oxide. Barium has a medium specific weight and high electrical conductivity. Because barium is difficult to purify, many of its properties have not been accurately determined.[5]: 2
At room temperature and pressure, barium metal adopts a body-centered cubic structure, with a barium–barium distance of 503 picometers, expanding with heating at a rate of approximately 1.8×10−5/°C.[5]: 2 It is a very soft metal with a Mohs hardness of 1.25.[5]: 2 Its melting temperature of 1,000 K (730 °C; 1,340 °F)[6]: 4–43 is intermediate between those of the lighter strontium (1,050 K or 780 °C or 1,430 °F)[6]: 4–86 and heavier radium (973 K or 700 °C or 1,292 °F);[6]: 4–78 however, its boiling point of 2,170 K (1,900 °C; 3,450 °F) exceeds that of strontium (1,655 K or 1,382 °C or 2,519 °F).[6]: 4–86 The density (3.62 g/cm3)[6]: 4–43 is again intermediate between those of strontium (2.36 g/cm3)[6]: 4–86 and radium (≈5 g/cm3).[6]: 4–78
Chemical reactivity[edit]
Barium is chemically similar to magnesium, calcium, and strontium, but even more reactive. It is usually found in the +2 oxidation state. Most exceptions are in a few rare and unstable molecular species that are only characterised in the gas phase such as BaF,[5]: 2 but in 2018 a barium(I) species was reported in a graphite intercalation compound.[7] Reactions with chalcogens are highly exothermic (release energy); the reaction with oxygen or air occurs at room temperature. For this reason, metallic barium is often stored under oil or in an inert atmosphere.[5]: 2 Reactions with other nonmetals, such as carbon, nitrogen, phosphorus, silicon, and hydrogen, are generally exothermic and proceed upon heating.[5]: 2–3 Reactions with water and alcohols are very exothermic and release hydrogen gas:[5]: 3
- Ba + 2 ROH → Ba(OR)2 + H2↑ (R is an alkyl group or a hydrogen atom)
Barium reacts with ammonia to form complexes such as Ba(NH3)6.[5]: 3
The metal is readily attacked by acids. Sulfuric acid is a notable exception because passivation stops the reaction by forming the insoluble barium sulfate on the surface.[8] Barium combines with several other metals, including aluminium, zinc, lead, and tin, forming intermetallic phases and alloys.[9]
Compounds[edit]
| O2− |
S2− |
F− |
Cl− |
SO2− 4 |
CO2− 3 |
O2− 2 |
H− |
|
|---|---|---|---|---|---|---|---|---|
| Ca2+ [6]: 4–48–50 |
3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2.9 | 1.7 |
| Sr2+ [6]: 4–86–88 |
5.1 | 3.7 | 4.24 | 3.05 | 3.96 | 3.5 | 4.78 | 3.26 |
| Ba2+ [6]: 4–43–45 |
5.72 | 4.3 | 4.89 | 3.89 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn2+ [6]: 4–95–96 |
5.6 | 4.09 | 4.95 | 2.09 | 3.54 | 4.4 | 1.57 | — |
Barium salts are typically white when solid and colorless when dissolved.[10] They are denser than the strontium or calcium analogs, except for the halides (see table; zinc is given for comparison).
Barium hydroxide («baryta») was known to alchemists, who produced it by heating barium carbonate. Unlike calcium hydroxide, it absorbs very little CO2 in aqueous solutions and is therefore insensitive to atmospheric fluctuations. This property is used in calibrating pH equipment.
Volatile barium compounds burn with a green to pale green flame, which is an efficient test to detect a barium compound. The color results from spectral lines at 455.4, 493.4, 553.6, and 611.1 nm.[5]: 3
Organobarium compounds are a growing field of knowledge: recently discovered are dialkylbariums and alkylhalobariums.[5]: 3
Isotopes[edit]
Barium found in the Earth’s crust is a mixture of seven primordial nuclides, barium-130, 132, and 134 through 138.[11] Barium-130 undergoes very slow radioactive decay to xenon-130 by double beta plus decay, with a half-life of (0.5–2.7)×1021 years (about 1011 times the age of the universe). Its abundance is ≈0.1% that of natural barium.[11] Theoretically, barium-132 can similarly undergo double beta decay to xenon-132; this decay has not been detected.[12] The radioactivity of these isotopes is so weak that they pose no danger to life.
Of the stable isotopes, barium-138 composes 71.7% of all barium; other isotopes have decreasing abundance with decreasing mass number.[11]
In total, barium has 40 known isotopes, ranging in mass between 114 and 153. The most stable artificial radioisotope is barium-133 with a half-life of approximately 10.51 years. Five other isotopes have half-lives longer than a day.[12] Barium also has 10 meta states, of which barium-133m1 is the most stable with a half-life of about 39 hours.[12]
History[edit]
Alchemists in the early Middle Ages knew about some barium minerals. Smooth pebble-like stones of mineral baryte were found in volcanic rock near Bologna, Italy, and so were called «Bologna stones». Alchemists were attracted to them because after exposure to light they would glow for years.[13] The phosphorescent properties of baryte heated with organics were described by V. Casciorolus in 1602.[5]: 5
Carl Scheele determined that baryte contained a new element in 1772, but could not isolate barium, only barium oxide. Johan Gottlieb Gahn also isolated barium oxide two years later in similar studies. Oxidized barium was at first called «barote» by Guyton de Morveau, a name that was changed by Antoine Lavoisier to baryte (in French) or baryta (in Latin). Also in the 18th century, English mineralogist William Withering noted a heavy mineral in the lead mines of Cumberland, now known to be witherite. Barium was first isolated by electrolysis of molten barium salts in 1808 by Sir Humphry Davy in England.[14] Davy, by analogy with calcium, named «barium» after baryta, with the «-ium» ending signifying a metallic element.[13] Robert Bunsen and Augustus Matthiessen obtained pure barium by electrolysis of a molten mixture of barium chloride and ammonium chloride.[15][16]
The production of pure oxygen in the Brin process was a large-scale application of barium peroxide in the 1880s, before it was replaced by electrolysis and fractional distillation of liquefied air in the early 1900s. In this process barium oxide reacts at 500–600 °C (932–1,112 °F) with air to form barium peroxide, which decomposes above 700 °C (1,292 °F) by releasing oxygen:[17][18]
- 2 BaO + O2 ⇌ 2 BaO2
Barium sulfate was first applied as a radiocontrast agent in X-ray imaging of the digestive system in 1908.[19]
Occurrence and production[edit]
The abundance of barium is 0.0425% in the Earth’s crust and 13 μg/L in sea water. The primary commercial source of barium is baryte (also called barytes or heavy spar), a barium sulfate mineral.[5]: 5 with deposits in many parts of the world. Another commercial source, far less important than baryte, is witherite, barium carbonate. The main deposits are located in Britain, Romania, and the former USSR.[5]: 5
Barite, left to right: appearance, graph showing trends in production over time, and the map showing shares of the most important producer countries in 2010.
The baryte reserves are estimated between 0.7 and 2 billion tonnes. The maximum production, 8.3 million tonnes, was produced in 1981, but only 7–8% was used for barium metal or compounds.[5]: 5 Baryte production has risen since the second half of the 1990s from 5.6 million tonnes in 1996 to 7.6 in 2005 and 7.8 in 2011. China accounts for more than 50% of this output, followed by India (14% in 2011), Morocco (8.3%), US (8.2%), Turkey (2.5%), Iran and Kazakhstan (2.6% each).[20]
The mined ore is washed, crushed, classified, and separated from quartz. If the quartz penetrates too deeply into the ore, or the iron, zinc, or lead content is abnormally high, then froth flotation is used. The product is a 98% pure baryte (by mass); the purity should be no less than 95%, with a minimal content of iron and silicon dioxide.[5]: 7 It is then reduced by carbon to barium sulfide:[5]: 6
- BaSO4 + 2 C → BaS + 2 CO2
The water-soluble barium sulfide is the starting point for other compounds: treating BaS with oxygen produces the sulfate, with nitric acid the nitrate, with aqueous carbon dioxide the carbonate, and so on.[5]: 6 The nitrate can be thermally decomposed to yield the oxide.[5]: 6 Barium metal is produced by reduction with aluminium at 1,100 °C (2,010 °F). The intermetallic compound BaAl4 is produced first:[5]: 3
- 3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4 is an intermediate reacted with barium oxide to produce the metal. Note that not all barium is reduced.[5]: 3
- 8 BaO + BaAl4 → Ba↓ + 7 BaAl2O4
The remaining barium oxide reacts with the formed aluminium oxide:[5]: 3
- BaO + Al2O3 → BaAl2O4
and the overall reaction is[5]: 3
- 4 BaO + 2 Al → 3 Ba↓ + BaAl2O4
Barium vapor is condensed and packed into molds in an atmosphere of argon.[5]: 3 This method is used commercially, yielding ultrapure barium.[5]: 3 Commonly sold barium is about 99% pure, with main impurities being strontium and calcium (up to 0.8% and 0.25%) and other contaminants contributing less than 0.1%.[5]: 4
A similar reaction with silicon at 1,200 °C (2,190 °F) yields barium and barium metasilicate.[5]: 3 Electrolysis is not used because barium readily dissolves in molten halides and the product is rather impure.[5]: 3
Gemstone[edit]
The barium mineral, benitoite (barium titanium silicate), occurs as a very rare blue fluorescent gemstone, and is the official state gem of California.
Barium in seawater
Barium exists in seawater as the Ba2+ ion with an average oceanic concentration of 109 nmol/kg.[21] Barium also exists in the ocean as BaSO4, or barite.[22] Barium has a nutrient-like profile[23] with a residence time of 10,000 years.[21]
Barium shows a relatively consistent concentration in upper ocean seawater, excepting regions of high river inputs and regions with strong upwelling.[24] There’s little depletion of barium concentrations in the upper ocean for an ion with a nutrient-like profile, thus lateral mixing is important.[24] Barium isotopic values show basin-scale balances instead of local or short-term processes.[24]
Applications[edit]
Metal and alloys[edit]
Barium, as a metal or when alloyed with aluminium, is used to remove unwanted gases (gettering) from vacuum tubes, such as TV picture tubes.[5]: 4 Barium is suitable for this purpose because of its low vapor pressure and reactivity towards oxygen, nitrogen, carbon dioxide, and water; it can even partly remove noble gases by dissolving them in the crystal lattice. This application is gradually disappearing due to the rising popularity of the tubeless LCD, LED, and plasma sets.[5]: 4
Other uses of elemental barium are minor and include an additive to silumin (aluminium–silicon alloys) that refines their structure, as well as[5]: 4
- bearing alloys;
- lead–tin soldering alloys – to increase the creep resistance;
- alloy with nickel for spark plugs;
- additive to steel and cast iron as an inoculant;
- alloys with calcium, manganese, silicon, and aluminium as high-grade steel deoxidizers.
Barium sulfate and baryte[edit]
Amoebiasis as seen in a radiograph of a barium-filled colon
Barium sulfate (the mineral baryte, BaSO4) is important to the petroleum industry as a drilling fluid in oil and gas wells.[6]: 4–5 The precipitate of the compound (called «blanc fixe», from the French for «permanent white») is used in paints and varnishes; as a filler in ringing ink, plastics, and rubbers; as a paper coating pigment; and in nanoparticles, to improve physical properties of some polymers, such as epoxies.[5]: 9
Barium sulfate has a low toxicity and relatively high density of ca. 4.5 g/cm3 (and thus opacity to X-rays). For this reason it is used as a radiocontrast agent in X-ray imaging of the digestive system («barium meals» and «barium enemas»).[6]: 4–5 Lithopone, a pigment that contains barium sulfate and zinc sulfide, is a permanent white with good covering power that does not darken when exposed to sulfides.[25]
Other barium compounds[edit]
Other compounds of barium find only niche applications, limited by the toxicity of Ba2+ ions (barium carbonate is a rat poison), which is not a problem for the insoluble BaSO4.
- Barium oxide coating on the electrodes of fluorescent lamps facilitates the release of electrons.
- By its great atomic density, barium carbonate increases the refractive index and luster of glass[6]: 4–5 and reduces leaks of X-rays from cathode ray tubes (CRT) TV sets.[5]: 12–13
- Barium, typically as barium nitrate imparts a yellow or «apple» green color to fireworks;[26] for brilliant green barium monochloride is used.
- Barium peroxide is a catalyst in the aluminothermic reaction (thermite) for welding rail tracks. It is also a green flare in tracer ammunition and a bleaching agent.[27]
- Barium titanate is a promising electroceramic.[28]
- Barium fluoride is used for optics in infrared applications because of its wide transparency range of 0.15–12 micrometers.[29]
- YBCO was the first high-temperature superconductor cooled by liquid nitrogen, with a transition temperature of 93 K (−180.2 °C; −292.3 °F) that exceeded the boiling point of nitrogen (77 K or −196.2 °C or −321.1 °F).[30]
- Ferrite, a type of sintered ceramic composed of iron oxide (Fe2O3) and barium oxide (BaO), is both electrically nonconductive and ferrimagnetic, and can be temporarily or permanently magnetized.
Palaeoceanography
The lateral mixing of barium is caused by water mass mixing and ocean circulation.[31] Global ocean circulation reveals a strong correlation between dissolved barium and silicic acid.[31] The large-scale ocean circulation combined with remineralization of barium show a similar correlation between dissolved barium and ocean alkalinity.[31]
Dissolved barium’s correlation with silicic acid can be seen both vertically and spatially.[32] Particulate barium shows a strong correlation with particulate organic carbon or POC.[32] Barium is becoming more popular to be used a base for palaeoceanographic proxies.[32] With both dissolved and particulate barium’s links with silicic acid and POC, it can be used to determine historical variations in the biological pump, carbon cycle, and global climate.[32]
The barium particulate barite (BaSO4), as one of many proxies, can be used to provide a host of historical information on processes in different oceanic settings (water column, sediments, and hydrothermal sites).[22] In each setting there are differences in isotopic and elemental composition of the barite particulate.[22] Barite in the water column, known as marine or pelagic barite, reveals information on seawater chemistry variation over time.[22] Barite in sediments, known as diagenetic or cold seeps barite, gives information about sedimentary redox processes.[22] Barite formed via hydrothermal activity at hydrothermal vents, known as hydrothermal barite, reveals alterations in the condition of the earth’s crust around those vents.[22]
Toxicity[edit]
| Hazards | |
|---|---|
| GHS labelling:[33] | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H228, H260, H301, H314 |
|
Precautionary statements |
P210, P231+P232, P260, P280, P303+P361+P353, P304+P340+P310, P305+P351+P338 |
| NFPA 704 (fire diamond) |
0 3 1
|
Because of the high reactivity of the metal, toxicological data are available only for compounds.[34] Soluble barium compounds are poisonous. In low doses, barium ions act as a muscle stimulant, and higher doses affect the nervous system, causing cardiac irregularities, tremors, weakness, anxiety, shortness of breath, and paralysis. This toxicity may be caused by Ba2+ blocking potassium ion channels, which are critical to the proper function of the nervous system.[35] Other organs damaged by water-soluble barium compounds (i.e., barium ions) are the eyes, immune system, heart, respiratory system, and skin[34] causing, for example, blindness and sensitization.[34]
Barium is not carcinogenic[34] and does not bioaccumulate.[36][37] Inhaled dust containing insoluble barium compounds can accumulate in the lungs, causing a benign condition called baritosis.[38] The insoluble sulfate is nontoxic and is not classified as a dangerous goods in transport regulations.[5]: 9
To avoid a potentially vigorous chemical reaction, barium metal is kept in an argon atmosphere or under mineral oils. Contact with air is dangerous and may cause ignition. Moisture, friction, heat, sparks, flames, shocks, static electricity, and exposure to oxidizers and acids should be avoided. Anything that may contact with barium should be electrically grounded. Anyone who works with the metal should wear pre-cleaned non-sparking shoes, flame-resistant rubber clothes, rubber gloves, apron, goggles, and a gas mask. Smoking in the working area is typically forbidden. Thorough washing is required after handling barium.[34]
See also[edit]
- Han purple and Han blue – synthetic barium copper silicate pigments developed and used in ancient and imperial China
References[edit]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 112. ISBN 978-0-08-037941-8.
- ^ «Standard Atomic Weights: Barium». CIAAW. 1985.
- ^ Lide, D. R., ed. (2005). «Magnetic susceptibility of the elements and inorganic compounds». CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Kresse, Robert; Baudis, Ulrich; Jäger, Paul; Riechers, H. Hermann; Wagner, Heinz; Winkler, Jochen; Wolf, Hans Uwe. «Barium and Barium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_325.pub2.
- ^ a b c d e f g h i j k l m n Lide, D. R. (2004). CRC Handbook of Chemistry and Physics (84th ed.). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0484-2.
- ^ W. Xu and M. Lerner, «A New and Facile Route Using Electride Solutions To Intercalate Alkaline Earth Ions into Graphite»
Chemistry of Materials 2018 30 (19), 6930-6935
https://DOI.org/10.1021/acs.chemmater.8b03421 - ^ Müller, Hermann. «Sulfuric Acid and Sulfur Trioxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_635.
- ^ Ferro, Riccardo & Saccone, Adriana (2008). Intermetallic Chemistry. Elsevier. p. 355. ISBN 978-0-08-044099-6.
- ^ Slowinski, Emil J.; Masterton, William L. (1990). Qualitative analysis and the properties of ions in aqueous solution (2nd ed.). Saunders. p. 87. ISBN 978-0-03-031234-2.
- ^ a b c de Laeter, John Robert; Böhlke, John Karl; De Bièvre, Paul; Hidaka, Hiroshi; Peiser, H. Steffen; Rosman, Kevin J. R.; Taylor, Philip D. P. (2003). «Atomic weights of the elements. Review 2000 (IUPAC Technical Report)». Pure and Applied Chemistry. 75 (6): 683–800. doi:10.1351/pac200375060683.
- ^ a b c Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). «The NUBASE2016 evaluation of nuclear properties» (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ a b Krebs, Robert E. (2006). The history and use of our earth’s chemical elements: a reference guide. Greenwood Publishing Group. p. 80. ISBN 978-0-313-33438-2.
- ^ Davy, H (1808). «Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia». Philosophical Transactions of the Royal Society of London. 98: 333–370. Bibcode:1808RSPT…98..333D. doi:10.1098/rstl.1808.0023. S2CID 96364168.
- ^ «Masthead». Annalen der Chemie und Pharmacie. 93 (3): fmi. 1855. doi:10.1002/jlac.18550930301.
- ^ Wagner, Rud; Neubauer, C.; Deville, H. Sainte-Claire; Sorel; Wagenmann, L.; Techniker; Girard, Aimé (1856). «Notizen». Journal für Praktische Chemie. 67: 490–508. doi:10.1002/prac.18560670194.
- ^ Jensen, William B. (2009). «The Origin of the Brin Process for the Manufacture of Oxygen». Journal of Chemical Education. 86 (11): 1266. Bibcode:2009JChEd..86.1266J. doi:10.1021/ed086p1266.
- ^ Ihde, Aaron John (1984-04-01). The development of modern chemistry. p. 681. ISBN 978-0-486-64235-2.
- ^ Schott, G. D. (1974). «Some Observations on the History of the Use of Barium Salts in Medicine». Med. Hist. 18 (1): 9–21. doi:10.1017/S0025727300019190. PMC 1081520. PMID 4618587.
- ^ Miller, M. M. Barite. USGS.gov
- ^ a b «Barium». www.mbari.org. Retrieved 2020-11-24.
- ^ a b c d e f Griffith, Elizabeth M.; Paytan, Adina (2012). «Barite in the ocean – occurrence, geochemistry and palaeoceanographic applications». Sedimentology. 59 (6): 1817–1835. Bibcode:2012Sedim..59.1817G. doi:10.1111/j.1365-3091.2012.01327.x. ISSN 1365-3091. S2CID 28056031.
- ^ «Graph». www.mbari.org. Retrieved 2020-11-24.
- ^ a b c Hsieh, Yu-Te; Henderson, Gideon M. (2017). «Barium stable isotopes in the global ocean: Tracer of Ba inputs and utilization». Earth and Planetary Science Letters. 473: 269–278. Bibcode:2017E&PSL.473..269H. doi:10.1016/j.epsl.2017.06.024.
- ^ Jones, Chris J. & Thornback, John (2007). Medicinal applications of coordination chemistry. Royal Society of Chemistry. p. 102. ISBN 978-0-85404-596-9.
- ^ Russell, Michael S. & Svrcula, Kurt (2008). Chemistry of Fireworks. Royal Society of Chemistry. p. 110. ISBN 978-0-85404-127-5.
- ^ Brent, G. F.; Harding, M. D. (1995). «Surfactant coatings for the stabilization of barium peroxide and lead dioxide in pyrotechnic compositions». Propellants, Explosives, Pyrotechnics. 20 (6): 300. doi:10.1002/prep.19950200604.
- ^ Wadhawan, Vinod K. (2000). Introduction to ferroic materials. CRC Press. p. 740. ISBN 978-90-5699-286-6.
- ^ «Crystran Ltd. Optical Component Materials». crystran.co.uk. Retrieved 2010-12-29.
- ^ Wu, M.; Ashburn, J.; Torng, C.; Hor, P.; Meng, R.; Gao, L.; Huang, Z.; Wang, Y.; Chu, C. (1987). «Superconductivity at 93 K in a New Mixed-Phase Y-Ba-Cu-O Compound System at Ambient Pressure». Physical Review Letters. 58 (9): 908–910. Bibcode:1987PhRvL..58..908W. doi:10.1103/PhysRevLett.58.908. PMID 10035069.
- ^ a b c Pyle, Kimberley M.; Hendry, Katharine R.; Sherrell, Robert M.; Legge, Oliver; Hind, Andrew J.; Bakker, Dorothee; Venables, Hugh; Meredith, Michael P. (2018-08-20). «Oceanic fronts control the distribution of dissolved barium in the Southern Ocean». Marine Chemistry. 204: 95–106. doi:10.1016/j.marchem.2018.07.002. ISSN 0304-4203. S2CID 104170533.
- ^ a b c d Bates, Stephanie L.; Hendry, Katharine R.; Pryer, Helena V.; Kinsley, Christopher W.; Pyle, Kimberley M.; Woodward, E. Malcolm S.; Horner, Tristan J. (2017-05-01). «Barium isotopes reveal role of ocean circulation on barium cycling in the Atlantic». Geochimica et Cosmochimica Acta. 204: 286–299. Bibcode:2017GeCoA.204..286B. doi:10.1016/j.gca.2017.01.043. hdl:1912/8676. ISSN 0016-7037. S2CID 55559902.
- ^ «Barium 237094». Sigma-Aldrich. 2021-10-28. Retrieved 2021-12-21.
- ^ a b c d e Barium. ESPI Metals. Retrieved 2012-06-11.
- ^ Patnaik, Pradyot (2003). Handbook of inorganic chemicals. McGraw-Hill. pp. 77–78. ISBN 978-0-07-049439-8.
- ^ «Toxicity Profiles, Ecological Risk Assessment». US EPA. Archived from the original on 2010-01-10. Retrieved 2012-06-16.
- ^ Moore, J. W. (1991). Inorganic Contaminants of Surface Waters, Research and Monitoring Priorities. New York: Springer-Verlag.
- ^ Doig, A. T. (1976). «Baritosis: a benign pneumoconiosis». Thorax. 31 (1): 30–9. doi:10.1136/thx.31.1.30. PMC 470358. PMID 1257935.
External links[edit]
- Barium at The Periodic Table of Videos (University of Nottingham)
- Elementymology & Elements Multidict
- 3-D Holographic Display Using Strontium Barium Niobate
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Барий / Barium (Ba), 56 |
||
| Атомная масса (молярная масса) |
137,327 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Xe] 6s2 |
||
| Радиус атома |
222 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
198 пм |
||
| Радиус иона |
(+2e) 134 пм |
||
| Электроотрицательность |
0,89 (шкала Полинга) |
||
| Электродный потенциал |
-2,906 |
||
| Степени окисления |
2 |
||
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
3,5 г/см³ |
||
| Температура плавления |
1 002 K |
||
| Температура кипения |
1 910 K |
||
| Теплота плавления |
7,66 кДж/моль |
||
| Теплота испарения |
142,0 кДж/моль |
||
| Молярная теплоёмкость |
28,1[1] Дж/(K·моль) |
||
| Молярный объём |
39,0 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая |
||
| Параметры решётки |
5,020 Å |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) (18.4) Вт/(м·К) |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Типы месторождений
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 8 Качественный и количественный анализ
- 9 Применение
- 9.1 Вакуумные электронные приборы
- 9.2 Антикоррозионный материал
- 9.3 Сегнето- и пьезоэлектрик
- 9.4 Оптика
- 9.5 Пиротехника
- 9.6 Атомно-водородная энергетика
- 9.7 Высокотемпературная сверхпроводимость
- 9.8 Ядерная энергетика
- 9.9 Химические источники тока
- 9.10 Применение соединений бария в медицине
- 10 Цены
- 11 Биологическая роль и токсичность
- 12 См. также
- 13 Примечания
- 14 Ссылки
История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[2]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый», так как его оксид (BaO) был охарактеризован, как имеющий необычно высокую для таких веществ плотность.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространенным (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при распаде урана, тория и плутония.
Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200—1250 °C:
Очищают барий перегонкой в вакууме или зонной плавкой.
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объемно-центрированной решеткой (параметр а = 0,501 нм), выше устойчив β-Ba.
Твердость по минералогической шкале 1,25.[3]
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксид бария BaO и нитрид бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который в свою очередь с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[4].
Соединения бария окрашивают пламя в желто-зеленый цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение соединений бария в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твердый неправильный пульс, судороги, позже возможны и параличи, синюха лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжелого отравления смерть наступает внезапно или в течение одних суток. Тяжелые отравления наступают при приеме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10-20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
См. также
- Бария титанат
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
Ссылки
| Барий на Викискладе? |
- Барий на Webelements
- Барий в Популярной библиотеке химических элементов
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
|
Соединения бария |
|---|
|
Амид бария (Ba(NH2)2) • Ацетат бария (Ba(CH3COO)2) • Бромид бария (BaBr2) • Гидрид бария (BaH2) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаборат бария (Ba(BO2)2) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Пероксид бария (BaO2) • Перхлорат бария (BaClO4) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3) |
|
|
Атом элемента и кристалл
К настоящему моменту науке известны бариевые изотопы, то есть разновидности атомов элемента, имеющие массовые числа от 114 до 153, а также ядерные изомеры в количестве 10 штук.
В форме простого вещества барий представляет собой металл светло-серебристого цвета. Показатели относительной молярной, атомной и молекулярной масс равные и составляют 137,33 г/моль. Для этого металла в чистом виде характерны:
- мягкость;
- ковкость;
- вязкость.
В радиусе атом этого элемента равен 222 пикометрам. Схематичное строение атома бария с электронными слоями:
Заряд элемента всегда совпадает с его порядковым номером в периодической таблице, то есть у бария он равен 56. Конфигурация электронов на внешнем слое атома — 6s во второй степени. Электронная формула бария (в обычном и графическом представлении):
Кристаллическая решетка бария в форме простого вещества имеет кубическую структуру объемноцентрированного типа. Ее параметр, то есть размер ячейки, составляет 5,02 ангстрема.
Название и история открытия
Свое название этот элемент таблицы Менделеева получил от древнегреческого слова, означавшего «тяжелый». Открытие нового химического элемента — бария — произошло в 1774 году. Этот металл в форме оксида с формулой BaO обнаружили шведские химики Юхан Ган и Карл Шееле. Однако дальше исследования ученых не продвинулись.
Металлический барий в чистом виде был выделен химиком-англичанином Гемфри Дэви в 1808 году, после проведения опыта по получению бариевой амальгамы. Сплав был получен Дэви путем электролиза ртутного катода и влажного едкого барита, то есть гидроксида бария. Затем британский химик нагреванием выпарил ртуть из полученного вещества, в результате чего был впервые в истории выделен чистый металлический барий.
Природное вещество и его местонахождение
Природный барий включает в себя семь изотопов. Их доли в составе вещества (в порядке убывания) и массовые числа:
- 71,66% — 138;
- 11,32% — 137;
- 7,81% — 136;
- 6,59% — 135;
- 2,42% — 134;
- 0,101% — 130;
- 0,097% — 132.
Изотоп с массовым числом 130 имеет огромный период полураспада, который во много раз превышает нынешний возраст Вселенной. Шесть других изотопов относятся к стабильному типу.
Что касается нахождения бария в природе, то в коре Земли он содержится в количестве 0,05% от общей массы этого слоя земного шара. В морской воде этот металл в среднем содержится в объеме 0,02 мг/л.
Природный барий из подгруппы щелочноземельных металлов активен. Его химические связи в составе минералов отличаются прочностью. Главными минералами, включающими в себя барий, считаются барит и витерит. К редким бариевым минералам относятся:
- гиалофан — бариево-калиевый алюмосиликат смешанного типа;
- цельзиан (также известен как бариевый полевой шпат) — бариевый алюмосиликат;
- нитробарит — бариевый нитрат.
Месторождения и их ценность
Природные месторождения бария называются баритовыми рудниками. Добываемые вещества, то есть баритовые руды, по минеральным ассоциациям подразделяются на две категории: комплексную и мономинеральную.
Руды комплексного типа, в свою очередь, делятся на следующие подвиды:
- барито-флюоритовый;
- барито-сульфидный;
- барито-кальцитовый;
- железо-баритовый.
Состав баритовых руд мономинерального типа не нуждается в дополнительном пояснении. Именно месторождения руд этой категории представляют наибольшую ценность (особенно гидротермальные жильные). Также с практической стороны интересны месторождения руд барито-флюоритового и барито-сульфидного типов.
Кроме того, для промышленности особое значение имеют россыпи элювиального типа, а также пластовые месторождения метасоматического типа. Что касается редко встречающихся осадочных месторождений, образованных химическими осадками водоемов, то их ценность минимальна.
Баритовые руды, относящиеся к комплексной категории, содержат множество других полезных и ценных компонентов:
- флюорит;
- золото;
- серебро;
- галенит (источник свинца);
- медь;
- сфалерит (источник цинка);
- железо;
- олово;
- никель;
- кальцит;
- кварц и так далее.
Дополнительные компоненты содержатся в баритовых рудах в промышленной концентрации. По этой причине комплексные руды имеют многоцелевое значение и применяются в самых разных областях и сферах.
Процесс получения
В качестве основного сырья в процессе получения бария используется так называемый баритовый концентрат — это 80-95-процентный бариевый сульфат (то же, что и сернокислый барий). Концентрированное вещество производится путем флотации (обогащения) барита — минерала, известного как тяжелый шпат.
Для последующего восстановления бариевого сульфата в производственном процессе используется либо каменноугольный кокс, либо природный газ. Затем сульфид нагревают для гидролиза до образования едкого барита — бариевого гидроксида. Альтернативный вариант (вместо нагревания и гидролиза) — превращение сульфида в бариевый карбонат нерастворимого типа посредством воздействия углекислым газом.
Следующее действие — перевод полученного вещества в бариевый оксид BaO. Для этого вещество прокаливают. Для прокаливания карбоната необходима температура свыше 1000 градусов Цельсия, а для гидроксида достаточно 800 градусов Цельсия.
Последний этап в процессе получения металлического бария — это электролиз расплава бариевого хлорида безводного типа. Вещество распадается на компоненты — барий и хлор отделяются друг от друга. Химическое уравнение, отражающее этот этап, максимально простое: BaCl2 = Ba + Cl2.
Барий обладает второй степенью окисления со знаком плюс. Валентность элемента совпадает с номером группы размещения в таблице Менделеева, то есть равна двум. Ковалентный радиус атома — 198 пикометров, а ионный — 134 пикометра.
По шкале Полинга показатель электроотрицательности бария составляет 0,89. Электродный потенциал элемента равняется -2,906. Энергия ионизации первого электрона достигает 502,5 кДж/моль, что равнозначно 5,21 электронвольта.
Согласно химическим свойствам бария, этот щелочноземельный металл:
- быстро окисляется на воздухе (в результате этого взаимодействия образуется смесь бариевых соединений — оксида и нитрида);
- воспламеняется даже при слабом нагревании;
- с водой реагирует энергично (результатом этой реакции служит образование бариевого гидроксида);
- с галогенами легко вступает в реакцию (образуются галогениды);
- с кислотами разбавленного типа взаимодействует активно.
Многие бариевые соли мало растворяются в воде или не растворяются полностью. К таким солям относятся:
- фосфат;
- сульфит;
- сульфат;
- карбонат.
Сульфид же, напротив, отлично растворяется в воде. Бариевые соли растворимого типа помогают установить содержание в растворе серной кислоты, а также ее растворимых солей. При их наличии в растворе выпадает осадок белого цвета — это бариевый сульфат, который не растворяется ни в кислотах, ни в воде.
Барий способен восстановить до соответствующего металла многие из таких соединений:
- галогениды;
- оксиды;
- сульфиды.
При совместном нагревании бария и водорода образуется бариевый гидрид. Кроме того, барий при нагревании вступает в реакцию с аммиаком. Бариевые соединения при попадании в пламя окрашивают его в насыщенный желто-зеленый цвет.
Термодинамические и физические свойства бария в форме простого вещества:
- молярный объем — 39 кубических сантиметров на моль;
- молярная теплоемкость — 28,1 джоуля на кельвин-моль;
- удельная теплота плавления — 7,66 килоджоуля на моль;
- удельная теплота испарения — 142 килоджоуля на моль.
В нормальных условиях плотность этого металла составляет 3,5 грамма на кубический сантиметр. Плавится он при температуре 1002 кельвина, а кипит при температуре 1910 кельвинов. Теплопроводность металла составляет 300 кельвинов или 18,4 ватта на метр-кельвин.
Такая физическая характеристика, как ковкость, не мешает барию раскалываться при резком ударе. По шкале Мооса твердость этого металла равна 1,25. Для хранения бария требуется определенная среда. Ее обеспечивает керосин или слой парафина, которым покрывают металл.
Области использования
Этот металл используется в самых разных отраслях. В электровакуумных приборах он играет роль геттера или, проще говоря, газопоглотителя. В металлургической отрасли и в производстве теплоносителей он используется в качестве антикоррозийного материала.
Помимо этого, барию найдено применение в следующих сферах:
- оптической;
- пиротехнической;
- медицинской и других.
Разумеется, это далеко не все области применения.
Воздействие на человека
Несмотря на активное использование бария в самых разных сферах, его биологическая роль пока мало изучена. К жизненно важным микроэлементам он не относится. Напротив, его воздействие на человеческий организм может быть смертельным.
В медицине применяется исключительно бариевый сульфат — это соединение нетоксично и нерастворимо. Что касается бариевых соединений, которые растворяются в воде, то их главная особенность — высокая токсичность. Абсолютно все они ядовиты и губительны для человеческого организма.
В зависимости от степени отравления бариевыми соединениями, человек может умереть всего за несколько часов (максимальный срок наступления летального исхода при сильном отравлении — сутки), поэтому крайне важно соблюдать максимальную осторожность при контакте с такими веществами и использовать их только по прямому назначению.
|
||||
| Внешний вид простого вещества | ||||
|---|---|---|---|---|
|
|
||||
| Свойства атома | ||||
| Имя, символ, номер |
Барий / Barium (Ba), 56 |
|||
| Атомная масса (молярная масса) |
137,327 а. е. м. (г/моль) |
|||
| Электронная конфигурация |
[Xe] 6s2 |
|||
| Радиус атома |
222 пм |
|||
| Химические свойства | ||||
| Ковалентный радиус |
198 пм |
|||
| Радиус иона |
(+2e) 134 пм |
|||
| Электроотрицательность |
0,89 (шкала Полинга) |
|||
| Электродный потенциал |
-2,906 |
|||
| Степени окисления |
2 |
|||
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
|||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) |
3,5 г/см³ |
|||
| Температура плавления |
1 002 K |
|||
| Температура кипения |
1 910 K |
|||
| Теплота плавления |
7,66 кДж/моль |
|||
| Теплота испарения |
142,0 кДж/моль |
|||
| Молярная теплоёмкость |
28,1[1] Дж/(K·моль) |
|||
| Молярный объём |
39,0 см³/моль |
|||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки |
кубическая |
|||
| Параметры решётки |
5,020 Å |
|||
| Прочие характеристики | ||||
| Теплопроводность |
(300 K) (18.4) Вт/(м·К) |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Типы месторождений
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 8 Качественный и количественный анализ
- 9 Применение
- 9.1 Вакуумные электронные приборы
- 9.2 Антикоррозионный материал
- 9.3 Сегнето- и пьезоэлектрик
- 9.4 Оптика
- 9.5 Пиротехника
- 9.6 Атомно-водородная энергетика
- 9.7 Высокотемпературная сверхпроводимость
- 9.8 Ядерная энергетика
- 9.9 Химические источники тока
- 9.10 Применение соединений бария в медицине
- 10 Цены
- 11 Биологическая роль и токсичность
- 12 См. также
- 13 Примечания
- 14 Литература
- 15 Ссылки
[править] История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[2]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
[править] Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый», так как его оксид (BaO) был охарактеризован, как имеющий необычно высокую для таких веществ плотность.
[править] Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
[править] Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
[править] Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространенным (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при распаде урана, тория и плутония.
[править] Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200—1250 °C:
Очищают барий перегонкой в вакууме или зонной плавкой.
[править] Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объемно-центрированной решеткой (параметр а = 0,501 нм), выше устойчив β-Ba.
Твердость по минералогической шкале 1,25.[3]
Хранят металлический барий в керосине или под слоем парафина.
[править] Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который в свою очередь с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
[править] Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[4].
Соединения бария окрашивают пламя в желто-зеленый цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
[править] Применение
[править] Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
[править] Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
[править] Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
[править] Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
[править] Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
[править] Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
[править] Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
[править] Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
[править] Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
[править] Применение соединений бария в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
[править] Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
[править] Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твердый неправильный пульс, судороги, позже возможны и параличи, синюха лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжелого отравления смерть наступает внезапно или в течение одних суток. Тяжелые отравления наступают при приеме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10-20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
[править] См. также
- Бария титанат
[править] Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
[править] Литература
- Барий // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
[править] Ссылки
| Барий на Викискладе? |
- Барий на Webelements
- Барий в Популярной библиотеке химических элементов
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
|
Соединения бария |
|---|
|
Азид бария (Ba(N3)2) • Амид бария (Ba(NH2)2) • Арсенид бария (Ba3As2) • Ацетат бария (Ba(CH3COO)2) • Бромат бария (Ba(BrO3)2) • Бромид бария (BaBr2) • Вольфрамат бария (BaWO4) • Гексаборид бария (BaB6) • Гидрид бария (BaH2) • Гидроарсенат бария (BaHAsO4) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Гидрофосфат бария (BaHPO4) • Гипонитрит бария (BaN2O2) • Гипохлорит бария (Ba(ClO)2) • Дигидрофосфат бария (Ba(H2PO4)2) • Диарсенат бария (Ba2As2O7) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаарсенат бария (Ba(AsO3)2) • Метаборат бария (Ba(BO2)2) • Молибдат бария (BaMoO4) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Ортоарсенат бария (Ba3(AsO4)2) • Перманганат бария (Ba(MnO4)2) • Пероксид бария (BaO2) • Пероксодисульфат бария (BaS2O6(O2)) • Перхлорат бария (BaClO4) • Пирофосфат бария (Ba2P2O7) • Селенат бария (BaSeO4) • Селенид бария (BaSe) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Теллурат бария (BaTeO4) • Теллурид бария (BaTe) • Тиосульфат бария (BaSO3S) • Тиоцианат бария (Ba(SCN)2) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Формиат бария (Ba(HCOO)2) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3) |
Ба́рий (лат. Barium), Ba, химический элемент II группы короткой формы (2-й группы длинной формы) периодической системы; относится к щёлочноземельным металлам; атомный номер 56, атомная масса 137,327. В природе 7 стабильных нуклидов, среди которых преобладает 138Ba (71,7 %); около 30 нуклидов получены искусственно.
Историческая справка
Барий в виде оксида открыл в 1774 г. К. Шееле, который обнаружил неизвестную ранее «землю», позже названную «тяжёлой землёй» – баритом (от греч. βαρύς – тяжёлый). В 1808 г. Г. Дэви получил металлический барий в виде амальгамы электролизом расплавленных солей.

Распространённость в природе
Содержание бария в земной коре составляет 5·10–2 % по массе. Вследствие высокой химической активности в свободном виде не встречается. Основные минералы: барит BaSO4 и витерит BaCO3. Мировое производство BaSO4 около 8,2 млн т/год (2020).
Свойства
Конфигурация внешней электронной оболочки атома бария 6s2; в соединениях проявляет степень окисления +2, редко +1; электроотрицательность по Полингу 0,89; атомный радиус 217,3 пм, радиус иона Ba2+ 149 пм (координационное число 6). Энергия ионизации Ba0→Ba+→Ba2+ 502,8 и 965,1 кДж/моль. Стандартный электродный потенциал пары Ba2+/Ba в водном растворе –2,906 B.
Барий – серебристо-белый ковкий металл; tпл 729 °С, tкип 1637 °С. При нормальном давлении кристаллическая решётка бария кубическая объёмноцентрированная; при 19 °С и 5530 МПа образуется гексагональная модификация. При 293 К плотность бария 3594 кг/м3, теплопроводность 18,4 Вт/(м·К), электрическое сопротивление 5·10–7 Ом·м. Барий парамагнитен; удельная магнитная восприимчивость 1,9·10–9 м3/кг.
Металлический барий быстро окисляется на воздухе; его хранят в керосине или под слоем парафина. Барий взаимодействует при обычной температуре с кислородом, образуя оксид бария BaO, и с галогенами, образуя галогениды. Прокаливанием BaO в токе кислорода или воздуха при 500 °C получают пероксид BaO2 (разлагается до BaO при 800 °C). Для реакций с азотом и водородом необходимо нагревание, продуктами реакций являются нитрид Ba3N2 и гидрид BaH2. Барий реагирует с парáми воды даже на холоде; в воде энергично растворяется, давая гидроксид Ba(OH)2, обладающий свойствами щелочей. С разбавленными кислотами барий образует соли. Из наиболее широко используемых солей бария растворимы в воде: хлорид BaCl2 и другие галогениды, нитрат Ba(NO3)2, хлорат Ba(ClO3)2, ацетат Ba(OOCCH3)2, сульфид BaS; плохо растворимы – сульфат BaSO4, карбонат BaCO3, хромат BaCrO4. Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла. С большинством металлов барий образует сплавы, иногда сплавы содержат интерметаллиды. Так, в системе Ba – Al обнаружены BaAl, BaAl2, BaAl4.
Растворимые соли бария токсичны; практически нетоксичен BaSO4.
Получение
Основное сырьё для производства бария – баритовый концентрат (80–95 %) BaSO4, который восстанавливают каменным углем, коксом или природным горючим газом; образующийся сульфид бария перерабатывают в другие соли этого элемента. Прокаливанием соединений бария получают BaO. Технически чистый металлический барий (96–98 % по массе) получают термическим восстановлением оксида BaO порошком Al. Перегонкой в вакууме барий очищают до содержания примесей менее 10–4 %, зонной плавкой – до 10–6 %. Другой способ получения бария из BaO – электролиз расплава оксида. Небольшие количества бария получают восстановлением бериллата BaBeO2 при 1300 °С титаном.
Применение
Барий используют как раскислитель меди и свинца, в качестве присадки к антифрикционным сплавам, чёрным и цветным металлам, а также к сплавам, применяемым для изготовления типографских шрифтов с целью увеличения их твёрдости. Из сплавов бария с никелем изготовляют электроды запальных свечей в двигателях внутреннего сгорания и в радиолампах. Сплав бария с алюминием – альба, содержащий 56 % Ba, основа геттеров. Металлический барий – материал для анодов в химических источниках тока. Активной частью большинства термоэмиссионных катодов является оксид бария. Пеpоксид бария используют в качестве окислителя, отбеливателя, в пиротехнике; ранее его применяли для регенерации кислорода из CO2. Гексаферрит бария BaFe12O19 – перспективный материал для использования в устройствах хранения информации; BaFe12O19 применяют для изготовления постоянных магнитов. BaSO4 вводят в буровые растворы при добыче нефти и газа. Титанат бария BaTiO3 – один из важнейших сегнетоэлектриков. Нуклид 140Ba (β-излучатель, период полураспада T1/2 12,8 суток) – изотопный индикатор, используемый для исследования соединений бария. Поскольку соединения бария хорошо поглощают рентгеновское и γ-излучение, их вводят в состав защитных материалов рентгеновских установок и ядерных реакторов. BaSO4 применяют как контрастное вещество для рентгенологических исследований желудочно-кишечного тракта.
Зайцев Дмитрий Дмитриевич. Первая публикация: Большая российская энциклопедия, 2005.
Дата публикации: 24 августа 2022 г. в 10:37 (GMT+3)





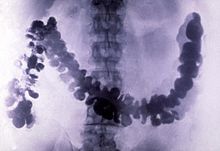














![mathsf{[Ba(NH_3)_6] rightarrow Ba(NH_2)_2 + 4NH_3 + H_2}](https://dic.academic.ru/dic.nsf/ruwiki/d537a896ed9dcb62c864ab22de8e3530.png)
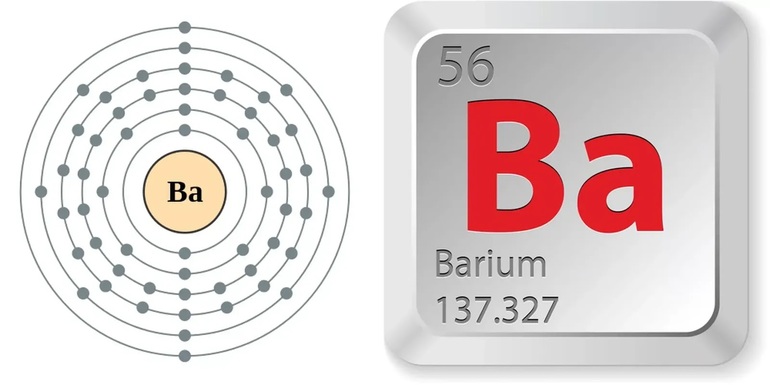
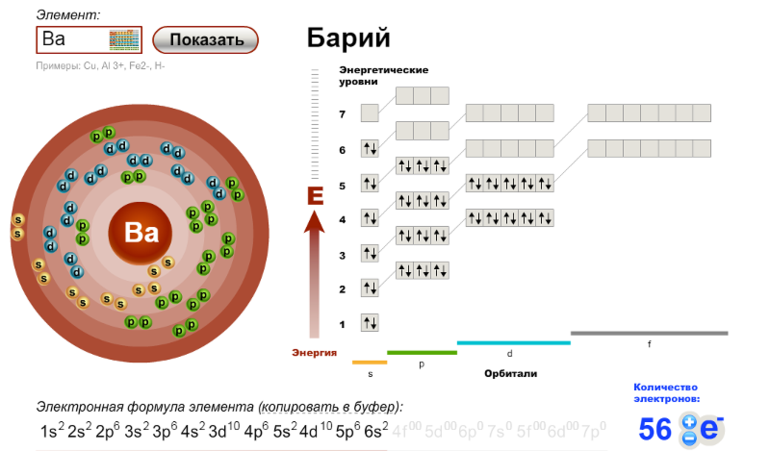

















![mathsf{[Ba(NH_3)_6] rightarrow Ba(NH_2)_2 + 4NH_3 + H_2}](https://web.archive.org/web/20130426165131im_/http://upload.wikimedia.org/math/d/5/3/d537a896ed9dcb62c864ab22de8e3530.png)