ЦИНК (химический элемент)
ЦИНК (лат. Zincum), Zn (читается «цинк»), химический элемент с атомным номером 30, атомная масса 65,39. Природный цинк состоит из смеси пяти стабильных нуклидов: 64Zn (48,6% по массе), 66Zn (27,9%), 67Zn (4,1%), 68Zn (18,8%) и 70Zn (0,6%). Расположен в четвертом периоде в группе IIВ периодической системы. Конфигурация двух внешних электронных слоев 3s2p6d104s2. В соединениях проявляет степень окисления +2 (валентность II).
Радиус атома Zn 0,139 нм, радиус иона Zn2+0,060 нм (координационное число 4), 0,0740 нм (координационное число 6) и 0,090 нм (координационное число 8). Энергии последовательной ионизации атома соответствуют 9,394, 17,964, 39,7, 61,6 и 86,3 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,66.
Историческая справка
Сплавы цинка с медью — латуни (см. ЛАТУНЬ) — были известны еще древним грекам и египтянам. Цинк получали в 5 в. до н. э. в Индии. Римский историк Страбон (см. СТРАБОН) в 60—20 годах до н. э. писал о получении металлического цинка, или «фальшивого серебра». В дальнейшем секрет получения цинка в Европе был утерян, так как образующийся при термическом восстановлении цинковых руд цинк при 900°C переходит в пар. Пары цинка реагируют с кислородом (см. КИСЛОРОД) воздуха, образуя рыхлый оксид цинка, который алхимики называли «белой шерстью».
В 1743 в Бристоле открылся первый завод по получению металлического цинка, где цинковую руду восстанавливали в ретортах без доступа воздуха. В 1746 А. С. Маргграф (см. МАРГГРАФ Андреас Сигизмунд) разработал способ получения металла прокаливанием смеси его окиси с углем без доступа воздуха в ретортах с последующей конденсацией паров цинка в холодильниках.
Слово «цинк» встречается в трудах Парацельса (см. ПАРАЦЕЛЬС) и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Название этого металла за его историю несколько раз менялось. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Содержание цинка в земной коре 8,3·10–3% по массе, в воде Мирового океана 0,01 мг/л. Известно 66 минералов цинка, важнейшие из них: сфалерит (см. СФАЛЕРИТ), клейофан (см. КЛЕЙОФАН), марматит (см. МАРМАТИТ), вюртцит, (см. ВЮРТЦИТ) смитсонит (см. СМИТСОНИТ) ZnCO3, каламин (см. КАЛАМИН) Zn4(OH)4Si2O7·H2O, цинкит (см. ЦИНКИТ) ZnO, виллемит (см. ВИЛЛЕМИТ). Цинк входит в состав полиметаллических руд, которые содержат также медь, свинец, кадмий, индий (см. ИНДИЙ), галлий (см. ГАЛЛИЙ), таллий (см. ТАЛЛИЙ) и другие. Цинк — важный биогенный элемент: в живом веществе содержится 5·10–4% по массе.
Получение
Цинк добывают из полиметаллических руд, содержащих 1—4% Zn в виде сульфида. Руду обогащают, получая цинковый концентрат (50—60%). Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в ZnO. От ZnO к Zn идут двумя путями. По пирометаллургическому методу концентрат спекают, а затем восстанавливают углем или коксом при 1200—1300°C. Затем испарившиеся из печи пары цинка конденсируют.
ZnO + C = Zn + CO.
Основной способ получения цинка гидрометаллургический. Обожженные концентраты обрабатывают серной кислотой. Из полученного сульфатного раствора удаляют примеси, осаждая их цинковой пылью. Очищенный раствор подвергают электролизу. Цинк осаждается на алюминиевых катодах. Чистота электролитного цинка 99,95%.
Для получения цинка высокой чистоты применяют зонную плавку (см. ЗОННАЯ ПЛАВКА).
Физические и химические свойства
Цинк — голубовато-белый металл.
Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. Температура плавления 419,58°C, температура кипения 906,2°C, плотность 7,133 кг/дм3. При комнатной температуре хрупок. При 100—150°C пластичен. Стандартный электродный потенциал –0,76 В, в ряду стандартных потенциалов расположен до железа Fe.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного (см. АМФОТЕРНОСТЬ) белого оксида ZnO.
2Zn + O2 = 2ZnO
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH (сплавление)= Na2ZnO2 + Н2О
В этой реакции образуется цинкат натрия Na2ZnO2.
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами (см. ГАЛОГЕНЫ) с образованием галогенидов ZnHal2. С фосфором (см. ФОСФОР) цинк образует фосфиды Zn3P2 и ZnP2.С серой (см. СЕРА) и ее аналогами — селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) — различные халькогениды (см. ХАЛЬКОГЕНИДЫ), ZnS, ZnSe, ZnSe2и ZnTe.
С водородом (см. ВОДОРОД), азотом (см. АЗОТ), углеродом (см. УГЛЕРОД), кремнием (см. КРЕМНИЙ) и бором (см. БОР (химический элемент)) цинк непосредственно не реагирует. Нитрид Zn3N2получают реакцией цинка с аммиаком (см. АММИАК) NH3 при 550—600°C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
Основная часть производимого цинка расходуется на изготовление антикоррозионных покрытий железа и стали. Цинк применяют в аккумуляторах и сухих элементах питания. Листовой цинк используют в типографском деле. Сплавы цинка (латунь, нейзильбер и другие) применяются в технике. ZnO служит пигментом в цинковых белилах. Соединения цинка являются полупроводниками. Раствором хлорида цинка ZnCl2 пропитывают железнодорожные шпалы, предохраняя их от гниения.
Физиологическое действие
Цинк входит в состав более 40 металлоферментов, катализирующих в организме человека гидролиз пептидов, белков и других соединений. Цинк входит в состав гормона инсулина. (см. ИНСУЛИН) В организм человека цинк поступает с мясом, молоком, яйцами.
Растения при недостатке цинка в почве заболевают.
Металлический цинк мало токсичен. Фосфид и оксид цинка ядовиты. Попадание в организм растворимых солей цинка приводит к расстройству пищеварения, раздражению слизистых оболочек. ПДК для цинка в воде 1,0 мг/л.
Энциклопедический словарь.
2009.
У этого термина существуют и другие значения, см. Цинк (значения).
| Цинк | |||
|---|---|---|---|
| ← Медь | Галлий → | |||
|
|||

Образцы очищенного цинка |
|||
| Название, символ, номер | Цинк / Zincum (Zn), 30 | ||
| Группа, период, блок | 12 (устар. 2), 4, d-элемент |
||
| Атомная масса (молярная масса) |
65,38(2)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация | [Ar] 3d104s2 1s22s22p63s23p63d104s2 |
||
| Радиус атома | 138 пм | ||
| Ковалентный радиус | 125 пм | ||
| Радиус иона | (+2e) 74 пм | ||
| Электроотрицательность | 1,65 (шкала Полинга) | ||
| Электродный потенциал | −0,76 В | ||
| Степени окисления | 0, +2 | ||
| Энергия ионизации (первый электрон) |
905,8 (9,39) кДж/моль (эВ) | ||
| Плотность (при н. у.) | 7,133 г/см³ | ||
| Температура плавления | 419,6 °C | ||
| Температура кипения | 906,2 °C | ||
| Уд. теплота плавления | 7,28 кДж/моль | ||
| Уд. теплота испарения | 114,8 кДж/моль | ||
| Молярная теплоёмкость | 25,4[2] Дж/(K·моль) | ||
| Молярный объём | 9,2 см³/моль | ||
| Структура решётки | Гексагональная | ||
| Параметры решётки | a = 2,6648, c = 4,9468 Å | ||
| Отношение c/a | 1,856 | ||
| Температура Дебая | 234 K | ||
| Теплопроводность | (300 K) 116 Вт/(м·К) | ||
| Номер CAS | 7440-66-6 |
Цинк (химический символ — Zn, от лат. Zincum) — химический элемент 12-й группы (по устаревшей классификации — второй группы побочной подгруппы, IIB), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30.
Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История[править | править код]
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII век), Китае (XI век). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом[en] был запатентован дистилляционный способ получения цинка[3]. В промышленном масштабе выплавка цинка началась также в XVIII веке: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом[4][5]:15. В 1746 году А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка[4].
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C[5]:28. Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года[5]:86. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США[5]:82.
Происхождение названия[править | править код]
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом лат. zincum или zinken в книге Liber Mineralium II[6]. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)[7].
Нахождение в природе[править | править код]
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространённый минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы цинка[источник не указан 114 дней]: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька[стиль].
Среднее содержание цинка в земной коре — 8,3⋅10−3 %, в основных изверженных породах его несколько больше (1,3⋅10−2 %), чем в кислых (6⋅10−3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5⋅10−4 % цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения[править | править код]
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане[8]. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»[9][неавторитетный источник?]. На территории Красноярского края в Нижнем Приангарье разрабатывается уникальное Горевское месторождение полиметаллов с запасами цинка 1004,5 тыс. тонн по категориям А + В + С1 и 798,4 тыс. тонн по категории С2. Месторождение было открыто в 1956 году, эксплуатация начата в 1975 году, однако первые сведения о наличии руд в прилегающих районах относятся к 1770-м годам. В 2012 году добыча цинка составила 25,8 тыс. тонн. Разработку месторождения ведёт группа компаний. Также разведаны месторождения Партизанское и Суровое на западе Таймырского полуострова. Прогнозные ресурсы цинка — 500 тыс. тонн.[10]
Изотопы[править | править код]
Цинк имеет пять стабильных изотопов (64Zn, 66Zn, 67Zn, 68Zn и 70Zn).
Получение[править | править код]
Цинк в природе как самородный металл не встречается.
Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С → Zn + CO. Образующиеся при этом пары́ металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией даёт металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства[править | править код]
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Собственная концентрация носителей заряда в цинке — 13,1⋅1028 м−3.
Химические свойства[править | править код]
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой плёнкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
так и со щелочами:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение[править | править код]
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, ёмкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм3, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм3), диоксисульфатно-ртутный элемент, иодатно-цинковый элемент, медно-окисный гальванический элемент (0,7—1,6 В, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм3), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (1,82 В, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм3), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии[5]:30—31.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Сульфид цинка используется при изготовлении люминофоров краткого послесвечения и других люминесцирующих составов, обычно это смеси ZnS и CdS, активированные ионами других металлов. Люминофоры на базе сульфидов цинка и кадмия также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
На разные применения цинка приходится:
- цинкование — 45—60 %,
- медицина (оксид цинка как антисептик) — 10 %,
- производство сплавов — 10 %,
- производство резиновых шин — 10 %,
- масляные краски — 10 %.
Мировое производство[править | править код]
Цинк — четвёртый по использованию металл в мире после железа, алюминия и меди, и третий среди цветных металлов. Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше, чем в 2008 г.[11] производство цинка в мире может увеличиться в мире в 2024 году до 14 млн тонн в год.[12]
Цена цинка в октябре 2021 года поднялась в Лондоне до 3528,5 USD/т, +3,7 %.[13]
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»)[14]:
Биологическая роль[править | править код]
В организме взрослого человека содержится в среднем около 2 г цинка в виде его соединений, который концентрируется преимущественно в простате, мышцах, печени и поджелудочной железе. В 50 миллилитрах человеческой спермы содержится около 10 миллиграмов цинка. Более 400 ферментов содержат цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных эфиров, образование альдегидов, полимеризацию ДНК и РНК. Ионы Zn2+ в составе ферментов вызывают поляризацию молекул воды и органических веществ, содействуя их депротонированию по реакции
- Zn2+ + H2O = ZnOH+ + H+
Наиболее изучен фермент карбоангидраза — белок, содержащий цинк и состоящий примерно из 260 аминокислотных остатков. Этот фермент содержится в эритроцитах крови и способствует превращению углекислого газа, образующегося в тканях в процессе их жизнедеятельности, в гидрокарбонат-ионы и угольную кислоту, которая кровью переносится в лёгкие, где выводится из организма в виде углекислого газа. В отсутствие фермента превращение СО2 в анион HCO3− протекает с очень низкой скоростью. В молекуле карбоангидразы атом цинка связан с тремя имидазольными группами остатков аминокислоты гистидина и молекулой воды, которая легко депротонируется, превращаясь в координированный гидроксид. Атом углерода молекулы углекислого газа, на котором находится частичный положительный заряд, вступает во взаимодействие с атомом кислорода гидроксильной группы. Таким образом, координированная молекула СО2 превращается в гидрокарбонат-анион, который покидает активный центр фермента, замещаясь на молекулу воды. Фермент ускоряет эту реакцию гидролиза в 10 миллионов раз.
Цинк
- необходим для продукции спермы и мужских гормонов[16],
- необходим для метаболизма витамина E,
- важен для нормальной деятельности простаты,
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста[16],
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы[16].
Содержание в продуктах питания[править | править код]
Рекомендуемая дневная норма цинка в рационе — 11 мг для мужчин и 8 мг для женщин[17]. В периоды активной половой жизни суточная потребность цинка у мужчин возрастает и составляет 30—70 мг. Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах, тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде.
Содержание цинка в продуктах на 100 г[18]:
- Орехи и семечки: тыквенные семечки — 10 мг, кунжут — 7 мг, кедровый орех — 6,4 мг, семена подсолнечника — 5,3 мг, миндаль — 3 мг, грецкие орехи — 3 мг.
- Мясо: говяжья печень — 4 мг, говядина — 3—8,4 мг, баранина — 2—6 мг, курица — 0,8—3,5 мг, свинина — 0,8—3,5 мг.
- Бобовые: чечевица — 4,78 мг, арахис — 4 мг, горох — 1,2 мг, соевые бобы — 3 мг.
- Молочные продукты: твёрдый сыр — 3—4 мг, мороженое, йогурт — 0,7—0,8 мг, молоко — 0,4 мг.
- Злаки и хлеб: овёс — 3,97, пшеница — 3,46 мг, рожь — 2,65 мг, рис — 1 мг, хлеб — 0,7—1,5 мг, печенье — 0,5—1 мг, мука пшеничная — 0,8 мг.
- Рыба и морепродукты: устрицы — 16—40 мг, анчоусы — 1,72 мг, осьминог — 1,68 мг, карп — 1,48 мг, икра — 1 мг, сельдь — 0,99 мг.
- Овощи и фрукты: зелёный горошек — 1,24 мг, ростки бамбука — 1,10 мг, кукуруза (варёная, консервированная) — 0,5—0,6 мг, финики — 0,44 мг, малина — 0,42 мг, брокколи — 0,41 мг, свёкла — 0,35 мг, картофель — 0,29 мг, чёрная смородина — 0,27 мг, инжир, бананы — 0,15 мг, апельсины — 0,07 мг, грейпфрут — 0,07 мг, лимоны — 0,06 мг, яблоки — 0,04 мг.
- Сладости: какао-порошок (неподслащенный) — 6,81 мг, шоколад — 2,3 мг, шоколадные конфеты — 1—2 мг, мёд — 0,22 мг.
Также цинк может присутствовать в минеральной воде.
Основные проявления дефицита цинка[править | править код]
Недостаток цинка в организме приводит к ряду расстройств. Среди них — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие[19].
Для оценки содержания цинка в организме определяют его содержание в волосах, крови и её сыворотке.
Токсичность[править | править код]
При длительном поступлении в организм в больших количествах всех солей цинка, особенно сульфатов и хлоридов, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжёлое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление сульфатом цинка происходит при вдыхании его мелкодисперсных частиц (пыли). Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
См. также[править | править код]
- Категория:Соединения цинка
- Цинкаты
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.). — Pure and Applied Chemistry, 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ Химическая энциклопедия: в 5 т. / Редкол.: Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1999. — Т. 5. — С. 378.
- ↑ Pollard A., Heron C. Archaeological Chemistry (англ.). — Royal Society of Chemistry, 2008. — P. 204.
- ↑ 1 2 Gray L. Zinc (англ.). — Marshall Cavendish, 2006. — P. 9.
- ↑ 1 2 3 4 5 Казаков Б. И. Металл из Атлантиды. (О цинке). — М.: Металлургия, 1984. — 128 с.
- ↑ Hoover, Herbert Clark (2003), Georgius Agricola de Re Metallica, Kessinger Publishing, с. 409, ISBN 0766131971.
- ↑ Gerhartz, Wolfgang (1996), Ullmann’s Encyclopedia of Industrial Chemistry (5th ed.), VHC, с. 509, ISBN 3527201009.
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны) (недоступная ссылка). Дата обращения: 29 ноября 2010. Архивировано 19 июня 2010 года.
- ↑ Дальполиметалл.
- ↑ Месторождения цинка. Энциклопедия Красноярского края (19 декабря 2014).
- ↑ Мир сократил производство и потребление цинка, а Китай — увеличил.
- ↑ Рынок цинка в 2020 г.: аналитический обзор УГМК // Новости металлургии. Металлоснабжение и сбыт.
- ↑ Металлы бьют рекорды на фоне сокращения поставок из-за энергетического кризиса // ProFinance.Ru.
- ↑ Minerals Yearbook 2006.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Ориентировочные данные.
- ↑ 1 2 3 А. В. Скальный. Цинк и здоровье человека. — РИК ГОУ ОГУ, 2003.
- ↑ Connie W. Bales; Christine Seel Ritchie. Handbook of Clinical Nutrition and Aging.
- ↑ Show Nutrients List.
- ↑ Сайт «Центра биотической медицины» (недоступная ссылка). Дата обращения: 30 мая 2011. Архивировано 3 февраля 2011 года.
Ссылки[править | править код]
- Цинк на Webelements
- Цинк в Популярной библиотеке химических элементов Архивная копия от 8 августа 2006 на Wayback Machine
- Цинк и цинковые аноды
|
|
|
| Название, символ, номер | Цинк / Zincum (Zn), 30 |
|---|---|
| Атомная масса (молярная масса) |
65,38(2) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s2 |
| Радиус атома | 138 пм |
| Ковалентный радиус | 125 пм |
| Радиус иона | (+2e) 74 пм |
| Электроотрицательность | 1,65 (шкала Полинга) |
| Электродный потенциал | -0,76 В |
| Степени окисления | 0; +2 |
| Энергия ионизации (первый электрон) |
905,8(9,39) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,133 г/см³ |
| Температура плавления | 419,6 °C |
| Температура кипения | 906,2 °C |
| Уд. теплота плавления | 7,28 кДж/моль |
| Уд. теплота испарения | 114,8 кДж/моль |
| Молярная теплоёмкость | 25,4 Дж/(K·моль) |
| Молярный объём | 9,2 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,6648 c=4,9468 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
| Теплопроводность | (300 K) 116 Вт/(м·К) |
| Номер CAS | 7440-66-6 |
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Месторождения
- 4 Получение
- 5 Физические свойства
- 6 Химические свойства
- 7 Применение
- 7.1 Мировое производство
- 8 Биологическая роль
- 8.1 Содержание в продуктах питания
- 8.2 Основные проявления дефицита цинка
- 9 Токсичность
Слиток цинка
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка. В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом. В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C . Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США.
Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы).
Нахождение в природе
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространённый минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Среднее содержание цинка в земной коре — 8,3⋅10-3%, в основных извержённых породах его несколько больше (1,3⋅10-2%), чем в кислых (6⋅10-3%). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5⋅10-4% цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл».
Получение
Цинк в природе как самородный металл не встречается.
Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Собственная концентрация носителей заряда в цинке — 13,1⋅1028 м−3.
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
-
- 2Zn + O2 → 2ZnO
Оксид цинка реагирует как с растворами кислот:
-
- ZnO + 2HCl → ZnCl2 + H2O
так и щелочами:
-
- ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
Цинк обычной чистоты активно реагирует с растворами кислот:
-
- Zn + 2HCl → ZnCl2 + H2↑
и растворами щелочей:
-
- Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Сульфид цинка используется при изготовлении люминофоров краткого послесвечения и других люминесцирующих составов, обычно это смеси ZnS и CdS, активированные ионами других металлов. Люминофоры на базе сульфидов цинка и кадмия также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
На разные применения цинка приходится:
- цинкование — 45—60 %
- медицина (оксид цинка как антисептик) — 10 %
- производство сплавов — 10 %
- производство резиновых шин — 10 %
- масляные краски — 10 %
Мировое производство
Основная статья: Список стран по выплавке цинка
Цинк — четвёртый по использованию металл в мире после железа, алюминия и меди, и третий среди цветных металлов. Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше, чем в 2008 г.
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»):
| Список стран по производству цинка | ||
|---|---|---|
| Место | Страна | Производительность (тонн) |
| — | Весь мир | 10,000,000 |
| 1 | Китай | 2,600,000 |
| 2 | Австралия | 1,380,000 |
| 3 | Перу | 1,201,794 |
| 4 | США | 727,000 |
| 5 | Канада | 710,000 |
| 6 | Мексика | 480,000 |
| 7 | Ирландия | 425,700 |
| 8 | Индия | 420,800 |
| 9 | Казахстан | 400,000 |
| 10 | Швеция | 192,400 |
| 11 | Россия | 190,000 |
| 12 | Бразилия | 176,000 |
| 13 | Боливия | 175,000 |
| 14 | Польша | 135,600 |
| 15 | Иран | 130,000 |
| 16 | Марокко | 73,000 |
| 17 | Намибия | 68,000 |
| 18 | Северная Корея | 67,000 |
| 19 | Турция | 50,000 |
| 20 | Вьетнам | 48,000 |
| 21 | Таиланд | 45,000 |
| 22 | Гондурас | 37,646 |
| 23 | Финляндия | 35,700 |
| 24 | ЮАР | 34,444 |
| 25 | Чили | 31,725 |
| 26 | Аргентина | 30,300 |
| 27 | Болгария | 17,300 |
| 28 | Румыния | 9,600 |
| 29 | Япония | 7,169 |
| 30 | Алжир | 5,000 |
| 31 | Саудовская Аравия | 1,500 |
| 32 | Грузия | 400 |
| 33 | Босния и Герцеговина | 300 |
| 34 | Мьянма | 100 |
Биологическая роль
В организме взрослого человека содержится в среднем около 2 г цинка, в виде его соединений, который концентрируется преимущественно в мышцах, печени и поджелудочной железе. Более 400 ферментов содержат цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных эфиров, образование альдегидов, полимеризацию ДНК и РНК. Ионы Zn2+ в составе ферментов вызывают поляризацию молекул воды и органических веществ, содействуя их депротонированию по реакции:
-
- Zn2+ + H2O = ZnOH+ + H+
Наиболее изучен фермент карбоангидраза — белок, содержащий цинк и состоящий примерно из 260 аминокислотных остатков. Этот фермент содержится в эритроцитах крови и способствует превращению углекислого газа, образующегося в тканях в процессе их жизнедеятельности, в гидрокарбонат-ионы и угольную кислоту, которая кровью переносится в легкие, где выводится из организма в виде углекислого газа. В отсутствие фермента превращение CO2 в анион HCO3— протекает с очень низкой скоростью. В молекуле карбоангидразы атом цинка связан с тремя имидазольными группами остатков аминокислоты гистидина и молекулой воды, которая легко депротонируется, превращаясь в координированный гидроксид. Атом углерода молекулы углекислого газа, на котором находится частичный положительный заряд, вступает во взаимодействие с атомом кислорода гидроксильной группы. Таким образом, координированная молекула CO2 превращается в гидрокарбонат-анион, который покидает активный центр фермента, замещаясь на молекулу воды. Фермент ускоряет эту реакцию гидролиза в 10 миллионов раз.
Цинк:
- необходим для продукции спермы и мужских гормонов
- необходим для метаболизма витамина E.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.
Содержание в продуктах питания
Рекомендуемая дневная норма цинка в рационе — 11 мг для мужчин и 8 мг для женщин. Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах, тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде.
Содержание цинка в продуктах на 100 г:
- Орехи и семечки: тыквенные семечки — 10 мг, кунжут — 7 мг, семена подсолнечника — 5,3 мг, миндаль — 3 мг, грецкие орехи — 3 мг.
- Мясо: говяжья печень — 4 мг, говядина — 3—8,4 мг, баранина — 2—6 мг, курица — 0,8—3,5 мг, свинина — 0,8—3,5 мг.
- Бобовые: чечевица — 4,78 мг, арахис — 4 мг, горох — 1,2 мг, соевые бобы — 3 мг.
- Молочные продукты: твёрдый сыр — 3—4 мг, мороженое, йогурт — 0,7—0,8 мг, молоко — 0,4 мг.
- Злаки и хлеб: овёс — 3,97, пшеница — 3,46 мг, рожь — 2,65 мг, рис — 1 мг, хлеб — 0,7—1,5 мг, печенье — 0,5—1 мг, мука пшеничная — 0,8 мг.
- Рыба и морепродукты: устрицы — 16—40 мг, анчоусы — 1,72 мг, осьминог — 1,68 мг, карп — 1,48 мг, икра — 1 мг, сельдь — 0,99 мг.
- Овощи и фрукты: зелёный горошек — 1,24 мг, ростки бамбука — 1,10 мг, кукуруза (варёная, консервированная) — 0,5—0,6 мг, финики — 0,44 мг, малина — 0,42 мг, брокколи — 0,41 мг, свёкла — 0,35 мг, картофель — 0,29 мг, чёрная смородина — 0,27 мг, инжир, бананы — 0,15 мг, апельсины — 0,07 мг, грейпфрут — 0,07 мг, лимоны — 0,06 мг, яблоки — 0,04 мг.
- Сладости: какао-порошок (неподслащенный) — 6,81 мг, шоколад — 2,3 мг, шоколадные конфеты — 1—2 мг, мёд — 0,22 мг.
Также цинк может присутствовать в минеральной воде.
Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие.
Для оценки содержания цинка в организме определяют его содержание в волосах, крови и её сыворотке.
Токсичность
При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
1. Положение цинка в периодической системе химических элементов
2. Электронное строение цинка
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой
7.1.3. Взаимодействие с фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с щелочами
7.2.6. Взаимодействие с окислителями
Оксид цинка
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с основными оксидами
2.2. Взаимодействие с основаниями
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотными оксидами
2.5. Взаимодействие с кислотами
2.6. Взаимодействие с восстановителями
2.7. Вытеснение более летучих оксидов из солей
Гидроксид цинка
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с щелочами
2.4. Разложение при нагревании
Соли цинка
Цинк
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии:
+30Zn 1s22s22p63s23p63d104s2
1s
2s 2p
3s 3p
3d
4s
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см3.
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10-3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе, который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический). При этом сульфид цинка обрабатывают серной кислотой:
ZnO + H2SO4 → ZnSO4 + H2O
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами. При этом образуется белый осадок гидроксида цинка.
Например, хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Обратите внимание, если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl
Химические свойства
1. Цинк – сильный восстановитель. Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами.
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Zn + I2 → ZnI2
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором. При этом образуется бинарное соединение — фосфид:
3Zn + 2P → Zn3P2
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn0 + H2+O → Zn+2O + H20
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, цинк реагирует с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Zn + H2SO4 → ZnSO4 + H2
2.3. Цинк реагирует с концентрированной серной кислотой. В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Zn + 2H2SO4(конц.) → ZnSO4 + SO2 + 2H2O
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S + 4H2O
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV), нитрат цинка и вода:
Zn + 4HNO3(конц.)→ Zn(NO3)2 + 2NO2 + 2H2O
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония, нитрат цинка и вода:
4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии цинка с раствором щелочи образуется тетрагидроксоцинкат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
Zn + 2NаОН(крист.) Nа2ZnО2 + Н2
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2
2.6. Цинк вытесняет менее активные металлы из оксидов и солей.
Например, цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример: цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
4Zn + KNO3 + 7KOH = NН3 + 4K2ZnO2 + 2H2O
4Zn + 7NaOH + 6H2O + NaNO3 = 4Na2[Zn(OH)4] + NH3
3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn + NaNO3 + 2HCl = ZnCl2 + NaNO2 + H2O
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами:
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
Zn(OН)2 → ZnO + H2O
3. Оксид цинка можно получить разложением нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Химические свойства
Оксид цинка — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например, оксид цинка взаимодействует с оксидом натрия:
ZnO + Na2O → Na2ZnO2
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом оксид цинка проявляет кислотные свойства.
Например, оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
ZnO + 2NaOH → Na2ZnO2 + H2O
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами. При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
ZnO + SO3 → ZnSO4
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства.
Например, оксид цинка при нагревании реагирует с углеродом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната бария:
ZnO + BaCO3 → BaZnO2 + СО2
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Na2[Zn(OH)4] + 2СО2 = Zn(OH)2 + 2NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например, хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
ZnCl2 + 2KOH(недост.) = Zn(OH)2↓+ 2KCl
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами.
Например, гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
Zn(OН)2 + 2HNO3 → Zn(NO3)2 + 2H2O
Zn(OН)2 + 2HCl = ZnCl2 + 2H2O
Zn(OН)2 + H2SO4 → ZnSO4 + 2H2O
Zn(OН)2 + 2HBr → ZnBr2 + 2H2O
2. Гидроксид цинка взаимодействует с кислотными оксидами.
Например, гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
Zn(OH)2 + SO3 → ZnSO4 + H2O
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом гидроксид цинка проявляет кислотные свойства.
Например, гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
2KOH + Zn(OН)2 → 2KZnO2 + 2H2O
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
Zn(OН)2 + 2NaOH = Na2[Zn(OH)4]
4. Гидроксид цинка разлагается при нагревании:
Zn(OH)2 → ZnO + H2O
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
2ZnSO4 → 2ZnO + 2SO2 + O2
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например, тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
K2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2KHCO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например, с соляной кислотой:
Na2[Zn(OH)4] + 4HCl(избыток) → 2NaCl + ZnCl2 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Na2[Zn(OH)4] + 2НCl(недостаток) → Zn(OH)2↓ + 2NaCl + 2H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Na2[Zn(OH)4] + 2HNO3(недостаток) → Zn(OH)2↓ + 2NaNO3 + 2H2O
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Na2[Zn(OH)4] → Na2ZnO2 + 2H2O↑
K2[Zn(OH)4] → K2ZnO2 + 2H2O↑
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn2+ + H2O = ZnOH+ + H+
II ступень: ZnOH+ + H2O = Zn(OH)2 + H+
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
ZnO + Na2O → Na2ZnO2
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка:
K2ZnO2 + 4HCl (избыток) → 2KCl + ZnCl2 + 2H2O
СaZnO2 + 4HCl (избыток) = CaCl2 + ZnCl2 + 2H2O
Na2ZnO2 + 4HNO3 → Zn(NO3)2 + 2NaNO3 + 2H2O
Na2ZnO2 + 2H2SO4 → ZnSO4 + Na2SO4 + 2H2O
Под действием избытка воды цинкаты переходят в комплексные соли:
K2ZnO2 + 2H2O = K2[Zn(OH)4]
Na2ZnO2 + 2H2O = Na2[Zn(OH)4]
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
ZnS + 8HNO3(конц.) → ZnSO4 + 8NO2 + 4H2O
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
ZnS + 4H2SO4(конц.) = ZnSO4 + 4SO2 + 4H2O
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
- Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
- Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ. Напишите уравнения описанных реакций.
- Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Напишите уравнения описанных реакций.
- Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
- В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
- Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
- Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
- Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
1)
ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HNO3(недостаток) = Zn(OH)2↓ + 2NaNO3 + 2H2O
2)
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
HNO3 + NaOH = NaNO3 + H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
3)
ZnO + H2SO4 = ZnSO4 + H2O
2ZnSO4 2ZnO + 2SO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
4)
2Zn(NO3)2 2ZnO + 4NO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
Zn(OH)2 + 4(NH3 · H2O) = [Zn(NH3)4](OH)2 + 4H2O
5)
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
2Zn(NO3)2 2ZnO + 4NO2 + O2
NH4NO3 N2O + 2H2O
ZnO + C Zn + CO
6)
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Na2[Zn(OH)4] + 2HNO3 = Zn(OH)2↓ + 2NaNO3 + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Zn(NO3)2 2ZnO + 4NO2 + O2
7)
4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4
Zn(NO3)2 + Mg = Zn + Mg(NO3)2
2Mg(NO3)2 → 2MgO + 4NO2 + O2↑

2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + 2KOH + H2O = K2[Zn(OH)4]
K2[Zn(OH)4] + CO2 = Zn(OH)2 + K2CO3 + H2O
(также возможная версия: K2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2KHCO3)
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
9)
ZnS + 2HCl = ZnCl2 + H2S↑
2ZnS + 3O2 = 2ZnO + 2SO2↑
2H2S + SO2 = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
10)
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
H2 + 2Li = 2LiH
K2[Zn(OH)4] + 2HCl = 2KCl + Zn(OH)2↓ + 2H2O
Zn(OH)2 = ZnO + H2O
ЦИНК (химический элемент) — ЦИНК (лат. Zincum), Zn (читается «цинк»), химический элемент с атомным номером 30, атомная масса 65,39. Природный цинк состоит из смеси пяти стабильных нуклидов: 64Zn (48,6% по массе), 66Zn (27,9%), 67Zn (4,1%), 68Zn (18,8%) и 70Zn (0,6%). Расположен в четвертом периоде в группе IIВ периодической системы. Конфигурация двух внешних электронных слоев 3s2p6d104s2. В соединениях проявляет степень окисления +2 (валентность II).
Радиус атома Zn 0,139 нм, радиус иона Zn2+0,060 нм (координационное число 4), 0,0740 нм (координационное число 6) и 0,090 нм (координационное число 8). Энергии последовательной ионизации атома соответствуют 9,394, 17,964, 39,7, 61,6 и 86,3 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,66.
Историческая справка
Сплавы цинка с медью — латуни (см. ЛАТУНЬ) — были известны еще древним грекам и египтянам. Цинк получали в 5 в. до н. э. в Индии. Римский историк Страбон (см. СТРАБОН) в 60-20 годах до н. э. писал о получении металлического цинка, или «фальшивого серебра». В дальнейшем секрет получения цинка в Европе был утерян, так как образующийся при термическом восстановлении цинковых руд цинк при 900°C переходит в пар. Пары цинка реагируют с кислородом (см. КИСЛОРОД) воздуха, образуя рыхлый оксид цинка, который алхимики называли «белой шерстью».
В 1743 в Бристоле открылся первый завод по получению металлического цинка, где цинковую руду восстанавливали в ретортах без доступа воздуха. В 1746 А. С. Маргграф (см. МАРГГРАФ Андреас Сигизмунд) разработал способ получения металла прокаливанием смеси его окиси с углем без доступа воздуха в ретортах с последующей конденсацией паров цинка в холодильниках.
Слово «цинк» встречается в трудах Парацельса (см. ПАРАЦЕЛЬС) и других исследователей 16-17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Название этого металла за его историю несколько раз менялось. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Содержание цинка в земной коре 8,3·10-3% по массе, в воде Мирового океана 0,01 мг/л. Известно 66 минералов цинка, важнейшие из них: сфалерит (см. СФАЛЕРИТ), клейофан (см. КЛЕЙОФАН), марматит (см. МАРМАТИТ), вюртцит, (см. ВЮРТЦИТ) смитсонит (см. СМИТСОНИТ) ZnCO3, каламин (см. КАЛАМИН) Zn4(OH)4Si2O7·H2O, цинкит (см. ЦИНКИТ) ZnO, виллемит (см. ВИЛЛЕМИТ). Цинк входит в состав полиметаллических руд, которые содержат также медь, свинец, кадмий, индий (см. ИНДИЙ), галлий (см. ГАЛЛИЙ), таллий (см. ТАЛЛИЙ) и другие. Цинк — важный биогенный элемент: в живом веществе содержится 5·10-4% по массе.
Получение
Цинк добывают из полиметаллических руд, содержащих 1-4% Zn в виде сульфида. Руду обогащают, получая цинковый концентрат (50-60%). Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в ZnO. От ZnO к Zn идут двумя путями. По пирометаллургическому методу концентрат спекают, а затем восстанавливают углем или коксом при 1200-1300°C. Затем испарившиеся из печи пары цинка конденсируют.
ZnO + C = Zn + CO.
Основной способ получения цинка гидрометаллургический. Обожженные концентраты обрабатывают серной кислотой. Из полученного сульфатного раствора удаляют примеси, осаждая их цинковой пылью. Очищенный раствор подвергают электролизу. Цинк осаждается на алюминиевых катодах. Чистота электролитного цинка 99,95%.
Для получения цинка высокой чистоты применяют зонную плавку (см. ЗОННАЯ ПЛАВКА).
Физические и химические свойства
Цинк — голубовато-белый металл.
Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. Температура плавления 419,58°C, температура кипения 906,2°C, плотность 7,133 кг/дм3. При комнатной температуре хрупок. При 100-150°C пластичен. Стандартный электродный потенциал -0,76 В, в ряду стандартных потенциалов расположен до железа Fe.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного (см. АМФОТЕРНОСТЬ) белого оксида ZnO.
2Zn + O2 = 2ZnO
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH (сплавление)= Na2ZnO2 + Н2О
В этой реакции образуется цинкат натрия Na2ZnO2.
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами (см. ГАЛОГЕНЫ) с образованием галогенидов ZnHal2. С фосфором (см. ФОСФОР) цинк образует фосфиды Zn3P2 и ZnP2.С серой (см. СЕРА) и ее аналогами — селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) — различные халькогениды (см. ХАЛЬКОГЕНИДЫ), ZnS, ZnSe, ZnSe2и ZnTe.
С водородом (см. ВОДОРОД), азотом (см. АЗОТ), углеродом (см. УГЛЕРОД), кремнием (см. КРЕМНИЙ) и бором (см. БОР (химический элемент)) цинк непосредственно не реагирует. Нитрид Zn3N2получают реакцией цинка с аммиаком (см. АММИАК) NH3 при 550-600°C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
Основная часть производимого цинка расходуется на изготовление антикоррозионных покрытий железа и стали. Цинк применяют в аккумуляторах и сухих элементах питания. Листовой цинк используют в типографском деле. Сплавы цинка (латунь, нейзильбер и другие) применяются в технике. ZnO служит пигментом в цинковых белилах. Соединения цинка являются полупроводниками. Раствором хлорида цинка ZnCl2 пропитывают железнодорожные шпалы, предохраняя их от гниения.
Физиологическое действие
Цинк входит в состав более 40 металлоферментов, катализирующих в организме человека гидролиз пептидов, белков и других соединений. Цинк входит в состав гормона инсулина. (см. ИНСУЛИН) В организм человека цинк поступает с мясом, молоком, яйцами.
Растения при недостатке цинка в почве заболевают.
Металлический цинк мало токсичен. Фосфид и оксид цинка ядовиты. Попадание в организм растворимых солей цинка приводит к расстройству пищеварения, раздражению слизистых оболочек. ПДК для цинка в воде 1,0 мг/л.
Химический элемент с атомным номером 30
Химический элемент с атомным номером 30
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цинк | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешний вид | серебристо-серый | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес A r, std (Zn) | 65,38 (2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цинк в Таблица Менделеева | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Постпереходный металл, альтернативно рассматриваемый переходный металл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Ar ] 3d 4s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при STP | твердое вещество | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка плавления | 692,68 K <848 (419,53 ° C, 787,15 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 1180 K (907 ° C, 1665 ° F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около rt ) | 7,14 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (при т.пл. ) | 6,57 г / см | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 7,32 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 115 кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,470 Дж / ( моль · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Давление пара
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомарные свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −2, 0, +1, +2 (амфо терический оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,65 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 122 ± 4 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван-дер-Ваальсовый радиус | 139 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное происхождение | первозданность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | гексагональная плотноупакованная (hcp) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 3850 м / с (при rt ) (прокат) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 30,2 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 116 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 59,0 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитное упорядочение | диамагнитный | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитная восприимчивость | -11,4 · 10 см / моль (298 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 108 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 43 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 70 ГПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 2,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 327–412 МПа | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7 440-66-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Индийские металлурги (до 1000 г. до н.э. ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Первая изоляция | Андреас Сигизмунд Маргграф (1746) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Признанный как уникальный металл | Расаратна Самучкая (800) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основные изотопы цинка | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ссылки |
Цинк — это химический элемент с символ Znи атомный номер 30. Цинк является слегка хрупким металлом при при комнатной температуре и после удаления окисления имеет сине-серебристый вид. Это первый элемент в 12 периодической таблицы. В некоторых отношениях цинк химически подобен магнию : оба элемента имеют только одну нормальную степень окисления (+2), и ионы Zn и Mg имеют аналогичный размер. Цинк является 24-м наиболее распространенным элементом в земной коре и имеет пять стабильных изотопов . Наиболее распространенной цинковой рудой является сфалерит (цинковая обманка), минерал сульфид цинка. Самые большие рабочие залежи в Австралии, Азии и США. Цинк очищается пенной флотацией руды, обжигом и окончательной экстракцией с использованием электричества (электровыделение ).
Латунь, сплав из меди и цинка в различных пропорциях, использовался еще в третьем тысячелетии до нашей эры в Эгейском море, Ирак, Объединенные Арабские Эмираты, Калмыкия, Туркменистан и Грузия, а также второе тысячелетие до нашей эры в <28 г.>Западная Индия, Узбекистан, Иран, Сирия, Ирак и Израиль / Палестина. Цинк металл не производился в больших масштабах до 12 века в Индии, хотя он был известен древним римлянам и грекам. Рудники Раджастана выдающие качества производства цинка, восходящего к 6 веку нашей до эры. На сегодняшний день самое древнее свидетельство чистого цинка происходит из Завара в Раджастане еще в 9 веке нашей эры, когда для получения чистого цинка используется процесс дистилляции. Алхимики сжигали цинк на воздухе, чтобы они называли «философская шерсть » или «белый снег».
Элемент, вероятно, был назван алхимиком Парацельсом в честь немецкого слова Zinke (зубец, зуб). Немецкому химику Андреасу Сигизмунду Маргграфу приписывают открытие чистого металлического цинка в 1746 году. Работа Луиджи Гальвани и Алессандро Вольта раскрыла электрохимические свойства цинка к 1800 году. Устойчивое к коррозии цинкование железа (горячее цинкование ) является основным испытанием цинка. Другие области применения — электрические батареи, небольшие неструктурные отливки и сплавы, такие как латунь. Обычно используются различные соединения цинка, такие как карбонат цинка и глюконат цинка (в качестве пищевых добавок), хлорид цинка (в дезодорантах), пиритион цинка (шампуни против- перхоти ), сульфид цинка (в люминесцентных красках) и диметилцинк или диэтилцинк в органической лаборатории.
Цинк является важным минералом, в том числе для внутриутробного и послеродового развития. Дефицит цинка исследует около двух миллиардов человек в медицине и лаборатории со многими заболеваниями. У детей вызывает задержку роста, задержку полового созревания, восприимчивость к инфекциям и диарею. Ферменты с атомом цинка в реактивном широко распространены в биохимии, например, алкогольдегидрогеназа у людей.
Потребление избыточного цинка может вызвать атаксию, летаргию и дефицит меди.
Содержание
- 1 Характеристики
- 1.1 Физические свойства
- 1.2 Возникновение
- 1.3 Изотопы
- 2 Соединения и химия
- 2.1 Реакционная способность
- 2.2 Соединения цинка (I)
- 2.3 Цинк (II) соединения
- 2.4 Тест на цинк
- 3 История
- 3.1 Древнее использование
- 3.2 Ранние исследования и название
- 3.3 Изоляция
- 3.4 Более поздние работы
- 4 Производство
- 4.1 Горнодобывающая промышленность и обработка
- 4.2 Воздействие на последнее
- 5 Области применения
- 5.1 Защита от коррозии и аккумуляторы
- 5.2 Сплавы
- 5.3 Другое промышленное использование
- 5.4 Органическая химия
- 5.5 Пищевая добавка
- 5.5. 1 Гастроэнтерит
- 5,5.2 Простуда
- 5.5.3 Увеличение веса
- 5.5.4 Другое
- 5.6 Местное применение
- 6 Биологическая роль
- 6.1 Ферменты
- 6.2 Сигнализация
- 6.3 Другие белки
- 6.4 Питание
- 6.4.1 Рекомендации по питанию
- 6.4.2 Прием пищи
- 6.5 Дефицит
- 6.6 Восстановление почвы
- 6.7 Сельское хозяйство
- 7 Меры предосторожности
- 7.1 Токсичность
- 7.2 Отравление
- 8 См. Также
- 9 Примечания
- 10 Ссылки
- 11 Библиография
- 12 Внешние ссылки
Характеристики
Физические свойства
Цинк имеет голубовато-белый цвет., блестящий, диамагнитный металл, хотя наиболее распространенные коммерческие сорта металла матовая поверхность. Он несколько менее плотен, чем железо, и имеет гексагональную кристаллическую структуру с искаженной формой гексагональной плотной упаковкой, в которой каждый имеет шесть ближайших соседей (в 265, 9 вечера) в собственном самолете и еще шесть на большем расстоянии 290,6 вечера. Металл твердый и хрупкий при большинстве температур, но становится пластичным при температуре от 100 до 150 ° C. При температуре выше 210 ° C металл снова хрупким, и его можно измельчить в порошок. Цинк — хороший проводник электричества. Что касается металла, цинк имеет относительно низкие температуры плавления (419,5 ° C) и кипения (907 ° C). Температура плавления является самой низкой из всех металлов d-блок, кроме ртути и кадмия ; по этой причине, среди прочего, цинк, кадмий и ртуть часто не считаются переходными металлами, как остальные металлы с d-блоком.
Многие сплавы содержат цинк, в том числе латунь. Другие металлы, которые, как известно, образуют бинарные сплавы с цинком, — это алюминий, сурьма, висмут, золото, железо, свинец, ртуть, серебро, олово, магний, кобальт, никель, теллур и натрий. Хотя ни цинк, ни цирконий не являются ферромагнитными, их сплав ZrZn. 2проявляет ферромагнетизм ниже 35 K.
Цинковый стержень издает характерный звук при изгибее, похожий на олово cry.
Встречаемость
Цинк составляет около 75 частей на миллион (0,0075%) земной коры, что делает его 24-м наиболее распространенным элементом. Почва содержит цинк в количестве 5–770 частей на миллион, в среднем 64 частей на миллион. В морской воде всего 30 частей на миллиард, а в атмосфере — 0,1–4 мкг / м3. Этот элемент обычно встречается в сочетании с другими неблагородными металлами, такими как медь и свинец в рудах. Цинк является халькофилом, что означает, что этот элемент с большей вероятностью будет обнаружен в минералах вместе с серой и другими тяжелыми халькогенами, чем с легким халькогеном кислород или с нехалькогенными электроотрицательными элементами, такими как галогены. Сульфиды, образовавшиеся в результате затвердевания коры в восстановительных условиях атмосферы ранней Земли. Сфалерит, который представляет собой форму сульфида цинка, является наиболее добываемым цинком. -содержащая руда, поскольку ее концентрат содержит 60–62% цинка.
Другие минералы-источники цинка включают смитсонит (цинк карбонат ), гемиморфит (цинк силикат ), вюрцит (другой сульфид цинка) и иногда гидроцинкит (основной карбонат цинка ). За исключением вюрцита, все эти минералы образовались в результате выветривания первичных сульфидов цинка.
Выявленные мировые ресурсы цинка составляют около 1,9–2,8 млрд тонн. Крупные месторождения находятся в Австралии, Канаде и США, самые большие месторождения находятся в Иране. Самая последняя оценка базы запасов цинка (соответствует установленным минимальным физическим критериям, оптимальной производственной практикой) была сделана в 2009 году и оценивается примерно в 480 млн. Запасы цинка, с другой стороны, укажите себя геологически идентифицированные рудные тела, пригодность которых к извлечению определяет экономически (местоположение, содержание, качество и количество) на момент. Количество запасов цинковых рудников не является фиксированным, и количество поставок цинковой руды нельзя судить, просто экстраполируя срок эксплуатации сегодняшних цинковых рудников. Эта концепция подтверждена данными Геологической службы США (USGS), которые показывают, что, хотя производство рафинированного цинка увеличилось на 80% в период с 1990 по 2010 год, срок службы запасов цинка остался неизменным. За всю историю до 2002 года было добыто около 346 миллионов тонн, и настоящее время используется около 109–305 миллионов тонн.

Изотопы
Пять стабильных изотопов цинка встречаются в природе, причем Zn является наиболее распространенным изотопом (49,17% естественное содержание ). Другими изотопами, встречающимися в природе, являются. Zn (27,73%),. Zn (4,04%),. Zn (18,45%) и. Zn (0,61%).). Самый распространенный изотоп Zn и редкий Zn теоретически нестабильны с точки зрения энергетики, хотя их прогнозируемые периоды полураспадают превышение 4,3 × 10 лет и 1,3 × 10 лет, что означает, что их радиоактивность можно игнорировать для практических целей.
Было охтеризовано несколько десятков радиоизотопов.. Zn с периодом полураспада 243,66 дня является наименее активным радиоизотопом, за ним следует. Zn с периодом полураспада 46,5 часов. Цинк имеет 10 ядерных изомеров. Zn имеет самый длинный период полураспада — 13,76 ч. Верхний индекс m указывает на метастабильный изотоп . Ядро метастабильного изотопа находится в возбужденном состоянии и вернется в основное состояние , испуская фотон в виде гамма-излучения… Zn имеет три возбужденных метастабильных состояний, а. Zn — два. Каждый изотоп. Zn,. Zn,. Zn и. Zn имеет только одно возбужденное метастабильное состояние.
Наиболее распространенная мода распада для радиоизотоп ка с массовым цинговым числом ниже 66 представляет собой захват электронов. Продукт распада, являющийся в результате захвата электрона, является изотопом меди.
- . 30Zn. + . e. →. 29Cu.
Наиболее распространенным способом распада радиоизотопа цинка с массовым числом выше 66 является бета-распад (β), который производит изотоп галлия.
- . 30Zn. →. 31Ga. + . e. + . ν. e
Соединения и химия
Реакционная способность
Цинк имеет электронную конфигурацию [Ar] 3d4s и является членом группа 12 периодической таблицы. Это умеренно реактивный металл и сильный восстановитель. Поверхность чистого металла быстро тускнеет, в итоге образуя защитный пассивирующий слой из основного карбоната цинка, Zn. 5(OH). 6(CO 3). 2, в результате реакции атмосферным углекислым газом.
Цинк горит на воздухе ярким голубовато-зеленым пламенем, уровняя пары оксида цинка. Цинк легко реагирует с кислотами, щелочи и другие неметаллы. Чрезвычайно чистый цинк очень медленно реагирует при комнатной температуре с кислотами. Сильные кислоты, такие как соляная или серная кислота, может
В химическом составе цинка преобладает степень окисления 2. Когда образуются соединения в этой степени окисления, электроны внешней оболочки оболочки теряются, образуя чистый ионный цинка с электронной конфигурацией [Ar] 3d. Zn (H. 2O)6].). улетучивание цинка в сочетании с хлоридом цинка при температуре выше 285 ° C указывает на образование Zn. 2Cl. 2, соединение цинка со степенью окисления +1. Никакие соединения цинка в степенях окисления, отличных от +1 или +2, неизвестны. Расчеты показывают, что соединение цинка со степенью окисления +4 вряд ли существует.
Химия цинка аналогична химии переходных металлов позднего первого ряда, никеля и меди, хотя он имеет заполненную d-оболочку, а соединение диамагнитны и в основном бесцветны. Ионные радиусы цинка и магния почти идентичны. , а в других обстоятельствах, когда ионный иммунный фактор, определяющий фактор, химический состав цинка много общего с химическим составным магния имеет много общего с химическим составом магния. В остальном мало сходства с поздними переходными металлами первого ряда. Цинк имеет тенденцию образовывать связи с большей степенью ковалентности и более стабильные комплексы с донорами N и S. Комплексы цинка в основном имеют 4- или 6- координаты, хотя известны 5-координатныесы.
Соединения цинка (I)
Соединения цинка (I) встречаются редко и нужны объемные лиганды для стабилизации низкой степени окисления. Большинство соединений цинка (I) формально содержат ядро [Zn 2 ], которое аналогично димерному катиону [Hg 2 ], присутствующему в ртути (I) соединения. диамагнитная природа иона подтверждает его димерную структуру. Первое соединение цинка (I), содержащее связь Zn-Zn, (η-C 5Me5)2Zn2, также является первым диметаллоценом. Ион [Zn 2 ] быстро диспропорционирует на металлический цинк и цинк (II), и было получено только желтое стекло только при охлаждении раствора металлического цинка в расплавленном ZnCl 2.
Соединения цинка (II)


Бинарные соединения цинка известны для большинства металлоидов и всех неметаллов, кроме благородных газов. Оксид ZnO — белый порошок, который почти нерастворим в нейтральных водных растворах, но является амфотерным, растворяющимся как в сильнощелочных, так и в кислых растворах. Другие халькогениды (ZnS, ZnSe и ZnTe ) нашли разнообразное применение в электронике и оптике. Пниктогениды (Zn. 3N. 2, Zn. 3P. 2, Zn. 3As. 2 и Zn. 3Sb. 2 ), пероксид (ZnO. 2 ), гидрид (ZnH. 2 ) и карбид (ZnC. 2) также известны. Из четырех галогенидов, ZnF. 2 имеет наиболее ионный характер, а другие (ZnCl. 2, ZnBr. 2 и ZnI. 2 ) имеют относительно низкие температуры плавления и считаются более ковалентными.
В слабых щелочных растворах, содержащих ионы Zn., гидроксид Zn (OH). 2 образуется в виде белого осадка. В более сильных щелочных растворах этот гидроксид растворяется с образованием цинкатов ([Zn (OH) 4]. ). Нитрат Zn (NO 3). 2, хлорат Zn (ClO 3). 2, сульфат ZnSO. 4, фосфат Zn. 3(PO 4). 2, молибдат ZnMoO. 4, цианид Zn (CN). 2, арсенит Zn (AsO 2). 2, арсенат Zn (AsO 4). 2· 8H. 2O и хромат ZnCrO. 4 (один из немногих окрашенных соединения цинка) являются несколькими примерами других распространенных неорганических соединений цинка. Одним из простейших примеров органического соединения цинка является ацетат (Zn (O. 2CCH 3). 2 ).
Цинкорганические соединения — это соединения, содержащие ковалентные связи цинк-углерод. Диэтилцинк ((C. 2H5). 2Zn ) — это реагент в синтетической химии. Впервые о нем было сообщено в 1848 году в результате реакции цинка и йодистого этила, и было первым известным соединением, содержащим сигма-связь металл-углерод .
Тест на цинк
Кобальтицианидная бумага (тест Риннмана для Zn) может использоваться в качестве химического индикатора для цинка. 4 г K 3 Co (CN) 6 и 1 г KClO 3 растворяют в 100 мл воды. Бумагу погружают в раствор и сушат при 100 ° С. Одна капля образца капает на сухую бумагу и нагревается. Зеленый диск указывает на присутствие цинка.
История
Древнее использование

Были обнаружены различные единичные примеры использования нечистого цинка в древние времена. Цинковые руды использовались для изготовления цинк-медного сплава латуни за тысячи лет до открытия цинка как отдельного элемента. Иудейская латунь XIV — X веков до нашей эры содержит 23% цинка.
Знания о том, как производить латунь, распространились в Древней Греции к VII веку до нашей эры, но их было мало разновидностей. Были обнаружены украшения из сплавов, содержащих 80–90% цинка, с оставшимися свинцом, железом, сурьмой и другими металлами, которым 2500 лет. Возможно, доисторическая статуэтка, содержащая 87,5% цинка, была найдена на археологическом участке даков.
Самые старые известные пилюли были сделаны из карбонатов цинка, гидроцинкита и смитсонита. Таблетки использовались при воспалении глаз и были найдены на борту римского корабля, потерпевшего крушение в 140 г. до н. Э.
Производство латуни было известно римлянам примерно к 30 г. до н.э. Они сделали латунь путем нагревания порошка каламина (цинка силикат или карбонат), древесного угля и меди вместе в тигле. Полученная каламиновая латунь была затем отлита или выкована в форме для использования в оружии. Некоторые монеты, отчеканенные римлянами в христианскую эпоху, сделаны из латуни, вероятно, из каламиновой латуни.
Страбон пишет в I веке до н.э. (но цитирует ныне утерянную работу историка IV века до н.э.>) упоминает «капли фальшивого серебра», которые при смешивании с медью образуют латунь. Это может относиться к небольшим количествам цинка, который является побочным продуктом плавки сульфидной руды. Цинк в таких остатках в плавильных печах обычно выбрасывался, так как считался бесполезным.
Бернская цинковая таблетка — вотивная табличка, датируемая Римской Галлией, сделанная из сплав, который в основном состоит из цинка.
Чарака Самхита, который, как считается, был написан между 300 и 500 годами нашей эры, упоминает металл, который при окислении дает пушпанджан, который, как считается, является оксидом цинка. Цинковые рудники в Заваре, около Удайпура в Индии, были активны с периода Маурьев (c.322 и 187 г. до н.э.). Однако выплавка металлического цинка здесь началась примерно в 12 веке нашей эры. По одной из оценок, это место произвело около миллиона тонн металлического цинка и оксида цинка в период с 12 по 16 века. По другой оценке, общее производство металлического цинка за этот период составило 60 000 тонн. Rasaratna Samuccaya, написанный примерно в 13 веке нашей эры, упоминает два типа цинксодержащих руд: один используется для добычи металлов, а другой используется в медицинских целях.
Ранние исследования и названия
Цинк был отчетливо признан металлом под обозначением Ясада или Джасада в медицинском лексиконе, приписываемом индуистскому королю Маданапале (из династии Така) и написанном около 1374 года. Выплавка и извлечение нечистого цинка путем восстановления каламина. с шерстью и другими органическими веществами было сделано в 13 веке в Индии. Китайцы не изучали эту технику до 17 века.

Алхимики сжигали металлический цинк на воздухе и собирали образовавшийся оксид цинка на конденсатор. Некоторые алхимики назвали этот оксид цинка lana Философская, что по-латыни означает «философская шерсть», потому что он собирался в шерстяные пучки, в то время как другие думали, что это похоже на белый снег, и назвали его nix album. Впервые задокументирован Парацельсом, немецким алхимиком швейцарского происхождения, который назвал этот металл «цинком» или «цинкеном» в своей книге «Liber Mineralium II» в 16 веке. Слово, вероятно, произошло от немецкого zinke и предположительно означало «зубчатый, заостренный или зазубренный» (металлические кристаллы цинка имеют игольчатый вид). Цинк также может означать «подобный олову» из-за его связи с немецким словом zinn, означающим олово. Еще одна возможность состоит в том, что это слово происходит от персидского слова سنگ seng, означающего камень. Металл также назывался индийским оловом, тутанего, каламином и прядильщиком.
Немецкий металлург Андреас Либавиус получил некоторое количество того, что он назвал «калай» Малабара, с грузового корабля, захваченного у Португальский в 1596 году. Либавиус описал свойства образца, который, возможно, был цинком. Цинк регулярно ввозился в Европу с Востока в 17 и начале 18 веков, но временами стоил очень дорого.

Изоляция
Металлический цинк был выделен в Индии к 1300 году нашей эры, намного раньше, чем на Западе. До того, как он был изолирован в Европе, он был импортирован из Индии примерно в 1600 году нашей эры. Универсальный словарь Постлевейта, современный источник, содержащий технологическую информацию в Европе, не упоминал цинк до 1751 года, но этот элемент был изучен до этого.
Фламандский металлург и алхимик П. Г-н де Респур сообщил, что он извлек металлический цинк из оксида цинка в 1668 году. К началу XVIII века Этьен Франсуа Жоффруа описал, как оксид цинка конденсируется в виде желтых кристаллов на железных слитках, помещенных над плавкой цинковой руды. В Великобритании Джон Лейн, как говорят, проводил эксперименты по плавлению цинка, вероятно, в Ландоре, до своего банкротства в 1726 году.
В 1738 году в Великобритании, Уильям Чэмпион запатентовал процесс извлечения цинка из каламина в плавильной печи с вертикальной ретортой. Его техника напоминала ту, что использовалась на цинковых рудниках Завара в Раджастане, но нет никаких свидетельств того, что он посетил Восток. Процесс Чемпиона использовался до 1851 года.
Немецкий химик Андреас Маргграф обычно получает признание за открытие чистого металлического цинка, хотя шведский химик Антон фон Сваб извлек цинк из каламина четыре года назад. В своем эксперименте 1746 года Маргграф нагрел смесь каламина и древесного угля в закрытом сосуде без меди, чтобы получить металл. Эта процедура стала коммерчески практичной к 1752 году.
Более поздняя работа

Брат Уильяма Чемпиона, Джон, в 1758 году запатентовал процесс кальцинирования. сульфид цинка в оксид, используемый в процессе автоклавирования. До этого для производства цинка можно было использовать только каламин. В 1798 году Иоганн Кристиан Руберг усовершенствовал процесс плавки, построив первый горизонтальный ретортный плавильный завод. Жан-Жак Даниэль Дони построил в Бельгии горизонтальный цинковый завод другого типа, который перерабатывал еще больше цинк. Итальянский врач Луиджи Гальвани в 1780 году обнаружил, что соединение спинного мозга только что рассеченной лягушки с железным рельсом, прикрепленным медным крючком, заставляло лягушку подергиваться. Он ошибочно полагал, что открыл способность нервов и мускулов создавать электричество, и назвал эффект «животным электричеством ». Гальванический элемент и процесс гальванизации были названы в честь Луиджи Гальвани, и его открытия проложили путь для электрических батарей, гальванизации и катодной защиты.
друга Гальвани, Алессандро Вольта, продолжил исследование эффекта и изобрел гальваническую батарею в 1800 году. Свая Вольта состояла из пакета упрощенных гальванических элементов, каждая из которых состояла из одной медной пластины и одной из цинковых соединенных. электролитом . При последовательном соединении этих блоков гальваническая батарея (или «батарея») в целом имела более высокое напряжение, которое можно было использовать легче, чем отдельные элементы. Электричество вырабатывается, потому что вольта-потенциал между двумя металлическими пластинами заставляет электроны течь от цинка к меди и разъедать цинк.
Немагнитный характер цинк и его отсутствие цвета в растворе отсрочили открытие его важности для биохимии и питания. Ситуация изменилась в 1940 году, когда было показано, что карбоангидраза, фермент, очищающий кровь от углекислого газа, имеет цинк в его активном центре. Пищеварительный фермент карбоксипептидаза стал вторым известным цинксодержащим ферментом в 1955 году.
Производство
Добыча и переработка
| Рейтинг | Страна | Тонны |
|---|---|---|
| 1 | Китай | 4,400,000 |
| 2 | Перу | 1,470,000 |
| 3 | Австралия | 842,000 |
| 4 | Индия | 833,000 |
| 5 | США | 774,000 |
| 6 | Мексика | 674,000 |



Цинк является четвертым по распространенности используемым металлом, уступая только железу, алюминию и меди с годовым производством около 13 миллионов тонн. Крупнейшим производителем цинка в мире является Nyrstar, слияние австралийской OZ Minerals и бельгийской Umicore. Около 70% мирового цинка происходит из горнодобывающей промышленности, а остальные 30% приходится на переработку вторичного цинка. Коммерчески чистый цинк известен как специальный высокосортный цинк, часто сокращенно SHG, и имеет чистоту 99,995%.
Во всем мире 95% нового цинка добывается из сульфидных рудных месторождений, в которых сфалерит ( ZnS) почти всегда смешан с сульфидами меди, свинца и железа. Цинковые рудники разбросаны по всему миру, основные районы — Китай, Австралия и Перу. В 2014 году Китай произвел 38% мирового производства цинка.
Металлический цинк производится с использованием добывающей металлургии. Руда тонко измельчается, затем подвергается пенной флотации для отделения минералов от пустой породы (по свойству гидрофобности ) с получением концентрата сульфидной руды цинка, состоящего из of about 50% zinc, 32% sulfur, 13% iron, and 5% SiO. 2.
Roasting converts the zinc sulfide concentrate to zinc oxide:
- 2 ZnS + 3 O. 2→ 2 ZnO + 2 SO. 2
The sulfur dioxide is used for the production of sulfuric acid, which is necessary for the leaching process. If deposits of zinc carbonate, zinc silicate, or zinc spinel (like the Skorpion Deposit in Namibia ) are used for zinc production, the roasting can be omitted.
For further processing two basic methods are used: pyrometallurgy or electrowinning. Pyrometallurgy reduces zinc oxide with carbon or carbon monoxide at 950 °C (1,740 °F) into the metal, which is distilled as zinc vapor to separate it from other metals, which are not volatile at those temperatures. Пары цинка собираются в конденсаторе. The equations below describe this process:
- 2 ZnO + C → 2 Zn + CO. 2
- ZnO + CO → Zn + CO. 2
In electrowinning, zinc is leached from the ore concentrate by sulfuric acid :
- ZnO + H. 2SO. 4→ ZnSO. 4+ H. 2O
Finally, the zinc is reduced by electrolysis.
- 2 ZnSO. 4+ 2 H. 2O → 2 Zn + 2 H. 2SO. 4+ O. 2
The sulfuric acid is regenerated and recycled to the leaching step.
When galvanised feedstock is fed to an electric arc furnace, the zinc is recovered from the dust by a number of processes, predominantly the Waelz process (90% as of 2014).
Environmental impact
Refinement of sulfidic zinc ores produces large volumes of sulfur dioxide and cadmium vapor. Smelter slag and other residues contain significant quantities of metals. About 1.1 million tonnes of metallic zinc and 130 thousand tonnes of lead were mined and smelted in the Belgian towns of La Calamine and Plombières between 1806 and 1882. The dumps of the past mining operations leach zinc and cadmium, and the sediments of the Geul River contain non-trivial amounts of metals. About two thousand years ago, emissions of zinc from mining and smelting totaled 10 thousand tonnes a year. After increasing 10-fold from 1850, zinc emissions peaked at 3.4 million tonnes per year in the 1980s and declined to 2.7 million tonnes in the 1990s, although a 2005 st Ученые обнаружили, что концентрации в тропосфере Арктики не отражают снижения. Отношение антропогенных и естественных выбросов составляет 20: 1.
Цинк в реках, протекающих через промышленные и горнодобывающие районы, может достигать 20 ppm. Эффективная очистка сточных вод значительно снижает это; Обработка вдоль Рейна, например, снизила уровни цинка до 50 частей на миллиард. Концентрация цинка до 2 частей на миллион отрицательно влияет на количество кислорода, которое рыба может нести в своей крови.

Почвы, загрязненные цинком в результате добычи, переработки, или удобрение цинксодержащим илом может содержать несколько граммов цинка на килограмм сухой почвы. Уровни цинка в почве, превышающие 500 ppm, влияют на способность растений поглощать другие важные металлы, такие как железо и марганец. Уровни цинка от 2000 ppm до 180 000 ppm (18%) были зарегистрированы в некоторых образцах почвы.
Области применения
Основные области применения цинка включают (числа даны для США)
- цинкование (55%)
- Латунь и бронза (16%)
- Другие сплавы (21%)
- Разное (8%)
Антикоррозийные и аккумуляторные батареи

Цинк чаще всего используется в качестве анти- коррозионного агента, и гальваника (покрытие железо или сталь ) — наиболее распространенная форма. В 2009 году в США для гальванизации использовалось 55% или 893 000 тонн металлического цинка.
Цинк более реакционноспособен, чем железо или сталь, и поэтому будет притягивать почти все местные окисления, пока полностью не разъедет. Защитный поверхностный слой из оксида и карбоната (Zn. 5(OH). 6(CO. 3). 2) образуется по мере коррозии цинка. Эта защита сохраняется даже после наличия биологических участков связывания цинка.
История цинка
Цинк в чистом виде впервые выделил Уильям Чемпион в 1738 году, хотя латунь (сплав меди с цинком) использовали в Древнем Египте и Древней Греции (calorizator). Иногда первооткрывателем цинка называют немца С. Маргграфа, который в 1746 году разработал аналогичный способ выработки цинка и описал его более подробно, чем Чемпион.
Названием цинк обязан Парацельсу, в чьих трудах встречаются слова zincum и zinken, которыми назван металл, видимо, из-за схожести его кристаллитов с иглами (zinke – зубец).
Общая характеристика цинка
Цинк является элементом побочной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 30 и атомную массу 65,39. Принятое обозначение – Zn (от латинского Zincum).
Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически во всех водных ресурсах Мирового Океана и во многих живых организмах. На сегодняшний день известно более 60-ти минералов цинка (сфалерит, цинкит, каламин и др.). крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
Физические и химические свойства
Цинк является хрупким, пластичным переходным металлом, имеет бело-голубоватый цвет, на воздухе покрывается слоем оксида цинка, что приводит к потускнению. При высоких температурах сгорает, образуя белый оксид цинка.
Суточная потребность в цинке
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, женщины в период беременности и кормления грудью – от 11 до 13 мг.
Продукты питания богатые цинком
Основные поставщики цинка – продукты питания, важный для жизнедеятельности организма элемент содержится в зелёных листовых овощах, брокколи, цветной капусте и редисе, моркови и кукурузе, зелёном луке, фасоли, горохе и чечевице, авокадо и ягодах, арахисе, кокосе, грецких и кедровых орехах, кунжуте, пшенице, овсянке и рисе. Присутствует цинк и в продуктах животного происхождения – свинине и баранине, говядине и индейке, мясе утки и говяжьем языке, морепродуктах и рыбе, плавленом сыре и яичном желтке.
Полезные свойства цинка и его влияние на организм
Функции и полезные свойства цинка:
- участие в формировании костных тканей,
- предупреждение диабета,
- препятствие появлению эпилепсии,
- обеспечение быстрого заживления ран,
- пособничество всасыванию витамина А,
- улучшение состояния волос,
- положительное влияние на умственные способности человека,
- профилактика возникновения артрита и ревматизма.
Взаимодействие с другими
Цинк необходим для метаболизма витамина E, витамин А действует только в присутствии цинка. Витамин С и цинк — хорошее средство против катаров и многих вирусных заболеваний.
Признаки нехватки цинка
Нехватка цинка в организме человека характеризуется следующими симптомами:
- расстройства деятельности желудочно-кишечного тракта,
- хрупкость ногтей и появление на них белых пятен,
- истощение и выпадение волос,
- потеря чувства вкуса и аппетита,
- незаживление мелких ран,
- нервозность, быстрая утомляемость,
- снижение памяти.
Признаки избытка цинка
Избыточное содержание цинка в организме человека как правило обусловлено приёмом БАДов и препаратов цинка, характеризуется головными болями, приступами слабости и тошнотой.
Применение цинка в жизни
Цинк в чистом виде используется как восстановитель благородных металлов, как защита стали от коррозии, для производства аккумуляторов, в полиграфической промышленности, в медицине, производстве различных сплавов, резиновых шин и масляных красок.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
У этого термина существуют и другие значения, см. Цинк (значения).
| Цинк | |||
|---|---|---|---|
| ← Медь | Галлий → | |||
|
|||
| Внешний вид простого вещества | |||

Образцы очищенного цинка |
|||
| Свойства атома | |||
| Название, символ, номер | Цинк / Zincum (Zn), 30 | ||
| Группа, период, блок |
12 (устар. 2), 4, d-элемент |
||
| Атомная масса (молярная масса) |
65,38(2)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 3d104s2 1s22s22p63s23p63d104s2 |
||
| Радиус атома | 138 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 125 пм | ||
| Радиус иона | (+2e) 74 пм | ||
| Электроотрицательность | 1,65 (шкала Полинга) | ||
| Электродный потенциал | −0,76 В | ||
| Степени окисления | 0, +2 | ||
| Энергия ионизации (первый электрон) |
905,8 (9,39) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 7,133 г/см³ | ||
| Температура плавления | 419,6 °C | ||
| Температура кипения | 906,2 °C | ||
| Уд. теплота плавления | 7,28 кДж/моль | ||
| Уд. теплота испарения | 114,8 кДж/моль | ||
| Молярная теплоёмкость | 25,4[2] Дж/(K·моль) | ||
| Молярный объём | 9,2 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Гексагональная | ||
| Параметры решётки | a = 2,6648, c = 4,9468 Å | ||
| Отношение c/a | 1,856 | ||
| Температура Дебая | 234 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 116 Вт/(м·К) | ||
| Номер CAS | 7440-66-6 |
Цинк (химический символ — Zn, от лат. Zincum) — химический элемент 12-й группы (по устаревшей классификации — побочной подгруппы второй группы, IIB), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30.
Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII век), Китае (XI век). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом[en] был запатентован дистилляционный способ получения цинка[3]. В промышленном масштабе выплавка цинка началась также в XVIII веке: в 1743 году в Бристоле начал работать первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом[4][5]:15. В 1746 году А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка[4].
В 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C[5]:28. Первый в России цинк был получен на заводе «Алагир» 1 января 1905 года[5]:86. Первые заводы, где цинк получали электролитическим способом, появились в 1915 году в Канаде и США[5]:82.
Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом лат. zincum или zinken в книге Liber Mineralium II[6]. Это слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)[7].
Нахождение в природе

Сфалерит
Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространённый минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Из-за трудности определения этого минерала его называют обманкой (др.-греч. σφαλερός — обманчивый). Цинковую обманку считают первичным минералом, из которого образовались другие минералы цинка[источник не указан 420 дней]: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька[стиль].
Среднее содержание цинка в земной коре — 8,3⋅10−3 %, в основных изверженных породах его несколько больше (1,3⋅10−2 %), чем в кислых (6⋅10−3 %). Цинк — энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение. Цинк также энергично мигрирует в поверхностных и подземных водах, главным осадителем для него является сероводород, меньшую роль играет сорбция глинами и другие процессы.
Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5⋅10−4 % цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Месторождения
Месторождения цинка известны в Иране, Австралии, Боливии, Казахстане[8]. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК Дальполиметалл»[9][неавторитетный источник?]. На территории Красноярского края в Нижнем Приангарье разрабатывается уникальное Горевское месторождение полиметаллов с запасами цинка 1004,5 тыс. тонн по категориям А + В + С1 и 798,4 тыс. тонн по категории С2. Месторождение было открыто в 1956 году, эксплуатация начата в 1975 году, однако первые сведения о наличии руд в прилегающих районах относятся к 1770-м годам. В 2012 году добыча цинка составила 25,8 тыс. тонн. Разработку месторождения ведёт группа компаний. Также разведаны месторождения Партизанское и Суровое на западе Таймырского полуострова. Прогнозные ресурсы цинка — 500 тыс. тонн.[10]
Изотопы
Цинк имеет пять стабильных изотопов (64Zn, 66Zn, 67Zn, 68Zn и 70Zn).
Получение
Цинк в природе как самородный металл не встречается.
Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С → Zn + CO. Образующиеся при этом пары́ металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией даёт металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Собственная концентрация носителей заряда в цинке — 13,1⋅1028 м−3.
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой плёнкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
так и со щелочами:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, ёмкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм3, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм3), диоксисульфатно-ртутный элемент, иодатно-цинковый элемент, медно-окисный гальванический элемент (0,7—1,6 В, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм3), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (1,82 В, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм3), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии[5]:30—31.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, -5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Сульфид цинка используется при изготовлении люминофоров краткого послесвечения и других люминесцирующих составов, обычно это смеси ZnS и CdS, активированные ионами других металлов. Люминофоры на базе сульфидов цинка и кадмия также применяются в электронной промышленности для изготовления светящихся гибких панелей и экранов в качестве электролюминофоров и составов с коротким временем высвечивания.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
На разные применения цинка приходится:
- цинкование — 45—60 %,
- медицина (оксид цинка как антисептик) — 10 %,
- производство сплавов — 10 %,
- производство резиновых шин — 10 %,
- масляные краски — 10 %.
Мировое производство

Слитки цинка на складе
Цинк — четвёртый по использованию металл в мире после железа, алюминия и меди, и третий среди цветных металлов. Производство цинка в мире за 2009 год составило 11,277 млн т, что на 3,2 % меньше, чем в 2008 г.[11] производство цинка в мире может увеличиться в мире в 2024 году до 14 млн тонн в год.[12]
Цена цинка в октябре 2021 года поднялась в Лондоне до 3528,5 USD/т, +3,7 %.[13]
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»)[14]:
| Место | Страна | Производительность (тонн) |
|---|---|---|
| — | 10 000 000 | |
| 1 | 02 600 000[15] | |
| 2 | 01 380 000 | |
| 3 | 01 201 794 | |
| 4 | 0 0727 000 | |
| 5 | 0 0710 000 | |
| 6 | 0 0480 000[15] | |
| 7 | 0 0425 700 | |
| 8 | 0 0420 800 | |
| 9 | 0 0400 000[15] | |
| 10 | 0 0192 400 | |
| 11 | 0 0190 000[15] | |
| 12 | 0 0176 000[15] | |
| 13 | 0 0175 000[15] | |
| 14 | 0 0135 600 | |
| 15 | 0 0130 000[15] | |
| 16 | 00 073 000[15] | |
| 17 | 00 068 000[15] | |
| 18 | 00 067 000[15] | |
| 19 | 00 050 000[15] | |
| 20 | 00 048 000[15] | |
| 21 | 00 045 000[15] | |
| 22 | 00 037 646 | |
| 23 | 00 035 700 | |
| 24 | 00 034 444 | |
| 25 | 00 031 725 | |
| 26 | 00 030 300[15] | |
| 27 | 00 017 300[15] | |
| 28 | 00 009 600[15] | |
| 29 | 00 007 169 | |
| 30 | 00 005 000[15] | |
| 31 | 00 001 500[15] | |
| 32 | 00 000400[15] | |
| 33 | 00 000300[15] | |
| 34 | 00 000100[15] |
Биологическая роль
В организме взрослого человека содержится в среднем около 2 г цинка в виде его соединений, который концентрируется преимущественно в простате, мышцах, печени и поджелудочной железе. В 50 миллилитрах человеческой спермы содержится около 10 миллиграмов цинка. Более 400 ферментов содержат цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных эфиров, образование альдегидов, полимеризацию ДНК и РНК. Ионы Zn2+ в составе ферментов вызывают поляризацию молекул воды и органических веществ, содействуя их депротонированию по реакции
- Zn2+ + H2O = ZnOH+ + H+
Наиболее изучен фермент карбоангидраза — белок, содержащий цинк и состоящий примерно из 260 аминокислотных остатков. Этот фермент содержится в эритроцитах крови и способствует превращению углекислого газа, образующегося в тканях в процессе их жизнедеятельности, в гидрокарбонат-ионы и угольную кислоту, которая кровью переносится в лёгкие, где выводится из организма в виде углекислого газа. В отсутствие фермента превращение СО2 в анион HCO3− протекает с очень низкой скоростью. В молекуле карбоангидразы атом цинка связан с тремя имидазольными группами остатков аминокислоты гистидина и молекулой воды, которая легко депротонируется, превращаясь в координированный гидроксид. Атом углерода молекулы углекислого газа, на котором находится частичный положительный заряд, вступает во взаимодействие с атомом кислорода гидроксильной группы. Таким образом, координированная молекула СО2 превращается в гидрокарбонат-анион, который покидает активный центр фермента, замещаясь на молекулу воды. Фермент ускоряет эту реакцию гидролиза в 10 миллионов раз.
Цинк
- необходим для продукции спермы и мужских гормонов[16],
- необходим для метаболизма витамина E,
- важен для нормальной деятельности простаты,
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста[16],
- необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы[16].
Содержание в продуктах питания
Рекомендуемая дневная норма цинка в рационе — 11 мг для мужчин и 8 мг для женщин[17]. В периоды активной половой жизни суточная потребность цинка у мужчин возрастает и составляет 30—70 мг. Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах, тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде.
Содержание цинка в продуктах на 100 г[18]:
- Орехи и семечки: тыквенные семечки — 10 мг, кунжут — 7 мг, кедровый орех — 6,4 мг, семена подсолнечника — 5,3 мг, миндаль — 3 мг, грецкие орехи — 3 мг.
- Мясо: говяжья печень — 4 мг, говядина — 3—8,4 мг, баранина — 2—6 мг, курица — 0,8—3,5 мг, свинина — 0,8—3,5 мг.
- Бобовые: чечевица — 4,78 мг, арахис — 4 мг, горох — 1,2 мг, соевые бобы — 3 мг.
- Молочные продукты: твёрдый сыр — 3—4 мг, мороженое, йогурт — 0,7—0,8 мг, молоко — 0,4 мг.
- Злаки и хлеб: овёс — 3,97, пшеница — 3,46 мг, рожь — 2,65 мг, рис — 1 мг, хлеб — 0,7—1,5 мг, печенье — 0,5—1 мг, мука пшеничная — 0,8 мг.
- Рыба и морепродукты: устрицы — 16—40 мг, анчоусы — 1,72 мг, осьминог — 1,68 мг, карп — 1,48 мг, икра — 1 мг, сельдь — 0,99 мг.
- Овощи и фрукты: зелёный горошек — 1,24 мг, ростки бамбука — 1,10 мг, кукуруза (варёная, консервированная) — 0,5—0,6 мг, финики — 0,44 мг, малина — 0,42 мг, брокколи — 0,41 мг, свёкла — 0,35 мг, картофель — 0,29 мг, чёрная смородина — 0,27 мг, инжир, бананы — 0,15 мг, апельсины — 0,07 мг, грейпфрут — 0,07 мг, лимоны — 0,06 мг, яблоки — 0,04 мг.
- Сладости: какао-порошок (неподслащенный) — 6,81 мг, шоколад — 2,3 мг, шоколадные конфеты — 1—2 мг, мёд — 0,22 мг.
Также цинк может присутствовать в минеральной воде.
Основные проявления дефицита цинка
Недостаток цинка в организме приводит к ряду расстройств. Среди них — раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие[19].
Для оценки содержания цинка в организме определяют его содержание в волосах, крови и её сыворотке.
Токсичность
При длительном поступлении в организм в больших количествах всех солей цинка, особенно сульфатов и хлоридов, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжёлое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.
Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.
Отравление сульфатом цинка происходит при вдыхании его мелкодисперсных частиц (пыли). Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
См. также
- Категория:Соединения цинка
- Цинкаты
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.). — Pure and Applied Chemistry, 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ Химическая энциклопедия: в 5 т. / Редкол.: Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1999. — Т. 5. — С. 378.
- ↑ Pollard A., Heron C. Archaeological Chemistry (англ.). — Royal Society of Chemistry, 2008. — P. 204.
- ↑ 1 2 Gray L. Zinc (англ.). — Marshall Cavendish, 2006. — P. 9.
- ↑ 1 2 3 4 5 Казаков Б. И. Металл из Атлантиды. (О цинке). — М.: Металлургия, 1984. — 128 с.
- ↑ Hoover, Herbert Clark (2003), Georgius Agricola de Re Metallica, Kessinger Publishing, с. 409, ISBN 0766131971.
- ↑ Gerhartz, Wolfgang (1996), Ullmann’s Encyclopedia of Industrial Chemistry (5th ed.), VHC, с. 509, ISBN 3527201009.
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны). Дата обращения: 29 ноября 2010. Архивировано из оригинала 19 июня 2010 года.
- ↑ Дальполиметалл.
- ↑ Месторождения цинка. Энциклопедия Красноярского края (19 декабря 2014).
- ↑ Мир сократил производство и потребление цинка, а Китай — увеличил.
- ↑ Рынок цинка в 2020 г.: аналитический обзор УГМК // Новости металлургии. Металлоснабжение и сбыт.
- ↑ Металлы бьют рекорды на фоне сокращения поставок из-за энергетического кризиса // ProFinance.Ru.
- ↑ Minerals Yearbook 2006.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Ориентировочные данные.
- ↑ 1 2 3 А. В. Скальный. Цинк и здоровье человека. — РИК ГОУ ОГУ, 2003.
- ↑ Connie W. Bales, Christine Seel Ritchie. Handbook of Clinical Nutrition and Aging
- ↑ Show Nutrients List
- ↑ Сайт «Центра биотической медицины». Дата обращения: 30 мая 2011. Архивировано из оригинала 3 февраля 2011 года.
Ссылки
- Цинк на Webelements
- Цинк в Популярной библиотеке химических элементов Архивная копия от 8 августа 2006 на Wayback Machine
- Цинк и цинковые аноды
Эта страница в последний раз была отредактирована 2 марта 2023 в 13:40.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
























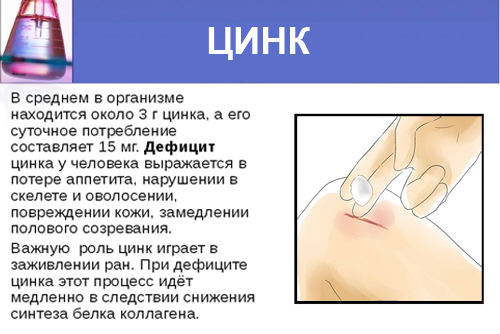



![{displaystyle {ce {ZnO + 2 NaOH + H2O -> Na2[Zn(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4bc52d4d15c04df5c297009b65f830169f9b0224)

![{displaystyle {ce {Zn + 2 NaOH + 2 H2O -> Na2[Zn(OH)4] + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a20be6db2d2cacbfb72e5f735247f09a735790e)