Версия: Справочник заболеваний MedElement
Категории МКБ:
Острый инфаркт миокарда неуточненный (I21.9)
Разделы медицины:
Кардиология
Общая информация
Краткое описание
Инфаркт миокарда (ИМ) — это острое заболевание, вызванное развитием очага
ишемическогонекроза
мышцы сердца, возникшего вследствие закупорки коронарной артерии тромбом. В дальнейшем развивается острое несоответствие между потребностью миокарда в кислороде и доставкой его по коронарной артерии (абсолютная или относительная недостаточность коронарного кровотока).
Критерии острого инфаркта миокарда
Термин ИМ используется, когда присутствуют признаки
некроза
миокарда, согласующиеся в клинической картине с ишемией миокарда. При таких условиях диагнозу ИМ соответствует любой из нижеперечисленных критериев:
1. Выявление подъема и/или падения уровня сердечных биохимических маркеров (преимущественно тропонина), а также при наличии признаков ишемии миокарда одновременно с одним из следующих признаков:
— симптомы ишемии;
— визуализация признаков новой потери жизнеспособности миокарда или новой региональной аномалии движения стенки;
— изменения ЭКГ, указывающие на новую ишемию (новые ST-T изменения или новая блокада левой ножки пучка Гиса (БЛНПГ));
— развитие патологических зубцов Q на ЭКГ.
2. Внезапная сердечная смерть (ВСС), включающая остановку сердца. Часто она имеет симптомы, предполагающие ишемию миокарда, и сопровождается, вероятно, новым подъемом ST или вновь возникшей БЛНПГ, и/или со свидетельством наличия свежего тромба на
коронарографии
и/или
аутопсии
. Однако смерть наступает еще до того, как становится возможным получить образцы крови или в то время, когда сердечные биохимические маркеры еще не появились в крови.
3. Для аортокоронарного шунтирования (АКШ) у пациентов с нормальным уровнем тропонина подъем сердечных маркеров служит указателем на перипроцедурный некроз миокарда. Признаками ИМ вследствие АКШ являются:
— подъем уровней биохимических маркеров больше, чем в пять раз по отношению к норме;
— патологические зубцы Q либо БЛНПГ;
— ангиографически задокументированная
окклюзия
венечной артерии или шунта;
— визуализация признаков потери жизнеспособности миокарда.
4. При выполнении чрескожных вмешательств на коронарных артериях (ЧВКА) у больных с исходно нормальным уровнем тропонина, повышение концентрации специфических маркеров повреждения миокарда указывает на развитие
некроза
миокарда в ходе выполнения вмешательства. При увеличении концентрации биомаркеров более чем в 3 раза по сравнению с нормой принято диагностировать ИМ, связанный с выполнением ЧВКА. Выделяют также ИМ, обусловленный подтвержденным тромбозом
стента
.
5. Патоморфологические находки, которые свидетельствуют о наличии острого ИМ.
Критерии для постановки диагноза «первичный инфаркт миокарда»
Любой из приведенных ниже критериев соответствует диагнозу первичного ИМ:
— визуализация свидетельств о регионе потери жизнеспособности миокарда, то есть истончение стенки и утеря способности к сокращению, при отсутствии неишемических причин;
— развитие новых патологических зубцов Q с симптомами или без них;
— наличие вылеченного или лечащегося ИМ.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Клиническая классификация различных типов инфаркта миокарда
| Тип 1 | Спонтанный инфаркт миокарда, связанный с ишемией вследствие первичного коронарного события, такого как эрозия и/или разрыв, трещина или расслоение бляшки. |
| Тип 2 | Инфаркт миокарда, вторичный по отношению к ишемии, возникшей либо из-за повышения потребности в кислороде, либо из-за снижения его доставки, например, из-за спазма коронарной артерии, коронарной эмболии, анемии, гипертонии или гипотонии. |
| Тип 3 | Внезапная сердечная смерть, включая остановку сердца, часто с симптомами, заставляющими предположить наличие ишемии миокарда, сопровождающимися новыми подъемами сегмента ST, или новой блокады левой ножки пучка Гиса, или признаками свежего тромба в коронарной артерии по данным ангиографии и/или аутопсии. Смерть наступает или до взятия проб крови, или до появления сердечных биомаркеров в крови. |
| Тип 4а | Инфаркт миокарда, связанный (ассоциируемый) с чрескожным коронарным вмешательством (ЧКВ). |
| Тип 4b | Инфаркт миокарда, связанный с тромбозом стента, что документировано ангиографией или аутопсией. |
| Тип 5 | Инфаркт миокарда, связанный с операцией аорто-коронарного шунтирования. |
В зависимости от размеров очагового поражения сердечной мышцы, выделяют два вида инфаркта миокарда:
— мелкоочаговый;
— крупноочаговый.
Около 20% клинических случаев приходится на долю мелкоочаговых инфарктов миокарда, однако часто мелкие очаги некроза в сердечной мышце трансформируются в крупноочаговый инфаркт миокарда (у 30% пациентов).
При мелкоочаговых инфарктах, в отличие от крупноочаговых, не возникают
аневризма
и разрыв сердца. Также течение мелкоочаговых инфарктов реже осложняется сердечной недостаточностью,
тромбоэмболией
,
фибрилляцией желудочков
.
В соответствии с глубиной некротического поражения сердечной мышцы различают следующие виды инфаркта миокарда:
— трансмуральный — с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый);
— интрамуральный – с некрозом в толще миокарда;
— субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду;
— субэпикардиальный — с некрозом миокарда в зоне прилегания к эпикарду.
Согласно изменениям, фиксируемым на ЭКГ, выделяют:
— «Q-инфаркт» — с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще — крупноочаговый трансмуральный инфаркт миокарда);
— «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще — мелкоочаговый инфаркт миокарда).
По топографии и в зависимости от поражения определенных ветвей коронарных артерий, инфаркт миокарда бывает:
— правожелудочковый;
— левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки.
По кратности возникновения инфаркт миокарда подразделяется на:
— первичный;
— рецидивирующий (развивается в срок до 8 недель после первичного);
— повторный (развивается спустя 8 недель после предыдущего).
По развитию осложнений инфаркт миокарда может быть:
— осложненный;
— неосложненный.
По наличию и локализации болевого синдрома различают следующие формы инфаркта миокарда:
— типичная – с локализацией боли за грудиной или в
прекордиальной области
;
— атипичная — с атипичными болевыми проявлениями:
а) периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная);
б) безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная;
— малосимптомная (стертая);
— комбинированная.
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
— стадию ишемии (острейший период);
— стадию некроза (острый период);
— стадию организации (подострый период);
— стадию рубцевания (постинфарктный период).
Этиология и патогенез
Непосредственной причиной развития инфаркта миокарда (ИМ) является остро наступающее несоответствие коронарного кровообращения запросам миокарда вследствие окклюзии коронарной артерии или резкого уменьшения притока крови по ней с последующей ишемией и некрозом.
Инфаркт миокарда с патологическими зубцами Q (тромботическая окклюзия коронарной артерии) развивается у 80% больных с инфарктом миокарда и приводит к трансмуральному некрозу миокарда и появлению зубца Q на ЭКГ.
Инфаркт миокарда без патологических зубцов Q наиболее часто возникает при спонтанном восстановлении
перфузии
или хорошо развитых
коллатералях
. Размер инфаркта в этом случае меньше, функция левого желудочка страдает меньше, больничная летальность ниже. Однако частота повторных инфарктов миокарда выше, чем при инфаркте миокарда с патологическими зубцами Q, вследствие того, что такие инфаркты миокарда — «незавершенные» (то есть миокард, оставшийся жизнеспособным, снабжается пораженной коронарной артерией); к концу первого года летальность уравнивается. Поэтому при инфаркте миокарда без патологических зубцов Q следует придерживаться более активной лечебно-диагностической тактики.
В основе развития ИМ лежат три патофизиологических механизма:
1. Разрыв атеросклеротической бляшки, спровоцированный внезапным повышением активности симпатической нервной системы (резкое повышение артериального давления, частоты и силы сердечных сокращений, усиление венечного кровообращения).
2. Тромбоз на месте разорванной или даже
интактной
бляшки в результате повышения тромбогенной способности крови (за счет усиления
агрегации
тромбоцитов, активации коагулянтной системы и/или ингибирования
фибринолиза
).
3.
Вазоконстрикция
: локальная (участка коронарной артерии, где находится бляшка) или генерализованная (всей коронарной артерии).
Первый этап развития острого инфаркта миокарда (ОИМ), хотя и не всегда обязательный — разрыв атеросклеротической бляшки, который в дальнейшем может иметь различное течение:
1. Благоприятное течение — когда после разрыва бляшки происходит кровоизлияние в бляшку, так называемый «внутреннеинтимальный» тромб, что не вызывает развития инфаркта миокарда, но в дальнейшем может способствовать прогрессированию клинической картины ишемической болезни сердца (ИБС).
2. Неблагоприятное течение — с формированием тромба, который полностью или практически полностью перекрывает просвет венечной артерии.
Выделяют три стадии формирования тромба,
обтурирующего
коронарную артерию:
1. Кровоизлияние в бляшку.
2. Формирование внутрисосудистого неокклюзирующего тромба.
3. Распространение тромба до полной закупорки сосуда.
Внутреннеинтимальный тромб состоит в основном из тромбоцитов. Формирование тромба является ключевым в развитии ОИМ.
Гораздо реже ОИМ возникает не как результат атеротромбоза. Ведущим патогенетическим механизмом в этом случае рассматривается
вазоспазм
.
Инфаркт миокарда как результат
коронароспазма
достаточно часто наблюдается у людей, принимающих наркотики, так называемый «кокаиновый» инфаркт миокарда.
Значительно реже инфаркт миокарда развивается в результате других причин.
Морфологические особенности
Инфаркт — заболевание всегда острое и стадийное. При инфаркте миокарда отмечают, что в первые сутки зона инфаркта внешне никак не отличается от здоровых участков миокарда. Зона инфаркта в это время носит мозаичный характер, то есть среди погибших клеток встречаются также частично или даже полностью работоспособные миоциты. На вторые сутки зона постепенно отграничивается от здоровой ткани и между ними формируется периинфарктная зона.
Часто в периинфарктной зоне различают зону очаговой дистрофии, граничащую с некротической зоной, и зону обратимой ишемии, примыкающую к участкам неповрежденного миокарда.
Все структурные и функциональные изменения в зоне очаговой дистрофии в большинстве случаев подлежат восстановлению (частично или даже полностью).
В зоне обратимой ишемии изменения бывают полностью обратимы. После отграничения зоны инфаркта наступает постепенное размягчение и растворение погибших миоцитов, элементов соединительной ткани, участков сосудов, нервных окончаний.
При крупноочаговом инфаркте миокарда примерно на 10-е сутки на периферии очага некроза уже образуется молодая грануляционная ткань, из которой в дальнейшем формируется соединительная ткань, выполняющая рубец. Заместительные процессы идут от периферии к центру, поэтому в центре очага какое-то время могут еще оставаться очаги размягчения, а это участок, который способен растягиваться, формируя аневризму сердца или даже разрываться при грубом несоблюдении двигательного режима или других нарушениях. В месте некроза плотная рубцовая ткань окончательно формируется не ранее чем через 3-4 месяца.
При мелкоочаговом инфаркте миокарда рубец иногда образуется в более ранние сроки. На скорость рубцевания влияют не только размеры очага некроза, но и состояние коронарного кровообращения в миокарде, в особенности в периинфарктных участках. Помимо этого, имеют значение следующие факторы:
— возраст больного;
— уровень АД;
— двигательный режим;
— состояние обменных процессов;
— обеспеченность пациента полноценными аминокислотами, витаминами;
— адекватность проводимого лечения;
— наличие сопутствующих заболеваний.
Все это определяет интенсивность восстановительных процессов в организме в целом и в миокарде в частности.
Даже относительно небольшая нагрузка в период формирования первичного рубца может привести к развитию аневризмы сердца (выпячиванию стенки желудочка, формированию своеобразного мешка), тогда как уже через месяц такая же нагрузка оказывается полезной и даже необходимой для укрепления сердечной мышцы и формирования более прочного рубца.
Эпидемиология
Признак распространенности: Очень распространено
Сегодня в развитых странах число пациентов с коронарной патологией постоянно растет, причем происходит сдвиг в сторону более молодого возраста, что делает проблему диагностики, лечения и профилактики ишемической болезни социально значимой.
Заболеваемость среди мужчин гораздо выше, чем среди женщин: в среднем 500 на 100 000 мужчин и 100 на 100 000 женщин, в возрасте старше 70 лет эта разница нивелируется.
Возрастной пик заболеваемости инфарктом миокарда — 50-70 лет.
У мужчин пик заболеваемости приходится на зимнее время, у женщин — на осень, снижение заболеваемости у мужчин и женщин происходит одновременно в летний период времени.
Самыми опасным временем суток у мужчин считаются предутренние часы (4-8 часов утра), когда частота развития ИМ достигает 23,9%; у женщин аналогичный показатель составляет 25,9% в утренние часы (8-12 часов). Такая частота развития ИМ в зависимости от сезонности и времени суток совпадает с аналогичными показателями «внезапной смерти».
Внезапная смерть обычно происходит в утренние часы при подъеме больного с постели, что вероятнее всего связано с повышением активности симпатической нервной системы при пробуждении. Это вызывает увеличение вязкости крови и агрегационную активность тромбоцитов с выбросом
вазоактивных
биологических веществ, за чем следует спазм сосудов и тромбообразование, с развитием ишемического инсульта или острого инфаркта миокарда (ОИМ).
Примерно одна треть всех случаев ОИМ (а у более молодых больных еще чаще) завершается летальным исходом на догоспитальном этапе, в большинстве случаев уже через 1 час после появления острых симптомов. Среди пациентов с ОИМ, доживших до поступления в больницу, в результате проведенной современной терапии отмечаются меньшая летальность и более продолжительная выживаемость.
Смерть больных ОИМ в первые 4 часа связана с появлением аритмий и развитием
фибрилляции желудочков
(аритмогенная смерть), а в более поздние сроки — с нарастанием острой сердечной недостаточности (кардиогенный шок).
Факторы и группы риска
Факторы риска развития инфаркта миокарда (ИМ) совпадают с таковыми при ишемической болезни сердца (ИБС).
Немодифицируемые факторы риска:
1. Наследственность. Считается отягощенной по ИБС, если у близких родственников (родители, братья, сестры, дедушки, бабушки) были случаи ИБС по мужской линии до 55 лет, по женской до 65 лет.
2. Возраст. В разных популяциях выявлена прямая зависимость между возрастом человека и частотой возникновения ИБС — чем старше человек, тем выше заболеваемость ИБС.
3. Пол. Мужчины гораздо чаще болеют ИБС. У женщин до 50-55 лет (возраст наступления стойкой менопаузы) ИБС диагностируется крайне редко. Исключение составляют женщины с ранней менопаузой и различными гормональными нарушениями при отягчающих обстоятельствах:
артериальная гипертония
,
гиперлипидемия
, сахарный диабет. После наступления менопаузы частота возникновения ИБС у женщин начинает неуклонно расти, и после 70-75 лет вероятность развития ИБС у мужчин и женщин одинакова.
Модифицируемые факторы риска:
1. Неправильное питание. Употребление пищи, богатой насыщенными жирами животного происхождения, с высоким содержанием поваренной соли и низким содержанием пищевой клетчатки.
2. Артериальная гипертония. Значение повышенного артериального давления, как одного из факторов риска, доказано многочисленными исследованиями во всем мире.
3.
Гиперхолестеринемия
. Повышенное содержание в крови общего холестерина, холестерина липопротеидов низкой плотности. Холестерин липопротеидов высокой плотности рассматривается как фактор антириска — чем выше его уровень, тем меньше риск возникновения ИБС.
4. Слабая физическая активность или отсутствие регулярных физических нагрузок. У людей, ведущих малоподвижный образ жизни, вероятность возникновения ИБС в 1,5-2,4 выше, чем у физически активных.
5. Ожирение. Особенно опасно ожирение по абдоминальному типу, когда жир откладывается в области живота.
6. Табакокурение. Прямая связь курения с развитием и прогрессированием атеросклероза хорошо известна и не нуждается в комментариях.
7. Сахарный диабет. Относительный риск смерти даже у лиц с нарушением толерантности к глюкозе выше на 30%, а у больных сахарным диабетом 2 типа — на 80%.
8. Злоупотребление алкоголем. Однако фактором антириска является употребление до 30 г чистого алкоголя в сутки для мужчин и 20 г — для женщин.
9. Во всем мире сейчас уделяется внимание изучению таких факторов риска, как хронический психоэмоциональный стресс, повышенная частота сердечных сокращений, нарушение системы свертываемости, гомоцистеинемия (повышение уровня в крови
гомоцистеина
).
Ученые также установили зависимость риска развития инфаркта миокарда в зависимости от психо-эмоционального типа человека. Так, холерики имеют в 2 раза больше шансов получить первый инфаркт и в 5 раз больше — повторный, а смертность от инфаркта у них встречается в 6 раз чаще.
Провоцирующими моментами для развития острого инфаркта миокарда (ОИМ) являются интенсивное физическое или психоэмоциональное напряжение. На протяжении часа после значительного физического напряжения риск развития ОИМ возрастает в 6 раз, причем у лиц, ведущих малоподвижный образ жизни, — в 10,7 раза, а у лиц, занимающихся интенсивными физическими упражнениями, — в 2,4 раза. Подобным эффектом обладают и сильные переживания. В течение 2 часов после психоэмоционального перенапряжения риск развития ОИМ возрастает в 2,3 раза.
Частота развития ОИМ возрастает в утренние часы, в течение первого часа после пробуждения. Это касается и частоты развития внезапной смерти, инсульта, транзиторной ишемии миокарда, по данным Холтеровского наблюдения. Повышение риска связывают с увеличением в это время артериального давления и
ЧСС
, усилением
агрегационных
свойств тромбоцитов и снижением
фибринолитической
активности плазмы крови, повышением уровня
катехоламинов
,
АКТГ
,
кортизола
.
Похолодание и изменение атмосферного давления также способствуют повышению риска развития ОИМ. Так, при снижении температуры на 10°С, по сравнению со среднегодовой для данного времени года, риск развития первого ИМ возрастает на 13%, а повторного — на 38%. Изменения атмосферного давления, как в одну, так и в другую сторону, сопровождаются учащением развития ИМ на 11-12%, а повторного — на 30%.
Клиническая картина
Cимптомы, течение
Фазы острого инфаркта миокарда (ОИМ):
1. Продромальный период (длится до 30 суток, может отсутствовать).
2. Острейший период (продолжается до 2 часов от начала
ангинозного статуса
).
3. Острый период (длится до 10 дней от начала инфаркта миокарда).
4. Подострый период (начинается с 10 дня и продолжается до 1-2 месяцев).
5. Период рубцевания (в среднем длится от 2-3 месяцев до полугода, иногда завершается лишь спустя 2-3 года).
В зависимости от стадии болезни ее проявления сильно варьируют.
Продромальный период
В этот период у пациентов развиваются признаки
нестабильной стенокардии
:
— учащаются боли в груди;
— боли появляются при меньших физических нагрузках, а то и вовсе в покое;
— боли хуже снимаются нитратами, требуется большая доза нитратов, чтобы боль прошла.
Острый коронарный синдром (ОКС) объединяет такие заболевания, как нестабильная стенокардия, острый инфаркт миокарда и внезапная сердечная смерть. В основе всех этих состояний, несмотря на разные их проявления, лежит один механизм. Как при инфаркте, так и при
нестабильной стенокардии
нарушается целостность одной из холестериновых бляшек в коронарной артерии. Организм реагирует на образовавшийся дефект, отправляя в очаг тромбоциты и активируя свертывающую систему крови. Как следствие, образуется тромб, перекрывающий ток крови. Кратковременное или неполное перекрытие просвета сосуда вызывает развитие симптомов
нестабильной стенокардии
. Если закупорка усугубляется, происходит инфаркт.
В связи с этим пациентов с нестабильной стенокардией необходимо экстренно госпитализировать.
Острейший период
В этот период наблюдается самая высокая летальность от инфаркта миокарда. В то же время, острейший период – самый благоприятный в плане терапии. Существуют препараты, которые разрушают образовавшийся тромб, тем самым восстанавливая нарушенный ток крови по сосуду. Однако эти лекарства эффективны лишь в течение первых 12 часов с момента развития инфаркта, и чем раньше они применены, тем лучше будет результат.
В острейший период появляется ангинозный статус — очень интенсивная боль, которая локализуется либо за грудиной, либо в левой половине грудной клетки. Пациенты описывают боль как кинжальную, сверлящую или давящую («сердце сжало в тисках»). Зачастую боль накатывает волнами, может отдавать в левое плечо, руку, межлопаточную область, нижнюю челюсть. Иногда она распространяется на правую половину грудной клетки и в верхнюю половину живота.
Боль в целом схожа с таковою во время приступа стенокардии, но интенсивность ее гораздо выше, она не проходит после приема 2-3 таблеток нитроглицерина и обычно длится от 30 минут и дольше.
Помимо боли нередко наблюдается холодный пот, выраженная общая слабость. Артериальное давление чаще снижается в результате уменьшения силы сокращений поврежденного сердца, реже — повышается, поскольку организм в ответ на стресс выбрасывает большое количество адреналина, оказывающего стимулирующее влияние на работу сердечно-сосудистой системы. Почти всегда при инфаркте миокарда пациенты испытывают выраженную тревогу, страх смерти.
Важно знать, что у 20% пациентов острейший период инфаркта протекает малосимптомно (так называемая «безболевая» форма инфаркта миокарда). Такие пациенты отмечают неясную тяжесть в груди («сердечную тоску»), выраженную утомляемость, недомогание, бессонницу, «беспричинную» тревогу.
Еще у части больных инфаркт миокарда может проявлять себя развитием нарушений ритма и проводимости. Такие пациенты ощущают перебои в работе сердца, возможно — резкое учащение, или, напротив, замедление пульса. Могут появляться головокружение, выраженная слабость, эпизоды потери сознания.
Иногда инфаркт миокарда может манифестировать внезапно возникшей одышкой или отеком легких.
Симптоматика клинических вариантов острейшей фазы инфаркта миокарда
|
Болевой (status anginosus) |
Типичное клиническое течение, основным проявлением при котором служит ангинозная боль, не зависящая от позы и положения тела, от движений и дыхания, устойчивая к нитратам. Боль имеет давящий, душащий, жгущий или раздирающий характер с локализацией за грудиной, во всей передней грудной стенке с возможной иррадиацией в плечи, шею, руки, спину, эпигастальную область. Характерно сочетание с гипергидрозом, резкой общей слабостью, бледностью кожных покровов, возбуждением, двигательным беспокойством. |
|
Абдоминальный (status gastralgicus) |
Проявляется сочетанием эпигастральных болей с диспептическими явлениями — тошнотой, не приносящей облегчения рвотой, икотой, отрыжкой, резким вздутием живота. Возможны иррадиация болей в спину, напряжение брюшной стенки и болезненность при пальпации в эпигастрии. |
| Атипичный болевой | Болевой синдром имеет атипичный характер по локализации (например, только в зонах иррадиации — горле и нижней челюсти, плечах, руках и т.д.) и/или по характеру. |
|
Астматический (status astmaticus) |
Единственный признак — приступ одышки, являющийся проявлением острой застойной сердечной недостаточности (сердечная астма или отек легких). |
| Аритмический | Нарушения ритма служат единственным клиническим проявлением или преобладают в клинической картине. |
| Цереброваскулярный | В клинической картине преобладают признаки нарушения мозгового кровообращения (чаще — динамического): обморок, головокружение, тошнота, рвота. Возможна очаговая неврологическая симптоматика. |
| Малосимптомный (бессимптомный) | Наиболее сложный для распознавания вариант, нередко диагностируемый ретроспективно по данным ЭКГ. |
Острый период
В этом периоде острая боль стихает, поскольку процесс разрушения кардиомиоцитов завершен, а некротизированные ткани не чувствительны к боли. Большинство больных могут отмечать сохранение остаточных болей: глухих и постоянных, как правило, локализующихся за грудиной.
На вторые сутки ферменты из поврежденных клеток и разрушенные ткани попадают в кровь, вызывая температурную реакцию: может появляться лихорадка до 39°С, а также недомогание, слабость, потливость.
Действие стрессовых гормонов (адреналина, норадреналина, дофамина) утихает, в результате чего артериальное давление снижается, иногда очень значительно.
В этот период могут появляться тупые боли в груди, усиливающиеся при дыхании, что является признаком развития плевроперикардита. У части больных интенсивные давящие боли в сердце могут возобновиться — в таком случае диагностируется постинфарктная стенокардия либо рецидив инфаркта миокарда.
Поскольку рубец еще не сформирован, а часть мышечных клеток сердца разрушена, в этот период очень важно минимизировать физическую активность, стресс. При несоблюдении этих правил может развиться аневризма сердца или наступить смерть от разрыва сердца.
Подострый период
В этот период болевые ощущения, как правило, отсутствуют. Учитывая тот факт, что сократительная способность сердца снижена, поскольку участок миокарда «выключен» из работы, могут появиться симптомы сердечной недостаточности: одышка, отеки ног. В целом же состояние пациента улучшается: температура нормализуется, артериальное давление стабилизируется, риск развития аритмии уменьшается.
В сердце происходят процессы рубцевания: организм устраняет образовавшийся дефект, замещая разрушенные кардиомиоциты соединительной тканью.
Период рубцевания инфаркта миокарда
В этот период продолжается и завершается образование полноценного рубца из грубоволокнистой соединительной ткани. Самочувствие пациента зависит от величины площади поражения и наличия или отсутствия осложнений инфаркта миокарда.
В целом, состояние нормализуется. Болевых ощущений в сердце нет либо имеется стабильная стенокардия определенного функционального класса. Человек привыкает к новым условиям жизни.
Диагностика
Электрокардиография — важнейший метод диагностики инфаркта миокарда (ИМ), позволяющий:
— выявить ИМ;
— установить локализацию ИМ, его глубину и распространенность;
— диагностировать осложнения ИМ (аритмии, формирование аневризмы сердца)
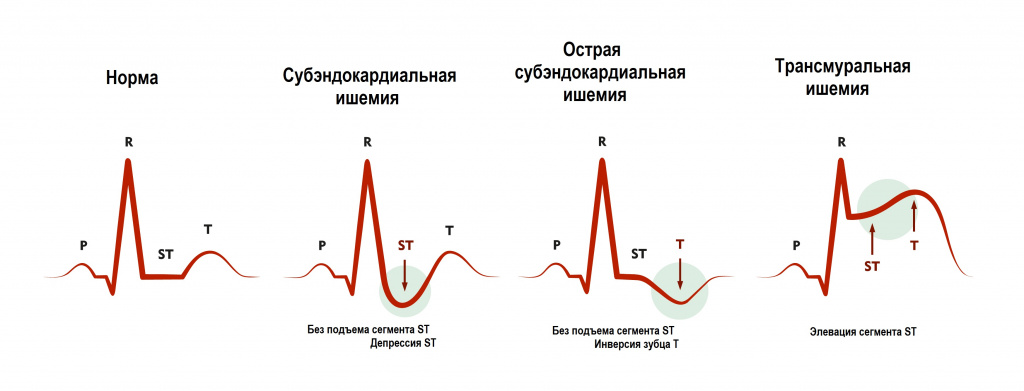
ЭКГ при ИМ формируется под влиянием трех зон, образующихся в области инфаркта и представленных в таблице ниже (Bayley)
|
Зона некроза — в центре очага поражения |
Трансмуральный ИМ | Патологический зубец Q |
| Нетрансмуральный ИМ | Отсутствие или невыраженность патологического зубца Q | |
| Зона повреждения — к периферии от зоны некроза, окружает ее | Субэндокардиальный ИМ | Депрессия сегмента ST |
| Субэпикардиальный или трансмуральный ИМ | Элевация сегмента ST | |
| Зона ишемии — кнаружи от зоны повреждения | Субэндокардиальный ИМ | Высокий и широкий зубец Т (высокий коронарный зубец Т) |
| Субэпикардиальный илитрансмуральный ИМ | Отрицательный симметричный зубец Т с заостренной вершиной (отрицательный коронарный зубец Т) |
Диагностика стадии ИМ (в динамике)
Топическая диагностика (локализация) ИМ
В таблице знаком (+) обозначено смещение вверх сегмента RS-Т или положительный зубец Т, знаком (–) — смещение сегмента RS-Т вниз от изолинии или отрицательный зубец Т.
| Локализация ИМ |
Отведения |
Характер изменений ЭКГ |
| Переднеперегородочный |
V1-V3 |
1) Q или QS 2) +(RS-T) 3) -Т |
| Передневерхушечный |
V3,V4 |
1) Q или QS 2) +(RS-T) 1) -Т |
| Переднебоковой |
I, aVL, V5, V6 |
1) Q 2) +(RS-T) 3) -Т |
| Распространенный передний |
I, aVL, V1-V6 |
1) Q или QS 2) +(RS-T) 3) -Т |
|
III, aVF |
Реципрокные изменения: 1) -(RS-T) 2) + Т (высокие) |
|
| Высокий передний (переднебазальный) |
V24-V26, V34- V36 |
1) Q или QS 2) +(RS-T) 3) -Т |
| Заднедиафрагмальный (нижний) |
III, aVF или III, II, aVF |
1) Q или QS 2) + (RS-T) 3) -T |
|
V1-V4 |
Реципрокные изменения: 1) -{RS-T) 2) + Т (высокие) |
|
| Заднебазальный |
V7–V9 (не всегда) |
1) Q или QS 2) +(RS-T) 3) -Т. |
|
V1– V3 |
Реципрокные изменения: 1) -(RS-T), 2) +Т (высокие); 3) Увеличение R. |
|
| Заднебоковой |
V5, V6, Ill, aVF |
1) Q 2) +(RS-T) 3) -Т |
|
V1-V3 |
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) + T (высокие). |
|
| Распространенный задний |
III, aVF, III, V5, V6, V7-9 |
1) Q или QS 2) +(RS-T) 3) -Т |
|
V1-V3 |
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) +T (высокие). |
Прекардиальное электрокардиографическое картирование сердца
Исследование применяется при остром инфаркте миокарда передней и переднебоковой стенок левого желудочка для косвенного определения размеров зоны некроза и периинфарктной зоны (участок ишемического повреждения). С этой целью после регистрации ЭКГ с 35 точек на поверхности грудной клетки строят картограмму, состоящую из 35 квадратов, каждый из которых соответствует одному из 35 отведений.
Размеры зоны некроза условно оценивают по количеству отведений, в которых выявляются признаки трансмурального некроза – комплекс QS. Это так называемая «площадь трансмурального некроза» (AQS).
Параметры определения величины периинфарктной зоны:
1. Количество отведений (квадратов), в которых регистрируется подъем сегмента RS-Т выше изолинии. Это площадь RS-T (ARS-T).
2. Величина суммарного подъема сегмента RS-Т во всех отведениях (квадратах) картограммы, в которых фиксируется ишемическое повреждение миокарда (ERS-Т).
3. Значение среднего индивидуального подъема сегмента RS-T (NRS-T), который рассчитывается по формуле: NRS – T= ERS – T/ARS–T
Указанные картографические показатели с успехом используются для наблюдения за динамикой зон некроза и периинфарктной зоны в процессе лечения больных острым инфарктом миокарда, а также для оценки прогноза заболевания; чем выше все описанные показатели, тем больше площадь и глубина поражения миокарда и, соответственно, тем хуже прогноз заболевания.
Коронарография
«Золотой стандарт» диагностики ишемической болезни сердца (ИБС). Больные с многососудистым поражением или поражением ствола левой венечной артерии имеют более высокий риск сердечно-сосудистых событий. Роль коронарографии в оценки критичности бляшки и других повреждений исключительно важна, если предполагается последующая
реваскуляризация
.
Сложные стенозы, бифуркационные поражения и извитость стенозированных сосудов служат показателями высокого риска. Самый высокий риск имеется при дефектах наполнения, так как при этом существуют внутрисосудистые тромбы. У 10-15% пациентов с болью в груди нет поражения венечных артерий и у них диагноз ИБС исключается.
Компьютерная томография
В настоящее время данное исследование не может заменить коронарографию при остром коронарном синдроме из-за субоптимальной диагностической точности.
КТ сердца не является оптимальным методом диагностики у больных с острым коронарным синдром из-за высокой вероятности в необходимости выполнения коронарной ангиопластики со стентированием. Это обусловлено тем, что на проведение КТ теряется время, пациент получает контрастный препарат и дозу облучения.
Двухмерная ЭхоКГ
Систолическая функция левого желудочка — важный прогностический показатель для больного с ИБС. Регионарные нарушения сократимости могут наступить сразу после ишемии, задолго до некроза, но они неспецифичны для острых событий и могут быть результатом старого инфаркта миокарда.
Транзиторная локальная акинезия и гипокинезия сегментов левого желудочка могут определяться в ходе ишемии, с восстановлением нормальной кинетики стенки при прохождении ишемии.
Отсутствие нарушений локальной сократимости исключает наличие ИМ.
ЭхоКГ имеет ценность для диагностики других причин болей в груди — расслоение и разрыв аорты, гипертрофическая
кардиомиопатия
,
перикардит
и массивная
ТЭЛА
.
Перфузионная сцинтиграфия
Обычно этот метод исследования недоступен, поэтому у острых больных он используется редко. Нормальная сцинтиграмма миокарда с 99Th в покое достоверно исключает крупноочаговый ИМ. Однако ненормальная сцинтиграмма не указывает на острый ИМ, если только нет данных, что раньше сцинтиграмма была нормальной, до наступления острого состояния, но она указывает на наличие ИБС и необходимость дальнейшего обследования.
Магнитно-резонансная томография
МРТ сердца еще пока не стала рутинной процедурой для визуализации венечных сосудов, но позволяет получить информацию о регионарной сократимости, перфузии и жизнеспособности миокарда. Это позволяет идентифицировать больных с ОКС и острым ИМ. Кроме того, МРТ может исключить или подтвердить другие причины боли в груди — миокардит,
перикардит
, расслаивающую аневризму аорты и
ТЭЛА
Лабораторная диагностика
Лабораторное подтверждение острого инфаркта миокарда (ОИМ) основано на выявлении:
— неспецифических показателей тканевого некроза и воспалительной реакции миокарда;
— гиперферментемии (входит в классическую триаду признаков ОИМ: болевой синдром, типичные изменения ЭКГ, гиперферментемия).
Неспецифические показатели тканевого некроза и воспалительной реакции миокарда:
1. Лейкоцитоз, не превышающий обычно 12-15*109/л (выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели).
2. Анэозинофилия.
3. Небольшой палочкоядерный сдвиг формулы крови влево.
4. Увеличение СОЭ (увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений ИМ).
Правильная трактовка этих показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных ОИМ свидетельствует о возможном развитии осложнений: (пневмония,
плеврит
, перикардит, тромбоэмболия мелких ветвей легочной артерии и другие).
Гиперферментемия
Основной причиной повышения активности и содержания ферментов в сыворотке крови у больных ОИМ является разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики ОИМ является определение активности нескольких ферментов в сыворотке крови:
— креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК);
— лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
— аспартатаминотрансферазы (АСТ);
— тропонина;
— миоглобина.
Повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для ОИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы.
Динамика МВ-КФК при ОИМ:
— через 3-4 часа активность начинает возрастать;
— через 10-12 часов достигает максимума;
— через 48 часов от начала ангинозного приступа возвращается к исходным цифрам.
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером ИМ — чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК 1.
Динамика КФК при ОИМ:
— к концу первых суток уровень фермента в 3-20 раз превышает норму;
— через 3-4 суток от начала заболевания возвращается к исходным значениям.
1 Следует помнить, что любые кардиохирургические вмешательства (включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию), как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК.
В литературе имеются также указания на возможность повышения уровня МВ-КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
В ряде случаев при обширных инфарктах миокарда вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой “концентрация-время” остается одинаковой.
Лактатдегидрогеназа
Активность ЛДГ при ОИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной 2.
Динамика ЛДГ при ОИМ:
— через 2-3 суток от начала инфаркта наступает пик активности;
— к 8-14 суткам происходит возвращение к исходному уровню.
2 Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, ТЭЛА, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
Изофермент ЛДГ1 более специфичен для поражений сердца, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотрансфераза
Динамика АСТ при ОИМ:
— через 24-36 часов от начала инфаркта относительно быстро наступает пик повышения активности;
— через 4-7 суток концентрация АСТ возвращается к исходному уровню.
Изменение активности АСТ неспецифично для ОИМ: уровень АСТ вместе с активностью АЛТ повышается при многих патологических состояниях, в том числе при заболеваниях печени 3.
3 При поражениях паренхимы печени в большей степени возрастает активность АЛТ, а при заболеваниях сердца в большей степени возрастает активность АСТ. При ИМ отношение АСТ/АЛТ (коэффициент де Ритиса) больше 1,33, а при заболеваниях печени отношение АСТ/АЛТ меньше 1,33.
Тропонин
Тропонин представляет собой универсальную для поперечно-полосатой мускулатуры структуру белковой природы, локализующуюся на тонких миофиламентах сократительного аппарата миокардиоцита.
Сам тропониновый комплекс состоит из трех компонентов:
— тропонин С — ответственный за связывание кальция;
— тропонин Т — предназначен для связывания тропомиозина;
— тропонина I — предназначен для ингибирования выше указанных двух процессов.
Тропонин Т и I существуют в специфичных для миокарда изоформах, отличающихся от изоформ скелетных мышц, чем и обусловливается их абсолютная кардиоспецифичность 4.
Динамика тропонинов при ОИМ:
— спустя 4-5 часов после гибели кардиомиоцитов вследствие развития необратимых некротических изменений, тропонин поступает в периферический кровоток и определяются в венозной крови;
— в первые 12-24 часа от момента возникновения ОИМ достигается пик концентрации.
Кардиальные изоформы тропонина длительно сохраняют свое присутствие в периферической крови:
— тропонин I определяется на протяжении 5-7 дней;
— тропонин Т определяется до 14 дней.
Присутствие этих изоформ тропонина в крови пациента выявляется при помощи
ИФА
с использованием специфических антител.
4 Следует помнить, что тропонины не являются ранними биомаркерами ОИМ, поэтому у рано обратившихся больных с подозрением на острый коронарный синдром при отрицательном первичном результате необходимо повторное (через 6-12 часов после болевого приступа) определение содержания тропонинов в периферической крови. В этой ситуации даже незначительное повышение уровня тропонинов свидетельствует о дополнительном риске для больного, поскольку доказано существование четкой корреляции между уровнем возрастания тропонина в крови и размером зоны поражения миокарда.
Многочисленными наблюдениями было показано, что повышенный уровень тропонина в крови больных с острым коронарным синдромом может рассматриваться как достоверный показатель наличия у пациента ОИМ. В то же время низкий уровень тропонина у этой категории больных свидетельствует в пользу постановки более мягкого диагноза нестабильной стенокардии.
Миоглобин
Специфичность миоглобина для диагностики ОИМ примерно такая же, как КФК, но ниже, чем МВ-КФК.
Уровень миоглобина может повышаться в 2-3 раза после внутримышечных инъекций, и диагностически значимым обычно считают повышение в 10 и более раз.
Подъем уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК. Диагностически значимый уровень зачастую достигается уже через 4 часа и в подавляющем большинстве случаев наблюдается через 6 часов после болевого приступа.
Высокая концентрация миоглобина в крови наблюдается только в течение нескольких часов, поэтому, если не повторять анализ каждые 2-3 часа, пик концентрации можно пропустить. Измерение концентрации миоглобина может быть применено только в случаях поступления больных в стационар менее чем через 6-8 часов после начала болевого приступа.
Принципы ферментативной диагностики ОИМ
1. У пациентов, поступивших в течение первых 24 часов после ангинозного приступа, производится определение активности КФК в крови — это следует делать даже в тех случаях, когда по клиническим и электрокардиографическим данным диагноз инфаркта миокарда не вызывает сомнения, так как степень повышения активности КФК информирует врача о размерах инфаркта миокарда и прогнозе.
2. Если активность КФК находится в пределах нормы или повышена незначительно (в 2-3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КФК.
3. Нормальные величины активности КФК и МВ-КФК, полученные при однократном заборе крови в момент поступления больного в клинику, недостаточны для исключения диагноза ОИМ. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24 часа.
4. Если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КФК и МВ-КФК нормальный, то целесообразно определить активность ЛДГ в крови (предпочтительнее — отношение активности ЛДГ1 и ЛДГ2), АСТ вместе с АЛТ и расчетом коэффициента де Ритиса.
5. Если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КФК и МВ-КФК сразу после приступа и через 12 и 24 часа.
6. Миоглобин в крови целесообразно определять только в первые часы после болевого приступа, повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень миоглобина отнюдь не исключает инфаркта.
7. Определение ферментов нецелесообразно у бессимптомных больных с нормальной ЭКГ. Диагноз на основании одной только гиперферментемии ставить все равно нельзя — должны быть клинические и (или) ЭКГ-признаки, указывающие на возможность ИМ.
8. Контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения ОИМ.
9. Исследование уровня активности КФК и МВ-КФК целесообразно проводить только в течение 1-2 суток от предположительного начала заболевания.
10. Исследование уровня активности АСТ целесообразно проводить только в течение 4-7 суток от предположительного начала заболевания.
11. Повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АСТ не является строго специфичным для ОИМ, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью.
12. Отсутствие гиперферментемии не исключает развития ОИМ.
Дифференциальный диагноз
1. Аллергический и инфекционно-токсический шок.
Симптомы: загрудинная боль, одышка, падение артериального давления.
Анафилактический шок может возникать при любой лекарственной непереносимости. Начало болезни острое, четко приурочено к причинному фактору (инъекция антибиотика, прививка с целью профилактики инфекционного заболевания, введение противостолбнячной сыворотки и др.). В некоторых случаях заболевание начинается через 5-8 дней от момента ятрогенного вмешательства, развивается по типу
феномена Артюса
, в котором сердце выступает в роли шок-органа.
Инфекционно-токсический шок с поражением миокарда может возникнуть при любом тяжелом инфекционном заболевании.
Клинически заболевание очень напоминает инфаркт миокарда (ИМ), отличаясь от него по этиологическим факторам. Дифференциация затрудняется в связи с тем, что при аллергическом и инфекционно-аллергическом шоке могут возникать некоронарогенные некрозы миокарда с грубыми изменениями ЭКГ, лейкоцитозом, увеличением СОЭ, гиперферментемией АСТ, ЛДГ,
ГБД
, КФК, МВ-КФК.
В отличие от типичного ИМ, при данных шоках на ЭКГ не бывает глубокого зубца Q и комплекса QS, дискордантности изменений конечной части.
2. Перикардит (миоперикардит).
Этиологические факторы перикардита: ревматизм, туберкулез, вирусная инфекция (чаще — вирус Коксаки или ECHO), диффузные болезни соединительной ткани; нередко — терминальная ХПН.
При остром перикардите в процесс часто вовлекаются субэпикардиальные слои миокарда.
В типичном варианте при сухом перикардите возникают тупые, давящие (реже — острые) боли в прекордиальной области без иррадиации в спину, под лопатку, в левую руку, свойственные инфаркту миокарда.
Шум трения перикарда регистрируется в те же дни, что и повышение температуры тела, лейкоцитоз, увеличение СОЭ. Шум стойкий, выслушивается в течение нескольких дней или недель.
При ИМ шум трения перикарда кратковременный; предшествует лихорадке и увеличению СОЭ.
Если у больных перикардитом появляется сердечная недостаточность, то она правожелудочковая или бивентрикулярная. Для ИМ характерна левожелудочковая сердечная недостаточность.
Дифференциально-диагностическая ценность энзимологических тестов невелика. Вследствие поражения субэпикардиальных слоев миокарда у больных перикардитом может регистрироваться гиперферментемия АСТ, ЛДГ, ЛДГ1,
ГБД
, КФК и даже изоэнзима МВ-КФК.
В правильной постановке диагноза помогают данные ЭКГ. При перикардите имеются симптомы субэпикардиального повреждения в виде элевации интервала ST во всех 12 общепринятых отведениях (нет дискордантности, свойственной ИМ). Зубец Q при перикардите, в отличие от ИМ, не выявляется. Зубец Т при перикардите может быть отрицательным, он становится положительным через 2-3 недели от начала болезни.
При появлении перикардиального экссудата очень характерной становится рентегнологическая картина.
3. Левосторонняя пневмония.
При пневмонии могут появляться боли в левой половине грудной клетки, иногда интенсивные. Однако в отличие от прекордиальных болей при ИМ, они четко связаны с дыханием и кашлем, не имеют типичной для ИМ иррадиации.
Для пневмонии характерен продуктивный кашель. Начало болезни (озноб, повышение температуры, бои в боку, шум трения плевры) совершенно не типично для ИМ.
Физикальные и рентгенологические изменения в легких помогают диагностировать пневмонию.
ЭКГ при пневмонии может меняться (низкий зубец Т, тахикардия), но никогда не бывает изменений, напоминающих таковые при ИМ.
Как и при ИМ, при пневмонии можно обнаружить лейкоцитоз, увеличение СОЭ, гиперферментемию АСТ, ЛДГ, но только при поражении миокарда повышается активность
ГБД
, ЛДГ1, МВ-КФК.
4. Спонтанный пневмоторакс.
При пневмотораксе возникают сильная боль в боку, одышка, тахикардия. В отличие от ИМ, спонтанный пневмоторакс сопровождается тимпаническим перкуторным тоном на стороне поражения, ослаблением дыхания, рентгенологическими изменениями (газовый пузырь, коллапс легкого, смещение сердца и средостения в здоровую сторону).
Показатели ЭКГ при спонтанном пневмотораксе либо нормальные, либо выявляется преходящее снижение зубца Т.
Лейкоцитоза, увеличения СОЭ при пневмотораксе не бывает. Активность сывороточных ферментов нормальная.
5. Ушиб грудной клетки.
Как и при ИМ возникают сильные боли в груди, возможен шок. Сотрясение и ушиб грудной клетки приводят к повреждению миокарда, что сопровождается элевацией или депрессией интервала ST, негативизацией зубца Т, а в тяжелых случаях — даже появлением патологического зубца Q.
В постановке правильного диагноза решающую роль играет анамнез.
Клиническая оценка ушиба грудной клетки с изменениями ЭКГ должна быть достаточно серьезной, поскольку в основе этих изменений лежат некоронарогенные некрозы миокарда.
6. Остеохондроз грудного отдела позвоночника с компрессией корешка.
При остеохондрозе с корешковым синдромом боли в грудной клетке слева могут быть очень сильными, нестерпимыми. Но, в отличие от болей при ИМ, они исчезают, когда больной принимает неподвижное вынужденное положение, и резко усиливаются при поворотах туловища и дыхании.
Нитроглицерин, нитраты при остеохондрозе совершенно не эффективны.
При грудном «радикулите» определяется четкая локальная болезненность в паравертебральных точках, реже по ходу межреберий.
Количество лейкоцитов, а также значения СОЭ, энзимологических показателей, ЭКГ в пределах нормы.
7. Опоясывающий лишай.
Клиника опоясывающего лишая весьма напоминает описанную выше (см. описание симптомов корешкового синдрома при остеохондрозе позвоночника в грудном отделе).
У некоторых больных может регистрироваться лихорадка в сочетании с умеренным лейкоцитозом, увеличением СОЭ.
ЭКГ, ферментные тесты, как правило, часто помогают исключить диагноз ИМ.
Диагноз «опоясывающий лишай» становится достоверным со 2-4 дня болезни, когда по ходу межреберий появляется характерная пузырьковая (везикулярная) сыпь.
8. Бронхиальная астма.
Астматический вариант ИМ в чистом виде встречается редко, чаще удушье сочетается с болями в предсердечной области, аритмией, симптомами шока.
9. Острая левожелудочковая недостаточность осложняет течение многих болезней сердца, в числе которых кардиомиопатии, клапанные и врожденные пороки сердца, миокардиты и другие.
10. Острый холецистопанкреатит.
При остром холецистопанкреатите, как и при гастралгическом варианте ИМ, возникают сильные боли в эпигастральной области, сопровождающиеся слабостью, потливостью, гипотензией. Однако боли при остром холецистопанкреатите локализуются не только в эпигастрии, но и в правом подреберье, иррадиируют вверх и вправо, в спину, иногда могут быть опоясывающими. Характерно сочетание болей с тошнотой, рвотой, причем в рвотных массах определяется примесь желчи.
Пальпаторно определяется болезненность в точке желчного пузыря, проекции поджелудочной железы, положительные
симптом Кера
,
симптом Ортнера
,
симптом Мюсси
, что не характерно для ИМ.
Вздутие живота, локальное напряжение в правом верхнем квадранте не типично для ИМ.
Лейкоцитоз, увеличение СОЭ, гиперферментемия АСТ, ЛДГ могут появляться при обоих заболеваниях. При холецистопанкреатите отмечается увеличение активности альфа-амилазы сыворотки крови и мочи, ЛДГ 3-5. При ИМ следует ориентироваться на высокие показатели ферментной активности КФК, МВ-КФК,
ГБД
.
ЭКГ при остром холецистопанкреатите: снижение интервала ST в ряде отведений, слабо отрицательный или двухфазный зубец Т.
Крупноочаговое метаболическое повреждение миокарда существенно ухудшает прогноз панкреатита, нередко является ведущим фактором в летальном исходе.
11. Прободная язва желудка.
Как при ИМ, характерны острые боли в эпигастрии. Однако при прободной язве желудка отмечаются нестерпимые, «кинжальные» боли, максимально выраженные в момент прободения и затем уменьшающиеся в интенсивности, при этом эпицентр болей смещается несколько вправо и вниз.
При гастралгическом варианте ИМ боли в эпигастрии могут быть интенсивными, но для них не характерно столь острое, мгновенное начало с последующим спадом.
При прободной язве желудка через 2-4 часа от момента прободения симптоматика меняется. У больных с прободной гастродуоденальной язвой появляются симптомы интоксикации; язык становится сухим, черты лица заостряются; живот становится втянутым, напряженным; отмечаются положительные симптомы раздражения; перкуторно определяется «исчезновение» печеночной тупости; рентгенологически выявляется воздух под правым куполом диафрагмы.
Как при ИМ, так и при прободении язвы температура тела может быть субфебрильной, отмечается умеренный лейкоцитоз в течение первых суток.
Для ИМ типично увеличение активности сывороточных ферментов (ЛДГ, КФК, МВ КФК).
ЭКГ при прободной язве желудка в течение первых суток, как правило, не меняется. На следующий день возможны изменения конечной части за счет электролитных нарушений.
12. Рак кардиального отдела желудка.
При раке кардии нередко возникают интенсивные давящие боли в эпигастрии и под мечевидным отростком, сочетающиеся с транзиторной гипотонией.
В отличие от ИМ при раке кардии эпигастральные боли закономерно повторяются ежедневно, они связаны с приемом пищи.
СОЭ увеличивается при обоих заболеваниях, однако динамика активности ферментов КФК, МВ КФК, ЛДГ,
ГБД
характерна только для ИМ.
Для исключения гастралгического варианта ИМ необходимо ЭКГ-исследование. На ЭКГ выявляются изменения интервала ST (чаще депрессия) и зубца Т (изоэлектричный или слабо отрицательный) в III, avF отведениях, что служит поводом для диагностики мелкоочагового заднего ИМ.
При раке кардии ЭКГ «застывшая», на ней не удается определить характерной для ИМ динамики.
Диагноз рака уточняется при проведении
ФГДС
, рентгенологического исследования желудка в различных положениях тела исследуемого, в том числе и в положении антиортостаза.
13. Пищевая токсикоинфекция.
Как и при ИМ появляются боли в эпигастрии, падает артериальное давление. Однако при пищевой токсикоинфекции боль в эпигастрии сопровождается тошнотой, рвотой, гипотермией. Диарея не всегда встречается при пищевой токсикоинфекции, но ее никогда не бывает при ИМ.
ЭКГ при пищевой токсикоинфекции либо не меняется, либо во время исследования определяются «электролитные нарушения» в виде корытообразного смещения вниз интервала ST, слабоотрицательного или изоэлектрического зубца Т.
Лабораторные исследования при пищевой токсикоинфекции показывают умеренный лейкоцитоз, эритроцитоз (сгущение крови), небольшое повышение активности АЛТ, АСТ, ЛДГ без существенных изменений активности КФК, МВ-КФК,
ГБД
, свойственных ИМ.
14. Острое нарушение мезентерального кровообращения.
Боль в эпигастрии, падение артериального давления возникают при обоих заболеваниях. Дифференциация усложняется тем, что тромбоз мезентеральных сосудов, как и ИМ, поражает, как правило, людей пожилого возраста с различными клиническим проявлениями ИБС, с артериальной гипертонией.
При нарушении кровообращения в системе мезентеральных сосудов боли локализуются не только в эпигастрии, но и по всему животу. Живот умеренно вздут, аускультативно не выявляются звуки перистальтики кишечника, возможно обнаружение симптомов раздражения брюшины.
Для уточнения диагноза проводится обзорная рентгенография брюшной полости и определяется наличие или отсутствие перистальтики кишечника и скопления газа в кишечных петлях.
Нарушение мезентерального кровообращения не сопровождается изменениями ЭКГ и ферментных показателей, характерных для ИМ.
При затруднении в диагностике тромбоза мезентеральных сосудов патогномоничные изменения могут быть обнаружены при лапароскопии и ангиографии.
15. Расслаивающая аневризма абдоминального отдела аорты.
При абдоминальной форме расслаивающей аневризмы аорты в отличие от гастралгического варианта ИМ, характерны следующие признаки:
— начало болезни с болей в груди;
— волнообразный характер болевого синдрома с иррадиацией в поясницу по ходу позвоночника;
— появление опухолевидного образования эластичной консистенции, пульсирующего синхронно с сердцем;
— появление систолического шума над опухолевидным образованием;
— нарастание анемии.
16. Некоронарогенные некрозы миокарда могут возникать при тиреотоксикозе, лейкозах и анемиях, системных васкулитах, гипо- и гипергликемических состояниях.
Клинически на фоне симптоматики основной болезни отмечаются боли в сердце (временами сильные), одышка.
Данные лабораторных исследований бывают малоинформативными в дифференциации некоронарогенных некрозов с ИМ атеросклеротического генеза. Гиперферментемия ЛДГ, ЛДГ1,
ГБД
, КФК, МВ-КФК обусловлены миокардиальными некрозами как таковыми, вне зависимости от их этиологии.
На ЭКГ при некоронарогенных некрозах миокарда выявляются изменения конечной части – депрессия или, реже, элевация интервала ST, негативные зубцы Т, с последующей динамикой, соответствующей нетрансмуральному ИМ.
Точный диагноз устанавливается на основе всей симптоматики заболеваний. Только такой подход дает возможность методически правильно оценить собственно сердечную патологию.
18. Опухоли сердца (первичные и метастатические).
При опухолях сердца могут появляться упорные интенсивные боли в прекордиальной области, резистентные к нитратам, сердечная недостаточность, аритмии.
На ЭКГ отмечаются патологический зубец Q, элевация интервала ST, отрицательный зубец Т. В отличие от ИМ при опухоли сердца не бывает типичной эволюции ЭКГ, она малодинамична.
Сердечная недостаточность, аритмии рефрактерны к лечению. Диагноз уточняется при тщательном анализе клинико-рентгенологических и Эхо-КГ-данных.
19. Посттахикардиальный синдром.
Посттахикардиальным синдромом называется ЭКГ-феномен, выражающийся в преходящей ишемии миокарда (депрессия интервала ST, негативный зубец Т) после купирования тахиаритмии. Данный симптомокомплекс необходимо оценивать очень осторожно.
Во-первых, тахиаритмия может быть началом ИМ и ЭКГ после ее купирования зачастую лишь выявляет инфарктные изменения.
Во-вторых, приступ тахиаритмии в такой степени нарушает гемодинамику и коронарный кровоток, что он может приводить к развитию миокардиальных некрозов, особенно при изначально дефектном коронарном кровообращении у больных со стенозирующим коронарным атеросклерозом. Следовательно, диагноз посттахикардиального синдрома достоверен после тщательного наблюдения за больным с учетом динамики клинических, ЭхоКГ-, лабораторных данных.
20. Синдром преждевременной реполяризации желудочков.
Синдром выражается в элевации интервала ST в вильсоновских отведениях, начинающегося с точки J, расположенной на нисходящем колене зубца R.
Этот синдром регистрируется у здоровых людей, спортсменов, больных с нейроциркуляторной дистонией.
Для постановки правильного диагноза надо знать о существовании ЭКГ-феномена — синдрома преждевременной реполяризации желудочков. При этом синдроме отсутствует клиника ИМ, не бывает свойственной ему динамика ЭКГ.
Примечание
При трактовке симптома «острая боль в эпигастрии» в сочетании с гипотензией при проведении дифференциального диагноза с ИМ надо иметь в виду и более редкие болезни: острую надпочечниковую недостаточность; разрыв печени, селезенки или полого органа при травме; сифилитическую сухотку спинного мозга с табетическими желудочными кризами (анизокория, птоз, рефлекторная неподвижность глазных яблок, атрофия зрительного нерва, атаксия, отсутствие коленных рефлексов); абдоминальные кризы при гипергликемии, кетоацидозе у больных с сахарным диабетом.
Осложнения
Группы осложнений инфаркта миокарда (ИМ):
1. Электрические — нарушения ритма и проводимости:
— брадитахиаритмии;
— экстрасистолии;
— внутрижелудочковые блокады;
— АВ-блокады.
Данные осложнения практически постоянно встречаются при крупноочаговом ИМ. Часто аритмии не являются угрожающими для жизни, но свидетельствуют о серьезных нарушениях (электролитных, продолжающейся ишемии, вагальной гиперактивности и др.), требующих коррекции.
2. Гемодинамические осложнения:
2.1 Вследствие нарушений насосной функции сердца:
— острая левожелудочковая недостаточность;
— острая правожелудочковая недостаточность;
— бивентрикулярная недостаточность;
— кардиогенный шок;
— аневризма желудочка;
— расширение инфаркта.
2.2 Вследствие дисфункции сосочковых мышц.
2.3 Вследствие механических нарушений:
— острая митральная регургитация вследствие разрыва сосочковых мышц;
— разрывы сердца, свободной стенки или межжелудочковой перегородки;
— аневризмы левого желудочка;
— отрывы сосочковых мышц.
2.4 Вследствие электромеханической диссоциации.
3. Реактивные и прочие осложнения:
— эпистенокардический перикардит;
— тромбоэмболии сосудов малого и большого круга кровообращения;
— ранняя постинфарктная стенокардия;
—
синдром Дресслера
.
По времени появления осложнения ИМ классифицируют на:
1. Ранние осложнения, возникающие в первые часы (нередко на этапе транспортировки больного в стационар) или в острейший период (3-4 дня):
— нарушения ритма и проводимости (90%), вплоть до фибрилляции желудочков и полной АВ-блокады (самые частые осложнения и причина летальности на догоспитальном этапе);
— внезапная остановка сердца;
— острая недостаточность насосной функции сердца — острая левожелудочковая недостаточность и кардиогенный шок (до 25%);
— разрывы сердца — наружные, внутренние; медленнотекущие, одномоментные (1-3%);
— острая дисфункция сосочковых мышц (митральная регургитация);
— ранний эпистенокардический перикардит.
2. Поздние осложнения (возникают на 2-3-й неделе, в период активного расширения режима):
— постинфарктный
синдром Дресслера
(3%);
— пристеночный тромбоэндокардит (до 20%);
— хроническая сердечная недостаточность;
— нейротрофические расстройства (плечевой синдром, синдром передней грудной стенки).
Как на ранних, так и на поздних стадиях течения ИМ могут возникать следующие осложнения:
— острая патология желудочно-кишечного тракта (острые язвы, желудочно-кишечный синдром, кровотечения и др.);
— психические изменения (депрессия, истерические реакции, психоз);
— аневризмы сердца (у 3-20% больных);
— тромбоэмболические осложнения: системные (вследствие пристеночного тромбоза) и ТЭЛА (из-за тромбоза глубоких вен голеней).
Тромбоэмболии клинически выявляются у 5-10% больных (на аутопсии — у 45%). Часто они имеют бессимптомное течение и являются причиной смерти у ряда госпитализированных больных с ИМ (до 20%).
У некоторых пожилых мужчин с доброкачественной гипертрофией предстательной железы развивается острая атония мочевого пузыря (снижается его тонус, нет позывов к мочеиспусканию) с увеличением объема пузыря до 2 л, задержкой мочеиспускания на фоне постельного режима и лечения наркотическими препаратами, атропином.
Лечение
Цели неотложной терапии инфаркта миокарда (ИМ):
— купирование болевого синдрома;
— восстановление коронарного кровотока;
— уменьшение работы сердца и потребности миокарда в кислороде;
— ограничение размеров ИМ;
— лечение и профилактика осложнений ИМ.
Купирование болевого приступа
Морфин — препарат выбора для купирования болевого синдрома при ИМ на догоспитальном этапе. Морфин обладает необходимыми эффектами и достаточной для транспортировки длительностью действия.
Препарат вводится внутривенно дробно: 1 мл 1% раствора разводят физиологическим раствором натрия хлорида до 20 мл (1 мл полученного раствора содержит 0,5 мг активного вещества) и вводят 2-5 мг каждые 5-15 минут до полного устранения болевого синдрома либо до появления побочных эффектов (гипотензии, угнетения дыхания, рвоты).
Суммарная доза не должна превышать 10-15 мг (1-1,5 мл 1% раствора) морфина (на догоспитальном этапе не допускается превышение дозы 20 мг).
При невыраженном болевом синдроме, пациентам старческого возраста и ослабленным больным наркотические анальгетики могут вводиться подкожно или внутримышечно. Не рекомендуется вводить подкожно более 60 мг морфина в течение 12 часов.
Для решения вопроса о возможности использования наркотических анальгетиков необходимо:
— убедиться, что типичный или атипичный болевой синдром не является проявлением “острого живота”, и изменения ЭКГ являются специфическим проявлением ИМ, а не неспецифической реакцией на катастрофу в брюшной полости;
— выяснить, имеются ли в анамнезе хронические заболевания системы дыхания (в частности — бронхиальная астма);
— уточнить, когда было последнее обострение бронхообструктивного синдрома;
— установить, имеются ли в настоящее время признаки дыхательной недостаточности, какие, какова степень ее выраженности;
— выяснить, имеется ли у больного в анамнезе судорожный синдром, когда был последний припадок.
Восстановление коронарного кровотока в острейшей фазе ИМ
Поскольку непосредственной причиной развития ИМ является окклюзия коронарной артерии, в основе лечения лежит восстановление коронарного кровотока — коронарная реперфузия путем системного тромболизиса.
Все больные ИМ должны быть безотлагательно обследованы для уточнения показаний и противопоказаний к восстановлению коронарного кровотока.
Показания к проведению тромболизиса:
1. Наличие подъема сегмента ST более чем на 1 mm по крайней мере в двух стандартных отведениях ЭКГ и более чем на 2 mm в двух смежных грудных отведениях.
2. Остро возникшая полная блокада левой ножки пучка Гиса при сроке, прошедшем с начала заболевания, более 30 минут, но не превышающем 12 часов.
Применение тромболитических средств возможно и позже, в случаях когда сохраняются подъем сегмента ST, продолжается боль и/или наблюдается нестабильная гемодинамика.
Абсолютные противопоказания к тромболитической терапии:
— ранее перенесенный геморрагический инсульт или нарушение мозгового кровообращения неизвестной этиологии;
— ишемический инсульт, перенесенный в течение последних 3 месяцев;
— опухоль мозга, первичная и метастазы;
— подозрение на расслоение аорты;
— наличие признаков кровотечения или геморрагического диатеза (за исключением менструации);
— существенные закрытые травмы головы в последние 3 месяца;
— изменение структуры мозговых сосудов, например,
артериовенозная мальформация
, артериальные
аневризмы
.
Относительные противопоказания к тромболитической терапии:
— устойчивая, высокая, плохо контролируемая
артериальная гипертензия
в анамнезе;
— наличие плохо контролируемой артериальной гипертензии (в момент госпитализации САД >180 мм рт.ст., ДАД >110 мм рт.ст.);
—
ишемический инсульт
давностью >3 месяцев;
— деменция или внутричерепная патология, не включенная в абсолютные противопоказания;
— травматичная или длительная (>10 минут), сердечно-легочная реанимация или обширное оперативное вмешательство, перенесенное в течение последних 3 недель;
— недавнее (в течение предыдущих 2-4 недель) внутреннее кровотечение;
— пункция сосуда, не поддающегося прижатию;
— противопоказание для стрептокиназы — введение стрептокиназы, в том числе модифицированной, более 5 суток назад или известная аллергия на нее;
— беременность;
— обострение язвенной болезни;
— прием антикоагулянтов непрямого действия (чем выше
МНО
, тем выше риск кровотечения).
Тромболитические препараты:
— стрептокиназа;
— рекомбинантный тканевой активатор плазминогена (алтеплаза) и его модификация — тенектеплаза;
— модифицированная (рекомбинантная) проурокиназа (пуролаза).
Наиболее часто используется стрептокиназа:
— введение препарата проводится только через периферические вены, попытки катетеризации центральных вен недопустимы;
— перед инфузией возможно внутривенное введение 5-6 мл 25% магния сульфата либо 10 мл кормагнезина-200 в/в струйно, медленно (за 5 минут);
— «нагрузочная» доза аспирина (250-300 мг — разжевать) дается всегда, за исключением случаев, когда аспирин противопоказан;
— 1 500 000 Ед стрептокиназы разводится в 100 мл изотонического раствора хлорида натрия и вводится внутривенно за 30 минут.
Клинические признаки восстановления коронарного кровотока:
— прекращение ангинозных приступов через 30-60 минут после введения тромболитика;
— стабилизация гемодинамики;
— исчезновение признаков левожелудочковой недостаточности;
— быстрая (в течение нескольких часов) динамика ЭКГ с приближением сегмента ST к изолинии и формированием патологического зубца Q, отрицательного зубца Т (возможно внезапное увеличение степени подъема сегмента ST с последующим его быстрым снижением);
— появление реперфузионных аритмий (ускоренного идиовентрикулярного ритма, желудочковой экстрасистолии и др.);
— быстрая динамика МВ-КФК (резкое повышение ее активности на 20-40%).
Показания к проведению антикоагулянтной терапии:
— отсутствие показаний к тромболитической терапии (поздние сроки, мелкоочаговый или не-Q-инфаркт);
— невозможность проведения тромболизиса по организационным причинам;
— отсрочка тромоболизиса до госпитального этапа;
— наличие противопоказаний к тромболизису, не являющихся противопоказанием к назначению гепарина.
При наличии показаний, гепарин вводится на догоспитальном этапе (линейной бригадой) внутривенно болюсно в дозе 10000-15000 МЕ. Если в условиях стационара не проводится тромболитическая терапия, то переходят на длительную внутривенную инфузию гепарина со скоростью 1000 МЕ/час под контролем активированного частичного тромбопластинового времени. Альтернативой может, по-видимому, служить подкожное введение низкомолекулярного гепарина в «лечебной» дозе.
Введение гепарина на догоспитальном этапе не служит препятствием к проведению тромболизиса в условиях стационара.
С первых минут ИМ всем больным, при отсутствии противопоказаний, показано назначение малых доз ацетилсалициловой кислоты (аспирина), антитромбоцитарный эффект которой достигает своего максимума уже через 30 минут и своевременное начало применения которой позволяет существенно снизить летальность.
Наибольший клинический эффект может быть получен при применении ацетилсалициловой кислоты перед проведением тромболизиса.
Доза для первого приема на догоспитальном этапе составляет 160-325 мг (разжевать).
В дальнейшем, на стационарном этапе, препарат назначается 1 раз в сутки по 100-125 мг.
Уменьшение работы сердца и потребности миокарда в кислороде. Показано полноценное обезболивание и применение следующих препаратов:
1. Вазодилататоры-нитраты.
Внутривенное введение нитратов при ОИМ не только помогает купировать болевой синдром, левожелудочковую недостаточность, артериальную гипертензию, но и уменьшает размеры некроза и летальность.
Нитраты вводят капельно под постоянным контролем артериального давления и частоты сердечных сокращений с начальной скоростью 5-10 мкг/мин. с последующим увеличением скорости на 20 мкг/мин. каждые 5 минут до достижения желаемого эффекта или максимальной скорости введения — 400 мкг/мин. Обычно эффект достигается при скорости 50-100 мкг/мин.
При отсутствии дозатора, приготовленный раствор, содержащий в 1 мл 100 мкг нитрата, вводят при тщательном контроле с начальной скоростью 6-8 капель в минуту, которая при условии стабильной гемодинамики и сохранения болевого синдрома может быть постепенно увеличена вплоть до максимальной скорости — 30 капель в минуту.
Продолжительность внутривенного введения нитратов — 24 часа и более; за 2-3 часа до окончания инфузии дается первая доза нитратов перорально.
Передозировка нитратов, вызывающая падение сердечного выброса и снижение систолического артериального давления ниже 80 мм рт. ст., может приводить к ухудшению коронарной перфузии и к увеличению размеров ИМ.
2. Бета-адреноблокаторы.
Внутривенное введение бета-адреноблокаторов, как и применение нитратов, способствует купированию болевого синдрома. Ослабляя симпатические влияния на сердце, они способствуют уменьшению размеров ИМ, подавляют желудочковые аритмии, уменьшают риск разрыва миокарда и повышают таким образом выживаемость пациентов.
При отсутствии противопоказаний бета-адреноблокаторы назначаются всем больным ОИМ.
В первые 2-4 часа заболевания показано дробное внутривенное введение пропранолола (обзидана) по 1 мг в минуту каждые 3-5 минут под контролем артериального давления, частоты сердечных сокращений и ЭКГ до достижения частоты сердечных сокращений 55-60 уд./мин. или до общей дозы 10 мг.
При наличии брадикардии, признаков сердечной недостаточности, АВ-блокакды и снижении систолического артериального давления менее 100 мм рт. ст. пропранолол не назначается; при развитии указанных изменений на фоне применения препарата, его введение прекращается.
Ограничение размеров ИМ
Необходимо адекватное обезболивание, восстановление коронарного кровотока, уменьшение работы сердца и потребности миокарда в кислороде.
Этой же цели служит оксигенотерапия, показанная при ОИМ всем больным в связи с частым развитием
гипоксемии
даже при неосложненном течении заболевания.
Ингаляция увлажненного кислорода, проводящаяся, если это не причиняет чрезмерных неудобств, с помощью маски или через носовой катетер со скоростью 4-6 л/мин., целесообразна в течение первых 24-48 часов заболевания (начинается на догоспитальном этапе и продолжается в стационаре).
Лечение и профилактика осложнений ИМ
Проводятся дифференцированно в зависимости от варианта осложнений (отек легких, кардиогеннй шок, нарушения сердечного ритма и проводимости, а также затянувшийся или рецидивирующий болевой приступ).
Основные хирургические методы лечения ИМ (вопрос о выборе метода всегда решается индивидуально)
1. Аортокоронарное шунтирование (АКШ).
2. Внутрисосудистая операция (баллонная ангиопластика, стентирование).
Коронарная ангиопластика является инвазивным способом лечения ишемической болезни сердца, который направлен на восстановление суженного просвета коронарной артерии различными механическими устройствами, доставляемыми путем чрескожной пункции и катетеризации артериального русла.
Устройства и инструменты для коронарной ангиопластики:
— баллонные катетеры для проведения баллонной ангиопластики;
— атерэктомические катетеры;
— ротаблаторы для проведения мелкодисперсной ротационной абляции;
— лазер-баллоны для лазерной абляции;
— стенты для эндопротезирования коронарных артерий.
Основной метод коронарной ангиопластики — баллонная ангиопластика. Остальные методы имеют ограниченное применение по специальным показаниям.
При баллонной ангиопластике баллонный катетер проводится по артериальной системе к коронарным сосудам. Баллон устанавливается в место сужения коронарной артерии и раздувается под давлением, восстанавливая просвет сосуда.
Абсолютные противопоказания для коронарной ангиопластики:
— локализация стеноза в главном стволе левой коронарной артерии;
— наличие стеноза в коронарной артерии, снабжающей весь оставшийся живой миокард;
— отказ больного от лечения.
Относительные противопоказания:
— тяжелая дисфункция левого желудочка;
— многососудистое окклюзирующее поражение со сложным коллатеральным снабжением миокарда, сопоставимое со стволовым стенозом;
— сложное с точки зрения морфологии поражение коронарной артерии, снабжающей значительный объем миокарда;
— невозможность достичь полной или почти полной
реваскуляризации
;
— нестабильное / неконтролируемое системное или метаболическое нарушение (например, почечная недостаточность, недавний инсульт, желудочно-кишечное кровотечение, лихорадка вследствие инфекции, неконтролируемая гипертензия, тяжелые электролитные нарушения, анафилаксия).
Стентирование, как доминирующая методика эндоваскулярного лечения, является наиболее эффективным и безопасным методом лечения ОИМ. Коронарная ангиопластика со стентированием позволяет воздействовать не только на тромб, но и на атеросклеротическую бляшку, суживающую просвет венечной артерии.
Именно стентирование способно восстанавливать исходную нативную анатомию коронарной артерии, в отличие от консервативной терапии и открытой хирургии.
Показанием к выполнению стентирования у больных с ОИМ является ИМ в ходу с признаками продолжающейся ишемии в области клинико-зависимой артерии при наличии ангиографических критериев возможности выполнения процедуры.
Определяющим фактором сохранения функционального состояния миокарда и снижения летальности у пациентов с ОИМ является время от начала ангинозного приступа до начала процедуры стентирования. Для улучшения непосредственных и отдаленных результатов стентирования необходимо сокращение до минимума временного интервала, с помощью экстренной госпитализации больных с ОИМ в специализированную клинику с наличием рентгеноперационной.
Показания к проведению коронарной ангиопластики постоянно расширяются. Основной стратегический принцип — максимально отсрочить необходимость проведения АКШ.
Поскольку коронарная ангиопластика может осложниться возникновением ситуаций, требующих срочного проведения хирургической операции, то если больной отказывается от АКШ, даже если выявленные сужения дилатируемы, коронарная ангиопластика не проводится.
При ОИМ коронарная ангиопластика (КА) или АКШ проводятся при неэффективности тромболитической терапии. Предпочтение следует отдавать проведению КА. АКШ проводится только при наличии прямых противопоказаний для КА.
При выполнении КА сразу после системного тромболизиса, ее называют немедленной, а через 1-7 суток — поздней.
Проведение немедленной КА сопряжено с высоким риском осложнений. Поэтому, если это возможно, предпочтительно ее выполнение после 4-7-дневной антикоагулянтной и антиагрегантной терапии.
Целью поздней коронарной ангиопластики является устранение остаточного стеноза, профилактика реокклюзии, ускорение восстановления функции левого желудочка. При этом существенно снижается риск формирования аневризмы сердца и летальности больных ОИМ.
Аортокоронарное шунтирование — это кардиохирургическая операция, при которой создается новый путь для кровотока в обход пораженной артерии. Для этого накладывается шунт между аортой и участком артерии после сужения. В качестве шунта применяются: большая подкожная вена, внутренняя грудная артерия, лучевая артерия, синтетический протез.
Доступ к сердцу осуществляется через разрез грудной клетки, чаще — через грудину. Еще один разрез выполняется в месте, где берут шунт. После АКШ требуется достаточно длительный период реабилитации, в течение которого заживают раны и срастается грудина.
Показания к проведению АКШ в остром периоде ИМ:
— неэффективность первичной коронароангиопластики;
— окклюзия сосуда или эндопротеза после эндоваскулярных вмешательств;
— кардиогенный шок;
— наружные и внутренние разрывы сердца.
Прогноз
Около 15-20% больных ИМ погибают на догоспитальном этапе, еще 15% — в больнице.
Общая летальность при ИМ составляет 30-35%.
Большая часть больничной летальности приходится на первые двое суток, поэтому основные лечебные мероприятия проводят именно в этот период.
Контролируемые испытания показали, что восстановление перфузии в течение первых 4-6 часов ИМ способствует ограничению его размеров, улучшению локальной и общей сократимости левого желудочка, снижению частоты больничных осложнений (сердечной недостаточности,
ТЭЛА
, аритмий) и летальности. Восстановление перфузии в течение первых 1-2 часов ИМ особенно благоприятно.
Позднее восстановление перфузии также сопровождается увеличением выживаемости, что связывают с улучшением заживления миокарда и уменьшением частоты аритмий (но не ограничением размеров инфаркта).
Госпитализация
Всем больным показана экстренная госпитализация.
Профилактика
Профилактические мероприятия в острой фазе ИМ
Важнейшее профилактическое значение с первых минут от начала инфаркта имеет антитромбоцитарная и антикоагулянтная терапия. Также целесообразно применение таких препаратов, как β-блокаторы, ингибиторы АПФ, нитраты, блокаторы кальциевых каналов, глюкозо-инсулино-калиевая смесь (ГИК) и др.
Вопрос о необходимости раннего, в том числе внутривенного, назначения бета-блокаторов в острой фазе остается открытым. В настоящее время рекомендуется дождаться стабилизации состояния больного и только после этого назначить бета-блокаторы обычным способом, перорально.
Не обнаружено существенных преимуществ раннего назначения нитратов, поэтому они не рекомендованы для рутинного использования, хотя возможность их применения у отдельных пациентов с продолжающейся ишемией миокарда не исключается.
Не рекомендованы для рутинного использования (без специальных показаний) также блокаторы кальциевых каналов, сульфат магния, ГИК , лидокаин.
Напротив, ингибиторы АПФ, назначаемые с первого дня ИМ, не намного, но достоверно уменьшают раннюю летальность больных. Поэтому в руководстве ESC рекомендуется начать прием ингибиторов АПФ в первые 24 часа от начала инфаркта, если нет противопоказаний.
Вторичная профилактика – общие принципы
Около 8-10% пациентов, выживших после ИМ, в течение года после выписки из стационара переживают повторный инфаркт. Летальность постинфарктных больных гораздо выше, чем смертность в общей популяции. На сегодняшний день известен ряд профилактических мероприятий, оказывающих достоверное благоприятное влияние на прогноз и уровень выживаемости таких пациентов.
1. Всем пациентам, перенесшим инфаркт, настоятельно рекомендуется отказаться от курения. Для медикаментозной поддержки больного, который бросает курить, могут использоваться бупропион и никотинсодержащие препараты, антидепрессанты.
2. Показана достаточная и регулярная физическая активность – аэробная нагрузка умеренной интенсивности как минимум 5 раз в неделю. Для больных высокого риска рекомендованы специальные реабилитационные программы с наблюдением медработников.
3. Если индекс массы тела ≥30 кг/м2 либо окружность талии превышает 102 см у мужчин или 88 см у женщин, необходимо снижение веса. Питание постинфарктных больных должно включать регулярное употребление фруктов, овощей, рыбы, отличаться низким содержанием соли и насыщенных жиров. Целесообразным может быть увеличение потребления омега-3-полиненасыщенных жирных кислот; с этой целью можно включать в рацион жирные сорта рыбы или же принимать рыбий жир. Не следует запрещать пациенту употреблять алкоголь в умеренных количествах.
4. Если у больного имеется сахарный диабет, необходимы соответствующие мероприятия по модификации образа жизни, контролю факторов риска (артериальной гипертензии, ожирения,
дислипидемии
) и сахароснижающая фармакотерапия для поддержания уровня гликозилированного гемоглобина <6,5%.
5. В случае артериальной гипертензии необходимы мероприятия по модификации образа жизни и фармакологическая терапия для поддержания уровня АД <130/80 мм рт. ст. .
Всем пациентам, перенесшим ИМ, при отсутствии противопоказаний как можно раньше следует назначить:
1. Антитромбоцитарную и/или антикоагулянтную терапию:
— АСК 75-100 мг/сут. постоянно;
— клопидогрель 75 мг/сут. в течение 12 месяцев в дополнение к АСК независимо от стратегии лечения (IIa, C) или постоянно вместо АСК, если прием АСК противопоказан;
— если противопоказаны и АСК, и клопидогрель, рекомендованы пероральные антикоагулянты (с удержанием МНО в рамках 2-3);
— пероральные антикоагулянты (с удержанием рекомендованного МНО) специально показаны в ряде клинических ситуаций (наличие мерцательной аритмии, тромба в полости левого желудочка, механических протезов клапанов сердца);
— в случае высокого риска тромбоэмболических событий, пероральные антикоагулянты можно принимать в комбинации с низкими дозами АСК, клопидогрелем или двойной антитромбоцитарной терапией (АСК + клопидогрель).
2. β-блокаторы (независимо от уровня АД или состояния функции левого желудочка).
3. Ингибиторы АПФ (независимо от уровня АД или состояния функции левого желудочка); при непереносимости – блокаторов рецепторов ангиотензина-II.
4. Гиполипидемическую терапию:
— статины рекомендованы у всех пациентов для достижения уровня холестерина липопротеинов низкой плотности (ЛПНП) < 100 мг/дл (2,5 ммоль/л) (I, A), у пациентов высокого риска следует рассмотреть целесообразность снижения этого показателя до еще более низкого целевого уровня – < 80 мг/дл (2,0 ммоль/л);
— если уровень триглицеридов превышает 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина липопротеинов высокой плотности (ЛПВП) < 40 мг/дл (1,0 ммоль/л), рекомендуются соответствующие мероприятия по модификации образа жизни;
— у пациентов, которые не переносят статины, могут использоваться фибраты и препараты омега-3-полиненасыщенных жирных кислот, особенно если уровень триглицеридов > 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина ЛПВП < 40 мг/дл (1,0 ммоль/л).
5. Прививки против гриппа (I, B).
Для уменьшения риска внезапной сердечной смерти у больных с фракцией выброса ≤ 30-40% и СН ≥ II класса по NYHA (или III класса на протяжении по крайней мере 40 суток после ИМ) показана имплантация кардиовертера-дефибриллятора. Следует рассмотреть целесообразность такой тактики и у пациентов с фракцией выброса ≤ 30-35% и СН I класса по NYHA на протяжении, по крайней мере, 40 суток после ИМ.
Информация
Источники и литература
-
ACC/AHA Guideline Update for the Management of Patients With Unstable Angina and Non–ST-Segment Elevation Myocardial Infarction, 2002
-
ACC/AHA Guidelines for the Management of Patients With Unstable Angina /Non–ST-Elevation Myocardial Infarction, 2007
-
ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction, 2013
-
Алперт Дж., Френсис Г. Лечение инфаркта миокарда, М.: Практика, 1994
- стр. 255
-
Бабунашвили А.М., Рабкин И.X., Иванов В.А. Коронарная ангиопластика,М.: АСВ, 1996
- стр. 352
-
Байес де Луна А., Фиол-Сала М., Антман Э.М. ЭКГ при инфаркте миокарда с подъемом ST, СПб: Медицинская литература, 2009
-
Болезни сердца и сосудов. Руководство для врачей в 4 томах, под ред. Чазова Е.И., М.: Медицина, 1992
- «Хирургическое лечение ишемической болезни сердца и инфаркта миокарда» Акчурин Р. С. —
-
Гриффин Б.,Тополь Э. Кардиология (Manual of Cardiovascular Medicine), М.: Практика, 2008
-
Гурвич М.М. Заболевания сердца и сосудов. Лечебное питание, СПб:Эксмо, 2008
-
Кузьменко А.Т., Камышников В.С. Лабораторная диагностика острого инфаркта миокарда, СПб: Адукацыя i выхаванне, 2009
-
Лайбольд Г. Здоровое сердце и сосуды. Лечение и профилактика заболеваний сердечно-сосудистой системы, СПб: АСТ, Астрель, ВКТ, 2008
-
Люсов В.А., Волов Н.А., Гордеев И.Г. Инфаркт миокарда, СПб: Литтерра, 2010
-
Малышева И.С. Инфаркт. Профилактика и лечение, М.:Вектор, 2008
-
Сыркин А.Л. Инфаркт миокарда, СПб: Медицинское информационное агентство, 2006
-
Филатова М. «Жизнь после инфаркта», СПб: АСТ, Сова, 2007
-
Хубутия М.Ш., Газарян Г.А., Захаров И.В. Реперфузионная терапия в остром периоде инфаркта миокарда, СПб: ГЭОТАР-Медиа, 2010
-
Шилов А.М. Инфаркт миокарда, М.:Миклош, 2009
-
Якушин С.С. Инфаркт миокарда. Руководство, СПб: ГЭОТАР-Медиа, 2010
-
«Force on Practice Guidelines (Committee on the Management of Patients with Unstable Angina) 2002», «Journal of the American College of Cardiology» №40, 2002
-
«Myocardial infarction redefined — a consensus document of The Joint European Society of Cardiology/American College of Cardiology committee for the redefinition of myocardial infarction», «Journal of the American College of Cardiology», №36(3), 2000
-
«Дальнейшие шаги в исследовании сердечной недостаточности» Бураковский В.И., Работников В.С., Казаков Э.Н., «Грудная и сердечно-сосудистая хирургия», №7, 1991
-
«Коронарное русло, гемодинамика и сократительная функция миокарда у больных ИБС с постинфарктным кардиосклерозом в аспекте хирургического лечения» Алекян Б.Г.,автореф. дис. канд. мед. наук., М., 1980
-
«Ранние и одногодичные результаты коронарного шунтирования: связь с дислипопротеидемией» Агапов А.А., Власова Э.Е., Акчурин Р.С. и др., журнал «Кардиология», №12, 1996
-
«Факторы риска коронарного шунтирования при нестабильной стенокардии» Агапов А.А., Тарасова Л.В., Ширяев А.А., Акчурин Р.С., журнал «Кардиология», №11, 1996
Информация
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.

Клинические рекомендации
МКБ 10: I21.0, I21.1, I21.2, I21.3, I21.9, I22.0, I22.1, I22.8, I22.9, I24.0, I24.8
Год утверждения (частота пересмотра): 2020
ID: КР157/1
URL
Профессиональные ассоциации
-
Российское кардиологическое общество При участии:
-
Ассоциации сердечно-сосудистых хирургов России.
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АБ — атеросклеротическая бляшка
АВС — активированное время свертывания крови
AГ — артериальная гипертензия
АД — артериальное давление
АДФ — аденозиндифосфат
АПФ — ангиотензинпревращающий фермент
АСК — ацетилсалициловая кислота
АЧТВ — активированное частичное тромбопластиновое время
БСК — болезни системы кровообращения
БРА — блокатор рецепторов к ангиотензину
ГПР IIb/IIIa — гликопротеиновые рецепторы IIb/IIIa тромбоцитов
ДАТТ — двойная антитромбоцитарная терапии
ЖТ — желудочковая тахикардия
ИАПФ — ингибитор ангиотензинпревращающего фермента
ИБС — ишемическая болезнь сердца
ИВЛ — искусственная вентиляция легких
ИМ — инфаркт миокарда
ИМбпST — инфаркт миокарда без подъема сегмента
ST ИМпST — инфаркт миокарда с подъемом сегмента
ST ИМТ — индекс массы тела
КА — коронарная артерия
КГ — коронарография
КР — кардиореабилитация
КШ — коронарное шунтирование (операция)
ЛЖ — левый желудочек
ЛНП — липопротеиды низкой плотности
ЛНПГ — левая ножка пучка Гиса
МНО — международное нормализованное отношение
НМГ — низкомолекулярный гепарин
НФГ — нефракционированный гепарин (гепарин
натрия)
ОАК — пероральные антикогулянты
ОКС — острый коронарный синдром
ОКСбпST — острый коронарный синдром без подъема сегмента ST на ЭКГ
ОКСпST — острый коронарный синдром с подъемом сегмента ST на ЭКГ
ПОАК — прямые пероральные антикоагулянты (апиксабан** , дабигатрана этексилат** ,
ривароксабан** )
РФ — Российская Федерация
СВ — сердечный выброс
СБЛП — стент для коронарных артерий
металлический непокрытый** (коронарный стент без лекарственного покрытия (голометаллический))
СВЛ — коронарный стент, выделяющий
лекарственный препарат/стент с лекарственным покрытием ***
СД — сахарный диабет
рСКФ — расчетная скорость клубочковой фильтрации
СН — сердечная недостаточность
ТИА — транзиторная ишемическая атака
ТГВ — тромбоз глубоких вен
ТЭЛА — тромбоэмболия легочных артерий
УДД — уровень достоверности доказательств
УУР — уровень убедительности рекомендаций
ФВ — фракция выброса
ФЖ — фибрилляция желудочков
ФК — функциональный класс
ФП — фибрилляция предсердий
ФР — фактор риска
ХБП — хроническая болезнь почек
ХС — холестерин
ХСН — хроническая сердечная недостаточность
ЧКВ — чрескожное коронарное вмешательство
ЭКГ — электрокардиография (электрокардиограмма)
ЭКС — электрокардиостимулятор
ЭхоКГ — эхокардиография
Термины и определения
Стент без лекарственного покрытия — стент, представляющий собой
металлический каркас из биологически инертного материала.
Доказательная медицина — надлежащее, последовательное и осмысленное
использование современных наилучших доказательств (результатов
клинических исследований) в процессе принятия решений о состоянии
здоровья и лечении пациента.
Заболевание — возникающее в связи с воздействием патогенных факторов
нарушение деятельности организма, работоспособности, способности
адаптироваться к изменяющимся условиям внешней и внутренней среды при
одновременном изменении защитно-компенсаторных и
защитно-приспособительных реакций и механизмов организма [1].
Инструментальная диагностика — диагностика с использованием для
обследования пациента различных приборов, аппаратов и инструментов.
Инфаркт миокарда со стойкими подъемами сегмента ST на ЭКГ (ИМпST) —
инфаркт миокарда, при котором в ранние сроки заболевания как минимум в
двух смежных отведениях ЭКГ фиксируются стойкие (длительностью более 20
минут) подъемы сегмента ST.
Инфаркт миокарда без стойких подъемов сегмента ST на ЭКГ (ИМбпST) —
инфаркт миокарда, при котором в ранние сроки заболевания как минимум в
двух смежных отведениях ЭКГ отсутствуют стойкие (длительностью более 20
минут) подъемы сегмента ST.
Исход — любой возможный результат, возникающий от воздействия
причинного фактора, профилактического или терапевтического
вмешательства, все установленные изменения состояния здоровья,
возникающие как следствие вмешательства.
Конфликт интересов — ситуация, при которой у медицинского или
фармацевтического работника при осуществлении ими профессиональной
деятельности возникает личная заинтересованность в получении лично либо
через представителя компании материальной выгоды или иного преимущества,
которое влияет или может повлиять на надлежащее исполнение ими
профессиональных обязанностей вследствие противоречия между личной
заинтересованностью медицинского работника или фармацевтического
работника и интересами пациента [1].
Клиническое исследование — любое исследование, проводимое с участием
человека в качестве субъекта для выявления или подтверждения клинических
и/или фармакологических эффектов исследуемых продуктов, и/или выявления
нежелательных реакций на исследуемые продукты, и/или изучения их
всасывания, распределения, метаболизма и выведения с целью оценить их
безопасность и/или эффективность. Термины «клиническое испытание» и
«клиническое исследование» являются синонимами [2].
Лабораторная диагностика — совокупность методов, направленных на
анализ исследуемого материала с помощью различного специализированного
оборудования.
Лекарственные препараты — лекарственные средства в виде лекарственных
форм, применяемые для профилактики, диагностики, лечения заболевания,
реабилитации, для сохранения, предотвращения или прерывания беременности
[3].
Медицинское вмешательство — выполняемые медицинским работником и иным
работником, имеющим право на осуществление медицинской деятельности, по
отношению к пациенту, затрагивающие физическое или психическое состояние
человека и имеющие профилактическую, диагностическую, лечебную,
реабилитационную или исследовательскую направленность виды медицинских
обследований и (или) медицинских манипуляций, а также искусственное
прерывание беременности [1].
Медицинский работник — физическое лицо, которое имеет медицинское или
иное образование, работает в медицинской организации и в трудовые
(должностные) обязанности которого входит осуществление медицинской
деятельности, либо физическое
лицо, которое является индивидуальным предпринимателем, непосредственно
осуществляющим медицинскую деятельность [1].
Нестабильная стенокардия — недавно возникшая или утяжелившаяся
стенокардия, когда тяжесть и продолжительность ишемии недостаточны для
развития некроза кардиомиоцитов.
Острое повреждение (некроз) миокарда — гибель кардиомиоцитов,
приведшая к повышению и/или снижению содержания в крови биомаркеров
некроза миокарда, которое как минимум однократно превышает 99-й
перцентиль значений у здоровых лиц.
Острый инфаркт миокарда (ОИМ) — острое повреждение (некроз) миокарда
вследствие ишемии, подтвержденное характерной динамикой уровня
биомаркеров в крови.
Острый коронарный синдром (ОКС) — термин, обозначающий любую группу
клинических признаков или симптомов, позволяющих подозревать острый
инфаркт миокарда или нестабильную стенокардию.
Острый коронарный синдром без стойких подъемов сегмента ST на ЭКГ (ОКСбпST) — недавно возникшие клинические признаки или симптомы ишемии
миокарда, когда как минимум в двух смежных отведениях ЭКГ отсутствуют
стойкие (длительностью более 20 минут) подъемы сегмента ST.
Острый коронарный синдром со стойкими подъемами сегмента ST на ЭКГ (ОКСпST) — недавно возникшие клинические признаки или симптомы ишемии
миокарда в сочетании с наличием стойких (длительностью более 20 минут)
подъемов сегмента ST как минимум в двух смежных отведениях ЭКГ.
Операция коронарного шунтирования — наложение обходного анастомоза,
позволяющего улучшить кровоток дистальнее гемодинамически значимого
стеноза в коронарной артерии. В зависимости от методики включает
аортокоронарное, маммаро-коронарное и другие виды шунтирования.
Пациент — физическое лицо, которому оказывается медицинская помощь или
которое обратилось за оказанием медицинской помощи, независимо от
наличия у него заболевания и от его состояния [1].
Первичное чрескожное коронарное вмешательство — способ реперфузионного
лечения острого коронарного синдрома со стойкими подъемами сегмента ST
на ЭКГ, когда первым мероприятием по восстановлению проходимости
коронарной артерии является чрескожное коронарное вмешательство. (а не
тромболитическая терапия)
Первый медицинский контакт — время первичного осмотра пациента врачом,
фельдшером, медицинской сестрой или сотрудниками бригады скорой помощи,
которые регистрируют ЭКГ (и имеют результаты ее интерпретации), могут
выполнить первичные манипуляции (например, дефибрилляцию сердца). Первый
медицинский контакт может состояться как на догоспитальном этапе, так и
при поступлении пациента в медицинское учреждение (например, в приемное
отделение).
Постинфарктная стенокардия — стенокардия, возникшая в первые 2 недели
после инфаркта миокарда.
Рабочая группа по разработке/актуализации клинических рекомендаций —
коллектив специалистов, работающих совместно и согласованно в целях
разработки/актуализации клинических рекомендаций, и несущих общую
ответственность за результаты данной работы.
Симптом (от греч. symptomos — признак, совпадение) – это признак
какого-либо заболевания, статистически значимое отклонение того или
иного показателя от границ его нормальных величин или возникновение
качественно нового, не свойственного здоровому организму явления.
Синдром — устойчивая совокупность ряда симптомов с единым патогенезом.
Состояние — изменения организма, возникающие в связи с воздействием
патогенных и (или) физиологических факторов и требующие оказания
медицинской помощи [1].
«Спасительное» («спасающее») чрескожное коронарное вмешательство —
срочное чрескожное коронарное вмешательство после неуспешной
тромболитической терапии.
Стент, выделяющий лекарство — стент, из структур которого выделается
антипролиферативное вещество, препятствующее образованию неоинтимы и за
счет этого способствующее замедлению повторного стенозирования.
Тезис-рекомендация — положение, отражающее порядок и правильность
выполнения того или иного медицинского вмешательства, имеющего
доказанную эффективность и безопасность.
Тромболитическая терапия — способ реперфузионного лечения острого
коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, когда для
восстановления проходимости окклюзированной коронарной артерии
парентерально, как правило внутривенно, вводится лекарство, создающее
условия для растворения тромба (тромболитик).
Уровень достоверности доказательств (УДД) — степень уверенности в том,
что найденный эффект от применения медицинского вмешательства является
истинным [4].
Уровень убедительности рекомендаций (УУР) — степень уверенности в
достоверности эффекта вмешательства и в том, что следование
рекомендациям принесет больше пользы, чем вреда в конкретной ситуации
[4].
Фармако-инвазивный подход — способ реперфузионного лечения острого
коронарного синдрома со стойкими подъемами сегмента ST на ЭКГ, когда в
первые сутки после тромболитической терапии выполняется коронарная
ангиография и при необходимости ЧКВ (неотложно при неуспешной
тромболитической терапии, срочно при рецидиве ишемии или через 3–24 часа
от начала тромболизиса при наличии признаков реперфузии миокарда).
Хирургическое лечение — метод лечения заболеваний путем разъединения и
соединения тканей в ходе хирургической операции.
Чрескожное коронарное вмешательство — восстановление кровотока в окклюзированном
или стенозированном участке коронарной артерии с использованием
чрескожного введения необходимых для этого устройств. Включает
реканализацию, транслюминальную баллонную ангиопластику, коронарное
стентирование*** и другие, менее распространенные методики. У отдельных
больных – эндоваскулярную аспирационную тромбэктомию. Как правило, если
больных – эндоваскулярную аспирационную тромбэктомию. Как правило, если
не указано иное, под чрескожным коронарным вмешательством подразумевают
коронарное стентирование***.
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острый коронарный синдром (ОКС) — термин, обозначающий любую группу
клинических признаков или симптомов, позволяющих подозревать острый
инфаркт миокарда (ИМ) или нестабильную стенокардию (НС). Термин «ОКС»
используется, когда диагностической информации еще недостаточно для
окончательного суждения о наличии или отсутствии очагов некроза в
миокарде и, следовательно, представляет собой предварительный диагноз в
первые часы и сутки заболевания, в то время как термины «ИМ» и
«нестабильная стенокардия» используются при формулировании
окончательного диагноза. Соответственно, термин «ОКС» может
использоваться на догоспитальном или раннем госпитальном этапах и в
дальнейшем трансформируется в диагноз «острый ИМ», «НС» либо, по
результатам дифференциальной диагностики, — в любой другой диагноз, в
том числе не кардиологический.
ОКС может быть как проявлением дестабилизации хронического течения ИБС,
так и первым признаком поражения коронарного русла у пациентов, не
предъявлявших ранее каких-либо жалоб.
Острый инфаркт миокарда (ОИМ) — острое повреждение (некроз) миокарда
вследствие ишемии. Для диагностики ОИМ, не связанного с ЧКВ или
операцией коронарного шунтирования, следует документировать повышение
и/или снижение содержания в крови биомаркеров некроза миокарда
(обязательно — сердечного тропонина), которое как минимум однократно
должно превышать 99-й перцентиль значений у здоровых лиц.
Критерии острой ишемии миокарда для диагностики ОИМ (достаточно наличия
хотя бы одного):
-
симптомы ишемии миокарда;
-
остро возникшие (или предположительно остро возникшие) ишемические
изменения ЭКГ; -
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков
миокарда с потерей жизнеспособности или нарушением локальной
сократимости в виде изменений, характерных для ишемической этиологии; -
выявление внутрикоронарного тромбоза при коронарной ангиографии или на
аутопсии. Подробнее критерии инфаркта миокарда представлены в Приложение Г
[5].
Изменения на ЭКГ, характерные для ишемии миокарда:
-
Остро возникшие подъемы сегмента ST на уровне точки J как минимум в двух
смежных отведениях ЭКГ, ≥0,1 мВ во всех отведениях, за исключением
отведений V2–V3, где элевация сегмента ST должна составлять ≥0,2 мВ у
мужчин в возрасте 40 лет и старше, ≥0,25 мВ у мужчин моложе 40 лет или
0,15 ≥мВ у женщин (при отсутствии гипертрофии левого желудочка или
БЛНПГ). -
Остро возникшие подъемы сегмента ST на уровне точки J ≥0,1 мВ в
отведениях V2–V3 в сравнении с ранее зарегистрированной ЭКГ (при
отсутствии гипертрофии левого желудочка или БЛНПГ). -
Остро возникшие горизонтальные или косонисходяшие снижения сегмента ST
≥0,05 как минимум в двух смежных отведениях ЭКГ и/или инверсии зубца Т
>0,1 мВ как минимум в двух смежных отведениях ЭКГ с доминирующим зубцом
R или соотношением амплитуды зубцов R/S >1 [5].
Инфаркт миокарда со стойкими подъемами сегмента ST на ЭКГ (ИМпST) —
инфаркт миокарда, при котором в ранние сроки заболевания имеют место
стойкие (длительностью более 20 минут) подъемы сегмента ST как минимум в
двух смежных отведениях ЭКГ. К этой категории также относят пациентов с
остро возникшей блокадой левой ножки пучка Гиса (ЛНПГ).
Подразумевается, что в абсолютном большинстве случаев подобные изменения
ЭКГ вызваны трансмуральной ишемией миокарда, обусловленной полной острой
окклюзией крупной ветви КА. В результате такой ишемии при ее
естественном течении (без патогенетического лечения) происходит некроз
достаточно большого участка сердечной мышцы, как правило,
трансмуральный. Наличие такого некроза сопряжено с очень высоким риском
смерти от фатальных нарушений ритма и проводимости сердца, разрыва
миокарда и острой сердечной недостаточности.
Постинфарктная стенокардия — стенокардия, возникшая в первые 2 недели
после инфаркта миокарда.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ИМ, как правило, является следствием тромбоза крупной ветви КА. Тромб
возникает чаще всего на месте разрыва так называемой уязвимой
(нестабильной) атеросклеротической бляшки (АБ) с большим липидным ядром,
богатой воспалительными элементами и истонченной покрышкой, однако
возможно образование окклюзирующего тромба и на дефекте эндотелия
(эрозии) КА, не обязательно локализованном на поверхности АБ. Нередко
окклюзия развивается в месте гемодинамически незначимого стеноза КА. В
отличие от ОКСбпST, основу патогенеза которого составляет
неокклюзирующий пристеночный тромбоз, при ИМпST почти всегда имеется
стойкая и полная тромботическая окклюзия крупной эпикардиальной ветви
КА, вызывающая трансмуральную ишемию миокарда.
В КА пациентов с ИМ нередко находят несколько уязвимых АБ, в том числе с
нарушенной целостностью их поверхностных структур. Из-за высокого риска
возникновения повторных окклюзий КА у таких пациентов локальные
воздействия на уровне конкретной АБ, обусловившей развитие клинической
картины ИМ, требуется сочетать с системными лечебными мероприятиями,
направленными на снижение вероятности повреждения других АБ и тромбоза.
Тромб, расположенный на поверхности и даже в структурах АБ, может быть
источником эмболий в дистальное сосудистое русло сердца. Эмболизация
микрососудов миокарда сама по себе может приводить к образованию мелких
очагов некроза и/или способствовать расширению основного участка
некроза. Кроме того, в случае устранения окклюзии крупной ветви КА,
мелкие тромбоэмболы могут нарушать движение крови на уровне
микроциркуляции, препятствуя полноценному восстановлению кровоснабжения
миокарда (реперфузии).
Ишемию миокарда могут спровоцировать или утяжелить анемия, гипоксемия,
воспаление, инфекция, лихорадка, а также метаболические или эндокринные
расстройства (в частности, гипертиреоз). Спазм, диссекция и тромбоз КА
наряду с тахикардией и повышением АД могут возникнуть при применении
кокаина и некоторых других препаратов.
У большинства пациентов с ИМпST, даже при использовании своевременного
лечения, развивается некроз миокарда различных размеров. Количество
погибающего и погибшего миокарда почти линейно связано с угрозой
остановки кровообращения, вызванной асистолией сердца или фатальными
желудочковыми аритмиям, прежде всего — фибрилляцией желудочков. Размер и
трансмуральность некроза определяют риск развития другого потенциально
фатального осложнения ИМ — разрыва миокарда. Следствием потери
существенной части активного миокарда является процесс ремоделирования
сердца. Образование очагов некроза в миокарде сопровождается изменением
размера, формы и толщины стенки левого желудочка (ЛЖ), а сохранившийся
миокард испытывает повышенную нагрузку и подвергается гипертрофии.
Насосная функция изменившего форму ЛЖ ухудшается, что ведет к появлению
сердечной недостаточности (СН). Наихудшим проявлением ремоделирования ЛЖ
при ИМ считается формирование аневризмы ЛЖ, почти всегда — с явной СН,
иногда — с образованием тромба в полости аневризмы с серьезной угрозой
эмболий в сосуды большого круга кровообращения.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Болезни системы кровообращения являются ведущей причиной смертей у
взрослого населения в РФ (46,3% от общего числа смертельных исходов). В
структуре смертности от БСК на долю ИБС в 2018 году пришлось более
половины (52,6%). В этом же году ИМ как причина смерти зафиксирован у
54427 человек (6,5% в структуре смертности при БСК) [6].
По данным Центрального Научно-исследовательского института организации и
информатизации здравоохранения Министерства здравоохранения, в 2016 году
в РФ зафиксировано 187240 случаев острого ИМ (включая повторный), из них
во время госпитализации умерло 33185 пациентов, т.е. 17,7%. Этот же
показатель в 2015 году составил 18,6% (при 188511 зарегистрированных
случаях острого ИМ). Представленные в этом документе данные позволяют
говорить о том, что на ИМ приходится около 90% всех острых форм ИБС
(87,7% и 90,3% в 2015 и в 2016 годах соответственно), остальное
приходится на «другие формы острых ишемических болезней сердца». Данный
документ не содержит информации о соотношении ИМпST и ИМбпST, но
клиническая практика указывает на то, что большая часть смертельных
исходов в период госпитализации происходит у пациентов с ИМпST [7].
В последние годы соотношение между ИМпST и ИМбпST в общем числе ИМ
неуклонно меняется в сторону ИМбпST [8], в основном за счет
лабораторного выявления дополнительных случаев ИМбпST среди тех, кого
еще недавно называли пациентами с нестабильной стенокардией. Объективной
предпосылкой для этого является широкое использование для подтвреждения
некроза миокарда определения уровня сердечных тропонинов, в т.ч.
высокочувствительными методами.
На фоне широкого внедрения инвазивного лечения смертность при ИМпST
снижается. По данным национальных регистров в Европе, летальность в
стационаре колеблется от 6 до 14%. Краткосрочный регистр ОКС,
выполненный в Москве в 2012 году, показал, что на долю ОКСпST пришлось
28,3% случаев от общего числа ОКС. Умерло в стационаре 12,4% пациентов с
ОКСпST (при ОКСбпST — только 1,9%) [9].
1.4 Особенности кодирования заболевания или сотсояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I 21. Острый инфаркт миокарда.
I 21.0. Острый трансмуральный инфаркт передней стенки миокарда.
I 21.1. Острый трансмуральный инфаркт нижней стенки миокарда.
I 21.2. Острый трансмуральный инфаркт миокарда других уточненных
локализаций.
I 21.3. Острый трансмуральный инфаркт миокарда неуточненной
локализации.
I 21.9. Острый инфаркт миокарда неуточненный.
I 22. Повторный инфаркт миокарда.
I 22.0. Повторный инфаркт передней стенки миокарда.
I 22.1. Повторный инфаркт нижней стенки миокарда.
I 22.8. Повторный инфаркт миокарда другой уточненной локализации.
I 22.9. Повторный инфаркт миокарда неуточненной локализации.
I 24. Другие формы острой ишемической болезни сердца.
I 24.0. Коронарный тромбоз, не приводящий к инфаркту миокарда.
I 24.8. Другие формы острой ишемической болезни сердца.
I 24.9. Острая ишемическая болезнь сердца неуточненная.
Чаще всего исходом ОКСпST является ИМ с формированием зубца Q на ЭКГ. В
таком случае присваиваются коды I21.0–I21.2, I22.0-I22.8. В случае, если
ОКСпST приводит к ИМ без формирования зубца Q, также присваиваются коды
I21.0–I21.2, I22.0–I22.8.
В случае, если ОКСбпST прогрессирует в ИМпST присваиваются коды
I21.0–I21.2, I22.0–I22.8.
В случае, когда при ОКСпST не развился ИМ (отсутствуют его критерии),
присваивается код I24.0. Рекомендуемая формулировка: «Острый коронарный тромбоз без развития ИМ (требуется указать — на фоне ТЛТ, ЧКВ или ТЛТ и ЧКВ)».
В случаях внезапной смерти пациента с ОКСпST (ИМ 3 типа по критериям
4-го универсального определения) в клиническом диагнозе следует
использовать рубрику I24.8.
Так называемые «неуточненные» рубрики (I21.3, I21.9, I22.9, I24.9) и
соответствующие им формулировки в заключительном клиническом диагнозе
могут использоваться только в исключительных случаях — при наличии
объективных трудностей диагностики. В патологоанатомических и
судебно-медицинских диагнозах использоваться не могут.
Использование кодов I23 «некоторые текущие осложнения ОИМ» при
кодировании основного заболевания / первоначальной причины смерти
недопустимо (данные состояния являются осложнением основного заболевания
— ИМ).
1.5 Классификация заболевания или стостояния (группы заболеваний или состояний)
Классификации ОКС и острого ИМ
На этапе предварительного диагноза:
-
ОКС с подъемом сегмента ST — ИМ с подъемом сегмента ST (к этой группе
относят также остро возникшую блокаду ЛНПГ). -
ОКС без подъема сегмента ST.
Клинический диагноз (в том числе заключительный) после
подтверждения/исключения ИМ:
-
ИМ с подъемом сегмента ST (к этой группе относят также остро возникшую
блокаду ЛНПГ). -
ИМ без подъема сегмента ST.
-
Нестабильная стенокардия.
Классификация ИМ на основании последующих изменений на ЭКГ (не
обязательна к применению):
-
ИМ с формированием патологических зубцов Q.
-
ИМ без формирования патологических зубцов Q.
Классификация ИМ на основании глубины поражения мышечного слоя (является
приоритетной для патологоанатомического/судебно-медицинского диагноза):
-
Субэндокардиальный ИМ.
-
Трансмуральный ИМ.
Классификация ИМ на основании локализации очага некроза:
-
ИМ передней стенки левого желудочка (передний ИМ).
-
ИМ боковой стенки левого желудочка (боковой ИМ).
-
ИМ верхушки сердца.
-
ИМ нижней стенки левого желудочка (нижний ИМ).
-
ИМ задней стенки ЛЖ (задний ИМ).
-
ИМ межжелудочковой перегородки.
-
ИМ правого желудочка.
-
ИМ предсердий.
-
Возможны сочетанные локализации: задненижний, переднебоковой и др.
Через 28 и более суток после начала симптомов ИМпST диагноз ИМ не
применяется. В таком случае принято указывать на перенесенный ранее ИМ,
обозначая его как постинфарктный кардиосклероз.
Классификация ИМ на основании наличия ИМ в анамнезе:
-
Повторный ИМ — ИМ, развившийся через 28 суток и позднее (после
предшествующего ИМ). -
Рецидив ИМ — ИМ, развившийся в течение 28 суток после предшествующего
ИМ.
Классификация типов ИМ:
Тип 1. ИМ, развившийся вследствие разрыва или эрозии
атеросклеротической АБ в КА с последующим формированием
внутрикоронарного тромба (атеротромбоз) с резким снижением кровотока
дистальнее поврежденной АБ или дистальной эмболизацией тромботическими
массами / фрагментами АБ с последующим развитием некроза миокарда. Более
редкой причиной ИМ 1 типа является интрамуральная гематома в
поврежденной атеросклеротической бляшке с быстрым увеличением ее объема
и уменьшением просвета артерии.
Тип 2. ИМ, развившийся в результате ишемии, вызванной причинами, не
связанными с тромботическими осложнениями коронарного атеросклероза.
Патофизиологически такие ИМ связаны с повышением потребности миокарда в
кислороде и/или уменьшения его доставки к миокарду, например, вследствие
эмболии коронарной артерии, спонтанной диссекции коронарной артерии,
дыхательной недостаточности, анемии, нарушений ритма сердца,
артериальной гипертензии или гипотензии и т.д. ИМ 2 типа может возникать
как у пациентов с наличием, так и у пациентов с отсутствием коронарного
атеросклероза.
Тип 3. ИМ 3 типа соответствует случаям появления симптомов,
указывающих на ишемию миокарда, сопровождающихся предположительно новыми
ишемическими изменениями ЭКГ или фибрилляцией желудочков, когда пациенты
умирают до появления возможности взятия образцов крови или в период до
повышения активности биохимических маркеров некроза миокарда в крови.
Диагноз подтверждается на основании обнаружения острого ИМ на аутопсии.
Тип 4а. ИМ, связанный с осложнениями, возникшими по время процедуры
ЧКВ и в ближайшие 48 часов после нее.
Тип 4б. ИМ, связанный с тромбозом
коронарного стента***, документированный при КГ или аутопсии. В
зависимости от сроков после имплантации стента выделяют острый (0–24 ч),
подострый (>24 ч — 30 суток), поздний (>30 суток — 1 год) и очень
поздний (>1 года) тромбоз стента.
Тип 4с. ИМ, связанный с рестенозом после ЧКВ. ИМ 4с типа
устанавливается в случае обнаружения выраженного рестеноза в артерии,
соответствующей зоне ИМ, когда отсутствуют признаки тромбоза и другие
поражения инфаркт-связанной артерии.
Тип 5. ИМ, связанный с операцией коронарного шунтирования.
Критерии диагностики и дифференциальной диагностики ИМ разных типов
представлены в приложении Г1 [5, 10, 11].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Для ишемии миокарда характерны боль или чувство сжатия, давления или
тяжести за грудиной, которые иногда описываются пациентом как
дискомфорт. Возможны иррадиация в левую руку, левое плечо, горло, нижнюю
челюсть, эпигастрий, а также нетипичные клинические проявления, такие
как потливость, тошнота, боль в животе, одышка, удушье, потеря сознания,
которые в некоторых случаях являются единственными или доминирующими.
При ИМ симптомы сходны по характеру с возникающими при приступе
стенокардии, но отличаются по силе и продолжительности (как правило,
сильнее и продолжительнее). При ИМ симптомы, как правило, возникают в
покое, не устраняются приемом нитроглицерина, а иногда — и повторными
инъекциями наркотических анальгетиков. Интенсивность болевого синдрома
при этом может быть различной — от незначительной до невыносимой;
симптомы могут носить волнообразный характер и продолжаться от 20 мин до
нескольких часов. При нетипичных клинических проявлениях в зависимости
от преобладающей симптоматики у пациентов с развивающимся ИМ выделяют
астматический вариант, абдоминальный вариант, аритмический вариант,
цереброваскулярный вариант, а также малосимптомную (безболевую) форму.
В клинической картине ИМпST могут присутствовать, иногда преобладать,
симптомы его основных осложнений
— острой сердечной недостаточности (отек легких, шок), выраженной
брадикардии или тахикардии.
Одним из возможных клинических проявлений ИМ, иногда единственным
доступным для врачебной оценки, может быть набор симптомов, свойственных
остановке кровообращения, вызванной желудочковой тахикардией /
фибрилляцией желудочков, асистолией или электромеханической
диссоциацией. У пациентов с устраненной или спонтанно разрешившейся
остановкой кровообращения ведущим симптомом может быть разной степени
стойкое угнетение сознания, вплоть до глубокой комы.
2. Диагностика
2.1 Жалобы и анамнез
В начальной диагностике ИМпST рекомендуется опираться на оценку
характера болевого синдрома и/или его эквиваленты (для указания в
диагнозе «повторного» ИМ потребуется информация о ранее перенесенных
ИМ).
В диагностике ИМпST рекомендуется опираться на клинические проявления
заболевания, изменения на ЭКГ и фиксировать время от начала болевого
эпизода до контакта с врачом. для принятия основных решений, касающихся
лечения пациента с ИМпST, требуются лишь опрос и оценка ЭКГ. В отдельных
случаях дифференциальной диагностики с другими
состояниями/заболеваниями, сопровождающимися похожими изменениями ЭКГ
(«некоронарные» подъемы сегмента ST), могут помочь дополнительные
характеристики болевого синдрома и данные других методов, например
эхокардиографии (ЭхоКГ).
2.2 Физикальное обследование
-
Физикальное обследование не дает информации о признаках ИМпST, но
рекомендуется для выявления осложнений заболевания (например, набухших
вен шеи и хрипы в легких при сердечной недостаточности) и данных,
позволяющих заподозрить наличие других причин появления симптомов, т.е.
помочь в дифференциальной диагностике. Среди примеров таких признаков —
шум трения перикарда при перикардите, асимметричный пульс при аневризме
аорты, перкуторные и аускультативные признаки наличия воздуха в
плевральной полости при пневмотораксе [36].
ЕОК 1C (УУР С; УДД 5)
2.3 Лабораторные и диагностические исследования
-
У пациентов с ИМпST для подтверждения диагноза рекомендуется определение
динамики уровня биохимических маркеров повреждения кардиомиоцитов в
крови, предпочтительно — исследование уровня сердечного тропонина I или
Т [12, 13].
ЕОК 1A (УУР A, УДД 1)
Комментарий: применительно к ИМпST лабораторное подтверждение
некроза миокарда с помощью исследования уровня тропонинов носит
формальный характер и имеет непервостепенное значение. Определение
маркеров повреждения необходимо для окончательного подтверждения
диагноза, но первичная лечебная стратегия строится на основании
клинической картины и ЭКГ. Все основные решения по оказанию помощи
пациенту с ИМпST не зависят от лабораторного подтверждения. Более того,
важнейшие решения, например решение о введении тромболитика или
проведении первичного ЧКВ, не должны откладываться до получения
информации об уровне тропонина.
Рекомендуется использовать количественное определение уровня сердечных
тропонинов. Качественные и полуколичественные методики неуместны, т.к.
не позволяют оценить изменения концентрации этих маркеров, обязательное
для постановки диагноза. Преходящее повышение уровня сердечного
тропонина в крови свидетельствует о некрозе кардиомиоцитов вне
зависимости от причины, которая может быть связана как с первичным
ограничением коронарного кровотока, так и другими, в том числе
внесердечными факторами (Приложение Г2). Повышение уровня сердечного
тропонина выше 99-го перцентиля здоровых лиц в условиях, указывающих на
наличие ишемии миокарда, свидетельствует об остром ИМ (Приложение Г1).
-
У всех пациентов с подозрением на ИМпST для оценки риска ишемических и
геморрагических событий, а также для обеспечения безопасности лечения
рекомендуется определение уровня креатинина в крови при поступлении в
стационар с расчетом клиренса креатинина и СКФ [14, 312].
ЕОК 1A (УУР В; УДД 3)
Комментарий: уровень креатинина в крови и расчетный показатель
клиренса креатинина важны для выбора дозировок ряда лекарственных
средств. Расчетная СКФ может использоваться для оценки риска ишемических
и геморрагических событий.
-
У всех пациентов с ИМпST для оценки и контроля риска кровотечений
рекомендуется исследование уровня общего гемоглобина в крови, оценка
гематокрита, а также уровней эритроцитов и тромбоцитов при поступлении в
стационар [313, 330, 331, 332].
ЕОК 1C (УУР C; УДД 4)
Комментарий: выявление сниженных уровней общего гемоглобина,
эритроцитов и тромбоцитов в крови является признаком повышенного
геморрагического риска; при высоком уровне тромбоцитов повышен риск
раннего тромбоза стентов***, установленных в коронарных артериях.
-
У всех пациентов с ИМпST для последующих оценки и контроля углеводного
обмена рекомендуется определение концентрации глюкозы в крови при
поступлении в стационар, скрининг на наличие сахарного диабета, а также
частое (не реже 3 раз в сутки) определение уровня глюкозы в крови при
известном сахарном диабете или гипергликемии в период госпитализации
[15, 16].
ЕОК IIaB (УУР В; УДД 3)
-
У всех пациентов с ИМпST для обеспечения безопасности лечения
рекомендуется определение содержания электролитов крови (минимально –
калия и натрия, оптимально – калия, натрия и магния) с коррекцией и
повторной оценкой их уровня при наличии отклонений от нормальных величин
[314].
ЕОК IIbС (УУР С; УДД 4)
2.4 Инструментальные диагностические исследования
-
У всех пациентов с подозрением на ИМпST рекомендуется зарегистрировать
ЭКГ в покое как в минимум в 12 стандартных отведениях [17–23].
ЕОК 1A (УУР A; УДД 2).
Комментарий: eсли изменения на ЭКГ в 12 стандартных отведениях
неинформативны (нет смещений сегмента ST, достаточных для постановки
диагноза), а по клиническим данным предполагается наличие ишемии
миокарда, рекомендуется использовать дополнительные отведения, такие
как V7–V9 и V3R–V4R. При
неинформативной ЭКГ у пациентов с сохраняющимся подозрением на ОКС,
продолжающимися или возобновляющимися симптомами для своевременного
выявления ишемических изменений на ЭКГ рекомендуется регистрировать
повторно (например, с интервалами в 15–30 мин в течение первого часа)
или начать мониторирование смещений сегмента ST в 12 отведениях.
-
Рекомендуется использовать дополнительные отведения ЭКГ V7–V9 и V3R–V4R
у пациентов с ИМпST задней и нижней стенки ЛЖ (для диагностики
распространения инфаркта на правый желудочек и базальные отделы левого
желудочка) [20].
ЕОК IIA (УУР B; УДД 2)
-
У пациентов с подозрением на ИМпST для ускорения диагностики
рекомендуется зарегистрировать ЭКГ в течение 10 мин на месте первого
контакта с медицинским работником (как правило, догоспитально) и
безотлагательно интерпретировать ее квалифицированным врачом [36].
ЕОК 1C (УУР С; УДД 5)
-
У пациентов с ИМпST для своевременного выявления и устранения нарушений
ритма сердца рекомендуется скорейшее начало мониторирования ЭКГ [36].
ЕОК 1C (УУР С; УДД 5)
-
У пациентов с ИМпST для подтверждения диагноза, оценки тяжести поражения
и определения прогноза рекомендуется эхокардиография (ЭхоКГ), оптимально
– выполненная в первые сутки госпитализации [36].
ЕОК 1C (УУР С; УДД 5)
Комментарий: Выполнение ЭхоКГ не должно задерживать
транспортировку пациента на КГ. ЭхоКГ необходима для оценки функции и
геометрии ЛЖ, а также для распознавания таких осложнений, как тромбоз
полости ЛЖ, разрывы сердца, нарушение функции клапанов сердца (в
частности, митральная регургитация), ИМ правого желудочка, перикардит.
При подозрении на разрыв миокарда (наружный или внутренний) или
расслоение восходящего отдела аорты ЭхоКГ рекомендуется выполнить до
проведения КГ. Оценка динамики локальной и глобальной функции сердца
помогает уточнить эффективность лечения. Кроме того, данные ЭхоКГ,
прежде всего ФВ ЛЖ, необходимы для определения прогноза заболевания.
-
Пациентам с ИМпST для решения вопроса о выполнении ЧКВ рекомендуется КГ,
обязательная как в рамках стратегии первичного ЧКВ, так и в рамках
стратегии с фармакоинвазивным подходом [32, 60].
ЕОК IA (УУР A; УДД 1)
Комментарий: основная задача КГ — обнаружение острой окклюзии
или осложненного стеноза артерии для последующего устранения этого
поражения с помощью ЧКВ (или обхода места окклюзии с помощью операции
КШ).
-
Магнитно-резонансная томография сердца при ОКCпST рекомендуется в
качестве предпочтительного метода для уточнения локализации и объема
поражения миокарда даже при относительно небольших размерах очагов
некроза, а также для дифференциальной диагностики поражений миокарда
[24, 25].
ЕОК IIbB (УУР С; УДД 5)
Комментарий: магнитно-резонансная томография сердца позволяет
дифференцировать ишемическую или воспалительную (миокардиты) природу
поражения, является эталонным методом трехмерной оценки морфологии и
функции камер сердца, а также клапанного аппарата. Дополнительное
преимущество метода — отсутствие лучевой нагрузки. Однако технические
сложности выполнения ограничивают его применение в самом остром периоде
заболевания. Необходимость и возможность выполнить магнитно-резонансную
томографию сердца не может быть основанием для задержки с КГ.
-
Сцинтиграфия миокарда с 99mTc-пирофосфатом в покое рекомендуется у
пациентов с ИМ в качестве дополнительного метода диагностики, который
показан для верификации некроза миокарда в тех случаях, когда имеются
существенные затруднения в интерпретации изменений ЭКГ в связи с
наличием блокады ножек пучка Гиса или признаков перенесенного в прошлом
ИМ [26, 27].
ЕОК IIaB (УУР В; УДД 2)
Комментарий: необходимость и возможность выполнить
сцинтиграфию миокарда не может быть основанием для задержки с КГ.
-
Спиральная компьютерная томография сердца не рекомендуется как
стандартный метод обследования при ИМпST. Однако обследование с
внутривенным введением контраста может оказаться полезным для
дифференциальной диагностики, позволяя выявить отличные от ИМ угрожающие
жизни состояния (расслоение аорты, ТЭЛА, пневмоторакс, и пр.). В
отдельных случаях расслоение аорты может сопровождаться развитием ИМ за
счет вовлечения в расслоение коронарных артерий, что может быть выявлено
при компьютерной томографии [28, 29].
ЕОК IIbB (УУР В; УДД 2)
Критерии установления заболевания или состояния – см. Приложение Г1 и
Г2, стр.135 и 139.
2.5 Иные диагностические исследования
2.5.1. Стратификация риска неблагоприятного исхода
Cуществуют многочисленные шкалы оценки
риска неблагоприятных исходов, разработанные для пациентов с ИМпST
(GRACE, TIMI, DYNAMIC TIMI, CADILLAC, PAMI, Zwolle). Тем не менее
внятных валидированных подходов, направленных на улучшение исходов
лечения за счет конкретных действий в период госпитализации и после нее,
основанных на оценке пациентов ИМпST с помощью этих шкал, не существует.
Индивидуальный риск неблагоприятного исхода определяется локализацией и
распространенностью ИМ (оцениваются по данным ЭКГ и ЭхоКГ), наличием
многососудистого поражения коронарных артерий, осложнений данного ИМ,
своевременностью и полноценностью реперфузии миокарда, возрастом и
сопутствующими состояниями (прежде всего — нарушенной функцией почек и
сахарным диабетом). Факт и успешность реперфузионной терапии, наличие
устойчивых желудочковых аритмий, СН и/или сниженная ФВ ЛЖ определяют
целесообразность и сроки имплантации кардиовертера-дефибриллятора .
-
Рутинная стратификация риска с помощью шкал у пациентов ИМпST в период
госпитализации не рекомендуется (из-за отсутствия доказанно эффективных
вмешательств, основанных на результатах стратификации) [36].
ЕОК IIIC (УУРС; УДД 5)
Комментарий: у отдельных пациентов с ИМпST с успешным первичным ЧКВ
при принятии решения о раннеей (в пределах 72 часов от поступления)
выписке может быть рассмотрено использование шкалы Zwolle (Приложение Г4) [30].
3. Лечение
3.1. Реперфузионное лечение заболевания
Тромботическая окклюзия крупной ветви КА в прямой связи с поврежденной
атеросклеротической бляшкой, общепризнанна как основной патогенетический
механизм развития и прогрессирования ИМпST. Локализация и стойкость
окклюзии определяют размер некроза миокарда, прямо связанный с риском
смерти от основных осложнений ИМ (сердечной недостаточности,
потенциально фатальных нарушений ритма и проводимости сердца, разрыва
миокарда). Устранение острой окклюзии и восстановление проходимости
коронарной артерии (реперфузия) являются основной лечения пациентов с
ИМпST. Поэтому все пациенты ИМпST сразу после установления диагноза
(независимо от возраста или половой принадлежности) должны
рассматриваться как кандидаты на реперфузионную терапию. Кроме того, у
пациентов после остановки кровообращения, предположительно вызванной
ИМпST, уровень сознания не может быть основанием для воздержания от
выполнения коронарной ангиографии (с намерением выполнить первичное
ЧКВ). В настоящее время реперфузионное лечение предусматривает
использование двух стратегий: первичного ЧКВ и фармакоинвазивного
подхода, включающего последовательное применение ТЛТ и ЧКВ. Выбор между
этими двумя стратегиями определяется прежде всего доступностью
подразделений, способных организовать своевременное ЧКВ.
3.1.1 Реперфузия: общие положения
-
Реперфузионная терапия для снижения риска смерти рекомендуется всем
пациентам с ИМпST и длительностью симптомов <12 часов [31, 32].
ЕОК IA (УУР A; УДД 1)
-
Для снижения риска смерти в качестве предпочтительного метода реперфузии
при ИМпST в указанный временной промежуток, при соблюдении
организационных требований, рекомендуется первичное ЧКВ [32].
ЕОК IA (УУР A; УДД 1)
Комментарий: кроме снижения риска
смерти, первичное ЧКВ имеет преимущество перед системной ТЛТ на уровне
предотвращения рецидивов ИМ и ишемии миокарда, меньшей частоты
инсультов, в том числе геморрагических. Значительная часть доказательств
преимущества первичного ЧКВ перед системной ТЛТ получена до широкого
применения коронарных стентов*** , т.е. при сравнении банальной баллонной
ангиопластики с ТЛТ.
-
Как подход к снижению риска смерти при ИМпST реперфузионное лечение не
рекомендуется, если от начала симптомов прошло более 48 часов и у
пациента нет дополнительных клинических оснований для вмешательства
(продолжающаяся или рецидивирующая ишемия миокарда с симптомами, СН,
угрожающие жизни нарушения ритма сердца) [33–35].
ЕОК IIIB (УУР A; УДД 2)
-
Пациентам с ИМпST с полным исчезновением симптомов и нормализацией
положения сегмента ST на ЭКГ без реперфузионного лечения (спонтанно или
после приема нитроглицерина) для уменьшения угрозы ретромбоза
рекомендована ранняя (в пределах 24 часов от начала симптомов) КГ с
намерением выполнить ЧКВ [36].
ЕОК IC (УУР С; УДД 5)
3.1.2 Первичное чрескожное коронарное вмешательство
-
Для снижения риска смерти первичное ЧКВ являетcя предпочтительной
реперфузионной стратегией в первые 12 часов от начала развития ИМпST,
если ожидаемое время от момента постановки диагноза до проведения
проводника в просвет инфаркт-связанной КА не превышает 120 минут [32].
ЕОК IA (УУР A; УДД 1)
Комментарий: в случаях первичного ЧКВ следует укладываться во
временной интервал от постановки диагноза до введения проводника в
просвет коронарной артерии. Для пациентов, поступивших непосредственно в
учреждение, реализующее первичные ЧКВ, это время не должно превышать 60
минут, а у пациентов, переведенных из «неинвазивных» учреждений, — 90
минут.
Не следует рассматривать в качестве ограничений/противопоказаний к
первичному ЧКВ возраст, указания на нарушенную азотвыделительную функцию
почек, сопутствующие заболевания и состояния. Как относительные
противопоказания к ЧКВ могут расцениваться непереносимость
рентгенконтрастных веществ и чрезвычайно
высокая масса тела пациента (превышающая ограничения, заявленные
производителем ангиографической установки). В этих случаях возможна
вынужденная тромболитическая терапия без последующего ЧКВ.
-
Рутинная стратегия первичного ЧКВ для снижения риска ишемических событий
рекомендована у пациентов, поступивших в интервале 12–48 часов от начала
симптомов ИМпST [33, 37, 38].
ЕОК IIaA (УУР A; УДД 2)
-
Рекомендуется предпочесть первичное ЧКВ тромболизису для снижения риска
смерти у пациентов с ИМпST, осложненным кардиогенным шоком или тяжелой
сердечной недостаточностью, независимо от продолжительности задержки,
связанной с организацией ЧКВ [39, 40].
ЕОК IA (УУР A; УДД 2)
-
У пациентов c ИМпST с противопоказаниями к ТЛТ для снижения риска смерти
рекомендуется стремиться выполнить ЧКВ, даже с существенными
отклонениями в соблюдении временных требований [41, 42].
ЕОК IIaB (УУР А; УДД 3)
-
При выполнении первичного ЧКВ при ИМпST для снижения риска смерти
рекомендуется обязательное вмешательство на инфаркт-связанном сосуде
[32, 44].
ЕОК IA (УУР A; УДД 1).
Комментарий: как правило, речь идет об устранении острой
тромботической окклюзии крупной ветви КА. Доказательства в данном случае
получены в метаанализах исследований, сравнивавших ЧКВ на инфаркт-
связанной артерии с тромболитической терапией.
-
Для снижения суммарного риска ишемических событий (смерть, рецидив ИМ
или необходимость в повторной реваскуляризации) рекомендуется ЧКВ на не
инфаркт-связанных артериях у гемодинамически стабильных пациентов с
ИМпST и многососудистым поражением (в основном в виде этапной процедуры,
выполненной в пределах индексной госпитализации или в ближайшие недели
после нее, но не ранее 72 часов после первичного вмешательства). При
значениях индекса SYNTAX > 23 показана непосредственная или
телемедицинская консультация кардиохирурга на предмет проведения
операции КШ [44–46].
ЕОК IIаA (УУР B; УДД 1)
Комментарий: отношение к полной реваскуляризации при ИМпST
основывается на результатах как данных метаанализов нескольких небольших
рандомизированных исследований, не выявивших убедительного преимущества
этого подхода на уровне смертности и риска рецидива ИМ, так и на
результатах недавнего крупного рандомизированного исследования COMPLETE.
В нем у пациентов с ИМпST и многососудистым поражением коронарных
артерий выполнение этапного (второго) ЧКВ на не инфаркт-связанных
артериях приводило к значительному снижению суммарной частоты
неблагоприятных событий (ИМ, сердечная смерть, повторная
реваскуляризация) при сравнении с тактикой консервативного лечения после
первичного ЧКВ. Имеющиеся данные упомянутых небольших исследований и
метаанализов не позволяют выбрать предпочтительные сроки для выполнения
вмешательства на не инфаркт-связанных артериях (в рамках первичного ЧКВ
или вторым этапом после периода наблюдения за пациентом), а этапное ЧКВ
в исследовании COMPLETE проводилось как в период госпитализации, так и
после выписки (в пределах 45 суток после первичного ЧКВ).
-
У пациентов с ИМпST, осложненным кардиогенным шоком, из-за возможного
увеличения риска смерти и почечной недостаточности рекомендуется
воздержаться от одномоментных многососудистых ЧКВ, ограничившись
вмешательством на инфаркт-связанной артерии [47, 48].
ЕОК IIIB (УУР B; УДД 2)
-
Для снижения риска рецидива ИМ и необходимости в повторной
реваскуляризации при первичном ЧКВ у пациентов с ИМпST рекомендуется
предпочесть коронарное стентирование** баллонной ангиопластике [49, 50].
ЕОК IA (УУР А; УДД 1)
Комментарий: метаанализы не выявили преимущества стентирования
перед ангиопластикой на уровне снижения риска смерти. Большая часть
доказательной базы, указывающей на преимущество ЧКВ перед ТЛТ на уровне
смертности, получена при использовании баллонной ангиопластики (без
стентирования). Поэтому воздерживаться от ЧКВ в виде баллонной
ангиопластики, ссылаясь на отсутствие подходящих стентов***, не
оправдано.
-
Для снижения
риска рецидива ИМ, тромбоза стента и необходимости в повторной
реваскуляризации в случае коронарного стентирования при ИМпST
рекомендуется использовать СВЛ*** нового поколения [51–53].
ЕОК IA (УУР А; УДД 1)
Комментарий: информация о преимуществе СВЛ*** перед СБЛП*** на уровне смертности
противоречива. Воздерживаться от стентирования с помощью СБЛП*** при
отсутствии СВЛ*** не оправдано.
-
Из-за отсутствия значимого влияния на риск ишемических событий и
возможного увеличения риска инсульта при ЧКВ у пациентов с ИМпST
рекомендуется воздержаться от рутинной тромбаспирации [54].
ЕОК IIIA (УУР А; УДД 1)
Комментарий: решение о выполнении тромбаспирации в начале или
по ходу ЧКВ может быть принято на основании индивидуальных
ангиографических и клинических данных пациента.
-
Для снижения риска кровотечений и риска осложнений в месте сосудистого
доступа, для снижения риска смерти, ЧКВ при ИМпST рекомендуется
выполнять, используя в качестве места доступа лучевую, а не бедренную
артерию (в случаях, когда это технически возможно) [55–58].
ЕОК IA (УУР А; УДД 1)
Комментарий: кроме уменьшения риска крупных кровотечений
ишемических событий, выбор лучевого доступа вместо бедренного
обеспечивает более раннюю активизацию пациента. Важно, что преимущество
лучевого доступа перед бедренным очевидно лишь в учреждениях, где с
помощью лучевого доступа выполняется более 80% всех диагностических и
лечебных коронарных процедур.
3.1.3 Тромболитическая терапия
-
ТЛТ при отсутствии противопоказаний рекомендована для снижения риска
смерти у пациентов с ИМпST с длительностью симптомов <12 часов, у
которых ожидается, что первичное ЧКВ не будет выполнено в пределах 120
минут после постановки диагноза [59].
ЕОК IA (УУР A; (УДД 1)
Комментарий: введение тромболитика должно быть начато в
пределах 10 минут от постановки диагноза (время, отведенное на
организацию ТЛТ, выбрано на основании медианы подобного времени (9
минут), зарегистрированной в исследовании STREAM, показавшем сходные
исходы лечения при стратегии первичного ЧКВ и стратегии с
фармакоинвазивным подходом) [60].
-
При условиях, оправдывающих ТЛТ как
начальную стратегию реперфузии (см. выше), при отсутствии
противопоказаний к ней и при наличии возможностей (тромболитик,
обученный персонал, дефибриллятор , средства для сердечно-легочной
реанимации), для снижения риска смерти у пациентов с ИМпST рекомендуется
догоспитальное применение данного метода реперфузии [61–63].
ЕОК IA (УУР-A; УДД -1)
Комментарий:
Абсолютные противопоказания к ТЛТ:
-
ранее перенесенный геморрагический инсульт или нарушение мозгового
кровообращения неизвестной этиологии; ишемический инсульт в
предшествующие 6 месяцев; -
повреждения или новообразования ЦНС, артериовенозные мальформации ЦНС;
-
недавняя серьезная травма / хирургическое вмешательство / травма головы
/ желудочно-кишечное кровотечение (в течение предыдущего месяца); -
известные геморрагический диатез или кровоточивость (кроме менструальных кровоmeчений);
-
расслоение аорты (заподозренное или подтвержденное);
-
пункция некомпрессируемых сосудов, биопсия печени, спинномозговая пункция в течение предыдущих 24 часов.
Относительные противопоказания к ТЛТ:
-
транзиторная ишемическая атака в предыдущие 6 месяцев;
-
прием пероральных антикоагулянтов;
-
беременность и 1-я неделя после родов;
-
рефрактерная АГ (САД >180 мм рт.ст. и/или ДАД >110 мм рт.ст.);
-
тяжелое заболевание печени;
-
инфекционный эндокардит;
-
травматичная или длительная сердечно-легочная реанимация;
-
обострение язвенной болезни.
-
При отсутствии противопоказаний, невозможности выполнения ЧКВ и
сохранении симптомов и признаков трансмуральной ишемии (подъемов
сегмента ST на ЭКГ) у отдельных пациентов c ИМпST (большая зона миокарда
под угрозой и/или гемодинамическая нестабильность) для снижения риска
смерти рекомендовано проведение тромболитической терапии через 12–24
часа после начала симптомов [36, 64].
ЕОК IIbC (УУР С; УДД 5)
-
Всем пациентам с ИМпST, получающим тромболитик (догоспитально или в
стационаре без возможности выполнения ЧКВ), для снижения риска смерти
рекомендован незамедлительный перевод в учреждения, реализующие ЧКВ в
круглосуточном режиме [65–68].
ЕОК IA (УУР А, УДД 1)
Комментарий: все случаи тромболитической терапии (эффективной
и неэффективной) должны рассматриваться как начальная часть стратегии
реперфузии в рамках фармакоинвазивного подхода, предусматривающего
последующее выполнение ЧКВ (спасающее, срочное или отсроченное) в
пределах суток от проведения тромболитической терапии.
-
В случае применения ТЛТ при ИМпST для уменьшения риска смерти
рекомендуется предпочесть фибринспецифичные тромболитики
нефибринспецифичным [69].
ЕОК IIaB (УУР B; УДД 2)
Комментарий: доказательства
преимущества одного из фибринспецифичных тромболитиков (альтеплазы )
перед нефибринспецифичной стрептокиназой на уровне смертности
продемонстрированы только в одном исследовании и не подтверждались при
последующих метаанализах. Предпочтительность фибриспецифических
тромболитиков в данном случае определяется не столько большей
эффективностью, сколько неудачным профилем переносимости стрептокиназы
(аллергические реакции и способность вызывать артериальную гипотонию) и
непредсказуемой угрозой нейтрализации ее эффектов специфическими
антителами (у отдельных пациентов). У больных с ИМпST старше 75 лет в
рамках фармакоинвазивного подхода (в случае использования тенектеплазы)
для снижения риска кровотечений, прежде всего внутричерепных, возможно
использование половинной дозы тромболитика [60].
Практические аспекты тромболитической терапии
-
При безуспешной ТЛТ (нет снижения подъемов сегмента ST более 50% от
исходного через 90 минут от начала введения фибринолитика) для
восстановления проходимости КА, предотвращения рецидива ИМ и сердечной
недостаточности рекомендуется срочное спасающее ЧКВ и не рекомендуется
повторная ТЛТ [70–74].
ЕОК IA (УУР А; УДД 1)
Комментарий: в исследованиях, посвященных сравнению спасающего
ЧКВ и консервативного ведения пациентов с ИМпST после неэффективной ТЛТ,
помимо снижения рисков рецидива ИМ и сердечной недостаточности, отмечена
статистически незначимая тенденция к меньшей смертности при выполнении
спасающего ЧКВ.
-
После успешной ТЛТ рекомендуется ранняя (2–24 часа после начала
тромболизиса) КГ с намерением выполнить ЧКВ в инфаркт-связанной артерии
(для снижения рецидива ИМ, суммарного риска рецидива ИМ и смерти, а
также для снижения риска повторной ишемии миокарда) [66, 67].
ЕОК IA (УУР А; УДД 1)
Комментарий: критерии успешности ТЛТ многочисленны, но на
практике оправдана оценка изменения положения сегмента ST в наиболее
информативном отведении ЭКГ (там, где на исходной ЭКГ смещение сегмента
вверх было наибольшим). Желательно полное исчезновение подъема сегмента
ST через 90 минут от начала ТЛТ, но для признания ТЛТ эффективной
достаточно снижения подъема сегмента ST на 50 и более процентов от
исходного.
2-часовая граница рекомендуемого интервала (от начала ТЛТ до выполнения
ЧКВ) выбрана достаточно условно, в основном для того, чтобы удержать
медицинских работников от выполнения так называемого
«подготовленного» ЧКВ (реализация процедуры, не дожидаясь оценки
эффективности тромболитической терапии). В исследованиях по оценке
эффектов «подготовленного» ЧКВ пациенты в рамках такой стратегии
получали не только ТЛТ, но и блокатор ГПР IIb/IIIa. В настоящее время
«подготовленное» ЧКВ не рекомендовано, т.к. в неоднократных сравнениях
его со «стратегией первичного ЧКВ» либо отсутствовали какие-либо
преимущества, либо регистрировалась более высокая частота
неблагоприятных исходов, включая увеличение риска кровотечений и смерти
[75-77].
-
Если при ИМпST после успешной ТЛТ не удалось по каким-то причинам
выполнить КГ и ЧКВ в интервале 2– 24 ч, для уменьшения риска рецидива ИМ
рекомендуется выполнить КГ и определиться с реваскуляризацией в более
поздний период (за время госпитализации) [36].
ЕОК IС (УУР С; УДД 5)
-
При рецидиве ишемии миокарда или признаках реокклюзии после
первоначально успешной ТЛТ у пациента ИМпST для снижения риска смерти
рекомендуется КГ с намерением выполнить срочное ЧКВ [36, 64]
ЕОК IС (УУР С, УДД 5)
-
При развитии острой левожелудочковой недостаточности, гемодинамической
или электрической нестабильности после первоначально успешной ТЛТ при
ИМпST для снижения риска смерти рекомендуется КГ с намерением выполнить
срочное ЧКВ [36, 64].
ЕОК IС (УУР С; УДД 5)
3.1.4 Коронарное шунтирование
КШ у пациентов с ИМпST имеет ограниченное применение и не
рассматривается среди основных подходов к реперфузии миокарда. Оно
никогда не изучалось у подобных пациентов в рандомизированных
исследованиях. Тем не менее, в отдельных случаях ИМпST в различные сроки
от начала заболевания может обсуждаться и должно выполняться КШ.
-
С целью снижения риска смерти при ИМпST неотложное КШ рекомендуется у
пациентов с невозможностью выполнения ЧКВ, но имеющих кардиогенный шок
или тяжелую сердечную недостаточность [78].
ЕОК IIaB (УУР B; УДД 2)
-
С целью снижения риска смерти неотложное КШ рекомендуется у пациентов с
ИМпST с невозможностью выполнения ЧКВ или c безуспешной ЧКВ, имеющих
продолжающуюся или рецидивирующую ишемию миокарда [36, 64].
ЕОК IIb C (УУР С; УДД 5)
-
С целью снижения риска смерти при ИМпST КШ рекомендуется у пациентов,
подвергнутых кардиохирургическим операциям в связи с механическим
осложнениями ИМ, такими как разрыв межжелудочковой перегородки, отрыв
или стойкая дисфункция папиллярной мышцы, наружный разрыв миокарда
желудочков [36, 64, 79, 80].
ЕОК IIa C (УУР C; УДД 4)
-
С целью снижения риска смерти и рецидива ИМ при ИМпST КШ рекомендуется
при осложнениях ЧКВ, а именно при неудачном раскрытии стента, переломе
стента или при рецидивирующем остром тромбозе в месте вмешательства. КШ
рекомендуется и при расслоении или перфорации коронарной артерии, если
осложнение не удается устранить применением эндоваскулярных методик
[36].
ЕОКIIb С (УУР С; УДД 5)
Комментарий: за исключением явно неотложных случаев (с
продолжающейся ишемией миокарда, шоком,
_механическими осложнениями ИМ), ясности со сроками выполнения КШ при
ИМпST нет. Сроки отчасти определяются необходимостью обеспечить
геморрагическую безопасность вмешательства, выждав 3–7 дней после отмены
блокатора P2Y12-рецепторов тромбоцитов (АТХ-группа — антиагреганты,
кроме гепарина)
(тикагрелор**
следует отменить как минимум за 3–5 дней, клопидогрел** — как минимум за 5
дней, прасугрел —
как минимум за 7 дней до планового хирургического вмешательства). У
отдельных стабильных пациентов с ИМпST после успешного первичного ЧКВ (c
высоким индексом SYNTAX, сахарным диабетом, низкой фракцией выброса
левого желудочка) следует рассматривать КШ как вариант отсроченной
полной реваскуляризации при многососудистом поражении. При обсуждении
вариантов КШ в каждом конкретном случае следует иметь в виду
использование доступного вспомогательного кровообращения (до, во время и
после операции) и выбор щадящих методик самой операции (например, КШ без
подключения аппарата искусственного кровообращения).
3.1.5 Антитромботическое сопровождение реперфузионных вмешательств
Своевременное восстановление кровотока в крупной ветви КА, механически,
спонтанно или с помощью ТЛТ, неизбежно создает угрозу повторной окклюзии
с рецидивом ишемии и угрозой серьезных последствий расширения зоны
ишемии/некроза. Ключевая роль в решении этой проблемы отводится
антитромботической терапии, направленной на предотвращение реокклюзии. В
острый период предлагается активно воздействовать на оба компонента
системы гемостаза: тромбоциты и коагуляцию крови. В рамках любой
стратегии реперфузии предусмотрено использование антиагрегантов (как
правило, не менее двух) и антикоагулянта.
Антитромботическое лечение, не зависящее от выбранной стратегии реперфузии
-
Для снижения риска смерти, рецидива ИМ и
ишемического инсульта (суммарно и отдельно для каждого из перечисленных
неблагоприятных исходов) всем пациентам с ИМпST при отсутствии
противопоказаний рекомендован прием АСК** до начала реперфузионного
вмешательства (или вместо него, если последнее не проводится по каким-то
причинам) [81, 82].
ЕОК IA (УУР А; УДД 1)
Комментарий:
применение АСК** на догоспитальном этапе не имеет доказательств
эффективности и безопасности (в сравнении с хорошо изученным
использованием в стационаре). Исключение составляют пациенты с
догоспитальным тромболизисом (АСК** должна быть применена до начала или во
время введения тромболитика). Оправданность применения АСК** у пациентов,
подвергаемых первичному ЧКВ, вытекает из того, что эффективность данного
вмешательства (ЧКВ) в клинических исследованиях продемонстрирована у
пациентов с ИМпST, получавших АСК** в качестве обязательного фонового
лечения.
-
Для снижения рисков смерти и/или рецидива ИМ всем пациентам с ИМпST при
отсутствии противопоказаний рекомендовано применение парентерально
вводимого антикоагулянта, начатое перед реперфузионным вмешательством
или как минимум во время него [83–91].
ЕОК IA (УУР А; УДД 1)
Комментарий: выбор антикоагулянта,
длительность антикоагуляции в зависимости от выбранной стратегии
реперфузии или вынужденном воздержании от реперфузии представлены ниже.
Как и в случае с АСК** , оправданность применения парентеральных
антикоагулянтов на догоспитальном этапе не имеет доказательств
клинической эффективности и безопасности (в сравнении с хорошо изученным
использованием в стационаре), полученных в рандомизированных,
контролируемых исследованиях. Исключение составляют пациенты с
догоспитальным тромболизисом (где антикоагулянт должен быть применен до
начала или во время введения тромболитика).
-
Для снижения суммарного риска ишемических
событий (сердечно-сосудистая смерть, ИМ, ишемический инсульт), блокатор
P2Y12-рецепторов тромбоцитов (АТХ -группа — антиагреганты, кроме
гепарина) рекомендуется в дополнение к АСК** до начала или во время
реперфузионного вмешательства всем пациентам с ИМпST, не имеющим
противопоказаний [92–95, 167].
ЕОК IA (УУР А, УДД 1)
Комментарий: выбор блокатора P2Y12-рецепторов тромбоцитов для сопровождения
реперфузионного вмешательства определяется стратегией реперфузии,
доступностью препаратов и их индивидуальными характеристиками,
ограничивающими безопасность их применения у отдельных категорий
пациентов с ИМпST. Применения блокатора P2Y12-рецепторов тромбоцитов
следует избегать при ИМпST с высокой вероятностью срочного КШ (известное
поражение коронарных артерий, неподходящее для ЧКВ или КШ в дополнение к
операциям в связи с механическими осложнениями инфаркта миокарда —
устранению дефекта межжелудочковой перегородки или свободной стенки
желудочка, протезированию митрального клапана). Как и в случае с АСК** ,
оправданность применения блокатора P2Y12-рецепторов тромбоцитов на
догоспитальном этапе не имеет полученных в рандомизированных,
контролируемых исследованиях доказательств эффективности и безопасности
на уровне ишемических событий. Дополнительным аргументом против
догоспитального применения этих средств является увеличение риска смерти
в первые сутки лечения у пациентов, получивших тикагрелор** в рамках
подготовки к первичному ЧКВ в исследовании ATLANTIC [96]. Гипотетически
догоспитальное назначение блокатора P2Y12 пациентам с ИМпST можно
рассматривать при соблюдении двух условий: 1) нет сомнений в диагнозе
(характерная клиническая картина и типичные изменения ЭКГ); 2)
существует согласованность между догоспитальным звеном и инвазивным
стационаром и высокая вероятность проведения экстренного ЧКВ. При этом
неназначение блокатора P2Y12 до ЧКВ не может являться причиной
задержки вмешательства. Оснований включать догоспитальное назначение
блокаторов P2Y12 в перечень
обязательных мероприятий нет. Соответственно, нельзя считать
неназначение блокаторов P2Y12 тактической ошибкой. При сомнениях в
диагнозе ОКСпST и тактике лечения прием ингибиторов P2Y12 оправдано
отложить до оценки коронарной анатомии.
Исключение для воздержания от догоспитального использования этих
средств составляют пациенты с догоспитальным тромболизисом (где блокатор
P2Y12-рецепторов тромбоцитов должен быть применен до начала или во время
введения тромболитика).
Антитромботическое сопровождение ТЛТ
Антиагреганты и ТЛТ
-
Для снижения
риска смерти, рецидива ИМ, суммарного риска ишемических событий
(сердечно-сосудистая смерть, ИМ, инсульт, рефрактерная ишемия, требующая
реваскуляризации), клопидогрел** рекомендован пациентам с ИМпST, не
имеющим противопоказаний, в дополнение к АСК** до начала или во время ТЛТ
[92, 93].
ЕОК IB (УУР А; УДД 2)
Комментарий: применение клопидогрела** на догоспитальном этапе не имеет
доказательств эффективности и безопасности (в отличие от убедительных
доказательств целесообразности его применения, полученных в стационаре).
Исключение — пациенты с догоспитальным тромболизисом (клопидогрел** в
нагрузочной дозе должен быть применена до начала или во время введения
тромболитика).
_Клопидогрел**
после его использования во время ТЛТ может быть достаточно рано (в
пределах суток от начала ТЛТ) заменен на тикагрелор** как в рамках
фармакоинвазивного подхода, так и у пациентов, получивших только
тромболитик (без последующего ЧКВ). Безопасность такого «раннего»
переключения с клопидогрела** на тикагрелор** показана в исследовании TREAT
[97], а большую эффективность тикагрелора** (по сравнению с клопидогрелом**
) в снижении риска ишемических событий (суммарный риск
сердечно-сосудистой смерти, ИМ и ишемического инсульта) в этой
клинической ситуации предлагается экстраполировать из результатов
исследования PLATO [98], в которое не включались пациенты с ИМпST,
получившие ТЛТ. Возможность раннего перехода с клопидогрела** на
тикагрелор** у пациентов с ИМпST, получивших тромболитик, не
распространяется на лиц старше 75 лет. Доказательств возможности и
безопасности раннего перехода с клопидогрела** на прасугрел у пациентов с
ИМ, получивших ТЛТ, в виде результатов рандомизированных контролируемых
исследований не существует.
-
Тикагрелор** и
прасугрел не рекомендуются в дополнение к АСК** до начала или во время ТЛТ
из-за отсутствия доказательств безопасности такого подхода при ИМпST
[36].
ЕОК IIIC (УУР С; УДД 5)
-
Блокаторы ГПРIIb/IIIa (АТХ группа —
Антиагреганты, кроме гепарина) не рекомендуются в дополнение к АСК** до
начала или во время ТЛТ из-за отсутствия доказательств эффективности и
наличия указаний на увеличение риска кровотечений у пациентов с ИМпST
[99, 100, 315, 316].
ЕОК IIIB (УУР B; УДД 2)
Антикоагулянты и ТЛТ
-
Для снижения
суммарного риска смерти или рецидива ИМ эноксапарин** рекомендуется как
антикоагулянт первого выбора (по результатам сравнения с НФГ** ) у
пациентов с ИМпST, получивших ТЛТ [101–105].
ЕОК IA (УУР А; УДД 1)
Комментарий: многократно продемонстрированное превосходство эноксапарина** над НФГ**
распространяется в основном на пациентов, получивших фибринспецифичные
тромболитики. Но доказательства целесообразности его применения есть и у
пациентов, получивших стрептокиназу [106]. Важно, что эноксапарин** в
упомянутых выше сравнениях не имел преимущества на уровне
геморрагической безопасности.
-
Для снижения суммарного риска (смерть и рецидив ИМ) у пациентов ИМпST,
получивших ТЛТ, рекомендуется ингибитор Xa фактора свертывания крови
фондапаринукс натрия [107].
ЕОК IIa B (УУР B; УДД 2)
Комментарий:
превосходство фондапаринукса натрия над НФГ** /плацебо в сложном
исследовании OASIS-6 получено в основном в подгруппе пациентов,
получавших стрептокиназу, где фондапаринукс натрия в большинстве случаев
сравнивался с плацебо. Но и у пациентов, получивших другие, в том числе
фибринспецифичные, тромболитики, он был как минимум не хуже НФГ** [108].
Не следует забывать, что фондапаринукс натрия — средство выбора при
наличии легкой и умеренной тромбоцитопении или при угрозе развития
гепарин-индуцированной тромбоцитопении.
-
НФГ** (в виде внутривенного болюса с
последующей внутривенной инфузией с контролем за АЧТВ и изменением
скорости инфузии с целью удержания АЧТВ в диапазоне 1,5-2 от верхней
границы нормального значения) рекомендуется в качестве парентерального
антикоагулянта у пациентов с ИМпST, получающих ТЛТ. Среди доказанных
эффектов такой антикоагуляции — лучшая проходимость инфаркт-связанной
артерии через несколько дней после введения тромболитика [109].
ЕОК IIb B (УУР B; УДД 2)
Комментарий: вводимый внутривенно НФГ** (в дополнение к ТЛТ) не имеет
доказательств эффективности на уровне снижения риска крупных ишемических
событий или смерти как в сравнении с плацебо, так и в сравнении с
другими антикоагулянтами. Тем не менее он, как и АСК** , не одно
десятилетие являлся обязательным элементом сопровождения ТЛТ у
пациентов, получивших фибринспецифичные тромболитики (производные
тканевого активатора плазминогена, в основном альтеплазу). Утраченные в
результате прямых сравнений с эноксапарином** , приоритетные позиции НФГ**
остаются неизменными, когда выбирается антикоагулянт в дополнение к ТЛТ
у пациентов с тяжелым нарушением азотвыделительной функции почек и у
пациентов с очень высокой или низкой массой тела. Подразумевается, что в
каждом из этих случаев изменяемая в зависимости от значений АЧТВ
скорость введения НФГ** призвана сделать лечение таких пациентов более
эффективным и безопасным.
Антитромботическое сопровождение первичного ЧКВ
Антиагреганты и ЧКВ
-
При
планируемом первичном ЧКВ у пациента с ИМпST для снижения суммарного
риска смерти, ИМ и инсульта (по сравнению с использованием клопидогрела**
) при отсутствии противопоказаний (внутричерепное кровоизлияние в
прошлом, продолжающееся кровотечение) в дополнение к АСК** рекомендуется
тикагрелор** , назначенный перед или во время ЧКВ [94].
ЕОК IB (УУР А; УДД 2)
Комментарий: переход на прием тикагрелора** , начиная с нагрузочной дозы,
возможен у пациентов, уже получивших клопидогрел** , в том числе в
нагрузочной дозе. Лечение тикагрелором** не исключает применение
блокаторов ГПР IIb/IIIa при выполнении ЧКВ. При одновременном применении
АСК** и тикагрелора** перед операцией КШ и перед другими крупными
хирургическими вмешательствами тикагрелор** следует отменить за
3 суток, кроме случаев, когда опасность последствий отказа от срочного
КШ превосходит ожидаемые последствия возможного кровотечения.
-
При
планируемом первичном ЧКВ у пациента с ИМпST для снижения суммарного
риска смерти, ИМ и инсульта (по сравнению с использованием клопидогрела**
) при отсутствии противопоказаний (любое нарушение мозгового
кровообращения в прошлом, продолжающееся кровотечение) в дополнение к
АСК** рекомендуется праcугрел, назначенный перед или во время ЧКВ [95].
ЕОК IB (УУР А; УДД 2)
Комментарий: безопасность перехода на прием прасугрела у пациентов, уже
получивших клопидогрел** , изучена недостаточно. Лечение праcугрелом не
исключает применение блокаторов ГПР IIb/IIIa при выполнении ЧКВ. При
одновременном применении АСК** и прасугрела перед операцией КШ и перед
другими крупными хирургическими вмешательствами прасугрел следует
отменить за 7 суток, кроме случаев, когда опасность последствий отказа
от срочного вмешательства превосходит ожидаемые последствия возможного
кровотечения.
-
При
планируемом первичном ЧКВ для снижения суммарного риска ишемических
событий при отсутствии противопоказаний (продолжающееся кровотечение) в
дополнение к АСК** рекомендован и клопидогрел** , с назначением его перед
или во время ЧКВ. Основные кандидаты на лечение клопидогрелом** —
пациенты, нуждающиеся в длительном приеме антикоагулянтов, и те, у кого
по каким-то причинам невозможно лечение тикагрелором** или прасугрелом
[36].
ЕОК IIaC (УУР C; УДД 5)
Комментарий: формально у
клопидогрела** нет доказательств его эффективности на уровне сравнения с
плацебо или другим блокатором P2Y12-рецепторов тромбоцитов при первичном
ЧКВ. Он используется по этому показанию задолго до конкурентов из-за
экстраполяции результатов его оценки при ЧКВ у других категорий
пациентов (ОКСбпST, стабильные формы ИБС).
При
одновременном применении АСК** и клопидогрела** перед операцией КШ и другими
крупными хирургическими вмешательствами клопидогрел** следует отменить за
5–7 суток, кроме случаев, когда опасность последствий отказа от срочного
вмешательства превосходит ожидаемые последствия возможного
кровотечения.
-
При планируемом первичном ЧКВ у пациентов с ИМпST для снижения риска
тромботических осложнений любой из трех доступных блокаторов P2Y12
рецепторов тромбоцитов (клопидогрел** , #прасугрел или
#тикагрелор**
) (АТХ -группа — антиагреганты, кроме гепарина)в виде антитромбоцитарной
монотерапии рекомендован вместо АСК** , когда ее применение невозможно
из-за аллергии и других угрожающих жизни или плохо переносимых побочных
эффектов [36].
ЕОКIIaC (УУР C; УДД 5)
Комментарий: формально предпочтителен клопидогрел** из-за наличия данных о его
сравнении с АСК** при других состояниях [110] и из-за возможности сочетать
его с низкой дозой ривароксабана** (после отмены парентерального
антикоагулянта).
-
Для снижения риска/лечения тромботических осложнений ЧКВ и для снижения
риска рецидива ИМ у пациентов с ИМпST рекомендуется использовать
блокаторы ГПР IIb/IIIa при ЧКВ (в условиях широкого применения ДАТТ)
только как аварийное вмешательство в случае возникновения тромботических
осложнений или высокого, по мнению оператора, риска их развития
(выраженный исходный внутрикоронарный тромбоз, феномен slow-reflow или
no-reflow) [36].
ЕОКIIa C (УУР C; УДД 5)
Комментарий: многочисленные доказательства эффективности
блокаторов ГПР IIb/IIIa при первичном и других видах ЧКВ у пациентов с
ИМпST получены до внедрения в стандарты лечения таких пациентов ДАТТ. Их
применение во время процедуры уместно, если пациент с ИМпST,
подвергаемый ЧКВ, по каким-то причинам не получил и не получит в
ближайшее время блокатор P2Y12-рецепторов тромбоцитов.
Антикоагулянты и ЧКВ
-
При первичном ЧКВ у пациентов с ИМпST для
снижения риска тромботических осложнений и крупных ишемических событий
рекомендуется использование НФГ** в виде внутривенного болюса [36].
ЕОКIIaC (УУР C; УДД 5)
Комментарий: у НФГ** нет доказательств его эффективности на уровне сравнения с
плацебо. Во время ЧКВ НФГ** вводят в/в болюсами, добиваясь поддержания
определенных значений активированного времени свертывания крови (250–300
секунд для анализатора Hemotech или 300–350 секунд для анализатора
Hemochron).
-
У пациентов с ИМпST при первичном ЧКВ для
снижения риска тромботических осложнений и крупных ишемических событий
рекомендуется внутривенное введение эноксапарина** натрия [111].
ЕОК IIa B (УУР А; УДД 2)
-
У пациентов с ИМпST при первичном ЧКВ для снижения риска тромботических
осложнений и крупных ишемических событий рекомендуется внутривенное
введение бивалирудина [112, 113].
ЕОК IIaB (УУР А; УДД 2)
Комментарий: в мета-анализе сравнительных исследований НФГ** и бивалирудина при
первичном ЧКВ не выявлено преимущества последнего на уровне смертности
(что в основном и стало основанием для приоритетного размещения НФГ** в
списке антикоагулянтов, используемых при этом методе реперфузии).
Применение бивалирудина в этих сравнениях сопровождалось более высокой
частотой тромбоза стентов*** и меньшей частотой кровотечений. Бивалирудин
является препаратом выбора у пациентов с наличием или угрозой развития
тромбоцитопении и при высоком риске кровотечения.
-
В случае выполнения первичного ЧКВ у
пациента, получившего до ЧКВ фондапаринукс натрия, для снижения риска
тромботических осложнений ЧКВ в связи с процедурой рекомендуется вводить
стандартный болюс НФГ** (не рекомендуется выполнять ЧКВ на фоне
антикоагуляции только фондапаринуксом натрия) [107].
ЕОК IIa B (УУР B; УДД 2)
-
Из-за неоправданного увеличения риска кровотечений продолжение
антикоагуляции после успешного ЧКВ не рекомендуется, если только нет
других оснований для лечебной (фибрилляция предсердий, тромбоз полости
левого желудочка, венозный тромбоз или ТЭЛА) или профилактической
(тяжелая сердечная недостаточность, ограниченная подвижность пациента)
антикоагуляции [36].
ЕОК IIIC (УУР C; УДД 5).
3.2 Медикаментозное лечение заболевания
3.2.1 Обезболивание
-
Для устранения боли, с целью седации и
снижения симпатической активности, приводящей к тахикардии и повышению
АД, у пациентов с ИМпST рекомендуется внутривенное введение морфина**
[114].
ЕОК IIaB (УУР С; УДД 4)
Комментарий: отличительная особенность ангинозного приступа при ИМ — слабая
реакция или отсутствие реакции на нитроглицерин . Тем не менее, если
ангинозный приступ не ослабевает через несколько минут после прекращения
действия провоцирующего фактора (физическая нагрузка) или если он
развился в покое, пациенту следует принять нитроглицерин в дозе 0,4–0,5
мг в виде таблеток под язык или аэрозоля (спрея). Если симптомы не
исчезают через 5 мин, а препарат удовлетворительно переносится, можно
использовать его повторно. Если боль в или дискомфорт грудной клетке
сохраняются в течение 5 мин после повторного приема нитроглицерина,
необходимо немедленно вызвать СМП. Если 2–3 приема нитроглицерина не
уменьшают интенсивность приступа, дальнейший прием не имеет смысла. В
связи с опасностью гипотонии постоянно контролируют АД.
Помимо
обезболивания, морфин** способствует уменьшению страха, возбуждения,
снижает симпатическую активность, увеличивает тонус блуждающего нерва,
уменьшает работу дыхания, вызывает расширение периферических артерий и
вен (последнее особенно важно при отеке легких). Доза, необходимая для
адекватного обезболивания, зависит от индивидуальной чувствительности,
возраста, размеров тела. Перед использованием 10 мг морфина** разводят как
минимум в 10 мл 0,9% раствора натрия хлорида** . Первоначально следует
ввести в/в медленно 2–4 мг лекарственного вещества. При необходимости
введение повторяют каждые 5–15 мин по 2–4 мг до
купирования боли или возникновения побочных эффектов, не позволяющих
увеличить дозу.
Назначение
морфина** приводит к замедлению и ослаблению основного эффекта
антиагрегантов (клопидогрел** , тикагрелор** , прасугрел), что может
отразиться на результатах лечения у некоторых пациентов [115–117].
При использовании морфина** возможны следующие осложнения:
-
выраженная артериальная гипотензия;
устраняется в горизонтальном положении в сочетании с поднятием ног (если
нет отека легких). Если этого недостаточно, в/в капельно вводится 0,9%
раствор натрия хлорида** . В редких случаях — адрено- и
допамин-стимуляторы; -
выраженная
брадикардия в сочетании с артериальной гипотензией; устраняется
атропином (в/в 0,5–1,0 мг); -
тошнота, рвота; устраняются производными
фенотиазина, в частности, метоклопрамидом (в/в 5–10 мг); -
выраженное
угнетение дыхания; устраняется налоксоном (в/в 0,1–0,2 мг, при
необходимости повторно каждые 15 мин), при этом уменьшается и
анальгезирующее действие препарата.
Опиаты могут ослаблять перистальтику кишечника и приводить к запорам.
Препараты этой группы снижают тонус мочевого пузыря и затрудняют
мочевыведение, особенно у мужчин с гипертрофией предстательной железы.
-
При наличии признаков выраженного беспокойства и возбуждения для их
устранения у пациентов с ИМпST рекомендуется назначение транквилизаторов
[36].
ЕОК IIaC (УУР С; УДД 5)
Комментарий: для уменьшения страха обычно достаточно создать спокойную
обстановку и ввести наркотический анальгетик. При выраженном возбуждении
могут потребоваться транквилизаторы (например, диазепам** в/в 2,5–10 мг).
Важное значение для эмоционального комфорта пациента имеют
соответствующий стиль поведения персонала, разъяснение диагноза,
прогноза и плана лечения. У пациентов с сохраняющимся беспокойством и
нарушенным поведением, а также симптомами отмены при никотиновой
зависимости, также можно назначить транквилизаторы. При возбуждении и
делирии достаточно эффективно и безопасно в/в введение галоперидола** .
3.2.2 Коррекция гипоксемии
-
Пациентам с ИМпST при наличии гипоксемии (SaO2 < 90% или PaO2 < 60 мм
рт.ст.) для ее устранения показано ингаляторное введение кислорода
(оксигенотерапия) [36].
ЕОК IC (УУР С; УДД 5)
Комментарий: дыхание кислородом проводят через носовые
катетеры со скоростью 2–8 л/мин. Контролируют насыщение крови
кислородом, измеряя сатурацию неинвазивно или оценивая показатели
кислотно-основного состояния крови лабораторно.
-
Из-за отсутствия положительных эффектов на течение болезни ингаляторное
введение кислорода (оксигенотерапия) не показано пациентам с ИМпST с
уровнем сатурации крови кислородом выше 90% [118].
ЕОК IIIB (УУР А; УДД 2)
Комментарий: ингаляторное введение кислорода (оксигенотерапия)
не только не приносит пользы пациентам с неосложненным ИМ, но может быть
вредно, что предположительно обусловлено увеличением повреждения
миокарда [119].
3.2.3 Нитраты
-
Из-за отсутствия доказательств эффективности рутинное назначение
нитратов в виде внутривенной инфузии, трансдермально или перорально, при
ИМпST не рекомендуется [120, 212].
ЕОК IIIB (УУР А; УДД 2)
Комментарий: внутрь нитраты при ИМ назначают только по
показаниям, к которым прежде всего относят постинфарктную стенокардию.
Иногда нитраты назначают по поводу сердечной недостаточности, хотя для
этой цели лучше подходят ингибиторы АПФ. Для профилактики толерантности
к нитратам их назначают прерывисто: промежуток времени между последним
приемом препарата и первым приемом на следующий день должен быть не
менее 12 ч (оптимально — 16 ч).
-
Внутривенная
инфузия нитратов (нитроглицерина** или изосорбида динитрата** )
рекомендуется для симптоматического лечения у пациентов с ИМпST и
продолжающейся ишемией миокарда, артериальной гипертензией, СН. Условие:
отсутствие противопоказаний (артериальная гипотония, ИМ ПЖ,
использование ингибиторов фосфодиэстеразы V в предшествующие 48 часов)
[36, 317, 318, 319, 333].
ЕОК IC (УУР B; УДД 2)
Комментарий: критерий адекватно подобранной скорости введения (дозировки) при
в/в инфузии нитратов — уровень систолического АД, который должен быть
снижен на 10–15% у нормотоников и на 25–30% у лиц с АГ, но не ниже 100
мм рт. ст. Обычная начальная скорость введения нитроглицерина** 10
мкг/мин. При ее неэффективности скорость инфузии увеличивается на 10–15
мкг/мин каждые 5–10 мин, пока не будет достигнут желаемый эффект. Если
достичь целевого уровня снижения АД не удается, даже увеличив скорость
инфузии нитроглицерина до 200 мкг/мин, то дальнейшее увеличение дозы не
имеет смысла. Оптимальная продолжительность инфузии нитратов — не более
24–48 ч, т.к. в дальнейшем часто развивается толерантность. При развитии
гипотонии обычно достаточно прекратить инфузию нитроглицерина** , так как
у препарата короткий период полувыведения. Реже приходится проводить
стандартные мероприятия по увеличению притока крови к сердцу (приподнять
нижние конечности; возможно в/в введение 0,9% раствора натрия хлорида** ,
адрено- и допамин-стимуляторы). Противопоказанием к назначению нитратов
является выраженная гипотония — систолическое АД <90 мм.рт.ст. При
появлении головной боли назначают анальгетики и кофеинсодержащие
препараты.
3.2.4 Бета-адреноблокаторы
-
Пациентам с ИМпST с высоким АД, сохраняющейся ишемией миокарда,
тахикардией, не имеющим признаков острой СН, для контроля за ишемией
рекомендуется внутривенное введение бета- адреноблокатора [122, 123].
ЕОК IIa B (УУР А; УДД 2).
Комментарий: первоначальная доза может быть введена в/в,
особенно у пациентов с АГ, сохраняющейся ишемией, тахикардией при
отсутствии признаков СН с последующим переходом на прием препаратов
внутрь. Есть данные, что польза от β-адреноблокаторов тем выше, чем
раньше начата терапия и чем быстрее проявляется их действие. Препараты и
дозы для в/в введения — см. Приложение Г8.
-
Всем пациентам с ИМпST, не имеющим противопоказаний, для снижения риска
осложнений ИМ и улучшения прогноза рекомендуется пероральный прием
бета-адреноблокаторов [124].
ЕОК IIaB (УУР В; УДД 1)
Комментарий: Убедительные данные об улучшении прогноза при
назначении бета-адреноблокаторов у пациентов с ОКСпST были получены в
основном в дореперфузионную эру.
Польза рутинного назначения бета-адреноблокаторов у пациентов, которые
подверглись первичной ЧКВ, на основании РКИ и системных метаанализов не
показана [125–128].
Вместе с тем результаты некоторых регистров говорят о том, что
назначение бета-адреноблокаторов приводит к улучшению прогноза [129,
130]. Гемодинамически стабильным пациентам с ИМпST бета- адреноблокаторы
могут быть назначены в первые 24 ч после начала болезни. В ранние сроки
ИМпST важнейшее значение имеет выбор приемлемой дозы препарата, которая
не должна быть слишком большой при опасности возникновения осложнений
(прежде всего — наличии СН). О достаточности дозы обычно судят по
достигнутой ЧСС. Она не должна быть ниже 44–46 ударов в 1 мин в ночные
часы в покое. Абсолютные противопоказания к использованию
бета-адреноблокаторов при ИМпST: кардиогенный шок, тяжелая обструктивная
болезнь легких в стадии обострения, атриовентрикулярная (АВ) блокада
II–III ст. у пациентов без функционирующего искусственного водителя
ритма сердца, аллергия. Относительные противопоказания: клинические
проявления СН, свидетельства наличия низкого сердечного выброса,
систолическое АД <100 мм рт. ст., ЧСС <60 ударов в 1 мин, удлинение
интервала PQ >0,24 сек, обструктивная болезнь легких в анамнезе, наличие
факторов риска возникновения кардиогенного шока. У пациентов с
существенным нарушением сократимости ЛЖ начинать лечение следует с
минимальных доз бета-адреноблокаторов. Через 24–48 ч после исчезновения
выраженной брадикардии, артериальной гипотензии, тяжелой СН, АВ-блокады
можно начать аккуратное титрование дозы препаратов для приема внутрь.
При наличии исходных противопоказаний к бета-адреноблокаторам
возможность их назначения следует регулярно пересматривать. Следует
воздержаться от назначения бета- адреноблокаторов с внутренней
симпатомиметической активностью.
-
Для уменьшения риска смерти при ИМпST с СН или сниженной ФВ ЛЖ (<40%)
рекомендуется пероральный прием бета-адреноблокаторов без внутренней
симпатомиметической активности [131, 132].
ЕОК IA (УУР A; УДД 1)
Комментарий: изученными у пациентов с ИМ считаются метопролол** и карведилол** .
3.2.5 Блокаторы кальциевых каналов
-
Из-за отсутствия доказательств эффективности у пациентов с ИМпST не
рекомендуется рутинное назначение блокаторов кальциевых каналов [133,
134].
ЕОК IIIA (УУР А; УДД 1)
Комментарий: в связи с
возможностью неконтролируемой гипотонии следует избегать назначения
нифедипина короткого действия у пациентов с ИМ [135].
-
При непереносимости бета-адреноблокаторов
для контроля за ишемией миокарда рекомендуется рассмотреть назначение
верапамила у пациентов с ИМпST без СН, без сниженной ФВ ЛЖ и без других
противопоказаний [133].
ЕОК IIb B (УУР В; УДД 2)
Комментарий: дилтиазем, верапамил и дигидропиридиновые производные (амлодипин )
можно назначать пациентам с постинфарктной стенокардией при
недостаточной эффективности бета-адреноблокаторов и нитратов или при
невозможности контролировать артериальную гипертонию другими средствами.
Дилтиазем и верапамил иногда используют для контроля сердечного ритма,
реже — для курирования суправентрикулярных аритмий в случае
неэффективности/противопоказаний к бета-адреноблокаторам. Верапамил или
дилтиазем могут использоваться только при отсутствии симптомов СН и/или
существенной сократительной дисфункции ЛЖ, нарушений синоатриальной и АВ
проводимости и брадиаритмий. Совместный прием верапамила или дилтиазема
с бета-адреноблокатором крайне нежелателен.
3.2.6 Блокаторы ренин-ангиотензин-альдостероновой системы
Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы
рецепторов ангиотензина II (БРА)
-
Для предотвращения дисфункции ЛЖ, СН и смерти рекомендуется применение
ингибитора АПФ у всех пациентов с ИМпST, не имеющих противопоказаний
[136].
ЕОК IIa A (УУР B; УДД 2)
-
Для снижения риска смерти и развития/прогрессирования СН рекомендуется
раннее (в первые 24 часа ИМпST) назначение ингибиторов АПФ у пациентов с
СН, сниженной ФВ ЛЖ, сахарным диабетом или ИМ передней локализации [136,
137].
ЕОК IA (УУР A; УДД 1)
Комментарий: у пациентов со стабильной гемодинамикой
назначение ИАПФ в первые 24ч от начала заболевания безопасно [138].
Следует постепенно увеличивать дозу ИАПФ до рекомендуемой (целевой),
которая по данным клинических исследований обеспечивает положительное
влияние на прогноз, а если это невозможно — до максимально переносимой
(Приложение Г8). Противопоказания для начала использования ИАПФ:
систолическое АД <100 мм рт. ст., выраженная почечная недостаточность,
гиперкалиемия, двусторонний стеноз почечных артерий, беременность,
индивидуальная непереносимость.
-
У пациентов с ИМпST, имеющих СН, сниженную ФВ ЛЖ или АГ в случае
непереносимости ИАПФ для лечения СН, снижения риска смерти и
прогрессирования СН рекомендуется использовать БРА, предпочтительно —
валсартан** [139]
ЕОК IB (УУР B; УДД 2)
Комментарий: начальная доза валсартана** составляет 20 мг/сут;
при хорошей переносимости дозу препарата постепенно увеличивают вплоть
до 160 мг 2 раза в сутки.
-
У пациентов, переживших ИМпST и имеющих
явную хроническую СН и ФВ ЛЖ менее 35%, для снижения риска смерти и
необходимости госпитализации из-за СН рекомендуется замена ИАПФ (или
БРА), принимаемого в максимальной переносимой дозе, на
сакубитрил/валсартан** [140].
ЕОК IIaB (УУР -B; УДД 2).
Комментарии: для предлагаемой замены СН должна быть подтверждена
повышенным уровнем мозгового натрийуретического пептида (≥150 пг/мл) или
его N- концевого фрагмента (≥600 пг/мл). Пациент должен находиться на
стабильных дозах бета-блокатора, ИАПФ или БРА не менее 4-х недель, иметь
уровень калия крови
менее 5,2 ммоль/л, систолическое АД ≥100 мм рт.ст. и расчетную СКФ≥30
мл/мин/1,72 м2. Сакубитрил/
валсартан** назначается в дозе 200 мг 2
раза в день. В ходе лечения обязателен контроль за АД и уровнем калия.
-
Для снижения риска смерти и прогресисрования СН рекомендуется
использовать альдостерона антагонисты, предпочтительно эплеренон, в
добавление к бета-адреноблокатору и ингибитору АПФ у пациентов с ИМпST и
ФВ ЛЖ ≤40% в сочетании с СН или с сахарным диабетом при условии, что нет
почечной недостаточности и гиперкалиемии [141]
ЕОК IIaB (УУР А; УДД 2)
Комментарий: предпочтительно
назначать эплеренон в первые сутки от начала ИМ [142]. Есть указания на
снижение риска смерти при альдостерона антагонистов, в том числе
спиронолактона , у всех пациентов ИМпST при отсутствии противопоказаний
и независимо от наличия сердечной недостаточности и сниженной ФВ ЛЖ
[143, 144]. При таком подходе предпочтительно назначать альдостерона
антагонист в пределах 72 часов от начала ИМ. Противопоказания к
назначению альдостерона антагонистов: уровень креатинина в крови у
мужчин >220 мкмоль/л, у женщин >175 мкмоль/л, а также концентрация калия
более 5 ммоль/л. Во время лечения альдостерона антагонистами
контролируют уровень креатинина и калия крови. Если уровень калия в
крови превышает 5,5 ммоль/л, препараты отменяют. Рекомендуется
поддерживать концентрацию калия в крови в диапазоне 4,0–5,0 ммоль/л.
3.2.7 Липидснижающая терапия
-
Для снижения суммарного риска ишемических событий у пациентов с ИмпST
рекомендуется в период госпитализации начать лечение ингибитором
ГМГ-КоА-редуктазы в высокой дозе (вне зависимости от исходного уровня
холестерина). Условие — отсутствие противопоказаний [145–149].
ЕОК IA (УУР A; УДД 1)
Комментарий: у пациентов с ИМпST, подвергнутых первичному ЧКВ,
имеются многочисленные доказательства дополнительного снижения риска
ишемических событий и даже смерти при использовании высоких доз
ингибиторов ГМГ-КоА-редуктазы, применение которых начато до ЧКВ (при
сравнении с использованием ингибиторов ГМГ-КоА-редуктазы с началом их
применения на более поздних этапах госпитализации) [150–157].
Терапия ингибиторами ГМГ-КоА-редуктазы обычно хорошо переносится,
частота серьезных побочных эффектов не превышает 2%. Возможно появление
миалгии и мышечной слабости, которые появляются в основном в первые
недели после начала терапии и обычно быстро проходят после отмены
ингибитора ГМГ-КоА-редуктазы. Рабдомиолиз с повышением уровня
креатинкиназы более чем в 10 раз наблюдается крайне редко. Возможно
бессимптомное повышение уровня трансаминаз в 3 и более раза, что требует
снижениия дозы или отмены препарата с дальнейшим наблюдением за
активностью печеночных трансаминаз. Следует помнить, что в острую фазу
ИМ повышение уровня трансаминаз обусловлено некрозом кардиомиоцитов и не
является причиной для отказа от назначения ингибиторов
ГМГ-КоА-редуктазы. Основные противопоказания для назначения ингибиторов
ГМГ-КоА-редуктазы: повышенная чувствительность; активное заболевание
печени или повышение активности печеночных трансаминаз в плазме крови
неясного генеза более чем в 3 раза по сравнению с верхней границей
нормы; женщины детородного возраста, не использующие адекватные методы
контрацепции; беременность; период грудного вскармливания.
Рекомендуется применение ингибиторов
ГМГ-КоА-редуктазы с наиболее выраженным гиполипидемическим действием, в
частности аторвастатина** в суточной дозе 40–80 мг или розувастатина в
суточной дозе 20–40 мг [158, 159].
-
При ИМпST рекомендуется как можно быстрее выполнить биохимический анализ
крови по оценке нарушений липидного обмена, предпочтительно в первые 24
ч. после госпитализации, для последующего сопоставления с уровнями
липидов, достигнутыми при использовании гиполипидемических лекарственных
средств [36].
ЕОК IC (УУР С; УДД 5)
-
У пациентов, перенесших ИМпST, рекомендуется поддерживать уровень ХС ЛНП
< 1,4 ммоль/л и добиваться его снижения как минимум на 50% от исходных
значений ХС ЛНП для обеспечения максимального эффекта по снижению риска
повторных ишемических событий [160, 161, 162, 165, 166].
ЕОК IA (УУР А; УДД 1)
Комментарий: Рекомендуется определить уровень ХС ЛНП в крови
через 4–6 недель после начала лечения для оценки эффективности терапии
ингибитором ГМГ-КоА-редуктазы, определения необходимости увеличения его
дозы и/или добавления гиполипидемических препаратов с другим механизмом
действия (эзетемиб и/или ингибитор пропротеиновой конвертазы
субтилизин-кексинового типа 9 (АТХ-группа — другие гиполипидемические
средства)) [161, 162].
-
Если у пациента после ИМпST при использовании максимально переносимой
дозы ингибитора ГМГ-КоА- редуктазы концентрация ХС ЛПН в крови остаётся
повышенной, рекомендуется добавить к ингибитору ГМГ- КоА-редуктазы
эзетимиб для дополнительного снижения уровня ХС ЛПН в крови и риска
ишемических событий [164].
ЕОК IIaB (УУР B; УДД 2)
-
Если у пациента после ИМпST при использовании максимально переносимой
дозы ингибитора ГМГ-КоА- редуктазы в сочетании с эзетимибом концентрация
ХС ЛПН в крови остаётся повышенной, рекомендуется добавить препарат из
группы блокаторов пропротеиновой конвертазы субтилизин-кексинового типа
9 (АТХ-группа —
другие гиполипидемические средства) (алирокумаб** или эволокумаб** ) для
дополнительного снижения уровня ХС ЛПН в крови и риска ишемических
событий [165, 166].
ЕОК IB (УУР А; УДД 2)
Комментарий: если на фоне терапии ингибиторами
ГМГ-КоА-редуктазы в максимально переносимых дозах уровень холестерина
ЛПНП остается значительно повышенным (> 2,5ммоль/л), можно рассмотреть
блокаторы пропротеиновой конвертазы субтилизин-кексинового типа 9
(АТХ-группа — другие гиполипидемические средства) без предварительного
применения эзетимиба.
-
У пациентов
после ИМпST с непереносимостью ингибиторов ГМГ-КоА-редуктазы для
достижения целевых значений холестерина ЛПНП рекомендуется использовать
эзетемиб и/или препарат из группы блокаторов пропротеиновой конвертазы
субтилизин-кексинового типа 9 (алирокумаб** или эволокумаб** ) (АТХ-группа —
другие гиполипидемические средства) [36].
ЕОК IIbB (УУР C; УДД 5).
3.2.8 Антитромботическая терапия
3.2.8.1. Антитромбоцитарные препараты (антиагреганты)
-
Для снижения риска смерти, сосудистой
смерти, повторного ИМ и ишемического инсульта рекомендуется длительный
(неопределенно долгий) прием АСК** всем пациентам с ИМпST, не имеющим
противопоказаний, вне зависимости от исходной стратегии реперфузии [82].
ЕОК IA (УУР А; УДД 1)
Комментарий: _у пациентов, в предшествующую неделю регулярно не принимавших АСК**
, рекомендуется начальная (нагрузочная) доза — 150–325 мг; постоянная
поддерживающая доза АСК** — 75–100 мг 1 раз в сутки.
-
Всем пациентам с ИМпST, не имеющим
высокого риска кровотечений, в добавление к АСК** на протяжении 12 месяцев
рекомендуется прием блокатора Р2Y12-рецептора тромбоцитов (для снижения
суммарного риска смерти, ИМ и ишемического инсульта) [98, 167].
ЕОК IA (УУР А; УДД 2)
-
У пациентов
с ИМпST после первичного ЧКВ для снижения суммарного риска (смерти и
ИМ), риска тромбоза стента в добавление к АСК** при отсутствии
противопоказаний (внутричерепное кровоизлияние в анамнезе,
продолжающееся кровотечение) рекомендуется тикагрелор** (нагрузочная доза
— 180 мг, поддерживающая
— 90 мг 2 раза в сутки в течение 12 месяцев) [94].
ЕОК IIaB (УУР А; УДД 2)
-
При
коронарном стентировании у пациентов с ИМпST, не получавших других
ингибиторов Р2Y12— рецептора тромбоцитов , в добавление к АСК** для
снижения риска смерти и суммы ишемических событий (смерть, ИМ, инсульт),
риска тромбоза стента рекомендуется прасугрел (нагрузочная доза — 60 мг,
ежедневная поддерживающая доза — 10 мг в течение 12 месяцев), если нет
противопоказаний (внутричерепное кровоизлияние в анамнезе, ишемический
инсульт / ТИА в анамнезе, продолжающееся кровотечение) [95].
ЕОК IIaB (УУР А; УДД 2)
Комментарии: у пациентов старше 75 лет, с массой тела ниже 60 кг
необходимо снизить суточную дозу прасугрела до 5 мг.
При выборе
блокатора P2Y12-рецепторов тромбоцитов (АТХ -группа — антиагреганты,
кроме гепарина) у пациентов с ИМпST, подвергнутых перивчному ЧКВ,
следует знать о результатах прямого сравнения тикагрелора** и прасугрела
(у пациентов с ИМпST, подвергнутых первичному ЧКВ) в исследовании
PRAGUE-18 (не выявившего преимущества одного препарата перед другим на
уровне ишемических и геморрагических событий за 7 и 30 дней наблюдения)
[168] и в исследовании ISAR-REACT5, в котором у пациентов с ОКС (более
40% из них — с ИМпST), подвергнутых ЧКВ, где показано преимущество
прасугрела над тикагрелором** на уровне суммарной частоты развития
ишемических событий (сумма случаев смерти, ИМ или инсульта за 12
месяцев) без убедительных различий в частоте крупных кровотечений
[169].
-
Пациентам с
ИМпST, которые не могут получать тикагрелор** или прасугрел, для
возможного снижения суммарного риска смерти, ИМ и инсульта и риска
тромбоза стента в добавление к АСК** рекомендуется
клопидогрел** (нагрузочная доза — 300–#600
мг, поддерживающая — 75 мг 1 раз в сутки) [170].
ЕОК IIа B (УУР А; УДД 2)
Комментарий: нагрузочная доза клопидогрела**
#600 мг используется в случаях, когда выполняется ЧКВ, 300 мг —
при ТЛТ. Считается необходимым воздерживаться от нагрузочной дозы
клопидогрела** у пациентов с ИМпST старше 75 лет, получивших ТЛТ. При
выполнении ЧКВ величина нагрузочной дозы клопидогрела** не имеет
возрастных ограничений.
Для прогнозирования пониженной лабораторной чувствительности к
клопидогрелу** возможно проведение фармакогенетического тестирования по
CYP2C19.
-
Для предотвращения ретромбоза начинать использование ингибитора
Р2Y12-рецептора тромбоцитов у пациентов с ИМпST рекомендуется перед ТЛТ
и перед или во время ЧКВ [36].
ЕОК IC (УУР С; УДД 5)
-
У пациентов с ИМпST для снижения риска
ишемических событий рекомендуется продолжать ДАТТ (сочетание АСК** с
блокатором Р2Y12-рецептора тромбоцитов) на протяжении 12 месяцев
независимо от стратегии реперфузии, методики ЧКВ и типа установленных
стентов***, при условии, что у пациента нет исходно очевидного высокого
риска кровотечений [98, 167]
ЕОК IA (УУР А; УДД 1)
-
При повышенном риске кровотечений
рекомендуемая длительность ДАТТ (сочетание АСК** с блокатором Р2Y12
рецептора тромбоцитов) у пациентов, перенесших ИМпST, для снижения этого
риска может быть меньше 12 месяцев [171, 172].
ЕОК IIа A (УУР А; УДД 1)
Комментарий: досрочное прекращение ДАТТ увеличивает частоту коронарных
осложнений. Частой причиной досрочного прекращения приема одного или
обоих компонентов ДАТТ являются кровотечения и необходимость в
хирургическом вмешательстве. Минимальная длительность ДАТТ после
установки стентов*** составляет 1 месяц для СБЛП*** и 3 месяца — для
современных СВЛ*** . В случае необходимости отменить блокатор P2Y12-
тромбоцитов из-за хирургического вмешательства крайне желательно
реализовать это вмешательство в условиях многопрофильного стационара с
возможностью проведения ЧКВ в случае возникновения периоперационного
тромбоза стента и ИМ.
При
необходимости экстренной несердечной хирургической операции или
серьезном кровотечении лечение ингибиторами Р2Y12-рецептора тромбоцитов
следует прекратить и возобновить при первой возможности после устранения
причин кровотечения. При высоком риске рецидива кровотечения минимальный
срок двойной антитромбоцитарной терапии составляет 1 месяц после
установки СБЛП*** и 3 месяца — после установки современных типов СВЛ***.
Если прерывание ДАТТ является абсолютно
необходимым, следует иметь в виду, что альтернативного более безопасного
варианта профилактики тромбоза стентов*** нет. По мере возможности АСК**
следует продолжить, так как отмена обоих препаратов еще больше повышает
риск тромбоза.
Тикагрелор**
следует отменить как минимум за 3 дня, клопидогрел** — как минимум за 5
дней, прасугрел — как минимум за 7 дней до планового хирургического
вмешательства. При отсутствии возможности выдержать указанные сроки
решение об оперативном лечении следует принимать консилиумом врачей
разных специальностей, который должен оценить риски кровотечения и
отмены двойной антитромбоцитарной терапии, а также учесть тип
хирургического вмешательства, риск рецидива ишемии миокарда, степень
поражения коронарных артерий, время, прошедшее от начала ИМ и ЧКВ,
характеристику установленных стентов***. О последствиях преждевременного
прерывания двойной антитромбоцитарной терапии следует помнить и у
пациентов с ИМпST, не получивших реперфузионного лечения. При
хирургических вмешательствах с низким риском кровотечения не следует
досрочно прерывать ДАТТ.
-
У пациентов с ИМпST, подвергнутых коронарному стентированию, с высоким
коронарным риском и низким риском кровотечений, не имевших кровотечений
в течение первого года лечения, для снижения риска смерти, повторного
ИМ, суммарного риска ишемических событий рекомендуется продление ДАТТ
(сочетание АСК** с блокатором Р2Y12 рецептора
тромбоцитов) на более длительный срок [173]. При этом в ходе
наблюдения за пациентом соотношение риска и пользы продления ДАТТ должно
регулярно пересматриваться.
ЕОК IIaB (УУР В; УДД 1)
-
У
пациентов, перенесших ИМ, с сохраняющимся высоким коронарным риском, не
имевших кровотечений в первый год ДАТТ (сочетание АСК** с блокатором
Р2Y12-рецептора тромбоцитов), для снижения суммарного риска ишемических
событий рекомендуется продление ДАТТ в виде сочетания АСК** с уменьшенной
дозой тикагрелора** (60 мг 2 раза в сутки) на дополнительные 36 месяцев
[174, 175].
ЕОК IIbB (УУР В; УДД 2)
Комментарий: к пациентам, перенесшим ИМ и имеющим высокий коронарный риск, относят лиц ³50 лет в сочетании как минимум с одним из следующих факторов риска: возраст ³65 лет, наличие СД, требующего медикаментозного лечения, два и более перенесенных ИМ в прошлом, многососудистый коронарный атеросклероз, ХБП с рСКФ менее 60 мл/мин/1,73 м2.
-
Для защиты слизистой желудочно-кишечного тракта и для возможного
снижения риска желудочно-кишечных кровотечений в период назначения ДАТТ
рекомендуется использовать ингибиторы протонного насоса [176, 177].
ЕОК IIaB (УУР B; УДД 3)
Комментарий: применение ингибиторов протонного насоса возможно как у всех
пациентов, переживших ИМпSТ и получающих ДАТТ, так и более избирательно
— у пациентов с повышенным риском желудочно- кишечных кровотечений
(язвенная болезнь или желудочно-кишечное кровотечение в анамнезе,
хроническое использование нестероидных противовоспалительных средств или
кортикостероидов, как минимум 2 из следующих признаков — возраст ³65
лет, диспепсия, желудочно-пищеводный рефлюкс, инфицирование Helicobacter
Pylory, хроническое употребление алкоголя). Известно о возможном
ослаблении антитромбоцитарного эффекта клопидогрела** при его сочетании с
омепразолом** или эзомепразолом** на уровне лабораторной оценки активности
тромбоцитов (но не с пантопразолом или рабепразолом). Нет доказательств,
что эти лекарственные взаимодействия оказывают неблагоприятное влияние
на клинические результаты лечения.
-
В некоторых
случаях в первые 12 месяцев после ИМпST для снижения риска кровотечений
рекомендуется рассмотреть переход с прасугрела или тикагрелора** на
клопидогрел** [178–180].
ЕОК IIb A (УУР B; УДД 2)
Комментарий: возможные основания для перехода с прасугрела или тикагрелора** на
клопидогрел** в первые 12 месяцев после ИМпST: появление или повторение
клинически значимых кровотечений, причину которых невозможно выявить
и/или устранить; небольшие повторяющиеся («надоедливые») кровотечения,
источник которых устранить не удается, сказывающиеся на приверженности к
лечению; побочные эффекты тикагрелора** (клинически значимая одышка,
клинические проявления гиперурикемии); появление показаний к длительному
лечению антикоагулянтами (ФП, ТГВ/ТЭЛА, тромб в полости левого
желудочка, имплантация искусственного клапана сердца); возникновение
ишемического инсульта или ТИА у получающих прасугрел; стремление
уменьшить стоимость лечения; желание пациента уменьшить кратность приема
препарата (переход с тикагрелора** на клопидогрел** ) и число принимаемых
таблеток (переход с тикагрелора** /прасугрела на фиксированную комбинацию
АСК** с клопидогрелом**) с целью улучшения приверженности лечению;
ограниченная доступность прасугрела или тикагрелора** , не позволяющая
обеспечить их регулярный прием.
С учетом
риска возникновения тромботических последствий при ИМ и/или ЧКВ при
изменении интенсивности ДАТТ выделяют «острый» период (первые 24 часа),
ранний период (со 2-х по 30-е сутки), поздний (от 31 суток до 12
месяцев) и очень поздний (более 1 года) периоды. Переход с прасугрела
или тикагрелора** на клопидогрел** в острый и ранний периоды крайне
нежелателен.
Предлагаемые
способы перехода с тикагрелора** или прасугрела на клопидогрел**:
1) В первые 30 дней от начала лечения ИМ и/или ЧКВ: прием внутрь #600 мг
клопидогрела** через 24 часа от последнего приема тикагрелора** или
прасугрела. При переходе на клопидогрел** из-за кровотечения или его
опасения следует рассмотреть начало приема клопидогрела** с поддерживающей
дозы (75 мг). В последующем доза клопидогрела** — 75 мг 1 раз в сутки.
2) Спустя 30 дней от начала лечения ИМ
и/или ЧКВ: прием внутрь 75 мг клопидогрела** через 24 часа от
последнего приема прасугрела; прием внутрь #600 мг клопидогрела** через
24 часа от последнего приема
тикагрелора**
. При переходе на клопидогрел** из-за кровотечения или его опасения
следует рассмотреть начало приема клопидогрела** с поддерживающей дозы (75
мг). В последующем доза клопидогрела** — 75 мг 1 раз в сутки.
-
На фоне широкого применения ДАТТ блокаторы ГПР IIb/IIIa при ИМпST
рекомендуются как спасительное средство только для лечения
тромботических осложнений ЧКВ, массивного интракоронарного тромбоза и
при развитии феномена no-reflow [98, 181, 182].
ЕОК IIaB (УУР В; УДД 2)
Комментарий: блокаторы ГПР IIb/IIIa при ИМпST активно
изучались до появления блокаторов Р2Y12— рецепторов тромбоцитов.
Основным осложнением, ограничивающим их применение, являются
кровотечения. Факторами, способствующими передозировке препаратов,
являются старческий и выше возраст, женский пол, почечная
недостаточность, малая масса тела, сахарный диабет, ХСН. Применение
блокаторов ГПР IIb/IIIa может вызывать тромбоцитопению. Блокаторы ГПР
IIb/IIIa в сочетании с ДАТТ должны использоваться вместе
с парентеральным антикоагулянтом. Сочетание блокатора ГПР IIb/IIIa с
бивалирудином в рутинной практике не рекомендуется, поскольку по частоте
ишемических событий оно эквивалентно монотерапии бивалирудином, но
вызывает больше крупных кровотечений.
3.2.8.2. Антикоагулянтная терапия у пациентов с ИМпST
(кроме этого раздела см. «Антитромботическое сопровождение реперфузии»)
-
При ИМпST парентеральное введение антикоагулянтов для снижения риска
тромботических осложнений рекомендуется продолжать максимально до 8
суток (или до выписки, если она произойдет раньше этого срока) или до
успешного завершения ЧКВ, если нет иных показаний к продленной
антикоагулянтной терапии [104, 107].
ЕОК IIb C (УДД 2; УУРА)
Комментарий: У пациентов,
получаюших антагонисты витамина К, рекомендуется воздержаться от
парентерального введения антикоагулянтов (в том числе во время ЧКВ) при
условии, что значение МНО равно или превышает 2,0 (для ЧКВ 2,5). При
меньшем значении МНО рекомендуется стандартный болюс НФГ**.
При ЧКВ у пациентов, получающих прямые пероральные антикоагулянты,
возможно продолжение их приема с дополнительным внутривенным введением
парентерального антикоагулянта во время ЧКВ (в обычной дозе и независимо
от времени, прошедшего после приема прямого перорального
антикоагулянта). Тромболитическая терапия на фоне сохраняющегося эффекта
прямого перорального антикоагулянта нежелательна.
-
Для снижения риска тромботических осложнений фондапаринукс натрия (2,5
мг ежедневно подкожно, первое введение — 2,5 мг внутривенно) при ИМпST
рекомендуется в качестве антикоагулянта для сопровождения ТЛТ с
использованием стрептокиназы и у пациентов, не получивших реперфузионную
терапию [107].
ЕОК IIaB (УУР B; УДД 2)
Комментарий: пациенту, получающему фондапаринукс натрия, во время ЧКВ следует внутривенно вводить НФГ** — первоначальный болюс в дозе 85 МЕ/кг (при одновременном применении блокатора ГПР IIb/IIIa — 60 МЕ/ кг), необходимость повторного введения определяется величиной активированного времени свертывания крови. Фондапаринукс натрия противопоказан при клиренсе креатинина ниже 20 мл/мин.
Бивалирудин
-
При ИМпST применение бивалирудина
(внутривенно болюс 0,75 мг/кг и инфузия 1,75 мг/кг/час) рекомендуется
рассмотреть в качестве альтернативы НФГ** для антитромботической поддержки
ЧКВ, т.е. для снижения риска тромботических осложнений ЧКВ [183–185].
ЕОК IIaA (УУР В; УДД 1)
Комментарии. Бивалирудин — препарат
выбора у пациентов с гепарин-индуцированной тромбоцитопенией. Инфузию
бивалирудина рекомендуется начать одновременно с ЧКВ и продолжать до 4
часов после его завершения. Рекомендация использовать бивалирудин как
альтернативу сочетанию НФГ** с блокатором ГПР IIb/IIIa во время ЧКВ
утратила актуальность, поскольку в условиях широкого распространения
ДАТТ применение блокакторов ГПР IIb/IIIa в основном ограничивается
случаями с тромботическими осложнениями во время ЧКВ.
Нефракционированный гепарин
-
При ИМпST
внутривенная инфузия НФГ** в сопровождение ТЛТ рекомендуется для поддержки
реперфузии (снижения риска тромботических осложнений) в случаях, когда
фондапаринукс натрия и эноксапарин** противопоказаны (в частности, из-за
выраженной почечной недостаточности) [36].
ЕОК IIa C (УУР С; УДД 5)
Комментарий: внутривенная инфузия НФГ** должна осуществляться в дозе,
обеспечивающей удлинение активированного частичного тромбопластинового
времени в 1,5–2,5 выше контрольного для данной лаборатории. При
использовании НФГ** во время ЧКВ рекомендуется ввести внутривенно болюсом
70–100 МЕ/кг (при одновременном применении ингибитора гликопротеиновых
рецепторов IIb/IIIa 50–70 МЕ/кг), необходимость повторного введения
определяется величиной активированного времени свертывания крови.
-
Если ЧКВ при
ИМпST выполняется на фоне начатой внутривенной инфузии НФГ** , во время
процедуры для поддержания должного уровня антикоагуляции рекомендуется
использовать дополнительное внутривенное введение болюсов НФГ** под
контролем активированного времени свертывания крови [186].
ЕОК IIaB (УУР С; УДД 2)
Эноксапарин**
-
Если пациент с ИМпST получал эноксапарин**
до ЧКВ (в связи с ТЛТ), для снижения риска ишемических и геморрагических
осложнений процедуру рекомендуется выполнять на фоне его продолжающегося
применения [89].
ЕОК IIaB (УУР В; УДД 2)
Комментарий: эноксапарин** не
рекомендуется при рСКФ ниже 15 мл/мин/1,73 м2.
-
У
пациентов с ИМпST, с ожидаемыми высоким риском ишемических событий и
низким риском кровотечений, не переносивших в прошлом инсульт или ТИА,
для снижения риска смерти, снижения суммарного риска смерти, ИМ,
инсульта и риска тромбоза коронарных стентов*** к сочетанию АСК** и
клопидогрела** после завершения лечения парентеральным антикоагулянтом
рекомендуется добавить ривароксабан** в дозе 2,5 мг 2 раза в сутки сроком
на 1 год [187].
ЕОК IIa B (УУР В; УДД 2)
Комментарий: добавление ривароксабана** в дозе 2,5 мг 2 раза в сутки не изучено в
комбинации с двойной антитромбоцитарной терапией, в состав которой
входят прасугрел или тикагрелор** . Данный подход не может использоваться
у пациентов, нуждающихся в использовании более высоких доз пероральных
антикоагулянтов (в частности, при наличии ФП с повышенным риском
инсульта). При присоединении к ДАТТ ривароксабана** в дозе 2,5 мг 2 раза в
день следует потенциальное увеличение риска кровотечений, прежде всего
внутричерепных.
-
У
пациентов, перенесших ИМ, с сохраняющимся высоким коронарным риском,
получающих АСК** без блокатора Р2Y12-рецептора тромбоцитов, в рамках
вторичной профилактики (для снижения суммарного риска ишемических
событий и риска смерти) рекомендуется присоединение к АСК** ривароксабана**
в дозе 2,5 мг 2 раза в день на неопределенно долгое время [188, 189].
ЕОК IIa B (УУР В; УДД 2)
Комментарий: к пациентам, перенесшим ИМ, имеющим достаточный
для предлагаемого вмешательства риск сердечно-сосудистых событий,
относят лиц ³65 лет или моложе, но в сочетании с документированным
поражением или вмешательством в двух сосудистых бассейнах, или в
сочетании с как минимум двумя
факторами риска: курение, сахарный диабет, нарушение функции почек с
рСКФ менее 60 мл/мин/1,73 м2 ,
нетяжелая
СН (ФВ ЛЖ > 30% и класс по NYHA I–II), нелакунарный ишемический инсульт
(более месяца до назначения ривароксабана** ). Не подходят для длительного
совместного использования АСК** и низкой дозы ривароксабана** пациенты с
высоким риском кровотечения, недавним инсультом, геморрагическим и
лакунарным инсультом в прошлом, с тяжелой сердечной недостаточностью (ФВ
ЛЖ < 30% или класс по NYHA
III–IV), с рСКФ менее 15 мл/мин/1,73 м2,
нуждающиеся в ДАТТ, лечении антиагрегантом, отличным от АСК**,
или в использовании лечебных доз антикоагулянтов по другим показаниям.
3.2.8.3. Антитромботическая терапия у пациентов с ИМпST, нуждающихся в длительном использовании антикоагулянтов
-
Пациенты c ИМпST, развившимся на фоне терапии пероральным
антикоагулянтом, из-за неприемлемого риска кровотечений не должны
получать ТЛТ [36].
ЕОК IIIC (УУР С; УДД 5)
-
При
необходимости в длительном использовании пероральных антикоагулянтов у
пациентов с ИМпST, подвергнутых коронарному стентированию***, длительность
применение сочетания перорального антикоагулянта с АСК** и клопидогрелом**
(тройная антитромботическая терапия) для уменьшения риска
геморрагических осложнений рекомендуется ограничить несколькими днями
(1–7 дней), с последующей отменой АСК** . Двойная антитромботическая
терапия (пероральный антикаогулянт и клопидогрел** ) применяется до 12
месяцев, после чего клопидогрел** отменяется, продолжается «монотерапия»
пероральным антикоагулянтом в целевой для профилактики
тромбоэмболических событий (у пациентов с ФП) дозе [190–194].
ЕОК IIaB (УУР В; УДД 2)
Комментарий: показания к
длительному применению антикоагулянтов — ФП в сочетании с умеренным/
тяжелым митральным стенозом; неклапанная ФП с суммой баллов по шкале
CHA2DS2-VASc ≥2 у мужчин или ≥3 у женщин; ТГВ/ТЭЛА, требующие лечения
антикоагулянтами; тромб в ЛЖ; механические протезы клапанов сердца*** .
Данные о возможности ранней отмены АСК**
получены в серии рандомизированных исследований, сравнивавших
геморрагическую безопасность тройной и двойной антитромботической
терапии у пациентов нуждавшихся в длительной антикоагуляции (как,
правило из-за наличия ФП) и приеме ДАТТ (из-за ОКС и/или ЧКВ). Двойная
антитромботическая терапия в абсолютном большинстве случаев состояла из
антикоагулянта и
клопидогрела** . В каждом исследовании
были представлены пациенты с ИМпST, в том числе подвергнутые ЧКВ. В
каждом из этих исследований удалось показать снижение риска кровотечений
при использовании сочетания антикоагулянта и одного антиагреганта при
сравнении с «тройной» антитромботической терапией. В каждом отдельном
исследовании и в их метаанализе это снижение риска зарегистрировано как
минимум без увеличения риска эмболических и ишемических событий.
-
Для снижения
риска кровотечений при необходимости в длительном использовании
пероральных антикоагулянтов у пациентов с ИМпST, подвергнутых
коронарному стентированию*** , использование двойной антитромботической
терапии, состоящей из перорального антикоагулянта и клопидогрела** ,
рекомендуется в случаях, когда риск кровотечений превосходит риск
коронарных осложнений [190–194].
ЕОК IIаB (УУР В; УДД 1)
Комментарий: Показания к
длительному применению антикоагулянтов — ФП в сочетании с умеренным/
тяжелым митральным стенозом; неклапанная ФП с суммой баллов по шкале
CHA2DS2-VASc ≥2 у мужчин или ≥3 у женщин; ТГВ/ТЭЛА, требующие лечения
антикоагулянтами; тромб в ЛЖ; механические протезы клапанов сердца.
Переход
на двойную антитромботическую терапию (отмена АСК** , продолжение приема
сочетания перорального антикоагулянта с клопидогрелом**) рекомендуется
через несколько дней после коронарного стентирования , обычно — при
выписке из стационара. Данные о безопасности раннего перехода на двойную
антитромботическую терапию у всех пациентов с ОКС, а также у имеющих
наиболее высокий риск коронарных и кардиоэмболических осложнений,
ограничены.
-
У пациентов с ИМпST и ФП, нуждающихся в сочетании антикоагулянта и
антитромбоцитарных препаратов, для снижения риска кровотечений
рекомендуется использовать ПОАК, а не антагонисты витамина К (АСК**) (если
к ПОАК нет противопоказаний) [191–194, 195–197].
ЕОК IB (УУР А; УДД 1)
Комментарий: данные о
сравнительной эффективности прямых пероральных антикоагулянтов и
варфарина** у пациентов с ИМ ограничены анализом подгрупп в
рандомизированных контролируемых исследованиях.
Целевые значения МНО при использовании антагонистов витамина К в
сочетании с антитромбоцитарными препаратами составляют 2,0–2,5 и могут
быть выше в некоторых клинических ситуациях (у пациентов с механическими
протезами клапанов сердца, при тромбоэмболических осложнениях на фоне
указанных значений МНО). При применении антагонистов витамина К
рекомендуется поддерживать время нахождения МНО в терапевтическом
диапазоне не менее 70%, для сохранения надлежащей эффективности и
снижения риска кровотечений.
-
У пациентов с ИМпST и ФП, нуждающихся в
сочетании антикоагулянта с антитромбоцитарным препаратом, для
предотвращения эмболических событий рекомендуется апиксабан** в дозах,
предназначенных для пациентов с неклапанной ФП, если к нему нет
противопоказаний [193].
ЕОК IIaB (УУР В; УДД 2)
Комментарий: по имеющимся данным, апиксабан** безопаснее варфарина** в составе
двойной и тройной антитромботической терапии при сходной с варфарином**
частоте коронарных осложнений. Рекомендуемой для большинства пациентов
дозой является 5 мг 2 раза в день. Сниженная до 2,5 мг 2 раза в день
доза используется при клиренсе креатинина от 15 до 30 мл/мин или при
наличии двух и более из пречисленных факторов: возраст старше 80 лет,
вес менее 60 кг и уровень креатинина крови выше 133 мкмоль/л.
-
У пациентов с ИМпST и ФП, нуждающихся в сочетании антикоагулянта и
антитромбоцитарных препаратов, для предотвращения эмболических событий
рекомендуется дабигатрана этексилат** в дозе 150 мг 2 раза в сутки или 110
мг 2 раза в сутки, если к нему нет противопоказаний [192].
ЕОК IIaB (УУР-В; УДД 2)
Комментарий: дабигатрана этексилат** в дозах 110 или 150 мг 2 раза в сутки в
составе двойной антитромбоцитарной терапии (в комбинации с клопидогрелом**
) безопаснее тройной антитромботической терапии (сочетание варфарина** ,
клопидогрела** и АСК** ). При этом отмечена тенденция к большей частоте
коронарных событий при использовании дозы дабигатрана 110 мг 2 раза в
сутки. Поэтому в составе двойной антитромботической терапии (в
комбинации с клопидогрелом** ) предпочтительно использовать дабигатрана
этексилат** в дозе 150 мг 2 раза в сутки. Дозу 110 мг 2 раза в сутки в
составе двойной антитромботической терапии можно рекомендовать для
пациентов с преобладающим риском кровотечений, при наличии показаний,
сформулированных в рекомендациях по лечению пациентов с ФП. В составе
тройной антитромботической терапии предпочтительнее доза 110 мг 2 раза в
сутки.
-
У пациентов с ИМпST и ФП, нуждающихся в
сочетании антикоагулянта и антитромбоцитарных препаратов, для
предотвращения эмболических событий рекомендуется ривароксабан** в дозе 15
мг 1 раз в сутки (у пациентов с клиренсом креатинина 30–50 мл/мин — 10
мг 1 раз в сутки), если к нему нет противопоказаний [191].
ЕОК IIa B (УУР В; УДД 2)
Комментарий: ривароксабан** в дозе 15 мг 1 раз в сутки (у пациентов с клиренсом
креатинина 30–50 мл/мин — 10 мг 1 раз в сутки) в комбинации с
клопидогрелом** безопаснее «тройной» антитромботической терапии (сочетание
варфарина** , клопидогрела** и АСК** ).
-
У пациентов с ИМпST, нуждающихся в
длительном использовании пероральных антикоагулянтов, которым не
выполнялось коронарное стентирование** , рекомендуется сочетание одного
антитромбоцитарного препарата с пероральным антикоагулянтом (двойная
антитромботическая терапия) [193].
ЕОК IIaB (УУР B; УДД 2)
Комментарий: в качестве антиагреганта в составе двойной антитромботической
терапии рекомендуется использовать клопидогрел** . Тройная
антитромботическая терапия у пациентов с ОКСпST, которым не выполнялось
коронарное стентирование** , в целом не рекомендуется из-за высокой
частоты кровотечений, но может быть рассмотрена в индивидуальном порядке
у пациентов с низким риском кровотечений и высоким риском коронарных
осложнений. апиксабан** безопаснее варфарина** в составе двойной и тройной
антитромботической терапии у больных с ОКС, которым не проводилось
стентирование** [193].
-
Для уменьшения риска геморрагических осложнений во время ЧКВ у
пациентов, получающих пероральные антикоагулянты, рекомендуется
использовать лучевой доступ [58].
ОК IIa A (УУР А; УДД 2)
-
У пациентов с ИМпST, получающих пероральный антикоагулянт, для
обеспечения геморрагической безопасности лечения не рекомендуется
использовать ингибиторы Р2Y12-рецептора тромбоцитов до получения
результатов коронарной ангиографии и принятия решения о выполнении ЧКВ,
а блокаторы ГПР IIb/IIIa рассматривать только при очевидных
тромботических осложнениях ЧКВ [36].
ЕОК IIIC (УУР С; УДД 5).
-
Для
защиты слизистой желудочно-кишечного тракта и возможного снижения риска
желудочно-кишечных кровотечений на период применения тройной
антитромботической (сочетание перорального антикоагулянта с
клопидогрелом* и АСК*) и двойной антитромботической (сочетание
перорального антикоагулянта с клопидогрелом** или аспирином) рекомендуется
использовать ингибиторы протонного насоса [36].
ЕОК IIbC (УУР С; УДД 5)
Комментарий: возможность ослабления антитромбоцитарного эффекта клопидогрела**
продемонстрирована при его сочетании с омепразолом** или эзомепразолом** ,
но не с пантопразолом или рабепразолом. Нет доказательств, что эти
лекарственные взаимодействия оказывают неблагоприятное влияние на
клинические результаты лечения.
3.2.9 Иное медикаментозное лечение
-
У пациентов с ИМпST при концентрации глюкозы в крови выше 10 ммоль/л
рекомендуется использование сахароснижающих лекарственных средств для
контроля уровня гликемии [200–205].
ЕОК IIaС (УУР B; УДД 2)
Комментарии: Целевой уровень глюкозы в крови при лечении ОКС не
определен и должен выбираться с учетом сопутствующих заболеваний
(допустимы более высокие уровни у пациентов с тяжелыми
сердечно-сосудистыми заболеваниями, в пожилом возрасте, при длительно
существующем сахарном диабете, выраженной сопутствующей патологии).
Следует избегать эпизодов снижения концентрации глюкозы в крови ниже 5
ммоль/ л. При гипергликемии у пациентов с ОКС без предшествующего СД
решить вопрос о наличии СД позволяет измерение гликированного
гемоглобина и решение о проведении сахароснижающей терапии принимается в
зависимости от клинической ситуации, однако при повышении уровня глюкозы
в крови более 10,0 ммоль/л рекомендуется начало сахароснижающей
терапии.
Для достижения целевого уровня гликемии у пациентов с ОКСпST
рекомендуется индивидуализированный подход к выбору сахароснижающих
лекарственных средств [36]. Наличие у пациента с ОКСпST СД 2 типа не
является обязательным показанием к переводу на инсулинотерапию; многие
могут продолжать прием пероральных сахароснижающих препаратов. Если у
пациента с СД 2 типа возникла необходимость в использовании инсулинов,
после стабилизации состояния рекомендуется переход на пероральные
сахароснижающие средства.
Пациенты с ОСКпST без нарушения сознания
и других серьезных осложнений, способные самостоятельно принимать пищу,
могут находиться на подкожной инсулинотерапии при условии, что она
позволяет поддерживать целевой диапазон гликемии и избегать
гипогликемии. Методом выбора для быстрого и управляемого достижения
компенсации углеводного обмена является непрерывная внутривенная инфузия
инсулинов и аналогов быстрого действия, при необходимости — в сочетании
с внутривенной инфузией декстрозы** (Приложение Г3).
-
У пациентов с ИМпST (с сахарным диабетом и без сахарного диабета) из-за
отсутствия доказательств значимого положительного влияния на риск смерти
и нефатальных осложнений не рекомендуется использовать
глюкозо-инсулиновую и глюкозо-инсулиново-калиевую смесь [206].
ЕОК IIIА (УУР А; УДД 1)
-
У пациентов с СД, перенесших ОКСпST, рекомендуется проводить лечение,
направленное на поддержание выбранного совместно с врачом-эндокринологом
индивидуального целевого уровня гликированного гемоглобина (у
большинства пациентов – ниже 7,0%) для снижения риска микро- и
макрососудистых осложнений СД [207].
ЕОК IIaB (УУР B; УДД 3)
-
Нестероидные
противовоспалительные средства (за исключением низких доз АСК** в качестве
антиагреганта и средних доз ACK для лечения перикардита) не
рекомендуются при ИМпST из-за неблагоприятного влияния на риск
сердечно-сосудистых событий [208–210].
ЕОК IIIB (УУР А; УДД 1)
Комментарий: рекомендуется отменить нестероидные
противовоспалительные средства и/или не начинать их использование при
госпитализации с ИМпST.
3.3. Осложнения инфаркта миокарда с подъемом ST и их лечение
Дисфункция миокарда
Дисфункция миокарда является наиболее частым проявлением/осложнением ИМ.
Причиной дисфункции является гибель кардиомиоцитов и/или их оглушение
(станнинг) вследствие ишемии миокарда. Дисфункции ЛЖ может быть
бессимптомной. Выраженная нарушение систолической функции приводит к
клиническим проявлениям СН. Степень дисфункции миокарда ЛЖ является
независимым предиктором смертности. Раннее выявление нарушенной функции
миокарда позволяет своевременно начать лечебные мероприятия по
профилактике развития СН.
-
Пациентам с ИМ рекомендуется срочно выполнить ЭхоКГ для оценки
сократительной функции миокарда ЛЖ [36].
ЕОК IIaC (УУР С; УДД 5)
Сердечная недостаточность
Острая левожелудочковая недостаточность Отек легких
На фоне выраженного снижения систолической функции миокарда ЛЖ и/или
механических осложнений (дисфункция митрального клапана, разрыв
межжелудочковой перегородки) происходит повышение давления крови в
капиллярах малого круга и поступление жидкой компоненты крови из
внутрисосудистого русла в ткань легких. Различают интерстициальный и
альвеолярный отек легких. Характерный клинические признаки отека легких
— тахипноэ и влажные хрипы, часто выслушиваемые на расстоянии.
Регистрируется снижение оксигенации крови. Диагноз можно подтвердить с
помощью рентгенографии грудной клетки и ультразвукового исследования
легких.
-
Рекомендуется для оценки выраженности проявлений сердечной
недостаточности у всех пациентов с ИМпST использовать классификацию
Killip [36, 211, 212].
ЕОК IIaC (УУР C; УДД 5)
Комментарий: классификация Killip приведена в Приложение Г5.
-
У пациентов с ИМ, осложнившимся острой левожелудочковой
недостаточностью, необходимо проводить повторное ЭхоКГ для контроля за
общей и локальной сократительной функцией ЛЖ и для выявления
механических осложнений ИМ [36].
ЕОК IIa C (УУР С; УДД 5)
-
Для улучшения эффективности и безопасности лечения ИМпST с острой
сердечной недостаточностью рекомендуется контроль за состоянием пациента
с постоянным мониторингом сердечного ритма, АД, насыщения крови
кислородом (SaO2) и диуреза [36].
ЕОК IC (УУР С; УДД 5)
-
Для коррекции гипоксемии у пациента с ИМпST и СН рекомендуется
проведение ингаляторного введения кислорода (оксигенотерапия) путем
ингаляции увлажнённого кислорода через маску при SaO2 ниже 90% с
поддержанием SaO2 > 95% [36, 119]
ЕОК IC (УУР С; УДД 5)
Комментарий: при длительно проводимой ингаляторном введении кислорода
(оксигенотерапия) рекомендуется периодическая оценка газового состава
артериальной и венозной крови.
-
Для улучшения эффективности лечения СН у пациентов с ИМпST при тяжелой
дыхательной недостаточности
(SaO2 ниже 90% и тахипноэ выше 25/мин) рекомендуется проведение
неинвазивной масочной ИВЛ с
постоянным положительным давлением в конце выдоха (постоянная или
бифазная вентиляция) [213, 214].
ЕОК IIaB (УУР А; УДД 1)
Комментарий: при проведении неинвазивной ИВЛ рекомендуется
периодическая оценка газового состава артериальной и венозной крови.
-
Для обеспечения полноценной вентиляции легких при лечении СН у пациентов
с ИМпST рекомендуется интубация трахеи и проведение ИВЛ. Условия:
наличие дыхательной недостаточности, сопровождающейся выраженной
гипоксемией, гиперкапнией и ацидозом (при неэффективности неинвазивной
ИВЛ или при ее непереносимости) [36].
ЕОК IIa C (УУР С; УДД 5)
-
При лечении СН у пациентов с ИМпST
рекомендуется в/в введение петлевых диуретиков (фуросемид ) для
уменьшения симптомов СН [36].
ЕОК IIaC (УУР С; УДД 5)
Комментарий: используют в/в болюсное введение фуросемида** . Рекомендуемая
первоначальная доза — 40 мг. При развернутой картине альвеолярного отека
легких, признаках задержки жидкости в организме, почечной
недостаточности начальная доза может быть увеличена до 60–80 мг. При
недостаточной эффективности начальной дозы фуросемида** при повторном
введении она может быть увеличена в 2 раза и более раза.
-
Для уменьшения одышки и возбуждения при
отеке легких у пациентов с ИМпST рекомендуется в/в введение морфина**
.
ЕОК IIaC (УУР С; УДД 5)
Комментарий: подробнее об
использовании морфина** — в разделе «Лекарственная терапия»
-
Пациентам с ИМпST, имеющим сердечную недостаточность, для уменьшения
выраженности симптомов рекомендуется в/в инфузия нитратов. Условие: САД
выше 90 мм рт. ст. [36]
ЕОК IIa C (УУР С; УДД 5)
Комментарий: подробнее об использовании нитратов — в разделе
«Лекарственная терапия»
-
Для снижения риска смерти и необходимости госпитализаций рекомендуется
назначение ингибиторов АПФ (а при их непереносимости — блокаторов
рецепторов ангиотензина) пациентам с ИМпST с ФВ ЛЖ <40% — при
стабилизации гемодинамики (при отсутствии артериальной гипотонии,
гиповолемии и выраженной почечной недостаточности) [139, 215].
ЕОК IA (УУР А; УДД 1)
-
Из-за угрозы увеличения риска смерти не рекомендуется (противопоказано)
внутривенное введение бета- адреноблокаторов пациентам с ИМпST и
признаками острой сердечной недостаточности [216].
ЕОК IIIB (УУР В; УДД 2)
-
При ИМпST рекомендуется назначение альдостерона антагонистов у пациентов
с сердечной недостаточностью и/или ФВ ЛЖ ≤40% для снижения смертности и
частоты госпитализаций. Условие — отсутствие выраженной почечной
недостаточности и гиперкалиемии. [141, 217]
ЕОК IB (УУР A; УДД 1)
-
У пациентов с ИМпST при острой левожелудочковой недостаточности на фоне
артериальной гипертензии для уменьшения выраженности симптомов и
контроля уровня АД рекомендуется внутривенная инфузия нитратов или
Нитропруссида натрия дигидрат [36].
ЕОК IIaC (УУР С; УДД 5)
Кардиогенный шок
Кардиогенный шок — жизнеугрожающее состояние, вызванное резким снижением
сердечного выброса (СВ) и проявляющееся выраженной гипоперфузией органов
и тканей и гипоксемией.
Основным клиническим признаком кардиогенного шока является стойкая
гипотензия (САД ≤ 90 мм рт. ст.), рефрактерная к инфузионной терапии и
сопровождающаяся признаками острой полиорганной недостаточности в
результате гипоперфузии.
Клинические признаки гипоперфузии:
-
снижение температуры кожных покровов;
-
мраморность кожных покровов;
-
снижение темпа диуреза (˂ 30 мл/ч);
-
изменения психического статуса и сознания.
Выделяют 3 основных варианта
кардиогенного шока при ИМ:
-
Истинный кардиогенный шок, связанный со снижением сократительной
способности ЛЖ. -
Шок вследствие относительной и абсолютной гиповолемии. Близкий к этому
вариант — рефлекторный шок, связанный с реакцией на болевой приступ. -
Аритмический вариант — нарушения гемодинамики на фоне тяжелых тахи- и
брадиаритмий (см. раздел
«Нарушения ритма»).
Кроме этих форм, у пациентов с ИМпST
нижней локализации вследствие рефлекса Бецольда-Яриша может быть
рефлекторный вагусный шок, требующий специфического лечения (введения
атропина** и инфузии физиологического раствора).
Гемодинамические критерии шока истинного кардиогенного шока (гипокинетический вариант)
-
Гипотензия САД < 80–90 мм рт. ст.
-
CИ < 1,8 л/мин/м2 без вазоактивной терапии;
< 2,0–2,2 л/мин/м2 на фоне вазоактивной терапии.
-
Повышение давления наполнения:
-
КДД ЛЖ > 18 мм рт. ст.;
-
КДД ПЖ > 10 мм рт. ст.
Гиповолемический кардиогенный шок
Предположить наличие гиповолемии можно у пациента со стойкой
артериальной гипотензией при сохраненной сократительной функции миокарда
ЛЖ. Относительную гиповолемию часто наблюдают при ИМ правого желудочка,
абсолютную — при предшествующем введении мочегонных препаратов, обильном
диурезе. Абсолютная гиповолемия может быть обусловлена кровотечением,
поэтому всем пациентам с устойчивой гипотонией нужно контролировать
уровень гемоглобина и эритроцитов. При мониторировании показателей
центральной гемодинамики обнаруживают признаки гиповолемического типа
кровообращения:
1) конечное диастолическое давление ЛЖ <18 мм.рт.ст.;
2) сердечный индекс <2,2 л/мин/м2.
Лечение истинного кардиогенного шока
-
У пациентов с ИМпST с кардиогенным шоком для выявления его причины
рекомендуется срочно выполнить ЭхоКГ с целью оценки сократительной
функции камер сердца, состояния клапанов и поиска механических
осложнений ИМ [36].
ЕОК IIaC (УУР С; УДД 5).
-
Для обеспечения безопасности при лечении кардиогенного шока у пациентов
с ИМпST рекомендуется инвазивный мониторинг АД [36].
ЕОК IIaC (УУР С; УДД 5).
-
При лечении кардиогенного шока у пациентов с ИМпST для уточнения причины
шока и контроля за эффективностью и безопасностью лечения рекомендуется
инвазивный мониторинг показателей центральной гемодинамики
(катетеризация легочной артерии при наличии физических и технических
возможностей) [36].
ЕОК IIaC (УУР С; УДД 5).
-
У пациентов с ИМпST и кардиогенным шоком для улучшения прогноза
рекомендуется скорейшая реваскуляризация миокарда [39].
ЕОК IIa B (УУР В; УДД 2).
Комментарий: выбор между ЧКВ и операцией КШ в данной
клинической ситуации определяется особенностями поражения коронарного
русла и наличием механических осложнений ИМ. При проведении ЧКВ у
пациента с ИМпST и кардиогенным шоком рекомендуется ограничиваться
вмешательством на инфаркт-связанной артерии [48].
-
Для улучшения исхода лечения у пациента с ИМпST и кардиогенным шоком при
невозможности выполнения ЧКВ рекомендуется рассмотреть возможность
проведения системной тромболитической терапии (при отсутствии
механических осложнений ИМ) [36].
ЕОК IIbC (УУР C; УДД 5)
-
У пациентов с ИМпST и кардиогенным шоком вследствие механических
осложнений ИМ, на период подготовки к оперативному лечению этих
осложнений для стабилизации состояния рекомендуется применение системы
внутриаортальной баллонной контрпульсации (при наличии физических и
технических возможностей) [36].
ЕОК IIaC (УУР С; УДД 5)
Комментарий: проведение лечения с использованием системы
внутриаортальной баллонной контрпульсации рутинно всем пациентам с
кардиогенным шоком нецелесообразно [218].
-
У пациентов с ИМпST и кардиогенным шоком для устранения гемодинамической
нестабильности рекомендуется применение инотропных и/или адрено- и
допамин-стимуляторов [36].
ЕОК IIbC (УУР C; УДД 5)
Комментарий: внятных
доказательств улучшения прогноза при использовании инотропных и/или
адрено- и допамин-стимуляторов у пациентов с ИМпST и кардиогенным шоком
нет. Поэтому устранение гемодинамической нестабильности на фоне введения
этих средств не может быть поводом для отсрочки реваскуляризации,
способной у части таких пациентов улучшить не только гемодинамические
показатели, но и прогноз. Инфузия допамина начинается со скоростью 5
мкг/кг/мин, в зависимости от гемодинамического ответа она постепенно
может быть увеличена до 15–20 мкг/кг/мин. Добутамин вводят с начальной
скоростью 2–10 мкг/кг/мин, которая при необходимости может быть
увеличена до 20 мкг/кг/мин. Норэпинефрин** начинают вводить со скоростью 2
мкг/мин, которую при необходимости увеличивают. При недостаточном
эффекте препараты можно комбинировать, прежде всего добутамин и
норэпинефрин** . В качестве альтернативы адренергическим агентам у
пациентов c ИМпST, получавших до развития острой СН длительное лечение
БАБ, и у пациентов с недостаточным выделением мочи в ответ на повторное
в/в введение диуретиков может рассматриваться левосимендан** . Его
использование уместно у пациентов с САД в диапазоне 90–100 мм рт.ст. и
имеющих признаки отека легких (III класс СН по Killip). Кроме этого,
левосимендан** может использоваться в качестве дополнительного
вмешательства в сочетании с норэпинефрином** или другими адрено- и
допамин-стимуляторами у пациентов с кардиогенным шоком и указаниями на
периферическую вазоконстрикцию (класс по Killip IV и САД <90 мм рт.ст.).
Инфузия левосимендана** начинается с нагрузочной дозы (6 мкг/кг) введенной
в/в болюсом за 10 минут с последующей в/в инфузией в дозе 0,1 мг/кг/мин
и титрацией до 0,2 мг/кг/мин (пока САД не будет стабильным в течение 3
часов). Реакцию на введение левосимендана** следует оценивать сразу по
окончанию введения нагрузочной дозы, или в течение 30–60 мин после
коррекции дозы, или при изменении в состоянии пациента. При
отрицательных изменениях показателей гемодинамики (выраженное снижение
АД, тахикардия), скорость введения уменьшают до 0,05 мкг/кг/мин или
прекращают инфузию. При хорошей переносимости начальной дозы и при
необходимости в усилении гемодинамического эффекта, скорость введения
может быть увеличена до 0,2 мкг/кг/мин. Рекомендуемая продолжительность
инфузии составляет 24 часа. Начальный болюс левосимендана** обычно не
вводится, чтобы предотвратить развитие гипотонии у пациентов с
систолическим артериальным давлением <100 мм рт. ст. или с
диастолическим артериальным давлением
<60 мм рт. ст. левосимендан** противопоказан при гиперчувствительности к
нему, механической обструкции выносящего тракта, препятствующей
заполнению и/ или выбросу крови из желудочков сердца, почечной
недостаточности (клиренс креатинина менее 30 мл/мин), печеночной
недостаточности (более 9 баллов по шкале Чайлд-Пью), стойкой
артериальной гипотензии (САД менее 80 мм рт.ст.), тахикардии (ЧСС более
120 уд/мин), желудочковой тахикардии типа «пируэт» в прошлом,
нескорректированной гипокалиемии или гиповолемии [219–221]
-
У пациентов
с ИМпST и кардиогенным шоком для устранения гемодинамической
нестабильности при выраженной артериальной гипотонии рекомендуется
внутривенная инфузия норэпинефрина** , который в этой ситуации из-за
меньшей частоты побочных действий предпочтительнее допамина [222].
ЕОК IIaC (УУР С; УДД 4)
-
У пациентов с ИMпST с кардиогенным шоком, не отвечающим на терапию
диуретиками, с целью стабилизации ссостояния рекомендуется
ультрафильтрация крови [36, 223].
ЕОК IIbC (УУР С; УДД 5)
-
У пациентов с ИMпST с кардиогенным шоком при наличии технической
возможности рекомендуется использование внешних и внутренних устройств
для поддержки кровообращения и/или экстракорпоральной мембранной
оксигенации, в том числе одновременное использование двух средств [36].
ЕОК IIa C (УУР С; УДД 5)
Комментарий: внятных доказательств улучшения прогноза при
использовании внешних и внутренних устройств для поддержки
кровообращения и/или экстракорпоральной мембранной оксигенации у
пациентов с кардиогенным шоком, осложнившим ИМ, пока нет. Это не
отменяет возможности рассматривать этот подход как временную меру для
стабилизации состояния пациентов, готовщихся к реваскуляризации,
хирургическому устранению причин шока или трансплантации сердца.
Лечение гиповолемического кардиогенного шока
-
У пациентов с ИМпST для обеспечения эффективности и безопасности лечение
гиповолемического шока рекомендуется проводить под контролем показателей
центральной гемодинамики, при наличии технических возможностей — с
измерением давления заклинивания легочной артерии, используя катетер
Сван-Ганза [36].
ЕОК IIb C (УУР С; УДД 5)
Комментарий: при отсутствии возможности измерять давление
заклинивания легочной артерии, возможна оценка центрального венозного
давления, но следует учитывать, что у пациентов с острым ИМ показатели
центрального венозного давления могут не отражать конечного
диастолического давления в ЛЖ.
-
Всем пациентам с ИМпST и подозрением на гиповолемический шок
рекомендуется ЭхоКГ для выявления возможных причин гиповолемии (инфаркт
правого желудочка, тампонада сердца и т.д.) и оценки функционального
состояния сердца [36].
ЕОК IIb C (УУР С; УДД 5)
-
Пациентам с
ИМпST и гиповолемическим шоком возмещение жидкости с целью нормализации
АД рекомендуется начать с в/в введения 200–250 мл 0,9% раствора натрия
хлорида** , который вводят за 5–10 мин. При сохранении артериальной
гипотонии рекомендуется вводить натрия хлорид повторно [36].
ЕОК IIb C (УУР С; УДД 5)
Комментарий: объем переливаемой пациенту жидкости может доходить до нескольких
литров. При стабилизации АД, появлении диуреза инфузию прекращают. Если
введение жидкости не дает эффекта, параллельно проводят лечение адрено-
и допамин-стимуляторами — допамином** или добутамином**.
Наджелудочковые аритмии
Наиболее часто у пациентов с ИМ наблюдается ФП. Возможны другие варианты
аритмии: синусовая тахикардия, пароксизмальные наджелудочковая и
АВ-реципрокная тахикардия.
Лечение ФП
ФП, как правило, хорошо переносится, но у ряда пациентов на фоне
тахисистолии может развиться гемодинамическая нестабильность.
-
Рекомендуется использование внутривенного или перорального
бета-адреноблокатора с целью контроля ЧСС у пациентов с ИМпST и
тахисистолической формой ФП при отсутствии острой сердечной
недостаточности и гипотонии [36].
ЕОК IIa C (УУР С; УДД 5)
-
Рекомендуется использование амиодарона
внутривенно с целью контроля ЧСС у пациентов ИМпST с тахисистолической
формой ФП при наличии острой сердечной недостаточности и отсутствии
тяжелой гипотонии [36].
ЕОК IIbC (УУР С; УДД 5)
Комментарий: амиодарон вводят
внутривенно в дозе 5 мг/кг, но не более 300 мг, за 10–60 мин. При
необходимости каждые 10–15 мин повторяют введение по 150 мг или начинают
инфузию в суточной дозе 1000 мг, на фоне которой допускаются
дополнительное введение препарата по 150 мг.
-
Рекомендуется внутривенное введение
дигоксина с целью контроля ЧСС у пациентов с ИМпST и тахисистолической
формой ФП при наличии острой сердечной недостаточности и гипотонии [36].
ЕОК IIbC (УУР С; УДД 5)
-
Рекомендуется проведение немедленной электрической кардиоверсии у
пациентов с ИМпST и тахисистолической формой ФП при невозможности
адекватного медикаментозного контроля ЧСС при наличии признаков ишемии,
острой сердечной недостаточности и гемодинамической нестабильности (для
устранения или уменьшения этих осложнений) [36].
ЕОК IIaC (УУР С; УДД 5)
-
Рекомендуется использование амиодарона
внутривенно для поддержки электрической кардиоверсии и снижения риска
рецидива ФП у гемодинамически нестабильных пациентов с ИМпST с недавно
возникшей ФП [36].
EOK IIa C (УУР С; УДД 5)
Пароксизмальная наджелудочковая тахикардия или атриовентрикулярно-узловая тахикардия
При небольшой частоте желудочкового ритма и хорошей переносимости
активные лечебные мероприятия обычно не рекомендуются. Тахикардия часто
купируется самостоятельно.
-
При высокой частоте сокращений желудочков у пациента с ИМпST и
пароксизмом наджелудочковой тахикардии для стабилизации состояния
рекомендуется экстренное купирование аритмии с помощью кардиоверсии
(энергия разряда 25–50 Дж) или медикаментов [36].
ЕОК IIaC (УУР С; УДД 5)
Комментарий: при устойчивом характере пароксизма и стабильной
гемодинамике аритмию купируют медикаментозно:
-
Бета-адреноблокаторы
вутривенно: пропранолол** по 1 мг каждые 5–10 мин, в общей дозе до 6–10
мг; метопролол по 2,5–5 мг каждые 3–5 мин, общая доза — до 15 мг;
атенолол** по 2,5–5 мг каждые 2 мин, общая доза — до 10 мг. -
Верапамил** по 2,5–10 мг в течение 2 мин,
при необходимости — повторно 5–10 мг через 15–30 мин; или дилтиазем
внутривенно — 20 мг (0,25 мг/кг) за 2 мин с последующей инфузией со
скоростью 10 мг/ч.
Желудочковые аритмии
-
Для восстановления кровообращения у пациента с ИМпST, осложненным
гемодинамически значимой ЖТ или ФЖ, рекомендуется проведение немедленной
электрической кардиоверсии или дефибрилляции соответственно [36].
ЕОК IC (УУР С; УДД 5)
-
У пациентов с ИМпST с полиморфной ЖТ или ФЖ для предупреждения рецидивов
аритмии рекомендуется внутривенное введение бета-адреноблокатора (при
отсутствии противопоказаний) [224, 225].
ЕОК IB (УУР В; УДД 3)
-
У пациентов с ИМпST с полиморфной ЖТ
рекомендуется использование амиодарона внутривенно с целью
предупреждения рецидивов аритмии [36].
ЕОК IIb C (УУР С; УДД 5)
-
У пациентов с ИМпST с ЖТ и/или ФЖ для снижения риска рецидива аритмии
рекомендуется выявление и коррекция электролитных расстройств (в
особенности гипокалиемии и гипомагнезиемии) [36].
ЕОК IIb C (УУР С; УДД 5)
-
У пациентов с ИМпST с рецидивирующей ЖТ для устранения аритмии
рекомендуется использование трансвенозной желудочковой сверхчастой
стимуляции [36].
ЕОК IIbC (УУР С; УДД 5)
-
У пациентов
с ИМпST с ЖТ и/или ФЖ с целью предупреждения рецидивов аритмии при
неэффективности амиодарона и сверхчастой стимуляции рекомендуется
использование лидокаина внутривенно [36].
ЕОК IIbC (УУР С; УДД 5)
-
У пациентов с ИМпST из-за угрозы проаритмических эффектов не
рекомендуется рутинное профилактическое использование антиаритмических
препаратов для предупреждения возникновения аритмий [226–229].
ЕОК IIIA (УУР А; УДД 1)
-
У пациентов с ИМпST из-за угрозы проаритмических эффектов не
рекомендуется лечение гемодинамически незначимых желудочковых и
наджелудочковых аритмий с помощью антиаритмических средств [36].
ЕОК III C (УУР С; УДД 5)
-
У пациентов с ИМпST при рецидивирующих ФЖ/ЖТ следует рассмотреть
экстренную реваскуляризацию с целью устранения ишемии как возможной
причины возникновения аритмий (в случае если реваскуляризация ранее не
проводилась или была не полной) [230].
ЕОК IIa B (УУР С; УДД 4)
-
У пациентов с ИМпST при наличии признаков
хронической СН II–III функционального класса по Нью- Йоркской
классификации и ФВ ЛЖ<35% (не ранее чем через 6 недель после
перенесенного ИМ), несмотря на оптимальную медикаментозную терапию, для
предотвращения внезапной смерти рекомендуется имплантация
кардиовертера-дефибриллятора [231–233].
ЕОК IA (УУР A; УДД 1)
-
У отдельных пациентов с ИМпST (с неполной
реваскуляризацией, дисфункцией ЛЖ и ЖТ/ФЖ, развившимися через 48 и более
часов от момента возникновения ИМ) для снижения риска внезапной смерти
рекомендуется имплантация кардиовертера-дефибриллятора или использование
внешнего дефибриллятора (в период менее 40 дней от развития ИМ) [36].
ЕОК IIbC (УУР С; УДД 5)
Синусовая брадикардия и АВ-блокада
-
У пациентов с ИМпST с гемодинамически значимой синусовой брадикардией
или c АВ-блокадой с неадекватным замещающим ритмом при неэффективности
хронотропных препаратов для стабилизации состояния пациента
рекомендуется временная эндокардиальная кардиостимуляция [36].
ЕОК I C (УУР С; УДД 5)
-
У пациентов
с ИМпST при гемодинамически значимой синусовой брадикардии или
АВ-блокаде с неадекватным замещающим ритмом для стабилизации
гемодинамики рекомендуется внутривенное введение препаратов, оказывающих
позитивное хронотропное действие (эпинефрина** , атропина** ) [36].
ЕОК IIbC (УУР С; УДД 5)
Механические осложнения ИМ
Разрыв свободной стенки левого желудочка
Разрыв свободной стенки ЛЖ наблюдается примерно у 1% пациентов с ИМ в
первую неделю от начала заболевания. Как правило, он проявляется
внезапной болью и/или сердечно-сосудистым коллапсом с
электромеханической диссоциацией. Диагноз подтверждается с помощью
ЭхоКГ. Случаи успешной реанимации очень редки.
-
При разрыве свободной стенки ЛЖ у пациента с ИМпST для предотвращения
смерти рекомендуются немедленная пункция и катетеризация перикарда с
последующим экстренным хирургическим вмешательством [234].
EОК IIa C (УУР С; УДД 4)
Разрыв межжелудочковой перегородки
Основные клинические проявления разрыва МЖП: внезапно появившаяся боль в
груди, одышка, слабость. Иногда разрыв МЖП проявляет себя как внезапная
острая сердечная недостаточность вплоть до кардиогенного шока.
Аускультативно выявляют ранее не выслушивавшийся грубый систолический
шум, наиболее выраженный у места прикрепления III–IV левых ребер к
грудине. Диагноз подтверждают с помощью ЭхоКГ, которая выявляет
собственно дефект МЖП, поток крови слева направо, признаки перегрузки
ПЖ.
-
У пациентов с ИМпST при выявлении разрыва МЖП для предотвращения смерти
рекомендуется хирургическое лечение [36].
ЕОК IIaC (УУР С; УДД 5)
Комментарий: cпособ и время вмешательства зависит от характера
дефекта и состояния пациента. В целом хирургическая реконструкция МЖП
предпочтительна после стабилизации состояния, однако при выраженном
нарушении гемодинамики операция проводится по экстренным показаниям.
-
У пациентов с ИМпST при выявлении разрыва МЖП в качестве временной меры
для стабилизации состояния рекомендуется использование системы
внутриаортальной баллонной контрпульсации и других механических средств
для вспомогательного кровообращения [36].
ЕОК IIbC (УУР С; УДД 5)
Острая митральная регургитация
Острая митральная регургитация обычно развивается на 2–7 день от начала
ИМ вследствие разрыва папиллярной мышцы или хорды. Разрыв может быть
полным или включать только отдельные головки мышцы. Наиболее часто
происходит разрыв заднемедиальной мышцы вследствие особенностей ее
кровоснабжения. В некоторых случаях выраженная митральная регургитация
развивается у пациентов с ИМ без разрыва или инфаркта сосочковой мышцы
как следствие обширного поражения ЛЖ с его последующей дилатацией и
расширением митрального кольца. Клинически острая митральная
недостаточность проявляется острой сердечной недостаточностью, отеком
легких, иногда кардиогенным шоком. Диагноз подтверждается на основании
данных ЭхоКГ.
-
У пациентов с ИМпST при развитии острой митральной недостаточности для
устранения острой СН и предотвращения смерти рекомендуется хирургическое
лечение — как правило, протезирование митрального клапана. Время
вмешательства зависит от степени митральной регургитации и состояния
пациента. В большинстве случаев операция проводится по экстренным
показаниям [235, 320].
ЕОК IIa C (УУР В; УДД 3)
Комментарий: время вмешательства зависит от степени митральной
регургитации и состояния пациента. В большинстве случаев операция
проводится по экстренным показаниям.
-
У пациентов с ИМпST при развитии острой митральной недостаточности в
качестве временной меры для стабилизации состояния рекомендуется
рассмотреть использование системы внутриаортальной баллонной
контрпульсации и/или других механических средств для вспомогательного
кровообращения [36].
ЕОК IIb C (УУР С; УДД 5).
Перикардит
Ранний постинфарктный (т. н. эпистенокардитический) перикардит возникает
вскоре после начала ИМ и быстро проходит, в то время как поздний
перикардит в рамках синдрома Дресслера как правило развивается через 1–2
недели от начала ИМ, и иногда его симтомы могут длиться несколько
недель. Классический синдром Дресслера в виде развернутого полисерозита
в последнее время встречается крайне редко. Клинически перикардит
проявляется болью в прекардиальной области и шумом трения перикарда,
который выслушивается лишь у каждого третьего пациента. Кроме этого, на
ЭКГ появляются конкордантные подъемы сегмента ST, иногда в сочетании с
депрессией сегмента PQ. Выпотной перикардит может сопровождаться
снижением амплитуды зубцов QRS во всех отведениях ЭКГ. Выявление
жидкости в перикарде, так же, как и контроль за изменением ее
количества, осуществляется с помощью ЭхоКГ.
-
У
пациентов с ИМпST при постинфарктном перикардите с выраженными
клиническими проявлениями препаратом рекомендуется применение АСК** в дозе
500–1000 мг каждые 6–8 ч. Длительность подобного лечения может
колебаться от 2–3 дней до нескольких недель. В случае затяжного течения,
в основном — в рамках синдрома Дресслера, следует снижать ежедневную
дозу АСК** на 250–500 мг каждую неделю. Использование других,
альтернативных АСК** нестероидных противовоспалительных средств при
постинфарктном миокардите не оправдано из-за потенциального
отрицательного влияния на риск сердечных событий [36, 236].
ЕОК IIa C (УУР С; УДД 5)
Комментарий: в качестве дополнительного средства для лечения
перикардита возможно использовать Безвременника осеннего семян экстракт
(#колхицин) (2 мг нагрузочная доза однократно, далее 0,5 мг 2 раза в
день в течение 3 месяцев).
Острая аневризма левого желудочка и тромбоз левого желудочка
Острая аневризма ЛЖ обычно развивается при обширном ИМ передней стенки
ЛЖ, особенно в отсутствие адекватной реперфузионной терапии. При острой
аневризме ЛЖ увеличивается вероятность разрыва сердца, а также таких
осложнений, как СН, нарушения ритма сердца, перикардит, тромбоз полости
ЛЖ, периферические ТЭ. Пристеночный тромбоз в полости ЛЖ обнаруживают
практически всегда при аневризме сердца и не менее чем в половине
случаев обширных передних ИМ. Методом диагностики для выявления острой
аневризмы и тромбоза в полости ЛЖ является ЭхоКГ.
-
У пациентов с ИМпST при обнаружении аневризмы ЛЖ с тромбозом полости
рекомендуется назначение антагониста витамина К под контролем МНО
(целевые значения — 2,0–3,0) минимум на 6 месяцев. Абсолютным показанием
для назначения антикоагулянтов являются следующие особенности тромба:
мобильный (флотирующий) свободный участок, большие размеры (более 2–3см)
и выраженная протрузия (выпячивание) тромба в полость ЛЖ, неоднородность
структуры, фрагментация тромба [237].
ЕОК IIa C (УУР С; УДД 5)
Комментарий: в период подбора дозы антагониста витамина К
следует продолжать парентерального ввеление лечебной дозы
антикгаоулянта.
Ранняя постинфарктная стенокардия и повторный инфаркт миокарда
Ранняя постинфарктная стенокардия является вариантом нестабильной
стенокардии и требует неотложных лечебных мероприятий. В основе ранней
постинфарктной стенокардии может лежать как ретромбоз (частичный или
полный) инфаркт-связанной артерии, так и стенозирующее поражение других
ветвей коронарных артерий. У пациентов после ЧКВ причиной возобновления
ангинозных приступов может быть тромбоз стента или диссекция коронарной
артерии. В ранние сроки после ИМ может отмечаться появление
стенокардитических болей, обусловленных ишемией жизнеспособного миокарда
в периинфарктной зоне (особенно если не проводилась реперфузионная
терапия) или, реже, в других сосудистых бассейнах. Ишемия может быть
связана с еще одной АСБ, иногда — расположенной в бассейне другой
коронарной артерии. Следует дифференцировать раннюю постинфарктную
стенокардию от болей, связанных с перикардитом.
В раннем периоде (до 28 дней) инфаркта может развиться рецидив ИМ,
приводящий к расширению зоны поражения. Рецидив ИМ следует исключать при
повторном ангинозном приступе длительностью более 20 мин,
сопровождающемся повышением уровня кардиомаркеров, изменениями ЭКГ и
появлением новых зон нарушенной локальной сократимости.
-
У пациентов с ИМпST при возникновении ангинозного болевого приступа
длительностью более 20 минут для диагностики рецидива ИМ, рекомендуется
исследование уровня сердечного тропонита I или Т с повторной оценкой
через 6 часов. Повышение уровня сердечного тропонина на 20% и более от
исходного свидетельствует о рецидиве ИМ [5, 36].
ЕОК IIaC (УУР С; УДД 5)
-
Для предотвращения распространения зоны ИМ у пациентов с ИМпST с ранней
постинфарктной стенокардией и рецидивом ИМ рекомендуется проведение
коронароангиографии и, при необходимости, выполнение реваскуляризации
[36].
ЕОК IIa C (УУР С; УДД 5)
ИМ правого желудочка
Изолированный ИМ ПЖ встречается редко, но его содружественное поражение
при ИМпST нижней стенки ЛЖ наблюдается не менее чем у 25% пациентов.
Клинически для ИМ ПЖ характерны артериальная гипотензия, набухание вен
шеи при отсутствии признаков застоя в малом круге. Гипотония при ИМ ПЖ
связана с относительной гиповолемией.
-
У пациентов с ИМпST нижней локализации для выявления вовлечения в зону
некроза миокарда правого желудочка рекомендуется регистрировать ЭКГ в
правых прекардиальных отведениях. Элевация сегмента ST
≥1 мм в отведениях V3R и V4R является признаком ИМ ПЖ. ЭхоКГ позволяет
выявить нарушения локальной сократимости ПЖ, расширение полости ПЖ [36].
ЕОК IIa C (УУР С; УДД 5)
Комментарий: ЭхоКГ позволяет выявить нарушения локальной
сократимости ПЖ, расширение его полости.
-
У пациентов с ИМпST при ИМ ПЖ для устранения гипотонии рекомендуется
обеспечить увеличение объема притекающей к правым отделам сердца крови с
помощью введения плазмоэкспандеров (физиологический раствор). В более
тяжелой ситуации рекомендуются адрено- и допамин-стимуляторы [36].
ЕОК IIa C (УУР С; УДД 5)
-
При ИМ ПЖ из-за угрозы усугубления относительной гиповолемии
рекомендуется избегать назначения диуретиков и особенно периферических
вазодилататоров [36].
ЕОК IIIC (УУР С; УДД 5)
4. Реабилитация
-
Для снижения риска смерти и улучшения функционального состояния
рекомендуется включение всех пациентов, перенесших ИМпST, в программы
кардиореабилитации (КР), нацеленные на изменение образа жизни пациентов,
контроль факторов риска ИБС, улучшение качества жизни, повышение
приверженности лечению, замедление прогрессирования заболевания и
улучшение прогноза [238].
ЕОК IA (УУР А; УДД 2)
Комментарий: с учетом существующей во всем мире проблемы
недостаточного участия пациентов в программах КР, с одной стороны, и
доказанного позитивного влияния КР на прогноз, с другой, организаторам
здравоохранения рекомендуется использовать ряд индикаторов, позволяющих
выявлять потенциально корректируемые причины недостаточного участия
пациентов в КР (связанные с пациентом или с системой здравоохранения), и
принимать меры по их устранению.
Программа КР должна осуществляться мультидисциплинарной командой и
включать три этапа: стационарный в блоке интенсивного наблюдения,
стационарный в отделении реабилитации и амбулаторный. Всех пациентов с
диагнозом «острый ИМпST» следует направлять на ранние этапы КР до
выписки из стационара. Все амбулаторные пациенты, перенесшие ИМпST в
течение последнего года и не участвовавшие в ранних программах КР,
должны направляться на амбулаторные программы КР.
Программа КР длится не менее 8–12 недель. Ее ключевыми компонентами
являются: физическая реабилитация, обучение и консультирование
пациентов, управление факторами риска ИБС посредством адекватного
назначения кардиопротективной терапии и мероприятий по повышению
приверженности пациентов.
Физическая реабилитация после перенесенного ИМпST реализуется
посредством персонализированной программы физических тренировок,
основанной на оценке физической работоспособности пациентов по данным
нагрузочных проб и включающей регулярные аэробные физические нагрузки
умеренной интенсивности общей длительностью не менее 2,5 часов в неделю
с возможным последующим присоединением силовых нагрузок.
Обучение пациентов рекомендуется проводить в групповом формате (Школа
для пациентов). Обучение пациентов, консультирование по имеющимся
факторам риска и психологическое консультирование основываются на
принципах когнитивной поведенческой терапии.
В рамках программ КР рекомендуется скрининг тревожной и депрессивной
симптоматики с помощью стандартизированных опросников с последующим
проведением психологического консультирования и, при необходимости,
консультации психотерапевта/психиатра и назначения психофармакотерапии
[239].
-
Для реализации программы КР пациентов, перенесших ИМпST, рекомендуется
сформировать мультидисциплинарную команду специалистов (врач-кардиолог,
врач-терапевт/врач общей практики, врач- диетолог, врач ЛФК/инструктор
ЛФК, медицинский психолог, медицинские сестры) [240–254].
ЕОК IA (УУР А; УДД 1)
-
Пациентам, перенесшим ИМпST, для улучшения кардиореспираторной
работоспособности и функциональных возможностей, для благоприятного
влияния на факторы риска ИБС, для снижения риска нефатальных ишемических
событий и смертности необходимо участие в реабилитационной программе,
включающей дозированные физические нагрузки [238, 255–262].
EОK IA (УУР А; УДД 1)
Комментарий: предпочтительными нагрузками для пациентов после
ИМпST являются умеренные аэробные тренировки на выносливость,
реализуемые в первые 2–6 недель в контролируемых условиях. Рекомендуемая
частота тренировок — не менее 3 раз в неделю, оптимально — ежедневно.
Продолжительность — не менее 30 минут. Стандартным является постоянный
уровень нагрузки в течение всей основной фазы тренировки, однако для
очень детренированных пациентов и лиц с сердечной недостаточностью более
подходящими могут быть интервальные тренировки низкой интенсивности
[263–267].
-
Для контроля за состоянием пациентов, перенесших ИМпST, во время
тренировок рекомендуется непрерывный или прерывистый контроль за ЧСС и
АД [36].
ЕОК IС (УУР С; УДД 5)
-
Для оценки функционального статуса пациента после ИМпST и выбора для
него уровня дозированных нагрузок рекомнедуется использовать стресс-тест
(велоэргометрия или электрокардиография с другой физической нагрузкой) с
непрерывной оценкой ритма сердца и ишемии миокарда по ЭКГ, или, при его
доступности, кардиопульмональный нагрузочный тест (последний особенно
актуален у пациентов с сердечной недостаточностью) [36].
ЕКО IС (УУР С; УДД 5)
5. Профилактика
5.1 Профилактика
Помимо продолжения медикаментозной терапии, начатой в ранние сроки
лечения ИМпST (разделе 3.1.), рекомендуются вмешательства по контролю
сердечно-сосудистых факторов риска и по предупреждению внезапной
сердечной смерти.
-
Для снижения риска сердечно-сосудистых событий среди перенесших ИМ
рекомендуются выявление курильщиков и регулярные вмешательства,
направленные на полный отказ от курения, включая отказ от пассивного
курения [268–277].
ЕОК IA (УУР А; УДД 1)
Комментарий: мероприятия по отказу от курения рекомендуется
начинать на госпитальном этапе и продолжить после выписки. Рекомендуются
поведенческие и фармакологические вмешательства (никотинзаместительная
терапия, варениклин или бупропион).
-
Всем пациентам, перенесшим ИМпST, рекомендуется придерживаться принципов
здорового питания для снижения риска ишемических событий [278–285].
ЕОК IA (УУР B; УДД 2)
Комментарий: Ключевые характеристики здорового питания:
ограничение потребления насыщенных жиров и транс-изомеров жирных кислот
до < 10% и < 1% от общей калорийности суточного рациона, соответственно;
поваренной соли до 5 г в сутки; легкоусваиваемых углеводов; потребление
большого количества фруктов (≥ 250 г в сутки), овощей (≥ 250 г в сутки)
и цельнозерновых продуктов. Рекомендуется потребление рыбы 1–2 раза в
неделю (хотя бы 1 раз в неделю – жирной рыбы), а также молочных
продуктов с низкой жирностью, постного мяса и птицы, бобовых и несоленых
орехов в количестве 30 г в день. Суточное потребление алкоголя не должно
превышать 1 стандартную дозу у женщин и 1–2 стандартных дозы у мужчин (1
стандартная доза – 40 мл крепких спиртных напитков или 120 мл сухого
вина или 330 мл пива).
-
Всем пациентам, перенесшим ИМпST, для улучшения прогноза рекомендуется
нормализация массы тела [286–288].
IA (УУР А; УДД 1)
Комментарий: Целевые значения индекса массы тела составляют
20–25 кг/м2, окружности талии — менее 80 см для женщин и менее 94 см для
мужчин.
-
У пациентов, перенесших ИМпST, для улучшения прогноза рекомендуется
контроль АД и поддержание его на нормальном уровне [289–291].
ЕОК IA (УУР А; УДД 1)
Комментарий: целевой уровень АД у пациентов после ИМ — ниже
140/90 мм рт.ст. При хорошей переносимости следует рассмотреть снижение
АД до 130/80 мм рт.ст. и ниже. Для контроля АД у пациентов после ИМ
предпочтительны бета-адреноблокаторы и ингибиторы АПФ.
-
У пациентов с СД, перенесших ИМпST, рекомендуется проводить лечение,
направленное на поддержание выбранного совместно с врачом-эндокринологом
индивидуального целевого уровня гликированного гемоглобина (у
большинства пациентов – ниже 7,0%) для снижения риска микро- и
макрососудистых осложнений СД [292].
ЕОК IIa B (УУР B; УДД 2)
Комментарий: у пациентов, перенесших ИМ и с СД 2 типа
перспективно использование антагонистов рецептора глюкагоноподобного
пептида-1 и ингибиторов натрий-глюкозного котранспортера 2 типа,
способствующих снижению частоты сердечно-сосудистых осложнений у
пациентов с атеросклеротическими сердечно-сосудистых заболеваниями.
-
У пациентов, перенесших ИМпST, с высоким уровнем стресса, тревожной и
депрессивной симптоматикой рекомендуются психологическое
консультирование (мультимодальные поведенческие вмешательства),
психотерапия и психофармакотерапия для улучшения психологического
статуса, снижения риска сердечно- сосудистых осложнений и
сердечно-сосудистой [293–295].
ЕОК IA (УУР B; УДД 1)
-
У пациентов, перенесших ИМпST, рекомендуется использовать фиксированные
комбинации препаратов для увеличения приверженности к лечению [296,
297].
ЕОК IIbB (УУР B; УДД 2)
-
Ежегодная вакцинация против гриппа рекомендуется всем пациентам,
перенесшим ИМ [298–303].
ЕОК IB (УУР B; УДД 2)
-
Профилактика внезапной смерти с помощью
имплантации кардиовертера-дефибриллятора (или прибора для
ресинхронизирующей терапии с функцией кардиовертера-дефибриллятора при
наличии показаний) рекомендуется при ФВ ЛЖ £35% у пациентов с сердечной
недостаточностью, сохраняющейся на фоне оптимальной медикаментозной
терапии, когда после ИМ прошло более 40 дней и пациент не подходит для
процедур реваскуляризации миокарда [231, 232].
ЕОК IA (УУР А; УДД 2)
Комментарии: У пациентов с ОКСбпST,
ФВ ЛЖ £ 35% и сохраняющейся ишемией миокарда (включая выявленную при
нагрузочных тестах) до принятия решения о профилактической имплантации
кардиовертера- дефибриллятора (или прибора для ресинхронизирующей
терапии с функцией кардиовертера-дефибриллятора) рекомендуется
рассмотреть реваскуляризацию миокарда и повторно определить ФВ ЛЖ как
минимум через 6 месяцев.
5.2.Диспансерное наблюдение
-
После выписки из стационара рекомендуется диспансерное наблюдение за
всеми пациентами, перенесшими ИМпST, для реализации комплекса мер по
профилактике и лечению сердечно-сосудистых осложнений, своевременной
коррекции терапии и повышения приверженности к лечению [36, 327, 328].
ЕОК IС (УУР С; УДД 5)
Комментарий: в соответствии с Приказом Министерства
здравоохранения РФ от 15 ноября 2012 г. № 918н
«Об утверждении Порядка оказания медицинской помощи больным с
сердечно-сосудистыми заболеваниями» (с изменениями и дополнениями от 22
февраля 2019 г.) и Приказом Министерства здравоохранения РФ от 29 марта
2019 г. № 173н «Об утверждении порядка проведения диспансерного
наблюдения за взрослыми», диспансерное наблюдение пациентов, перенесших
инфаркт миокарда, в течение 12 месяцев после оказания медицинской помощи
в стационарных условиях медицинских организаций, осуществляется
врачом-кардиологом. Минимальная периодичность диспансерных приемов — не
реже 2 раз в год. Контролируемые показатели здоровья включают измерение
АД, измерение ЧСС, определение ХС ЛНП. По медицинским показаниям могут
быть назначены дополнительные профилактические, диагностические,
лечебные и реабилитационные мероприятия. В дальнейшем пожизненное
диспансерное наблюдение осуществляется врачом-терапевтом, прием (осмотр,
консультация) врача-кардиолога осуществляется по медицинским показаниям
при направлении врача- терапевта участкового (семейного врача).
У пациентов, перенесших ИМпST с осложненным течением заболевания, а
также нуждающихся в титровании доз лекарственных средств
(гиполипидемических, бета-адреноблокаторов, блокаторов
ренин-ангиотензин- альдостероновой системы, пероральных антикоагулянтов
и др.), частота диспансерных приемов должна определяться клинической
необходимостью. В частности, подбор гиполипидемической терапии требует
оценки ХС ЛНП каждые 4–6 недель, пока не будут достигнуты стабильные
целевые значения показателя.
Организация оказания медицинской помощи
Показания для госпитализации
Любое подозрение на ОКС(ИМ)пST является показанием для экстренной
госпитализации.
Пациенты ИМпST должны госпитализироваться в региональные сосудистые
центры для пациентов с ОКС, в кардиологические отделения с палатой
реанимации и интенсивной терапии для пациентов с ОКС (первичные
сосудистые отделения), а также в кардиологические отделения с палатой
реанимации и интенсивной терапии, специализирующиеся на лечении
пациентов с ОКС и включенные в схему маршрутизации таких пациентов в
регионе, но не имеющие статуса регионального сосудистого отделения или
первичного сосудистого отделения. Поскольку многим пациентам с
подозрением на ИМ может потребоваться углубленная дифференциальная
диагностика, их оптимально госпитализировать в многопрофильный
стационар с возможностью экстренной диагностики и лечения острой
коронарной и иной патологии. Маршрутизация пациентов с ИМпST должна быть
организована так, чтобы все они госпитализировались или как можно
быстрее переводились в стационар с возможностью инвазивного лечения
ИМпST.
-
На догоспитальном этапе не рекомендуется проведение диагностических
мероприятий, направленных на подтверждение или исключение ИМ [36, 306,
307].
ЕОК IC (УУР С; УДД 5)
Комментарий: на догоспитальном этапе для принятия решения о
дальнейшем ведении пациента с подозрением на ИМпST достаточно
регистрации ЭКГ. Определять уровень маркеров повреждения миокарда
нецелесообразно. В случае оказания помощи на догоспитальном этапе
фельдшерской бригадой обязательна передача ЭКГ по каналам связи в
специализированный диагностический центр с целью согласования ведения и
маршрутизации пациента.
-
При подозрении на ИМпST пациента, госпитализированного в стационар, не
располагающий возможностями для экстренной реваскуляризации,
рекомендуется своевременно перевести в лечебное учреждение, где
реализуется программа реваскуляризации при ИМ [36].
ЕОК IC (УУР С; УДД 5)
-
В каждом регионе рекомендуется разработать региональный протокол
маршрутизации пациентов с ИМпST с учетом действующих рекомендаций и
особенностей региона [36].
ЕОК IC (УУР С; УДД 5)
-
В каждом регионе рекомендуется выделить специализированное
кардиохирургическое отделение для проведения экстренных операций
коронарного шунтирования у пациентов с ИМ, а также разработать
региональные правила экстренного перевода таких пациентов [36].
ЕОК IC (УУР С; УДД 5)
Показания к выписке пациента из стационара
Продолжительность госпитализации определяется индивидуально в
соответствии с сердечным риском пациента, сопутствующими заболеваниями,
функциональным статусом и социальной поддержкой. В то же время пациенты
не должны находиться в больнице дольше необходимого по психосоциальным
причинам и с целью предупреждения внутригоспитальных инфекций.
Безопасность ранней выписки (48–96 часов) после первичного ЧКВ
определяется в первую очередь отсутствием ранних осложнений ИМпST, таких
как рецидив ишемии, тромбоз стента, острая сердечная недостаточность,
наджелудочковые и желудочковые аритмии, нарушения проводимости, разрыв
межжелудочковой перегородки или свободной стенки левого желудочка,
острая митральная недостаточность, перикардит, тромб левого желудочка с
угрозой системной эмболии.
Вместе с тем новые технологии (в первую очередь ЧКВ и агрессивная
антитромботическая терапия) могут также служить причиной развития
кровотечений, как связанных с местом доступа, так и других, в первую
очередь желудочно-кишечных и церебральных, а также
контраст-индуцированной острой почечной недостаточности. Рецидив ИМ в
послеоперационном периоде может быть связан либо с острым/подострым
тромбозом стента, либо с критическим стенозом или разрывом нестабильной
бляшки в изначально не инфаркт-связанном сегменте коронарной артерии.
В качестве инструмента стратификации риска ранней выписки может быть
рекомендована шкала Zwolle, основанная на шести клинических и
ангиографических признаках — возраст пациента, класс сердечной
недостаточности по Killip, локализация ИМ (передний или другой
локализации), время до реперфузии, наличие трехсосудистого поражения,
кровоток в инфаркт связанной артерии по TIMI (Приложение Г4) [30].
Показано, что данные факторы являются независимыми предикторами
30-дневной смертности. Пациенты с
≤3 баллами по шкале Zwolle имеют 0,5% риск 30-дневной смертности и могут
быть безопасно выписаны из стационара в первые 72 часа. Валидность шкалы
Zwolle была показана в целом ряде исследований [308–311].
-
Ранняя выписка пациентов с ИМпST низкого риска после первичного ЧКВ
рекомендована у отдельных пациентов, если организованы ранняя
реабилитация и адекватное наблюдение [321-326].
ЕОК IB (УУР A; УДД 2)
Комментарий: за время госпитализации пациент должен начать
реабилитацию, получить подробную информацию о случившемся, а также о
предстоящей модификации образа жизни. Кроме того, должна быть
инициирована медикаментозная терапия в рамках вторичной профилактики
(оптимальная
антитромбоцитарная терапия, бета-блокатор, ингибитор АПФ, ингибитор
ГМГ-КоА-редуктазы).
Иные организационные технологии
-
Интенсивное наблюдение с мониторированием ритма сердца рекомендуется
осуществлять за всеми пациентами с ИМпST до и в течение как минимум 24
часов после реперфузионного лечения и/или до клинической стабилизации
[36].
ЕОК IC (УУР С; УДД 5)
Комментарий: перед выпиской всем пациентам следует оценить
риск неблагоприятных событий в отдаленном периоде, учитывающий ФВ ЛЖ,
тяжесть поражения КА и полноту коронарной реваскуляризации, наличие
резидуальной ишемии, осложнения, отмеченные во время госпитализации, и
уровни метаболических маркеров, определенных в за время пребывания в
стационаре: общий холестерин, холестерин липопротеинов низкой плотности
(ХС-ЛПНП), триглицериды натощак, уровень гликемиии, а также показатели
функции почек (креатинин и расчетную СКФ).
Критерии оценки качества медицинской помощи
| № | Критерий качества | УДД | Уровень убедительности рекомендаций | ЕОК | Да/нет |
|---|---|---|---|---|---|
|
1 |
Указан временной интервал от момента обращения за медицинской помощью до |
2 |
А |
IB |
|
|
2 |
Время от постановки диагноза до введения проводника в инфаркт-связанную |
2 |
А |
IB |
|
|
3 |
Время от постановки/подтверждения диагноза в ЧКВ- центре до введения |
2 |
A |
IB |
|
|
4 |
Время от постановки диагноза в неинвазивном центре до начала |
2 |
A |
IB |
|
|
5 |
Начало ТЛТ в пределах 10 минут после постановки диагноза (при |
3 |
В |
IB |
|
|
6 |
Проведение коронарной ангиографии и, при необходимости, ЧКВ в пределах |
2 |
A |
IB |
|
|
7 |
При КГ/ЧКВ использован доступ через лучевую артерию |
1 |
B |
IA |
|
|
8 |
Исследование уровня тропонинов I, T в крови |
2 |
B |
IB |
|
|
9 |
Оценена динамика уровня сердечного тропонина I или T в крови при |
I |
A |
IA |
|
|
10 |
Выполнена ЭхоКГ в первые сутки госпитализации |
2 |
B |
IB |
|
|
11 |
Выполнена оценка ФВ ЛЖ перед выпиской |
1 |
A |
IA |
|
|
13 |
У пациентов, не имеющих показаний к длительному применению |
1 |
A |
IA |
|
|
14 |
У пациентов с показаниями к длительному применению антикоагулянтов |
1 |
А |
IА |
|
|
15 |
Использован бета-адреноблокатор у пациентов ИМпST с ФВ ЛЖ ≤40%. При |
1 |
A |
1А |
|
|
16 |
Использован ингибитор АПФ или блокатор рецепторов ангиотензина у |
1 |
A |
1А |
Список литературы
-
Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об
основах охраны здоровья граждан в Российской Федерации». -
Федеральное агентство по техническому регулированию и метрологии.
Национальный стандарт Российской Федерации. ГОСТ Р 52379-2005.
Надлежащая клиническая практика. Москва, 2005. -
Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об
обращении лекарственных средств». -
Андреева Н. С., Реброва О.Ю., Зорин Н.А. и др. Системы оценки
достоверности научных доказательств и убедительности рекомендаций:
сравнительная характеристика и перспективы унификации. Медицинские
технологии. Оценка и выбор. 2012;4:10–24. -
Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White
HD; ЕОК Scientific Document Group. Fourth universal definition of
myocardial infarction (2018). Eur Heart J 2019; 40: 237–269. -
Данные Росстата на 22.06.2019. URL:
www.gsk.ru -
Леонов С.А., Голубев Н.А., Зайченко Н.М. Сборник статистических
материалов по болезням системы кровообращения. ФГБУ «Центральный
Научно-исследовательский институт организации и информатизации
здравоохранения Министерства здравоохранения РФ». М., 2017. С. 1–295.
URL:
http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf
17.07.2019
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
McManus
DD, Gore J, Yarzebski J, Spencer F, Lessard D, Goldberg RJ. Recent
trends in the incidence, treatment, and outcomes of patients with STEMI
and NSTEMI. Am J Med 2011;124(1):40–47.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Эрлих
А.Д., Мацкеплишвили С.Т., Грацианский Н.А., Бузиашвили Ю.И. и др..
Первый московский регистр острого коронарного синдрома: характеристика
пациентов, лечение и исходы за время пребывания в стационаре.
Кардиология. 2013; 12:4–14.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Pasupathy
S, Air T, Dreyer RP, Tavella R, Beltrame JF. Systematic review of
patients presenting with suspected myocardial infarction and
nonobstructive coronary arteries. Circulation. 2015;131:861–870.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Niccoli
G, Scalone G, Crea F. Acute myocardial infarction with no obstructive
coronary atherosclerosis: mechanisms and management. Eur Heart J 2015;
36: 475–481.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Neumann
J.T., Twerenbold R., Ojeda F., Sörensen N.A., Chapman A.R., Shah A.S.V.,
Anand A., Boeddinghaus J., Nestelberger T., Badertscher P., Mokhtari A.,
Pickering J.W., Troughton R.W., Greenslade J., Parsonage W.,
Mueller‑Hennessen M., Gori T., Jernberg T., Morris N., Liebetrau C.,
Hamm C., Katus H.A., Münzel T., Landmesser U., Salomaa V., Iacoviello
L., Ferrario M.M., Giampaoli S., Kee F., Thorand B., Peters A., Borchini
R., Jørgensen T., Söderberg S., Sans S., Tunstall‑Pedoe H., Kuulasmaa
K., Renné T., Lackner K.J., Worster A., Body R., Ekelund U., Kavsak
P.A., Keller T., Lindahl B., Wild P., Giannitsis E., Than M., Cullen
L.A., Mills N.L., Mueller C., Zeller T., Westermann D., Blankenberg S.
Application of High-Sensitivity Troponin in Suspected Myocardial
Infarction. N Engl J Med 2019; 380: 2529-2540.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Pickering
JW, Than MP, Cullen L, Aldous S, Ter Avest E, Body R, Carlton EW,
Collinson P, Dupuy AM, Ekelund U, Eggers KM, Florkowski CM, Freund Y,
George P, Goodacre S, Greenslade JH, Jaffe AS, Lord SJ, Mokhtari A,
Mueller C, Munro A, Mustapha S, Parsonage W, Peacock WF, Pemberton C,
Richards AM, Sanchis J, Staub LP, Troughton R, Twerenbold R, Wildi K,
Young J. Rapid Rule-out of Acute Myocardial Infarction With a Single
High-Sensitivity Cardiac Troponin T Measurement Below the Limit of
Detection: A Collaborative Meta-analysis. Ann Intern Med 2017; 166:
715-3724.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
D»Ascenzo
F, Biondi-Zoccai G, Moretti C, Bollati M, Omede P et al: TIMI, GRACE and
alternative risk scores in acute coronary syndromes: a meta-analysis of
40 derivation studies on 216,552 patients and of 42 validation studies
on 31,625 patients. Contemporary clinical trials. 2012;33:507–514.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Giraldez
RR, Clare RM, Lopes RD, Dalby AJ, Prabhakaran D, Brogan GX Jr, Giugliano
RP, James SK, Tanguay JF, Pollack CV Jr, Harrington RA, Braunwald E,
Newby LK. Prevalence and clinical outcomes of undiagnosed diabetes
mellitus and prediabetes among patients with high-risk non-ST-segment
elevation acute coronary syndrome. Am Heart J. 2013;165:918–925.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Bartnik
M, Malmberg K, Norhammar A, Tenerz A, Ohrvik J, Ryden L. Newly detected
abnormal glucose tolerance: an important predictor of long-term outcome
after myocardial infarction. Eur Heart J 2004;25:1990–1997.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Boden
WE, Kleiger RE, Gibson RS et al. Electrocardiographic evolution of
posterior acute myocardial infarction: importance of early precordial
ST-segment depression. Am J Cardiol. 1987;59:782–787.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Rouan
GW, Lee TH, Cook EF, Brand DA, Weisberg MC et al. Clinical
characteristics and outcome of acute myocardial infarction in patients
with initially normal or nonspecific electrocardiograms (a report from
the Multicenter Chest
Pain
Study). Am J Cardiol. 1989;64:1087–1092.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
McCarthy
BD, Wong JB, Selker HP. Detecting acute cardiac ischemia in the
emergency department: a review of the literature. J Gen Intern Med.
1990;5:365–373.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Zalenski
RJ, Rydman RJ, Sloan EP et al. Value of posterior and right ventricular
leads in comparison to the standard 12-lead electrocardiogram in
evaluation of ST-segment elevation in suspected acute myocardial
infarction. Am J Cardiol. 1997;79: 1579–1585.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Fesmire
FM, Percy RF, Bardoner JB et al. Usefulness of automated serial 12-lead
ECG monitoring during the initial emergency department evaluation of
patients with chest pain. Ann Emerg Med. 1998; 31:3–11.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Savonitto
S, Ardissino D, Granger CB, Morando G, Prando MD et al. Prognostic value
of the admission electrocardiogram in acute coronary syndromes. JAMA
1999;281: 707–713.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Matetzky
S, Freimark D, Feinberg MS et al. Acute myocardial infarction with
isolated ST-segment elevation in posterior chest leads V7–9: «hidden»
ST-segment elevations revealing acute posterior infarction. J Am Coll
Cardiol. 1999;34:748–753.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Kim
HW, Faraneh-Far A, Kim RJ. Cardiovascular magnetic resonance in patients
with myocardial infarction. J Am Coll Cardiol. 2009;55:1–16.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Beek
AM, van Rossum AC. Cardiovascular magnetic resonance imaging in patients
with acute myocardial infarction. Heart 2010;96:237–243.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Kontos
MC, Jesse RL, Schmidt KL et al. Value of acute rest sestamibi perfusion
imaging for evaluation of patients admitted to the emergency department
with chest pain. J Am Coll Cardiol. 1997;30:976–982.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Udelson
JE, Beshansky JR, Ballin DS et al. Myocardial perfusion imaging for
evaluation and triage of patients with suspected acute cardiac ischemia:
a randomized controlled trial. JAMA 2002;288:2693–2700.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Goldstein
JA, Chinnaiyan KM, Abidov A et al. The CT-STAT (Coronary Computed
Tomographic Angiography for Systematic Triage of Acute Chest Pain
Patients to Treatment) trial J Am Coll Cardiol. 2011;58:1414-1422.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Hoffmann
U, Truong QA, Schoenfeld DA et al. Coronary CT angiography versus
standard evaluation in acute chest pain. N Engl J ed. 2012;367:299–308.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
De
Luca G, Suryapranata H, van»t Hof AWJ, de Boer M-J, Hoorntje JCA,
Dambrink J-HE et al. Prognostic assessment of patients with acute
myocardial infarction treated with primary angioplasty: implications for
early discharge. Circulation. 2004;109:2737–2743.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Fibrinolytic
Therapy Trialists’ (СTT) Collaborative Group. Indications for
fibrinolytic therapy in suspected acute myocardial infarction:
collaborative overview of early mortality and major morbidity results
from all randomised trials of more than 1000 patients. Lancet.
1994;343:311–322. Erratum in: Lancet. 1994;343:742-782.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Keeley
EC, Boura JA, Grines CL. Primary angioplasty versus intravenous
thrombolytic therapy for acute myocardial infarction: a quantitative
review of 23 randomised trials. Lancet. 2003;361:13–20.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Hochman
JS, Lamas GA, Buller CE, Dzavik V, Reynolds HR, Abramsky SJ,Forman S,
Ruzyllo W, Maggioni AP, White H, Sadowski Z, Carvalho AC, Rankin JM,
Renkin JP, Steg PG, Mascette AM, Sopko G, Pfisterer ME, Leor J, Fridrich
V, Mark DB, Knatterud GL, Occluded Artery Trial Investigators. Coronary
intervention for persistent occlusion after myocardial infarction. N
Engl J Med. 2006;355(23):2395–2407.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Ioannidis
JP, Katritsis DG. Percutaneous coronary intervention for late
reperfusion after myocardial infarction in stable patients. Am Heart J.
2007;154(6):1065–1071.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Menon
V, Pearte CA, Buller CE, Steg PG, Forman SA, White HD, Marino PN,
Katritsis DG, Caramori P, Lasevitch R, Loboz-Grudzien K, Zurakowski A,
Lamas GA, Hochman JS. Lack of benefit from percutaneous intervention of
persistently occluded infarct arteries after the acute phase of
myocardial infarction is time independent: insights from Occluded Artery
Trial. Eur Heart J. 2009;30(2):183–191.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Ibanez
B, James S, Agewall S et al. 2017 ESC Guidelines for the management of
acute myocardial infarction in patients presenting with ST-segment
elevation: the task force for the management of acute myocardial
infarction in patients presenting with ST-segment elevation of the
European Society of Cardiology. Eur Heart J. 2018;39:119–177.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Schomig
A, Mehilli J, Antoniucci D, Ndrepepa G, Markwardt C, Di Pede F, Nekolla
SG, Schlotterbeck K, Schuhlen H, Pache J, Seyfarth M, Martinoff S,
Benzer W, Schmitt C, Dirschinger J, Schwaiger M, Kastrati A. Beyond 12
hours reperfusion alternative evaluation trial investigators. Mechanical
reperfusion in patients with acute myocardial
infarction
presenting more than 12 hours from symptom onset: a randomized
controlled trial. JAMA. 2005;293(23):2865–2872.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Nadrepepa
G, Kastrati A, Mehilli J, Antoniucci D, Schomig A. Mechanical
reperfusion and long-term mortality in patients with acute myocardial
infarction presenting 12 to 48 hours from onset of symptoms. JAMA.
2009;301(5):487–488.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Hochman
JS, Sleeper LA, Webb JG et al; for the SHOCK Investigators. Early
revascularization in acute myocardial infarction complicated by
cardiogenic shock. N Engl J Med. 1999;341:625–634.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Wu
AH, Parsons L, Every NR et al. Hospital outcomes in patients presenting
with congestive heart failure complicating acute myocardial infarction:
a report from the Second National Registry of Myocardial Infarction
(NRMI-2). J Am Coll Cardiol. 2002;40:1389–1394.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Zahn
R, Schuster S, Schiele R et al; Maximal Individual Therapy in Acute
Myocardial Infarction (MITRA) Study Group. Comparison of primary
angioplasty with conservative therapy in patients with acute myocardial
infarction and contraindications for thrombolytic therapy. Catheter
Cardiovasc Interv. 1999;46:127–133.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Grzybowski
M, Clements EA, Parsons L et al. Mortality benefit of immediate
revascularization of acute ST-segment elevation myocardial infarction in
patients with contraindications to thrombolytic therapy: a propensity
analysis. JAMA. 2003;290:1891–1898.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Cucherat
M, Bonnefoy E, Tremeau G. Primary angioplasty versus intravenous
thrombolysis for acute myocardial infarction. Cochrane Database Syst
Rev. 2003;3:CD001560..
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Bangalore
S, Toklu B, Wetterslev J. Complete versus culprit-only revascularization
for ST-segment-elevation myocardial infarction and multivessel disease:
a meta-analysis and trial sequential analysis of randomized trials. Circ
Cardiovasc Interv. 2015;8(4):e002142.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Elgendy
IY, Mahmoud AN, Kumbhani DJ, Bhatt DL, Bavry AA. Complete or
culprit-only revascularization for patients with multivessel coronary
artery disease undergoing percutaneous coronary intervention: a pairwise
and network meta-analysis of randomized trials. JACC Cardiovasc Interv.
2017;10(4):315–324.
(http://mednet.ru/images/stories/files/CMT/kardioilogiya_2017.pdf%2017.07.2019) -
Mehta
SR, Wood DA, Storey RF, Mehran R, Bainey KR, Nguyen H, Meeks B, Di
Pasquale G, López-Sendón J, Faxon DP, Mauri L, Rao SV, Feldman L, Steg
PG, Avezum Á, Sheth T, Pinilla-Echeverri N, Moreno R, Campo G, Wrigley
B, Kedev S, Sutton A, Oliver R, Rodés-Cabau J, Stanković G, Welsh R,
Lavi S, Cantor WJ, Wang J, Nakamya J, Bangdiwala SI, Cairns JA; Complete
Trial Steering Committee and Investigators. Complete revascularization
with multivessel PCI for myocardial infarction. N Engl J Med. 2019 Oct
10;381(15):1411–1421. doi: 10.1056/NEJMoa1907775
(https://clinicaltrials.gov/ct2/bye/rQoPWwoRrXS9-i-wudNgpQDxudhWudNzlXNiZip9Ei7ym67VZRFjWgF8-
KC8A6h9Ei4L3BUgWwNG0it.) -
Thiele
H, Akin I, Sandri M, Fuernau G et al., on behalf of the CULPRIT‐SHOCK
Investigators. PCI strategies in patients with acute myocardial
infarction and cardiogenic shock. N Engl J Med. 2017; 377:2419–2432.
(https://clinicaltrials.gov/ct2/bye/rQoPWwoRrXS9-i-wudNgpQDxudhWudNzlXNiZip9Ei7ym67VZRFjWgF8-
KC8A6h9Ei4L3BUgWwNG0it.) -
Thiele
H, Akin I, Sandri M et al., on behalf of the CULPRIT-SHOCK
Investigators. One-year outcomes after PCI strategies in cardiogenic
shock. (https://clinicaltrials.gov/ct2/bye/rQoPWwoRrXS9-i-
wudNgpQDxudhWudNzlXNiZip9Ei7ym67VZRFjWgF8-KC8A6h9Ei4L3BUgWwNG0it.)N
Engl J Med. 2018;379:1699– 1710.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Zhu MM, Feit A,
Chadow H et al. Primary stent implantation compared with primary balloon
angioplasty for acute myocardial infarction: a meta-analysis of
randomized clinical trials. Am J Cardiol. 2001;88:297–301.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Nordmann AJ,
Hengstler P, Harr T, Young J, Bucher HC. Clinical outcomes of primary
stenting versus balloon angioplasty in patients with myocardial
infarction: a meta-analysis of randomized controlled trials. Am J Med.
2004;116(4):253–262.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Kastrati A, Dibra A,
Spaulding C, Laarman GJ, Menichelli M, Valgimigli M, DiLorenzo E, Kaiser
C, Tierala I, Mehilli J, Seyfarth M, Varenne O, Dirksen MT, Percoco G,
Varricchio A, Pittl U, Syvanne M, Suttorp MJ, Violini R, Schomig A.
Meta-analysis of randomized trials on drug-eluting stents vs. bare-metal
stents in patients with acute myocardial infarction. Eur Heart J
2007;28(22):2706–2713.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Sabate M, Reaber L,
Heg D, Brugaletta S et al. Comparison of newer-generation drug-eluting
with bare-metal stents in patients with acute ST-segment elevation
myocardial infarction: a pooled analysis of the EXAMINATION (clinical
Evaluation of the Xience-V stent in Acute Myocardial INfArcTION) and
COMFORTABLE-AMI (Comparison of biolimus eluted from an erodible stent
coating with bare metal stents in acute ST-elevation myocardial
infarction) trials. JACC Cardiovasc Interv 2014;7:55–63.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Philip F, Stewart S,
Southard J. Very late stent thrombosis with second generation drug
eluting stents compared to bare metal stents: Network meta-analysis of
randomized primary percutaneous coronary intervention trials. Cathet
Cardiovasc Interv. 2016;88:38–48.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Jolly SS, James S,
Dzavik V, Cairns JA, Mahmoud KD, Zijlstra F et al. Thrombus aspiration
in ST-segment-elevation myocardial infarction: an individual patient
meta-analysis: Thrombectomy trialists collaboration. Circulation.
2017;135:143–152. (http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Jang JS, Jin HY, Seo
JS et al. The transradial versus the transfemoral approach for primary
percutaneous coronary intervention in patients with acute myocardial
infarction: a systematic review and meta-analysis. EuroIntervention.
2012;8(4):501–510. 32.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Joyal D, Bertrand OF,
Rinfret S et al. Meta-analysis of ten trials on the effectiveness of the
radial versus the femoral approach in primary percutaneous coronary
intervention. Am J Cardiol. 2012;109(6):813–818.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Bertrand OF, Bélisle
P, Joyal D et al. Comparison of transradial and femoral approaches for
percutaneous coronary interventions: a systematic review and
hierarchical Bayesian meta-analysis. Am J Cardiol. 2012;163(4):632‒648.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Valgimigli M, Gagnor
A, Calabró P, et al. Radial versus femoral access in patients with acute
coronary syndromes undergoing invasive management: a randomised
multicentre trial. Lancet. 2015;385(9986):2465‒2476. 31.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Boersma E, Primary
Coronary Angioplasty vs Thrombolysis Group. Does time matter? A pooled
analysis of randomized clinical trials comparing primary percutaneous
coronary intervention and in-hospital fibrinolysis in acute myocardial
infarction patients. Eur Heart J. 2006;27(7):779–788.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Armstrong PW,
Gershlick AH, Goldstein P, Wilcox R, Danays T, Lambert Y,Sulimov V,
Rosell Ortiz F, Ostojic M, Welsh RC, Carvalho AC, Nanas J, Arntz HR,
Halvorsen S, Huber K, Grajek S, FrЕОКo C, Bluhmki E, Regelin A,
Vandenberghe K, Bogaerts K, Van de Werf F, STREAM Investigative Team.
Fibrinolysis or primary PCI in ST-segment elevation myocardial
infarction. N Engl J Med. 2013;368(15):1379–1387.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
Morrison LJ, Verbeek
PR, McDonald AC, et al. Mortality and prehospital thrombolysis for acute
myocardial infarction: a meta-analysis. J Am Med Assoc.
2000;283:2686–2692.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1808788) -
McCaul
M, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=McCaul%20M%5BAuthor%5D&cauthor=true&cauthor_uid=25208209)Lourens
A, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Lourens%20A%5BAuthor%5D&cauthor=true&cauthor_uid=25208209)Kredo T. Pre-hospital versus in-hospital thrombolysis for ST-elevation
myocardial infarction (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Kredo%20T%5BAuthor%5D&cauthor=true&cauthor_uid=25208209)Cochrane
Database Syst Rev. 2014, Issue 9. Art. No.: CD010191. doi:
10.1002/14651858.CD010191.pub2
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Bonnefoy E, Steg PG,
Boutitie F, Dubien PY, Lapostolle F, Roncalli J, Dissait F, Vanzetto G,
Leizorowicz A, Kirkorian G, Mercier C, McFadden EP, Touboul P.
Comparison of primary angioplasty and pre-hospital fibrinolysis in acute
myocardial infarction (CAPTIM) trial: a 5-year follow-up. Eur Heart J.
2009;30 (13):1598–1606. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
O»Gara PT, Kushner FG,
Ascheim DD et al. 2013 ACCF/aha guideline for the management of
ST-elevation myocardial infarction. A report of the American College of
Cardiology Foundation/American Heart Association Task Force on Practice
Guidelines. JACC 2013; 61: 485–510.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Gershlick AH,
Stephens-Lloyd A, Hughes S, Abrams KR, Stevens SE, Uren NG, de Belder A,
Davis J, Pitt M, Banning A, Baumbach A, Shiu MF, Schofield P, Dawkins
KD, Henderson RA, Oldroyd KG, Wilcox R, REACT Trial Investigators.
Rescue angioplasty after failed thrombolytic therapy for acute
myocardial infarction. N Engl J Med. 2005;353(26):2758–2768.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Borgia F, Goodman SG,
Halvorsen S, Cantor WJ, Piscione F, Le May MR, Fernandez-Aviles F,
Sanchez PL, Dimopoulos K, Scheller B, Armstrong PW, Di Mario C. Early
routine percutaneous coronary intervention after fibrinolysis vs.
standard therapy in ST-segment elevation myocardial infarction: a
meta-analysis. Eur Heart J. 2010;31(17):2156– 2169.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
D’Souza SP, Mamas MA,
Fraser DG, Fath-Ordoubadi F. Routine early coronary angioplasty versus
ischaemia-guided angioplasty after thrombolysis in acute ST-elevation
myocardial infarction: a meta-analysis. Eur Heart J 2011;32(8):972–982.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Cantor WJ, Fitchett D,
Borgundvaag B, Ducas J, Heffernan M, Cohen EA, Morrison LJ, Langer A,
Dzavik V, Mehta SR, Lazzam C, Schwartz B, Casanova A, Goodman SG,
TRANSFER-AMI Trial Investigators. Routine early angioplasty after
fibrinolysis for acute myocardial infarction. N Engl J Med
2009;360(26):2705–2718. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
GUSTO Investigators. An
international randomized trial comparing four thrombolytic strategies
for acute myocardial infarction. The GUSTO investigators. N Engl J Med.
1993;329:673–682. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Ellis SG, da Silva ER,
Heyndrickx G, Talley JD, Cernigliaro C, Steg G, Spaulding C, Nobuyoshi
M, Erbel R, Vassanelli C, Topol EJ, RЕSCUE Investigators. Randomized
comparison of rescue angioplasty with conservative management of
patients with early failure of thrombolysis for acute anterior
myocardial infarction. Circulation. 1994;90(5):2280– 2284.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Sutton AGC, Campbell PG,
Graham R et al. A randomized trial of rescue angioplasty versus a
conservative approach for failed fibrinolysis in ST-segment elevation
myocardial infarction: the Middlesbrough Early Revascularization to
Limit INfarction (MERLIN)
trial. J Am Coll Cardiol. 2004;44:287–296.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Wijeysundera HC,
Vijayaraghavan R, Nallamothu BK et al. Rescue angioplasty or repeat
fibrinolysis after failed fibrinolytic therapy for ST-segment myocardial
infarction: a meta-analysis of randomized trials. J Am Coll Cardiol.
2007;49:422–430. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Collet JP, Montalesot G, Le
May M et al. Percutaneous coronary intervention after fibrinolysis: a
multiple meta- analyses approach according to the type of strategy. J Am
Coll Cardiol. 2006;48:1326 –1335.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Appleton DL, Abbate A,
Biondi-Zoccai GGL. Late percutaneous coronary intervention for the
totally occluded infarct- related artery: a meta-analysis of the effects
on cardiac function and remodeling. Catheter Cardiovasc Interv.
2008;71:772–781. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Ellis SG, Tendera M, de
Belder MA et al. Facilitated PCI in patients with ST-elevation
myocardial infarction. N Engl J Med. 2008;358:2205–2217.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Thiele H, Eitel I, Meinberg
C, et al. Randomized comparison of pre-hospital-initiated facilitated
percutaneous coronary intervention versus primary percutaneous coronary
intervention in acute myocardial infarction very early after symptom
onset: the LIPSIA-STEMI trial (Leipzig immediate prehospital facilitated
angioplasty in ST-segment myocardial infarction) JACC Cardiovasc Interv.
2011;4:605–614. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
The ASSENT-4 PCI
Investigators.Primary versus tenecteplase-facilitated percutaneous
coronary intervention in patients with ST-segment elevation acute
myocardial infarction (ASSENT-4 PCI): randomised trial. Lancet.
2006;367:569–578. (https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Hochman JS, Buller CE,
Sleeper LA et al. Cardiogenic shock complicating acute myocardial
infarction: etiologies, management and outcome: a report from the SHOCK
Trial Registry: SHould we emergently revascularize Occluded Coronaries
for cardiogenic shocK? J Am Coll Cardiol. 2000;36:1063–1070.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Dalrymple-Hay MJ, Langley
SM, Sami SA et al. Should coronary artery bypass grafting be performed
at the same time as repair of a post-infarct ventricular septal defect?
Eur J Cardiothorac Surg. 1998;13: 286–292.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Menon V, Webb JG, Hillis LD
et al. Outcome and profile of ventricular septal rupture with cardiogenic
shock after myocardial infarction: a report from the SHOCK Trial
Registry: SHould we emergently revascularize Occluded Coronaries in
cardiogenic shocK? J Am Coll Cardiol. 2000; 36:1110–1116.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
ISIS-2 (Second
International Study of Infarct Survival) Collaborative Group. Randomised
trial of intravenous streptokinase, oral aspirin, both, or neither among
17,187 cases of suspected acute myocardial infarction: ISIS-2. Lancet.
1988;2(8607):349–360. 213, 214.
(https://www.ncbi.nlm.nih.gov/pubmed/25208209) -
Antithrombotic
Trialists» Collaboration. Collaborative meta-analysis of randomised
trials of antiplatelet therapy for prevention of death, myocardial
infarction, and stroke in high risk patients.
(https://www.ncbi.nlm.nih.gov/pubmed/?
term=Antithrombotic%20Trialists%27%20Collaboration%5BCorporate%20Author%5D)BMJ.
2002 Jan 12;324(7329):71–86.
(https://www.ncbi.nlm.nih.gov/pubmed/11786451) -
Collins
R, MacMahon S, Flather M et al. Clinical effects of anticoagulant
therapy in suspected acute myocardial infarction: systematic overview of
randomised trials. BMJ. 1996;313:652.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-infarction/abstract/8) -
Eikelboom
JW, Quinlan DJ, Mehta SR et al. Unfractionated and low-molecular-weight
heparin as adjuncts to thrombolysis in aspirin-treated patients with
ST-elevation acute myocardial infarction: a meta-analysis of the
randomized trials. Circulation 2005; 112:3855.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-
acute-st-elevation-myocardial-infarction/abstract/11) -
Yusuf
S, Mehta SR, Xie C et al. Effects of reviparin, a low-molecular-weight
heparin, on mortality, reinfarction, and strokes in patients with acute
myocardial infarction presenting with ST-segment elevation. JAMA
2005;293:427.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/16) -
Yusuf
S, Mehta SR, Chrolavicius S et al. Effects of fondaparinux on mortality
and reinfarction in patients with acute ST-segment elevation myocardial
infarction: the OASIS-6 randomized trial. JAMA. 2006; 295:1519.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/24) -
White
H, Hirulog and Early Reperfusion or Occlusion (HERO)-2 Trial
Investigators. Thrombin-specific anticoagulation with bivalirudin versus
heparin in patients receiving fibrinolytic therapy for acute myocardial
infarction: the HERO-2 randomised trial. Lancet. 2001;358:1855.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/28) -
Navarese
EP, De Luca G, Castriota F et al. Low-molecular-weight heparins vs.
unfractionated heparin in the setting of percutaneous coronary
intervention for ST-elevation myocardial infarction: a meta-analysis. J
Thromb Haemost. 2011; 9:1902.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/41) -
Silvain
J, Beygui F, Barthélémy O et al. Efficacy and safety of enoxaparin
versus unfractionated heparin during percutaneous coronary intervention:
systematic review and meta-analysis. BMJ. 2012; 344:e553.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/42) -
Capodanno
D, Gargiulo G, Capranzano P et al. Bivalirudin versus heparin with or
without glycoprotein IIb/IIIa inhibitors in patients with STEMI
undergoing primary PCI: An updated meta-analysis of 10,350 patients from
five randomized clinical trials. Eur Heart J Acute Cardiovasc Care.
2016;5:253–262.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/42) -
Erlinge
D, Omerovic E, Fröbert O et al. Bivalirudin versus heparin monotherapy
in myocardial infarction. N Engl J Med. 2017;377:1132–1142.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-
myocardial-infarction/abstract/42) -
Chen
ZM, Jiang LX, Chen YP, Xie JX, Pan HC, Peto R, Collins R, Liu LS, COMMIT
(ClOpidogrel and Metoprolol in Myocardial Infarction Trial)
Collaborative Group. Addition of clopidogrel to aspirin in 45,852
patients with acute myocardial infarction: randomised placebo-controlled
trial. Lancet 2005;366(9497):1607–1621.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/42) -
Sabatine
MS, Cannon CP, Gibson CM, Lopez-Sendon JL, Montalesot G, Theroux P,
Claeys MJ, Cools F, Hill KA, Skene AM, McCabe CH, Braunwald E,
CLARITY-TIMI 28 Investigators. Addition of clopidogrel to aspirin and
fibrinolytic therapy for myocardial infarction with ST-segment
elevation. N Engl J Med. 2005;352(12):1179–1189.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/42) -
Steg
PG, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Steg%20PG%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)James
S, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=James%20S%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Harrington
RA, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Harrington%20RA%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Ardissino
D, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Ardissino%20D%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Becker
RC, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Becker%20RC%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Cannon
CP, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Cannon%20CP%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Emanuelsson
H, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Emanuelsson%20H%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Finkelstein
A, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Finkelstein%20A%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Husted
S, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Husted%20S%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Katus
H, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Katus%20H%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Kilhamn
J, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Kilhamn%20J%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Olofsson
S, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Olofsson%20S%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Storey
RF, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Storey%20RF%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Weaver
WD, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Weaver%20WD%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)Wallentin
L; (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Wallentin%20L%5BAuthor%5D&cauthor=true&cauthor_uid=21060072)PLATO
Study Group. Ticagrelor versus clopidogrel in patients with ST-elevation
acute coronary syndromes intended for reperfusion with primary
percutaneous coronary intervention: A Platelet Inhibition and Patient
Outcomes (PLATO) trial subgroup analysis.
(https://www.ncbi.nlm.nih.gov/pubmed/?
term=PLATO%20Study%20Group%5BCorporate%20Author%5D)Circulation.
2010 Nov 23;122(21):2131–2141.
(https://www.ncbi.nlm.nih.gov/pubmed/21060072) -
Montalescot G, Wiviott SD,
Braunwald E, Murphy SA, Gibson CM, McCabe CH et al. Prasugrel compared
with clopidogrel in patients undergoing percutaneous coronary
intervention for ST-elevation myocardial infarction (TRITON-TIMI 38):
double-blind, randomised controlled trial. Lancet 2009;373:723–731.
10.1016/S0140- 6736(09)60441-4.
(https://www.ncbi.nlm.nih.gov/pubmed/21060072) -
Montalesot G, Van’t Hof AW,
Lapostolle F et al., on behalf of the ATLANTIC Investigators.
Prehospital Ticagrelor in
ST-Segment Elevation
Myocardial Infarction. (https://www.ncbi.nlm.nih.gov/pubmed/21060072)N
Engl J Med. 2014;371:1016–1027.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Berwanger O, Nicolau
JC, Carvalho AC et al. Ticagrelor vs clopidogrel after fibrinolytic
therapy in patients with ST- elevation myocardial infarction: a
randomized clinical trial. JAMA Cardiol. 2018 May 1; 3(5):391–399.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Wallentin L, Becker
RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute
coronary syndromes. N Engl J Med. 2009;361:1045–1057.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Sanchez PL, Gimeno F,
Ancillo P, Sanz JJ, Alonso-Briales JH, Bosa F, Santos I, Sanchis J,
Bethencourt A, Lopez-Messa J, de Prado AP, Alonso JJ, San Roman JA,
Fernandez-Aviles F. Role of the paclitaxel-eluting stent and tirofiban
in patients with ST-elevation myocardial infarction undergoing
postfibrinolysis angioplasty: the GRACIA-3 randomized clinical trial.
Circ Cardiovasc Interv. 2010;3(4):297–307.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Gurm HS, Lincoff AM,
Lee D, Tang WH, Jia G, Booth JE, Califf RM, Ohman EM, Van de Werf F,
Armstrong PW, Guetta V, Wilcox R, Topol EJ, GUSTO V Trial. Outcome of
acute ST-segment elevation myocardial infarction in diabetics treated
with fibrinolytic or combination reduced fibrinolytic therapy and
platelet glycoprotein IIb/IIIa inhibition: lessons from the GUSTO V
trial. J Am Coll Cardiol. 2004 Feb 18; 43(4):542–548.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Baird SH, Menown IB,
McBride SJ et al. Randomized comparison of enoxaparin with
unfractionated heparin following fibrinolytic therapy for acute
myocardial infarction. Eur Heart J. 2002;23:627–632.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Antman EM,
Louwerenburg HW, Baars HF et al. Enoxaparin as adjunctive antithrombin
therapy for ST-elevation myocardial infarction: results of the
ENTIRE-Thrombolysis in Myocardial Infarction (TIMI) 23 Trial.
Circulation. 2002;105:1642–1649.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Wallentin L,
Goldstein P, Armstrong PW et al. Efficacy and safety of tenecteplase in
combination with the low- molecular-weight heparin enoxaparin or
unfractionated heparin in the prehospital setting: the Assessment of the
Safety and Efficacy of a New Thrombolytic Regimen (ASSENT)-3 PLUS
randomized trial in acute myocardial infarction. Circulation.
2003;108:135–142. (http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Giraldez RR, Nicolau
JC, Corbalan R, Gurfinkel EP, Juarez U, Lopez-Sendon J, Parkhomenko A,
Molhoek P, Mohanavelu S, Morrow DA, Antman EM. Enoxaparin is superior to
unfractionated heparin in patients with ST elevation myocardial
infarction undergoing fibrinolysis regardless of the choice of lytic: an
ExTRACT-TIMI 25 analysis. Eur Heart J. 2007;28(13):1566–1573.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Eikelboom JW, Quinlan
DJ, Mehta SR et al. Unfractionated and low-molecular-weight heparin as
adjuncts to thrombolysis in aspirin-treated patients with ST-elevation
acute myocardial infarction: a meta-analysis of the randomized trials.
Circulation. 2005;112:3855–3867.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Simoons M,
Krzeminska-Pakula M, Alonso A et al. Improved reperfusion and clinical
outcome with enoxaparin as an adjunct to streptokinase thrombolysis in
acute myocardial infarction. The AMI-SK study. Eur Heart J.
2002;23:1282– 1290.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1407024) -
Yusuf
S, Mehta SR, Chrolavicius S et al. Effects of fondaparinux on mortality
and reinfarction in patients with acute ST-segment elevation myocardial
infarction: the OASIS-6 randomized trial. JAMA. 2006; 295:1519.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/24) -
Peters
RJ, Joyner C, Bassand JP, Afzal R, Chrolavicius S, Mehta SR et al. The
role of fondaparinux as an adjunct to thrombolytic therapy in acute
myocardial infarction: a subgroup analysis of the OASIS-6 trial. Eur
Heart J. 2008;29(3):324–331.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/24) -
de
Bono DP, Simoons ML, Tijssen J, Arnold AE, Betriu A, Burgersdijk C et
al. Effect of early intravenous heparin on coronary patency, infarct
size, and bleeding complications after alteplase thrombolysis: Results
of a randomised double blind European Cooperative Study Group trial. Br
Heart J. 1992; 67(2):122–128.
(https://www.uptodate.com/contents/anticoagulant-therapy-in-acute-st-elevation-myocardial-
infarction/abstract/24) -
CAPRIE
Steering Committee. A randomised, blinded trial of clopidogrel versus
aspirin in patients at risk of ischaemic events (CAPRIE).
(https://www.ncbi.nlm.nih.gov/pubmed/?
term=CAPRIE%20Steering%20Committee%5BCorporate%20Author%5D)Lancet.1996
Nov 16;348(9038):1329–1339.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Silvain J, Beygui F,
Barthelemy O, Pollack C, Jr, Cohen M, Zeymer U, Huber K, Goldstein P,
Cayla G, Collet JP, Vicaut E, Montalescot G. Efficacy and safety of
enoxaparin versus unfractionated heparin during percutaneous coronary
intervention: systematic review and meta-analysis. BMJ. 2012;344:e553.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Cavender MA, Sabatine MS.
Bivalirudin versus heparin in patients planned for percutaneous coronary
intervention: a meta-analysis of randomised controlled trials. Lancet.
2014;384(9943):599–606. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Capodanno D, Gargiulo G,
Capranzano P, Mehran R, Tamburino C, Stone GW. Bivalirudin versus
heparin with or without glycoprotein IIb/IIIa inhibitors in patients
with STEMI undergoing primary PCI: an updated meta-analysis of 10,350
patients from five randomized clinical trials. Eur Heart J Acute
Cardiovasc Care. 2016;5(3):253–262.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Bonin M, Mewton N, Roubille
F, Morel O et al; for CIRCUS Study Investigators. Effect and safety of
morphine use in acute anterior ST-segment elevation myocardial
infarction. J Am Heart Assoc. 2018 Feb 10;7(4). pii: e006833. doi:
10.1161/JAHA.117.006833. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Lapostolle F, Van»t Hof AW,
Hamm CW, Stibbe O et al. for ATLANTIC Investigators. Morphine and
ticagrelor interaction in primary percutaneous coronary intervention in
ST-segment elevation myocardial infarction: ATLANTIC-Morphine. Am J
Cardiovasc Drugs. 2019 Apr;19(2):173–183. doi: 10.1007/s40256-018-0305-0
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Thomas MR, Morton AC,
Hossain R, Chen B, Luo L, Shahari NN, Hua P, Beniston RG, Judge HM,
Storey RF. Morphine delays the onset of action of prasugrel in patients
with prior history of ST-elevation myocardial infarction. Thromb
Haemost. 2016 Jul 4;116(1):96–102. doi: 10.1160/TH16-02-0102. Epub 2016,
Apr 21. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Hobl EL, Stimpfl T, Ebner J,
Schoergenhofer C, Derhaschnig U, Sunder-Plassmann R, Jilma-Stohlawetz P,
Mannhalter C, Posch M, Jilma B. Morphine decreases clopidogrel
concentrations and effects: a randomized, double-blind,
placebo-controlled trial. J Am Coll Cardiol 2014;63(7):630–635.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Hofmann R, James SK, PhD,
Jernberg T, MD, Lindahl B, Erlinge D, Witt N, Arefalk G, Frick M,
Alfredsson J, Nilsson L, Ravn‑Fischer A, Omerovic E, Kellerth T, Sparv
D, Ekelund U, Linder R, Ekström M, Lauermann J, Haaga U, Pernow J,
Östlund O, Herlitz J, Svensson L, DETO2X-SWEDEHEART Investigators.
Oxygen therapy in suspected acute myocardial infarction. N Engl J Med
2017; 377:1240–1249. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Stub D, Smith K, Bernard S,
Nehme Z, Stephenson M, Bray JE, Cameron P, Barger B, Ellims AH1, Taylor
AJ, Meredith IT1, Kaye DM; AVOID Investigators. Air versus oxygen in
ST-segment-elevation myocardial infarction. Circulation. 2015 Jun
16;131(24):2143–2150. doi: 10.1161/CIRCULATIONAHA.114.014494. Epub 2015,
May 22. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
ISIS-4 (Fourth International
Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised
factorial trial assessing early oral captopril, oral mononitrate, and
intravenous magnesium sulphate in 58,050 patients with suspected acute
myocardial infarction. Lancet 1995;345(8951):669–685.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
ISSI-3: effects of
lisinopril and transdermal glyceryl trinitrate singly and together on
6-week mortality and ventricular function after acute myocardial
infarction. Gruppo Italiano per lo STudio della Sopravvivenza
nell’infarto Miocardico // Lancet. 1994. Vol. 343. 1115.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Mooss AN, Hilleman DE,
Mohiuddin SM, Hunter CB. Safety of esmolol in patients with acute
myocardial infarction treated with thrombolytic therapy who had relative
contraindications to beta-blocker therapy. Ann Pharmacother. 1994
Jun;28(6):701-703. (https://www.ncbi.nlm.nih.gov/pubmed/8918275) -
Ann Pharmacother. 1994
Jun;28(6):701-3.Frishman WH, Ruggio J, Furberg C.
(https://www.ncbi.nlm.nih.gov/pubmed/8918275)Use
of beta-adrenergic blocking agents after myocardial infarction. Postgrad
Med. 1985 Dec;78(8):40-6 (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Postgrad
Med. 1985 Dec;78(8):40-6 Freemantle N, Cleland J, Young P, Mason J,
Harrison J. Beta blockade after myocardial infarction: systematic review
and meta regression analysis. BMJ 1999;318(7200):1730–1737.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Roolvink
V, Ibanez B, Ottervanger JP, Pizarro G, van Royen N, Mateos A, Dambrink
JH, Eskalera N, Lipsic E, Albarran A, Fernandez-Ortiz A,
Fernandez-Aviles F, Goicolea J, Botas J, Remkes W, Hernandez-Jaras V,
Kedhi E, Zamorano JL, Navarro F, Alfonso F, Garcia-Lledo A, Alonso J,
van Leeuwen M, Nijveldt R, Postma S, Kolkman E, Gosselink M, de Smet B,
Rasoul S, Piek JJ, Fuster V, van ’t Hof AW, EARLY-BAMI Investigators.
Early intravenous beta-blockers in patients with ST-segment elevation
myocardial infarction before primary percutaneous coronary intervention.
J Am Coll Cardiol. 2016;67(23):2705–2715.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Watanabe
H, Ozasa N, Morimoto T, Shiomi H, Bingyuan B, Suwa S, Nakagawa Y, Izumi
4, Kadota K, Ikeguchi S, Hibi K, Furukawa Y, Kaji S, Suzuki T, Akao M,
Inada T, Hayashi Y, Nanasato M, Okutsu M, Kametani R, Sone T, Sugimura
Y, Kawai K, Abe M, Kaneko H, Nakamura S, Kimura T; CAPITAL-RCT
investigators. Long-term use of carvedilol in patients with ST-segment
elevation myocardial infarction treated with primary percutaneous
coronary intervention. PLoS One. 2018 Aug 28;13(8):e0199347.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Bangalore
S, Makani H, Radford M, Thakur K, Toklu B, Katz SD, DiNicolantonio JJ,
Devereaux PJ, Alexander KP, Wetterslev J, Messerli FH. Clinical outcomes
with β-blockers for myocardial infarction: a meta-analysis of randomized
trials. Am J Med. 2014 Oct;127(10):939–953.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Huang
BT, Huang FY, Zuo ZL, Liao YB, Heng Y, Wang PJ, Gui YY, Xia TL, Xin ZM,
Liu W, Zhang C, Chen SJ, Pu XB, Chen M, Huang DJ. Meta-analysis of
relation between oral β-blocker therapy and outcomes in patients with
acute myocardial infarction who underwent percutaneous coronary
intervention. Am J Cardiol. 2015 Jun 1;115(11):1529– 1538.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Goldberger
JJ, Bonow RO, Cuffe M, Liu L, Rosenberg Y, Shah PK, Smith SC, Jr,
Subacius H, OBTAIN Investigators. Effect of beta-blocker dose on
survival after acute myocardial infarction. J Am Coll Cardiol.
2015;66(13):1431–1441. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Andersson
C, Shilane D, Go AS, Chang TI, Kazi D, Solomon MD, Boothroyd DB, Hlatky
MA. Beta-blocker therapy and cardiac events among patients with newly
diagnosed coronary heart disease. J Am Coll Cardiol. 014;64(3):247–252.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Dargie
HJ. Effect of carvedilol on outcome after myocardial infarction in
patients with left-ventricular ysfunction: the CAPRICORN randomised
trial. Lancet. 2001;357(9266):1385–1390.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Sterling
LH, Filion KB, Atallah R, Reynier P, Eisenberg MJ. Intravenous
beta-blockers in ST-segment elevation myocardial infarction: a
systematic review and meta-analysis. Int J Cardiol. 2017 Feb
1;228:295–302. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Crea
F, Deanfield J, Crean P, Sharom M, Davies G, Maseri A. Effects of
verapamil in preventing early postinfarction angina and reinfarction. Am
J Cardiol. 1985, 1;55(8):900-904.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Yusuf
S, Held P, Furberg C. Update of effects of calcium antagonists in
myocardial infarction or angina in light of the second Danish Verapamil
Infarction Trial (DAVIT-II) and other recent studies. Am J Cardiol
1991;67(15):1295–1297. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Goldbourt
U, Behar S, Reicher-Reiss H, Zion M, Mandelzweig L, Kaplinsky E. Early
administration of nifedipine in suspected acute myocardial infarction.
The secondary prevention reinfarction Israel nifedipine trial 2 study.
Arch Intern Med. 1993 Feb 8;153(3):345–353.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
ACE
Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE
inhibitors in the early treatment of acute myocardial infarction:
systematic overview of individual data from 100,000 patients in
randomized trials. Circulation 1998;97(22):2202–2212.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Flather
MD, Yusuf S, Køber L, Pfeffer M, Hall A, Murray G, Torp-Pedersen C, Ball
S, Pogue J, Moyé L, Braunwald E.Long-term ACE-inhibitor therapy in
patients with heart failure or left-ventricular dysfunction: a
systematic overview of data from individual patients. ACE-Inhibitor
Myocardial Infarction Collaborative Group. Lancet. 2000 May
6;355(9215):1575–1581. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Pfeffer
MA, Greaves SC, Arnold JM, Glynn RJ, LaMotte FS, Lee RT, Menapace FJ,
Jr, Rapaport E, Ridker PM, Rouleau JL, Solomon SD, Hennekens CH. Early
versus delayed angiotensin-converting enzyme inhibition therapy in acute
myocardial infarction. The healing and early afterload reducing therapy
trial. Circulation. 1997;95(12):2643–2651.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Pfeffer
MA, McMurray JJ, Velazquez EJ, Rouleau JL, Kober L, Maggioni AP, Solomon
SD, Swedberg K, Van de Werf F, White H, Leimberger JD, Henis M, Edwards
S, Zelenkofske S, Sellers MA, Califf RM, Valsartan in Acute Myocardial
Infarction Trial Investigators. Valsartan, captopril, or both in
myocardial infarction complicated by heart failure, left ventricular
dysfunction, or both. N Engl J Med 2003;349(20):1893–1906.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
McMurray
JJ, Packer M, Desai AS et al., on behalf of the PARADIGM-HF
Investigators and Committees. Angiotensin- neprilysin inhibition versus
enalapril in heart failure. N Engl J Med. 2014. 371(11):993–1004.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Pitt
B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B, Bittman R, Hurley
S, Kleiman J, Gatlin M, Eplerenone Post-Acute Myocardial Infarction
Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a
selective aldosterone blocker, in patients with left ventricular
dysfunction after myocardial infarction. N Engl J Med.
2003;348(14):1309–1321. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Montalescot
G, Pitt B, Lopez de Sa E, Hamm CW, Flather M, Verheugt F, Shi H,
Turgonyi E, Orri M, Vincent J, Zannad F, REMINDER Investigators. Early
eplerenone treatment in patients with acute ST-elevation myocardial
infarction without heart failure: the Randomized Double-Blind Reminder
Study. Eur Heart J 2014;35(34):2295–2302__.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Dahal
K, Hendrani A, Sharma SP et al. Aldosterone antagonist therapy and
mortality in patients with ST-segment elevation myocardial infarction
without heart failure: a systematic review and meta-analysis. JAMA
Intern Med. 2018;178(7):913–920. doi:10.1001/jamainternmed.2018.0850
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Beygui
F, Van Belle E, Ecollan P et al. Individual participant data
analysis of two trials on aldosterone blockade in myocardial infarction.
Heart. 2018;104:1843–1849. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Stenestrand
U, Wallentin L, for the Swedish Register of Cardiac Intensive Care
(RIKS-HIA). Early Statin Treatment Following Acute Myocardial Infarction
and 1-Year Survival. JAMA. 2001;285(4):430–436.
doi:10.1001/jama.285.4.430 (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Aronow
HD, Topol EJ, Roe MT et al. Effect of lipid-lowering therapy on early
mortality after acute coronary syndromes: an observational study.
Lancet. 2001;357:1063–1068.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Giugliano
RP, Antman EM, Thompson SL et al. Lipid lowering drug therapy initiated
during hospitalization for acute MI is associated with lower
postdischarge 1-year mortality. J Am Coll Cardiol. 2001;37
(suppl A):316A. Abstract. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Fonarow
GC, Wright RS, Spencer FA et al. Effect of statin use within the first
24 hours of admission for acute myocardial infarction on early morbidity
and mortality. Am J Cardiol .2005; 96:611–616.
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Han
X, Zhang Y, Yin L et al. Statin in the treatment of patients with
myocardial infarction: a meta-analysis. Medicine/ 2018, vol.
97;12(2018):e0167. doi:10.1097/MD.0000000000010167
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Winchester
DE, Wen X, Xie L, Bavry AA. Evidence of pre-procedural statin therapy a
meta-analysis of randomized trials. J Am Coll Cardiol. 2010;
56:1099–1109. doi:10.1016/j.jacc.2010.04.023
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Benjo
AM, El-Hayek GE, Messerli F et al. High dose statin loading prior to
percutaneous coronary intervention decreases cardiovascular events: a
meta-analysis of randomized controlled trials. Catheter Cardiovasc
Interv. 2015;85:53–60. doi:10.1002/ccd.25302
(https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Yu
XL, Zhang HJ, Ren SD et al. Effects of loading dose of atorvastatin
before percutaneous coronary intervention on periprocedural myocardial
injury. Coron Artery Dis. 2011;22:87–91. doi:10.1097/MCA.
0b013e328341baee (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Liu
Y, Su Q, Li L. Efficacy of short-term high-dose atorvastatin
pretreatment in patients with acute coronary syndrome undergoing
percutaneous coronary intervention: a meta-analysis of nine randomized
controlled trials. Clin Cardiol. 2013 Dec; 36(12): E41–48. Epub 2013,
Aug 27. (https://pubmed.ncbi.nlm.nih.gov/2866506/?
from_term=beta+blockers+myocardial+infarction&from_filter=pubt.clinicaltrial&from_page=5&from_pos=5) -
Navarese
EP, Kowalewski M, Andreotti F et al. Meta-analysis of time-related
benefits of statin therapy in patients with acute coronary syndrome
undergoing percutaneous coronary intervention. Am J Cardiol. 2014;
113:1753.
(https://www.uptodate.com/contents/low-density-lipoprotein-cholesterol-ldl-c-lowering-after-an-acute-coronary-
syndrome/abstract/12) -
Ma
Y , (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Ma%20Y%5BAuthor%5D&cauthor=true&cauthor_uid=30580373)Xiang
C, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Xiang%20C%5BAuthor%5D&cauthor=true&cauthor_uid=30580373)Zhang B. Efficacy Evaluation of high-dose atorvastatin pretreatment in
patients with acute coronary syndrome: a meta-analysis of randomized
controlled trials. Med Sci Monit. 2018 Dec 23;24:9354–9363. doi:
10.12659/MSM.912544.
(https://www.ncbi.nlm.nih.gov/pubmed/?term=Zhang%20B%5BAuthor%5D&cauthor=true&cauthor_uid=30580373) -
Ma
M, Bu L, Shi L, Guo R, Yang B, Cao H, Luo L, Lu L. Effect of loading
dose of atorvastatin therapy prior to percutaneous coronary intervention
in patients with acute coronary syndrome: a meta-analysis of six
randomized controlled trials. Drug Design, Development and Therapy.
2019;13:1233–1240.
(https://www.ncbi.nlm.nih.gov/pubmed/?term=Zhang%20B%5BAuthor%5D&cauthor=true&cauthor_uid=30580373) -
Burgos
LM, Battioni L, Costabel JP, Trivi M. Effect of high-dose statin
pretreatment in patients with ST-segment elevation myocardial infarction
undergoing primary percutaneous coronary intervention: meta-analysis of
randomized controlled trials. Presented on ESC 2019 (P831), 31 Aug 2019.
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Cannon
CP, Braunwald E, McCabe CH, Rader DJ, Rouleau JL, Belder R, Joyal SV,
Hill KA, Pfeffer MA, Skene AM, Pravastatin or Atorvastatin Evaluation
and Infection Therapy-Thrombolysis in Myocardial Infarction 22
Investigators. Intensive versus moderate lipid lowering with statins
after acute coronary syndromes. N Engl J Med 2004;350(15):1495–1504.
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Burgos
LM, Battioni L, Costabel JP, Trivi M. Effect of high-dose statin
pretreatment in patients with ST-segment elevation myocardial infarction
undergoing primary percutaneous coronary intervention: meta-analysis of
randomized controlled trials. Presented on ESC 2019 (P831), 31 Aug 2019.
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Cholesterol
Treatment Trialists C, Fulcher J, O’Connell R, Voysey M, Emberson J,
Blackwell L, Mihaylova B, Simes J, Collins R, Kirby A, Colhoun H,
Braunwald E, La Rosa J, Pedersen TR, Tonkin A, Davis B, Sleight P,
Franzosi MG, Baigent C, Keech A. Efficacy and safety of LDL-lowering
therapy among men and women: meta-analysis of individual data from
174,000 participants in 27 randomised trials. Lancet
2015;385(9976):1397–1405. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Cannon
ChP, Blazing MA, Giugliano RP, McCagg A, B.S., White JA, M.S., Theroux
P, Darius H, Lewis BS, Ophuis TO, Jukema JW, de Ferrari GM, Ruzyllo W,
de Lucca P, Im KA, Bohula EA, PhD, Reist C, Wiviott SD, Tershakovec AM,
Musliner T, Braunwald E, Califf RM, for the IMPROVE-IT Investigator
Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl
J Med 2015; 372:2387–2397. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Schwartz
GG, Steg PG, Szarek M, Bhatt DL, and ODYSSEY OUTCOMES Committees and
Investigators. Alirocumab and cardiovascular outcomes after acute
coronary syndrome. N Engl J Med. 2018;379:2097–2107.
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Benner
JS, Tierce JC, Ballantyne CM et al. Follow-up lipid tests and physician
visits are associated with improved adherence to statin therapy.
Pharmacoeconomics. 2004;22(suppl 3):13–23.
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Cannon
CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, Darius H,
Lewis BS, Ophuis TO, Jukema JW, De Ferrari GM, Ruzyllo W, De Lucca P, Im
K, Bohula EA, Reist C, Wiviott SD, Tershakovec AM, Musliner TA,
Braunwald E, Califf RM, IMPROVE-IT Investigators. Ezetimibe added to
statin therapy after acute coronary syndromes. N Engl J Med.
2015;372(25):2387–2397. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Sabatine
MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, Kuder
JF, Wang H, Liu T, Wasserman SM, Sever PS, Pedersen TR, FOURIER Steering
Committee and Investigators. Evolocumab and clinical outcomes in
patients with cardiovascular disease. N Engl J Med
2017;376(18):1713–1722. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Schwartz
GG, MD, Steg G, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM,
Goodman ShG, Hanotin C, Harrington RA, Jukema JW, Lecorps G, for the
ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and
Cardiovascular
Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018;
379:2097–2107. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Shah
R, Rashid A, Hwang I, Fan TM, Khouzam RN, Reed GL. Meta-Analysis of the
Relative Efficacy and Safety of Oral P2Y12 Inhibitors in Patients With
Acute Coronary Syndrome. Am J Cardiol. 2017; 119:1723-1728
(https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ) -
Motovska
Z, Hlinomaz O, Miklik R et al., on behalf of the PRAGUE-18 Study Group.
Prasugrel versus ticagrelor in patients with acute myocardial infarction
treated with primary percutaneous coronary intervention: multicenter
randomized PRAGUE-18 Study. (https://www.google.com/search?
newwindow=1&sxsrf=ACYBGNRdGpcO1rQgCNCbogJmm4Cw96Msmg:1570895128943&q=ESC+2019+Burgos+LM+et+al.Effect+of
dose+statin+pretreatment+in+patients+with+ST-
segment+elevation+myocardial+infarction+undergoing+primary+percutaneous+coronary+intervention:+meta-
analysis+of+randomized+controlled+trials.Presented+on+ESC+2019
(P831),+31+Aug+2019&tbm=isch&source=univ&sa=X&ved=2ahUKEwi1go-
xiJflAhXRJpoKHd07CXUQ7Al6BAgIECQ)Circulation.
2016; 134:1603–1612__.
(http://circ.ahajournals.org/content/134/21/1603.long) -
Schüpke S, Neumann
FJ, Menichelli M et al., on behalf of the ISAR-REACT 5 Trial
Investigators. Ticagrelor or
prasugrel in patients
with acute coronary syndromes.
(http://circ.ahajournals.org/content/134/21/1603.long)N Engl J Med.
2019;381:1524–1534.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Mehta SR, Tanguay JF,
Eikelboom JW, Jolly SS, Joyner CD, Granger CB, Faxon DP, Rupprecht HJ,
Budaj A, Avezum A, Widimsky P, Steg PG, Bassand JP, Montalescot G,
Macaya C, Di Pasquale G, Niemela K, Ajani AE, White HD, Chrolavicius S,
Gao P, Fox KA, Yusuf S, for CURRENT-OASIS Trial Investigators.
Double-dose versus standard-dose clopidogrel and high-dose versus
low-dose aspirin in individuals undergoing percutaneous coronary
intervention for acute coronary syndromes (CURRENT-OASIS 7): a
randomised factorial trial. Lancet. 2010;376:1233–1243.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Palmerini T, Della
Riva D, Benedetto U, Reggiani LB, Feres F, Abizaid A, Gilard M, Morice
M, Valgimigli M, Hong M, Kim B, Jang Y, Kim H, Park KW, Colombo A,
Chieffo A, Sangiorgi D, Biondi-Zoccai G, Genereux P, Angelini GD, White,
Bhatt DL, Stone GW. Three, six or twelve months of dual antiplatelet
therapy after drug-eluting stent implantation in patients with or
without acute coronary syndromes: an individual patient data pairwise
and network meta-analysis of six randomized trials and 11,473 patients.
Eur Heart J. 2017; 38: 1034–1043.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Costa F, van Klaveren
D, James S, Heg D, Raber L, Feres F, Pilgrim T, Hong MK, Kim HS, Colombo
A, Steg PG, Zanchin T, Palmerini T, Wallentin L, Bhatt DL, Stone GW,
Windecker S, Steyerberg EW, Valgimigli M; PRECISE-DAPT Study
Investigators. Derivation and validation of the predicting bleeding
complications in patients undergoing stent implantation and subsequent
dual antiplatelet therapy (PRECISE-DAPT) score: a pooled analysis of
individual- patient datasets from clinical trials. Lancet 2017; 389:
1025–1034. (http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Udell JA, Bonaca MP,
Collet JP, Lincoff AM, Kereiakes DJ, Costa F, Lee CW, Mauri L,Valgimigli
M, Park SJ, Montalescot G, Sabatine MS, Braunwald E, Bhatt DL. Long-term
dual antiplatelet therapy for secondary prevention of cardiovascular
events in the subgroup of patients with previous myocardial infarction:
a collaborative meta-analysis of randomized trials. Eur Heart J.
2016;37:390–399. (http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Bonaca MP, Bhatt DL,
Cohen M, Steg PG, Storey RF, Jensen EC, Magnani G, Bansilal S, Fish MP,
Im K, Bengtsson O, Oude Ophuis T, Budaj A, Theroux P, Ruda M, Hamm C,
Goto S, Spinar J, Nicolau JC, Kiss RG, Murphy SA, Wiviott SD, Held P,
Braunwald E, Sabatine MS, PEGASUS-TIMI 54 Steering Committee and
Investigators. Long-term use of ticagrelor in patients with prior
myocardial infarction. N Engl J Med 2015;372:1791–1800.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Bonaca MP, Bhatt DL,
Steg PG, Storey RF, Cohen M, Im K, Oude Ophuis T, Budaj A, Goto S,
Lopez-Sendon J, Diaz R, Dalby A, Van de Werf F, Ardissino D, MontalЕОКot
G, Aylward P, Magnani G, Jensen EC, Held P, Braunwald E, Sabatine MS.
Ischaemic risk and efficacy of ticagrelor in relation to time from P2Y12
inhibitor withdrawal in patients with prior myocardial infarction:
Insights from PEGASUS-TIMI 54. Eur Heart J 2016; 37: 1133–1142.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1908973) -
Schjerning
Olsen AM, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Schjerning%20Olsen%20AM%5BAuthor%5D&cauthor=true&cauthor_uid=26481405)Lindhardsen
J, (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Lindhardsen%20J%5BAuthor%5D&cauthor=true&cauthor_uid=26481405)Gislason
GH et al. Impact of proton
pump
inhibitor treatment on gastrointestinal bleeding associated with
non-steroidal anti-inflammatory drug use among post-myocardial
infarction patients taking antithrombotics: nation-wide study. BMJ. 2015
Oct 19;351:h5096. (https://www.ncbi.nlm.nih.gov/pubmed/?
term=Gislason%20GH%5BAuthor%5D&cauthor=true&cauthor_uid=26481405)http://dx.doi.org/10.1136/bmj.h5096
(http://dx.doi.org/10.1136/bmj.h5096) -
Sehested
TS, Carlson N, Hansen PW et al.
(http://dx.doi.org/10.1136/bmj.h5096)Reduced risk of gastrointestinal
bleeding associated with proton pump inhibitor therapy in patients
treated with dual antiplatelet therapy after myocardial infarction. Eur
Heart J. 2019; 40:1963–1970.
(https://academic.oup.com/eurheartj/article-
abstract/40/24/1963/5372329) -
Cuisset
T, Deharo P, Quilici J, Johnson TW., Deffarges S, Bassez C, Bonnet G,
Fourcade L, Mouret JP, Lambert, Verdier V, Morange PE, Alessi MC, Bonnet
JL. Benefit of switching dual antiplatelet therapy after acute coronary
syndrome: the TOPIC (timing of platelet inhibition after acute coronary
syndrome) randomized study. Eur Heart J. 2017;38: 3070-3078.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Sibbing
D, Aradi D, Jacobshagen C, Gross L, Trenk D, Geisler T, Orban M,
Hadamitzky M, Merkely B, Kiss RG, Komócsi A, Dézsi CA, Holdt L, Felix
SB, Parma R, Klopotowski M, Schwinger RHG, Rieber J, Huber K, Neumann
F-J, Koltowski Mehilli J, Huczek Z, Massberg S, on behalf of the
TROPICAL-ACS Investigators. Guided de-ЕОКalation of antiplatelet
treatment in patients with acute coronary syndrome undergoing
percutaneous coronary intervention (TROPICAL- ACS): a randomised,
open-label, multicentre trial. Lancet. 2017;390:1747–1757.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Gurbel
PA, Bliden KP, Butler K, Antonino MJ, Wei C, Teng R, Rasmussen L, Storey
RF, Nielsen T, Eikelboom JW, Sabe- Affaki G, Husted S, Kereiakes DJ,
Henderson D, Patel DV, Tantry US. Response to ticagrelor in clopidogrel
non- responders and responders and effect of switching therapies: the
RESPOND study. Circulation. 2010;121:1188–1199.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
O’Donoghue
M, Antman EM, Braunwald E, Murphy SA, Steg PG, Finkelstein A, Penny WF,
Fridrich V, McCabe CH, Sabatine MS, Wiviott SD. The efficacy and safety
of prasugrel with and without a glycoprotein IIb/IIIa inhibitor in
patients with acute coronary syndromes undergoing percutaneous
intervention: a TRITON-TIMI 38 (Trial to Assess Improvement in
Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel
—Thrombolysis in Myocardial Infarction 38) analysis. J Am Coll Cardiol.
2009;54:678–685. (https://academic.oup.com/eurheartj/article-
abstract/40/24/1963/5372329) -
Mehilli
J, Kastrati A, Schulz S et al. Abciximab in patients with acute
ST-segment-elevation myocardial infarction undergoing primary
percutaneous coronary intervention after clopidogrel loading: a
randomized double-blind trial. Circulation 2009;119:1933–1940.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Valgimigli
M, Frigoli E, Leonardi S, Rothenbuhler M, Gagnor A, Calabro P, Garducci
S, Rubartelli P, Briguori C, Ando G, Repetto A, Limbruno U, Garbo R,
Sganzerla P, Russo F, Lupi A, Cortese B, Ausiello A, Ierna S, Esposito
G, Presbitero P, Santarelli A, Sardella G, Varbella F, Tresoldi S, de
Cesare N, Rigattieri S, Zingarelli A, Tosi P, van’t Hof A, Boccuzzi G,
Omerovic E, Sabate M, Heg D, Juni P, Vranckx P; MATRIX Investigators.
Bivalirudin or unfractionated heparin in acute coronary syndromes. N
Engl J Med. 2015;373:997–1009.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Zhang
S, Gao W, Li H, Zou M, Sun S, Ba Y, Liu Y, Cheng G. Efficacy and safety
of bivalirudin versus heparin in patients undergoing percutaneous
coronary intervention: a meta-analysis of randomized controlled trials.
Int J Cardiol. 2016;209:87–95.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Nuhrenberg
TG, Hochholzer W, Mashayekhi K, Ferenc M, Neumann FJ. Efficacy and
safety of bivalirudin for percutaneous coronary intervention in acute
coronary syndromes: A meta-analysis of randomized-controlled trials.
Clin Res Cardiol. 2018;107:807–815.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Brener
SJ, Moliterno DJ, Lincoff AM, Steinhubl SR, Wolski KE, Topol EJ.
Relationship between activated clotting time and ischemic or hemorrhagic
complications: analysis of 4 recent randomized clinical trials of
percutaneous coronary intervention. Circulation 2004; 110:994–998.
(https://academic.oup.com/eurheartj/article-
abstract/40/24/1963/5372329) -
Mega
JL, Braunwald E, Wiviott SD, Bassand JP, Bhatt DL, Bode C, Burton P,
Cohen M, Cook-Bruns N, Fox KA, Goto S, Murphy SA, Plotnikov AN,
Schneider D, Sun X, Verheugt FW, Gibson CM, ATLAS ACS 2-TIMI 51
Investigators. Rivaroxaban in patients with a recent acute coronary
syndrome. N Engl J Med. 2012;366:9–19.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329) -
Eikelboom
JW, Connolly SJ, Bosch J et al., on behalf of the COMPASS Investigators.
Rivaroxaban with or without
aspirin in stable
cardiovascular disease.
(https://academic.oup.com/eurheartj/article-abstract/40/24/1963/5372329)N
Engl J Med. 2017; 377:1319–1930.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1709118) -
Connolly SJ,
Eikelboom JW, Bosch J et al. Rivaroxaban with or without aspirin in
patients with stable coronary artery disease: an international,
randomised, double-blind, placebo-controlled trial.
(http://www.nejm.org/doi/full/10.1056/NEJMoa1709118)Lancet
2018;391:205–218.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Dewilde
WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Herrman JP,
Adriaenssens T, Vrolix M, Heestermans AA, Vis MM, Tijsen JG, van’t Hof
AW, ten Berg JM: WOEST Study Investigators. Use of clopidogrel with or
without aspirin in patients taking oral anticoagulant therapy and
undergoing percutaneous coronary intervention: an open-label,
randomised, controlled trial. Lancet 2013;381:1107–1115.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Gibson
CM, Mehran R, Bode C, Halperin J, Verheugt FW, Wildgoose P, Birmingham
M, Ianus J, Burton P, van Eickels M, Korjian S, Daaboul Y, Lip GY, Cohen
M, Husted S, Peterson ED, Fox KA. Prevention of bleeding in patients
with atrial fibrillation undergoing PCI. N Engl J Med.
2016;375:2423–2434.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Cannon
CP, Bhatt DL, Oldgren J, Lip GYH, Ellis SG, Kimura T, Maeng M, Merkely
B, Zeymer U, Gropper S, Nordaby M, Kleine E, Harper R, Manassie J,
Januzzi JL, Ten Berg JM, Steg PG, Hohnloser SH; DUAL RE-Steering
Committee PCI and Investigators. Dual antithrombotic therapy with
dabigatran after PCI in atrial fibrillation. N Engl J Med.
2017;377:1513–1524.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Lopes
RD., Heizer G, Aronson R, Vora AN., Massaro T, Mehran R, Goodman SG.,
Windecker S, Darius H, Averkov O, Bahit MC, Berwanger O, Budaj A, Hijazi
Z, Parkhomenko A, Sinnaeve P, Storey F., Thiele H, Vinereanu D, Granger
CB., Alexander JH., for the AUGUSTUS Investigators. Antithrombotic
therapy after acute coronary syndrome or PCI in atrial fibrillation.
NEJM. 2019;380:1509-1524.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-
6736(17)32458-3/fulltext) -
Lopes
RD, Hong H, Harskamp RE, Bhatt DL et al. Safety and efficacy of
antithrombotic strategies in patients with atrial fibrillation
undergoing percutaneous coronary intervention: a network meta-analysis
of randomized controlled trials. JAMA Cardiol. 2019;
10.1001/jamacardio.2019.1880.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Dans
AL, Connolly SJ, Wallentin L, Yang S, Nakamya J, Brueckmann M, Ezekowitz
M, Oldgren J, Eikelboom JW, Reilly PA, Yusuf S. Concomitant use of
antiplatelet therapy with dabigatran or warfarin in the Randomized
Evaluation of Long-Term Anticoagulation Therapy (RE-LY) trial.
Circulation. 2013;127:634–640.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Kopin
D, Jones WS, Sherwood MW, Wojdyla DM, Wallentin L, Lewis BS, Verheugt
FWA, Vinereanu D, Bahit MC, Halvorsen S, Huber K, Parkhomenko A, Granger
CB, Lopes RD, Alexander JH. Percutaneous coronary intervention and
antiplatelet therapy in patients with atrial fibrillation receiving
apixaban or warfarin: insights from the ARISTOTLE trial. Am Heart J.
2018;197:133–141.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-
3/fulltext) -
Ruff
CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD,
Camm AJ, Weitz JI, Lewis BS, Parkhomenko A, Yamashita T, Antman EM.
Comparison of the efficacy and safety of new oral anticoagulants with
warfarin in patients with atrial fibrillation: A meta-analysis of
randomised trials. Lancet 2014;383:955–962.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Lamberts
M, Olesen JB, Ruwald MH, Hansen CM, Karasoy D, Kristensen SL, Kober L,
Torp-Pedersen C, Gislason GH, Hansen ML. Bleeding after initiation of
multiple antithrombotic drugs, including triple therapy, in atrial
fibrillation patients following myocardial infarction and coronary
intervention: a nationwide cohort study. Circulation 2012;126:1185–1193.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Lamberts
M, Gislason GH, Olesen JB, Kristensen SL, Schjerning Olsen AM, Mikkelsen
A, Christensen CB, Lip GY, Kober L, Torp-Pedersen C, Hansen ML. Oral
anticoagulation and antiplatelets in atrial fibrillation patients after
myocardial infarction and coronary intervention. J Am Coll Cardiol
2013;62:981–989.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Svensson
AM, McGuire DK, Abrahamsson P, Dellborg M. Association between hyper-
and hypoglycaemia and 2 year all-cause mortality risk in diabetic
patients with acute coronary events. Eur Heart J. 2005;26:1255–1261.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Finfer
S, Chittock DR, Su SY, et al. Intensive versus conventional glucose
control in critically ill patients. N Engl J Med 2009;360:1283–1297.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Investigators
N-SS, Finfer S, Chittock DR, Su SY, Blair D, Foster D, Dhingra V,
Bellomo R, Cook D, Dodek P, Henderson WR, Hebert PC, Heritier S, Heyland
DK, McArthur C, McDonald E, Mitchell I, Myburgh JA, Norton R, Potter J,
Robinson BG, Ronco JJ. Intensive versus conventional glucose control in
critically ill patients. N Engl J Med. 2009;360:1283–1297.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Malmberg
K, Ryden L, Efendic S, Herlitz J, Nicol P, Waldenstrom A, Wedel H, Welin L. Randomized trial of insulin- glucose infusion followed by
subcutaneous insulin treatment in diabetic patients with acute
myocardial infarction (DIGAMI study): effects on mortality at 1 year. J
Am Coll Cardiol 1995;26:57–65. 4750.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Malmberg K. Prospective randomised study of intensive insulin treatment on long
term survival after acute myocardial infarction in patients with
diabetes mellitus. DIGAMI (Diabetes Mellitus, Insulin Glucose Infusion
in Acute Myocardial Infarction) Study Group. BMJ. 1997;314:1512–1515.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Ritsinger
V, Malmberg K, Martensson A, Ryden L, Wedel H, Norhammar A. Intensified
insulin-based glycaemic control after myocardial infarction: mortality
during 20 year follow-up of the randomised Diabetes Mellitus Insulin
Glucose Infusion in Acute Myocardial Infarction (DIGAMI 1) trial. Lancet
Diabetes Endocrinol 2014;2:627–633.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Mamas
MA, Neyses L, Fath-Ordoubadi F. A meta-analysis of
glucose-insulin-potassium therapy for treatment of acute myocardial
infarction. Exp Clin Cardiol. 2010;15(2):e20–e24.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Skyler
JS., Bergenstal R, Bonow RO., Buse J, Deedwania P, Gale EAM., Howard BV,
Kirkman MS, Kosiborod M, Reaven P, Sherwin RS. Intensive glycemic
control and the prevention of cardiovascular events: implications of the
ACCORD,
ADVANCE,
and VA Diabetes Trials. Diabetes Care 2009;32:187–192.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Gislason
GH, Jacobsen S, Rasmussen JN et al. Risk of death or reinfarction
associated with the use of selective cyclooxygenase-2 inhibitors and
nonselective nonsteroidal antiinflammatory drugs after acute myocardial
infarction. Circulation. 2006;113:2906–2913.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-
3/fulltext) -
Kearney
PM, Baigent C, Godwin J et al. Do selective cyclo-oxygenase-2 inhibitors
and traditional non-steroidal anti- inflammatory drugs increase the risk
of atherothrombosis? Meta-analysis of randomised trials. BMJ.
2006;332:1302– 1308.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Gibson
CM, Pride YB, Aylward PE et al. Association of non-steroidal
anti-inflammatory drugs with outcomes in patients with ST-segment
elevation myocardial infarction treated with fibrinolytic therapy: an
ExTRACT-TIMI 25 analysis. J Thromb Thrombolysis. 2009;27:11–17.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-
6736(17)32458-3/fulltext) -
Killip
T, Kimball J. T. Treatment of myocardial infarction in a coronary care
unit Am. J. Cardiol 1967;20(4):457–464.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Khot
UN, Jia G, Moliterno DJ et al. Prognostic importance of physical
examination for heart failure in non-ST- elevation acute coronary
syndromes: the enduring value of Killip classification. JAMA. 2003;
Vol.290(16):2174–2181.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Weng
CL, Zhao YT, Liu QH, Fu CJ, Sun F, Ma YL, Chen YW, He QY. Meta-analysis:
non-invasive ventilation in acute cardiogenic pulmonary edema. Ann
Intern Med 2010;152(9):590–600.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Gray
A, Goodacre S, Newby DE, Masson M, Sampson F, Nicholl J, 3CPO Trialists.
Noninvasive ventilation in acute cardiogenic pulmonary edema. N Engl J
Med. 2008;359(2):142–151.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
McAlister
FA, Stewart S, Ferrua S, McMurray JJ. Multidisciplinary strategies for
the management of heart failure patients at high risk for admission: a
systematic review of randomized trials. J Am Coll Cardiol.
2004;44(4):810–819.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Chen
ZM, Pan HC, Chen YP, Peto R, Collins R, Jiang LX, Xie JX, Liu LS, COMMIT
Collaborative Group. Early intravenous then oral metoprolol in 45,852
patients with acute myocardial infarction: randomised placebo-controlled
trial. Lancet. 2005;366 (9497):1622–1632.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-
6736(17)32458-3/fulltext) -
Bossard
M, Binbraik Y, Beygui F, et al. Mineralocorticoid Receptor Antagonists
in Patients With Acute Myocardial Infarction — A Systematic Review and
Meta-Analysis of Randomized Trials. Am Heart J 2018; 195: 60-69.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Buerke
M, Prondzinsky R, Lemm H, Dietz S, Buerke U, Ebelt H, Bushnaq H, Silber
RE, Werdan K. Intra-aortic balloon counterpulsation in the treatment of
infarction-related cardiogenic shock — review of the current evidence.
Artif Organs. 2012;36(6):505–511.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Karami
M, Hemradj V,Ouweneel D, Vlaar A et al. TCT-820 systematical review and
meta-analysis on the use of inotropes and vasopressors in cardiogenic
shock: time to close the gap between current clinical practice and
evidence? J Am Coll Cardiol. 2019 Oct, 74(13 Supplement) B803.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Moiseyev
VS, Põder P, Andrejevs N, Ruda MY et al, RUSSLAN Study Investigators.
Safety and efficacy of a novel calcium sensitiser, levosimendan, in
patients with left ventricular failure due to an acute myocardial
infarction: a randomized, placebo-controlled, double-blind study
(RUSSLAN). Eur Heart J. 2002;23:1422–1432.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Nieminen
MS, Buerke M, Cohen-Solál A et al. The role of levosimendan in acute
heart failure complicating acute coronary syndrome: A review and expert
consensus opinion. Int J Cardiol. 2016 Sep 1;218:150–157.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
De
Backer D, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, Brasseur
A, Defrance P, Gottignies P, Vincent JL, SOAP II Investigators.
Comparison of dopamine and norepinephrine in the treatment of shock. N
Engl J Med. 2010;362(9):779–789.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Costanzo
M.R., Guglin M.E., Saltzberg M.T., Jessup M.L, Bart B.A., Teerlink J.R.,
UNLOAD Trial Investigators et al. Ultrafiltration versus intravenous
diuretics for patients hospitalized for acute decompensated heart
failure. J Am Coll Cardiol. 2007;49:675–683.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Hjalmarson A. Effects of beta blockade on sudden cardiac death during acute
myocardial infarction and the postinfarction period. Am J Cardiol. 1997
Nov 13;80(9B):35J-39J
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Piccini
JP, Hranitzky PM, Kilaru R, Rouleau JL, White HD, Aylward PE et al.
Relation of mortality to failure to prescribe beta-blockers acutely in
patients with sustained ventricular tachycardia and ventricular
fibrillation following acute myocardial infarction (from the VALsartan
In Acute myocardial iNfarcTion trial [VALIANT Registry). Am J Cardiol
2008; 102: 1427-1432.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-
3/fulltext)] -
Hine
LK, Laird N, Hewitt P, Chalmers TC. Meta-analytic evidence against
prophylactic use of lidocaine in acute myocardial infarction. Arch
Intern Med. 1989;149(12):2694–2698.
(http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32458-3/fulltext) -
Echt
DS, Liebson PR, Mitchell LB et al. Mortality and morbidity in patients
receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia
Suppression Trial. N Engl J Med. 1991;324:781.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/8) -
Cardiac
Arrhythmia Suppression Trial II Investigators. Effect of the
antiarrhythmic agent moricizine on survival after myocardial infarction.
N Engl J Med. 1992;327:227.
(https://www.uptodate.com/contents/ventricular-arrhythmias-
during-acute-myocardial-infarction-prevention-and-treatment/abstract/9) -
Teo
KK, Yusuf S, Furberg CD. Effects of prophylactic antiarrhythmic drug
therapy in acute myocardial infarction. An overview of results from
randomized controlled trials. JAMA. 1993; 270:1589.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Dumas
F, Cariou A, Manzo-Silberman S, Grimaldi D, Vivien B, Rosencher J,
Empana JP, Carli P, Mira JP, Jouven X, Spaulding C. Immediate
percutaneous coronary intervention is associated with better survival
after out-of-hospital cardiac arrest: insights from the PROCAT (Parisian
Region Out of hospital Cardiac ArresT) registry. Circ Cardiovasc Interv.
2010;3(3):200–207.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-
infarction-prevention-and-treatment/abstract/10) -
Moss
AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS, Daubert JP,
Higgins SL, Brown MW, Andrews ML, Multicenter Automatic Defibrillator
Implantation Trial II Investigators. Prophylactic implantation of a
defibrillator in patients with myocardial infarction and reduced
ejection fraction. N Engl J Med. 2002;346(12):877–883.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Bardy
GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R, Domanski M,
Troutman C, Anderson J, Johnson G, McNulty SE, Clapp-Channing N,
Davidson-Ray LD, Fraulo ES, Fishbein DP, Luceri RM, Ip JH, Sudden
Cardiac Death in Heart Failure Trial Investigators. Amiodarone or an
implantable cardioverter-defibrillator for congestive heart failure. N
Engl J Med. 2005;352(3):225–237.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-
myocardial-infarction-prevention-and-treatment/abstract/10) -
Hess
PL, Laird A, Edwards R, Bardy GH, Bigger JT, Buxton AE, Moss AJ, Lee KL,
Hall WJ, Steinman R, Dorian P, Hallstrom A, Cappato R, Kadish AH,
Kudenchuk PJ, Mark DB, Al-Khatib SM, Piccini JP, Inoue LY, Sanders GD.
Survival benefit of primary prevention implantable
cardioverter-defibrillator therapy after myocardial infarction: does
time to implant matter? A meta-analysis using patient-level data from 4
clinical trials. Heart Rhythm. 2013 Jun;10(6):828– 835.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-
and-treatment/abstract/10) -
Haddadin
S, Milano AD, Faggian G. et al. Surgical treatment of postinfarction
left ventricular free wall rupture. J Card Surg. 2009;24:624–631.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-
infarction-prevention-and-treatment/abstract/10) -
Fasol
R, Lakew F, Wetter S. Mitral repair in patients with a ruptured
papillary muscle. Am Heart J 2000; 139: 549–554.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Adler
Y, Charron P, Imazio M et al. 2015 ESC uidelines for the diagnosis and
management of pericardial diseases: The Task Force for the Diagnosis and
Management of Pericardial Diseases of the European Society of Cardiology
Endorsed by: The European Association for Cardio-Thoracic Surgery
(EACTS). Eur Heart J. 2015;36:2921–2964.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Keeley
EC, Hillis LD. Left ventricular mural thrombus after acute myocardial
infarction. Clinical Cardiology 1996; 19: 83–86.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-
prevention-and-treatment/abstract/10) -
Rauch
B, Davos CH, Doherty P et al. The prognostic effect of cardiac
rehabilitation in the era of acute revascularisation and statin therapy:
a systematic review and meta-analysis of randomized and non-randomized
studies — The Cardiac Rehabilitation Outcome Study (CROS). Eur J Prev
Cardiol. 2016; 23(18):1914–1939.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Pogosova
N, Saner H, Pedersen SS et al. Psychosocial aspects in cardiac
rehabilitation: from theory to practice. A Position Paper From the
Cardiac Rehabilitation Section of The European Association of
Cardiovascular Prevention and Rehabilitation of the European Society of
Cardiology. . Eur J Prev Cardiol. 2015;22(10):1290–1306.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Giannuzzi
P, Temporelli PL, Marchioli R, Maggioni AP, Balestroni G, Ceci V,
Chieffo C, Gattone M, Griffo R, Schweiger C, Tavazzi L, Urbinati S,
Valagussa F, Vanuzzo D, Investigators G. Global secondary prevention
strategies to limit event recurrence after myocardial infarction:
results of the GOSPEL study, a multicenter, randomized controlled trial
from the Italian Cardiac Rehabilitation Network. Arch Intern Med.
2008;168:2194–2204.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Voogdt-Pruis
HR, Beusmans GH, Gorgels AP, Kester AD, Van Ree JW. Effectiveness of
nurse-delivered cardiovascular risk management in primary care: a
randomised trial. Br J Gen Pract. 2010;60:40–46.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Wood
DA, Kotseva K, Connolly S, Jennings C, Mead A, Jones J, Holden A, De
Bacquer D, Collier T, De Backer G, Faergeman O, Group ES.
Nurse-coordinated multidisciplinary, family-based cardiovascular disease
prevention programme (EUROACTION) for patients with coronary heart
disease and asymptomatic individuals at high risk of cardiovascular
disease: a paired, cluster-randomised controlled trial. Lancet.
2008;371:1999–2012.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Lamotte
M, Niset G, van de Borne P. The effect of different intensity modalities
of resistance training on beat-to-beat blood pressure in cardiac
patients. Eur J Cardiovasc Prev Rehabil. 2005 Feb;12(1):12–17.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Fidalgo
ASF, Farinatti P, Borges JP, de Paula T, Monteiro W. Institutional
guidelines for resistance exercise training in cardiovascular disease: a
systematic review. Sports Med. 2019 Mar;49(3):463-475. doi:
10.1007/s40279-019-01059-z.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Taylor
RS, Brown A, Ebrahim S, Jolliffe J, Noorani H, Rees K, Skidmore B, Stone
JA, Thompson DR, Oldridge N. Exercise-based rehabilitation for patients
with coronary heart disease: systematic review and meta-analysis of
randomized controlled trials. Am J Med. 2004;116:682–692.
(https://www.uptodate.com/contents/ventricular-
arrhythmias-during-acute-myocardial-infarction-prevention-and-treatment/abstract/10) -
Clark
AM, Hartling L, Vandermeer B, McAlister FA. Meta-analysis: secondary
prevention programs for patients with coronary artery disease. Ann
Intern Med. 2005;143:659–672.
(https://www.uptodate.com/contents/ventricular-
arrhythmias-during-acute-myocardial-infarction-prevention-and-treatment/abstract/10) -
Iestra
JA, Kromhout D, van der Schouw YT, Grobbee DE, Boshuizen HC, van
Staveren WA. Effect size estimates of lifestyle and dietary changes on
all-cause mortality in coronary artery disease patients: a systematic
review. Circulation 2005;112:924–934.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-
myocardial-infarction-prevention-and-treatment/abstract/10) -
Taylor
RS, Una lB, Critchley JA, Capewel LS. Mortality reduction in patients
receiving exercise-based cardiac rehabilitation: how much can be
attributed to cardiovascular risk factor improvements? Eur J Cardiovasc
Prev Rehabil. 2006;13:369–374.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-
infarction-prevention-and-treatment/abstract/10) -
Giannuzzi
P, Temporelli PL, Marchioli R, Maggioni AP, Balestroni G, Ceci V,
Chieffo C, Gattone M, Griffo R, Schweiger C, Tavazzi L, Urbinati S,
Valagussa F, Vanuzzo D, Investigators G. Global secondary prevention
strategies to limit event recurrence after myocardial infarction:
results of the GOSPEL study, a multicenter, randomized controlled trial
from the Italian Cardiac Rehabilitation Network. Arch Intern Med.
2008;168:2194–2204.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Hammill
BG, Curtis LH, Schulman KA, Whellan DJ. Relationship between cardiac
rehabilitation and long-term risks of death and myocardial infarction
among elderly Medicare beneficiaries. Circulation. 2010;121:63–70.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Chow
CK, Jolly S, Rao-Melacini P, Fox KA, Anand SS, Yusuf S. Association of
diet, exercise, and smoking modification with risk of early
cardiovascular events after acute coronary syndromes. Circulation
2010;121:750–758.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Aldcroft
SA, Taylor NF, Blackstock FC, O»Halloran PD. Psychoeducational
rehabilitation for health behavior change in coronary artery disease: a
systematic review of controlled trials. J Cardiopulm Rehabil Prev.
2011;31:273–281.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Heran
BS, Chen JM, Ebrahim S, Moxham T, Oldridge N, Rees K, Thompson DR,
Taylor RS. Exercise-based cardiac rehabilitation for coronary heart
disease. Cochrane Database Syst Rev. 2011;1:CD001800.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Janssen
V, De Gucht V, Dusseldorp E, Maes S. Lifestyle modification programmes
for patients with coronary heart disease: a systematic review and
meta-analysis of randomized controlled trials. Eur J Prev Cardiol.
2013;20:620–640.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Lawler,
PR, Filion, KB, Eisenberg, MJ. Efficacy of exercise-based cardiac
rehabilitation post-myocardial infarction: a systematic review and
meta-analysis of randomized controlled trials. Am Heart J.
2011;162:571–584.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10) -
Mezzani
A, Hamm LF, Jones AM, McBride PE, Moholdt T, Stone JA, … Williams MA.
Aerobic exercise intensity assessment and prescription in cardiac
rehabilitation: a joint position statement of the European Association
for Cardiovascular Prevention and Rehabilitation, the American
Association of Cardiovascular and Pulmonary Rehabilitation and the
Canadian Association of Cardiac Rehabilitation. Eur J Prev Cardiol.
2013;20(3):442–467.
(https://www.uptodate.com/contents/ventricular-arrhythmias-during-acute-myocardial-infarction-prevention-and-
treatment/abstract/10)https://doi.org/10.1177/2047487312460484[https://doi.org/10.1177/2047487312460484
(https://doi.org/10.1177/2047487312460484)] -
Bruning RS, Sturek M. Benefits
of exercise training on coronary blood flow in coronary artery disease
patients. Prog Cardiovasc Dis. 2015;57:443–453.
(https://doi.org/10.1177/2047487312460484) -
Anderson L, Oldridge N,
Thompson DR, Zwisler AD, Rees K, Martin N, Taylor RS. Exercise-based
cardiac rehabilitation for coronary heart disease: Cochrane systematic
review and meta-analysis. J Am Coll Cardiol. 2016;67:1–12.
(https://doi.org/10.1177/2047487312460484) -
Rauch B, Davos CH, Doherty P,
Saure D, Metzendorf MI, Salzwedel A, Voller H, Jensen K, Schmid JP,
Cardiac Rehabilitation Section EAoPCicwtIoMB, Informatics DoMBUoH, the
Cochrane M, Endocrine Disorders Group IoGPH- HUDG. The prognostic effect
of cardiac rehabilitation in the era of acute revascularisation and
statin therapy: A systematic review and meta-analysis of randomized and
non-randomized studies — The Cardiac Rehabilitation Outcome Study
(CROS). Eur J Prev Cardiol. 2016;23:1914–1939.
(https://doi.org/10.1177/2047487312460484) -
Stewart RAH, Held C,
Hadziosmanovic N, Armstrong PW, Cannon CP, Granger CB, Hagstrom E,
Hochman JS, Koenig W, Lonn E, Nicolau JC, Steg PG, Vedin O, Wallentin L,
White HD, Investigators S. Physical activity and mortality in patients
with stable coronary heart disease. J Am Coll Cardiol.
2017;70:1689–1700. (https://doi.org/10.1177/2047487312460484) -
Booth JN, 3rd, Levitan EB,
Brown TM, Farkouh ME, Safford MM, Muntner P. Effect of sustaining
lifestyle modifications (non-smoking, weight reduction, physical
activity, and mediterranean diet) after healing of myocardial
infarction, percutaneous intervention, or coronary bypass (from the
REasons for Geographic and Racial Differences in Stroke Study). Am J
Cardiol. 2014; 113:1933–1940.
(https://doi.org/10.1177/2047487312460484) -
de Vries H, Kemps HM, van
Engen-Verheul MM, Kraaijenhagen RA, Peek N. Cardiac rehabilitation and
survival in a large representative community cohort of Dutch patients.
4923 Eur Heart J. 2015;36:1519–1528.
(https://doi.org/10.1177/2047487312460484) -
American Association of
Cardiovascular and Pulmonary Rehabilitation. Guidelines for Cardiac
Rehabilitation and Secondary Prevention Programs, 5th ed. Champaign, IL:
Human Kinetics, 2013.
(https://doi.org/10.1177/2047487312460484) -
Piepoli MF, Corra U, Benzer W.
Secondary prevention through cardiac rehabilitation: Physical activity
counselling and exercise training: key components of the position paper
from the Cardiac Rehabilitation Section of the European Association of
Cardiovascular Prevention and Rehabilitation. Eur Heart J Suppl.
2010;31:1967–197. (https://doi.org/10.1177/2047487312460484) -
Mezzani A, Hamm LF, Jones AM,
McBride PE, Moholdt T, Stone JA, Williams MA. Aerobic exercise intensity
assessment and prescription in cardiac rehabilitation: a joint position
statement of the European Association for Cardiovascular Prevention and
Rehabilitation, the American Association of Cardiovascular and Pulmonary
Rehabilitation and the Canadian Association of Cardiac Rehabilitation.
Eur J Prev Cardiol. 2013;20(3);442–467.
(https://doi.org/10.1177/2047487312460484) -
Piepoli MF, Corrà U,
Adamopoulos S, Benzer W, Bjarnason-Wehrens B, Cupples M., … Giannuzzi P.
Secondary prevention in the clinical management of patients with
cardiovascular diseases. Core components, standards and outcome measures
for referral and delivery: A Policy Statement from the Cardiac
Rehabilitation Section of the European Association for Cardiovascular
Prevention & Rehabilitation. Endorsed by the Committee for Practice
Guidelines of the European Society of Cardiology. . Eur J Prev Cardiol.
2014;21(6):664–681. https://doi.org/10.1177/2047487312449597
(https://doi.org/10.1177/2047487312460484) -
Piepoli MF, Corra U, Dendale P
et al. Challenges in secondary prevention after acute myocardial
infarction: a call for action. . Eur J Prev Cardiol.
2016;23(18):1994–2006. (https://doi.org/10.1177/2047487312460484) -
Critchley JA, Capewell S.
Mortality risk reduction associated with smoking cessation in patients
with coronary heart disease: a systematic review. JAMA. 2003;290:86–97.
(https://doi.org/10.1177/2047487312460484) -
Thomson CC, Rigotti NA.
Hospital- and clinic-based smoking cessation interventions for smokers
with cardiovascular disease. Prog Cardiovasc Dis. 2003;45:459–479.
(https://doi.org/10.1177/2047487312460484) -
Meine TJ, Richard P et al.
Reduced incidence of admissions for myocardial infarction associated
with public smoking ban: before and after study. BMJ. 2004;328:977–980.
(https://doi.org/10.1177/2047487312460484) -
Hughes JR, Stead LF, Lancaster T. Antidepressants for smoking cessation. Cochrane Database Syst Rev.
2007;1:CD000031. (https://doi.org/10.1177/2047487312460484) -
Chow CK, Jolly S, Rao-Melacini
P, Fox KA, Anand SS, Yusuf S. Association of diet, exercise, and smoking
modification with risk of early cardiovascular events after acute
coronary syndromes. Circulation. 2010;121:750–758.
(https://doi.org/10.1177/2047487312460484) -
Rigotti NA, Clair C, Munafo MR,
Stead LF. Interventions for smoking cessation in hospitalised patients.
Cochrane Database Syst Rev. 2012;5:CD001837.
(https://doi.org/10.1177/2047487312460484) -
Cahill K, Stead LF, Lancaster T. Nicotine receptor partial agonists for smoking cessation. Cochrane
Database Syst Rev. 2012;4:CD006103.
(https://doi.org/10.1177/2047487312460484) -
Cahill K, Stevens S, Perera R,
Lancaster T. Pharmacological interventions for smoking cessation: an
overview and network meta-analysis. Cochrane Database Syst Rev.
2013;5:CD009329. (https://doi.org/10.1177/2047487312460484) -
Mills EJ, Thorlund K, Eapen S,
Wu P, Prochaska JJ. Cardiovascular events associated with smoking
cessation pharmacotherapies: a network meta-analysis. Circulation.
2014;129:28–41. (https://doi.org/10.1177/2047487312460484) -
Stead LF, Koilpillai P,
Fanshawe TR, Lancaster T. Combined pharmacotherapy and behavioural
interventions for smoking cessation. Cochrane Database Syst Rev.
2016;3:CD008286. (https://doi.org/10.1177/2047487312460484) -
Trichopoulou A, Bamia C, Norat
T et al. Modified Mediterranean diet and survival after myocardial
infarction: the EPIC-Elderly STudy. Eur J Epidemiol 2007;22:871–881.
(https://doi.org/10.1177/2047487312460484) -
Sofi F, Abbate R, Gensini GF,
Casini A. Accruing evidence on benefits of adherence to the
Mediterranean diet on health: an updated systematic review and
meta-analysis. Am J Clin Nutr. 2010;92:1189-1196.
(https://doi.org/10.1177/2047487312460484) -
Estruch R, Ros E, Salas-Salvado
J, Covas MI, Corella D, Aros F, Gomez-Gracia E, Ruiz-Gutierrez V, Fiol
M, Lapetra J, Lamuela-Raventos RM, Serra-Majem L, Pinto X, Basora J,
Munoz MA, Sorli JV, Martinez JA, Martinez-Gonzalez MA, Investigators PS.
Primary prevention of cardiovascular disease with a Mediterranean diet.
N Engl J Med 2013; 368: 1279-1290.
(https://doi.org/10.1177/2047487312460484) -
Wang X, Ouyang Y, Liu J, Zhu M,
Zhao G, Bao W, Hu FB. Fruit and vegetable consumption and mortality from
all causes, cardiovascular disease, and cancer: systematic review and
dose-response meta-analysis of prospective cohort studies. BMJ.
2014;349:g4490. (https://doi.org/10.1177/2047487312460484) -
Freeman AM, Morris PB, Barnard
N, Esselstyn CB, Ros E, Agatston A, Devries S, O»Keefe J, Miller M,
Ornish D, Williams K, Kris-Etherton P. Trending Cardiovascular Nutrition
Controversies. J Am Coll Cardiol. 2017;69:1172–1187.
(https://doi.org/10.1177/2047487312460484) -
Miller V, Mente A, Dehghan M,
Rangarajan S, Zhang X, Swaminathan S, Dagenais G, Gupta R, Mohan V, Lear
S, Bangdiwala SI, Schutte AE, Wentzel-Viljoen E, Avezum A, Altuntas Y,
Yusoff K, Ismail N, Peer N, Chifamba J, Diaz R, Rahman O, Mohammadifard
N, Lana F, Zatonska K, Wielgosz A, Yusufali A, Iqbal R, Lopez-Jaramillo
P, Khatib R, Rosengren A, Kutty VR, Li W, Liu J, Liu X, Yin L, Teo K,
Anand S, Yusuf S, Prospective Urban Rural Epidemiology study. Fruit,
vegetable, and legume intake, and cardiovascular disease and deaths in
18 countries (PURE): a prospective cohort study. Lancet.
2017;390:2037–2049. (https://doi.org/10.1177/2047487312460484) -
Wood AM, Kaptoge S, Butterworth
AS et al, Emerging Risk Factors Collaboration E-CVDUKBASG. Risk
thresholds for alcohol consumption: combined analysis of
individual-participant data for 599,912 current drinkers in 83
prospective studies. Lancet. 2018;39:1513–1523.
(https://doi.org/10.1177/2047487312460484) -
Collaborators GBDA. Alcohol use
and burden for 195 countries and territories, 1990–2016: a systematic
analysis for the Global Burden of Disease Study 2016. Lancet
2018;392:1015–1035. (https://doi.org/10.1177/2047487312460484) -
Pack QR, Rodriguez-ЕОКudero JP,
Thomas RJ, Ades PA, West CP, Somers VK, Lopez-Jimenez F. The prognostic
importance of weight loss in coronary artery disease: a systematic
review and meta-analysis. Mayo Clin Proc 2014;89:1368–1377.
(https://doi.org/10.1177/2047487312460484) -
Jackson Ch L, Joshy G,
Lewington S et al. Body mass index and all-cause mortality: individual
participant-data meta- analysis of 239 prospective studies in four
continents. Lancet. 2016;388:776-786.
(https://doi.org/10.1177/2047487312460484) -
Khan SS, Ning H, Wilkins JT,
Allen N, Carnethon M, Berry JD, Sweis RN, Lloyd-Jones DM. Association of
body mass index with lifetime risk of cardiovascular disease and
compression of morbidity. JAMA Cardiol 2018;3:280–287.
(https://doi.org/10.1177/2047487312460484) -
Thomopoulos C, Parati G,
Zanchetti A. Effects of blood pressure lowering on outcome incidence in
hypertension. 1. Overview, meta-analyses, and metaregression analyses of
randomized trials. J Hypertens. 2014;32:2285–2295.
(https://doi.org/10.1177/2047487312460484) -
SPRINT Research Group, Wright
JT, Jr, Williamson JD, Whelton PK, Snyder JK, Sink KM, Rocco MV,
Reboussin DM, Rahman M, Oparil S, Lewis CE, Kimmel PL, Johnson KC, Goff
DC, Jr, Fine LJ, Cutler JA, Cushman WC, Cheung AK, Ambrosius WT. A
randomized trial of intensive versus standard blood-pressure control. N
Engl J Med. 2015; 373:2103–2116.
(https://doi.org/10.1177/2047487312460484) -
Ettehad D, Emdin CA, Kiran A,
Anderson SG, Callender T, Emberson J, Chalmers J, Rodgers A, Rahimi K.
Blood pressure lowering for prevention of cardiovascular disease and
death: a systematic review and meta-analysis. Lancet. 2016;387:957–967.
(https://doi.org/10.1177/2047487312460484) -
UK Prospective Diabetes Study
(UKPDS) Group. Intensive Blood-Glucose Control With Sulphonylureas or
Insulin Compared With Conventional Treatment and Risk of Complications
in Patients With Type 2 Diabetes (UKPDS 33). UK Prospective Diabetes
Study (UKPDS) Group. Lancet 1998; 352: 837–853
(https://doi.org/10.1177/2047487312460484) -
Baumeister H, Hutter N, Bengel J. Psychological and pharmacological interventions for depression in
patients with coronary artery disease. Cochrane Database Syst Rev.
2011(9):CD008012. (https://doi.org/10.1177/2047487312460484) -
Rutledge T, Redwine LS, Linke
SE, Mills PJ. A meta-analysis of mental health treatments and cardiac
rehabilitation for improving clinical outcomes and depression among
patients with coronary heart disease. Psychosom Med. 2013;75:335–349.
(https://doi.org/10.1177/2047487312460484) -
Richards SH, Anderson L,
Jenkinson CE, Whalley B, Rees K, Davies P, Bennett P, Liu Z, West R,
Thompson DR, Taylor RS. Psychological interventions for coronary heart
disease: Cochrane systematic review and meta-analysis. Eur J Prev
Cardiol. 2018;25:247–259. (https://doi.org/10.1177/2047487312460484) -
Thom S, Poulter N, Field J,
Patel A, Prabhakaran D, Stanton A, Grobbee DE, Bots ML, Reddy KS,
Cidambi R, Bompoint S, Billot L, Rodgers A, UMPIRE Collaborative Group.
Effects of a fixed-dose combination strategy on adherence and
risk factors in patients with
or at high risk of CVD: the UMPIRE randomized clinical trial. JAMA.
2013;310:918–929. (https://doi.org/10.1177/2047487312460484) -
Castellano JM, Sanz G, Penalvo
JL, Bansilal S, Fernandez-Ortiz A, Alvarez L, Guzman L, Linares JC,
Garcia F, D’Aniello F, Arnaiz JA, Varea S, Martinez F, Lorenzatti A,
Imaz I, Sanchez-Gomez LM, Roncaglioni MC, Baviera M, Smith SC, Jr,
Taubert K, Pocock S, Brotons C, Farkouh ME, Fuster V. A polypill
strategy to improve adherence: results from the FOCUS project. J Am Coll
Cardiol. 2014;64:2071–2082. (https://doi.org/10.1177/2047487312460484) -
Gurfinkel E, Leon de la Fuente
R, Mendiz O, Mautner B. Flu vaccination in acute coronary syndromes and
planned percutaneous coronary interventions (FLUVACS) study. Eur Heart J. 2004;25:25–31. (https://doi.org/10.1177/2047487312460484) -
Ciczewski A, Bilinska ZT et al.
Influenza vaccination in secondary prevention from coronary ischaemic
events in coronary artery disease: FLUCAD Study. Eur Heart J
2008;29:1350–1358. (https://doi.org/10.1177/2047487312460484) -
Clar C, Oseni Z, Flowers N,
Keshtkar-Jahromi M, Rees K. Influenza vaccines for preventing
cardiovascular disease. Cochrane Database Syst Rev 2015(5):CD005050.
(https://doi.org/10.1177/2047487312460484) -
Caldeira D, Costa J,
Vaz-Carneiro A. [Analysis of the Cochrane Review: Influenza Vaccines for
Preventing Cardiovascular Disease. Cochrane Database Syst Rev. 2015;5:
CD005050. Acta Med Port 2015;28 424–426.
(https://doi.org/10.1177/2047487312460484)] -
MacIntyre CR, Mahimbo A, Moa
AM, Barnes M. Influenza vaccine as a coronary intervention for
prevention of myocardial infarction. Heart 2016;102:1953–1956.
(https://doi.org/10.1177/2047487312460484) -
Caldeira D, Ferreira JJ, Costa J. Influenza vaccination and prevention of cardiovascular disease
mortality. Lancet 2018;391:426–427.
(https://doi.org/10.1177/2047487312460484) -
Al-Khatib SM, Hellkamp AS, Lee
KL, Anderson J, Poole JE, Mark DB, Bardy GH. Implantable cardioverter
defibrillator therapy in patients with prior coronary revascularization
in the Sudden Cardiac Death in HEart Failure Trial (SCD- HEFT). J
Cardiovasc Electrophysiol. 2008;19:1059–1065.
(https://doi.org/10.1177/2047487312460484) -
Barsheshet A, Goldenberg I,
Moss AJ, Huang DT, ZarebaW, McNitt S, Klein HU, Guetta V. Effect of
elapsed time from coronary revascularization to implantation of a
cardioverter defibrillator on long-term survival in the MADIT-II trial.
J Cardiovasc Electrophysiol. 2011;22:1237–1242.
(https://doi.org/10.1177/2047487312460484) -
Slater DK, Hlatky MA, Mark DB,
Harrell FE Jr, Pryor DB et al. Outcome in suspected acute myocardial
infarction with normal or minimally abnormal admission
electrocardiographic findings. Am Journal Cardiol. 1987;60:766–770.
(https://doi.org/10.1177/2047487312460484) -
Lev EI, Battler A, Behar S,
Porter A, Haim M et al. Frequency, characteristics, and outcome of
patients hospitalized with acute coronary syndromes with undetermined
electrocardiographic patterns. American Journal Cardiol.
2003;91:224–227. (https://doi.org/10.1177/2047487312460484) -
Schellings DA, Adiyaman A,
Giannitsis E. et al. Early discharge after primary percutaneous coronary
intervention: the added value of N-terminal pro-brain natriuretic
peptide to the Zwolle Risk Score. J Am Heart Assoc. 2014;3(6):e001089.
(https://doi.org/10.1177/2047487312460484) -
Ferreira TAM, Madeira S et al.
Applicability of the Zwolle risk score for safe early discharge after
primary percutaneous coronary intervention in ST segment elevation
myocardial infarction. Rev Port Cardiol. 2015;34(9):535–541.
(https://doi.org/10.1177/2047487312460484) -
Ganovska E, Arrigo M, Helanova
K et al. Natriuretic peptides in addition to Zwolle score to enhance
safe and early discharge after acute myocardial infarction: a
prospective observational cohort study. Int J Cardiol. 2016;215:527– 531. (https://doi.org/10.1177/2047487312460484) -
Banga S, Gumm DC, Kizhakekuttu
TJ, Emani VK, Singh S, Singh S, Kaur H, Wang Y, Mungee S. Left
ventricular ejection fraction along with Zwolle risk score for risk
stratification to enhance safe and early discharge in STEMI patients
undergoing primary percutaneous coronary intervention: a retrospective
observational study. Cureus. 2019 Jul 29;11(7):e5272.
(https://doi.org/10.1177/2047487312460484) -
McNamara RL, Kennedy KF, Cohen
DJ, et al. Predicting In-Hospital Mortality inPatients With Acute
Myocardial Infarction. JACC 2016; 68: 626-635.
(https://doi.org/10.1177/2047487312460484) -
Mathews R, Peterson E, Chen AY,
et al. In-Hospital Major Bleeding During ST-Elevation and
Non–STElevation Myocardial Infarction Care: Derivation and Validation of
a Model from the ACTION Registry®-GWTG™. Am J Cardiol 2011; 107:
1136–1143. (https://doi.org/10.1177/2047487312460484) -
Goyal A, Spertus JA, Gosch K,
Venkitachalam L, Jones PG, Van den Berghe G, Kosiborod M. Serum
potassium levels and mortality in acute myocardial infarction. JAMA
2012; 307: 157–164. (https://doi.org/10.1177/2047487312460484) -
Combining thrombolysis with the
platelet glycoprotein IIb/IIIa inhibitor lamifiban: results of the
Platelet Aggregation Receptor Antagonist Dose Investigation and
Reperfusion Gain in Myocardial Infarction (PARADIGM) trial. JACC 1998;
32: 2003–2010. (https://doi.org/10.1177/2047487312460484) -
Ohman EM, Kleiman NS, Gacioch
G, et al; IMPACT-AMI Investigators. Combined accelerated
tissue-plasminogen activator and platelet glycoprotein IIb/IIIa integrin
receptor blockade with Integrilin in acute myocardial infarction:
results of a randomized, placebo-controlled, dose-ranging trial.
Circulation 1997; 95: 846 –554.
(https://doi.org/10.1177/2047487312460484) -
Gruppo Italiano per lo Studio
della Sopravvivenza nell’infarto Miocardico. GISSI-3: effects of
lisinopril and transdermal glyceryl trinitrate singly and together on
6-week mortality and ventricular function after acute myocardial
infarction. Lancet. 1994; 343: 1115–1122.
(https://doi.org/10.1177/2047487312460484) -
ISIS-4 (Fourth International
Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised
factorial trial assessing early oral captopril, oral mononitrate, and
intravenous magnesium sulphate in 58,050 patients with suspected acute
myocardial infarction. Lancet. 1995;345: 669–685.
(https://doi.org/10.1177/2047487312460484) -
R Roberts. Intravenous
Nitroglycerin in Acute Myocardial Infarction. Am J Med. 1983 Jun
27;74(6B): 45-52. (https://doi.org/10.1177/2047487312460484) -
Alajaji WA, Akl EA, Farha A,
Jaber WA, AlJaroudi WA. Surgical versus medical management of patients
with acute ischemic mitral regurgitation: a systematic review. BMC Res
Notes 2015; 8: 712. (https://doi.org/10.1177/2047487312460484) -
Grines CL, Marsalese DL, Brodie
B, et al. Safety and costeffectiveness of early discharge after primary
angioplasty in low risk patients with acute myocardial infarction.
PAMI-II Investigators. Primary Angioplasty in Myocardial Infarction. J
Am Coll Cardiol 1998; 31: 967–972.
(https://doi.org/10.1177/2047487312460484) -
Azzalini L, Sole E, Sans J,
Vila M, Duran A, Gil-Alonso D, Santalo M, Garcia-Moll X, Sionis A.
Feasibility and safety of an early discharge strategy after low-risk
acute myocardial infarction treated with primary percutaneous coronary
intervention: the EDAMI pilot trial. Cardiology 2015; 130: 120–129.
(https://doi.org/10.1177/2047487312460484) -
Melberg T, Jorgensen M, Orn S,
Solli T, Edland U, Dickstein K. Safety and health status following early
discharge in patients with acute myocardial infarction treated with
primary PCI: a randomized trial. Eur J Prev Cardiol 2015; 22: 1427–1434.
(https://doi.org/10.1177/2047487312460484) -
Noman A, Zaman AG, Schechter C,
Balasubramaniam K, Das R. Early discharge after primary percutaneous
coronary intervention for ST-elevation myocardial infarction. Eur Heart
J Acute Cardiovasc Care 2013; 2: 262–269.
(https://doi.org/10.1177/2047487312460484) -
Jones DA, Rathod KS, Howard JP,
et al. Safety and feasibility of hospital discharge 2 days following
primary percutaneous intervention for ST-segment elevation myocardial
infarction. Heart 2012; 98: 1722–1727.
(https://doi.org/10.1177/2047487312460484) -
Jones DA, Rathod KS, Howard JP,
et al. Safety and feasibility of hospital discharge 2 days following
primary percutaneous intervention for ST-segment elevation myocardial
infarction. Heart 2012; 98: 1722–1727.
(https://doi.org/10.1177/2047487312460484) -
Приказ Министерства
здравоохранения Российской Федерации от 15 ноября 2012 г. №918н «Об
утверждении Порядка оказания медицинской помощи больным с
сердечно-сосудистыми заболеваниями» (с изменениями и дополнениями от 22
февраля 2019 г.). (https://doi.org/10.1177/2047487312460484) -
Приказ Министерства
здравоохранения РФ от 29 марта 2019 г. №173н «Об утверждении порядка
проведения диспансерного наблюдения за взрослыми».
(https://doi.org/10.1177/2047487312460484) -
Shah R, Rashid A, Hwang I, Fan
TM, Khouzam RN, Reed GL. Meta-Analysis of the Relative Efficacy and
Safety of Oral P2Y12 Inhibitors in Patients With Acute Coronary
Syndrome. Am J Cardiol. 2017; 119:1723-1728
(https://doi.org/10.1177/2047487312460484) -
G K Paul 1, B Sen, M A Bari, Z
Rahman, F Jamal, M S Bari, S R Sazidur. Correlation of Platelet Count
and Acute ST- elevation in Myocardial Infarction. Mymensingh Med J. 2010
Jul;19(3):469-73. (https://doi.org/10.1177/2047487312460484) -
Ghaffari S, Pourafkari L,
Sepehrvand N, Aslanabadi N, Faridi L, Tajlil A, Masoumi N, Nader N. Red
Cell Distribution Width Is a Predictor of ST Resolution and Clinical
Outcome Following Thrombolysis in Acute ST Elevation Myocardial
Infarction. Thromb Res. 2016 Apr;140:1-6
(https://doi.org/10.1177/2047487312460484) -
Cecchi E, Liotta A, Gori A,
Valente S, Giglioli C, Lazzeri C, Sofi F, Gensini G, Abbate R, Mannini L. Comparison of Hemorheological Variables in ST-elevation Myocardial
Infarction Versus Those in non-ST-elevation Myocardial Infarction or
Unstable Angina Pectoris. Am J Cardiol. 2008 Jul 15;102(2):125-8. doi:
10.1016/j.amjcard.2008.03.026. Epub 2008 May 9.
(https://doi.org/10.1177/2047487312460484) -
Charvat J, Kuruvilla T, al Amad H. Beneficial Effect of Intravenous Nitroglycerin in Patients With non-Q
Myocardial Infarction. Cardiologia. 1990 Jan;35(1):49-54.
(https://doi.org/10.1177/2047487312460484)
Приложение А1. Состав рабочей группы
Президиум рабочей группы:
д.м.н. Аверков О.В. (Москва) — сопредседатель
проф. Дупляков Д.В.
(Самара)
д.м.н. Гиляров М.Ю. (Москва)
д.м.н. Новикова Н.А. (Москва)
д.м.н. Шахнович Р.М. (Москва) — сопредседатель
к.м.н. Яковлев А.Н.
(Санкт-Петербург),
Другие члены рабочей группы:
проф. Абугов С.А. (Москва)
академик РАН, проф. Алекян Б.Г. (Москва),
проф. Архипов М.В.
(Екатеринбург),
член-корр. РАН, проф. Барбараш О.Л. (Кемерово)
академик РАН, проф.
Бойцов С.А. (Москва),
проф. Васильева Е.Ю. (Москва)
проф. Галявич А.С. (Казань)
проф. Ганюков В.И. (Кемерово)
проф.
Гиляревский С.Р. (Москва)
академик РАН, проф. Голухова Е.З. (Москва)
проф. Грацианский Н.А.
(Москва)
проф. Затейщиков Д.А. (Москва)
проф. Карпов Ю.А. (Москва)
проф.
Космачева Е.Д. (Краснодар)
проф. Лопатин Ю.М. (Волгоград)
проф. Марков
В.А. (Томск)
проф. Никулина Н.Н. (Рязань)
проф. Панченко Е.П. (Москва)
к.м.н. Певзнер
Д.В. (Москва)
проф.Погосова Н.В. (Москва)
проф. Протопопов А.В. (Красноярск)
проф. Скрыпник Д.В (Москва)
проф. Терещенко С.Н. (Москва)
проф. Устюгов С.А. (Красноярск)
д.м.н.
Хрипун А.В. (Ростов-на-Дону)
проф. Шалаев С.В. (Тюмень)
академик РАН, проф. Шляхто Е.В. (Санкт-Петербург)
проф. Шпектор А.В. (Москва)
д.м.н. Явелов И.С. (Москва)
проф. Якушин С.С. (Рязань).
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить. В случае
сообщения о наличии конфликта интересов члены рабочей группы были
исключены из обсуждения разделов, связанных с областью конфликта
интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врач-кардиолог.
-
Врач-анестезиолог-реаниматолог.
-
Фельдшер скорой медицинской помощи.
-
Врач скорой медицинской помощи.
-
Врач-терапевт.
-
Врач-терапевт участковый.
-
Врач общей практики (семейный врач).
-
Врач-сердечно-сосудистый хирург.
-
Врач по рентгенэноваскулярным методам диагностики и лечения.
Вследствие того, что члены Российского кардиологического общества входят
в состав Европейского общества кардиологов и также являются его членами,
все рекомендации Европейского общества кардиологов (ЕОК) формируются с
участием российских экспертов, которые являются соавторами европейских
рекомендаций. Таким образом, существующие рекомендации ЕОК отражают
общее мнение ведущих российских и европейских кардиологов. В связи с
этим формирование Национальных рекомендаций проводилось на основе
рекомендаций ЕОК, с учетом национальной специфики, особенностей
обследования, лечения, учитывающих доступность медицинской помощи. По
этой причине в тексте настоящих клинических рекомендаций одновременно
использованы две шкалы оценки достоверности доказательств тезисов
рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД.
Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость
выполнения тезиса рекомендаций (Таблица 1
2, 3, 4).
| Класс рекомендаций ЕОК | Определение | Предлагаемая формулировка |
|---|---|---|
|
I |
Доказано или общепризнанно, что диагностическая процедура, |
Рекомендовано/ показано |
|
II IIa IIb |
Противоречивые данные и/или мнения об эффективности/пользе Большинство данных/мнений в пользу эффективности/пользы диагностической Эффективность/польза диагностической процедуры, вмешательства, лечения |
Можно применять |
|
III |
Данные или единое мнение, что диагностическая процедура, вмешательство, |
Не рекомендуется применять |
| Уровни достоверности доказательств ЕОК | |
|---|---|
|
A |
Данные многочисленных рандомизированных клинических исследований |
|
B |
Данные получены по результатам одного рандомизированного |
|
C |
Согласованное мнение экспертов и/или результаты небольших |
| УДД | Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные |
|
3 |
Исследования без последовательного контроля референсным методом, или |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
| УДД | Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением метаанализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные |
|
4 |
Несравнительные исследования, описание клинического случая или серии |
|
5 |
Имеется лишь обоснование механизма действия вмешательства |
| УУР | Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества; |
Приложение А3. Связанные документы
-
Приказ Министерства здравоохранения РФ от 1 июля 2015 г. № 404ан «Об
утверждении стандарта специализированной медицинской помощи при остром
инфаркте миокарда (с подъемом сегмента ST электрокардиограммы)». -
Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016
г. № 520н «Об утверждении критериев оценки качества медицинской помощи». -
Приказ Министерства здравоохранения РФ от 29 марта 2019 г. № 173н «Об
утверждении порядка проведения диспансерного наблюдения за взрослыми». -
«Методические рекомендации по оценке достоверности доказательств и
убедительности рекомендаций» ФГБУ «ЦЭККМП» Минздрава России, 2018.
Приложение Б. Алгоритмы ведения пациента
Приложение Б1. Выбор реперфузии у пациента с ИМпST
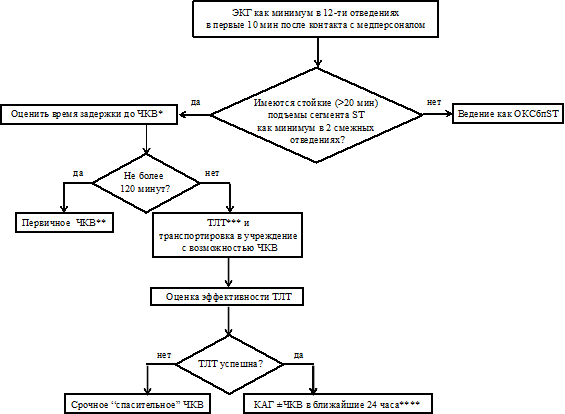
Примечания: КГ — коронарография; ТЛТ — тромболитическая терапия; ЧКВ —
чрескожное коронарное вмешательство (как правило, со стентированием).
* от первого контакта с медицинским
работником;
** предпочтительно в первые 60 мин и максимум
в первые 90 мин от первого контакта с медицинским работником,
предпочтительно в учреждениях с программой выполнения первичного ЧКВ 24
часа 7 дней в неделю;
*** предпочтительно
на догоспитальном этапе, в течение 10 мин от постановки диагноза;
**** у
стабильных пациентов предпочтительно через 2–24 часа после успешной ТЛТ.
Приложение Б2. Варианты реперфузии и временные задержки при ИМпST
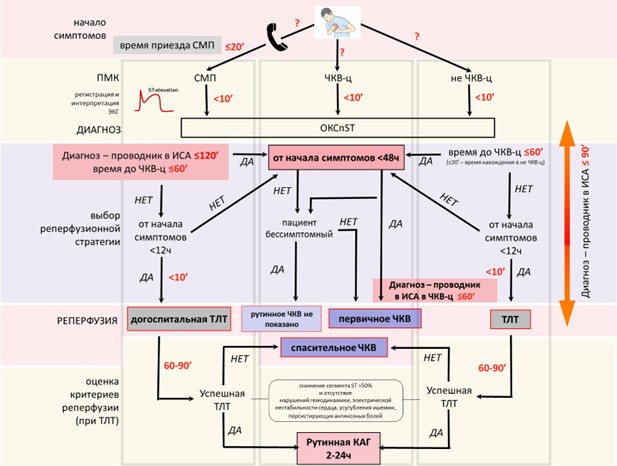
Примечание:
ИСА — инфаркт-связанная артерия; КГ — коронарограция; ОКСпST — острый
коронарный синдром с подъемом сегмента ST; ПМК — первичный медицинский
контакт; СМП — скорая медицинская помощь; ТЛТ — тромболитическая
терапия; ЧКВ — чрескожное коронарное вмешательство; ЧКВ-ц — центр с
возможностью
проведения чрескожного коронарного вмешательства; не ЧКВ-ц — центр без
возможности проведения чрескожного коронарного вмешательства.
Пояснения:
-
НАЧАЛО СИМПТОМОВ
Время от вызова пациентом бригады скорой медицинской помощи (СМП) до
ее прибытия не должно превышать 20 минут.
-
Первый медицинский контакт — ДИАГНОЗ
Первый контакт пациента с подозрением на ОКСпST с медицинским персоналом
обозначается термином первичный медицинский контакт (ПМК). ПМК может
осуществляться бригадой СМП, врачами стационара с возможностью проведения чрескожного коронарного вмешательства (ЧКВ-ц) или врачами
стационара без возможности проведения чрескожного коронарного вмешательства (не ЧКВ-ц). Время от момента ПМК до постановки диагноза
ОКСпST в каждом из трех случаев не должно превышать 10 минут. Это
время необходимо для регистрации и интерпретации электрокардиограммы
(ЭКГ).
-
ВЫБОР РЕПЕРФУЗИОННОЙ СТРАТЕГИИ и 4. РЕПЕРФУЗИЯ
После постановки диагноза необходимо выбрать метод реперфузии (выбор
реперфузионной стратегии): первичное чрескожное коронарное
вмешательство (пЧКВ) или тромболитическая терапия (ТЛТ):
-
если персонал СМП или не ЧКВ-ц рассчитывает, что время от момента постановки диагноза ОКСпST до проведения проводника в инфаркт-связанную артерию (ИСА) не должно превышать 120 минут, следует выбрать тактику пЧКВ и не проводить ТЛТ. Этот временной отрезок включает время транспортировки (не более 60 минут) и время от постановки/подтверждения диагноза в ЧКВ-ц до проведения проводника в инфаркт-связанную артерию (ИСА) (не более 60 минут);
-
если после постановки диагноза ОКСпST бригадой СМП пациент
госпитализирован в не ЧКВ-ц, и расчетное время от момента постановки
диагноза до проведения проводника в инфаркт-связанную артерию (ИСА)
(т.е. до пЧКВ) не превышает 120 минут, пациент должен быть
транспортирован в ЧКВ-ц, при этом время от госпитализации в не ЧКВ-ц до
начала транспортировки в ЧКВ-ц не должно превышать 30 минут; -
если персонал СМП или не ЧКВ-ц рассчитывает, что время от момента
постановки диагноза до проведения проводника в инфаркт-связанную артерию
(ИСА) (т.е. до пЧКВ) превысит 120 минут, и от начала симптомов прошло
не более 12 часов, пациенту показано проведение тромболитической
терапии; -
если врачи СМП или врачи не ЧКВ-ц рассчитывают, что время от момента
постановки диагноза до проведения проводника в инфаркт-связанную артерию
(ИСА) (т.е. до пЧКВ) превысит 120 минут, но от начала симптомов прошло
более 12 часов, пациент транспортируется в ЧКВ-ц; -
когда пациент госпитализирован в ЧКВ-ц и время от начала симптомов не
превышает 48 часов, проводится пЧКВ; -
в случае, если время от начала симптомов превышает 48 часов и пациент
бессимптомен (нет симптомов ишемии или гемодинамической нестабильности
или жизнеугрожающих нарушений ритма и проводимости и т.д.), рутинное ЧКВ
не проводится; -
в случае, если время от начала симптомов превышает 48 часов и есть
симптомы ишемии или гемодинамическая нестабильность, или жизнеугрожающие
нарушения ритма и проводимости, проводится пЧКВ; -
после транспортировки пациента в ЧКВ-ц время от
постановки/подтверждения диагноза в ЧКВ-ц до проведения проводника в
инфаркт-связанную артерию (ИСА) не должно превышать 60 минут; -
если в качестве реперфузионного метода выбрана ТЛТ, то время от момента
принятия решения до введения тромболитического средства не должно
превышать 10 минут; -
после введения тромболитического средства бригадой СМП или врачами не
ЧКВ-ц пациент должен быть транспортирован в ЧКВ-ц в максимально ранние
сроки.
-
ОЦЕНКА КРИТЕРИЕВ РЕПЕРФУЗИИ (ПРИ ТЛТ) и ЧКВ после ТЛТ
-
через 60–90 минут после осуществления тромболизиса должна проводиться
оценка достижения реперфузии на основании ЭКГ (снижение сегмента ST >50%
в отведения, где элевация сегмента ST была максимальной; -
если реперфузия
не достигнута (отсутствует хотя бы один критерий достижения реперфузии),
необходимо провести спасительное ЧКВ в максимально ранние сроки; -
если реперфузия достигнута (присутствуют все критерии достижения
реперфузии), необходимо провести коронарную ангиографию и, при
необходимости, ЧКВ, в сроки от 2 до 24 часов от начала тромболизиса.
Приложение Б3. Выбор пероральных антитромботических средств при ИМпST
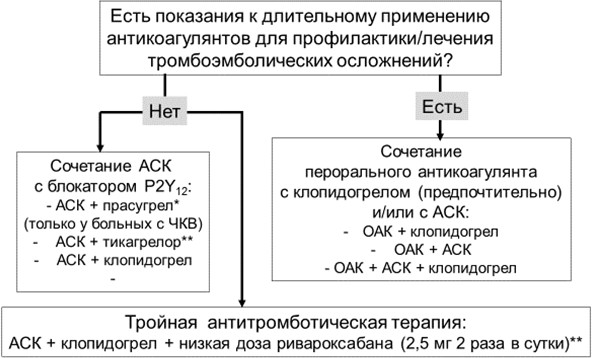
Рисунок 1. Выбор антитромботических средств при ИМпST
Приложение В. Информация для пациентов
Инфаркт миокарда — отмирание участка сердечной мышцы из-за недостаточной
доставки к ней кислорода. В большинстве случаев это происходит из-за
внезапно возникшей закупорки крупной коронарной артерии сердца тромбом.
Тромб, как правило, возникает на поверхности разорвавшейся
атеросклеротической бляшки.
В ранние сроки инфаркта миокарда повышен риск серьезных и угрожающих
жизни осложнений инфаркта. Среди них — остановка сердца, разрыв сердца и
острая сердечная недостаточность. Каждое из этих осложнений может быть
смертельным. Часть из них может устраняться медицинскими работниками,
находящимися рядом с пациентом. Эта возможность уменьшить риск смерти
определяет необходимость нахождения рядом с медицинским персоналом и
специальным оборудованием. Многие из этих осложнений предотвратимы. При
быстром и качественном открытии коронарной артерии удается спасти
существенную часть сердечной мышцы и уменьшить риск смертельных
осложнений. Поэтому важнейшее значение имеет своевременное обращение
пациента с развивающимся инфарктом миокарда за медицинской помощью.
Другими словами Вам, при появлении определенных жалоб необходимо срочно
вызвать бригаду скорой медицинской помощи. Для инфаркта миокарда
характерно возникновение давящей боли или дискомфорта за грудиной,
которые не проходят в покое и после приема нитроглицерина. Эти ощущения
могут распространяться на шею, нижнюю челюсть, левую руку, под левую
лопатку, в верхние отделы живота. Разобраться в ситуации и решить, что
делать дальше, может специально обученный медицинский работник. Он
зарегистрирует электрокардиограмму и, если результат укажет на
прекращение кровотока по крупной коронарной артерии, определится с
возможностью его восстановления. Это может быть как немедленное введение
лекарственного средства, разрушающего тромбы, так и срочная
транспортировка в лечебное учреждение, где проходимость коронарной
артерии будет восстановлена механическим способом, и в сосуд изнутри
установят специально разработанный каркас (стент). В любом случае из-за
опасности вышеупомянутых серьезных осложнений лечение острого инфаркта
миокарда проводится в специально созданных подразделениях лечебных
учреждений.
Инфаркт миокарда — как правило, проявление прогрессирования
атеросклероза, который развивается во всех артериях человека. Поэтому
после выписки существует угроза повторного инфаркта миокарда и
сосудистых катастроф в органах, кровоснабжаемых другими артериями. В
связи с этой угрозой крайне важно не прекращать лечение, начатое в
стационаре, и сосредоточиться на устранении факторов, способствующих
прогрессированию атеросклероза. Следует отказаться от курения,
обеспечить регулярную физическую активность, соблюдать диету,
разработанную для таких случаев, избавиться от лишнего веса, следуя
рекомендациям врача поддерживать низкие значения холестерина в крови с
помощью лекарств, обеспечить стойкую нормализацию артериального давления
(при наличии артериальной гипертонии), поддерживать нормальный уровень
сахара в крови (при наличии сахарного диабета). Кроме того, при обширном
поражении сердечной мышцы и/или осложнениях инфаркта миокарда требуется
дополнительное лечение, которое назначается врачом. Известно, что
преждевременное прекращение приема необходимых лекарств существенно
увеличивает риск возникновения повторного инфаркта миокарда и смерти,
появления сердечной недостаточности, которая может существенно
ограничить вашу ежедневную активность. Отменять лекарства. не
посоветовавшись с врачом, нельзя. Для снижения риска повторных событий
(инфаркта миокарда, его осложнений) для вас крайне желательно участие в
специальной программе реабилитации, включающей регулярные дозированные
физические нагрузки, психологическую поддержку, организацию контроля за
факторами риска. Спросите своего врача о вашей программе реабилитации,
необходимой лекарственной терапии и изменениях в образе жизни.
При соблюдении всех рекомендаций и регулярном наблюдении у врача ваши
шансы не подпустить к себе очередной инфаркт миокарда и его грозные
осложнения, очень высоки. Сотрудничайте с врачом, и всё будет хорошо.
Приложение Г.
Приложение Г1. Критерии диагностики инфаркта миокарда
Критерии диагностики острого ИМ [5]
Термин «острый ИМ» используется в случаях, когда наряду с
доказательством острого повреждения миокарда (характерная динамика
уровня биомаркеров в крови) имеются свидетельства острой ишемии
миокарда.
Критерии диагностики острого ИМ 1 и 2 типов
Повышение и/или снижение концентрации сердечного тропонина в крови,
которая должна как минимум однократно превысить 99-й перцентиль верхней
референсной границы у пациентов без исходного повышения уровня
сердечного тропонина в крови, либо его увеличение >20% при исходно
повышенном уровне сердечного тропонина, если до этого он оставался
стабильным (вариация £20%) или снижался, в сочетании с хотя бы одним
критерием острой ишемии миокарда:
-
симптомы ишемии миокарда;
-
остро возникшие (или предположительно остро возникшие) ишемические
изменения на ЭКГ; -
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков
миокарда с потерей жизнеспособности или нарушением локальной
сократимости, характерных для ишемической этиологии; -
выявление внутрикоронарного тромбоза при коронарной ангиографии или
атеротромбоза (или признаков нестабильной АБ) на аутопсии (для ИМ 1
типа).
Критерии дифференциальной диагностики ИМ 1 и 2 типов представлены на
рис.3.
Критерии диагностики острого ИМ 3 типа
Сердечная смерть у пациента с симптомами, указывающими на ишемию
миокарда, сопровождающимися предположительно новыми ишемическими
изменениями ЭКГ или фибрилляцией желудочков, в случаях, когда пациент
умирает до появления возможности взятия образцов крови или раньше, чем
отмечается повышение активности биохимических маркеров некроза миокарда
в крови, или наличие ИМ подтверждено на аутопсии. При выявлении на
аутопсии ИМ в сочетании со свежим или недавно возникшим атеротромбозом
(или признаками нестабильной АБ) в инфаркт-связанной коронарной артерии
ИМ 3 типа должен быть реклассифицирован в ИМ 1 типа.
Критерии диагностики острого ИМ 4а типа (первые 48 часов после процедуры ЧКВ)
Повышение концентрации сердечного тропонина в крови более 5 раз от 99-го
перцентиля верхней референсной границы у пациентов с исходно нормальным
уровнем в крови (если до процедуры концентрация тропонина в крови была
повышена и стабильна (вариация ≤20%) или снижалась, после процедуры она
должна повыситься
>20%) в сочетании как минимум с один признаком острой ишемии миокарда:
-
остро возникшие ишемические изменения ЭКГ;
-
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков
миокарда с потерей жизнеспособности или нарушением локальной
сократимости в виде паттерна, характерного для ишемической этиологии; -
ангиографические признаки, указывающие на ограничения коронарного
кровотока, связанные с процедурой (диссекция КА, окклюзия/тромбоз
крупной эпикардиальной /боковой ветви, разрушение коллатерального
кровотока или дистальная эмболизация); -
посмертное выявление тромба, связанного с процедурой, в целевой артерии,
или область некроза в миокарде, кровоснабжаемом этой артерией.
Критерии диагностики острого ИМ 4b типа
Критерии острого ИМ 1 типа в сочетании с тромбозом стента,
документированным при коронарной ангиографии или на аутопсии.
Критерии диагностики острого ИМ 4с типа
Критерии острого ИМ 1 типа, когда при коронарной ангиографии
единственной причиной возникновения ИМ представляется рестеноз (не
выявляются другие поражения, потенциально связанные с развившимся ИМ,
нет признаков внутрикоронарного тромбоза).
Критерии диагностики острого ИМ 5 типа (первые 48 часов после операции КШ)
Повышение концентрации сердечного тропонина в крови более 10 раз от
99-го перцентиля от верхней референсной границы у пациентов с исходно
нормальным уровнем в крови (если до процедуры концентрация тропонина в
крови была повышена и стабильна (вариация ≤20%) или снижалась, после
процедуры она должен повыситься >20%) в сочетании как минимум с один
признаком острой ишемии миокарда:
-
появление патологических зубцов Q на ЭКГ;
-
подтверждение с помощью методов визуализации наличия новых участков
миокарда с потерей жизнеспособности или нарушением локальной
сократимости в виде паттерна, характерного для ишемической этиологии; -
острая окклюзия шунта или нативной коронарной артерии, документированная
при коронарной ангиографии.
Для биохимической диагностики острого ИМ должны использоваться методы
определения концентрации сердечного тропонина в крови, обеспечивающие
коэффициент вариации определений 99-го перцентиля верхней референсной
границы не выше 20% (оптимально — не выше 10%).
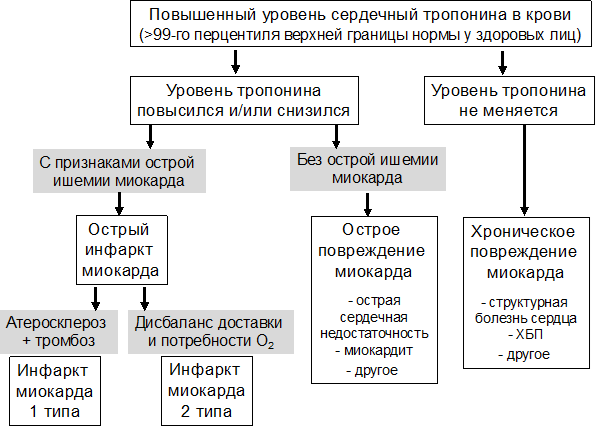
Рисунок 2. Диагностика и дифференциальная диагностика острого инфаркта миокарда 1 и 2 типов.
Критерии диагностики ранее перенесенного ИМ
-
Патологические зубцы Q на ЭКГ (с наличием предшествующих симптомов или
без них) при отсутствии не ишемических причин для появления
патологических зубцов Q. -
Подтверждение с помощью методов визуализации наличия участков миокарда с
потерей жизнеспособности в виде паттерна, характерного для ишемической
этиологии. -
Морфологические находки, характерные для перенесенного ИМ.
Приложение Г2. Причины повышения уровня сердечного тропонина и заболевания или состояния, затрудняющие оценку ЭКГ при подозрении на ИМпST
|
Повреждение (некроз) миокарда из-за острой ишемии миокарда
|
|
|
Повреждение (некроз) миокарда из-за острой ишемии миокарда |
за счет дисбаланса потребности и доставки кислорода |
|
Снижение перфузии миокарда:
|
Повышение потребности миокарда в кислороде:
|
|
Другие причины повреждения (некроза) миокарда |
|
|
Сердечные причины:
|
Несердечные причины:
|
Заболевания и состояния, затрудняющие ЭКГ диагностику ИМпST
-
Синдром ранней реполяризации желудочков сердц
-
Блокада ЛНПГ
-
Возбуждение желудочков сердца по дополнительному проводящему пути
-
ГЛЖ
-
Синдром Бругада
-
Перикардит, миокардит ТЭЛА
-
Субарахноидальное кровоизлияние
-
Метаболические нарушения (например, гиперкалиемия)
-
Кардиомиопатия
-
Холецистит
-
Сохраняющиеся изменения ЭКГ, свойственные молодому возрасту
-
Неправильное
наложение электродов -
ИМ в анамнезе с формированием патологических зубцов Q и/или
сохраняющимся подъемом ST (например, хроническая аневризма ЛЖ) -
Ритм сердца, навязанный с помощью ЭС желудочков
Приложение Г3. Внутривенная инсулинотерапия при ИМпST
Показания для инсулинотерапии у пациентов ИМпST и сахарным диабетом
-
Сахарный диабет 1 типа
-
Глюкоза плазмы при поступлении и последующих определениях стойко выше 10
ммоль/л -
Диабетический кетоацидоз
-
Гиперосмолярное гипергликемическое состояние
-
Известное лечение высокими дозами стероидов
-
Парентеральное питание
-
Тяжелое/критическое состояние
-
Кардиогенный шок, выраженная застойная СН, тяжелая постинфарктная
стенокардия, артериальная гипотензия, тяжелые нарушения сердечного ритма -
Любая степень нарушения сознания
Алгоритм для непрерывной внутривенной инфузии инсулинов
-
Непрерывная внутривенная инфузия инсулинов
проводится через отдельный инфузомат с применением раствора инсулинов и
аналогов быстрого действия действия с концентрацией 1 ед/1 мл 0,9 %
раствора натрия хлорида** . В отсутствие инфузомата допускается
внутривенное капельное введение. -
Рекомендуется определять уровень глюкозы плазмы 1 раз в час до ее
стабилизации в выбранном целевом диапазоне минимум 4 часа; затем 1 раз в
2 часа в течение 4 часов; в дальнейшем — 1 раз в 4 часа. У пациентов в
критическом состоянии требуется определять глюкозу плазмы 1 раз в час
даже при стабильном целевом уровне. -
Рекомендуемая средняя начальная скорость непрерывной внутривенной
инфузии инсулинов у пациентов уже имеющих уровень глюкозы плазмы в
целевом диапазоне — 0,5–1 ед/ч, для не находящихся в целевом диапазоне —
2–3 ед/ч (при наличии кетоацидоза — 0,1 ед/кг массы тела в час (но не
более 15 ед/ч). Более низкая начальная скорость (<0,5 ед/ч) используется
при дефиците массы тела, почечной, печеночной или надпочечниковой
недостаточности. Более высокая начальная скорость (> 3 ед/ч)
используется при сверхвысокой гипергликемии (более 25 ммоль/л) и
предполагаемой инсулинорезистентности (выраженном ожирении, признаках
инфекции, хронической терапии стероидами). -
Одновременно с непрерывной внутривенной
инфузией инсулинов желательно наладить инфузию 5–10 % раствора глюкозы
(требуется вводить 5 г глюкозы в час). Важно вводить инсулины и
декстрозу через разные инфузионные системы, так как требуется частая
раздельная коррекция скорости инфузии каждого из двух растворов. При
уровне глюкозы плазмы выше 14 ммоль/л глюкозу не вводят (до следующего
определения ее уровня). -
При уровне ГП менее 3,3 ммоль/л требуется
остановить инфузию инсулинов и ввести внутривенно 30–60 мл 40% раствора
глюкозы, при необходимости повторять введение декстрозы** каждые 20 минут.
После двукратного подтверждения уровня глюкозы плазмы выше 3,9 ммоль/л
следует возобновить инфузию инсулинов с меньшей скоростью. -
При переходе на подкожное введение инсулинов его инфузию прекращают
через 1–2 часа после первой подкожной инъекции инсулинов и аналогов
быстрого действия, или через 2–3 часа после первой инъекции инсулинов и
аналогов длительного действия.
| Глюкоза (ммоль/ л) | <3,9 | 3,9–6,1 | 6,2–6,6 | 6,7–8,3 | 8,4–9,9 | 10–13,3 | 13,4–16,6 | 16,7–19,9 | >20 |
|---|---|---|---|---|---|---|---|---|---|
|
Скорость введения инсулинов (ед/ час) |
Не вводить |
0,2 |
0,5 |
1 |
1,5 |
2 |
3 |
4 |
6 |
У отдельных пациентов (ранее получавших более 80 ЕД инсулинов в сутки,
получающих кортикостероиды, не достигающих целевой гликемии при
использовании предлагаемого алгоритма) может потребоваться использование
более интенсивных алгоритмов. У пациентов с повторным определением
уровня глюкозы менее 3,9 ммоль/л (два раза подряд) требуется перейти на
менее интенсивный алгоритм. Ознакомиться с этими алгоритмами можно в
рекомендациях по ведению пациентов с сахарным диабетом.
Приложение Г4. Оценка риска неблагоприятных событий у пациентов с ИМпST после выписки (для принятия решения о ранней выписке по шкале Zwolle)
| Фактор риска | Число баллов |
|---|---|
|
Класс СН по Killip |
|
|
II |
4 |
|
III |
9 |
|
IV |
9 |
|
Кровоток по инфаркт-связанной артерии (TIMI) |
|
|
0 |
2 |
|
1 |
2 |
|
2 |
1 |
|
Возраст |
|
|
Равен или старше 60 лет |
2 |
|
Трехсосудистое поражение при КГ |
|
|
Трехсосудистое поражение при КГ |
1 |
|
ИМ в прошлом (данный ИМпST повторный) |
|
|
ИМ в прошлом |
1 |
|
Продолжитлеьность ишемии > 4 часов |
|
|
Продолжитлеьность ишемии миокарда >4 часов |
1 |
|
РЕЗУЛЬТАТ (сумма баллов) |
|
|
Ранняя выписка (в пределах 72 часов от поступления) |
Сумма баллов |
|
Возможна |
≤3 |
|
Не оправдана |
≥4 |
Примечание:* — шкала предназначена для
пациентов с ИМпST, подврегнутых первичному ЧКВ Первичная публикация от
разработчиков шкалы [30]:
Данные по валидации шкалы [308–311]:
Приложение Г5. Классификация сердечной недостаточности при ИМ по Killip
| Класс | Признаки | Госпитальная смертность* |
|---|---|---|
|
I |
Нет признаков сердечной недостаточности |
2–3% |
|
II |
III тон, влажные хрипы в нижних отделах легких |
5–12% |
|
III |
Отек легких, влажные хрипы выше углов лопаток |
10–20% |
|
IV |
Кардиогенный шок |
50–81% |
Приложение Г6. Тромболитики и режимы их дозирования при ИМпST
| Тромболитические средства и режимы их дозирования при ИМпST & | |
|---|---|
|
Алтеплаза** |
В/в 1 мг/кг МТ (но не более 100 мг): болюс 15 мг; последующая инфузия 0,75 мг/кг МТ за 30 мин |
|
Проурокиназа рекомбинантная** |
В/в: болюс 2000000 МЕ и последующая инфузия 6000000 МЕ в течение 30–60 мин. |
|
Стафилокиназа рекомбинантная** |
1. Однократное внутривенное введение болюсом в дозе 15 мг (предпочтительно для 2. Первый болюс внутривенно 10 мг, повторный болюс 5 мг через 30 минут после первого. 3. Внутривенный болюс 10 мг, затем внутривенная инфузия 5 мг за 30 минут. |
|
Стрептокиназа |
В/в инфузионно 1500000 МЕ за 30–60 мин |
|
Тенектеплаза |
В/в болюсом за 5–10 сек: 30 мг при МТ <60 кг, 35 мг при МТ от 60 до <70 кг, 40 мг при МТ от 70 |
& — представлены доступные и разрешенные к применению в РФ средства.
Все представленные в таблице тромболитики, кроме стрептокиназы,
считаются фибринспецифичными.
Приложение Г7. Антитромботические средства при ИМпST
| Препарат | Рекомендации по применению |
|---|---|
|
Антиагреганты |
|
|
АСК** |
Внутрь; у ранее регулярно не принимавших первая доза 250 мг |
|
Клопидогрел** |
Сопровождение первичного ЧКВ: внутрь; первая доза #600 мг (как можно Сопровождение ТЛТ: внутрь; первая доза 300 мг или 75 мг у пациентов Сопровождение ЧКВ вскоре после ТЛТ: в первые 24 ч от введения Отсутствие реперфузионного #лечения: внутрь; 75 мг 1 раз/сут; |
|
Прасугрел |
Сопровождение первичного ЧКВ: внутрь; первая доза 60 мг, |
|
Тикагрелор** |
Сопровождение первичного ЧКВ: внутрь; первая доза 180 |
|
Блокаторы ГП IIb/IIIa рецепторов тромбоцитов |
|
|
F(ab`)2 фрагменты антител моноклональных FRaMon |
В/в; 0,25 мг/кг в |
|
Эптифибатид |
Болюс 180 мкг/кг в/в, затем в/в инфузия 1 мкг/кг/мин с |
|
Антикоагулянты для парентерального введения^^ |
|
|
Нефракционированный гепарин (гепарин натрия)** |
Сопровождение ТЛТ и другие показания к использованию лечебных доз антикоагулянтов: внутривенно; болюсом 60 ЕД/кг (максимально 4000 ЕД) Сопровождение ЧКВ: в/в болюсом 70–100 ЕД/кг, при необходимости Профилактика венозного тромбоза и ТЭЛА: под кожу живота 5000 ЕД 2–3 |
|
Бивалирудин |
Сопровождение первичного ЧКВ: в/в болюсом 0,75 мг/кг с |
|
Эноксапарин натрия** |
Сопровождение ТЛТ (у мужчин с уровнем креатинина в крови <2,5 мг/дл Сопровождение первичного ЧКВ: в/в болюсом 0,5 мг/кг, при процедуре ЧКВ на фоне начатого введения лечебных доз эноксапарина** натрия: Профилактика венозного тромбоза и ТЭЛА: п/к живота, 40 мг 1 раз/сут. (если нет необходимости в более высоких |
|
Фондапаринукс натрия |
Сопровождение ТЛТ стрептокиназой или отсутствие реперфузионного лечения (у пациентов с уровнем креатинина в крови <3,0 мг/дл или265 Профилактика венозного тромбоза и ТЭЛА: п/к живота 2,5 мг 1 раз/сут |
Приложение Г8. Медикаментозное лечение ИМпST
| Препарат | Доза* |
|---|---|
|
Лечение с 1-х суток заболевания |
|
|
Метопролол |
В/в медленно под контролем ЭКГ и АД по 5 мг 2–3 раза с |
|
Пропранолол |
В/в медленно под контролем АД и ЭКГ в дозе 0,1 мг/кг за |
|
Эсмолол |
В/в инфузия под контролем ЭКГ и АД; нагрузочная доза 0,5 мг/кг в течение |
|
Лечение с более отдаленных сроков заболевания** & |
|
|
Карведилол # |
Внутрь; начальная доза 3,125–6,25 мг 2 раза/сут., при |
|
Метопролол |
Внутрь; начальная доза 12,5–25 мг 2–3 раза/сут., обычная |
|
Бисопролол |
Внутрь; начальная доза 1,125–2,5 мг 1 раза/сут., при |
Примечания: в пределах одной группы лекарственные средства перечислены
по алфавиту; лечение b- адреноблокаторами, начатое в первые сутки
заболевания, при отсутствии противопоказаний должно продолжаться
неопределенно долго;
* указаны ориентировочные дозы, которые
могут быть меньше или несколько выше в зависимости от индивидуальной
переносимости и клинического эффекта у конкретного пациента;
** могут использоваться и другие препараты в
надлежащих дозах, не обладающие внутренней симпатомиметической
активностью;
#свидетельство положительного влияния на выживаемость получено у
пациентов с существенно нарушенной сократительной функцией ЛЖ (ФВ ≤40%);
& положительное влияние на выживаемость пациентов с ХСН при существенно
нарушенной сократительной
функции ЛЖ показано для бисопролола в целевой дозе 10 мг 1 раз в сутки,
карведилола в целевой дозе 25 мг 2 раза в сутки и метопролола сукцината
пролонгированного действия в целевой дозе 200 мг 1 раз в сутки.
| Препарат | Доза* |
|---|---|
|
Каптоприл |
Внутрь; первая доза 6,25 мг, через 2 часа 12,5 мг, через |
|
Лизиноприл |
Внутрь; первая доза 5 мг, через 24 ч 5 мг; целевая доза 10 |
|
Зофеноприл |
Внутрь; первая доза 7,5 мг, через 12 ч еще 7,5 мг, затем |
|
Рамиприл** & |
Внутрь; начальная доза 1,25–2,5 мг; целевая доза 5 мг 2 |
|
Трандолаприл** |
Внутрь; начальная доза 0,5–1 мг; целевая доза 4 мг 1 |
|
Эналаприл** |
Внутрь; начальная доза 2,5 мг; целевая доза 10 мг 2 |
|
Блокаторы рецептора ангиотензина II |
|
|
Валсартан** |
Внутрь; первая доза 20 мг с постепенным увеличением до 160 |
|
Альдостерона антагонисты |
|
|
Эплеренон# |
Внутрь при уровне креатинина в крови у мужчин <2,5 мг/дл |
|
Спиронолактон** |
Внутрь при уровне креатинина в крови < 220 мкмоль/л и |
Примечания: в пределах одной группы лекарственные средства перечислены
по алфавиту; лечение иАПФ следует начать как можно раньше (с первых
часов заболевания), как только стабилизируется гемодинамика (в
частности, САД станет не <100 мм рт.ст.) и при отсутствии
противопоказаний продолжать неопределенно долго;
* особенности подбора дозы у конкретного
пациента зависят от реакции АД, уровня креатинина и калия в крови; если
достичь целевой дозы препарата не удается, следует использовать
максимально переносимую дозу.
Приложение Г9. Дозы антитромботических средств при нарушенной функции почек
| Препарат | рСКФ 30-59 мл/мин/1,73 м2 или
КлКр 30–59 мл/мин |
рСКФ 15-29 мл/мин/1,73 м2 или
КлКр 15–29 мл/мин |
рСКФ < 15 мл/мин/1,73 м2 или
КлКр < 15 мл/мин |
|
|---|---|---|---|---|
|
Антитромбоцитарные препараты |
||||
|
АСК |
Неотложная помощь |
Дозировка не меняется [1] |
||
|
Плановое назначение |
Согласно инструкции, АСК противопоказана при |
|||
|
Клопидогрел [1] |
Неотложная помощь |
Обычная доза [1, 2] |
Обычная доза |
Нет данных [1]. В таких случаях рекомендуется индивидуальная оценка |
|
Плановое назначение |
Обычная доза [1, 2] |
Обычная доза [1, 2] |
||
|
Прасугрел |
Обычная доза [1, 2] |
Обычная доза [1, 2] |
Опыт применения |
|
|
Тикагрелор [3]] |
Обычная доза [1, 2] |
Обычная доза [1, 2] |
Отсутствует |
|
|
РF(ab`)2 фрагменты антител моноклональных FRaMon |
В инструкции к |
|||
|
Эптифибатид [1] |
КК ≥50 мл/мин: обычная доза. КлКр ≥30, но <50 мл/мин: |
Данных нет [2]. Клинические рекомендации ESC использовать не рекомендуют [1]. |
||
|
Антикоагулянты |
||||
|
НФГ** |
Доза подбирается под контролем АЧТВ независимо от фильтрационной функции почек |
|||
|
Эноксапарин натрия |
Обычная доза [1, 2] |
Согласно инструкции, при тяжелой почечной недостаточности (без указания |
Не рекомендуется (нет данных) [1, 2] |
|
|
Фондапаринукс натрия [1] |
Не рекомендован у пациентов с КлКр <20 мл/мин. |
|||
|
Бивалирудин |
Доза не меняется, за исключением |
Противопоказан [1, 2] |
||
|
Ривароксабан [1] в дозе 2,5 мг 2 раза в сутки |
Доза без изменений, но |
Доза без |
Противопоказан (данных нет) [2] |
|
Инфаркт миокарда: причины появления, симптомы, диагностика и способы лечения.
Определение
Инфаркт миокарда (ИМ) – это омертвление участка сердечной мышцы вследствие недостаточного ее кровоснабжения с развитием характерной клинической картины.
Причины появления инфаркта миокарда
Сердце – полый мышечный орган, имеющий форму конуса. Стенки сердца состоят из трех слоев. Внутренний слой – эндокард – выстилает полости сердца изнутри, и его выросты образуют клапаны сердца. Средний слой – миокард – состоит из сердечной мышечной ткани. Наружный слой – перикард. Сердце человека имеет четыре камеры: два предсердия и два желудочка. В правое предсердие поступает кровь из тканей самого сердца и всех частей тела (по верхней и нижней полым венам). В левое предсердие впадают четыре легочные вены, несущие артериальную кровь из легких. Из правого желудочка выходит легочный ствол, по которому венозная кровь поступает в легкие. Из левого желудочка выходит аорта, несущая артериальную кровь в сосуды большого круга кровообращения. Кислород к миокарду сердца доставляется по коронарным артериям.
Нарушение кровообращения вследствие атеросклеротического поражения коронарных артерий в 97-98% случаев имеет основное значение в возникновении инфаркта миокарда.
Атеросклерозом может поражаться как одна коронарная артерия, так и все три. Степень и протяженность сужения артерии могут быть различными. При повышении артериального давления склерозированный внутренний слой сосуда (эндотелий) легко повреждается, кровь проникает внутрь бляшки, активируется процесс свертывания крови и формируется тромб, который может частично или полностью закупорить сосуд.
Где может формироваться тромб:
- на месте разрыва уязвимой (нестабильной) атеросклеротической бляшки;
- на дефекте (эрозии) эндотелия коронарной артерии, не обязательно локализованном на поверхности атеросклеротической бляшки;
- в месте гемодинамически незначимого сужения коронарной артерии.
Тромбоз коронарной артерии бывает с полной или неполной пристеночной окклюзией. Тромб, расположенный проксимально (ближе к центру) в коронарной артерии имеет свойство переноситься с током крови более дистально (ближе к стенке сосуда) и приводить к образованию мелких очагов некроза и/или способствовать расширению основного участка некроза.
Развивающийся некроз миокарда может быть различных размеров, а некроз, проходящий через все слои сердца (трансмуральный) может стать причиной разрыва миокарда.
Образование очагов некроза в миокарде сопровождается изменением размера, формы и толщины стенки сердца, а сохранившийся миокард испытывает повышенную нагрузку и подвергается гипертрофии с увеличением объема и массы.
Такие сопутствующие состояния как: анемия, воспаление, инфекция, лихорадка, метаболические или эндокринные расстройства (в частности, гипертиреоз) могут спровоцировать или утяжелить ишемию миокарда.
К факторам риска развития инфаркта миокарда относятся:
- гиперлипидемия (нарушение нормального соотношения липидов крови);
- курение,
- сахарный диабет,
- артериальная гипертензия,
- абдоминальное ожирение,
- психосоциальные причины (стресс, депрессия и т.д.),
- низкая физическая активность,
- несбалансированное питание и потребление алкоголя.
Рецидивирующий инфаркт миокарда развивается в течение 28 дней после первоначального инфаркта миокарда. Если ИМ развивается в более поздние сроки, говорят о повторном инфаркте миокарда.
Классификация инфаркта миокарда
I. Острый инфаркт миокарда.
- Острый трансмуральный инфаркт передней стенки миокарда.
- Острый трансмуральный инфаркт нижней стенки миокарда.
- Острый трансмуральный инфаркт миокарда других уточненных локализаций.
- Острый трансмуральный инфаркт миокарда неуточненной локализации.
- Острый инфаркт миокарда неуточненный.
II. Повторный инфаркт миокарда.
- Повторный инфаркт передней стенки миокарда.
- Повторный инфаркт нижней стенки миокарда.
- Повторный инфаркт миокарда другой уточненной локализации.
- Повторный инфаркт миокарда неуточненной локализации.
III. Некоторые текущие осложнения острого инфаркта миокарда.
- Гемоперикард.
- Дефект межпредсердной перегородки.
- Дефект межжелудочковой перегородки.
- Разрыв сердечной стенки без гемоперикарда.
- Разрыв сухожильной хорды.
- Разрыв сосочковой мышцы.
- Тромбоз предсердия, ушка предсердия и желудочка сердца.
- Другие текущие осложнения острого инфаркта миокарда.
IV. Другие формы острой ишемической болезни сердца.
- Коронарный тромбоз, не приводящий к инфаркту миокарда.
- Синдром Дресслера — постинфарктный склероз.
- Другие формы острой ишемической болезни сердца.
- Острая ишемическая болезнь сердца неуточненная.
V. Перенесенный в прошлом инфаркт миокарда.
Симптомы инфаркта миокарда
При инфаркте миокарда в результате нарушения кровообращения в пораженном участке сердца накапливаются продукты обмена, которые раздражают рецепторы миокарда и коронарных сосудов, что проявляется острой болью. Болевой приступ приводит к выбросу адреналина и норадреналина корой надпочечников.
Боль при типичном течении инфаркта миокарда является основным его признаком. Она возникает за грудиной, иногда может отдавать в левую руку, левое плечо, горло, нижнюю челюсть, в подложечную область.
По интенсивности и длительности такая боль в значительной степени превосходит обычный приступ стенокардии. Боль не снимается приемом нитроглицерина. Длительность болевого синдрома может быть различной — от 1 часа до нескольких суток. Иногда инфаркт миокарда сопровождается резкой слабостью, головокружением, головной болью, рвотой, потерей сознания. Больной выглядит бледным, губы синеют, наблюдается потливость.
В первые сутки развития инфаркта миокарда может регистрироваться тахикардия (учащенное сердцебиение), нарушение ритма, повышение температуры до 37-38℃.
В 30% случаев инфаркт миокарда в первые часы своего развития может проявляться нетипично.
Выделяют следующие клинические варианты:
- астматический — протекает как приступ бронхиальной астмы (присутствуют одышка, затрудненное дыхание, чувство нехватки воздуха);
- гастралгический – характеризуется болями в области желудка с распространением в загрудинное пространство, может быть отрыжка, икота, тошнота, многократная рвота, вздутие живота;
- аритмический – возникают нарушения ритма сердца, угрожающие жизни;
- церебральная – характеризуется нарушением мозгового кровообращения (наблюдаются тошнота, головокружение, нарушение сознания с развитием обморока);
- бессимптомный – инфаркт миокарда без типичного болевого приступа. В связи с несоблюдением постельного режима и отсутствием должного лечения протекает неблагоприятно.
Диагностика инфаркта миокарда
Существуют четкие критерии диагностики инфаркта миокарда:
- клиническая картина инфаркта миокарда;
- картина инфаркта миокарда по данным ЭКГ;
- наличие новых участков миокарда со сниженным кровообращением или нарушение сократимости миокарда по данным инструментальных исследований;
- выявление тромбоза коронарных артерий по данным ангиографии.
Для подтверждения диагноза проводят следующие лабораторные исследования:
- определение уровня биохимических маркеров повреждения кардиомиоцитов в крови;
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
Альбумин (в крови) (Albumin)
Синонимы: Человеческий сывороточный альбумин; ЧСА; Альбумин плазмы;
Human Serum Albumin; ALB.
Краткая характеристика исследуемого вещества Альбумин
Альбумин – эт…
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Мочевина (в крови) (Urea)
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины.
Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea.
Краткая характеристика аналита Мочевина
Моче�…
Глюкоза (в крови) (Glucose)
Материал для исследования
Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазм…
Триглицериды (Triglycerides)
Синонимы: Липиды крови; нейтральные жиры; ТГ.
Triglycerides; Trig; TG.
Краткая характеристика определяемого вещества Триглицериды
Триглицериды (ТГ) – источник получен…
Калий, натрий, хлор в сыворотке крови (К+, Potassium, Na+, Sodium, Сl-, Chloride, Serum)
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl.
Краткая характеристика определяемых �…
Магний в сыворотке (Magnesium, Serum; Мg)
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium.
Краткая характеристика определяемого аналита Магний
…
Инструментальные исследования сердца:
- регистрация 12-канальной электрокардиограммы (ЭКГ) в покое, во время или сразу после приступа боли в грудной клетке для выявления признаков ишемии.
ЭКГ без расшифровки
ЭКГ представляет собой исследование, в основе которого — регистрация биопотенциалов сердца. Применяется для диагностики функциональной активности миокарда.
Рекомендуется зарегистрировать ЭКГ в течение 10 минут на месте первого контакта с медицинским работником (как правило, догоспитально) и безотлагательно интерпретировать ее.
- Трансторакальная эхокардиография (ЭхоКГ) в состоянии покоя № 786 для оценки функции и геометрии левого желудочка, а также для распознавания таких осложнений, как тромбоз полости, разрывы сердца, нарушение функции клапанов, перикардит, расслоение аорты и тромбоэмболия легочной артерии.
- Магнитно-резонансное томографическое (МРТ) исследование сердца для уточнения локализации и объема поражения даже при относительно небольших размерах очага (очагов) некроза. Исследование позволяет дифференцировать ишемическую или воспалительную (миокардиты) природу поражения, а также дать оценку работы клапанного аппарата сердца.
-
Компьютерная томография (КТ) может оказаться полезной для дифференциальной диагностики, если другие методы недостаточно информативны.
- Сцинтиграфия миокарда с 99тТс-пирофосфатом — дополнительный метод диагностики, который показан в тех случаях, когда имеются существенные затруднения в интерпретации изменений ЭКГ.
- Коронароангиография — исследование, выполняемое в условиях операционной путем введения контрастного вещества в устья коронарных артерий под рентгенологическим контролем. Коронароангиогарфия используется для выявления стенозов (сужений) в коронарных артериях, их локализации, протяженности и выраженности, а также для обнаружения участков нестабильности атеросклеротической бляшки. Коронароангиографию проводят для определения показаний к хирургическому лечению.
К каким врачам обращаться
Пациента с острым инфарктом необходимо оперативно доставить в стационар для профилактики осложнений и повышения шансов на выживание.
Система оказания помощи больным инфарктом миокарда включает следующие этапы:
- Догоспитальный этап. Бригада скорой помощи оказывает помощь и транспортирует больного в стационар.
- Госпитальный этап. Помощь оказывается кардиологами в специализированных отделениях.
- Реабилитационный этап. Реабилитация проводится в специальных отделениях больниц или специализированных кардиологических санаториях.
- Диспансерное наблюдение и амбулаторное лечение. Диспансеризация в постинфарктном периоде осуществляется в областных или городских кардиологических центрах или в кардиологических кабинетах поликлиник.
Лечение инфаркта миокарда
На догоспитальном этапе необходимо положить больному под язык таблетку нитроглицерина (или использовать нитросодержащий спрей) и дать аспирин, боль снимается введением обезболивающих препаратов; ликвидируются нарушения ритма сердца.
В острейшем (от 30 мин. до 2 часов) и остром периоде (от 2 часов до 14 суток) необходимо предотвратить увеличение очага омертвения миокарда, устранить боль, восстановить ток крови по сердечным артериям.
При переходе болезни в подострую стадию (до 1 месяца) и в постинфарктном периоде (свыше 1 месяца) необходимо снизить риск рецидива приступа и возможных осложнений.
Для лечения острого инфаркта миокарда используются лекарственные препараты из различных фармакологических групп:
- обезболивающие препараты: анальгетики из группы наркотических обезболивающих в сочетании с анальгином, антигистаминные препараты (димедрол), нейролептанальгезия (комбинация анальгетика с сильным нейролептиком). Для снятия возбуждения могут использоваться транквилизаторы. Для уменьшения гипоксии (снижения уровня кислорода в тканях) используют ингаляции кислорода с помощью носового катетера.
- Тромболитическая терапия необходима для восстановления тока крови по коронарным артериям и растворения тромбов, чтобы омертвение сердечной мышцы не распространялось дальше. Тромболитики вводят внутривенно.
- Антиагреганты препятствуют слипанию тромбоцитов, улучшая кровоток по артериям (ацетилсалициловая кислота). Также используются ингибиторы P2Y12-рецепторов тромбоцитов.
- Внутривенные/подкожные антикоагулянты нужны для профилактики тромбоза глубоких вен и тромбоэмболии легочной артерии.
-
Для ограничения зоны ишемии и некроза миокарда, уменьшения нагрузки на сердце используют нитраты и бета-блокаторы.
Для восстановления коронарного кровотока применяют хирургическое лечение:
- чрескожное коронарное вмешательство (ЧКВ) со стентированием (установкой каркаса в просвет коронарных артерий);
- аорто-коронарное шунтирование (хирургическое вмешательство, в результате которого восстанавливается кровоток в артериях сердца путем создания обхода места сужения коронарного сосуда с помощью отрезка вены с ноги или с внутренней грудной или лучевой артерии).

- Дисфункция сердца как проявление гибели кардиомиоцитов.
- Кардиогенный шок – жизнеугрожающее состояние, вызванное резким снижением сердечного выброса, приводящее к неадекватному кровоснабжению органов и тканей.
- Гемоперикард — кровоизлияние в полость перикарда.
- Отек легких — состояние, обусловленное обильным пропотеванием жидкой части крови в ткань легких, проявляющееся тяжелым удушьем, цианозом и клокочущим дыханием.
- Острая аневризма аорты (расширение участка аорты) и ее разрыв.
- Разрыв стенки левого желудочка (возникает примерно у 1% больных в первую неделю заболевания).
- Разрыв межжелудочковой перегородки.
- Аневризма сердца (участок истонченной рубцовой ткани с выпячиванием стенки желудочка в этой области).
- Острая сердечно-сосудистая недостаточность — состояние, вызванное ослаблением сократительной способности миокарда и застойными явлениями в малом или большом круге кровообращения.
- Тромбоэндокардит — образование пристеночных тромбов в полостях сердца, на клапанах сердца и прилежащем эндокарде при его воспалении.
- Тромбоэмболические нарушения — закупорка сосуда тромбом, оторвавшимся от места своего образования.
- Нарушения сердечного ритма.
- Постинфарктный синдром – это перикардит аутоиммунного генеза, развивающийся спустя несколько недель после острого инфаркта миокарда.
- Постинфарктная недостаточность кровообращения — состояние, при котором сердечно-сосудистая система не обеспечивает полностью потребности организма в кровоснабжении при нормальной жизнедеятельности.
Профилактика инфаркта миокарда
Профилактика инфаркта миокарда подразделяется на первичную и вторичную.
- Первичная профилактика проводится при наличии каких-либо проблем с сердцем до того, как произошел инфаркт, и включает:
- занятия спортом, так как малоподвижный образ жизни отрицательно влияет на сердечно-сосудистую систему;
- отказ от вредных привычек (курения, приема алкоголя);
- правильное питание (включение в рацион свежих овощей, фруктов и зелени, мяса птицы и кролика, рыбы и морепродуктов, ограничение соли; отказ от пряностей при экстрасистолии, так как они провоцируют развитие аритмии);
- отдых и полноценный сон не менее восьми часов в сутки;
- регулярные ежегодные посещения кардиолога для пациентов старше 40 лет с обязательным ЭКГ-исследованием, определением липидного профиля и контролем уровня сахара в крови;
-
контроль артериального давления, повышение которого зачастую провоцирует разрыв атеросклеротической бляшки. При выявленной артериальной гипертензии необходим своевременный и постоянный прием гипотензивных препаратов (снижающих артериальное давление), назначенных кардиологом.
- Вторичная профилактика направлена на предотвращение повторного инфаркта миокарда, проводится пациентам, которые уже перенесли инфаркт миокарда, длится всю жизнь и включает:
- соблюдение всех мер, применяемых для первичной профилактики инфаркта миокарда;
- постоянное применение медикаментозных препаратов, назначенных врачом;
- регулярный контроль состояния, уровня артериального давления, показателей биохимии, изменений на ЭКГ и эхокардиографии.
Источники:
- Клинические рекомендации «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы». Минздрав РФ, 2020.
- Кузьмичев Д.Е., Вильцев И.М., Скребов Р.В., Чирков С.В. Инфаркт миокарда в клинике. Проблемы экспертизы в медицине, журнал. 2015. С. 49-51.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
13060
01 Марта
-
13057
23 Февраля
-
4417
21 Февраля
Похожие статьи
Туннельные синдромы
Туннельные синдромы: причины появления, симптомы, диагностика и способы лечения.
Перелом шейки бедра
Перелом шейки бедра: причины появления, симптомы, диагностика и способы лечения.
Панариций
Панариций: причины появления, симптомы, диагностика и способы лечения.
Туберкулез легких
Туберкулез легких: причины появления, симптомы, диагностика и способы лечения.