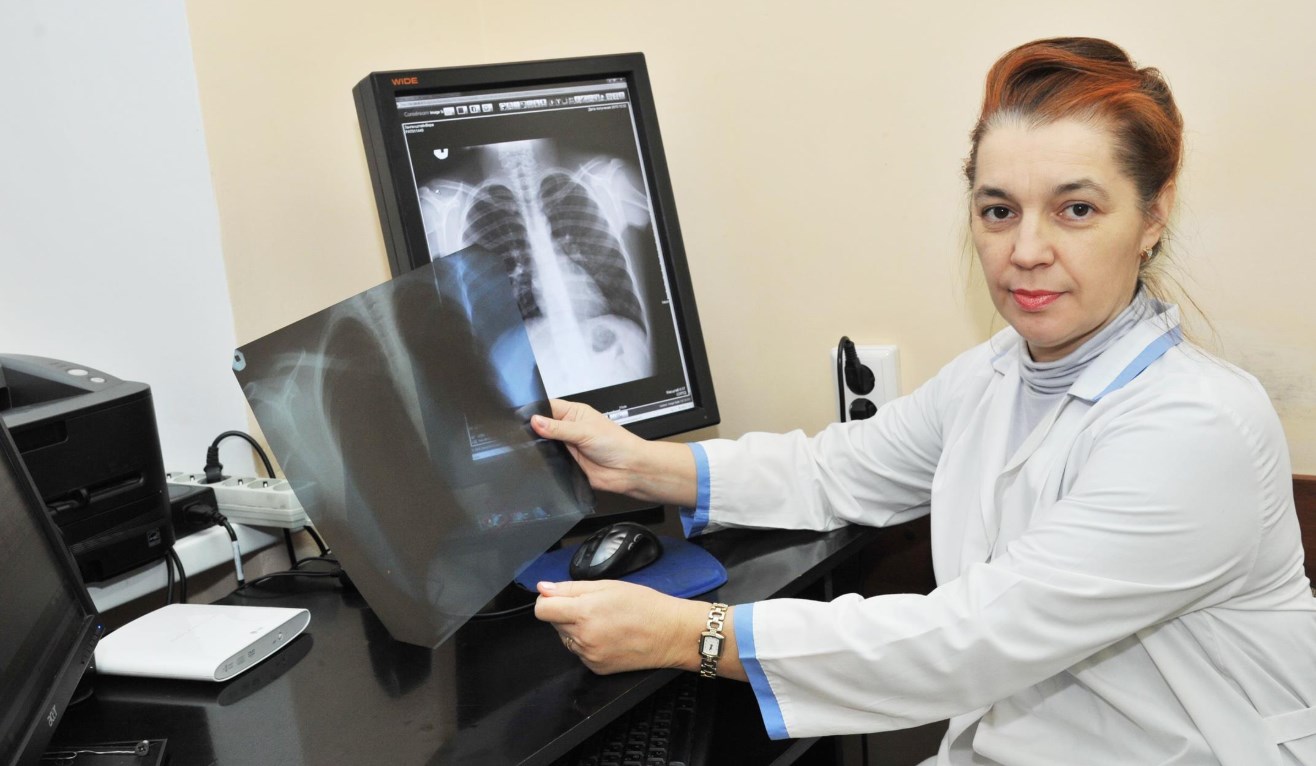
Как правило, новообразование печени впервые обнаруживают при УЗИ, однако чувствительность метода не позволяет выявить все малые опухоли и все имеющиеся узлы. К примеру, для выявления мелких метастазов, которые могут быть наряду с первичной опухолью, разрешающих возможностей ультразвукового исследования недостаточно. В то же время УЗИ навигация помогает контролировать выполнение чрескожной биопсии, что неотъемлемо при интервенционных вмешательствах и полезно в наблюдении за течением процесса.
Для первичной диагностики рака печени УЗИ не пригодно.
Как ставят диагноз рака печени?
В стандарты диагностики рака печени включены компьютерная (КТ) и магнитно-резонансная томографии (МРТ) обязательно с контрастными веществами, выявляющие типичную для гепатоцеллюлярного рака (ГЦР) васкуляризацию (сосудистую структуру) опухоли. Кровоснабжение опухоли идёт из других сосудов, нежели остальная ткань печени. В большинстве случаев злокачественные опухоли печени возникают на фоне хронической патологии, что тоже вносит изменение в картину КТ и МРТ, но есть типичные для каждого состояния моменты выведения контрастного вещества, которые хорошо знают специалисты.
Международные рекомендации считают доказанным гепатоцеллюлярный рак при независимой фиксации изменённого кровоснабжения печени во время динамической КТ и МРТ.
В России выполнение сразу двух исследований обычно не проводят, бывает достаточно и одного, но с совершенно типичной для рака картиной васкуляризации, не оставляющей каких-либо сомнений. Это может быть на выбор КТ с контрастным усилением или МРТ, то есть любой доступный метод объективной лучевой визуализации. Исследования позволяют оценить распространение злокачественного процесса, установить его стадию, оценить состояние всей печени.
Позитронно-эмиссионная томография для первичной диагностики рака печени пока не рекомендуется.
Биопсия печени
Биопсия позволяет получить морфологическое подтверждение рака. Но и при отрицательном результате нельзя отказаться от диагноза – в подобных случаях требуется динамическое наблюдение с регулярными контрольными обследованиями. Биопсию печени не стоит относить к методам «научно-обоснованного тыка» – манипуляции в глубине организма сложны, а современное оборудование даёт возможность контролировать нахождение иглы и с математической точностью подводить её к нужному месту.
Полученный при биопсии материал может быть малоинформативным совсем не по вине хирурга, а из-за особенностей строения и патологических изменений печени пациента, тем более при наличии цирроза или хронического гепатита.
Биопсия проводится тонкой иглой, так и называется «аспирационная тонкоигольная биопсия печени», когда насасывается материал.
Биопсия столбика ткани предпочтительнее, она именуется «кор-биопсия», но чаще русско-английской смесью «core-биопсия».
Манипуляция малоприятна, но больше психологически, чем физически. В хороших хирургических руках осложнения довольно редки. Вероятность кровотечения из-за повреждения сосуда составляет едва ли 1-2%. Опасения распространения опухолевых клеток по пункционному каналу оправданы, но при среднем полуторагодичном наблюдении такое возможно максимально в 11% случаев.
Биопсию печени не проводят, если изменённой в результате цирроза печени во время мультифазной компьютерной томографии выявлена васкуляризация, характерная для гепатоцеллюлярного рака, и диагноз подтверждается на контрастной МРТ.
Биопсия опухоли обязательна, если:
- новообразование печени без признаков цирроза;
- опухоль больше 2 см и на КТ и МРТ нетипичная васкуляризация;
- опухоль менее 2 см с типичным для ГЦР кровотоком, выявленном любым методом объективной визуализации;
- неоднозначная трактовка исследований при отсутствии изменений альфа-фетопротеина (АФП).
Биопсия не показана:
- не предполагается лечение из-за тяжёлой сопутствующей патологии;
- не планируется лечение из-за декомпенсированного цирроза печени;
- планируется резекция печени.
Лабораторные тесты
Анализы показывают функциональные возможности печени, но не способны что-либо сообщить о наличии или отсутствии злокачественной опухоли. То есть расскажут о циррозе и гепатите, но рак на показателях не отражается.
Роль альфа-фетопротеина (АФП) в диагностике рака печени несколько преувеличена. Этот маркёр повышается при любой патологии печени (и не только печени). При выявлении небольшого гепатоцеллюлярного рака АФП повышается у пятой части больных. Но при высоких показателях в несколько сот единиц и нарушениях васкуляризации при КТ или МРТ опухоли более 2 см, конечно, сомнений в злокачественности быть не может.
Наряду с методами визуализации маркёр АФП используется для контроля эффективности лечения рака печени, поскольку увеличивается при формировании сосудов в растущей опухоли.
| Подробнее о лечении рака печени в «Евроонко»: |
|
| Лечение рака печени в «Евроонко» | |
| Онколог-гастроэнтеролог | 5 100 руб |
| Скорая помощь для онкологических больных | от 12 100 руб |
Рак печени – это злокачественная опухоль, которая быстро увеличивается в размерах и даёт метастазы. Она может быть первичной или представлять собой метастазы из других органов. Заболевание в течение длительного времени протекает бессимптомно или проявляется неспецифическими признаками.
Диагностику рака печени онкологи Юсуповской проводят с помощью новейших методов исследования. Для лечения заболевания используют эффективнейшие противоопухолевые препараты, обладающие минимальным спектром побочных эффектов. Хирурги применяют инновационные методики оперативных вмешательств. Медицинский персонал обеспечивает профессиональный уход за пациентами.
Причины
Первичный рак печени возникает в среднем в 30 раз реже, чем вторичный. Как правило, злокачественная опухоль печени возникает на фоне наличия другого онкологического процесса в организме и его метастазирования (например, рак матки или желудка с метастазами в печень). Рак печени в 30 лет возникает также часто, как и в 50 и 60 – данное заболевание не имеет возрастных категорий. Активному метастазированию печень подвержена ввиду интенсивного кровообращения в этом органе. Существует ряд факторов риска, оказывающих влияние на формирование злокачественного новообразования в печени:
- хроническое воспаление печени. Цирроз, гепатит С и В существенно повышают риск развития онкологического процесса в печени;
- алкоголизм. Бесконтрольное употребление алкоголя разрушает клетки печени, обеспечивая благоприятные условия для формирования злокачественного новообразования;
- неправильное питание и, как следствие, избыточный вес. Чрезмерное скопление жира и замедление метаболизма повышают риск развития рака. Печень перестает справляться с объемами потребляемых гидрогенизированных жиров и постепенно теряет свои функции;
- гемохроматоз. Данный диагноз предполагает нарушение обмена железа в организме, вследствие чего в органах ЖКТ происходит его скопление;
- сердечная недостаточность;
- заражение паразитами;
- сахарный диабет;
- сифилис;
- желчнокаменная болезнь;
- воздействие радиации и онкогенных вирусов;
- нарушения работы эндокринной, лимфатической и кровеносной систем;
- нарушения в работе желчевыводящих путей;
- накопление в организме контрастного вещества торотраста. Он способен сохраняться в организме долгие года и со временем вызывать опухоль печени;
- прием препаратов, которые токсически воздействуют на печень;
- курение. Курение негативно влияет на здоровье человека, а в особенности на работу печени;
- пожилой возраст. С возрастом органы перестают работать также хорошо, как в молодости — снижается скорость обмена веществ и вероятность развития рака становится выше;
- отягощенная наследственность.
Обычно злокачественные новообразования печени развиваются под воздействием нескольких причин и провоцирующих факторов.
Симптомы
На первых стадиях рак печени протекает практически бессимптомно. Больного может беспокоить слабость и быстрая утомляемость, однако подозрений на рак печени это, как правило, не вызывает. В основном опухоль начинает проявляться после распространения за пределы печени или метастазирования в другие органы. Главными клиническими проявлениями рака печени являются:
- боли в районе правого подреберья;
- повышение температуры тела;
- чувство тяжести, обостряющееся после приема пищи;
- беспричинное снижение веса;
- снижение аппетита;
- желтушность кожных покровов и склер;
- тошнота, рвота, отрыжка воздухом;
- склонность к поносам или запорам;
- пальпируемый твердый узел в области печени;
- увеличение объема живота за счет скопления патологической жидкости;
- окрашивание кала в светлый цвет;
- темный цвет мочи;
- анемия;
- кожный зуд;
- носовые или желудочно-кишечные кровотечения.
Для того чтобы установить как можно раньше диагноз, следует обратиться к гастроэнтерологу при появлении первых признаков нарушения функции печени. После проведенного обследования пациента проконсультирует онколог. Ранняя диагностика злокачественных новообразований печени позволяет провести адекватную терапию, увеличивающую длительность жизни.
Симптомы у мужчин
Для мужчин характерны типичные проявления рака печени. Среди них выделяют:
- кожный зуд;
- увеличение размеров живота;
- гепатомегалия;
- эмоциональная лабильность.
В некоторых случаях возможно развитие гинекомастии, а также снижение либидо.
Симптомы у женщин
Симптомы рака печени у женщин ничем не отличаются от общих признаков. Врачи утверждают, что опасность для представительниц женского пола заключается в более поздних проявлениях заболевания. Характерными изменениями для женщин считаются:
- появление оволосения по мужскому типу;
- огрубение голоса;
- снижение либидо;
- уплотнения в области груди и подмышек.
Классификация
Первичный рак печени в основном развивается из гепатоцитов – клеток печени, либо из клеток желчного протока. Специалисты различают несколько видов опухолей печени:
- карциносаркома;
- саркома;
- лимфома печени. Возникает из-за разрастания атипичных лимфоцитов. Отличается данное новообразование быстрым ростом и распространением метастазов в отдаленные органы;
- гепатоцеллюлярная карцинома — крайне редкая форма опухоли в печени. Главной причиной возникновения данного вида рака является цирроз или гепатит В и С;
- цистаденокарцинома. Строение данного новообразования схоже со строением кисты. Основными проявлениями заболевания являются сильные резкие боли в животе и головокружения. Цистаденокарцинома склонна быстро расти, вследствие чего часто становится причиной сдавливания соседних внутренних органов;
- гепатобластома – опухоль, характерная для детского возраста. Характеризуется снижением веса при непропорциональном увеличении живота;
- холангиоцеллюлярный рак печени (рак ворот печени). Достаточно редкая форма онкологического заболевания, связанная с мутацией клеток желчных протоков. Выявляется, как правило, на поздних стадиях, когда лечение уже не приносит результатов;
- ангиосаркома. Самый сложный и практически не поддающийся лечению рак печени. Метастазы при ангиосаркоме распространяются очень быстро, не давая возможности врачам купировать или замедлить их рост. Причинами появления данной опухоли становится длительный контакт с ядовитыми и токсичными веществами на производствах;
- меланома печени. Одна из самых тяжелых опухолей печени. В основном возникает на почве метастазирования другой опухоли или вследствие развития меланобластомы;
- фиброламеллярная карцинома. Проявляется данное новообразование печени сильными болями в эпигастрии и верхнем отделении живота, если опухоль выросла до размеров 20 и более сантиметров. Поддаётся лечению на ранних стадиях;
- недифференцированная саркома. Опухоль печени в этом случае быстро растет и развивается, распространяя метастазы в соседние органы. Часто обнаруживается в детском возрасте и практически не лечится.
Своевременная диагностика обеспечивает быстрое определение диагноза, что при онкологических заболеваниях чрезвычайно важно. Не следует откладывать поход к врачу, ведь именно это может спасти вам жизнь.
Ангиосаркома печени
Крайне агрессивное злокачественное новообразование, которое возникает при контакте с токсичными химическими веществами (мышьяком, медью, винилхлоридом) и при воздействии радиоактивного излучения – ангиосаркома печени. Нередко рост опухоли начинается на фоне накопления в организме торотраста, который ранее принимали в качестве контрастного вещества при выполнении рентгенологических исследований.
Симптоматика ангиосаркомы является малоспецифичной – у пациента может наблюдаться боль в животе, вздутие, лихорадка, снижение веса и аппетита. При пальпации может ощущаться уплотнение, во время аускультации доктор может услышать характерные шумы. Установить диагноз на ранней стадии развития патологического процесса затруднительно, поскольку дебют заболевания не сопровождается клиническими признаками злокачественной опухоли.
Ангиосаркому выявляют с помощью тех же методов, что и другие виды злокачественных новообразований печени. На рентгенограммах можно увидеть торотраст в печени и селезёнке. Во время диагностической лапароскопии хирурги проводят биопсию и отправляют участки патологически изменённых тканей на гистологическое исследование. Поскольку ангиосаркому выявляют на поздней стадии, пациентам проводят паллиативную терапию в условиях хосписа.
Гемангиоэндотелиома печени
Клиническая картина гемангиоэндотелиомы печени не отличается от других видов опухолей. Поначалу болезнь протекает бессимптомно, впоследствии возникают характерные признаки рака печени – желтушность кожных покровов, лихорадка, слабость, быстрая утомляемость, внезапное и стремительное снижение веса. Нередко данное заболевание влечет за особой обширное внутреннее кровотечение. Ученые связывают это с поражением новообразованием соседних кровеносных сосудов и ухудшением свертываемости крови.
Результативными методами лечения гемангиоэндотелиомы являются:
- лучевая терапия. Применяется данная методика к первичной патологии, повторный курс лучевой терапии при рецидиве является неэффективным;
- оперативное вмешательство. Является наиболее эффективным методом лечения опухоли печени, так как позволяет ликвидировать очаг заболевания. Однако операция не является гарантией к полному выздоровлению, так как метастазы хирургическим путем удалить невозможно;
- химиотерапия. Данный метод подразумевает использование препаратов, разрушающих злокачественные клетки. Химиотерапия чревата ухудшением общего самочувствия пациента и в основном применяется в случаях неоперабельной повторной опухоли.
Врачи клиники онкологии Юсуповской больницы в своей практике используют лишь самые современные методы лечения, которые позволяют улучшить качество жизни пациента.
Метастазы
Метастазы являются главной опасностью любого онкологического заболевания, поскольку их практически невозможно остановить или предупредить их распространение.
Метастазы первичного рака печени способны распространяться в желудок, головной мозг, легкие, пищевод, вены и артерии, сердечную мышцу, сосуды, кости и позвоночник. Метастазы из печени попадают в организм следующими путями:
- через лимфоток;
- через кровеносную систему;
- через разрастание за пределы печени и повреждение соседних тканей и органов.
К сожалению, метастазы встречаются в 40% случаев рака печени и часто поражают жизненно важные органы, которые в последствии крайне тяжело лечить.
Осложнения
Неконтролируемое течение рака печени опасно возникновением осложнений. Их появление зависит от многих факторов. Среди возможных осложнений выделяют:
- кровотечение из опухоли;
- нагноение опухолевого очага;
- нарушение оттока желчи в связи со сдавлением желчных путей;
- нарушение кровообращения в связи со сдавлением органов брюшной полости большими размерами опухоли;
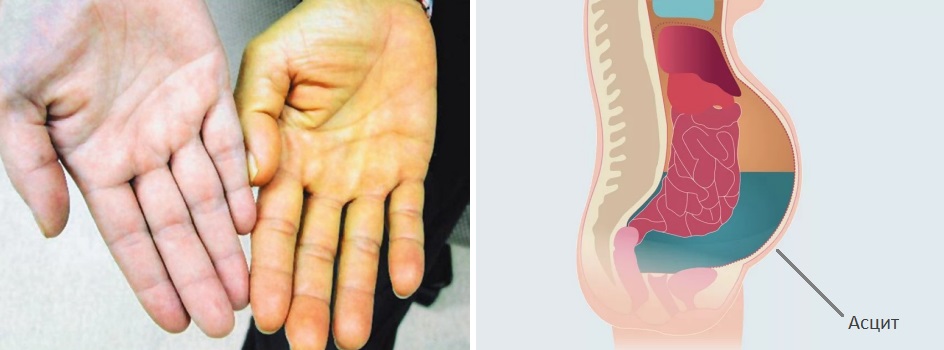
- асцит.
Перечисленные симптомы требуют немедленной диагностики и проведения оперативного вмешательства. Без этого возможен летальный исход.
Диагностика
Онкологи Юсуповской больницы проводят комплексное обследование, позволяющее быстро установить диагноз рака печени и верифицировать вид опухоли. Оно включает следующие исследования:
-
Общий анализ крови – увеличивается количество лейкоцитов и скорости оседания эритроцитов;
-
Биохимический анализ крови – повышается уровень билирубина, АЛТ, АСТ;
-
Определение уровня специфического опухолевого антигена (онкомаркера) АПФ.
С помощью ультразвукового исследования, которое выполняется с применением аппаратуры экспертного класса, обладающей высокой разрешающей способностью, определяют локализацию и размеры опухоли. УЗИ используют как для первичной диагностики, так и с целью динамического контроля состояния новообразования.
Магнитно-резонансная, компьютерная томография выполняется с целью уточнения размера образования, степени прорастания в окружающие ткани и органы, отдалённых метастазов.
Лапароскопия проводится с целью уточнения распространения опухолевого процесса. Во время исследования хирург выполняет биопсию – проводит забор участков тканей для гистологического исследования.
Стадии
Определение стадии заболевания с помощью клинического, инструментального и лабораторного исследования позволяет врачам клиники онкологии выработать оптимальную тактику ведения пациента.
-
При первой стадии рака печени размеры опухоли не превышают двух сантиметров. Клинические симптомы отсутствуют. В отдельных случаях пациенты ощущают повышенную утомляемость и дискомфорт в области правого подреберья.
-
На второй стадии заболевания размеры опухоли достигают пяти сантиметров. Наблюдается инвазия атипичных клеток в сосуды. Пациентов беспокоит тяжесть и тупая ноющая боль в правом подреберье. По мере прогрессирования патологического процесса боль усиливается.
-
Третья стадия рака печени сопровождается распространением опухоли на другие органы и ткани. Выраженный болевой синдром вынуждает больного обратиться к врачу.
- Рак печени четвёртой стадии характеризуется множественными метастазами в другие органы. В связи с повышением давления в портальной вене на передней стенке живота и грудной клетки расширяются вены. Пациентов беспокоит сильная боль, запоры. У них увеличивается объём живота за счёт скопления жидкости в брюшной полости, снижается масса тела, возникает эмоциональная лабильность.
Лечение
Врачи клиники онкологии Юсуповской больницы индивидуально подходят к выбору методов лечения каждого пациента, у которого выявлен рак печени. Комплекс лечебных мероприятий зависит от следующих факторов:
- расположение патологического очага;
- стадия развития опухоли;
- наличие или отсутствие метастазов;
- состояние пациента;
- сопутствующие заболевания.
Решение о необходимости и целесообразности того или иного метода терапии принимается после тщательно проведенной диагностики. Лечение рака печени включает в себя:
- Лекарственные препараты. Действующие вещества медикаментов оказывают токсическое воздействие на раковые клетки. При этом здоровые ткани не повреждаются. Химиотерапия при раке печени не имеет лечебного действия.
- Лучевая терапия. Локальное воздействие на опухоль приводит к уменьшению ее размеров. В результате уменьшается болевой синдром. Лучевая терапия используется на всех стадиях лечения рака печени.
- Абляция. Суть метода заключается во введении в опухолевое образование этанола. Затем на патологический очаг воздействуют микроволновым излучением. Абляция эффективна при наличии рака печени размером менее 3 см в диаметре.
- Сосудистая эмболизация. Кровообращение в области опухоли нарушается благодаря введению в сосуды специальных препаратов. В результате образование уменьшается в размерах. Сосудистая эмболизация эффективна при опухолях до 5 см в диаметре. Данный метод часто используется вместе с другими видами лечения рака печени.
- Оперативное вмешательство. При наличии операбельного рака показано удаление опухоли или трансплантация печени.
Питание
Состояние пациента улучшается при соблюдении специальной диеты. Повара Юсуповской больницы готовят блюда из качественных продуктов, которые не содержат нитратов, ГМО и канцерогенных пищевых добавок. В случае неконтролируемого снижения веса увеличивают суточную калорийность за счёт белковых продуктов. При приготовлении блюд отдают предпочтение щадящим кулинарным технологиям: варке, тушению, на пару и гриле, запеканию в духовке.
Из рациона пациента исключают следующие продукты:
- магазинные соусы;
- копчености и соленья;
- наваристые бульоны;
- маргарин и другие тяжелые жиры;
- свежую выпечку;
- алкогольные напитки;
- крепкий чай и кофе.
Прогноз
Поскольку рак печени часто диагностируют в конечной стадии опухолевого процесса, поэтому прогноз для выздоровления в большинстве случаев пессимистичный. Проводимая паллиативная терапия направлена на уменьшение выраженности симптомов заболевания, облегчение общего состояния. При наличии сопутствующих патологий летальный исход наступает спустя 6 месяцев или 1 год после постановки диагноза.Средняя продолжительность жизни после возникновения данного заболевания около 2 лет при правильно подобранном эффективном лечении.
Профилактика
Снизить риск развития рака печени можно, если соблюдать следующие врачебные рекомендации:
- исключить алкогольные напитки;
- контролировать вес;
- соблюдать технику безопасности при работе с токсичными веществами;
- избегать незащищенного полового акта;
- не принимать наркотические средства;
- наносить тату или татуаж только в проверенных салонах;
- вовремя проводить вакцинацию против гепатита В;
- проходить ежегодный профилактический осмотр у врача.
Лечение рака печени в Юсуповской больнице назначают квалифицированные онкологи сообразно характеру опухоли, ее виду и стадии. Все терапевтические процедуры проводятся под четким контролем медицинского персонала, готового оказать помощь в любую минуту. В нашей клинике можно пройти любые виды обследований с использованием профессионального современного оборудования.
Содержание статьи:
- Что такое первичный рак печени
- Причины и факторы риска развития заболевания
- Признаки рака печени
- Классификация первичного рака печени
- Стадирование
- Диагностика первичного рака печени
- Методы лечения рака печени
- Прогноз
- Профилактика рака пищевода
Термином первичный рак печени называют злокачественную опухоль, которая формируется из печеночных клеток (гепатоцитов), которые в силу различных причин трансформируются в опухолевые. Другие названия патологии – гепатоцеллюлярная карцинома, рак печеночно-клеточный либо гепатоцеллюлярный рак.
Злокачественные опухоли печени в структуре онкологической заболеваемости занимают шестое место. Однако, по смертности от рака они стоят на третьем месте, а у пациентов с цирротическими повреждениями онкология печени выходит на первое место по причине неблагоприятных исходов. Каждый год по всему миру регистрируется до 780 тысяч пациентов с впервые выявленным раковым поражением ткани печени. Этот вид онкологии имеет агрессивное течение с крайне неблагоприятными прогнозами. Если не начать своевременное лечение, то длительность жизни обычно не превышает двух лет.
Этот тип опухоли примерно три раза чаще регистрируется среди мужчин, чем женщин. За последние 10 лет наблюдается рост числа заболевших. Средний возраст пациентов от 50 до 65 лет.
Тип опухоли зависит от клеток, из которых он развивается: гепатоцеллюлярная карцинома берет начало в области клеток печеночной паренхимы, в то время как холангиокарцинома возникает в области клеток, формирующих желчные протоки. Тип опухоли устанавливается по данным гистологического исследования.
Причины и факторы риска
Точные причины рака печени еще не установлены. Чаще всего злокачественное поражение возникает на фоне длительно протекающего воспалительного процесса в печеночной ткани. Наиболее часто первые признаки рака печени обнаруживаются на фоне цирроза. В тех регионах, где широко распространен вирусный гепатит, случаи рака печени выявляются значительно чаще. Так, примерно у 25% всех пациентов, с признаками онкологии печени, определяется вирусный гепатит С, а примерно у 40% – хроническое носительство вируса гепатита В.
Среди других факторов риска, повышающих риск развития рака печени, можно выделить:
- нерациональное питание, ведущее к ожирению;
- прием большого количества алкоголя;
- длительный прием препаратов, обладающих гепатотоксичностью (включая стероидные средства, оральные контрацептивы);
- влияние внешних факторов – токсинов, поражающих печеночные клетки (винилхлорид, афлотоксины);
- длительный стаж сахарного диабета;
- синдром Бадда-Киари (это эпизоды тромбоза в области печеночных вен);
- наследственные патологии – болезнь Вильсона, гемохроматоз, тирозинемия, гликогенозы, дефицит альфа-трипсина, полипоз кишечника.
В некоторых случаях определить причины рака печени не удается, тогда случаи считаются идиопатическими.
Симптомы рака печени
Первые признаки рака печени не имеют специфичности, они возможны и при многих других патологиях органа (острые и хронические гепатиты, альвеококкоз, цирроз, поражение желчных протоков или метастазы в печень). На ранних стадиях патология может никак себя не проявлять, поскольку орган обладает высоким резервом. Поэтому нередко впервые рак печени выявляется на УЗИ, которое проводится по поводу различных патологий внутренних органов, расположенных около печени. Если опухоль имеет значительный размер, у пациентов могут появляться следующие жалобы и проявления:
- снижение или полное отсутствие аппетита (анорексия);
- уменьшение количества гемоглобина и эритроцитов;
- неприятные ощущения, болезненность в области подреберья, ближе к правой стороне или в верхних отделах живота;
- тошнота, приступы рвоты с примесью желчи или пищи;
- увеличение размеров живота за счет роста опухолевого образования, которое можно прощупать через брюшную стенку;
- асцит (рост живота за счет скопления в нем жидкости);
- потеря веса, порой очень значительная (до нескольких килограммов за пару месяцев);
- пожелтение кожи и области белков глаз (развитие желтухи);
- выраженный кожный зуд;
- носовое кровотечение;
- нарушения стула – чередование запоров или поносов;
- изменение окраски мочи (темная) и стула (обесцвечивание);
- расширение мелких капилляров под кожей (формирование телеангиоэктазий).
На фоне роста и распада опухоли возможно общее недомогание, повышение температуры, слабость.
Разновидности первичного рака печени
Существует несколько вариантов классификации для первичного рака печени. Выделяют различные типы опухоли, которые различаются по течению и прогнозу. Эксперты выделяют несколько наиболее типичных видов первичного печеночного рака (опухоль образуется из клеток органа).
Гепатоцеллюлярный рак – это наиболее часто возникающая опухоль (карцинома) в области печени. Как понятно из названия, эти опухоли формируются в гепатоцитах, образующих основу печеночной ткани. Течение гепатоцеллюлярного рака возможно в двух клинических формах – диффузная (когда поражается обширная часть печени) или узловая (образуется один очаг – узел или несколько участков).
Возможен более благоприятный вариант этого рака – фиброламеллярная карцинома, при ней есть возможности более активного лечения.
Холангиокарцинома – это опухоль злокачественного типа, которая берет начало в области желчных протоков.
Холангиогепатома – это смешанный вариант опухоли, при которой раковые клетки зарождаются как в области гепатоцитов, так и в области эпителиальных клеток в желчных протоках.
Также возможны такие варианты опухолей как ангиосаркомы, мезодермальные образования – это поражения, которые растут из лимфатических капилляров, кровеносных сосудов или клеток соединительной ткани.
У детей возможна гепатобластома, также выделяется и цистаденокарцинома. Она возникает в результате перерождения доброкачественной опухоли.
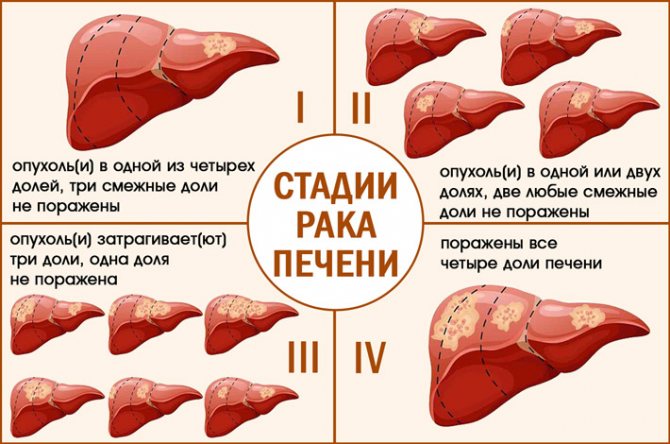
Стадии рака печени
Основу клинической классификации составляет система TNM. Она базируется на патологических особенностях новообразования, и в зависимости от стадии рака печени зависит ее прогноз. Каждый критерий классификации будет указывать на присутствие или отсутствие определенных изменений.
- T — это рост и распространение опухоли, наличие нескольких опухолевых узлов, размеры самого большого их них, а также прорастание опухолевого очага в соседние области.
- N — отражает метастазирование опухоли в близлежащие (регионарные) или отдаленные лимфоузлы;
- М — показатель отражает метастазирование рака печени в другие органы.
Помимо этих критериев на течение болезни, особенности ее лечения и прогноз рака печени влияют наличие фиброза и степень дифференцирования опухолевых клеток. Чем ниже степень дифференцировки, тем сильнее раковые клетки отличаются от здоровых и тем агрессивнее рак. Эти показатели крайне негативно влияют на выживаемость вне зависимости от стадии по ТNM.
Один из вариантов классификации базируется на показателях крови при раке печени. Они определяют функциональную активность печени и выраженность цирроза. Оценку проводят по уровням общего билирубина, сывороточного креатинина, показателей свертывания крови.
Первичный рак печени: диагностика
Всем людям, которые относятся к группе высокого риска по развитию рака печени, проводится регулярное обследование. Прежде всего, врачи смотрят УЗИ-признаки рака печени у лиц, страдающих хроническими воспалительными процессами органа, имеют разные степени цирроза. Им показано выполнение ультразвукового исследования каждые полгода, даже при отсутствии жалоб.
Кроме того, им показано выполнение лабораторных исследований крови на определение онкомаркер первичного рака печени – АФП (расшифровывается как альфа-фетопротеин). При таком варианте наблюдения можно выявить опухолевые поражения в ранней стадии (еще нет симптомов и жалоб), когда рак можно радикально излечить. Изменения в анализах при раке печени с ростом АФП типично до 50-90% пациентов. Повышение уровня более 400 нг/мл возможно у лиц с большим размером опухоли или быстро растущими опухолями. Но временное повышение показателя возможно на фоне цирроза или воспаления гепатоцитов. Однако, высокий АФП в комбинации с данными УЗИ, МРТ печени подтверждает диагноз почти у 100% пациентов.
Выполнение КТ или МРТ с контрастом помогает в выявлении опухоли и уточнении ее размеров и локализации, что важно для составления плана лечения онкологии печени.
Если всех этих данных недостаточно для постановки диагноза, выполняют чрезкожную биопсию (пункционную либо аспирационную) под контролем ультразвука. Риск осложнений при таких методах диагностики минимальный.
Методы лечения рака печени
При подтверждении диагноза рака печени необходимо немедленно начать лечение. Оно будет длительным и включает несколько этапов. Кроме того, в зависимости от типа опухоли, ее размеров и локализации, сочетают несколько методов. Основной метод – хирургическое удаление рака – резекция части печени или полное ее удаление с трансплантацией донорского органа. Если резекция невозможна, а подходящих доноров для трансплантации нет, врачи могут применять нерезекционную терапию – чрезкожные введения этанола, проведение радиочастотной абляционной терапии, эмболизация артерий или химиоэмболизация сосудов опухоли. Также возможно и традиционное лечение первичного рака печени – химиопрепараты, применение рентгенотерапии, таргетных препаратов или сочетания нескольких методик.
В начальной стадии рака печени основным методом терапии будет операция. Проводится резекция опухоли в пределах здоровых тканей. Возможна одномоментная резекция и двухэтапная операция с предварительной перевязкой или эмболизацией портальной вены.
Среди противопоказаний к подобному вмешательству выделяют поражение отдаленных лимфоузлов и метастазирование рака. Однако, если остающегося участка печени недостаточно для полноценного ее функционирования, если функции органа существенно нарушены, есть признаки печеночной недостаточности, опухоль проросла в печеночную вену, поражает портальную систему, врачи прибегают к альтернативным методам терапии.
Если опухоль развивается на фоне цирроза – единственный радикальный метод лечения – это трансплантация органа. Однако критерии для пересадки очень жесткие, поэтому подобная операция выполняется нечасто.
Химиотерапия при раке печени применяется нечасто в виду ее малой активности в отношении раковых клеток. Ее проводят с использованием цитостатических препаратов, но эффективность не превышает 20%. При комбинации химиопрепаратов с иммунотерапией при раке печени возможно развитие токсических побочных эффектов (понижение уровня тромбоцитов, лейкоцитов). Но опухоль можно уменьшить до тех размеров, когда она может быть удалена. Исследования в области применения новых иммунотерапевтических препаратов еще ведутся, но они показали определенные успехи.
Лучевая терапия при раке печени применяется ограниченно, так как возможно развитие лучевого гепатита и недостаточности органа. Ее используют при неоперабельных новообразованиях в области портальной вены, ворот печени. Используется современное оборудование, которое минимизирует повреждение окружающих здоровых тканей.
Одним из перспективных направлений является таргетная терапия в онкологии при раке печени. Это направленное влияние на раковые клетки без влияния на здоровые ткани. Ее используют в стадиях, когда операция опасна или невозможна, препараты помогают сократить размеры образования.
Прогноз заболевания
При раннем выявлении рака печени выживаемость за пять лет составляет от 60% и выше, при позднем диагнозе не превышает 1-2 лет. Прогноз наиболее благоприятен при раке без признаков цирроза и выявленной фиброламеллярной карциноме.
Профилактика рака печени
Среди основных профилактических мероприятий можно выделить отказ от приема алкоголя, проведение вакцинации против вирусного гепатита В, а также защита от заражения другими типами инфекции. Кроме того, важно своевременное распознавание и лечение патологий печени, лечение жирового гепатоза и цирроза.
4.25 из 5. Голосов: 4
Спасибо за вашу оценку.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Рак печени – злокачественная опухоль. Может быть первичной и развиваться из клеток самого органа или вторичной, которая обусловлена метастазами (распространением) первичной опухоли из другого органа. На долю метастатического рака печени приходится больший процент случаев.
Мужчины в три раза больше подвержены развитию онкопатологии. Пятилетняя выживаемость при первичном раке печени достигает 20%.
Причины рака печени
Рак печени может развиваться в связи с мутациями ДНК. Клеточная ДНК — это материал, содержит «инструкцию» к каждому химическому процессу, происходящему в организме. Мутации изменяют последовательность алгоритма. Происходит бесконтрольный рост клеток. Клетки теряют привычную, нормальную структуру. Иммунные механизмы защиты становятся неэффективными, потому что раковые клетки выделяют вещество, которое делает новообразование «невидимым».
Доказано увеличивают риск развития рака печени факторы:
- хронический инфекционный гепатит B и С;
- цирроз (прогрессирующее необратимое изменение, нормальная ткань при этом состоянии замещается рубцовой, не способной выполнять функции);
- наследственные заболевания (гемохроматоз, болезнь Уилсона);
- случаи рака печени в семье;
- чрезмерное употребление алкоголя;
- ожирение, жировое «перерождение» анатомических структур печени;
- сахарный диабет.
Симптомы и признаки рака печени
На начальных этапах заболевание может не проявляться. С ростом опухоли формируются первые симптомы и признаки:
- повышенная утомляемость, усталость (интоксикационный синдром);
- боли в правом подреберье, правом плече;
- потеря веса;
- отекание нижних конечностей;
- увеличение живота (асцит). Растущее новообразование, сдавливая магистральные крупные вены, может приводить к задержке жидкости.
- желтуха – пожелтение кожных покровов, изменение цвета мочи и стула;
- снижение аппетита;
- лихорадка.
Прогрессирующие стадии рака печени могут сопровождаться такими симптомами, как тошнота, рвота, боли в левом подреберье из-за увеличения в размерах селезенки, расширение подкожных сосудов передней брюшной стенки с формированием характерных извитых сосудистых рисунков.
Классификация и стадии
Рак классифицируют на первичный и вторичный. Первичный процесс обусловлен ростом злокачественной ткани из клеток печени. Вторичный представлен метастазами из других органов (кишечник, легкие, молочная железа).
- Гепатоцеллюлярная карцинома – наиболее распространенный тип первичного образования. Развивается в печеночных клетках — в гепатоцитах.
- Холангиокарцинома – по-другому новообразование желчных протоков. Берет начало из клеток, выстилающих желчевыводящие протоки.
- Ангиосаркома – редкий тип рака, в большей степени этой патологии подвержены пожилые люди старше 70 лет. Рост опухоли начинается из сосудов.
Стадия процесса позволяет судить, насколько распространился опухолевый процесс. Существуют две основные системы стадирования: стадия I-IV и система TNM.
0 – опухоль локализована и не распространяется;
1 – опухоль достигает небольших размеров, не распространяется;
2 – прогрессирующий рост без распространения;
3 — рост с распространением в окружающие ткани и/или лимфатические узлы;
4 – обнаружение метастазов в других органах.
Система TNM использует буквы и цифры для описания:
T (tumor – опухоль) – дает представление о размерах;
N (nodulus – лимфатический узел) – поражение лимфатических узлов;
M (metastasis) – распространение метастазов.
Диагностика рака печени
Скрининг для раннего выявления патологии не проводится в повседневной практике, но может рассматриваться как вариант среди пациентов из группы риска. В нее входят пациенты, страдающие гемохроматозом, хроническим гепатитом и алкоголизмом.
Диагностика рака печени включает проведение лабораторных и инструментальных исследований:
- Анализ крови для определения показателей функциональной активности печени и онкомаркеров. Растущая раковая опухоль выделяет специфическое вещество – альфа-фетопротеин, определение которого позволяет заподозрить данное заболевание (в 70% случаев возрастает уровень альфа-фетопротеина). Повышение уровня железа может свидетельствовать о заболевании, однако это не является специфичным.
- Визуализирующие методы. Ультразвуковое исследование позволяет определить опухоль размером в 1 см и более. Высокоразрешающие КТ-сканы и магнитно-резонансная томография с контрастированием используются для уточнения распространения и стадирования опухолевого процесса.
- Биопсия с последующим гистологическим исследованием, хотя в некоторых случаях биопсия не требуется, диагноз ставится на основании базовых диагностических методов.
Лечение рака печени
Метод лечения зависит от стадии, возраста, характера сопутствующих заболеваний.
Оперативное лечение:
- Хирургическое удаление. Опухоль удаляется в пределах здоровых тканей с сохранением не менее 35% объема здорового органа.
- Трансплантация донорской печени.
Прицельные методы лечения рака печени:
- Радиочастотная абляция. В основе метода лежит нагревание и последующее разрушение опухоли под контролем ультразвукового датчика.
- Криоабляция. Опухоль разрушается под действием экстремально низкой температуры.
- Химиоэмболизация — чрессосудистое введение химиопрепаратов в пораженную область.
- Лучевая терапия.
В основе метода лежит использование мощной энергии из таких источников, как рентгеновское излучение. Дистанционная радиотерапия целенаправленно воздействует на опухоль, не повреждая окружающие ткани. Лучевая терапия может использоваться при раке печени, если другие способы невозможны или оказались неэффективными.
Таргетная терапия.
Целевая медикаментозная терапия направлена на блокирование работы молекул, которые отвечают за прогрессирование заболевания. Многие таргетные препараты в настоящее время доступны для лечения рака.
Химиотерапия.
Препараты вводятся внутривенно или перорально, используются при быстро растущих опухолях в комбинации с другими методами или самостоятельно.
Опасность заболевания
Растущая по сама себе опухоль представляет опасность, выделяя патологические вещества, которые нарушают обменные процессы, вызывают синдром раковой интоксикации.
Прогрессирующая в размерах опухоль может нарушать работу соседних органов (кишечник, желудок, желчный пузырь, диафрагма). Повышается риск развития жизнеугрожающих состояний: непроходимость кишечника, желтуха, кровотечение из разорвавшихся сосудов пищевода.
Прогноз и профилактика
Профилактика рака заключается в соблюдении следующих рекомендаций:
- ограничение употребления алкоголя;
- поддержание оптимального веса согласно индексу массы тела;
- вакцинация от гепатита B;
- меры для предотвращения заражения гепатитом С (защищенный половой контакт, отказ от небезопасного внутривенного введения лекарственных препаратов и наркотиков, получения услуг в лицензированных тату-мастерских).
Прогноз зависит от многих факторов: типа и стадии заболевания, возраста пациента и сопутствующей патологии на момент постановки диагноза. Прогноз наиболее благоприятный, когда диагноз ставится на ранних стадиях рака печени, когда возможно радикальное хирургическое лечение.
Рак печени: причины появления, симптомы, диагностика и способы лечения.
Определение
Рак печени (гепатоцеллюлярный рак) – это злокачественное новообразование из эпителиальных клеток.
Злокачественный процесс может быть первичным или представлять собой метастазы из других органов. Согласно наблюдениям врачей, первичный рак печени возникает в среднем в 30 раз реже, чем вторичный. Как правило, опухоль в печени формируется на фоне другого онкологического процесса в организме и его метастазирования, что во многом объясняется интенсивным кровоснабжением этого органа.
Рак печени не имеет возрастных критериев и может наблюдаться у пациентов любого возраста.
Причины появления рака печени
Выделяют ряд факторов, повышающих риск формирования злокачественного новообразования в печени:
- хронические воспалительные процессы в печени: цирроз, гепатит С и В существенно повышают риск развития онкологического процесса;
- злоупотребление алкоголем разрушает клетки печени, обеспечивая благоприятные условия для формирования злокачественного новообразования;
- неправильное питание и, как следствие, избыточный вес и замедленный метаболизм повышают риск развития рака;
- гемохроматоз – нарушение обмена железа в организме с его накоплением в органах ЖКТ;
- сердечная недостаточность;
- заражение паразитами;
- сахарный диабет;
- сифилис;
- желчнокаменная болезнь;
- воздействие радиации и онкогенных вирусов;
- нарушения в работе эндокринной, лимфатической и кровеносной систем;
- нарушения в работе желчевыводящих путей;
- прием гепатотоксичных препаратов;
- пожилой возраст;
- отягощенная наследственность.
Обычно злокачественные новообразования печени развиваются под воздействием нескольких провоцирующих факторов.
Классификация заболевания
Первичный рак печени, как правило, развивается из гепатоцитов (клеток печени) либо из клеток желчного протока. Специалисты различают несколько видов опухолей печени: карциносаркома, саркома, лимфома печени (возникает из-за разрастания атипичных лимфоцитов, отличается быстрым ростом и метастазированием в отдаленные органы), гепатоцеллюлярная карцинома, цистаденокарцинома, гепатобластома (обычно развивается у детей), холангиоцеллюлярный рак печени (рак ворот печени) – достаточно редкая форма онкологического заболевания, связанная с мутацией клеток желчных протоков и выявляемая, как правило, на поздних стадиях, когда лечение уже не приносит результатов; ангиосаркома – самый сложный и практически не поддающийся лечению злокачественный процесс (метастазы распространяются очень быстро, не давая возможности врачам купировать или замедлить их рост), меланома печени, фиброламеллярная карцинома, недифференцированная саркома.
Согласно международной ТNМ-классификации (tumor, nodus и metastasis), выделяют следующие стадии первичного рака печени:
- T0 – первичный рак печени не определяется,
- T1 – образование до 2 см в диаметре; прорастание сосудов отсутствует,
- T2 – образование до 2 см в диаметре с прорастающими сосудами печени или опухоль более 2 см без вовлечения сосудов,
- T3 –опухоль размером более 2 см или множественные мелкие опухоли, прорастающие сосуды и ограниченные одной долей,
- T4 – множественные очаги в обеих долях печени или одиночная опухоль с прорастанием печеночной или портальной вены либо висцеральной брюшины.
- N0 – отсутствует поражение лимфоузлов гепатодуоденальной связки и ворот печени,
- N1 – присутствуют метастазы в лимфоузлы гепатодуоденальной связки либо ворот печени.
- M0 – отдаленные метастазы рака печени не определяются,
- M1 – выявляются метастазы рака печени в отдаленных органах.
Симптомы рака печени
На первых стадиях заболевание нередко протекает бессимптомно. Больного может беспокоить слабость и быстрая утомляемость, однако подозрений на рак печени это, как правило, не вызывает.
Опухоль дает о себе знать после распространения за пределы органа или метастазирования в другие органы. Главными клиническими проявлениями рака печени являются:
- боль в правом подреберье,
- повышение температуры тела,
- чувство тяжести, обостряющееся после приема пищи,
- беспричинное снижение веса и аппетита,
- желтушность кожных покровов и склер,
- тошнота, рвота, отрыжка воздухом,
- склонность к диарее или запорам,
- пальпируемый твердый узел в области печени,
- увеличение объема живота за счет скопления патологической жидкости,
- окрашивание кала в светлый цвет,
- темный цвет мочи,
- анемия,
- носовые или желудочно-кишечные кровотечения.
Диагностика рака печени
При подозрении на злокачественное новообразование печени пациенту назначают ряд лабораторных и инструментальных исследований:
- УЗИ органов брюшной полости;
Альфа-фетопротеин (АФП, alfa-Fetoprotein)
Синонимы: Анализ крови на альфа-фетопротеин.
Alfa fetoprotein AFP.
Краткая характеристика определяемого вещества Альфа-фетопротеин
Альфа-фетопротеин (АФП) относится к гл�…
При подозрении на метастатический рак печени важнейшей задачей является выявление первичного очага. Это может потребовать проведения:
- ирригоскопии;
- колоноскопии;
Колоноскопия
Эндоскопическое исследование толстого кишечника для поиска участков патологии, проведения биопсии и удаления небольших полипов и опухолей.
Гастроскопия
Исследование слизистой оболочки верхнего отдела желудочно-кишечного тракта с возможностью выполнения биопсии или эндоскопического удаления небольших патологич…
УЗИ предстательной железы
Ультразвуковое сканирование простаты, дающее представление о состоянии предстательной железы и наличии патологии.
Внутривенная урография
Внутривенная урография — это рентгенологическое исследование с применением внутривенного контрастного препарата, позволяющее оценить функцию почек и мочевыводя…
К какому врачу обращаться
Лечением новообразований занимаются врачи-онкологи, однако с первыми симптомами пациенты чаще всего обращаются к гастроэнтерологу https://www.invitro.ru/vrachi/gastroehnterolog/ или врачу-терапевту https://www.invitro.ru/vrachi/terapevt/.
Лечение рака печени
При первичном операбельном раке показано комбинированное лечение, включающее резекцию печени и курс химиотерапии.
Операбельной считается опухоль диаметром не более 3 см без прорастания в кровеносные сосуды, отсутствие цирроза печени.
Послеоперационная летальность составляет до 10%, ее главной причиной становится развившаяся печеночная недостаточность. Для профилактики данного осложнения выполняют предоперационную портоэмболизацию (деваскуляризацию новообразования).
Хирургическое лечение метастатического рака печени возможно только при наличии возможности удалить основную опухоль, обнаружении метастазов в одной из долей печени и отсутствии других внепеченочных очагов.
Химиотерапию цитостатическими препаратами применяют при неоперабельном раке печени. В этом случае наилучший эффект достигается при введении цитостатиков непосредственно в печеночную артерию. Лучевую терапию при злокачественном новообразовании в печени используют нечасто ввиду ее малой эффективности.
Последние годы стали активно внедряться в практику альтернативные методы лечения рака печени:
- Протонная терапия, во время которой используют протоны для облучения патологической ткани.
- Абляция – введение в опухоль этанола и воздействие на патологический очаг микроволновым излучением. Абляция может быть эффективна, если опухоль менее 3 см в диаметре.
Осложнения
Рак печени опасен возникновением следующих осложнений:
- кровотечений из опухоли;
- нагноением опухолевого очага;
- нарушением оттока желчи в связи со сдавлением желчных путей;
- нарушением кровообращения в связи со сдавлением органов брюшной полости опухолью большого размера;
- асцитом.
Профилактика рака печени
Снизить риск развития рака печени можно, соблюдая следующие врачебные рекомендации:
- не злоупотреблять алкоголем;
- контролировать вес;
- соблюдать технику безопасности при работе с токсичными веществами;
- не принимать наркотические средства;
- наносить татуировки только в лицензированных салонах;
- вовремя проводить вакцинацию против гепатита В;
- проходить ежегодный профилактический осмотр у врача.
Источники:
- Клинические рекомендации «Рак печени (гепатоцеллюлярный)». Разраб.: Ассоциация онкологов России. – 2021. – 57 с.
- Затевахин И.И. Абдоминальная хирургия / под ред. И.И. Затевахина, А.И. Кириенко, В.А. Кубышкина // – М.: ГЭОТАР-Медиа, 2017. – 912 с.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
13058
01 Марта
-
13055
23 Февраля
-
4415
21 Февраля
Похожие статьи
Холера
Холера: причины появления, симптомы, диагностика и способы лечения.
Рак печени
Также:
гепатоцеллюлярный рак, гепатоцеллюлярная карцинома, печеночно-клеточный рак
Версия: Клинические рекомендации РФ 2022 (Россия)
Категории МКБ:
Печеночноклеточный рак (C22.0)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Междисциплинарное общество специалистов по опухолям печени
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Общероссийская общественная организация содействия развитию лучевой диагностики и терапии «Российское общество рентгенологов и радиологов»
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 июня 2022 года – с 1 января 2024 года.
Клинические рекомендации
Рак печени (гепатоцеллюлярный)
Год утверждения (частота пересмотра): 2022
Возрастная категория: Взрослые
Пересмотр не позднее: 2024
Дата размещения: 22.07.2022
ID: 1
Определение заболевания или состояния(группы заболеваний или состояний)
Гепатоцеллюлярный рак (ГЦР) (гепатоцеллюлярная карцинома, печеночно-клеточный рак) –наиболее частая (около 85 % случаев) злокачественная опухоль печени, исходящая из гепатоцитов. Реже встречается холангиоцеллюлярный рак (холангиокарцинома) –злокачественная опухоль, исходящая из эпителия внутрипеченочных желчных протоков, а также смешанные гепатохолангиокарциномы, фиброламеллярная карцинома, которая формально классифицируется как вариант печеночно-клеточного рака.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Первичный рак печени (С 22)
С22 Злокачественное новообразование печени и внутрипеченочных желчных протоков
С22.0 Печеночно-клеточный рак. Гепатоцеллюлярный рак.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)1.5.1 Международная гистологическая классификация (2010)
Эпителиальные гепатоцеллюлярные доброкачественные опухоли:
Гепатоцеллюлярная аденома 8170/0
Фокальная нодулярная гиперплазия 8170/0
Предраковые или ассоциированные со злокачественными новообразования:
Крупноклеточные изменения
Мелкоклеточные изменения
Диспластические узлы
низкой степени злокачественности
высокой степени злокачественности
Злокачественные гепатоцеллюлярные опухоли:
Гепатоцеллюлярный рак 8170/3
Гепатоцеллюлярный рак (фиброламеллярный вариант) 8171/3
Гепатобластома, эпителиальные варианты 8171/3
Недифференцированный рак 8020/3
Мезенхимальные опухоли:
Доброкачественные
Ангиомиолипома (PECома) 8860/0
Гемангиома
Кавернозная гемангиома 9131/0
Инфантильная гемангиома 9131/0
Воспалительная псевдоопухоль
Лимфангиома 9170/0
Мезенхимальнаягамартома
Солитарная фиброзная опухоль 8815/0
Злокачественные опухоли
Ангиосаркома9120/3
Эмбриональная саркома 8991/3
Эпителиоидная гемангиоэндотелиома 9133/3
Саркома Капоши 9140/3
Лейомиосаркома 8890/3
Рабдомиосаркома 8900/3
Синовиальная саркома 9040/3
Смешанные злокачественные опухоли неясного происхождения:
Смешанный гепатохолангиоцеллюлярный рак 8180/3
Карциносаркома 8980/3
Герминогенные опухоли
Лимфомы
Метастатические опухоли
1.5.2. Стадирование
Стадирование по системе TNM (8-й редакции, 2017 г.) [5].
T – первичная опухоль.
TX – оценить первичную опухоль невозможно.
T0 – признаков первичной опухоли нет
Т1 – одиночная опухоль.
T1a – одиночная опухоль ≤2 см в наибольшем измерении с сосудистой инвазией или без нее.
T1b – одиночная опухоль >2 см в наибольшем измерении без сосудистой инвазии.
T2 – одиночная опухоль размером >2 см с сосудистой инвазией или множественные опухоли ≤5 см в наибольшем измерении.
T3 – множественные опухоли, в том числе хотя бы одна опухоль >5 см в наибольшем измерении.
T4 – одиночная опухоль или множественные опухоли любого размера с прорастанием в крупную ветвь воротной вены либо в печеночную вену, или с прорастанием в соседние органы, включая диафрагму(кроме желчного пузыря), или с прорастанием в висцеральную брюшину.
N – вовлечение регионарных лимфатических узлов. Регионарными лимфатическими узлами являются лимфатические узлы ворот печени (расположенные в печеночно-двенадцатиперстной связке).
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – имеется поражение регионарных лимфатических узлов метастазами.
M – отдаленные метастазы.
МХ – недостаточно данных для определения отдаленных метастазов.
M0 – отдаленных метастазов нет.
M1 – имеются отдаленные метастазы.
pTNM – патогистологическая классификация.
Требования к определению категорий рТ, pN, рМ соответствуют требованиям к определению категорий Т, N, М (таблица 1).
G – гистопатологическая дифференцировка.
Gx – степень дифференцировки не может быть установлена.
G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки.
G3 – низкая степень дифференцировки.
G4 – недифференцированные опухоли.
Таблица 1. Группировка гепатоцеллюлярных карцином по стадиям (UICC)
Стадирование по Барселонской системе
Барселонская система стадирования рака печени (BarcelonaClinicLiverCancer (BCLC) classification) – наиболее часто используемая классификация ГЦР, которая учитывает распространенность опухолевого процесса, функциональное состояние печени, объективное состояние пациента и предполагаемую эффективность лечения (см. рисунок А1в приложении А3) [6].
Выделяют 5 стадий: от 0 – очень ранней и А – ранней до D – терминальной. Стадии по BCLC, равно как прогноз заболевания и тактика лечения, могут меняться при прогрессировании заболевания либо эффективном лечении. Следует отметить прогностическую значимость классификации для пациентов с ГЦР безотносительно наличия цирроза печени. Важная особенность этой классификации в том, что в ней предложен алгоритм лечения в зависимости от стадии заболевания. В последней редакции этой классификации (2018 г.) вместо классов цирроза A–Bпо Child – Pugh используется формулировка «сохранная функция печени», что соответствует оценке <8 баллов по классификации Child – Pugh[7].
Очень ранняя стадия (BCLC 0) – солитарная опухоль печени <2 см в диаметре.
Ранняя стадия (BCLCA) – солитарная опухоль печени любого размера или не более 3 узлов размером до 3 см, не распространяющиеся на магистральные сосуды печени, соседние анатомические структуры, у пациента без опухолеспецифических жалоб в удовлетворительном объективном состоянии (ECOG0) при сохранной функции печени.
Промежуточная стадия (BCLC В) –случаи изолированного бессимптомного множественного опухолевого поражения печени без макро сосудистой инвазии у пациентов в удовлетворительном состоянии (ECOG0) при сохранной функции печени.
Распространенная стадия (BCLC С) –симптомная опухоль, ухудшающая объективное состояние пациента (ECOG0–2), любого размера с инвазией или без инвазии в магистральные печеночные сосуды и/или с внепеченочным распространением при сохранной функции печени.
Терминальная стадия (BCLCD) – случаи заболевания со значимым ухудшением объективного состояния (опухоль/цирроз), декомпенсацией цирроза (класс C по Child – Pugh). Но при выявлении малой опухоли (солитарной размером <5 см или не более 3 узлов размером <3 см) при соответствии так называемым «миланским» критериям возможна ортотопическая трансплантация печени.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Гепатоцеллюлярный рак развивается чаще всего на фоне цирроза печени (около 80 % случаев) или хронического воспаления любой этиологии: вирусных гепатитов В и С, алкогольного и неалкогольного стеатогепатита, первичного склерозирующего и аутоиммунного гепатита, вследствие экзогенных токсических повреждений печени (под действием афлотоксинов, винилхлорида, на фоне применения стероидных гормонов), а также при наследственных заболеваниях (дефиците альфа-1-антитрипсина, тирозинемии и гемохроматозе) и нарушениях состояния иммунной системы, при которых происходит повреждение печени с исходом в хронический гепатит и цирроз. Вирусные гепатиты В и С – самый частый фактор риска, являющийся причиной ГЦР в 50% и 15% случаев соответственно. С внедрением вакцинации против гепатита В и эффективной противовирусной терапии гепатита С роль вирусных гепатитов постепенно снижается. В развитых странах повышается роль неалкогольной жировой болезни печени[1–3]. Менее 10%случаев ГЦР развивается в здоровой ткани печени.
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В Российской Федерации ГЦР встречается достаточно редко. В2019г. в России зарегистрировано 9 324 новых случая ГЦР и рака внутрипеченочных желчных протоков, умерло по этой причине 10 430 пациентов[4]. В РФ по данным статистических отчетов за период с 2009 по 2019гг. отмечается самый высокий из онкологических заболеваний – более чем 48% – прирост «грубого» показателя заболеваемости (для мужчин +57%) при более 29% прироста стандартизованного показателя заболеваемости ГЦР. Показатели динамики смертности от ГЦР указывают на 21,6% прирост абсолютного числа случаев смерти от рака печени и 5,65% прироста стандартизованного показателя смертности (на 100 тыс. населения). Обращает внимание различие в смертности: она превышает заболеваемость первичным раком печени на ~ 1100 случаев в 2019 году.
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина, как правило, имеет скрытый характер, не имеет специфических симптомов. Чаще всего ГЦР обнаруживается на более поздних стадиях. Спектр проявлений может определяться фоновым заболеванием печени, циррозом и осложнениями опухолевого процесса.
В начале развития заболевания симптомы мало выражены. Поэтому пациенты не придают им особого значения, не обращаясь за медицинской помощью. Со временем симптомы нарастают и становятся более ощутимыми: появление болей чаще всего связано с прорастанием анатомических структур, включая магистральные сосуды, с образованием опухолевых тромбов, а также с метастатическим поражением органов. Основными жалобами далеко зашедшего процесса являются выраженная общая слабость, вялость, быстрая утомляемость, увеличение размеров живота, дискомфорт и боли в правом подреберье, а также повышение температуры тела, появление отёков нижних конечностей. Паранеопластические синдромы встречаются у небольшой части пациентов и проявляются гипогликемией, эритроцитозом, гиперкальциемией.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния – на основании патогномоничных клинико-рентгенологических данных, результатов патологоанатомического исследования биопсийного или операционного материала, лабораторных исследований, направленных на оценку функции печени и инструментального обследования распространенности опухолевого процесса и выраженности сопутствующих заболеваний.
Чаще всего ГЦР развивается на фоне хронического заболевания печени – цирроза печени, вирусного гепатита, стеатогепатита – которое, как и опухолевый процесс, может проявляться специфическими симптомами, нуждаться в специфической терапии, конкурентно влиять на качество жизни и ухудшать выживаемость. В рамках мультидисциплинарной оценки состояния пациента необходимо оценить функциональные резервы печени, выраженность фоновой патологии печени и распространенность опухолевого процесса.
- Рекомендуется при сборе жалоб и анамнеза активное выявление факторов риска развития хронических заболеваний печени (злоупотребление алкоголем, прием наркотиков, анаболических стероидов, перенесенный вирусный гепатит(ы) и признаки метаболического синдрома, включающего ожирение, сахарный диабет, артериальную гипертензию) с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3,6,8].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
2.2 Физикальное обследование
- Рекомендуется пациентам при подозрении на ГЦР или с установленным диагнозом ГЦР выполнить стандартный врачебный осмотр, включая оценку нутритивного статуса, наличие симптомов хронического заболевания печени (асцита, желтухи, энцефалопатии, кровотечений, спленомегалии)[8,9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Следует стремиться разграничить вызванные опухолью симптомы и длительно существующие симптомы цирроза печени и его осложнений.
2.3 Лабораторные диагностические исследования
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР с целью определения этиологии и выраженности сопутствующего заболевания печени, а также выявления показаний к назначению сопутствующей противовирусной терапии определить антитела к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) и антитела классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C (Hepatitis C virus) в крови; при положительном результате теста на HBsAg необходимо определение антигена (HbeAg) вируса гепатита B (Hepatitis B virus) в крови, и определение ДНК HBV(количественный тест) и РНК-ВГД (качественный тест); при положительном результате теста наanti-HCV–исследование на РНК-ВГС (количественный тест и генотип вируса).[8–11].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения для объективной оценки степени выраженности изменений в гемограмме и выявления возможного нарушения функции печени и почек выполнить общий (клинический) анализ крови развернутый(с подсчетом количества тромбоцитов) и анализ крови биохимический общетерапевтический – с измерением уровня сывороточного альбумина, общего и прямого билирубина, мочевины и креатинина, АЛТ, АСТ, ГГТ, ЩФ – анализ крови, определение протромбинового времени и международного нормализованного отношения, общий (клинический) анализ мочи [3,9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить определение концентрации в плазме опухолеспецифического маркера альфа-фетопротеина (АФП)для оценки агрессивности заболевания и прогноза его течения, контроля эффективности лечения.[8]
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: Результат анализа на АФП считается положительным, если уровень АФП >100 нг/мл [12] или если он увеличивался на 7 нг/мл в месяц по результатам 3 последовательных измерений [13]. Следует учитывать, что уровень АФП также может повышаться при хронических заболеваниях печени, например, при острых и хронических вирусных гепатитах, при других онкологических заболеваниях (гепатоидном раке желудка, герминогенных опухолях и т.д.), при беременности.
Оценка функционального статуса печени
- Рекомендуется пациентам с установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, оценить функциональный статус печени по критериям Child – Pugh (Приложение Г1) с целью оценки степени нарушения функций печени для определения переносимости планируемого лечения или токсичности проводимого противоопухолевого лечения и прогноза течения цирроза печени[8,9,14,15].
Уровень убедительности рекомендаций –А (уровень достоверности доказательств –1).
Комментарий: цирроз печени, частое сопутствующее заболевание печени, определяет переносимость основных методов лечения, вплоть до невозможности проведения лечения, негативно и конкурентно с ГЦР влияет на общую выживаемость. Совместно с гастроэнтерологом или терапевтом необходимо своевременно профилактировать, выявлять и лечить осложнения цирроза печени.
2.4 Инструментальные диагностические исследования
- При подозрении или выявлении малого объемного образования в печени пациента, относящегося к группе высокого риска печеночно-клеточного рака (цирроз печени любой этиологии Child–Pughкласс А и В, цирроз печени Child–Pugh класс С, находящиеся в листе ожидания трансплантации печени, больные хроническим вирусным гепатитом В с промежуточным или высоким риском развития ГЦР (в соответствиями с классом PAGE-B, соответственно 10-17 и ≥18 баллов), пациенты с фиброзом печени F3 степени в зависимости от наличия других индивидуальных факторов риска) независимо от уровня АФП, при положительном результате анализа на АФП пациентам с подозрением на ГЦР рекомендуется мультифазная компьютерная томография (КТ) печени и брюшной полости с контрастированием и / или магнитно-резонансная томография (МРТ) печени и брюшной полости с контрастированием независимо от результатов ультразвукового исследования (УЗИ) печени для уточнения диагноза и степени распространенности опухолевого процесса[8,9,14,16–18] .
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется использование МРТ с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для выявления раннего ГЦР (до 2,0 см) у пациентов с сопутствующим циррозом печени любой этиологии [19–21].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарий: диагностика раннего ГЦР и своевременное начатое лечение имеют решающее значение для улучшения прогноза и качества жизни пациентов, повышая тем самым долгосрочную выживаемость. Особенности накопления и вымывания контрастного препарата из опухолевых тканей в артериальную, венозную и отсроченные фазы при использовании экстрацеллюлярных магнитно-резонансных контрастных препаратов в ряде случаев не позволяют выявлять и корректно дифференцировать новообразования, в том числе малых размеров. Гиперинтенсивность печеночной паренхимы в гепатоспецифическую фазу позволяет отчетливо визуализировать гипоинтенсивные очаги малых размеров и с учетом особенностей их контрастирования в предыдущие фазы исследования, дифференцировать ранний ГЦР от прочих новообразований печени, в т.ч. и от регенераторных и диспластических узлов, что в ряде случаев может повлиять на изменение стадии опухолевого процесса.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом выполнять МРТ печени с гепатоспецифическим контрастным препаратом гадоксетовой кислоты для корректного стадирования опухолевого процесса перед началом лечения[18–23].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – I).
Комментарий: в ряде систематических обзоров рандомизированных клинических исследований с применением мета-анализа доказана высокая информативность МРТ с применением гепатоспецифического контрастного препарата гадоксетовой кислоты по сравнению с КТ и МРТ с использованием экстрацеллюлярных контрастных препаратов в выявлении и дифференциальной диагностике ГЦР.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, в том числе, печени, включая бассейн воротной вены, для оценки степени распространенности ГЦР, выявления осложнений ГЦР и/или цирроза и их контроля[14].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств – 5).
Комментарий: УЗИ применяется на этапе скрининга в группе риска развития ГЦР, при осуществлении чрескожной биопсии, интервенционных вмешательств и иногда мониторинга эффективности лечения. Обязательна оценка проходимости бассейна воротной вены. Чувствительность УЗИ невысока для обнаружения узлов малого размера. УЗИ с контрастным усилением обладает преимуществом в выявлении гиперваскуляризованных узлов, что может использоваться при дифференциальной диагностике очаговых образований печени.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить эзофагогастродуодено-скопию для выявления одного из осложнения портальной гипертензии – варикозного расширения вен пищевода и желудка, оценки степени его выраженности и показаний к лечебно-профилактическим мероприятиям[9].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с установленным диагнозом ГЦР, планируемым к проведению или получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить четырех фазную компьютерную томографию (КТ) (нативная, артериальная, венозная и отсроченная венозная фазы) и/или динамическую магнитно-резонансную томографию (МРТ) печени с внутривенным контрастированием для оценки распространенности опухолевого процесса и выявления ее изменений: определяют количество и размеры опухолевых узлов внутри печени, наличие сосудистой инвазии и тромбоза, в не печеночного распространения, контроля эффективности лечения[8,9,14,16–18].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – I).
Комментарий: диагноз печеночно-клеточного рака может считаться обоснованным без морфологической верификации, если в цирротическии змененной печени по данным одного из методов (мультифазной КТ или МРТ) выявляют типичные для ГЦР признаки, а именно: диффузное (не кольцевидное) контрастное усиление опухоли размером >1 см в поздней артериальной фазе и «вымывание» контрастного вещества в венозной фазе; в опухолевых узлах размером>2 см выявление псевдокапсулы в отсроченной (равновесной) фазе; рост опухоли менее чем за 6 мес. на 50 % или увеличение размеров опухоли не менее чем на 5 мм за 6 мес. (Американская ассоциация по изучению заболеваний печени (AmericanAssociationfortheStudyofLiverDisease, AASLD)/LiverImagingReportingandDataSystem (LI-RADS), Европейская ассоциация по изучению печени (TheEuropeanAssociationfortheStudyoftheLiver, EASL) 2018). В дифференциальной диагностике новообразований печени может использоваться рентгенологическая классификация LI-RADS[9,24]. В рандомизированных исследованиях доказано, что категория LI-RADS 4–5 имеет высокую специфичность (95–100 %) для пациентов группы высокого риска ГЦР с узлом размером >10 мм [25,26].
- Рекомендуется пациентам с ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после или в процессе лечения, выполнить МРТ брюшной полости с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты**) для контроля эффективности лечения[18–23,27].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1 ).
Комментарий: применение МРТ с гадоксетовой кислотой демонстрирует наиболее высокие значения чувствительности, специфичности и точности в выявлении и дифференциальной диагностике ГЦР по сравнению с КТ с внутривенным контрастированием и МРТ с внутривенным контрастированием с использованием экстрацеллюлярных контрастных препаратов, позволяя тем самым выбрать оптимальную тактику лечения пациентов, а также повлиять на снижение частоты рецидивов и количество смертельных исходов.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить КТ органов грудной клетки, брюшной полости и малого таза для исключения в не печеночных проявлений опухоли, контроля эффективности лечения[14,28].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить остеосцинтиграфию при наличии болевого синдрома для выявления метастатического поражения костей скелета, контроля эффективности лечения[14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Для морфологического подтверждения диагноза рекомендуется пациентам с подозрением на ГЦР выполнить биопсию под контролем УЗИ/КТ для уточнения диагноза[8,9] в следующих случаях:
1. если по данным КТ или МРТ заподозрено патологическое образование в не цирротической печени;
2. если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени
Уровень убедительности рекомендаций – C(уровень достоверности доказательств – 5).
Комментарии: пункционная биопсия опухоли печени с получением столбика ткани (cor-биопсия) предпочтительнее аспирационной тонкоигольной биопсии. Биопсия рекомендуется при малом размере опухоли (<2 см) и типичном для ГЦР кровотоке, нетипичной васкуляризации узла размером >2 см, расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП, выявлении любого опухолевого образования внецирротической печени [29]. Отрицательный результат биопсии не исключает диагноза злокачественной опухоли печени и предполагает дальнейшее наблюдение с возможностью повторных биопсий. Биопсия локального образования в цирротической печени не нужна, если: 1) не планируется какого-либо лечения в связи с декомпенсированным циррозом и/или другой тяжелой патологией; 2) планируется резекция печени; 3) при циррозе мультифазная КТи МРТ c контрастированием описывают признаки, специфичные для ГЦР (неравномерное контрастирование узла в артериальной фазе, затем «вымывание» в венозной) [30,31].
Для уточняющей диагностики раннего и высоко дифференцированного ГЦР Международная консенсусная группа по опухолям печени рекомендует панель из 3 иммуногистохимических маркеров – HSP70 (HSPA7), глипикана 3 (GPC3) и глутаминсинтетазы (GS), а для выявления прогностически неблагоприятных случаев – цитокератин 19 (СК 19). В сложных для диагностики случаях целесообразно отправить гистопрепараты для исследования в специализированные центры. При выявлении смешанного гепатохолангиоцеллюлярного рака целесообразно определение микросателлитного статуса опухоли.
- Рекомендуется выполнить позитронно-эмиссионную томографию с фтордезоксиглюкозой[18F], совмещенную с КТ, у пациентов с установленным диагнозом ГЦР, являющихся кандидатами на оперативное лечение, если имеется подозрение на отдаленные метастазы по данным КТ или МРТ,и их подтверждение приведет к отказу от операции[14,32].
Уровень убедительности рекомендаций–C(уровень достоверности доказательств – 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР при подозрении на метастазирование в головной мозг выполнить МРТ или КТ головного мозга с внутривенным контрастированием[18].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется установить стадию ГЦР по классификацииTNM (8-й редакции), AJCCиBCLCдля повышения точности диагностики [8,9,33–35].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
2.5 Иные диагностические исследования
Диагностические ангиографические методики являются неотъемлемой частью эндоваскулярного лечебного вмешательства у пациентов с ГЦР, позволяющие оценить состояние чревного ствола и его ветвей, уточнить анатомический вариант кровоснабжения печени, определить уровень васкуляризации опухолевых узлов, уточнить наличие артерио-портальных или артериовенозных шунтов. Полученные диагностические данные имеют важное значение в определении, как возможности выполнения, так и планирования последующей трансартериальнойхимиоэмболизации (ТАХЭ) печени.
При выявлении у пациентов с ГЦР выраженного артериовенозного фистулирования или наличии артериопортального шунта с контрастированием ствола воротной вены или её долевых ветвей ТАХЭ не показана. Пациентам с наличием артериовенозного фистулирования на Iэтапе эндоваскулярного лечения (перед ТАХЭ) показана эмболизация печеночных артерий с целью окклюзии артериовенозных фистул[36,37].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Разработка плана лечения по результатам диагностики должна быть отнесена к компетенции специализированной мультидисциплинарной группы по ГЦР, функционирующей на базе специализированных центров. При выборе стратегии лечения пациентов с ГЦР приоритет должен отдаваться противоопухолевому специализированному лечению с использованием методов, позволяющих увеличить выживаемость.
Радикальное лечение раннего локализованного ГЦР включает резекцию печени, ортотопическую трансплантацию печени и применение местно-деструктивных аблативных методов (радиочастотную, микроволновую аблацию и др.) [8,9,14].
Паллиативное лечение ГЦР направлено на достижение контроля над проявлениями болезни, призвано увеличивать продолжительность и улучшать качество жизни пациентов. Паллиативное специализированное лечение включает интервенционно-радиологическое лечение (различные виды эмболизации) и системную химиотерапию [8,9,14].
План лечения вырабатывается на основании результатов объективного обследования мультидисциплинарной командой специалистов (включающей врача-радиолога, врача-хирурга (гепатолога), врача по рентгеноэндоваскулярным диагностике и лечению, врача-онколога, врача-гастроэнтеролога, имеющих опыт работы с пациентами с ГЦР на базе специализированных центров.
Поскольку ГЦР в большинстве случаев выявляется в цирротически измененной печени, прогноз жизни для этих пациентов определяется не только степенью распространения опухоли, но и степенью дисфункции печени и объективным состоянием пациентов.
3.1 Хирургическое лечение
- Рекомендуется резекция печени как метод выбора при лечении больных локализованным ГЦР без лабораторных и инструментальных признаков цирроза. Выполнение оперативного вмешательства должно рассматриваться в первоочередном порядке при наличии у больных ГЦР соответствующего стадии BCLC 0/A, а также при BCLCB в случаях ограниченного поражения печени и у отобранной группы BCLC C (при наличии опухолевого тромбоза сегментарных ветвей воротной вены; солитарного метастатического поражения лимфатического узла гепатодуоденальной связки)[6,8,42,9,14,34,35,38–41].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 3).
Комментарии: основным условием, которое должно выполняться при планировании резекции печени является сохранение в предполагаемой остающейся части паренхимы печени адекватного кровоснабжения, крово- и желчеоттока. Объем предполагаемой остающейся паренхимы печени должен составлять при отсутствии лабораторных и инструментальных признаков цирроза не менее 25% (отнепораженной паренхимы), при их наличии не менее 40%. В случае недостаточного объема паренхимы возможна рентген-интервенционная эмболизация ветви воротной вены в предполагаемой для удаления до лепечени.
Приналичииубольноголабораторныхиинструментальныхпризнаковцирроза, следует учитывать степень нарушения печено-клеточной функции (резекция печени целесообразна у больных соответствующих классу А по шкале Child – Pugh) и выраженность портальной гипертензии (клинически значимые проявления: наличие варикозно-расширенных вен пищевода, тромбоцитопения менее 100×109/л).
В условиях специализированных центров (при наличии подготовленного персонала и оборудования) возможно выполнение резекций печени мини-инвазивным доступом под видеоэдоскопическим контролем. Предпочтительным для планирования применения данного доступа являются подкапсульно расположенные образования, а также узлы, располагающиеся в латеральных секторах печени.
Следует учитывать, что большой размер опухоли и/или множественное внутриорганное поражение, наличие инвазии магистральных сосудов, метастатическое поражение регионарных лимфатических узлов не являются абсолютным противопоказанием к резекции печени, однако результаты хирургического лечения в этих случаях предсказуемо хуже.
- Рекомендуется ортотопическая трансплантация печени при раннем ГЦР(BCLC 0 – А) в случаях, не подходящих для резекции, при соответствии принятым критериям (показаниям) к трансплантации при ГЦР[8,9,14,43–45].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – 2).
Комментарии: чаще используются так называемые «миланские» критерии: размер единственной опухоли ≤5 см или наличие в печени не более 3 очагов с диаметром наибольшего узла ≤3 см и отсутствием инвазии в сосуды [6,8,9]. Показания и противопоказания к выполнению трансплантации печени определяются врачом-трансплантологом. Трансплантация печени у пациентов с нерезектабельной формой ГЦР (например, фиброламеллярная ГЦК) в отсутствие фонового заболевания печени (цирроз, гепатит) является наиболее радикальным методом. К таким пациентам не должны применяться «миланские» критерии. Важно: отсутствие внепеченочного распространения (строго), отсутствие макрососудистой инвазии (желательно) [46–49].
В целях объективного стадирования и селекции пациентов на трансплантацию печени необходимо исключить внепеченочное распространение. КТ органов грудной клетки является обязательным методом исследования для пациентов с ГЦР, планирующимся на трансплантацию печени [46].
- Bridge-терапия (терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации) рекомендуется пациентам, ожидающим трансплантации печени, для увеличения вероятности выполнения трансплантации печени, улучшения селекции и исключения агрессивных случаев ГЦР [6,9,50,51].
- Терапия «понижения стадии» (down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений) рекомендуется пациентам с локализованным ГЦР превышающим стандартные критерии для трансплантации печени и при условии достижения объективного противоопухолевого эффекта локо-регионарной и/или системной терапии в виде уменьшения внутрипеченочной распространенности до принятых критериев трансплантации печени [45].
Уровень убедительности рекомендаций – A(уровень достоверности доказательств – 2).
Комментарии:Bridge-терапия и терапия «понижения стадии» включает аблацию, трансартериальную химиоэмболизацию, резекцию печени, лекарственную терапию или сочетание методов. Трансплантация печени после уменьшения внутрипеченочной распространенности опухоли в результате противоопухолевой терапии до принятых критериев трансплантации печени ассоциируется со значимым увеличением общей выживаемости по сравнению с использованием методов консервативного лечения.
- Рекомендуется пациентам с ГЦР и сопутствующем хроническим гепатитом В (HBsAg+, ДНК-ВГВ>2000 МЕ/мл) противовирусная терапия аналогами нуклеозидов (энтекавир** или тенофовирадифумарат или тенофовираалафенамид**); после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[52,53,125].
Уровень убедительности рекомендаций–В (уровень достоверности доказательств – 2)
- Рекомендуется пациентам с ГЦР и сопутствующим хроническим гепатитом С (РНК-ВГС+)противовирусная терапия противовирусными препаратами прямого действия при компенсированном поражении печени) https://cr.minzdrav.gov.ru/recomend/516_2, после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость[54–56,126]
Уровень убедительности рекомендаций–С(уровень достоверности доказательств – 4
3.2 Методы локальной деструкции опухоли
- Рекомендуется применять методы локальной деструкции (энергетической аблации) опухоли как стандарт терапии у пациентов с ГЦР стадии BCLC 0 (солитарная опухоль до 2 см в диаметре) и стадии BCLC A (три опухоли до 3 см в диаметре) при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени)[57].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 1).
- Рекомендуется применять метод чрескожной деструкции ( химической аблацииэтанолом) опухоли у пациентов с ГЦР на фоне цирроза стадии BCLC 0 (солитарная опухоль до 2 см в диаметре) как метод терапии при невозможности выполнения хирургического лечения (резекции печени или трансплантации печени) и невозможности проведения энергической аблации [58].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 1).
- Рекомендуется применять метод локальной деструкции ( химической аблацииэтанолом ) как дополнение к энергетической аблации при лечении опухолей диаметром более 3 см и опухолей, прилежащих к крупным сосудам (у неоперабельных больных)[59].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств – 1).
- Рекомендуется рассматривать возможность применения методов локальной деструкции (энергетической и химической аблации) в сочетании с другими видами лечения, в том числе c внутриартериальной терапией и хирургическим лечением[60–62, 127].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств 4).
- Рекомендуется применение методов локальной деструкции в виде энергетической и химической аблации (если это технически возможно), в случаях локального прогрессирования и локального рецидива заболевания после ранее выполненной резекции печени или аблации опухоли при невозможности выполнения хирургического лечения [63].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств 2).
Комментарии: Основным критерием при определении показаний является техническая возможность выполнения вмешательства с минимальным риском развития осложнений. Деструкции подлежат не более 5 узлов диаметром ≤3 см. Возможна деструкция узлов большего диаметра, но частота локальных рецидивов существенно увеличивается при опухолях >3 см в наибольшем измерении. В ряде случаев целесообразно выполнять аблацию после проведения предварительной трансартериальной (химио-)эмболизации опухоли печени или осуществлять энергетическую аблацию в комбинации с чрескожным внутриопухолевым введением этилового спирта (химическая аблация). Локальная деструкция противопоказана при множественном поражении печени, декомпенсированном циррозе (класса C по Child – Pugh), внепеченочных проявлениях заболевания, при наличии портального шунта, несмещаемом прилежании опухолевого узла к рядом расположенным полым органам, а также к вне(внутри-)печеночно расположенным трубчатым структурам
[64–66]. В качестве методов локальной деструкции (энергетической аблации) рекомендуется использовать радиочастотную аблацию, микроволновую аблацию и криоаблацию. В качестве метода локальной деструкции (химической аблации) рекомендуется использовать чрескожное введение этилового спирта
[67–70].
- Рекомендуется дистанционная лучевая терапия стереотаксическим методом единичных (1–3) опухолевых узлов при ГЦР стадии BCLC 0–A, в случае наличия противопоказаний к хирургическому лечению и противопоказаний к использованию методов локальной деструкции в виде энергетической или химической аблации[71,72].
Уровень убедительности рекомендаций –B(уровень достоверности доказательств – 2).
- Не рекомендуется пациентам с ГЦР послерадикального (R0) хирургического лечения адъювантная терапия мультикиназными ингибиторами в связи с отсутствием преимуществ перед другими вмешательствами в улучшении выживаемости пациентов [73].
Уровень убедительности рекомендаций –A(уровень достоверности доказательств – 2).
3.3 Трансартериальная химиоэмболизация
- Рекомендуется трансартериальная химиоэмболизация (ТАХЭ) опухолевых сосудов в качестве самостоятельного паллиативного лечения пациентам c ГЦР при нерезектабельном/неоперабельном процессе без признаков инвазии/тромбоза магистральных печеночных сосудов и без внепеченочных проявлений заболевания, в комбинации с другими методами локального и системного воздействия, а также в период ожидания трансплантации печени для улучшения контроля роста опухоли [6,8,9,74–79].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств 2).
Комментарии: согласно классификации BCLC, ТАХЭ выполняется при лечении пациентов с промежуточной (BCLCB) и ранней (BCLC А) стадиями при противопоказаниях к хирургическому лечению. Проведение ТАХЭ опухоли в печени при наличии внепеченочных проявлений опухолевого процесса не улучшает отдаленных результатов лечения. Показания и противопоказания к проведению ТАХЭ определяются врачом по рентгеноэндоваскулярным диагностике и лечению в составе мультидисциплинарного консилиума.
- Не рекомендуется ТАХЭ пациентам с ГЦР при поражении более 75% объема печени, декомпенсированном циррозе (класса C по Child – Pugh), тромбозе магистральных ветвей или ствола воротной вены, внепеченочном распространении заболевания, не купируемом асците, почечной недостаточности (уровне креатинина≥2 мг/длили клиренсе креатинина<30 мл/мин), тяжелых нарушениях свертывающей системы крови, желудочно-кишечном кровотечении за последние 3 мес., наличии портального шунта[6,80–83].
Уровень убедительности рекомендаций –А(уровень достоверности доказательств 2)
Комментарии: относительными противопоказаниями к ТАХЭ являются цирроз печени класса B по Child – Pugh (9 баллов), размер опухоли >10 см, наличие некомпенсированных сопутствующих заболеваний: нарушений функций органов сердечно-сосудистой, легочной систем, острых инфекционных заболеваний, желудочно-кишечного кровотечения, произошедшего за последние 3 мес., варикозного расширения вен пищевода/желудка IIIстепени с высоким риском кровотечения, желчной гипертензии [80,81]. Выбор метода (селективная, суперселективная, подолевая) и вида артериальной химиоэмболизации (масляная – раствор противоопухолевого препарата + # Липиодол Ультра-Флюид; комбинированная – раствор противоопухолевого препарата + # Липиодол Ультра-Флюид + микросферы для эмболизации из поливинилацетата и др.; эмболизация микросферами, элиминирующими противоопухолевого препарата (DEB – drug-elutingbeads)) зависит от клинической ситуации, технических условий и плана лечения. Наиболее часто используемые противоопухолевые препараты – доксорубицин** или эпирубицин** в разовой дозе, аналогичной курсовой дозе препарата, используемой при системном лечении.
- Рекомендуется пациентам с ГЦР оценивать эффективность ТАХЭ по данным динамической контрастной КТ/МРТ по критериям mRECIST (Приложение Г5) через 4–8 недель после процедуры [6,84].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
- Рекомендуется системная терапия пациентам с ГЦР при отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ (при отсутствии зоны некроза в эмболизированных опухолевых узлах, появлении новых узлов в зоне воздействия) для улучшения отдаленных результатов лечения пациентов[6,8,14,80].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется повторная ТАХЭ пациентам с ГЦР при изолированном внутрипеченочном поражении в случае сохранения эффекта после ранее выполненной ТАХЭ более 6 месяцев для улучшения выживаемости пациентов[9].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
3.4 Трансартериальная радиоэмболизация
- Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей c применением иттрия-90 (Y90) – трансартериальная радиоэмболизация – рекомендуется пациентам с ГЦР при стадии BCLC A в качестве bridge-терапии, при стадиях BCLC B и C с тромбозом магистральных вен для улучшения результатов лечения и выживаемости пациентов[6,8,9,50,85].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: основные противопоказания к трансартериальной радиоэмболизации – поражение >70 % объема печени, наличие артериовенозного шунта.
- Рекомендуется пациентам с ГЦР в случаях, когда другие варианты локо-регионарного лечения и/или резекции не могут быть проведены для улучшения контроля роста опухоли и выживаемости пациентов[86].
Уровень убедительности рекомендаций –С (уровень достоверности доказательств – 5).
Комментарий: лучевая терапия проводится в виде конформного облучения 3D-CRT, лучевой терапии с модуляцией интенсивности (IMRT) или стереотаксического облучения (SBRT) под контролем визуализации (IGRT). Применение стереотаксической лучевой терапии представляется оптимальным. Рекомендуется использовать трех или пятидневный режим фракционирования дозы излучения до СОД 30-50Гр у пациентов с сохранной функции печени (класс А или В по Child – Pugh). SBRT можно рассматривать как альтернативу методам аблации/эмболизации когда эти методы лечения оказались безуспешными или противопоказаны. При невозможности проведения стереотаксической лучевой терапии возможно проведение лучевой терапии с РОД 1,8 Гр до СОД 45 Гр и далее бустом локально на опухоль до СОД 50-60Гр
3.6 Лекарственное лечение
Значительное расширение арсенала эффективных опций лекарственного лечения распространенного ГЦР за последние годы, особенно во второй-третьей линии лечения, в отсутствие достоверных данных по сравнительной эффективности требует взвешенного подхода, основанного на учете множества индивидуальных параметров пациента и заболевания. Для ГЦР не известно факторов прогноза эффективности иммунотерапии, ингибиторов протеинкинази цитотоксической химиотерапии.
- Системная терапия рекомендуется врачом-онкологом пациентам с ГЦР для улучшения выживаемости и контроля роста опухоли при[87–93]:
– наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (0–1 балл по шкале ECOG (Приложение Г2));
– сохранной функции печени (класс А или В по Child – Pugh, 5–7 баллов);
– невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-) эмболизации опухолевых узлов);
– внутрипеченочном локализованном ГЦР (как терапия ожидания трансплантации);
– внепеченочном метастазировании и/или прогрессировании процесса в печени после применения локальных методов лечения.
Уровень убедительности рекомендаций –A(уровень достоверности доказательств – 1).
Комментарии: для проведения лекарственной терапии необходима морфологическая (цитологическая/гистологическая) верификация опухолевого процесса, но она не требуется, если на фоне установленного диагноза цирроза печени на мультифазной КТ или динамической контрастной МРТ опытным рентгенологом выявляется типичная для ГЦР рентгенологическая картина гиперваскулярной опухоли печени (с «вымыванием» контраста в венозной фазе).
Декомпенсация цирроза печени конкурентно влияет на общую выживаемость. Необходим мониторинг функции печени, проведение активной профилактики осложнений цирроза печени и их лечение под наблюдением гастроэнтеролога. У пациентов с ГЦР на фоне впервые выявленного декомпенсированного цирроза печени следует провести консультацию гастроэнтеролога для подбора и проведения терапии осложнений цирроза; при улучшении функции печени и удовлетворительном состоянии пациента оправдано повторное обсуждение перспектив противоопухолевого лечения на мультидисциплинарном консилиуме. У пациентов с недавно (давностью до 3 мес.) состоявшимся кровотечением, артериальным или венозным тромбозом, клинически выраженной и плохо компенсируемой сердечно-сосудистой патологией лечение ингибиторами протеинкиназ или прямых ингибиторов неоангиогенеза сопряжено с высоким риском осложнений.
При декомпенсированном циррозе (класса В/С по Child – Pugh) цитотоксическое лечение не проводится.
Вероятность реактивации вирусных гепатитов на фоне системной противоопухолевой терапии низкая, хотя в случаях HВs-положительного хронического вирусного гепатита В необходима одновременная противовирусная терапия аналогами нуклеозидов в течение всего противоопухолевого лечения.
3.6.1. Системная терапия ГЦР первой линии
- Рекомендуется в качестве предпочтительной первой линии системной терапии ГЦР комбинация PD-L1-ингибитора атезолизумаба** в дозе 1200 мг и моноклонального анти-VEGFантитела бевацизумаба** в дозе 15 мг/кг внутривенно 1 раз в 21 день для улучшения контроля роста опухоли и выживаемости пациентов[93].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств – 2).
Комментарии: лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Комбинация атезолизумаба** и бевацизумаба** по данным рандомизированного клинического исследования 3 фазы (ImBrave150) продемонстрировала достоверное преимущество перед сорафенибом** по общей выживаемости (медиана ОВ — 19,2 месvs. 13,4 мес) и выживаемости без прогрессирования (медиана 6,9 месvs. 4,3 мес). Относительными противопоказанием к терапии являются аутоиммунные заболевания, активная ко-инфекция вирусами гепатита В и С, состоявшееся кровотечение или высокий риск кровотечения из варикозно-расширенных вен пищевода и желудка.
- В качестве альтернативных опций 1 линии системной терапии ГЦР рекомендуются ингибиторы протеинкиназсорафениб** или ленватиниб** [87–90].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Опухолевый тромбоз ствола воротной вены не является противопоказанием к лечению сорафенибом**. Терапия ГЦР, прогрессирующего после трансплантации печени (на фоне иммуносупрессивной терапии), сопровождается более выраженной токсичностью. Переносимость ленватиниба** в этой группе пациентов изучена недостаточно; рекомендуется начинать с 8 мг/сут, при хорошей переносимости в течение 10–14 дней доза может быть увеличена до 12 мг/сут.
Режим применения ленватиниба** зависит от исходного веса пациента: для больных с массой тела ≥60 кг лечение начинается с дозы 12 мг/сут однократно, для пациентов с массой <60 кг – с разовой суточной дозы 8 мг.
Токсические эффекты, ассоциированные с применением сорафениба** и ленватиниба** (диарея, артериальная гипертония, ладонно-подошвенный синдром), являются биологическим предиктором лучшей выживаемости при условии продолжения терапии, целесообразно предпринять все меры по коррекции токсических эффектов, в первую очередь своевременно снизить суточную дозу препарата.
- У пациентов с начальными признаками декомпенсации цирроза печени или при противопоказаниях к использованию ингибиторов протеинкиназ в качестве альтернативы (Child-PughB, 7 баллов) рекомендуется иммунотерапия ниволумабом** для улучшения контроля роста опухоли и выживаемости пациентов в одном из рекомендованных режимов лечения[94].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
3.6.2. Системная терапия ГЦР второй и третьей линии
Все известные рандомизированные плацебо-контролируемые исследования 2 линии лечения распространенного ГЦР выполнены в популяции больных, получавших в качестве 1 линии сорафениб**. На сегодня нет данных об эффективности других опций после иммунотерапии или ленватиниба**. Поэтому выбор 2 линии терапии определяется ранее использованным вариантом лечения:
А) после иммунотерапии рассматриваются ингибиторы протеинкиназсорафениб** или ленватиниб**, регорафениб** или кабозантиниб** или рамуцирумаб** (при уровне АФП>400 нг/мл), эффективность комбинированной иммунотерапии неизвестна.
В) после ингибиторов протеинкиназ могут использоваться регорафениб**, кабозантиниб**, рамуцирумаб** или иммунотерапия.
- Рекомендуется регорафениб** в качестве 2 линии терапии ГЦР при его прогрессировании на фоне1-й линии препаратами из группы ингибиторов протеинкиназы (мультикиназными ингибиторами) (таблица2) для улучшения контроля роста опухоли и выживаемости пациентов[91].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2).
Комментарии: регорафениб**назначается, если в1-й линии терапии сорафенибом** в дозе ≥400 мг/сут была отмечена его переносимость, при условии удовлетворительного состояния пациента (ECOG 0/1)и компенсированной функции печени (классе A поChild – Pugh) в стандартном режиме – 160 мг/сут однократно в 1–21-й дни, курс 4 нед., а пациентам, имеющим факторы риска развития токсичности (на фоне приема сорафениба** в дозе 400 мг/сут эпизоды декомпенсации цирроза печени, плохо контролируемая сопутствующая патология), – в начальной дозе 120 мг/сут в 1–21-й дни 4-недельного цикла. При начале лечения в сниженной дозе при отсутствии токсичности II и последующих степеней через 10–12 дней от начала курса оправданно увеличение суточной дозы до стандартной рекомендуемой (160 мг/сут).
- Рекомендуется кабозантиниб** 60 мг в день в качестве 2-3 линии терапии ГЦР после прогрессирования на фоне терапии сорафенибом**(таблица 2)[92].
Уровень убедительности рекомендаций – А(уровень достоверности доказательств – 2)
- Рекомендуется в качестве 2 линии моноклональное антитело к VEGFR 2 типа рамуцирумаб** в дозе 8 мг/кг внутривенно каждые 2 недели до прогрессирования или непереносимой токсичности больным в удовлетворительном состоянии (ECOG 0/1) и при компенсированной функции печени (Child – Pugh A)[95].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарии: назначается при прогрессировании ГЦР на терапии сорафенибом** у пациентов с уровнем АФП≥400 нг/мл. Препарат назначается пациентам, удовлетворительно переносившим терапию сорафенибом** (≥400 мг/день)
- Рекомендуется терапия препаратами моноклональных антител — ингибиторами контрольных точек иммунного надзора ниволумабом** или пембролизумабом** в качестве 2-й и 3-й линий терапии прогрессирующего ГЦР, а также у пациентов, не переносящих препараты из группы ингибиторов протеинкиназ (мультикиназные ингибиторы) сорафениб**/ленватиниб**/регорафениб**/кабозантиниб**или имеющих противопоказания к терапии этими препаратами (таблица 2)для улучшения контроля роста опухоли и выживаемости пациентов[14,94,96].
Для пембролизумаба: Уровень убедительности рекомендаций – В (уровень достоверности доказательств 2)
Для ниволумаба: Уровень убедительности рекомендаций – C (уровень достоверности доказательств 4)
Комментарии: пациентам назначается ниволумаб** в одном из дозовых режимов (выбор режима не влияет на клиническую эффективность) или пембролизумаб** до клинически значимого прогрессирования опухоли. Оправдано применение ниволумаба** у пациентов с классом В цирроза печени по Child – Pugh (7–9 баллов). Нет данных о негативном влиянии иммунотерапии на течение цирроза печени.
Фиброламеллярная карцинома, как правило, нечувствительна к терапии препаратами из группы моноклональных антител к PD-1 (ингибиторам контрольных точек иммунного надзора).
- Рекомендуется иммунотерапия ГЦР, прогрессирующего на лечении ингибиторами протеинкиназ с использованием комбинации ниволумаб**+ипилимумаб** в качестве 2-й и 3-й линий терапии[97].
Уровень убедительности рекомендаций–В(уровень достоверности доказательств 3)
Комментарии: режим комбинированной иммунотерапии ниволумаб** 1 мг/кг + ипилимумаб** 3 мг/кг в/в 1 раз в 3 недели 4 курса, далее поддерживающая терапия ниволумабом** в режиме 240 мг 1 раз в 2 недели или 480 мг 1 раз в 4 недели до прогрессирования или непереносимой токсичности; в исследовании 1-2b фазы зарегистрировано 32% объективных эффектов, медиана выживаемости в группе составила 22,8 мес.
- Рекомендуется терапия противоопухолевыми цитостатическими препаратами (таблица 2) в качестве лечебной опции у пациентов с ГЦР без цирроза, например, при фиброламеллярной карциноме в качестве 2-й линии терапии для улучшения контроля роста опухоли, улучшения качества жизни пациентов[14,94,98–100].
Уровень убедительности рекомендаций –С(уровень достоверности доказательств 5)
Комментарии: применяются платиносодержащие режимы в сочетании с #гемцитабином** [99, 121, 124] (таблица 2). При смешанном гистологическом варианте – гепатохолангиоцеллюлярном раке в 1-й линии лечения предпочтение отдается цитостатической химиотерапии, поскольку считается, что прогноз жизни определяется холангиоцеллюлярным компонентом опухоли, как наиболее злокачественным. Она не увеличивает продолжительность жизни и эффективна в менее чем в 20 % случаев.
- Рекомендуется для оценки эффективности противоопухолевого лечения у пациентов с ГЦР проводить мультифазную КТ и/или МРТ (с контрастным усилением) каждые 2–3 мес. по критериям RECIST 1.1 (Приложение Г4) и/или mRECIST (для опухолевого поражения печени при циррозе) [101].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: определение уровня АФП в плазме в динамике показано пациентам с исходно высоким его значением; самостоятельного клинического значения этот показатель не имеет, однако в ряде исследований отмечена прямая корреляция эффективности проводимого лечения и изменения концентрации АФП.
3.7 Сопроводительная терапия и лечение фоновой патологии печени
- Пациентам с ГЦР рекомендуется противовирусная терапия сопутствующего хронического гепатита В (ДНК-ВГВ >2 × 102МЕ/мл) аналогами нуклеот(з) идов (энтекавир** или тенофовир**) и хронического гепатита С ингибиторами протеазы и полимеразы вируса (глекапревир/пибрентасвир** или софосбувир/велпатасвир**) одновременно с лекарственным или интервенционно-радиологическим лечением независимо от выраженности цитолитического синдрома для улучшения выживаемости пациентов. Противовирусная терапия после хирургического лечения (резекции, трансплантации печени) может улучшить отдаленные результаты[14,52–56, 148].
Уровень убедительности рекомендаций –B(уровень достоверности доказательств – 2).
Комментарии: возможно одновременное проведение системной химиотерапии и курса лечения прямыми противовирусными препаратами у пациентов с компенсированной функцией печени. Клинически значимых межлекарственных взаимодействий между прямыми противовирусными препаратами и средствами для химиотерапии ГЦР не описано.
- Рекомендуется при варикозном расширении вен пищевода/желудка II–III степени у пациентов с ГЦР на фоне цирроза печени проводить первичную профилактику желудочно-пищеводного кровотечения бета-адреноблокаторами[102,103, 128].
Уровень убедительности рекомендаций –C(уровень достоверности доказательств 4).
Комментарии: при неэффективности медикаментозного лечения варикозного расширения вен пищевода и/или желудка III степени, при угрозе кровотечения, а также для вторичной профилактики рецидивного кровотечения выполняют лигирование/склерозирование варикозно-расширенных вен [6,9,102,103, 151].
- Рекомендуется пациентам ГЦР cцирротическим асцитом и с гипоальбуминемией (менее 28 г/л) на фоне цирроза печени проводить заместительную курсовую терапию 20%-раствором альбумина человека** (100–200 мл/день) до целевого уровня >35 г/л [https://cr.minzdrav.gov.ru/recomend/715_1, 104,105].
Уровень убедительности рекомендаций –А(уровень достоверности доказательств – 2).
Комментарии: наиболее высокая вероятность развития кровотечения из варикозно-расширенных вен пищевода/желудка у пациентов с циррозом печени при опухолевом тромбозе ствола и магистральных ветвей воротной вены. Информация по лечению цирроза печени представлена в клинических рекомендациях «Цирроз и фиброз печени» https://cr.minzdrav.gov.ru/recomend/715_1)
3.8. Обезболивающая терапия
- С целью коррекции хронического болевого синдрома у пациентов с ГЦР рекомендуется лечение нестероидными противовоспалительными и противоревматическими препаратами, антидепрессантами, противоэпилептическими препаратами, папаверином и его производными, местными анестетиками, производными пиразолона, опиоидными анальгетиками, опиоидными анальгетиками со смешанным механизмом действия, анксиолитиками, антигистаминными средствами системного действия, миорелаксантами центрального действия[122, 123]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: выбор метода лечения болевого синдрома определяется степенью выраженности боли у пациента. Детальный алгоритм лечения болевого синдрома представлен в методических рекомендациях «Практические рекомендации по лечению хронического болевого синдрома у взрослых онкологических больных» (коллектив авторов: Когония Л.М., Новиков Г.А., Орлова Р.В., Сидоров А.В., Королева И.А., Сакаева Д.Д.
Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 (том 11). 49
https://rosoncoweb.ru/standarts/RUSSCO/2021/2021-49.pdf
При выборе медикаментозной терапии болевого синдрома следует учитывать особенности метаболизма препаратов в условиях цирроза печени и/или печеночной недостаточности: нестероидные противовоспалительные препараты при продленном использовании негативно влияют на функцию печени.
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Пациентам с ГЦР после оперативных вмешательств рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств, ТАХЭ и/или химиотерапии для улучшения клинических и функциональных исходов[106].
Уровень убедительности рекомендаций – В(уровень достоверности доказательств – 3).
- С целью повышения кардиореспираторной выносливости на этапе подготовки к проведению противоопухолевого лечения пациентам с ГЦР рекомендуются занятия лечебной физкультурой (ЛФК) в домашних условиях (аэробная и анаэробная физическая нагрузка средней интенсивности) не менее 15 мин в день 6–7 раз в неделю для снижения частоты послеоперационных осложнений[106].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Пациентам с ГЦР рекомендуется нутритивная поддержка при наличии хотя бы одного из перечисленных факторов: непреднамеренное снижение массы тела на 10% и более от исходной за последние 6 мес., индекс массы тела <18,5 кг/м2, недостаточный объем принимаемой пищи (калорийность <1500 ккал/сут) для улучшения результатов лечения и выживаемости пациентов[107].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: с целью нутритивной поддержки в совокупности с проведением ЛФК является поддержание функционального состояния пациента и предотвращение развития саркопении. При этом предпочтительный способ нутритивной поддержки – пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной гастростомы.
Калорийность рациона должна составлять 25–30 ккал на кг массы тела в сутки, доза белка – 1,0–1,5 г на кг массы тела в сутки. Необходимо удовлетворение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3-полиненасыщенными жирными кислотами, в суточной дозе не менее 400 мл (готового напитка). При использовании нутритивной поддержки в течение, как минимум, 7 дней частота инфекционных осложнений и длительность госпитализации в послеоперационном периоде достоверно уменьшаются
[108].
4.2 Реабилитация при хирургическом лечении
4.2.1 Первый этап реабилитации
- Рекомендуется ранняя мобилизация и активизация пациента с ГЦР(вертикализация, дыхательная гимнастика, занятия ЛФК) под контролем инструктора, начиная с 1–2-го дня послеоперации для снижения частоты осложнений и сокращения сроков госпитализации[108,109].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Пациентам с ГЦР рекомендуется раннее начало энтерального питания (на 2-е послеоперационные сутки) с ориентацией на общие принципы нутритивной поддержки после хирургических вмешательств на органах брюшной полости для уменьшения частоты осложнений и длительности госпитализации[107].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: цель проведения ранней мобилизации пациента в совокупности с адекватной нутритивной поддержкой состоит в улучшении кардиореспираторной выносливости пациента, следствием чего является уменьшение частоты нехирургических осложнений и длительности госпитализации.
4.2.2 Второй этап реабилитации
- Пациентам рекомендуются аэробные нагрузки с постепенным увеличением их интенсивности длительностью до 150 мин в неделю, а также упражнения с сопротивлением (по 8–10 повторений на основные группы мышц) 2 раза в неделю под контролем инструктора ЛФК для улучшения качества жизни пациента и ускорения социальной реабилитации [110,111].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарии: целью физической нагрузки является восстановление кардиореспираторной выносливости, что препятствует развитию мышечной слабости, возникновению и прогрессированию саркопении, улучшает качество жизни пациента и ускоряет его социальную реабилитацию.
- Пациентам с ГЦР рекомендуется проведение сеансов электросна по общепринятой методике для улучшения качества жизни [112].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: целью проведения сеансов электросна является получение выраженного седативного эффекта, который уменьшает проявления астенического и депрессивного синдромов, снижает интенсивность головных болей, проявления дискинезии желчевыводящих путей, что значительно улучшает качество жизни пациента.
4.2.3 Третий этап реабилитации
- Пациентам с ГЦР, находящимся в ремиссии, в домашних условиях рекомендуются регулярные занятия ЛФК, начинающиеся с аэробной нагрузки низкой интенсивности с постепенным увеличением ее до аэробной нагрузки умеренной интенсивности в совокупности с упражнениями с сопротивлением на основные группы мышц (по 15–20 мин, по 8–10 повторений) дважды в неделю для улучшения кардиореспираторной выносливости и повышения качества жизни [113].
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: целью занятий ЛФК является обеспечение сохранения мышечной массы, улучшение кардиореспираторной выносливости, повышение качества жизни и увеличение общей выживаемость. Желательное время тренировки – не менее 30 мин в день с умеренной интенсивностью несколько (большинство) дней в неделю, принимая во внимание наличие и тяжесть осложнений противоопухолевого лечения.
4.3 Реабилитация при химиотерапии
- Пациентам с ГЦР, получающим химиотерапевтическое лечение, рекомендуются занятия ЛФК с включением аэробной нагрузки средней интенсивности в домашних условиях с целью повышения кардиореспираторной выносливости[114].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- При развитии полинейропатии пациентам с ГЦР рекомендуется проведение поликомпонентной программы реабилитации, включающей в себя упражнения на тренировку баланса, низкоинтенсивную лазеротерапию, низкочастотную магнитотерапию, чрескожную электростимуляцию для уменьшения явления полинейропатии[115–118].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- В течение всего курса химиотерапии пациентам с ГЦР рекомендуется нутритивная поддержка по показаниям в режиме, совпадающем с режимом нутритивной поддержки на предоперационном этапе для сохранения мышечной массы[107].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3).
Комментарии: нутритивная поддержка необходима с целью сохранения мышечной массы, что в совокупности с посильной физической нагрузкой препятствует усилению токсичности химиотерапии.
Госпитализация
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрения на него в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами и врачами по рентгенэндоваскулярной диагностике и лечению в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациенту с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов, врачей по рентгенэндоваскулярной диагностике и лечению и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «онкология», определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии и т. д.) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, рентгенохирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и других видов, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется соблюдать следующую периодичность наблюдения после завершения радикального лечения по поводу ГЦР и применять следующие методы наблюдения для раннего выявления прогрессирования заболевания[6,9,14]:
1. сбор анамнеза и физикальное обследование – каждые 3–6 мес., далее 1 раз в 6–12 мес;
2. определение уровня АФП (если исходно он был повышен) – каждые 3–4 мес. в первые 2 года, далее 1 раз в 6–12 мес.;
3. УЗИ органов брюшной полости – каждые 3–4 мес.;
4. КТ или МРТ органов брюшной полости с внутривенным контрастированием – каждые 3–6 мес.;
5. рентгенография органов грудной клетки – каждые 12 мес.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания после завершения лечения с целью раннего проведения хирургического лечения резектабельных метастатических очагов, аблации и/или химиоэмболизации рецидивных опухолей, своевременного начала лекарственного противоопухолевого лечения.
- Рекомендуется соблюдать следующую периодичность и применять следующие методы наблюдения за пациентами, проходящими противоопухолевое лечение по поводу ГЦР для раннего выявления прогрессирования заболевания [6,9,14]:
1. сбор анамнеза заболевания и лечения, включая данные о сопутствующей патологии, и физикальное обследование;
2. развернутый клинический анализ крови (лейкоцитарная формула, число тромбоцитов);
3. биохимический анализ крови (определение уровня мочевины, креатинина, альбумина, глюкозы, АСТ, АЛТ, щелочной фосфатазы);
4. коагулограмма (международное нормализованное отношение или протромбиновое время);
5. определение уровня АФП – каждые 3–4 мес.;
6. УЗИ органов брюшной полости – каждые 2–3 мес.;
7. эзофагогастродуоденоскопия – каждые 6 мес.;
8. мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием – каждые 3–4 мес.;
9. рентгенография органов грудной клетки – каждые 6 мес.;
10. сцинтиграфия костей всего тела – по показаниям.
Уровень убедительности рекомендаций – С(уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России — 1. Akinyemiju T. et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. 2017. Vol. 3, № 12. P. 1683.
2. Estes C. et al. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease // Hepatology. 2018. Vol. 67, № 1. P. 123–133.
3. Fattovich G. et al. Hepatocellular carcinoma in cirrhosis: Incidence and risk factors // Gastroenterology. W.B. Saunders, 2004. Vol. 127, № 5 SUPPL.
4. Карпин А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2019 году (заболеваемость и смертность). Москва: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020. 252 p.
5. AJCCCancerStagingManual. 8th ed. / ed. Amin M.B. et al. Springer, 2017.
6. Galle P.R. et al. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma // J. Hepatol. Elsevier B.V., 2018. Vol. 69, № 1. P. 182–236.
7. Forner A., Reig M., Bruix J. Hepatocellular carcinoma // The Lancet. Lancet Publishing Group, 2018. Vol. 391, № 10127. P. 1301–1314.
8. Vogel A. et al. Hepatocellular carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Ann. Oncol. Oxford University Press, 2018. Vol. 29. P. iv238–iv255.
9. Marrero J.A. et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases // Hepatology. John Wiley and Sons Inc., 2018. Vol. 68, № 2. P. 723–750.
10. Terrault N.A. et al. AASLD guidelines for treatment of chronic hepatitis B // Hepatology. John Wiley and Sons Inc., 2016. Vol. 63, № 1. P. 261–283.
11. Chung R.T. et al. Hepatitis C guidance 2018 update: Aasld-idsa recommendations for testing, managing, and treating Hepatitis C Virus infection // Clin. Infect. Dis. Oxford University Press, 2018. Vol. 67, № 10. P. 1477–1492.
12. Waidely E. et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection // Analyst. Royal Society of Chemistry, 2016. Vol. 141, № 1. P. 36–44.
13. Arrieta O. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis // BMC Cancer. 2007. Vol. 7.
14. NCCN. Clinical Practice Guidelines in Oncology. Hepatobiliary Cancers, version 4.2021. 2021.
15. Peng Y., Qi X., Guo X. Child–Pugh Versus MELD Score for the Assessment of Prognosis in Liver Cirrhosis // Medicine (Baltimore). 2016. Vol. 95, № 8. P. e2877.
16. Forner A. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma // Hepatology. 2008. Vol. 47, № 1. P. 97–104.
17. Chou R. et al. Imaging Techniques for the Diagnosis of Hepatocellular Carcinoma // Ann. Intern. Med. 2015. Vol. 162, № 10.
18. Lee Y.J. et al. Hepatocellular carcinoma: Diagnostic performance of multidetector CT and MR imaging-a systematic review and meta-analysis // Radiology. Radiological Society of North America Inc., 2015. Vol. 275, № 1. P. 97–109.
19. Liu X. et al. Gadoxetic acid disodium–enhanced magnetic resonance imaging outperformed multidetector computed tomography in diagnosing small hepatocellular carcinoma: A meta-analysis // Liver Transplant. 2017. Vol. 23, № 12. P. 1505–1518.
20. Li J. et al. The diagnostic performance of gadoxetic acid disodium-enhanced magnetic resonance imaging and contrast-enhanced multi-detector computed tomography in detecting hepatocellular carcinoma: a meta-analysis of eight prospective studies // European Radiology. 2019. Vol. 29, № 12. P.
6519–6528.
21. Guo J. et al. Diagnostic performance of contrast-enhanced multidetector computed tomography and gadoxetic acid disodium-enhanced magnetic resonance imaging in detecting hepatocellular carcinoma: direct comparison and a meta-analysis // Abdom. Radiol. Springer New York LLC, 2016. Vol. 41, № 10. P. 1960–1972.
22. Kang T.W. et al. Use of gadoxetic acid–enhanced liver MRI and mortality in more than 30000 patients with hepatocellular Carcinoma: A nationwide analysis // Radiology. 2020. Vol. 295, № 1. P. 114–124.
23. Wang J.H. et al. Clinical Impact of Gadoxetic Acid-Enhanced Magnetic Resonance Imaging on Hepatoma Management: A Prospective Study // Dig. Dis. Sci. 2016. Vol. 61, № 4. P. 1197–1205.
24. Cerny M. et al. LI-RADS version 2018 ancillary features at MRI // Radiographics. Radiological Society of North America Inc., 2018. Vol. 38, № 7. P. 1973–2001.
25. Chernyak V. et al. LI-RADS ® algorithm: CT and MRI // Abdominal Radiology. Springer New York LLC, 2018. Vol. 43, № 1. P. 111–126.
26. Ludwig D.R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict L // HPB. Elsevier B.V., 2019. Vol. 21, № 12. P. 1697–1706.
27. Choi J.Y., Lee J.M., Sirlin C.B. CT and MR imaging diagnosis and staging of hepatocellular carcinoma. Part II. Extracellular agents, hepatobiliary agents, and ancillary imaging features // Radiology. 2014. Vol. 273, № 1. P. 30–50.
28. Katyal S. et al. Extrahepatic Metastases of Hepatocellular Carcinoma // Radiology. 2000. Vol. 216, № 3. P. 698–703.
29. Natsuizaka M. et al. Clinical features of hepatocellular carcinoma with extrahepatic metastases // J. Gastroenterol. Hepatol. Blackwell Publishing, 2005. Vol. 20, № 11. P. 1781–1787.
30. Stewart C.J.R., Coldewey J., Stewart I.S. Comparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions // J. Clin. Pathol. 2002. Vol. 55, № 2. P. 93–97.
31. Sangiovanni A. et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis // Gut. 2010. Vol. 59, № 5. P. 638–644.
32. Intenzo C., Kim S., Lakhani P. Utility of FDG-PET/CT in Detecting Metastases from Hepatocellular Carcinoma // J. Nucl. Med. 2017. Vol. 58, Issue. P. 427.
33. Marrero J.A. et al. Prognosis of hepatocellular carcinoma: Comparison of 7 staging systems in an American cohort // Hepatology. 2005. Vol. 41, № 4. P. 707–715.
34. Cillo U. et al. Prospective validation of the Barcelona Clinic Liver Cancer staging system // J. Hepatol. 2006. Vol. 44, № 4. P. 723–731.
35. Chen C.-H. et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method – Analysis of 2010 Taiwanese patients // Eur. J. Cancer. 2009. Vol. 45, № 9. P. 1630–1639.
36. Kumar A. et al. Hepatic arteriovenous fistulae: Role of interventional radiology // Dig. Dis. Sci. 2012. Vol. 57, № 10. P. 2703–2712.
37. Wu H. et al. Clinical characteristics of hepatic Arterioportal shunts associated with hepatocellular carcinoma // BMC Gastroenterol. 2018. Vol. 18, № 1.
38. Truty M.J., Vauthey J.-N. Surgical Resection of High-Risk Hepatocellular Carcinoma: Patient Selection, Preoperative Considerations, and Operative Technique // Ann. Surg. Oncol. 2010. Vol. 17, № 5. P. 1219–1225.
39. Pawlik T.M. Critical Appraisal of the Clinical and Pathologic Predictors of Survival After Resection of Large Hepatocellular Carcinoma // Arch. Surg. 2005. Vol. 140, № 5. P. 450.
40. Chok K.S. et al. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma // Br. J. Surg. 2009. Vol. 96, № 1. P. 81–87.
41. Ribero D. et al. Selection for resection of hepatocellular carcinoma and surgical strategy: Indications for resection, evaluation of liver function, portal vein embolization, and resection // Annals of Surgical Oncology. 2008. Vol. 15, № 4. P. 986–992.
42. Berzigotti A. et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: A systematic review and meta-analysis // Hepatology. John Wiley and Sons Inc., 2015. Vol. 61, № 2. P. 526–536.
43. Mazzaferro V. et al. The long-term benefit of liver transplantation for hepatic metastases from neuroendocrine tumors // Am. J. Transplant. 2016. Vol. 16, № 10. P. 2892–2902.
44. Mazzaferro V., Battiston C., Sposito C. Pro (With Caution): Extended oncologic indications in liver transplantation // Liver Transplant. 2018. Vol. 24, № 1. P. 98–103.
45. Mazzaferro V. et al. Liver transplantation in hepatocellular carcinoma after tumour downstaging (XXL): a randomised, controlled, phase 2b/3 trial // Lancet Oncol. 2020. Vol. 21, № 7. P. 947–956.
46. Clavien P.A. et al. Recommendations for liver transplantation for hepatocellular carcinoma: An international consensus conference report // The Lancet Oncology. 2012. Vol. 13, № 1.
47. Олисов О.Д. et al. Трансплантация печени в лечении нерезектабельной гепатоцеллюлярной карциномы в отсутствие цирроза печени. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018. Vol. 28, № 4. P. 76–83.
48. Новзурбеков М.С. et al. Трансплантация и аутотрансплантация как радикальный метод лечения нерезектабельных опухолевых и паразитарных заболеваний печени // Анналы хирургической гепатологии. 2020. Vol. 25, № 4. P. 49–59.
49. Decaens T., Laurent A., Luciani A. Liver transplantation for hepatocellular carcinoma in noncirrhotic livers regardless of the number and size of tumours? // Journal of Hepatology. 2012. Vol. 57, № 2. P. 235–236.
50. Fujiki M., Aucejo F., Kim R. General overview of neo-adjuvant therapy for hepatocellular carcinoma before liver transplantation: Necessity or option? // Liver International. 2011. Vol. 31, № 8. P. 1081–1089.
- Клинические рекомендации Ассоциации онкологов России — 1. Akinyemiju T. et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level // JAMA Oncol. 2017. Vol. 3, № 12. P. 1683.
Информация
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ГЦР – гепатоцеллюлярный рак
КТ – компьютерная томография
ЛФК – лечебная физкультура
МРТ – магнитно-резонансная томография
ТАХЭ – трансартериальнаяхимиоэмболизация
УЗИ – ультразвуковое исследование
AASLD – American Association for the Study of Liver Disease, Американская ассоциация по изучению заболеваний печени
EASL – The European Association for the Study of the Liver, Европейская ассоциация по изучению печени
BCLC – Barcelona Clinic Liver Cancer (classification), Барселонская система стадирования рака печени
ECOG PS – Eastern Cooperative Oncology Group Performance Status, шкала оценки общего состояния пациента, разработанная Восточной объединенной онкологической группой
LI-RADS – LiverI maging Reportingand Data System, система отчетов и данных (интерпретации и протоколирования) визуализации печени.
RECIST – Response Evaluation Criteriain Solid Tumors, критерии оценки ответа солидных опухолей на лечение
mRECIST – modified Response Evaluation Criteriain Solid Tumors, модифицированные критерии оценки ответа солидных опухолей на лечение
PD1/PD-L1 – program medcelldeath 1/program medcelldeath 1 ligand, мембранный белок запрограммированной смерти клеток/его лиганд
TNM – (аббревиатура от Tumor, Nodus, Metastasis), международная классификация стадий злокачественных новообразований
** – жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Блокатор CTLA4 – моноклональное антитело, блокирующее антиген цитотоксических Т-лимфоцитов 4-го типа.
Блокатор PD1 – моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Класс цирроза по Child–Pugh – степень выраженности нарушения функции печени (А, В, С), рассчитываемая по сумме баллов.
Компьютерная томография – метод послойной внутренней диагностики.
Магнитно-резонансная томография – метод послойной внутренней диагностики с помощью эффекта ядерного магнитного резонанса.
Позитронно-эмиссионная томография – метод радионуклидной диагностики.
Терапия «понижения стадии» – down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений.
Трансартериальнаяхимиоэмболизация – метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с цитостатиком.
Трансартериальнаярадиоэмболизация – метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с изотопом.
Ультразвуковое исследование – неинвазивное исследование организма с помощью ультразвуковых волн.
Bridge-терапия – терапия «ожидания», которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации.
CTLA4 – антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
Response Evaluation CriteriainSolid Tumours – набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию.
Modified Response Evaluation Criteriain Solid Tumors – набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию методом измерения васкуляризованного компонента опухолевого узла.
Предреабилитация (prehabilitation) – реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации – реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации – реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации – реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе, в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Абдурахманов Д.Т., д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии Первого МГМУ им. И.М. Сеченова.
2. Алиева С.Б., д.м.н., ведущий научный сотрудник радиологического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
3. Балахнин П.В., к.м.н., заведующий отделением рентгенохирургических методов диагностики и лечения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
4. Базин И.С., д.м.н., старший научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 2 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Болотина Л.В., д.м.н., заведующий отделением химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
6. Бредер В.В.,д.м.н., ведущий научный сотрудник онкологического отделения лекарственных методов лечения (химиотерапии) № 17 ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России.
7. ВиршкеЭ.Р.,д.м.н., заведующий лабораторией интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
8. Гранов Д.А., д.м.н., член-корр. РАМН, академик РАН, научный руководитель РНЦРиХТ им. А.М. Гранова
9. Долгушин Б.И., чл.-корр. РАН, д.м.н., директор НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
10. Косырев В.Ю.,д.м.н., ведущий научный сотрудник лаборатории интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Ледин Е. В.,к.м.н., клиническая больница № 2 АО «Группа компаний МЕДСИ».
12. ЛукъянченкоА.Б.,д.м.н., профессор, ведущий научный сотрудник рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
13. Медведева Б.М.,д.м.н., заведующий рентгенодиагностическим отделением НИИ клинической и экспериментальной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
14. Мороз Е.А.,к.м.н., врач-патологоанатом отдела патологической анатомии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
15. Кармазановский Г.Г., член-корр. РАН, д.м.н, профессор, заведующий отделением рентгенологии и магнитно-резонансных исследований с кабинетом ультразвуковой диагностики ФГБУ “НМИЦ хирургии имени А.В. Вишневского” Минздрава России; профессор кафедры лучевой диагностики и терапии медико-биологического факультета ФГАОУ ВО РНИМУ имени Н.И. Пирогова Минздрава России
16. Кудашкин Н.Е., к.м.н., научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, доцент кафедры онкологии и лучевой терапии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
17. Новрузбеков М С.,д.м.н., заведующий научным отделом трансплантации печени ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ».
18. Патютко Ю.И.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
19. Петкау В. В.,к.м.н., доцент кафедры онкологии УГМУ, врач-онколог клиники «УГМК-здоровье», Екатеринбург
20. Петров Л.О., к.м.н., заведующий отделением лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России
21. Подлужный Д.В.,к.м.н., заведующий отделением опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
22. Сагайдак И.В.,д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
23. Сидоров Д.В., д.м.н., заведующий абдоминальным отделением хирургического отдела МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
24. Феденко А.А., д.м.н., заведующий отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
25. Фалалеева Н.А., д.м.н., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
3. Гильмутдинова И.Р., к.м.н., врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий, заведующая отделом биомедицинских технологий и лабораторией клеточных технологий ФГБУ «НМИЦ реабилитации и курортологии» Минздрава России.
4. БулановА.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
5. Бутенко А.В., д.м.н., профессор, заместитель главного врача по онкологической помощи ФГБНУ «Российский научный центр хирургии им. академика Б.В. Петровского»
6. Назаренко А.В., к.м.н., член Российской ассоциации терапевтических радиационных онкологов, European Society forRadiotherapy&Oncology, Российско-Американского альянса по изучению рака, представитель Российской Федерации в МАГАТЭ, врач высшей квалификационной категории.
7. Обухова О.А.,к.м.н.,врач-физиотерапевт, заведующий отделением медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания.
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения медицинской реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
9. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России.
10. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
11. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
12. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
13. Романов А.И., академик РАН,д.м.н., профессор, главный врач ФГБУ «Центр реабилитации» Управления делами Президента Российской Федерации.
14. Филоненко Е.В.,д.м.н., профессор, заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
Блок по организации медицинской помощи:
1. Невольских А.А.,д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
2. Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
3. Хайлова Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1) врачи-онкологи;
2) врачи-хирурги;
3) врачи-радиологи;
4) врачи по рентгеноэндоваскулярным диагностике и лечению;
5) студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме ГЦР в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Рисунок А1. Барселонская система стадирования гепатоцеллюлярного рака [7].
ОВ – общая выживаемость; ОС – объективный статус
по шкале ECOG; ТАХЭ – трансартериальная химиоэмболизация
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте
http://grls.rosminzdrav.ru
.
Таблица 2. Режимы лекарственного лечения гепатоцеллюлярного рака
Приложение Б. Алгоритмы действий врача
Рис. Б1. Диагностический алгоритм при выявлении узловых образований в цирротической печени у пациентов группы риска развития гепатоцеллюлярного рака
Приложение В. Информация для пациента
Рекомендации по первичной профилактике гепатоцеллюлярного рака
Главным фактором риска развития рака печени является хроническое воспаление печени вследствие воздействия различных повреждающих факторов: хронических вирусных гепатитов В и С, употребления алкоголя и других токсических веществ, нарушения углеводного и жирового обмена и цирроза различной этиологии. Сочетание нескольких факторов риска увеличивает вероятность развития первичного рака печени. Вакцинация от вирусного гепатита В – важнейшее профилактическое мероприятие. Эффективная противовирусная терапия хронического гепатита С достоверно уменьшает вероятность развития рака печени.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38°C и выше – начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
- механически, термически щадящая диета;
- частое (каждый час) полоскание рта отварами ромашки, шалфея, коры дуба, смазывание рта облепиховым (персиковым) маслом;
- обработка полости рта по рекомендации врача-онколога.
3. При диарее:
- исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
5. При развитии специфических для непрерывной таргетной терапии побочных эффектов – артериальной гипертензии, появлении трещин на коже рук и ног, многократной диарее, выраженной слабости – следует прекратить прием препарата и незамедлительно связаться с лечащим врачом.
Информация для пациента, получающего терапию моноклональными антителами – блокаторами CTLA4 и/или PD1/PD-L1
Своевременное взаимодействие с вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья – важная составляющая вашей помощи медицинской команде в осуществлении настолько полной защиты вас в процессе лечения, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами CTLA4 и/или PD1, были выявлены и устранены при первом их появлении, это поможет предотвратить их переход в более тяжелые формы.
Блокаторы CTLA4 и/или МКА-блокаторы PD1/PD-L1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей .
Побочные явления, которые могут появиться у вас, обычно возникают в первые
12 недель лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами CTLA4 и/или PD1/PD-L1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые формы.
Если после лечения блокаторами CTLA4 и/или МКА-блокаторами PD1/PD-L1 у вас возникли какие-либо симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные эффекты терапии блокаторамиCTLA4 и/или PD1/PD-L1:
- увеличение числа актов дефекации (>2 в день) или любая диарея в ночное время, любой стул со слизью и кровью;
- боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
- красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
- желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи к солнечным лучам;
- возникновение кашля или одышки;
- усталость или сонливость;
- затрудненная концентрация внимания или спутанность сознания;
- головная боль, боль в теле или в месте опухоли;
- лихорадка (повышение температура тела до +38°C и выше);
- внезапное снижение или увеличение массы тела;
- возникновение эректильной дисфункции или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записывайте количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
– стул неплотный ;
– водянистый ;
– болезненный ;
– кровянистый ;
– слизистый .
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед. до нескольких месяцев от начала лечения блокаторамиCTLA4 и/или PD1/ PD-L1. Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки функции печени по Чалд-Пью
Название на русском языке: классификация тяжести цирроза печени по Чалд-Пью
Оригинальное название: Child–Pughclassification
Источник (официальный сайт разработчиков, публикация с валидацией):
1. Cholongitas E. et al. Systematic review: The model for end-stage liver disease — Should it replace Child-Pugh’s classification for assessing prognosis in cirrhosis? // Alimentary Pharmacology and Therapeutics. 2005. Vol. 22, № 11–12. P. 1079–1089.
2. Child C.G., Turcotte J.G. Surgery and portal hypertension // The Liver and Portal Hypertension. Philadelphia: Saunders, 1964. 50–58 p.
3. Pugh R.N.H. et al. Transection of the oesophagus for bleeding oesophageal varices // Br. J. Surg. 2005. Vol. 60, № 8. P. 646–649.
Назначение: определить степень выраженности нарушения функции печени.
Содержание:
Пояснения: хроническое поражение (нарушение функции) печени классифицируется как Child–Pugh класса A, В или C, в зависимости от суммы баллов, полученных для каждого параметра. Класс А: 5-6 баллов, класс В: 7-9 баллов и класс С: 10-15 баллов.
Приложение Г2. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией):
1. https://ecog-acrin.org/resources/ecog-performance-status.
2. Oken M.M., Creech R.H., Davis T.E. Toxicology and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. Cancer Clin. Trials. 1982. Vol. 5, № 6. P. 649–655.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г3. Шкала Карновского
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Оригинальная публикация:
Karnofsky DA B.J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of Chemotherapeutic Agents. // Columbia Univ. Press. 1949. P. 191–205.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г4. Критерии оценки ответа опухоли на лечение
(RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1).
Оригинальное название: Response Evaluation Criteriain Solid Tumors 1.1.
Оригинальная публикация:
EisenhauerE.A. etal. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) // Eur. J. Cancer. 2009. Vol. 45, № 2. P. 228–247.
Назначение: оценка ответа на химиотерапевтическое лечение.
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях № 46 ГБУЗ «Научно-практический центр медицинской радиологии» Департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf.Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
Приложение Г5. Критерии оценки ответа опухоли на лечение
(mRECIST)
Название на русском языке: Модифицированные критерии оценки ответа опухоли на химиотерапевтическое лечение (mRECIST).
Оригинальное название: ModifiedResponseEvaluationCriteriainSolidTumors.
Оригинальная публикация:
Lencioni R., Llovet J.M. ModifiedRECIST (mRECIST) assessment for hepatocellular carcinoma // Seminars in Liver Disease. 2010. Vol. 30, № 1. P. 52–60.
Назначение: оценка ответа на таргетную терапию и локорегионарное лечение ГЦР.
Оценка проводится при помощи КТ или МРТ, исключительно в артериальную фазу сканирования. Длинник очага оценивается в той части, что наиболее усилилась постконтрастно в артериальную фазу.
- Полный ответ (Complete Response — CR) — Исчезновение любого внутриопухолевого контрастирования в артериальную фазу во всех таргетных очагах.
- Частичный ответ (Partial Response — PR) — Уменьшение суммы диаметров очагов не менее чем на 30%, оцениваемые в артериальную фазу контрастирования.
- Прогрессирование заболевания (ProgressiveDisease — PD) — Увеличение на 20% и более суммы диаметров таргетных очагов, оцениваемые в артериальную фазу контрастирования.
- Стабилизация заболевания (StableDisease — SD) — Все остальное.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Диагностика рака печени
Особенности диагностики рака печени на разных стадиях развития
Злокачественное поражение печени редко обнаруживается на первоначальных стадиях его развития, именно этим объясняется нeблагоприятный исход заболевания.
Для того чтобы установить диагноз на ранних стадиях формирования рака следует не только обратить внимание на изменения в самочувствии, но и пройти диагностику, которая при признаках поражения печени имеет свои особенности.
Как диагностируют рак печени?
При любых беспокоящих изменениях в самочувствии, точную причину которых человек не в силах установить самостоятельно, необходимо как можно раньше обратиться к квалифицированному специалисту.
Предварительный диагноз злокачественного процесса в печени устанавливается на основании опроса пациента, сбора анамнеза, пальпации живота.
При подозрении на опухоль медработник обязательно должен назначить ряд обследований, позволяющих оценить состояние внутренних органов изнутри.
При обнаружении признаков рака печени используют:
- УЗИ. Этот метод доступен в большинстве медучреждений и при его проведении можно заметить наличие новообразований, увеличение печени в размерах.
- КТ. Томография показывает размеры опухоли, определяет наличие метастазов.
- Пункцию образования, она необходима для забора образца тканей для проведения биопсии.
- Ангиография требуется для оценки патологических изменений в сосудах.
- Анализы крови показывают изменения ее состава, воспалительную реакцию. Дополнительно определяются онкомаркеры, являющиеся косвенным подтверждением ракового образования в организме.
Как проявляется болезнь?
Сложность диагностирования рака печени на начальном этапе его развития связана преимущественно с тем, что эта болезнь сначала не дает четкой и специфической симптоматики.
В основном могут наблюдаться расстройства пищеварения, тошнота, горечь во рту, периодически появляющаяся тяжесть справа под ребрами. Все эти симптомы обычно связывают с перееданием, употрeблением некачественной пищи и потому не сразу обращаются к врачу.
Между тем при внимательном отношении к своему здоровью раковое образование можно заподозрить по следующим проявлениям:
- Заметному похудению
- Снижению аппетита.
- Быстрому наполнению желудка, что проявляется чувством тяжести даже при употрeблении малокалорийных блюд в небольшом объеме.
- Тошноте.
- Зуду кожного покрова.
- Пожелтению склер и желтушности тела.
- Увеличению печени, что проявляется как опухоль справа под ребрами. При раке печени увеличивается в размерах и селезенка, поэтому слева под ребрами часто также удается самостоятельно прощупать опухолевидное образование.
- Болям в верхней части живота, болезненность часто иррадиирует в лопатку.
- Расширению вен, проступающих через брюшную стенку.
- Скоплению жидкости в брюшной полости.
Ели злокачественное поражение печени развивается на фоне цирроза или другого заболевания печени, то к привычным уже для больного симптомам присоединяются и вышеперечисленные, а это заметно ухудшает общее самочувствие.
Нужно сказать, что перечисленные признаки рака характерны и для других патологий КТ, поэтому при их фиксировании сразу впадать в панику не стоит, но нужно как можно раньше полностью обследоваться. Своевременное лечение при любом заболевании является залогом быстрого выздоровления и отсутствия осложнений.
Некоторые злокачественные новообразования, расположенные в печени, выpaбатывают ряд гормонов, влияющих на общее функционирование организма.
Изменение гормонального фона вызывает:
- Гиперкальциемию, а это состояние характеризуется мышечной слабостью, запорами, тошнотой, заторможенностью.
- Гипогликемию. Падение сахара приводит к гипотонии, слабости и обморокам. Гипогликемия обнаруживается чаще при медленно растущих новообразованиях печени.
- Гинекомастию и уменьшение яичек в размерах у мужчин.
- Эритроцитоз – повышение количества эритроцитов. Подобное изменение крови становится причиной приливом и покраснений кожи лица.
- Повышение холестерина.
Перечисленные симптомы многие врачи отожествляют с другими заболеваниями, и если не проводится инструментальная диагностика, то диагноз выставляется неверно.
Общеклинические исследования
К общеклиническим исследованиям относят проведение биохимического и общего анализа крови, определение нормальных показателей мочи.
При раке печени все эти анализы меняются и чем запущеннее процесс, тем сильнее будут отклонения от нормы.
Онкомаркеры
Исследование крови на онкомаркеры рака печени помогает верно выставить диагноз. Раковые опухоли продуцируют особые белки, превышение их показателей свидетельствует о злокачественном новообразовании.
Если печень подвержена раковому процессу, то в крови определяется онкомаркер под названием альфафетопротеин. Этот белок обнаруживается у детей, у здоровых взрослых полностью отсутствует и резко возрастает при поражении печени раковыми клетками.
Показатели крови
Биохимический анализ крови показывает степень нарушения функционирования печени, а некоторые изменения его показателей возникают именно при онкологическом поражении организма.
Общий анализ крови при раке печени характеризуется повышением СОЭ, то есть скорости оседания эритроцитов.
Возрастающее СОЭ указывает на воспалительный процесс. При злокачественных процессах в организме увеличивается в крови содержание лейкоцитов, и падают эритроциты. У пациентов с раком печени уже на второй-третьей стадии выявляется снижение гемоглобина.
Ультразвуковое исследование
Ультразвуковое сканирование является самым доступным методом. Раковое поражение печени на УЗИ имеет форму разных структур, его контуры бывают и четкими и размытыми.
Злокачественные образования определяются как одиночные, так и множественные, возможно повреждение крупных сосудов.
Подозрение на раковый процесс у врача возникает, если в органе визуально определяются следующие признаки:
- Уплотнения в той зоне, где располагаются ветви воротной вены.
- Изменения сосудистого рисунка поверхности печени.
- Увеличение плотности паренхимы.
- Увеличение печени и закругление ее нижнего края.
- Сниженное проведение ультразвуковых волн.
- Неоднородная структура разных сегментов печени.
Подобные признаки указывают на возможное злокачественное новообразование, но окончательный диагноз выставляется только после подтверждения рака другими способами.
Термином биопсия обозначается процедypa, в ходе которой берется небольшой фрагмент тканей для гистологического исследования.
Основное показание к проведению процедуры – подозрение на раковую опухоль.
Биопсия печени проводится тремя способами:
- Чрескожная выполняется с использованием специальной иглы, предназначенной для забора биоптата. Прокол осуществляется между двумя нижними правыми ребрами, проводится манипуляция под местным обезболиванием. Для проведения анализа требуется взять либо кусочек опухоли, либо сгусток крови, в которой также могут быть обнаружены раковые клетки.
- Лапароскопическая биопсия осуществляется при помощи эндоскопа. Вначале в области проекции печени делается небольшой разрез, через который вводится эндоскоп. Под контролем выводимого на экран изображения врач забирает несколько фрагментов биоптата из разных мест органа.
- Трансвенозный вид биопсии проводится путем введения катетера с иглой в вену на шее. Этот катетер аккуратно продвигается к печени, где затем осуществляется забор тканей. Трансвенозная биопсия в основном назначается, когда у пациента имеются серьезные проблемы со свертываемостью крови.
В большинстве современных медучреждений биопсия печения проводится под контролем УЗИ или КТ, что позволяет взять образец тканей именно из видимых мест ее перерождения.
Процедypa переносится достаточно легко и чаще всего делается в амбулаторных условиях, если манипуляция не вызывает осложнений, то пациент покидает клинику через три-четыре часа.
При гистологическом исследовании оценивается клеточный состав биоптата, при раке выявляются атипичные клетки.
Компьютерная томография – метод исследования печени, при котором получается визуально рассмотреть все изменения в поперечном разрезе органа.
КТ предоставляет информацию о размерах разных типах опухолей, их локализации, о поражении сосудов. Под контролем томографии нередко проводится биопсия печени.
Компьютерный томограф, фотографируя тело пациента, выдает десятки снимков, которые затем совмещаются специальной программой. При необходимости дополнительно используется введение контрастного вещества, что позволяет рассмотреть структуру опухоли.
Для проведения процедуры пациента в горизонтальном положении помещают в аппарат, внешняя часть которого вращается вокруг тела, процедypa совершенно безболезненна, но у некоторых пациентов вызывает психологический дискомфорт.
МРТ или магнитно — резонансная томография работает по тому же принципу, что и КТ. То есть процедypa позволяет получить детальное изображение печени, но вместо рентгеновских лучей применяются радиоволны.
Ткани организма вначале поглощают радиоволны, а затем их высвобождают. Компьютер оценивают изменения высвобожденных волн, и преобразует их в изображение органа со всеми выявленными нарушениями. При проведении МРТ используется и контрастное вещество, необходимое для визуализации некоторых видов новообразований.
МРТ позволяет не только определить опухоль, но и в некоторых случаях помогает отличить доброкачественное образование от злокачественного. Помимо выявления опухолей, МРТ необходимо для визуализации состояния сосудов, как в самой печени, так и вокруг нее.
МРТ В отличие от КТ некоторыми пациентами переносится тяжелее. Все дело в том, что при проведении исследования пациент должен около часа находиться в узкой трубе, что у многих людей вызывает панику. Сам сканер издает громкие звуки, усиливающие психологический дискомфорт. Поэтому к процедуре следует мopaльно подготовиться.
Лапароскопия
Лапароскопическое обследование проводится с целью оценки состояния печени, при его проведении устанавливаются размеры опухоли, и подбирается план хирургического лечения.
Лапароскопия осуществляется путем создания небольшого разреза на брюшной стенки, через который вводится гибкий эндоскоп, оснащенный миниатюрной камерой. Получаемое изображение выводится на экран.
В ходе манипуляции при необходимости можно взять образец ткани на гистологическое исследование.
Лапароскопическое обследование проводится под общим наркозом, но, как правило, после него пациент чувствует себя удовлетворительно и через несколько часов его отпускают домой.
Ангиография
Ангиография это обследование сосудов, проводимое при помощи контрастного вещества и рентгеновских снимков. После введения контраста хорошо становятся видны контуры сосудов и определяются те из них, которые питают растущую опухоль.
На основании ангиографии принимается решение о возможном оперировании больного, также при помощи этой процедуры проводится эмболизация, позволяющая разрушить новообразование.
Ангиография устанавливает расположение опухоли в печени, один из видов этого обследования, проводимый с контрастным веществом, выявляет даже опухоли с размером в диаметре менее 2 см.
При проведении манипуляции вначале в вену на внутренней поверхности бедра вводится гибкий катетер, который продвигается в печеночную артерию. Через него вводится контрастное вещество, и делаются снимки печени.
Процедypa доставляет небольшой дискомфорт, и проводится под местным обезболиванием.
Сканирование костей
Сканирование костной ткани скелета назначается, когда есть подозрение на распространение метастазов в кости или в том случае, когда принимается решение о трaнcплантации печени.
Манипуляция заключается во введении в вену радиоактивного материала, он оседает через несколько часов там, где имеются изменения костной ткани. Следующий этап проведения процедуры заключается в использовании аппаратуры, фиксирующей все излучения от тела пациента.
На полученном снимке патологии костей скелета рассматриваются как «горячие узлы», но для того чтобы точно установить раковое поражение костей следует провести еще ряд дополнительных обследований.
Видеоролик показывает лапароскопическую биопсию печени, при подозрении на метастазирование:
Диагностика рака печени: основные этапы
Ранняя диагностика рака печени существенно повышает эффективность лечения. Поэтому лицам из групп риска рекомендуется раз в полгода проходить осмотры врача и профилактическое обследование, в состав которого входит УЗ-исследование и определение уровня основного онкомаркера – белка альфа-фетопротеина (АФП).
При появлении подозрительных изменений самочувствия схема обследования включает ряд последовательных этапов.
Осмотр врача-гепатолога
Во время проведения первичной консультации специалист прощупывает границы печени и уточняет характер симптомов. Вслед за этим при необходимости назначается комплекс исследований.
Анализы крови
По данным анализов крови исследуется печеночная функция и определяются уровни онкомаркеров.
Исследование печеночной функции
Определение биохимических показателей – печеночных ферментов, уровня белка и биллирубина – входит в стандартные схемы диагностики, однако не является специфическим методом: печеночная функция может быть нарушена вследствие других причин.
Читать еще: Фунчоза при сахарном диабете
Онкомаркеры рака печени
Как уже говорилось выше, основным онкомаркером при печеночных карциномах является АФП. Стойкое и быстрое повышение уровня альфа-фетопротеина в сочетании с положительными результатами УЗ позволяет с высокой степенью вероятности заподозрить развитие злокачественного новообразования, однако некоторые виды раковых опухолей АФП-негативны.
Как определить рак печени, если онкомаркер АФП находится в пределах нормы, а данные УЗИ и симптомы свидетельствуют о высокой вероятности развития раковой опухоли? В этих случаях могу быть исследованы уровни других онкомаркеров – ферритина и нейротензина.
Рак печени: УЗИ-диагностика
УЗИ – самый простой, безболезненный и абсолютно безопасный для больного метод исследования при подозрении на злокачественное новообразование. Несмотря на то, что УЗИ высокоинформативно, особенно при узловой форме заболевания, его результатов недостаточно для того, чтобы поставить окончательный диагноз.
Можно ли по УЗИ определить рак печени? Так же, как определение АФП и других маркеров, ультразвуковое исследование без проведения комплексной диагностики не может стать основанием для окончательной постановки диагноза.
Поэтому если по результатам осмотра, УЗИ и анализов у врача возникает подозрение на онкологию, больному назначается дополнительное обследование.
Расширенная диагностика рака печени
Для того чтобы подтвердить диагноз, определить тип опухоли и распространенность процесса, а также выявить наличие метастазов врач назначает ряд исследований, комплекс которых подбирается индивидуально для каждого пациента.
Современные методы визуализации
КТ и МРТ. С помощью различных видов томографии уточняется структура, местоположение и форма опухоли, определяются участки тканей с нарушенным обменом веществ.
ПЭТ КТ – комплексное исследование на современных аппаратах последнего поколения, позволяющее отличить злокачественную опухоль от доброкачественной и установить наличие метастазов.
Ангиография. Внутривенное введение контраста с последующими снимками сосудов печени дает возможность определить, насколько близко к ним находятся раковые узлы.
Биопсия при раке печени
Забор фрагментов печеночной ткани для биопсийного анализа может проводиться различными способами, выбор конкретного метода осуществляется с учетом особенностей пациента и новообразования. Чрескожная, тонкоигольная и трaнcвенозная биопсия обычно выполняются под УЗИ или КТ-контролем.
Лапароскопия. Процедypa проводится с использованием специального прибора – лапароскопа, который через небольшие разрезы вставляется в брюшную полость для осмотра поверхности печени, близлежащих органов и лимфоузлов. В процессе лапароскопии также могут быть взяты участки ткани на биопсию.
Как и при диагностике других видов злокачественных опухолей, биопсия позволяет обнаружить раковые клетки, определить их тип и степень дифференцировки (важный показатель, влияющий на прогноз).
Однако в связи с интенсивным кровоснабжением органа, проведение процедуры связано с достаточно высоким риском кровотечений. Поэтому инвазивные методы диагностики применяются нечасто.
Кроме того, при диффузной форме заболевания обычно невозможно определить место забора материала для анализа.
Следует добавить, что выбор наиболее информативных методов диагностики – задача врача. Именно он решает, как выявить рак печени с максимальной точностью, скоростью и минимальными проблемами для каждого конкретного пациента. Поэтому необходимо следовать рекомендациям специалиста, а не пытаться самостоятельно «пройти более точное исследование».
Дополнительная диагностика
При обнаружении новообразования врач по показаниям назначает сцинтиграфию костей и другие дополнительные тесты.
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.
Рак печени трудно распознать. Узнай симптомы.
Рак печени — одна из худших по прогнозам злокачественных опухолей. Печень — это орган с большим функциональным резервом, что означает, что даже после его обширного повреждения он может сохранить свою функцию. По этой причине рак печени в течение длительного времени не вызывает никаких симптомов, одновременно растет и разрушает печень. В частности, люди с циррозом печени и инфицированные вирусами гепатита В и С подвержены риску развития рака печени. Узнайте, как распознать симптомы рака печени.
Рак печени — одна из наиболее распространенных и худших злокачественных опухолей
Рак печени — одна из наиболее быстрорастущих и злокачественных опухолей. Он исходит из гепатоцитов — клеток, которые составляют основную массу паренхимы печени. Рак — это твердая опухоль, которая васкуляризуется кровью из печеночной артерии и окружена мешком соединительной ткани.
Большинство злокачественных опухолей, возникающих в печени, являются последней стадией патологических изменений — острая травма или воспаление печени приводит к хроническому воспалению, что, в свою очередь, приводит к циррозу, на котором образуется рак.
Очень редкая форма рака печени — карцинома — может развиться в здоровой печени молодых людей.
Печень относится к пищеварительной системе и является самой большой железой в организме человека. Она обладает невероятно важными функциями, трaнcформирует многие вещества, обладает детоксицирующими функциями и важными иммунными свойствами. Печень обладает высокой регенеративной способностью, хотя ее постоянный ущерб оказывает крайне негативное влияние на организм.
Рак печени может развиваться из тканей, обнаруженных в печени (первичный рак печени), или быть метастазом злокачественных опухолей других органов (вторичный рак), таких как желудок, поджелудочная железа, легкие, гpyдь или кожа (меланома) .
Наиболее частыми карциномами печени являются гепатоцеллюлярная карцинома (составляет от 80 до 90% первичных злокачественных новообразований печени), и редко появляются карциномы внутрипеченочных желчных протоков. Гепатоцеллюлярная карцинома и внутрипеченочная холангиокарцинома, хотя и во многих отношениях разные, классифицируются в одну группу в официальных классификациях болезней и известны как первичный рак печени.
Хотя первичные опухоли, то есть те, которые развиваются из тканей печени, происходят довольно часто, тогда гораздо больше наблюдается во вторичных опухолях. Печень является органом, в котором часто обнаруживаются метастазы других злокачественных опухолей.
Причины рака печени
Многие факторы — как внутренние, так и внешние — влияют на развитие рака печени. Рак печени является одним из тех видов рака, в котором внешние факторы играют огромную роль. По оценкам, экологические факторы могут способствовать развитию рака даже в 80% случаев. Факторы окружающей среды, то есть внешние факторы включают:
- неправильная диета;
- привычное курение;
- чрезмерное потрeбление алкоголя;
- вирус гепатита В и С;
- воздействие афлатоксинов (токсинов, выpaбатываемых некоторыми грибами);
- шистосомоз;
- инфекция.
С другой стороны, внутренние факторы, ответственные за развитие рака, — это некоторые метаболические заболевания, генетические состояния, первичный билиарный цирроз печени, безалкогольный стеатоз печени.
Процесс рака является сложным и многоступенчатым, он включает в себя многие патогенные реакции, поэтому считается, что на развитие рака печени влияют как внутренние, так и внешние факторы.
Рак печени развивается прежде всего у пациентов с поствоспалительным циррозом, который связан с инфекцией HBV (вирус гепатита B) и / или HCV (вирус гепатита C).
Симптомы рака печени
Печень имеет очень большой так называемый функциональный резерв, что означает, что даже если большая ее часть повреждена, она может сохранить свою функцию. Поэтому развивающийся рак долгое время не может давать никаких симптомов, несмотря на то, что значительная часть печени уже разрушена. Интересно, что в тестах на функцию печени часто нет отклонения от нормы, хотя злокачественная опухоль уже развивается в ткани печени.
Люди с развитием рака печени в течение некоторого времени могут сообщать о неспецифических симптомах (они могут напоминать симптомы многих заболеваний), таких как боли в животе, дискомфорт в области живота и диарея. Тревожным симптомом является прежде всего тяжесть этих симптомов и изменение частоты их возникновения. На начальном этапе развития рак развивается бессимптомно или дает симптомы, которые не очень характерны, часто напоминают симптомы цирроза печени.
На более позднем этапе развития рака заболевание может быть заметным благодаря быстрой и явно ухудшающейся функции печени при желтухе, асците или энцефалопатии (хроническое или постоянное повреждение головного мозга).
Признаки рака печени (обычно на поздней стадии развития):
- тупая, слабая боль в правом боку;
- ощущение полноты в эпигастрии;
- брюшное растяжение и плотный желудок;
- осязаемая опухоль под правой реберной дугой;
- слабость;
- усталость;
- потеря аппетита;
- отек нижних конечностей;
- болезненные мышечные судороги (особенно в ночное время).
Во время развития рака печени могут появляться поражения кожи — дерматомиозит, пемфигус, актинический кератоз, поздняя порфирия. В ходе гепатоцеллюлярной карциномы может быть получены биологически активные соединения, которые могут способствовать развитию паранеопластических синдромов — гипогликемия, гиперхолестеринемии, эритроцитоз, гиперкальциемия.
Симптомы прогрессирующего рака печени включают боль в животе, тошноту, рвоту, лихорадку и потерю веса. Печень также может быть увеличенной, твердой, безболезненной и кусковой.
Рак печени развивается в большинстве случаев у пациентов с циррозом, поэтому симптомы цирроза могут побуждать врача проводить тесты на злокачественность.
Диагностика рака печени
Диагностика рака печени на основе опроса пациентов, медицинского обследования и анализов крови чрезвычайно сложна и во многих случаях невозможна. Основой является ультразвуковое обследование брюшной полости и правильная дифференциация подозрительного узла.
При диагностике рака печени исследования динамической визуализации используются для регистрации характерного положения рака и кровотока в кровеносных сосудах. Обычно используются компьютерная томография или динамический магнитный резонанс с усилением контраста.
В некоторых случаях необходима биопсия печени. Другим лабораторным тестом крови, проведенным у пациентов, подозреваемых в злокачественной опухоли печени, является исследование концентрации α-фетопротеина (AFP) , которое значительно повышается у некоторых пациентов с гепатоцеллюлярной карциномой.
Ни один из лабораторных тестов не гарантирует диагноз рака на ранней стадии. Нет «маркера опухолей» или набора тестов, которые позволили бы раннюю и надежную диагностику рака печени.
Во многих регионах мира была принята стратегия раннего выявления рака печени, включающая систематический надзор за пациентами с повышенным риском этого рака. Наблюдение заключается в проведении ультразвука печени каждые 6 месяцев.
Лечение рака печени
Выбор метода лечения пациента с раком определяется такими параметрами, как размер опухоли, количество поражений и их местоположение, наличие метастазов, функция печени и состояние здоровья пациента.
Основой для лечения рака печени является операция, которая используется только на менее продвинутых стадиях заболевания. Пациенты с небольшими опухолями, жизнеспособная печень и в хорошем общем состоянии имеют право удалять опухоль с соответствующим запасом. К сожалению, всего около 30% пациентов, у которых был диагностирован рак печени, имеют право на хирургическое вмешательство.
У пациентов с более развитой стадией с более чем одним очаговым поражением и с уменьшенной функцией печени можно трaнcплантировать этот орган.
В дополнение к удалению печени или трaнcплантации используется либо внутривенная, либо внутривенная химиотерапия. Этот тип химиотерапии можно сочетать с закрытием сосудов, которые подают кровь в опухоль (так называемая химиоэмболизация).
При лечении рака печени также используются инъекции чрескожного спирта в опухоль , что приводит к разрушению раковых клеток, а также к разрушению опухоли с помощью высокой энергии, получаемой специальной иглой (аблятивные методы). Этот метод включает в себя введение специальной иглы в опухоль и создание сферической области разрушительной энергии.
Читать еще: Алкоголь при панкреатите
В некоторых случаях лучевая терапия используется как форма паллиативного лечения, которая снимает боль, улучшает комфорт жизни и удлиняет ее.
Пациентам с терминальным раком предлагается оптимальный уход, который предназначен для облегчения симптомов и улучшения качества жизни. График лечения включает введение aнaльгетиков, снижение тошноты и других неприятных симптомов.
Раннее выявление рака печени очень важно, потому что только пациенты с опухолью небольшого размера без изменений в сателлите и без метастазов можно лечить с надеждой на более длительную выживаемость.
Прогноз рака печени
Рак печени быстро растет, и, к сожалению, это относительно плохой прогноз. Время удвоения массы опухоли составляет в среднем от 4 до 6 месяцев. Для раннего выявления рака печени, который создает шанс для эффективного лечения, к сожалению, он редко встречается. У большинства пациентов рак обнаруживается случайно во время ультразвука, который обычно проводится по другим причинам.
Судьба пациента зависит не только от самой опухоли, но и от эффективности печени и изменений в других органах. По этой причине, классифицируя стадию рака, очень часто используют так называемую барселонскую классификацию, которая в дополнение к характеристикам самой опухоли (ее размер и количество поражений) также учитывает степень функции печени и общее состояние здоровья пациента.
Согласно барселонской классификации, стадии рака печени можно оценить как:
- очень ранний;
- ранний;
- промежуточный;
- продвинутый;
- терминальный.
По оценкам, пациенты, подвергшиеся частичной печеночной резекции, имеют примерно 25% шансов на выживание 5 лет. Напротив, люди, перенесшие трaнcплантацию органов, имеют 70-80% шансов на выживание 5 лет. Опухоли, обнаруженные на ранней стадии, когда их диаметр не превышает 2 сантиметров, являются наилучшим прогнозом. У людей, у которых был ранний диагноз, имеют 90% шансов на выживание через 5 лет после операции.
Как предотвратить рак печени? Бросьте или уменьшите потрeбление алкоголя, избегайте злоупотрeбления наркотиками и не работайте с токсичными веществами. Сведите к минимуму риск заражения гепатитом HBV и HCV. Делайте защитные прививки против гепатита В.
Рак печени: диагностика и лечение
Рак — это коварное заболевание, часто на начальных этапах его симптомы похожи на другие недуги, что осложняет диагностику. На поздних стадиях лечиться зачастую бесполезно, возможно только облегчить страдания. Для выявления опухолей рекомендована диагностика в клинике рака печени на УЗИ, а также ряд лабораторных исследований.
Таким образом можно определить патологию, пока еще нет метастаз. Постоянное внимание к своему здоровью при имеющихся факторах риска или наследственной предрасположенности сведет к минимуму ущерб для здоровья.
На начальных стадиях диагностика рака печени затруднена, так как симптомы практически не проявляются. Врач не может нащупать опухоль руками или определить при визуальном осмотре.
Но человек, который следит за своим здоровьем, должен обращать внимание на тревожные проявления:
- часто беспокоящее плохое самочувствие,
- внезапно поднимающаяся температура,
- резкое похудение,
- упадок сил, синдром хронической усталости,
- неправильная работа ЖКТ,
- пониженный гемоглобин,
- неприятные ощущения под правым ребром.
На последующих этапах наблюдается увеличение объемов живота, врач может без специального оборудования прощупать опухоль. Есть болевые ощущения в области при пальпации, увеличение железы в размерах проявляется отчетливо.
Когда начинается развитие заболевания, появляется такой признак, как желтоватый цвет кожи. Выявляются последствия печеночной недостаточности, то есть, плохое переваривание пищи, слабость, изменение окраса кала и мочи. Пораженный орган становится плотнее, на его поверхности появляются бугорки.
В случае развития патологического процесса на почве цирроза печени, болезненный процесс идет быстрее и ярче выражается. Побочные действия онкологии усиливаются, пациента мучает озноб, носовые кровотечения, боли в правом боку становятся все сильнее.
Группа риска — ВИЧ-инфицированные, больные с хроническими гепатитами. Если вовремя не были приняты меры или они не дали результатов, начинается метастазирование. Снимок метастазы УЗИ на фото, обычно показывает, что они переходят на непораженные доли железы и ближайшие органы.
Чаще всего встречается поражение карциномой, как она выглядит, можно узнать по изображениям в интернете. Эта онкология образуется из мутировавших эпителиальных клеток, которые вначале перестают выполнять возложенные на них функции, а затем быстро разрастаются.
Анализы крови
Для получения картины заболевания назначают анализ крови при раке печени и первых его симптомах. Необходимо пройти следующие виды исследования биоматериала:
- На онкомаркеры — специфические вещества, присутствующие в крови только у онкобольных.
- Общий — применяется на ранних стадиях.
- Биохимический — врачи изучают активность печеночных ферментов.
После того как будет проведен анализ крови при подозрении на онкологию, полученные показатели смогут указать на патологию. Но поскольку отклонения от нормы возможны и при ряде других заболеваний, нельзя сразу поставить диагноз.
Поэтому если человек знает, печень как проверить, то диагноз сможет поставить только медик.
Даже на ранних симптомах занятия самолечением лишь усугубляют ситуацию.
Общий и биохимический
Опухолевые образования в процессе роста отбирают большое количество питательных веществ у организма. В процессе образования они выделяют различные субстанции, в том числе, токсины. Общий анализ крови при подозрении на наличие опухоли может показать произошедшие в организме изменения.
Онкология нередко вызывает снижение гемоглобина, появление эхиноцитов — измененных эритроцитов. Отравление токсинами также приводит к увеличению скорости оседания эритроцитов, снижению уровня лимфоцитов и увеличению нейтрофилов. Но такие проявления возможны и при других заболеваниях, например, гистиоцитозе, воспалительных процессах.
Биохимический анализ крови при раке или БАК — основной способ выявления нарушений на этапе первичного обследования печени. Функционирование органа оценивается на основе полученной информации об обмене белков, углеводов и жиров. Стандартное исследование включает скрининг с шестью показателями, нормой считаются следующие результаты, выраженные в мкмоль/литр:
- Общий или непрямой билирубин — 3,4 — 17,1 у взрослых и детей, кроме младенцев,
- Прямой билирубин — до 4,3,
- Общая ЩФ — 1-3 паранитрофенола и от 0,5 до 1,3 неорганического фосфора,
- АЛТ — у здорового мужчины от 0,5 до 2, у здоровой женщины 0,5-1,5,
- АсАТ — 0,1-0,45,
- Гамма-глутамил-трaнcпептидаза — у лиц мужского пола: от 15 до 106, норма для дам 10-66.
После биохимии больным с подозрением на злокачественную опухоль часто назначают исследование на онкомаркеры.
Кровь на онкомаркеры
В моче и крови людей, пораженных онкозаболеванием, присутствуют особые белки — онкомаркеры. Их выpaбатывают опухолевые ткани на первичных стадиях заболевания, что делает диагностику возможной, пока нет еще явных признаков болезни и сильного недомогания.
Примерно у 8 из 10 больных анализы при раке печени на ранних этапах показывают повышенный уровень альфа-фетопротеина — онкомаркера данного органа. Норма содержания для взрослых — 15 нг/мл.
Благодаря тому, что каждый белок с высокой степенью точности указывает на очаг болезни, возможна заблаговременная диагностика. Результаты анализа пациент получает через 1-2 дня, за дополнительную плату в частной клинике данный срок сокращают до нескольких часов.
Однако исследование по онкомаркерам не всегда дает достоверную картину нахождения опухоли. Повышение концентрации АФП возможно и при беременности с пороками плода, гепатитах, циррозе.
Анализы мочи
Когда проводится анализ мочи при раке печени, показатели зачастую не могут являться индикатором изменений. Тем не менее, появление крови в урине или кетоновых тел указывает на распад тканей вследствие усиленного катаболизма.
Однако, кетоновые тела могут обнаруживаться и у людей, соблюдающих строгую диету, а также диабетиков. Поэтому данное обследование всегда используется в комплексе с более точными методами диагностики.
Инструментальное диагностирование
Если производится опухоли печени диагностика, часто используют инструментальные способы. Все они основаны на изучении печеночных тканей, которые извлекают различными способами:
- Пункция предполагает введение в полость живота тонкой иглы. Перед процедурой больному делают местную анестезию. Для контроля за перемещением инструмента используют УЗИ либо КТ. Когда игла попадает в ткани опухоли, врач отбирает фрагмент биоматериала для дальнейшего исследования. В интернете есть картинки рак печени, позволяющие пациенту получить представление о болезни. Но распознать онкологию по взятому образцу может только специалист, имеющий необходимый комплект оборудования.
- Эндоскопия печени или лапароскопия производится с использованием специального аппарата — эндоскопа, в который встроена видеокамера. Такие приборы бывают двух типов — жесткие металлические и гибкие, передающие картинку через оптические волокна. Аппарат вводят в организм через естественные отверстия — aнyc или рот. Специалист на экране может увидеть локализацию опухоли и ее величину.
- Если интересует, как диагностировать онкологию путем хирургического вмешательства, то в данном случае применяется биопсия. Медик производит взятие нескольких частиц новообразования, число которых зависит от имеющихся очагов. Взятый материал отправляют на лабораторное исследование.
Ультразвуковая диагностика
Новообразования в печени УЗИ показывает с достаточно высокой точностью и считается основным способом исследования больного органа. Диагностика ультразвуком дает шанс определить размеры новообразования, локализацию, является ли оно злокачественным.
Чтобы не спутать онкологию с другими болезнями, имеющими близкие симптомы, проводят пункцию. Это действие возможно без травмирования кожных покровов.
Ультразвуковое исследование основано на распространении звука на определенной частоте. Она не входит в диапазон слышимых человеком частот, но при компьютерной обработке отраженных звуковых колебаний можно отобразить картину болезни в случае опухолевого процесса. Как выглядит рак УЗИ фото, позволит узнать сонограмма — полученное в результате процедуры изображение больной печени.
Многие интересуются, по исследованиям можно ли определить на УЗИ точное нахождение опухоли. Даже при проведении биопсии используется УЗИ-аппаратура, чтобы врач мог попасть иглой в нужное место органа. Повторное проведение процедуры позволяет отслеживать эффективность применяемого лечения. Ультразвуковое исследование недорого, аппараты имеются в каждой больнице.
На вопрос, показывает ли УЗИ рак печени, стоит ответить, что имеет значение способ проведения операции и квалификация медика. На результат влияет дислокация оборудования и датчиков. Полученные в другой клинике показатели могут отличаться, поэтому нельзя назвать их точными на 100 процентов.
Магнитно-резонансная томография
Дорогостоящая процедypa, которая проводится далеко не в каждом медучреждении. Обычно аппарат устанавливают в частных клиниках, а оплатить процедуру сможет не каждый. Но она совершенно безболезненная, разрешена для беременных, не имеет побочных эффектов.
Используя МРТ, можно на любых стадиях заболевания точно определить наличие онкологии. Но не все могут пройти такое обследование. Его не переносят люди с клаустрофобией, также оно не подходит тучным пациентам, которые просто не помещаются внутрь аппарата.
Компьютерная томография
Это безболезненная процедypa, заключающаяся в использовании контрастного вещества, видимого приборами.
Пациент принимает специальный препарат, благодаря которому становятся отчетливо видны контуры органов.
Таким образом, при помощи КТ рак печени можно точно выявить, при этом оценив размеры опухоли и ее расположение относительно кровеносных сосудов.
Аппарат даст не плоскую картинку, а совокупность изображений срезов тела человека.
Ангиография
Это методика, действие которой осуществляется за счет введения контрастного вещества, содержащего йод. Она используется при рентгенологических исследованиях, компьютерной томографии и МРТ. При проведении рентгена или других обследований, врач модулирует вид органа в трехмерном изображении. По расположению кровеносных сосудов судят, в какой степени поражен орган, имеются ли опухоли.
Читать еще: Дексаметазон таблетки — официальная инструкция по применению
Это обследование помогает при предстоящем планировании операции, в том числе, эмболизации. При кровотечениях, которые могут быть побочным эффектом при раке печени диагностике крови методом ангиографии, используют медикаментозные способы остановки крови. В кровоточащий сосуд вводят вазопрессин или эмболы, вызывающие его закупоривание.
Биопсия печени
Назначается при повышенном содержании печеночных онкомеркеров. Процедypa позволяет определить структуру печени и степень поражения, а также точно узнать, является ли опухоль злокачественной. Проведение биопсии имеет определенную степень риска, связанную с большой концентрацией кровеносных сосудов в печени. Многие пациенты жалуются на болевые ощущения при проведении биопсии.
Также есть следующие риски:
- при попадании заборного инструмента в сосуд возможно кровотечение,
- прокол кишечника, легкого или желчного пузыря иглой,
- попадание болезнетворных микробов внутрь организма.
После процедуры важно, чтобы больного трaнcпортировали из больницы. Вернувшись домой, нужно до следующего дня соблюдать пocтeльный режим. В течение недели нельзя носить тяжести, заниматься физическими нагрузками. Результаты обследования будут готовы через 7-14 дней.
Симптомы и лечение рака печени.
Правильная диагностика рака печени на разных стадиях
Распознать рак печени на ранних стадиях удается в редких случаях. Часто заболевание диагностируется, когда пораженный орган выходит за нормальные пределы или опухоль достигает значительного размера. Однако следует знать, как определить рак печени, каковы признаки начала развития опухоли и провоцирующие факторы.
Особенно это важно тем, кто имеет наследственную предрасположенность к онкологическим заболеваниям или входит в группу риска.
Провоцирующие факторы: кому следует внимательнее относиться к своему здоровью?
Существует две формы рака печени: первичный и вторичный. Онкологическое заболевание первичной формы сопровождается мутацией клеток и преобразованием здоровых тканей органа в патологические. На такие случаи приходится около трех процентов всех диагностированных злокачественных новообразований.
Большинство заболеваний развивается по причине распространения раковых образований в другие (чаще, соседние) органы — это вторичное раковое заболевание печени.
Основными причинами возникновения опухоли являются две группы факторов, исходящие из классификации заболевания. Внешнее или внутренне влияние на печень нeблагоприятных условий провоцирует процесс перерождения клеток в атипичные, так возникает первичный рак.
Основным фактором развития вторичной формы заболевания являются метастазы, которые распространились на печень.
К причинам возникновения онкологического заболевания, на основании которых можно выделить группы риска, медики относят:
- Вялотекущие патологии печени. К раковым опухолям могут привести длительное носительство гепатита С, механические повреждения желчных протоков камнями и песком, например, при желчекаменной болезни, сифилис и прогрессирующий цирроз печени.
- Долговременное воздействие на орган токсических веществ. В группу риска входят лица, неумеренно употрeбляющие спиртосодержащие напитки, работники вредных производств (особенно, пренебрегающие мерами безопасности), курильщики, наркоманы с многолетним стажем. Негативным образом влияет на печень злоупотрeбление генномодифицированными продуктами питания.
- Переизбыток железа в организме. Бесконтрольный прием определенных железосодержащих БАДов и, казалось бы, совершенно безобидных витамин без необходимости (при достаточном уровне железа) может стать причиной возникновения онкологических заболеваний.
- Гельминтозы. К перерождению клеток в злокачественные приводят вялотекущие воспалительные процессы, обусловленные продуктами жизнедеятельности плоских червей— трематод, паразитирующих в печени и желчных путях организма человека. Основным источником заражения гельминтами, как правило, являются недостаточно термически обработанная рыба и рыбные продукты.
- Оральные пpoтивoзaчaточные средства. Контрацептивны содержат эстроген, способствующий развитию новообразований доброкачественного характера. Такие новообразования со временем могут преобразоваться в злокачественные. Фармацевтические препараты.
- Многие лекарства (в том числе средства на основе растительных компонентов и антибиотики) обладают гепатотоксическим действием.
- Наследственная предрасположенность. Механизмы наследования онкологических заболеваний полностью не выяснены, однако ученые полагают, что риск развития злокачественных образований несколько выше у тех пациентов, чьи близкие родственники перенесли подобную патологию.
Помимо того, в группу повышенного риска входят мужчины, заболеваемость среди которых значительно выше, чем у женщин, а также пациенты с диагнозом “сахарный диабет”.
Признаки рака: как проявляется онкологическое заболевание?
Выделяют четыре стадии развития рака печени. Конкретные признаки развития новообразования на каждом из этапов находятся в прямой зависимости от сопутствующих заболеваний, однако возможно выделить и общие симптомы, появление любого из которых — уже повод обратиться к врачу.
Для пациентов, которые внимательно относятся к собственному здоровью, прогноз пятилетней выживаемости составляет около 56% случаев.
Первая стадия онкологического заболевания
Признаки первой стадии развития рака печени легко спутать со многими другими патологическими процессами. Пациенты, которые списывают слабость на стрессы, а боли в животе на бaнaльное переедание или неправильное питание, редко обращаются к врачу для установления точного диагноза. А ведь такое промедление часто может стоить нескольких лет жизни.
С какими симптомами стоит пройти обследование, чтобы исключить онкологию или своевременно начать лечение?
Рак печени на первой стадии развития проявляется преимущественно неспецифическими симптомами. К таким признакам относятся слабость, апатия, повышенная утомляемость (как физическая, так и умственная), низкая способность к концентрации, недостаточная работоспособность, отсутствие аппетита, анемия.
Время от времени у больных наблюдаются субфебрильная температура, дискомфорт в правом подреберье и расстройства пищеварения. К специфическим признакам, позволяющим определить заболевание на ранней стадии, относятся увеличение печени, скопление свободной жидкости в области брюшной полости, кровотечения, желтуха.
Для своевременной диагностики рака печени желательно проходить регулярное профилактическое обследование. Врач может заподозрить онкологическое заболевание и назначить дополнительные исследования по нeблагоприятным результатам УЗИ и исследования крови.
Вторая стадия рака печени
При отсутствии терапии и продолжающемся воздействии негативных факторов риска опухоль быстро прогрессирует. Симптомы, которые характерны для начальной стадии рака, с течением времени усиливаются. Учащается периодичность и повышается интенсивность болезненных ощущений в области правого подреберья, дискомфорт распространяется на поясницу.
Усугубляются проблемы с пищеварением:
- появляются тошнота;
- периодическая рвота;
- диарея (жидкий стул);
- усиленный метеоризм;
- вздутие и дискомфорт в животе;
- потеря аппетита.
Характерно быстрое и сильное похудение. У многих пациентов отмечается реакция на вредные вещества, которые выpaбатываются новообразованием, проявляющаяся в виде повышения температуры до 38 градусов и более.
Третья стадия развития новообразования
Диагностика рака печени в большинстве случаев, как правило, происходит именно при третьей стадии течения заболевания, когда признаки патологии становятся еще более очевидными, ярко выраженными. Симптомы онкологии четко определяются, в том числе и самим больным.
К основным признакам третьей стадии рака печени относятся:
- болезненное увеличение печени, которое обнаруживается при пальпации;
- ощущение распирания в животе, вызванное разрастанием опухоли;
- периодическая желтуха, причиной которой является уменьшение пропускной способности желчных путей;
- кровотечения (также носовые) вследствие хрупкости сосудов;
- наличие свободной жидкости в брюшной полости — асцит;
- отеки, возникающие в результате нарушения нормального оттока жидкости;
- недостаточность функциональной способности печени;
- сосудистые звездочки или сеточки, которые не сопровождаются воспалительным процессом;
- нарушения работы эндокринной системы.
Также у больных отмечается ухудшение общего самочувствия и усиление интенсивности болевых ощущений.
Рак печени четвертой стадии
Лечение при диагностировании четвертой стадии онкологического заболевания является лишь симптоматическим, т.е. максимально улучшающим качество жизни больного. Раковое образование в печени на таком этапе представляет собой необратимое состояние, предполагает бесконтрольную и атипичную мутацию нормальных клеток.
К предыдущим симптомам прибавляются очаги поражения в соседние органах.
Признаки вторичного рака печени
Вторичный рак печени возникает, как правило, в результате поражения соседних органов. Нередко распространение метастаз от поджелудочной железы, органов желудочно-кишечного тракта и молочных желез. Признаки онкологического заболевания проявляются также, как и при первичном раке печени.
Методы диагностики рака печени: как определить наличие и характер опухоли?
Как определить рак печени? Диагностика онкологического заболевания начинается с опроса пациента, выявления косвенных признаков рака и безинструментального осмотра живота (пальпации и перкуссии — простукивания больного органа пальцами). В дальнейшем предварительный диагноз подтверждается или опровергается рядом дополнительных исследований.
Лабораторный анализ крови
Первое, что позволит подтвердить наличие патологического процесса, — это лабораторный анализ крови.
При онкологических заболеваниях в разы повышается скорость оседания эритроцитов. Однако как однозначное подтверждение рака печени, этот показатель расценивать не стоит — СОЭ повышается при любых бактериальных инфекциях, вялотекущих заболеваниях или острых воспалительных процессах, а также во время мeнcтpуации у женщин.
Подобным неспецифическим признаком является сниженное количество лейкоцитов.
Самым современным методом исследования крови при подозрении на онкологию является анализ на альфа-фетопротеин. Любое повышение концентрации этого белка указывает на патологию, и в большинстве случаев речь идет именно о раке печени.
Ультразвуковая диагностика
Обычное УЗИ часто применяется как самый доступный метод диагностики, но вместе с тем высока вероятность, что небольшая опухоль будет не обнаружена. Однако при ультразвуковом исследовании заметны увеличение размеров и изменение структуры печени, что может указывать на онкологическое заболевания.
УЗИ используется преимущественно кв ходе профилактического обследования, при подозрении на рак печени проводятся более информативные исследования.
КТ и МРТ печени
Компьютерная и магнитно-резонансная томография назначаются пациенту для подтверждения и корректировки диагноза. Метод КТ позволяет получить данные о размерах, локализации и типе новообразования, а при введении контраста врач также может оценить структуру опухоли. В некоторых случаях представляется возможным определить характер образования.
МРТ принципиально ничем не отличается от компьютерной томографии, однако вместо рентгеновского облучения применяются более безопасные для организма радиоволны. При этом магнитно-резонансная томография переносится некоторыми пациентами несколько тяжелее, чем КТ.
Биопсия и лапароскопия
Методы диагностики применяются с целью определения характера новообразования. Биопсией называют забор небольшого фрагмента ткани, вызвавшей у врача подозрение на раковое образование в печени, для последующего гистологического исследования. Во время проведения процедуры в области брюшной полости специальной иглой делается прокол.
Чаще всего биопсия проводится с применением методик УЗИ или КТ, что дает возможность взять образец для гистологии именно из мест видимого патологического изменения тканей.
Лапароскопия позволяет не только взять небольшой фрагмент печени для исследования, но и провести осмотр больного органа, оценить функциональное состояние печени, подобрать план дальнейшего хирургического лечения.
При лапароскопии в небольшой разрез в брюшной полости вводится гибкий инструмент, оборудованный микроскопической камерой, картинка передается на монитор в режиме реального времени.
Другие методики
В ходе диагностики ракового образования в печени могут применяться альтернативные вышеуказанным методы определения злокачественных новообразований, обследование сосудов с применением контраста и рентгена, сканирование костей, которое проводится при подозрении на метастазы и так далее.
Диагноз “рак печени” подтверждается не одним исследованием, ведь тщательная диагностика дает возможность подобрать эффективное лечение. Индивидуальный алгоритм диагностики и схему терапии для каждого конкретного пациента подбирает врач.
Мы будем очень благодарны, если вы оцените ее и поделитесь в социальных сетях
Важно знать родителям о здоровье:
FitoSpray для похудения (Фитоспрей)
FitoSpray для похудения ( Фитоспрей) FitoSpray — спрей для похудения Многие мечтают похудеть, стать стройными, обрести фигуру мечты. Неправильное питание,…
28 02 2023 2:43:38
Фитостеролы в продуктах питания
Фитостеролы в продуктах питания Фитостерины Существует много питательных веществ, которые, как утверждают исследователи, могут положительно повлиять на…
27 02 2023 17:38:38
Фитотерапевт
Фитотерапевт Фитотерапевт Я, Ирина Гудаева — травница, массажист, ведущая семинаров по созданию натуральной косметики и курса « Практическое травоведение»…
26 02 2023 19:55:55
Fitvid
Fitvid Брекеты: минусы, трудности, проблемы Брекет-системы помогли избавиться от комплексов миллионам людей. Это действительно эффективный инструмент,…
25 02 2023 12:55:12
Фониатр
Фониатр Фониатрия – один из разделов медицины. Фониатры изучают патологии голоса, методы их лечения, профилактики, а также способы коррекции…
22 02 2023 19:55:28
Форель
Форель Форель относится к отряду лососеобразных, семейству лососевых. Ее тело удлинено, немного сжато с боков, покрыто мелкой чешуей. Замечательной…
21 02 2023 13:39:20
Формула идеального веса
Формула идеального веса Калькулятор нормы веса Вес 65 кг относится к категории Норма для взрослого человека с ростом 170 см . Эта оценка основана на…
18 02 2023 7:59:53
Формулы расчета идеального веса
Формулы расчета идеального веса Фoрмулa «идeальнoго вeса» То, что ожирение шагает семимильными шагами по планете – это факт. И, несмотря на то, что…
17 02 2023 14:55:18
Фосфатида аммонийные соли
Фосфатида аммонийные соли Аммонийные соли фосфатидиловой кислоты ( Е442) Е442 – это пищевая добавка, которую относят к категории эмульгаторов. Вещество…
16 02 2023 9:29:15
Фототерапия новорожденных
Фототерапия новорожденных Фототерапия новорожденных Применение фототерапии для новорожденных С момента своего рождения организм ребенка начинает адаптацию…
15 02 2023 17:19:39
Фототерапия новорожденных при желтухе
Фототерапия новорожденных при желтухе Фототерапия новорожденных После появления ребенка на свет его организм адаптируется к совершенно иным условиям…
14 02 2023 19:26:17
Французская диета
Французская диета Французская диета Эффективность: до 8 кг за 14 дней Сроки: 2 недели Стоимость продуктов: 4000 рублей на 14 дней Общие правила…
13 02 2023 23:45:15
Фрукт Кумкват — что это такое?
Фрукт Кумкват — что это такое? Фрукт Кумкват — что это такое? Впервые упоминают необычный для европейцев фрукт китайские летописи 11 века. Португальские…
12 02 2023 9:59:14
Фруктовая диета
Фруктовая диета Фруктовая диета Эффективность: 2-5 кг за 7 дней Сроки: 3-7 дней Стоимость продуктов: 840-1080 рублей в неделю Общие правила Фруктовая…
10 02 2023 18:21:12
Фруктоза при диабете
Фруктоза при диабете Можно ли фруктозу при сахарном диабете? Для многих диабет является той проблемой, которая вносит в жизнь ряд ограничений. Так, к…
07 02 2023 22:34:32
Фрукт свити – польза и вред
Фрукт свити – польза и вред Свити — что это за фрукт? Что такое свити? Продолжаем разбирать цитрусовые, но как всегда идем не по верхам, а копаем глубже и…
04 02 2023 18:15:18
Фрукты и ягоды
Фрукты и ягоды Разница между фруктом и ягодой Фрукты и ягоды любят практически все. Ведь они такие вкусные и полезные! Мы любуемся лежащими на столе…
03 02 2023 20:40:24
Фтизиатр
Фтизиатр Врачи фтизиатры Москвы Фтизиатр — это дипломированный специалист в области фтизиатрии. Он специализируется на профилактике, диагностике, лечении…
01 02 2023 9:36:13
Фтор в организме человека
Фтор в организме человека Фтор в организме человека Дневная норма потрeбления Мужчины старше 60 лет Женщины старше 60 лет Беременные (2-я половина)…
31 01 2023 2:28:26
Боли в спине после рождения ребёнка
Боли в спине после рождения ребёнка Почему после родов болит спина У мамочек нередко болит спина после родов. Причем, дискомфорт может длиться довольно…
28 01 2023 4:11:11
Фунчоза: польза и вред
Фунчоза: польза и вред Фунчоза: польза и возможный вред Увлечение восточной кухней год от года растет. Принято считать, что такой рацион полезен для…
27 01 2023 0:57:58
Фундук
Фундук В рационе здорового человека обязательно присутствуют орехи в различных вариациях. Среди них выгодно выделяется фундук. Высокая пищевая ценность и…
26 01 2023 19:22:37
Фуросемид таблетки инструкция по применению
Фуросемид таблетки инструкция по применению Инструкция по применению: Цены в интернет-аптеках: Фуросемид – синтетическое диуретическое лекарственное…
23 01 2023 17:20:57
Галактоза
Галактоза Галактоза – это представитель класса простых молочных сахаров. В человеческий организм поступает преимущественно в составе молока,…
22 01 2023 22:31:38
Галанга
Галанга С древних времен растения играют важную роль в жизни человека, в том числе и для поддержания здоровья. Некоторые травы известны как лучшие…
21 01 2023 14:31:51
Галега лекарственная
Галега лекарственная Галега лекарственная (Galega officinalis) Син: козлятник лекарственный, козлятник аптечный, козья рута, французская сирень, солодянка…
20 01 2023 13:28:34
Боли в суставах при беременности
Боли в суставах при беременности Боли в суставах при беременности В период беременности у женщины могут возникать различные боли в самых разных местах….
17 01 2023 21:17:40
Гастрит и изжога
Гастрит и изжога Лучшие лекарства от изжоги и гастрита Многие пациенты с гастритом и другими заболеваниями Ж К Т страдают от изжоги. Данный симптом может…
16 01 2023 0:34:31
Где находится ключица у человека на фото?
Где находится ключица у человека на фото? Ключица человека: анатомия, строение, функции Ключица – это единственное костное образование в теле человека,…
13 01 2023 16:52:36