В древние времена считалось, что все состоит из земли, воды и воздуха, другого — нет. И сравнительно недавно люди смогли показать всю составляющую нашего мира. Важным вопросом было: что из себя представляет вещество?
Вещество — это материя, которая есть во всех физических телах на нашей планете.
Оно может быть простым и сложным.
Различие этих двух групп состоит в том, что простые вещества состоят из одного вида атомов, а сложные — из нескольких, поэтому впервые в ходе реакций не могут раскладываться на другие атомы, как это делают вторые.
Образцом сложного вещества можно назвать воду (H2O). Если провести химическую реакцию, то оно образует 2 элемента — водород (Н) и кислород (О). То, что получилось, — простые вещества, без последующего разложения.
В 19 веке считалось, что сами элементы не поддаются изменениям и независимы от объединения. Но такие высказывания были опровергнуты русским химиком Дмитрием Ивановичем Менделеевым, который доказал обратное, при этом указав на то, что качественная характеристика каждого элемента влияет на его атомный вес, из-за чего происходит повтор их свойств. Это умозаключение он олицетворил в своей периодической системе, назвав в честь себя.
Атом
Атом — мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества — это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
- Масса;
- Размер;
- Физические хар-ки;
- Химические хар-ки;
- Энергия;
- Вес атома.
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома — ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия — 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы — химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
Элементарные частицы
Протоны, нейтроны
Протоны — положительно заряженные части ядра. Заряд равен заряду электрона. Вес составляет 0,0625 грамм.
Нейтроны — нейтральная часть ядра. Чтобы узнать их значение, нужно из атомного веса элемента вычесть значение протонов (= электронов).
Поскольку электроны отделены от своих “напарников”, кружась вокруг них, стоит уделить им отдельное внимание.
Электроны
Электроны — частицы, у которых самый маленький отрицательный электрический заряд.
До настоящего времени считалось, что атомы, разложенные из элементов, являются конечным продуктом. На сегодняшний день эта мысль была развеяна учеными, которые доказали, что даже эти разложенные атомы содержат в себе крохотные молекулы.
Обратимся к одной из гипотез, объясняющую вещественную структуру. Там говорится, что элементный атом — некая совокупность, где есть центр, вокруг которого происходит вращение других крупинок.
Начнем с рассмотрения окраин центра, а именно с электронных уровней и электронов.
Как и говорилось ранее, значение электронов такое же, как и у протонов.
Их можно сравнить с шаром , а диаметр 40-13 сантиметров (что доказывает свою мизерность по сравнению с обычными атомами).
Электроны способны находиться в бездействии. Их масса при этом составляет 91-27 грамм. Это подчеркивает скудность инертных свойств, благодаря которым электроны способны быстро вращаться вокруг свой оси.
Масса электрона зависит от его скорости. Поговорив про массу “покоя”, которая есть у всех тел на Земле, нужно посмотреть и на массу “скорости”. Когда электрон занимается перемещением, то он образовывает электромагнитное поле. Оно играет большую роль, ибо именно из-за проявления ее инертных свойств набирается масса и энергия, передавая это все частицам. Сделаем вывод, что ускоренный динамизм этой частицы, приводит к набору его веса.
Но перемещение электронов не происходит ровно. Научно доказано, что эти частицы двигаются волнообразно из-за интерференции и дифракции.
Интерференция электронов — слияние нескольких волн электронов.
Дифракция электронов — волновое обтекание области места, через которое проходит ток.
Помимо того, что электроны двигаются волнами, так еще они крутят вокруг самих себя. Крутящееся и волновое движение говорит о нем (электроне) как о некоем магните.
Все три вида элементарных частиц фигурируют в постоянном обменивающемся контакте. Между электроном и протоном возникает связь, заставляющая их содействовать, поскольку их заряды противоположны, а вот две одинаковые частицы (например, два электрона) отталкиваются, т.к. заряды одинаковы (так же и у протона).
Нахождение частиц у элемента
Найти у какого-либо элемента эти частицы несложно. Разберем это на примере алюминия (Al).
Его порядковый номер — 13, соответственно, это есть ядро. Атомная масса алюминия составляет 26,98154 (значение округляется, поэтому 27). Протоны равны массе заряда (р=13), так же и электроны (е=13). Чтобы узнать значение нейтронов, нужно из атомной массы вычесть значение заряда ядра (n=27-13=14).
Взаимосвязь частиц
Каждая частица имеет свое электрическое поле, через которое оно “соприкасается” с остальными. Такие поля можно обозначить определенной материей, в которой, помимо этих частиц, есть и другие, наполняющие эту материю — фотоны.
Фотон — частица, не имеющая массы. Является переносчиком электромагнитного “общения”.
Все они имеют конкретный запас энергии. Именно через фотоны происходит коммуникация частиц. В такой связи происходит “бартер” фотонами, что служит для хорошей энергетической силы, то есть взаимосвязи частиц.
И в самом ядре происходит “общение” протона и нейтрона, но здесь уже нет электрического поля, поскольку нейтрон его не образовывает. Здесь все проходит при помощи особого поля, исходящего от ядра.
Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
Мезон — частица, которая способствует взаимодействию протонов и нейтронов, а также влияет на то, чтобы эти частицы оставались в ядре.
Благодаря мезонам, протоны и нейтроны способны внутри своего ядра передавать определенную информацию путем ядерной силы. Ее работа в ядре происходит на определенной дистанции (приблизительно сантиметров).
Ядерная сила — сила влияния протона и нейтрона друг на друга.
Ядерные силы, происходящие внутри ядра, способны делать из протонов нейтроны и наоборот при помощи мезонов.
Можно сказать, что ядерные силы намного мощнее электрических, но вместе они не дают протонам выйти за границы ядра. Несмотря на то, что частицы сопротивляются, объединение двойной силы подавляет их, при этом создавая крепкое ядро. Из-за них и зависит его прочность.
Все три частицы называются элементарными, потому что их невозможно разложить на другие упрощенные элементы, но они могут становиться и образовываться друг из друга.
Химическое строение атомов
Работа электрона
Структура водорода (Н) заслуживает внимания. Это единственный элемент, который содержит в себе две частицы — один протон, находящийся в ядре, и один электрон, вращающийся вокруг него. Но даже тут есть нюанс: у электрона нет определенного барьера, отгораживающего его от окружающей среды.
Путь электрона вокруг ядра достаточно пластичен и поддается изменениям (причиной может стать увеличение массы электрона). А поскольку в ядре и на оболочке противоположно заряженные частицы, то они имеют свойство присоединяться. Но есть один момент: когда отрицательно заряженная частица облетает ядро, то образовывается центробежная сила, которая пытается максимально отдалить частицу. Все эти моменты создают спорную ситуацию.
Самое важное, чтобы была стабильность, тогда электрон будет спокойно находиться на своем месте. Поскольку вес орбитальной частицы небольшой, то для стабилизации ему придется летать возле ядра намного быстрее (примерно 60 15 облетов).
Получается, что электрон водорода (Н) находится неподалеку от протона, сохраняя минимум своей энергии. Но если какая-либо частица вторгнется в данную схему, и водород (Н) отдалится от ядра, то его энергия станет больше, но не надолго. Дело в том, что электрон все равно будет пытаться вернуться на место, приближенное к ядру. Электрон таким действием (переходом на другую орбиту) предоставил определенную часть своей энергии — лучистой энергии.
Если электрону дадут энергию, то он перейдет на другое место (чем больше энергии, тем дальше от протона). При этом, когда он будет возвращаться к ядру, то будет происходить активная выработка электромагнитной энергии с последующем излучением.
Когда ученые наблюдали за такими переходами этой частицы, они сделали вывод, что как и в любом элементе, так и в водороде (Н) электрон может совершать отойти только на конкретный круг, опираясь на полученное извне питание.Слои, на которых электрон способен перемещаться, называют дозволенными.
Работа протона и нейтрона в ядре
Как говорилось ранее, протон и электрон водорода (Н) — разноименные и аналогичные по значениям, поэтому их совместный заряд составляет — ноль. Из этого выходит, что водород (в обычном его состоянии) — нейтральная частица.
Такой вывод относится ко всем элементам из таблицы Менделеева. Все их атомы в нормальном состоянии нейтральны из-за равновесия разных зарядов.
Вернемся к ядру водорода (Н). Известно, что в нем находится только один протон. Обратимся к массе ядра.
Масса ядра — общее число протонов и нейтронов внутри ядра. Ее можно найти у всех элементов периодической таблицы.
Согласно этому, масса ядра водорода тоже будет составлять один (так как есть 1 протон и полностью отсутствуют нейтроны).
Что говорилось выше, относилось к природному водороду (Н), равному единице. Но существует еще и тяжелый водород (Н) — он же изотоп дейтерий (2H, имеет название тяжелого водорода). Масса равна двум. Если в ядре простого водорода (Н) всего лишь один протон, то у дейтерия — дейтоны.
Дейтон — объединение протона и нейтрона в ядре.
Водород и его изотопы
В природе обычный водород (Н) может вмещать в себя дейтерий, но в очень маленьком количестве (на 6 000 атомов Н один 2H). Но есть еще более тяжелый изотоп водорода (Н) — тритий (³Н, сверхтяжелый водород). В его ядре уже не одна, и не две частицы, а три — два нейтрона и один протон, между которыми есть ядерная сила. Масса трития составляет три. Получается, что он в целых три раза превосходит самый легкий водород.
Несмотря на то, что вес водорода и его изотопов различается, их объединяют некоторые общие свойства. Например, если самый простой водород (Н) вступит в связь с кислородом (О), то получится вода (Н2О). То же самое происходит и в цепи дейтерия ( 2H) и кислорода (О). У этого изотопа тоже на выходе получается вода, но тяжелая, которая пользуется спросом в производстве атомной энергии.
Читайте про свойства магнитного поля.
Из примера можно сделать вывод, главную роль в химических свойствах играет электронная оболочка и ее устройство, а не массу ядра. Водород и его изотопы несут в себе разную массу, но общее у них — это электроны возле ядра, которые и сохраняют идентичные свойства.
Водород (Н) взял первое место в менделеевской таблице. Такое решение было неслучайным. Как мы знаем, порядковый номер напрямую зависит от числа заряда ядра. То же самое и у водорода (Н) (номер в таблице — один = заряд ядра — один). Если правильно сказать, то: всякое вещество, занимающее место в периодической таблице Менделеева, имеет свой порядковый номер, соотносящийся заряду ядра и числу электронов на его оболочках.
Из всего сказанного получается, что водород (Н), занимающий первое место, имеет заряд ядра — +1 и один электрон на орбите.
Гелий и его изотопы
На втором месте в таблице стоит гелий (Не). Как и говорилось ранее про все элементы, его номер и заряд ядра однозначны, поэтому второй будет равен +2 (внутри ядра два протона), а оболочка будет содержать два электрона.
Как и все составляющие таблицы, гелий (Не) имеет изотопы. Их целых девять, но самыми стабильными из них считаются легкий и тяжелый, поэтому ими пользуются чаще. Рассмотрим первый.
Легкий гелий (³Не, еще имеет название гелион). Масса его ядра составляет 3, состоит из двух протонов, одного нейтрона и трех электронов на оболочке. Считается, что содержание гелиона в природном гелии 1/1 000 000 тяжелого гелия. Выводится искусственным путем.
Тяжелый гелий (⁴Не). Считается самым востребованным из всех изотопов гелия (Не). Ядро содержит два протона и два нейтрона, а на орбитах расположены четыре электрона.Образовывает около 99% гелия на нашей планете. Есть забавный факт про это вещество: если охладить его (-271 ºС) и поместить в открытую емкость, то этот изотоп вытечет из нее.
Затруднение состава атома в элементе обусловлено возрастанием объема элементарных частиц: протонов и нейтронов в ядре и электронов на оболочке. При помощи таблицы Менделеева можно узнать все эти необходимые данные об элементе (а именно про частицы).
В науке доказано, что легкие элементы имеют большое преимущество: их ядра, содержащие одинаковое количество протонов и нейтронов, считаются самыми крепкими, поскольку ядерная сила превышена, чем у остальных. Рассмотрим тяжелый гелий (⁴Не). В его составе располагаются два протона и два нейтрона, соответственно, у него неплохая прочность, точно так же, как и возникающая сила ядра.
Такие тяжелые вещества содержат разное количество частиц (протонов, нейтронов и электронов), из-за чего в ядре контакт между ними теряется, чего не происходит в легких. В тяжелых элементах возможно расщепить их ядра при разрыве атомных бомб.
Радиоактивные элементы
У тяжелых элементов есть и подразделение радиоактивных. Они отличаются тем, что их ядра настолько непрочны, что они способны самостоятельно расщепляться на отдельные частицы. Радий (Ra) — самый известный радиоактивный химический элемент. Его порядковый номер — 88. Масса атома равна 226 (если быть точнее, то 226,025).
Состав протонов в ядре — 88, а нейтронов — 138. Все они занимаются распадом, где позже они трансформируются в атомы радона (Rn, радиоактивный газ, номер в периодической таблице — 86). Все происходит точно так же: атомы радона (Rn) занимаются распадом, после чего тоже преобразовываясь в другие элементы.
Электронные оболочки
Электронные оболочки — это тоже важная часть, без которой представление какого-то химического элемента просто не было бы. Как было рассмотрено ранее, электроны единственные, кто размещен за ядром, при этом крутится вокруг него, собираясь определенными группами по разным “отсекам”.
Познание с ядрами и их частицами подошло к концу, поэтому теперь стоит уделить внимание тому, что находится за пределами этой главной точки.
Нахождение электронных оболочек и его содержимого
Чтобы определить количество электронных слоев элемента, нужно обратиться к его номеру периода. Например, алюминий (Al) с порядковым номером 13, находится в третьем периоде, поэтому число его слоев равно 3.
Еще одной удивительной характеристикой оболочек является закрепленное число электронов, которые могут находиться на слое. На первой орбите могут расположиться два электрона, на втором — восемь, на третьем — 16 и т.д. (с каждым разом нужно умножать на четыре).
Завершенным считается тот слой, который достиг окончательного предела. Электроны, которые расположены дальше всего от ядра, более активны, поэтому предпочитают вступать в контакт с другими атомами (научно это можно назвать валентностью). Число электронов на внешней оболочке зависит от номера группы. Например, бор (В) имеет заряд — +5, он находится во втором периоде, поэтому количество электронных слоев равно двум. Первый слой равен двум, а второй — трем, поскольку бор (В) находится в 3 группе.
Когда электронный слой полностью заполнен, то он считается стабилизированным. Это говорит о том, что атому не требуется брать дополнительные силы (электроны) из окружающей среды или других веществ. Если взять гелий (Не), у которого два электрона, находящиеся на одной оболочке, а у неона (Ne) электронов десять, располагающиеся на двух электронных слоях(на первом — 2, на втором — 8). Из этого выходит, что и гелий, и неон полностью заполнены, поэтому они не нуждаются в посторонней помощи, так как их оболочки завершенные. Такие элементы являются инертными в химическом плане (не идут на контакт с другими элементами, чтобы “занять” или “обменяться” этими частицами).
Но таких самодостаточных элементов достаточно мало, больше всего тех, где на внешней оболочке будет не хватать электронов, поэтому такие элементы охотнее прибегают к воздействию с другими. Калий (К) имеет 19 электронов, находящихся на четырех слоях (первый — 2, второй — 8, третий — 8, четвертый — 1). Больше всего интересует последняя оболочка. Поскольку там всего лишь один электрон, который очень далеко от ядра, то последнее не в силах удержать электрон, поэтому он с легкостью может перейти к другому элементу.
Если же взять кислород (О), у которого восемь электронов и две электрические оболочки (на первом — 2, на втором — 6). Как видно, второй слой является незавершенным, до предела ему не хватает еще двух частиц. Кислород пытается сохранить недостающее число, а также найти два электрона, чтобы завершить свой последний круг. Это может произойти в реакции с другими элементами, у которых внешний слой тоже является незавершенным и достаточно отдаленным от ядра, чтобы тот, в свою очередь, не пытался что-либо удержать.
Элементы с проблемой недостатка электронов довольно энергичны в реакциях друг с другом, поскольку у них есть потребность в присоединении или отдаче нужного числа электронов.
Распределение электронов по слоям
Размещение электронов на оболочках происходит в установленном для них порядке. Если же получается, что частица изменяет свое местонахождение или число, то электронный слой просто меняется (а именно его физические и химические свойства).
Одинаковое число протонов и электронов в элементе является доказательством того, что общий заряд (электрический) равняется нулю.
Ионы
Изменение количества двух этих частиц способно привести к тому, что атом преобразуется в электрически заряженный.
Если же у атома возникает проблема с большим объемом электронов, он меняется на отрицательный ион.
Ион — заряженная молекула. Ионы бывают катионами и анионами. Есть во всех веществах.
Катион — положительный ион.
Анион — отрицательный ион.
Хлор (Cl), который вобрал в себя всего лишь один электрон, превращается отрицательным ионом (или же анионом). Такой ион будет считаться однозарядным, так как вместил в себя одну частицу. Писаться он будет уже так: Cl⁻.
Кислороду (О), чтобы стать отрицательным ионом, нужно присоединить два электрона. Он будет считаться двухзарядным. Записываться будет вот так: О⁻.
Когда атом превращается в ион, то для окружающего мира он является системой, которая электрически заряжена, что подразумевает появление определенного электрического поля, объединяющее и сам атом, и все происходящее в его зоне контроля. Это электрическое поле позволяет атому контактировать с другими такими же частицами, имеющими заряженность (ионы, электроны и т.д.).
Как и в остальных случаях, ионы, обладающие разными зарядами, притягиваются химически, что приводит к появлению новых, сложных частиц. Ими считаются молекулы.
Окисление
Степень окисления — заряд элемента, находящегося в соединении, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную.
Окисление — важная часть в образовании новых соединений.
Частицы в реакциях
Когда происходит химическая реакция, электроны либо объединяются, либо переходят к более отрицательному атому, чтобы стать заряженными.
Если бы вещества состояли только из ионов, то их заряды имели целые числа, которые равнялись бы количеству электронов (отданных или не отданных). Рассмотрим хлорид натрия (NaCl). Хлор (Cl) отнимает у натрия (Na) один электрон, при этом два элемента становятся ионами, но с разными зарядами. Натрий (Na) становится положительным, то есть катионом (записывается Na⁺¹), а хлор (Cl) — отрицательным, то есть анионом (записывается Cl⁻¹). Перейдем к соляной кислоте (HCl).
В этой паре хлор (Cl) считается самым отрицательным в электрическом плане, поэтому все два электрона (от водорода (Н) и от него) больше направлены к хлору (Cl), а если электрон водорода (Н) перейдет к хлору, что заряды будут полными, а не частичными как в первом случае. Правильная запись выглядит вот так: H+1CI-1.
Эти надстрочные значки и являются степенью окисления.
Правила записи степени окисления
Чтобы правильно записать степень окисления, нужно знать несколько правил:
- Степень окисления располагается над элементом справа;
- Первым делом записывается знак заряда (плюс или минус), не записывать его нельзя, это считается грубой ошибкой;
- После знака следует само значение;
- Даже если степень окисления равна +1 или -1, то она так и записывается без сокращения ( с сокращением, то есть + или -, пишутся только ионы);
- Заряд ионов записывается над ними справа;
- На первом месте в написании заряда стоит значение, а уже только потом знак.
Пример степени окисления: H+2O-2
Пример заряда иона: AL3+ii.
Вычисление степени окисления
Вычисление степени окисления проводится по некоторым пунктам, которых стоит придерживаться:
1.Есть элементы, у которых степень окисления неизменна, к ним относятся:
- щелочные металлы (степень окисления всегда +1);
- металлы из 2А группы (+2);
- алюминий (FI+3) и бор (B+3);
- фтор (F-1);
- часто кислород (О) имеет степень окисления — 2, но есть исключение у пероксидов, где у кислорода (О) -1;
- водород (Н). С неметаллами его степень равна +1, с металлами — -2.
2. Остальное в периодической таблице с плавающей степенью. Если рассмотреть хлор (Cl), то его значения нечетны: начиная от -1, заканчивая +7 (сюда входит +1, +3, +5). А вот у серы (S) все наоборот — она имеет лишь четные: от -2 до +6 (входит +2, +4).
Главное правило: если сложить все степени из соединения, то должен получиться ноль. Также, если состав какого-либо вещества из одного элемента, то его степень будет нулем.
Бывает такое, что соединение из трех составляющих. Ни в коем случае нельзя делать так, как в соединении двух элементов. Значение первого и последнего элементов известны, а значение третьего нужно считать по специальной формуле.
Пример
Возьмем Н3РО4 (фосфорная кислота).
Из правила водород (Н) будет +1, а кислород (О) — -2, осталось узнать о фосфоре (Р). Мы должны сложить все известные значения.
Здесь будем использовать уравнение.
(+1) × 3 + Х + (-2) × 4 = 0
Х = +5
Мы знаем, что сумма всех элементов должна быть нулем, поэтому приравниваем весь пример ему. Перед водородом (Н) стоит цифра 3, поэтому его степень умножаем на это число, то же самое и с кислородом (О). Фосфор (Р) у нас неизвестен, поэтому обозначаем его иксом. Дальше решаем обычным уравнением и вписываем полученное значение над ним.
Если говорить про степень окисления и валентность, то это абсолютно разные вещи. Первое имеет отрицательное или нулевое значения, а второе только положительное.
Ключевые мометы
Эта тема переплела два ответвления — физику и химию, показывая всю многогранность нашей природы и взаимосвязь этих наук. Как мы поняли, некоторые моменты до сих пор непонятны нам, но ученые не останавливаются на достигнутом, продвигаясь дальше. Данный предмет обсуждения, находящийся в этой работе — базовые понятия, написанные доступным языком.
Этот материал разбирал такие маленькие, но важные для нас моменты — атомы, которых мы не видим, хотя они влияют на все вокруг, даже на нас самих.
Чтобы лучше усвоить материал, здесь собраны ключевые моменты из текста, требующие особого внимания:
- Вещества бывают простыми и сложными;
- Атомы — это неразлагающиеся мелкие частицы;
- Чем выше порядковый номер у элемента, тем больше его атомный вес;
- Изотопы — химические элементы под одним порядковым номером, но с разной массой ядер. Есть у любого элемента;
- У атомов есть частицы (элементарные): протоны, нейтроны, электроны;
- Протоны — положительно заряженные частицы, находящиеся в ядре;
- Нейтроны — беззарядные частицы;
- Электроны — частицы, с самым маленьким отрицательным электрическим зарядом;
- Значение протона равно значению электрона;
- Чем быстрее скорость электрона, тем его масса больше;
- Движение электрона волнообразное, упорядоченное, при этом он вращается;
- Интерференция электронов — слияние нескольких волн электронов;
- Дифракция электронов — волновое обтекание области места, через которое проходит ток;
- Порядковый номер — это заряд ядра;
- У каждой частицы есть электрическое поле, позволяющее взаимодействовать с другими частицами;
- Фотон — переносчик электромагнитного “общения” частиц;
- Ядерное поле — вид материи, который состоит из протонов, нейтронов и мезонов.
- Мезон — частица, позволяющая протонам и нейтронам контактировать, а также удерживает их внутри ядра ядерной силой;
- Ядерная сила — сила влияния протона и нейтрона друг на друга;
- Ядерные силы могут из протонов нейтроны и наоборот при помощи мезонов;
- Ядерные силы мощнее электрических;
- Протон, нейтрон и электрон называются элементарными, потому что их невозможно разложить на более простые частицы, но они могут становиться друг другом и образовываться друг из друга;
- Если электрон отдалится от ядра, то он ненадолго образует энергию, но все равно вернется на свое место, тоже образовывая энергию, переходящую в излучение;
- Дозволенные слои — орбиты, на которые электрон может переходить;
- Дейтон — объединение протона и нейтрона в ядре;
- Легкие элементы считаются лучше, потому что их ядра прочнее из-за одинакового числа частиц;
- Число электронных слоев = номер периода;
- У каждой электронной оболочки есть определенное конечное число электронов, которое оно способно вместить;
- Те элементы, у которых оболочки не полностью заполнены, лучше вступают в контакт с другими элементами;
- Ион — заряженная молекула.
- Катион — положительный ион.
- Анион — отрицательный ион;
- Степень окисления — заряд элемента, который вычислен путем того, что в соединении ковалентная полярная связь превратилась в ионную;
- Есть элементы, чья степень окисления постоянна, а есть те, у кого она изменяется;
- Если сложить все степени окисления в соединении, то всё будет равно нулю.
Короткое, но познавательное видео про элементарные частицы:
Элементарные частицы: нейтроны, протоны, электроны. Действительно элементарные?
Когда речь заходит о том, из чего состоят различные окружающие нас объекты, мы сразу начинаем говорить о молекулах, затем об атомах. А из чего же состоят сами атомы? Так ли просто они устроены, как шарик, который мы видели на уроках химии и физике в школе? На самом деле, все не так уж и просто. Для простоты в самом начале скажем, что абсолютное большинство всех вещей в мире состоит из элементарных частиц. Почему не все? Дело в том, что далеко не вся Вселенная изучена человеком, поэтому мы не можем однозначно сказать, все ли состоит из частиц.
Например, свет — это волна, состоящая из элементарных частиц — фотонов, но раньше наука не могла такое сказать.
Теперь об этих самых частицах. Элементарные частицы — это такие частицы, которые человек сейчас расщепить на более маленькие не может, поэтому пока считается, что из них все и состоит. Таких частиц бывает огромное множество, но сегодня же мы будем больше говорить о наиболее популярных из них, а именно — нейтроны, протоны, электроны.
Где встречаются нейтроны, протоны, электроны?
Почему мы сказали выше, что эти три элементарные частицы считаются наиболее популярными? Все просто — из них состоит абсолютно любой атом. Если говорить об этом чуть более подробно, то атом состоит из двух частей:
- ядро атома
- электроны
В свою же очередь ядро атома включает в себя протоны и нейтроны. Таким образом, атом состоит из трех элементарных частиц, две из которых составляют ядро, а множество третьих вращается вокруг этого ядра.
Классификация элементарных частиц
Чтобы получше разобраться в том, какие бывают элементарные частицы и как они взаимодействуют друг с другом, нам нужно разделить их на группы по принципу схожести определенных свойств. Это и называется классификация. Сейчас все поймете.
Разделим по времени жизни
Делить какие-то там частицы по времени жизни звучит очень странно, ведь это неодушевленные предметы и о жизни здесь речь идти не должна. Вы будете абсолютно правы, имея такую точку зрения. Однако в данном случае имеется в виду не жизнь, как существование живого организма, а скорей пребывание в одном и том же состоянии. Если говорить проще, то не все из элементарных частиц могут сохранять свои свойства в течение большого отрезка времени, поэтому мы и решили их так разделить. Итак, разделить в данном случае можно на две группы:
- стабильные (это те частицы, которые как раз могут очень долго сохранять свойства, некоторые даже говорят бесконечно долго). Сюда относятся электроны, фотоны, протоны и другие частицы)
- нестабильные (а это те, которые через некоторый промежуток времени меняют свои свойства и переходят в другие формы). Сюда относятся все остальные виды частиц.
Разделим по тому, как они взаимодействуют
Интересно, что при довольно схожем строении, разные частицы могут взаимодействовать друг с другом совсем по-разному. Давайте посмотрим, как можно разделить элементарные частицы по такому принципу:
- составные
- бесструктурные
Действительно, частицы тоже бывают составные и фундаментальные (по сути самые простые), и от этого многое зависит. Давайте подробно разберемся с каждым из этих видов.
Составные частицы, которые по-другому еще называются адронами (вы наверняка слышали про Адронный коллайдер в Швейцарии) взаимодействуют со всеми частицами. Такое взаимодействие еще называют фундаментальным. Они в свою очередь тоже подразделяются на мезоны и барионы.
Теперь давайте поговорим о фундаментальных частицах. Здесь все гораздо более интересно, ведь таких частиц в мире открыто великое множество. Давайте для начала узнаем, на какие виды разделяются фундаментальные или же бесструктурные частицы:
- кварки
- лептоны
- калибровочные бозоны
Теперь давайте остановимся на каждом виде отдельно и поговорим о нем более подробно. А начать предлагаем с кварков.
Кварки — это такие частицы, которые находятся в составе адронов. Отдельно их встретить ученым пока не удавалось, только в составе других частиц. Для того, чтобы их изучать, ученым приходится использовать различные хитрые методы. Они подразделяются еще на шесть подтипов, но о них сегодня мы говорить не будем. Интересной особенностью кварков является то, что они, являясь фундаментальными частицами, все же участвуют в сильных взаимодействиях.
Теперь давайте перейдем к лептонам (точечным частицам). Это тоже довольно важный вид бесструктурных частиц. Они в отличие от кварков уже не участвуют в сильных взаимодействиях. Однако именно заряженные лептоны все же могут принимать участие в взаимодействии электромагнитном. Здесь так же, как и в кварках, отмечается целых шесть подтипов.
Ну а теперь последний тип с довольно странным для многих названием — калибровочные бозоны. Это тоже немаловажный тип, ведь именно он служит своего рода посредником в различных взаимодействиях между частицами. Чтобы вам было легче запомнить, приведем несколько примеров таких частиц: фотон, гравитон и глюон.
Ядро протон нейтрон электрон
Отлично, когда мы уже знаем довольно много про то, как устроены остальные элементарные частицы, давайте вернемся обратно к протону, нейтрону и электрону. Теперь самое время поговорить об устройстве ядра атома.
Начнем с того, что в ядре атома собран весь его положительный заряд, который обеспечивается протонами. Несмотря на большой заряд, размеры ядра очень малы по сравнению с электронными орбитами (орбиты, по которым вращается электрон вокруг ядра). В среднем они колеблются от 10 в минус 15 степени до 10 в минус 14 степени. Как мы помним из школьного курса химии количество протонов атома — это номер Z атома и порядковый номер элемента в таблице Менделеева. Примечательно также то, что количество протонов и электронов в атоме всегда одинаково.
Наверняка вам очень интересно, почему ядро атома, которое тоже состоит из элементарных частиц, такое плотное. Дело в том, что связь между протонами и нейтронами не является ни гравитационной, и электромагнитной, но при этом она в несколько раз сильнее, чем связь между ядром и электроном.
Число протонов нейтронов и электронов
Как мы уже поняли выше, в атоме абсолютно всегда количество протонов и электронов равно. Это обусловлено тем, что заряд должен быть нейтрален, а значит и количество положительных должно равняться количеству отрицательных частиц (отметим, что заряд протона +1, а заряд электрона -1). Также напомним, что количество протонов дает нам порядковый номер в таблице Менделеева этого атома. Теперь поговорим о нейтронах. Можно ли каким-то образом определить их количество внутри атома? Конечно можно. Это можно сделать, зная массу атома и количество протонов. Нужно просто вычесть из массы атома количество протонов и мы получим количество нейтронов (иногда нужно округлять). Для примера возьмем Медь (Cu). Ее атомная масса примерно равна 64, а номер в таблице 29, значит количество нейтронов будет равно 64 — 29 = 35. Все очень просто.
3 протона 3 нейтрона 3 электрона
Теперь для того, чтобы получше разобраться в этой теме, давайте попробуем все понять на примере другого атома. Это, как вы могли уже догадаться, атом Лития. У него 3 протона, 3 нейтрона и 3 электрона. По той формуле, которую мы уже узнали выше, тут сразу можно понять, что примерная масса атома Лития будет равна 6 (3 нейтрона + 3 протона). Также мы сходу можем сказать, что номер Лития в таблице Менделеева тоже 3 (количество протонов).
Теперь давайте посмотрим на таблицу Менделеева, представленную выше. Действительно, у Лития именно 3 номер и масса равна 6,941.
Видите, как все легко и просто. Однако особенно внимательный читатель уже давно заметил ошибку. Действительно, округлив массу Лития мы понимаем, что здесь количество нейтронов будет равно 4. Как же так получается, что у нас 3 нейтрона. Это подводит нас к следующей теме, о которой мы сейчас и поговорим.
Протон изотоп нейтрон электрон
Наверное, на одном из школьных уроков вы слышали такой термин, как изотоп. В школе это была та самая тема, после которой я полюбил естественные науки. Сейчас я не могу дать однозначный ответ, почему, просто было очень интересно. Итак, изотопы.
Что такое изотоп
Если говорить просто, то Изотопы представляют собой измененную модель обычного атома какого-то вещества. То есть возьмем любой атом какого-то вещества. У него есть фиксированное количество электронов, протонов и электронов. Однако, как мы уже заметили выше, это количество может быть и другим благодаря существованию изотопов. У изотопов такой же порядковый номер элемента в таблице Менделеева, а значит, как мы уже поняли, у них точно такое же количество протонов. Однако, есть отличия в массе элемента, а значит и в количестве нейтронов. Теперь давайте узнаем, как нам пригодится эта информация и как определить, что перед нами изотоп какого-то элемента.
Как определить, что перед нами изотоп
Наверняка самые догадливые и внимательные из вас уже догадались, что обычная формула с определением количества нейтронов с изотопами не работает от слова совсем, ведь это уже измененная модель обыкновенного элемента. Раз так, то мы можем просто попробовать подставить данные по атому в нашу формулу и понять, работает она или нет. Если нет, то перед нами изотоп. Но естественно, для удобства ученые придумали специальные обозначения для изотопов, чтобы нам, обычным людям, было удобнее с ними работать и изучать их. Как же эти обозначения работаю. А очень просто!
У изотопов после названия еще дописывается количество нуклонов в ядре (то есть количество элементарных частиц внутри ядра, сумма протонов и нейтронов). Давайте разберемся на примере очень популярного изотопа урана-235, радиоактивного урана. Обычный же уран по сути называется уран-238.
Зачем нам это знать?
Как вы уже могли понять, все многообразие элементарных частиц не ограничивается таблицей Менделеева и элементами, которые в ней представлены. У некоторых элементов бывает сразу несколько популярных изотопов, поэтому если вы хотите действительно хорошо разбираться в этой теме, то и запоминание всех популярных изотопов не будет лишним. А эта таблица вам в этом поможет:
Отлично, теперь мы уже неплохо разобрались с массой атома, таблицей Менделеева и разобрали основные типы элементарных частиц. Пришло время поговорить о более серьезных вещах. О чем же?
Радиоактивность
Для многих, кто в школе проходил эту тему лишь вскользь, это понятие выглядит очень страшным и непонятным. Кроме того, у многих на ум приходят различные катастрофы, косвенно связанные с этим понятием. Ну кто из вас сейчас не подумал о Хиросиме или о Чернобыле? Однако мы сейчас будем развеивать все эти мифы и стереотипы и хорошенько разберемся в этой далеко не легкой, но при этом очень интересной теме.
Как это работает?
Для того, чтобы разобраться в чем-либо, нужно сначала понять, с чего все начинается. В данном случае все идет от превращения атомов, а точнее от превращения их ядер. Интересно здесь то, что процесс этот самопроизвольный, то есть для того, чтобы он начался, нужно все-таки воздействовать извне, но как только превращения ядер начались, их уже не остановить! Да, далее произойдет именно то, о чем вы думаете. Ядро, с которого и начнется этот необыкновенно интересный с одной стороны и ужасно опасный с другой процесс называется материнским. Соответственно, если радиоактивный процесс затрагивает какое-то ядро помимо материнского, оно будет считаться дочерним, а 2 ядра, между которыми произошел обмен, называют генетически связанными — все как у людей.
Что такое радиоактивный распад?
Разумеется, радиоактивный распад встречается и в природе, однако происходит он крайне редко и не приносит никакого весомого вреда. А вот искусственный распад — штука очень опасная, если уметь ей управлять. Вся суть в том, что самопроизвольно меняется количество элементарных частиц. Существует несколько типов распадов и зависит этот тип от того, какие частицы будет испускать наш атом. Если это будут 2 протона и 2 нейтрона, то это положительно заряженная частица, называемая альфа-частицей. Соответственно, такой распад будет называться альфа-распадом. А вот с бета-частицами все немного посложнее.
Существует сразу 2 типа таких частиц: электроны и позитроны. Если эта частица электрон, то она обязательно образована нейтроном, распавшимся на протон и электрон. Если же эта бета-частица позитрон, то она всегда образована протоном, который распался на нейтрон и электрон. Распад, при котором из атома вылетает бета-частица — это уже бета-распад. Существует еще и менее популярный тип распада (изомерный переход или гамма-распад), при котором из атома вылетают гамма-кванты. Тут все еще сложнее, ведь такой изомерный переход никогда не бывает один. О чем я говорю? Дело в том, что гамма-распад очень часто сопровождают и другие типы распада. Это происходит в тот момент, когда частица распадается в первый раз. На этом этапе могут произойти другие виды распадов, а уж только потом процесс переходит непосредственно к гамма-распаду.
А в природе где это все можно встретить?
Как мы уже сказали выше, в природе тоже встречается радиоактивность. Если немного подумать, то оказывается, что радиоактивны по сути все вещества, у которых нет стабильных изотопов (кто еще не знает, что это, почитайте о них выше). Так вот, ученые пошли еще дальше и подошли к этому вопросу системно. В итоге они получили, что оказывается по таблице менделеева радиоактивны по своей природе вещества, у которых номер 83 или больше. Однако это если мы говорим о тех веществах, которые однозначно радиоактивны.
А ведь встречаются и немного другие. Например среди элементов с атомной массой поменьше встречаются такие, у изотопов которых очень большой период полураспада. Для примера возьмем теллур-128. У обычного теллура номер в таблице Менделеева 52, а значит он не подходит под первую группу, верно? И это неудивительно, ведь его изотоп теллур-128 так стабилен, что его период полураспада примерно в 2 раза больше, чем( 10 в степени 15 миллиардов лет). Неплохо, верно? Спешим вас успокоить, это элемент с самым большим периодом полураспада, но все-таки это очень много, ведь наша земля в миллиарды раз моложе. А для чего нужны все эти цифры? Это как-то практически применимо? Ну конечно, с помощью этих данных можно определять возраст многих минералов, горных пород и даже возраст планет в космосе! А ведь вы еще не знаете, что же такое период полураспада. Давайте разберемся с этим важнейшим понятием.
А что такое период полураспада?
Говоря о том, где можно встретить радиоактивность в природе, мы затронули такой термин, о котором еще не говорили. Что-ж, это неплохой повод, что это сделать сейчас. Так вот, период полураспада — это такое время, за которое частица распадается.
Но почему же именно ПОЛУраспад? Ну да, здесь все не так просто. Если говорить точнее, то это время, за которое она (частица) распадается с вероятностью 50 процентов. Теперь более понятно, верно?
Как вы уже могли догадаться у одной и той же частицы периоды полураспада могут отличаться в зависимости от изотопов. Однако для изотопа частицы это число постоянно.
Заключение
Как вы уже поняли, об элементарных частицах можно говорить очень много и говорить о них можно бесконечно много. Однако на этом наше небольшое вводное повествование о них предлагаем закончить. Если вам понравилась эта статья и вы хотите, чтобы мы публиковали больше материала на эту тему, то не забудьте проявить немного активности ниже. Напомним также, что на нашем сайте есть множество статей на смежные тематики, поэтому предлагаем вам с ними ознакомиться. До скорых встреч!
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
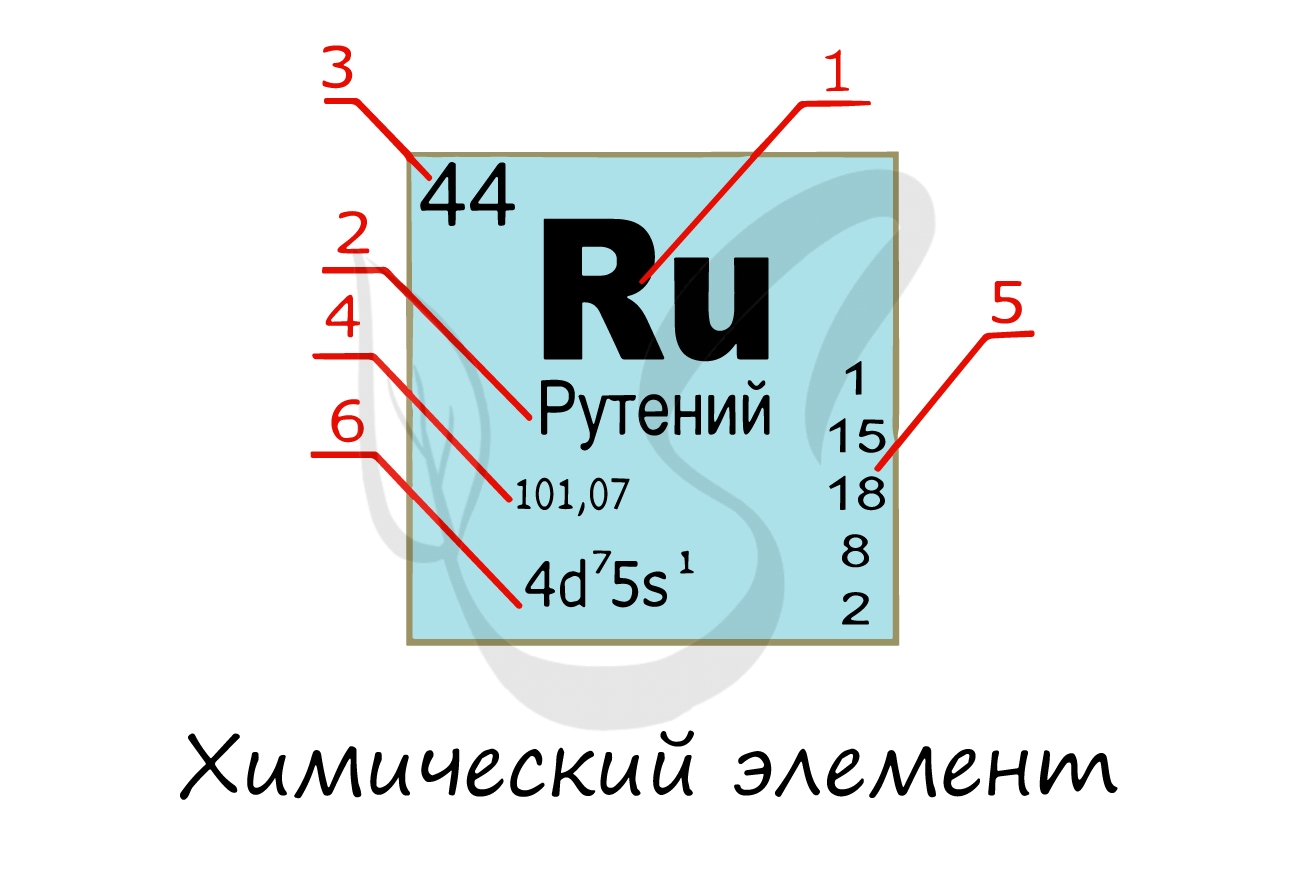
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
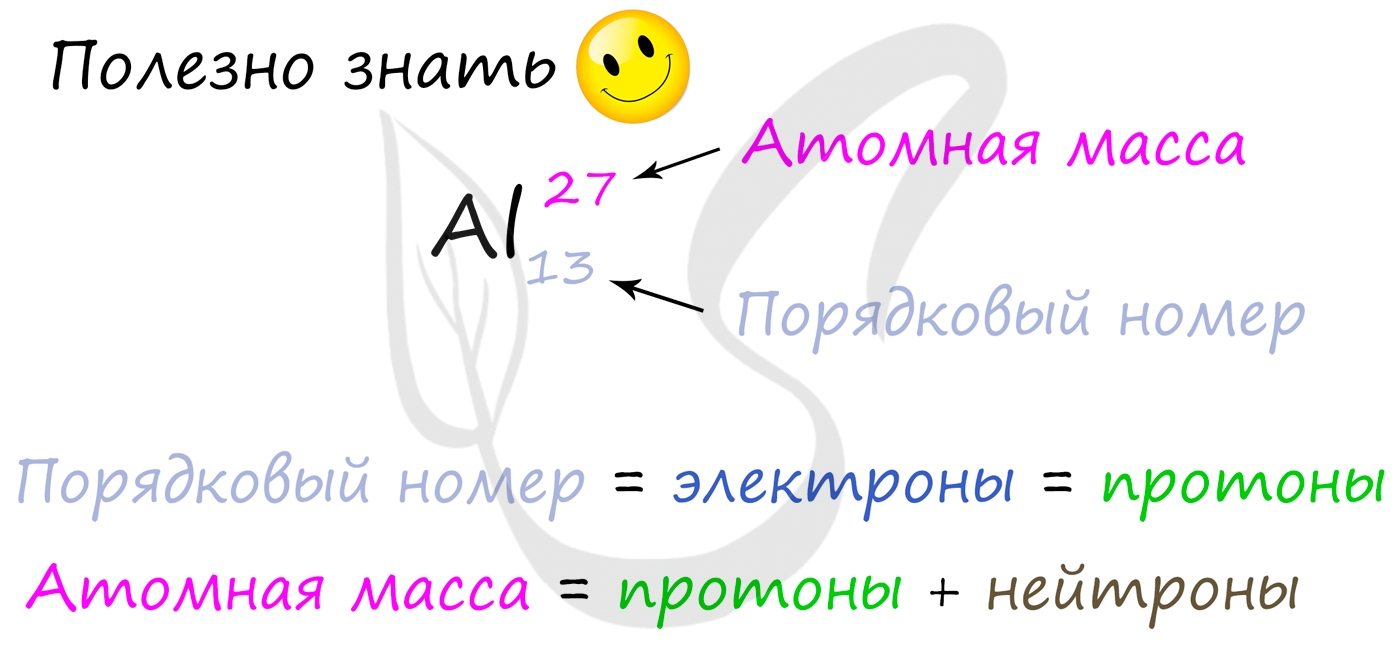
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
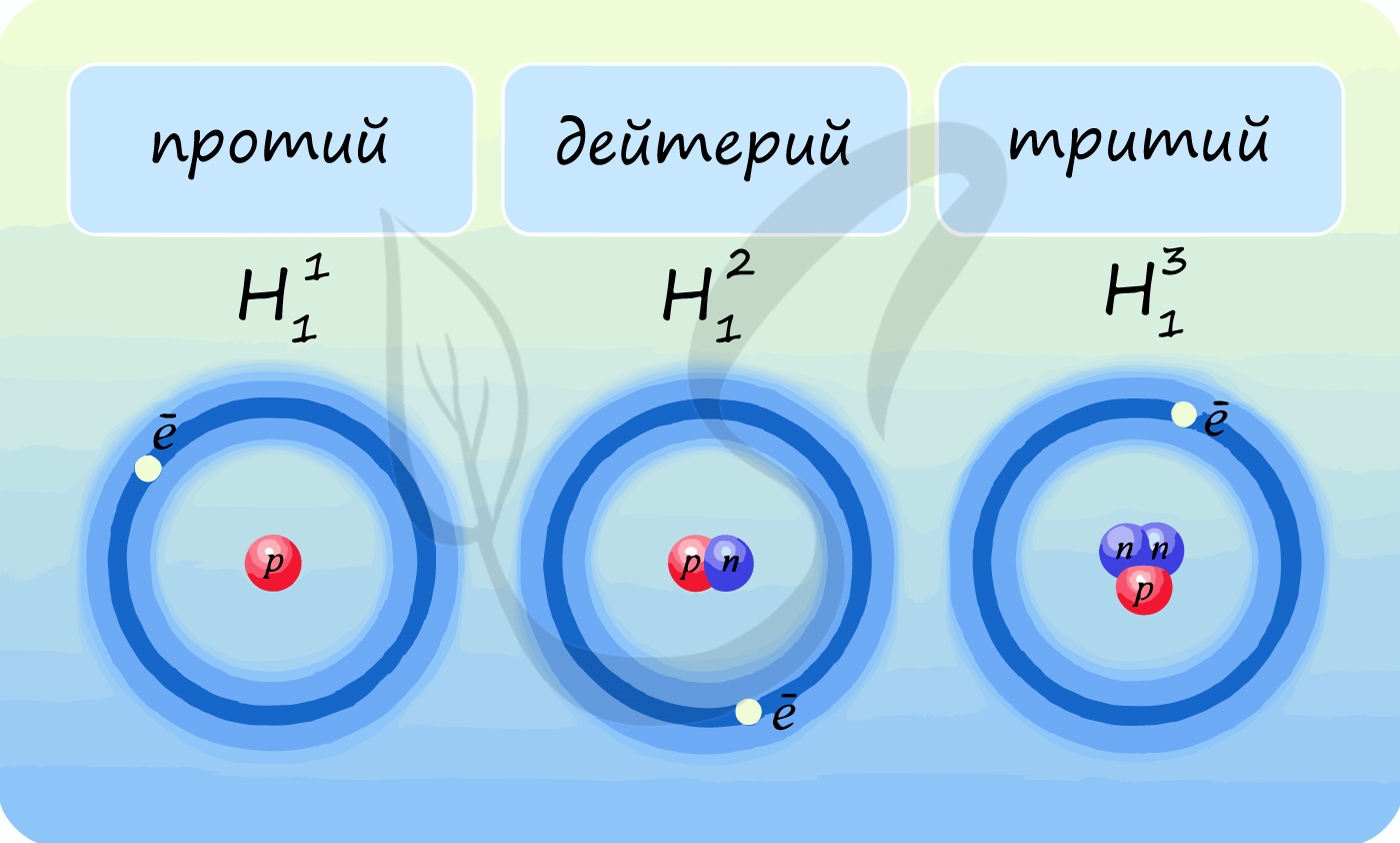
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
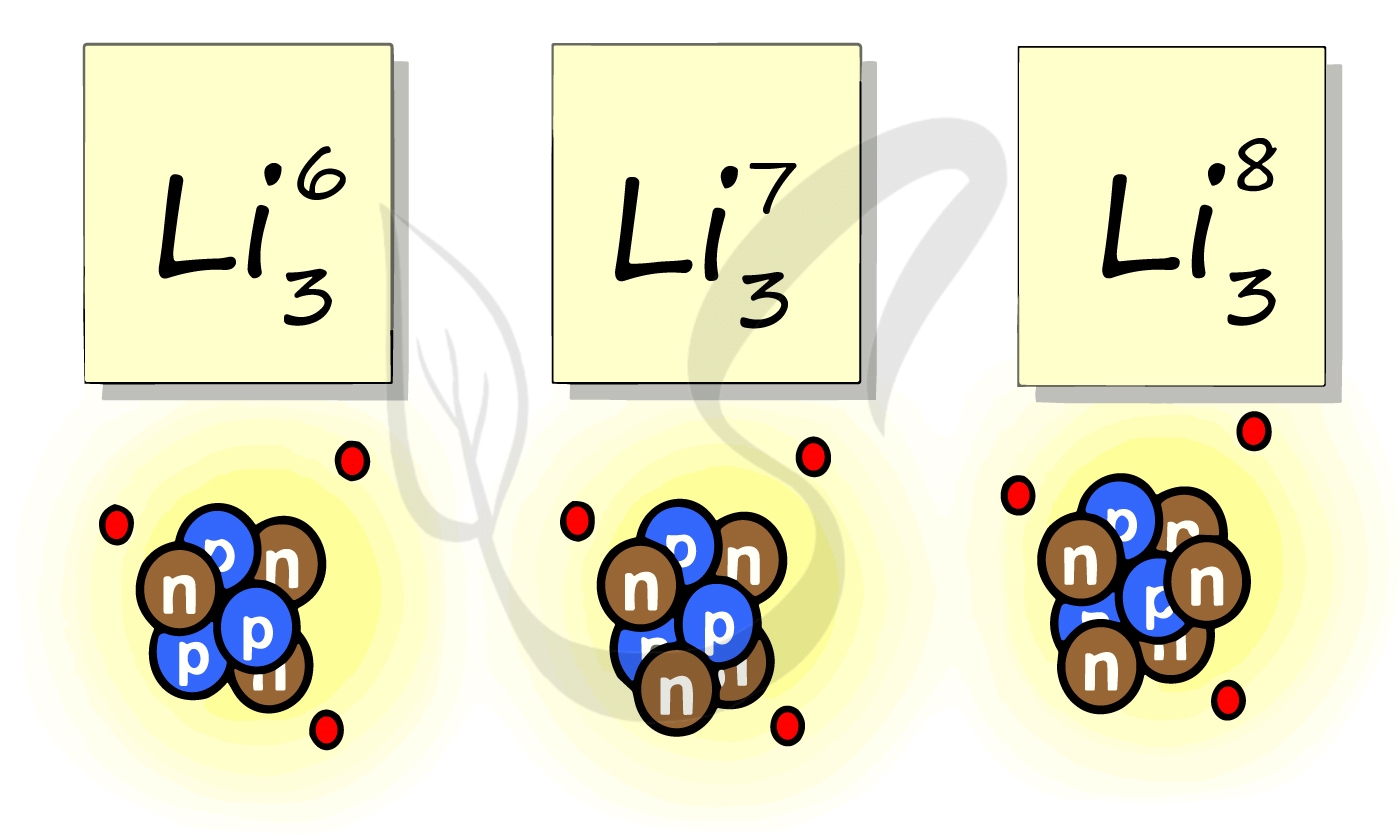
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 924 063 раза.
Была ли эта статья полезной?
Атом — это электронейтральная частица, состоящая из положительно заряженного ядра и электронной оболочки.
В состав ядра входят нуклоны, или ядерные частицы. Это протоны и нейтроны. Электронная оболочка образована электронами. Протоны, нейтроны и электроны называют элементарными частицами атома.
Нуклоны в ядре удерживаются ядерным взаимодействием, энергия которого намного больше энергии химической связи. Поэтому в химических реакциях ядра не разрушаются.
Протон ((p)) — это частица с относительным зарядом (+1) и относительной массой (1).
Нейтрон ((n)) не имеет заряда, а его относительная масса тоже равна (1).
Электрон (
e−
) имеет заряд (-1), а его масса в (1837) раз меньше массы протона и нейтрона.
Строение атома можно охарактеризовать по положению химического элемента в периодической системе.
Порядковый номер элемента равен заряду ядра, числу протонов в ядре и числу электронов в его электронной оболочке.
Учитывая, что масса атома в основном сосредоточена в ядре и масса каждого нуклона равна (1), можно определить число нейтронов. Для этого от массового числа нужно отнять число протонов (порядковый номер).
Пример:
порядковый номер радия
Ra
(88), относительная атомная масса равна (226). Значит, в атоме содержится (88) протонов и (88) электронов, а число нейтронов равно (226 — 88 = 138).
Число нейтронов в атомах одного элемента непостоянно. Поэтому атомы одного химического элемента могут различаться своими массами и существуют в виде разных нуклидов (изотопов).
Изотопы (нуклиды) — разновидности атомов с одинаковым зарядом ядра, но разными массами.
Изотопы с одинаковым зарядом ядра составляют химический элемент. Их обозначают, указывая справа вверху от символа элемента массовое число. Справа внизу часто записывают также протонное число (порядковый номер):
O816
,
O817
.
Большинство химических элементов в природе представлено несколькими разновидностями атомов. Всего их известно более (2500).
Пример:
водород в природе представлен тремя изотопами. Ядро самого лёгкого изотопа (протия) состоит только из одного протона. В ядре дейтерия один протон и один нейтрон, а в ядре трития один протон и два нейтрона.
Рис. (1). Изотопы водорода
Указанная в периодической системе относительная атомная масса — это средняя масса всех существующих в природе изотопов данного элемента. Когда мы её округляем до целых, то получаем массу самого распространённого изотопа.
Источники:
Рис. 1. Изотопы водорода. © ЯКласс
Строение атома
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Атом — в переводе с древнегреческого – неделимый — это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e— | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов. Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям — орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
Электроны располагаются на орбиталях в соответствии со следующими правилами:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).
Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Тип орбитали | Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки. Возможных значений всего два: +1/2 (обозначаем стрелкой вверх) и -1/2 (обозначаем стрелкой вниз).
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
С правилом Паули всё достаточно ясно: спины двух электронов на одной орбитали различны, а значит у одного электрона +1/2 (стрелочка вверх), у другого – -1/2 (стрелочка вниз). Но каков смысл правила Хунда? В данном случае обратимся всё к тем же значениям спина электрона. При заполнении электронного уровня всегда сначала заполняется один подуровень, только затем электроны помещаются на следующий. Рассмотрим p-подуровень. На нём имеются 3 орбитали (см. таблицу выше). В целом, есть разные варианты развития событий. Допустим, у нас есть 4 электрона, которые надо расположить на подуровне. Мы можем поместить два в первую ячейку, два во вторую. Посчитаем суммарный спин. У двух элетронов спин 1/2, у других -1/2. Тогда при сложении мы получаем ноль. Теперь расположим три первых электрона по одному, оставшийся поместим на первую орбитал (в пару). Теперь суммарный спин 1. Значит, подходит второй случай. Для того чтобы каждый раз не высчитывать суммарный спин, можно запомнить, что вначале следует расположить все имеющиеся электроны по одному, и если на подуровне уже не останется свободных ячеек, начинать составлять пары.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов главных подгрупп всегда заполняется внешний электронный уровень, у элементов побочных – один из предыдущих.
— магний – двенадцатый элемент, имеет по 12 протонов и электронов, находится в главной подгруппе. Распределим эти электроны в соответствии с рассмотренными выше правилами, не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона — 3s2. Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
— фосфор – пятнадцатый элемент, находится в главной подгруппе. Распределяем 15 электронов: Фосфор — элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены — 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов — 3s23p3. Итого получаем1s22s22p63s23p3.
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
— цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент побочной подгруппы! Поэтому у него заполняется предыдущий электронный уровень (4d-подуровень). Цирконий – второй d – элемент в пятом периоде, значит, он содержит 2 электрона на 4d – подуровне. Итого получаем: 1s22s22p63s23p64s23d104p65s24d2.
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Важно отметить, что в обычном состоянии цирконий не может образовывать связей, так как для этого необходимы неспаренные электроны на внешнем электронном уровне. Соответственно, во всех соединениях цирконий находится в возбуждённом состоянии.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. (Атому более комфортно иметь на d-подуровне 5 или 10 электронов, чем 4 или 9). Например, электронные конфигурации хрома и меди вместо 4s23d4 и 4s23d9 имеют вид 4s13d5 и 4s13d10.
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2—
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
1) 2Н
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Строение атома» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
06.02.2023
Количество протонов, нейтронов и электронов химических элементов.
Протон (от др.-греч. πρῶτος – «первый, основной») – элементарная частица, имеющая электрический заряд +1e.
Нейтрон (от лат. neuter – «ни тот, ни другой») – тяжёлая элементарная частица, не имеющая электрического заряда.
Электрон (от др.-греч. ἤλεκτρον – «янтарь») – стабильная отрицательно заряженная элементарная частица. Считается фундаментальной частицей (не имеющей, насколько это известно, составных частей) и является одной из основных структурных единиц вещества.
Количество протонов, нейтронов и электронов химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Количество электронов, протонов и нейтронов |
| 1 | Водород | H | 1 электрон, 1 протон, 0 нейтронов |
| 2 | Гелий | He | 2 электрона, 2 протона, 2 нейтрона |
| 3 | Литий | Li | 3 электрона, 3 протона, 4 нейтрона |
| 4 | Бериллий | Be | 4 электрона, 4 протона, 5 нейтронов |
| 5 | Бор | B | 5 электронов, 5 протонов, 6 нейтронов |
| 6 | Углерод | C | 6 электронов, 6 протонов, 6 нейтронов |
| 7 | Азот | N | 7 электронов, 7 протонов, 7 нейтронов |
| 8 | Кислород | O | 8 электронов, 8 протонов, 8 нейтронов |
| 9 | Фтор | F | 9 электронов, 9 протонов, 10 нейтронов |
| 10 | Неон | Ne | 10 электронов, 10 протонов, 10 нейтронов |
| 11 | Натрий | Na | 11 электронов, 11 протонов, 12 нейтронов |
| 12 | Магний | Mg | 12 электронов, 12 протонов, 12 нейтронов |
| 13 | Алюминий | Al | 13 электронов, 13 протонов, 14 нейтронов |
| 14 | Кремний | Si | 14 электронов, 14 протонов, 14 нейтронов |
| 15 | Фосфор | P | 15 электронов, 15 протонов, 16 нейтронов |
| 16 | Сера | S | 16 электронов, 16 протонов, 16 нейтронов |
| 17 | Хлор | Cl | 17 электронов, 17 протонов, 18 нейтронов |
| 18 | Аргон | Ar | 18 электронов, 18 протонов, 22 нейтронов |
| 19 | Калий | K | 19 электронов, 19 протонов, 20 нейтронов |
| 20 | Кальций | Ca | 20 электронов, 20 протонов, 20 нейтронов |
| 21 | Скандий | Sc | 21 электрон, 21 протон, 24 нейтрона |
| 22 | Титан | Ti | 22 электрона, 22 протона, 26 нейтронов |
| 23 | Ванадий | V | 23 электрона, 23 протона, 28 нейтронов |
| 24 | Хром | Cr | 24 электрона, 24 протона, 28 нейтронов |
| 25 | Марганец | Mn | 25 электронов, 25 протонов, 30 нейтронов |
| 26 | Железо | Fe | 26 электронов, 26 протонов, 30 нейтронов |
| 27 | Кобальт | Co | 27 электронов, 27 протонов, 32 нейтрона |
| 28 | Никель | Ni | 28 электронов, 28 протонов, 31 нейтрон |
| 29 | Медь | Cu | 29 электронов, 29 протонов, 35 нейтронов |
| 30 | Цинк | Zn | 30 электронов, 30 протонов, 35 нейтронов |
| 31 | Галлий | Ga | 31 электрон, 31 протон, 39 нейтронов |
| 32 | Германий | Ge | 32 электрона, 32 протона, 41 нейтрон |
| 33 | Мышьяк | As | 33 электрона, 33 протона, 42 нейтрона |
| 34 | Селен | Se | 34 электрона, 34 протона, 45 нейтронов |
| 35 | Бром | Br | 35 электронов, 35 протонов, 45 нейтронов |
Количество протонов, нейтронов и электронов химических элементов (2 часть):
| 36 | Криптон | Kr | 36 электронов, 36 протонов, 48 нейтронов |
| 37 | Рубидий | Rb | 37 электронов, 37 протонов, 48 нейтронов |
| 38 | Стронций | Sr | 38 электронов, 38 протонов, 50 нейтронов |
| 39 | Иттрий | Y | 39 электронов, 39 протонов, 50 нейтронов |
| 40 | Цирконий | Zr | 40 электронов, 40 протонов, 51 нейтрон |
| 41 | Ниобий | Nb | 41 электрон, 41 протон, 52 нейтрона |
| 42 | Молибден | Mo | 42 электрона, 42 протона, 54 нейтрона |
| 43 | Технеций | Tc | 43 электрона, 43 протона, 55 нейтронов |
| 44 | Рутений | Ru | 44 электрона, 44 протона, 57 нейтронов |
| 45 | Родий | Rh | 45 электронов, 45 протонов, 58 нейтронов |
| 46 | Палладий | Pd | 46 электронов, 46 протонов, 60 нейтронов |
| 47 | Серебро | Ag | 47 электронов, 47 протонов, 61 нейтрон |
| 48 | Кадмий | Cd | 48 электронов, 48 протонов, 64 нейтрон |
| 49 | Индий | In | 49 электронов, 49 протонов, 66 нейтронов |
| 50 | Олово | Sn | 50 электронов, 50 протонов, 69 нейтронов |
| 51 | Сурьма | Sb | 51 электрон, 51 протон, 71 нейтрон |
| 52 | Теллур | Te | 52 электрона, 52 протона, 76 нейтронов |
| 53 | Йод | I | 53 электрона, 53 протона, 74 нейтронов |
| 54 | Ксенон | Xe | 54 электрона, 54 протона, 77 нейтронов |
| 55 | Цезий | Cs | 55 электронов, 55 протонов, 78 нейтронов |
| 56 | Барий | Ba | 56 электронов, 56 протонов, 81 нейтрон |
| 57 | Лантан | La | 57 электронов, 57 протонов, 82 нейтрона |
| 58 | Церий | Ce | 58 электронов, 58 протонов, 82 нейтрона |
| 59 | Празеодим | Pr | 59 электронов, 59 протонов, 82 нейтрона |
| 60 | Неодим | Nd | 60 электронов, 60 протонов, 84 нейтрона |
| 61 | Прометий | Pm | 61 электрон, 61 протон, 84 нейтрона |
| 62 | Самарий | Sm | 62 электрона, 62 протона, 88 нейтронов |
| 63 | Европий | Eu | 63 электрона, 63 протона, 89 нейтронов |
| 64 | Гадолиний | Gd | 64 электрона, 64 протона, 93 нейтрона |
| 65 | Тербий | Tb | 65 электронов, 65 протонов, 94 нейтрона |
| 66 | Диспрозий | Dy | 66 электронов, 66 протонов, 97 нейтронов |
| 67 | Гольмий | Ho | 67 электронов, 67 протонов, 98 нейтронов |
| 68 | Эрбий | Er | 68 электронов, 68 протонов, 99 нейтронов |
| 69 | Тулий | Tm | 69 электронов, 69 протонов, 100 нейтронов |
| 70 | Иттербий | Yb | 70 электронов, 70 протонов, 103 нейтрона |
Количество протонов, нейтронов и электронов химических элементов (3 часть):
| 71 | Лютеций | Lu | 71 электрон, 71 протон, 104 нейтрона |
| 72 | Гафний | Hf | 72 электрона, 72 протона, 106 нейтронов |
| 73 | Тантал | Ta | 73 электрона, 73 протона, 108 нейтронов |
| 74 | Вольфрам | W | 74 электрона, 74 протона, 110 нейтронов |
| 75 | Рений | Re | 75 электронов, 75 протонов, 111 нейтронов |
| 76 | Осмий | Os | 76 электронов, 76 протонов, 114 нейтронов |
| 77 | Иридий | Ir | 77 электронов, 77 протонов, 115 нейтронов |
| 78 | Платина | Pt | 78 электронов, 78 протонов, 117 нейтронов |
| 79 | Золото | Au | 79 электронов, 79 протонов, 118 нейтронов |
| 80 | Ртуть | Hg | 80 электронов, 80 протонов, 121 нейтрон |
| 81 | Таллий | Tl | 81 электрон, 81 протон, 123 нейтрона |
| 82 | Свинец | Pb | 82 электрона, 82 протона, 125 нейтронов |
| 83 | Висмут | Bi | 83 электрона, 83 протона, 126 нейтронов |
| 84 | Полоний | Po | 84 электрона, 84 протона, 125 нейтронов |
| 85 | Астат | At | 85 электронов, 85 протонов, 125 нейтронов |
| 86 | Радон | Rn | 86 электронов, 86 протонов, 136 нейтронов |
| 87 | Франций | Fr | 87 электронов, 87 протонов, 136 нейтронов |
| 88 | Радий | Ra | 88 электронов, 88 протонов, 138 нейтронов |
| 89 | Актиний | Ac | 89 электронов, 89 протонов, 138 нейтронов |
| 90 | Торий | Th | 90 электронов, 90 протонов, 142 нейтрона |
| 91 | Протактиний | Pa | 91 электрон, 91 протон, 140 нейтронов |
| 92 | Уран | U | 92 электрона, 92 протона, 146 нейтронов |
| 93 | Нептуний | Np | 93 электрона, 93 протона, 144 нейтрона |
| 94 | Плутоний | Pu | 94 электрона, 94 протона, 150 нейтрона |
| 95 | Америций | Am | 95 электронов, 95 протонов, 148 нейтронов |
| 96 | Кюрий | Cm | 96 электронов, 96 протонов, 151 нейтрон |
| 97 | Берклий | Bk | 97 электронов, 97 протонов, 150 нейтронов |
| 98 | Калифорний | Cf | 98 электронов, 98 протонов, 153 нейтрона |
| 99 | Эйнштейний | Es | 99 электронов, 99 протонов, 153 нейтрона |
| 100 | Фермий | Fm | 100 электронов, 100 протонов, 157 нейтронов |
| 101 | Менделевий | Md | 101 электрон, 101 протон, 157 нейтронов |
| 102 | Нобелий | No | 102 электрона, 102 протона, 157 нейтронов |
| 103 | Лоуренсий | Lr | 103 электрона, 103 протона, 163 нейтрона |
| 104 | Резерфордий (Курчатовий) | Rf | 104 электрона, 104 протона, 157 нейтронов |
| 105 | Дубний (Нильсборий) | Db | 105 электронов, 105 протонов, 157 нейтронов |
| 106 | Сиборгий | Sg | 106 электронов, 106 протонов, 163 нейтронов |
| 107 | Борий | Bh | 107 электронов, 107 протонов, 160 нейтронов |
| 108 | Хассий | Hs | 108 электронов, 108 протонов, 161 нейтрон |
| 109 | Мейтнерий | Mt | 109 электронов, 109 протонов, 169 нейтронов |
| 110 | Дармштадтий | Ds | 110 электронов, 110 протонов, 171 нейтрон |
Коэффициент востребованности
9 243































