| 1. /10 КЛАСС.doc | Тема: «феррум как химический элемент. Простое вещество железо. Соединения феррума (II) и феррума(III)» |
ХИМИЯ
10 КЛАСС
ТЕМА: «ФЕРРУМ КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. ПРОСТОЕ ВЕЩЕСТВО ЖЕЛЕЗО. СОЕДИНЕНИЯ ФЕРРУМА (II) И ФЕРРУМА(III)»
(45 минут)
ПАРХОМЕНКО ГАЛИНА ЮРЬЕВНА,
УЧИТЕЛЬ ХИМИИ
УЧЕБНО-ВОСПИТАТЕЛЬНОГО КОМПЛЕКСА ОБШЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА I-II СТУПЕНЕЙ — МОРСКОЙ ТЕХНИЧЕСКИЙ ЛИЦЕЙ,
Г.КЕРЧЬ
В классе — зашторивание, экран, мультимедийный проектор;На доске – тема урока, домашнее задание;На учительском столе – карточки с целью урока, поднос для демонстрации, модели машин и самолетов, магниты, «ромашки» с правилами ТБ, задания экспресс — опроса;На столах учащихся – инструктивные карты для лабораторных опытов, карточки с Периодической системой, рабочие тетради, подносы с реактивами и оборудованием.План урока:
1.Организация начала занятия (приветствие, объявление темы урока)-3мин
2. Подготовка к основному этапу занятия (мотивация цели и учебно-познавательной деятельности, актуализация опорных знаний)-3 мин
3.Постановка и обоснование цели урока-5 мин
4.Усвоение новых знаний, информация к размышлению (компьютерная презентация учащегося по теме урока, показ коллекции минералов)-10 мин
5.Повторение правил техники безопасности перед началом лабораторных опытов, целевой инструктаж- 5 мин
6.Краткое объяснение учителем хода работы-5 мин
7.Выполнение лабораторных опытов учащимися, обсуждение выводов-20 мин
8.Контроль и самопроверка знаний (экспресс – опрос)-7 мин
9.Информация о домашнем задании, инструктаж по его выполнению- 3 мин
10.Подведение итогов занятия-7 мин
Ход урокаУчитель. Здравствуйте, садитесь!
Тема нашего сегодняшнего урока – «Феррум как химический элемент. Простое вещество железо. Соединения Феррума (II) и Феррума(III».
Мы с вами уже успели познакомиться с общими свойствами металлов, и с их отдельными представителями, поэтому сегодняшний урок пройдет с вашим активным участием. Однако вначале не помешает вспомнить, что мы знаем о предмете нашего разговора.
Посмотрите на эти симпатичные модели автомобилей и самолетов у меня в руках, а теперь — представьте их в натуральную величину. Что их объединяет? Из какого материала они изготовлены? Из чего сделаны наши транспортные средства, инженерные сооружения, летательные аппараты, инструменты и оружие?
Конечно же, этот материал – это сталь, железо, первый и главнейший среди металлов по производству и применению.
Ученые древности утверждали:
Семь металлов знает свет
По числу семи планет.
Дал нам Космос на добро
Медь, железо, серебро,
Злато, олово, свинец,
Сера всем им был отец.
Поспеши, мой друг, узнать-
Ртуть для них родная мать.
Недаром же вслед за каменным и бронзовым веком в истории человечества наступил век железный (9-7 век до н.э.). У средневековых алхимиков золото обозначалось символом Солнца, серебро – символом Луны. Как вы думаете, символом какой планеты, и почему, в древности обозначали железо? (ответ — символом планеты Марс — красная планета, названная именем бога войны; красный – это цвет крови и железных руд, цвет гемоглобина и т.д.).
Учитель. Этот урок химии мы проводим сегодня с постановкой лабораторных опытов. Скажите, пожалуйста, какие цели и задачи мы ставим перед собой на таких уроках? Чему научит нас этот урок, чем поможет?
(Учитель с помощью учащихся формулирует цели и задачи урока, учащиеся берут соответствующие карточки, и, с помощью магнитов прикрепляют их на доску. Таким образом, в течение всего урока, эти карточки находятся перед глазами учащихся, напоминая о том, какие цели поставлены).
Учащиеся формулируют:
-изучить свойства элемента Феррум и его соединений, а также свойства железа, как простого вещества;
-закрепить умения обращаться с лабораторным оборудованием и реактивами;
-закрепить навыки составления химических уравнений;
-учиться наблюдать, анализировать, делать выводы;
-учиться формулировать свою точку зрения, и отстаивать ее.
Учитель. Раскройте тетради, запишите сегодняшнее число, вид работы, тему.
В начале урока — немного информации к размышлению, которую подготовил для нас ученик вашего класса, действительный член МАН по секции «химия».
Выступление учащегося с компьютерной презентацией на тему «Феррум и его соединения».Краткое содержание презентации.
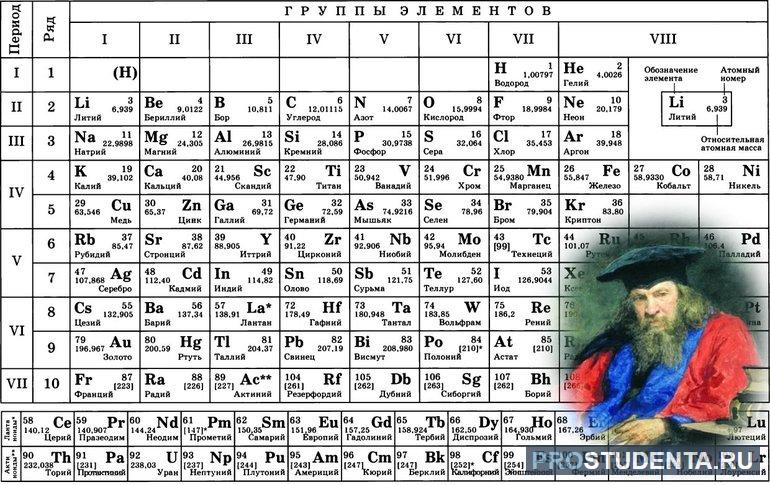
- В периодической системе элемент Феррум находится в четвертом периоде, в побочной подгруппе VIII группы, порядковый номер 26.
- Атом элемента содержит 26 электронов, 26 протонов, 30 нейтронов. Его относительная атомная масса 56.
- В атоме Феррума 4 электронных слоя, Распределение электронов: 2)8)14)2), электронная конфигурация: 1s22s22p63s23p63d64s2
- Степень окисления 0,+2, +3 и иногда + 6; является восстановителем.
- Электронно-графические формулы строения атома Феррума в стационарном и в возбужденном состоянии.
6.Феррум — один из самых распространенных в природе элементов. В земной коре его массовая доля составляет 5,10%, и оно уступает лишь Оксигену, Силицию и Алюминию. Много железа содержится и в небесных телах, что установлено методом спектрального анализа. Феррум входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием Феррума 30-70%.
- Минералы с содержанием Феррума:
- Fe3O4 магнитный железняк или магнетит
- Fe2O3 красный железняк или гематит
- 2Fe2O3.3H2O бурый железняк или лимонит
- FeS2 железный или серный колчедан
- FeSO4.7H2O железный купорос
- Например:
- Сидерит — FeCO3
содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. - Марказит — FeS2
содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов
- Биологическая роль Феррума:
входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Феррум стимулирует функцию кроветворных органов.
- Источники Феррума в питании:
- Шпинат
- Салат
- Капуста
- Черная черешня
- Говядина
- Телятина
- Яблоки
- Железо как простое вещество Феррума.
Физические свойства железа:
Простое вещество железо — ковкий металл серебристо-белого цвета с температурой плавления 15390С, обладает парамагнитными свойствами, хорошей тепло- и электропроводностью, с высокой химической реакционной способностью.
- Химические свойства железа как простого вещества.
- Железо — активный металл.
- На воздухе образуется защитная оксидная пленка, препятствующая коррозии металла.
- 3Fe + 2O2 = Fe2O3 • FeO (Феррит железа)
- Во влажном воздухе железо окисляется и покрывается ржавчиной, которая частично состоит из гидратированного феррум(III) оксида.
- 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
- Взаимодействует с хлором, углеродом и другими неметаллами при нагревании:
- 2Fe + 3Cl2 = 2FeCl3
- Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа:
- Fe + CuSO4 = FeSO4 + Cu
- Растворяется в разбавленных сульфатной и хлоридной кислотах c выделением водорода:
- Fe + 2HCl = FeCl2 + H2
- Получение железа.
Чистое железо можно получить электролитическим восстановлением солей железа.
- FeCl2 = Fe2+ + 2Cl—
Восстановление оксидов железа Fe2O3 и Fe3O4 при алюминотермии:
- 8Al + 3Fe3O4 = 9Fe + 4Al2O3
Основная масса железа используется не в чистом виде, а виде сплавов с углеродом (чугуна и стали) и другими элементами. Основная масса железа вырабатывается в доменных печах. Процесс, протекающий в доменной печи при получении сплавов железа, основан на восстановлении оксидов железа при нагревании:
- 3Fe2O3 + CO = 2Fe3O4 + CO2
- Fe3O4 + CO = 3FeO + CO2
- FeO + CO = Fe + CO2
- FeO + C = Fe + CO
- Железо сыграло большую роль в развитии человеческого общества и не потеряло своего значения и в настоящее время: из всех металлов оно наиболее широко используется в современной промышленности.
- Первобытный человек стал использовать железные орудия за несколько тысячелетий до нашей эры. Тогда единственным источником этого металла были упавшие на Землю метеориты, которые содержат довольно чистое железо. Это породило у многих народов легенды, дошедшие до наших дней, о небесном происхождении железа.
- В середине II тысячелетия до н.э. в Египте была освоена металлургия железа — получение его из железных руд. Это положило начало железному веку в истории человечества, который пришел на смену каменному и бронзовому векам. На территории нашей страны начало железного века относят к рубежу II и I тысячелетий до н. э.
- В настоящее время основным промышленным способом переработки железных руд является производство чугуна доменным процессом. Чугун — это сплав железа, содержащий 2,2-4% углерода, кремний, марганец, фосфор, серу. В дальнейшем большая часть чугуна подвергается переделу на сталь. Сталь отличается от чугуна главным образом меньшим содержанием углерода (до 2%), фосфора и серы.
- В последнее время большое внимание уделяется разработке методов прямого получения железа из руд без осуществления доменного процесса. Еще в 1899 г. Д. И. Менделеев писал: «Я полагаю, что придет со временем опять пора искать способов прямого получения железа и стали из руд, минуя чугун». Слова великого химика оказались пророческими: такие способы найдены и реализованы в промышленности.
- Источники информации:
http://ru.wikipedia.org/wiki/Железо http://chem100.ru/elem.php?n=26 http://biotaupe.org/him-sv-va.htm
После компьютерной презентации лаборант показывает учащимся коллекцию
железосодержащих минералов.Учитель. Прежде чем приступить к выполнению основной части урока с выполнением лабораторных опытов, мы с вами должны вспомнить основные правила техники безопасности. У меня в руках две ромашки, которые помогут нам сделать это быстрее.Игра «ромашка» (учащиеся по очереди отрывают «лепестки» ромашки и громко зачитывают правила работы с реактивами и оборудованием, а также правила безопасности жизнедеятельности на уроках химии).Учитель. Итак, проверьте, все ли, согласно инструктивной карте, есть у вас на столах. Сегодня, как обычно, мы работаем полумикрометодом, используя вместо пробирок гнезда пластины, поэтому обходимся несколькими каплями реактивов.Также обращаю внимание на то, что работаем сегодня на три варианта.
1й вариант – первыми выполняет и комментирует задания №1 и 2.
2й вариант — сразу выполняет и комментирует задания № 3 и 4.
3й вариант — сразу выполняет и комментирует задания № 5 и 6.
Однако к концу урока у каждого из вас в тетради должны быть оформлены все шесть опытов, а в гнездах пластины проделаны все шесть реакций. Итак, время пошло.
Ход лабораторных опытов и их обсуждение. Опыт первый — взаимодействие железа с кислотами.
Показать взаимодействие порошка железа с раствором хлоридной кислоты. Написать на доске и в тетради уравнение реакции.
Fe + 2HCl = FeCl2 + H2↑
Что наблюдаем? Какой это тип реакции? Разобрать уравнение как окислительно–восстановительное. Где здесь окислитель? Где восстановитель?
Опыт второй — взаимодействие железа с солями мене активных металлов.
Показать взаимодействие порошка железа с раствором медного купороса. Написать на доске и в тетради уравнение реакции.
Fe + CuSO4 = FeSO4 + Cu
Что наблюдаем? Написать уравнение, разобрать как ОВР. Почему обратная реакция между медью и раствором железного купороса невозможна?
Опыт третий — получение осадка Феррум (II) гидроксида и его окисление на воздухе.
Показать получение гидроксида Феррума (
II) взаимодействием соли и щелочи. Написать на доске и в тетради уравнение реакции в молекулярной и в ионной форме.
FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4
Что наблюдаем? Как и почему изменился цвет осадка? О протекании какого явления – физического или химического – это свидетельствует? Почему происходит потемнение осадка на воздухе? Написать на доске и в тетради уравнение реакции. Дать пояснения.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Опыт четвертый — получение осадка Феррум (III) гидроксида и его взаимодействие с кислотами.
Получить гидроксид Феррума(
III) реакцией обмена и рассмотреть его взаимодействие с кислотой.
FeCl3 + 3NaOH = Fe(OH)3↓ +3NaCl
Fe(OH)3 + 3HCl = FeCl3 + 3 H2O
Что наблюдаем? Уравнения составить в молекулярной и в ионной форме.
Феррум (
III) гидроксид проявляет слабые амфотерные свойства. Он, как и амфотерный алюминий гидроксид, реагирует не только с кислотами, но и со щелочами или основными оксидами при сплавлении.Опыт пятый и шестой — проведение качественных реакций на ионы Феррума(II) и Феррума(III).
Ионы Феррума Fe2+ можно распознать в растворе с помощью красной кровяной соли, при добавлении нескольких капель которой цвет раствора меняется на синий (осадок – турнбулева синь), тогда как в растворе солей Феррума (
III) аналогичное явление не наблюдается.
Fe+2 Cl2 + K3[ Fe+3(CN)6] =KFe +2 [Fe+3 (CN)6 ]↓ + 2KCl
Ионы Феррума Fe3+ можно обнаружить с помощью растворов роданидов, а также с помощью такого реагента, как желтая кровяная соль. При добавлении нескольких ее капель раствор соли Феррума (
III) приобретает синий цвет (осадок – берлинская лазурь).
Fe+3 Cl3 + K4[ Fe+2(CN)6] =KFe +3 [Fe+2 (CN)6 ]↓ + 3KCl
(качественные реакции записывает на доске специально подготовленный учащийся, который также комментирует их).
Желтая кровяная соль, красная кровяная соль и продукты их взаимодействия относятся к комплексным соединениям, поэтому запоминание этих реакций от всех учащихся не требуется.
Учитель. Давайте подведем итог практической части урока. Какие выводы мы можем сделать по сегодняшней работе?Учащиеся формулируют и записывают в тетради выводы к лабораторной части урока:
изучили на примере конкретных реакций свойства железа, как активного металла;
закрепили умения обращаться с лабораторным оборудованием и реактивами;
закрепили навыки составления соответствующих химических уравнений;
учились наблюдать признаки химических реакций, анализировать результаты опытов, делать выводы.
Учитель. Теперь проведем небольшой экспресс – опрос на тему «Феррум и его соединения».
На заготовленных листочках учащиеся записывают свою фамилию, тему и номера вопросов в столбик – от одного до десяти.
Вопросы задания также высвечиваются на экране.Учитель зачитывает вопросы.
1.Охарактеризуйте положение Феррума в Периодической системе.
2.К какому семейству элементов по строению электронной оболочки относится Феррум?
3.Назовите характерные для Феррума степени окисления.
4.Какие железные руды вы знаете?
5.Перечислите физические свойства железа.
6.Какие металлы железо вытесняет из их солей?
7.Какие кислоты пассивируют железо на холоду?
8.Назовите основные сплавы железа.
9.Феррум содержится в составе многих биологически важных соединений. Назовите их.
10.Назовите процесс самопроизвольного разрушения металлов и сплавов под действием факторов окружающей среды.
Учитель. Проведем взаимопроверку ваших ответов. Обменяйтесь листочками с соседом по парте и посчитайте количество правильных ответов. Поставьте оценку своему товарищу и передайте листочки на первую парту.Учитель проводит обсуждение вопросов, а учащиеся — проверку ответов.Учитель. Приготовьте дневники, запишем домашнее задание.Вопросы задания также высвечиваются на экране. Учитель объясняет и комментирует домашнее задание.
- 1й уровень. Выучить по учебнику §22, выполнить задания № 1-3, стр. 186
- 2й уровень. Используя дополнительные источники информации, подготовить сообщения на тему «Биологическая роль Феррума» или «Соединения Феррума в природе».
- 3й уровень. В составе малых творческих групп по 2-3 человека выполните учебный проект на тему «Феррум – основа цивилизации», в котором проработайте такие вопросы:
- -роль железа в развитии цивилизации;
- -свойства, которые предопределяют широкое использование железа, чугуна и стали;
- -использование железа и его сплавов в технике и в промышленности;
- -использование соединений Феррума в медицине, в сельском хозяйстве, в других областях человеческой деятельности;
- -производство чугуна и стали в Украине.
Учитель. Давайте подведем итог нашему уроку: достигли ли мы поставленных целей и задач, что удалось, что понравилось, что нового узнали?
Учащиеся обсуждают поставленный вопрос, высказывают свою точку зрения.
Учитель. На сегодняшнем уроке мы изучили свойства такого важнейшего элемента как Феррум, познакомились со свойствами железа и соединений Феррума. А для чего же мы должны хорошо знать эти свойства? Где нам могут понадобиться эти знания? (учащиеся высказывают свои версии). Приведу несколько жизненных примеров, а вы попробуйте объяснить эти явления с использованием полученных знаний.Пример первый. Один американский миллионер заказал себе яхту для морских прогулок. Яхту построили богатую. Подводную часть яхты сделали стальную (из сплава железа), а сверху яхту обшили роскошным сплавом из меди и никеля. Недешево обошлась яхта, но проплавала она совсем недолго. Объясните причину (коррозия).Пример второй. Концентрированную сульфатную (серную) кислоту транспортируют в стальных цистернах. Однажды водитель, осуществлявший такую перевозку, решил для устойчивости наполнить цистерну доверху, и разбавил свой опасный груз водой. Объясните, какое правило безопасности нарушил водитель, плохо знавший химию? И почему его «эксперимент» закончился серьезнейшей аварией, и вдобавок – экологической катастрофой на шоссе? (нельзя лить воду в кислоту; концентрированная серная кислота пассивирует железо, а разбавленная – взаимодействует с ним).
Урок хочу закончить словами великого ученого Михаила Васильевича Ломоносова: «Широко распростирает химия руки свои в дела человеческие… Куда ни посмотрим, куда ни оглянемся, везде обращаются перед очами нашими успехи ее прилежания». В наше время слова ученого приобрели особую актуальность.
Всем спасибо за внимание, урок окончен.На экране слайд: «СПАСИБО ЗА УРОК».
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Железо / Ferrum (Fe), 26 |
||
| Атомная масса (молярная масса) |
55,847 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Ar] 3d6 4s2 |
||
| Радиус атома |
126 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
117 пм |
||
| Радиус иона |
(+3e) 64 (+2e) 74 пм |
||
| Электроотрицательность |
1,83 (шкала Полинга) |
||
| Электродный потенциал |
Fe←Fe3+ −0,04 В |
||
| Степени окисления |
6, 3, 2, 0, |
||
| Энергия ионизации (первый электрон) |
759,1 (7,87) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
7,874 г/см³ |
||
| Температура плавления |
1812 K (1538.85 °C) |
||
| Температура кипения |
3134 K |
||
| Теплота плавления |
247,1 кДж/кг 13,8 кДж/моль |
||
| Теплота испарения |
~6088 кДж/кг ~340 кДж/моль |
||
| Молярная теплоёмкость |
25,14[1] Дж/(K·моль) |
||
| Молярный объём |
7,1 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая объёмноцентрированная |
||
| Параметры решётки |
2,866 Å |
||
| Температура Дебая |
460 K |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) 80,4 Вт/(м·К) |
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al[2]). Считается также, что железо составляет бо́льшую часть земного ядра.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Изотопы
- 4 Геохимия железа
- 4.1 Геохимические свойства железа
- 4.2 Минералы железа
- 4.3 Основные месторождения
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Свойства простого вещества
- 7.3 Соединения железа (II)
- 7.4 Соединения железа (III)
- 7.5 Соединения железа (VI)
- 7.6 Соединения железа VII и VIII
- 8 Применение
- 9 Биологическое значение железа
- 10 Примечания
- 11 Источники (к разделу История)
- 12 См. также
- 13 Ссылки
История
Железо, как инструментальный материал, известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.) и кинжал из шумерского города Ура (около 3100 года до н. э.). От небесного происхождения метеоритного железа происходит, видимо, одно из названий железа в греческом и латинском языках: «сидер» (что значит «звёздный»).
Изделия из железа, полученного выплавкой, известны со времени расселения арийских племён из Европы в Азию, острова Средиземного моря, и далее (конец 4-го и 3-е тысячелетие до н. э. [источник не указан 137 дней]). Самые древние железные инструменты из известных — стальные лезвия, найденные в каменной кладке пирамиды Хеопса в Египте (построена около 2530 года до н. э. [источник не указан 137 дней]). Как показали раскопки в Нубийской пустыне, уже в те времена египтяне, стараясь отделить добываемое золото от тяжёлого магнетитового песка, прокаливали руду с отрубями и подобными веществами, содержащими углерод. В результате на поверхности расплава золота всплывал слой тестообразного железа, который обрабатывали отдельно. Из этого железа ковались орудия, в том числе найденные в пирамиде Хеопса. Однако после внука Хеопса Менкаура (2471—2465 год до н. э.) в Египте наступила смута: знать во главе со жрецами бога Ра свергла правящую династию, и началась чехарда узурпаторов, закончившаяся воцарением фараона следующей династии Усеркара, которого жрецы объявили сыном и воплощением самого бога Ра (с тех пор это стало официальным статусом фараонов). В ходе этой смуты культурные и технические знания египтян пришли в упадок, и, так же как деградировало искусство строительства пирамид, технология производства железа была утеряна [источник не указан 137 дней], вплоть до того, что позднее, осваивая в поисках медной руды Синайский полуостров, египтяне не обратили никакого внимания на имевшиеся там залежи железной руды, а получали железо от соседних хеттов и митаннийцев.
Первые освоили производства железа хатты, на это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов, основавших свою империю на территории хатттов (современной Анатолии в Турции). Так, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошел, человек из города Пурусханды ко мне поклониться пришел (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнес…
(источник: Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов // Вестник древней истории. 1965. № 4.)
В древности мастерами железных изделий слыли халибы. В легенде об аргонавтах (их поход в Колхиду состоялся примерно за 50 лет до троянской войны) рассказывается, что царь Колхиды Эет дал Ясону железный плуг чтобы он вспахал поле Ареса, и описываются его подданные халиберы:
Они не пашут землю, не сажают плодовые деревья, не пасут стада на тучных лугах; они добывают руду и железо из необработанной земли и выменивают на них продукты питания. День не начинается для них без тяжкого труда, в темноте ночи и густом дыму проводят они, работая весь день…
Аристотель описал их способ получения стали: «халибы несколько раз промывали речной песок их страны — тем самым выделяя чёрный шлих (тяжелая фракция состоящая в основном из магнетита и гематита), и плавили в печах; полученный таким образом металл имел серебристый цвет и был нержавеющим».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и имела превосходные свойства. Такой своеобразный способ получения железа говорит о том, что халибы лишь распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до н. э., то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет как о прародине троянцев:
«Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида…»
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Первое письменное свидетельство о железе имеется в глиняных табличках архива египетских фараонов Аменхотепа III и Эхнатона, и относится к тому же времени (1450—1400 год до н. э.). Там упоминается о выделке железа на юге Закавказья, которое греки называли Колхидой (и возможно, что слово «kolhidos» может быть модификацией слова «halibos») — а именно, что царь страны Митанни и властитель Армении и Южного Закавказья послал египетскому фараону Аменхотепу II «вместе с 318 наложницами кинжалы и кольца из хорошего железа». Такие же подарки фараонам дарили и хетты.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога.
В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона Тутанхамона и его тестя Хаттусиля — царя хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя, и посылает только один кинжал из «хорошего железа» (то есть стали). Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты новые месторождения железа и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
«Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полоненых. И пир уготовлен веселый…»
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
«Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…»
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. Так получалось «хорошее железо» — и хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими и твердыми, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 градусов, а чистое железо плавится при 1535 градусах). При этом образуется чугун с температурой плавления 1100—1200 градусов, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторной переплавке в печи с усиленным продуванием через него воздуха, чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Библиография: Карл Бакс. Богатства земных недр. М.: Прогресс, 1986, стр. 244, глава «Железо»
Происхождение названия
Имеется несколько версий происхождения славянского слова «железо» (белор. жалеза, укр. залізо, ст.-слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo).
Одна из этимологий связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень»[3][4]. Третья версия предполагает древнее заимствование из неизвестного языка[5].
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum . Латинское ferrum (< *ferzom), скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla[6].
Германские языки заимствовали название железа (готск. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских[7].
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой»[8].
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра[9].
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы
Природное железо состоит из четырёх стабильных изотопов: 54Fe (изотопная распространённость 5,845 %), 56Fe (91,754 %), 57Fe (2,119 %) и 58Fe (0,282 %). Так же известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых — 60Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 миллиона лет[10]), 55Fe (2,737 года), 59Fe (44,495 суток) и 52Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут[11].
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд (см. Железная звезда), а все последующие элементы могут образоваться только в результате взрывов сверхновых[12].
Геохимия железа
Гидротермальный источник с железистой водой. Оксиды железа окрашивают воду в бурый цвет
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %. Содержание железа значительно повышается в изверженных породах основного состава, где оно связано с пироксеном, амфиболом, оливином и биотитом. В промышленных концентрациях железо накапливается в течение почти всех экзогенных и эндогенных процессов, происходящих в земной коре. В морской воде железо содержится в очень малых количествах 0,002—0,02 мг/л. В речной воде несколько выше — 2 мг/л.
Геохимические свойства железа
Распространение железа в пересчете на 106 атомов кремния.
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде — 1·10−5—1·10−8 %.
Другие часто встречающиеся минералы железа[13]:
- Сидерит — FeCO3 — содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см³ и твёрдость 3,5—4,5 по шкале Мооса.
- Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см³ и твёрдостью 5—6 по шкале Мооса.
- Лёллингит — FeAs2 — содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7—7,4 г/см³, твёрдость 5—5,5 по шкале Мооса.
- Миспикель — FeAsS — содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6—6,2 г/см³ и твёрдостью 5,5—6 по шкале Мооса.
- Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8—1,9 г/см³.
- Вивианит — Fe3(PO4)2·8H2O — встречается в виде сине-серых или зелено-серых моноклинных кристаллов с плотностью 2,95 г/см³ и твёрдостью 1,5—2 по шкале Мооса.
Помимо вышеописанных минералов железа существуют, например:
|
|
|
|
Основные месторождения
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн.[14] Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Венесуэле, Либерии, Украине, Франции, Индии. В России железо добывается на Курской магнитной аномалии (КМА), Кольском полуострове, в Карелии и в Сибири. Значительную роль в последнее время приобретают донные океанские месторождения, в которых железо совместно с марганцем и другими ценными металлами находится в конкрециях[источник не указан 801 день].
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода:
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III):
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например, кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида:
Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция:
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:
,
при этом не происходит загрязнения железа такими примесями как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа)
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
- выше 1394 °C устойчиво δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe как отдельную фазу[15], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.
- От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой.
- От 1400 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
- В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.[16]) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлом. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +2 | FeO | Fe(OH)2 | Слабоосновный | |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
- Кислота в свободном виде не существует — получены только её соли.
Для железа характерны степени окисления железа — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли кислоты несуществующей в свободном виде кислоты HFeO2):
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
При нагревании железо реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. В хлоре железо горит (при температуре около 200 °C), при этом образуется коричневый летучий димер Fe2Cl6. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
При взаимодействии железа с приблизительно 70%-й серной кислотой при нагревании реакция протекает с образованием сульфата железа(III):
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)[17].
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+ как правило окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При рН>4 этот ион практчиески полностью осаждается[18] в виде Fe(OH)3:
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Основные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]—.[19] Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи[20], например, феррат(VI) калия K2FeO4. Ферраты окрашены в фиолетовый цвет.
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода:[21]:
Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа VII и VIII
Имеются сообщения об электрохимическом получении соединений железа(VIII).[22],[23],[24], однако независимых работ, подтверждающих эти результаты, нет.
Применение
Железная руда
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
- Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
- Железо может входить в состав сплавов на основе других металлов — например, никелевых.
- Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
- Ультрадисперсный порошок магнетита используется во многих черно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
- Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
- Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
- Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
- Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
- Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 %[источник не указан 522 дня] являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Неорганические соединения железа встречаются в некоторых бактериях, иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой).
Суточная потребность человека в железе следующая[25]: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс). Суточная потребность в железе мала и её легко удовлетворить. Однако у ребенка, которого кормят грудью, нередко возникает дефицит железа. В организме легко восстанавливается равновесие между поступлением и выведением железа, и временный дефицит его легко восполняется за счет имеющихся запасов. Потребность в железе значительно возрастает при анемии, вызванной, например, такими паразитарными инвазиями, как малярия и анкилостомоз, которые очень широко распространены в тропических странах.
Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Примечания
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 140. — 671 с. — 100 000 экз.
- ↑ Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия: Учебник для вузов. — 4-е изд., стер. — М.: Химия, 2000, ISBN 5-7245-1130-4, с. 529
- ↑ М. Фасмер. Этимологический словарь русского языка. — Прогресс. — 1986. — Т. 2. — С. 42—43.
- ↑ Трубачёв О. Н. Славянские этимологии. // Вопросы славянского языкознания, № 2, 1957.
- ↑ Boryś W. Słownik etymologiczny języka polskiego. — Kraków: Wydawnictwo Literackie. — 2005. — С. 753—754.
- ↑ Walde A. Lateinisches etymologisches Wörterbuch. — Carl Winter’s Universitätsbuchhandlung. — 1906. — С. 285.
- ↑ Мейе А. Основные особенности германской группы языков. — УРСС. — 2010. — С. 141.
- ↑ Matasović R. Etymological Dictionary of Proto-Celtic. — Brill. — 2009. — С. 172.
- ↑ Mallory, J. P., Adams, D. Q. Encyclopedia of Indo-European Culture. — Fitzroy-Dearborn. — 1997. — P. 314.
- ↑ «New Measurement of the 60Fe Half-Life». Physical Review Letters 103: 72502. DOI:10.1103/PhysRevLett.103.072502.
- ↑ G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ Ю. М. Широков, Н. П. Юдин. Ядерная физика. М.: Наука, 1972. Глава Ядерная космофизика.
- ↑ Р. Рипан, И. Четяну. Неорганическая химия // Химия неметаллов = Chimia metalelor. — Москва: Мир, 1972. — Т. 2. — С. 482—483. — 871 с.
- ↑ Gold and Precious Metals
- ↑ Металловедение и термическая обработка стали. Справ. изд. В 3-х т./ Под ред. М. Л. Берштейна, А. Г. Рахштадта. — 4-е изд., перераб. и доп. Т. 2. Основы термической обработки. В 2-х кн. Кн. 1. М.: Металлургия, 1995. 336 с.
- ↑ T. Takahashi & W.A. Bassett, «High-Pressure Polymorph of Iron,» Science, Vol. 145 #3631, 31 Jul 1964, p 483-486.
- ↑ Schilt A. Analytical Application of 1,10-phenantroline and Related Compounds. Oxford, Pergamon Press, 1969.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989. С. 297.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989, С. 315.
- ↑ Брауэр Г. (ред.) Руководство по неорганическому синтезу. т. 5. М., Мир, 1985. С. 1757—1757.
- ↑ Реми Г. Курс неорганической химии. т. 2. М., Мир, 1966. С. 309.
- ↑ Киселёв Ю. М., Копелев Н. С., Спицын В. И., Мартыненко Л. И. Восьмивалентное железо // Докл. АН СССР. 1987. Т.292. С.628-631
- ↑ Перфильев Ю. Д., Копелев Н. С., Киселёв Ю. М., Спицын В. И. Мёссбауэровское исследование восьмивалентного железа // Докл. АН СССР. 1987. T.296. С.1406-1409
- ↑ Kopelev N.S., Kiselev Yu.M., Perfiliev Yu.D. Mossbauer spectroscopy of the oxocomplexes iron in higher oxidation states // J. Radioanal. Nucl. Chem. 1992. V.157. Р.401-411.
- ↑ «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» МР 2.3.1.2432-08
Источники (к разделу История)
- Железо в Популярной библиотеке химических элементов
- Климент Александрийский. «Строматы», глава 21
- Г. Г. Гиоргадзе. «Текст Анитты» и некоторые вопросы ранней истории хеттов
- Р. М. Абрамишвили. К вопросу об освоении железа на территории Восточной Грузии, ВГМГ, XXII-В, 1961.
- Хахутайшвили Д. А. К истории древнеколхской металлургии железа. Вопросы древней истории (Кавказско-ближневосточный сборник, вып. 4). Тбилиси, 1973.
- Геродот. «История», 1:28.
- Гомер. «Илиада», «Одиссея».
- Вергилий. «Энеида», 3:105.
- Аристотель. «О невероятных слухах», II, 48. ВДИ, 1947, № 2, стр. 327.
- Ломоносов М. В. Первые основания металлургии.
См. также
- Категория:Соединения железа
- Оксиды железа
- Гидроксиды железа
- Железнение
- Железо самородное
Ссылки
| Железо на Викискладе? |
- Железо на Webelements
- Железо в Популярной библиотеке химических элементов
- Железо на сайте XuMuK.ru
- Железо в месторождениях
- Болезни, вызванные недостатком и избытком железа в организме человека
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
| |
|
|---|---|
| Металлы | Алюминий (Al) | Железо (Fe) | Золото (Au) | Медь (Cu) | Никель (Ni) | Олово (Sn) | Палладий (Pd) | Платина (Pt) | Серебро (Ag) | Свинец (Pb) | Хром (Cr) | Цинк (Zn) |
| Сплавы | Акмонитал | Алюминиевая бронза (CuAl) | Биллон (CuAg) | Бронза (CuSn) | Колыванская медь (CuAuAg) | Латунь (CuZn) | Медно-никелевый сплав (CuNi) | Мельхиор (CuNiFeMn) | Нейзильбер, нойзильбер (CuZnNi) | Нержавеющая сталь (FeCrNi) | Никелевая бронза (CuSnNi) | Никелево-железный сплав (NiFe) | Никелево-цинковый сплав (NiZn) | Потин | Северное золото (CuAlZnSn) | Сталь (Fe) | Стерлинг (AgCu) | Томпак (CuZn) | Хромированная сталь (FeCr) | Чугун (Fe) | Электр, электрон, электрум (AuAg) |
| Группы монет | Биметаллические монеты | Бронзовые монеты | Медные монеты | Железные монеты | Золотые монеты | Палладиевые монеты | Платиновые монеты | Серебряные монеты | Сибирская монета |
| Группы металлов | Монетная группа (подгруппа меди) | Благородные металлы | Платиновая группа |
| См. также | Безмонетный период | Бумажные деньги | Денежная бумага | Кожаные рубли | Марки-деньги | Монетное дело | Нотгельд | Символы благородных металлов |
Железо (Fe от лат. Ferrum) — элемент восьмой группы (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Один из самых распространённых в земной коре металлов: второе место после алюминия.
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
|
|
|
| Название, символ, номер | Железо / Ferrum (Fe), 26 |
|---|---|
| Атомная масса (молярная масса) |
55,845(2) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Радиус атома | 126 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+3e) 64 (+2e) 74 пм |
| Электроотрицательность | 1,83 (шкала Полинга) |
| Электродный потенциал | Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) |
759,1 (7,87) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,874 г/см³ |
| Температура плавления | 1812 K (1538,85 °C) |
| Температура кипения | 3134 K (2861 °C) |
| Уд. теплота плавления | 247,1 кДж/кг 13,8 кДж/моль |
| Уд. теплота испарения | ~6088 кДж/кг ~340 кДж/моль |
| Молярная теплоёмкость | 25,14 Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 2,866 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 80,4 Вт/(м·К) |
| Номер CAS | 7439-89-6 |
История
Основная статья: История железа
Железо как инструментальный материал известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.) и кинжал из шумерского города Ура (около 3100 года до н. э.). От небесного происхождения метеоритного железа происходит, видимо, одно из названий железа в греческом и латинском языках: «сидер» (что значит «звёздный»).
Первыми освоили метод выплавки железа хатты. На это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов, основавших свою империю на территории хаттов (современной Анатолии в Турции). Так, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошёл, человек из города Пурусханды ко мне поклониться пришёл (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнёс…
— Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов // Вестник древней истории. 1965. № 4.
В древности мастерами железных изделий слыли халибы. В легенде об аргонавтах (их поход в Колхиду состоялся примерно за 50 лет до троянской войны) рассказывается, что царь Колхиды Эет дал Ясону железный плуг, чтобы он вспахал поле Ареса, и описываются его подданные халиберы:
Они не пашут землю, не сажают плодовые деревья, не пасут стада на тучных лугах; они добывают руду и железо из необработанной земли и выменивают на них продукты питания. День не начинается для них без тяжкого труда, в темноте ночи и густом дыму проводят они, работая весь день…
Аристотель описал их способ получения стали: «халибы несколько раз промывали речной песок их страны — тем самым выделяя чёрный шлих (тяжёлая фракция, состоящая в основном из магнетита и гематита), и плавили в печах; полученный таким образом металл имел серебристый цвет и был нержавеющим».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и имела превосходные свойства. Такой своеобразный способ получения железа говорит о том, что халибы лишь распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до н. э., то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет как о прародине троянцев:
Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида…
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Первое письменное свидетельство о железе имеется в глиняных табличках архива египетских фараонов Аменхотепа III и Эхнатона, и относится к тому же времени (1450—1400 год до н. э.). Там упоминается о выделке железа на юге Закавказья, которое греки называли Колхидой (и возможно, что слово «kolhidos» может быть модификацией слова «halibos») — а именно, что царь страны Митанни и властитель Армении и Южного Закавказья послал египетскому фараону Аменхотепу II «вместе с 318 наложницами кинжалы и кольца из хорошего железа». Такие же подарки фараонам дарили и хетты.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога.
В гробнице Тутанхамона (около 1350 года до н. э.) было найдено девятнадцать предметов из железа, включая кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона Тутанхамона и его тестя Хаттусиля — царя хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя, и посылает только один кинжал из «хорошего железа» (то есть стали). Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты новые месторождения железа и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полонёных. И пир уготовлен весёлый…
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь, приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. Так получалось «хорошее железо» — и хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими и твёрдыми, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 °C, а чистое железо плавится при 1535 °C). При этом образуется чугун с температурой плавления 1100—1200 °C, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторной переплавке в печи с усиленным продуванием через него воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Происхождение названия
Праславянское *želězo (белор. жалеза, укр. залізо, ст.‑слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo) имеет ясные параллели в балтийских языках (лит. geležis, латыш. dzelzs). Слово является однокоренным словам «железа» и «желвак»; и имеет смысл «округлый камень, окатыш, блямба».
Имеется несколько версий дальнейшей этимологии этого балтославянского слова.
Одна из них связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень». Третья версия предполагает древнее заимствование из неизвестного языка.
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum. Латинское ferrum (< *ferzom), возможно, заимствовано из какого-то восточного языка, скорее всего, из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla. Отсюда же, вероятно, баскское burdina.
Германские языки заимствовали название железа (готск. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских.
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой».
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра.
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности, древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы
Основная статья: Изотопы железа
Природное железо состоит из четырёх стабильных изотопов: 54Fe (изотопная распространённость 5,845 %), 56Fe (91,754 %), 57Fe (2,119 %) и 58Fe (0,282 %). Так же известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых — 60Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 миллиона лет), 55Fe (2,737 года), 59Fe (44,495 суток) и 52Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут.
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд (см. Железная звезда), а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Геохимия железа
Гидротермальный источник с железистой водой. Оксиды железа окрашивают воду в бурый цвет
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %. Содержание железа значительно повышается в изверженных породах основного состава, где оно связано с пироксеном, амфиболом, оливином и биотитом. В промышленных концентрациях железо накапливается в течение почти всех экзогенных и эндогенных процессов, происходящих в земной коре. В морской воде железо содержится в очень малых количествах 0,002—0,02 мг/л. В речной воде его концентрация значительно выше — 2 мг/л.
Геохимические свойства железа
Распространение железа в пересчёте на 106 атомов кремния.
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро Земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeO · Fe2O3 или Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире.
Содержание железа в морской воде — 1⋅10−5—1⋅10−8 %.
Другие часто встречающиеся минералы железа:
- Сидерит — FeCO3 — содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см³ и твёрдость 3,5—4,5 по шкале Мооса.
- Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см³ и твёрдостью 5—6 по шкале Мооса.
- Лёллингит — FeAs2 — содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7—7,4 г/см³, твёрдость 5—5,5 по шкале Мооса.
- Миспикель — FeAsS — содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6—6,2 г/см³ и твёрдостью 5,5—6 по шкале Мооса.
- Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8—1,9 г/см³.
- Вивианит — Fe3(PO4)2·8H2O — встречается в виде сине-серых или зелёно-серых моноклинных кристаллов с плотностью 2,95 г/см³ и твёрдостью 1,5—2 по шкале Мооса.
Помимо вышеописанных минералов железа, существуют, например:
|
|
|
|
Основные месторождения
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн. Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Венесуэле, Либерии, Украине, Франции, Индии. В России железо добывается на Курской магнитной аномалии (КМА), Кольском полуострове, в Карелии и в Сибири. Значительную роль в последнее время приобретают донные океанские месторождения, в которых железо совместно с марганцем и другими ценными металлами находится в конкрециях.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода:
- 2C + O2 ⟶ 2CO↑
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III):
- 3CO + Fe2O3 ⟶ 2Fe + 3CO2↑
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например, кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида:
- CaCO3 →1000∘C CaO + CO2↑
Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция:
- CaO + SiO2 →>1000∘C CaSiO3
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:
- Fe2O3 + 3H2 →1000∘C 2Fe + 3H2O,
при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа);
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмно-центрированной кубической решётки и магнитными свойствами парамагнетика;
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой;
- выше 1394 °C устойчиво δ-Fe с объёмно-центрированной кубической решёткой.
Металловедение не выделяет β-Fe как отдельную фазу, и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- от абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой;
- от 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой;
- от 1400 до 1539 °C устойчива δ-модификация с объёмно-центрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо—углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
- В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
Диаграмма Пурбе для Fe-H2O
Для железа характерны степени окисления — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2):
-
- Fe2O3 + 2NaOH → 2NaFeO2 + H2O
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Известны также степени окисления: −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
Взаимодействует с кислотами.
- С соляной кислотой:
-
- Fe + 2HCl → FeCl2 + H2↑
- С разбавленной серной кислотой:
-
- Fe + H2SO4 → FeSO4 + H2↑
- Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании:
-
- 2Fe + 6H2SO4 →to Fe2(SO4)3 + 3SO2↑ + 6H2O
- Взаимодействие с кислородом.
-
- Железо горит в кислороде, нагретое горит на воздухе, пирофорное — на воздухе без нагревания:
-
- 3Fe + 2O2 →150−600oC Fe3O4
- Пропускание кислорода или воздуха через расплавленное железо:
-
- 2Fe + O2 →to 2FeO
- Взаимодействие с порошком серы при нагревании:
-
- Fe + S →to FeS
- Взаимодействие с галогенами при нагревании.
-
- Горение в хлоре:
-
- 2Fe + 3Cl2 →to 2FeCl3
- При повышенном давлении паров брома:
-
- 2Fe + 3Br2 →p 2FeBr3
- Взаимодействие с йодом:
-
- 3Fe + 4I2 → Fe3I8
- Взаимодействие с неметаллами.
-
- С азотом при нагревании:
-
- 6Fe + N2 →to 2Fe3N
- С фосфором при нагревании:
-
- Fe + P →to FeP
- 2Fe + P →to Fe2P
- 3Fe + P →to Fe3P
- С углеродом:
-
- 3Fe + C → Fe3C
- С кремнием:
-
- Fe + Si → FeSi
- Взаимодействие раскалённого железа с водяным паром:
-
- 3Fe + 4H2O →to Fe3O4 + 4H2↑
- Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей:
-
- Fe + CuSO4 → FeSO4 + Cu
- Железо восстанавливает соединения железа(III):
-
- Fe + 2FeCl3 → 3FeCl2
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
-
- 4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6H2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок гексацианоферрата (III) калия-железа (II) (турнбулева синь):
-
- K3[Fe(CN)6] + Fe2+ → KFeII[FeIII(CN)6]↓ + 2K+,
который внутримолекулярно перегруппировывается в гексацианоферрат (II) калия-железа (III) (берлинская лазурь):
-
- KFeII[FeIII(CN)6] → KFeIII[FeII(CN)6]
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9).
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
-
- 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+, как правило, окружён шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При pH>4 этот ион практически полностью осаждается в виде Fe(OH)3:
-
- Fe3+ + 3H2O → Fe(OH)3↓ + 3H+
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Кислотные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
-
- Fe(OH)3 + 3KOH → K3[Fe(OH)6]
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
-
- Fe2O3 + 2NaOH → 2NaFeO2 + H2O
Соединения железа(III) в растворах восстанавливаются металлическим железом:
-
- Fe + 2FeCl3 → 3FeCl2
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с неорганическими тиоцианатами SCN−. При этом образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]—. Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок гексацианоферрата (II) калия-железа (III) (берлинская лазурь):
-
- K4[Fe(CN)6] + FeCl3 → KFeIII[FeII(CN)6]↓ + 3KCl
Количественно ионы Fe3+ определяют по образованию красных (в слабокислой среде) или жёлтых (в слабощелочной среде) комплексов с сульфосалициловой кислотой. Эта реакция требует грамотного подбора буферов, так как некоторые анионы (в частности, ацетат) образуют с железом и сульфосалициловой кислотой смешанные комплексы со своими оптическими характеристиками.
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щёлочи:
-
- 2Fe(OH)3 + 3Cl2 + 10KOH → 2K2FeO4 + 6KCl + 8H2O
Ферраты также можно получить электролизом 30%-ного раствора щёлочи на железном аноде:
-
- Fe + 2KOH + 2H2O → K2FeO4 + 3H2↑
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода:
-
- 4FeO42− + 20H+ → 4Fe3+ + 3O2↑ + 10H2O
Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа VII и VIII
Известна степень окисления VII в анионе [FeO4]—.
Имеются сообщения об электрохимическом получении соединений железа(VIII), однако независимых работ, подтверждающих эти результаты, нет.
Применение
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
- Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
- Железо может входить в состав сплавов на основе других металлов — например, никелевых.
- Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
- Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
- Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
- Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
- Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
- Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
- Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). Основным внутриклеточным депо железа является глобулярный белковый комплекс — ферритин. Недостаток железа проявляется как болезнь организма: хлороз у растений и анемия у животных.
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК. Неорганические соединения железа встречаются в некоторых бактериях, иногда используется ими для связывания азота воздуха.
Железо в организме человека
В организме взрослого человека содержится около 3—4 граммов железа (около 0,02 %), из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68 % железа всего организма, ферритин — 27 %, миоглобин — 4 %, трансферрин — 0,1 %. Источниками железа при биосинтезе железосодержащих белков служат железо, поступающее из пищи, и железо, освобождающееся при постоянном распаде эритроцитов в гепатоцитах (клетках печени) и клетках селезёнки.
Суточная потребность человека в железе, по российским данным, следующая: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин детородного возраста потребность в железе выше ввиду регулярной кровопотери во время менструаций.
Национальная Академия медицины США различает среднюю потребность в железе и рекомендованное потребление железа, последняя норма разработана с тем, чтоб обеспечивать среднюю потребность для не менее 97 % в каждой группе населения. Расчет средней потребности в железе зависит от усваиваемости железа, нижеприведённая таблица основана на предположении о потреблении 10 % железа из животных продуктов (средняя усваиваемость 25 %) и 90 % железа из растительных продуктов (средняя усваиваемость 16,8 %), с общей усваиваемостью 18 %. Поскольку рацион детей до года сильно отличается от взрослого, норма для них основана на предполагаемой усваиваемости 10 %
| Пол | Возраст | Рекомендованное потребление железа (по Национальной Академии медицины США), мг/сутки |
|---|---|---|
| Младенцы | до 6 месяцев | 0,27 |
| Младенцы | 7—12 месяцев | 11 |
| Дети | 1—3 года | 7 |
| Дети | 4—8 лет | 10 |
| Подростки | 9—13 лет | 8 |
| Юноши | 14—18 лет | 11 |
| Девушки | 14—18 лет | 15 |
| Мужчины | 19 лет и старше | 8 |
| Женщины | 19—50 лет | 18 |
| Женщины | 50 лет и старше | 8 |
В организм животных и человека железо поступает с пищей. Наиболее богаты им печень и мясо, в меньшей степени яйца, бобовые, семена тыквы и кунжута, цельнозерновые крупы, а также некоторые виды зелени — тимьян, петрушка, полевой салат. Долгое время список железосодержащих продуктов возглавлял шпинат, ошибочно внесённый из-за опечатки в результатах анализа (был потерян «лишний» ноль после запятой).
Железо в питании подразделяют на гемовое, или гемное (из мяса и других животных источников) и негемовое (из растительной пищи). В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонуклеотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа. Описанные белки, содержащие негемовое железо, относятся к классу ферредоксинов, наиболее изученные из которых содержатся в хлоропластах зелёных растений и окисляются при переносе электрона в процессе фотосинтеза, а также бактериальные ферредоксины (например анаэробной бактерии Clostridium pasteurianum), участвующие в аэробном или анаэробном переносе электрона. Человеческий ферредоксин-1 участвует в гидроксилировании и расщеплении стероидных гормонов и холестерола в системе микросомальных (эндоплазматического ретикулума гепатоцитов) ферментов цитохрома Р450, а также в синтезе гормонов щитовидной железы. Сердцевина ферредоксина состоит из молекул двух- или четырёх-валентной серы и четырёхвалентного железа и имеет общую формулу вида FenSmHp (например Fe2S2), она соединена с белковыми остовами через аминокислоту цистеин.Гемовое железо усваивается наиболее эффективно (от 15 до 35 %). На усвоение негемового железа (даже в животной пище его порядка 60 %) влияют многочисленные факторы. Заметно улучшают усвоение железа потребляемые вместе с пищей аскорбиновая кислота или мясной белок. Препятствуют усвоению железа яйца, кальций, но главным образом антипитательные вещества — фитиновая кислота, оксалаты, танины и кофеин.
К примеру, из-за высокого уровня фитиновых соединений усвоение железа из бобовых находится в районе 0,84-0,91 %. Согласно одному из американских исследований, потребление с железосодержащей пищей богатого танинами чая снижает усвоение микроэлемента на 62 %, кофе — на 35 %, а потребление апельсинового сока (с высоким содержанием аскорбиновой кислоты) увеличивает его на 85 %. В то же время данные из Китая указывают на то, что даже очень высокое потребление чая в целом не сказывается на содержании железа в крови.
Дефицит железа
Основная статья: Дефицит железа
При недостатке железа костный мозг продуцирует меньше эритроцитов, а клетки крови сокращаются в размерах.
При сбалансированной диете железа, поступающего с пищей, как правило, вполне достаточно. В организме легко восстанавливается равновесие между поступлением и выведением железа, и временный дефицит его легко восполняется за счёт имеющихся запасов. И, тем не менее, дефицит железа — обычное явление в развивающихся странах с ограниченной доступностью мясных продуктов. Это самое распространённое на Земле нарушение питания, которому подвержены до 2 млрд человек во всём мире.
В некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс). Потребность в железе значительно возрастает при анемии, вызванной, например, такими паразитарными инвазиями, как малярия и анкилостомоз, которые очень широко распространены в тропических странах.
Вегетарианцам советуют принимать примерно в 1,8 раза больше железа, чем не вегетарианцам. В западных странах продукты, ориентированные на веганов, часто обогащают железом, хотя усваиваемость солей железа (железосодержащих препаратов) зачастую проблематична и польза от приёма таких добавок здоровыми людьми не доказана. Известно, что организм вегетарианцев приспосабливается к диете и более эффективно удерживает имеющиеся запасы железа.
По результатам ряда исследований, за время приготовления в железной и чугунной посуде содержание железа в пище возрастает в от 1,2 до 21 раза . При этом содержание железа сильнее возрастает в соусах или еде, приготовленной в соусе (например, чили). Испытывающим недостаток в железе даже предлагают класть в посуду, где готовится еда, специальные фигурки из чугуна.
В то время, как некоторые исследователи считают, что кормление грудью приводит к дефициту железа, есть множество исследований, показывающих, что это не так, и дети, которых кормят грудью, усваивают железо намного лучше.
Переизбыток железа
Гемохроматоз
Избыточное железо может попадать в организм городского жителя вместе с ржавой водой из-под крана (по чугунным трубам). Так же использование железной и чугунной посуды в приготовлении пищи повышает содержание в ней железа.
Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени — гемохроматоза. ПДК железа в воде 0,3 мг/л.
Избыточное накопление железа в организме оказывает токсическое действие. Передозировка железа стимулирует выработку свободных радикалов, угнетает антиоксидантную систему организма и, вероятно, способствует развитию атеросклероза, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2.6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).

Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойства
Оксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц.) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц.) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Содержание:
Фуррум это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума играют особую роль в живой природе.
Атом Феррума может потерять 2 электрона и превратиться в ион
Железо
Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда человек использовал метеоритное железо, а позднее научился получать металл из руды.
Распространенность феррума в природе
По распространенности в земной коре Феррум разделяет с Кальцием б—7-е места (в каждой тысяче атомов содержится по 18 атомов этих элементов).
Известно много природных соединений Феррума. Соединения Феррума с Оксигеном — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из крупнейших в мире.
Кроме соединений Феррума, в природе иногда встречается метеоритное железо.
Небольшое количество Феррума содержится в природной воде (в виде ионов 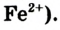
По утверждениям ученых, железо вместе с никелем образуют ядро нашей планеты.
В живых существах Феррума очень мало. Ионы 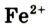
В организме взрослого человека содержится 3-5 г Феррума.
Физические свойства железа
Железо — серовато-серебристый пластичный металл, который плавится при температуре 1539 °С, притягивается магнитом. Образует много сплавов с различными металлами.
Химические свойства железа
Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот металл самовозгорается на воздухе. Довольно чистое железо (например, метеоритное) не ржавеет.
В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами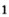
Реакции с неметаллами
При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла. Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла):
Рис. 67. Горение стальной пружинки в кислороде
Формулу продукта реакции можно записать и так: 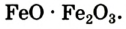
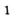
Железо сгорает и в газе хлоре (рис. 68):
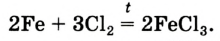
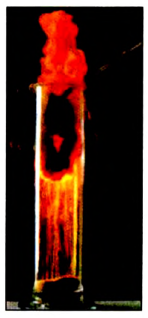
Если нагреть смесь порошков железа и серы, то при определенной температуре начинается реакция, которая происходит с выделением значительного количества теплоты. Продуктом реакции является соединение Феррума
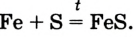
Реакция с водой. Железо при высокой температуре может взаимодействовать с водой (раскаленный металл реагирует с водяным паром):
Раньше с помощью этой реакции получали в промышленности водород.
Ржавление (коррозия) железа
С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желто-бурый налет — ржавчина. Разрушение железа под действием воды и кислорода называют ржавлением, или коррозией.
Использовав для ржавчины формулу 
Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными
Рис. 69.Коррозия железа: а — бочка, которую «съела» ржавчина; б — ржавая проволока, на которой закреплена оцинкованная железная сетка
смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).
Полностью исключает коррозию замена железа нержавеющей сталью — сплавом железа с хромом и никелем.
Применение железа
Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, железа промышленное оборудование и т. п. (схема 10).
Схема 10.Применение железа
Выводы:
- Феррум — металлический элемент; его простое вещество — металл железо. Кроме атомов Феррума, существуют ионы
+ и
, которые входят в состав соединений Феррума
и Феррума
Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.
- Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода.
- Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией.
- Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем.
- Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях.
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
- Атом в химии
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
| Железо | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Марганец | Кобальт → | ||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||||||||||||||||||||||

Сверхчистое железо |
||||||||||||||||||||||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||||||||||||||||||||||
| Название, символ, номер | Железо / Ferrum (Fe), 26 | |||||||||||||||||||||||||||||||||||||||
| Группа, период, блок |
8 (устар. 8), 4, d-элемент |
|||||||||||||||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
55,845(2)[1] а. е. м. (г/моль) | |||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация |
[Ar] 3d64s2 1s22s22p63s23p63d64s2 |
|||||||||||||||||||||||||||||||||||||||
| Радиус атома | 140 [2] 126[3] пм | |||||||||||||||||||||||||||||||||||||||
| Химические свойства | ||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 117 пм | |||||||||||||||||||||||||||||||||||||||
| Радиус иона | (+3e) 63 (+2e) 77 [3] пм | |||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1,83 (шкала Полинга) | |||||||||||||||||||||||||||||||||||||||
| Электродный потенциал |
Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
|||||||||||||||||||||||||||||||||||||||
| Степени окисления | +2; +3 (наиболее характерны) +1; +4; +6; +8 (встречаются реже) [2] +7 (в ионном соединении) [4]. | |||||||||||||||||||||||||||||||||||||||
| Энергия ионизации |
1‑я: 759,1 (7,893)[2] кДж/моль (эВ) 3‑я: (30,65) кДж/моль (эВ) |
|||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 7,874 г/см³ | |||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1812 K (1538,85 °C) | |||||||||||||||||||||||||||||||||||||||
| Температура кипения | 3134 K (2861 °C) | |||||||||||||||||||||||||||||||||||||||
| Уд. теплота плавления | 247,1 кДж/кг 13,8 кДж/моль | |||||||||||||||||||||||||||||||||||||||
| Уд. теплота испарения | ~6088 кДж/кг ~340 кДж/моль | |||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 25,14[5] Дж/(K·моль) | |||||||||||||||||||||||||||||||||||||||
| Молярный объём | 7,1 см³/моль | |||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||||||||||||||||||||||
| Структура решётки | Кубическая объёмноцентрированная | |||||||||||||||||||||||||||||||||||||||
| Параметры решётки | 2,866 Å | |||||||||||||||||||||||||||||||||||||||
| Температура Дебая | 460 K | |||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 K) 80,4 Вт/(м·К) | |||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7439-89-6 | |||||||||||||||||||||||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||||||||||||||||||||||
|
Основная статья: Изотопы железа
|
Желе́зо (химический символ — Fe, от лат. Ferrum) — химический элемент 8-й группы (по устаревшей классификации — побочной подгруппы восьмой группы, VIIIB) четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26.
Простое вещество железо — это ковкий переходный металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует на воздухе при высоких температурах или при высокой влажности. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Один из самых распространённых в земной коре металлов: второе место после алюминия.
Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, ванадий и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего — в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 %[3] (4-е место после O, Si, Al[6]). Считается также, что железо составляет бо́льшую часть земного ядра, что проявляется в наличии магнитного поля Земли.
История
Железо как инструментальный материал известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), украшения из египетских гробниц (около 3800 года до н. э.)[7][8]и кинжал из шумерского города Ура (около 3100 года до н. э.).[9]
Первыми освоили метод выплавки железа хатты. На это указывает древнейшее (2-е тысячелетие до н. э.) упоминание железа в текстах хеттов, основавших свою империю на территории хаттов (современной Анатолии в Турции)[10].
В древности мастерами железных изделий считались халибы[11].
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400.[12] В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие описан «одр железный» рефаимского царя Ога[13].
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл[14].
В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть в это время железо уже стало широко применяться в больших количествах.
В дальнейшем научились[кто?] делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 °C, а чистое железо плавится при 1535 °C). При этом образуется чугун с температурой плавления 1100—1200 °C, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке) и не обладающий упругостью стали.[15][неавторитетный источник?] Первоначально его считали[кто?] вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось[кем?], что при повторной переплавке в печи с усиленным продуванием через него воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов[16].
Происхождение названия
Праславянское *želězo (белор. жалеза, укр. залізо, ст.‑слав. желѣзо, болг. желязо, сербохорв. жељезо, польск. żelazo, чеш. železo, словен. železo) имеет ясные параллели в балтийских языках (лит. geležis, латыш. dzelzs). Слово является однокоренным словам «железа» и «желвак»; и имеет смысл «округлый камень, окатыш, блямба»[17].
Имеется несколько версий дальнейшей этимологии этого балтославянского слова.
Одна из них связывает праслав. *želězo с греческим словом χαλκός, что означало железо и медь, согласно другой версии *želězo родственно словам *žely «черепаха» и *glazъ «скала», с общей семой «камень»[18][19]. Третья версия предполагает древнее заимствование из неизвестного языка[20].
Романские языки (итал. ferro, фр. fer, исп. hierro, порт. ferro, рум. fier) продолжают лат. ferrum. Латинское ferrum (< *ferzom), возможно, заимствовано из какого-то восточного языка, скорее всего, из финикийского. Ср. ивр. barzel, шумерск. barzal, ассирийск. parzilla[21]. Отсюда же, вероятно, баскское burdina.
Германские языки заимствовали название железа (готск. eisarn, англ. iron, нем. Eisen, нидерл. ijzer, дат. jern, швед. järn) из кельтских[22].
Пракельтское слово *isarno- (> др.-ирл. iarn, др.-брет. hoiarn), вероятно, восходит к пра-и.е. *h1esh2r-no- «кровавый» с семантическим развитием «кровавый» > «красный» > «железо». Согласно другой гипотезе данное слово восходит к пра-и.е. *(H)ish2ro- «сильный, святой, обладающий сверхъестественной силой»[23].
Древнегреческое слово σίδηρος, возможно, было заимствовано из того же источника, что и славянское, германское и балтийское слова для серебра[24].
Название природного карбоната железа (сидерита) происходит от лат. sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности, древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы
Природное железо состоит из четырёх стабильных изотопов: 54Fe (изотопная распространённость 5,845 %), 56Fe (91,754 %), 57Fe (2,119 %) и 58Fe (0,282 %). Также известно более 20 нестабильных изотопов железа с массовыми числами от 45 до 72, наиболее устойчивые из которых — 60Fe (период полураспада по уточнённым в 2009 году данным составляет 2,6 миллиона лет[25]), 55Fe (2,737 года), 59Fe (44,495 суток) и 52Fe (8,275 часа); остальные изотопы имеют период полураспада менее 10 минут[26].
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут увеличить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы увеличить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд (см. Железная звезда), а все последующие элементы могут образоваться только в результате взрывов сверхновых[27].
Геохимия железа

Гидротермальный источник с железистой водой. Оксиды железа окрашивают воду в бурый цвет
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %. Содержание железа значительно повышается в изверженных породах основного состава, где оно связано с пироксеном, амфиболом, оливином и биотитом. В промышленных концентрациях железо накапливается в течение почти всех экзогенных и эндогенных процессов, происходящих в земной коре. В морской воде железо содержится в очень малых количествах 0,002—0,02 мг/л. В речной воде его концентрация значительно выше — 2 мг/л.
Геохимические свойства железа
Распространение железа в пересчёте на 106 атомов кремния.
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро Земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeO · Fe2O3 или Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире[источник не указан 3613 дней].
Содержание железа в морской воде — 1⋅10−5—1⋅10−8 %.
Другие часто встречающиеся минералы железа[28]:
- Сидерит — FeCO3 — содержит примерно 35 % железа. Обладает желтовато-белым (с серым или коричневым оттенком в случае загрязнения) цветом. Плотность равна 3 г/см³ и твёрдость 3,5—4,5 по шкале Мооса.
- Марказит — FeS2 — содержит 46,6 % железа. Встречается в виде жёлтых, как латунь, бипирамидальных ромбических кристаллов с плотностью 4,6—4,9 г/см³ и твёрдостью 5—6 по шкале Мооса.
- Лёллингит — FeAs2 — содержит 27,2 % железа и встречается в виде серебристо-белых бипирамидальных ромбических кристаллов. Плотность равна 7—7,4 г/см³, твёрдость 5—5,5 по шкале Мооса.
- Миспикель — FeAsS — содержит 34,3 % железа. Встречается в виде белых моноклинных призм с плотностью 5,6—6,2 г/см³ и твёрдостью 5,5—6 по шкале Мооса.
- Мелантерит — FeSO4·7H2O — реже встречается в природе и представляет собой зелёные (или серые из-за примесей) моноклинные кристаллы, обладающие стеклянным блеском, хрупкие. Плотность равна 1,8—1,9 г/см³.
- Вивианит — Fe3(PO4)2·8H2O — встречается в виде сине-серых или зелёно-серых моноклинных кристаллов с плотностью 2,95 г/см³ и твёрдостью 1,5—2 по шкале Мооса.
Помимо вышеописанных минералов железа, существуют, например:
|
|
|
|
Основные месторождения
По данным Геологической службы США (оценка 2011 г.), мировые разведанные запасы железной руды составляют порядка 178 млрд тонн[29].
Основные месторождения железа находятся в Бразилии (1 место), Австралии, США, Канаде, Швеции, Германии, Венесуэле, Либерии, Украине, Польше, ЮАР, Японии, Китае, Болгарии, Монголии, Франции, Индии.
В 2019 было добыто 2,896 млрд тонн железной руды, общей стоимостью приблизительно 366 млрд долларов США[30]. Цена железной руды составляет 126,35 долларов/тонна[31].
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, оно имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа);
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмно-центрированной кубической решётки и магнитными свойствами парамагнетика;
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой;
- выше 1394 °C устойчиво δ-Fe с объёмно-центрированной кубической решёткой.
Металловедение не выделяет β-Fe как отдельную фазу[32], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- от абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой;
- от 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой;
- от 1400 до 1539 °C устойчива δ-модификация с объёмно-центрированной кубической (ОЦК) кристаллической решёткой.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо—углерод). Твёрдый раствор углерода в α- и δ-железе называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы. Твёрдый раствор углерода в γ-железе называется аустенитом.
- В области высоких давлений (свыше 13 ГПа, 128,3 тыс. атм.[33]) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо относится к умеренно тугоплавким металлам. В ряду стандартных электродных потенциалов железо стоит до водорода и легко реагирует с разбавленными кислотами. Таким образом, железо относится к металлам средней активности.
Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
Химическая активность железа зависит от степени его чистоты, дисперсности, присутствия влаги и кислорода.

Для железа наиболее характерны степени окисления — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2):
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят друг в друга при изменении окислительно-восстановительных потенциалов.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Известны также степени окисления: −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
Взаимодействует с кислотами.
- С соляной кислотой, образуя хлорид железа (ΙΙ):
- С разбавленной серной кислотой, образуя сульфат железа (II):
- Концентрированные азотная и серная кислоты пассивируют железо. C концентрированной серной кислотой взаимодействует только при нагревании, образуя сульфат железа(III):
- Взаимодействие с кислородом.
-
- Железо[34] горит в кислороде при нагревании; или без, в случае пирофорности; образуя оксид железа (II, III):[35][36][37]:
- Пропускание кислорода или воздуха через расплавленное железо, образуется оксид железа (II):
- Взаимодействует с порошком серы при нагревании, образуя сульфид железа (II):
- Взаимодействует с галогенами при нагревании:
-
- Горит в хлоре, образуя хлорид железа (III) :
- При повышенном давлении взаимодействует с парами брома, образуя бромид железа (III):
- Взаимодействует с йодом, образуя йодид железа (II, III):
- Взаимодействие с неметаллами.
-
- С азотом при нагревании, образуя нитрид дижелеза:
- С фосфором при нагревании, образуя фосфиды железа:
- С углеродом, образуя карбид железа:
- С кремнием при нагревании, образуя силицид железа:
- Взаимодействие раскалённого железа с водяным паром даёт оксид железа (III):
- Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей:
- Железо восстанавливает соединения железа(III):
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
Соединения железа (II)
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2.
Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок гексацианоферрата (III) калия-железа (II) (турнбулева синь):
-
,
который внутримолекулярно перегруппировывается в гексацианоферрат (II) калия-железа (III) (берлинская лазурь):
Для количественного определения железа (II) в растворе используют фенантролин Phen, образующий с железом (II) красный комплекс FePhen3 (максимум светопоглощения — 520 нм) в широком диапазоне рН (4-9)[38].
Соединения железа (III)
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+, как правило, окружён шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Ион Fe3+ полностью гидролизуется даже в кислой среде. При pH>4 этот ион практически полностью осаждается в виде Fe(OH)3[39]:
При частичном гидролизе иона Fe3+ образуются многоядерные оксо- и гидроксокатионы, из-за чего растворы приобретают коричневый цвет.
Кислотные свойства гидроксида железа(III) Fe(OH)3 выражены очень слабо. Он способен реагировать только с концентрированными растворами щелочей:
Образующиеся при этом гидроксокомплексы железа(III) устойчивы только в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
При сплавлении со щелочами и оксидами других металлов Fe2O3 образует разнообразные ферриты:
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
Для качественного обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с неорганическими тиоцианатами SCN−. При этом образуется смесь ярко-красных роданидных комплексов железа [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]−[40]. Состав смеси (а значит, и интенсивность её окраски) зависит от различных факторов, поэтому для точного качественного определения железа этот метод неприменим.
Другим качественным реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок гексацианоферрата (II) калия-железа (III) (берлинская лазурь):
Количественно ионы Fe3+ определяют по образованию красных (в слабокислой среде) или жёлтых (в слабощелочной среде) комплексов с сульфосалициловой кислотой. Эта реакция требует грамотного подбора буферов, так как некоторые анионы (в частности, ацетат) образуют с железом и сульфосалициловой кислотой смешанные комплексы со своими оптическими характеристиками.
Соединения железа (VI)
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты.
Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щёлочи[41]:
Ферраты также можно получить электролизом 30%-ного раствора щёлочи на железном аноде:
Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода[42]:
Окислительные свойства ферратов используют для обеззараживания воды.
Соединения железа VII и VIII
Известна степень окисления +7 в анионе [FeO4]−[4].
Имеются сообщения об электрохимическом получении соединений железа (VIII)[43][44][45], однако независимых работ, подтверждающих эти результаты, нет.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода:
В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа(III):
Флюс добавляется для избавления от нежелательных примесей (в первую очередь от силикатов; например, кварц) в добываемой руде. Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Для устранения других примесей используют другие флюсы.
Действие флюса (в данном случае карбонат кальция) заключается в том, что при его нагревании он разлагается до его оксида:
Оксид кальция соединяется с диоксидом кремния, образуя шлак — метасиликат кальция:
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности — это свойство позволяет разделять шлак от металла. Шлак затем может использоваться при строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме таких случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишки углерода и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используются и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо:
,
при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Применение

Железная руда
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
- Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
- Железо может входить в состав сплавов на основе других металлов — например, никелевых.
- Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
- Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
- Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
- Порошок железа используется как поглотитель кислорода при упаковке некоторых продуктов питания, что помогает продлить их срок хранения.
- Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
- Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
- Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
- Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
- Порошок железа и чугуна используется в качестве искрообразователя и горючего в пиротехнике[46].
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). Основным внутриклеточным депо железа является глобулярный белковый комплекс — ферритин. Недостаток железа проявляется как болезнь организма: хлороз у растений и анемия у животных.
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. Именно он окрашивает кровь в красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК. Неорганические соединения железа встречаются в некоторых бактериях, иногда используется ими для связывания азота воздуха.
Железо в организме человека
В организме взрослого человека содержится около 3—4 граммов железа[47] (около 0,005 %), из которых только около 3,5 мг находится в плазме крови. Гемоглобин содержит примерно 68 % всего железа организма, ферритин — 27 %, миоглобин — 4 %, трансферрин — 0,1 %. Источниками железа при биосинтезе железосодержащих белков служат железо, поступающее из пищи, и железо, освобождающееся при постоянном распаде эритроцитов в гепатоцитах (клетках печени) и клетках селезёнки[48].
Суточная потребность человека в железе, по российским данным, следующая[49]: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг.
У женщин детородного возраста потребность в железе выше ввиду регулярной кровопотери во время менструаций[50][51].
«Национальная академия медицины США» (National Academy of Medicine) различает среднюю потребность в железе и рекомендованное потребление железа, последняя норма разработана с тем, чтоб обеспечивать среднюю потребность для не менее 97 % в каждой группе населения. Расчёт средней потребности в железе зависит от усваиваемости железа, нижеприведённая таблица основана на предположении о потреблении 10 % железа из животных продуктов (средняя усваиваемость 25 %) и 90 % железа из растительных продуктов (средняя усваиваемость 16,8 %), с общей усваиваемостью 18 %. Поскольку рацион детей до года сильно отличается от взрослого, норма для них основана на предполагаемой усваиваемости 10 %[52].
| Пол | Возраст | Рекомендуемая суточная норма потребления железа (по данным «Национальной академии медицины США» (National Academy of Medicine))[52], мг/сутки |
|---|---|---|
| Младенцы | до 6 месяцев | 0,27 |
| Младенцы | 7—12 месяцев | 11 |
| Дети | 1—3 года | 7 |
| Дети | 4—8 лет | 10 |
| Подростки | 9—13 лет | 8 |
| Юноши | 14—18 лет | 11 |
| Девушки | 14—18 лет | 15 |
| Мужчины | 19 лет и старше | 8 |
| Женщины | 19—50 лет | 18 |
| Женщины | 50 лет и старше | 8 |
В организм животных и человека железо поступает с пищей. Наиболее богаты им печень и мясо, в меньшей степени яйца, бобовые (чечевица, фасоль), семена тыквы и кунжута, цельнозерновые крупы (крупа гречневая), а также некоторые виды зелени — тимьян, петрушка, полевой салат[53]. Долгое время список железосодержащих продуктов возглавлял шпинат, ошибочно внесённый из-за опечатки в результатах анализа (был потерян ноль после запятой).
Железо в питании подразделяют на гемовое, или гемное (из мяса и других животных источников) и негемовое (из растительной пищи). В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонуклеотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинатдегидрогеназа[48]. Описанные белки, содержащие негемовое железо, относятся к классу ферредоксинов, наиболее изученные из которых содержатся в хлоропластах зелёных растений и окисляются при переносе электрона в процессе фотосинтеза, а также бактериальные ферредоксины (например анаэробной бактерии Clostridium pasteurianum), участвующие в аэробном или анаэробном переносе электрона. Человеческий ферредоксин-1 участвует в гидроксилировании и расщеплении стероидных гормонов и холестерола в системе микросомальных (эндоплазматического ретикулума гепатоцитов) ферментов цитохрома Р450, а также в синтезе гормонов щитовидной железы. Сердцевина ферредоксина состоит из молекул двух- или четырёх-валентной серы и четырёхвалентного железа и имеет общую формулу вида 

К примеру, из-за высокого уровня фитиновых соединений усвоение железа из бобовых находится в районе 0,84-0,91 %[52].
Согласно одному из американских исследований, потребление с железосодержащей пищей богатого танинами чая снижает усвоение микроэлемента на 62 %, кофе — на 35 %, а потребление апельсинового сока (с высоким содержанием аскорбиновой кислоты) увеличивает его на 85 %[60]. В то же время данные из Китая указывают на то, что даже очень высокое потребление чая в целом не сказывается на содержании железа в крови[61].
Дефицит железа
Основная статья: Дефицит железа
При сбалансированной диете железа, поступающего с пищей, как правило, вполне достаточно. В организме легко восстанавливается равновесие между поступлением и выведением железа, и временный дефицит его легко восполняется за счёт имеющихся запасов. И, тем не менее, дефицит железа — обычное явление в развивающихся странах с ограниченной доступностью мясных продуктов. Это самое распространённое на Земле нарушение питания, которому подвержены до 2 млрд человек во всём мире[62].
В некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс). Потребность в железе значительно возрастает при анемии, вызванной, например, такими паразитарными инвазиями, как малярия и анкилостомоз, которые очень широко распространены в тропических странах.
Вегетарианцам советуют принимать примерно в 1,8 раза больше железа, чем не вегетарианцам[63]. В западных странах продукты, ориентированные на веганов, часто обогащают железом, хотя усваиваемость солей железа (железосодержащих препаратов) зачастую проблематична и польза от приёма таких добавок здоровыми людьми не доказана[64]. Известно, что организм вегетарианцев приспосабливается к диете и более эффективно удерживает имеющиеся запасы железа[65].
По результатам ряда исследований, за время приготовления в железной и чугунной посуде содержание железа в пище возрастает в от 1,2 до 21 раза
[66][67][68]. При этом содержание железа сильнее возрастает в соусах или еде, приготовленной в соусе (например, чили). Испытывающим недостаток в железе даже предлагают класть в посуду, где готовится еда, специальные фигурки из чугуна[en].
В то время, как некоторые исследователи считают, что кормление грудью приводит к дефициту железа, есть множество исследований, показывающих, что это не так, и дети, которых кормят грудью, усваивают железо намного лучше.
Переизбыток железа
Избыточное железо может попадать в организм городского жителя вместе с ржавой водой из-под крана (по чугунным трубам). Также использование железной и чугунной посуды в приготовлении пищи повышает содержание в ней железа[66].
Содержание железа в воде превышающее 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции[источник не указан 1337 дней], может стать причиной болезни крови и печени — гемохроматоза. ПДК железа в воде 0,3 мг/л.
Избыточное накопление железа в организме оказывает токсическое действие. Передозировка железа стимулирует выработку свободных радикалов, угнетает антиоксидантную систему организма и, вероятно, способствует развитию атеросклероза[69], поэтому употреблять препараты железа здоровым людям не рекомендуется.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 Л. Ю. Аликберова; С. В. Кузьминых, В. А. Попов (исторические сведения). Железо. Большая российская энциклопедия 2004-2017. Научное издательство «Большая Российская энциклопедия».
- ↑ 1 2 3 Коллектив авторов. Химическая энциклопедия в 5 томах. Том 2 / И.Л.Кнунянц — главный редактор. — М.: Советская энциклопедия, 1990. — С. 270. — 671 с. — ISBN 5-85270-008-8.
- ↑ 1 2 Jun-Bo Lu, Jiwen Jian, Wei Huang, Hailu Lin, Jun Li. Experimental and theoretical identification of the Fe(vii) oxidation state in FeO4− (англ.) // Phys. Chem. Chem. Phys.. — 2016-11-16. — Vol. 18, iss. 45. — P. 31125—31131. — ISSN 1463-9084. — doi:10.1039/c6cp06753k.
- ↑ Химическая энциклопедия: в 5 тт. / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 140. — 671 с. — 100 000 экз.
- ↑ Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия: Учебник для вузов. — 4-е изд., стер. — М.: Химия, 2000, ISBN 5-7245-1130-4, с. 529
- ↑ Бахарева А. Древние египтяне назвали небо железной миской с водой. Архивная копия от 16 января 2021 на Wayback Machine
- ↑ Русакова E. Железо с неба. Архивная копия от 17 января 2021 на Wayback Machine
- ↑ Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. С.16.
- ↑ Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов Архивная копия от 30 ноября 2007 на Wayback Machine // Вестник древней истории. 1965. № 4.
- ↑ Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. С.16.; Кларк Г. Доисторическая Европа. Пер. M. Б. Граковой-Свиридовой. М. 1953. С. 201—203.; Дикшит С. К. Введение в археологию. М., 1960. С. 428—430.
- ↑ Менабде Э. А. Хеттское общество. Тбилиси, 1965. С. 67.; Арешян Г. Е. Железо в культуре древней Передней Азии и бассейна Эгейского моря (по данным письменных источников) Архивная копия от 2 июля 2021 на Wayback Machine // «Советская археология», 1976, № 1. С.90.
- ↑ Второзаконие III, 3,7,10,11.; Арешян Г. Е. Железо в культуре древней Передней Азии и бассейна Эгейского моря (по данным письменных источников)] // «Советская археология», 1976, № 1. С.95.
- ↑ Гомер. Илиада, песня 23.
- ↑ Давно ли люди гибнут за металл и как именно закаля (Ольга Листопад) / Проза.ру. proza.ru. Дата обращения: 26 сентября 2021. Архивировано 26 сентября 2021 года.
- ↑ Карл Бакс. Богатства земных недр. М.: Прогресс, 1986, стр. 244, глава «Железо»
- ↑ Иванов В. В., Шанский Н. М., Шанская Т. В., Краткий этимологический словарь русского языка, издание 2-е, испр. и доп., М. Просвещение, 1971, 542 стр.
- ↑ М. Фасмер. Этимологический словарь русского языка. — Прогресс. — 1986. — Т. 2. — С. 42—43.
- ↑ Трубачёв О. Н. Славянские этимологии. // Вопросы славянского языкознания, № 2, 1957.
- ↑ Boryś W. Słownik etymologiczny języka polskiego. — Kraków: Wydawnictwo Literackie. — 2005. — С. 753—754.
- ↑ Walde A. Lateinisches etymologisches Wörterbuch. — Carl Winter’s Universitätsbuchhandlung. — 1906. — С. 285.
- ↑ Мейе А. Основные особенности германской группы языков. — УРСС. — 2010. — С. 141.
- ↑ Matasović R. Etymological Dictionary of Proto-Celtic. — Brill. — 2009. — С. 172.
- ↑ Mallory, J. P., Adams, D. Q. Encyclopedia of Indo-European Culture. — Fitzroy-Dearborn. — 1997. — P. 314.
- ↑ New Measurement of the 60Fe Half-Life (англ.) // Physical Review Letters : journal. — Vol. 103. — P. 72502. — doi:10.1103/PhysRevLett.103.072502.
- ↑ Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ Ю. М. Широков, Н. П. Юдин. Ядерная физика. М.: Наука, 1972. Глава Ядерная космофизика.
- ↑ Рипан Р., И. Четяну. Неорганическая химия // Химия неметаллов = Chimia metalelor. — М.: Мир, 1972. — Т. 2. — С. 482—483. — 871 с.
- ↑ Gold and Precious Metals. Дата обращения: 25 августа 2011. Архивировано 20 августа 2011 года.
- ↑ Modest global growth for iron ore production — report — MINING.COM. Дата обращения: 9 марта 2020. Архивировано 15 февраля 2020 года.
- ↑ Цена железной руды выросла до максимума за 5 лет. Кто от этого выиграет? :: Новости :: РБК Инвестиции. Дата обращения: 9 марта 2020. Архивировано 31 октября 2019 года.
- ↑ Металловедение и термическая обработка стали. Справ. изд. В 3-х т./ Под ред. М. Л. Берштейна, А. Г. Рахштадта. — 4-е изд., перераб. и доп. Т. 2. Основы термической обработки. В 2-х кн. Кн. 1. М.: Металлургия, 1995. 336 с.
- ↑ T. Takahashi & W.A. Bassett, «High-Pressure Polymorph of Iron», Science, Vol. 145 #3631, 31 Jul 1964, p 483—486. doi:10.1126/science.145.3631.483. Bibcode: 1964Sci…145..483T.
- ↑ В виде стружки или проволоки
- ↑ Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ Аликберова Л.Ю. Железа оксиды // Большая Российская энциклопедия / Председатель Науч.-ред. совета Ю. С. Осипов. Отв. ред. С. Л. Кравец. — М.: Большая Российская энциклопедия, 2007. — Т. 9. Динамика атмосферы — Железнодорожный узел. — С. 747.
- ↑ Горение железа в кислороде Архивная копия от 6 октября 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Schilt A. Analytical Application of 1,10-phenantroline and Related Compounds. Oxford, Pergamon Press, 1969.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989. С. 297.
- ↑ Лурье Ю. Ю. Справочник по аналитической химии. М., Химия, 1989, С. 315.
- ↑ Брауэр Г. (ред.) Руководство по неорганическому синтезу. т. 5. М., Мир, 1985. С. 1757—1757.
- ↑ Реми Г. Курс неорганической химии. т. 2. М., Мир, 1966. С. 309.
- ↑ Киселёв Ю. М., Копелев Н. С., Спицын В. И., Мартыненко Л. И. Восьмивалентное железо // Докл. АН СССР. — 1987. — Т. 292. — С. 628—631.
- ↑ Перфильев Ю. Д., Копелев Н. С., Киселёв Ю. М., Спицын В. И. Мёссбауэровское исследование восьмивалентного железа // Докл. АН СССР. — 1987. — T. 296. — С. 1406—1409.
- ↑ Kopelev N.S., Kiselev Yu.M., Perfiliev Yu.D. Mossbauer spectroscopy of the oxocomplexes iron in higher oxidation states (недоступная ссылка) // J. Radioanal. Nucl. Chem. — 1992. — V. 157. — Р. 401—411.
- ↑ А. В. Чувурин. Занимательная пиротехника (2003) [страница не указана 1056 дней]
- ↑ Iron, Nature’s Universal Element: Why People Need Iron & Animals Make Magnets. — С. 100. — 204 с. — ISBN 0-8135-2831-3.
- ↑ 1 2 Е. С. Северин. Биохимия. Учебник для ВУЗов. — 2003. — С. 641. — 779 с. — ISBN 5-9231-0254-4. Архивированная копия. Дата обращения: 3 августа 2014. Архивировано из оригинала 25 июня 2013 года.
- ↑ «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации» (МР 2.3.1.2432—08). Архивная копия от 6 августа 2017 на Wayback Machine // rospotrebnadzor.ru (9 ноября 2015 года)
- ↑ Jo Lewin. Spotlight on… high-iron. — Are you getting enough iron? Jo Lewin explains when you should eat a high-iron diet, and which foods can help ensure you get your daily dose. Архивная копия от 5 июля 2014 на Wayback Machine (англ.) // bbcgoodfood.com
- ↑ Анастасия Каадзе. Железо: микроэлемент с высоким приоритетом важности. Архивная копия от 22 января 2021 на Wayback Machine Официальный сайт газеты «Комсомольская правда» // kp.ru (31 мая 2017 года)
- ↑ 1 2 3 Gregory J. Anderson, Gordon D. McLaren. Iron Physiology and Pathophysiology in Humans (Springer, 2012, pages 88-90). Архивная копия от 18 апреля 2017 на Wayback Machine (англ.) // books.google.com — ISBN 1-60327-484-7
- ↑ Foods highest in Iron. Дата обращения: 22 июня 2014. Архивировано 6 июля 2014 года.
- ↑ Д. Г. Кнорре, С. Д. Мызина. «Биологическая химия». — Москва: «Высшая школа», 2003. — С. 66. — 479 с. — ISBN 5-06-003720-7.
- ↑ И. В. Довжикова. Ферменты стероидогенеза (обзор литературы). Дальневосточный научный центр физиологии и патологии дыхания Сибирского отделения РАМН, Благовещенск. Бюллетень, выпуск № 37, 2010; УДК 577.175.63/.64:577.152.1. Архивная копия от 25 декабря 2015 на Wayback Machine // cyberleninka.ru
- ↑ Iron in the Vegan Diet. Архивная копия от 29 мая 2014 на Wayback Machine The Vegetarian Resource Group // vrg.org
- ↑ Review on iron and its importance for human health. Архивная копия от 9 апреля 2019 на Wayback Machine // ncbi.nlm.nih.gov
- ↑ [https://web.archive.org/web/20171104174240/https://www.ncbi.nlm.nih.gov/pubmed/15743017 Архивная копия от 4 ноября 2017 на Wayback Machine Enhancers of iron absorption: ascorbic … [Int J Vitam Nutr Res. 2004] — PubMed — NCBI.] // ncbi.nlm.nih.gov
- ↑ [https://web.archive.org/web/20180723184758/https://www.ncbi.nlm.nih.gov/pubmed/16366727 Архивная копия от 23 июля 2018 на Wayback Machine Meat and ascorbic acid can promote Fe avai… [J Agric Food Chem. 2005] — PubMed — NCBI]
- ↑ [https://web.archive.org/web/20180219063900/https://www.ncbi.nlm.nih.gov/pubmed/6896705 Архивная копия от 19 февраля 2018 на Wayback Machine Effect of different drinks on the absorpt… [Hum Nutr Appl Nutr. 1982] — PubMed — NCBI]
- ↑ [https://web.archive.org/web/20180217103054/https://www.ncbi.nlm.nih.gov/pubmed/10201801 Архивная копия от 17 февраля 2018 на Wayback Machine Iron status of middle-aged women in five cou… [Eur J Clin Nutr. 1999] — PubMed — NCBI]
- ↑ Micronutrient deficiencies. WHO. Дата обращения: 22 июня 2014. Архивировано из оригинала 13 июля 2017 года.
- ↑ Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press, 2001.
- ↑ Bioavailability of iron, zinc, and other trace minerals from vegetarian diets. Дата обращения: 22 июня 2014. Архивировано 16 января 2015 года.
- ↑ [https://web.archive.org/web/20161017200944/https://www.ncbi.nlm.nih.gov/pubmed/10232635 Архивная копия от 17 октября 2016 на Wayback Machine Nonheme-iron absorption, fecal ferritin excre… [Am J Clin Nutr. 1999] — PubMed — NCBI]
- ↑ 1 2 Andrew Weil, M.D. Cooking with Cast-Iron? (англ.). drweil.com (21 марта 2006). Дата обращения: 22 апреля 2018. Архивировано 22 апреля 2018 года.
- ↑ Результаты исследования влияния железной посуды на содержание железа в приготовленной в них пище, опубликованные в журнале Journal of the American Dietetic Association в выпуске от июля 1986 года. Таблица результатов доступна на: Linda Stradley. Iron and Carcinogens in Cast Iron (англ.). What’s Cooking America (12 января 2005). Дата обращения: 11 октября 2014. Архивировано 1 октября 2014 года.
- ↑ Geerligs PD1, Brabin BJ, Omari AA. Food prepared in iron cooking pots as an intervention for reducing iron deficiency anaemia in developing countries: a systematic review. (англ.). Journal of human nutrition and dietetics : the official journal of the British Dietetic Association. The National Center for Biotechnology Information (8 января 2003). Дата обращения: 11 октября 2014. Архивировано 15 октября 2014 года.
- ↑ [https://web.archive.org/web/20151225062728/https://www.ncbi.nlm.nih.gov/pubmed/7542998 Архивная копия от 25 декабря 2015 на Wayback Machine Iron overload augments the dev… [Arterioscler Thromb Vasc Biol. 1995] — PubMed — NCBI]
Литература
- Железо, в технике // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо, в химии // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо, в медицине // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Железо в Популярной библиотеке химических элементов.
- Климент Александрийский. «Строматы», глава 21.
- Абрамишвили Р. М. К вопросу об освоении железа на территории Восточной Грузии, ВГМГ, XXII-В, 1961.
- Арешян Г. Е. Железо в культуре древней передней Азии и бассейна Эгейского моря. М., 1976.
- Бакс К. Богатства земных недр. М.: Прогресс, 1986. 384 стр. Глава «Железо».
- Гиоргадзе Г. Г. «Текст Анитты» и некоторые вопросы ранней истории хеттов.
- Граков Б. Н. Ранний железный век. М.: Изд-во МГУ, 1977. 235 с.
- Татарченко Д.М. Металлургия чугуна, железа и стали в общедоступном изложении. — Государственное научно-техническое издательство, 1932.
- Хахутайшвили Д. А. К истории древнеколхской металлургии железа. Вопросы древней истории (Кавказско-ближневосточный сборник, вып. 4). Тбилиси, 1973.
Ссылки
- Железо на Webelements
- Железо в Популярной библиотеке химических элементов.
- Фото соединений железа на сайте ’Химия и Химики’
- в месторождениях.
- Болезни, вызванные недостатком и избытком железа в организме человека.
Эта страница в последний раз была отредактирована 5 марта 2023 в 12:18.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Строение веществ и их переходы из одного состояния в другое изучает химия. В первую очередь для успешного понимания науки нужно выучить названия и произношение химических элементов. Существует общепринятая система классификации. Её первоначальный вариант разработал русский учёный Дмитрий Иванович Менделеев, назвав свой свод периодической таблицей. Всего же на начало 2019-го года известно 118 элементов.
Оглавление:
- Классификация химических веществ
- Правильное произношение
- Названия популярных элементов
- Чтение формул и символов
Классификация химических веществ
Вещество состоит из различных частиц. В его состав входят электроны, нейтроны и протоны. Взаимосвязи элементарных зарядов образуют атомы. В свою очередь, из них формируются молекулы и кристаллы. Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Каждому состоянию тела присущ набор свойств. Это характеристики, определяющие индивидуальность вещества, позволяя их отличать друг от друга.
Из наиболее интересных можно отметить: температуру плавления и кипения, строение кристаллической решётки, плотность, термодинамические и фазовые характеристики.
Вещества могут не только изменять свои агрегатные состояния, но и взаимодействовать между собой, образовывая новые соединения. Впервые классифицировать тела попробовал Д. И. Менделеев.
Его периодическая таблица, составленная им с 1869 года по 1871 год, строилась на отличии атомного веса (массы). В современном варианте его система видоизменилась. Так было выполнено сведение веществ в двумерную таблицу, в которой столбцы определяют главные физико-химические свойства, а строки являются периодами, в определённой мере подобными друг другу.
Каждый элемент, внесённый в таблицу, имеет свою историю открытия. Учёные, исследуя то или иное вещество, выделяли в нём индивидуальные особенности, что позволяло им давать названия, ассоциирующиеся с какими-то либо личными убеждениями и сравнениями.
Но перед этим в учёном мире были приняты важные термины:
- Элемент — слово произошло от латинского elementum, обозначающего какую-либо часть. Ученые античного времени говорили: «Как слова состоят из букв, так и тела — из элементов». Слово образовано из отрицательной приставки «а» и «томе» — рассечение.
- Атом — в переводе с греческого языка слово обозначает целое (неделимое).
- Молекула — термин происходит от латинского moles. На русский язык это слово можно перевести как «массив», «глыба».
Как видно из названия, химические совокупности ассоциируются с их свойствами. По этому же принципу давались названия и открытым веществам. Так как исследованиями занимались в основном Европейские учёные, то их названия записывались на латыни.
При этом у подавляющего числа элементов, звучащих на русском, они фонетически близки к латинским.
Правильное произношение
В таблице Менделеева все вещества написаны на латыни. Часто вместе с сокращённым названием указывается полное. Например, Ar — argon, Ba — barium, Au — aurum. Но для русскоязычного населения полное наименование пишут на русском. Так, Ar — аргон, Ba — барий, Au — аурум.
Произношение их что на латыни, что на русском языке одинаково. Единственное — присутствует акцент. Но существуют элементы, которые имеют двойное название. То есть, их можно произносить так же, как они и пишутся, или совсем по-другому. К таким веществам относятся:
- Золото — обозначается знаком Au и читается аурум. Слово в переводе с иностранного обозначает «жёлтое».
- Серебро — символизируется символом Ar, может произноситься как «аргентум». Слово имеет индоевропейское происхождение. Arg — обозначает светлый.
- Железо — подписывают знаком Fe, а читают как феррум. С латинского ferrum происходит от fars, что обозначает «крепкий».
- Сера — правильное название sulfur (сульфур). Обозначают её символом S. Интересно, что в древнерусском и старославянском под серой понимали любое горючее вещество, например, жир.
- Свинец — произносится как плюмбум (plumbum). Причина названия элемента доподлинно неизвестна. Сокращённое обозначение элемента — Pb.
- Олово — химический символ Sn. Элемент четырнадцатой группы пишется на латыни как stannum. Произносится также — «станниум». Происхождение записи связывают с санскритским словом, обозначающим прочность.
- Углерод — элемент, обозначающийся знаком C. Латинское название carboneum произносится как «карбон». Слово имеет в названии корень carbō обозначающий «уголь».
- Ртуть — с латинского звучит как «гидраргиум». Hydrargirum произошло от слияния слов «хюдор» — вода и «аргирос» — серебро.
- Медь — международное обозначение Сu. Пишется как cuprum, а произносится «купрум». Считается, что элемент получил название в честь острова Кипр, где находилось много рудников.
- Азот — пишется в зарубежной литературе как nitrogenium. За обозначение принят символ N. На русском языке произносится как «нитрогениум». Слово происходит от древнегреческого ἄζωτоς — «безжизненный».
Названия популярных элементов
В классической периодической таблице указано 118 элементов.
Расположены они по атомным номерам. Но вместе с этим существует и расширенный свод. Он является логическим продолжением труда русского химика и включает возможные, ещё не выявленные вещества. С учётом расширенной таблицы всего предполагается существование 218 веществ. Вот самые распространённые химические элементы таблицы Менделеева с произношением:
| Азо́т | эн | N | Nitrogenium |
| Алюми́ний | алюми́ний | Al | Aluminium |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бор | Borum | B | бор |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водород | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| Индий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Литий | Lithium | Li | ли́тий |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Мышьяк | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Ни́кель | Niccolum | Ni | ни́кель |
| Олово | Stannum | Sn | ста́ннум |
| Осмий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Платина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Танта́л | Tantalum | Ta | танта́л |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фо́сфор | Phosphorus | P | пэ |
| Фтор | Fluorum | F | фтор |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
Следует отметить, что знаковое обозначение элементов принято Международным союзом теоретической и прикладной химии. Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
В качестве аббревиатуры комитета используется ИЮПАК. Именно его члены занимаются стандартизацией в области химии.
Чтение формул и символов
Цифра, стоящая перед веществом, обозначает количество молекул. Элемент же записывают буквенными символами. В устной речи придерживаются правила, при котором называют последовательно, начиная справа, все знаки.
Например, H2O — формула воды, её читают как «аш два о», NaCl (хлорид натрия) — «натрий хлор». Чтобы правильно произносить химические соединения, необходимо знать, как звучат символы элементов. Не стоит забывать и то, что индекс, относящийся к скобкам (группе атомов), произносят с суффиксом -жды. Например: дважды, трижды, четырежды.
Таким образом, несмотря на то, что существуют русские и латинские обозначения каждого химического элемента, в химических формулах используется только стандартное правило. При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
То есть, например, гелий, так и произносится в формулах. Но если встречаются сокращённые буквы латиницы, то нужно произносить элемент полностью, как он и называется, например, Si — сицилициум и так далее. Вот некоторые названия редких элементов:
- Сm — кюрий.
- Сf — калифорний.
- Fm — фермий.
- No — нобелий.
- Lr — лоуренций.
- Hs — хассий.
- Po — полоний.
- Pa — проктаний.
- Gd — гадолиний.
- Er — эрбий.
Интересно и то, что последние элементы, которые добавляют в таблицу Менделеева являются синтезированными. Так, 115 был получен в Дубне. Назвали его moscovium (Mc), произносится на русском — «московий». Элемент 117 назвали tennessine (TS). Имя ему было дано в честь штата Теннесси.
В честь Юрия Цолаковича Оганесяна было решено назвать 118 элемент. Пишется он как oganesson (Og), читается — «оганесон». Это пока последний элемент, добавленный в таблицу.


 Ковкий, вязкий металл серебристо-белого цвета
Ковкий, вязкий металл серебристо-белого цвета
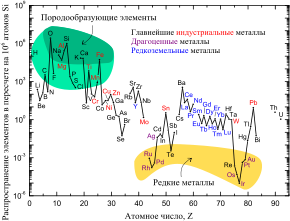




 ,
,





![mathsf{3K_3[Fe(CN)_6] + 3Fe^{2+} rightarrow 3KFe^{II}[Fe^{III}(CN)_6]downarrow + 6K^+}](https://dic.academic.ru/dic.nsf/ruwiki/c9da277835815b431f7710a0c339d600.png)


![mathsf{Fe(OH)_3 + 3KOH rightarrow K_3[Fe(OH)_6]}](https://dic.academic.ru/dic.nsf/ruwiki/22b43bec38f6c23d5e4b05e94efa4eb4.png)

![mathsf{4K_4[Fe(CN)_6] + 4FeCl_3 rightarrow 4KFe^{III}[Fe^{II}(CN)_6]downarrow + 12KCl}](https://dic.academic.ru/dic.nsf/ruwiki/5e772cb80f9ab3c20fb5eb0dce08823b.png)





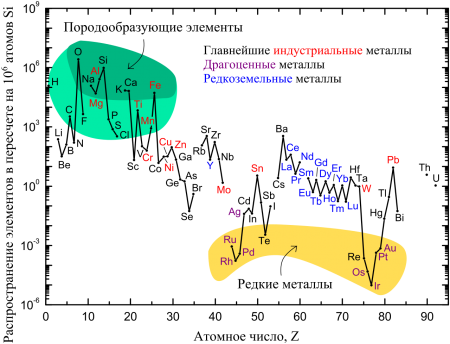

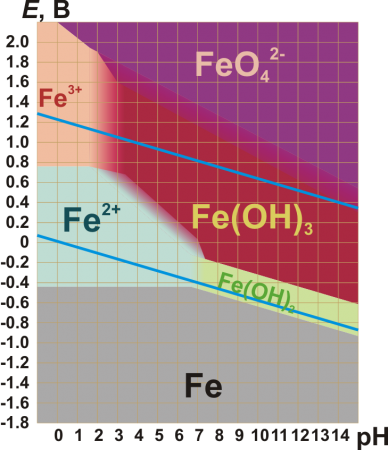














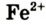
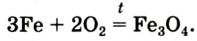

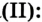
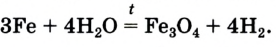
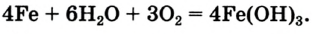


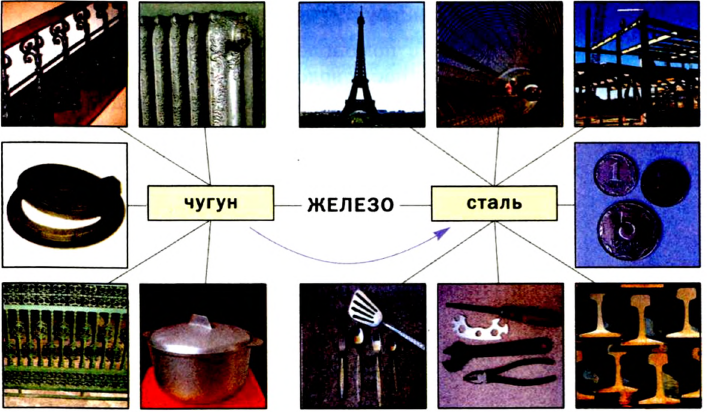
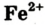 + и
+ и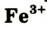 , которые входят в состав соединений Феррума
, которые входят в состав соединений Феррума и Феррума
и Феррума Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.
Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.





















![{displaystyle {mathsf {K_{3}[Fe(CN)_{6}]+Fe^{2+}rightarrow KFe^{II}[Fe^{III}(CN)_{6}]downarrow +2K^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9b81a87fef766fae5e65b6c26babb38901c482a)
![mathsf{KFe^{II}[Fe^{III}(CN)_6] rightarrow KFe^{III}[Fe^{II}(CN)_6]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd5754f2157be00c80a1ea3c3212d55a5fbb6178)


![mathsf{Fe(OH)_3 + 3KOH rightarrow K_3[Fe(OH)_6]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9970e88e8b33b0aec36c52ffd5aed803d95e468)
![{displaystyle {mathsf {K_{4}[Fe(CN)_{6}]+FeCl_{3}rightarrow KFe^{III}[Fe^{II}(CN)_{6}]downarrow +3KCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b02f4ca8c591e27abb75156eea3756341065a8f3)