From Wikipedia, the free encyclopedia
|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Aluminium hydroxide |
|
| Systematic IUPAC name
Trihydroxidoaluminium |
|
| Other names
Aluminic acid Aluminic hydroxide Orthoaluminic acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.040.433 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties[1][2] | |
|
Chemical formula |
Al(OH)3 |
| Molar mass | 78.00 g/mol |
| Appearance | White amorphous powder |
| Density | 2.42 g/cm3, solid |
| Melting point | 300 °C (572 °F; 573 K) |
|
Solubility in water |
0.0001 g/100 mL |
|
Solubility product (Ksp) |
3×10−34 |
| Solubility | soluble in acids and alkalis |
| Acidity (pKa) | >7 |
| Isoelectric point | 7.7 |
| Thermochemistry[3] | |
|
Std enthalpy of |
−1277 kJ·mol−1 |
| Pharmacology[4] | |
|
ATC code |
A02AB01 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H319, H335 |
|
Precautionary statements |
P261, P264, P271, P280, P304+P340, P305+P351+P338, P312, P337+P313 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
>5000 mg/kg (rat, oral) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
None |
|
Related compounds |
Sodium oxide, aluminium oxide hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium hydroxide, Al(OH)3, is found in nature as the mineral gibbsite (also known as hydrargillite) and its three much rarer polymorphs: bayerite, doyleite, and nordstrandite. Aluminium hydroxide is amphoteric, i.e., it has both basic and acidic properties. Closely related are aluminium oxide hydroxide, AlO(OH), and aluminium oxide or alumina (Al2O3), the latter of which is also amphoteric. These compounds together are the major components of the aluminium ore bauxite. Aluminium hydroxide also forms a gelatinous precipitate in water.
Structure[edit]
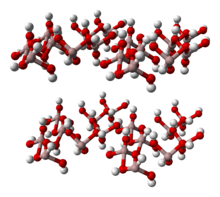
Al(OH)3 is built up of double layers of hydroxyl groups with aluminium ions occupying two-thirds of the octahedral holes between the two layers.[5][6] Four polymorphs are recognized.[7] All feature layers of octahedral aluminium hydroxide units, with hydrogen bonds between the layers. The polymorphs differ in terms of the stacking of the layers. All forms of Al(OH)3 crystals are hexagonal[disputed – discuss]:
- gibbsite is also known as γ-Al(OH)3 [8] or α-Al(OH)3[citation needed]
- bayerite is also known as α-Al(OH)3 [8] or β-alumina trihydrate[citation needed]
- nordstrandite is also known as Al(OH)3[8]
- doyleite
Hydrargillite, once thought to be aluminium hydroxide, is an aluminium phosphate. Nonetheless, both gibbsite and hydrargillite refer to the same polymorphism of aluminium hydroxide, with gibbsite used most commonly in the United States and hydrargillite used more often in Europe. Hydrargillite is named after the Greek words for water (hydra) and clay (argylles).
Properties[edit]
Aluminium hydroxide is amphoteric. In acid, it acts as a Brønsted–Lowry base. It neutralizes the acid, yielding a salt:[9]
- 3 HCl + Al(OH)3 → AlCl3 + 3 H2O
In bases, it acts as a Lewis acid by binding hydroxide ions:[9]
- Al(OH)3 + OH− → Al(OH)4−
Production[edit]
Red mud reservoirs (this one in Stade, Germany) contain the corrosive residues from the production of aluminum hydroxide.
Virtually all the aluminium hydroxide used commercially is manufactured by the Bayer process[10] which involves dissolving bauxite in sodium hydroxide at temperatures up to 270 °C (518 °F). The waste solid, bauxite tailings, is removed and aluminium hydroxide is precipitated from the remaining solution of sodium aluminate. This aluminium hydroxide can be converted to aluminium oxide or alumina by calcination.
The residue or bauxite tailings, which is mostly iron oxide, is highly caustic due to residual sodium hydroxide. It was historically stored in lagoons; this led to the Ajka alumina plant accident in 2010 in Hungary, where a dam bursting led to the drowning of nine people. An additional 122 sought treatment for chemical burns. The mud contaminated 40 square kilometres (15 sq mi) of land and reached the Danube. While the mud was considered non-toxic due to low levels of heavy metals, the associated slurry had a pH of 13.[11]
Uses[edit]
Fire retardant filler[edit]
Aluminium hydroxide also finds use as a fire retardant filler for polymer applications. It is selected for these applications because it is colorless (like most polymers), inexpensive, and has good fire retardant properties.[12] Magnesium hydroxide and mixtures of huntite and hydromagnesite are used similarly.[13][14][15][16][17] It decomposes at about 180 °C (356 °F), absorbing a considerable amount of heat in the process and giving off water vapour. In addition to behaving as a fire retardant, it is very effective as a smoke suppressant in a wide range of polymers, most especially in polyesters, acrylics, ethylene vinyl acetate, epoxies, polyvinyl chloride (PVC) and rubber.[18]
Precursor to Al compounds[edit]
Aluminium hydroxide is a feedstock for the manufacture of other aluminium compounds: calcined aluminas, aluminium sulfate, polyaluminium chloride, aluminium chloride, zeolites, sodium aluminate, activated alumina, and aluminium nitrate.[6]
Freshly precipitated aluminium hydroxide forms gels, which are the basis for the application of aluminium salts as flocculants in water purification. This gel crystallizes with time. Aluminium hydroxide gels can be dehydrated (e.g. using water-miscible non-aqueous solvents like ethanol) to form an amorphous aluminium hydroxide powder, which is readily soluble in acids. Heating converts it to activated aluminas, which are used as desiccants, adsorbent in gas purification, and catalyst supports.[12]
Pharmaceutical[edit]
Under the generic name «algeldrate», aluminium hydroxide is used as an antacid in humans and animals (mainly cats and dogs). It is preferred over other alternatives such as sodium bicarbonate because Al(OH)3, being insoluble, does not increase the pH of stomach above 7 and hence, does not trigger secretion of excess acid by the stomach. Brand names include Alu-Cap, Aludrox, Gaviscon or Pepsamar. It reacts with excess acid in the stomach, reducing the acidity of the stomach content,[19][20] which may relieve the symptoms of ulcers, heartburn or dyspepsia. Such products can cause constipation, because the aluminium ions inhibit the contractions of smooth muscle cells in the gastrointestinal tract, slowing peristalsis and lengthening the time needed for stool to pass through the colon.[21] Some such products are formulated to minimize such effects through the inclusion of equal concentrations of magnesium hydroxide or magnesium carbonate, which have counterbalancing laxative effects.[22]
This compound is also used to control hyperphosphatemia (elevated phosphate, or phosphorus, levels in the blood) in people and animals suffering from kidney failure. Normally, the kidneys filter excess phosphate out from the blood, but kidney failure can cause phosphate to accumulate. The aluminium salt, when ingested, binds to phosphate in the intestines and reduce the amount of phosphorus that can be absorbed.[23][24]
Precipitated aluminium hydroxide is included as an adjuvant in some vaccines (e.g. anthrax vaccine). One of the well-known brands of aluminium hydroxide adjuvant is Alhydrogel, made by Brenntag Biosector.[25][full citation needed][dead link] Since it absorbs protein well, it also functions to stabilize vaccines by preventing the proteins in the vaccine from precipitating or sticking to the walls of the container during storage. Aluminium hydroxide is sometimes called «alum», a term generally reserved for one of several sulfates.[citation needed]
Vaccine formulations containing aluminium hydroxide stimulate the immune system by inducing the release of uric acid, an immunological danger signal. This strongly attracts certain types of monocytes which differentiate into dendritic cells. The dendritic cells pick up the antigen, carry it to lymph nodes, and stimulate T cells and B cells.[26] It appears to contribute to induction of a good Th2 response, so is useful for immunizing against pathogens that are blocked by antibodies. However, it has little capacity to stimulate cellular (Th1) immune responses, important for protection against many pathogens,[27] nor is it useful when the antigen is peptide-based.[28]
Safety[edit]
In the 1960s and 1970s it was speculated that aluminium was related to various neurological disorders, including Alzheimer’s disease.[29][30] Since then, multiple epidemiological studies have found no connection between exposure to environmental or swallowed aluminium and neurological disorders, though injected aluminium was not looked at in these studies.[31][32][33]
Neural disorders were found in experiments on mice motivated by Gulf War illness (GWI). Aluminum hydroxide injected in doses equivalent to those administered to the United States military, showed increased reactive astrocytes, increased apoptosis of motor neurons and microglial proliferation within the spinal cord and cortex.[34]
References[edit]
- ^ For solubility product: «Solubility product constants». Archived from the original on 15 June 2012. Retrieved 17 May 2012.
- ^ For isoelectric point: Gayer, K. H.; Thompson, L. C.; Zajicek, O. T. (September 1958). «The solubility of aluminum hydroxide in acidic and basic media at 25 ?c». Canadian Journal of Chemistry. 36 (9): 1268–1271. doi:10.1139/v58-184. ISSN 0008-4042.
- ^ Zumdahl, Steven S. (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ Black, Ronald A.; Hill, D. Ashley (15 June 2003). «Over-the-Counter Medications in Pregnancy». American Family Physician. 67 (12): 2517–2524. ISSN 0002-838X. PMID 12825840. Retrieved 1 July 2017.
- ^ Wells, A. F. (1975), Structural Inorganic Chemistry (4th ed.), Oxford: Clarendon Press
- ^ a b Evans, K. A. (1993). «Properties and uses of aluminium oxides and aluminium hydroxides». In A. J. Downs (ed.). Chemistry of aluminium, gallium, indium, and thallium (1st ed.). London; New York: Blackie Academic & Professional. ISBN 9780751401035.
- ^ Karamalidis, A. K.; Dzombak D. A. (2010). Surface Complexation Modeling: Gibbsite. John Wiley & Sons. pp. 15–17. ISBN 978-0-470-58768-3.
- ^ a b c Wefers, Karl; Misra, Chanakya (1987). Oxides and hydroxides of aluminum. Alcoa Research Laboratories. p. 2. OCLC 894928306.
- ^ a b Boundless (26 July 2016). «Basic and Amphoteric Hydroxides». Boundless Chemistry. Archived from the original on 22 August 2017. Retrieved 2 July 2017.
- ^ Hind, AR; Bhargava SK; Grocott SC (1999). «The Surface Chemistry of Bayer Process Solids: A Review». Colloids Surf Physiochem Eng Aspects. 146 (1–3): 359–74. doi:10.1016/S0927-7757(98)00798-5.
- ^ «Hungary Battles to Stem Torrent of Toxic Sludge». BBC News Website. 5 October 2010.
- ^ a b Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; Wefers, Karl; Williams, F. S. (2000). «Aluminum Oxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_557.
- ^ Hollingbery, LA; Hull TR (2010). «The Fire Retardant Behaviour of Huntite and Hydromagnesite — A Review» (PDF). Polymer Degradation and Stability. 95 (12): 2213–2225. doi:10.1016/j.polymdegradstab.2010.08.019.
- ^ Hollingbery, LA; Hull TR (2010). «The Thermal Decomposition of Huntite and Hydromagnesite — A Review» (PDF). Thermochimica Acta. 509 (1–2): 1–11. doi:10.1016/j.tca.2010.06.012.
- ^ Hollingbery, LA; Hull TR (2012). «The Fire Retardant Effects of Huntite in Natural Mixtures with Hydromagnesite» (PDF). Polymer Degradation and Stability. 97 (4): 504–512. doi:10.1016/j.polymdegradstab.2012.01.024.
- ^ Hollingbery, LA; Hull TR (2012). «The Thermal Decomposition of Natural Mixtures of Huntite and Hydromagnesite» (PDF). Thermochimica Acta. 528: 45–52. doi:10.1016/j.tca.2011.11.002.
- ^ Hull, TR; Witkowski A; Hollingbery LA (2011). «Fire Retardant Action of Mineral Fillers» (PDF). Polymer Degradation and Stability. 96 (8): 1462–1469. doi:10.1016/j.polymdegradstab.2011.05.006. S2CID 96208830.
- ^ Huber Engineered Materials. «Huber Non-Halogen Fire Retardant Additives» (PDF). Retrieved 3 July 2017.
- ^ Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A (1999). Fundamentals of pharmacology: a text for nurses and health professionals. Harlow: Pearson. p. 482.
- ^ Papich, Mark G. (2007). «Aluminum Hydroxide and Aluminum Carbonate». Saunders Handbook of Veterinary Drugs (2nd ed.). St. Louis, Mo: Saunders/Elsevier. pp. 15–16. ISBN 9781416028888.
- ^ Washington, Neena (2 August 1991). Antacids and Anti Reflux Agents. Boca Raton, FL: CRC Press. p. 10. ISBN 978-0-8493-5444-1.
- ^ Bill, Robert L. (1 September 2016). Clinical Pharmacology and Therapeutics for Veterinary Technicians — E-Book. Elsevier Health Sciences. p. 105. ISBN 9780323444026.
- ^ Plumb, Donald C. (2011). «Aluminum Hydroxide». Plumb’s Veterinary Drug Handbook (7th ed.). Stockholm, Wisconsin; Ames, Iowa: Wiley. pp. 36–37. ISBN 9780470959640.
- ^ Lifelearn Inc. (1 November 2010). «Aluminum Hydroxide». Know Your Pet. Retrieved 30 June 2017.
- ^ «About Brenntag Biosector — Brenntag». brenntag.com. Retrieved 19 April 2018.
- ^ Kool, M; Soullié T; van Nimwegen M; Willart MA; Muskens F; Jung S; Hoogsteden HC; Hammad H; Lambrecht BN (24 March 2008). «Alum adjuvant boosts adaptive immunity by inducing uric acid and activating inflammatory dendritic cells». J Exp Med. 205 (4): 869–82. doi:10.1084/jem.20071087. PMC 2807488. PMID 18362170.
- ^ Petrovsky N, Aguilar JC (2004). «Vaccine adjuvants: current state and future trends». Immunology & Cell Biology. 82 (5): 488–96. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ^ Cranage, MP; Robinson A (2003). Robinson A; Hudson MJ; Cranage MP (eds.). Vaccine Protocols — Volume 87 of Methods in Molecular Medicine Biomed Protocols (2nd ed.). Springer. p. 176. ISBN 978-1-59259-399-6.
- ^ «Alzheimer’s Myth’s». Alzheimer’s Association. Retrieved 29 July 2012.
- ^ Khan, A (1 September 2008). «Aluminium and Alzheimer’s disease». Alzheimer’s Society. Archived from the original on 11 March 2012. Retrieved 8 March 2012.
- ^ Rondeau V (2002). «A review of epidemiologic studies on aluminum and silica in relation to Alzheimer’s disease and associated disorders». Rev Environ Health. 17 (2): 107–21. doi:10.1515/REVEH.2002.17.2.107. PMC 4764671. PMID 12222737.
- ^ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (May 1997). «Aluminum concentrations in drinking water and risk of Alzheimer’s disease». Epidemiology. 8 (3): 281–6. doi:10.1097/00001648-199705000-00009. JSTOR 3702254. PMID 9115023. S2CID 32190038.
- ^ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (September 1998). «Occupational exposures to solvents and aluminium and estimated risk of Alzheimer’s disease». Occup Environ Med. 55 (9): 627–33. doi:10.1136/oem.55.9.627. PMC 1757634. PMID 9861186.
- ^ Shaw, Christopher A.; Petrik, Michael S. (November 2009). «Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration». Journal of Inorganic Biochemistry. 103 (11): 1555–1562. doi:10.1016/j.jinorgbio.2009.05.019. ISSN 1873-3344. PMC 2819810. PMID 19740540.
External links[edit]
- International Chemical Safety Card 0373
- «Some properties of aluminum hydroxide precipitated in the presence of clays», Soil Research Institute, R C Turner, Department of Agriculture, Ottawa[permanent dead link]
- Effect of ageing on properties of polynuclear hydroxyaluminum cations
- A second species of polynuclear hydroxyaluminum cation, its formation and some of its properties
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Aluminium hydroxide |
|
| Systematic IUPAC name
Trihydroxidoaluminium |
|
| Other names
Aluminic acid Aluminic hydroxide Orthoaluminic acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.040.433 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties[1][2] | |
|
Chemical formula |
Al(OH)3 |
| Molar mass | 78.00 g/mol |
| Appearance | White amorphous powder |
| Density | 2.42 g/cm3, solid |
| Melting point | 300 °C (572 °F; 573 K) |
|
Solubility in water |
0.0001 g/100 mL |
|
Solubility product (Ksp) |
3×10−34 |
| Solubility | soluble in acids and alkalis |
| Acidity (pKa) | >7 |
| Isoelectric point | 7.7 |
| Thermochemistry[3] | |
|
Std enthalpy of |
−1277 kJ·mol−1 |
| Pharmacology[4] | |
|
ATC code |
A02AB01 (WHO) |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Hazard statements |
H319, H335 |
|
Precautionary statements |
P261, P264, P271, P280, P304+P340, P305+P351+P338, P312, P337+P313 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
>5000 mg/kg (rat, oral) |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
None |
|
Related compounds |
Sodium oxide, aluminium oxide hydroxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium hydroxide, Al(OH)3, is found in nature as the mineral gibbsite (also known as hydrargillite) and its three much rarer polymorphs: bayerite, doyleite, and nordstrandite. Aluminium hydroxide is amphoteric, i.e., it has both basic and acidic properties. Closely related are aluminium oxide hydroxide, AlO(OH), and aluminium oxide or alumina (Al2O3), the latter of which is also amphoteric. These compounds together are the major components of the aluminium ore bauxite. Aluminium hydroxide also forms a gelatinous precipitate in water.
Structure[edit]
Al(OH)3 is built up of double layers of hydroxyl groups with aluminium ions occupying two-thirds of the octahedral holes between the two layers.[5][6] Four polymorphs are recognized.[7] All feature layers of octahedral aluminium hydroxide units, with hydrogen bonds between the layers. The polymorphs differ in terms of the stacking of the layers. All forms of Al(OH)3 crystals are hexagonal[disputed – discuss]:
- gibbsite is also known as γ-Al(OH)3 [8] or α-Al(OH)3[citation needed]
- bayerite is also known as α-Al(OH)3 [8] or β-alumina trihydrate[citation needed]
- nordstrandite is also known as Al(OH)3[8]
- doyleite
Hydrargillite, once thought to be aluminium hydroxide, is an aluminium phosphate. Nonetheless, both gibbsite and hydrargillite refer to the same polymorphism of aluminium hydroxide, with gibbsite used most commonly in the United States and hydrargillite used more often in Europe. Hydrargillite is named after the Greek words for water (hydra) and clay (argylles).
Properties[edit]
Aluminium hydroxide is amphoteric. In acid, it acts as a Brønsted–Lowry base. It neutralizes the acid, yielding a salt:[9]
- 3 HCl + Al(OH)3 → AlCl3 + 3 H2O
In bases, it acts as a Lewis acid by binding hydroxide ions:[9]
- Al(OH)3 + OH− → Al(OH)4−
Production[edit]
Red mud reservoirs (this one in Stade, Germany) contain the corrosive residues from the production of aluminum hydroxide.
Virtually all the aluminium hydroxide used commercially is manufactured by the Bayer process[10] which involves dissolving bauxite in sodium hydroxide at temperatures up to 270 °C (518 °F). The waste solid, bauxite tailings, is removed and aluminium hydroxide is precipitated from the remaining solution of sodium aluminate. This aluminium hydroxide can be converted to aluminium oxide or alumina by calcination.
The residue or bauxite tailings, which is mostly iron oxide, is highly caustic due to residual sodium hydroxide. It was historically stored in lagoons; this led to the Ajka alumina plant accident in 2010 in Hungary, where a dam bursting led to the drowning of nine people. An additional 122 sought treatment for chemical burns. The mud contaminated 40 square kilometres (15 sq mi) of land and reached the Danube. While the mud was considered non-toxic due to low levels of heavy metals, the associated slurry had a pH of 13.[11]
Uses[edit]
Fire retardant filler[edit]
Aluminium hydroxide also finds use as a fire retardant filler for polymer applications. It is selected for these applications because it is colorless (like most polymers), inexpensive, and has good fire retardant properties.[12] Magnesium hydroxide and mixtures of huntite and hydromagnesite are used similarly.[13][14][15][16][17] It decomposes at about 180 °C (356 °F), absorbing a considerable amount of heat in the process and giving off water vapour. In addition to behaving as a fire retardant, it is very effective as a smoke suppressant in a wide range of polymers, most especially in polyesters, acrylics, ethylene vinyl acetate, epoxies, polyvinyl chloride (PVC) and rubber.[18]
Precursor to Al compounds[edit]
Aluminium hydroxide is a feedstock for the manufacture of other aluminium compounds: calcined aluminas, aluminium sulfate, polyaluminium chloride, aluminium chloride, zeolites, sodium aluminate, activated alumina, and aluminium nitrate.[6]
Freshly precipitated aluminium hydroxide forms gels, which are the basis for the application of aluminium salts as flocculants in water purification. This gel crystallizes with time. Aluminium hydroxide gels can be dehydrated (e.g. using water-miscible non-aqueous solvents like ethanol) to form an amorphous aluminium hydroxide powder, which is readily soluble in acids. Heating converts it to activated aluminas, which are used as desiccants, adsorbent in gas purification, and catalyst supports.[12]
Pharmaceutical[edit]
Under the generic name «algeldrate», aluminium hydroxide is used as an antacid in humans and animals (mainly cats and dogs). It is preferred over other alternatives such as sodium bicarbonate because Al(OH)3, being insoluble, does not increase the pH of stomach above 7 and hence, does not trigger secretion of excess acid by the stomach. Brand names include Alu-Cap, Aludrox, Gaviscon or Pepsamar. It reacts with excess acid in the stomach, reducing the acidity of the stomach content,[19][20] which may relieve the symptoms of ulcers, heartburn or dyspepsia. Such products can cause constipation, because the aluminium ions inhibit the contractions of smooth muscle cells in the gastrointestinal tract, slowing peristalsis and lengthening the time needed for stool to pass through the colon.[21] Some such products are formulated to minimize such effects through the inclusion of equal concentrations of magnesium hydroxide or magnesium carbonate, which have counterbalancing laxative effects.[22]
This compound is also used to control hyperphosphatemia (elevated phosphate, or phosphorus, levels in the blood) in people and animals suffering from kidney failure. Normally, the kidneys filter excess phosphate out from the blood, but kidney failure can cause phosphate to accumulate. The aluminium salt, when ingested, binds to phosphate in the intestines and reduce the amount of phosphorus that can be absorbed.[23][24]
Precipitated aluminium hydroxide is included as an adjuvant in some vaccines (e.g. anthrax vaccine). One of the well-known brands of aluminium hydroxide adjuvant is Alhydrogel, made by Brenntag Biosector.[25][full citation needed][dead link] Since it absorbs protein well, it also functions to stabilize vaccines by preventing the proteins in the vaccine from precipitating or sticking to the walls of the container during storage. Aluminium hydroxide is sometimes called «alum», a term generally reserved for one of several sulfates.[citation needed]
Vaccine formulations containing aluminium hydroxide stimulate the immune system by inducing the release of uric acid, an immunological danger signal. This strongly attracts certain types of monocytes which differentiate into dendritic cells. The dendritic cells pick up the antigen, carry it to lymph nodes, and stimulate T cells and B cells.[26] It appears to contribute to induction of a good Th2 response, so is useful for immunizing against pathogens that are blocked by antibodies. However, it has little capacity to stimulate cellular (Th1) immune responses, important for protection against many pathogens,[27] nor is it useful when the antigen is peptide-based.[28]
Safety[edit]
In the 1960s and 1970s it was speculated that aluminium was related to various neurological disorders, including Alzheimer’s disease.[29][30] Since then, multiple epidemiological studies have found no connection between exposure to environmental or swallowed aluminium and neurological disorders, though injected aluminium was not looked at in these studies.[31][32][33]
Neural disorders were found in experiments on mice motivated by Gulf War illness (GWI). Aluminum hydroxide injected in doses equivalent to those administered to the United States military, showed increased reactive astrocytes, increased apoptosis of motor neurons and microglial proliferation within the spinal cord and cortex.[34]
References[edit]
- ^ For solubility product: «Solubility product constants». Archived from the original on 15 June 2012. Retrieved 17 May 2012.
- ^ For isoelectric point: Gayer, K. H.; Thompson, L. C.; Zajicek, O. T. (September 1958). «The solubility of aluminum hydroxide in acidic and basic media at 25 ?c». Canadian Journal of Chemistry. 36 (9): 1268–1271. doi:10.1139/v58-184. ISSN 0008-4042.
- ^ Zumdahl, Steven S. (2009). Chemical Principles (6th ed.). Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ Black, Ronald A.; Hill, D. Ashley (15 June 2003). «Over-the-Counter Medications in Pregnancy». American Family Physician. 67 (12): 2517–2524. ISSN 0002-838X. PMID 12825840. Retrieved 1 July 2017.
- ^ Wells, A. F. (1975), Structural Inorganic Chemistry (4th ed.), Oxford: Clarendon Press
- ^ a b Evans, K. A. (1993). «Properties and uses of aluminium oxides and aluminium hydroxides». In A. J. Downs (ed.). Chemistry of aluminium, gallium, indium, and thallium (1st ed.). London; New York: Blackie Academic & Professional. ISBN 9780751401035.
- ^ Karamalidis, A. K.; Dzombak D. A. (2010). Surface Complexation Modeling: Gibbsite. John Wiley & Sons. pp. 15–17. ISBN 978-0-470-58768-3.
- ^ a b c Wefers, Karl; Misra, Chanakya (1987). Oxides and hydroxides of aluminum. Alcoa Research Laboratories. p. 2. OCLC 894928306.
- ^ a b Boundless (26 July 2016). «Basic and Amphoteric Hydroxides». Boundless Chemistry. Archived from the original on 22 August 2017. Retrieved 2 July 2017.
- ^ Hind, AR; Bhargava SK; Grocott SC (1999). «The Surface Chemistry of Bayer Process Solids: A Review». Colloids Surf Physiochem Eng Aspects. 146 (1–3): 359–74. doi:10.1016/S0927-7757(98)00798-5.
- ^ «Hungary Battles to Stem Torrent of Toxic Sludge». BBC News Website. 5 October 2010.
- ^ a b Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; Wefers, Karl; Williams, F. S. (2000). «Aluminum Oxide». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_557.
- ^ Hollingbery, LA; Hull TR (2010). «The Fire Retardant Behaviour of Huntite and Hydromagnesite — A Review» (PDF). Polymer Degradation and Stability. 95 (12): 2213–2225. doi:10.1016/j.polymdegradstab.2010.08.019.
- ^ Hollingbery, LA; Hull TR (2010). «The Thermal Decomposition of Huntite and Hydromagnesite — A Review» (PDF). Thermochimica Acta. 509 (1–2): 1–11. doi:10.1016/j.tca.2010.06.012.
- ^ Hollingbery, LA; Hull TR (2012). «The Fire Retardant Effects of Huntite in Natural Mixtures with Hydromagnesite» (PDF). Polymer Degradation and Stability. 97 (4): 504–512. doi:10.1016/j.polymdegradstab.2012.01.024.
- ^ Hollingbery, LA; Hull TR (2012). «The Thermal Decomposition of Natural Mixtures of Huntite and Hydromagnesite» (PDF). Thermochimica Acta. 528: 45–52. doi:10.1016/j.tca.2011.11.002.
- ^ Hull, TR; Witkowski A; Hollingbery LA (2011). «Fire Retardant Action of Mineral Fillers» (PDF). Polymer Degradation and Stability. 96 (8): 1462–1469. doi:10.1016/j.polymdegradstab.2011.05.006. S2CID 96208830.
- ^ Huber Engineered Materials. «Huber Non-Halogen Fire Retardant Additives» (PDF). Retrieved 3 July 2017.
- ^ Galbraith, A; Bullock, S; Manias, E; Hunt, B; Richards, A (1999). Fundamentals of pharmacology: a text for nurses and health professionals. Harlow: Pearson. p. 482.
- ^ Papich, Mark G. (2007). «Aluminum Hydroxide and Aluminum Carbonate». Saunders Handbook of Veterinary Drugs (2nd ed.). St. Louis, Mo: Saunders/Elsevier. pp. 15–16. ISBN 9781416028888.
- ^ Washington, Neena (2 August 1991). Antacids and Anti Reflux Agents. Boca Raton, FL: CRC Press. p. 10. ISBN 978-0-8493-5444-1.
- ^ Bill, Robert L. (1 September 2016). Clinical Pharmacology and Therapeutics for Veterinary Technicians — E-Book. Elsevier Health Sciences. p. 105. ISBN 9780323444026.
- ^ Plumb, Donald C. (2011). «Aluminum Hydroxide». Plumb’s Veterinary Drug Handbook (7th ed.). Stockholm, Wisconsin; Ames, Iowa: Wiley. pp. 36–37. ISBN 9780470959640.
- ^ Lifelearn Inc. (1 November 2010). «Aluminum Hydroxide». Know Your Pet. Retrieved 30 June 2017.
- ^ «About Brenntag Biosector — Brenntag». brenntag.com. Retrieved 19 April 2018.
- ^ Kool, M; Soullié T; van Nimwegen M; Willart MA; Muskens F; Jung S; Hoogsteden HC; Hammad H; Lambrecht BN (24 March 2008). «Alum adjuvant boosts adaptive immunity by inducing uric acid and activating inflammatory dendritic cells». J Exp Med. 205 (4): 869–82. doi:10.1084/jem.20071087. PMC 2807488. PMID 18362170.
- ^ Petrovsky N, Aguilar JC (2004). «Vaccine adjuvants: current state and future trends». Immunology & Cell Biology. 82 (5): 488–96. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ^ Cranage, MP; Robinson A (2003). Robinson A; Hudson MJ; Cranage MP (eds.). Vaccine Protocols — Volume 87 of Methods in Molecular Medicine Biomed Protocols (2nd ed.). Springer. p. 176. ISBN 978-1-59259-399-6.
- ^ «Alzheimer’s Myth’s». Alzheimer’s Association. Retrieved 29 July 2012.
- ^ Khan, A (1 September 2008). «Aluminium and Alzheimer’s disease». Alzheimer’s Society. Archived from the original on 11 March 2012. Retrieved 8 March 2012.
- ^ Rondeau V (2002). «A review of epidemiologic studies on aluminum and silica in relation to Alzheimer’s disease and associated disorders». Rev Environ Health. 17 (2): 107–21. doi:10.1515/REVEH.2002.17.2.107. PMC 4764671. PMID 12222737.
- ^ Martyn CN, Coggon DN, Inskip H, Lacey RF, Young WF (May 1997). «Aluminum concentrations in drinking water and risk of Alzheimer’s disease». Epidemiology. 8 (3): 281–6. doi:10.1097/00001648-199705000-00009. JSTOR 3702254. PMID 9115023. S2CID 32190038.
- ^ Graves AB, Rosner D, Echeverria D, Mortimer JA, Larson EB (September 1998). «Occupational exposures to solvents and aluminium and estimated risk of Alzheimer’s disease». Occup Environ Med. 55 (9): 627–33. doi:10.1136/oem.55.9.627. PMC 1757634. PMID 9861186.
- ^ Shaw, Christopher A.; Petrik, Michael S. (November 2009). «Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration». Journal of Inorganic Biochemistry. 103 (11): 1555–1562. doi:10.1016/j.jinorgbio.2009.05.019. ISSN 1873-3344. PMC 2819810. PMID 19740540.
External links[edit]
- International Chemical Safety Card 0373
- «Some properties of aluminum hydroxide precipitated in the presence of clays», Soil Research Institute, R C Turner, Department of Agriculture, Ottawa[permanent dead link]
- Effect of ageing on properties of polynuclear hydroxyaluminum cations
- A second species of polynuclear hydroxyaluminum cation, its formation and some of its properties
|
Гидроксид алюминия |
|
|---|---|
| Хим. формула | AlH₃O₃ |
| Номер CAS | 21645-51-2 |
| PubChem | 10176082 |
| ChemSpider | 8351587 |
| Номер EINECS | 244-492-7 |
| RTECS | BD0940000 |
| ChEBI | 33130 |
| DrugBank | DB06723 |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. |
Гидроксид алюминия — вещество с формулой Al(OH)3 (а также H3AlO3) — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Безопасность
- 4.1 ЛД50
- 5 Применение
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
AlCl3 + 3 NaOH ⟶ Al(OH)3 ↓ + 3 NaCl
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
-
- 2 AlCl3 + 3 Na2CO3 + 3 H2O → 2 Al(OH)3 ↓ + 6 NaCl + 3 CO2
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидрагилит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
- Al(OH)3 + 3 HCl ⟶ AlCl3 + 3 H2O
- Al(OH)3 + 3 HNO3 ⟶ Al(NO3)3 + 3 H2O
- щелочами
- В концентрированном растворе гидроксида натрия:
- Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
- При сплавлении твёрдых реагентов:
- Al(OH)3 + NaOH →1000oC NaAlO2 + 2 H2O
При нагревании разлагается:
-
- 2 Al(OH)3 →t>575oC Al2O3 + 3 H2O
С растворами аммиака не реагирует.
Безопасность
ЛД50
>5000 мг/кг (крысы, перорально).
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.

Содержание
- Получение
- Физические свойства
- Химические свойства
- Безопасность
- ЛД50
- Применение
Гидроксид алюминия — вещество с формулой Al(OH)3 — соединение оксида алюминия с водой. Белое студенистое вещество, плохо растворимое в воде, обладает амфотерными свойствами.
|
Гидроксид алюминия |
|
|---|---|
|
|
|
|
Общие |
|
| Хим. формула | AlH₃O₃ |
|
Классификация |
|
| Номер CAS | 21645-51-2 |
| PubChem | 10176082 |
| ChemSpider | 8351587 |
| Номер EINECS | 244-492-7 |
| RTECS | BD0940000 |
| ChEBI | 33130 |
| DrugBank | DB06723 |
|
SMILES |
|
|
[OH-].[OH-].[OH-].[Al+3] |
|
|
InChI |
|
|
1S/Al.3H2O/h;3*1H2/q+3;;;/p-3 |
|
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. |
Получение
Al(OH)3 получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
Гидроксид алюминия выпадает в виде белого студенистого осадка.
Второй способ получения гидроксида алюминия — взаимодействие водорастворимых солей алюминия с растворами карбонатов щелочных металлов:
Физические свойства
Гидроксид алюминия представляет собой белое кристаллическое вещество, для которого известны 4 кристаллические модификации:
- моноклинный (γ) гиббсит
- триклинный (γ’) гиббсит (гидраргиллит)
- байерит (γ)
- нордстрандит (β)
Существует также аморфный гидроксид алюминия переменного состава Al2O3•nH2O
Химические свойства
Свежеосаждённый гидроксид алюминия может взаимодействовать с:
- кислотами
- щелочами
- В концентрированном растворе гидроксида натрия:
- При сплавлении твёрдых реагентов:
При нагревании разлагается:
С растворами аммиака не реагирует.
Безопасность
ЛД50
>5000 мг/кг (крысы, перорально).
0
0
0
Применение
Гидроксид алюминия используется при очистке воды, так как обладает способностью адсорбировать различные вещества.
В медицине, в качестве антацидного средства, в качестве адъюванта при изготовлении вакцин.
В качестве абразивного компонента зубной пасты.
В качестве антипирена (подавителя горения) в пластиках и других материалах.
После обработки до окислов применяется в качестве носителя для катализаторов.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Гидроксид алюминия
Брутто-формула:
H3AlO3
CAS# 21645-51-2
Категории:
Гидроксиды
PubChem CID: 10176082
Названия
Русский:
- Гидроксид алюминия(IUPAC)
- Гидроокись алюминия
English:
- Aluminic acid
- Aluminic hydroxide
- Aluminium hydroxide(CAS)
- Aluminium(3+) trioxidanide
- Aluminium(III) hydroxide
- Hydrated alumina
- Orthoaluminic acid
- Orthoaluminic acidAluminic acid
- aluminum;trihydroxide(IUPAC)
العربية:
- هيدروكسيد الألومنيوم
Español:
- Hidróxido de aluminio
German:
- Aluminiumhydroxid
- Bayerit
- Böhmit
- Diaspor
- Hydrargillit
- Nordstrandit
- Tonerdehydrat
French:
- Hydroxyde d’aluminium(IUPAC)
- hydrate d’alumine
- trihydrate d’oxyde d’aluminium
Italiano:
- Idrossido di alluminio
- idrargillite
- triidrossido di alluminio(IUPAC)
日本語:
- 水酸化アルミニウム
中文:
- 氢氧化铝
Варианты формулы:
Al(OH)3
H3AlO3
HO-Al<`|OH>-OH
H/O^-Al^3+<|0O^-`/H>/0O`^-H
HO/Al<`|O/H>O/H
Химический состав
Реакции, в которых участвует Гидроксид алюминия
-
AlCl3 + 3NaOH -> Al(OH)3″|v» + 3NaCl
-
{M}{X}3 + 3{R}OH -> {M}(OH)3″|v» + 3{R}{X}
, где M =
Al Cr Fe Ti La; X =
Cl F Br I; R =
Li Na K Rb Cs NH4 -
Al(OH)3 + 3H{X} -> Al{X}3 + 3H2O
, где X =
F Cl Br I (NO3) -
Al(OH)3 + {M}OH -> {M}[Al(OH)4]
, где M =
Na K -
2Al + 6H2O -> 2Al(OH)3 + 3H2
И ещё 18 реакций…
Гидроксид алюминия, характеристика, свойства и получение, химические реакции.
Гидроксид алюминия – неорганическое вещество, имеет химическую формулу Al(OH)3.
Краткая характеристика гидроксида алюминия
Модификации гидроксида алюминия
Физические свойства гидроксида алюминия
Получение гидроксида алюминия
Химические свойства гидроксида алюминия
Химические реакции гидроксида алюминия
Применение и использование гидроксида алюминия
Краткая характеристика гидроксида алюминия:
Гидроксид алюминия – неорганическое вещество белого цвета.
Химическая формула гидроксида алюминия Al(OH)3.
Плохо растворяется в воде.
Обладает способностью адсорбировать различные вещества.
Модификации гидроксида алюминия:
Известны 4 кристаллические модификации гидроксида алюминия: гиббсит, байерит, дойлеит и нордстрандит.
Гиббсит обозначается γ-формой гидроксида алюминия, а байерит – α-формой гидроксида алюминия.
Гиббсит является наиболее химически стабильной формой гидроксида алюминия.
Физические свойства гидроксида алюминия:
| Наименование параметра: | Значение: |
| Химическая формула | Al(OH)3 |
| Синонимы и названия иностранном языке для гидроксида алюминия α-формы | aluminum hydroxide α-form (англ.)
байерит (рус.) |
| Синонимы и названия иностранном языке для гидроксида алюминия γ-формы | aluminium hydroxide (англ.)
aluminum hydroxide (англ.) гиббсит (рус.) |
| Синонимы и названия иностранном языке для гидроксида алюминия γ’-формы | hydrargillite (англ.)
гидраргиллит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид гидроксида алюминия α-формы | белые гексагональные кристаллы |
| Внешний вид гидроксида алюминия γ-формы | белые моноклинные кристаллы |
| Цвет | белый |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2420 |
| Плотность гидроксида алюминия γ-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,42 |
| Температура разложения гидроксида алюминия, °C | 150-200 °C, > 575 °C |
| Молярная масса, г/моль | 78,004 |
* Примечание:
— нет данных.
Получение гидроксида алюминия:
Гидроксид алюминия получают в результате следующих химических реакций:
- 1. в результате взаимодействия хлорида алюминия и гидроксида натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка.
- 2. в результате взаимодействия хлорида алюминия, карбоната натрия и воды:
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2 + 6NaCl.
При этом гидроксид алюминия выпадает в виде белого студенистого осадка.
Гидроксид алюминия получают также при взаимодействии водорастворимых солей алюминия с карбонатами щелочных металлов.
Химические свойства гидроксида алюминия. Химические реакции гидроксида алюминия:
Гидроксид алюминия обладает амфотерными свойствами, т. е. обладает как основными, так и кислотными свойствами.
Химические свойства гидроксида алюминия аналогичны свойствам гидроксидов других амфотерных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида алюминия с гидроксидом натрия:
Al(OH)3 + NaOH → NaAlO2 + 2H2O (t ≈ 1000 °C),
Al(OH)3 + 3NaOH → Na3[Al(OH)6],
Al(OH)3 + NaOH → Na[Al(OH)4].
В результате реакции образуются в первом случае – алюминат натрия и вода, во втором – гексагидроксоалюминат натрия, в третьем – тетрагидроксоалюминат натрия. В третьем случае в качестве исходного вещества гидроксид натрия используется в виде концентрированного раствора.
2. реакция гидроксида алюминия с гидроксидом калия:
Al(OH)3 + KOH → KAlO2 + 2H2O (t ≈ 1000 °C),
Al(OH)3 + KOH → K[Al(OH)4].
В результате реакции образуются в первом случае – алюминат калия и вода, во втором – тетрагидроксоалюминат калия. Во втором случае в качестве исходного вещества гидроксид калия используется в виде концентрированного раствора.
3. реакция гидроксида алюминия с азотной кислотой:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O.
В результате реакции образуются нитрат алюминия и вода.
Аналогично проходят реакции гидроксида алюминия и с другими кислотами.
4. реакция гидроксида алюминия с фтороводородом:
Al(OH)3 + 3HF → AlF3 + 3H2O,
6HF + Al(OH)3 → H3[AlF6] + 3H2O.
В результате реакции образуются в первом случае – фторид алюминия и вода, во втором – гексафтороалюминат водорода и вода. При этом фтороводород в первом случае в качестве исходного вещества используется в виде раствора.
5. реакция гидроксида алюминия с бромоводородом:
Al(OH)3 + 3HBr → AlBr3 + 3H2O.
В результате реакции образуются бромид алюминия и вода.
6. реакция гидроксида алюминия с йодоводородом:
Al(OH)3 + 3HI → AlI3 + 3H2O.
В результате реакции образуются йодид алюминия и вода.
7. реакция термического разложения гидроксида алюминия:
Al(OH)3 → AlO(OH) + H2O (t = 150-200 °C),
2Al(OH)3 → Al2O3 + 3H2O (t > 575 °C).
В результате реакции образуются в первом случае – метагидроксид алюминия и вода, во втором – оксид алюминия и вода.
8. реакция гидроксида алюминия и карбоната натрия:
2Al(OH)3 + Na2CO3 → 2NaAlO2 + CO2 + 3H2O.
В результате реакции образуются алюминат натрия, оксид углерода (IV) и вода.
10. реакция гидроксида алюминия и гидроксида кальция:
Ca(OH)2 + 2Al(OH)3 → Ca[Al(OH)4]2.
В результате реакции образуется тетрагидроксоалюмината кальция.
Применение и использование гидроксида алюминия:
Гидроксид алюминия используется при очистке воды (как адсорбирующее вещество), в медицине, в качестве наполнителя в зубной пасте (как абразивное вещество), пластиках и пластмассах (как антипирен).
Примечание: © Фото //www.pexels.com, //pixabay.com
гидроксид алюминия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения реакции масса взаимодействие гидроксида
Коэффициент востребованности
11 961





