| Барий | |
|---|---|
| Мягкий, вязкий серебристо-белый металл | |

Барий в пробирке |
|
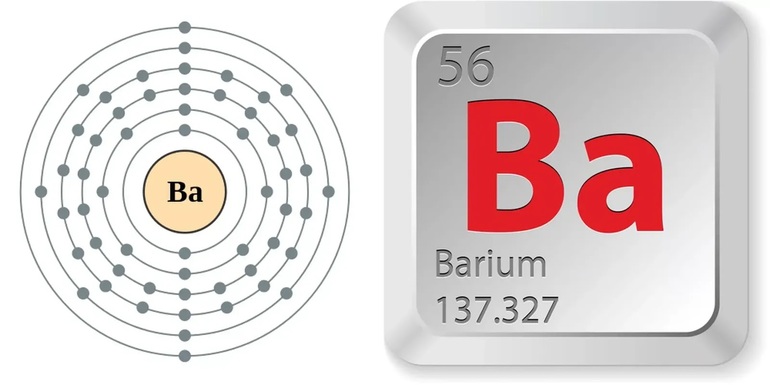
| Название, символ, номер | Барий / Barium (Ba), 56 |
| Атомная масса (молярная масса) |
137,327(7) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s2 |
| Радиус атома | 222 пм |
| Ковалентный радиус | 198 пм |
| Радиус иона | (+2e) 134 пм |
| Электроотрицательность | 0,89 (шкала Полинга) |
| Электродный потенциал | -2,906 |
| Степени окисления | +2 |
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
| Плотность (при н. у.) | 3,5 г/см³ |
| Температура плавления | 1 002 K |
| Температура кипения | 1 910 K |
| Уд. теплота плавления | 7,66 кДж/моль |
| Уд. теплота испарения | 142,0 кДж/моль |
| Молярная теплоёмкость | 28,1 Дж/(K·моль) |
| Молярный объём | 39,0 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,020 Å |
| Теплопроводность | (300 K) (18.4) Вт/(м·К) |
| Номер CAS | 7440-39-3 |
Барий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Типы месторождений
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 8 Качественный и количественный анализ
- 9 Применение
- 10 Цены
- 11 Биологическая роль и токсичность
История
Барий был открыт в виде оксида BaO в 1774 году Карлом Шееле и Юханом Ганом. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/л. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Основная статья: Изотопы бария
Известны изотопы бария с массовыми числами от 114 до 153, и 10 ядерных изомеров. Природный барий состоит из смеси шести стабильных изотопов (132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba) и одного изотопа с огромным периодом полураспада, много больше возраста Вселенной (130Ba).
Получение
Основное сырьё для получения бария — баритовый концентрат (80—95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
- BaSO4 + 4C → BaS + 4CO
- BaSO4 + 2CH4 → BaS + 2C + 4H2O
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
- BaS + 2H2O → Ba(OH)2 + H2S↑
- BaS + H2O + CO2 → BaCO3 + H2S↑
- BaCO3 → BaO + CO2
Получают металлический барий электролизом безводного расплава хлорида бария:
- BaCl2 → Ba + Cl2
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объёмно-центрированной решёткой (а = 0,501 нм), выше устойчив β-Ba.
Твёрдость по шкале Мооса 1,25.
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксида бария BaO и нитрида бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
- Ba + 2H2O → Ba(OH)2 + H2↑
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который, в свою очередь, с гидридом лития LiH даёт комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
- 6Ba + 2NH3 → 3BaH2 + Ba3N2
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
- Ba3N2 + 2CO → Ba(CN)2 + 2BaO
С жидким аммиаком даёт тёмно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
- [Ba(NH3)6] → Ba(NH2)2 + 4NH3 + H2
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углём.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора.
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
- Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
- Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
- Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
- Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
- Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
- Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
- Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов, а также купрат бария, применяются для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
- Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
- Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
- Применение в медицине
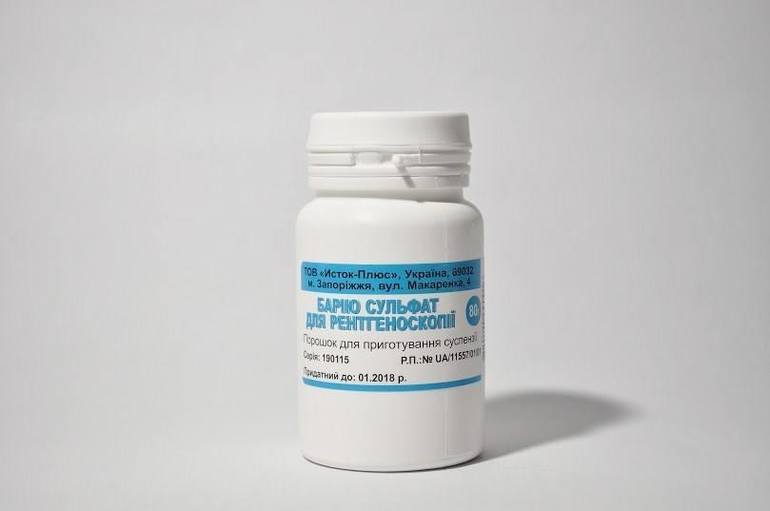
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, фторид, йодид, бромид, сульфид, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2—0,5 г солей бария, смертельная доза 0,8—0,9 г.
Для оказании первой помощи необходимо промыть желудок 1 % раствором сульфата натрия или магния. Клизмы из 10 % растворов тех же солей. Приём внутрь раствора тех же солей (20,0 частей соли на 150,0 частей воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3 % раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
|
Периодическая система химических элементов Д. И. Менделеева |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Электрохимический ряд активности металлов |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, |
Характеристика бария
Положение в ПСХЭ
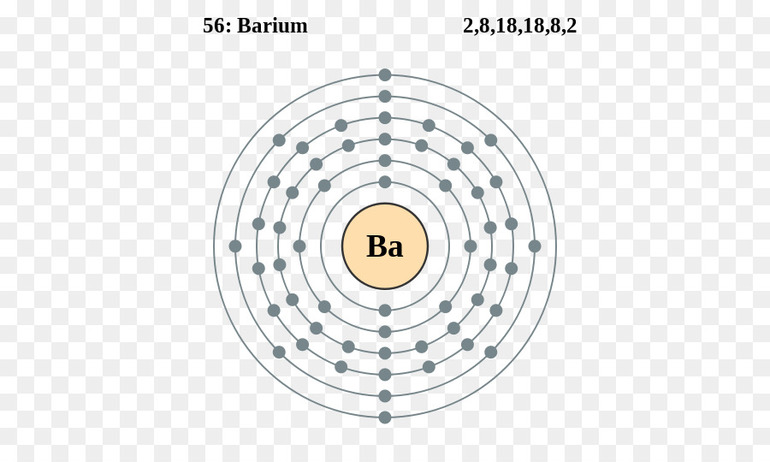
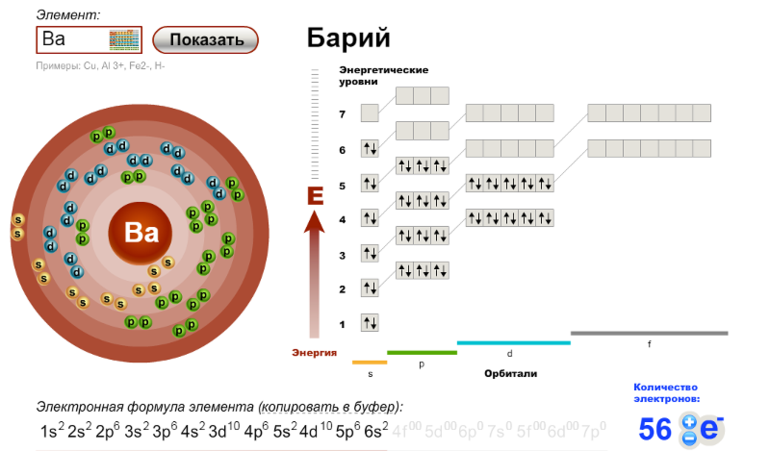
Барий (Ba) располагается в 5 периоде, во II группе, главной подгруппе, имеет порядковый номер 56.
Атомные числа
A (массовое число) = 137
P (число протонов) = 56
N (число нейтронов) = A — Z = 137 — 56 = 81
ē (число электронов) = 56
Электронное строение атома
Ba
+56
2
8
18
18
8
2
56Ba 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
Валентные электроны
| 56Ba | ↑↓ | |||||
| 6s | 6p |
| 56Ba* | ↑ | ↑ | ||||
| 6s | 6p |
Степени окисления
минимальная: 0
максимальная: +2
Свойства простого вещества
Барий – s-элемент, металл.
Высший оксид
BaO – оксид бария.
Проявляет основные свойства:
BaO + 2HCl ⟶ BaCl2 + H2O
Высший гидроксид
Ba(OH)2 – гидроксид бария.
Проявляет основные свойства:
Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2O
|
|||
| Внешний вид простого вещества | |||
|---|---|---|---|
|
|
|||
| Свойства атома | |||
| Имя, символ, номер |
Барий / Barium (Ba), 56 |
||
| Атомная масса (молярная масса) |
137,327 а. е. м. (г/моль) |
||
| Электронная конфигурация |
[Xe] 6s2 |
||
| Радиус атома |
222 пм |
||
| Химические свойства | |||
| Ковалентный радиус |
198 пм |
||
| Радиус иона |
(+2e) 134 пм |
||
| Электроотрицательность |
0,89 (шкала Полинга) |
||
| Электродный потенциал |
-2,906 |
||
| Степени окисления |
2 |
||
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) |
||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) |
3,5 г/см³ |
||
| Температура плавления |
1 002 K |
||
| Температура кипения |
1 910 K |
||
| Теплота плавления |
7,66 кДж/моль |
||
| Теплота испарения |
142,0 кДж/моль |
||
| Молярная теплоёмкость |
28,1[1] Дж/(K·моль) |
||
| Молярный объём |
39,0 см³/моль |
||
| Кристаллическая решётка простого вещества | |||
| Структура решётки |
кубическая |
||
| Параметры решётки |
5,020 Å |
||
| Прочие характеристики | |||
| Теплопроводность |
(300 K) (18.4) Вт/(м·К) |
Ба́рий — элемент главной подгруппы второй группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56. Обозначается символом Ba (лат. Barium). Простое вещество барий (CAS-номер: 7440-39-3) — мягкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
Содержание
- 1 История
- 2 Происхождение названия
- 3 Нахождение в природе
- 3.1 Типы месторождений
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 8 Качественный и количественный анализ
- 9 Применение
- 9.1 Вакуумные электронные приборы
- 9.2 Антикоррозионный материал
- 9.3 Сегнето- и пьезоэлектрик
- 9.4 Оптика
- 9.5 Пиротехника
- 9.6 Атомно-водородная энергетика
- 9.7 Высокотемпературная сверхпроводимость
- 9.8 Ядерная энергетика
- 9.9 Химические источники тока
- 9.10 Применение соединений бария в медицине
- 10 Цены
- 11 Биологическая роль и токсичность
- 12 См. также
- 13 Примечания
- 14 Ссылки
История
Барий был открыт в виде оксида BaO в 1774 г. Карлом Шееле и Юханом Ганом[2]. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый», так как его оксид (BaO) был охарактеризован, как имеющий необычно высокую для таких веществ плотность.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/литр. Барий активен, он входит в подгруппу щелочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гетит и гидрогетит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Природный барий состоит из смеси семи стабильных изотопов: 130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba. Последний является самым распространенным (71,66 %). Известны и радиоактивные изотопы бария, наиболее важным из которых является 140Ba. Он образуется при распаде урана, тория и плутония.
Получение
Основное сырье для получения бария — баритовый концентрат (80-95 % BaSO4), который в свою очередь получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария Ba(OH)2 или под действием CO2 превращают в нерастворимый карбонат бария BaCO3, который затем переводят в оксид бария BaO (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Металлический барий получают из оксида восстановлением алюминием в вакууме при 1200—1250 °C:
Очищают барий перегонкой в вакууме или зонной плавкой.
Физические свойства
Барий — серебристо-белый ковкий металл. При резком ударе раскалывается. Существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba с кубической объемно-центрированной решеткой (параметр а = 0,501 нм), выше устойчив β-Ba.
Твердость по минералогической шкале 1,25.[3]
Хранят металлический барий в керосине или под слоем парафина.
Химические свойства
Барий — щёлочноземельный металл. На воздухе барий быстро окисляется, образуя смесь оксид бария BaO и нитрид бария Ba3N2, а при незначительном нагревании воспламеняется. Энергично реагирует с водой, образуя гидроксид бария Ba(ОН)2:
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2, который в свою очередь с гидридом лития LiH дает комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
С жидким аммиаком дает темно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
Карбид бария BaC2 может быть получен при нагревании в дуговой печи BaO с углем.
С фосфором образует фосфид Ba3P2.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария BaSO4, отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок родизоната бария. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[4].
Соединения бария окрашивают пламя в желто-зеленый цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
Пиротехника
Пероксид бария используется для пиротехники и как окислитель. Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов применяется для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространенных типов таких стекол имеет следующий состав — (оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). В стекловарении для атомной промышленности применяется также и фосфат бария.
Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
Применение соединений бария в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария изучена недостаточно. В число жизненно важных микроэлементов он не входит.
Все растворимые в воде соединения бария высокотоксичны. Вследствие хорошей растворимости в воде из солей бария опасен хлорид, а также нитрат, нитрит, хлорат и перхлорат. Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы острого отравления солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твердый неправильный пульс, судороги, позже возможны и параличи, синюха лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может кивнуть головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжелого отравления смерть наступает внезапно или в течение одних суток. Тяжелые отравления наступают при приеме внутрь 0,2 — 0,5 г солей бария, смертельная доза 0,8 — 0,9 г.
Для оказании первой помощи необходимо промыть желудок 1%-ным раствором сульфата натрия или магния. Клизмы из 10%-ных растворов тех же солей. Приём внутрь раствора тех же солей (20,0 ч. соли на 150,0 ч. воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10-20 мл 3%-ного раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
См. также
- Бария титанат
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 241. — 623 с. — 100 000 экз.
- ↑ Барий. // Популярная библиотека химических элементов. — М.: Издательство «Наука», 1977.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Н.С. Фрумина, Н.Н. Горюнова, С.Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
Ссылки
| Барий на Викискладе? |
- Барий на Webelements
- Барий в Популярной библиотеке химических элементов
| Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
|
| |
|---|
|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au Элементы расположены в порядке возрастания стандартного электродного потенциала. |
|
Соединения бария |
|---|
|
Амид бария (Ba(NH2)2) • Ацетат бария (Ba(CH3COO)2) • Бромид бария (BaBr2) • Гидрид бария (BaH2) • Гидроксид бария (Ba(OH)2) • Гидросульфид бария (Ba(HS)2) • Дитионат бария (BaS2O6) • Иодат бария (Ba(IO3)2) • Иодид бария (BaI2) • Карбид бария (BaC2) • Карбонат бария (BaCO3) • Манганат бария (BaMnO4) • Метаборат бария (Ba(BO2)2) • Нитрат бария (Ba(NO3)2) • Нитрид бария (Ba3N2) • Нитрит бария (Ba(NO2)2) • Оксалат бария (BaC2O4) • Оксид бария (BaO) • Пероксид бария (BaO2) • Перхлорат бария (BaClO4) • Силикат бария (ВаSiO3) • Сульфат бария (BaSO4) • Сульфид бария (BaS) • Сульфит бария (BaSO3) • Титанат бария (BaTiO3) • Феррат бария (BaFeO4) • Феррит бария (BaFe2O4) • Фосфат бария (Ba3(PO4)2) • Фосфид бария (Ba3P2) • Фторид бария (BaF2) • Хлорат бария (Ba(ClO3)2) • Хлорид бария (BaCl2) • Хромат бария (BaCrO4) • Хромат(V) бария (Ba3(CrO4)2) • Цианид бария (Ba(CN)2) • Цирконат бария (BaZrO3) |
|
|
| Барий | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Цезий | Лантан → | |||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид простого вещества | |||||||||||||||||||||||||||||||||||||||||||||

Образец бария |
|||||||||||||||||||||||||||||||||||||||||||||
| Свойства атома | |||||||||||||||||||||||||||||||||||||||||||||
| Название, символ, номер | Барий / Barium (Ba), 56 | ||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок |
2 (устар. 2), 6, p-элемент |
||||||||||||||||||||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
137,327(7)[1] а. е. м. (г/моль) | ||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Xe] 6s2 | ||||||||||||||||||||||||||||||||||||||||||||
| Радиус атома | 222 пм | ||||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 198 пм | ||||||||||||||||||||||||||||||||||||||||||||
| Радиус иона | (+2e) 134 пм | ||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 0,89 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||
| Электродный потенциал | -2,906 | ||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | 0, +2 | ||||||||||||||||||||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
502,5 (5,21) кДж/моль (эВ) | ||||||||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 3,78 г/см³ | ||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1002 K | ||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 1910 K | ||||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота плавления | 7,66 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота испарения | 142,0 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 28,1[2] Дж/(K·моль) | ||||||||||||||||||||||||||||||||||||||||||||
| Молярный объём | 39,0 см³/моль | ||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||||||||||||||||||||||||||||||||
| Структура решётки |
Кубическая объёмноцентрированная |
||||||||||||||||||||||||||||||||||||||||||||
| Параметры решётки | 5,020 Å | ||||||||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | |||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 K) (18.4) Вт/(м·К) | ||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | |||||||||||||||||||||||||||||||||||||||||||||
|
Основная статья: Изотопы бария
|
Ба́рий (химический символ — Ba, от лат. Barium) — химический элемент 2-й группы (по устаревшей классификации — главной подгруппы второй группы, IIA), шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 56.
Простое вещество барий — мягкий, вязкий, ковкий щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью.
История
Барий был открыт в виде оксида BaO в 1774 году Карлом Шееле и Юханом Ганом[3].
В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария; после испарения ртути при нагревании он выделил металлический барий.
Происхождение названия
Своё название получил от др.-греч. βαρύς — «тяжёлый».
Физические свойства
Полная электронная конфигурация атома бария: 1s22s22p63s23p64s23d104p65s24d105p66s2
Барий — серебристо-белый ковкий металл с плотностью 3,78 г/см3[2]. При резком ударе раскалывается. Примесь ртути (например, при получении амальгамным методом) делает его хрупким[4]. При нормальном давлении существуют две аллотропные модификации бария: до 375 °C устойчив α-Ba, кубической сингонии (объёмно-центрированная решётка), пространственная группа Im3m, параметры ячейки a = 0,501 нм[5], при более высоких температурах устойчив β-Ba[2]. Теплота перехода Ba-α ↔ Ba-β составляет 0,86 кДж/моль. При давлении 5530 МПа и 19 °C обнаружена гексагональная модификация[2].
Температура плавления 727 °C (1000 К), кипения 1637 °C (1910 К). Теплота плавления 7,12 кДж/моль. Теплота испарения 150,9 кДж/моль (при температуре кипения). Тройная точка: 710 °C, 1,185 Па. Критическая температура 2497 °C. Теплоёмкость при постоянном давлении 28,1 Дж/(моль·К). Энтропия S0
298 62,5 Дж/(моль·К). Температурный коэффициент линейного расширения (17…21)·10−6 К−1[2].
Твёрдость по шкале Мооса, по разным данным, 1,25[6], 1,5[7], 2[2] или 3[4]. Твёрдость по Бриннелю 42 МПа. Коэффициент сжимаемости 1,04·1012 Па−1[2].
Барий является парамагнетиком, его магнитная восприимчивость 1,5·108. Удельное электрическое сопротивление бария 6·10−8 Ом·м (при 0 °С). Температурный коэффициент сопротивления 3,6·10−3 К−1[2].
Соли бария окрашивают пламя газовой горелки в жёлто-зелёный цвет[4].
Химические свойства
Барий — щёлочноземельный химически активный металл, в соединениях проявляет степень окисления +2. На воздухе барий быстро окисляется, образуя на поверхности смесь оксида бария (BaO) и нитрида бария (Ba3N2) теряя при этом блеск и становясь сперва коричневато-жёлтым, а затем серым[4]. При незначительном нагревании на воздухе воспламеняется.
Энергично реагирует с водой, образуя гидроксид бария (Ba(ОН)2):
Активно взаимодействует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфат бария (BaSO4), сульфит бария (BaSO3), карбонат бария (BaCO3), фосфат бария (Ba3(PO4)2). Сульфид бария (BaS), в отличие от сульфида кальция (CaS), хорошо растворим в воде. Растворимые соли бария позволяют определить наличие в растворе серной кислоты и её растворимых солей по выпадению белого осадка сульфата бария, нерастворимого в воде и кислотах[8].
Кроме сульфида бария, растворимы в воде также цианид Ba(CN)2, тиоцианат Ba(SCN)2 и ацетат Ba(CH3COO)2[2].
Легко вступает в реакцию с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария (BaH2), который, в свою очередь, с гидридом лития LiH даёт комплекс Li[BaH3].
Реагирует при нагревании с аммиаком:
Нитрид бария Ba3N2 при нагревании взаимодействует с CO, образуя цианид:
С жидким аммиаком даёт тёмно-синий раствор, из которого можно выделить аммиакат [Ba(NH3)6], имеющий золотистый блеск и легко разлагающийся с отщеплением NH3. В присутствии платинового катализатора аммиакат разлагается с образованием амида бария:
Карбид бария (BaC2) может быть получен при нагревании в дуговой печи BaO с углём.
С фосфором образует фосфид (Ba3P2):
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Реагирует при комнатной температуре с углекислым газом, образуя карбид бария BaC2[4].
Получение
Основное сырьё для получения бария — баритовый концентрат (80—95 % BaSO4), который, в свою очередь, получают флотацией барита. Сульфат бария в дальнейшем восстанавливают коксом или природным газом:
Далее сульфид при нагревании гидролизуют до гидроксида бария (Ba(OH)2) или под действием CO2 превращают в нерастворимый карбонат бария (BaCO3), который затем переводят в оксид бария (BaO) (прокаливание при 800 °C для Ba(OH)2 и свыше 1000 °C для BaCO3):
Получают металлический барий электролизом безводного расплава хлорида бария:
Качественный и количественный анализ
Качественно в растворах барий обнаруживается по выпадению осадка сульфата бария (BaSO4), отличимого от соответствующих сульфатов кальция и сульфатов стронция крайне низкой растворимостью в неорганических кислотах.
Родизонат натрия выделяет из нейтральных солей бария характерный красно-бурый осадок. Реакция является очень чувствительной, специфичной, позволяя определить 1 часть ионов бария на 210000 массовых частей раствора[9].
Соединения бария окрашивают пламя в желто-зелёный цвет (длина волн 455 и 493 нм).
Количественно барий определяют гравиметрическим методом в виде BaSO4 или BaCrO4.
Применение
- Вакуумные электронные приборы
Металлический барий, часто в сплаве с алюминием используется в качестве газопоглотителя (геттера) в высоковакуумных электронных приборах, так как активно реагирует со многими газами.
Оксид бария, в составе твёрдого раствора оксидов других щёлочноземельных металлов — кальция и стронция (CaO, SrO), используется в качестве активного слоя катодов косвенного накала.
- Антикоррозионный материал
Барий добавляется совместно с цирконием в жидкометаллические теплоносители (сплавы натрия, калия, рубидия, лития, цезия) для уменьшения агрессивности последних к трубопроводам, и в металлургии.
- Сегнето- и пьезоэлектрик
Титанат бария используется в качестве диэлектрика при изготовлении керамических конденсаторов, а также в качестве материала для пьезоэлектрических микрофонов и пьезокерамических излучателей.
- Оптика
Фторид бария применяется в виде монокристаллов в оптике (линзы, призмы).
- Пиротехника
Пероксид бария используется для пиротехники и как окислитель.
Нитрат бария и хлорат бария используется в пиротехнике для окрашивания пламени (зелёный огонь).
- Атомно-водородная энергетика
Хромат бария применяется при получении водорода и кислорода термохимическим способом (цикл Ок-Ридж, США).
- Высокотемпературная сверхпроводимость
Пероксид бария совместно с оксидами меди и редкоземельных металлов, а также купрат бария[10], применяются для синтеза сверхпроводящей керамики, работающей при температуре жидкого азота и выше.
- Ядерная энергетика
Оксид бария применяется для варки специального сорта стекла — применяемого для покрытия урановых стержней. Один из широкораспространённых типов таких стёкол имеет следующий состав: оксид фосфора — 61 %, ВаО — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %.
В стекловарении для атомной промышленности применяется также и фосфат бария.
- Химические источники тока
Фторид бария используется в твердотельных фторионных аккумуляторных батареях в качестве компонента фторидного электролита.
Оксид бария используется в мощных медноокисных аккумуляторах в качестве компонента активной массы (окись бария-окись меди).
Сульфат бария применяется в качестве расширителя активной массы отрицательного электрода при производстве свинцово-кислотных аккумуляторов.
- Применение в медицине
Сульфат бария, нерастворимый и нетоксичный, применяется в качестве рентгеноконтрастного вещества при медицинском обследовании желудочно-кишечного тракта.
Нахождение в природе
Содержание бария в земной коре составляет 0,05 % по массе; в морской воде среднее содержание бария составляет 0,02 мг/л. Барий активен, он входит в подгруппу щёлочноземельных металлов и в минералах связан достаточно прочно. Основные минералы: барит (BaSO4) и витерит (BaCO3).
Редкие минералы бария: цельзиан или бариевый полевой шпат (алюмосиликат бария), гиалофан (смешанный алюмосиликат бария и калия), нитробарит (нитрат бария) и пр.
Типы месторождений
По минеральным ассоциациям баритовые руды делятся на мономинеральные и комплексные. Комплексные подразделяются на барито-сульфидные (содержат сульфиды свинца, цинка, иногда меди и железного колчедана, реже Sn, Ni, Au, Ag), барито-кальцитовые (содержат до 75 % кальцита), железо-баритовые (содержат магнетит, гематит, а в верхних зонах гётит и гидрогётит) и барито-флюоритовые (кроме барита и флюорита, обычно содержат кварц и кальцит, а в виде небольших примесей иногда присутствуют сульфиды цинка, свинца, меди и ртути).
С практической точки зрения наибольший интерес представляют гидротермальные жильные мономинеральные, барито-сульфидные и барито-флюоритовые месторождения. Промышленное значение имеют также некоторые метасоматические пластовые месторождения и элювиальные россыпи. Осадочные месторождения, представляющие собой типичные химические осадки водных бассейнов, встречаются редко и существенной роли не играют.
Как правило, баритовые руды содержат другие полезные компоненты (флюорит, галенит, сфалерит, медь, золото в промышленных концентрациях), поэтому они используются комплексно.
Изотопы
Известны изотопы бария с массовыми числами от 114 до 153, и 10 ядерных изомеров. Природный барий состоит из смеси шести стабильных изотопов (132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba) и одного изотопа с огромным периодом полураспада, много больше возраста Вселенной (130Ba).
Биологическая роль
Барий относится к токсичным микроэлементам. В человеческом организме ионы бария оказывают выраженное влияние на гладкие мышцы.
Суточная потребность организма человека в барии чётко не установлена; среднесуточное поступление бария в организм находится в пределах 0,3-1 миллиграммов[11].
Содержание бария в человеческом организме составляет 20—22 мг.
В микроколичествах барий находится во всех органах и тканях, но наивысшая концентрация данного микроэлемента приходится на головной мозг, селезёнку, мышцы, а также — на хрусталик глаза (барий находится во всех областях глаза). Около 90 % всего микроэлемента концентрируется в костях и зубах.
Токсичность
Барий и его некоторые соединения могут являться токсичными при превышении ПДК в пище и в воде. Предельно допустимая концентрация бария в питьевой воде составляет 0,7 мг/дм³ и в соответствии с российскими гигиеническими нормативами нормируется по санитарно-токсикологическому лимитирующему признаку вредности; класс опасности — 2 (вещества высокоопасные)[12].
Контакт металлического бария с кожей и слизистыми оболочками приводит к химическим ожогам[13]. Вследствие хорошей растворимости в воде из солей бария наиболее опасен хлорид[14], а также — опасны нитрит, гипохлорит, иодид, бромид, сульфид, хлорат, бромат и перманганат. При попадании на кожу в больших количествах могут вызвать химический ожог также оксид бария, пероксид бария, надпероксид бария и едкий барит.
Хорошо растворимые в воде соли бария быстро резорбируются в кишечнике. Смерть может наступить уже через несколько часов от паралича сердца.
Симптомы отравления растворимыми солями бария
Симптомы острого отравления растворимыми солями бария: слюнотечение, жжение во рту и пищеводе. Боли в желудке, колики, тошнота, рвота, понос, повышенное кровяное давление, твёрдый неправильный пульс, судороги, позже возможны и параличи, синюшность лица и конечностей (конечности холодные), обильный холодный пот, мышечная слабость, в особенности конечностей, доходящая до того, что отравленный не может пошевелить головой. Расстройство походки, а также речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, расстройство зрения.
В случае тяжёлого отравления смерть наступает внезапно или в течение одних суток. Тяжёлые отравления наступают при приёме внутрь 0,2—0,5 г растворимых солей бария, смертельная доза 0,8—0,9 г.
Помощь при отравлении
Для оказании первой помощи необходимо промыть желудок 1 % раствором сульфата натрия или магния. Клизмы из 10 % растворов тех же солей. Приём внутрь раствора тех же солей (20,0 частей соли на 150,0 частей воды) по столовой ложке каждые 5 мин. Рвотные средства для удаления из желудка образовавшегося нерастворимого сульфата бария. Внутривенно 10—20 мл 3 % раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло на ноги. Внутрь слизистые супы и молоко.
Хранение
Хранят металлический барий в керосине или под слоем парафина (в связи с его химической реактивностью)[2].
Цены
Цены на металлический барий в слитках чистотой 99,9 % колеблются около 30 долларов за 1 кг.
См. также
- Микроэлементы
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 Иофис Н. А., Иофис Б. Г. Барий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А — Дарзана. — С. 241—242. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Барий // Популярная библиотека химических элементов. — М.: Наука, 1977. Архивная копия от 11 августа 2011 на Wayback Machine
- ↑ 1 2 3 4 5 Рипан Р., Четяну И. Неорганическая химия. — М.: Мир, 1971. — Т. 1 : Химия металлов. — С. 239 сл.
- ↑ Wyckoff R. W. G. Crystal Structures (англ.). — 2nd Ed. — NY ; London ; Sydney: Interscience Publishers ; John Wiley & Sons, 1963. — V. 1: [Introduction, Structures of the elements, Structures of the compounds RX and RX2]. — P. 16. — VI+467 p. — ISBN 0898743877.
- ↑ Поваренных А. С. Твёрдость минералов. — АН УССР, 1963. — С. 197—208. — 304 с.
- ↑ Mechanical Properties of the Elements // Handbook of the Physicochemical Properties of the Elements / Samsonov G. V.. — IFI-Plenum, 1968. — P. 432. — ISBN 978-1-4684-6068-1. — doi:10.1007/978-1-4684-6066-7.
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Фрумина Н. С., Горюнова Н. Н., Еременко С. Н. . Аналитическая химия бария. — М.: Наука, 1977.
- ↑ Обогащенный дырками купрат бария оказался высокотемпературным сверхпроводником. Дата обращения: 26 мая 2019. Архивировано 26 мая 2019 года.
- ↑ name=https://www.pharmacognosy.com.ua_Барий (недоступная ссылка): маг для гладких мышц
- ↑ name=https://books.Google.ru_Методы концентрирования и разделения микроэлементов
- ↑ name =https://safework.ru_Barium (недоступная ссылка)
- ↑ name=https://safework.ru_Хлорид (недоступная ссылка) бария
Литература
- Барий // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
- Барий на Webelements
- Барий в Популярной библиотеке химических элементов
Эта страница в последний раз была отредактирована 8 декабря 2022 в 21:11.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Барий
Брутто-формула:
Ba
CAS# 7440-39-3
Названия
Формула:
Электронная конфигурация
|
Периодическая система химических элементов Д.И. Менделеева
Реакции, в которых участвует Барий
-
{M} + 2H2O -> {M}(OH)2 + H2″|^»
, где M =
Ca Sr Ba -
{M} + 2H{X} -> {M}{X}2 + H2″|^»
, где M =
Ca Mg Ba Sr Cd Zn; X =
Cl F Br I -
{M} + {Hal}2 = {M}{Hal}2
, где M =
Mg Ca Ba Sr Cd Zn; Hal =
F Cl Br I -
{M} + H2{X} -> {M}{X} + H2″|^»
, где M =
Mg Ca Ba Sr Zn Cd Fe; X =
SO4 -
Ba(N3)2 «220^oC»—> Ba + 3N2
Атом элемента и кристалл
К настоящему моменту науке известны бариевые изотопы, то есть разновидности атомов элемента, имеющие массовые числа от 114 до 153, а также ядерные изомеры в количестве 10 штук.
В форме простого вещества барий представляет собой металл светло-серебристого цвета. Показатели относительной молярной, атомной и молекулярной масс равные и составляют 137,33 г/моль. Для этого металла в чистом виде характерны:
- мягкость;
- ковкость;
- вязкость.
В радиусе атом этого элемента равен 222 пикометрам. Схематичное строение атома бария с электронными слоями:
Заряд элемента всегда совпадает с его порядковым номером в периодической таблице, то есть у бария он равен 56. Конфигурация электронов на внешнем слое атома — 6s во второй степени. Электронная формула бария (в обычном и графическом представлении):
Кристаллическая решетка бария в форме простого вещества имеет кубическую структуру объемноцентрированного типа. Ее параметр, то есть размер ячейки, составляет 5,02 ангстрема.
Название и история открытия
Свое название этот элемент таблицы Менделеева получил от древнегреческого слова, означавшего «тяжелый». Открытие нового химического элемента — бария — произошло в 1774 году. Этот металл в форме оксида с формулой BaO обнаружили шведские химики Юхан Ган и Карл Шееле. Однако дальше исследования ученых не продвинулись.
Металлический барий в чистом виде был выделен химиком-англичанином Гемфри Дэви в 1808 году, после проведения опыта по получению бариевой амальгамы. Сплав был получен Дэви путем электролиза ртутного катода и влажного едкого барита, то есть гидроксида бария. Затем британский химик нагреванием выпарил ртуть из полученного вещества, в результате чего был впервые в истории выделен чистый металлический барий.
Природное вещество и его местонахождение
Природный барий включает в себя семь изотопов. Их доли в составе вещества (в порядке убывания) и массовые числа:
- 71,66% — 138;
- 11,32% — 137;
- 7,81% — 136;
- 6,59% — 135;
- 2,42% — 134;
- 0,101% — 130;
- 0,097% — 132.
Изотоп с массовым числом 130 имеет огромный период полураспада, который во много раз превышает нынешний возраст Вселенной. Шесть других изотопов относятся к стабильному типу.
Что касается нахождения бария в природе, то в коре Земли он содержится в количестве 0,05% от общей массы этого слоя земного шара. В морской воде этот металл в среднем содержится в объеме 0,02 мг/л.
Природный барий из подгруппы щелочноземельных металлов активен. Его химические связи в составе минералов отличаются прочностью. Главными минералами, включающими в себя барий, считаются барит и витерит. К редким бариевым минералам относятся:
- гиалофан — бариево-калиевый алюмосиликат смешанного типа;
- цельзиан (также известен как бариевый полевой шпат) — бариевый алюмосиликат;
- нитробарит — бариевый нитрат.
Месторождения и их ценность
Природные месторождения бария называются баритовыми рудниками. Добываемые вещества, то есть баритовые руды, по минеральным ассоциациям подразделяются на две категории: комплексную и мономинеральную.
Руды комплексного типа, в свою очередь, делятся на следующие подвиды:
- барито-флюоритовый;
- барито-сульфидный;
- барито-кальцитовый;
- железо-баритовый.
Состав баритовых руд мономинерального типа не нуждается в дополнительном пояснении. Именно месторождения руд этой категории представляют наибольшую ценность (особенно гидротермальные жильные). Также с практической стороны интересны месторождения руд барито-флюоритового и барито-сульфидного типов.
Кроме того, для промышленности особое значение имеют россыпи элювиального типа, а также пластовые месторождения метасоматического типа. Что касается редко встречающихся осадочных месторождений, образованных химическими осадками водоемов, то их ценность минимальна.
Баритовые руды, относящиеся к комплексной категории, содержат множество других полезных и ценных компонентов:
- флюорит;
- золото;
- серебро;
- галенит (источник свинца);
- медь;
- сфалерит (источник цинка);
- железо;
- олово;
- никель;
- кальцит;
- кварц и так далее.
Дополнительные компоненты содержатся в баритовых рудах в промышленной концентрации. По этой причине комплексные руды имеют многоцелевое значение и применяются в самых разных областях и сферах.
Процесс получения
В качестве основного сырья в процессе получения бария используется так называемый баритовый концентрат — это 80-95-процентный бариевый сульфат (то же, что и сернокислый барий). Концентрированное вещество производится путем флотации (обогащения) барита — минерала, известного как тяжелый шпат.
Для последующего восстановления бариевого сульфата в производственном процессе используется либо каменноугольный кокс, либо природный газ. Затем сульфид нагревают для гидролиза до образования едкого барита — бариевого гидроксида. Альтернативный вариант (вместо нагревания и гидролиза) — превращение сульфида в бариевый карбонат нерастворимого типа посредством воздействия углекислым газом.
Следующее действие — перевод полученного вещества в бариевый оксид BaO. Для этого вещество прокаливают. Для прокаливания карбоната необходима температура свыше 1000 градусов Цельсия, а для гидроксида достаточно 800 градусов Цельсия.
Последний этап в процессе получения металлического бария — это электролиз расплава бариевого хлорида безводного типа. Вещество распадается на компоненты — барий и хлор отделяются друг от друга. Химическое уравнение, отражающее этот этап, максимально простое: BaCl2 = Ba + Cl2.
Барий обладает второй степенью окисления со знаком плюс. Валентность элемента совпадает с номером группы размещения в таблице Менделеева, то есть равна двум. Ковалентный радиус атома — 198 пикометров, а ионный — 134 пикометра.
По шкале Полинга показатель электроотрицательности бария составляет 0,89. Электродный потенциал элемента равняется -2,906. Энергия ионизации первого электрона достигает 502,5 кДж/моль, что равнозначно 5,21 электронвольта.
Согласно химическим свойствам бария, этот щелочноземельный металл:
- быстро окисляется на воздухе (в результате этого взаимодействия образуется смесь бариевых соединений — оксида и нитрида);
- воспламеняется даже при слабом нагревании;
- с водой реагирует энергично (результатом этой реакции служит образование бариевого гидроксида);
- с галогенами легко вступает в реакцию (образуются галогениды);
- с кислотами разбавленного типа взаимодействует активно.
Многие бариевые соли мало растворяются в воде или не растворяются полностью. К таким солям относятся:
- фосфат;
- сульфит;
- сульфат;
- карбонат.
Сульфид же, напротив, отлично растворяется в воде. Бариевые соли растворимого типа помогают установить содержание в растворе серной кислоты, а также ее растворимых солей. При их наличии в растворе выпадает осадок белого цвета — это бариевый сульфат, который не растворяется ни в кислотах, ни в воде.
Барий способен восстановить до соответствующего металла многие из таких соединений:
- галогениды;
- оксиды;
- сульфиды.
При совместном нагревании бария и водорода образуется бариевый гидрид. Кроме того, барий при нагревании вступает в реакцию с аммиаком. Бариевые соединения при попадании в пламя окрашивают его в насыщенный желто-зеленый цвет.
Термодинамические и физические свойства бария в форме простого вещества:
- молярный объем — 39 кубических сантиметров на моль;
- молярная теплоемкость — 28,1 джоуля на кельвин-моль;
- удельная теплота плавления — 7,66 килоджоуля на моль;
- удельная теплота испарения — 142 килоджоуля на моль.
В нормальных условиях плотность этого металла составляет 3,5 грамма на кубический сантиметр. Плавится он при температуре 1002 кельвина, а кипит при температуре 1910 кельвинов. Теплопроводность металла составляет 300 кельвинов или 18,4 ватта на метр-кельвин.
Такая физическая характеристика, как ковкость, не мешает барию раскалываться при резком ударе. По шкале Мооса твердость этого металла равна 1,25. Для хранения бария требуется определенная среда. Ее обеспечивает керосин или слой парафина, которым покрывают металл.
Области использования
Этот металл используется в самых разных отраслях. В электровакуумных приборах он играет роль геттера или, проще говоря, газопоглотителя. В металлургической отрасли и в производстве теплоносителей он используется в качестве антикоррозийного материала.
Помимо этого, барию найдено применение в следующих сферах:
- оптической;
- пиротехнической;
- медицинской и других.
Разумеется, это далеко не все области применения.
Воздействие на человека
Несмотря на активное использование бария в самых разных сферах, его биологическая роль пока мало изучена. К жизненно важным микроэлементам он не относится. Напротив, его воздействие на человеческий организм может быть смертельным.
В медицине применяется исключительно бариевый сульфат — это соединение нетоксично и нерастворимо. Что касается бариевых соединений, которые растворяются в воде, то их главная особенность — высокая токсичность. Абсолютно все они ядовиты и губительны для человеческого организма.
В зависимости от степени отравления бариевыми соединениями, человек может умереть всего за несколько часов (максимальный срок наступления летального исхода при сильном отравлении — сутки), поэтому крайне важно соблюдать максимальную осторожность при контакте с такими веществами и использовать их только по прямому назначению.
Физические свойства
Барий Ba — щелочноземельный металл. Серебристо-белый, ковкий, пластичный. На воздухе покрывается темной оксидно-нитридной пленкой. Реакционноспособный. Сильный восстановитель;
Относительная молекулярная масса Mr = 137,327; относительная плотность для твердого и жидкого состояния d = 3,6; tпл = 727º C; tкип = 1860º C.
Способ получения
1. В результате взаимодействия оксида бария и кремния при 1200º С образуются силикат бария и барий:
3BaO + Si = BaSiO3 + 2Ba
2. Оксид бария взаимодействует с алюминием при 1100 — 1200º С образуя барий и алюминат бария:
4BaO + 2Al = 3Ba + Ba(AlO2)2
3. В результате разложения гидрида бария при температуре выше 675º С образуется барий и водород:
BaH2 = Ba + H2
Качественная реакция
Барий окрашивает пламя газовой горелки в желто — зеленый цвет.
Химические свойства
1. Барий вступает в реакцию с простыми веществами:
1.1. Барий взаимодействует с азотом при 200 — 460º С образуя нитрид бария:
3Ba + N2 = Ba3N2
1.2. Барий сгорает в кислороде (воздухе), на выходе будет образовываться оксид бария:
2Ba + O2 = 2BaO
1.3. Барий реагирует с хлором, бромом, йодом и фтором. При этом образуются соответствующие соли:
Ba + Br2 = BaBr2
Ba + Cl2 = BaCl2
Ba + I2 = BaI2
Ba + F2 = BaF2
1.4. С водородом барий реагирует при температуре 150 — 300º C с образованием гидрида бария:
Ba + H2 = BaH2
1.6. Барий взаимодействует с серой при 150º С и образует сульфид бария:
Ba + S = BaS
1.7. Барий взаимодействует с углеродом (графитом) при 500º С и образует карбид бария:
Ba + 2C = BaC2
2. Барий взаимодействует со сложными веществами:
2.1. Барий при комнатной температуре реагирует с водой. Взаимодействие бария с водой приводит к образованию гидроксида бария и газа водорода:
Ba + 2H2O = Ba(OH)2↓ + H2↑,
2.2. Барий взаимодействует с кислотами:
2.2.1. Барий реагирует с разбавленной соляной кислотой, при этом образуются хлорид бария и водород:
Ba + 2HCl = BaCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой барий образует нитрат бария, оксид азота (I) и воду:
4Ba + 10HNO3= 4Ba(NO3)2 + N2O↑ + 5H2O,
если азотную кислоту еще больше разбавить, то образуются нитрат бария, нитрат аммония и вода:
4Ba + 10HNO3 = 4Ba(NO3)2 + NH4NO3 + 3H2O
2.2.3. Барий вступает во взаимодействие с сероводородной кислотой при температуре выше 350 с образованием сульфида бария и водорода:
Ba + H2S = BaS + H2
2.3. Барий вступает в реакцию с газом аммиаком при 600 — 650º С. В результате данной реакции образуется нитрид бария и гидрид бария:
6Ba + 2NH3 = Ba3N2 + 3BaH2,
если аммиак будет жидким, то в результате реакции в присутствии катализатора платины образуется амид бария и водород:
Ba + 2NH3 = Ba(NH2)2↓ + H2↑
2.4. Барий взаимодействует с оксидами:
Барий реагирует с углекислым газом при комнатной температуре с образованием карбоната бария и углерода:
2Ba + 3CO2 = 2BaCO3 + C













![mathsf{[Ba(NH_3)_6] rightarrow Ba(NH_2)_2 + 4NH_3 + H_2}](https://dic.academic.ru/dic.nsf/ruwiki/d537a896ed9dcb62c864ab22de8e3530.png)



![{displaystyle {mathsf {BaH_{2}+LiHrightarrow Li[BaH_{3}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/08e4eb350de2ee360cf7d1b0cd5521046f75acb0)


![{mathsf {[Ba(NH_{3})_{6}]rightarrow Ba(NH_{2})_{2}+4NH_{3}+H_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7898645660d2f5680f116ccd25112a4a0ae444eb)