Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Хлорид натрия
Брутто-формула:
ClNa
Названия
Русский:
- Хлорид натрия(IUPAC)
- галит
- каменная соль
- натрия хлорид
- обычная соль
- пищевая соль
- поваренная соль
- столовая соль
English:
- Common salt
- Halite
- Rock salt
- Saline
- Sodium chloric
- Sodium chloride(IUPAC)
- Table salt
Варианты формулы:
Реакции, в которых участвует Хлорид натрия
-
2{M} + {Hal}2 = 2{M}{Hal}
, где M =
Li Na K Rb Cs; Hal =
F Cl Br I -
2NaCl + 2H2O «e-«-> 2NaOH + Cl2″|^» + H2″|^»
-
ZnCl2 + 4NaOH «90^oC»—> Na2[Zn(OH)4] + 2NaCl
-
Na2[Zn(OH)4] + 2HCl -> 2NaCl + Zn(OH)2″|v» + 2H2O
-
Na2[Zn(OH)4] + 4HCl -> 2NaCl + ZnCl2 + 4H2O
-
Вы здесь:
- Главная
- Продукция
- Реактивы
- Натрий хлористый
Поиск
Каталог
Натрий хлористый
ГОСТ 4233-77
NaCl
Хлорид натрия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
| Общие | |
|---|---|
| Систематическое наименование |
Хлорид натрия |
| Традиционные названия |
Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит |
| Хим. формула |
NaCl |
| Физические свойства | |
| Молярная масса |
58,44277 г/моль |
| Плотность |
2,165 г/см³ |
| Термические свойства | |
| Т. плав. |
800,8 °C |
| Т. кип. |
1465 °C |
| Мол. теплоёмк. |
50,8 Дж/(моль·К) |
| Энтальпия образования |
-234,8 кДж/моль |
| Удельная теплота испарения |
170,85 кДж/моль |
| Удельная теплота плавления |
28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
35,6 г/100 мл (0 °C) |
| Растворимость в метаноле |
1,49 г/100 мл |
| Растворимость в аммиаке |
21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления |
1,544202 (589 нм) |
Фтористый натрий получил широкое применение в производстве зубной пасты, помогая бороться с кариесом. Большая часть современных моющих средств также содержит NaF, благодаря чему обрабатываемые поверхности не просто блестят, но еще и великолепным образом дезинфицируются. Фторид натрия получил широкое применение в процессе обработки древесины, играя роль антисептика, эффективно борющегося с плесенью, грибками, насекомыми.
Содержание
- Структурная формула
- Русское название
- Английское название
- Латинское название вещества Натрия хлорид
- Брутто формула
- Фармакологическая группа вещества Натрия хлорид
- Нозологическая классификация
- Код CAS
- Фармакологическое действие
- Характеристика
- Фармакология
- Применение вещества Натрия хлорид
- Противопоказания
- Ограничения к применению
- Побочные действия вещества Натрия хлорид
- Передозировка
- Способ применения и дозы
- Торговые названия с действующим веществом Натрия хлорид
Структурная формула
Русское название
Натрия хлорид
Английское название
Sodium chloride
Латинское название вещества Натрия хлорид
Natrii chloridum (род. Natrii chloridi)
Фармакологическая группа вещества Натрия хлорид
Нозологическая классификация
Список кодов МКБ-10
- K92.2 Желудочно-кишечное кровотечение неуточненное
- K52.1 Токсический гастроэнтерит и колит
- T79.3 Посттравматическая раневая инфекция, не классифицированная в других рубриках
- K30 Диспепсия
- E87.1 Гипоосмолярность и гипонатриемия
- E86 Уменьшение объема жидкости [гиповолемия]
- T30 Термические и химические ожоги неуточненной локализации
- R58 Кровотечение, не классифицированное в других рубриках
- T57.8 Других уточненных неорганических веществ
- A00.9 Холера неуточненная
- K56.6 Другая и неуточненная кишечная непроходимость
- R11 Тошнота и рвота
- Z100* КЛАСС XXII Хирургическая практика
Фармакологическое действие
—
гидратирующее, дезинтоксикационное, нормализующее КЩС, плазмозамещающее.
Характеристика
Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Легко растворим в воде (1:3), мало растворим в этаноле.
Фармакология
Натрия хлорид поддерживает соответствующее осмотическое давление плазмы крови и внеклеточной жидкости. При снижении концентрации натрия хлорида в плазме крови вода переходит из сосудистого русла в межтканевую жидкость, при значительном дефиците возникают спазмы гладких мышц и судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем.
Раствор натрия хлорида 0,9% изотоничен плазме крови человека и поэтому быстро выводится из сосудистого русла, лишь временно увеличивая объем циркулирующей жидкости. Гипертонические растворы (3–5–10%) применяются в/в и наружно. При наружной аппликации они способствуют выделению гноя, проявляют противомикробную активность, при в/в введении — усиливают диурез и восполняют дефицит ионов натрия и хлора.
Применение вещества Натрия хлорид
Раствор 0,9% — большие потери внеклеточной жидкости (в т.ч. токсическая диспепсия, холера, диарея, неукротимая рвота, обширные ожоги с сильной экссудацией), гипохлоремия и гипонатриемия с обезвоживанием, кишечная непроходимость, в качестве дезинтоксикационного средства; промывание ран, глаз, полости носа, для растворения и разведения различных лекарственных веществ и увлажнения перевязочного материала.
Гипертонический раствор — легочное, желудочное и кишечное кровотечение, в качестве вспомогательного осмотического диуретика при проведении форсированного диуреза, обезвоживание, отравление нитратом серебра, для обработки гнойных ран (местно), запор (ректально).
Противопоказания
Гипернатриемия, ацидоз, гиперхлоремия, гипокалиемия, внеклеточная гипергидратация; циркуляторные нарушения, угрожающие отеком мозга и легких; отек мозга, отек легких, острая левожелудочковая недостаточность, сопутствующая терапия ГК в больших дозах.
Ограничения к применению
Нарушение функции почек, сердечная недостаточность, артериальная гипертензия, периферические отеки, токсикоз беременных (для больших объемов изотонического раствора).
Побочные действия вещества Натрия хлорид
Ацидоз, гипергидратация, гипокалиемия.
Передозировка
Случаи передозировки не описаны.
Способ применения и дозы
Изотонический раствор — в/в, п/к, в клизмах, местно. Перед введением раствор нагревают до 36–38 °C. Доза определяется в зависимости от потери организмом жидкости, в среднем составляет 1 л/сут; при дегидратации и интоксикациях — до 3 л/сут. Скорость введения — 540 мл/ч; при необходимости — больше. 0,9% раствор натрия хлорида применяют для промывания ран, глаз, слизистой оболочки полости носа, увлажнения перевязочного материала.
Гипертонические растворы: 10% раствор — в/в (до 20 мл); 2–5% раствор — для промывания желудка; 5% раствор — в клизмах (100 мл) для стимуляции дефекации при запорах (либо до 3 л/сут 0,9% раствора); местно — для обработки гнойных ран.
Торговые названия с действующим веществом Натрия хлорид
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Аква-Риносоль |
от 63.00 до 63.00 |
| АкваМастер® |
от 186.00 до 327.00 |
| ЛинАква беби Средство для промывания и орошения полости носа для детей и взрослых |
от 209.00 до 418.00 |
| ЛинАква норм Средство для промывания и орошения полости носа для детей и взрослых |
от 418.00 до 418.00 |
| ЛинАква софт Средство для промывания и орошения полости носа для детей и взрослых |
от 451.00 до 451.00 |
| ЛинАква форте Средство для промывания и орошения полости носа для детей и взрослых |
от 398.00 до 418.00 |
| ЛинАква форте Средство для промывания и орошения полости рта и горла для детей и взрослых |
от 434.00 до 456.00 |
| Натрия хлорид |
от 43.10 до 509.00 |
| Натрия хлорид Браун |
от 495.40 до 605.00 |
| Натрия хлорид буфус |
от 71.80 до 144.00 |
| Натрия хлорид-СОЛОфарм |
от 57.00 до 1445.00 |
Физические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пероксид натрия образует хлорид натрия и пероксид водорода:
Na2O2 + 2HCl = 2NaCl + H2O2
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия. Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра, хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами:
2.1. Хлорид натрия взаимодействует с кислотами:
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
2NaCl + H2SO4 = Na2SO4 + HCl↑,
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
NaCl + H2SO4 = NaHSO4 + HCl↑
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями:
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия. Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
10NaCl + 8H2SO4 + 2KMnO4 = 5Cl2↑ + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C. При этом образуются сульфат натрия и хлороводородная кислота:
NaCl + NaHSO4 = Na2SO4 + HCl
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Натрий хлорид
Оглавление раздела
Оптовые поставки • Свойства вещества • Транспортировка • Получение • Применение • Безопасность • Производитель • Заказать

Торговое наименование фармацевтической субстанции Натрия хлорид
Международное непатентованное, группировочное или химическое наименование Натрия хлорид
Физическое состояние Субстанция-порошок
Внешний вид Белый кристаллический порошок или крупинки или бесцветные кристаллы
Оптовые поставки хлорида натрия
Наш завод по производству химических реагентов, производит хлорид натрия в любых объемах. Так же Вы можете заказать его доставку, в каком бы городе России Вы ни находились, товар дойдет в полной сохранности, т.к. мы используем только тару по ГОСТу.
Сделав заказ натрия хлорида партии любого объема, Вы получите продукт вовремя и должного качества, с отгрузкой прямо с нашего завода без посреднических наценок и других издержек. Чистое вещество напрямую от российского производителя.
Свойства хлорида натрия
Хлорид натрия с обозначением химической формулы как NaCl — представляет из себя натриевую соль соляной кислоты. Этот химический элемент называют еще как поваренная соль, или как обычная соль, которую используют широко в кулинарии и которая знакома каждой домохозяйке. Хлорид натрия в большом количестве содержится в морской воде, из которой ее активно добывают. А уже чистый хлорид натрия имеет вид бесцветных кристаллов.

Кристаллы хлорида натрия под микроскопом
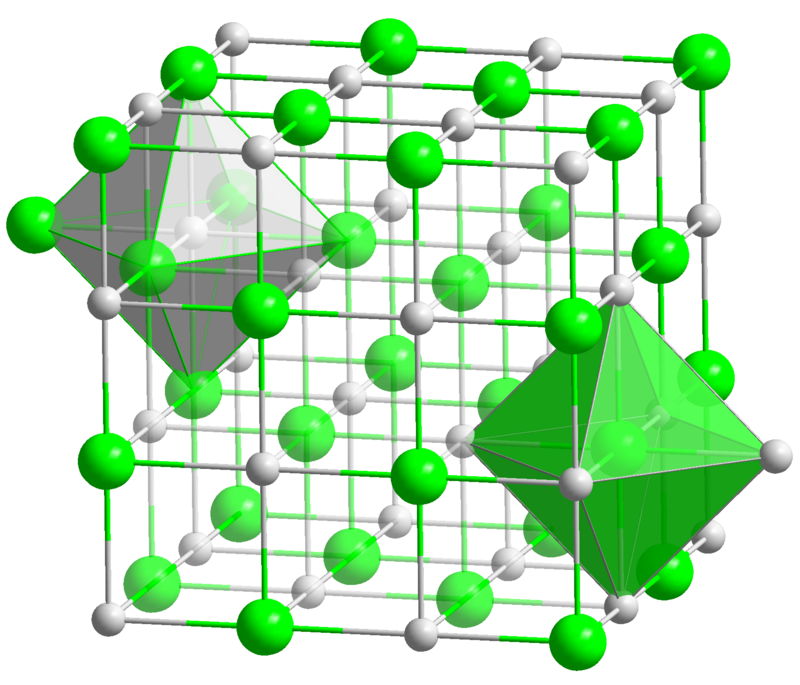
Схема строения молекул вещества
Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты
| Показатели качества | |
| Наименование показателя | Требования ФСП |
| 1. Описание | Белый кристаллический порошок или крупинки, или бесцветные кристаллы |
| 2. Растворимость | Легко растворим в воде, мало растворим в спирте 96% |
| 3. Подлинность | Дает характерные реакции на натрий и хлориды |
| 4. Прозрачность раствора | Должен быть прозрачным |
| 5. Цветность раствора | Должен быть бесцветным |
| 6. Кислотность или щелочность | Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты |
| Щелочноземельные металлы и магний | Не более 0,01% в пересчете на кальций |
| 8. Барий | Мутность раствора субстанции не должна превышать мутность эталонного раствора |
| 9. Железо, %, не более | 0,0003 |
| 10. Тяжелые металлы, %, не более | 0,0005 |
| 11. Сульфаты, %, не более | 0,005 |
| 12. Калий, %, не более | 0,05 |
| 13. Соли аммония, %, не более | 0,004 |
| 14. Потеря в массе при высушивании, %, не более | 0,5 |
| 15. Мышьяк, %, не более | 0,00005 |
| 16. Фосфаты, %, не более | 0,0025 |
| 17. Бромиды, %, не более | 0,005 |
| 18. Иодиды | Раствор не должен окрашиваться в голубой цвет |
| 19. Ферроцианиды | Раствор не должен окрашиваться в голубой цвет |
| 20. Микробиологическая чистота | Категория 1.2.Б |
| 21. Количественное определение (NaCl), %, в пределах | Не менее 99,5% NaCl в пересчете на сухое вещество |
| 22. Бактериальные эндотоксины, предельное содержание не более | Не более 5 ЕЭ на 1 г субстанции |
| Упаковка | По 1 кг, 3 кг, 5 кг в полипропиленовые пакет из полиэтиленовой пленки, который термосваривают двумя швами, снабжая внутренней этикеткой. Пакеты укладывают в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом и прошивают вместе с этикеткой. По 25 кг – в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом Полиэтиленовый пакет термосваривают, полипропиленовый мешок прошивают. Каждая упаковка снабжена этикеткой. Этикетка из этикеточной бумаги, писчей, офсетной. |
| Маркировка | В соответствии с нормативной документацией |
| Хранение | В сухом месте при температуре не выше 250С |
| Срок годности | 5 лет |
Не более 5 ЕЭ на 1 г субстанции
| Общие свойства | |
|---|---|
| Систематическое наименование |
Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит |
| Хим. формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| Растворимость в метаноле | 1,49 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,544202 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 FAPWRFPIFSIZLT-UHFFFAOYSA-M |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |
Транспортировка
Наш завод предоставляет гарантию на хранение вещества при должном соответствии требований, предъявляемые при правильной транспортировке и хранении.
Так как хлорид натрия требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Вообще, разработаны ГОСТы по его упаковке, и мы конечно, стараемся их соблюдать. Поэтому на нашем химическом заводе готовое вещество упаковываются в прочные полиэтиленовые мешки, которые в свою очередь завязываются двойным узлом нитью (или запаиваются). После этого возможна дополнительная упаковка в в фанерные коробы или в картонные. Или, на выбор покупателя, так же возможна упаковка этого вещества в бумажные пяти-шести-слойные мешки.
Получение
Хлорид натрия добывается из естественных природных источников, обычно к ним относятся залежи галита, осадочной горной породы в виде каменной соли ну и конечно же он содержится в огромном количестве в морской воде, из которой ее просто выделяют методом выпаривания
Применение
Для приготовления стерильных (инъекционных) лекарственных форм
В фармацевтике изотонический раствор хлорида натрия применяется как средство для дезинтоксикации, а так же в качестве растворителя каких либо других лекарственных средств. А так же при многих других ситуациях — как гипертонический раствор, вспомогательный осмотический диуретик, так же используется для поднятия давления при кровотечениях, при отравлении нитратом серебра, а так же для обработки гнойных ран и при отечностях в качестве наружного средства.
Как видно из описания, данный химический элемент довольно распространен в медицинской области. Но он так же активно применяется чуть ли не повсеместно и в промышленности и быту.
Применение

А так же имеем собственный автотранспорт, специально приспособленный для перевозки химических веществ на дальние расстояния.
При заключении долговременного на поставки продукции с нашего химического предприятия, для Вас начинают действовать особые цены, которые помогут сделать общение с нами еще более выгодным.
Хлорид калия оптом доступен для отгрузки с нашего склада, в любых количествах, в различных фасовках по самым выгодным ценам от Российского производителя. Предоставляем готовые ТУ, а также разрабатываем новые — под ваши конкретные запросы.
Безопасность
Изза того что вещество само по себе практически безопасно для человека, само собой в умеренных количествах, особые меры предосторожности не обязательны.
В помещениях где активно ведется работа с хлорид натрием, у рабочих должны быть маски (респираторы) и защитные очки. При попадании вещества в глаза, обильно промыть водой. При вдыхании большого количества пыли, выйти на свежий воздух, продышаться.
Среди экологических меры предосторожности есть рекомендации держать вещество подальше от канализации, поверхностных и грунтовых вод.
Производитель натрий хлорида

МЗХР обладает всем необходимым, что бы выполнить любой заказ точно по техническим условиям заказчика и, что не маловажно, в нужный временной интервал.
Вот какие преимущества позволяют нам этого добиться:
- собственный ж/д тупик, благодаря которому возможно отправить продукцию в любую точку Европы или Азии, а так же ближнего востока;
- контроль качества производства, имеется собственная лаборатория;
- Надежное и проверенное оборудование, которое позволяет произвести большие объемы за короткое время;
- наличие больших запасов сырья;
- собственные склады;
- свой автотранспорт.
Михайловский завод химических реагентов — российский прямой поставщик натрий хлорида на рынки Росии и СНГ, а так же некоторых зарубежных государств. Географически расположенный приблизительно в центре России — в Алтайском крае, дает нам преимущество по отправке продукции как на запад, так и на восточные направления.
Поэтому, если Вы искали производителя натрий хлорида именно в России, то стоит узнать все условия по работе с нами, возможно наш завод будет полностью удовлетворять Ваши потребности в этом веществе долгие годы.
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
натрия хлорид
Синонимы:
галит
каменная соль
поваренная соль
Внешний вид:
бесцветн. кубические кристаллы
Брутто-формула (система Хилла): ClNa
Формула в виде текста: NaCl
Молекулярная масса (в а.е.м.): 58,44
Температура плавления (в °C): 801
Температура кипения (в °C): 1455
Растворимость (в г/100 г или характеристика):
2-этилгексанол: 0,0001 (20°C)
аммиак жидкий: 4,2 (-30°C)
аммиак жидкий: 12,9 (0°C)
ацетон: не растворим 0,000032 (18°C)
бензиловый спирт: 0,017 (20°C)
вода: 35,7 (0°C)
вода: 35,9 (20°C)
вода: 36,4 (40°C)
вода: 37,2 (60°C)
вода: 38,1 (80°C)
вода: 39,4 (100°C)
глицерин: 8,2 (25°C)
диоксид серы: 0,016 (0°C)
диэтиловый эфир: не растворим
изобутанол: 0,0005 (20°C)
изопентанол: 0,0016 (20°C)
метанол: 1,31 (25°C)
н-бутанол: 0,005 (20°C)
н-гексанол: 0,001 (20°C)
н-пентанол: 0,002 (20°C)
перекись водорода: 17,6 (-14,5°C)
перекись водорода: 18,4 (-10°C)
перекись водорода: 20,5 (0°C)
этанол: 0,065 (25°C)
Вкус, запах, гигроскопичность:
вкус: соленый
запах: без запаха
Природные и антропогенные источники:
76% сухого остатка от выпаривания морской воды составляет хлорид натрия.
Плотность:
2,165 (20°C, г/см3)
Давление паров (в мм.рт.ст.):
0,1 (752°C)
1 (863°C)
10 (1014°C)
100 (1216°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
1,38 (817°C)
1,12 (867°C)
0,95 (917°C)
0,82 (967°C)
Поверхностное натяжение (в мН/м):
114 (803°C)
110 (850°C)
107 (900°C)
102 (970°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-411,1 (т)
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-384 (т)
Стандартная энтропия образования S (298 К, Дж/моль·K):
72,12 (т)
Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
49,71 (т)
Энтальпия плавления ΔHпл (кДж/моль):
28,5
Энтальпия кипения ΔHкип (кДж/моль):
171
Аналитические свойства катиона:
на ион натрия: с водным раствором гексагидроксостибата (V) калия образуется белый кристаллический осадок
Аналитические свойства аниона:
на хлорид-ион: с азотнокислым водным раствором нитрата серебра образуется белый, творожистый осадок хлорида серебра
Применение:
Как пищевой антисептик, для засолки грибов, рыбы, капусты и т.д. Необходимый для жизни пищевой продукт.
История:
Древние приписывали соли священные свойства, связывали ее с добрыми духами. В ряде стран сохранился обычай ставить перед гостями или подавать соль как символ дружбы и гостеприимства. Просыпать соль считалась навлечь гнев богов.
В Эфиопии еще в XIX в. были в ходу соляные деньги — стандартные бруски каменной соли. В Китае изготавливались соляные монеты, на которые ставилось клеймо богдыхана. Солью вместо денег платили жалование римским воинам и крестоносцам.
Дополнительная информация:
Твердость по Моосу 2-2,5, кристаллы хрупкие. При нагревании хлорида натрия с небольшим количеством металлического натрия без доступа воздуха образуется соль сине-фиолетового цвета (за счет встраивания атомов натрия в полости кристаллов).
Под действием перегретого водяного пара при 500 С и давлении 10 атмосфер подвергается гидролизу и получающийся хлороводород может быть выведен из сферы реакции с прохождением гидролиза практически до конца.
- «Справочник химика» т.3, Л.-М.: Химия, 1965 стр. 289-302
- «Справочник химика» т.5, Л.-М.: Химия, 1966 стр. 94-95
- Беликов В.Г. «Учебное пособие по фармацевтической химии» М.: Медицина, 1979 стр. 18
- Девяткин В.В., Ляхова Ю.М. «Химия для любознательных, или о чем не узнаешь на уроке» Ярославль:Академия Холдинг, 2000 стр. 30, 65-70, 76
- Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. «Натрий» М.:Наука, 1986 стр. 239
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 86
Источники информации:
Алф. указатель:
1-9
A-Z
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Щ
Э
Я
Еще по теме:
- НАТРИЯ ХЛОРИД — химическая энциклопедия
- Натрия хлорид — лекарственные препараты
<amp/>
|
Хлорид натрия |
|
|---|---|
| Названия: | натрия хлорид натрий хлористый натрий солянокислый соль поваренная соль столовая соль пищевая соль каменная соль морская соль пищевая добавка Е508 PubChem: 5234 |
| Формула: | NaCl |
| SMILES: | [Cl-].[Na+] |
| Молярная масса: | 58,443 г/моль |
| Плотность: | 2,165 г/см3 |
| Сингония: | кубическая (безводный) a=5,6404 Å, b=5,6404 Å, c=5,6404 Åα=90°, β=90°, γ=90° моноклинная (дигидрат) α=90°, γ=90° |
| Формы: |
https://media.crystalls.info/w/uploads/media/Cube.json
Куб
https://media.crystalls.info/w/uploads/media/Tetragonal_prism.json
Четырехугольная призма
https://media.crystalls.info/w/uploads/media/Tetragonal_flat_prism.json
Четырехугольная плоская призма
https://media.crystalls.info/w/uploads/media/Tetragonal_pedion.json
Четырехугольный моноэдр
https://media.crystalls.info/w/uploads/media/Octahedron.json
Октаэдр
https://media.crystalls.info/w/uploads/media/Tetragonal_pyramid.json
Четырехугольная пирамида
https://media.crystalls.info/w/uploads/media/Rhombic_pedion.json
Ромбический моноэдр
https://media.crystalls.info/w/uploads/media/Beveled_rhombic_prism.json
Скошенная ромбическая призма |
| Цвет: | бесцветный белый серый |
| Температура плавления: | 800,7 °C1073,85 K <br />1473,26 °F <br />1932,93 °R <br /> |
| Температура кипения: | 1465 °C1738,15 K <br />2669 °F <br />3128,67 °R <br /> |
| Температура разложения: | 0,15 °C273,3 K <br />32,27 °F <br />491,94 °R <br /> (дигидрат) |
| Показатель преломления: | 1,5442 |
| Магнитные свойства: | диамагнетик χ=-3,03 · 10-5см³/моль |
| Устойчивость: | стабилен |
| Прочность: | прочен (2,5 по Моосу) |
| Токсичность: | не токсичен ЛД50=3000мг/кг |
Описание
Нахождение в природе
Встречается в природе как минералы галит и гидрогалит.
Где приобрести
Можно приобрести в продуктовом магазине (как «поваренная соль», смесь с небольшим содержанием хлоридов калия и магния).
Методы получения
Взаимодействие гидроксида, гидрокарбоната или карбоната натрия и соляной кислоты
Уравнение реакции:
Для получения 100,00 грамм хлорида натрия требуется 68,44 грамм гидроксида или 143,74 грамм гидрокарбоната или 90,68 грамм карбоната и 164,18 грамм 38% соляной кислоты.
В емкость с кислотой небольшими порциями добавляют соответствующее соединение натрия и перемешивают до его полного растворения, а в случае с карбонатом — до прекращения выделения углекислого газа. После завершения реакции раствор фильтруют и используют для выращивания кристаллов.
Влияние температуры
При повышении температуры раствора до 40°C и выше вырастают исключительно поликристаллы либо корка на стенках сосуда. Ниже, в основном, происходит так называемый «скелетный» рост — на гранях монокристалла начинается рост других крупных монокристаллов, образуя подобие «каркаса».
При отрицательных температурах из раствора кристаллизуются кристаллы дигидрата.
Влияние примесей
Добавление значительных количеств хлоридов других металлов положительно влияет на размер и форму кристаллов. Например, добавка хлорида железа(II) приводит к росту более крупных кристаллов с незначительными желто-коричневыми вкраплениями внутри кристалла. Аналогично действует добавка хлорида меди(II), придавая кристаллам неравномерную зеленую окраску. Примесь больше 40% хлорида калия приводит к росту более крупных кристаллов, а при больших процентах — росту преимущественно монокристаллов.
Также на форму кристаллов оказывает добавление красителей или некоторых органических веществ — например, при добавлении мочевины форма меняется на кубооктаэдр, октаэдр или их производные, зачастую искаженные.
Влияние оказывает и состав растворителя. При росте из смеси воды и этанола могут образовываться пирамиды, а при росте из нашатырного спирта форма меняется на снежинкоподобную.
Условия хранения
Хранить в исходном виде или под несколькими слоями лака, при средней влажности воздуха и комнатной температуре. Не хранить в спичечных коробках или вате и не нагревать.
Растворимость
ТаблицаГрафик
| Температура | гр/100,00 гр воды |
гр/100,00 гр этанола |
гр/100,00 гр этанола 40% |
гр/100,00 гр этанола 50% |
гр/100,00 гр этанола 75% |
гр/100,00 гр метанола |
гр/100,00 гр глицерина |
гр/100,00 гр ДМСО |
гр/100,00 гр этилацетата |
гр/100,00 гр этиленгликоля |
гр/100,00 гр муравьиной кислоты 95% |
гр/100,00 гр соляной кислоты |
гр/100,00 гр уксусной кислоты |
гр/100,00 гр пропанола |
гр/100,00 гр изопропанола |
гр/100,00 гр изобутанола |
гр/100,00 гр 1-бутанола |
гр/100,00 гр 2-бутанола |
гр/100,00 гр 1-пентанола |
гр/100,00 гр 1-гексанола |
гр/100,00 гр аммиака |
гр/100,00 гр гидразина |
гр/100,00 гр гидроксиламина |
гр/100,00 гр диметилформамида |
гр/100,00 гр N-метилформамида |
гр/100,00 гр формамида |
гр/100,00 гр ацетонитрила |
гр/100,00 гр изоамилового спирта |
гр/100,00 гр бензилового спирта |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0°C273,15 K <br />32 °F <br />491,67 °R <br /> | 35,7 |
46,4 |
12,9 |
||||||||||||||||||||||||||
| 10°C283,15 K <br />50 °F <br />509,67 °R <br /> | ~35,8 |
||||||||||||||||||||||||||||
| 15°C288,15 K <br />59 °F <br />518,67 °R <br /> | ~35,9 |
13,25 |
9,77 |
0,661 |
|||||||||||||||||||||||||
| 20°C293,15 K <br />68 °F <br />527,67 °R <br /> | 35,9 |
0,7 |
1,43 |
5,8 |
0,0005 |
0,005 |
0,002 |
0,001 |
8 |
14,7 |
0,00015 |
0,0016 |
0,017 |
||||||||||||||||
| 25°C298,15 K <br />77 °F <br />536,67 °R <br /> | 36,02 |
0,06 |
~0,71 |
1,39 |
8,2 |
0,5 |
0,24 |
7,15 |
0,012 |
0,0027 |
0,00047 |
0,04 |
3,2 |
9,4 |
0,00025 |
||||||||||||||
| 30°C303,15 K <br />86 °F <br />545,67 °R <br /> | 36,15 |
~0,06 |
~0,72 |
1,38 |
0,11 |
0,074 |
|||||||||||||||||||||||
| 40°C313,15 K <br />104 °F <br />563,67 °R <br /> | 36,43 |
~0,07 |
0,736 |
1,33 |
|||||||||||||||||||||||||
| 50°C323,15 K <br />122 °F <br />581,67 °R <br /> | 36,78 |
0,07 |
~0,84 |
1,25 |
|||||||||||||||||||||||||
| 60°C333,15 K <br />140 °F <br />599,67 °R <br /> | 37,19 |
~0,07 |
~0,94 |
1,24 |
|||||||||||||||||||||||||
| 70°C343,15 K <br />158 °F <br />617,67 °R <br /> | 37,62 |
~0,08 |
1,033 |
||||||||||||||||||||||||||
| 80°C353,15 K <br />176 °F <br />635,67 °R <br /> | 38,13 |
0,08 |
|||||||||||||||||||||||||||
| 90°C363,15 K <br />194 °F <br />653,67 °R <br /> | ~38,8 |
0,162 |
|||||||||||||||||||||||||||
| 100°C373,15 K <br />212 °F <br />671,67 °R <br /> | 39,4 |
Нерастворим в ацетоне, диэтиловом эфире, пиридине, метилацетате и бензонитриле.
Галерея
Видео
Источники
- Р.А.Кипер, Свойства веществ. Справочник
- Р.А.Кипер, Свойства веществ. Справочник
- Д.Уолкер, Температурные изменений в решетке типа галит-сильвин
- С.Пинхо, Растворимость хлоридов натрия и калия, а также бромида натрия в воде, метаноле, этаноле и их смесях
- Сайт Zircon81.narod.ru
