Федеральное
агентство по образованию
Нижнекамский
химико-технологический институт (филиал)
государственного
образовательного учреждения
высшего
профессионального образования
«Казанский
государственный технологический
университет»
Реферат
По дисциплине:
«Общая и неорганическая химия»
На тему:
«Химический элемент йод»
Выполнил:
студент группы 5027
ФПКП
Кириллов Данил
Алексеевич
Нижнекамск,
2011
ОГЛАВЛЕНИЕ
Введение
3
- Открытие 3
- Распространение
в природе 4 - Физические
и химические свойства 5 - Получение 6
- Иод в организме 6
- Иод и человек 8
- Болезни,
связанные с недостатком иода 8 - Иод в медицине 9
- Иод радиоактивный
10 - Применение
иода 10
Заключение
12
Список
используемой литературы
13
Приложения
14
Введение
Иод
знают все. Порезав палец, мы тянемся
к склянке с иодом, точнее с
его спиртовым раствором. Но не все
знают насколько важно содержание иода
в нашем организме. Иод является очень
сильным антисептическим препаратом.
Однако иод служит не только для смазывания
ссадин и царапин. Хотя иода в человеческом
организме всего 25 мг, он играет важную
роль. Большая часть «человеческого иода»
находится в щитовидной железе: он входит
в состав вещества, которое регулирует
обмен веществ в организме. При недостатке
иода задерживается физическое и умственное
развитие и возникает болезнь, называющаяся
эндемический зоб. Это случается в высокогорных
районах, где естественное содержание
иода в воздухе, воде и пище очень низкое.
Открытие
иода
Иод
– химический элемент VII группы периодической
системы Менделеева. Атомный номер
— 53. Относительная атомная масса
126,9045±0,0001.
Галоген. Из имеющихся в природе галогенов
– самый тяжёлый, если, конечно, не считать
радиоактивный короткоживущий астат.
Практически весь природный иод состоит
из атомов одного – единственного изотопа
с массовым числом 127, его содержание
в земной коре 4 . 10—5% по массе. Радиоактивный
иод – 125 образуется в ходе естественных
радиоактивных превращений. Из искусственных
изотопов иода важнейшие – иод-131
и иод-133: их в основном используют
в медицине.
I2
– галоген. Темно-серые кристаллы с металлическим
блеском. Летуч. Плохо растворяется в воде,
хорошо – в органических растворителях
(с фиолетовым или коричневым окрашиванием
раствора) или в воде с добавкой солей
– иодидов. Слабый окислитель и восстановитель.
Реагирует с концентрированными серной
и азотной кислотами, металлами, неметаллами,
щелочами, сероводородом. Образует соединения
с другими галогенами.
Молекула элементного иода, как
и прочих галогенов, состоит
из двух атомов. Иод – единственный
из галогенов – находится в
твёрдом состоянии при нормальных
условиях. Красивые тёмно – синие кристаллы
иода больше всего похожи на графит. Отчётливо
выраженное кристаллическое строение
(приложение 3), способность проводить
электрический ток – все эти «металлические»
свойства характерны для чистого иода.
Конец
XVII и начало XVIII века были отмечены в
Европе непрекращающимися войнами. Требовалось
много пороха и, следовательно, много селитры.
Производство селитры приняло невиданные
масштабы, наряду с обыкновенным растительным
сырьём в дело шли и морские водоросли.
В них и обнаружили новый химический элемент.
Одним
из французских селитроваров был
химик и промышленник Бернар Куртуа
(1777–1838), он был весьма наблюдательным
человеком. Считается, что именно это
помогло ему в 1811 г. стать первооткрывателем
нового химического элемента иода.
Однажды он заметил, что медный котёл,
в котором выпаривался щелок, полученный
из фукуса, ламинарий и других бурых водорослей,
быстро разрушается, как будто его разъедает
какая – то кислота. Куртуа решил выяснить,
в чём тут дело. Осадив и удалив из раствора
соли натрия, он выпарил раствор, обнаружил
в котле сульфид калия и чтобы разложить
его, прилил к осадку концентрированной
серной кислоты – и тут появился фиолетовый
дым. Куртуа повторил опыт, на этот раз
в реторте, и в приёмнике реторты осели
блестящие чёрные пластинчатые кристаллы.
Иодид
натрия из водорослей, взаимодействуя
с серной кислотой, выделяет иод I2;
одновременно образуется сернистый газ
– диоксид серы SO2
и воду:
2NaI
+ 2H2SO4 = I2 + SO2+ Na2SO4 + 2H2O
При
охлаждении пары иода превращались в
темно-серые кристаллы с ярким блеском.
Куртуа писал: «В маточном растворе щелока,
полученного из водорослей, содержится
довольно большое количество необычного
вещества. Его легко выделить: для этого
достаточно прилить серную кислоту к данному
раствору и нагреть смесь в реторте… Новое
вещество осаждается в приемнике в виде
черного порошка, который при нагревании
превращается в пары великолепного фиолетового
цвета».
Название
новому элементу присвоил в 1813 году французский
химик Жозеф-Луи Гей-Люссак (1778–1850)
за фиолетовый цвет его паров («иодос»
по-гречески значит «фиолетовый»). Он же
получил многие производные нового элемента
– иодоводород HI, иодноватую кислоту HIO3,
оксид иода(V) I2O5, хлорид иода
ICl и другие. Практически одновременно
элементарную природу иода доказал и английский
химик Гэмфри Дэви (1778–1829).
Распространение
в природе
Среднее
содержание иода в земной коре 4*10-5%
по массе. В мантии и магмах и в образовавшихся
из них породах (гранитах, базальтах) соединения
иода рассеяны; глубинные минералы иода
неизвестны. История иода в земной
коре тесно связана с живым веществом
и биогенной миграцией. В биосфере наблюдаются
процессы его концентрации, особенно морскими
организмами (водорослями, губками). Известны
8 гипергенных минералов иода,
образующихся в биосфере, однако они очень
редки. Основным резервуаром иода для
биосферы служит Мировой океан
(в 1 литре в среднем содержится
5*10-5 грамм иода).
Из океана соединения иода, растворенные
в каплях морской воды, попадают в атмосферу
и переносятся ветрами на континенты.
Местности, удаленные от океана или отгороженные
от морских ветров горами, обеднены
иодом. Иод легко адсорбируется
органическими веществами почв и морских
илов. При уплотнении этих илов и образовании
осадочных горных пород происходит десорбция,
часть соединений иода переходит в подземные
воды. Так образуются используемые для
добычи иода иодо — бромные воды,
особенно характерные для районов нефтяных
месторождений (местами 1 литр этих вод
содержит свыше 100 мг иода).
Адсорбция
– связывание одного вещества на поверхности
другого вещества, как правило, твёрдого
тела.
Физические
и химические свойства
Плотность
иода 4,94 г/см3, tпл 113,5 °С, tкип
184,35 °С. Молекула жидкого и газообразного
иода состоит из двух атомов (I2).
Заметная диссоциация I2 Û
2I наблюдается выше 700 °С, а также
при действии света. Уже при обычной температуре
иод испаряется, образуя резко пахнущий
фиолетовый пар. При слабом нагревании
иод возгоняется, оседая в виде
блестящих тонких пластинок; этот
процесс служит для очистки иода в лабораториях
и в промышленности. Иод плохо растворим
в воде (0,33 г/л при 25 °С), хорошо
— в сероуглероде и органических растворителях
(бензоле, спирте), а также в водных растворах
иодидов.
Конфигурация
внешних электронов атома иода 5s2
5p5. В соответствии с этим проявляет
в соединениях переменную валентность
(степень окисления): -1 (в HI, KI); +1 (в HIO, KIO);
+3 (в IСl3); +5 (в НIO3, КIO3);
и +7 (в HIO4, KIO4). Химически иод
довольно активен, хотя и в меньшей степени,
чем хлор и бром. С металлами иод при легком
нагревании энергично взаимодействует,
образуя иодиды (Hg + I2 = HgI2).
С водородом иод реагирует только при
нагревании и не полностью, образуя йодистый
водород. Элементный иод — окислитель,
менее сильный, чем хлор и бром. Сероводород
H2S, тиосульфат натрия Na2S2O3
и другие восстановители восстанавливают
его до I- (I2 + H2S = S + 2НI). Хлор
и другие сильные окислители в водных
растворах переводят его в IO3-. При
растворении в воде иода частично реагирует
с ней; в горячих водных растворах щелочей
образуются иодид и иодат. Адсорбируясь
на крахмале, иод окрашивает его в темно-синий
цвет; это используется в иодометрии и
качественном анализе для обнаружения
иода. Пары иода ядовиты и раздражают слизистые
оболочки. На кожу иод оказывает прижигающее
и обеззараживающее действие. Пятна от
иода смывают растворами соды или тиосульфата
натрия.
Получение
Сырьем
для промышленного получения
иода в России служат нефтяные буровые
воды (приложение 2); за рубежом –
морские водоросли, а также маточные
растворы чилийской (натриевой) селитры,
содержащие до 0,4% иода в виде иодата натрия.
Для извлечения иода из нефтяных вод (содержащих
обычно 20 – 40 мг/л иода в виде иодидов)
на них сначала действуют хлором или азотистой
кислотой. Выделившийся иод либо адсорбируют
активным углем, либо выдувают воздухом.
На иод, адсорбированный углем,
действуют едкой щелочью или сульфитом
натрия. Из продуктов реакции свободный
иод выделяют действием хлора
или серной кислоты и окислителя,
например дихромата калия. При выдувании
воздухом иод поглощают смесью двуокиси
серы с водяным паром и затем вытесняют
иод хлором. Сырой кристаллический
иод очищают возгонкой.
Иод
в организме
Иод
– необходимый для животных и
человека микроэлемент. В почвах и
растениях таёжно-лесной нечерноземной,
сухостепной, пустынной и горных биогеохимических
зон. Иод содержится в недостаточном количестве
или не сбалансирован с некоторыми другими
микроэлементами (Са, Mn, Cu); с этим связано
распространение в этих зонах эндемического
зоба. Среднее содержание иода в почвах
около 3*10-4%, в растениях около 2*10-5%.
В поверхностных питьевых водах иода мало
(от 10-7 до 10-9%). В приморских
областях количество иода в 1 м3 воздуха
может достигать 50 мкг, в континентальных
и горных – составляет 1 или даже 0,2 мкг.
Поглощение
иода растениями зависит от содержания
в почвах его соединений и от вида растений.
Некоторые организмы (так называемые концентраторы
иода, например морские водоросли – фукус,
ламинария, филлофора, накапливают до
1% иода, некоторые губки – до 8,5% (в скелетном
веществе спонгине). Водоросли, концентрирующие
иод, используются для его промышленного
получения. В животный организм иод поступает
с пищей, водой, воздухом. Основной источник
иода – растительные продукты и корма.
Всасывание иода происходит в передних
отделах тонкого кишечника. В организме
человека накапливается от 20 до 50 мг иода,
в том числе в мышцах около 10 – 25 мг, в щитовидной
железе в норме 6 – 15 мг. С помощью радиоактивного
иода (I131 и I125) показано, что
в щитовидной железе иод накапливается
в митохондриях эпителиальных клеток
и входит в состав образующихся в них алл
— и моноиодтирозинов, которые конденсируются
в гормон тетраиодтиронин (тироксин). Выделяется
иод из организма преимущественно через
почки (до 70 – 80% ), молочные, слюнные и потовые
железы, частично с жёлчью.
В
различных биогеохимических провинциях
содержание иода в суточном рационе
колеблется (для человека от 20 до 240 мкг,
для овцы от 20 до 400 мкг). Потребность животного
в иода зависит от его физиологического
состояния, времени года, температуры,
адаптации организма к содержанию иода
в среде. Суточная потребность в иоде человека
и животных – около 3 мкг на 1 кг массы (возрастает
при беременности, усиленном росте, охлаждении).
Введение в организм иода повышает основной
обмен, усиливает окислительные процессы,
тонизирует мышцы.
В
связи с большим или меньшим
недостатком иода в пище и воде
применяют иодирование поваренной
соли, содержащей обычно 10 – 25
г йодистого калия на 1 тонну соли.
Применение удобрений, содержащих иод,
может удвоить и утроить его содержание
в сельскохозяйственных культурах. Кроме
иодирования соли в последние годы стали
широко применять иодирование других
продуктов. Иод добавляют в некоторые
хлебобулочные изделия, молоко, всё большее
распространение получают так называемые
БАДЫ «биологически активные добавки»,
содержащие иод, такие как Иод – актив,
Иодомарин, Цыгапан, Кламин, и некоторые
другие. Одним из самых известных препаратов
для восполнения содержания иода в организме
считается «Иод – актив». Мы обязаны появлению
этого препарата Павлу Флоренскому. Как
инженер он был жёстким и расчётливым
реалистом. А вот к науке у него с детства
была огромная страсть. Павлу Флоренскому
было 10 лет, когда он впервые прочёл книгу
Фарадея. И Майкл стал его кумиров на всю
жизнь. У Флоренского никогда не было сомнений,
кто открыл иод конечно Фарадей! Не случайно
последним открытием Флоренского, стала
формула уникального иодистого препарата,
способного оберегать человека от тяжелых
болезней. Открытие великого русского
учёного имеет планетарное значение.
Ведь проблема нехватке иода волнует граждан
во всём мире. Дефицитом иода страдают
около 1,5 миллиардов человек. В том числе
в России от недостатка иода страдает
около 70% населения. Беда, точнее катастрофа,
бушует на планете. Из – за постоянной
нехватки иода люди порой не блещут умом,
даже взрослые. Такие люди, отличаются
взрывным характером, а потому часто терпят
неудачи на работе и в личной жизни. Учёные
Всемирной организации здравоохранения
уже однозначно пришли к выводу, что коэффициент
интеллекта IQ напрямую зависит от содержания
иода в организме. В нашем городе применение,
таких добавок очень актуально так как,
в почве, и соответственно в продуктах
очень маленькое содержание иода. Поэтому
для сохранения здоровья и интеллектуального
потенциала населения, недостаток иода
нужно восполнять.
Морфологические и синтаксические свойства
йод (дореформ. іодъ)
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 1a по классификации А. А. Зализняка).
Существует два варианта написания: иод и йод. Первый вариант, стандартизованный решением ИЮПАК, используется в основном в химической литературе; в медицине и в быту употребителен второй вариант.
Корень: -йод- [Тихонов, 1996].
Произношение
- МФА: [jɵt]
Семантические свойства
Значение
- хим. химический элемент с атомным номером 53, обозначается химическим символом I, типичный неметалл из группы галогенов ◆ Поверхностные воды Чёрного моря содержат хлор, йод, бром, сульфаты, карбонаты, натрий, калий Елена Зенина, «Морская симфония», 15 марта 2001 г. // «Туризм и образование» [НКРЯ]
- простое вещество I2, в нормальных условиях — кристаллы чёрно-серого цвета с металлическим блеском ◆ Кроме того, галогенные лампы (бром и йод, которые подмешивают в газ, относятся к галогенам) можно делать совсем малюсенькими. Мария Русанова, «До лампочки», 2004 г. // «Парадокс» [НКРЯ]
- разг. то же, что йодная настойка; дезинфицирующее средство, водно-спиртовый раствор иода и иодида калия ◆ У меня и бинт, и йод, и спиртику флакончик есть. В. П. Астафьев, «Пролётный гусь», 2000 г. [НКРЯ]
- буква в семитских алфавитах (финикийский, еврейский, арабский) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- иод
- иод
- йодная настойка, раствор Люголя
- —
Антонимы
- —
- —
- —
- —
Гиперонимы
- галоген, неметалл, химический элемент
- простое вещество
- антисептик
- буква
Гипонимы
- —
- —
- —
- йуд, йа
Родственные слова
| Список всех слов с корнем иод | ||
|---|---|---|
|
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Перевод
Библиография
Смотреть также
Морфологические и синтаксические свойства
йод
Существительное, мужской род, склонение 1.
Корень: -йод-.
Произношение
Семантические свойства
Значение
- йод (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- —
Родственные слова
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Библиография
Морфологические и синтаксические свойства
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | йо́д | *йо́ди |
| Р. | йо́ду | *йо́дів |
| Д. | йо́дові йо́ду |
*йо́дам |
| В. | йо́д | *йо́ди |
| Тв. | йо́дом | *йо́дами |
| М. | на/у йо́ді по йо́ду |
*на/у йо́дах |
| Зв. | йо́де* | *йо́ди* |
йод
Существительное, неодушевлённое, мужской род, 2-склонение (тип склонения 1a- по классификации А. А. Зализняка); формы мн. ч. не используются.
Корень: -йод-.
Произношение
- МФА: [ˈjɔd]
Семантические свойства
Значение
- йод (аналогично русскому слову) ◆ Отсутствует пример употребления (см. рекомендации).
Синонимы
- ?
Антонимы
- —
Гиперонимы
- ?
Гипонимы
- —
Родственные слова
Этимология
Происходит от франц. iode «иод», далее из др.-греч. ἰοειδής «похожий цветом на фиалку, тёмно-синий», далее из ἴον «фиалка», из праиндоевр. *wiy- «фиалка», + εἶδος «вид, внешность, образ», далее из εἴδω «видеть», далее из праиндоевр. *weide- «видеть».
Фразеологизмы и устойчивые сочетания
Библиография
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
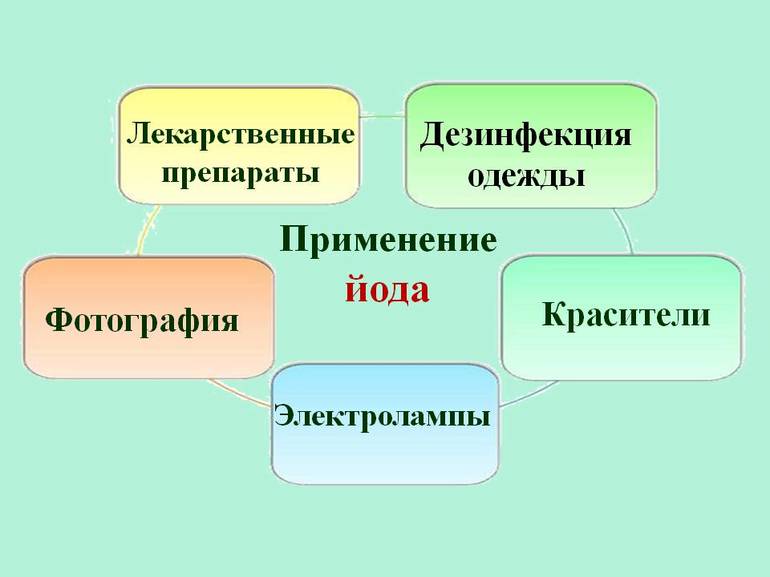
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
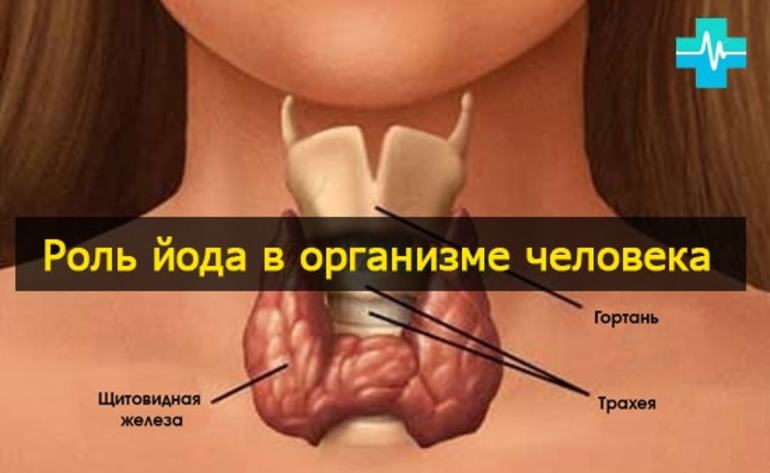
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
Иод или йод?
Идея этой статьи появилась после публикации в разделе «Переписка» ответа А.Васильеву из Зеленогорска: «Символ иода, как указано в Химической энциклопедии и БСЭ – от латинского Iodium, а J, видимо, периодически появляется как производное от русского «иод».
Однако такой ответ сам вызывает вопросы. Иод был открыт только в XIX веке, у древних римлян этого слова не было, так что очевидно, что латинское название придумано химиками, и не так давно. Кстати, правильное написание этого элемента на латыни не Iodium, а Iodum. Причем писать это слово химики могли как с «i», так и с «j»! Так, в «Курсе общей химии» Б.В.Некрасова (М.: Госхимиздат, 1962) читаем: «Латинское название Jodum, химический знак J». Причем в тексте, в таблицах и в химических формулах в этом учебнике используется символ элемента J, но одновременно везде написано только «иод», «иодиды» и т.д. (но не «йод», «йодиды»…).
Далее, «периодически появляющаяся J» (очевидно, речь идет о символе элемента в периодических таблицах) никак не может быть «производной от русского иод», а лишь от слова «йод»! Не говоря уже о том, что символы химических элементов никогда не производились от русских названий элементов, а только от греческих и латинских корней – кто бы и в какой бы стране эти названия ни придумывал. Такова традиция.
Что говорят словари русского языка? В четырехтомном академическом «Словаре русского языка» (М.: Русский язык, 1981) – только «йод». Однако можно встретить оба написания: иод и йод, причем чаще всего на первое место ставят «йод», например, в Словаре иностранных слов (М.: Русский язык, 1983). В Советском энциклопедическом словаре (1983) читаем: «Йод, см. Иод», то же и в Новом энциклопедическом словаре (2006). В современных таблицах элементов и в химических формулах мы встречаем только I. Почему так происходит? И как правильно?
В химических текстах принято писать это слово через «и-восьмеричное», то есть «иод». А вот в медицинских и художественных текстах принято писать это слово с «и-кратким»: йод. Поясним заодно, что термин «и-восьмеричное» происходит от цифрового значения 8 этой буквы в старом славянском алфавите, как и греческой буквы «ита» («эта») – з, от которой и произошла кириллическая «и» (буква «б» не имела в кириллице числового соответствия). Соответственно десятая буква старого алфавита i называлась «и-десятеричным», так как имела числовое соответствие 10, как и греческая «йота» – й.
Прежде всего выясним, откуда произошло название «иод» и кто его придумал. Оказывается, открыл этот элемент один химик, а название ему дал другой, что бывало, кстати, не так уж редко. Честь открытия иода принадлежит французу Бер-нару Куртуа (Bernard Courtois). Он родился в Дижоне в 1777 году. С детства работал на селитроваренном заводе, принадлежавшем его отцу. Потом был подмастерьем у фармацевта. В 1799 году, после учебы в Политехнической школе, был призван в армию, работал фармацевтом в военных госпиталях. В 1801 году Куртуа вернулся в Политехническую школу, чтобы стать ассистентом известного химика Луи Жака Тенара, будущего академика и президента Парижской академии наук.
После смерти отца Куртуа вернулся в Дижон. Для производства солей натрия и калия на своем теперь заводе Куртуа использовал золу из бурых морских водорослей. Щелок, полученный при выварке золы, выпаривали в медных котлах. Для осаждения примесей в раствор добавляли серную кислоту. При этом медь подвергалась коррозии, чего не было при варке чистых солей. Куртуа занялся поиском вещества, разъедающего медь, и в 1811 году открыл новый элемент. Не имея возможности изучить его более детально, Куртуа обратился к другим химикам. Широкую известность его открытие получило лишь спустя два года, когда 9 ноября 1813 года о нем сделал доклад французский химик Никола Клеман. В нем, в частности, говорилось: Куртуа обнаружил, что «маточный рассол золы морских водорослей содержит довольно большое количество весьма странного и интересного вещества. Извлечь его очень легко… Вещество, выпавшее в виде черного порошка после прибавления серной кислоты, выделяется под действием тепла, образуя пар великолепного фиолетового цвета; этот пар конденсируется в аллонже и приемнике в виде кристаллических пластинок с ярким блеском».
Последующие анализы показали, что сплавленная зола морских водорослей может содержать до 1 % NaI. При упаривании раствора происходит концентрирование не только солей, но и серной кислоты, которая проявляет окислительные свойства: 2NaI + 2H2SO4 = I2 + Na2SO4 + SO2 + 2H2O.
Завод в Дижоне вскоре пришел в упадок из-за ввоза во Францию индийской селитры. Тогда Куртуа решил заняться добычей иода. Препараты этого элемента стали широко использоваться для лечения болезни щитовидной железы -зоба. За медицинское использование своего открытия Куртуа в 1831 году получил большую награду — 6000 франков. А 9 ноября 1913 году, спустя ровно сто лет после публичного сообщения об открытии, в Дижоне состоялась торжественная церемония, и на доме, в котором родился Куртуа, была укреплена памятная табличка, а через год его именем была названа улица в Дижоне. Первооткрыватель иода (он умер в 1838 году) не опубликовал за свою жизнь ни одной научной статьи.
Клеман сделал свое сообщение лишь после того, как новое вещество подробно исследовал Жозеф Луи Гей-Люссак, который установил элементарную природу иода, а также синтезировал многие его производные, в том числе иодоводородную кислоту HI, иодную кислоту HIO3, иодный ангидрид I2O3, хлорид иода ICl и другие.
Гей-Люссак не только подробно изучил новый элемент, но и дал ему название. Он произвел его от греческих корней «фиалка» и «вижу, кажусь», по-гречески ιξειδής — цвета фиалки, фиолетовый. По-французски слово писалось (и сейчас пишется) iode. А как в других языках?
В России до реформы орфографии 1918 года проблем с написанием не было: по правилам, перед гласными (а также в окончаниях перед «й») писалась только i: Iаковъ, iезуиты, iодъ, iюль, химическiй и т. д. Соответственно и символом элемента служила буква I. Отсюда, кстати, следует, что модные сейчас «старые» надписи в названиях, витринах, на вывесках и т.п. типа «Русский холодъ», «Храмъ Хрiста» и множество других написаны с грубыми ошибками. После реформы орфографии и упразднения ряда букв некоторые вопросы остались не урегулированными. Во всяком случае, в изданной в 1924 году книге В.Герца «Очерк истории развития основных воззрений химии» написано «иод», «иодиды». Такое же правописание в «Курсе неорганической химии» Г.Реми издания 1963 года. Но, в отличие от учебника Некрасова, символ элемента I, а не J.
Посмотрим, что в других языках. В английском название элемента пишется несколько иначе, чем во французском: iodine и произносится «айоудин» – с кратким или долгим «и» в последнем слоге. В испанском существует два написания: iodo в химических текстах и yodo – в остальных. То есть полная аналогия с русским языком! (По традиции, латинская i транслитерируется в русском языке как «и», а j – как «й».) В португальском, как и в испанском, iodo. По-итальянски написание аналогично французскому: iodio. Однако в Русско-немецком словаре М.Я.Цвиллинга, содержащем около 150 тысяч слов (М.: Русский язык, 1997), это слово написано через «жи» (нем. «йот») – Jod! В Немецко-русском словаре того же издательства (1998) также читаем: Jod (хим. знак J) йод. То же наблюдаем и в других языках германской группы, а также в языках, на которые значительное влияние оказали германские языки. Например, в голландском – jood (в химических текстах jodium), в исландском joр, в датском, шведском, норвежском – jod; так же это слово пишется в польском, сербскохорватском (jod и jод), венгерском, чешском (jуd) и др. языках. Буква j присутствует в названии этого вещества в латышском (jods), эстонском (jood), литовском (jodas).
Так, может быть, именно в немецком языке следует искать происхождение нашего «йод» и символа J? Эту гипотезу можно проверить по периодическим таблицам элементов, изданных в разные годы в разных странах, благо подборку из 27 таблиц с комментариями опубликовал в 1992 году крупнейший отечественный историк химии Д.Н.Трифонов. Во всех англоязычных изданиях, как и следовало ожидать, стоит символ I. Символ J мы встречаем в «лестничной» таблице датского физикохимика Юлиуса Томсена (1895), написанной на немецком языке; в «астероидной» таблице чешского химика Богуслава Браунера (1902); в прообразе современной длинной формы таблицы швейцарского химика Альфреда Верне-ра (1905); в таблице шведского физика Йоханнеса Роберта Ридберга (1906), в которой впервые проставлены порядковые номера элементов; в таблице немецкого химика Эмиля Бауэра (1911), предложившего термины «главная» и «побочная» подгруппы; а также в таблицах родившегося в Польше, но работавшего тогда в Германии Казимира Фаянса (1915), немецкого физика Рудольфа Вальтера Ладенбурга (1920), знаменитого датского физика Нильса Бора (1921), немецкого химика Рихарда Иоганна Свинне (1926), немецкого химика Карла Малера (1927). То есть во всех этих «немецкоязычных» таблицах стоит символ J, тогда как в таблицах английских, американских, французских химиков – символ I. Значит, вполне вероятно, что и символ J, и слово «йод» появились у нас под влиянием немецкого языка. Тем более что Германия в течение длительного времени была законодательницей в области химии и лидировала по числу Нобелевских премий по химии. Этот вывод подтверждает и «Краткий этимологический словарь русского языка» Н.М.Шанского, В.В.Иванова и Т.В.Шанской (М.: Просвещение, 1971): «Иод. Заимств. в XIX в. из франц. яз. через нем. посредство». Неудивительно, что превалирование «немецкой химии» отразилось и на химии фармацевтической. В течение длительного периода немецкие фармацевтические концерны «Bayer», «Merck» снабжали лекарствами весь мир. Многие русские врачи, как и химики, учились в Германии. И «вывезли» оттуда и «йодную настойку», и «йодоформ», и символ этого элемента J.
Появление в современном немецком языке все большего числа англицизмов приводит к тому, что «истинно немецкий» Jod начинает уступать место слову Iod. Так, в изданной в 1989 году в Лейпциге книге по истории химии «ABC Geschichte der Chemie» на традиционное написание этого слова по-немецки следует отсылка: «Jod. > Iod». Трудно сказать, появится ли со временем такая тенденция и в русском языке.
В заключение – мнение филолога Натальи Юдиной, декана факультета русского языка и литературы Владимирского государственного педагогического университета, доктора филологических наук: «Узаконенное «Правилами орфографии» написание слова «йод» через сочетание «йо» противоречит русской графической норме, т.к. звучание «йод» требовало бы написания «ёд», как и в слове «ёлка». Буква «ё», собственно, и придумана была для того, чтобы преодолеть неестественность сочетания «йо» на письме». Именно такое написание мы находим в белорусском языке: ёд, ёдзiсты, ёдаформ. Кстати, слова «йод» и «ёд» по-русски должны читаться практически одинаково. Но вряд ли в русском языке в обозримом будущем верх возьмет тенденция замены написания «йод» на «иод» и тем более – на «ёд»!
Йод
Ио́д (тривиальное (общеупотребительное) название — йод; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы перйодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого перйода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
История
йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης, ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
Физические свойства
йод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Химические свойства
йод относится к группе галогенов.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
1. С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Hg + I2 = HgI2
2. С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
I2 + H2 = 2HI
3. Атомарный йод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I—:
I2 + H2S = S + 2HI
4. При растворении в воде йод частично реагирует с ней:
I2 + H2O ↔ HI + HIO, pKс=15.99
Источник: Википедия
Другие заметки по химии
| Иод | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества |
 |
| Свойства атома | |
|
Атомная масса (молярная масса) |
126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
|
Электроотрицательность (по Полингу) |
2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Молярная теплоёмкость | 54,44[1] Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
| 5s25p5 | |
| Иод |
Иод, йод (от др.-греч. ιώδης, iodes — «фиолетовый») — элемент главной подгруппы седьмой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
В большом количестве находится в виде иодидов в морской воде. Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99% запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, что намного удорожает производство йода из такого сырья.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
- Hg + I2 = HgI2
- С водородом иод реагирует только при нагревании и не полностью, образуя йодистый водород:
- I2 + H2 = 2HI
- Элементный иод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I—:
- I2 + H2S = S + 2HI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
См. также
- Зелёнка
- Фукорцин
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму) Так же при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, слабеет память и интеллект, нервозность и раздражительность. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Токсичность
Иод — токсичное вещество. Смертельная доза 2-3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день воспаляются почки, появляется кровь в моче. Если не лечить через 2-3 дня могут отказать почки и наступить миокардит. Без лечения наступает летальный исход.
- Тиреоидит
Всего найдено: 15
Добрый день! Пытаюсь задать вопрос в третий раз. Вы не отвечаете, а для меня это важно: в тексте (не научном, для широкого читателя) неоднократно встречается слово «йод«, и автор настаивает на написании с буквой и. Итак, вопрос. Объясните, пожалуйста, почему из вариативных написаний слова «йод» (йод — иод) и производных от него была выбрана в качестве нормативной форма с й (см. Орфографический словарь РАН). По мнению химиков, слово, обозначающее химический элемент, может писаться только с буквой и (такого написания специалисты придерживаются во многих современных научных и справочных изданиях). Имеет ли, на ваш взгляд, какие-либо основания это требование ученых (кстати, достаточно категорическое)? Буду признателен за подробное разъяснение.
Ответ справочной службы русского языка
Нормативное написание: йод. Сочетание [jo] на письме передается при помощи буквы Ё (для исконно русских слов) или сочетания ЙО (для заимствованных слов). Использование букв ЙО указывает на устоявшееся произношение слова йод с [jo].
Добрый день. Подскажите, как правильно писать политико-формирующий или политикоформирующий? И какое правило применить в данном случае?
Ответ справочной службы русского языка
Корректно слитное написание. Сложные прилагательные с подчинительным отношением основ и без суффикса в первой части пишутся слитно, ср.: йодосодержащий и йодсодержащий, овощемоечный, статусоформирующий, градоформирующий.
Гадолинийсодержащее контрастрое средство или гадолиний-содержащее? или гадолиний содержащее? в научной литературе чаще встречается слитное написание, но встречаются и другие способы. Есть правило?
Ответ справочной службы русского языка
Слитное написание соответствует современной норме. Основное правило таково: сложные прилагательные с подчинительным отношением основ и без суффикса в первой части пишутся слитно, напр.: колесотокарный, йодосодержащий и йодсодержащий, овощемоечный, рельсоукладочный, сталелитейный. (Подробнее см. здесь.)
Доброе утро!
Подскажите, пожалуйста, верна ли здесь расстановка знаков препинания?
Хлорид серебра — белый, бромид серебра — кремовый, а йодид серебра — желтый.
Спасибо!
Ответ справочной службы русского языка
По основному правилу постановка всех трех тире не требуется.
Уважаемая Грамота!
Проект федерального закона имеет название «Об йодировании пищевой поваренной соли». Как все-таки правильно: «Об йодировании…» или «О йодировании…»? Спасибо.
Ответ справочной службы русского языка
Перед согласным звуком нужен предлог О: о йодировании.
Вопрос № 268471
Дорогая Грамота! Нужно срочно! «Лида выскочила из автомобиля, уселась на колени и стала промакивать мою ссадину салфеткой с йодом». Можно ли сказать «промакивать»? Спасибо.
Редактор-корректор
Ответ справочной службы русского языка
Ссадина — почти то же, что и царапина, почти бескровная, неглубокая. Вряд ли слово «промакивать» здесь уместно.Скажите, это только меня повеселило, что Лида уселась на колени (видимо, к потерпевшему), чтобы промакивать ссадину?
Ответ справочной службы русского языка
Да, забавно

Дорогая Грамота! Нужно срочно! «Лида выскочила из автомобиля, уселась на колени и стала промакивать мою ссадину салфеткой с йодом». Можно ли сказать «промакивать»? Спасибо.
Ответ справочной службы русского языка
Ссадина — почти то же, что и царапина, почти бескровная, неглубокая. Вряд ли слово «промакивать» здесь уместно.
«НАСТОИ» и » НАСТОЙКИ» — ДВА РАЗНЫХ СЛОВА (ПО СМЫСЛУ) ИЛИ ЭТО ОДНО И ТО ЖЕ? СПАСИБО ЗА ОТВЕТ!
Ответ справочной службы русского языка
Большой толковый словарь
НАСТОЙ, -я; м.
Лекарственный, водный экстракт какого-л. вещества, растения. Хвойный, ромашковый н. Н. на травах. Н. липы, ревеня. Сделать н. из хвои.НАСТОЙКА, -и; мн. род. -стоек, дат. -стойкам; ж.
1.
Спиртной напиток, настоянный на ягодах, плодах, травах. Вишнёвая, клубничная н. Выпить рюмочку настойки. Сделать настойку из сливы.
2. Разг.
Лекарственный спиртовой экстракт какого-л. вещества, растения. Н. йода. Н. мяты, календулы. < Настоечный, -ая, -ое. Н. запах. Н-ые пятна на скатерти.
Добрый день! Помогите, пож., как следует писать йододефицит или йоддефицит, а также йоддефицитные состояния или йододефицитные состояния? В орфографическом словаре указывается на два возможных варианта написания этих слов, но посоветуйте, пож., какой из этих вариантов предпочесть, какой из них наиболее ПРАВИЛЬНЫЙ? Мне кажется, что О в йододефиците — перегружает это слово. Спасибо!
Ответ справочной службы русского языка
Все варианты написания верны: йододефицит и йоддефицит, йододефицитный и йоддефицитный, среди них нет «более правильного» и «менее правильного». Какой из вариантов предпочесть – решать Вам, не нам.
Почему буква ё обозначена как е, ведь эти звуки не тождественны?
Ответ справочной службы русского языка
Буква ё пишется в следующих случаях:
1. Когда необходимо предупредить неверное чтение и понимание слова, например: узнаём в отличие от узнаем; всё в отличие от все; вёдро в отличие от ведро; совершённый (причастие) в отличие от совершенный (прилагательное).
2. Когда надо указать произношение малоизвестного слова, например: река Олёкма.
3. В cпециальных текстах: букварях, школьных учебниках русского языкa, учебниках орфоэпии и т. п., а также в словарях для указания места ударения и правильного произношения.
Примечание. В иноязычных словах в начале слов и после гласных вместо буквы ё пишется йо, например: йод, йот, район, майор.
Склоняется ли мужская фамилия Шалайода?
Ответ справочной службы русского языка
Да, эту фамилию нужно склонять.
Как правильно говорить йодная сетка или йодовая сетка?
Ответ справочной службы русского языка
Оба варианта правильны.
Добрый день.
Нужно ли в предложении «зеленка лишена свойственных йоду побочных эффектов» выделять запятыми «свойственных йоду» и почему?
Заранее спасибо.
Ответ справочной службы русского языка
Запятые не нужны, т. к. определительный оборот свойственных йоду стоит перед определяемым словом эффектов. Ср. (при обратном порядке): зеленка лишена побочных эффектов, свойственных йоду.
Пожалуйста, подскажите, как пишется ЙОДО-КРАХМАЛЬНЫЙ? я на столько вариантов натолкнулась… Спасибо!
Ответ справочной службы русского языка
Корректно слитное написание: йодокрахмальный.
Как писать правильно, спиртовый раствор йода или спиртовой раствор йода? Компьютер предлагает последний вариант.
Спасибо.
Ответ справочной службы русского языка
Правильно: _спиртовой_.
Йод
Йод (тривиальное (общеупотребительное) название — йод; от греч. ἰώδης — «фиалковый (фиолетовый)») — химический элемент с атомным номером 53. Принадлежит к 17-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA), находится в пятом периоде таблицы. Атомная масса элемента 126,90447 а. е. м.. Обозначается символом I (от лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество йод при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высокотоксичен. Молекула простого вещества двухатомна (формула I2).
|
|
|
| Название, символ, номер | Йод / Iodum (I), 53 |
|---|---|
| Атомная масса (молярная масса) |
126,90447(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Радиус атома | 136 пм |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность | 2,66 (шкала Полинга) |
| Электродный потенциал | +0,535 В |
| Степени окисления | +7, +5, +3, +1, 0, −1 |
| Энергия ионизации (первый электрон) |
1008,3 (10,45) кДж/моль (эВ) |
| Плотность (при н. у.) | 4,93 г/см³ |
| Температура плавления | 113,5 °C |
| Температура кипения | 184,35 °C |
| Уд. теплота плавления | 15,52 (I—I) кДж/моль |
| Уд. теплота испарения | 41,95 (I—I) кДж/моль |
| Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| Молярный объём | 25,7 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=7,18 b=4,71 c=9,81 |
| Отношение c/a | — |
| Теплопроводность | (300 K) (0,45) Вт/(м·К) |
| ГОСТ | ГОСТ 4159-79 ГОСТ 545-76 |
| Номер CAS | 7553-56-2 |
Содержание
- 1 Название и обозначение
- 2 История
- 3 Нахождение в природе
- 4 Физические свойства
- 4.1 Изотопы
- 5 Химические свойства
- 6 Применение
- 6.1 В медицине
- 6.2 В криминалистике
- 6.3 В технике: рафинирование металлов
- 6.3.1 Источники света
- 6.3.2 Производство аккумуляторов
- 6.3.3 Лазерный термоядерный синтез
- 6.3.4 Радиоэлектронная промышленность
- 6.4 Динамика потребления йода
- 7 Биологическая роль
- 7.1 Йод и щитовидная железа
- 7.2 Токсичность
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰο-ειδής (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например, «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например, в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
История
Йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Нахождение в природе
Йод — редкий элемент. Его кларк — всего 400 мг/т. Однако он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде (20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода, например, чилийская Atacama Minerals производит свыше 720 тонн йода в год. Наиболее известный из минералов йода — лаутарит Ca(IO3)2. Некоторые другие минералы йода — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство йода из такого сырья.
Физические свойства
Жидкий йод на дне химического стакана
Природный йод состоит только из одного изотопа — йода-127 (см. Изотопы йода). Конфигурация внешнего электронного слоя — 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома йода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома йода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность йода — 2,66, йод принадлежит к числу неметаллов.
Йод при обычных условиях — твёрдое вещество, чёрно-серые или тёмно-фиолетовые кристаллы со слабым металлическим блеском и специфическим запахом.
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например, в бензоле — в отличие от бурого раствора в полярном этиловом спирте. Слабо растворяется в воде (0,28 г/л), лучше растворяется в водных растворах йодидов щелочных металлов с образованием трийодидов (например трийодида калия KI3).
При нагревании при атмосферном давлении йод сублимирует (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении при атмосферном давлении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Жидкий йод можно получить, нагревая его под давлением.
Изотопы
Известны 37 изотопов йода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов йода составляет от 103 мкс до 1,57⋅107 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ.
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
-
- Hg + I2 → HgI2
- С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
-
- H2 + I2 → 2HI
- Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
-
- I2 + H2S → S + 2HI
-
- I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
- При растворении в воде йод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
-
- I2 + H2O → HI + HIO , pKc=15,99
- Реакция образования нитрида трийода:
-
- 3I2 + 5NH3 → 3NH4I + NH3 ⋅ NI3↓
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
- Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
-
- KI + I2 → KI3
Применение
В медицине
5 % спиртовой раствор йода
«Раствор йода» ссылается сюда. На эту тему нужна отдельная статья.
Основная статья: Раствор Люголя
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных инъекций, на их месте пациенту делается йодная сетка, — йодом рисуется сетка на площади, в которую делаются инъекции (напр., на ягодицах). Это нужно для того, чтобы быстро рассасывались «шишки», образовавшиеся в местах внутримышечных инъекций.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в целом мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором йода используется зелёнка, фукорцин, пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
Йод-131, как и некоторые радиоактивные изотопы йода (125I, 132I) применяются в медицине для диагностики и лечения заболеваний щитовидной железы. Изотоп широко применяется при лечении диффузно-токсического зоба (болезни Грейвса), некоторых опухолей. Согласно нормам радиационной безопасности НРБ-99/2009, принятым в России, выписка из клиники пациента, лечившегося с использованием йода-131, разрешается при снижении общей активности этого нуклида в теле пациента до уровня 0,4 ГБк.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например, на купюрах.
В технике: рафинирование металлов
Источники света
Йод используется в источниках света:
- галогеновых лампах — в качестве компонента газового наполнителя колбы для осаждения испарившегося вольфрама нити накаливания обратно на неё.
- металлогалогеновых дуговых лампах — в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик.
Производство аккумуляторов
Йод используется в качестве компонента положительного электрода (окислителя) в литиево-ионных аккумуляторах для автомобилей.
Лазерный термоядерный синтез
Некоторые йодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах йода (исследования в области лазерного термоядерного синтеза).
Радиоэлектронная промышленность]
В последние годы резко повысился спрос на йод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления йода
Мировое потребление йода в 2005 году составило 25,8 тыс. тонн
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность
Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
|
Соединения йода |
|
|---|---|
| Оксиды |
|
| Галогениды и оксигалогениды |
|
| Кислоты |
|
| Прочие |
|