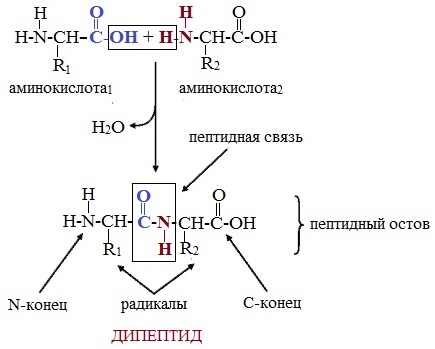
Пептиды – семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединенных в цепь пептидными (амидными) связями —С(О)NН- .
Пептиды можно рассматривать как продукты конденсации двух или более молекул аминокислот.
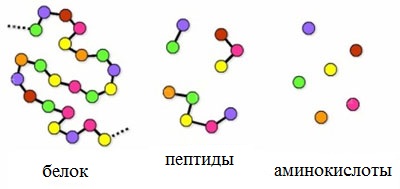
Число пептидов, которые могут быть построены из 20 природных аминокислот, огромно.

Две молекулы аминокислоты могут реагировать друг с другом с отщеплением молекулы воды и образованием продукта, в котором фрагменты связаны пептидной связью –СО-NH- .
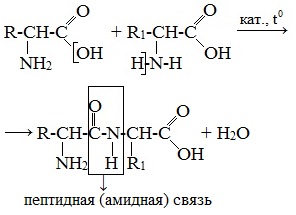
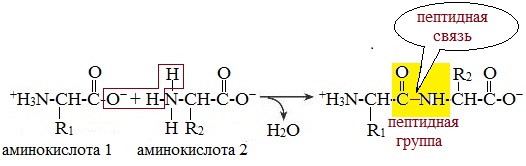
Образование дипептидов
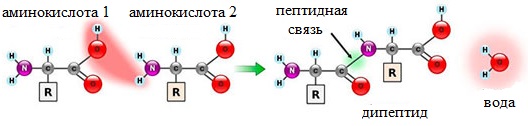
Две аминокислоты образуют дипептид:
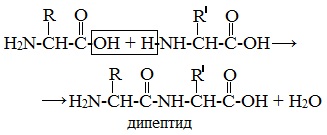
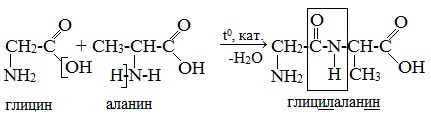
Например:
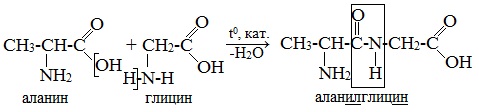
Или
Образование трипептидов
Молекула дипептида, подобно аминокислотам, содержит аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты:
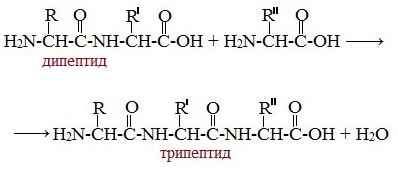
Полученное соединение называется трипептидом.
Процесс наращивания пептидной цепи может продолжаться неограниченно и приводит к веществам с очень высокой молекулярной массой (белкам).
Формулы пептидов обычно записываются так, что свободная аминогруппа находится слева, а свободная карбоксильная группа – справа. Основная часть пептидной цепи построена из повторяющихся участков –СН-СО-NН- и боковых групп R, R’ и т.д.
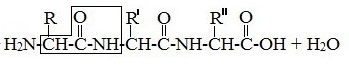
Структуру пептидов, содержащих большое число остатков аминокислот, записывают в сокращенном виде с использованием обозначений.
Например, строение молекулы вазопрессина – пептида, построенного из 9 аминокислотных остатков, можно изобразить следующим образом:
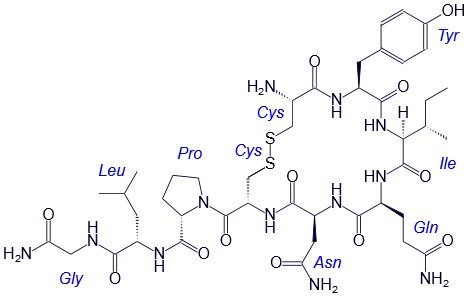
Структурная формула вазопрессина
Эту же структуру можно изобразить в сокращенном виде с использованием трехбуквенных и однобуквенных обозначений аминокислот:
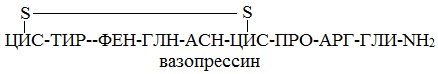
В этом пептиде остатки цистеина связаны дисульфидными мостиками. Правый конец цепи содержит амидную группу –СО-NН2 вместо карбоксильной.
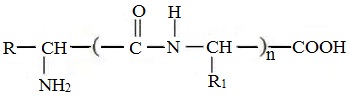
Номенклатура
При составлении названия дипептида сначала называют аминокислоту, у которой в образовании дипептида участвует группа –СООН. В тривиальном названии этой кислоты последняя буква «н» заменяется буквой «л». Затем прибавляют без изменений тривиальное название аминокислоты, у которой в образовании дипептида участвует группа –NH2.
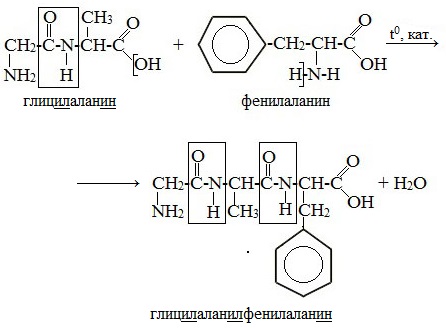
Любой дипептид имеет свободные амино- и карбоксильную группы и поэтому может взаимодействовать еще с одной молекулой аминокислоты, образуя трипептид. Таким же путем получают тетрапептиды и т.д.
Биологическое значение
Многие пептиды проявляют биологическую активность. Простейший из них – трипептид глутатион, который относится к классу гормонов – веществ, регулирующих процессы жизнедеятельности. Этот гормон построен из остатков глицина, цистеина и глутаминовой кислоты.
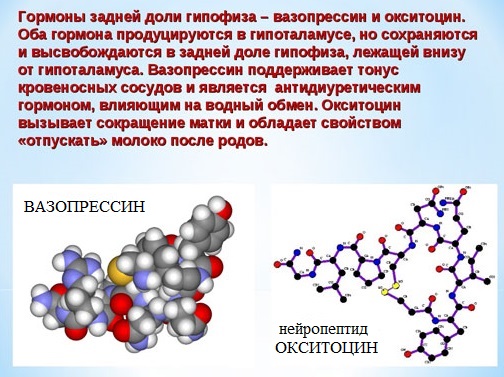
Некоторые пептиды (окситоцин, вазопрессин, инсулин) имеют огромное биологическое значение, являются важными гормонами.
Вазапрессин и окситоцин содержат 9 аминокислотных остатков.
Вазопрессин вырабатывается гипофизом и стимулирует сокращение кровеносных сосудов, повышает кровяное давление, а окситоцин стимулирует выделение молока молочными железами.
Инсулин – биологически важный пептид, который построен из двух цепей, состоящих из 21 и 30 α-аминокислотных остатков, которые связаны между собой дисульфидными мостиками. Вырабатывается поджелудочной железой и снижает содержание сахара в крови.
Химические свойства
Основное свойство пептидов – способность к гидролизу. При гидролизе происходит полное или частичное расщепление пептидной цепи и образуются более короткие пептиды с меньшей молекулярной массой или α-аминокислоты, составляющие цепь.
Анализ продуктов полного гидролиза позволяет установить аминокислотный состав пептида. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой.
Последовательность аминокислот в цепи может быть установлена путем частичного гидролиза пептида. Для этого необходимо последовательно, одну за другой, отщеплять аминокислоты от одного из концов цепи и устанавливать их структуру.
Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. В кислой и щелочной средах образуются соли аминокислот.
Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенный участки пептидной цепи. Селективный гидролиз может протекать и под действием неорганических реагентов. Так, бромистый циан (BrCN) расщепляет полипептидную цепь только по пептидной связи, образованной карбоксильной группой метионина.
Аминокислоты
Строение белков
From Wikipedia, the free encyclopedia
A dipeptide is an organic compound derived from two amino acids. The constituent amino acids can be the same or different. When different, two isomers of the dipeptide are possible, depending on the sequence. Several dipeptides are physiologically important, and some are both physiologically and commercially significant. A well known dipeptide is aspartame, an artificial sweetener.[1]
Dipeptides are white solids. Many are far more water-soluble than the parent amino acids.[1] For example, the dipeptide Ala-Gln has the solubility of 586 g/L more than 10x the solubility of Gln (35 g/L). Dipeptides also can exhibit different stabilities, e.g. with respect to hydrolysis. Gln does not withstand sterilization procedures, whereas this dipeptide does. Because dipeptides are prone to hydrolysis, the high solubility is exploited in infusions, i.e. to provide nutrition.[2]
Examples[edit]
Aspartame is produced commercially as an artificial sweetener.
Commercial value[edit]
About six dipeptides are of commercial interest.[1]
- Aspartame (N—L-α-aspartyl-L-phenylalanine 1-methyl ester) is an artificial sweetener.
- Carnosine (beta-alanyl-L-histidine) and Anserine (beta-alanyl-N-methyl histidine) are highly concentrated in muscle and brain tissues. They are used in sports medicines.
- Acetylcarnosine, cataract prevention
- Ala-Gln and Gly-Tyr, infusion[2]
- Val-Tyr, antihypertensive
Other dipeptides[edit]
- Homoanserine (N-(4-aminobutyryl)-L-histidine) is another dipeptide identified in the brain and muscles of mammals.
- Diphenylalanine is the most studied building block in peptide nanotechnology
- Kyotorphin (L-tyrosyl-L-arginine) is a neuroactive dipeptide which plays a role in pain regulation in the brain.
- Balenine [ja] (or ophidine) (beta-alanyl-N tau-methyl histidine) has been identified in the muscles of several species of mammal (including man), and the chicken.
- Glorin (N-propionyl-γ-L-glutamyl-L-ornithine-δ-lac ethyl ester) is a chemotactic dipeptide for the slime mold Polysphondylium violaceum.
- Barettin (cyclo-[(6-bromo-8-en-tryptophan)-arginine]) is a cyclic dipeptide from the marine sponge Geodia barretti.
- Pseudoproline
- Dialanine is commonly used as a model in molecular dynamics.
- Xenortides, isolated from the bacterium Xenorhabdus nematophila
Production[edit]
Synthetic dipeptides[edit]
Dipeptides are produced by coupling amino acids. The amino group on one amino acid is rendered non-nucleophilic (P in eq) and the carboxylic acid group in the second amino acid is deactivated as its methyl ester. The two modified amino acids are then combined in the presence of a coupling agent, which facilitates formation of the amide bond:
- RCH(NHP)CO2H + R’CH(NH2)CO2CH3 → RCH(NHP)C(O)NH(CHR’)CO2CH3 + H2O
Subsequent to this coupling reaction, the amine protecting group P and the ester are converted to the free amine and carboxylic acid, respectively.[3]
For many amino acids, the ancillary functional groups are protected. The condensation of the amine and the carboxylic acid to form the peptide bond generally employs coupling agents to activate the carboxylic acid.[4]
The Bergmann azlactone peptide synthesis is a classic organic synthesis for the preparation of dipeptides.[1]
Biosynthesis[edit]
Dipeptides are produced from polypeptides by the action of the hydrolase enzyme dipeptidyl peptidase.[5] Dietary proteins are digested to dipeptides and amino acids, and the dipeptides are absorbed more rapidly than the amino acids, because their uptake involves a separate mechanism. Dipeptides activate G-cells found in the stomach to secrete gastrin.
Diketopiperazines (cyclic dipeptides)[edit]
Diketopiperazines are a special class of dipeptides, which are cyclic. They form as side products in peptide synthesis. Many have been produced from non-canonical amino acids.[7]
References[edit]
- ^ a b c d Yagasaki M, Hashimoto S (November 2008). «Synthesis and application of dipeptides; current status and perspectives». Applied Microbiology and Biotechnology. 81 (1): 13–22. doi:10.1007/s00253-008-1590-3. PMID 18795289.
- ^ a b Fürst P, Pogan K, Stehle P (1997). «Glutamine dipeptides in clinical nutrition». Nutrition. 13 (7–8): 731–7. doi:10.1016/S0899-9007(97)83035-3. PMID 9263278.
- ^ Subirós-Funosas AE, Albericio F (2013). «Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe». Organic Syntheses. 90: 306. doi:10.15227/orgsyn.090.0306.
- ^ Suppo JS, de Figueiredo RM, Campagne JM (2015). «Dipeptide Syntheses via Activated α-Aminoesters». Organic Syntheses. 92: 296–308. doi:10.15227/orgsyn.092.0296.
- ^ Steane R. «Hydrolysis of a dipeptide». BioTopics. Retrieved 28 July 2014.
- ^ Borthwick AD, Liddle J (January 2013). «Retosiban and Epelsiban: Potent and Selective Orally available Oxytocin Antagonists». In Domling A (ed.). Methods and Principles in Medicinal Chemistry: Protein-Protein Interactions in Drug Discovery. Weinheim: Wiley-VCH. pp. 225–256. ISBN 978-3-527-33107-9.
- ^ Borthwick AD (July 2012). «2,5-Diketopiperazines: synthesis, reactions, medicinal chemistry, and bioactive natural products». Chemical Reviews. 112 (7): 3641–716. doi:10.1021/cr200398y. PMID 22575049.
External links[edit]
- An introduction to dipeptides at PeptideGuide.
From Wikipedia, the free encyclopedia
A dipeptide is an organic compound derived from two amino acids. The constituent amino acids can be the same or different. When different, two isomers of the dipeptide are possible, depending on the sequence. Several dipeptides are physiologically important, and some are both physiologically and commercially significant. A well known dipeptide is aspartame, an artificial sweetener.[1]
Dipeptides are white solids. Many are far more water-soluble than the parent amino acids.[1] For example, the dipeptide Ala-Gln has the solubility of 586 g/L more than 10x the solubility of Gln (35 g/L). Dipeptides also can exhibit different stabilities, e.g. with respect to hydrolysis. Gln does not withstand sterilization procedures, whereas this dipeptide does. Because dipeptides are prone to hydrolysis, the high solubility is exploited in infusions, i.e. to provide nutrition.[2]
Examples[edit]
Aspartame is produced commercially as an artificial sweetener.
Commercial value[edit]
About six dipeptides are of commercial interest.[1]
- Aspartame (N—L-α-aspartyl-L-phenylalanine 1-methyl ester) is an artificial sweetener.
- Carnosine (beta-alanyl-L-histidine) and Anserine (beta-alanyl-N-methyl histidine) are highly concentrated in muscle and brain tissues. They are used in sports medicines.
- Acetylcarnosine, cataract prevention
- Ala-Gln and Gly-Tyr, infusion[2]
- Val-Tyr, antihypertensive
Other dipeptides[edit]
- Homoanserine (N-(4-aminobutyryl)-L-histidine) is another dipeptide identified in the brain and muscles of mammals.
- Diphenylalanine is the most studied building block in peptide nanotechnology
- Kyotorphin (L-tyrosyl-L-arginine) is a neuroactive dipeptide which plays a role in pain regulation in the brain.
- Balenine [ja] (or ophidine) (beta-alanyl-N tau-methyl histidine) has been identified in the muscles of several species of mammal (including man), and the chicken.
- Glorin (N-propionyl-γ-L-glutamyl-L-ornithine-δ-lac ethyl ester) is a chemotactic dipeptide for the slime mold Polysphondylium violaceum.
- Barettin (cyclo-[(6-bromo-8-en-tryptophan)-arginine]) is a cyclic dipeptide from the marine sponge Geodia barretti.
- Pseudoproline
- Dialanine is commonly used as a model in molecular dynamics.
- Xenortides, isolated from the bacterium Xenorhabdus nematophila
Production[edit]
Synthetic dipeptides[edit]
Dipeptides are produced by coupling amino acids. The amino group on one amino acid is rendered non-nucleophilic (P in eq) and the carboxylic acid group in the second amino acid is deactivated as its methyl ester. The two modified amino acids are then combined in the presence of a coupling agent, which facilitates formation of the amide bond:
- RCH(NHP)CO2H + R’CH(NH2)CO2CH3 → RCH(NHP)C(O)NH(CHR’)CO2CH3 + H2O
Subsequent to this coupling reaction, the amine protecting group P and the ester are converted to the free amine and carboxylic acid, respectively.[3]
For many amino acids, the ancillary functional groups are protected. The condensation of the amine and the carboxylic acid to form the peptide bond generally employs coupling agents to activate the carboxylic acid.[4]
The Bergmann azlactone peptide synthesis is a classic organic synthesis for the preparation of dipeptides.[1]
Biosynthesis[edit]
Dipeptides are produced from polypeptides by the action of the hydrolase enzyme dipeptidyl peptidase.[5] Dietary proteins are digested to dipeptides and amino acids, and the dipeptides are absorbed more rapidly than the amino acids, because their uptake involves a separate mechanism. Dipeptides activate G-cells found in the stomach to secrete gastrin.
Diketopiperazines (cyclic dipeptides)[edit]
Diketopiperazines are a special class of dipeptides, which are cyclic. They form as side products in peptide synthesis. Many have been produced from non-canonical amino acids.[7]
References[edit]
- ^ a b c d Yagasaki M, Hashimoto S (November 2008). «Synthesis and application of dipeptides; current status and perspectives». Applied Microbiology and Biotechnology. 81 (1): 13–22. doi:10.1007/s00253-008-1590-3. PMID 18795289.
- ^ a b Fürst P, Pogan K, Stehle P (1997). «Glutamine dipeptides in clinical nutrition». Nutrition. 13 (7–8): 731–7. doi:10.1016/S0899-9007(97)83035-3. PMID 9263278.
- ^ Subirós-Funosas AE, Albericio F (2013). «Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe». Organic Syntheses. 90: 306. doi:10.15227/orgsyn.090.0306.
- ^ Suppo JS, de Figueiredo RM, Campagne JM (2015). «Dipeptide Syntheses via Activated α-Aminoesters». Organic Syntheses. 92: 296–308. doi:10.15227/orgsyn.092.0296.
- ^ Steane R. «Hydrolysis of a dipeptide». BioTopics. Retrieved 28 July 2014.
- ^ Borthwick AD, Liddle J (January 2013). «Retosiban and Epelsiban: Potent and Selective Orally available Oxytocin Antagonists». In Domling A (ed.). Methods and Principles in Medicinal Chemistry: Protein-Protein Interactions in Drug Discovery. Weinheim: Wiley-VCH. pp. 225–256. ISBN 978-3-527-33107-9.
- ^ Borthwick AD (July 2012). «2,5-Diketopiperazines: synthesis, reactions, medicinal chemistry, and bioactive natural products». Chemical Reviews. 112 (7): 3641–716. doi:10.1021/cr200398y. PMID 22575049.
External links[edit]
- An introduction to dipeptides at PeptideGuide.
A дипептид представляет собой органическое соединение, полученное из две аминокислоты. Составляющие аминокислоты могут быть одинаковыми или разными. Если они различны, возможны два изомера дипептида в зависимости от последовательности. Некоторые дипептиды имеют физиологическое значение, а некоторые имеют как физиологическое, так и коммерческое значение. Хорошо известным дипептидом является аспартам, искусственный подсластитель.
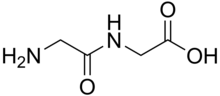
Дипептиды представляют собой белые твердые вещества. Многие из них гораздо более растворимы в воде, чем исходные аминокислоты. Например, дипептид Ala-Gln имеет растворимость на 586 г / л, что более чем в 10 раз превышает растворимость Gln (35 г / л). Дипептиды также могут обладать различной стабильностью, например в отношении гидролиза. Gln не выдерживает процедур стерилизации, в отличие от этого дипептида. Поскольку дипептиды склонны к гидролизу, их высокая растворимость используется в инфузиях, то есть для обеспечения питания.
Содержание
- 1 Примеры
- 1,1 Коммерческая ценность
- 1,2 Другие дипептиды
- 2 Производство
- 2,1 Синтетические дипептиды
- 2.2 Биосинтез
- 3 Дикетопиперазины (циклические дипептиды)
- 4 Ссылки
- 5 Внешние ссылки
Примеры

Коммерчески значение
Примерно шесть дипептидов представляют коммерческий интерес.
- Аспартам (N- L -α-аспартил- L -фенилаланин 1-метиловый эфир) представляет собой искусственный подсластитель.
- Карнозин (бета-аланил- L -гистидин) и ансерин (бета-аланил-N-метилгистидин) высоко концентрируется в мышцах и тканях мозга. Они используются в спортивных лекарствах.
- Ацетилкарнозин, профилактика катаракты
- и инфузия
- , антигипертензивные
Другие дипептиды
- (N- (4-аминобутирил) — L -гистидин) представляет собой другой дипептид, идентифицированный в мозге и мышцах млекопитающих.
- Киоторфин (L-тирозил- L -аргинин) представляет собой нейроактивный дипептид, который играет роль в регуляции боли в головном мозге.
- [ja ] (или офидин) (бета-аланил-N тау-метилгистидин) был обнаружен в мышцах нескольких видов млекопитающих (включая человека), и курица.
- (N-пропионил-γ- L -глутамил- L -орнитин-δ-лак этиловый эфир) представляет собой хемотаксический дипептид для слизистой плесени Polysphondylium violaceum.
- Бареттин (цикло — [(6-бром-8-ен-триптофан) -аргинин]) представляет собой циклический дипептид из морской губки Geodia barretti.
- Псевдопролин
- обычно используется в качестве модели в Молекулярная динамика.
Производство
Синтетические дипептиды
Дипептиды производятся связыванием аминокислот. Аминогруппа одной аминокислоты становится ненуклеофильной (P в экв.), А группа карбоновой кислоты во второй аминокислоте дезактивируется как ее метиловый эфир. Затем две модифицированные аминокислоты объединяют в присутствии связующего агента, который облегчает образование амидной связи:
- RCH (NHP) CO 2 H + R’CH (NH 2) CO 2CH3→ RCH (NHP) C (O) NH (CHR ‘) CO 2CH3+ H 2O
После этой реакции сочетания аминозащитная группа P и сложный эфир превращаются в свободную амин и карбоновая кислота, соответственно.
Для многих аминокислот вспомогательные функциональные группы защищены. В конденсации амина и карбоновой кислоты с образованием пептидной связи обычно используются связывающие агенты для активации карбоновой кислоты.
Синтез азлактонового пептида Бергмана представляет собой классический органический синтез для получения дипептидов.
Биосинтез
Дипептиды производятся из полипептидов под действием фермента гидролаза дипептидилпептидаза. Пищевые белки перевариваются до дипептидов и аминокислот, и дипептиды всасываются быстрее, чем аминокислоты, поскольку их поглощение включает отдельный механизм. Дипептиды активируют G-клетки, обнаруженные в желудке, чтобы секретировать гастрин.
Дикетопиперазины (циклические дипептиды)

Дикетопиперазины представляют собой особый класс дипептидов, которые являются циклическими. Они образуются как побочные продукты при синтезе пептидов. Многие из них были получены из неканонических аминокислот.
Ссылки
Внешние ссылки
- Введение в дипептиды в PeptideGuide.
Практическое занятие
«Составление
полипептидных цепей из аминокислот»
Цель: научиться
составлять уравнения реакций поликонденсации пептидной связи.
Планируемый результат обучения:
обучающийся должен уметь:
— называть:
изученные вещества по тривиальной или международной номенклатуре;
— определять: принадлежность веществ к разным классам органических соединений;
— характеризовать:
строение изученных органических соединений;
— объяснять: зависимость свойств
веществ от их состава и строения, природу химической связи;
— проводить: самостоятельный
поиск химической информации с использованием различных источников
(научно-популярных изданий, компьютерных баз данных, ресурсов Интернета);
использовать компьютерные технологии для обработки и передачи химической
информации и ее представления в различных формах.
Обучающийся должен знать/понимать:
— важнейшие химические понятия: вещество, углеродный скелет, функциональная группа, изомерия;
— основные теории химии: химической связи, строения органических соединений;
— важнейшие вещества и материалы: аминокислоты,
белки.
Оборудование и материалы: таблицы и схемы по тематике.
Теоретическая
часть
Белки
(протеины, полипептиды) — высокомолекулярные органические вещества,
состоящие из соединённых в цепочку пептидной связью α-аминокислот.
В
живых организмах аминокислотный состав белков определяется генетическим кодом,
при синтезе в большинстве случаев используется 20 стандартных аминокислот.
Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме
того, аминокислоты в составе белка часто подвергаются посттрансляционным
модификациям, которые могут возникать и до того, как белок начинает выполнять
свою функцию, и во время его «работы» в клетке. Часто в живых организмах
несколько молекул белков образуют сложные комплексы, например,
фотосинтетический комплекс.
В пептидах остатки
аминокислот соединены пептидными звеньями.
По числу аминокислотных остатков различают
олигопептиды (ди-, три-, тетрапептиды и т.д.) и полипептиды, содержащие более
10 аминокислотных остатков. В состав олигопептидов могут входить остатки
аминокислот, не встречающиеся в белках, например β-аминокислот, а также
фрагменты неаминокислотной природы. К пептидам относятся многие природные
биологически активные вещества, в том числе гормоны, регуляторы иммунитета,
антибиотики, токсины. Природные полипептиды с молекулярной массой более 6000
называю белками.
Молекула пептида представляет собой
линейную или разветвленную цепь с аминогруппой (-NH2) на одном и карбоксильной
группой (- СООН) на другом конце цепи. Встречаются пептиды с
замкнутой цепью-циклопептиды.
Аминокислотный остаток пептида, несущий
свободную аминогруппу, называют N-концевым, а несущий свободную карбоксильную группу-С-концевым. Название
пептида образуется из названий входящих в его состав аминокислотных остатков,
перечисляемых последовательно, начиная с N-концевого. При
этом используют тривиальные названия аминокислот, в которых окончание «-ин»
заменяется на «-ил». Название С-концевого остатка совпадает с названием
соответствующей аминокислоты.
Все аминокислотные остатки, входящие
в полипептид, нумеруются, начиная с N-конца.
Длина связи С-N
(0,132 нм) в пептидном фрагменте меньше, чем длина одинарной связи С-N (0,147 нм). Это говорит об увеличении кратности связи за счет
сопряжения с карбонильной группой. Результатом является затрудненность
свободного вращения вокруг нее.
Упрощенно синтез полипептидов можно представить как последовательное
взаимодействие соответствующих аминокислот. Так, из глицина, аланина и цестеина
образуется трипептид глицил-алнил-цистеин:
Практическая часть
Задание 1. Первый
олигопептид был получен из мясного фарша и поэтому назван карнозином (от
латинского carnis-мясо).
Дипептид карнозин представляет собой
β-аланил-гистидин. Его химическую формулу в 1900 г. Определили профессор
Московского университета В.С. Гулевич и его ученик С. Амираджиби. Напишите ее.
Задание 2. Составьте
уравнения реакций, отражающие схему синтеза аланил-серил-фенил-аланил-глицина.
Задание 3.
Напишите формулы и названия веществ, образующихся при гидролизе соединения
Задание 4. Составьте
уравнения реакций, отражающие схему синтеза из 11 аминокислотных остатков.
Критерии оценки
практического занятия
Оценка «5»: все 4 задания
выполнены верно.
Оценка «4»: выполнено 4
задания с незначительными ошибками.
Оценка «3»: выполнено 3
задания верно.
Оценка «2»: выполнено
меньше 3-х заданий верно.
Оценка «1»: не приступил
к практической части занятия.



