Научные исследования в области медицины можно описать как «спланированные и систематизированные действия, направленные на получение достоверных данных для решения разных медицинских проблем, используя данные с высокой степенью точности» [1]. Получается, что цель медицинских исследований – это приобретение знаний, обладающих не только научной, но и практической значимостью для отдельного человека и общества в целом. Это накладывает большую ответственность на исследователя. Однако ученые порой забывают, что необходимым условием качественного исследования является тщательное планирование его дизайна. Ведь если ошибки, допущенные при статистической обработке данных, можно исправить, дизайн проведенного исследования изменить нельзя. Некачественное планирование дизайна является одной из главных причин отклонения рукописей научными журналами и одной из ключевых проблем исследований, проводимых российскими аспирантами [2].
При планировании исследования особого внимания заслуживают следующие два фактора. Первый и наиболее значимый фактор – точная формулировка научной гипотезы на основании тщательного изучения опубликованных работ и выявления существующих пробелов в исследуемой области [3]. Изучаемый вопрос должен соответствовать этическим нормам и обладать научной новизной, актуальностью и практической значимостью. Однако часто исследователи тратят свое время, силы и прочие ресурсы на решение уже изученных проблем или, наоборот, формулируют гипотезу, которую на практике проверить очень сложно. Иногда авторы не уделяют должного внимания этическими аспектам проведения и публикации исследований.
Второй важный этап планирования исследования – выбор типа дизайна. Он зависит от цели и задач исследования, которые бывают следующими: изучение этиологии и факторов риска, заболеваемости, распространенности, выживаемости, качества скрининговых процедур и диагностических тестов, эффективности и безопасности лечебных и профилактических вмешательств, показателей исходов, сообщаемых пациентами. Дизайны исследований различаются по простоте, доступности, времени и другим ресурсам, необходимым для их планирования и проведения. Цель данного обзора – описать ключевые моменты в планировании исследований, различия между наиболее частыми типами дизайна исследований, особенности их применения и недостатки. Кроме того, в тексте даны ссылки на руководства по оформлению дизайна основных видов исследований в клинической медицине.
Терминология
Ниже представлены определения некоторых терминов, которые используются в данном обзоре.
Субъект – это лицо (пациент), участвующее в исследовании.
Проспективные и ретроспективные исследования. В проспективных исследованиях группа субъектов наблюдается в течение заранее определенного периода времени, по истечении которого оценивается, наступил исход или нет. В ретроспективных исследованиях для уже известных исходов собирается информация (например, по данным медицинской документации) о воздействиях (факторах риска) в прошлом. Более сложным видом являются двунаправленные исследования, которые включают проспективную и ретроспективную фазы.
Показатель распространенности (превалентность) отражает встречаемость среди определенного населения в данный период времени изучаемого явления, независимо от давности его появления. Показатель распространенности выражают в процентах (например, 10%, то есть 10 человек из 100) или количестве случаев на 1000, 10 000 или 100 000 человек.
Показатель заболеваемости (инцидентность) отражает частоту вновь выявленных случаев изучаемого заболевания среди определенного населения за данный период времени. Показатель заболеваемости выражают в количестве новых случаев на 1000, 10 000 или 100 000 человек за определенный период времени, например 10 случаев на 1000 человек в год.
Ассоциация – взаимосвязь двух переменных (например, воздействующего фактора и исхода), которая не всегда подразумевает наличие причинно-следственной связи.
Причинно-следственная связь означает, что действие изучаемого фактора приводит к развитию исхода.
Систематическая ошибка (смещение, bias) представляет собой смещение в оценке результатов исследования из-за фактора, который не учитывался в статистическом анализе. Другими словами, bias – это тенденция переоценить или недооценить изученный параметр. Систематическая ошибка может возникнуть в любом исследовании и на любом этапе – от сбора данных до статистического анализа результатов [4].
Конфаундинг – это искажение эффекта изучаемого воздействия на исход, вносимое одним или несколькими вмешивающимися факторами (конфаундерами). Основной причиной конфаундинга является связь конфаундера как с изучаемым фактором, так и с исходом (рис. 1). Систематическая ошибка, вызванная присутствием вмешивающегося фактора, называется ошибкой конфаундинга.
FIG. 1. Illustration of confounding.
РИС. 1. Пример конфаундинга.
Note: statistical analysis showed that coffee consumption is a significant risk factor for heart disease occurrence. However, available evidence suggests that many subjects who regularly drink coffee are also smokers. In reality, smoking is the true risk factor of heart diseases development, but if the results of the study would not be adjusted for a potential confounder this may lead to significant bias – and the effect of coffee consumption on the occurrence of the heart diseases would be overestimated.
Примечание: представим, что по результатам некоторого статистического анализа чрезмерное употребление кофе является достоверным фактором риска сердечно-сосудистых заболеваний (ССЗ). При этом известно, что многие люди, регулярно употребляющие кофе, также являются курильщиками. Курение – один из истинных факторов риска ССЗ. Таким образом, если при статистическом анализе не сделать поправку на курение (стандартизацию по курению), можно допустить систематическую ошибку и влияние употребления кофе на развитие ССЗ будет переоценено.
Систематическая ошибка отбора – ошибка, вызванная различиями в исходных характеристиках участников сравниваемых групп. Такие различия между группами (речь не идет об изучаемом факторе или вмешательстве) могут существенно влиять на результаты исследования. Систематическую ошибку отбора можно избежать с помощью случайного распределения участников между группами воздействия и контроля (рандомизации).
Систематическая ошибка проведения исследования обусловлена различиями в уходе, оказываемом участникам исследования, за исключением сравниваемых методов лечения.
Систематическая ошибка измерения возникает из-за ошибок в измерении количественных признаков, например показателей биохимического анализа крови.
Систематическая ошибка памяти характерна для ретроспективных исследований и появляется вследствие неточных или неполных воспоминаний участников о прошлых событиях.
Систематическая ошибка наблюдателя возникает в тех случаях, когда исследователь знает, какая группа является экспериментальной, а какая – контрольной. В этом случае исследователь может придавать чрезмерное значение изменениям, которые он ожидает получить, и не замечать изменения, которые он не ожидает. Систематическую ошибку наблюдателя можно ограничить маскированием («двойным ослеплением»), при котором о характере проводимого вмешательства не будет знать ни исследователь, ни участник.
Систематическая ошибка информации – это погрешность в измерении воздействия или исхода, связанная, например, с неверным распределением участников на группы «случай» (заболевание) и «контроль» (без заболевания). Попадание участников с заболеванием в группу контроля может отразиться на характеристиках диагностического теста (например, чувствительности и специфичности).
Систематическая ошибка времени возникает при установлении неверной последовательности событий и приводит к ложному заключению о причинно-следственной связи. Данный вид ошибок преимущественно встречается в ретроспективных исследованиях.
Систематическая ошибка выбывания возникает, когда участники не доходят до конца исследования. Выбывание любого числа участников из экспериментальной или контрольной групп может менять их характеристики. Schulz и Grimes [5] считают, что потеря из исследования 5% участников не приводит к систематической ошибке, 5–20% – может стать причиной смещения результатов, а более 20% участников – сопряжено с высокой вероятностью систематической ошибки.
Систематическая ошибка публикации возникает в том случае, когда решение о публикации исследования принимается исходя из результатов работы. Например, исследования, содержащие статистически значимые результаты, имеют большие шансы быть опубликованными, чем исследования без них.
КЛАССИФИКАЦИЯ НАУЧНЫХ ИССЛЕДОВАНИЙ
Существуют различные классификации научных исследований в зависимости от способа сбора данных, цели (описательные и аналитические), наличия причинно-следственной связи между фактором и исходом и др. (рис. 2).
FIG. 2. Classification of study design in medicine.
РИС. 2. Классификация медицинских исследований.
Фундаментальные исследования
Фундаментальные (экспериментальные) исследования – это исследования, которые раскрывают причинно-следственные связи между изменением независимой переменной и ее влиянием на зависимую переменную в строго контролируемых условиях. Они применяются в разработке и совершенствовании аналитических процедур, включая биохимические и генетические тесты, методы инструментальной диагностики и статистического анализа. Фундаментальные исследования также включают эксперименты на животных, исследования клеточных культур, генетические, биохимические, фармакологические и физиологические эксперименты (см. пример [6] в таблице 1). При проведении фундаментальных исследований необходимо точно определить их условия, включая вид экспериментальных животных, количество животных в каждой группе, дозу тестируемого лекарственного препарата и т. д. [7]. Это позволит устранить влияние конфаундеров, повысить внутреннюю валидность исследования и снизить риск систематических ошибок. Однако внешняя валидность таких исследований (возможность обобщить выявленную связь на клинические ситуации) зачастую ограничена. Для проведения и представления результатов фундаментальных исследований с участием животных разработан ряд рекомендаций, одной из которых является руководство ARRIVE (Animal Research: Reporting Of In Vivo Experiments, исследования на животных: отчетность об экспериментах in vivo)1 [8].
Наблюдательные исследования
В ходе наблюдательных исследований исследователь никак не вмешивается в ход событий и не влияет на участников и изучаемые факторы. При этом результаты таких исследований, в отличие от фундаментальных, ближе к условиям реальной клинической практики. Наблюдательные исследования могут быть описательными и аналитическими. Описательные исследования представляют собой наблюдения отдельных клинических случаев или когорты, а аналитические – изучение взаимосвязи между фактором и исходом (рис. 1). В большинстве случаев в наблюдательных исследованиях используются описательные и аналитические приемы одновременно. К этому типу исследований относятся: описание клинического случая или серии, исследование «случай-контроль», а также поперечные, когортные и экологические исследования.
Описание клинического случая или серии случаев
Описание клинического случая используется для представления редких клинических наблюдений отдельного пациента (см. пример [9] в табл. 1) или серии случаев (см. пример [10] в табл. 1). Данные исследования являются наиболее простыми, поскольку не требуют наличия контрольной группы, вместе с этим они должны содержать четкую и подробную информацию о течении заболевания каждого пациента, чтобы читатели могли применить представленный опыт в своей практике. При описании серии случаев характеристики всех пациентов должны быть представлены одинаковым образом, для анализа используются методы дескриптивной (описательной) статистики с представлением дискретных данных (например, «есть» или «нет» признак) в виде абсолютного числа и доли от общего числа) и непрерывных данных (например, показатель систолического артериального давления или уровня креатинина в сыворотке крови) в виде среднего значения со стандартным отклонением или медианы с интерквартильным размахом.
Таблица 1. Примеры различных дизайнов исследований в опубликованных статьях (полные тексты всех статей были в открытом доступе на момент подачи рукописи)
Table 1. Examples of different study designs in the published articles (free full text was available for all articles at the time of manuscript submission)
|
Дизайн исследования |
Публикация |
Результаты |
|
Фундаментальное |
Krieger N.S. et al. [6] |
У растущих мышей c отсутствием протон-чувствительных рецепторов рака яичников OGR1 наблюдалось более быстрое формирование и резорбция костной ткани, чем у мышей с диким типом OGR1. Результаты работы свидетельствуют о роли OGR1 в костеобразовании в условиях ацидоза |
|
Описание клинического случая |
Shaigany S. et al. [9] |
Авторы представили первый клинический случай Кавасаки-подобного мультисистемного воспалительного синдрома, ассоциированного с COVID-19, у взрослого пациента мужского пола, который ранее был описан только у детей |
|
Описание серии клинических случаев |
Centers for Disease Control and Prevention [10] |
Опубликована серия случаев пневмоцистной пневмонии у прежде здоровых гомосексуальных мужчин. В этой работе содержится первое официальное упоминании о заболевании, получившем позже название ВИЧ-инфекция/СПИД |
|
Поперечное |
Mokdad A.H. et al. [12] |
В данном поперечном исследовании, проведенном с помощью телефонного интервьюирования, была продемонстрирована высокая распространенность ожирения и сахарного диабета среди взрослых людей, проживающих в США. Была обнаружена устойчивая связь между ожирением и наличием сахарного диабета, артериальной гипертензии, гиперлипидемии и другими значимыми факторами риска |
|
Экологическое |
Shaposhnikov D. et al. [16] |
Авторы продемонстрировали влияние высокой температуры воздуха и его загрязнения на повышение уровня смертности, не обусловленной несчастными случаями, во время аномальной жары и лесных пожаров в Москве в 2010 году |
|
Случай-контроль |
D’Souza G. et al. [17] |
Сравнение 100 пациентов с впервые диагностированным раком ротоглотки с 200 пациентами без рака показало устойчивую связь между наличием вируса папилломы человека и развитием рака ротоглотки, независимо от других известных факторов риска |
|
Проспективное когортное |
Rico-Campà A. et al. [19] |
В исследовании с участием 19 899 человек, которые обследовались каждые два года в период с 1999 по 2014 г., было показано, что употребление ультраобработанных продуктов повышает риск смерти от всех причин |
|
Ретроспективное когортное |
De Blok C.J.M. et al. [20] |
В данном исследовании было показано, что риск развития рака молочной железы у трансгендерных женщин выше, |
|
Пред- и постэкспериментальное |
Chauhan K. et al. [21] |
В результате проведенного исследования наблюдалось повышение приверженности к гигиене рук студентов-медиков и улучшение их знаний по этой проблеме |
|
Нерандомизированное контролируемое |
Agusti A. et al. [22] |
По результатам исследования не получено данных об эффективности гидроксихлорохина в отношении элиминации вируса и регресса клинических симптомов у медицинских работников со среднетяжелой формой COVID-19 |
|
Рандомизированное контролируемое |
Wiviott S.D. et al. [23] |
У пациентов с сахарным диабетом 2-го типа, получавших ингибитор SGLT2 дапаглифлозин, частота серьезных побочных явлений со стороны сердечно-сосудистой системы была такой же, как и в контрольной группе, однако частота госпитализаций по поводу сердечной недостаточности – ниже |
|
Систематический обзор |
Coughlin S.S. et al. [25] |
Важное влияние на риск развития острого инфаркта миокарда и выживаемость оказывают такие социальные факторы, как материальное неблагополучие, статус иммигранта, отсутствие социальной поддержки и социальная изоляция |
|
Систематический обзор и метаанализ |
Wang B. et al. [26] |
По данным 42 исследований, наличие у пациентов с COVID-19 хронической болезни почек и развитие острого почечного повреждения статистически значимо повышает риск тяжелого течения инфекции и смерти |
Примечание / Note: OGR1 – G-protein-coupled receptor 1, рецептор 1, связанный с G-белком; COVID-19 – COrona VIrus Disease 2019, коронавирусное заболевание 2019 года; ВИЧ / СПИД, вирус иммунодефицита человека / синдром приобретенного иммунодефицита, HIV/AIDS–Human Immunodeficiency Virus /Acquired Immunodeficiency syndrome; SGLT2 – sodium-glucose cotransporter-2, натрий-глюкозный котранспортер 2-го типа.
Цель данных исследований – сформулировать гипотезу для планирования испытаний с более сложным дизайном, а также информировать профессиональное сообщество о новых заболеваниях. Данные исследования отличаются простотой, дешевизной и доступностью для выполнения в медицинских учреждениях, а также возможностью использовать ретроспективные данные. Их недостатком является отсутствие группы сравнения и систематическая ошибка отбора случаев, которые наиболее часто представляют собой наиболее типичные или наиболее атипичные примеры заболевания, что приводит к плохой обобщаемости результатов на общую популяцию (низкая внешняя валидность).
Для повышения точности, открытости (транспарентности) и практической значимости описаний клинических случаев и серии случаев разработано руководство CARE2 (CAse REports, описание случаев) [11].
Поперечные (одномоментные) исследования
Поперечные исследования (одномоментные, исследования распространенности) применяются для оценки распространенности заболеваний, факторов риска, исходов и других показателей в конкретной популяции в определенный момент времени (см. пример [12] в табл. 1). Распространенность интересующего события в данных исследованиях оценивается как отношение количества людей с данным событием (например, с хронической болезнью почек) в определенный момент времени к общему количеству людей в группе риска. Для проведения одномоментных исследований определяют исследуемую популяцию, создают из нее выборку и исследуют наличие или отсутствие в ней интересующего события. Выборка должна быть репрезентативной, то есть каждая комбинация лиц в общей популяции должна иметь равную вероятность быть выбранной для достижения адекватного представительства в исследуемой выборке. Для этого применяется рандомизация. Однако в некоторых случаях допускается создание «удобных выборок» из пациентов, с которыми легко связаться или вызвать на осмотр. Еще одно важное требование для одномоментных исследований заключается в необходимости точного и ясного определения исследуемого заболевания и методов его диагностики. Все пациенты должны быть обследованы по единому алгоритму с помощью опроса, изучения архивной электронной документации, инструментальной диагностики и т. д. Распространенность события в одномоментных исследованиях представляют в виде процента или числа выявленных случаев к общему числу человек (например, к 1000 или 100 000 человек) с 95% доверительным интервалом (ДИ).
Во многих случаях в поперечных исследованиях (опросах) также собираются данные о распространенности воздействия факторов, которые могут быть ассоциированы с исходом заболевания [13]. Например, путем обследования каждого участника можно изучить распространенность в выборке курения (фактор риска) и сердечно-сосудистых заболеваний (исход). В результате каждый человек из выборки попадет в одну из четырех групп: а) лица с фактором риска и исходом; б) лица с фактором риска, но без исхода; в) лица без фактора риска, но с исходом; г) лица без фактора риска и исхода. Распределение участников можно представить в четырехпольной таблице, в строках которой будет указано наличие или отсутствие фактора риска, а в столбцах – заболевания (или другого исхода) (табл. 2).
Таблица 2. Четырехпольная таблица
Table 2. 2×2 contingency table
|
Заболевание есть |
Заболевания нет |
Всего |
|
|
Фактор риска есть |
a |
b |
a + b |
|
Фактора риска нет |
c |
d |
c + d |
|
Всего |
a + c |
b + d |
N |
С помощью этих четырех переменных можно рассчитать значения следующих параметров:
- общее количество лиц с наличием фактора риска: a + b;
- общее количество лиц без фактора риска: c + d;
- общее количество лиц с заболеванием (исходом): a + c;
- общее количество лиц без заболевания (исхода): b + d;
- общее количество лиц в исследовании (N): a + b + c + d;
- распространенность заболевания среди лиц с фактором риска и без него: a/(a+b) и c/(c+d) соответственно;
- распространенность фактора риска среди лиц с заболеванием и без него: a/(a+c) и b/(b+b) соответственно.
Для того чтобы оценить влияние факторов риска на развитие заболевания (исхода) с помощью логистической регрессии, можно рассчитать отношение шансов (ОШ) или относительный риск (ОР) и 95% ДИ. Для вычисления ОШ и ОР используются статистические программы (R, SPSS и другие) и онлайн-калькуляторы3 4. Особенностям расчета этих показателей будет посвящен отдельный обзор.
Поперечные исследования широко применяются для планирования общественного здравоохранения, при анализе факторов риска распространенных заболеваний, а также разработке гипотез для последующих исследований. Однако они не предоставляют данных о причинно-следственных связях, а только описывают ассоциации. Поперечные исследования менее подвержены систематической ошибке по сравнению с описанием серии случаев. Кроме того, поперечные исследования проводятся на репрезентативных выборках, так как они отбираются из генеральной совокупности или другой изучаемой популяции (например, работники тяжелой промышленности). Однако в результате этого генерализация ограничивается выбранной популяцией, что приводит к систематической ошибке отбора.
Одним из важных недостатков таких исследований является невозможность определить последовательность событий (что появилось сначала – действие фактора риска или наблюдаемый исход) и сделать однозначный вывод о причинно-следственной связи между ними. Однако можно попробовать устранить этот недостаток, применяя опросник для сбора данных, в котором используется временнáя шкала для оценки фактора риска и исхода. К преимуществам данных исследований относятся сохранение исходного количества участников на протяжении всего наблюдения (что нехарактерно для продольных исследований), быстрота выполнения и относительно низкие затраты. Однако все это актуально только в отношении распространенных заболеваний.
Поперечные исследования не подходят для изучения редких заболеваний (их определение варьирует, по мировым данным составляя в среднем 40–50 случаев на 100 000 населения [14], по данным в России – 10 случаев на 100 000 населения5), поскольку это требует создания очень большой выборки, для таких заболеваний проводятся исследования «случай-контроль». Не подходят они и для изучения распространенных, но коротких по продолжительности заболеваний (например, инфекционных заболеваний дыхательных путей), так как их лучше всего характеризует показатель заболеваемости. Заболеваемость в поперечных случаях оценить невозможно, потому что они основаны на данных о существующих случаях и не включают данные о новых случаях заболеваний.
Более подробно с рекомендациями по проведению поперечных исследований можно ознакомиться в руководстве STROBE (The Strengthening the Reporting of Observational Studies in Epidemiology, укрепление отчетности в наблюдательных исследованиях в эпидемиологии)6 [15].
Экологические исследования
Экологические (корреляционные) исследования исследуют ассоциации между возникновением заболевания и воздействием потенциального фактора риска. Однако показатели заболеваемости и воздействия измеряются не у отдельных пациентов, а в нескольких популяциях или сообществах (см. пример [16] в таблице 1). Для анализа используются вторичные данные, полученные в популяционных исследованиях и статистических отчетах, поэтому экологические исследования характеризуются быстротой и простотой выполнения и возможностью включения больших выборок. Однако результаты таких исследований не предоставляют данных о воздействии фактора риска и исходе для отдельного человека. Это может привести к ошибке интерпретации, когда выводы, полученные на уровне совокупности людей, переносятся на индивидуальный уровень (экологическая ошибка). Кроме того, в экологических исследованиях практически невозможно контролировать действие конфаундеров и без дополнительных исследований доказать причинно-следственные связи между явлениями.
Исследования «случай-контроль»
Исследования «случай-контроль» проводятся для ретроспективного анализа пациентов с наличием или отсутствием определенного исхода (см. пример [17] в таблице 1). Лица с исходом образуют основную группу, а лица без исхода – контрольную (рис. 3). Основной принцип данных исследований заключается в сравнении двух групп и выявлении статистически значимых различий по частоте или выраженности потенциальных факторов риска. Для исключения влияния конфаундеров обе группы должны быть максимально сопоставимы по как можно большему количеству параметров за исключением исследуемых.
FIG. 3. Schematic diagram of a case-control study design.
РИС. 3. Схема исследования «случай-контроль».
Note: data analysis in case-control studies is usually performed in a similar way to cross-sectional surveys, where all subjects are divided into four groups depending on the presence of diseases (outcomes) and potential risk factors (see cross-sectional studies section). The association between risk factors and outcomes is represented by the odds ratio or relative risk with 95% confidence interval.
Примечание: в исследованиях «случай-контроль» (как и в одномоментных исследованиях) все участники распределяются по четырем группам в зависимости от наличия заболевания (исхода) и потенциального фактора риска (см. раздел «Одномоментные исследования»). Взаимосвязь между фактором риска и исходом выражается в виде ОШ или ОР с 95% ДИ.
Одна из проблем появления систематических ошибок в исследованиях «случай-контроль» – нерепрезентативность случаев. Такое происходит, например, когда в исследование включают госпитализированных пациентов, течение заболевания у которых отличается от проходящих лечение с аналогичным заболеванием в амбулаторных условиях. Другая проблема заключается в нерепрезентативности группы контроля, характеристики которой должны соответствовать характеристикам лиц без изучаемого исхода. В теории систематическую ошибку, связанную с данной проблемой, можно устранить с помощью рандомизации, однако на практике рандомизация не всегда осуществима. В некоторых случаях решить проблему нерепрезентативности можно путем включения участников, находящихся в одних и тех же условиях, в основную и контрольную группы. Например, если случаи выбираются среди пациентов, госпитализированных в больницу, контроли могут быть выбраны из пациентов, госпитализированных в ту же больницу по причинам, отличным от исследуемого исхода. Наконец, для обеих групп методы сбора данных должны быть идентичными, а определения понятий «исхода» и «факторов риска» ясными и точными.
Исследования «случай-контроль» не требуют большого числа наблюдений в отличие от других видов исследований, поэтому наиболее эффективны для изучения факторов риска редких заболеваний. Другой особенностью данных исследований является возможность оценить влияние на исход сразу нескольких факторов риска. Соблюдая основные правила проведения исследований «случай-контроль», можно избежать воздействия конфаундеров. Однако в реальной практике зачастую трудно получить полную и достоверную информацию о факторах риска за длительный период времени. Поэтому в данных исследованиях нередко возникают систематические ошибки памяти, выборки и другие, что может приводить к конфаундингу. Тем не менее хорошо спланированные исследования «случай-контроль» могут служить доказательством ассоциации между фактором риска и исходом. Кроме того, в исследованиях «случай-контроль» нельзя оценить распространенность заболевания, в отличие от одномоментных исследований. Рекомендации по проведению исследований «случай-контроль» приведены в руководстве STROBE [15].
Отдельным вариантом исследования «случай-контроль» является исследование методом вложенной выборки (nested case–control study, гнездовое исследование «случай-контроль»). Этот вид исследования проводится в рамках уже имеющегося когортного исследования (см. раздел «Когортные исследования»), что позволяет экономить время и материальные ресурсы, используя ранее собранные данные.
Другой вид исследований с дизайном, подобным «случай-контроль», – изучение диагностической точности, в котором эффективность нового метода диагностики сравнивается с общепризнанным «золотым стандартом». Рекомендации по проведению и описанию исследований по оценке диагностической точности приведены в руководстве STARD7 (STAndards for Reporting Diagnostic Accuracy, стандарты отчетности о точности диагностики) [18].
Когортные исследования
Когорта представляет собой группу лиц, объединенных некоторыми общими признаками, факторами риска или исходами. В когортных исследованиях отбирают участников на основе статуса воздействия на них фактора риска в настоящий момент и наблюдают за развитием в ней исходов в течение определенного времени (проспективное исследование) либо используют данные, созданные до развития исхода (ретроспективное исследование) (см. примеры [19, 20] в таблице 1). Таким образом, когортные исследования позволяют проследить влияние потенциального фактора риска на развитие заболевания или другого исхода. В отличие от исследований «случай-контроль», в когортных исследованиях распределение участников по группам происходит в зависимости от наличия воздействующего фактора, а не исхода (рис. 4).
FIG. 4. Schematic diagram of a prospective cohort study design.
РИС. 4. Схема проспективного когортного исследования.
Проспективное когортное исследование является золотым стандартом наблюдательных исследований. Как и в других типах исследований, в нем необходимо ясно и точно обозначить факторы риска и исходы и однотипно изучить их наличие у всех испытуемых. Кроме того, отобранная когорта должна быть репрезентативной. Одним из недостатков когортных исследований является их продолжительность: изучаемые заболевания могут развиваться годами и десятилетиями, а критерии для их диагностики со временем могут измениться. Другой недостаток, который может привести к систематической ошибке, заключается в не изменяющемся воздействии фактора риска в исследовании, что противоречит реальной действительности. Например, уровень холестерина в крови, артериального давления, статус курения являются динамическими показателями и требуют поправки, чтобы не допустить систематической ошибки.
Ретроспективные (исторические) когортные исследования могут быть выполнены, если имеется доступ к подробной и надежной медицинской документации больших групп людей. В этом случае течение заболевания от воздействия фактора риска до исхода может быть изучено в одно и то же время. Однако при проведении таких исследований есть высокий риск систематической ошибки информации, связанной с неточностями в архивных данных.
Взаимосвязь между фактором риска и исходом можно оценить с помощью построения четырехпольной таблицы и расчета ОШ или ОР. В когортных исследованиях известно точное время возникновения исхода в каждом конкретном наблюдении, что позволяет рассчитать не только распространенность заболевания, но и заболеваемость и отношение рисков (hazard ratio) с 95% ДИ. Последние два показателя в исследованиях «случай-контроль» не рассчитываются. Преимуществами когортных исследований является то, что они менее подвержены систематическим ошибкам, а также дают возможность за одно исследование проследить взаимосвязь множества факторов риска и исходов. Однако проспективные когортные исследования являются дорогостоящими и трудоемкими. Такие исследования не подходят для изучения редких заболеваний, но могут применяться для анализа воздействия на исход нечастых факторов. Рекомендации по описанию когортных исследований приведены в руководстве STROBE [15].
Экспериментальные исследования
В экспериментальных (интервенционных) исследованиях проводится сравнение экспериментальной группы, участникам которой назначают определенное лечение (или иное вмешательство) с контролем, получающим другое лечение или плацебо. Данные исследования применяются для выявления причинно-следственной связи между явлениями. Иногда при описании таких исследований используют термин «испытание». Среди экспериментальных исследований выделяют пред- и постэкспериментальные, нерандомизированные контролируемые и рандомизированные контролируемые исследования. Рекомендации по дизайну, проведению, анализу и оценке клинических (интервенционных) исследований приведены в руководстве ICH (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к фармацевтическим препаратам для человека)8.
Пред- и постэкспериментальные исследования (исследования с самоконтролем, исследования до и после)
В пред- и постэкспериментальных исследованиях изучается развитие исхода до и после вмешательства (см. пример [21] в таблице 1). Такие исследования включают всего одну группу пациентов, в которой исход оценивается до и после вмешательства. Таким образом, исследуемая группа является одновременно и экспериментальной, и контрольной. Целью пред- и постэкспериментальных исследований является сравнить качественные и количественные признаки в группе до и после вмешательства и сделать вывод о причинно-следственной связи между вмешательством и исходом. Однако в таких исследованиях невозможно контролировать другие факторы, которые могут влиять на результат и в то же время непредсказуемо изменяться.
Нерандомизированные контролируемые исследования (НКИ)
В НКИ сравнивают исходы пациентов экспериментальной группы, которые получали изучаемое вмешательство, с исходами контролей, которым вмешательство не проводилось (см. пример [22] в таблице 1). При этом распределение участников по группам происходит по воле исследователя или самого участника, то есть без рандомизации. НКИ достаточно просты в проведении и позволяют выявить причинно-следственную связь между вмешательством и исходом. Однако в связи с отсутствием рандомизации такие исследования подвержены различным систематическим ошибкам.
Рандомизированные контролируемые исследования (РКИ)
При проведении РКИ однородную группу участников распределяют по двум отдельным группам случайным образом (рандомно). Участникам одной группы проводится исследуемое вмешательство, после чего исходы обеих групп сравниваются между собой (см. пример [23] в таблице 1). Одним из важных условий для получения достоверных результатов является качественная рандомизация. Теоретически сравниваемые группы должны быть максимально сопоставимы по всем потенциальным конфаундерам (возраст, пол, сопутствующая терапия, тяжесть и длительность заболевания и т. д.) за исключением изучаемого вмешательства. Однако на практике обеспечить такую сопоставимость довольно сложно.
К другим методам, позволяющим наряду с рандомизацией повысить качество РКИ, относятся следующие: сокрытие распределения, процедура маскирования («ослепление»), анализ «по намерению лечить» (проводится из допущения, что все пациенты получили лечение в соответствии с распределением в группы), одновременное обследование обеих групп и т. д. РКИ являются довольно затратными по финансовым, временным ресурсам и требуют значительного количества квалифицированных исследователей. Однако именно РКИ (при надлежащем проведении) имеют наивысшую доказательную способность и являются «золотым стандартом» клинических исследований, направленных на выявление причинно-следственной связи. С рекомендациями по проведению РКИ можно ознакомиться в руководствах CONSORT9 (CONsolidated Standards of Reporting Trials, сводные стандарты отчетности об испытаниях) и SPIRIT10 (Standard Protocol Items: Recommendations for Interventional Trials, стандартные элементы протокола: Рекомендации по интервенционным испытаниям) [24].
Систематический обзор и метаанализ
Как правило, с течением времени проводится несколько когортных исследований и РКИ, посвященных одной и той же проблеме, но в разных условиях и с разными результатами. Систематические обзоры направлены на оценку и анализ результатов всех опубликованных исследований по определенной проблеме (см. пример [25] в таблице 1). В отличие от традиционного обзора литературы, в который авторы могут выборочно, на свое усмотрение отбирать публикации, систематический обзор должен включать все опубликованные по данной теме исследования надлежащего качества. В некоторых случаях результаты отдельных исследований объединяют с помощью статистических методов и проводят метаанализ (см. пример [26] в таблице 1). В настоящее время систематический обзор и метаанализ занимают самый высокий уровень доказательств в иерархии клинических исследований. Методология проведения систематического обзора и метаанализа приведена в руководстве PRISMA11 (Preferred Reporting Items for Systematic reviews and Meta-Analysis, Предпочтительные пункты отчетности для систематических обзоров и метаанализов) [27].
ОПИСАНИЕ РЕЗУЛЬТАТОВ СТАТИСТИЧЕСКОГО АНАЛИЗА
Результаты исследований в зависимости от дизайна могут быть представлены непрерывными двоичными данными, частотой наступления событий, выживаемостью. статистические методы анализа, которые используют для описания и сравнения результатов исследований [28], будут обсуждаться в следующих обзорах.
ВЫБОР ДИЗАЙНА ИССЛЕДОВАНИЯ
Для выбора подходящего дизайна исследования необходимо определить цель и задачи исследования, сформулировать гипотезу, проанализировать опубликованные данные в выбранной научной области, оценить ресурсы, доступные исследовательской группе, а также их собственный опыт и знания. лучше провести простое, но качественное исследование, тщательно спланировав его дизайн, чем взяться за сложное и, не уделив достаточно усилий для его планирования и проведения, получить недостоверные результаты. в таблице 3 представлены основные характеристики разных видов исследований в зависимости от их целей и задач.
Таблица 3. Выбор дизайна исследования в зависимости от цели и задач
Table 3. Preferred types of study design for different objectives
|
Экологическое |
Поперечное |
«Случай-контроль» |
Когортное |
Экспериментальное |
|
|
Исследование редких заболеваний |
+ |
− |
+ |
− |
− |
|
Исследование редких факторов риска |
+/− |
− |
+/− |
+ |
− |
|
Исследование множественных эффектов воздействия |
+/− |
+/− |
− |
+ |
− |
|
Исследование нескольких воздействий |
+/− |
+/− |
+ |
+ |
− |
|
Оценка распространенности |
− |
+ |
− |
+ |
− |
|
Оценка заболеваемости |
− |
− |
+/− |
+ |
− |
|
Исследование изменений показателей во времени |
− |
− |
+/− |
+ |
− |
|
Исследование результатов вмешательства |
− |
− |
− |
− |
+ |
Примечание: + предпочтительный, +/- менее предпочтительный, но допустимый, – неподходящий.
Note: + preferred, +/- possible, but less suitable, – unsuitable.
Для каждого вида исследования характерны свои недостатки и варианты систематических ошибок, которые нужно учитывать при планировании исследования (табл. 4) [29]. Одним из основных этапов планирования исследования является расчет размера выборки, который помогает избежать систематических ошибок, получить статистически и клинически значимые результаты и оптимизировать использование ресурсов. слишком маленький размер выборки может стать причиной статистически незначимых результатов (при наличии таких различий в действительности). Слишком большой размер выборки может повлечь значительные финансовые расходы, нецелесообразное проведение вмешательства некоторым участникам и получение статистически значимых, но не имеющих клинического значения результатов. существуют различные подходы к расчету размера выборки в зависимости от типа исхода. Для этого используются различные пакеты статистических программ (например, r) или онлайн-калькуляторы12 13.
Таблица 4. Частота систематических ошибок и прочих затруднений при проведении различных видов исследований
Table 4. Probability of bias and limitations in different types of studies
|
Экологические |
Поперечные |
«Случай-контроль» |
Когортные |
|
|
Систематическая ошибка отбора |
n/a |
M |
H |
L |
|
Систематическая ошибка памяти |
n/a |
H |
H |
L |
|
Выбывание из исследования |
n/a |
n/a |
L |
H |
|
Конфаундинг |
H |
M |
M |
M |
|
Временные затраты |
L |
M |
M |
H |
|
Финансовые затраты |
L |
M |
M |
H |
Примечание: H – высокая, L – низкая, М – средняя, n/a – не применимо.
Note: H – High, L – Low, М – Medium, n/a – not available.
Необходимо заранее составить план исследования, так называемый «протокол исследования» с подробным описанием цели и задач, этических аспектов и дизайна исследования, критериев включения и исключения, изучаемых исходов, методов статистической обработки результатов. протоколы клинических исследований с участием людей должны быть зарегистрированы до получения результатов в реестре клинических испытаний, таких как clinicaltrials.gov14 или международной платформе реестров клинических испытаний воз (who international clinical trials registry platform)15. С помощью данных реестров каждый может получить всю интересующую информацию об исследованиях. такой подход способствует прозрачности клинических исследований, и многие медицинские журналы настоятельно рекомендуют указывать регистрационный номер исследования в рукописи.
ЗАКЛЮЧЕНИЕ
Выбор дизайна является важным этапом и требует тщательного подхода, так как от него зависит качество исследования и достоверность его результатов. Разные виды наблюдательных и экспериментальных исследований преследуют разные цели и задачи, поэтому перед проведением исследования необходимо дать точное определение изучаемым факторам риска и исходам. Для того чтобы избежать систематических ошибок исследуемые выборки должны обладать репрезентативностью и надлежащим размером. С целью повышения качества исследований в медицине и уменьшения вероятности систематических ошибок разработаны различные руководства по их проведению и описанию.
1.
Дизайн медицинских
исследований
Пивина Л.М, к.м.н., ассистент
кафедры внутренних болезней № 2
2. Современная медицинская практика требует от врача, чтобы диагностика заболеваний, назначение эффективного лечения, минимизация неблагоп
Современная медицинская практика
требует от врача, чтобы диагностика
заболеваний, назначение эффективного
лечения, минимизация неблагоприятных
последствий вмешательств и составление
индивидуального прогноза для больного
основывались только на самой надежной
информации.
2
3. Предшествующие события
• Уменьшение младенческой смертности и
быстрый рост населения
• Изменение структуры заболеваемости с
острых заболеваний к преобладанию
хронических
• Изменение этиологической природы
заболеваний – с инфекционных агентов на
поведенческие факторы
• Бурное развитие медицинской науки и рост
медицинских технологий
• Развитие систем социального страхования
4. Нужды нового общественного здравоохранения
• Надо знать, какие проблемы являются
наиболее важными
• Знать, какие вмешательства являются
эффективными
• Знать, какие из эффективных вмешательств
окажут наибольшее положительное
воздействие на здоровье населения при
имеющемся уровне ресурсов
5. Что означает доказательная медицина?
• “…добросовестное, точное и
осмысленное использование лучших
результатов клинических исследований
для принятия решений в оказании
помощи конкретному пациенту.”
(Sackett D., Richardson W., Rosenberg W., Haynes R.
Evidence-based medicine. How to practice and teach EBM.
Churchill Livingstone, 1997.)
6. Концепция доказательной медицины
• Цель концепции доказательной медицины – дать
врачам возможность найти и использовать при
принятии клинических решений научно
обоснованные факты, полученные в ходе
корректно проведенных клинических
исследований, повысить точность прогноза
исходов врачебных вмешательств.
Концепция базируется на двух основных идеях:
• Каждое клиническое решение врача должно
приниматься с учетом научных данных
• Вес каждого факта тем больше, чем строже
методика научного исследования, в ходе которого
он был получен.
Пальцев М.А. 2006г
7. Клиническая эпидемиология
• В основе ДМ лежит клиническая
эпидемиология являющаяся разделом
медицины, использующим
эпидемиологический метод для получения
медицинской информации, основанной
только строго доказанных научных фактах,
исключающих влияние систематических и
случайных ошибок.
8.
• Framingham Heart Study (Фремингемское исследование) типичный
пример клинической эпидемиологии. Это исследование началось в
1948 г. с целью исследования сердечно-сосудистого здоровья в
городе Фремингем, штат Массачусетс, под эгидой Национального
Института Сердца (в последствии был переименован в
Национальный Институт Сердца, Легких и Крови: National Heart,
Lung and Blood Institute; NHLBI). Первоначально исследование
охватило 5209 мужчин и женщин. В 1971 г. в него вошли 5124
представителя второго поколения участников -“потомство”.
Сейчас исследователи планируют начать обследование 3500
внуков тех лиц, кто вошел в исследование более 50 лет назад –
“третье поколение“. Исследование не имеет себе равных по
продолжительности и величине когорты и его значение для
современной медицины, и в первую очередь кардиологии, трудно
переоценить. За годы тщательного наблюдения за участниками
исследования были выявлены основные факторы риска, ведущие к
заболеваниям сердечно-сосудистой системы: повышенное
давление, повышенный уровень холестерина в крови, курение,
ожирение, диабет и т.д. С момента начала по результатам
исследования было опубликовано около 1200 статей в основных
мировых медицинских журналах.
9.
Типы клинических вопросов
Отклонение от нормы Здоров или болен
Диагноз
Насколько точны методы
Частота
Насколько часто встречается данное
заболевание
Риск
Какие факторы связаны с повышенным
риском заболевания
Прогноз
Каковы последствия заболевания
Лечение
Как изменится течение заболевания при
лечении?
Профилактика
Существуют ли методы предупреждения
болезни у здоровых? Улучшается ли
течение заболевания при его раннем
распознавании и
лечении?
Причина
Какие факторы приводят к заболеванию?
Стоимость
Сколько стоит лечение данного
заболевания?
10. Каждый вопрос подразумевает дизайн исследования и доказательство
Частота
Когортное,
распространённости
Когортное, случай-контроль,
распространённости
Риск
Прогноз
Когортное, РКИ
Лечение
Рандомизированное
испытание
Профилактика
Рандомизированное
испытание
Причина
Когортное, случай-контроль,
10
РКИ
11. Иерархия доказательности дизайнов исследований
http://servers.medlib.hscbklyn.edu/ebm/2700.htm
12. Клинические исследования:
• Ретроспективные (retrospective study) –
оцениваются уже прошедшие события
(например, по историям болезни)
• Проспективные (prospective study) – вначале
составляется план исследования,
устанавливается порядок сбора и обработки
данных, а затем проводится исследование по
этому плану.
12
13. Классификация исследований по дизайну
1. Обсервационные исследования
(исследования — наблюдения)
одна или более групп пациентов
описываются и наблюдаются по
определенным характеристикам
2. Экспериментальные исследования
оцениваются результаты вмешательства
(препарат, процедура, лечение и т.д.),
участвуют одна, две или более группы.
Наблюдается предмет исследования
14. Классификация научных клинических исследований
Клинические
исследования
Обсервационные
Описательные
•Сообщение о
случаях
•Серии случаев
•Одномоментные
(поперечные)
Аналитические
•Случайконтроль
•Когортные
Экспериментальные
Клинические
испытания
15.
Процесс исследования
Клинический
вопрос
Критическая
оценка
Док-во
Процесс
исследования
Применить
на практике
?
Результаты
Биостатистика
Эпидемиология
Воздействие
Риск
Заболевание
Клинические
исследования
16. Структура исследований
По времени:
Поперечные исследования
Продольные исследования
17. Продольные исследований
Прош лое
Н а сто я щ е е
О предел яется
к о го р т а
О предел яется
к о го р т а
И зуча е тся
возн и кн о ве н и е
заб олеваний
В ы я сн я ется
прош лая
экспозиция
О предел я ю тся
случаи и
контроли
Б уд ущ е е
И зуча е тся
возн и кн о ве н и е
заб олеваний
ПРО СПЕКТИВНОЕ
КО ГО РТ Н О Е
И СТО РИ ЧЕС КО Е
КО ГО РТ Н О Е
ИСК
18. Описание случаев
• Описательные обзоры – наиболее
«читаемые» научные публикации, которые
отражают позицию автора по конкретной
проблеме
• Чаще всего представляют историю болезни
одного пациента
• Один из способов осмысления сложных
клинических ситуаций
• Но не имеет научной доказательности
18
19. Серии клинических случаев и клинические случаи
Больница
Журнальная
статья
Больные
Записи о
заболевании
20. Типы обсервационных исследований Исследование серии случаев или описательное исследование
• Описание серии случаев –
исследование одного и того же
вмешательства у отдельных
последовательно включенных больных
без группы контроля.
• Например, сосудистый хирург может
описать результаты реваскуляризации
сонных артерий у 100 больных с
ишемией головного мозга.
21. Типы обсервационных исследований Исследование серии случаев или описательное исследование, особенности
• описывается определенное количество
интересующих характеристик в наблюдаемых
малых группах пациентов
• относительно короткий период исследования
• не включает никаких исследовательских гипотез
• не имеет контрольных групп
• предшествует другим исследованиям
• этот вид исследования ограничен данными об
отдельных больных
22. Исследование случай — контроль (case control study)
Исследование случай контроль (case control study)
Исследование методом случай-контроль (ИМСК)– это тип
аналитического исследования, при котором избираются две
группы людей с заболеванием (Случай) и без заболевания
(Контроль), а потом между ними сравнивается частота
контакта с источником заражения или экспозицией.
Цель исследования – определить причину, по которой в
группе-случай развилось заболевание, а в группе-контроль
нет.
Такая структура исследования наиболее пригодна при
попытках определить причину возникновения редко
встречающихся заболеваний, например, развитие
нарушений со стороны ЦНС у детей после применения
коклюшной вакцины.
23. Исследование случай-контроль (ретроспективное)
• Этиологическое исследование
(исследование причин)
– Исследующее (выработка гипотезы)
– Аналитическое (проверка гипотезы)
• Оценка установленных вмешательств
– Когда рандомизированное контролируемое
испытание не подходит по этическим или
другим соображениям
23
24. Исследования «случай-контроль»
Исследования «случайконтроль»
• Воздействие
Дизайн
есть
Заболевшие
(случай)
Воздействия
нет
Мониторинг
Воздействие
есть
Не заболевшие
(контроль)
Воздействия
нет
время
24
t=0
25. Типы ИМСК
• Основанное на популяции
– Группа-Контроль и группа-Случай выбираются из
людей, проживающих на определённой
территории. Для установления группы-Случай
зачастую используется информация из
регистратур, а затем набирается группа-Контроль
из людей, проживающих в этой же местности.
– «Вложенные» ИМСК – проводятся внутри
когортных исследований. Часто используются как
базовый (исходный) уровень для когортного
исследования
• Клинически основанное
– Группа-Случай и группа-Контроль набираются на
основании медицинских карт и информации из
больниц, клиник и т.д.
– Трудно определить популяцию, из которой
выбраны люди в состав групп.
26. Отбор Случаев
Определение Случаев:
– Чёткая диагностика (определение заболевания,
результатов) и операционный (воспроизводимое
исследование) критерий
– Однородность случаев
Источники Случаев:
– Все случаи в определённом помещении, среди общего
населения, и пр.
– Генерализуемость (возможность распространения
результатов анализа ограниченного числа случаев на
большее количество случаев)
Случайные (недавно диагностированные) против
Превалирующих (давно существующих) случаев
– Случайные: меньше причинно-следственной путаницы в
исследовании, потому что эти случаи близки по времени
и воспоминания людей более полные
– Превалирующих случаев больше, если заболевание
продолжительное
27. Отбор Контролей
• Контроли должны соответствовать Случаям
• Источники Контролей:
– Общее население, если Случаи из этого
населения
– Больничная группа-Контроль, однако они могут
быть подвержены одинаковой экспозиции
(например, контакт с источником заражения)
– Люди, связанные с группой-Случай (например,
соседи) используются в исследованиях для
установления одинаковой социо-экономичесой
переменной
– Родственники (например, братья и сёстры)
используются в исследованиях для контроля
за генетическим фактором и домашней
обстановкой
28. Информация об экспозиции
• Карты (медицинские или с места работы)
• Анкеты по почте
• Личные интервью
• Медицинские осмотры
• Замеры окружающей среды
29. Интерпретация
• Отбор Случаев и Контролей
• Качество информации – верно ли
классифицированны группа-Случай и
группа-Контроль по типу заболевания и
статусу экспозиции? Были ли
использованы одинаковые источники
информации? Соответствующий сбор
информации? Не ответившие люди?
Ошибки при воспоминании и описании?
• Соответствие – как контролировать
искажение результатов? Умение
классифицировать информацию,
использовать многомерный
регрессионный анализ
30. Пример смешанных результатов
Экспозиция:
Кофе
Заболевание:
Сердечная
недостаточность
Искажение:
Курение
31. Преимущества и недостатки Случай-контроль
• Преимущества
– Лучший дизайн для редких заболеваний или условий,
требующих длительные временные промежутки
– Используются для тестирования первичных гипотез
– Очень кратковременные
– Наименее дорогие
• Недостатки
– Большое количество смещений и систематических
ошибок
– Зависит от качества первичных описаний и измерений
– Трудности в подборе соответствующей контрольной
группы
– При работе с заболеваниями с долгим латентным
(скрытым) периодом приходиться полагаться на
воспоминания людей об экспозициях, случившихся в
прошлом (т.е. ошибки описания)
32. Когортное исследование (cohort study)
• Исследование, структура которого
позволяет проследить за группой
(когортой) участников и выявить
различия в частоте развития у них
определенных клинических исходов.
32
33. Когортные исследования
• Участвующие в исследовании
классифицируются на основании наличия или
отсутствия подверженности определённому
фактору, и после за ними наблюдают на
протяжении определённого времени для
слежения за развитием заболевания в каждой
группе.
• Когорты могут быть перспективными
(интересующий результат ещё не произошёл,
хотя участники уже могли подвергнуться
воздействию) или ретроспективными
(воздействие и интересующий результат уже
случились).
• Отвечает на вопрос «Заболеют ли люди, если
они подверглись воздействию фактора риска?»
34. Когортные исследования
• Перспективные когортные исследования
очень дорогостоящи и требуют дольшего
периода времени, чем ретроспективные.
• Эти исследования обычно планируются
когда:
• (1) достаточное количество сведений было
получено в результате проведения
недорогих ретроспективных
исследований, и
• (2) для нового препарата необходимо
тестирование на возможные связи с
другими заболеваниями, как например в
случае с оральными контрацептивами или
с заместительной гормональной терапией.
35. Когортные исследования
• Ретроспективные когортные исследования
проводятся быстрее и менее
дорогостоящи по сравнению с
перспективными.
• Ретроспективные исследования зависят от
наличия необходимой информации в
существующих источниках, как например
административные и вторичные данные
(риск того, что информация будет
неполной для целей исследования,
некоторые данные, как диета или курение,
обычно недоступны)
36. Когортные исследования
• Другие преимущества когортных
исследований:
• этически надёжно
• участников можно подбирать
• очень ценно, если подверженность
воздействию случается редко
• возможность проследить взаимосвязи
между воздействием и несколькими
заболеваниями
• исследовать множество эффектов при
одном воздействии
37. Когортные исследования
• Другие преимущества (продолжение):
• В перспективных когортах при слежении за
воздействием предвзятость и необъективность
сведены к минимуму, а в ретроспективнызх
наоборот (потому что все интересующие
результаты уже произошли)
• Позволяет прямое измерение частоты
заболеваний в группе подверженной лечению и в
группе, не подверженной лечению (можно
высчитать фактический риск уменьшения)
• Лучший дизайн для изучения причин состояний,
заболеваний, факторов риска и результатов.
• Достаточно времени для получения строгих
доказательств
38. Недостатки когортных исследований:
1. Трудно найти контрольную группу
2. Воздействие может быть связано со скрытыми
факторами
3. Невозможно рандомизировать как в RCT
4. Необходимо большое число участников и долгое
время слежения в случае исследования редких
заболеваний в перспективных когортных
исследованиях, дорогое.
5. Проблемы кодирования, особенно в
ретроспективных когортных исследованиях
6. Позволяет оценить связь между заболеванием и
воздействием относительно небольшого числа
факторов (тех, что были определены в начале
исследования)
7. Не могут использоваться для редких заболеваний
(размер выборки должен быть больше, чем число
лиц с изучаемым заболеванием)
39. Когортное исследование
Опытная
группа
Наблюдение
«Курящие»
Сравнение исходов
Наблюдение
«Некурящие»
Контрольная
группа
40. Когортные исследования
• Дизайн
Заболевшие
Воздействие
есть
Не заболевшие
Мониторинг
Заболевшие
Воздействия
нет
Не заболевшие
T=0
Время
40
41.
42. Типы обсервационных (описательных) исследований Поперечное исследование (распространенность)
• Данные собираются в определенный
момент времени
• Типы:
• Распространенности заболевания или
исхода
• Изучение течения заболевания, стадийности
• Отвечают на вопрос «Сколько?»
43. Исследования распространённости
Дизайн
Общая
популяция
Случайная
выборка
Показатель
Заболевание
Отсутствие
заболевания
Распространённость =
= все заболевшие/ вся выборка популяции
44. Особые характеристики
• Происходит в определённом временном
срезе;
• Не вовлекает воздействующие переменные;
• Позволяет исследователям взглянуть на
комплекс данных сразу (возраст, пол, доход);
• Часто используется, чтобы выяснить
распространённость чего-либо в конкретной
популяции.
45. ТЕРМИНОЛОГИЯ
• Преваленс (Prevalence) – распространенность.
Пример: преваленс ИБС в популяции количество лиц
с ИБС/общая численность популяции в процентах.
• Инциденс (Incidence) – первичная заболеваемость.
Пример: инциденс бронхиальной астмы у детей г.
Семей = число новых случаев астмы у детей г. Семей
/ количество детей, проживающих в г. Семей.
• Преваленс (Р) тем выше, чем выше инциденс (I) и
длительнее заболевание или состояние
Р=IxL
46. РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИСПЫТАНИЕ (РКИ) (Controlled Clinical Trials, CCT)
• — ЗОЛОТОЙ СТАНДАРТ ЛЮБОГО
МЕТОДА ДИАГНОСТИКИ И ЛЕЧЕНИЯ.
• Обычно это исследование, в котором
участников в случайном порядке
(рандомизированно) распределяют в две
группы — основную (где применяется изучаемое
вмешательство) и контрольную (где
применяется плацебо или другое
вмешательство. Такая структура исследования
позволяет сравнить эффективность
вмешательств.
47. Схема типичного РКИ
48. РКИ
• Дизайн
Группы, получающие
лечение
Улучшение
A
Нет
улучшения
Исследование
выборки
Рандомизация
Улучшение
B
Нет
улучшения
t=0
время
48
49. РКИ: Виды контрольных групп
• Плацебо-контроль
• Активное лечение
• Сравнительная
характеристика доз
49
50.
Рандомизация – («random»)
Это процедура, направленная на обеспечение пациентам
равных шансов получения исследуемого препарата
Позволяет минимизировать различие между
характеристиками групп сравнения
Создает условия для корректного использования
статистических тестов на достоверность
Современная норма и стандарт качества исследования
эффективности и безопасности лекарственных средств.
51.
Виды рандомизации
простая —
(подбрасывание монетки, применение
открытой таблицы случайных чисел,
метод конвертов
использование компьютерных программ
генератора случайных чисел) –
используется в больших РКИ
Блочная – обеспечивает равное количество
участников в группах сравнения при
небольших РКИ
Стратифицированная – выделение подвыборок по
признаку, который может влиять на
результаты исследования, например по полу
52.
Виды слепых исследований
Открытое
– все все знают
Простое слепое
— не знает больной
Двойное слепое
– не знает больной и
врач-исследователь
Тройное слепое
– не знает больной,
врач исследователь и
статист
Полное слепое
– не знают парамедицинские
службы, обслуживающие
исследование
(клиническая лаборатория,
рентгенографы и т д)
53. Контролируемое клиническое исследование
Опытная группа
Истории болезни
Сравнение
историй
заключения
Истории болезни
Контрольная группа
54. Преимущества и недостатки Контролируемые клинические испытания
Недостатки
– чаще требует длительного времени
– Очень дорого
– Не подходит для редких заболеваний
– Ограниченная возможность обобщаемости
• Преимущества
– самые лучшие данные для пациентов
– меньше смещение (систематическая ошибка)
– лучшее для оценки эффективности и проверки
вмешательств
– Если рандомизированное, самые строгое по дизайну и
достоверные
54
55. Что такое контролируемое клиническое исследование
Строгий протокол
Рандомизированное
Сравнительное
Проспективное
Слепое
Многоцентровое
56. Разработка Протокола исследования
• Протокол (программа) клинического исследования
представляет собой документ, в котором содержатся
инструкции для всех, кто принимает участие в
клиническом исследовании, с конкретными задачами
каждого участника и указаниями по выполнению этих
задач.
• Протокол обеспечивает квалифицированное
проведение исследований, а также сбор и анализ
данных, которые затем поступают на рецензию в
органы контрольно-разрешительной системы.
57. Разделы, которые должны быть включены в Протокол клинического исследования
• Введение (краткое описание проблемы
и схемы лечения).
• Цели исследования.
• Длительность исследования.
• Количество испытуемых.
• Информированное согласие.
• Рецензия Этического комитета.
58. Разделы, которые должны быть включены в Протокол клинического исследования
• • Критерии отбора испытуемых:
— критерии включения;
— критерии исключения.
• Методология:
— план исследования;
— календарный план (схема) исследования;
— визиты для исследования;
— оценки/процедуры исследования;
— определение конечных показателей эффективности;
— курсы лечения.
59. Разделы, которые должны быть включены в Протокол клинического исследования
• • Отчетность по безопасности:
— случаи неблагоприятных реакций;
— тяжелые случаи неблагоприятных реакций;
— неправильные результаты лабораторных тестов;
— неправильные результаты по другим параметрам
безопасности;
— исключение из исследования.
• Клинические лабораторные параметры.
• Другие параметры безопасности.
• Сопутствующая терапия.
• Анализ данных.
• Приложения.
60. Разработка Индивидуальной регистрационной карты
• Индивидуальная регистрационная
карта (ИРК) представляет собой
средство сбора данных исследования
на бумажных носителях, проводимого в
исследовательском центре. В
некоторых исследованиях для этих
целей используются также электронные
средства.
61. Индивидуальные регистрационные карты служат выполнению нескольких задач:
• • обеспечивают сбор данных в соответствии с
Протоколом;
• обеспечивают удовлетворение требований органов
контрольно-разрешительной системы для сбора
информации;
• способствуют эффективной и полной обработке
данных, их анализу и отчетности по результатам;
• способствуют обмену данными по безопасности
среди проектной группы и других подразделений
организации.
• Данные, собранные во время проведения испытания
в исследовательском центре, должны быть полными
и точно отражать, что произошло с каждым
испытуемым. Только в случае соответствия этим
критериям исследование достоверно отвечает на
вопросы об эффективности и безопасности
изучаемого лекарственного средства.
62. Во всех ИРК должны быть указаны данные по следующим позициям:
• номер, название исследования;
• фамилия исследователя;
• идентификационные данные
испытуемого/пациента (номер и инициалы);
• информация о критериях
включения/исключения;
• демографические данные;
• детальное описание дозирования исследуемого
препарата;
• сопутствующий курс лечения;
• случаи неблагоприятных реакций (побочные
эффекты и интеркуррентные заболевания);
• заключение о состоянии здоровья испытуемого;
• подпись исследователя и дата.
63. В состав Индивидуальных регистрационных карт должны быть включены модули
• • история болезни;
• данные физического обследования;
• основной и сопутствующий диагноз;
• предыдущий релевантный курс лечения;
• характеристика исходного состояния,
промежуточные исследования и измерения
конечных показателей эффективности,
лабораторные тесты, процедуры и т.д.
64. Этапы (фазы) клинического исследования
• На первом этапе (1 фаза) клинического
исследования исследователи изучают новое
лекарство или метод лечения на небольшой группе
людей (20-80 человек), для того чтобы сначала
определить его безопасность, установить
интервал безопасных доз и идентифицировать
побочные эффекты.
• На втором этапе (II фаза) изучаемое лекарство или
метод лечения назначается большей группе людей
(100-300 человек), с целью убедиться, является ли
оно эффективным, а также для дальнейшей
проверки его безопасности.
65. Этапы (фазы) клинического исследования
• На третьем этапе (III фаза) изучаемое лекарство или метод
лечения назначается еще большим группам людей (10003000 человек) для подтверждения эффективности и
безопасности, контроля побочных эффектов, а также для
сравнения с часто используемыми препаратами и методами
лечения, накопления информации, которая позволит
использовать это лекарство или метод лечения безопасно.
• Четвертый этап (IV фаза) исследований проводится после
того, как лекарство или метод лечения были разрешены для
применения Министерством здравоохранения РК. Эти
исследования продолжают тестирование изучаемого
препарата или метода лечения с целью дальнейшего сбора
информации о его воздействии на различные группы
людей и выявлении любых побочных эффектов,
проявляющихся при длительном использовании.
66. Систематический обзор (systematic review)
• Обзор, представляющий собой серьезное
научное исследование, в котором четко
сформулирован изучаемый вопрос,
подробно описаны методы, применяемые
для поиска, отбора, оценки и обобщения
результатов различных исследований,
соответствующих изучаемому вопросу.
Систематический анализ может включить
в себя мета-анализ (но его применение
необязательно).
66
67. Мета-анализ (meta-analysis)
• Суммирование результатов нескольких
исследований, посвященных одной и той же
тематике
• В основном составляется на основе
систематизированных обзоров. Метод
статистического анализа, в ходе которого
объединяются результаты нескольких
исследований, а итоговая оценка представлена в
виде одного взвешенного показателя (при этом
больший вес обычно присваивают крупным
исследованиям или исследованиям более
высокого методологического качества).
68. Дизайн медицинских исследований Выводы
• РКИ – максимальное по силе , но часто дорогое
и время- затратное
• Хорошо подготовленные обсервационные
исследования дают хорошие результаты
выявления причин заболеваний, но не
достаточно доказательны
• Когортные исследования –лучшие для
исследования течения болезней и выявлении
факторов риска
• Исследования случай-контроль быстрые и
недорогие
69. Выбор методики исследования
• Количественное исследование: призвано
ответить на вопросы: “Сколько” и “Какое
количество?” Направлено на выявление
взаимосвязей, как правило, причинноследственных связей между переменными.
• Сбор информации по интересуемой проблеме и
математический анализ полученных
количественных данных.
• Целью является выявление общих
закономерностей, характерных не только для
обследованной группы людей, но и для всей
популяции в целом, что позволит
исследователю интерпретировать проблему и
сделать прогнозы.
70. Качественное исследование
• Призвано ответить на вопросы: “Кто?
Почему? Когда? и Где?” и направлено на
более глубокое изучение проблемы.
• Проблема рассматривается с различных
точек зрения.
• Целью исследования является раскрытие
характерных для исследуемой популяции
принципов (паттернов) по которым протекают
интересующие нас явления и которые
позволят дать более глубокое понимание
проблемы.
71. Качественное исследование
Кого она оставила?
Почему ее семья
переехала?
Когда они переехали?
Куда они переехали?
Чем отличается новая
школьная система?
Насколько хорошо она
адаптировалась?
Что можно было бы
сделать для лучшей
адаптации?
72. Методы сбора данных:
• Количественное
• Тесты и различные
методы измерения
• Анкеты, вопросники
• Формализованный сбор
данных
• Важными элементами
являются:
– Наличие контрольной
группы
– Рандомизация
• Качественное
• Широкий спектр
методов
• Наблюдение за
участниками
• Беседы
• Полуформализованные
интервью
73. Анализ полученных данных
• Количественное
• Статистика
• Качественное
• Данные группируют по
тематическим
категориям,
статистические методы
не применяются
74. Достоверность доказательств
Достоверность
рекомендаций
Уровень
достоверн
ости
Мероприятие
1a
Систематический обзор РКИ
1b
РКИ
2a
Систематический обзор когортных
исследований
2b
Когортное исследование
3a
Систематический обзор «случай –
контроль» исследований
3b
Исследование
«случай- контроль»
C
4
Серия случаев
D
5
Мнения экспертов
A
B
75.
Мнение эксперта
76.
Пессимист видит трудности в
каждой возможности.
Оптимист видит возможности в
каждой трудности.
Уинстон Черчилль (1874-1965)
Введение
Существует несколько типов дизайна клинических испытаний. Их можно классифицировать следующим образом:
- В зависимости от метода, который используется для распределения участников в группы лечения и контрольные группы (нерандомизированные и рандомизированные контролируемые испытания).
- В зависимости от осведомленности участников или исследователей (или обоих) относительно того, в какую группу распределены участники (простые или двойные слепые исследования).
- В зависимости от предполагаемой степени различий между группами лечения и контрольными группами (испытания для подтверждения большей или не меньшей эффективности).
Дизайны нерандомизированных контролируемых клинических испытаний
В нерандомизированных контролируемых клинических испытаниях исследователь распределяет участников в группы лечения и контрольные группы. В этих испытаниях контрольные группы могут быть параллельными или историческими. В случае использования исторического контроля все пациенты в испытании получают исследуемый лекарственный препарат; результаты сравниваются с предыдущим состоянием пациента (например, у пациента с хроническим заболеванием) или с контрольной группой предыдущего исследования.
Дизайны рандомизированных контролируемых клинических испытаний
В рандомизированных контролируемых испытаниях участников испытания случайным образом распределяют в группы лечения или контрольные группы. Процесс случайного распределения участников испытания в группы лечения или контрольные группы называется «рандомизация». Для рандомизации используются разные методы (закрытые конверты, последовательность, созданная компьютером, случайные числа). Для рандомизации необходимы два компонента: создание случайной последовательности и применение случайной последовательности, желательно так, чтобы участникам не была известна эта последовательность. Рандомизация избавляет от потенциальных систематических ошибок.
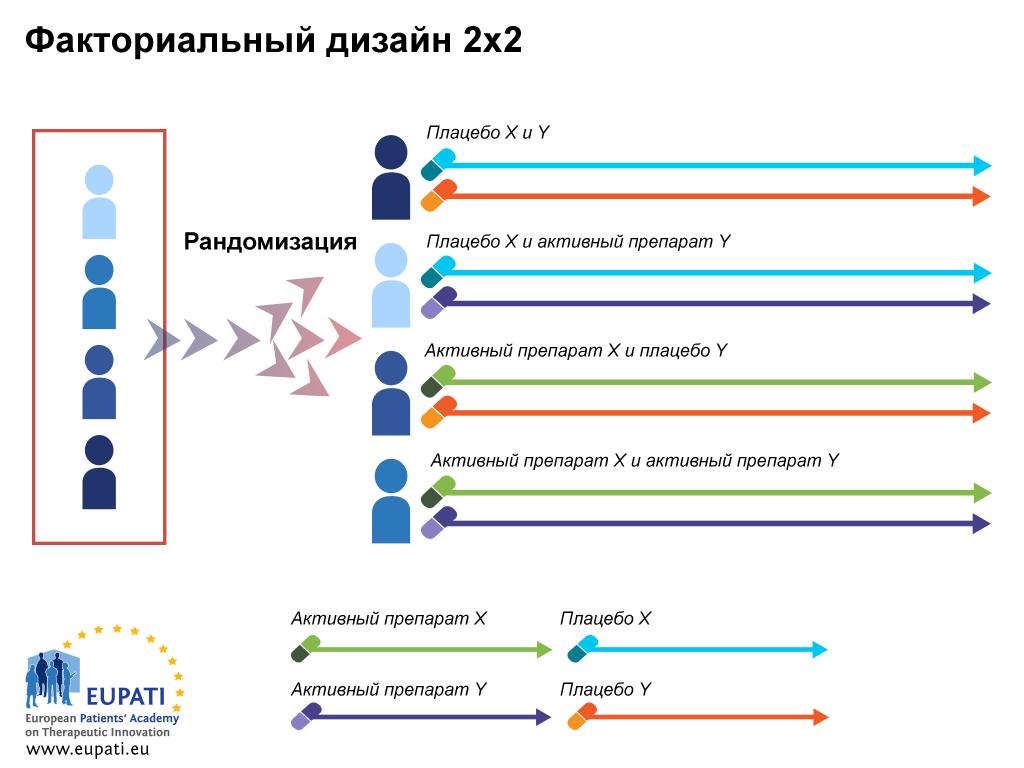
Существуют разные типы дизайнов рандомизированных испытаний.
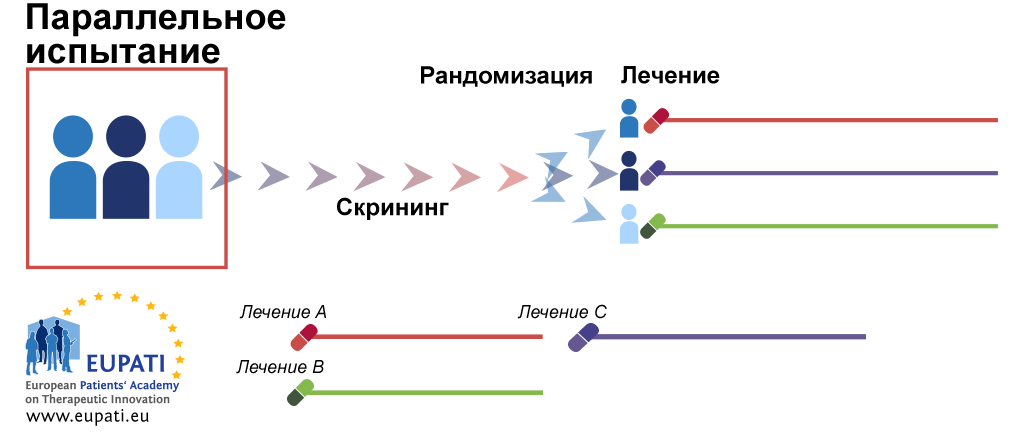
Дизайн испытания с параллельными группами
В случае рандомизации в параллельных группах после рандомизации каждый участник остается в назначенной группе лечения в течение всего исследования. Дизайн с параллельными группами можно применять при многих заболеваниях, что позволяет проводить эксперименты одновременно в нескольких группах, и эти группы могут находиться в разных местах.
-
- После скрининга пациентов рандомизируют в отдельные группы лечения. Они остаются в этих группах лечения в течение всего испытания, анализа и деятельности в рамках последующего наблюдения.
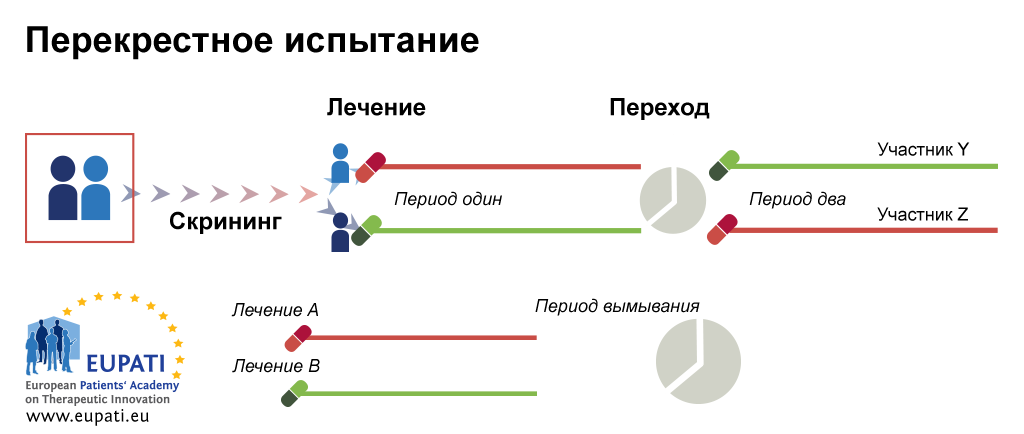
Дизайн перекрестного испытания
Перекрестная рандомизация предусматривает последовательное получение участниками разных видов лечения (например, получение вещества-кандидата в первой фазе и препарата сравнения/контрольного препарата во второй фазе). Каждое лечение начинается в точке эквивалентности, и состояние каждого участника контролируется относительно его собственного состояния. Это имеет определенные преимущества, например низкая вариабельность вследствие того, что один и тот же пациент находится в группе лечения и контрольной группе, и возможности оценки нескольких видов лечения. Однако между разными фазами лечения должно быть достаточно времени (период вымывания).
-
- Пациенты X и Y были рандомизированы в две разные группы лечения. Пациент X получает лечение А в течение первого периода исследования; пациент Y получает лечение B. После завершения первого периода наступает период вымывания. Затем пациент X получает лечение B в течение второго периода исследования, а пациент Y получает лечение А.
Дизайн испытания со связанными парами
В случае дизайна со связанными парами участники сначала распределяются по парам в зависимости от определенных характеристик. Затем каждый участник пары случайным образом распределяется в одну из двух разных исследуемых подгрупп. Это позволяет сравнивать похожих участников исследования, которые проходят разные процедуры, предусмотренные исследованием.
-
- После скрининга участников распределяют по парам. В пределах каждой пары одного участника рандомизируют для получения лечения А, а второго — для получения лечения B.
Стратификация
Стратификация также позволяет сравнивать похожих участников исследования, которые проходят разные процедуры, предусмотренные исследованием. Все участники исследования перед рандомизацией распределяются по группам в зависимости от одного или более факторов (например, в зависимости от возраста, пола, бытовых факторов, сопутствующих лекарственных препаратов). Это позволяет достичь баланса при распределении в пределах каждой комбинации.
Групповая выборка
В рандомизированных испытаниях может также использоваться групповая выборка. В случае использования групповой выборки находят соответствующие географические области (например, город, район и т. п.). Затем проводят случайные отбор ряда таких географических областей. Для каждой отобранной географической области выбирают пропорциональную подгруппу из представителей исследуемой выборки в этой отобранной области, и затем такие подгруппы объединяют в выборочную группу.
Испытания с отменой лечения
В испытаниях с отменой лечения участники получают исследуемое лечение в течение определенного времени, а затем их рандомизируют для продолжения применения исследуемого лечения или получения плацебо (отмена активной терапии).
-
- Во время испытания с отменой лечения после истечения первого обозначенного периода времени участников рандомизируют в две группы, из которых одна получает плацебо вместо продолжения активного лечения.
Факториальный дизайн
В факториальных клинических испытаниях изучается эффект более одного лечения. Это позволяет оценивать потенциальные взаимодействия между разными видами лечения.
Дизайны сравнительных клинических испытаний
Существует несколько разных типов сравнительных испытаний:
- Большей эффективности — чтобы подтвердить, что исследуемый лекарственный препарат лучше, чем контроль.
- Эквивалентности — чтобы подтвердить, что показатель конечной точки не отличается (не лучше, не хуже) от контроля.
- Не меньшей эффективности — чтобы подтвердить, что исследуемый лекарственный препарат не хуже, чем контроль.
- Испытания для выявления зависимости эффекта от дозы, чтобы определить показатели для разных доз, в том числе начальной дозы и максимальной дозы.
Приложения
- типы дизайна клинического испытания
Size: 1,270,450 bytes, Format: .pptx
Презентация посвящена разным типам дизайна клинических испытаний. Подается подробная информация об ослеплении, контроле и рандомизации.
A2-4.30-v1.4
- Размер: 430.5 Кб
- Количество слайдов: 31
Описание презентации Дизайн медицинских клинических исследований Дизайн медицинских клинических по слайдам































Скачать материал

Скачать материал


- Сейчас обучается 409 человек из 62 регионов


- Сейчас обучается 267 человек из 63 регионов




Описание презентации по отдельным слайдам:
-
1 слайд
Доказательная медицина
Дизайн медицинских исследованийПивина Л.М, к.м.н., ассистент
кафедры внутренних болезней № 2 -
2 слайд
2
Современная медицинская практика требует от врача, чтобы диагностика заболеваний, назначение эффективного лечения, минимизация неблагоприятных последствий вмешательств и составление индивидуального прогноза для больного основывались только на самой надежной информации. -
3 слайд
Предшествующие события
Уменьшение младенческой смертности и быстрый рост населения
Изменение структуры заболеваемости с острых заболеваний к преобладанию хронических
Изменение этиологической природы заболеваний – с инфекционных агентов на поведенческие факторы
Бурное развитие медицинской науки и рост медицинских технологий
Развитие систем социального страхования -
4 слайд
Что означает доказательная медицина?
“…добросовестное, точное и осмысленное использование лучших результатов клинических исследований для принятия решений в оказании помощи конкретному пациенту.”
(Sackett D., Richardson W., Rosenberg W., Haynes R. Evidence-based medicine. How to practice and teach EBM. Churchill Livingstone, 1997.) -
5 слайд
Концепция доказательной медицины
Цель концепции доказательной медицины – дать врачам возможность найти и использовать при принятии клинических решений научно обоснованные факты, полученные в ходе корректно проведенных клинических исследований, повысить точность прогноза исходов врачебных вмешательств.
Концепция базируется на двух основных идеях:
Каждое клиническое решение врача должно приниматься с учетом научных данных
Вес каждого факта тем больше, чем строже методика научного исследования, в ходе которого он был получен.
Пальцев М.А. 2006г -
6 слайд
Когда появилась доказательная медицина?
1940 г — Первые рандомизированные исследования (использование стрептомицина при туберкулезе)
1960 г — трагедия, связанная с талидомидом
1962 г — Комитет США по контролю за медикаментами и продуктами питания ввел правила, требующие проведения контролируемых исследований новых препаратов
1971 г — Кокран поднял вопрос о недостаточности научных доказательств
1980-90 гг – Привлечение внимания к необходимости включения систематических обзоров в клинические руководства
1994 г. — первый Cochrane colloquium в Оксфорде
1994 г. — термин EBM
1996 г. — большинство Британских докторов уже знают термин EBM
1996 г. — британский министр здравоохранения заявил, что его главная задача состоит в том, чтобы продвигать концепцию EBM
1996 г. — термин EBM в заголовках ведущих британских газет
1999 г. — BMJ издает справочник по EBM (тираж в США ½ млн. экз.)
2001 г. – немецкое, испанское, русское, японское издания -
7 слайд
История доказательной медицины
ДМ была названа в честь Арчи Кокрана (Archie Cochrane) английского эпидемиолога, указавшего на необходимость оценивать с помощью контролируемых клинических исследо-ваний роль конкретного клинического вмешательства и хранить результаты в специальной базе данных по эффективности оказания медицинской помощи.
Им впервые была сформулирована концепция доказательной медицины. -
8 слайд
8
Врачам нужна информация
В исследованиях показано, что
для 2/3 пациентов врачи
нуждаются в информации, но
получают ее лишь в
небольшом числе случаев. Где взять необходимую информацию? -
9 слайд
Наблюдения показывают, что в некоторых отечественных журналах до ½ статей носят рекламный характер по содержанию, оформлению, или связаны с печатной рекламой
-
10 слайд
Чтобы идти в ногу со временем…….
«… врачу необходимо читать 10 журналов, примерно 70 оригинальных реферативных статей в месяц….»
Sackett D.L. (1985)
«…необходимо читать по 15 статей 365 дней в году…»
McCrory D.C. (2002)Время, которым располагает практикующий врач для чтения, – менее 1 часа в неделю
-
11 слайд
Взаимоотношения практикующего врача и медицинской информации
Информационный бум
Затруднения в нахождении достоверной («доказательной») информации
Затруднения в анализе информации
Затруднения в принятии эффективных клинических решений
Врачебные ошибки
Назначение необоснованных вмешательств -
12 слайд
Обоснование необходимости регулирования
В США 98 000 смертей с год от врачебных ошибок (IOM, 2000)
Только 30% медицинских вмешательств с надежно доказанной эффективностью
Широко распространены неэффективные (а иногда вредные) вмешательства
Вмешательства с доказанной эффективностью получают далеко не все нуждающиеся -
13 слайд
Результаты мета-анализа 39 перспективных исследований, проведенных в США в период с 1966 по 1996 гг., показали, что серьезные неблагоприятные побочные реакции возникали в среднем в 6,7% случаев, а летальные осложнения имели место у 0,32% всех госпитализированных больных.
Осложнения лекарственной терапии заняли 4-6-е место среди причин смертности после сердечно-сосудистых, онкологических, бронхо-легочных заболеваний и травм -
14 слайд
Врачебные ошибки в личном опыте
Источник: Национальный фонд безопасности пациентов (National Patient Safety Foundation), Сентябрь 1997
“ Сталкивались ли когда-нибудь Вы, Ваш близкий друг или родственник, с ситуацией, где имела место врачебная ошибка?” -
15 слайд
15
ПРИМЕРЫ НЕОБОСНОВАННЫХ МЕТОДОВ ЛЕЧЕНИЯ
Примение кокарбоксилазы, рибоксина, аспаркама
Парентеральное введение витаминов как вспомогательное лечение
Назначение ангиопротекторов, рассасывающих препаратов -
16 слайд
Примеры отсутствия доказательств на вмешательства
Профилактическое назначение железа и фолиевой кислоты беременным – положительное влияние на здоровье матери и новорожденногоМаммография для раннего выявления рака молочной железы
-
17 слайд
Во всем мире вводятся новые медицинские вмешательства без должного основания, т.е. медицинская и особенно профилактическая деятельность в значительной степени еще не основаны на доказательствах
Это приносит огромный прямой и опосредованный вред
-
18 слайд
18
Реабилитация при инфаркте миокарда1) 1930 – 1950 гг. – безраздельное господство концепции длительной и строгой иммобилизации больных ОИМ (из-за страха внезапной смерти, развития аневризмы сердца и ее разрыва). В СССР этот период длился до конца семидесятых годов ХХ века
2) 1950-1960 гг. – Сообщение S. Levine и B. Lown об эффективном лечении больных ОИМ в кресле (в том числе по результатам длительного наблюдения). Др. П.Д.Уайт рекомендует президенту Эйзенхауэру во время обострения болезни сердца активный двигательный режим -
19 слайд
Влияние реабилитационных тренировочных программ на исходы КБС у больных, перенесших инфаркт миокарда за 3 года реабилитации (метаанализ)
-
20 слайд
Составляющие качественного медицинского ухода (Haynes et al’96)
Клинический опыт
Предпочтения пациента
Научные доказательства -
21 слайд
Клиническая эпидемиология
В основе ДМ лежит клиническая эпидемиология являющаяся разделом медицины, использующим эпидемиологический метод для получения медицинской информации, основанной только строго доказанных научных фактах, исключающих влияние систематических и случайных ошибок. -
22 слайд
Чувства, которые у нас вызывают научные исследования
-
23 слайд
Framingham Heart Study (Фремингемское исследование) типичный пример клинической эпидемиологии. Это исследование началось в 1948 г. с целью исследования сердечно-сосудистого здоровья в городе Фремингем, штат Массачусетс, под эгидой Национального Института Сердца (в последствии был переименован в Национальный Институт Сердца, Легких и Крови: National Heart, Lung and Blood Institute; NHLBI). Первоначально исследование охватило 5209 мужчин и женщин. В 1971 г. в него вошли 5124 представителя второго поколения участников -“потомство”. Сейчас исследователи планируют начать обследование 3500 внуков тех лиц, кто вошел в исследование более 50 лет назад – “третье поколение“. Исследование не имеет себе равных по продолжительности и величине когорты и его значение для современной медицины, и в первую очередь кардиологии, трудно переоценить. За годы тщательного наблюдения за участниками исследования были выявлены основные факторы риска, ведущие к заболеваниям сердечно-сосудистой системы: повышенное давление, повышенный уровень холестерина в крови, курение, ожирение, диабет и т.д. С момента начала по результатам исследования было опубликовано около 1200 статей в основных мировых медицинских журналах.
-
24 слайд
Отклонение от нормыЗдоров или болен
ДиагнозНасколько точны методы
ЧастотаНасколько часто встречается данное заболевание
РискКакие факторы связаны с повышенным риском заболевания
ПрогнозКаковы последствия заболевания
Лечение Как изменится течение заболевания при лечении?
ПрофилактикаСуществуют ли методы предупреждения болезни у здоровых? Улучшается ли течение заболевания при его раннем распознавании и лечении?
ПричинаКакие факторы приводят к заболеванию?
СтоимостьСколько стоит лечение данного
заболевания?
Типы клинических вопросов -
25 слайд
25
Каждый вопрос подразумевает дизайн исследования и доказательство
ЧастотаРиск
Прогноз
Лечение
Профилактика
Причина
ЧНС, когортное, распространённости
Когортное, случай-контроль, распространённостиКогортное, РКИ
Рандомизированное испытание
Рандомизированное испытание
Когортное, случай-контроль,
РКИ -
26 слайд
Иерархия доказательности дизайнов исследований
http://servers.medlib.hscbklyn.edu/ebm/2700.htm -
27 слайд
27
Клинические исследования:
Ретроспективные (retrospective study) – оценивается уже прошедшие события (например, по историям болезни)Проспективные (prospective study) – вначале составляется план исследования, устанавливается порядок сбора и обработки данных, а затем проводится исследование по этому плану.
-
28 слайд
Классификация исследований по дизайну
1. Обсервационные исследования (исследования — наблюдения)
одна или более групп пациентов описываются и наблюдаются по определенным характеристикам
2. Экспериментальные исследования
оцениваются результаты вмешательства (препарат, процедура, лечение и т.д.), участвуют одна, две или более группы. Наблюдается предмет исследования -
29 слайд
Классификация научных клинических исследований
Клинические исследования
Обсервационные
Экспериментальные
Описательные
Аналитические
Сообщение о случаях
Серии случаев
Одномоментные
(поперечные)
Клинические испытания
Случай-контроль
Когортные -
30 слайд
Клинический
вопрос
Док-во
Критическая
оценка
Клинические
исследованияРезультаты
ЭпидемиологияВоздействие Риск Заболевание
Биостатистика
Процесс исследования и
доказательная медицина
Процесс
исследования
Применить
на практике
?
-
31 слайд
Структура исследований
По времени:
Поперечные исследования
Продольные исследования -
32 слайд
Продольные исследований
-
33 слайд
33
Описание случаев
Описательные обзоры – наиболее «читаемые» научные публикации, которые отражают позицию автора по конкретной проблеме
Чаще всего представляют историю болезни одного пациента
Один из способов осмысления сложных клинических ситуаций
Но не имеет научной доказательности -
34 слайд
Серии клинических случаев и клинические случаи
Больные
Записи о заболевании
Больница
Журнальная
статья -
35 слайд
Типы обсервационных исследований
Исследование серии случаев или описательное исследование
Описание серии случаев – исследование одного и того же вмешательства у отдельных последовательно включенных больных без группы контроля.
Например, сосудистый хирург может описать результаты реваскуляризации сонных артерий у 100 больных с ишемией головного мозга. -
36 слайд
Типы обсервационных исследований
Исследование серии случаев или описательное исследование, особенности
описывается определенное количество интересующих характеристик в наблюдаемых малых группах пациентов
относительно короткий период исследования
не включает никаких исследовательских гипотез
не имеет контрольных групп
предшествует другим исследованиям
этот вид исследования ограничен данными об отдельных больных -
37 слайд
Исследование случай — контроль (case control study)
Исследование, структура которого предусматривает сравнение двух групп участников с развившимся и не развившимся клиническим исходом (обычно неблагоприятным) с целью выявления различий во влиянии определенных факторов риска на развитие этого клинического исхода.
Такая структура исследования наиболее пригодна при попытках определить причину возникновения редко встречающихся заболеваний, например, развитие нарушений со стороны ЦНС у детей после применения коклюшной вакцины. -
38 слайд
38
Исследование случай-контроль (ретроспективное)
Случаи: наличие заболевания или исхода
Контроль: отсутствие заболевания или исхода
Ретроспективно оцениваются возможные причины или факторы риска заболевания, но это не исторический контроль
Отвечает на вопрос «Что произошло?»
Продольное или лонгитудиальное исследование -
39 слайд
39
Исследования«случай-контроль»
Дизайн
Воздействие
есть
Воздействия
нет
Воздействие
есть
Воздействия
нет
Заболевшие
(случай)
Не заболевшие
(контроль)
t = 0
время
Мониторинг -
40 слайд
Преимущества и недостатки
Случай-контроль
Преимущества
Лучший дизайн для редких заболеваний или условий, требующих длительные временные промежутки
Используются для тестирования первичных гипотез
Очень кратковременные
Наименее дорогие
Недостатки
Большое количество смещений и систематических ошибок
Зависит от качества первичных описаний и измерений
Трудности в подборе соответствующей контрольной группы -
41 слайд
41
Когортное исследование (cohort study)
Исследование, структура которого позволяет проследить за группой (когортой) участников и выявить различия в частоте развития у них определенных клинических исходов. -
42 слайд
Когортные исследования
Подбирается группа пациентов на предмет сходного признака, которая будет прослежена в будущем
Начинается с предположения фактора риска или исхода
Подвергшиеся воздействию ФР и Не подвергшиеся воздействию
Проспективное во времени, определение искомых факторов в экспонированной группе
Отвечает на вопрос «Заболеют ли люди, если они подверглись воздействию фактора риска?»
В основном – проспективные, но встречаются и исторические когортные (ретроспективные) -
43 слайд
43
Когортные исследования
ДизайнВоздействие
есть
Воздействия
нет
Заболевшие
Не заболевшие
Заболевшие
Не заболевшие
Время
T = 0
Мониторинг -
44 слайд
Преимущества и недостатки
Когортные испытания
Преимущества
Лучший дизайн для изучения причин состояний, заболеваний, факторов риска и результатов.
Достаточно времени для получения строгих доказательств
Многих систематических ошибок можно избежать (возникают , если исход известен заранее)
Позволяет оценить связь между воздействием фактора риска и несколькими заболеваниями
Недостатки
Лонгитудинальное
Дорогое (исследования большего числа людей)
Позволяет оценить связь между заболеванием и воздействием относительно небольшого числа факторов (тех, что были определены в начале исследования)
Не могут использоваться для редких заболеваний (размер выборки должен быть больше, чем число лиц с изучаемым заболеванием) -
45 слайд
Типы обсервационных (описательных) исследований
Поперечное исследование (распространенность)
Данные собираются в определенный момент времени
Типы:
Распространенности заболевания или исхода
Изучение течения заболевания, стадийностиОтвечают на вопрос «Сколько?»
-
46 слайд
Исследования распространённости
Дизайн
Общая
популяция
Случайная
выборка
Показатель
Заболевание
Отсутствие
заболевания
Распространённость =
= все заболевшие/ вся выборка популяции -
47 слайд
ТЕРМИНОЛОГИЯ
Преваленс (Prevalence) – распространенность. Пример: преваленс ИБС в популяции количество лиц с ИБС/общая численность популяции в процентах.Инциденс (Incidence) – первичная заболеваемость. Пример: инциденс бронхиальной астмы у детей г. Семей = число новых случаев астмы у детей г. Семей / количество детей, проживающих в г. Семей.
Преваленс (Р) тем выше, чем выше инциденс (I) и длительнее заболевание или состояние
Р = I x L -
48 слайд
РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИСПЫТАНИЕ (РКИ)
(Controlled Clinical Trials, CCT)
— ЗОЛОТОЙ СТАНДАРТ ЛЮБОГО МЕТОДА ДИАГНОСТИКИ И ЛЕЧЕНИЯ.
Обычно это исследование, в котором участников в случайном порядке (рандомизированно) распределяют в две группы — основную (где применяется изучаемое вмешательство) и контрольную (где применяется плацебо или другое вмешательство. Такая структура исследования позволяет сравнить эффективность вмешательств. -
49 слайд
Схема типичного РКИ
-
50 слайд
50
РКИ
Дизайн
Рандомизация
Улучшение
Нет
улучшения
Улучшение
Нет
улучшения
Исследование
выборки
A
B
t = 0
время
Группы, получающие
лечение -
51 слайд
51
РКИ:
Виды контрольных групп
Плацебо-контрольАктивное лечение
Сравнительная характеристика доз
-
52 слайд
Рандомизация – («random»)
Это процедура, направленная на обеспечение пациентам равных шансов получения исследуемого препарата
Позволяет минимизировать различие между характеристиками групп сравненияСоздает условия для корректного использования статистических тестов на достоверность
Современная норма и стандарт качества исследования эффективности и безопасности лекарственных средств.
-
53 слайд
Виды рандомизации
простая — (подбрасывание монетки, применение открытой таблицы случайных чисел,
метод конвертов
использование компьютерных программ генератора случайных чисел) – используется в больших РКИ
Блочная – обеспечивает равное количество участников в группах сравнения при небольших РКИ
Стратифицированная – выделение подвыборок по признаку, который может влиять на результаты исследования, например по полу -
54 слайд
Виды слепых исследований
Открытое – все все знают
Простое слепое — не знает больной
Двойное слепое – не знает больной и
врач-исследователь
Тройное слепое – не знает больной,
врач исследователь и статист
Полное слепое – не знают парамедицинские службы, обслуживающие исследование (клиническая лаборатория, рентгенографы и т д) -
55 слайд
55
Преимущества и недостатки
Контролируемые клинические испытания
Недостатки
чаще требует длительного времени
Очень дорого
Не подходит для редких заболеваний
Ограниченная возможность обобщаемости
Преимущества
самые лучшие данные для пациентов
меньше смещение (систематическая ошибка)
лучшее для оценки эффективности и проверки вмешательств
Если рандомизированное, самые строгое по дизайну и достоверные -
56 слайд
Что такое контролируемое клиническое исследование
Строгий протокол
Рандомизированное
Сравнительное
Проспективное
Слепое
Многоцентровое -
57 слайд
Разработка Протокола исследования
Протокол (программа) клинического исследования представляет собой документ, в котором содержатся инструкции для всех, кто принимает участие в клиническом исследовании, с конкретными задачами каждого участника и указаниями по выполнению этих задач.
Протокол обеспечивает квалифицированное проведение исследований, а также сбор и анализ данных, которые затем поступают на рецензию в органы контрольно-разрешительной системы. -
58 слайд
Разработка Индивидуальной регистрационной карты
Индивидуальная регистрационная карта (ИРК) представляет собой средство сбора данных исследования на бумажных носителях, проводимого в исследовательском центре. В некоторых исследованиях для этих целей используются также электронные средства. -
59 слайд
Этапы (фазы) клинического исследования
На первом этапе (1 фаза) клинического исследования исследователи изучают новое лекарство или метод лечения на небольшой группе людей (20-80 человек), для того чтобы сначала определить его безопасность, установить интервал безопасных доз и идентифицировать побочные эффекты.На втором этапе (II фаза) изучаемое лекарство или метод лечения назначается большей группе людей (100-300 человек), с целью убедиться, является ли оно эффективным, а также для дальнейшей проверки его безопасности.
-
60 слайд
Этапы (фазы) клинического исследования
На третьем этапе (III фаза) изучаемое лекарство или метод лечения назначается еще большим группам людей (1000-3000 человек) для подтверждения эффективности и безопасности, контроля побочных эффектов, а также для сравнения с часто используемыми препаратами и методами лечения, накопления информации, которая позволит использовать это лекарство или метод лечения безопасно.Четвертый этап (IV фаза) исследований проводится после того, как лекарство или метод лечения были разрешены для применения Министерством здравоохранения РК. Эти исследования продолжают тестирование изучаемого препарата или метода лечения с целью дальнейшего сбора информации о его воздействии на различные группы людей и выявлении любых побочных эффектов, проявляющихся при длительном использовании.
-
61 слайд
61
Систематический обзор (systematic review)
Обзор, представляющее собой серьезные научные исследования, в котором четко сформулирован изучаемый вопрос, подробно описаны методы, применяемые для поиска, отбора, оценки и обобщения результатов различных исследований, соответствующих изучаемому вопросу. Систематический анализ может включить в себя мета-анализ (но его применение необязательно). -
62 слайд
Мета-анализ (meta-analysis)
Суммирование результатов нескольких исследований, посвященных одной и той же тематике
В основном составляется на основе систематизированных обзоров. Метод статистического анализа, в ходе которого объединяются результаты нескольких исследований, а итоговая оценка представлена в виде одного взвешенного показателя (при этом больший вес обычно присваивают крупным исследованиям или исследованиям более высокого методологического качества). -
63 слайд
Дизайн медицинских исследований
Выводы
РКИ – максимальное по силе , но часто дорогое и время- затратное
Хорошо подготовленные обсервационные исследования дают хорошие результаты выявления причин заболеваний, но не достаточно доказательны
Когортные исследования –лучшие для исследования течения болезней и выявлении факторов риска
Исследования случай-контроль быстрые и недорогие -
64 слайд
Выбор методики исследования
Количественное исследование: призвано ответить на вопросы: “Сколько” и “Какое количество?” Направлено на выявление взаимосвязей, как правило, причинно-следственных связей между переменными.
Сбор информации по интересуемой проблеме и математический анализ полученных количественных данных.
Целью является выявление общих закономерностей, характерных не только для обследованной группы людей, но и для всей популяции в целом, что позволит исследователю интерпретировать проблему и сделать прогнозы. -
65 слайд
Качественное исследование
Призвано ответить на вопросы: “Кто? Почему? Когда? и Где?” и направлено на более глубокое изучение проблемы.
Проблема рассматривается с различных точек зрения.
Целью исследования является раскрытие характерных для исследуемой популяции принципов (паттернов) по которым протекают интересующие нас явления и которые позволят дать более глубокое понимание проблемы. -
66 слайд
Качественное исследование
Кого она оставила?
Почему ее семья переехала?
Когда они переехали?
Куда они переехали?
Чем отличается новая школьная система?
Насколько хорошо она адаптировалась?
Что можно было бы сделать для лучшей адаптации? -
67 слайд
Методы сбора данных:
Количественное
Тесты и различные методы измерения
Анкеты, вопросники
Формализованный сбор данных
Важными элементами являются:
Наличие контрольной группы
Рандомизация
Качественное
Широкий спектр методов
Наблюдение за участниками
Беседы
Полу-формализованные интервью -
68 слайд
Анализ полученных данных
Количественное
Статистика
Качественное
Данные группируют по тематическим категориям, статистические методы не применяются -
69 слайд
Достоверность доказательств
-
-
71 слайд
Пессимист видит трудности в каждой возможности.
Оптимист видит возможности в каждой трудности.Уинстон Черчилль (1874-1965)
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 144 643 материала в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 27.10.2020
- 505
- 1
- 10.10.2020
- 139
- 0
- 18.09.2020
- 205
- 0
- 14.09.2020
- 322
- 5
- 10.09.2020
- 176
- 1
- 03.09.2020
- 114
- 0
- 24.07.2020
- 131
- 0
- 13.07.2020
- 249
- 1
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Подростковый возраст — важнейшая фаза становления личности»
-
Курс профессиональной переподготовки «Управление персоналом и оформление трудовых отношений»
-
Курс повышения квалификации «Введение в сетевые технологии»
-
Курс повышения квалификации «История и философия науки в условиях реализации ФГОС ВО»
-
Курс повышения квалификации «Организация практики студентов в соответствии с требованиями ФГОС медицинских направлений подготовки»
-
Курс повышения квалификации «Правовое регулирование рекламной и PR-деятельности»
-
Курс повышения квалификации «Финансы предприятия: актуальные аспекты в оценке стоимости бизнеса»
-
Курс повышения квалификации «Источники финансов»
-
Курс профессиональной переподготовки «Организация деятельности секретаря руководителя со знанием английского языка»
-
Курс повышения квалификации «Актуальные вопросы банковской деятельности»
-
Курс профессиональной переподготовки «Управление информационной средой на основе инноваций»
-
Курс повышения квалификации «Информационная этика и право»