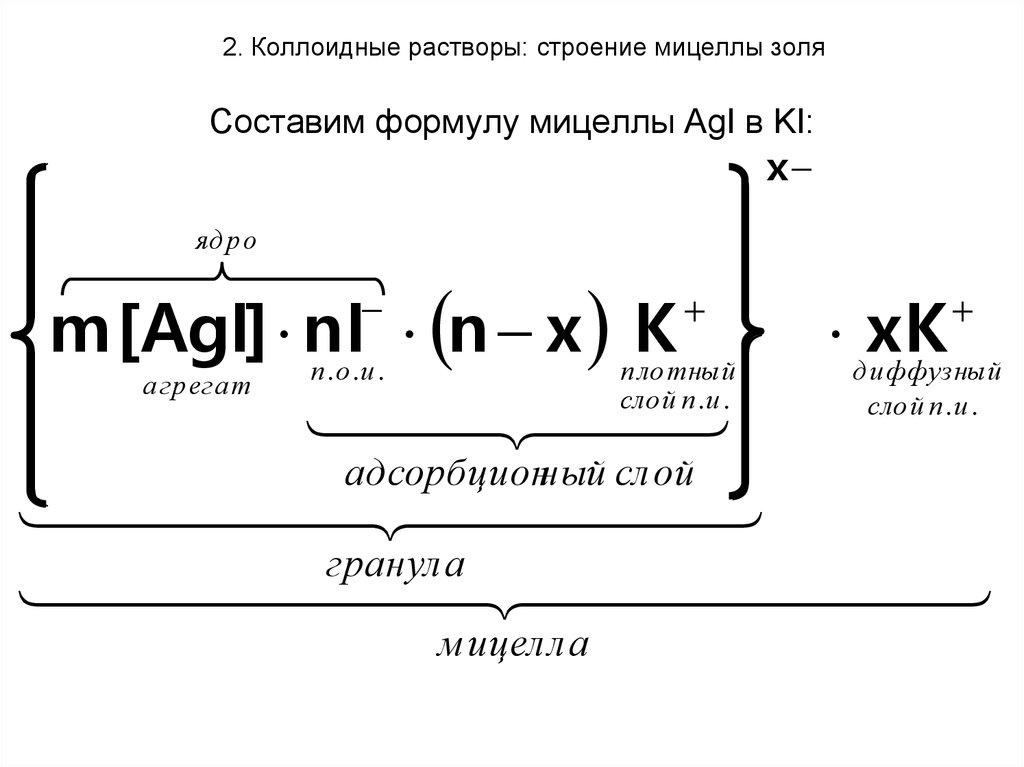
Правила составления мицелл
-
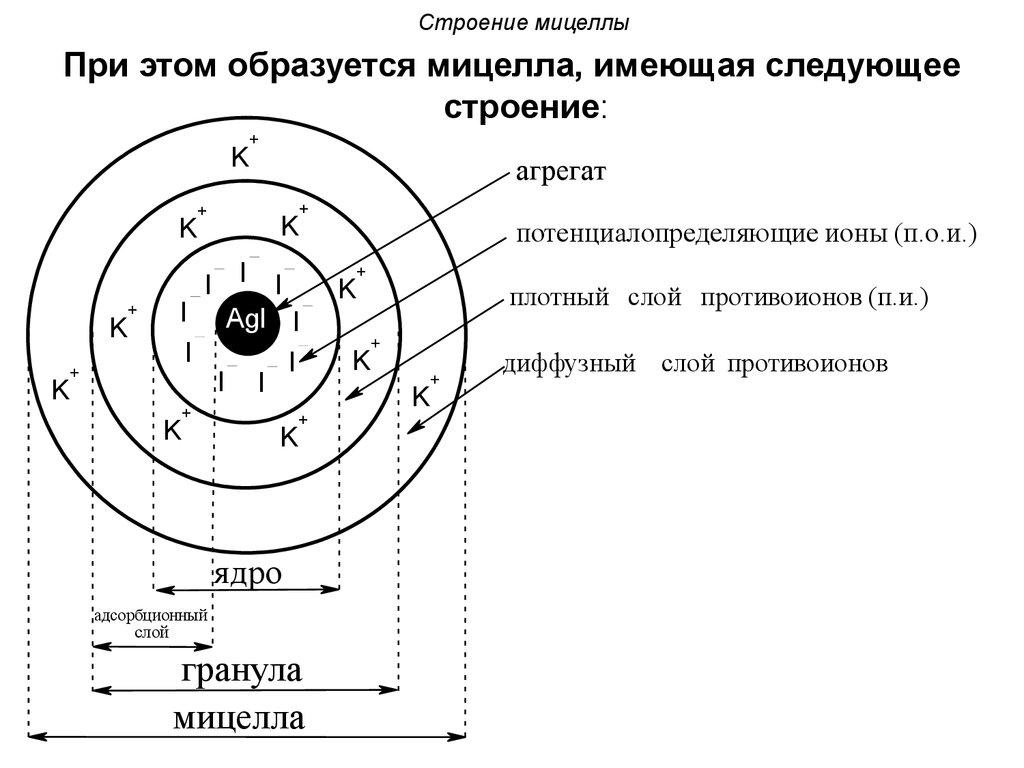
Основа мицеллы
– агрегат,
нерастворимый в данной дисперсионной
среде, состоящий из множества (m)
молекул (атомов) простого вещества. -
Согласно правилу
Пескова-Фаянса-Панета,
на
поверхности агрегата адсорбируются
ионы электролита-стабилизатора,
входящие в состав агрегата, либо имеющие
общую природу
с ним, либо специфически взаимодействующие
с ним и находящиеся
в избытке.
Ионы, сообщающие агрегату поверхностный
заряд, называются потенциалопределяющими.
Агрегат + потенциалопределяющие ионы
= ядро мицеллы. -
Заряд ядра
компенсируется эквивалентным количеством
противоположно заряженных ионов
электролита-стабилизатора – противоионов.
Часть противоионов, прочно связанных
с ядром, входит в адсорбционный
слой. Агрегат
+ адсорбционный слой = коллоидная
частица (имеет заряд). -
Остальная часть
противоионов образует диффузионный
слой. -
Суммы электрических
зарядов коллоидной частицы и диффузионного
слоя равны друг другу по абсолютной
величине и противоположны по знаку. -
Электрический
заряд коллоидной частицы равен
алгебраической сумме электрических
зарядов потенциалопределяющих ионов
и противоионов адсорбционного слоя. -
Мицелла гидрофобного
золя является электронейтральной,
т.е. алгебраическая сумма электрических
зарядов ионов всех слоев равна нулю
Для
любого типа реакции одно из исходных
веществ берут в избытке по сравнению
со стехиометрически необходимым
соотношением:
Na3AsO3
+ 3AgNO3
→ ↓Ag3AsO3
+ 3NaNO3
избыток
осадок
Электролитическая
диссоциация электролита, взятого в
избытке:
Na3AsO3
3Na+
+ AsO33-
{mAg3AsO3·nAsO33-
3(n—x)Na+}-3x3xNa+
Агрегат
Потенциалоп- Противоионы Ионы
ределяющие адсорбционного
диффузионного
ионы
слоя слоя
Ядро
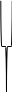
Адсорбционный
слой Диффузионный слой
Коллоидная
частица
Здесь
m,
n,
x
– натуральные числа;
m
– число молекул в агрегате;
n
– число потенциалопределяющих ионов;
(n
– x)
– число противоионов адсорбционного
слоя;
x
– число противоионов диффузного слоя.
Численный
коэффициент 3 перед (n
– x)
и х
поставлен ввиду трехосновности аниона
AsO33-.
Определение заряда коллоидной частицы (правило 6)
n(-3)
+ 3(n
– x)(+1)
= -3x
Для проверки
правильности записи формулы мицеллы
подсчитывают алгебраическую сумму
зарядов всех ионов (правило 7):
n(-3)
+ 3(n
– x)(+1)
+ 3х(+1)
= 0
Коллоидная частица
имеет отрицательный заряд, мицелла в
целом электронейтральна.
Работа № 4
МИЦЕЛЛООБРАЗОВАНИЕ
В РАСТВОРАХ
ПОВЕРХНОСТНО-АКТИВНЫХ
ВЕЩЕСТВ
-
Какие
вещества называют поверхностно-активными
(ПАВ)? -
Как
классифицируют ПАВ? -
Чем отличаются
коллоидные ПАВ от истинно растворимых?
Что называется критической
концентрацией мицеллообразования
(ККМ)? -
Что
такое поверхностная
активность
коллоидных ПАВ? -
Как зависит форма
мицелл от концентрации ПАВ в растворе?
Каким образом ориентируются молекулы
ПАВ в мицеллах в полярной
и неполярной
средах? -
Какое явление
называют солюбилизацией?
Чем обусловлено это явление? Каково
практическое
значение
этого явления? -
Факторы, влияющие
на ККМ в растворах ПАВ:
-
влияние длины
углеводородного радикала
на ККМ в разных по полярности
растворителях; -
влияние природы
полярной группы
молекулы ПАВ; -
влияние добавок
индифферентного электролита
на ККМ ионогенных
и неионогенных
ПАВ; -
зависимость
мицеллообразования от температуры,
точка Крафта.
-
Условия образования
мицеллярных
растворов ПАВ. -
Методы определения
ККМ. Почему при концентрации выше ККМ
поверхностное натяжение растворов
ПАВ не изменяется? -
Как влияет явление
мицеллообразования на подвижность
ионов?
Работа №5
-
Что
такое защитное
действие
ВМС? -
Механизм
образования
защитного действия. -
Что
такое флокуляция? -
Что
такое сенсибилизация? -
Действие
стабилизаторов. -
Особенности
белков как
стабилизаторов. Смешанные пленки. -
Влияние
заряда
на прочность
макромолекул. -
Что
такое
осмотическое
расклинивающее
давление?
Работа №6
-
Перечислить три
механизма
образования двойного электрического
слоя (ДЭС). -
Строение
ДЭС. -
Факторы, влияющие
на -потенциал:
а) 0;
б) добавка
индифферентного электролита;
в) добавка
неиндифферентного электролита;
г) рН среды;
д) концентрация
золя;
е) температура;
ж) природа
дисперсионной среды.
-
Особенности
белковых веществ как коллоидов: строение
ДЭС в кислой
и щелочной
средах. -
Обоснование
возможности разделения белков
электрофорезом. -
Изоэлектрическая
точка
белков.
Работа № 7
АДСОРБЦИЯ И
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ НА ГРАНИЦЕ
«ЖИДКОСТЬ-ГАЗ»
-
Что
называется поверхностным
натяжением?
Единицы измерения? -
Методы измерения
поверхностного натяжения (4 самых
распростра-ненных метода). -
Что лежит в основе
определения поверхностного натяжения
по методу Ребиндера?
Работа установки. Формула
расчета
поверхностного натяжения по методу
наибольшего
давления воздуха в пузырьке. -
Зависимость
поверхностного натяжения жидкости от
температуры. -
Почему
жидкость стремится принять форму шара? -
*Что такое
поверхностно-активные вещества? Их
структура? При-вести примеры. -
Как поверхностное
натяжение зависит от концентрации для
ПАВ
(поверхностно-активных веществ) и ПИВ
(поверхностно-инактивных веществ)? -
Понятие Гиббсовской
адсорбции,
её размерность и физический смысл. -
Зависимость
Гиббсовской адсорбции от концентрации,
от температуры. -
Что такое
поверхностная
активность
вещества? Анализ уравнения Гиббса. -
Как определить
поверхностную активность графическим
методом? -
У какого из этих
веществ поверхностная активность будет
больше: СН3СООН;
С2Н5СООН;
С3Н7СООН
и т.д.? -
Понятие предельной
адсорбции. -
Как определить
площадь, приходящуюся на одну молекулу
в насыщенном
адсорбционном слое? Зависит ли эта
площадь от длины
радикала? -
Как определить
линейные размеры молекулы ПАВ по
величине
адсорбции? -
Какие характеристики
и величины можно рассчитать, исходя из
уравнения
Гиббса?
Работа № 7а
АДГЕЗИЯ, СМАЧИВАНИЕ
И РАСТЕКАНИЕ ЖИДКОСТЕЙ
-
Что такое адгезия?
Определение, единицы измерения. Работа
адгезии. -
Что такое когезия?
Определение, единицы измерения. Работа
когезии. -
Уравнение Дюпре.
Условие растворения. -
Что такое смачивание?
Нарисовать векторы сил, действующих
на каплю жидкости, помещенную на твердую
поверхность. -
Что такое краевой
угол смачивания?
Как по нему оценить гидрофильность/гидрофобность
поверхности? -
Закон Юнга.
-
Уравнение
Дюпре-Юнга. -
Растекание
жидкости. Эффект Марангони.
Работа № 8
МОЛЕКУЛЯРНАЯ
АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА
«ЖИДКИЙ РАСТВОР
– ТВЕРДЫЙ АДСОРБЕНТ»
-
Что называется
адсорбцией?
Что такое адсорбент,
адсорбат
и адсорбтив?
Количественные
характеристики
адсорбции (абсолютная
и избыточная
величины). -
Дайте определение
изотермы,
изостеры
и изопикны
адсорбции. Их графическое
построение. -
При каких
условиях
соблюдается при адсорбции закон
Генри?
Физический
смысл константы
Генри? -
Уравнение
изотермы
мономолекулярной адсорбции Ленгмюра.
Анализ
его, физический
смысл
входящих в него величин. При каких
условиях
это уравнение применимо? -
Чем отличаются
константы
адсорбции в уравнениях Ленгмюра
и Генри,
какова взаимосвязь
между ними? -
Уравнение
Фрейндлиха,
физический
смысл входящих в него констант.
Область применения. -
Как определяют
константы
уравнения
Ленгмюра
и Фрейндлиха? -
Какие геометрические
характеристики можно рассчитать, зная
константы уравнения Ленгмюра? -
Какова ориентация
молекул ПАВ на поверхности адсорбента
в случае предельной
адсорбции
(нарисовать)? Чем определяется величина
площади
молекулы в
адсорбционном слое? -
Какие формулы
используют для расчета
величины адсорбции
из экспериментальных данных? -
На чем основано
измерение
удельной поверхности
твердых адсорбентов? -
Чем отличается
адсорбция из растворов
от адсорбции газов
и
паров?
Работа № 9
ОПТИЧЕСКИЕ МЕТОДЫ
АНАЛИЗА ДИСПЕРСНЫХ СИСТЕМ
ТУРБИДИМЕТРИЯ
-
Какие оптические
явления
наблюдаются при падении
луча света
на дисперсную систему? Какие методы
исследования
дисперсных систем основаны на этих
явлениях? -
Какие оптические
методы
используются для определения
размеров частиц
дисперсных систем? Укажите границы
применимости
(по дисперсности) этих методов. -
Чем обусловлено
светорассеяние
в дисперсных
системах и
истинных
растворах?
Какими параметрами
количественно характеризуют рассеяние
света в системе? -
Какова связь между
оптической
плотностью
и мутностью
«белых» золей? Для каких дисперсных
систем применимо уравнение
Рэлея? -
Как влияют размеры
частиц на
зависимость оптической
плотности
«белых» золей от длины
волны
падающего света? -
Чем различаются
методы нефелометрии
и турбидиметрии?
Какие уравнения
используются для определения характеристик
рассеяния света? -
Для каких дисперсных
систем применимо уравнение Дебая?
Какие параметры
дисперсных систем определяют по методу
Дебая? -
В чем заключаются
особенности метода ультрамикроскопии?
Для каких дисперсных систем применим
этот метод? Какие характеристики
дисперсных систем могут быть определены
этим методом?
Лабораторная
работа № 10
СЕДИМЕНТАЦИОННЫЙ
АНАЛИЗ СУСПЕНЗИЙ
-
Понятие
о дисперсных системах, количественные
характеристики
дисперсных систем (Лекция №1). -
Цель седиментационного
анализа. Практическое применение
результатов седиментационного анализа. -
Методика
седиментационного анализа. -
Закон Стокса.
Номограмма
Стокса, её использование. -
Что такое
седиментация?
Какие силы
действуют на частицу? -
Напишите уравнение
Стокса для
скорости
оседания
частиц. Каков физический
смысл
входящих в него величин? Изменением
каких параметров
системы можно изменять скорость
осаждения
частиц? -
Кривая
седиментации полидисперсной
системы. Как определяют размеры
частиц, используя кривую седиментации? -
Определите по
графику массу
фракции,
радиус частиц которой равен или больше
радиуса в данной точке. -
Определите по
графику массу фракции для заданного
интервала размеров (например от радиуса
r3
до r4). -
Что можно определить,
используя дифференциальную
кривую
распределения частиц по размерам? -
Как определить
содержание
частиц для
данного интервала размеров по
дифференциальной кривой распределения? -
Как рассчитать
удельную
поверхность
дисперсной фазы Sуд?
Лабораторная
работа № 11
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Составление формулы мицеллы коллоидного раствора
Методические рекомендации
По решению задач
«Коллоидные растворы»
для специальностей 19.02.03 «Технология хлеба, кондитерских и макаронных изделий»; 19.02.05 «Технология бродильных производств и виноделие»; 19.02.10 «Технология продукции общественного питания»
Коллоидные растворы
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
AgNO3 + NaCl → NaNO3 + AgCl↓
Ag + + NO3 — + Na + + Cl — → Na + + NO3 — + AgCl↓
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами, обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции Сl — , на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl — называются потенциалопределяющими ионами.
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы. В данном случае – это ионы Na + .

Агрегат, ядро, адсорбционный слой образуют гранулу. Заряд гранулы поределяется знаком заряда потенциалопределяющих ионов (Сl — ), обозначается в правом верхнем углу.
Гранула имеет вид:
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.

Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
Формула мицеллы:




m ‑ количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n – х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Мицелла: строение, схема, описание и химическая формула
Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.
Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.
Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
Условия проведения химической конденсации
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:
- содержание веществ в смешиваемых растворах должно быть низким;
- скорость их смешивания должна быть невысокой;
- один из растворов должен быть взят в избытке.
Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва 2+ . Со слоем потенциалопределяющих ионов связано 2(n — x) ионов Cl — . А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.
Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO4 2- , а противоионами – Na + . В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Запись мицеллы
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:
Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:
Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли — Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Влияние концентрации на форму мицеллы
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).
Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Алгоритм составления формулы мицеллы
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1. Агрегатом является получающийся в ходе реакции осадок.
2. Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3. Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4. Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
Ag + + NO3 — + Na + + Cl — #8594; Na + + NO3 — + AgCl#8595;
Ag + + Cl — #8594; AgCl#8595;
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами . обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции Сl -. на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl — называются потенциалопределяющими ионами.
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы. В данном случае – это ионы Na + .
Агрегат, ядро, адсорбционный слой образуют гранулу. Заряд гранулы поределяется знаком заряда потенциалопределяющих ионов (Сl — ), обозначается в правом верхнем углу.
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
агрегат адсорбционный слой диффузионный слой
m #8209; количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n –х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Задачи для самостоятельного решения:
1. Составить схему строения мицеллы золя гидроксида меди (II) в растворе хлорида меди.
2.Составить формулу мицеллы по уравнению: FeCL3 +3NaOH=Fe(OH)3+3NaCl
3. Золь иодида серебра получен при добавлении к раствору AgNO3 избытка KI. Определить заряд частиц полученного золя и написать формулу его мицеллы.
4. Напишите формулу мицеллы сульфата бария, полученного сливанием одинакового объема сильно разбавленной серной кислоты и менее разбавленного раствора хлорида бария.
5. Золь сернокислого бария получен смешением равных объемов растворов Ва(NО3)2 иН2SО4. Написать формулу мицеллы.
6. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и NaОН. Напсать формулу мицеллы золя.
Самостоятельная работа № 8
Тема 2.3. Растворы высокомолекуляр-ных соединений
Задания
1. Выполнение домашних заданий по теме 2.3
2. Составление конспекта по учебнику о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Порядок выполнения задания: составление конспекта о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Методические рекомендации по написанию конспекта представлены в самостоятельной работе № 4.
Список литературы
1. Белик В.В. Физическая и коллоидная химия: учебник для студ. учреждений сред. проф. образования – М.: «Академия», 2013. – 288 с.
2. Макаров А.Г. Теоретические и практические основы физической химии: учебное пособие/ А.Г. Макаров, М.О. Сагида, Д.А. Раздобреев; Министерство образования и науки Российской Федерации. — Оренбург: Оренбургский государственный университет, 2015. — 172 с. [Электронный ресурс]
3. Органическая и физколлоидная химия: практикум / сост. И.В. Васильцова, Т.И. Бокова, Г.П. Юсупова. — Новосибирск: Новосибирский государственный аграрный университет, 2013. — 155 с. [Электронный ресурс]
источники:
http://fb.ru/article/379039/mitsella-stroenie-shema-opisanie-i-himicheskaya-formula
http://lektsia.com/8x54ea.html
1. Реакция будет иметь вид:
MgCl2(избыток) + 2NaOH = Mg(OH)2 + 2NaCl.
MgCl2 = Mg2+ + 2Cl—.
Так как в избытке MgCl2, то потенциалопределяющим ионом будет Mg2+
Противоионами будут служить ионы Cl–
Формула мицеллы золя будет выглядеть следующим образом:
{[Mg(OH)2)m]·nMg2+, 2(n-x)Cl–]}2x+·2xCl–
Строение мицеллы. Задачи 136 — 138 (buzani.ru)
2. Коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности). Следовательно, наименьший порог коагуляции (или наибольшая коагулирующая способность) у иона с большим зарядом по отношению к иону с меньшим зарядом, т.е. коагулирующая способность трёхзарядного иона выше коагулирующей способности двухзарядного иона и тем более однозарядного.
Поскольку в электролитах K3PO4, (CHCOO)2Zn, AlCl3 заряд катионов в ряду наибольший у Al3+, то AlCl3 будет обладать наименьшим порогом коагуляции в случае если потенциалопределяющими ионами будут катионы (электролит взят в избытке). Если же потенциалопределяющими ионами будут являться анионы, то наименьшим порогом коагуляции будет являться K3PO4, так как электролит содержит 3-зарядный ион PO43— — электролит взят в недостатке.
Порог коагуляции золя. Задачи 16 — 19 (buzani.ru)
Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.
Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.
Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
- Ионный обмен: NaCl + AgNO3 = AgCl↓ + NaNO3.
- Окислительно-восстановительные процессы: 2H2S + O2 = 2S↓ + 2H2O.
- Гидролиз: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S.
Условия проведения химической конденсации
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:
- содержание веществ в смешиваемых растворах должно быть низким;
- скорость их смешивания должна быть невысокой;
- один из растворов должен быть взят в избытке.
Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
BaCl2(p) + Na2SO4(p) = BaSO4(т) + 2NaCl(p).
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва2+. Со слоем потенциалопределяющих ионов связано 2(n — x) ионов Cl—. А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.
Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO42-, а противоионами – Na+. В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Запись мицеллы
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:
CuCl2 + Na2S = CuS↓ + 2NaCl.
Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
{[mCuS]·nCu2+·xCl—}+(2n-x) ·(2n-x)Cl—.
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:
{[m(CuS)]∙nS2–∙xNa+}–(2n – x) ∙(2n – x)Na+.
Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли — Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Влияние концентрации на форму мицеллы
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).
Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.