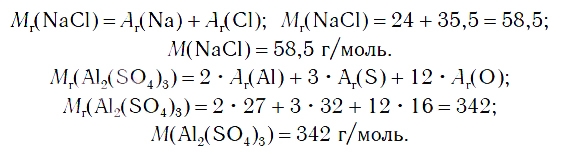Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.

Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2

Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.


Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
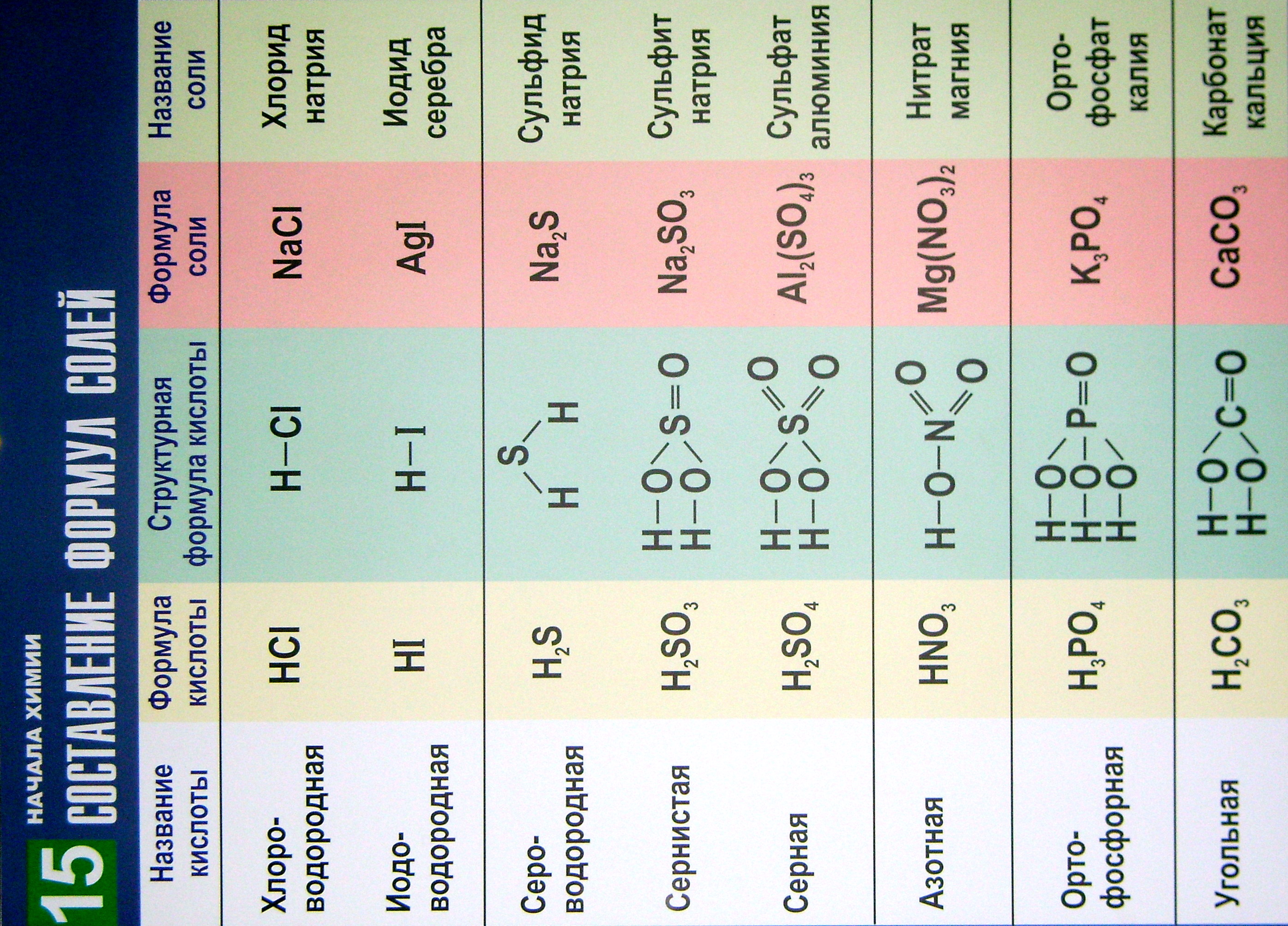
В таблице 15 приведены
названия часто встречающихся кислот,
их молекулярные и структурные формулы,
а также формульные единицы и названия
соответствующих солей.
Таблица помогает
составлять химические формулы солей
бескислородных и кислородсодержащих
кислот. Для образования химических
формул солей надо атомы водорода в
кислотах заменить на атомы металлов с
учётом их валентности.
Приведённые
названия кислот и солей соответствуют
принятой международной номенклатуре.
Название
бескислородных кислот образуются по
правилам для бинарных соединений.
Названия солей
начинаются с названия кислотного остатка
в именительном падеже. Это название
образуется из корня латинского названия
химического элемента, образующего
кислоту, и окончания «ат» или «ит»
в случае солей кислородсодержащих
кислот, для солей бескислородных кислот
– «ид».
Затем в солях бескислородных кислот
называется металл в родительном падеже.
Причём если атом металла может иметь
разную валентность, то её отмечают
римской цифрой (в скобках) после названия
химического элемента (без пробела).
Например, хлорид железа(II) и хлорид
олова(IV).
Включение в таблицу
названий молекулярных и структурных
формул часто встречающихся кислот
позволяет легко запомнить приведённые
в ней сведения.
Названия кислот
типа HnXOm
составляют с учётом валентности (степени
окисления) центрального атома:
-
атом X
имеет высшую (или единственную)
валентность (степень окисления): H2SО4
–
серная; HNО3
–
азотная; Н2СО3
– угольная; -
атом X
имеет промежуточные степени окисления:
H2SO3
–
сернистая; HNО2
–
азотистая; НСlО – хлорноватистая.
Таблица 15
Составление химических формул солей
16. Генетическая связь классов неорганических веществ
Таблица 16 показывает
в виде схемы взаимосвязь неорганических
веществ разных классов. Изучение свойств
веществ показывает, что можно при помощи
химических реакций переходить от простых
веществ к сложным и от одних сложных
веществ к другим. Связь между веществами
разных классов, основанная на их
взаимопревращениях и отражающая единство
их происхождения, называется
генетической.
Вещества по составу
подразделяются на простые и сложные.
Среди простых веществ различают
металлы и неметаллы. Эти две группы
веществ могут образовывать многочисленные
сложные вещества. К основным классам
неорганических соединений принадлежат
оксиды, гидроксиды и соли. Связь между
этими классами веществ обозначена при
помощи стрелок.
По таблице можно
проследить переходы металлов и неметаллов
в оксиды и гидроксиды:
|
металл |
+ |
О2 |
→ |
оксид, |
оксид металла |
+ |
Н2О |
→ |
гидроксид1 |
|
|
неметалл |
+ |
О2 |
→ |
оксид, |
оксид неметалла |
+ |
Н2О |
→ |
кислород |
Эти две цепочки
превращений аналогичны и роднят металлы
и неметаллы.
Однако надо
подчеркнуть, что простое вещество металл
является родоначальником сложных
веществ, обладающих оснóвными
свойствами (оснóвных оксидов и оснований).
Простое вещество неметалл выступает в
качестве родоначальника сложных
веществ, проявляющих кислотные свойства
(кислотных оксидов и кислот).
Различие свойств
кислотных и оснóвных оксидов, а также
свойств кислот и оснований приводит к
их взаимодействию друг с другом с
образованием солей. Таким образом, соли
генетически связаны с исходными
веществами – металлами и неметаллами
– посредством
их оксидов и гидроксидов.
Так как соли
представляют собой продукты реакций
кислот и оснований, то по составу
различают средние (нормальные), кислые
и оснóвные соли. Кислые соли содержат
в своём составе атомы водорода, оснóвные
– гидроксогруппы. Названия кислых солей
складываются из названий солей с
прибавлением слова «гидро», а
основных –
«гидроксо».
Существуют также
двойные соли (соли двух металлов), к ним
относят, например, алюмокалиевые квасцы
KA1(SО4)2
· 12Н2О,
смешанные соли NаСl · NаF, СаВrСl, комплексные
соли Nа2[Zn(ОН)4],
К3[Fе(СN)6],
К4[Fе(СN)6],
включая кристаллогидраты СuSО4
· 5Н2О
(медный купорос), Nа2SО4
· 10Н2О
(глауберова соль)
Необходимо научиться
составлять химические формулы гидроксидов
(кислородсодержащих кислот и оснований)
для атома элемента Э с валентностью
«n». Гидроксиды получают по реакции
присоединения воды к соответствующим
оксидам. При этом не имеет значение,
происходит ли эта реакция в реальных
условиях. Например, химическую формулу
угольной кислоты получают сложением
всех атомов по уравнению реакции
СО2
+ Н2О
= Н2СО3.
Химические формулы
метафосфорной,
пирофосфорной
и ортофосфорной
кислот составляют из формулы оксида
фосфора(V)1
и соответственно одной, двух и трёх
молекул воды:
Р2О5
+ Н2О
= 2НРО3;
Р2О5
+ 2Н2О
= Н4Р2О7;
Р2О5
+ 3Н2О
= 2Н3РО4.
Приведённая схема
взаимосвязи между классами неорганических
веществ не охватывает всего многообразия
химических соединений. В этой схеме в
качестве бинарных веществ выступают
оксиды,
Таблица 16
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
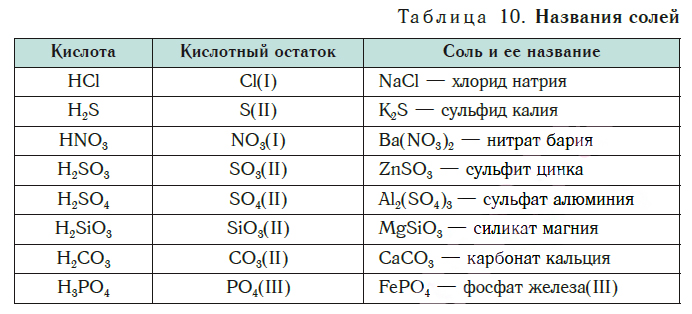
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- 8-11 класс: Умскул, Годограф, Знанио.
- Английский: Инглекс, Puzzle, Novakid.
- Взрослым: Skillbox, Нетология, Geekbrains, Яндекс, Otus, SkillFactory.
Соли
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Соли по своему составу похожи на кислоты, только вместо атомов водорода – ионы металлов. Поэтому их можно назвать продуктами замещения атомов водорода в кислоте на ионы металлов. Например, поваренную соль NaCl можно рассматривать как продукт замещения водорода в соляной кислоте HCl на ион натрия.
Заряд иона натрия равен 1+, а заряд иона хлора 1-. Поскольку это соединение электрически нейтрально, формула поваренной соли Na⁺Cl⁻. Если нужно вывести формулу сульфида алюминия (III), делается это следующим образом:
- Записывают заряды ионов, входящих в соединение: Al3+S2-. Заряд иона алюминия равен 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты H2S, он равен 2-.
- Находят наименьшее общее кратное значений зарядов для ионов алюминия и серы (3 и 2), оно равно 6.
- Находят индексы, разделив наименьшее общее кратное на значения зарядов, и записывают формулу:
Аналогичным образом выводят формулы солей со сложными ионами кислородсодержащих кислот. Например, выведем формулу кальциевой соли фосфорной кислоты – фосфата кальция. Используя таблицу Менделеева, определяем, что заряд иона кальция, который является элементом главной подгруппы II группы (IIA группы), равен 2+. Из формулы фосфорной кислоты H3PО4 определяем заряд иона, образованного кислотным остатком: . Отсюда получаем формулу фосфата кальция:
(читается «кальций три, пэ-о-четыре дважды»).
Легко понять, что формулы для солей выводятся по зарядам ионов точно так же, как формулы для бинарных соединений по валентности и степеням окисления составляющих элементов.
Вы уже рассмотрели, как образуются названия солей бескислородных кислот, когда знакомились с номенклатурой бинарных соединений: соли HCl называются хлоридами, а соли H2S – сульфидами.
Название солей кислородсодержащих кислот составляется из двух слов: название иона, образованного кислотным остатком, в именительном падеже и название иона металла в родительном. Названия ионов кислотных остатков образуются из корней названий элементов с суффиксами -aт для высшей степени окисления и -ит для низшей степени окисления атомов неметаллов, которые образуют сложный ион остатка кислородсодержащей кислоты.
Например, соли азотной кислоты HNO3 называются нитратами: KNO3 – нитрат калия, а соли азотистой кислоты HNO2 нитритами: Ca(NO2)2 – нитрит кальция. Если металл имеет разные степени окисления, то они записываются в скобках римской цифрой, например: Fe2+SO3 – сульфит железа (II), – сульфат железа (III).
По растворимости в воде соли делятся на растворимые (P), нерастворимые (H) и малорастворимые (M). Чтобы определить растворимость солей, используют таблицу растворимости кислот, оснований и солей в воде. Если этой таблицы нет под рукой, можно воспользоваться следующими правилами:
- Растворимы все соли азотной кислоты – нитраты.
- Растворимы все соли соляной кислоты – хлориды, кроме AgCl (H), PbCl2 (M).
- Растворимы все соли серной кислоты – сульфаты, кроме BaSO4 (H), PbSO4 (H), CaSO4 (M), Ag2SO4 (M).
- Растворимы соли натрия и калия.
- Нерастворимы все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и K+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты – хлорид натрия NaCl – и нерастворимые кальциевые соли угольной и фосфорной кислот – карбонат кальция CaCO3 и фосфат кальция Ca3(PO4)2.
Хлорид натрия NaCl
Хлорид натрия NaCl – хорошо растворимая соль в воде, известная как поваренная соль. Без этой соли жизнь растений, животных и человека была бы невозможна, поскольку она обеспечивает основные физиологические процессы в организмах: соль в крови создаёт необходимые условия для существования кровяных телец, в мышцах она определяет способность к возбуждению, в желудке образует соляную кислоту, без которой переваривание и усвоение пищи было бы невозможным.
С древних времен известно, что соль необходима для жизни. Её важность отображается в многочисленных пословицах, поговорках, обычаях. «Хлеб да соль» – одно из пожеланий русских людей, подчёркивающее, что соль так же важна, как и хлеб. Хлеб и соль стали символами гостеприимства и сердечного радушия русского народа.
Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не долго: за год один человек съедает 3–5,5 кг соли, поэтому за два года двое съедают пуд соли (16 кг).Слово соль входит в названия многих городов и поселков, таких как Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Солтвиль и Зальцбург и т. д.
Соль образует толстые отложения в земной коре. Например, в Соль-Ирецке толщина слоя соли превышает 1,5 километра. Соли в озере Баскунчак в Астрахани хватит нашей стране на 400 лет. Воды морей и океанов содержат большое количество соли. С помощью соли, добытой из Мирового океана, можно покрыть всю сушу земного шара слоем в 130 метров. Во многих странах Азии и Африки соль часто добывают из соляных озёр, а в европейских странах – из соляных шахт.
Хлорид натрия широко используется в химической промышленности при производстве натрия, хлора и соляной кислоты, в медицине, в кулинарии и при консервировании пищевых продуктов (соление и квашение овощей).
Карбонат кальция CaCO3
Карбонат кальция CaCO3 – нерастворимая в воде соль, из которой многие морские животные (моллюски, раки, простейшие) строят свои покровы тела – раковины и кораллы. Остатки коралловых полипов образуют тропические острова (атоллы) и коралловые рифы. Самым известным из них является Большой Барьерный риф в Австралии. В течение миллионов лет эти раковины, отложившиеся на дне вод, после смерти своих «хозяев», образовывали толстые слои соединений кальция, из которых образовались породы, известные как известняк CaCO3.
Кроме того, мрамор и мел, полученные из карьеров и меловых гор, имеют ту же формулу. Известняк используется для производства негашёной и гашёной извести, и в строительстве. Мрамор используется для изготовления статуй и отделки станций метро.
Наземные животные используют карбонат кальция для создания своего скелета – внутренней опоры для своих мягких тканей, вес которых в десять раз превышает вес самой опоры.
Фосфат кальция Ca3(PO4)2 – нерастворимая в воде соль является основой минералов фосфоритов и апатитов. Они используются для производства фосфатных удобрений, без которых высокие урожаи в сельском хозяйстве были бы невозможны. Фосфат кальция также является компонентом костей животных.
- До 7 класса: Алгоритмика, Кодланд, Реботика.
- 8-11 класс: Умскул, Годограф, Знанио.
- Английский: Инглекс, Puzzle, Novakid.
- Взрослым: Skillbox, Нетология, Geekbrains, Яндекс, Otus, SkillFactory.