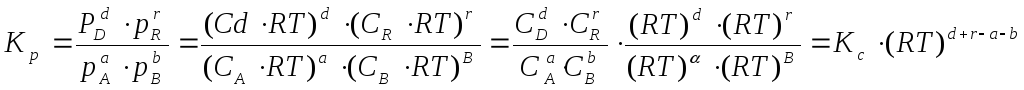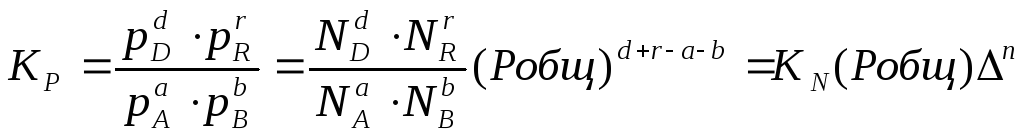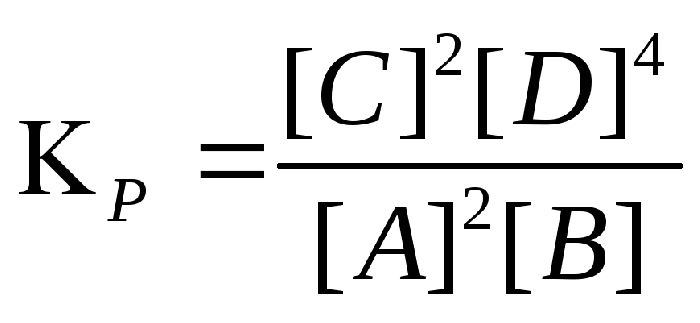Константа
равновесия может быть выражена различными
способами. Если концентрации веществ,
участвующих в реакции, выражены в
молярных единицах молярности , т.е. в
моль/л, то она обычно обозначается Кс и
для равновесия обратимой реакции
аА
+ bB
dD
+ rR
записывается в
виде:

Для
гомогенной газовой реакции константу
равновесия удобнее выразить через
парциальные давления веществ:
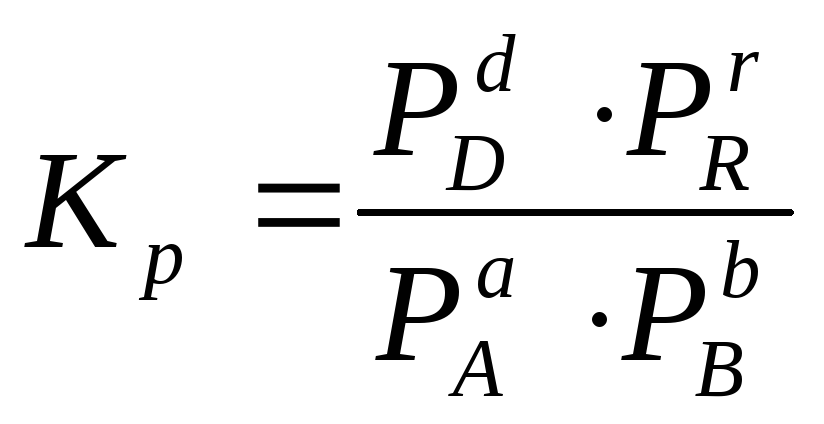
Иногда
константу равновесия удобно выразить
не через парциальные давления и
концентрации, а через количества
веществ:
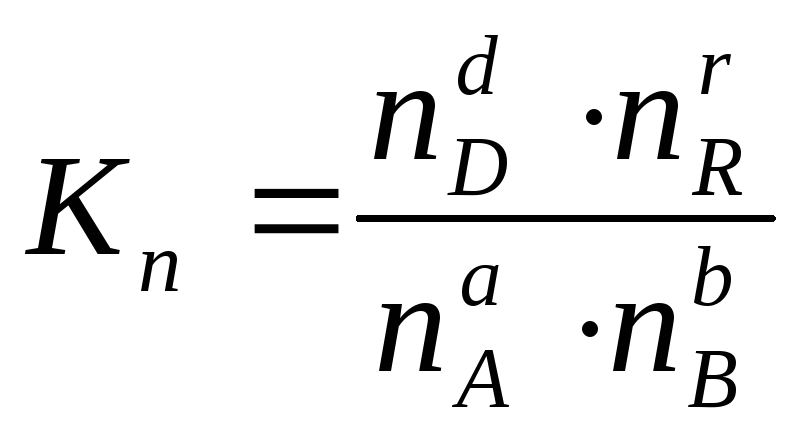
или через
соответствующие мольные доли:
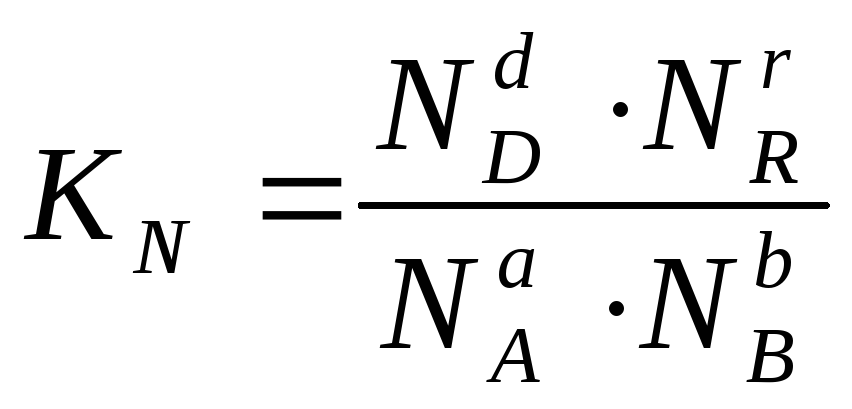
В
общем случае константы равновесия Кс,
Кр, Кn
и КN
различны по значениям. Установим связь
между ними.
В
газовых системах, для характеристики
которых применимо уравнение состояния
идеальных газов Менделеева – Клайперона,
значение парциального давления любого
компонента можно вычислить следующим
образом:
откуда
(2.8)
где
C
– концентрация i-го
компонента, выраженная в моль/л. Подставим
значение р из уравнения (2.8) в уравнение
(2.5) и получим соотношение, которым
определяется связь Кс и Кр:
или
,
(2.9)
где
–
изменение числа моль в результате
реакции.
Для
идеальных газов парциальные давления
связаны с общим давлением Робщ
и мольной долей Ni
данного компонента в смеси согласно
законам Дальтона следующим равенством:
pi
= NiPобщ
(2.10),
где
рi
– парциальное давление компонента; Ni
– мольная доля этого компонента в смеси;
Робщ
– общее давление.
Подставим
значение рi
в уравнение (2.5), получим:
или
Кр
= К∙ (Робщ)∆n
(2.11).
Воспользовавшись
соотношением Pi
= Ni∙
Робщ
=общ)∆n,
где
ni
– число моль компонента i
в смеси, а ni
– число моль всех компонентов в смеси,
получаем:
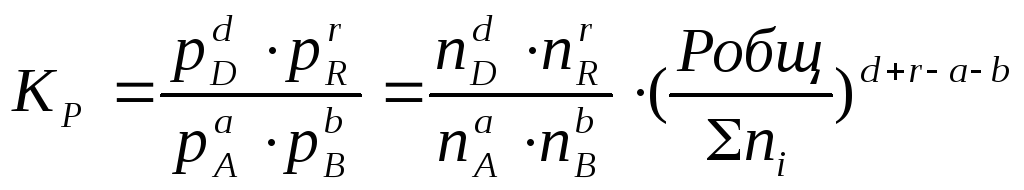
Таким
образом, если n≠
0, т.е. если
реакция сопровождается изменением
числа моль, то имеет место соотношение:
(2.12).
Если
же ∆n=0
(реакция не сопровождается изменением
числа моль), то Кр
= Кс
= Кn
= KN
, т.е. значения
всех видов констант равновесия совпадают.
Кр
и Кс
для реакции идеальных газов не зависят
от давления.
КN
и Кn
от давления зависят в случае ∆n≠0.
2.4. Смещение химического равновесия
При
постоянных условиях химическое равновесие
сохраняется как угодно долго. Однако
внешние условия не могут бесконечно
оставаться неизменными, а изменение
хотя бы одного из них нарушает состояние
равновесия, т.е. скорос-
ти
прямой и обратной реакций не будут равны
между собой (v1
v2).
Но, так как все физико-химические системы
самопроизвольно стремятся к состоянию
равновесия, то с течением времени оно
вновь установится. Однако, это будет
новое равновесие, с другими значениями
равновесных концентраций, отвечающими
другим, изменившимся условиям.
В
каком направлении сместится равновесие
при том или ином внешнем воздействии?
Ответ на этот вопрос дает принцип
Ле-Шателье
Брауна, который можно сформулировать
следующим образом: если
на систему, находящуюся в состоянии
равновесия, оказывается какое – либо
внешнее воздействие, то система отвечает
таким образом, чтобы это воздействие
ослабить.
При этом, если в результате нарушения
равновесия скорость прямой реакции
будет больше скорости обратной реакции,
то говорят, что равновесие смещено
вправо (v1
v2),
и соответственно, если преобладает
скорость обратной реакции, говорят, что
равновесие смещено влево (v1
v2
).
Важнейшими
условиями, определяющими состояние
химического равновесия, являются:
1) концентрация
реагирующих веществ
2) температура
3)
давление (для реакций, протекающих с
изменением давления).
Изменение
хотя бы одного из них приведет к нарушению
равновесия.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Константа равновесия химической реакции

4.8
Средняя оценка: 4.8
Всего получено оценок: 161.
4.8
Средняя оценка: 4.8
Всего получено оценок: 161.
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
- обратимые, одновременно протекающие в двух взаимно противоположных направлениях;
- необратимые, протекающие в одном направлении с полным расходом хотя бы одного исходного вещества.
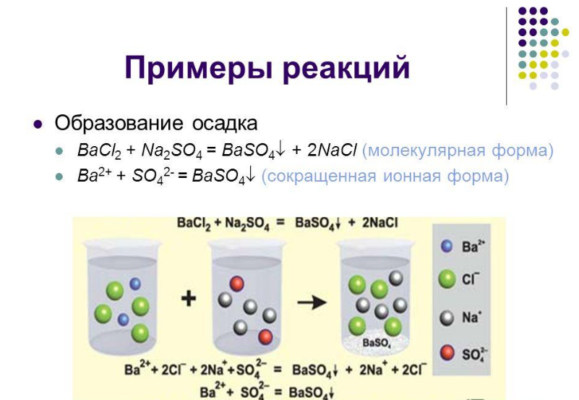
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
- горение:
C2H5OH + 3O2 → 2CO2 + H2O;
- разложение:
2KMnO4 → K2MnO4 + MnO2 + H2O;
- присоединение с образованием осадка или газа:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl.
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
- прямая реакция –
H2 + I2 ↔ 2HI;
- обратная реакция –
2HI ↔ H2 + I2.
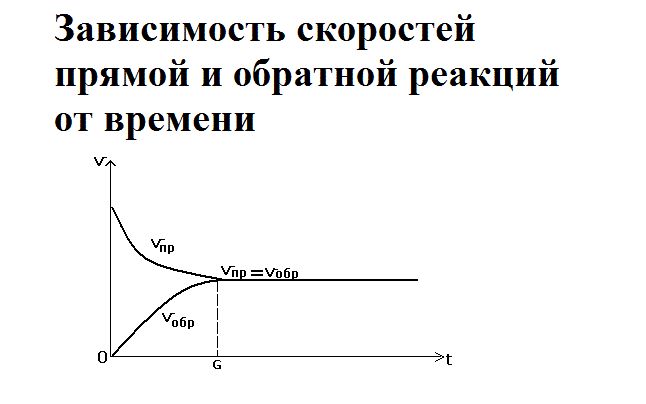
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
νпр = kпр ∙ [H2] ∙ [I2],
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
νобр = kобр ∙ [HI]2.
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Kp = kпр / kобр = const.
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
aA + bB ↔ cC + dD.
Тогда скорости прямой и обратной реакции будут равны:
- νпр = kпр ∙ [A]pa ∙ [B]pb
- νобр = kобр ∙ [C]pc ∙ [D]pd.
Соответственно, если
νпр = νобр,
то
kпр ∙ [A]pa ∙ [B]pb = kобр ∙ [C]pc ∙ [D]pd.
Отсюда можно выразить соотношение констант:
kобр / kпр = [C]pc ∙ [D]pd / [A]pa ∙ [B]pb.
Это соотношение равно константе равновесия:
Kp = [C]pc ∙ [D]pd / [A]pa ∙ [B]pb.
Величина показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции.
Что мы узнали?
Реакции в зависимости от конечных продуктов классифицируются на обратимые и необратимые. Обратимые реакции протекают в обе стороны: исходные вещества образуют конечные продукты, которые разлагаются на исходные вещества. В ходе реакции скорости прямой и обратной реакций уравновешиваются. Такое состояние называется химическим равновесием. Оно может быть выражено как соотношение произведения равновесных концентраций продуктов реакции к произведению разновесных концентраций исходных веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Усмон Бозоров
4/5
Оценка доклада
4.8
Средняя оценка: 4.8
Всего получено оценок: 161.
А какая ваша оценка?
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
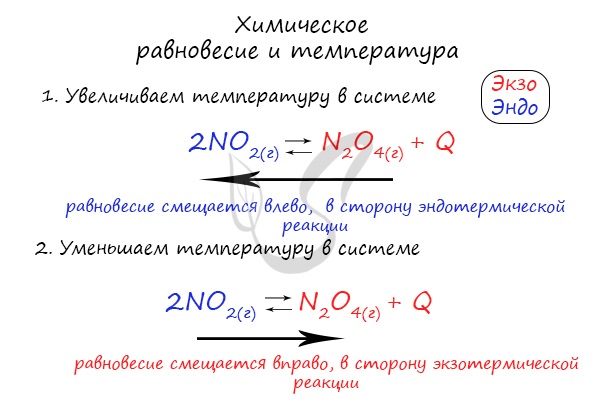
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
Как правильно рассчитывать равновесные концентрации веществ. Смещение равновесия реакции
Задача 249.
Для предложенной обратимой реакции напишите математическое выражение константы химического равновесия и укажите направление смещения равновесия при изменении условий:
а) уменьшении концентрации одного из газообразных продуктов;
б) понижении давления в системе;
в) повышении температуры в системе.
2Н2(г) + О2(г) ⇔ 2Н2O(г); ∆Hx.p. = -484кДж.
Решение:
Кр можно выразить через соотношение констант прямой и обратной реакций, получим:
Кр = [Н2О]/[Н2]2 . [O2].
а) Понижение концентрации продукта реакции (отведение из системы Н2О) будет увеличивать скорость прямой реакции, поэтому согласно принципа Ле-Шателье при понижениии концентрации Н2О равновесие сместится в сторону прямой реакции, т. е. в сторону увеличения образования Н2О.
б) При понижении давления смещение равновесия будет наблюдаться в сторону прямой реакции, так как объм газообразного реагента в полтора раза больше объема продукта реакции системы:
2V(Н2) + 1VO2 > 2V(H2O).
в) При повышении температуры равновесие сместится в сторону обратной реакции, так как прямая реакция – экзотермическая (∆Hx.p. = -484кДж). Согласно принципу Ле-Шателье равновесие реакции смещается в сторону уменьшения оказываемого на систему действия. Данная реакция протекает с выделением тепла (∆H < 0), то, естественно, что при повышении температуры равновесие экзотермической реакции сместится в сторону уменьшения тепловой энергии реакции, т.е. в сторону обратной реакции.
Задача 250.
Дано уравнение реакции: N2 + 3H2 = 2NH3
1) Укажите в какую сторону сместится равновесие системы при повышении и уменьшения давления. 2) Напишите выражение константы равновесия данной системы.
Решение:
1. При воздействии на систему равновесие смещается в сторону уменьшения этого воздействия. Так в системе N2 + 3H2 = 2NH3 из 4 объемов газообразных исходных веществ образуется 2 объема газообразного продукта, значит, при обычных условиях система протекает с уменьшением объема в 2 раза [4V(исх.в-ва)/2V(пр.) = 2]. Поэтому при повышении давления равновесие системы сместится в сторну прямой реакции, т.е. в сторону уменьшения воздействия на систему (уменьшения объема), на образование NH3, а при уменьшении давления — равновесие сместится в сторону увеличения воздействия на систему (увеличение объема), в сторону образовани исходных продуктов реакции (N2 и H2).
2. Выражение константы равновесия системы N2 + 3H2 = 2NH3 будет иметь вид:
[NH3]2/[N2].[H2]3.
Отсюда находим константу равновесия реакции, получим:
Кр = [NH3]2/[N2].[H2]3 = (4)2/3 . (9)3 = 16/2187 = 0,0073 или 7,3 . 10-3.
Задача 251.
Константа равновесия реакции А + В = С + D равна 1. Начальная конццентрация [А] = 0,01 моль/л, [В ]= 0,1 моль/л. Какая доля (в %) исходного количества вещества А подвергнется превращению при равновесии? Каковы равновесные концентрации веществ?
Решение:
Уравнение реакции имеет вид:
А + В = С + D
Из уравнения следует, что из 1 моля А и 1 моля В образуется по 1 молю С и D т.е. по 0,01 молю С и D.
Обозначим равновесную концентрацию С и D через х, тогда [С] = [D].
Таким образом, равновесные концентрации A и B будут составлять, соответственно, (0,01 – х) и (0,1 – х) моль/л, а С и D – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
К = [C][D]/[A][B];
1 = (х . х)/[(0,01 – х)(0,1 – х)];
x2 = 0,001 — 0,1x — 0,01x — x2;
0,001 = 0,11x;
x = 0,0091.
Отсюда равновесные концентрации (моль/л):
[C]p = [D]p = х = 0,0091 моль/л;
[A]p = 0,01 – х = 0,01 – 0,0091 = 0,0009 моль/л;
[B]p = 0,1 – х = 0,1 – 0,0091 = 0,0909 моль/л.
Значит, 91% вещества А подвергнется превращению при равновесии.
0,01 — 100%
0,0091 — х
х = (0,0091 . 100%)/0,01 = 91%.
Задача 252.
В какую сторону сместится равновесие системы — PCl5(г) = PCl2(г) + Cl2(г), Н > 0:
а) при увеличении температуры;
б) при увеличении давления;
в) при увеличении концентрации хлора?
Решение:
а) прямая реакция эндотермическая (с поглощением тепла). Чтобы компенсировать увеличение температуры — должна пойти реакция с поглощением тепла. Смещение в сторону образования продуктов.
б) При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов.
Прямая реакция идет с увеличением числа молей газообразных веществ (увеличение давления). Обратная реакция с понижением давления. При увеличении давления пойдет реакция, уменьшающая его (обратная). Равновесие сместится влево.
в) При вводе в систему продукта реакции пойдет реакция, способствующая его расходу. Это обратная реакция. Равновесие сместится влево.
Задача 253.
При нагревании смеси углекислого газа и водорода образуется угарный газ и вода, а также устанавливаетася равновесие. При температуре 1123 К и константе скорости Кр = 1. Сколько молей углекислого газа необходимо на 1 моль водорода, чтобы 70% его превратилось в воду.
Решение:
Уравнение реакции имеет вид:
СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.).
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Находим количество Н2, которое вступило в реакцию: 1 . 0,7 = 0,7 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,3 моль/л (1 – 0,7 = 0,3). Следовательно, из взятых веществ остаются непрореагировавшими 0,3 моля углекислого газа и 0,3 моля водорода:
Первоначальные количества реагирующих веществ (в молях)…. 1(СО2) : 1(Н2) = 0(СО) : 0(Н2О).
Количества веществ по достижении предела реакции 1123 К (в молях)…. 0,3(СО2) : 0,3(Н2) = 0,7(СО) : 0,7(Н2О)
Значит, причиной «остановки» разбираемой нами реакции является наличие обратной реакции.
После смешения углекислого газа с водородом между ними начинается взаимодействие, в результате которого образуются молекулы окиси углерода и воды. По мере течения этой реакции концентрации взятых веществ уменьшаются и скорость реакции становится все меньше и меньше. В то же время возникает возможность обратной реакции. Молекулы окиси углерода и воды, сталкиваясь между собой, могут снова превращаться в молекулы углекислого газа и водорода. Вначале, пока молекул окиси углерода и воды еще мало, их столкновения происходят довольно редко. Однако по мере накопления молекул этих веществ столкновения становятся все чаще, в результате чего скорость обратной реакции постепенно увеличивается. Наконец, наступает момент, когда скорости прямой и обратной реакций уравниваются, т. е. в каждую единицу времени исчезает столько же молекул углекислого газа и водорода, сколько их появляется вновь вследствие обратной реакции. С этого момента концентрации всех четырех газов перестают изменяться, несмотря на то, что первоначально взятые углекислый газ и водород целиком не прореагировали.
Таким образом, при температуре 1123 К в данной системе наступает равновесие когда на 1 моль водорода и на 1 моль углекислого газа прореагируют по о,7 моль этих веществ и образуется такое же количество угарного газа и воды, и в системе наступит равновесие при концентрациях веществ (в молях)….
0,3(СО2) : 0,3(Н2) = 0,7(СО) : 0,7(Н2О).
Ответ: СО2 = 0,7 моль.
Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 0,7 : 0,3 = 2,33 : 1. Значит, на 1 моль водорода необходимо 0,43 моль СО2 (1/2,33 = 0,429).
Уравнения константы равновесия с примерами
Химическим равновесием называется такое состояние обратимой химической реакции
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
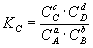
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
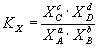
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
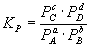
Константа равновесия связана с rG o химической реакции:
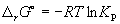
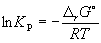
Изменение rG или rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
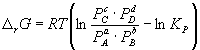
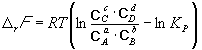
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
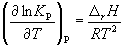
и изохоры химической реакции (изохоры Вант-Гоффа)
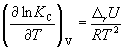
Интегрирование уравнения (9.9) в предположении, что rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
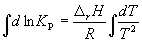
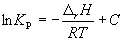
где C – константа интегрирования. Таким образом, зависимость ln KP от 1/Т должна быть линейной, а наклон прямой равен – rH /R.
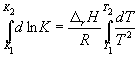
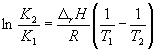
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать rH реакции. Соответственно, зная rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
при 500 K. fG o для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж . моль –1 и –134.20 кДж . моль –1 соответственно.
Решение. G o реакции:
rG o = fG o (CH3OH) – fG o (CO) = –134.20 – (–155.41) = 21.21 кДж . моль –1 .
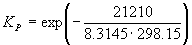
Пример 9-2. Константа равновесия реакции
равна KP = 1.64 10 –4 при 400 o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало моль N2. Тогда
0
| N2(г) | + | 3H2(г) | = | 2NH3(г) |
| Исходное количество | 1 | 1 | ||
| Равновесное количество | 1– | 1–3 | 2 (Всего: 2–2 ) | |
| Равновесная мольная доля: | 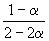 |
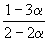 |
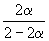 |
Следовательно, KX = 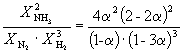
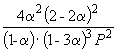
Подставляя = 0.1 в полученную формулу, имеем
1.64 10 –4 =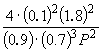
Пример 9-3. Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) |
| Исходное количество: | 1 | 2 | 0 | |
| Равновесное количество: | 1– | 2–2 | ||
| Всего в равновесной смеси: | 3–2 моль компонентов + 1 моль N2 = 4–2 моль | |||
| Равновесная мольная доля | 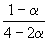 |
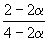 |
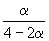 |
Следовательно, KX = 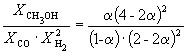
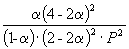
Таким образом, 6.09 10 –3 = 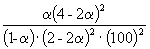
Решая это уравнение, получаем = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны: 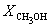
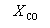
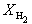
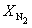
Пример 9-4. Для реакции
при 298 К KP = 6.0 10 5 , а fH o (NH3) = –46.1 кДж . моль –1 . Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
rH o = 2 fH o (NH3) = –92.2 кДж . моль –1 .
Согласно уравнению (9.14), 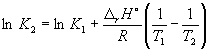
= ln (6.0 10 5 ) + 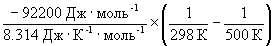
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
- При 1273 К и общем давлении 30 атм в равновесной смеси
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
При 2000 o C и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
Константа равновесия реакции
при 500 o C равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
Константа равновесия реакции
при 25 o C равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
Сосуд объемом 3 л, содержащий 1.79 10 –2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
при 250 o C rG o = –2508 Дж . моль –1 . При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250 o C составит 30%?
константа равновесия KP = 1.83 10 –2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250 o C. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250 o C для протекающей в сосуде реакции
Константа равновесия реакции
при 500 K равна KP = 6.09 10 –3 . Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
устанавливается при 227 o C и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать rG o для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400 o C. Константа равновесия для реакции
при 400 o C равна K = 1.60 10 –4 .
При 250 o C и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
При 2000 o C для реакции
Kp = 2.5 10 –3 . В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
При 420 o C давление газов равно 5.16 10 4 Па, а при 450 o C 10.8 10 4 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
получены следующие данные по зависимости константы равновесия от температуры:
3.98 10 –4
1.41 10 –2
1.86 10 –1
Определить стандартную энтальпию реакции в этом температурном интервале.
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Рассчитать rG o , rH o и rS o реакции при 400 К.

Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Химическое равновесие
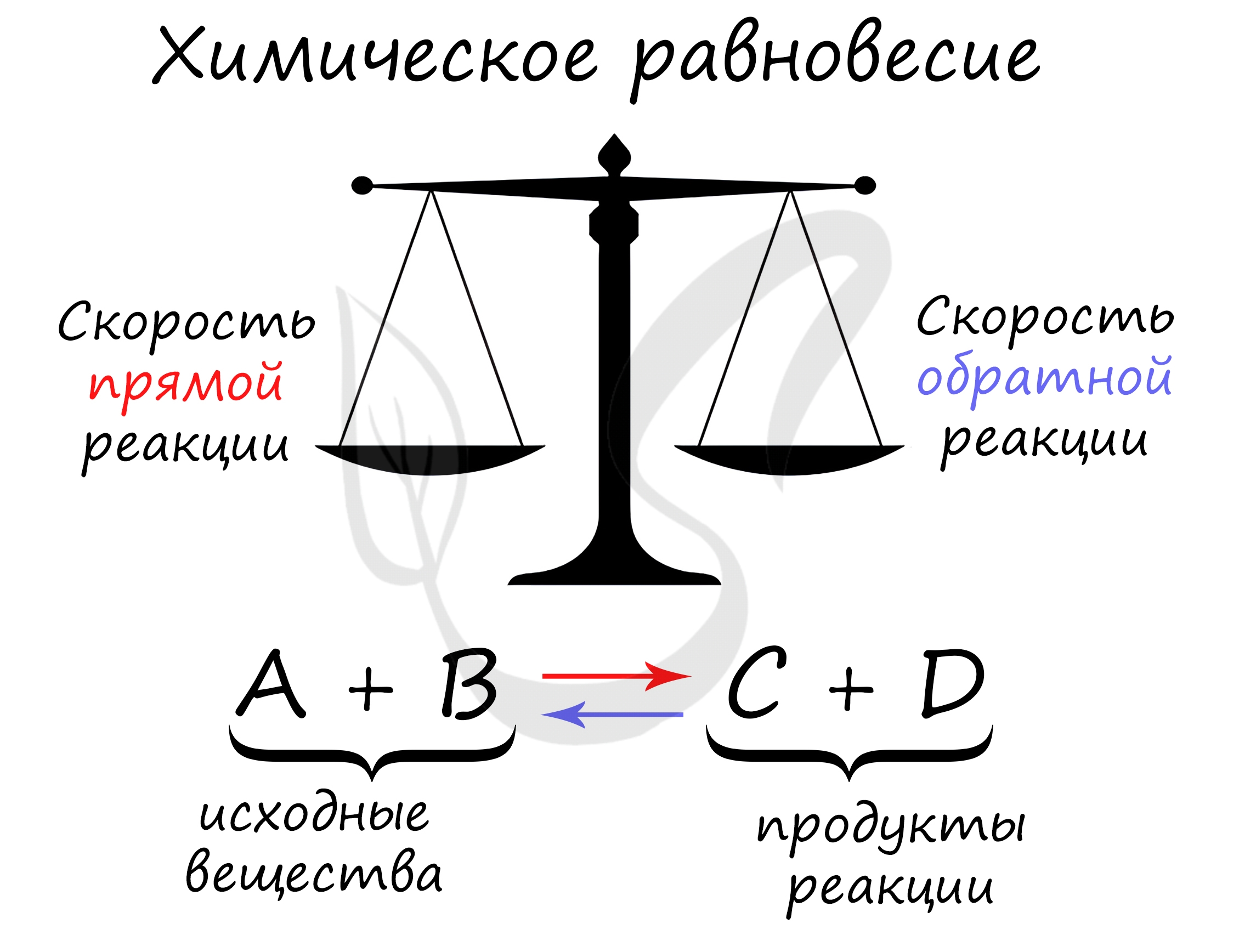
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.
Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
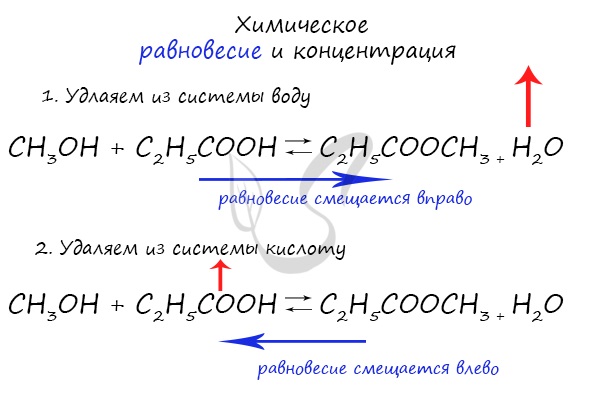
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.
Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:
В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
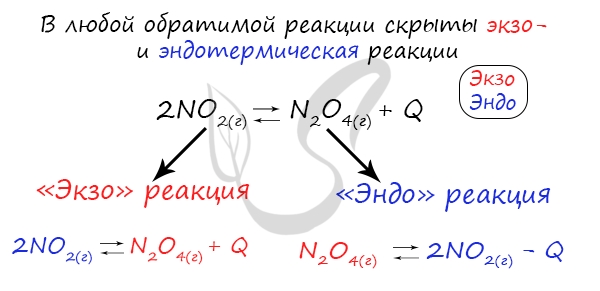
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:
Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:
Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
Константу равновесия для данной задачи можно представить в виде 1.64 * 10 -1 .
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
ВеществоCOO2CO2 Сисходн, моль/л0,520,480 Спрореагир,моль/л0,320,160,16 Сравн, моль/л0,20,320,16
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
источники:
http://studarium.ru/article/156
http://chemege.ru/ravnovesie/
Что такое химическое равновесие
Прежде чем мы раскроем суть понятия «химическое равновесие», давайте рассмотрим одну и ту же химическую реакцию, но с единственным отличием в условиях. Вот первая реакция:
Это разложение карбоната кальция в открытой системе. Иными словами, в такой, где обмен энергией и веществом с окружающим миром, будет необратимым. В ходе этой реакции углекислый газ улетучится.
Теперь рассмотрим ту же самую реакцию, но с одним отличным условием: система будет закрытая, то есть без обмена веществом и энергией с окружающим миром. Как мы видим из записи уравнения, обозначение необратимой реакции поменялось на обозначение обратимой. Давайте сразу разберемся, что это такое.
Обратимая реакция — это такая реакция, которая протекает сразу в противоположных направлениях.
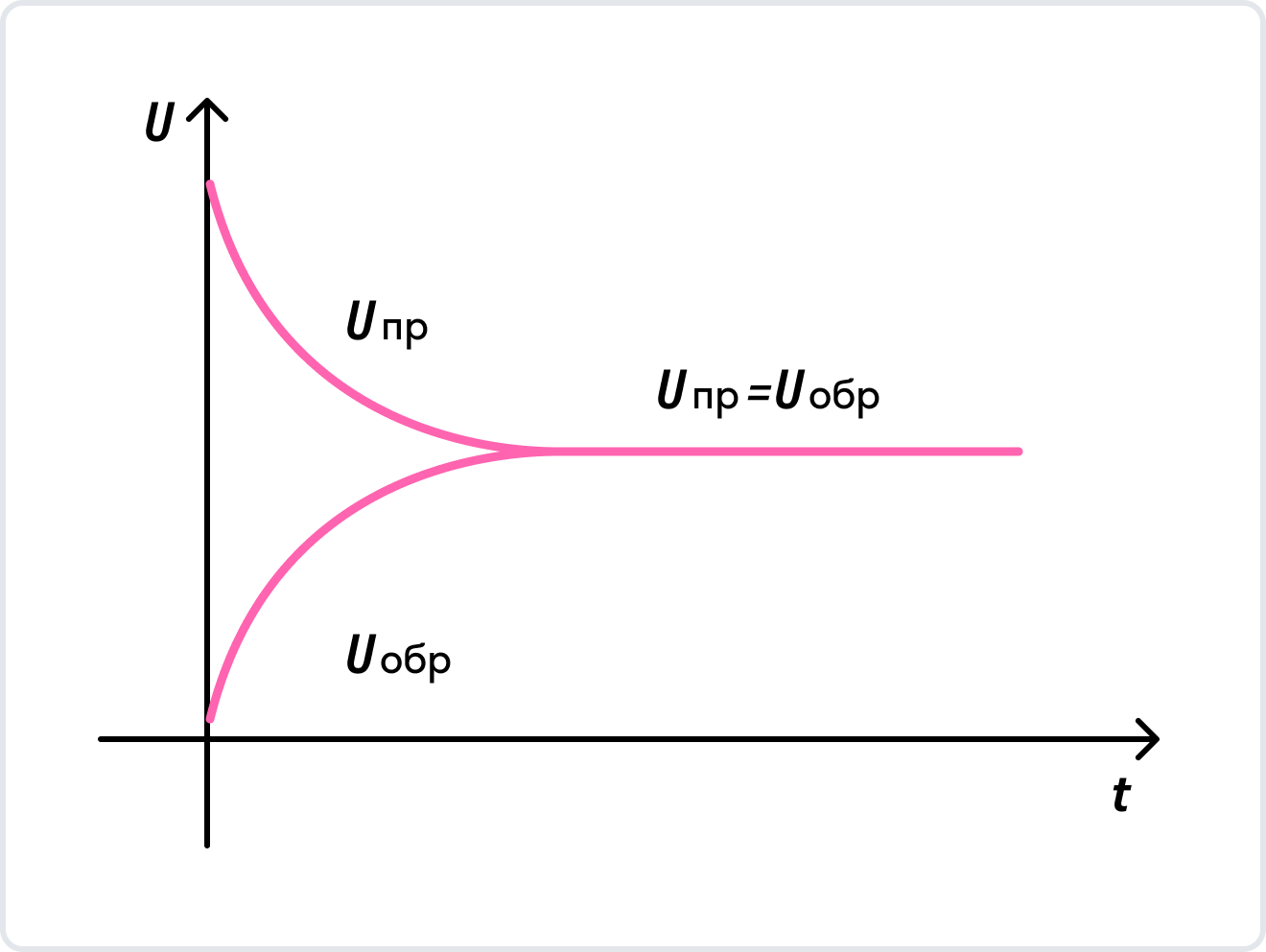
В данном случае направление прямой реакции — это разложение карбоната кальция, а направление обратной реакции — образование карбоната кальция из оксида кальция и углекислого газа. Давайте рассмотрим на графике, как изменяются скорости протекания противоположных по направлению химических реакций.
Как видно на графике, в начальный момент времени скорость образования продуктов химической реакции максимальна, в то время как скорость разложения продуктов реакции равна нулю из-за отсутствия тех самых продуктов реакции. Через какое-то время скорость образования продуктов и скорость разложения продуктов реакции становятся численно равны. Наступает химическое равновесие. Закрепим это в определении.
Химическое равновесие — это такое состояние химической системы, в котором скорости прямой реакции и обратной реакции равны.
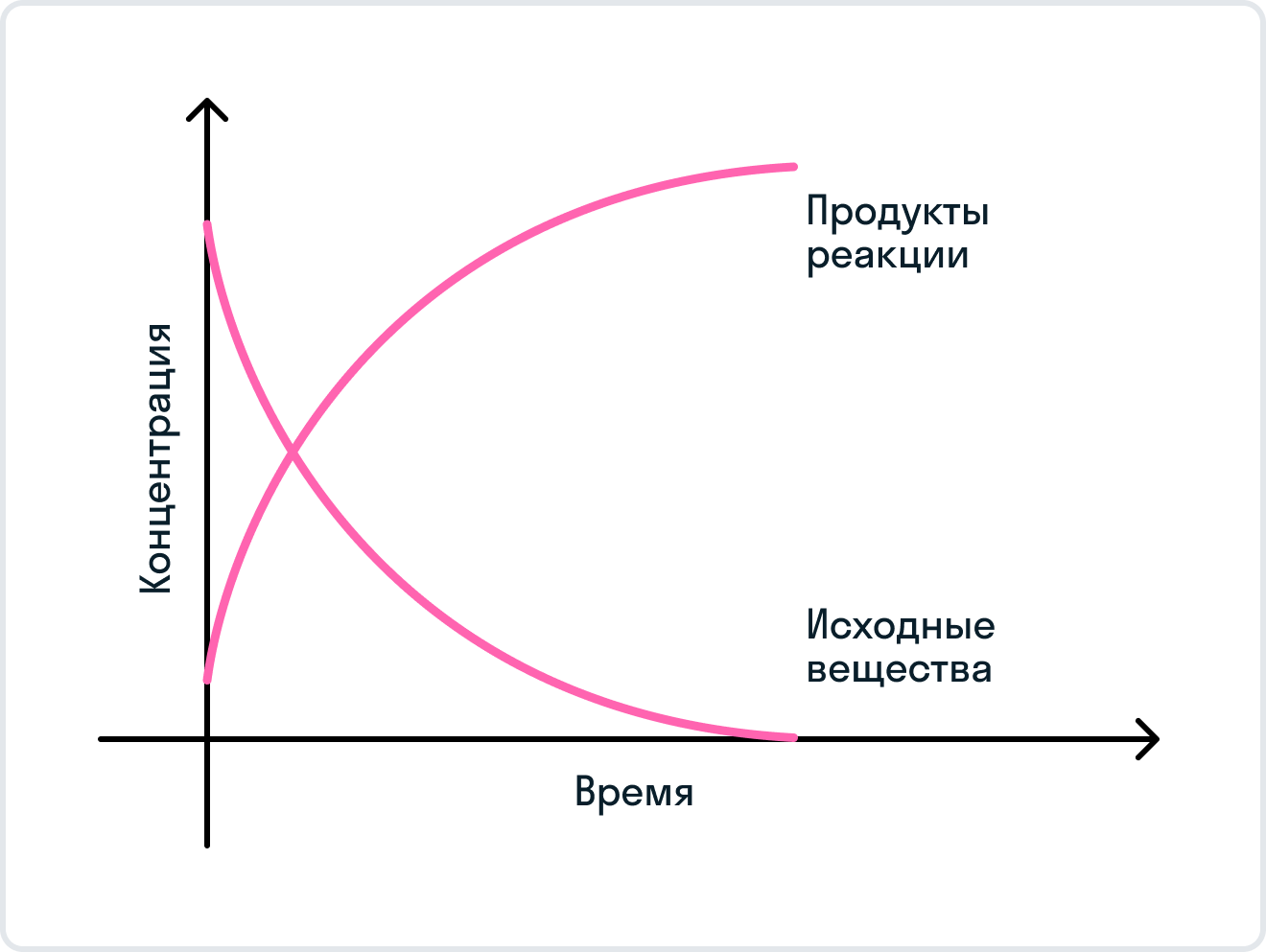
Вам может стать интересно, как же получаются продукты реакции, а затем снова исходные вещества. Чтобы понять это, рассмотрим график, на котором показано как изменяется концентраций исходных реагентов в течение времени, и как изменяется концентрация продуктов реакции.
Резюмируем: в начальный момент времени концентрация, показывающая содержание исходных веществ, максимальна, поскольку реакция только начинается, и кроме исходных реагентов в системе ничего нет. В этот же момент скорость прямой реакции, отвечающая за образование продуктов реакции, является максимальной, так как система стремится к созданию продуктов реакции. По мере того, как концентрация и скорость исходных веществ уменьшаются вследствие образования некоторых веществ, являющихся продуктами реакции, скорость обратной реакции и концентрация продуктов реакции возрастают. В некоторый момент времени скорость образования продуктов реакции и разложения продуктов реакции становятся равными друг другу. Наступает химическое равновесие.
Следует отметить, что при достижении состояния химического равновесия продолжают протекать как образование продуктов, так и разложение продуктов в рамках одной химической реакции. Но концентрации, являющиеся равновесными, всех веществ при этом остаются незименными благодаря равенству скоростей. Хочется отметить, что изменение внешних условий может повлиять на скорость как прямой и обратной реакций, что влечет за собой смещение химического равновесия. В результате воздействия система переходит в новое состояние равновесия с новыми концентрациями реагирующих веществ и продуктов реакции.
Важно
Изменения, которые происходят в результате внешних воздействий, в обратимых реакциях определяются принципом Ле Шателье.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Принцип Ле Шателье
Анри Луи Ле Шателье — это французский химик, который родился в семье ученых. Он изучал химические реакции, которые связаны с несчастными случаями на шахтах и в металлургическом производстве, участвовал в исследовании детонации рудничного газа. Ле Шателье разработал термоэлектрический пирометр (оптический прибор для определения температуры раскаленных тел по цвету) и гидравлические тормоза для железнодорожных составов, изобрел кислородно-ацетиленовую сварку.
Принцип Ле Шателье
Если на систему, которая находится в состоянии равновесия, накладывать некоторое внешнее воздействие, то в ней усилится тот процесс, который ведет к ослаблению этого воздействия, и положение равновесия сместится в ту же сторону.
Факторы, которые влияют на смещение равновесия
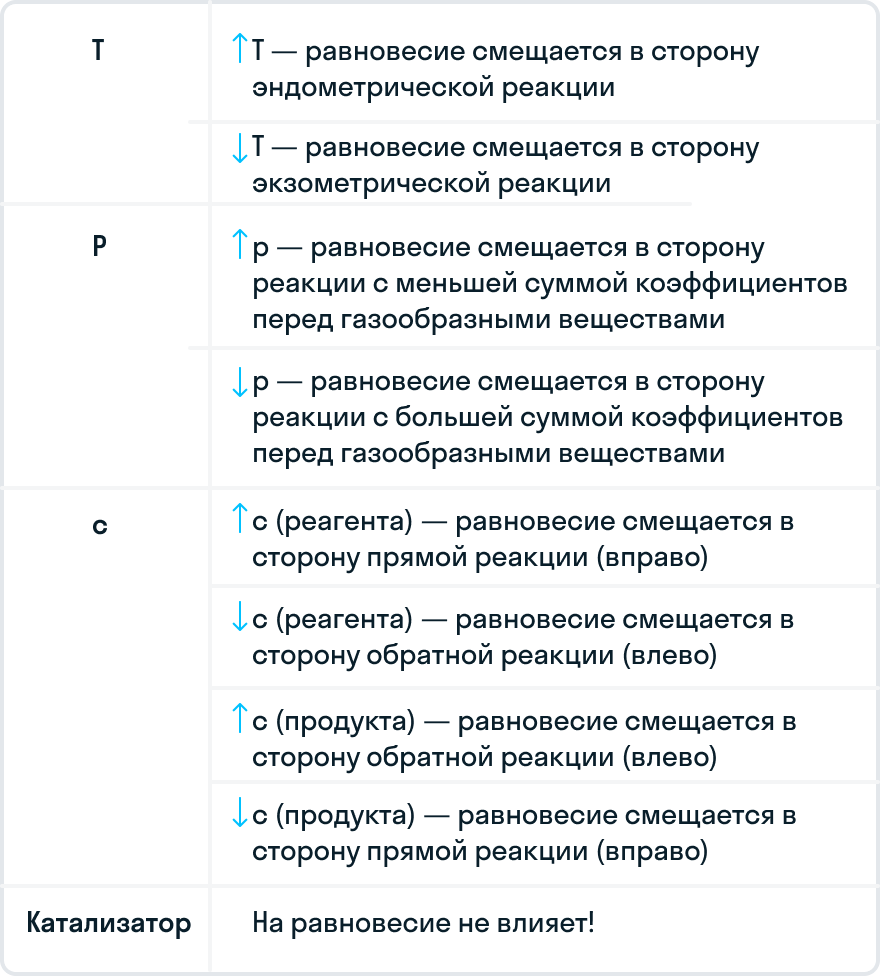
1. Перемена температуры
Отметим, что прямая и обратная химические реакции имеют одинаковые по величине, но разные по знаку тепловые эффекты. Если повысить температуру системы, то химическое равновесие будет смещаться в сторону охлаждения системы, соответственно при понижении — в сторону нагрева системы. Если прямая реакция — экзотермическая (Q > 0), то равновесие при нагревании смещается влево, а если прямая реакция — эндотермическая (Q < 0), то вправо.
Важно
При повышении температуры равновесие сместится в сторону охлаждения системы, то есть в сторону эндотермической реакции, в то время как при понижении температуры — в сторону нагревания системы или экзотермической реакции.
2. Перемена давления
Давление влияет только на обратимые процессы с участием газообразных веществ с изменением количества моль в системе. Для того чтобы понять, влияет ли давление на смещение химического равновесия, посчитайте все коэффициенты только у газообразных соединений в левой и правой частях.
Важно
При увеличение давления равновесие смещается в сторону меньшего числа моль газообразных веществ, а при уменьшении давления — в бОльшую сторону числа моль газообразных веществ. Если реакция протекает без изменения числа молей, то изменения давления не влияет на смещение равновесия.
3. Перемена объема
Изменение объема напрямую связано с изменением давления. Если увеличивать объем реакционного сосуда, то давление будет уменьшаться. Если уменьшать объем реакционного сосуда, то давление будет увеличиваться. Как только мы узнаём поведение давления в реакционном сосуде, делаем вывод на основании п. 2.
Давайте разберемся, как это работает, на примере из жизни. Решили мы, например, заварить чай во френч-прессе. В момент наполнения кипятком поршень поднят к самому верху, то есть давления на листики заварки нет, а объем максимальный. По мере того, как мы будем опускать поршень, объем уменьшается, а давление увеличивается. К тому же, листья чая уже не могут свободно плавать по всему объему френч-пресса. Соответственно при поднятии поршня объем увеличивается, а давление уменьшается. Значит, заварка снова может занимать весь предоставленный ей объем. Зная, как меняется давление, делаем выводы на основании п. 2.
4. Перемена концентрации веществ
При добавлении или удалении некоторого количество веществ, участвующих в реакции, меняются концентрации всей системы. Вследствие этого происходит смещение химического равновесия. Если из равновесной системы удалить небольшое количество участника химической реакции, то равновесие сместится в сторону протекания такой реакции, в результате которой это вещество образуется. При добавлении участника реакции в систему, равновесие будет смещаться в сторону той химической реакции, в результате которой это вещество расходуется.
Важно
Если увеличить концентрацию исходных веществ и удалить продукты реакции, это приведет к смещению равновесия в сторону прямой реакции и наоборот.
5. Добавление катализатора или ингибитора
Напомним, что катализатор — это вещество, которое ускоряет химическую реакцию, но не участвует в ней. В свою очередь, ингибитор — вещество, которые замедляет реакцию и тоже в ней не участвует.
Важно
Катализатор и ингибитор не влияют на смещение химического равновесия.
Это связано с тем, что катализатор ускоряет как прямую, так и обратную химические реакции. Следовательно, состояние равновесия не изменяется.
Константа химического равновесия
Константа равновесия — величина, которая показывает соотношение между концентрациями продуктов реакции и исходными веществами, которая устанавливается при равновесии.
При неизменной температуре константа равновесия остается неизменной величиной. Она рассчитывается из экспериментальных данных и определяет равновесные концентрации как исходных веществ, так и продуктов реакции при определенной температуре.
Важно
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания.
Если константа равновесия численно больше единицы, то значит концентрации продуктов реакции преобладают над исходными веществами. Если константа меньше единицы, то выход продукта мал, концентрация исходных веществ выше.
Рассмотрим обратимую реакцию образования иодоводорода из йода и водорода:
Запишем для реакции константу равновесия с учетом всех стехиометрических коэффициентов:
Также можно выразить константу равновесия для обратной химической реакции:
Зная численные значения для каждой концентрации, можно выразить константу в виде числа.
В случае гетерогенных реакций для этого используют концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Рассмотрим на примере взаимодействия углекислого газа с углеродом:
Для данной реакции константу равновесия можно записать следующим образом:
От присутствия катализатора константа не зависит, поскольку он изменяет скорость и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, но не влияет на значение константы равновесия.
Коротко о главном
Теперь, когда основная часть статьи позади, давайте подведем итоги:
-
Химическое равновесие — это отношение скоростей прямой реакции к обратной в случае обратимых реакций.
-
Значение константы равновесия характеризует полноту протекания химической реакции.
-
Из принципа Ле Шателье делаем вывод: система всегда стремится противодействовать влиянию извне в противоположную сторону, равновесие смещается в ту же сторону.
Чтобы лучше запомнить всю информацию о факторах, которые влияют на смещение химического равновесия, смотрите таблицу ниже. Сохраняйте ее и пользуйтесь!
Проверьте себя
Задание 1
Вычислите константу равновесия реакции А + 2В ⇄ С, если равновесные концентрации [А] = 0,3 моль/л, [В] = 1,1 моль/л, [С] = 2,1 моль/л.
Задание 2
В реакции каталитического окисления оксида серы (IV) до оксида серы (VI) при некоторой температуре и давлении равновесие устанавливается при следующих концентрациях веществ: [SO2] = [O2] = 1,25 моль/дм3, [SO3] = 2,4 моль/дм3. Рассчитайте константу равновесия при данных условиях.
Задание 3
Рассчитайте равновесную концентрацию йодоводорода, если известно, что Кр = 0,0156, [I2] = [H2] = 0,1 моль/дм3.
Задание 4
Напишите выражение константы равновесия для следующих обратимых процессов:
-
Fe (тв) + 4Н2О (г) ⇄ Fe3О4 (тв) + 4Н2 (г).
-
2А (г) + В (г) ⇄ С (г).
-
С (тв) + СО2 (г) ⇄2СО (г).
-
СаО (тв) + СО2 (г)⇄ СаСО3 (тв).
Задание 5
Исходные концентрации оксида углерода (II) и паров воды равны 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО + Н2О ⇄ СО2 + Н2, если равновесная концентрация СО2 оказалась равной 0,01 моль/л. Вычислите константу равновесия.
Задание 6
При температуре 625 К протекает реакция СО + Cl2 ⇄ COCl2. Равновесные концентрации: [Cl2] = 0,3 моль/л; [CО] = 0,2 моль/л и [СОCl2] = 1,2 моль/л. Вычислите константу равновесия и начальные концентрации хлора и оксида углерода (II).
Задание 7
Вычислите константу равновесия системы N2 + 3H2 ⇄ 2NH3, если в состоянии равновесия концентрация аммиака составляет 0,4 моль/л, азота 0,03 моль/л, а водорода 0,1 моль/л.
Задание 8
Укажите, как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция: CaCO3 (к) ⇄ CaO (к) + СО2 (г) — 178 кДж сместить в сторону продуктов разложения.
Надеемся, что эта статья помогла вам разобраться в нюансах химического равновесия. Если вы хотите более глубоко погрузиться в эту тему и решить еще больше связанных с ней интересных задач, ждем вас на онлайн-курсах химии в Skysmart. Познакомьтесь с платформой на бесплатном вводном уроке — там мы поможем определить уровень знаний и составим индивидуальный план под цель ученика.