Метаанализ данных представляет собой один из наиболее эффективных статистических подходов. Во многом метаанализ похож на обзорное исследование, представляет собой его частную форму, разновидность. Суть методики метаанализа заключается в подробном изучении статистических данных, которые представлены по определенному научному вопросу, которые применяются при написании курсовых работ, а также в некоторых выпускных квалификационных работах.
При этом метаанализ отличается тремя важными характеристиками:
- Он проводится по отношению к определенной теме. Например, в рамках выявления статистики по глиальным опухолям головного мозга. Смысла сравнивать опухоли в общем и глиальные в частности нет. Поскольку данные различны и их сложно сопоставлять.
- Метаанализ предполагает использование всех доступных сведений.
- При этом данные должны быть свежими. Нет никакого смысла в качестве представителя выборки использовать статью, исследование двадцатилетней давности. Разве что нет ничего более свежего и актуального, чего практически не встречается.
Учитывая особенности методики, активнее всего ее применяют в медицинских научно-исследовательских работах. Поскольку там процент статистики наиболее существенный и играет большую роль. Хотя метаанализ данных находит свое место и в экономических, и в чисто статистических, и в технических науках. Говорить, что он применяется лишь в медицине неправильно.
Методика имеет много преимуществ. Но только в тех случаях, когда инструментарий метаанализа используется верно. Иначе велика вероятность прийти к неправильным результатам. Чтобы не сделать фатальных ошибок, необходимо придерживаться базовых принципов, правил, порядка проведения соответствующего анализа информации.
В каких сферах используется метаанализ данных
Метаанализ (систематический обзор) информации как способ исследования числовых показателей, расхождений, установления закономерностей тех или иных явлений, процессов используется в тех сферах знания, где велика роль именно статистических данных.
- В медицинских исследованиях числовые значения представлены практически всегда. Это могут быть статистические данным по встречаемости заболеваний, количеству побочных эффектов от тех или иных препаратов или же исходам после проведенного по определенной схеме лечения. Вариантов намного больше. Метаанализ используется, чтоб систематизировать весь этот массив знаний. Добиться его унификации и получения более точного результата по сравнению с итогами отдельных исследований. Тем более что и выборка при метаанализа автоматически становится больше за счет большего числа участников исследования.
- В экономических науках, исследованиях в области финансов, денежных средств. Также как и в медицине, в экономике велика роль статистических сведений. Как правило, метаанализу подвергают долгосрочные, актуальные в длительной перспективе данные. Те, которые предполагают фундаментальные исследования в описываемой области. Преходящие, такие как статистика безработицы по странам, ее структура представляют интерес только в моменте. Поскольку ситуация на рынке труда может резко измениться под влиянием экономической ситуации, а в развивающихся странах — еще и политического строя.
- В технических науках. Инженерных направлениях знания, деятельности. Например, в области строительства, при сравнении различных материалов для производства технологически сложной продукции и пр. Или при изучении технологий, их преимуществ и недостатков.
Использования инструментов метаанализа может пригодиться и в исследованиях, посвященных высоким технологиям, IT-сфере.
Метаанализ предназначен в первую очередь для работы со статистическими данными, чтобы получить наиболее точную картину, представление о реальном положении вещей. Но точность — всего лишь часть преимуществ методики.
Этапы проведения метаанализа
Метаанализ данных представляет собой сложную технику проведения исследований. Чтобы упростить работу, был выработан понятный алгоритм анализа данных. Его можно представить в виде 6 шагов, каждый из которых предваряет следующий.
- На первом этапе необходимо максимально четко сформулировать вопрос. Грамотно поставленный вопрос это то, ради чего и затевается вся исследовательская работа.
При формулировании вопроса можно использовать разные модели. Например, в медицине речь идет о PICO (проблема, вмешательство, сравнение, результат), которая позволит понять, о каком исследовании или лечении чего идет речь.
Пример: есть 6 исследований, которые описывают глиому головного мозга у взрослых и детей. В каждом имеется собственная выборка, которая включает от нескольких сотен до нескольких тысяч пациентов.
Задачу можно сформулировать по разному. Узнать, какие именно мутации были обнаружены у пациентов. Или уточнить, в каком возрасте патологический процесс манифестирован. Опираться нужно на сведения, которые представлены в самих исследованиях и перекликаются друг с другом. Также на собственное исследование, которое будет использовать полученные данные.
От постановки задачи зависит то, какие данные будут на выходе.
- На второй стадии автор занимается поисками подходящей литературы. Отбор источников играет большую роль, поскольку качество данных в разных исследователей может существенно различаться. Необходимо брать только наиболее авторитетные источники, которые обладают высоким индексом цитирования и заслуживают доверия. Если взять высококачественную литературу, такой метаанализ будет бесполезен. На этой стадии необходимо брать всю подходящую литературу по теме. С учетом авторитетности и достоверности.
- На третьей стадии проводится подбор литературы из того массива, что был получен ранее. Важно, чтобы сведения соответствовали выдвинутому вопросу, который стоит во главе метаанализа. Часть источников придется отбросить, даже несмотря на то, что они высококачественные.
Пример: имеется 20 материалов разного размера, которые посвящены тематике неходжкинских лимфом. Авторов интересует частота развития у детей момента манифестации заболевания и влияние определенных факторов на вероятность начала болезни.
В такой ситуации нужно искать источники, которые отвечают именно этим критериям. Имеют в структуре данные по срокам, возрастам заболеваемости, анамнезу, а также статистика по заболеваемости среди взрослых и детей. Источники, где имеются данные по отдельным аспектам вопроса, брать тоже можно. Но соотносить их нужно только в части имеющихся сведений.
- Выбор инструментария для работы с данными. Определение данных, которые не будут включаться в работу.
- Выбор модели метаанализа. Есть разные техники проведения исследования. Они опираются на разные механизмы и инструменты.
Пример: существует множество моделей анализа. Модели случайных, фиксированных эффектов, IVhet и пр. Они позволяют собирать и исследовать большие массивы информации с высокой точностью.
На финальном этапе проводится верификация или перепроверка полученных данных. Метаанализ, входящий в часть систематического обзора можно считать успешным, если конечный результат оказался более информативным, точным, чем сведения, представленные в исходных статьях и прочих исследованиях. Если метаанализ проведен верно, в соответствии с правилами, так и получается.
Возникли сложности?
Нужна помощь преподавателя?
Мы всегда рады Вам помочь!
Принципы проведения исследования
Чтобы провести грамотное исследование данных, получить точные результаты, знать лишь алгоритм проведения работы недостаточно. Необходимо опираться на несколько принципов, руководящих правил, которые позволят добиться наилучшего результата.
Среди принципов метаанализа можно назвать следующие.
- Полнота. Первый и наиболее важный принцип исследования. Суть его заключается в том, чтобы брать все исследования, которые предлагают специализированные сайты и информационные системы. Разумеется, первичную фильтрацию проводить необходимо. Избавляясь от низкокачественных, сомнительных работ. Но наиболее глубокая аналитика последует потом. Принцип полноты требует, чтобы ничего не оставалось за скобками.
- Актуальность. Медицинские данные, как и другая информация, особенно в части дискуссионных вопросов, не до конца понятных тем, имеют свойство устаревать. Может быть не так быстро, как юридические сведения, но все же.
Брать в качестве статистической базы нужно только те исследования, которые считаются актуальными до сих пор. Не стоит брать в работу сведения давностью в несколько десятков лет. Хотя порой актуальность отсутствует даже у более новых исследований. Чтобы не оказаться в неудачном положении, стоит внимательно следить за этапами развития вопроса, его проработки. И брать только наиболее свежие данные.
- Авторитетность источников. В качестве базы для статистического обобщения, анализа нужно брать только авторитетные статьи, монографии, авторефераты, диссертации, которые можно считать достоверными в плане проверки сведений и выдаваемой информации. Проверять авторитетность глубже следует уже после сбора информационного массива.
- Релевантность. Помимо авторитетности источников, нужно придерживаться принципа релевантности. Брать только те материалы, которые имеют непосредственное отношение к теме. А также перекликаются в плане данных, которые можно сравнивать. Заниматься определение релевантности следует уже после первичной обработки информационного массива, отбрасывая все лишнее.
Например, не стоит примешивать к материалам по теме нарушений репродуктивных функций на фоне диабета материалы о бесплодии в целом и осложнениях диабета. В них с большой вероятностью не будет необходимых сведений. Однако в некоторых случаях следует проверить.
- Постановка вопроса. Чтобы получить действительно качественные результаты, нужно знать, что искать. Постановка вопроса предполагает четкое определение, ради чего затевается все исследование. Например, чтобы выявить наиболее частые причины или осложнения рака молочной железы. Исходы того или иного заболевания с лечением, без лечения, с определенными формами комплексной терапии и т.д. Вариантов бесконечное множество. Все зависит от темы. Без четко поставленного вопроса смысла в исследовании нет.
- Целеполагание. Нужно хорошо понимать, для чего будет использоваться результат проведенного метаанализа. Для обоснования своего мнения, опровержения гипотез или чего-то иного.
- Четкая разбивка работы на стадии. При попытке смешать отдельные этапы работы, например, на стадии сбора и первичной фильтрации информационного массива, велика вероятность критических ошибок, которые будут обнаруживаться по мере работы, заводя в тупик. Поэтому следует четко прописать план действий и неукоснительно его соблюдать.
- Выбор правильной методики. Есть разные методики оценки данных. Все они обладают своими преимуществами и недостатками. Что именно выбрать — зависит от случая и целей исследования.
- Обязательная верификация. Верификация или проверка должна проводиться обязательно. Без проверки конечный результат нельзя считать на все сто процентов достоверным. Вероятность ошибок существует всегда.
Эти базовые принципы требуют обязательного учета и позволяют справиться с задачей проще.
Преимущества методики
Преимущества метаанализа данных очевидны:
- Более широкая выборка. Автор получает возможность исследовать большую выборку ситуаций: не сотни, а тысячи и даже десятки тысяч, в зависимости от темы и объема исследования.
- Повышение статистической мощности.
- Через повышение статистической мощности — увеличение достоверности сведений. Особенно, если анализ проводится в соответствии со всеми правилами и принципами.
- Возможность найти систематические ошибки. Такие, которые допускали авторы отдельных исследований при попытке обосновать и объяснить определенные закономерности в рамках полученных ими статистических сведений. Имея на руках широкую, разнообразную выборку, зачастую еще и исчерпывающую, сделать это гораздо проще.
- Возможность определить закономерности развития патологий, ситуаций и пр. То есть провести самостоятельную аналитическую работу, не имея непосредственного контакта с предметом исследований. Это удобно и позволяет получить новые данные.
Нередко случается так, что авторы метаанализа приходят к неожиданным, действительно ценным выводам.
Недостатки использования метаанализа
Существует как минимум три недостатка, на которые обращают внимание практически все опытные исследователи.
- Первый — это необходимость широкого опыта и владения инструментарием метаанализа. Методика считается одной из самых сложных. Это непростой исследовательский труд. Начинающему ученому метаанализ может быть не под силу.
- Второй — это высокая вероятность ошибок. Этот пункт напрямую связан с первым. Если автору исследования не достает опыта, почти гарантированно серьезные метаанализ сведений будет иметь несколько ошибок или неточностей. Это снижает информативность результата, если не ставит крест на всей работе исследователя.
- Третий — это значительные объемы информации. Как правило, подготовкой метаанализа занимается группа исследователей. Хотя для небольших выборок достаточно одного человека. И все равно объем работы будет существенным, что скажется на времени подготовки собственной публикации или научной работы иного плана.
Недостатки условные, их можно преодолеть.
Возникли сложности?
Нужна помощь преподавателя?
Мы всегда рады Вам помочь!
С какими проблемами сталкиваются исследователи
Можно назвать 4 основных трудности и проблемы, с которыми сталкиваются ученые при проведении метаанализа:
- Предвзятость самого автора. Может привести к получению неточных результатов.
- Отсутствие части статистических сведений в отдельных источниках. Что заставит разбивать исследование на несколько частей.
- Сложности верификации результатов. В некоторых случаях подтвердить точность конечных сведений невозможно.
- Низкий уровень владения необходимым научно-исследовательским инструментарием.
Из-за высокой вероятности ошибки далеко не все исследователи прибегают к методике.
Стоит ли прибегать к метаанализу данных
Метаанализ данных может оказаться полезными инструментом исследовательской работы. Прибегать к нему следует, когда есть реальная необходимость исследовать статистические данные. Для действительно сложных многокомпонентных исследований требуется участие группы специалистов, которые будут работать в тандеме.
Систематический обзор и мета-анализ. Общие сведения
Систематические обзоры являются формой анализа медицинских исследований, суть которых сводится к тематическому подбору и изучению всех доступных статей на определенную тему, например об эффективности конкретного медицинского препарата.
Мета-анализ – является разновидностью систематических обзоров. Он объединяет в себе численный анализ аналогичных исследований, и может проводиться как сам по себе, так и быть частью систематического обзора.
Исследователи, проводящие соответствующие систематические обзоры, как правило, являются экспертами, и работают согласно известному протоколу исследования, анализируя медицинские данные.
Выводы систематических обзоров имеют гораздо большую ценность, нежели данные отдельно взятого исследования, благодаря лучшей методологии и большей выборке учитываемых случаев.
На основании этих выводов формируются рекомендации в гайдлайнах (клинических руководствах), а также решаются принципиальные экономические вопросы, например, следует ли финансировать производство нового препарата.
К СВЕДЕНИЮ: Рандомизированные контролируемые исследования являются золотым стандартом получения научных данных о новых медицинских вмешательствах. В пирамиде доказательности РКИ занимают одно из ведущих мест. Подробнее: РАНДОМИЗИРОВАННОЕ КОНТРОЛИРУЕМОЕ ИССЛЕДОВАНИЕ В МЕДИЦИНЕ
Как проводятся систематические обзоры?
Проведение таких исследований строго стандартизировано. Например, Institute of Medicine опубликовал подробный пошаговый стандарт проведения систематических обзоров [
1
]. Одним из органов, следящих за соблюдением этого протокола, является U.S. Preventive Services Task Force (
USPSTF
).
Проведенные когда-либо систематические обзоры публикуются в
Кокрановской библиотеке
, которая получила признание международного медицинского сообщества — и стала надежным авторитетом и мерилом. Публикация в ней систематического обзора является достаточным доказательством того, что он проведен с соблюдением всех требований строгого научного протокола.
Каковы преимущества систематических обзоров?
Если какие-то из современных научных исследований в принципе способны давать окончательные ответы на медицинские вопросы, то это – систематические обзоры. Резюмируя все, известные на момент проведения обзора, исследования, они дают наиболее достоверное из всех возможных, заключение. Это заключение может касаться конкретного вопроса терапии, профилактики, и тд. Особенно высокую ценность имеют заключения систематических обзоров об эффективности и безопасности какого-либо определенного лекарственного препарата.
К СВЕДЕНИЮ: Исследование типа «случай-контроль» является одной из разновидностей медицинского исследования, и часто используется с целью определения причины заболевания, особенно при расследовании вспышек инфекционных заболеваний, или изучении редких болезней. Исследование «случай-контроль» всегда является ретроспективным, то есть исследователи используют данные, собранные в прошлом, с целью проверки наличия связи между конкретным полученным результатом и подозреваемым фактором риска. Подробнее: ИССЛЕДОВАНИЕ СЛУЧАЙ-КОНТРОЛЬ
Обобщая большие объемы доказательств, систематические обзоры помогают практикующим врачам понимать последние события в медицинской литературе.
Они предлагают области применения полученных данных (в «выводах» обзора), и выявляют пробелы в знаниях, которые требуют проведения дополнительных исследований.
Выводы обзоров являются более надежными, чем выводы отдельных исследований. Обзоры полностью избавляют практического врача от необходимости разбираться в противоречащих друг другу исследованиях.
Систематические обзоры снимают все подозрения в «сфабрикованности» результатов, их математическая мощность и точность – весьма высоки.
Систематические обзоры, помимо всего прочего, имеют относительно невысокую стоимость – провести такой обзор дешевле и быстрее, нежели проводить новое клиническое исследование.
ЭФФЕКТ ПЛАЦЕБО (PLACEBO EFFECT) — как правило (но не обязательно или не всегда), благоприятный эффект, приписываемый пациентами лекарственному средству или лечению, назначенному лечащим врачом. Ощущаемое благоприятное действие плацебо связано с ожиданием эффекта от лечения, например, из-за внушения. Подробнее об ЭФФЕКТЕ ПЛАЦЕБО.
Каковы недостатки систематических обзоров?
Иногда исследования, включенные в систематический обзор, и, особенно, мета-анализ, берутся только из одной библиотеки, имеют общую системную ошибку и не включают многих других, полезных исследований. Поэтому данные бывают ненадежными.
Также не является редкостью эффект смещения результатов, когда положительные результаты преувеличиваются, а нейтральные или отрицательные — подавляются.
Что может вызвать систематическую ошибку?
Обычным среди врачей является широкое распространение своих успешных результатов, и сокрытие своих неудач. Более того, даже среди редакторов медицинских журналов и рецензентов наблюдается тенденция отказывать в публикации исследованиям с отрицательными результатами, а положительные результаты выставлять на обозрение, в целях угождения читателям.
Второй проблемой является то, что ученым удается легче добиться финансирования своих исследований, если заведомо можно предполагать положительный результат. Напротив, если результат, скорее всего, будет отрицательным — такому исследованию труднее найти финансирование.
Что такое мета-анализ?
Мета-анализ может проводиться отдельно или быть частью более широкого систематического обзора. Мета-анализ – это предельно надежный из всех возможных способов получения информации об эффективности лечения, особенно если он проводится на рандомизированных контролируемых исследованиях.
К СВЕДЕНИЮ: Еще одним методом объективизации данных, полученных в РКИ является ослепление. Слепой метод, или ослепление — это метод проведения исследования, заключающийся в сокрытии информации от того или иного участника исследования, призванный исключить субъективное воздействие участников исследования на результат. Если РКИ сопровождалось ослеплением, то в таком случае говорят о [двойном] слепом рандомизированном клиническом исследовании. Подробнее об ослеплении (слепом методе исследования): СЛЕПОЕ ИССЛЕДОВАНИЕ
В то время как систематический обзор может включать самые разные типы исследований, мета-анализ должен включать только исследования аналогичной структуры (избегая «неоднородности» в исследованиях).
Мета-анализ использует статистический анализ, чтобы объединить цифры, полученные в отдельных исследованиях, и вычислить общий количественный результат так, словно он был получен из единого исследования.
Мета-анализ являются мощным инструментом, но не всегда практичным.
Несмотря на то, что мета-анализ обеспечивает наилучшие доказательства, основываясь на имеющихся исследованиях, цифры, которые получаются в его результате, не всегда можно экстраполировать на повседневную практику врача.
«Мы пришли к выводу, что мета-анализ не является точной статистической наукой, он лишь дает определенные простые ответы на сложные клинические проблемы», — такой отзыв экспертов однажды был опубликован в журнале The Lancet.
Метаанализ — это один из типичных способов написания, который потребуется студентам колледжа. Это также один из самых любимых методов письма, который будет использоваться преподавателями, поскольку он требует, чтобы студенты выполняли очень специфические риторические или писательские действия. Метаанализ происходит в два отдельных этапа: предварительный анализ и затем метаанализ.
«Мета» определена
Чтобы понять, как выполнить метаанализ, сначала нужно понять термин «мета». Мета — это греческий префикс, который означает «после» или «за». Поэтому, когда писатель выполняет метаанализ, он идет после или вне анализа, который был ранее. Это означает, что писатель должен проанализировать свой ранее написанный анализ предмета. Короче говоря, они должны написать анализ о своем анализе.
$config[code] not found
Этап 1: Анализ
Первым этапом метаанализа является предварительный анализ. О чем бы ни был написан предмет: о книге, фильме или газетной статье (все обычные предметы для написания в колледже), писатель должен подойти к анализу этого предмета со знанием, которое он / она уже обрабатывает. Никаких исследований или экспертизы не требуется; только тщательный и вдумчивый ответ на материал под рукой.
Видео дня
Принесено вам Саженцем Принесено вам Саженцем
Этап 2: метаанализ
Второй этап метаанализа — это этап, на котором писатель идет «после» того, что уже написано, и производит знания «за пределами» того, что они знали раньше. На этом этапе, прежде чем писать, исследование и более глубокое изучение рассматриваемой темы помогает углубить понимание не только предмета, но и знаний писателей или их отсутствия по этому предмету. Именно на этом этапе авторы вынуждены лучше объяснять себя, лучше понимать себя и бросать вызов своим собственным предположениям или отказываться от выводов, особенно если автор анализирует свои собственные убеждения или мнения.
Этап 3,4 и так далее: углубляться
После первого и второго этапов метаанализ фактически завершен. Однако, если писатель или инструктор в этом отношении хочет глубже вникнуть в понимание как материала, так и способности писателя анализировать материал, тогда Стадия 2 может быть повторена для Стадии 3, 4 и так далее. Это просто делается путем анализа предшествующего анализа: определения или переопределения терминов, оспаривания или исправления допущений, а также исследования и раскрытия новой информации.
- Review
- Open Access
- Published: 01 August 2019
- Kadek Agus Surya Dila2,3,
- Muawia Yousif Fadlelmola Mohamed2,4,
- Dao Ngoc Hien Tam2,5,
- Nguyen Dang Kien2,6,
- Ali Mahmoud Ahmed2,7 &
- …
- Nguyen Tien Huy8,9,10
Tropical Medicine and Health
volume 47, Article number: 46 (2019)
Cite this article
-
548k Accesses
-
140 Citations
-
93 Altmetric
-
Metrics details
Abstract
Background
The massive abundance of studies relating to tropical medicine and health has increased strikingly over the last few decades. In the field of tropical medicine and health, a well-conducted systematic review and meta-analysis (SR/MA) is considered a feasible solution for keeping clinicians abreast of current evidence-based medicine. Understanding of SR/MA steps is of paramount importance for its conduction. It is not easy to be done as there are obstacles that could face the researcher. To solve those hindrances, this methodology study aimed to provide a step-by-step approach mainly for beginners and junior researchers, in the field of tropical medicine and other health care fields, on how to properly conduct a SR/MA, in which all the steps here depicts our experience and expertise combined with the already well-known and accepted international guidance.
We suggest that all steps of SR/MA should be done independently by 2–3 reviewers’ discussion, to ensure data quality and accuracy.
Conclusion
SR/MA steps include the development of research question, forming criteria, search strategy, searching databases, protocol registration, title, abstract, full-text screening, manual searching, extracting data, quality assessment, data checking, statistical analysis, double data checking, and manuscript writing.
Introduction
The amount of studies published in the biomedical literature, especially tropical medicine and health, has increased strikingly over the last few decades. This massive abundance of literature makes clinical medicine increasingly complex, and knowledge from various researches is often needed to inform a particular clinical decision. However, available studies are often heterogeneous with regard to their design, operational quality, and subjects under study and may handle the research question in a different way, which adds to the complexity of evidence and conclusion synthesis [1].
Systematic review and meta-analyses (SR/MAs) have a high level of evidence as represented by the evidence-based pyramid. Therefore, a well-conducted SR/MA is considered a feasible solution in keeping health clinicians ahead regarding contemporary evidence-based medicine.
Differing from a systematic review, unsystematic narrative review tends to be descriptive, in which the authors select frequently articles based on their point of view which leads to its poor quality. A systematic review, on the other hand, is defined as a review using a systematic method to summarize evidence on questions with a detailed and comprehensive plan of study. Furthermore, despite the increasing guidelines for effectively conducting a systematic review, we found that basic steps often start from framing question, then identifying relevant work which consists of criteria development and search for articles, appraise the quality of included studies, summarize the evidence, and interpret the results [2, 3]. However, those simple steps are not easy to be reached in reality. There are many troubles that a researcher could be struggled with which has no detailed indication.
Conducting a SR/MA in tropical medicine and health may be difficult especially for young researchers; therefore, understanding of its essential steps is crucial. It is not easy to be done as there are obstacles that could face the researcher. To solve those hindrances, we recommend a flow diagram (Fig. 1) which illustrates a detailed and step-by-step the stages for SR/MA studies. This methodology study aimed to provide a step-by-step approach mainly for beginners and junior researchers, in the field of tropical medicine and other health care fields, on how to properly and succinctly conduct a SR/MA; all the steps here depicts our experience and expertise combined with the already well known and accepted international guidance.
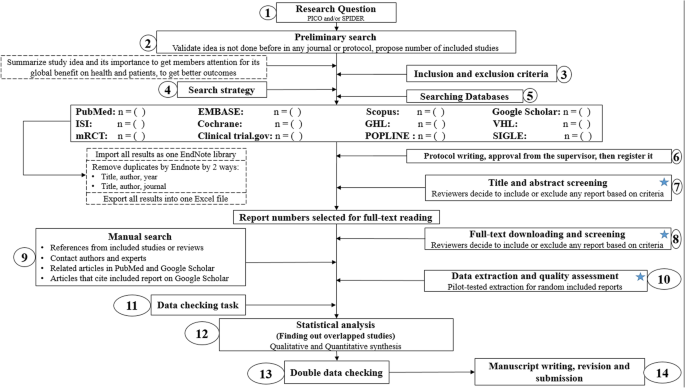
Detailed flow diagram guideline for systematic review and meta-analysis steps. Note: Star icon refers to “2–3 reviewers screen independently”
Full size image
Methods and results
Detailed steps for conducting any systematic review and meta-analysis
We searched the methods reported in published SR/MA in tropical medicine and other healthcare fields besides the published guidelines like Cochrane guidelines {Higgins, 2011 #7} [4] to collect the best low-bias method for each step of SR/MA conduction steps. Furthermore, we used guidelines that we apply in studies for all SR/MA steps. We combined these methods in order to conclude and conduct a detailed flow diagram that shows the SR/MA steps how being conducted.
Any SR/MA must follow the widely accepted Preferred Reporting Items for Systematic Review and Meta-analysis statement (PRISMA checklist 2009) (Additional file 5: Table S1) [5].
We proposed our methods according to a valid explanatory simulation example choosing the topic of “evaluating safety of Ebola vaccine,” as it is known that Ebola is a very rare tropical disease but fatal. All the explained methods feature the standards followed internationally, with our compiled experience in the conduct of SR beside it, which we think proved some validity. This is a SR under conduct by a couple of researchers teaming in a research group, moreover, as the outbreak of Ebola which took place (2013–2016) in Africa resulted in a significant mortality and morbidity. Furthermore, since there are many published and ongoing trials assessing the safety of Ebola vaccines, we thought this would provide a great opportunity to tackle this hotly debated issue. Moreover, Ebola started to fire again and new fatal outbreak appeared in the Democratic Republic of Congo since August 2018, which caused infection to more than 1000 people according to the World Health Organization, and 629 people have been killed till now. Hence, it is considered the second worst Ebola outbreak, after the first one in West Africa in 2014, which infected more than 26,000 and killed about 11,300 people along outbreak course.
Research question and objectives
Like other study designs, the research question of SR/MA should be feasible, interesting, novel, ethical, and relevant. Therefore, a clear, logical, and well-defined research question should be formulated. Usually, two common tools are used: PICO or SPIDER. PICO (Population, Intervention, Comparison, Outcome) is used mostly in quantitative evidence synthesis. Authors demonstrated that PICO holds more sensitivity than the more specific SPIDER approach [6]. SPIDER (Sample, Phenomenon of Interest, Design, Evaluation, Research type) was proposed as a method for qualitative and mixed methods search.
We here recommend a combined approach of using either one or both the SPIDER and PICO tools to retrieve a comprehensive search depending on time and resources limitations. When we apply this to our assumed research topic, being of qualitative nature, the use of SPIDER approach is more valid.
PICO is usually used for systematic review and meta-analysis of clinical trial study. For the observational study (without intervention or comparator), in many tropical and epidemiological questions, it is usually enough to use P (Patient) and O (outcome) only to formulate a research question. We must indicate clearly the population (P), then intervention (I) or exposure. Next, it is necessary to compare (C) the indicated intervention with other interventions, i.e., placebo. Finally, we need to clarify which are our relevant outcomes.
To facilitate comprehension, we choose the Ebola virus disease (EVD) as an example. Currently, the vaccine for EVD is being developed and under phase I, II, and III clinical trials; we want to know whether this vaccine is safe and can induce sufficient immunogenicity to the subjects.
An example of a research question for SR/MA based on PICO for this issue is as follows: How is the safety and immunogenicity of Ebola vaccine in human? (P: healthy subjects (human), I: vaccination, C: placebo, O: safety or adverse effects)
Preliminary research and idea validation
We recommend a preliminary search to identify relevant articles, ensure the validity of the proposed idea, avoid duplication of previously addressed questions, and assure that we have enough articles for conducting its analysis. Moreover, themes should focus on relevant and important health-care issues, consider global needs and values, reflect the current science, and be consistent with the adopted review methods. Gaining familiarity with a deep understanding of the study field through relevant videos and discussions is of paramount importance for better retrieval of results. If we ignore this step, our study could be canceled whenever we find out a similar study published before. This means we are wasting our time to deal with a problem that has been tackled for a long time.
To do this, we can start by doing a simple search in PubMed or Google Scholar with search terms Ebola AND vaccine. While doing this step, we identify a systematic review and meta-analysis of determinant factors influencing antibody response from vaccination of Ebola vaccine in non-human primate and human [7], which is a relevant paper to read to get a deeper insight and identify gaps for better formulation of our research question or purpose. We can still conduct systematic review and meta-analysis of Ebola vaccine because we evaluate safety as a different outcome and different population (only human).
Inclusion and exclusion criteria
Eligibility criteria are based on the PICO approach, study design, and date. Exclusion criteria mostly are unrelated, duplicated, unavailable full texts, or abstract-only papers. These exclusions should be stated in advance to refrain the researcher from bias. The inclusion criteria would be articles with the target patients, investigated interventions, or the comparison between two studied interventions. Briefly, it would be articles which contain information answering our research question. But the most important is that it should be clear and sufficient information, including positive or negative, to answer the question.
For the topic we have chosen, we can make inclusion criteria: (1) any clinical trial evaluating the safety of Ebola vaccine and (2) no restriction regarding country, patient age, race, gender, publication language, and date. Exclusion criteria are as follows: (1) study of Ebola vaccine in non-human subjects or in vitro studies; (2) study with data not reliably extracted, duplicate, or overlapping data; (3) abstract-only papers as preceding papers, conference, editorial, and author response theses and books; (4) articles without available full text available; and (5) case reports, case series, and systematic review studies. The PRISMA flow diagram template that is used in SR/MA studies can be found in Fig. 2.
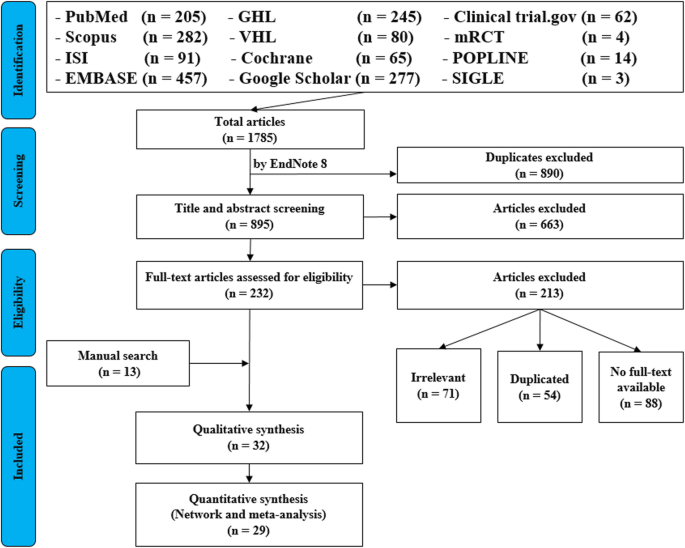
PRISMA flow diagram of studies’ screening and selection
Full size image
Search strategy
A standard search strategy is used in PubMed, then later it is modified according to each specific database to get the best relevant results. The basic search strategy is built based on the research question formulation (i.e., PICO or PICOS). Search strategies are constructed to include free-text terms (e.g., in the title and abstract) and any appropriate subject indexing (e.g., MeSH) expected to retrieve eligible studies, with the help of an expert in the review topic field or an information specialist. Additionally, we advise not to use terms for the Outcomes as their inclusion might hinder the database being searched to retrieve eligible studies because the used outcome is not mentioned obviously in the articles.
The improvement of the search term is made while doing a trial search and looking for another relevant term within each concept from retrieved papers. To search for a clinical trial, we can use these descriptors in PubMed: “clinical trial”[Publication Type] OR “clinical trials as topic”[MeSH terms] OR “clinical trial”[All Fields]. After some rounds of trial and refinement of search term, we formulate the final search term for PubMed as follows: (ebola OR ebola virus OR ebola virus disease OR EVD) AND (vaccine OR vaccination OR vaccinated OR immunization) AND (“clinical trial”[Publication Type] OR “clinical trials as topic”[MeSH Terms] OR “clinical trial”[All Fields]). Because the study for this topic is limited, we do not include outcome term (safety and immunogenicity) in the search term to capture more studies.
Search databases, import all results to a library, and exporting to an excel sheet
According to the AMSTAR guidelines, at least two databases have to be searched in the SR/MA [8], but as you increase the number of searched databases, you get much yield and more accurate and comprehensive results. The ordering of the databases depends mostly on the review questions; being in a study of clinical trials, you will rely mostly on Cochrane, mRCTs, or International Clinical Trials Registry Platform (ICTRP). Here, we propose 12 databases (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical trials.gov, mRCTs, POPLINE, and SIGLE), which help to cover almost all published articles in tropical medicine and other health-related fields. Among those databases, POPLINE focuses on reproductive health. Researchers should consider to choose relevant database according to the research topic. Some databases do not support the use of Boolean or quotation; otherwise, there are some databases that have special searching way. Therefore, we need to modify the initial search terms for each database to get appreciated results; therefore, manipulation guides for each online database searches are presented in Additional file 5: Table S2. The detailed search strategy for each database is found in Additional file 5: Table S3. The search term that we created in PubMed needs customization based on a specific characteristic of the database. An example for Google Scholar advanced search for our topic is as follows:
-
1.
With all of the words: ebola virus
With at least one of the words: vaccine vaccination vaccinated immunization
Where my words occur: in the title of the article
-
2.
With all of the words: EVD
With at least one of the words: vaccine vaccination vaccinated immunization
Where my words occur: in the title of the article
Finally, all records are collected into one Endnote library in order to delete duplicates and then to it export into an excel sheet. Using remove duplicating function with two options is mandatory. All references which have (1) the same title and author, and published in the same year, and (2) the same title and author, and published in the same journal, would be deleted. References remaining after this step should be exported to an excel file with essential information for screening. These could be the authors’ names, publication year, journal, DOI, URL link, and abstract.
Protocol writing and registration
Protocol registration at an early stage guarantees transparency in the research process and protects from duplication problems. Besides, it is considered a documented proof of team plan of action, research question, eligibility criteria, intervention/exposure, quality assessment, and pre-analysis plan. It is recommended that researchers send it to the principal investigator (PI) to revise it, then upload it to registry sites. There are many registry sites available for SR/MA like those proposed by Cochrane and Campbell collaborations; however, we recommend registering the protocol into PROSPERO as it is easier. The layout of a protocol template, according to PROSPERO, can be found in Additional file 5: File S1.
Title and abstract screening
Decisions to select retrieved articles for further assessment are based on eligibility criteria, to minimize the chance of including non-relevant articles. According to the Cochrane guidance, two reviewers are a must to do this step, but as for beginners and junior researchers, this might be tiresome; thus, we propose based on our experience that at least three reviewers should work independently to reduce the chance of error, particularly in teams with a large number of authors to add more scrutiny and ensure proper conduct. Mostly, the quality with three reviewers would be better than two, as two only would have different opinions from each other, so they cannot decide, while the third opinion is crucial. And here are some examples of systematic reviews which we conducted following the same strategy (by a different group of researchers in our research group) and published successfully, and they feature relevant ideas to tropical medicine and disease [9,10,11].
In this step, duplications will be removed manually whenever the reviewers find them out. When there is a doubt about an article decision, the team should be inclusive rather than exclusive, until the main leader or PI makes a decision after discussion and consensus. All excluded records should be given exclusion reasons.
Full text downloading and screening
Many search engines provide links for free to access full-text articles. In case not found, we can search in some research websites as ResearchGate, which offer an option of direct full-text request from authors. Additionally, exploring archives of wanted journals, or contacting PI to purchase it if available. Similarly, 2–3 reviewers work independently to decide about included full texts according to eligibility criteria, with reporting exclusion reasons of articles. In case any disagreement has occurred, the final decision has to be made by discussion.
Manual search
One has to exhaust all possibilities to reduce bias by performing an explicit hand-searching for retrieval of reports that may have been dropped from first search [12]. We apply five methods to make manual searching: searching references from included studies/reviews, contacting authors and experts, and looking at related articles/cited articles in PubMed and Google Scholar.
We describe here three consecutive methods to increase and refine the yield of manual searching: firstly, searching reference lists of included articles; secondly, performing what is known as citation tracking in which the reviewers track all the articles that cite each one of the included articles, and this might involve electronic searching of databases; and thirdly, similar to the citation tracking, we follow all “related to” or “similar” articles. Each of the abovementioned methods can be performed by 2–3 independent reviewers, and all the possible relevant article must undergo further scrutiny against the inclusion criteria, after following the same records yielded from electronic databases, i.e., title/abstract and full-text screening.
We propose an independent reviewing by assigning each member of the teams a “tag” and a distinct method, to compile all the results at the end for comparison of differences and discussion and to maximize the retrieval and minimize the bias. Similarly, the number of included articles has to be stated before addition to the overall included records.
Data extraction and quality assessment
This step entitles data collection from included full-texts in a structured extraction excel sheet, which is previously pilot-tested for extraction using some random studies. We recommend extracting both adjusted and non-adjusted data because it gives the most allowed confounding factor to be used in the analysis by pooling them later [13]. The process of extraction should be executed by 2–3 independent reviewers. Mostly, the sheet is classified into the study and patient characteristics, outcomes, and quality assessment (QA) tool.
Data presented in graphs should be extracted by software tools such as Web plot digitizer [14]. Most of the equations that can be used in extraction prior to analysis and estimation of standard deviation (SD) from other variables is found inside Additional file 5: File S2 with their references as Hozo et al. [15], Xiang et al. [16], and Rijkom et al. [17]. A variety of tools are available for the QA, depending on the design: ROB-2 Cochrane tool for randomized controlled trials [18] which is presented as Additional file 1: Figure S1 and Additional file 2: Figure S2—from a previous published article data—[19], NIH tool for observational and cross-sectional studies [20], ROBINS-I tool for non-randomize trials [21], QUADAS-2 tool for diagnostic studies, QUIPS tool for prognostic studies, CARE tool for case reports, and ToxRtool for in vivo and in vitro studies. We recommend that 2–3 reviewers independently assess the quality of the studies and add to the data extraction form before the inclusion into the analysis to reduce the risk of bias. In the NIH tool for observational studies—cohort and cross-sectional—as in this EBOLA case, to evaluate the risk of bias, reviewers should rate each of the 14 items into dichotomous variables: yes, no, or not applicable. An overall score is calculated by adding all the items scores as yes equals one, while no and NA equals zero. A score will be given for every paper to classify them as poor, fair, or good conducted studies, where a score from 0–5 was considered poor, 6–9 as fair, and 10–14 as good.
In the EBOLA case example above, authors can extract the following information: name of authors, country of patients, year of publication, study design (case report, cohort study, or clinical trial or RCT), sample size, the infected point of time after EBOLA infection, follow-up interval after vaccination time, efficacy, safety, adverse effects after vaccinations, and QA sheet (Additional file 6: Data S1).
Data checking
Due to the expected human error and bias, we recommend a data checking step, in which every included article is compared with its counterpart in an extraction sheet by evidence photos, to detect mistakes in data. We advise assigning articles to 2–3 independent reviewers, ideally not the ones who performed the extraction of those articles. When resources are limited, each reviewer is assigned a different article than the one he extracted in the previous stage.
Statistical analysis
Investigators use different methods for combining and summarizing findings of included studies. Before analysis, there is an important step called cleaning of data in the extraction sheet, where the analyst organizes extraction sheet data in a form that can be read by analytical software. The analysis consists of 2 types namely qualitative and quantitative analysis. Qualitative analysis mostly describes data in SR studies, while quantitative analysis consists of two main types: MA and network meta-analysis (NMA). Subgroup, sensitivity, cumulative analyses, and meta-regression are appropriate for testing whether the results are consistent or not and investigating the effect of certain confounders on the outcome and finding the best predictors. Publication bias should be assessed to investigate the presence of missing studies which can affect the summary.
To illustrate basic meta-analysis, we provide an imaginary data for the research question about Ebola vaccine safety (in terms of adverse events, 14 days after injection) and immunogenicity (Ebola virus antibodies rise in geometric mean titer, 6 months after injection). Assuming that from searching and data extraction, we decided to do an analysis to evaluate Ebola vaccine “A” safety and immunogenicity. Other Ebola vaccines were not meta-analyzed because of the limited number of studies (instead, it will be included for narrative review). The imaginary data for vaccine safety meta-analysis can be accessed in Additional file 7: Data S2. To do the meta-analysis, we can use free software, such as RevMan [22] or R package meta [23]. In this example, we will use the R package meta. The tutorial of meta package can be accessed through “General Package for Meta-Analysis” tutorial pdf [23]. The R codes and its guidance for meta-analysis done can be found in Additional file 5: File S3.
For the analysis, we assume that the study is heterogenous in nature; therefore, we choose a random effect model. We did an analysis on the safety of Ebola vaccine A. From the data table, we can see some adverse events occurring after intramuscular injection of vaccine A to the subject of the study. Suppose that we include six studies that fulfill our inclusion criteria. We can do a meta-analysis for each of the adverse events extracted from the studies, for example, arthralgia, from the results of random effect meta-analysis using the R meta package.
From the results shown in Additional file 3: Figure S3, we can see that the odds ratio (OR) of arthralgia is 1.06 (0.79; 1.42), p value = 0.71, which means that there is no association between the intramuscular injection of Ebola vaccine A and arthralgia, as the OR is almost one, and besides, the P value is insignificant as it is > 0.05.
In the meta-analysis, we can also visualize the results in a forest plot. It is shown in Fig. 3 an example of a forest plot from the simulated analysis.
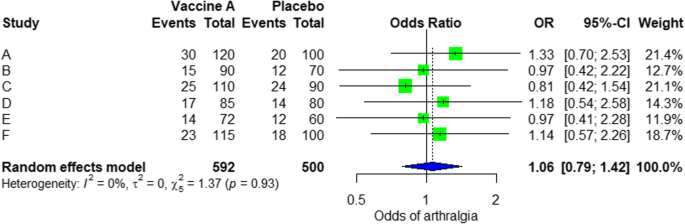
Random effect model forest plot for comparison of vaccine A versus placebo
Full size image
From the forest plot, we can see six studies (A to F) and their respective OR (95% CI). The green box represents the effect size (in this case, OR) of each study. The bigger the box means the study weighted more (i.e., bigger sample size). The blue diamond shape represents the pooled OR of the six studies. We can see the blue diamond cross the vertical line OR = 1, which indicates no significance for the association as the diamond almost equalized in both sides. We can confirm this also from the 95% confidence interval that includes one and the p value > 0.05.
For heterogeneity, we see that I2 = 0%, which means no heterogeneity is detected; the study is relatively homogenous (it is rare in the real study). To evaluate publication bias related to the meta-analysis of adverse events of arthralgia, we can use the metabias function from the R meta package (Additional file 4: Figure S4) and visualization using a funnel plot. The results of publication bias are demonstrated in Fig. 4. We see that the p value associated with this test is 0.74, indicating symmetry of the funnel plot. We can confirm it by looking at the funnel plot.
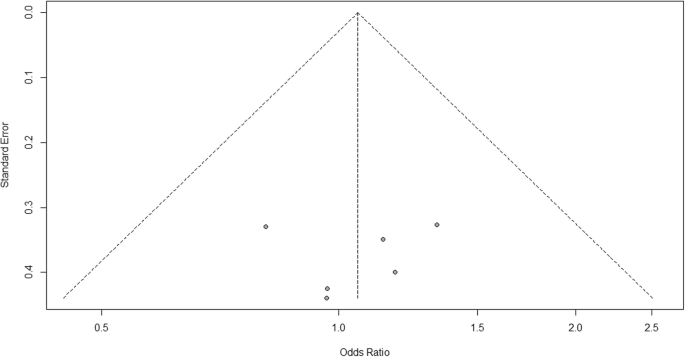
Publication bias funnel plot for comparison of vaccine A versus placebo
Full size image
Looking at the funnel plot, the number of studies at the left and right side of the funnel plot is the same; therefore, the plot is symmetry, indicating no publication bias detected.
Sensitivity analysis is a procedure used to discover how different values of an independent variable will influence the significance of a particular dependent variable by removing one study from MA. If all included study p values are < 0.05, hence, removing any study will not change the significant association. It is only performed when there is a significant association, so if the p value of MA done is 0.7—more than one—the sensitivity analysis is not needed for this case study example. If there are 2 studies with p value > 0.05, removing any of the two studies will result in a loss of the significance.
Double data checking
For more assurance on the quality of results, the analyzed data should be rechecked from full-text data by evidence photos, to allow an obvious check for the PI of the study.
Manuscript writing, revision, and submission to a journal
Writing based on four scientific sections: introduction, methods, results, and discussion, mostly with a conclusion. Performing a characteristic table for study and patient characteristics is a mandatory step which can be found as a template in Additional file 5: Table S3.
After finishing the manuscript writing, characteristics table, and PRISMA flow diagram, the team should send it to the PI to revise it well and reply to his comments and, finally, choose a suitable journal for the manuscript which fits with considerable impact factor and fitting field. We need to pay attention by reading the author guidelines of journals before submitting the manuscript.
Discussion
The role of evidence-based medicine in biomedical research is rapidly growing. SR/MAs are also increasing in the medical literature. This paper has sought to provide a comprehensive approach to enable reviewers to produce high-quality SR/MAs. We hope that readers could gain general knowledge about how to conduct a SR/MA and have the confidence to perform one, although this kind of study requires complex steps compared to narrative reviews.
Having the basic steps for conduction of MA, there are many advanced steps that are applied for certain specific purposes. One of these steps is meta-regression which is performed to investigate the association of any confounder and the results of the MA. Furthermore, there are other types rather than the standard MA like NMA and MA. In NMA, we investigate the difference between several comparisons when there were not enough data to enable standard meta-analysis. It uses both direct and indirect comparisons to conclude what is the best between the competitors. On the other hand, mega MA or MA of patients tend to summarize the results of independent studies by using its individual subject data. As a more detailed analysis can be done, it is useful in conducting repeated measure analysis and time-to-event analysis. Moreover, it can perform analysis of variance and multiple regression analysis; however, it requires homogenous dataset and it is time-consuming in conduct [24].
Conclusions
Systematic review/meta-analysis steps include development of research question and its validation, forming criteria, search strategy, searching databases, importing all results to a library and exporting to an excel sheet, protocol writing and registration, title and abstract screening, full-text screening, manual searching, extracting data and assessing its quality, data checking, conducting statistical analysis, double data checking, manuscript writing, revising, and submitting to a journal.
Availability of data and materials
Not applicable.
Abbreviations
- NMA:
-
Network meta-analysis
- PI:
-
Principal investigator
- PICO:
-
Population, Intervention, Comparison, Outcome
- PRISMA:
-
Preferred Reporting Items for Systematic Review and Meta-analysis statement
- QA:
-
Quality assessment
- SPIDER:
-
Sample, Phenomenon of Interest, Design, Evaluation, Research type
- SR/MAs:
-
Systematic review and meta-analyses
References
-
Bello A, Wiebe N, Garg A, Tonelli M. Evidence-based decision-making 2: systematic reviews and meta-analysis. Methods Mol Biol (Clifton, NJ). 2015;1281:397–416.
Article
Google Scholar
-
Khan KS, Kunz R, Kleijnen J, Antes G. Five steps to conducting a systematic review. J R Soc Med. 2003;96(3):118–21.
Article
Google Scholar
-
Rys P, Wladysiuk M, Skrzekowska-Baran I, Malecki MT. Review articles, systematic reviews and meta-analyses: which can be trusted? Polskie Archiwum Medycyny Wewnetrznej. 2009;119(3):148–56.
PubMed
Google Scholar
-
Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. 2011.
-
Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009;339:b2535.
Article
Google Scholar
-
Methley AM, Campbell S, Chew-Graham C, McNally R, Cheraghi-Sohi S. PICO, PICOS and SPIDER: a comparison study of specificity and sensitivity in three search tools for qualitative systematic reviews. BMC Health Serv Res. 2014;14:579.
Article
Google Scholar
-
Gross L, Lhomme E, Pasin C, Richert L, Thiebaut R. Ebola vaccine development: systematic review of pre-clinical and clinical studies, and meta-analysis of determinants of antibody response variability after vaccination. Int J Infect Dis. 2018;74:83–96.
Article
CASGoogle Scholar
-
Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, … Henry DA. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017;358:j4008.
-
Giang HTN, Banno K, Minh LHN, Trinh LT, Loc LT, Eltobgy A, et al. Dengue hemophagocytic syndrome: a systematic review and meta-analysis on epidemiology, clinical signs, outcomes, and risk factors. Rev Med Virol. 2018;28(6):e2005.
Article
Google Scholar
-
Morra ME, Altibi AMA, Iqtadar S, Minh LHN, Elawady SS, Hallab A, et al. Definitions for warning signs and signs of severe dengue according to the WHO 2009 classification: systematic review of literature. Rev Med Virol. 2018;28(4):e1979.
Article
Google Scholar
-
Morra ME, Van Thanh L, Kamel MG, Ghazy AA, Altibi AMA, Dat LM, et al. Clinical outcomes of current medical approaches for Middle East respiratory syndrome: a systematic review and meta-analysis. Rev Med Virol. 2018;28(3):e1977.
Article
Google Scholar
-
Vassar M, Atakpo P, Kash MJ. Manual search approaches used by systematic reviewers in dermatology. Journal of the Medical Library Association: JMLA. 2016;104(4):302.
Article
Google Scholar
-
Naunheim MR, Remenschneider AK, Scangas GA, Bunting GW, Deschler DG. The effect of initial tracheoesophageal voice prosthesis size on postoperative complications and voice outcomes. Ann Otol Rhinol Laryngol. 2016;125(6):478–84.
Article
Google Scholar
-
Rohatgi AJaiWa. Web Plot Digitizer. ht tp. 2014;2.
-
Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005;5(1):13.
Article
Google Scholar
-
Wan X, Wang W, Liu J, Tong T. Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range. BMC Med Res Methodol. 2014;14(1):135.
Article
Google Scholar
-
Van Rijkom HM, Truin GJ, Van’t Hof MA. A meta-analysis of clinical studies on the caries-inhibiting effect of fluoride gel treatment. Carries Res. 1998;32(2):83–92.
-
Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
Article
Google Scholar
-
Tawfik GM, Tieu TM, Ghozy S, Makram OM, Samuel P, Abdelaal A, et al. Speech efficacy, safety and factors affecting lifetime of voice prostheses in patients with laryngeal cancer: a systematic review and network meta-analysis of randomized controlled trials. J Clin Oncol. 2018;36(15_suppl):e18031-e.
Article
Google Scholar
-
Wannemuehler TJ, Lobo BC, Johnson JD, Deig CR, Ting JY, Gregory RL. Vibratory stimulus reduces in vitro biofilm formation on tracheoesophageal voice prostheses. Laryngoscope. 2016;126(12):2752–7.
Article
CASGoogle Scholar
-
Sterne JAC, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, et al. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355.
-
RevMan The Cochrane Collaboration %J Copenhagen TNCCTCC. Review Manager (RevMan). 5.0. 2008.
-
Schwarzer GJRn. meta: An R package for meta-analysis. 2007;7(3):40-45.
Google Scholar
-
Simms LLH. Meta-analysis versus mega-analysis: is there a difference? Oral budesonide for the maintenance of remission in Crohn’s disease: Faculty of Graduate Studies, University of Western Ontario; 1998.
Download references
Funding
This study was conducted (in part) at the Joint Usage/Research Center on Tropical Disease, Institute of Tropical Medicine, Nagasaki University, Japan.
Author information
Authors and Affiliations
-
Faculty of Medicine, Ain Shams University, Cairo, Egypt
Gehad Mohamed Tawfik
-
Online research Club http://www.onlineresearchclub.org/
Gehad Mohamed Tawfik, Kadek Agus Surya Dila, Muawia Yousif Fadlelmola Mohamed, Dao Ngoc Hien Tam, Nguyen Dang Kien & Ali Mahmoud Ahmed
-
Pratama Giri Emas Hospital, Singaraja-Amlapura street, Giri Emas village, Sawan subdistrict, Singaraja City, Buleleng, Bali, 81171, Indonesia
Kadek Agus Surya Dila
-
Faculty of Medicine, University of Khartoum, Khartoum, Sudan
Muawia Yousif Fadlelmola Mohamed
-
Nanogen Pharmaceutical Biotechnology Joint Stock Company, Ho Chi Minh City, Vietnam
Dao Ngoc Hien Tam
-
Department of Obstetrics and Gynecology, Thai Binh University of Medicine and Pharmacy, Thai Binh, Vietnam
Nguyen Dang Kien
-
Faculty of Medicine, Al-Azhar University, Cairo, Egypt
Ali Mahmoud Ahmed
-
Evidence Based Medicine Research Group & Faculty of Applied Sciences, Ton Duc Thang University, Ho Chi Minh City, 70000, Vietnam
Nguyen Tien Huy
-
Faculty of Applied Sciences, Ton Duc Thang University, Ho Chi Minh City, 70000, Vietnam
Nguyen Tien Huy
-
Department of Clinical Product Development, Institute of Tropical Medicine (NEKKEN), Leading Graduate School Program, and Graduate School of Biomedical Sciences, Nagasaki University, 1-12-4 Sakamoto, Nagasaki, 852-8523, Japan
Nguyen Tien Huy
Authors
- Gehad Mohamed Tawfik
You can also search for this author in
PubMed Google Scholar - Kadek Agus Surya Dila
You can also search for this author in
PubMed Google Scholar - Muawia Yousif Fadlelmola Mohamed
You can also search for this author in
PubMed Google Scholar - Dao Ngoc Hien Tam
You can also search for this author in
PubMed Google Scholar - Nguyen Dang Kien
You can also search for this author in
PubMed Google Scholar - Ali Mahmoud Ahmed
You can also search for this author in
PubMed Google Scholar - Nguyen Tien Huy
You can also search for this author in
PubMed Google Scholar
Contributions
NTH and GMT were responsible for the idea and its design. The figure was done by GMT. All authors contributed to the manuscript writing and approval of the final version.
Corresponding author
Correspondence to
Nguyen Tien Huy.
Ethics declarations
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Additional files
Additional file 1:
Figure S1. Risk of bias assessment graph of included randomized controlled trials. (TIF 20 kb)
Additional file 2:
Figure S2. Risk of bias assessment summary. (TIF 69 kb)
Additional file 3:
Figure S3. Arthralgia results of random effect meta-analysis using R meta package. (TIF 20 kb)
Additional file 4:
Figure S4. Arthralgia linear regression test of funnel plot asymmetry using R meta package. (TIF 13 kb)
Additional file 5:
Table S1. PRISMA 2009 Checklist. Table S2. Manipulation guides for online database searches. Table S3. Detailed search strategy for twelve database searches. Table S4. Baseline characteristics of the patients in the included studies. File S1. PROSPERO protocol template file. File S2. Extraction equations that can be used prior to analysis to get missed variables. File S3. R codes and its guidance for meta-analysis done for comparison between EBOLA vaccine A and placebo. (DOCX 49 kb)
Additional file 6:
Data S1. Extraction and quality assessment data sheets for EBOLA case example. (XLSX 1368 kb)
Additional file 7:
Data S2. Imaginary data for EBOLA case example. (XLSX 10 kb)
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Tawfik, G.M., Dila, K.A.S., Mohamed, M.Y.F. et al. A step by step guide for conducting a systematic review and meta-analysis with simulation data.
Trop Med Health 47, 46 (2019). https://doi.org/10.1186/s41182-019-0165-6
Download citation
-
Received: 30 January 2019
-
Accepted: 24 May 2019
-
Published: 01 August 2019
-
DOI: https://doi.org/10.1186/s41182-019-0165-6
Keywords
- Search
- Data
- Extraction
- Analysis
- Study
- Results
- Review
- Open Access
- Published: 01 August 2019
- Kadek Agus Surya Dila2,3,
- Muawia Yousif Fadlelmola Mohamed2,4,
- Dao Ngoc Hien Tam2,5,
- Nguyen Dang Kien2,6,
- Ali Mahmoud Ahmed2,7 &
- …
- Nguyen Tien Huy8,9,10
Tropical Medicine and Health
volume 47, Article number: 46 (2019)
Cite this article
-
548k Accesses
-
140 Citations
-
93 Altmetric
-
Metrics details
Abstract
Background
The massive abundance of studies relating to tropical medicine and health has increased strikingly over the last few decades. In the field of tropical medicine and health, a well-conducted systematic review and meta-analysis (SR/MA) is considered a feasible solution for keeping clinicians abreast of current evidence-based medicine. Understanding of SR/MA steps is of paramount importance for its conduction. It is not easy to be done as there are obstacles that could face the researcher. To solve those hindrances, this methodology study aimed to provide a step-by-step approach mainly for beginners and junior researchers, in the field of tropical medicine and other health care fields, on how to properly conduct a SR/MA, in which all the steps here depicts our experience and expertise combined with the already well-known and accepted international guidance.
We suggest that all steps of SR/MA should be done independently by 2–3 reviewers’ discussion, to ensure data quality and accuracy.
Conclusion
SR/MA steps include the development of research question, forming criteria, search strategy, searching databases, protocol registration, title, abstract, full-text screening, manual searching, extracting data, quality assessment, data checking, statistical analysis, double data checking, and manuscript writing.
Introduction
The amount of studies published in the biomedical literature, especially tropical medicine and health, has increased strikingly over the last few decades. This massive abundance of literature makes clinical medicine increasingly complex, and knowledge from various researches is often needed to inform a particular clinical decision. However, available studies are often heterogeneous with regard to their design, operational quality, and subjects under study and may handle the research question in a different way, which adds to the complexity of evidence and conclusion synthesis [1].
Systematic review and meta-analyses (SR/MAs) have a high level of evidence as represented by the evidence-based pyramid. Therefore, a well-conducted SR/MA is considered a feasible solution in keeping health clinicians ahead regarding contemporary evidence-based medicine.
Differing from a systematic review, unsystematic narrative review tends to be descriptive, in which the authors select frequently articles based on their point of view which leads to its poor quality. A systematic review, on the other hand, is defined as a review using a systematic method to summarize evidence on questions with a detailed and comprehensive plan of study. Furthermore, despite the increasing guidelines for effectively conducting a systematic review, we found that basic steps often start from framing question, then identifying relevant work which consists of criteria development and search for articles, appraise the quality of included studies, summarize the evidence, and interpret the results [2, 3]. However, those simple steps are not easy to be reached in reality. There are many troubles that a researcher could be struggled with which has no detailed indication.
Conducting a SR/MA in tropical medicine and health may be difficult especially for young researchers; therefore, understanding of its essential steps is crucial. It is not easy to be done as there are obstacles that could face the researcher. To solve those hindrances, we recommend a flow diagram (Fig. 1) which illustrates a detailed and step-by-step the stages for SR/MA studies. This methodology study aimed to provide a step-by-step approach mainly for beginners and junior researchers, in the field of tropical medicine and other health care fields, on how to properly and succinctly conduct a SR/MA; all the steps here depicts our experience and expertise combined with the already well known and accepted international guidance.

Detailed flow diagram guideline for systematic review and meta-analysis steps. Note: Star icon refers to “2–3 reviewers screen independently”
Full size image
Methods and results
Detailed steps for conducting any systematic review and meta-analysis
We searched the methods reported in published SR/MA in tropical medicine and other healthcare fields besides the published guidelines like Cochrane guidelines {Higgins, 2011 #7} [4] to collect the best low-bias method for each step of SR/MA conduction steps. Furthermore, we used guidelines that we apply in studies for all SR/MA steps. We combined these methods in order to conclude and conduct a detailed flow diagram that shows the SR/MA steps how being conducted.
Any SR/MA must follow the widely accepted Preferred Reporting Items for Systematic Review and Meta-analysis statement (PRISMA checklist 2009) (Additional file 5: Table S1) [5].
We proposed our methods according to a valid explanatory simulation example choosing the topic of “evaluating safety of Ebola vaccine,” as it is known that Ebola is a very rare tropical disease but fatal. All the explained methods feature the standards followed internationally, with our compiled experience in the conduct of SR beside it, which we think proved some validity. This is a SR under conduct by a couple of researchers teaming in a research group, moreover, as the outbreak of Ebola which took place (2013–2016) in Africa resulted in a significant mortality and morbidity. Furthermore, since there are many published and ongoing trials assessing the safety of Ebola vaccines, we thought this would provide a great opportunity to tackle this hotly debated issue. Moreover, Ebola started to fire again and new fatal outbreak appeared in the Democratic Republic of Congo since August 2018, which caused infection to more than 1000 people according to the World Health Organization, and 629 people have been killed till now. Hence, it is considered the second worst Ebola outbreak, after the first one in West Africa in 2014, which infected more than 26,000 and killed about 11,300 people along outbreak course.
Research question and objectives
Like other study designs, the research question of SR/MA should be feasible, interesting, novel, ethical, and relevant. Therefore, a clear, logical, and well-defined research question should be formulated. Usually, two common tools are used: PICO or SPIDER. PICO (Population, Intervention, Comparison, Outcome) is used mostly in quantitative evidence synthesis. Authors demonstrated that PICO holds more sensitivity than the more specific SPIDER approach [6]. SPIDER (Sample, Phenomenon of Interest, Design, Evaluation, Research type) was proposed as a method for qualitative and mixed methods search.
We here recommend a combined approach of using either one or both the SPIDER and PICO tools to retrieve a comprehensive search depending on time and resources limitations. When we apply this to our assumed research topic, being of qualitative nature, the use of SPIDER approach is more valid.
PICO is usually used for systematic review and meta-analysis of clinical trial study. For the observational study (without intervention or comparator), in many tropical and epidemiological questions, it is usually enough to use P (Patient) and O (outcome) only to formulate a research question. We must indicate clearly the population (P), then intervention (I) or exposure. Next, it is necessary to compare (C) the indicated intervention with other interventions, i.e., placebo. Finally, we need to clarify which are our relevant outcomes.
To facilitate comprehension, we choose the Ebola virus disease (EVD) as an example. Currently, the vaccine for EVD is being developed and under phase I, II, and III clinical trials; we want to know whether this vaccine is safe and can induce sufficient immunogenicity to the subjects.
An example of a research question for SR/MA based on PICO for this issue is as follows: How is the safety and immunogenicity of Ebola vaccine in human? (P: healthy subjects (human), I: vaccination, C: placebo, O: safety or adverse effects)
Preliminary research and idea validation
We recommend a preliminary search to identify relevant articles, ensure the validity of the proposed idea, avoid duplication of previously addressed questions, and assure that we have enough articles for conducting its analysis. Moreover, themes should focus on relevant and important health-care issues, consider global needs and values, reflect the current science, and be consistent with the adopted review methods. Gaining familiarity with a deep understanding of the study field through relevant videos and discussions is of paramount importance for better retrieval of results. If we ignore this step, our study could be canceled whenever we find out a similar study published before. This means we are wasting our time to deal with a problem that has been tackled for a long time.
To do this, we can start by doing a simple search in PubMed or Google Scholar with search terms Ebola AND vaccine. While doing this step, we identify a systematic review and meta-analysis of determinant factors influencing antibody response from vaccination of Ebola vaccine in non-human primate and human [7], which is a relevant paper to read to get a deeper insight and identify gaps for better formulation of our research question or purpose. We can still conduct systematic review and meta-analysis of Ebola vaccine because we evaluate safety as a different outcome and different population (only human).
Inclusion and exclusion criteria
Eligibility criteria are based on the PICO approach, study design, and date. Exclusion criteria mostly are unrelated, duplicated, unavailable full texts, or abstract-only papers. These exclusions should be stated in advance to refrain the researcher from bias. The inclusion criteria would be articles with the target patients, investigated interventions, or the comparison between two studied interventions. Briefly, it would be articles which contain information answering our research question. But the most important is that it should be clear and sufficient information, including positive or negative, to answer the question.
For the topic we have chosen, we can make inclusion criteria: (1) any clinical trial evaluating the safety of Ebola vaccine and (2) no restriction regarding country, patient age, race, gender, publication language, and date. Exclusion criteria are as follows: (1) study of Ebola vaccine in non-human subjects or in vitro studies; (2) study with data not reliably extracted, duplicate, or overlapping data; (3) abstract-only papers as preceding papers, conference, editorial, and author response theses and books; (4) articles without available full text available; and (5) case reports, case series, and systematic review studies. The PRISMA flow diagram template that is used in SR/MA studies can be found in Fig. 2.

PRISMA flow diagram of studies’ screening and selection
Full size image
Search strategy
A standard search strategy is used in PubMed, then later it is modified according to each specific database to get the best relevant results. The basic search strategy is built based on the research question formulation (i.e., PICO or PICOS). Search strategies are constructed to include free-text terms (e.g., in the title and abstract) and any appropriate subject indexing (e.g., MeSH) expected to retrieve eligible studies, with the help of an expert in the review topic field or an information specialist. Additionally, we advise not to use terms for the Outcomes as their inclusion might hinder the database being searched to retrieve eligible studies because the used outcome is not mentioned obviously in the articles.
The improvement of the search term is made while doing a trial search and looking for another relevant term within each concept from retrieved papers. To search for a clinical trial, we can use these descriptors in PubMed: “clinical trial”[Publication Type] OR “clinical trials as topic”[MeSH terms] OR “clinical trial”[All Fields]. After some rounds of trial and refinement of search term, we formulate the final search term for PubMed as follows: (ebola OR ebola virus OR ebola virus disease OR EVD) AND (vaccine OR vaccination OR vaccinated OR immunization) AND (“clinical trial”[Publication Type] OR “clinical trials as topic”[MeSH Terms] OR “clinical trial”[All Fields]). Because the study for this topic is limited, we do not include outcome term (safety and immunogenicity) in the search term to capture more studies.
Search databases, import all results to a library, and exporting to an excel sheet
According to the AMSTAR guidelines, at least two databases have to be searched in the SR/MA [8], but as you increase the number of searched databases, you get much yield and more accurate and comprehensive results. The ordering of the databases depends mostly on the review questions; being in a study of clinical trials, you will rely mostly on Cochrane, mRCTs, or International Clinical Trials Registry Platform (ICTRP). Here, we propose 12 databases (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical trials.gov, mRCTs, POPLINE, and SIGLE), which help to cover almost all published articles in tropical medicine and other health-related fields. Among those databases, POPLINE focuses on reproductive health. Researchers should consider to choose relevant database according to the research topic. Some databases do not support the use of Boolean or quotation; otherwise, there are some databases that have special searching way. Therefore, we need to modify the initial search terms for each database to get appreciated results; therefore, manipulation guides for each online database searches are presented in Additional file 5: Table S2. The detailed search strategy for each database is found in Additional file 5: Table S3. The search term that we created in PubMed needs customization based on a specific characteristic of the database. An example for Google Scholar advanced search for our topic is as follows:
-
1.
With all of the words: ebola virus
With at least one of the words: vaccine vaccination vaccinated immunization
Where my words occur: in the title of the article
-
2.
With all of the words: EVD
With at least one of the words: vaccine vaccination vaccinated immunization
Where my words occur: in the title of the article
Finally, all records are collected into one Endnote library in order to delete duplicates and then to it export into an excel sheet. Using remove duplicating function with two options is mandatory. All references which have (1) the same title and author, and published in the same year, and (2) the same title and author, and published in the same journal, would be deleted. References remaining after this step should be exported to an excel file with essential information for screening. These could be the authors’ names, publication year, journal, DOI, URL link, and abstract.
Protocol writing and registration
Protocol registration at an early stage guarantees transparency in the research process and protects from duplication problems. Besides, it is considered a documented proof of team plan of action, research question, eligibility criteria, intervention/exposure, quality assessment, and pre-analysis plan. It is recommended that researchers send it to the principal investigator (PI) to revise it, then upload it to registry sites. There are many registry sites available for SR/MA like those proposed by Cochrane and Campbell collaborations; however, we recommend registering the protocol into PROSPERO as it is easier. The layout of a protocol template, according to PROSPERO, can be found in Additional file 5: File S1.
Title and abstract screening
Decisions to select retrieved articles for further assessment are based on eligibility criteria, to minimize the chance of including non-relevant articles. According to the Cochrane guidance, two reviewers are a must to do this step, but as for beginners and junior researchers, this might be tiresome; thus, we propose based on our experience that at least three reviewers should work independently to reduce the chance of error, particularly in teams with a large number of authors to add more scrutiny and ensure proper conduct. Mostly, the quality with three reviewers would be better than two, as two only would have different opinions from each other, so they cannot decide, while the third opinion is crucial. And here are some examples of systematic reviews which we conducted following the same strategy (by a different group of researchers in our research group) and published successfully, and they feature relevant ideas to tropical medicine and disease [9,10,11].
In this step, duplications will be removed manually whenever the reviewers find them out. When there is a doubt about an article decision, the team should be inclusive rather than exclusive, until the main leader or PI makes a decision after discussion and consensus. All excluded records should be given exclusion reasons.
Full text downloading and screening
Many search engines provide links for free to access full-text articles. In case not found, we can search in some research websites as ResearchGate, which offer an option of direct full-text request from authors. Additionally, exploring archives of wanted journals, or contacting PI to purchase it if available. Similarly, 2–3 reviewers work independently to decide about included full texts according to eligibility criteria, with reporting exclusion reasons of articles. In case any disagreement has occurred, the final decision has to be made by discussion.
Manual search
One has to exhaust all possibilities to reduce bias by performing an explicit hand-searching for retrieval of reports that may have been dropped from first search [12]. We apply five methods to make manual searching: searching references from included studies/reviews, contacting authors and experts, and looking at related articles/cited articles in PubMed and Google Scholar.
We describe here three consecutive methods to increase and refine the yield of manual searching: firstly, searching reference lists of included articles; secondly, performing what is known as citation tracking in which the reviewers track all the articles that cite each one of the included articles, and this might involve electronic searching of databases; and thirdly, similar to the citation tracking, we follow all “related to” or “similar” articles. Each of the abovementioned methods can be performed by 2–3 independent reviewers, and all the possible relevant article must undergo further scrutiny against the inclusion criteria, after following the same records yielded from electronic databases, i.e., title/abstract and full-text screening.
We propose an independent reviewing by assigning each member of the teams a “tag” and a distinct method, to compile all the results at the end for comparison of differences and discussion and to maximize the retrieval and minimize the bias. Similarly, the number of included articles has to be stated before addition to the overall included records.
Data extraction and quality assessment
This step entitles data collection from included full-texts in a structured extraction excel sheet, which is previously pilot-tested for extraction using some random studies. We recommend extracting both adjusted and non-adjusted data because it gives the most allowed confounding factor to be used in the analysis by pooling them later [13]. The process of extraction should be executed by 2–3 independent reviewers. Mostly, the sheet is classified into the study and patient characteristics, outcomes, and quality assessment (QA) tool.
Data presented in graphs should be extracted by software tools such as Web plot digitizer [14]. Most of the equations that can be used in extraction prior to analysis and estimation of standard deviation (SD) from other variables is found inside Additional file 5: File S2 with their references as Hozo et al. [15], Xiang et al. [16], and Rijkom et al. [17]. A variety of tools are available for the QA, depending on the design: ROB-2 Cochrane tool for randomized controlled trials [18] which is presented as Additional file 1: Figure S1 and Additional file 2: Figure S2—from a previous published article data—[19], NIH tool for observational and cross-sectional studies [20], ROBINS-I tool for non-randomize trials [21], QUADAS-2 tool for diagnostic studies, QUIPS tool for prognostic studies, CARE tool for case reports, and ToxRtool for in vivo and in vitro studies. We recommend that 2–3 reviewers independently assess the quality of the studies and add to the data extraction form before the inclusion into the analysis to reduce the risk of bias. In the NIH tool for observational studies—cohort and cross-sectional—as in this EBOLA case, to evaluate the risk of bias, reviewers should rate each of the 14 items into dichotomous variables: yes, no, or not applicable. An overall score is calculated by adding all the items scores as yes equals one, while no and NA equals zero. A score will be given for every paper to classify them as poor, fair, or good conducted studies, where a score from 0–5 was considered poor, 6–9 as fair, and 10–14 as good.
In the EBOLA case example above, authors can extract the following information: name of authors, country of patients, year of publication, study design (case report, cohort study, or clinical trial or RCT), sample size, the infected point of time after EBOLA infection, follow-up interval after vaccination time, efficacy, safety, adverse effects after vaccinations, and QA sheet (Additional file 6: Data S1).
Data checking
Due to the expected human error and bias, we recommend a data checking step, in which every included article is compared with its counterpart in an extraction sheet by evidence photos, to detect mistakes in data. We advise assigning articles to 2–3 independent reviewers, ideally not the ones who performed the extraction of those articles. When resources are limited, each reviewer is assigned a different article than the one he extracted in the previous stage.
Statistical analysis
Investigators use different methods for combining and summarizing findings of included studies. Before analysis, there is an important step called cleaning of data in the extraction sheet, where the analyst organizes extraction sheet data in a form that can be read by analytical software. The analysis consists of 2 types namely qualitative and quantitative analysis. Qualitative analysis mostly describes data in SR studies, while quantitative analysis consists of two main types: MA and network meta-analysis (NMA). Subgroup, sensitivity, cumulative analyses, and meta-regression are appropriate for testing whether the results are consistent or not and investigating the effect of certain confounders on the outcome and finding the best predictors. Publication bias should be assessed to investigate the presence of missing studies which can affect the summary.
To illustrate basic meta-analysis, we provide an imaginary data for the research question about Ebola vaccine safety (in terms of adverse events, 14 days after injection) and immunogenicity (Ebola virus antibodies rise in geometric mean titer, 6 months after injection). Assuming that from searching and data extraction, we decided to do an analysis to evaluate Ebola vaccine “A” safety and immunogenicity. Other Ebola vaccines were not meta-analyzed because of the limited number of studies (instead, it will be included for narrative review). The imaginary data for vaccine safety meta-analysis can be accessed in Additional file 7: Data S2. To do the meta-analysis, we can use free software, such as RevMan [22] or R package meta [23]. In this example, we will use the R package meta. The tutorial of meta package can be accessed through “General Package for Meta-Analysis” tutorial pdf [23]. The R codes and its guidance for meta-analysis done can be found in Additional file 5: File S3.
For the analysis, we assume that the study is heterogenous in nature; therefore, we choose a random effect model. We did an analysis on the safety of Ebola vaccine A. From the data table, we can see some adverse events occurring after intramuscular injection of vaccine A to the subject of the study. Suppose that we include six studies that fulfill our inclusion criteria. We can do a meta-analysis for each of the adverse events extracted from the studies, for example, arthralgia, from the results of random effect meta-analysis using the R meta package.
From the results shown in Additional file 3: Figure S3, we can see that the odds ratio (OR) of arthralgia is 1.06 (0.79; 1.42), p value = 0.71, which means that there is no association between the intramuscular injection of Ebola vaccine A and arthralgia, as the OR is almost one, and besides, the P value is insignificant as it is > 0.05.
In the meta-analysis, we can also visualize the results in a forest plot. It is shown in Fig. 3 an example of a forest plot from the simulated analysis.

Random effect model forest plot for comparison of vaccine A versus placebo
Full size image
From the forest plot, we can see six studies (A to F) and their respective OR (95% CI). The green box represents the effect size (in this case, OR) of each study. The bigger the box means the study weighted more (i.e., bigger sample size). The blue diamond shape represents the pooled OR of the six studies. We can see the blue diamond cross the vertical line OR = 1, which indicates no significance for the association as the diamond almost equalized in both sides. We can confirm this also from the 95% confidence interval that includes one and the p value > 0.05.
For heterogeneity, we see that I2 = 0%, which means no heterogeneity is detected; the study is relatively homogenous (it is rare in the real study). To evaluate publication bias related to the meta-analysis of adverse events of arthralgia, we can use the metabias function from the R meta package (Additional file 4: Figure S4) and visualization using a funnel plot. The results of publication bias are demonstrated in Fig. 4. We see that the p value associated with this test is 0.74, indicating symmetry of the funnel plot. We can confirm it by looking at the funnel plot.

Publication bias funnel plot for comparison of vaccine A versus placebo
Full size image
Looking at the funnel plot, the number of studies at the left and right side of the funnel plot is the same; therefore, the plot is symmetry, indicating no publication bias detected.
Sensitivity analysis is a procedure used to discover how different values of an independent variable will influence the significance of a particular dependent variable by removing one study from MA. If all included study p values are < 0.05, hence, removing any study will not change the significant association. It is only performed when there is a significant association, so if the p value of MA done is 0.7—more than one—the sensitivity analysis is not needed for this case study example. If there are 2 studies with p value > 0.05, removing any of the two studies will result in a loss of the significance.
Double data checking
For more assurance on the quality of results, the analyzed data should be rechecked from full-text data by evidence photos, to allow an obvious check for the PI of the study.
Manuscript writing, revision, and submission to a journal
Writing based on four scientific sections: introduction, methods, results, and discussion, mostly with a conclusion. Performing a characteristic table for study and patient characteristics is a mandatory step which can be found as a template in Additional file 5: Table S3.
After finishing the manuscript writing, characteristics table, and PRISMA flow diagram, the team should send it to the PI to revise it well and reply to his comments and, finally, choose a suitable journal for the manuscript which fits with considerable impact factor and fitting field. We need to pay attention by reading the author guidelines of journals before submitting the manuscript.
Discussion
The role of evidence-based medicine in biomedical research is rapidly growing. SR/MAs are also increasing in the medical literature. This paper has sought to provide a comprehensive approach to enable reviewers to produce high-quality SR/MAs. We hope that readers could gain general knowledge about how to conduct a SR/MA and have the confidence to perform one, although this kind of study requires complex steps compared to narrative reviews.
Having the basic steps for conduction of MA, there are many advanced steps that are applied for certain specific purposes. One of these steps is meta-regression which is performed to investigate the association of any confounder and the results of the MA. Furthermore, there are other types rather than the standard MA like NMA and MA. In NMA, we investigate the difference between several comparisons when there were not enough data to enable standard meta-analysis. It uses both direct and indirect comparisons to conclude what is the best between the competitors. On the other hand, mega MA or MA of patients tend to summarize the results of independent studies by using its individual subject data. As a more detailed analysis can be done, it is useful in conducting repeated measure analysis and time-to-event analysis. Moreover, it can perform analysis of variance and multiple regression analysis; however, it requires homogenous dataset and it is time-consuming in conduct [24].
Conclusions
Systematic review/meta-analysis steps include development of research question and its validation, forming criteria, search strategy, searching databases, importing all results to a library and exporting to an excel sheet, protocol writing and registration, title and abstract screening, full-text screening, manual searching, extracting data and assessing its quality, data checking, conducting statistical analysis, double data checking, manuscript writing, revising, and submitting to a journal.
Availability of data and materials
Not applicable.
Abbreviations
- NMA:
-
Network meta-analysis
- PI:
-
Principal investigator
- PICO:
-
Population, Intervention, Comparison, Outcome
- PRISMA:
-
Preferred Reporting Items for Systematic Review and Meta-analysis statement
- QA:
-
Quality assessment
- SPIDER:
-
Sample, Phenomenon of Interest, Design, Evaluation, Research type
- SR/MAs:
-
Systematic review and meta-analyses
References
-
Bello A, Wiebe N, Garg A, Tonelli M. Evidence-based decision-making 2: systematic reviews and meta-analysis. Methods Mol Biol (Clifton, NJ). 2015;1281:397–416.
Article
Google Scholar
-
Khan KS, Kunz R, Kleijnen J, Antes G. Five steps to conducting a systematic review. J R Soc Med. 2003;96(3):118–21.
Article
Google Scholar
-
Rys P, Wladysiuk M, Skrzekowska-Baran I, Malecki MT. Review articles, systematic reviews and meta-analyses: which can be trusted? Polskie Archiwum Medycyny Wewnetrznej. 2009;119(3):148–56.
PubMed
Google Scholar
-
Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. 2011.
-
Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009;339:b2535.
Article
Google Scholar
-
Methley AM, Campbell S, Chew-Graham C, McNally R, Cheraghi-Sohi S. PICO, PICOS and SPIDER: a comparison study of specificity and sensitivity in three search tools for qualitative systematic reviews. BMC Health Serv Res. 2014;14:579.
Article
Google Scholar
-
Gross L, Lhomme E, Pasin C, Richert L, Thiebaut R. Ebola vaccine development: systematic review of pre-clinical and clinical studies, and meta-analysis of determinants of antibody response variability after vaccination. Int J Infect Dis. 2018;74:83–96.
Article
CASGoogle Scholar
-
Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, … Henry DA. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017;358:j4008.
-
Giang HTN, Banno K, Minh LHN, Trinh LT, Loc LT, Eltobgy A, et al. Dengue hemophagocytic syndrome: a systematic review and meta-analysis on epidemiology, clinical signs, outcomes, and risk factors. Rev Med Virol. 2018;28(6):e2005.
Article
Google Scholar
-
Morra ME, Altibi AMA, Iqtadar S, Minh LHN, Elawady SS, Hallab A, et al. Definitions for warning signs and signs of severe dengue according to the WHO 2009 classification: systematic review of literature. Rev Med Virol. 2018;28(4):e1979.
Article
Google Scholar
-
Morra ME, Van Thanh L, Kamel MG, Ghazy AA, Altibi AMA, Dat LM, et al. Clinical outcomes of current medical approaches for Middle East respiratory syndrome: a systematic review and meta-analysis. Rev Med Virol. 2018;28(3):e1977.
Article
Google Scholar
-
Vassar M, Atakpo P, Kash MJ. Manual search approaches used by systematic reviewers in dermatology. Journal of the Medical Library Association: JMLA. 2016;104(4):302.
Article
Google Scholar
-
Naunheim MR, Remenschneider AK, Scangas GA, Bunting GW, Deschler DG. The effect of initial tracheoesophageal voice prosthesis size on postoperative complications and voice outcomes. Ann Otol Rhinol Laryngol. 2016;125(6):478–84.
Article
Google Scholar
-
Rohatgi AJaiWa. Web Plot Digitizer. ht tp. 2014;2.
-
Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005;5(1):13.
Article
Google Scholar
-
Wan X, Wang W, Liu J, Tong T. Estimating the sample mean and standard deviation from the sample size, median, range and/or interquartile range. BMC Med Res Methodol. 2014;14(1):135.
Article
Google Scholar
-
Van Rijkom HM, Truin GJ, Van’t Hof MA. A meta-analysis of clinical studies on the caries-inhibiting effect of fluoride gel treatment. Carries Res. 1998;32(2):83–92.
-
Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
Article
Google Scholar
-
Tawfik GM, Tieu TM, Ghozy S, Makram OM, Samuel P, Abdelaal A, et al. Speech efficacy, safety and factors affecting lifetime of voice prostheses in patients with laryngeal cancer: a systematic review and network meta-analysis of randomized controlled trials. J Clin Oncol. 2018;36(15_suppl):e18031-e.
Article
Google Scholar
-
Wannemuehler TJ, Lobo BC, Johnson JD, Deig CR, Ting JY, Gregory RL. Vibratory stimulus reduces in vitro biofilm formation on tracheoesophageal voice prostheses. Laryngoscope. 2016;126(12):2752–7.
Article
CASGoogle Scholar
-
Sterne JAC, Hernán MA, Reeves BC, Savović J, Berkman ND, Viswanathan M, et al. ROBINS-I: a tool for assessing risk of bias in non-randomised studies of interventions. BMJ. 2016;355.
-
RevMan The Cochrane Collaboration %J Copenhagen TNCCTCC. Review Manager (RevMan). 5.0. 2008.
-
Schwarzer GJRn. meta: An R package for meta-analysis. 2007;7(3):40-45.
Google Scholar
-
Simms LLH. Meta-analysis versus mega-analysis: is there a difference? Oral budesonide for the maintenance of remission in Crohn’s disease: Faculty of Graduate Studies, University of Western Ontario; 1998.
Download references
Funding
This study was conducted (in part) at the Joint Usage/Research Center on Tropical Disease, Institute of Tropical Medicine, Nagasaki University, Japan.
Author information
Authors and Affiliations
-
Faculty of Medicine, Ain Shams University, Cairo, Egypt
Gehad Mohamed Tawfik
-
Online research Club http://www.onlineresearchclub.org/
Gehad Mohamed Tawfik, Kadek Agus Surya Dila, Muawia Yousif Fadlelmola Mohamed, Dao Ngoc Hien Tam, Nguyen Dang Kien & Ali Mahmoud Ahmed
-
Pratama Giri Emas Hospital, Singaraja-Amlapura street, Giri Emas village, Sawan subdistrict, Singaraja City, Buleleng, Bali, 81171, Indonesia
Kadek Agus Surya Dila
-
Faculty of Medicine, University of Khartoum, Khartoum, Sudan
Muawia Yousif Fadlelmola Mohamed
-
Nanogen Pharmaceutical Biotechnology Joint Stock Company, Ho Chi Minh City, Vietnam
Dao Ngoc Hien Tam
-
Department of Obstetrics and Gynecology, Thai Binh University of Medicine and Pharmacy, Thai Binh, Vietnam
Nguyen Dang Kien
-
Faculty of Medicine, Al-Azhar University, Cairo, Egypt
Ali Mahmoud Ahmed
-
Evidence Based Medicine Research Group & Faculty of Applied Sciences, Ton Duc Thang University, Ho Chi Minh City, 70000, Vietnam
Nguyen Tien Huy
-
Faculty of Applied Sciences, Ton Duc Thang University, Ho Chi Minh City, 70000, Vietnam
Nguyen Tien Huy
-
Department of Clinical Product Development, Institute of Tropical Medicine (NEKKEN), Leading Graduate School Program, and Graduate School of Biomedical Sciences, Nagasaki University, 1-12-4 Sakamoto, Nagasaki, 852-8523, Japan
Nguyen Tien Huy
Authors
- Gehad Mohamed Tawfik
You can also search for this author in
PubMed Google Scholar - Kadek Agus Surya Dila
You can also search for this author in
PubMed Google Scholar - Muawia Yousif Fadlelmola Mohamed
You can also search for this author in
PubMed Google Scholar - Dao Ngoc Hien Tam
You can also search for this author in
PubMed Google Scholar - Nguyen Dang Kien
You can also search for this author in
PubMed Google Scholar - Ali Mahmoud Ahmed
You can also search for this author in
PubMed Google Scholar - Nguyen Tien Huy
You can also search for this author in
PubMed Google Scholar
Contributions
NTH and GMT were responsible for the idea and its design. The figure was done by GMT. All authors contributed to the manuscript writing and approval of the final version.
Corresponding author
Correspondence to
Nguyen Tien Huy.
Ethics declarations
Ethics approval and consent to participate
Not applicable.
Consent for publication
Not applicable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Additional files
Additional file 1:
Figure S1. Risk of bias assessment graph of included randomized controlled trials. (TIF 20 kb)
Additional file 2:
Figure S2. Risk of bias assessment summary. (TIF 69 kb)
Additional file 3:
Figure S3. Arthralgia results of random effect meta-analysis using R meta package. (TIF 20 kb)
Additional file 4:
Figure S4. Arthralgia linear regression test of funnel plot asymmetry using R meta package. (TIF 13 kb)
Additional file 5:
Table S1. PRISMA 2009 Checklist. Table S2. Manipulation guides for online database searches. Table S3. Detailed search strategy for twelve database searches. Table S4. Baseline characteristics of the patients in the included studies. File S1. PROSPERO protocol template file. File S2. Extraction equations that can be used prior to analysis to get missed variables. File S3. R codes and its guidance for meta-analysis done for comparison between EBOLA vaccine A and placebo. (DOCX 49 kb)
Additional file 6:
Data S1. Extraction and quality assessment data sheets for EBOLA case example. (XLSX 1368 kb)
Additional file 7:
Data S2. Imaginary data for EBOLA case example. (XLSX 10 kb)
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Tawfik, G.M., Dila, K.A.S., Mohamed, M.Y.F. et al. A step by step guide for conducting a systematic review and meta-analysis with simulation data.
Trop Med Health 47, 46 (2019). https://doi.org/10.1186/s41182-019-0165-6
Download citation
-
Received: 30 January 2019
-
Accepted: 24 May 2019
-
Published: 01 August 2019
-
DOI: https://doi.org/10.1186/s41182-019-0165-6
Keywords
- Search
- Data
- Extraction
- Analysis
- Study
- Results
- «Мета» определена
- Этап 1: Анализ
- Этап 2: метаанализ
- Этап 3,4 и так далее: углубляясь
Метаанализ — это один из типичных способов написания, который потребуется студентам колледжа. Это также один из предпочтительных методов письма, который будет использоваться преподавателями, поскольку он требует, чтобы студенты выполняли очень специфические риторические или писательские действия. Метаанализ происходит в два отдельных этапа: предварительный анализ и затем метаанализ.
«Мета» определена
Чтобы понять, как выполнить метаанализ, сначала нужно понять термин «мета». Мета — это греческий префикс, который означает «после» или «за». Поэтому, когда писатель выполняет метаанализ, он идет после или вне анализа, который был ранее. Это означает, что писатель должен проанализировать свой ранее написанный анализ предмета. Короче говоря, они должны написать анализ о своем анализе.
Этап 1: Анализ
Первым этапом метаанализа является предварительный анализ. О чем бы ни был написан предмет: о книге, фильме или газетной статье (все обычные предметы для написания в колледже), писатель должен подойти к анализу этого предмета со знанием, которое он / она уже обрабатывает. Никаких исследований или экспертизы не требуется; только тщательный и вдумчивый ответ на материал под рукой.
Этап 2: метаанализ
Второй этап метаанализа — это этап, на котором писатель идет «после» того, что уже написано, и производит знания «за пределами» того, что они знали раньше. На этом этапе, прежде чем писать, исследование и более глубокое изучение рассматриваемой темы помогает углубить понимание не только предмета, но и знаний писателей или их отсутствия по этому предмету. Именно на этом этапе авторы вынуждены лучше объяснять себя, понимать себя острее и бросать вызов своим собственным предположениям или отказываться от выводов, особенно если автор анализирует свои собственные убеждения или мнения.
Этап 3,4 и так далее: углубляясь
После первого и второго этапов метаанализ фактически завершен. Однако, если писатель или инструктор в этом отношении хочет глубже вникнуть в понимание как материала, так и способности писателя анализировать материал, тогда Стадия 2 может быть повторена для Стадии 3, 4 и так далее. Это просто делается путем анализа предшествующего анализа: определения или переопределения терминов, оспаривания или исправления допущений, а также исследования и раскрытия новой информации.
FAQ — 💬
❓ Как пишется мета анализ?
👉 Мета—ана́лиз (англ. meta-analysis) — понятие научной методологии. Означает объединение результатов нескольких исследований методами статистики (то есть количественными методами оценки) для проверки одной или нескольких взаимосвязанных научных гипотез.
❓ Как писать систематический обзор?
👉 Systematic review) — научное исследование, представляющее из себя обзор ряда опубликованных законченных работ, выполненных исследователями, учёными или практикующими специалистами, с целью критического анализа, оценки и обобщения данных в рамках чётко сформулированного вопроса с использованием заранее определённого …
❓ Чем метаанализ отличается от систематического обзора?
👉 В сухом итоге: — Систематические обзоры и мета-анализы обобщают данные нескольких исследований по определенной тематике, и могут помочь сформулировать обобщенный вывод. — Мета-анализ — это подвид систематического обзора, при котором проводится специальная статистическая обработка данных нескольких исследований.
❓ Что собой представляет мета анализ в практике доказательной медицины?
👉 Мета—анализ – это количественный анализ объединенных результатов эколого-эпидемиологических исследований по оценке воздействия одного и того же фактора окружающей среды. Он предусматривает количественную оценку степени согласованности или расхождения результатов, полученных в разных исследованиях.
❓ Как пишется слово мета?
👉 Мета— (с греч. μετά- «между, после, через») — часть сложных слов, обозначающая абстрагированность, обобщённость, промежуточность, следование за чем-либо, переход к чему-либо другому, перемену состояния, превращение (например, метагалактика, метацентр).
❓ Как правильно метаанализ или мета анализ?
👉 Как правильно: мета—анализ или метаанализ? Верно слитное написание.
❓ Как написать хорошую обзорную статью?
👉 Как написать обзор на научную статью?
- Правило № 1: Четко определите тему обзора и его аудиторию
- Правило № 2: Поиск литературы
- Правило № 3: Пометки на полях
- Правило № 4: Определите тип обзора
- Правило № 5: Рассматривайте проблему под разными углами
- Правило № 6: Будьте критичны и последовательны
❓ В чем суть доказательной медицины?
👉 Современный подход к принятию решений в медицине называется доказательной медициной, или медициной, основанной на доказательствах (в англоязычной литературе — Evidence Based Medicine). В его основе лежит ключевой принцип — врач должен лечить пациентов опираясь на научные факты.
❓ Что такое литературный обзор в проекте?
👉 Литературный обзор — часть исследования, в которой автор знакомит читателей с контекстом своего исследования и/или его теоретической основой. Важно, чтобы в литературном обзоре была рассмотрена соответствующая теме исследования литература и обоснован выбор именно этой литературы.
❓ Для чего используют принцип Pico?
👉 Постановка проблемы с помощью вопросов PICO. PICO (patient or population — пациент или популяция, intervention — вмешательство, comparison — сравнение, outcomes — исходы) — метод формулировки проблемы, который ставит вопросы относительно к конкретной клинической практике.
❓ Как называется Пятый шаг доказательной медицины?
👉 Уровень 5: экспертное заключение, основанное не на критической оценке, а на доводах физиологии, доклинических исследований или основополагающих принципов.
Фон
За последние несколько десятилетий огромное количество исследований, касающихся тропической медицины и здоровья, значительно возросло. В области тропической медицины и здравоохранения хорошо организованный систематический обзор и метаанализ (SR / MA) считается возможным решением для того, чтобы держать клиницистов в курсе современной доказательной медицины. Понимание шагов SR / MA имеет первостепенное значение для его выполнения. Это нелегко сделать, поскольку существуют препятствия, с которыми может столкнуться исследователь. Чтобы устранить эти препятствия, это методологическое исследование было направлено на предоставление пошагового подхода, в основном для начинающих и начинающих исследователей, в области тропической медицины и других областях здравоохранения, о том, как правильно проводить SR / MA, в которой все Приведенные здесь шаги отражают наш опыт и знания в сочетании с уже хорошо известными и принятыми международными рекомендациями.
Мы предлагаем, чтобы все этапы SR / MA были выполнены независимо путем обсуждения 2-3 рецензентов, чтобы обеспечить качество и точность данных.
Вывод
Этапы SR / MA включают разработку вопроса исследования, формирование критериев, стратегии поиска, поиск в базах данных, регистрация протокола, заголовок, аннотация, полнотекстовый скрининг, ручной поиск, извлечение данных, оценка качества, проверка данных, статистический анализ, двойная проверка данных. и написание рукописи.
Вступление
Количество исследований, опубликованных в биомедицинской литературе, особенно в области тропической медицины и здравоохранения, резко возросло за последние несколько десятилетий. Такое огромное количество литературы делает клиническую медицину все более сложной, и знания различных исследований часто необходимы для принятия конкретного клинического решения. Однако имеющиеся исследования часто неоднородны в отношении их дизайна, качества работы и изучаемых предметов и могут по-разному решать вопрос исследования, что усложняет синтез фактических данных и выводов (1).
Систематический обзор и метаанализ (SR / MA) имеют высокий уровень доказательности, представленной пирамидой, основанной на фактических данных. Таким образом, хорошо проведенная СР / МА считается возможным решением проблемы, когда медицинские работники опережают современные доказательные методы медицины.
В отличие от систематического обзора, бессистемный нарративный обзор, как правило, носит описательный характер, в котором авторы часто выбирают статьи на основе своей точки зрения, что приводит к ее низкому качеству. Систематический обзор, с другой стороны, определяется как обзор с использованием систематического метода для обобщения фактических данных по вопросам с подробным и всесторонним планом исследования. Кроме того, несмотря на растущие руководящие принципы для эффективного проведения систематического обзора, мы обнаружили, что основные шаги часто начинаются с формулировки вопроса, а затем с определения соответствующей работы, которая состоит из разработки критериев и поиска статей, оценки качества включенных исследований, обобщения доказательств и интерпретировать результаты (2, 3). Тем не менее, эти простые шаги не так легко достичь в реальности. Исследователь может столкнуться со многими проблемами, которые не имеют подробных указаний.
Проведение SR / MA в тропической медицине и здоровье может быть трудным, особенно для молодых исследователей; поэтому понимание его основных шагов имеет решающее значение. Это нелегко сделать, поскольку существуют препятствия, с которыми может столкнуться исследователь. Чтобы устранить эти препятствия, мы рекомендуем блок-схему (рис. 1), которая иллюстрирует подробные и пошаговые этапы исследований SR / MA. Это методологическое исследование было нацелено на предоставление пошагового подхода, в основном для начинающих и начинающих исследователей, в области тропической медицины и других областях здравоохранения, о том, как правильно и кратко проводить SR / MA; все шаги здесь отражают наш опыт и знания в сочетании с уже хорошо известными и принятыми международными рекомендациями.
Подробное руководство для систематической проверки и мета-анализа шагов. Примечание. Значок звездочки означает «2–3 экрана обозревателей независимо».
Изображение в полном размере
Методы и результаты
Подробные шаги для проведения любого систематического обзора и мета-анализа
Мы искали методы, о которых сообщалось в опубликованных SR / MA в тропической медицине и других областях здравоохранения, помимо опубликованных руководств, таких как Кокрановские рекомендации {Higgins, 2011 # 7} (4), чтобы собрать лучший метод с низким смещением для каждого этапа проведения SR / MA. шаги. Кроме того, мы использовали рекомендации, которые мы применяем в исследованиях для всех этапов SR / MA. Мы объединили эти методы, чтобы заключить и провести детальную диаграмму потока, которая показывает шаги SR / MA, как они выполняются.
Любая SR / MA должна следовать общепринятым предпочтительным элементам отчетности для систематического обзора и заявления о мета-анализе (контрольный список PRISMA 2009) (Дополнительный файл 5: Таблица S1) (5).
Мы предложили наши методы в соответствии с действительным пояснительным примером моделирования, выбрав тему «Оценка безопасности вакцины против Эболы», так как известно, что Эбола является очень редким тропическим заболеванием, но смертельным. Все объясненные методы основаны на стандартах, применяемых на международном уровне, с нашим накопленным опытом проведения СР, что, по нашему мнению, подтвердило определенную ценность. Эта СР проводится под руководством пары исследователей, объединенных в исследовательскую группу, более того, поскольку вспышка Эболы, которая произошла (2013–2016 гг.) В Африке, привела к значительной смертности и заболеваемости. Кроме того, поскольку существует множество опубликованных и продолжающихся исследований, посвященных оценке безопасности вакцин против Эболы, мы подумали, что это даст прекрасную возможность для решения этой горячо обсуждаемой проблемы. Кроме того, Эбола снова начала стрелять, и с августа 2018 года в Демократической Республике Конго появилась новая смертельная вспышка, которая, по данным Всемирной организации здравоохранения, привела к заражению более 1000 человек, и до сих пор погибло 629 человек. Следовательно, она считается второй по величине вспышкой Эболы после первой в Западной Африке в 2014 году, которая заразила более 26 000 человек и убила около 11 300 человек в ходе вспышки.
Вопрос исследования и цели
Как и другие планы исследований, вопрос исследования SR / MA должен быть выполнимым, интересным, новым, этичным и актуальным. Следовательно, должен быть сформулирован четкий, логичный и четко определенный исследовательский вопрос. Обычно используются два общих инструмента: PICO или SPIDER. PICO (население, вмешательство, сравнение, результат) используется главным образом для синтеза количественных данных. Авторы продемонстрировали, что PICO обладает большей чувствительностью, чем более специфический подход SPIDER (6). SPIDER (образец, интересующее явление, дизайн, оценка, тип исследования) был предложен в качестве метода поиска качественных и смешанных методов.
Здесь мы рекомендуем комбинированный подход с использованием одного или обоих инструментов SPIDER и PICO для получения комплексного поиска в зависимости от ограничений по времени и ресурсам. Когда мы применяем это к нашей предполагаемой теме исследования, имеющей качественный характер, использование подхода SPIDER является более обоснованным.
PICO обычно используется для систематического обзора и мета-анализа клинических испытаний. Для наблюдательного исследования (без вмешательства или сравнения) во многих тропических и эпидемиологических вопросах обычно достаточно использовать P (пациент) и O (результат) только для формулирования исследовательского вопроса. Мы должны четко указать население (P), затем вмешательство (I) или воздействие. Далее необходимо сравнить (C) указанное вмешательство с другими вмешательствами, т.е. плацебо. Наконец, нам необходимо уточнить, каковы наши соответствующие результаты.
Чтобы облегчить понимание, мы выбираем болезнь Эбола (EVD) в качестве примера. В настоящее время вакцина против EVD находится в стадии разработки и проходит клинические испытания I, II и III фазы; мы хотим знать, безопасна ли эта вакцина и может ли она вызвать достаточную иммуногенность для субъектов.
Примером вопроса исследования для SR / MA на основе PICO для этой проблемы является следующий: Какова безопасность и иммуногенность вакцины против Эболы у человека? (P: здоровые субъекты (человек), I: вакцинация, C: плацебо, O: безопасность или побочные эффекты)
Предварительное исследование и проверка идеи
Мы рекомендуем провести предварительный поиск, чтобы выявить соответствующие статьи, обеспечить обоснованность предложенной идеи, избежать дублирования ранее рассмотренных вопросов и убедиться, что у нас достаточно статей для проведения ее анализа. Кроме того, темы должны быть сосредоточены на актуальных и важных проблемах здравоохранения, учитывать глобальные потребности и ценности, отражать современную науку и соответствовать принятым методам обзора. Знакомство с глубоким пониманием области исследования с помощью соответствующих видео и обсуждений имеет первостепенное значение для лучшего поиска результатов. Если мы проигнорируем этот шаг, наше исследование может быть отменено, если мы обнаружим подобное исследование, опубликованное ранее. Это означает, что мы тратим время на решение проблемы, которая решалась в течение длительного времени.
Чтобы сделать это, мы можем начать с простого поиска в PubMed или Google Scholar с поисковыми терминами Эбола И вакцина. Делая этот шаг, мы определяем систематический обзор и мета-анализ детерминантных факторов, влияющих на реакцию антител от вакцинации против вакцины против лихорадки Эбола у человека, не являющейся человеком, приматом и человеком (7), которая является соответствующей статьей, которую можно прочитать, чтобы получить более глубокое понимание и определить пробелы для лучшей постановки нашего исследовательского вопроса или цели. Мы все еще можем проводить систематический обзор и метаанализ вакцины против Эболы, потому что мы оцениваем безопасность как другой исход и разные группы населения (только человек).
Критерии включения и исключения
Критерии соответствия основаны на подходе PICO, дизайне исследования и дате. Критериями исключения в основном являются несвязанные, дублированные, недоступные полные тексты или реферативные статьи. Эти исключения должны быть указаны заранее, чтобы не допустить предвзятости исследователя. Критериями включения могут быть статьи с целевыми пациентами, исследуемые вмешательства или сравнение двух изученных вмешательств. Вкратце, это будут статьи, содержащие информацию, отвечающую на наш вопрос исследования. Но самое главное, что для ответа на вопрос должна быть четкая и достаточная информация, в том числе положительная или отрицательная.
Для выбранной темы мы можем установить критерии включения: (1) любое клиническое исследование, оценивающее безопасность вакцины против Эболы, и (2) отсутствие ограничений в отношении страны, возраста пациента, расы, пола, языка публикации и даты. Критерии исключения следующие: (1) исследование вакцины против лихорадки Эбола на людях, не являющихся людьми, или исследования in vitro; (2) исследование с данными, которые не были надежно извлечены, дублированы или перекрываются; (3) реферативные статьи, такие как предыдущие статьи, тезисы и книги на конференции, редакционные статьи и ответы авторов; (4) статьи без полного текста доступны; и (5) сообщения о случаях, серии случаев и систематические обзоры. Шаблон блок-схемы PRISMA, который используется в исследованиях SR / MA, можно найти на рис. 2.
Принципиальная схема отбора и отбора исследований PRISMA
Изображение в полном размере
Стратегия поиска
В PubMed используется стандартная стратегия поиска, которая затем модифицируется в соответствии с каждой конкретной базой данных для получения наилучших релевантных результатов. Основная стратегия поиска строится на основе формулировки исследовательского вопроса (например, PICO или PICOS). Стратегии поиска составлены таким образом, чтобы включать в себя термины в свободном тексте (например, в названии и аннотации) и любые соответствующие предметные указатели (например, MeSH), которые должны найти подходящие исследования, с помощью эксперта в области тематики обзора или специалиста по информации., Кроме того, мы советуем не использовать термины для результатов, так как их включение может помешать поиску в базе данных для поиска подходящих исследований, поскольку используемый результат явно не упоминается в статьях.
Улучшение поискового термина производится во время пробного поиска и поиска другого релевантного термина в каждом понятии из найденных статей. Для поиска клинического испытания мы можем использовать следующие дескрипторы в PubMed: «клиническое испытание» (тип публикации) ИЛИ «клинические испытания как тема» (термины MeSH) ИЛИ «клиническое испытание» (Все поля). После нескольких раундов испытаний и уточнения поискового термина мы формулируем окончательный поисковый термин для PubMed следующим образом: (Эбола ИЛИ вирус Эбола ИЛИ болезнь Эбола ИЛИ ИБС) И (вакцина ИЛИ вакцинация ИЛИ вакцинация ИЛИ иммунизация) И («клиническое испытание») (Тип публикации) ИЛИ «Клинические испытания как тема» (Термины MeSH) ИЛИ «Клиническое испытание» (Все поля)). Поскольку исследование по этой теме ограничено, мы не включаем термин результата (безопасность и иммуногенность) в поисковый термин, чтобы охватить больше исследований.
Поиск в базах данных, импорт всех результатов в библиотеку и экспорт в таблицу Excel
В соответствии с рекомендациями AMSTAR, в SR / MA нужно искать как минимум две базы данных, но по мере увеличения числа поисковых баз вы получаете большую доходность и более точные и полные результаты. Порядок баз данных зависит в основном от вопросов обзора; участвуя в исследовании клинических испытаний, вы будете в основном полагаться на Cochrane, mRCT или Международную платформу регистрации клинических испытаний (ICTRP). Здесь мы предлагаем 12 баз данных (PubMed, Scopus, Web of Science, EMBASE, GHL, VHL, Cochrane, Google Scholar, Clinical trials.gov, mRCTs, POPLINE и SIGLE), которые помогают охватить почти все опубликованные статьи по тропической медицине. и другие области, связанные со здоровьем. Среди этих баз данных POPLINE фокусируется на репродуктивном здоровье. Исследователи должны рассмотреть возможность выбора соответствующей базы данных в соответствии с темой исследования. Некоторые базы данных не поддерживают использование логических или цитат; в противном случае есть некоторые базы данных, которые имеют особый способ поиска. Поэтому нам нужно изменить начальные условия поиска для каждой базы данных, чтобы получить ценные результаты; поэтому руководства по манипулированию для каждого поиска в базе данных онлайн представлены в дополнительном файле 5: Таблица S2. Подробная стратегия поиска для каждой базы данных приведена в дополнительном файле 5: Таблица S3. Поисковый термин, который мы создали в PubMed, нуждается в настройке на основе конкретной характеристики базы данных. Пример расширенного поиска по нашей теме в Google Scholar:
-
1.
Со всеми словами: вирус Эбола
Как минимум одним из слов: вакцинация, вакцинация, вакцинация, иммунизация
Где мои слова встречаются: в заголовке статьи
-
2.
Со всеми словами: EVD
Как минимум одним из слов: вакцинация, вакцинация, вакцинация, иммунизация
Где мои слова встречаются: в заголовке статьи
Наконец, все записи собираются в одну библиотеку Endnote для удаления дубликатов, а затем экспортируются в лист Excel. Использование функции удаления дубликатов с двумя вариантами обязательно. Все ссылки, которые имеют (1) одинаковый заголовок и автора и опубликованы в одном и том же году, и (2) одинаковые заголовок и автора и опубликованы в одном журнале, будут удалены. Ссылки, оставшиеся после этого шага, должны быть экспортированы в файл Excel с необходимой информацией для проверки. Это могут быть имена авторов, год публикации, журнал, DOI, URL-ссылка и реферат.
Написание протокола и регистрация
Регистрация протокола на ранней стадии гарантирует прозрачность в процессе исследования и защищает от проблем дублирования. Кроме того, это считается документально подтвержденным планом действий команды, вопросом исследования, критериями приемлемости, вмешательством / воздействием, оценкой качества и планом предварительного анализа. Рекомендуется, чтобы исследователи отправляли его главному исследователю (ПИ) для его проверки, а затем загружали на сайты реестра. Для SR / MA доступно много сайтов реестра, подобных тем, которые были предложены сотрудниками Cochrane и Campbell; однако мы рекомендуем зарегистрировать протокол в PROSPERO, поскольку это проще. Макет шаблона протокола, согласно PROSPERO, можно найти в Дополнительном файле 5: Файл S1.
Заголовок и реферат
Решения о выборе найденных статей для дальнейшей оценки основаны на критериях приемлемости, чтобы минимизировать вероятность включения не относящихся к делу статей. Согласно Кокрановскому руководству, два рецензента должны сделать этот шаг, но что касается начинающих и младших исследователей, это может быть утомительным; таким образом, мы предлагаем, основываясь на нашем опыте, по крайней мере, три рецензента должны работать независимо друг от друга, чтобы уменьшить вероятность ошибки, особенно в командах с большим количеством авторов, чтобы добавить больше внимания и обеспечить надлежащее поведение. В основном качество с тремя рецензентами было бы лучше, чем у двух, поскольку только двое будут иметь разные мнения друг от друга, поэтому они не могут принять решение, в то время как третье мнение имеет решающее значение. И вот некоторые примеры систематических обзоров, которые мы провели по одной и той же стратегии (другой группой исследователей в нашей исследовательской группе) и успешно опубликовали, и в них представлены соответствующие идеи для тропической медицины и болезней (9, 10, 11).
На этом этапе дубликаты будут удаляться вручную, когда рецензенты их обнаружат. Когда есть сомнения в отношении решения по статье, команда должна быть включающей, а не исключительной, пока главный лидер или ИП не примет решение после обсуждения и консенсуса. Все исключенные записи должны иметь причины исключения.
Загрузка и просмотр полного текста
Многие поисковые системы предоставляют ссылки для бесплатного доступа к полнотекстовым статьям. В случае, если он не найден, мы можем выполнить поиск на некоторых исследовательских веб-сайтах как ResearchGate, которые предлагают возможность прямого полнотекстового запроса от авторов. Кроме того, изучите архивы разыскиваемых журналов или свяжитесь с PI, чтобы приобрести его, если таковой имеется. Аналогичным образом, 2-3 рецензента работают независимо, чтобы принять решение о включении полных текстов в соответствии с критериями приемлемости, с указанием причин исключения статей. В случае возникновения каких-либо разногласий, окончательное решение должно быть принято путем обсуждения.
Ручной поиск
Нужно исчерпать все возможности уменьшить смещение, выполнив явный ручной поиск для поиска отчетов, которые могли быть исключены из первого поиска (12). Для ручного поиска мы применяем пять методов: поиск ссылок из включенных исследований / обзоров, контакт с авторами и экспертами, а также просмотр связанных статей / цитируемых статей в PubMed и Google Scholar.
Мы опишем здесь три последовательных метода для увеличения и уточнения результатов ручного поиска: во-первых, поиск по спискам ссылок включенных статей; во-вторых, выполнение так называемого отслеживания цитирования, при котором рецензенты отслеживают все статьи, которые ссылаются на каждую из включенных статей, и это может включать электронный поиск в базах данных; и в-третьих, аналогично отслеживанию ссылок, мы следуем всем статьям, связанным с «похожими» или «похожими». Каждый из вышеупомянутых методов может быть выполнен 2-3 независимыми рецензентами, и все возможные соответствующие статьи должны подвергаться дальнейшей проверке на предмет соответствия критериям включения после того, как будут следовать те же записи, полученные из электронных баз данных, то есть заголовок / аннотация и полнотекстовый скрининг, Мы предлагаем независимый анализ, назначив каждому члену команды «метку» и отдельный метод, чтобы в конце собрать все результаты для сравнения различий и обсуждения, а также максимизировать поиск и свести к минимуму систематическую ошибку. Аналогично, количество включенных статей должно быть указано до добавления к общим включенным записям.
Извлечение данных и оценка качества
Этот шаг дает право на сбор данных из включенных полных текстов в лист Excel для структурированного извлечения, который предварительно испытан для извлечения с использованием некоторых случайных исследований. Мы рекомендуем извлекать как скорректированные, так и не скорректированные данные, поскольку они дают наиболее допустимый смешивающий фактор для использования при анализе, объединяя их позже (13). Процесс извлечения должен выполняться 2–3 независимыми рецензентами. В основном, лист классифицируется на инструмент исследования и характеристики пациента, результаты и оценку качества (QA).
Данные, представленные в виде графиков, следует извлекать с помощью программных инструментов, таких как дигитайзер веб-сюжета (14). Большая часть уравнений, которые могут быть использованы при извлечении до анализа и оценки стандартного отклонения (SD) от других переменных, находится внутри Дополнительного файла 5: Файл S2 со ссылками на него, как Hozo et al. (15), Xiang et al. (16) и Rijkom et al. (17). Для обеспечения качества доступны различные инструменты, в зависимости от конструкции: Кокрановский инструмент ROB-2 для рандомизированных контролируемых испытаний (18), который представлен в виде Дополнительного файла 1: Рисунок S1 и Дополнительный файл 2: Рисунок S2 — из предыдущей опубликованной статьи data- (19), инструмент NIH для наблюдательных и поперечных исследований (20), инструмент ROBINS-I для нерандомизированных исследований (21), инструмент QUADAS-2 для диагностических исследований, инструмент QUIPS для прогностических исследований, инструмент CARE для случая отчеты и ToxRtool для исследований in vivo и in vitro. Мы рекомендуем, чтобы 2-3 рецензента независимо оценивали качество исследований и добавляли в форму извлечения данных перед включением в анализ, чтобы уменьшить риск систематической ошибки. В инструменте NIH для наблюдательных исследований — когортных и поперечных — как в этом случае EBOLA, для оценки риска систематической ошибки рецензенты должны оценивать каждый из 14 пунктов в дихотомические переменные: да, нет или не применимо. Общий балл рассчитывается путем сложения всех баллов по пунктам, поскольку да равно единице, а нет и NA равно нулю. Баллы будут выставляться за каждую статью, чтобы классифицировать их как плохие, удовлетворительные или хорошо проведенные исследования, где оценка от 0 до 5 считалась плохой, 6–9 — как удовлетворительная, а 10–14 — как хорошая.
В приведенном выше примере случая EBOLA авторы могут извлечь следующую информацию: имя авторов, страна пациентов, год публикации, дизайн исследования (отчет случая, когортное исследование или клиническое исследование или РКИ), размер выборки, момент заражения после инфицирования EBOLA, интервал наблюдения после вакцинации, эффективность, безопасность, побочные эффекты после вакцинации и таблица качества (Дополнительный файл 6: Данные S1).
Проверка данных
В связи с ожидаемой человеческой ошибкой и предвзятостью мы рекомендуем этап проверки данных, на котором каждая включенная статья сравнивается со своим аналогом в листе для извлечения по фотографиям с доказательствами, чтобы обнаружить ошибки в данных. Мы рекомендуем назначать статьи 2–3 независимым рецензентам, в идеале не тем, кто выполнял извлечение этих статей. Когда ресурсы ограничены, каждому рецензенту назначается статья, отличная от той, которую он извлек на предыдущем этапе.
статистический анализ
Исследователи используют различные методы для объединения и обобщения результатов включенных исследований. Перед анализом существует важный шаг, который называется очистка данных в листе извлечения, когда аналитик организует данные листа извлечения в форме, которая может быть считана аналитическим программным обеспечением. Анализ состоит из 2 типов, а именно качественный и количественный анализ. Качественный анализ в основном описывает данные в исследованиях SR, а количественный анализ состоит из двух основных типов: MA и сетевой метаанализ (NMA). Подгруппа, чувствительность, кумулятивный анализ и мета-регрессия подходят для проверки того, являются ли результаты последовательными или нет, и для изучения влияния определенных факторов, влияющих на результат, и для поиска лучших предикторов. Предвзятость публикации должна быть оценена, чтобы исследовать наличие пропущенных исследований, которые могут повлиять на резюме.
Чтобы проиллюстрировать базовый метаанализ, мы приводим мнимые данные для исследовательского вопроса о безопасности вакцины против лихорадки Эбола (с точки зрения нежелательных явлений, через 14 дней после инъекции) и иммуногенности (повышение антител к вирусу Эбола в среднем геометрическом титре, через 6 месяцев после инъекции). Исходя из результатов поиска и извлечения данных, мы решили провести анализ для оценки безопасности и иммуногенности вакцины против вируса Эбола «А». Другие вакцины против лихорадки Эбола не были подвергнуты мета-анализу из-за ограниченного числа исследований (вместо этого они будут включены для повествовательного обзора). Мнимые данные для мета-анализа безопасности вакцин можно найти в Дополнительном файле 7: Данные S2. Для проведения мета-анализа мы можем использовать бесплатное программное обеспечение, такое как RevMan (22) или пакет R meta (23). В этом примере мы будем использовать мета-пакет R Доступ к учебному пособию по метапакету можно получить через учебное пособие «Общий пакет для мета-анализа», pdf (23). Коды R и инструкции по выполнению метаанализа можно найти в Дополнительном файле 5: Файл S3.
Для анализа мы предполагаем, что исследование носит неоднородный характер; поэтому мы выбираем модель случайного эффекта. Мы провели анализ безопасности вакцины против лихорадки Эбола А. Из таблицы данных мы можем видеть некоторые нежелательные явления, возникающие после внутримышечной инъекции вакцины А субъекту исследования. Предположим, что мы включили шесть исследований, которые соответствуют нашим критериям включения. Мы можем выполнить мета-анализ для каждого из неблагоприятных событий, извлеченных из исследований, например, артралгии, из результатов мета-анализа случайных эффектов с использованием мета-пакета R.
Из результатов, показанных в дополнительном файле 3: Рисунок S3, мы можем видеть, что отношение шансов (ИЛИ) артралгии составляет 1, 06 (0, 79; 1, 42), значение р = 0, 71, что означает отсутствие связи между внутримышечной инъекцией Эболы вакцина А и артралгия, так как ОР почти один, и, кроме того, значение Р незначительно, так как оно> 0, 05.
В метаанализе мы также можем визуализировать результаты на лесном участке. На рис. 3 показан пример лесного участка из смоделированного анализа.
Модель случайного эффекта лесного участка для сравнения вакцины А и плацебо
Изображение в полном размере
На лесном участке мы видим шесть исследований (от А до F) и соответствующие им OR (95% ДИ). Зеленое поле представляет величину эффекта (в данном случае ИЛИ) каждого исследования. Чем больше поле, тем больше вес исследования (т. Е. Чем больше размер выборки). Форма синего ромба представляет объединенное ИЛИ шести исследований. Мы можем видеть, что синий ромб пересекает вертикальную линию OR = 1, что указывает на отсутствие значимости для ассоциации, так как ромб почти уравновешен с обеих сторон. Мы можем подтвердить это также из доверительного интервала 95%, который включает единицу и значение p> 0, 05.
Для гетерогенности мы видим, что I 2 = 0%, что означает, что гетерогенность не обнаружена; исследование является относительно однородным (это редко встречается в реальном исследовании). Чтобы оценить предвзятость публикации, связанную с метаанализом побочных эффектов артралгии, мы можем использовать функцию метабиаз из метапакета R (Дополнительный файл 4: Рисунок S4) и визуализацию с использованием воронкообразного графика. Результаты систематической ошибки публикации показаны на рис. 4. Мы видим, что значение p, связанное с этим тестом, составляет 0, 74, что указывает на симметрию графика воронки. Мы можем подтвердить это, посмотрев на участок воронки.
Публикация смещенной воронки для сравнения вакцины А и плацебо
Изображение в полном размере
Глядя на воронкообразный график, количество исследований в левой и правой части воронкообразного графика одинаково; следовательно, график является симметричным, что указывает на отсутствие смещения публикации.
Анализ чувствительности — это процедура, используемая для определения того, как различные значения независимой переменной будут влиять на значимость конкретной зависимой переменной, удаляя одно исследование из МА. Если все включенные значения p исследования <0, 05, следовательно, удаление любого исследования не изменит значимой ассоциации. Он выполняется только при наличии существенной связи, поэтому, если значение p сделанного MA составляет 0, 7 — больше, чем один, анализ чувствительности не требуется для данного примера конкретного случая. Если есть 2 исследования со значением p> 0, 05, удаление любого из двух исследований приведет к потере значимости.
Двойная проверка данных
Для большей уверенности в качестве результатов анализируемые данные должны быть перепроверены из полнотекстовых данных с помощью фотографий доказательств, чтобы обеспечить очевидную проверку для ИП исследования.
Написание рукописи, редактирование и подача в журнал
Письмо основано на четырех научных разделах: введение, методы, результаты и обсуждение, в основном с заключением. Выполнение таблицы характеристик для исследования и характеристик пациента является обязательным этапом, который можно найти в виде шаблона в Дополнительном файле 5: Таблица S3.
После завершения написания рукописи, таблицы характеристик и блок-схемы PRISMA, команда должна отправить его в ИП, чтобы тщательно его пересмотреть, ответить на его комментарии и, наконец, выбрать подходящий журнал для рукописи, который подходит со значительным импакт-фактором и соответствием поле. Мы должны обратить внимание, читая руководящие указания авторов журналов, прежде чем представлять рукопись.
обсуждение
Роль доказательной медицины в биомедицинских исследованиях быстро растет. СР / МА также увеличиваются в медицинской литературе. В этом документе предпринята попытка предложить комплексный подход, позволяющий рецензентам производить высококачественные СО / МА. Мы надеемся, что читатели смогут получить общие знания о том, как проводить SR / MA, и иметь уверенность в их выполнении, хотя такое исследование требует сложных шагов по сравнению с описательными обзорами.
Имея основные этапы проведения МА, существует множество дополнительных этапов, которые применяются для определенных конкретных целей. Одним из этих шагов является мета-регрессия, которая проводится для исследования ассоциации любого нарушителя и результатов МА. Кроме того, существуют другие типы, а не стандартные MA, такие как NMA и MA. В NMA мы исследуем разницу между несколькими сравнениями, когда данных было недостаточно для проведения стандартного мета-анализа. Он использует как прямые, так и косвенные сравнения, чтобы сделать вывод, что является лучшим среди конкурентов. С другой стороны, мега МА или МА пациентов, как правило, суммируют результаты независимых исследований, используя данные отдельных субъектов. Поскольку можно провести более подробный анализ, он полезен при проведении повторного анализа измерений и анализа времени до события. Кроме того, он может выполнять дисперсионный анализ и анализ множественной регрессии; однако, он требует однородного набора данных и требует много времени в поведении (24).
Выводы
Этапы систематического обзора / мета-анализа включают разработку вопроса исследования и его валидацию, формирование критериев, стратегию поиска, поиск в базах данных, импорт всех результатов в библиотеку и экспорт в лист Excel, написание и регистрацию протоколов, просмотр заголовков и тезисов, полный просмотр текста, ручной поиск, извлечение данных и оценка их качества, проверка данных, проведение статистического анализа, двойная проверка данных, написание рукописей, редактирование и отправка в журнал.
Доступность данных и материалов
Непригодный.
Сокращения
-
НМА:
-
Сетевой метаанализ
-
ЧИСЛО ПИ:
-
Главный следователь
-
PICO:
-
Население, вмешательство, сравнение, результат
-
PRISMA:
-
Предпочтительные элементы отчетности для систематического обзора и мета-анализа
-
QA:
-
Оценка качества
-
SPIDER:
-
Образец, Интересное явление, Дизайн, Оценка, Тип исследования
-
SR / MAS:
-
Систематический обзор и метаанализ









