Физические свойства
Оксид натрия Na2O — бинарное неорганическое вещество. Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород:
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
2Na2O2 = 2Na2O + O2
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Na2O2 + 2Na = 2Na2O
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами:
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия:
2Na2O + O2 = 2Na2O2
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой. Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
Na2O + CO2 = Na2CO3
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
Na2O + NO + NO2 = 2NaNO2
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Na2O + Al2O3 = 2NaAlO2
Как получить оксид натрия
Оксид натрия имеет химическую формулу Na2O, представляет собою бесцветные кристаллы. Характерный представитель оксидов щелочных металлов, обладает всеми их свойствами. Исключительно активен, поэтому хранить его рекомендуется в безводных органических растворителях. Как получить это вещество?

Инструкция
Казалось бы, самый простой и естественный способ – окисление кислородом металлического натрия! Однако тут есть своя специфика. Дело в том, что окисление щелочных металлов протекает так бурно и быстро, что при этом наряду с оксидами образуются перекиси. Например:
2Na + O2 = Na2O2 (перекись натрия).
Причем ее образуется гораздо больше, чем оксида натрия (в соотношении примерно 4:1). И для того, чтобы превратить перекись в оксид натрия, потребуется осторожный нагрев в присутствии металлического натрия. Реакция идет таким образом:
Na2O2 + 2Na = 2Na2O
Поэтому используют другие способы получения этого вещества. Например, путем реакции металлического натрия с натрием азотнокислым (нитратом натрия, натриевой селитрой). Она протекает так:
2NaNO3 + 10Na = 6Na2O + N2В ходе этой реакции металлический натрий восстанавливает азот, имеющий в нитрат-ионе степень окисления +5, до чистого азота.
Оксид натрия можно получить также путем прокаливания натрия углекислого (карбоната) при высоких температурах (не ниже 1000 градусов). Реакция идет следующим образом:
Na2CO3 = Na2O + CO2
Весьма экзотический и к тому же небезопасный, поэтому не рекомендуемый способ получения этого вещества: нагреванием смеси азид натрия – нитрат натрия в вакууме, при температуре не ниже 350 градусов. Реакция протекает так:
5NaN3 + NaNO3 = 8N2+3Na2O
Обратите внимание
Учитывая, что все азиды – взрывоопасные вещества, эту реакцию можно проводить, только имея большой опыт обращения с подобными соединениями! Но лучше воздержаться.
Полезный совет
Бурно реагирует с водой, образуя раствор гидроксида натрия (едкого натра):
Na2O + H2O = 2NaOH
Легко вступает в реакцию с кислотами, образуя соль и воду:
Na2O + H2SO4 = Na2SO4 + H2O
Реагирует с кислотными оксидами, образуя соль:
Na2O + CO2 = Na2CO3
Используется главным образом в лабораторной практике, для демонстрационных опытов, а также в качестве реактива. Иногда применяется в производстве масел, в качестве катализатора.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
| Оксид натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Традиционные названия | окись натрия, натр |
| Хим. формула | Na2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| Номер ООН | 1825 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 |
0 3 3
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O. Типичный представитель основных оксидов. Бурно реагирует с водой.
Описание
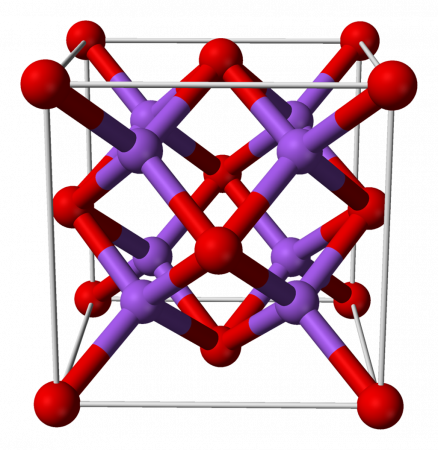
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 80 % оксида натрия и 20 % пероксида натрия:
-
- [math]displaystyle{ mathsf{6 Na + 2 O_2 longrightarrow 2 Na_2O + Na_2O_2} }[/math]
2. Взаимодействие металлического натрия с нитратом натрия:
-
- [math]displaystyle{ mathsf{10 Na + 2 NaNO_3 longrightarrow 6 Na_2O + N_2} }[/math]
3. Прокаливание пероксида натрия с избытком натрия:
-
- [math]displaystyle{ mathsf{Na_2O_2 + 2 Na longrightarrow 2 Na_2O} }[/math]
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
[math]ce{ NaHCO_3 ->[{T = 200}][{H_2O + CO_2}] Na_2CO3->[{T=1000}][{CO_2}] Na_2O }[/math]
5. Разложением нитрита натрия.
[math]displaystyle{ mathsf{4NaNO_2 rightarrow 2Na_2O + 4NO + O_2} }[/math]
Химические свойства
1. При нагревании разлагается до пероксида натрия[2]:
-
- [math]displaystyle{ mathsf{2Na_2O xrightarrow{700^oC} Na_2O_2 + 2Na} }[/math]
2. Взаимодействие с водой с образованием щёлочи:
-
- [math]displaystyle{ mathsf{Na_2O + H_2O longrightarrow 2 NaOH} }[/math]
- Данная реакция сильно экзотермична, вода при реакции с окисью натрия закипает.
3. Взаимодействие с кислотными оксидами с образованием соли:
-
- [math]displaystyle{ mathsf{Na_2O + CO_2 xrightarrow{450-550^oC} Na_2CO_3} }[/math]
4. Взаимодействие с кислотами с образованием соли и воды:
-
- [math]displaystyle{ mathsf{Na_2O + 2 HCl longrightarrow 2 NaCl + H_2O} }[/math]
5. Взаимодействие с жидким аммиаком с образованием амида:
-
- [math]displaystyle{ mathsf{Na_2O + NH_3 xrightarrow{-50^oC} NaNH_2 + NaOH} }[/math]
6. Окисление кислородом до пероксида[2]:
-
- [math]displaystyle{ mathsf{2Na_2O + O_2 xrightarrow{250-350^oC, p} 2Na_2O_2} }[/math]
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия, динептуната(VI) натрия и других веществ[1].
Примечания
- ↑ 1,0 1,1 [www.xumuk.ru/encyklopedia/2/2773.html XuMuK.Ru — сайт о химии]
- ↑ 2,0 2,1 Лидин, 2000, с. 20.
Литература
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
| Оксид натрия | |
|---|---|
 |
|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
-
- 4 Na + O2 ⟶ 2Na2O
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
-
- 6 Na + 2 O2 ⟶ 2Na2O + Na2O2
2. Взаимодействие металлического натрия с нитратом натрия:
-
- 10 Na + 2NaNO3 ⟶ 6Na2O + N2
3. Прокаливание пероксида натрия с избытком натрия:
-
- Na2O2 + 2 Na ⟶ 2Na2O
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
-
- Na2O + H2O ⟶ 2 NaOH
2. Взаимодействие с кислотными оксидами с образованием соли:
-
- Na2O + CO2 ⟶ Na2CO3
3. Взаимодействие с кислотами с образованием соли и воды:
-
- Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Оксид натрия
Брутто-формула:
Na2O
CAS# 1313-59-3
Категории:
Оксиды
PubChem CID: 73971
| ChemSpider ID: 66599
Названия
Русский:
- Окись натрия
- Оксид натрия [Wiki]
English:
- EINECS:215-208-9
- Sodium oxide [Wiki]
- disodium;oxygen(2-)(IUPAC)
German:
- Dinatriumoxid
- Natriummonoxid
- Natriumoxid [Wiki]
العربية:
- أكسيد الصوديوم(IUPAC) [Wiki]
- أكسيد ثنائي الصوديوم(IUPAC)
Español:
- Óxido de sodio(IUPAC) [Wiki]
French:
- Oxyde de sodium(IUPAC) [Wiki]
Italiano:
- Monossido di sodio
- Monossido disodico
- Ossido di disodio(IUPAC)
- Ossido di sodio [Wiki]
- Ossido disodico
日本語:
- 酸化ナトリウム(IUPAC) [Wiki]
Português:
- Óxido de sódio(IUPAC) [Wiki]
中文:
- 氧化钠 [Wiki]
Варианты формулы:
Na2O
Na-O-Na
NaO/Na
Na^+$L(1.5)O^2-/0Na^+
Химический состав
Реакции, в которых участвует Оксид натрия
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
{M}2O + H2O -> 2{M}OH
, где M =
Li Na K Rb Cs -
{M}2O + 2H{X} = 2{M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 ClO4 BrO4 -
10Na + 2NaNO3 -> 6Na2O + N2
-
2NaNO2 + 6Na -> 4Na2O + N2
И ещё 19 реакций…
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Оксид натрия
Из Википедии — свободной энциклопедии
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O. Типичный представитель основных оксидов. Бурно реагирует с водой.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 80 % оксида натрия и 20 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
![{displaystyle {ce {NaHCO_{3}->[{T=200}][{H_{2}O+CO_{2}}]Na_{2}CO3->[{T=1000}][{CO_{2}}]Na_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8745afe18b26884d2274af7ff87d73943dfbabd)
5. Разложением нитрита натрия.

Химические свойства
1. При нагревании разлагается до пероксида натрия[2]:
2. Взаимодействие с водой с образованием щёлочи:
-
- Данная реакция сильно экзотермична, вода при реакции с окисью натрия закипает.
3. Взаимодействие с кислотными оксидами с образованием соли:
4. Взаимодействие с кислотами с образованием соли и воды:
5. Взаимодействие с жидким аммиаком с образованием амида:
6. Окисление кислородом до пероксида[2]:
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия, динептуната(VI) натрия и других веществ[1].
Примечания
- ↑ 1 2 [www.xumuk.ru/encyklopedia/2/2773.html XuMuK.Ru — сайт о химии]
- ↑ 1 2 Лидин, 2000, с. 20.
Литература
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| п • <abbr title=»Обсуждение этого шаблона»>о</abbr> • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Эта страница в последний раз была отредактирована 7 декабря 2022 в 19:48.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Оксид натрия
Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
| Оксид натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Термические свойства | |
| Т. плав. | 1132 °C |
| Т. кип. | 1950 °C |
| Энтальпия образования | −416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Безопасность | |
| Токсичность |
0 3 3
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:

Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:

2. Взаимодействие металлического натрия с нитратом натрия:

3. Прокаливание пероксида натрия с избытком натрия:

4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:

2. Взаимодействие с кислотными оксидами с образованием соли:

3. Взаимодействие с кислотами с образованием соли и воды:

Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ[1].
Примечания
- ↑ 1 2 XuMuK.Ru — сайт о химии
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.







