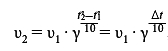Термохимические уравнения
Для
того, чтобы сравнивать энергетические
эффекты различных процессов, тепловые
эффекты определяют при стандартных
условиях.
За стандартные принимают давление 100
кПа (1 бар), температуру 250С
(298 К), концентрацию — 1 моль/л. Если
исходные вещества и продукты реакции
находятся в стандартном состоянии, то
тепловой эффект химической реакции
называется стандартной
энтальпией системы
и обозначается ΔН0298
или ΔН0.
Уравнения
химических реакций с указанием теплового
эффекта называют термохимическими
уравнениями.
В
термохимических уравнениях указывают
фазовое состояние и полиморфную
модификацию реагирующих и образующихся
веществ: г —газовое, ж — жидкое, к
—кристаллическое, т — твердое, р —
растворенное и др. Если агрегатные
состояния веществ для условий реакции
очевидны, например, О2,
N2,
Н2
— газы, Аl2О3,
СаСО3
— твердые вещества и т.д. при 298 К, то их
могут не указывать.
Термохимическое
уравнение включает в себя тепловой
эффект реакции ΔН,
который в современной терминологии
записывают рядом с уравнением.
Например:
С6Н6(Ж)
+ 7,5О2
= 6СО2
+ 3Н2О(Ж)
ΔН0
= — 3267,7 кДж
N2
+ 3Н2
= 2NН3(Г)
ΔН0
= — 92,4 кДж.
С
термохимическими уравнениями можно
оперировать, как и с алгебраическими
уравнениями (складывать, вычитать друг
из друга, умножать на постоянную величину
и т.д.).
Термохимические
уравнения часто (но не всегда) приводятся
для одного моля рассматриваемого
вещества (получаемого или расходуемого).
При этом другие участники процесса
могут входить в уравнение с дробными
коэффициентами. Это допускается, так
как термохимические уравнения оперируют
не с молекулами, а с молями веществ.
Термохимические расчеты
Тепловые
эффекты химических реакций определяют
как экспериментально, так и с помощью
термохимических расчетов.
В
основе термохимических расчетов лежит
закон Гесса
(1841 г):
Тепловой
эффект реакции не зависит от пути, по
которому протекает реакция (т.е. от числа
промежуточных стадий), а определяется
начальным и конечным состоянием системы.
Например,
реакция горения метана может протекать
по уравнению:
СН4
+2О2
= СО2
+ 2Н2О(Г)
ΔН01
= —802,34 кДж
Эту же реакцию
можно провести через стадию образования
СО:
СН4
+3/2О2
= СО + 2Н2О(Г)
ΔН02
= —519,33 кДж
СО
+1/2О2
= СО2
ΔН03
= —283,01 кДж
При
этом оказывается, что
ΔН01
= ΔН02
+ ΔН03
.
Следовательно, тепловой эффект реакции,
протекающей по двум путям, одинаков.
Закон Гесса хорошо иллюстрируется с
помощью энтальпийных диаграмм (рис.2)
И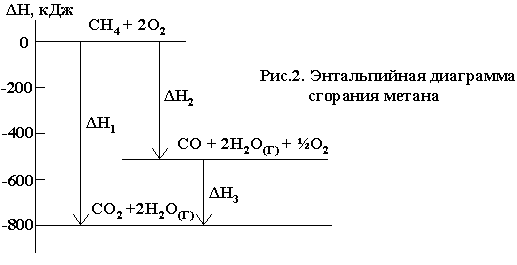
закона Гесса вытекает ряд следствий:
1. Тепловой эффект
прямой реакции равен тепловому эффекту
обратной реакции с противоположным
знаком.
2.
Если в результате ряда последовательных
химических реакций система приходит
в состояние, полностью совпадающее с
исходным, то сумма тепловых эффектов
этих реакций равна нулю (ΔН
= 0). Процессы, в которых система после
последовательных превращений возвращается
в исходное состояние, называются
круговыми процессами или циклами.
Метод циклов широко используется в
термохимических расчетах. .
3.
Энтальпия химической реакции равна
сумме энтальпий образования продуктов
реакций за вычетом суммы энтальпий
образования исходных веществ с учетом
стехиометрических коэффициентов.
Здесь
встречаемся с понятием »энтальпия
образования».
Энтальпией
(теплотой) образования химического
соединения называется тепловой эффект
реакции образования 1 моля этого
соединения из простых веществ, взятых
в их устойчивом состоянии при данных
условиях.
Обычно теплоты образования относят к
стандартному состоянию, т.е. 250С
(298 К) и 100 кПа. Стандартные энтальпии
образования химических веществ
обозначаются ΔН0298
(или ΔН0),
измеряются в кДж/моль и приводятся в
справочниках. Энтальпию образования
простых веществ , устойчивых при 298 К и
давлении 100 кПа, принимают равной нулю.
В
таком случае следствие из закона Гесса
для теплового эффекта химической реакции
(ΔН(Х.Р.))
имеет вид:
ΔН(Х.Р.)
= ∑ΔН0продуктов
реакции
—
∑ΔН0исходных
веществ
Используя
закон Гесса, можно рассчитывать энергию
химической связи, энергию кристаллических
решеток, теплоты сгорания топлив,
калорийность пищи и т.д.
Наиболее
распространенные расчеты – вычисление
тепловых эффектов (энтальпий) реакций,
что необходимо для технологических и
научных целей.
Пример
1. Напишите
термохимическое уравнение реакции
между СО2(Г)
и водородом,
в результате которой образуются СН4(Г)
и Н2О(Г),
вычислив ее тепловой эффект на основе
данных, приведенных в приложении. Сколько
теплоты выделится в этой реакции при
получении 67,2 л метана в пересчете на
стандартные условия?
Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения:
СО2(Г)
+ 3Н2(Г)
= СН4(Г)
+ 2Н2О(Г)
Находим
в справочнике (приложение) стандартные
теплоты образования соединений,
участвующих в процессе:
ΔН0
(СО2(Г))
= —393,51 кДж/моль ΔН0
(СН4(Г))
= —74,85 кДж/моль ΔН0
(Н2(Г))
= 0 кДж/моль ΔН0
(Н2О(Г))
= ―241,83
кДж/моль
Обратите
внимание, что теплота образования
водорода, как и всех простых веществ в
их устойчивом при данных условиях
состоянии, равна нулю. Рассчитываем
тепловой эффект реакции:
ΔН(Х.Р.)
= ∑ΔН0(прод.)
—
∑ΔН0(исх.)
=
ΔН0(СН4(Г))
+ 2ΔН0(Н2О(Г))
— ΔН0(СО2(Г))
—3ΔН0
(Н2(Г)))
=
—74,85 + 2(—241,83) —
(—393,51) — 3·0 = —165,00 кДж/моль.
Термохимическое
уравнение имеет вид:
СО2(Г)
+ 3Н2(Г)
= СН4(Г)
+ 2Н2О(Г);
ΔН = —165,00
кДж
Согласно
этому термохимическому уравнению,
165,00 кДж теплоты выделится при получении
1 моль, т.е. 22,4 л метана. Количество
теплоты, выделившейся при получении
67,2 л метана, находим из пропорции:
22,4 л ——
165,00 кДж 67,2·165,00
67,2 л ——
Q кДж Q = —————— =
22,4
= 495,00 кДж
Пример
2. При сгорании
1л этилена С2Н4(Г)
(стандартные условия) с образованием
газообразного оксида углерода (IV) и
жидкой воды выделяется 63,00 кДж теплоты.
Рассчитайте по этим данным мольную
энтальпию горения этилена и запишите
термохимическое уравнение реакции.
Вычислите энтальпию образования С2Н4(Г)
и сравните полученное значение с
литературными данными (приложение).
Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения:
С2Н4(Г)
+ 3О2(Г)
= 2СО2(Г)
+ 2Н2О(Ж);
Н
= ?
Создаваемое
термохимическое уравнение описывает
горение 1 моль, т.е. 22,4 л этилена. Необходимую
для него мольную теплоту горения этилена
находим из пропорции:
1л ——
63,00 кДж 22,4·63,00
22,4 л —— Q кДж
Q = —————— =
1
= 1410,96 кДж
Н
= -Q,
термохимическое уравнение горения
этилена имеет вид: С2Н4(Г)
+ 3О2(Г)
= 2СО2(Г)
+ 2Н2О(Ж);
Н
= -1410,96 кДж
Для
расчета энтальпии образования С2Н4(Г)
привлекаем
следствие из закона Гесса: ΔН(Х.Р.)
= ∑ΔН0(прод.)
—
∑ΔН0(исх.).
Используем
найденную нами энтальпию горения этилена
и приведенные в приложении энтальпии
образования всех (кроме этилена)
участников процесса.
—1410,96
= 2·(—393,51) + 2·(—285,84) — ΔН0(С2Н4(Г))
— 3·0
Отсюда
ΔН0(С2Н4(Г))
= 52,26 кДж/моль. Это совпадает со значением,
приведенным в приложении и доказывает
правильность наших вычислений.
Пример
3. Напишите
термохимическое уравнение образования
метана из простых веществ, вычислив
энтальпию этого процесса из следующих
термохимических уравнений:
СН4(Г)
+ 2О2(Г)
= СО2(Г)+
2Н2О(Ж)
ΔН1
= -890,31 кДж
(1)
С(
ГРАФИТ)
+ О2(Г)
= СО2(Г)
Н2
= -393,51 кДж (2)
Н2(Г)
+ ½О2(Г)
= Н2О(Ж)
Н3
= -285,84 кДж (3)
Сравните
полученное значение с табличными данными
(приложение).
Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения:
С(ГРАФИТ)
+ 2Н2(Г)
= СН4(Г)
Н4
= Н0(СН4(Г)))
=? (4)
С
термохимическими уравнениями можно
оперировать так же, как и с алгебраическими.
Мы должны в результате алгебраических
действий с уравнениями 1, 2 и 3 получить
уравнение 4. Для этого следует уравнение
3 умножить на 2, результат сложить с
уравнением 2 и вычесть уравнение 1.
2Н2(Г)
+ О2(Г)
= 2Н2О(Ж)
Н0(СН4(Г))
= 2Н3
+ Н2
— Н1
+
С(ГРАФИТ)
+ О2(Г)
+ СО2(Г)
Н0(СН4(Г))
= 2(—285,84)
— СН4(Г)
— 2О2(Г)
—СО2(Г)—
2Н2О(Ж)
+ (—393,51)
― (—890,31).
С(ГРАФИТ)
+ 2Н2(Г)
= СН4(Г)
Н0(СН4(Г))
= —74,88 кДж
Это
совпадает со значением, приведенным в
приложении, что доказывает правильность
наших вычислений.
Соседние файлы в папке методички
- #
- #
- #
- #
- #
- #
- #
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
0,25 / 1 = 700 / Q
Решая которое, находим, что:
Q = 2800 кДж
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
4 моль Al2O3 — 3330 кДж
0,667 моль Al2O3 — x кДж
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
x = 4 моль
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Если в результате химического взаимодействия теплота выделяется, то это экзотермические реакции (+Q) ; если теплота поглощается – эндотермические (-Q) .
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться термохимическим .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://himzadacha.ru/vychislit-teplovoj-effekt-reakcii/
http://prosto-o-slognom.ru/chimia_primery/005-termochimicheskie_uravneniya.html
Термохимия — раздел химии, изучающий тепловые эффекты химических реакций. Ранние исследования термохимических явлений принадлежат учёному Н. Н. Бекетову.
Уравнения химических реакций, в которых указан тепловой эффект, называют термохимическими.
Обрати внимание!
Значение теплового эффекта относят к тем количествам веществ, которые соответствуют уравнению реакции.
— в экзотермической реакции образования (1) моль углекислого газа из простых веществ выделяется (394) кДж теплоты;
кДж
— в эндотермической реакции разложения (1) моль карбоната кальция поглощается (1200) кДж теплоты.
Обрати внимание!
Значение теплового эффекта зависит от агрегатного состояния исходных веществ и продуктов реакции.
Поэтому в термохимических уравнениях также указываются агрегатные состояния веществ:
- (г) — газ;
- (ж) — жидкость;
- (т) или (к) — твёрдое (кристаллическое) вещество.
кДж.
По термохимическим уравнениям можно определять количество теплоты, которое выделяется или поглощается в ходе реакции, если известно химическое количество (масса, объём) одного из реагентов.
Если известно количество теплоты, то можно определить химическое количество (массу, объём) любого вещества, участвующего в реакции.
Чтобы составить термохимическое уравнение, нужно знать количество выделившейся или поглотившейся теплоты и химическое количество (масса, объём) одного из веществ.
Термохимические
уравнения
|
Термохимические уравнения включают в Например: Термохимическое (CuOH)2 CO3 = 2CuO + H 2 O + CO 2 — 47 кДж Мы видим, что на разложение 1 моля малахита необходимо Аналогично можно установить Решим задачи: Задача 1. Определите количество 2 Mq + O2 = 2MqO + 1204 кДж
Отсюда
Ответ: При образовании 120г оксида магния выделится Задача 2. В результате реакции, 2 C2H2+ 5O2 = 4CO2 +2H2O + 2610 кДж выделилось 652,5 кДж теплоты. Определите массу сгоревшего
Ответ: масса сгоревшего ацетилена 13 г. Задача 3. В результате
Задача 2KClO3 = если
Ответ: объем выделившегося кислорода равен 134,4 л. Решите самостоятельно: 1. Согласно термохимическому уравнению реакции CH4+ 2O2 = CO2 +2H2O + 802 кДж определите количество теплоты, выделившейся при сжигании 24 г 2. Тепловой эффект реакции горения серы равен 297 кДж. 3. По термохимическому уравнению H2+ Cl2 = 2HCl + 184,36 кДж рассчитайте, какой объем |
Практикум по решению
задач «Термохимические расчёты»
Задача 1. Определите количество
теплоты, которое выделится при образовании
120 граммов оксида
магния в результате реакции горения магния, если термохимическое
уравнение: 2 Mg + O2 = 2 MgO + 1204 кДж
Задача 2. В результате реакции,
термохимическое уравнение которой
2 C2H2+
5O2 = 4CO2 +2H2O +
2610 кДж
выделилось 652,5 кДж
теплоты. Определите массу сгоревшего ацетилена.
Задача
3. В
результате горения 48 г метана выделилось 2406 кДж теплоты. Составьте термохимическое
уравнение этой реакции.
Задача 4. При сжигании 6,5 г цинка
выделилась теплота, равная 34,8 кДж. Составьте термохимическое уравнение
реакции.
Задача 5. Составьте термохимическое
уравнение реакции, если известно, что при взаимодействии 7 г железа с серой
выделяется 12,15 кДж теплоты.
Задача 6. Какой объем кислорода (при
н.у.) выделится в результате реакции, термохимическое уравнение которой 2KClO3 =
2KCl + 3O2 – 91 кДж,
если на разложение
бертолетовой соли было затрачено 182 кДж теплоты.
Задача 7. Составьте термохимическое
уравнение реакции, если известно, что при взаимодействии 0,5 моль натрия с
хлором образуется хлорид натрия и выделяется 205 кДж теплоты.
Задача 8. Согласно термохимическому
уравнению реакции
CH4+
2O2 = CO2 +2H2O +
802 кДж
определите
количество теплоты, выделившейся при сжигании 24 г метана.
Задача 9. Тепловой эффект реакции горения
серы равен 297 кДж. Какая масса серы сгорела, если выделилось 742,5
кДж теплоты.
Задача 10. Составьте термохимическое уравнение
реакции, если известно, что при сгорании 20 г водорода в кислороде выделяется
2860 кДж теплоты.
Задача 11. По термохимическому
уравнению H2+ Cl2 =
2HCl + 184,36 кДж
рассчитайте, какой объем
водорода затрачен на образование хлороводорода (при
н.у.), если при этом выделилось 921,8 кДж теплоты.
Задача 12. Дано термохимическое уравнение: 3Н2 + N2 = 2NН3 + 92 кДж, выделилось 23 кДж теплоты.
Чему равен объём полученного (при н.у.) аммиака ?
Задача 13. Дано термохимическое уравнение: 2SО2 + О2 = 2SО3 + 198 кДж.
В результате реакции
выделилось 495 кДж теплоты. Какая масса оксида серы (IV) (в граммах) прореагировала
с кислородом?
Задача 14. В результате реакции, термохимическое
уравнение которой
2SO2 + О2 = 2SО3 + 198 кДж, выделилось 297 кДж теплоты.
Вычислите объем израсходованного оксида серы (1V).
Задача 15. В реакции, протекающей в соответствии
с термохимическим уравнением: 2Мg +O2 = 2МgО + 1204 кДж, выделилось 1806 кДж
теплоты. Чему равна масса вступившего в реакцию магния ?
Задача 16. Дано термохимическое уравнение: 2Мg + O2 = 2МgО
+ 1204 кДж. В результате реакции выделилось 903 кДж теплоты. Какая масса магния
(в граммах) сгорела?
Задача 17. В соответствии с термохимическим
уравнением реакции
2Са + О2 = 2СаО + 635,1 кДж
Определите количество
теплоты, выделяющееся при горении 10 г кальция.
Задача 18. В реакцию, протекающую в соответствии
с термохимическим уравнением 4Li +
2O2 = 2Li2O + 1198кДж, вступило 1 моль лития.
Вычислите количество выделившейся теплоты.
Задача 19. Термохимическое уравнение реакции:
4А1+3О2 =2А12О3+
3350 кДж. Вычислите количество теплоты, выделившееся при окислении 54 г
алюминия,
Задача 20.Дано термохимическое уравнение:
2FеО + С = 2Fе + СО2 —
132 кДж.
В результате реакции
поглотилось 55 кДж теплоты. Какая масса оксида железа (П) в граммах
прореагировала с углеродом?
Задача 21. Дано термохимическое уравнение:
2NО + О2 = 2NО2 + 114 кДж. Сколько теплоты (в кДж)
выделится при взаимодействии 100 г оксида азота (II) с избытком кислорода?
Задача 22. В реакцию, протекающую в соответствии
с термохимическим уравнением 2А1 + 3S =
Аl2S3 + 509 кДж,
вступило 108 г алюминия. Чему равно количество выделившейся теплоты?
Задача 23. При соединении 4,2 г железа с серой
выделилось 7,15 кДж теплоты. Составьте термохимическое уравнение реакции.
Задача 24. Термохимическое уравнение реакции: 4Р + 5О2= 2Р2О5 + 3010 кДж. Сколько теплоты выделится
при сгорании 310 г фосфора?
Задача 25. В соответствии с термохимическим
уравнением
4Р + 5О2 = 2Р2О5 + 3010 кДж
выделится 1505 кДж. Какая
масса фосфора для этого потребуется ?
Задача 26. Вычислите по термохимическому
уравнению: С + O2 = CO2 + 402 кДж
сколько грамм углерода
сгорело, если выделилось 2412 кДж теплоты.
Задача 27. В результате реакции, термохимическое
уравнение которого С(графит) +
О2(г) = СО2(г) + 393,5 кДж, выделилось 1967,5 кДж
теплоты. Объем (н.у.) образовавшегося при этом углекислого газа равен чему ?
ЭЛЕМЕНТЫ ТЕРМОХИМИИ
Термохимия – раздел химии, в котором рассматриваются тепловые явления, происходящие в процессе химических реакций.
Нужен репетитор по химии? Записывайтесь на занятия в каталоге TutorOnline!
Все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты эндотермические. Критерием таких процессов является тепловой эффект реакции.
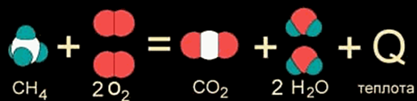
Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана
СН4 + 2O2 = СО2 + 2Н2О + Q (1)
а к эндотермическим реакциям – реакции разложения. Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+ Q) или поглощается (- Q):
СаCO3 = СаO + CO2 -Q (2)
При химических процессах может выделяться или поглощаться не только тепловая, но и другие виды энергии: электрическая, световая, механическая и др.
Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку, например, оксид кальция (СаО) при взаимодействии с водой образует гидроксид кальция (Са(ОН)2). Процесс сопровождается выделением большого количества теплоты:
СаО + Н2О = Са(ОН) + 108 кДж (3)
А реакция разложения гидроксида кальция (Са(ОН)2) осуществляется с поглощением такого же количества теплоты извне
Са(ОН)2 = СаО + Н2О — 108 кДж (4)
Если тепловой эффект реакции определяется при постоянном давлении, температуре, то он будет соответствовать стандартной энтальпии реакции, обозначаемой ∆Н, которая противоположна по знаку величине теплового эффекта реакции. Например, если в процессе экзотермической реакции во взаимодействие вступают алюминий (Аl) и оксид железа (Fe2O3), то в конце уравнения это обозначится следующим образом:
2Аl + Fe2O3 = 2Fe + Al2O3 (+Q) или (-∆Н) (5)
А в случае эндотермической реакции значения этих тепловых величин будут иметь противоположные знаки:
С + СО2 = 2СО (-Q) или (+∆Н) (6)
Это объясняется тем, что выделяющаяся в процессе экзотермической реакции теплота как энергия, теряется системой (-∆Н), а при эндотермических процессах, наоборот – приобретается (+∆Н). Величина (Н) называется энтальпией системы. Часто её называют так же теплосодержанием или теплотой образования ∆Н данного вещества. В расчётах применяют справочные значения тепловых эффектов образования (или сгорания) одного моля вещества, отнесённые к 298К (250С) и Р = 101,325 кПа (1 атм). Эти условия считаются стандартными и поэтому используемые значения тепловых эффектов называют стандартными теплотами образования(или сгорания) вещества и обозначают как ∆Н0298. Например, тепловой эффект реакции взаимодействия графита с кислородом, выраженный через изменение энтальпии, следует записать как ∆Н0298 = — 393,6 кДж, а так как при этом из простых веществ образуется 1 моль СО2, то данный тепловой эффект является теплотой образования СО2, выраженной в кДж/моль. Главной характеристикой топлив являются их теплоты сгорания. Тепловой эффект реакции горения одного моля вещества называется теплотой сгорания данного вещества. Следовательно, исходя из вышеприведённых положений, теплота сгорания одного моля графита (12 г) составляет 393,6 кДж/моль.
Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением.
На практике это имеет большое значение. При строительстве тепловых трасс, доменных печей, котельных и т.п. теплотопотребляющих промышленных объектов, необходимо предусмотреть или приток энергии для поддержания процессов, или наоборот, отвод избытка теплоты, чтобы не было перегрева вплоть до взрыв
Расчёт теплового эффекта реакции между простыми веществами не предоставляется затруднительным. Например, для реакции образования хлористого водорода:
Н2 + Cl2 = 2НCl (7)
Энергия затрачивается на разрыв двух химических связей Н–Н и Cl — Cl. При этом энергия выделяется при образовании двух химических связей Н- Cl. Значения энергий этих связей можно найти в справочных таблицах и по разности между ними определить тепловой эффект (Q) реакции (7):
ЕН–Н = 436 кДж/моль, ЕCl–Cl = 240 кДж/моль,
ЕН–Cl = 240 кДж/моль,
Q = 2 х 430 — ( 1 х 436 — 1 х 240 ) = 184 кДж.
Приведённая в качестве примера термохимическая реакция (7) является экзотермической. Теплоты образования простых веществ при стандартных условиях приняты равными нулю.
Термохимические уравнения имеют особую форму записи. Они отличаются от обычных уравнений тем, что:
1). В термохимических уравнениях обязательно указывают агрегатные состояния веществ (жидкое, твёрдое, газообразное) Это связано с тем, что одна и та же реакция может иметь различный тепловой эффект в зависимости от фазового состояния вещества
2). Коэффициенты в термохимическом уравнении равны количеству веществ ( в молях), вступивших в реакцию. Например, дана реакция сгорания ацетилена:
2С2Н2(г) + 5О2(г) = 4СО2(г) + 2Н2О (+Q) (8)
При сгорании одного моль ацетилена С2Н2 выделяется 1257кДж теплоты. Поэтому, относительно одного моль С2Н2 необходимо все коэффициенты перед реагентами поделить на 2, тогда получим следующую запись термохимического уравнения:
С2Н2 + 5/2О2 = 2СО2 + Н2О + 1257 кДж (9)
Или другая тождественная запись:
С2Н2 + 2,5О2 = 2СО2 + Н2О + 1257 кДж (10)
Например, дано термохимическое уравнение сгорания метана:
СН4 + 2О2 = СО2 + 2Н2О + 802 кДж (11)
Необходимо вычислить, какое количество теплоты выделится при сгорании 20 г метана?
Поскольку 1 моль метана имеет массу 16 г, а 20 г метана соответственно составляют
n = m/Mr = 20:12 = 1,25 моль,
то, составив пропорцию: при сгорании
1 моль СН4 выделяется 802 кДж теплоты
1,25 СН4 ———«——-Х кДж теплоты
Определим, что на сгорание 20г метана потребуется
Х = 1,25 х 802 / 1 = 1002,5 кДж
Приведём другой пример . Дано уравнение реакции сгорания оксида азота(+4):
4NО2(г) + O2(г) + 2H2O(г) = 4НNО3(ж) + 448 кДж (12)
Необходимо составить термохимическое уравнение относительно сгорания одного моль оксида азота. Определить: какой объём оксида азота потребуется на образование 4258 кДж теплоты в процессе данной реакции?
Для составления термохимического уравнения относительно одного моль оксида азота(+4) необходимо все коэффициенты, стоящие перед реагентами, разделить на коэффициент, стоящий перед NО2, т.е. на «4», тогда уравнение примет вид:
NО2(г) + 1/4O2(г) + 1/2H2O(г) = НNО3(ж) +112 кДж (13)
В уравнении изменится количество выделяющейся теплоты, оно станет равным 112, т.е. в четыре раза меньше, чем в приведённом уравнении. В соответствии с уравнением (13) 1 моль оксида азота(NО2) или 22,4 л в данной реакции образует 112 кДж теплоты, а Х л соответственно 4258 кДж:
22,4 моль NО2 при сгорании образуют 112 кДж теплоты.
Х л —————-«————-4258 кДж теплоты.
Хг = 22,4 х 4258 / 112 = 851,6 кДж
Важнейшим законом термохимии является закон Г.И.Гесса (1840): тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. При помощи закона Гесса можно рассчитывать такие тепловые эффекты реакции, которые измерить трудно или невозможно. Например, теплоту образования угарного газа(СО) можно вычислить, если полное сгорание углерода
С (графит) + О2 = СО2 (∆Н1) (14)
разбить на стадии:
С (графит) + 0,5О2 = СО (∆Н2) (15)
СО + 0,5О2 = СО2 (∆Н3) (16)
Зная, что ∆Н1 = -393,6 кДж/моль и ∆Н3 = — 283,1 кДж/моль, из равенства ∆Н1 = ∆Н2 + ∆Н3
находим, что ∆Н2 = — 110,5 кДж/моль.
В качестве другого примера можно привести образование сульфата алюминия при сгорании алюминия и серы ромбической согласно реакции:
2Al(к) + 3S(ромб) + 6О2(г) = Al2(SO4)3(к) (17)
∆Н может быть найдена по тепловым эффектам отдельных стадий:
2Al + 1,5О2 = Al2O3 ∆Н1= -1670,2 кДж/моль (18)
3S + 1,5О2 = SO3 ∆Н2= -395,3 кДж/моль (19)
Al2O3 + 3SO3 = Al2(SO4)3 ∆Н3= -579,7 кДж/моль (20)
Тогда ∆Н = ∆Н1 + 3∆Н2 + ∆Н3 = (- 1670,2) – 3х (-395,3) – (579,7) = — 3435,8 кДж/моль.
На основании закона Гесса термохимические уравнения можно разбивать на отдельные стадии независимо от того, осуществимы они на практике или нет. Из закона Гесса вытекает важное следствие: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходный веществ:
∆Н = ∑ (𝘮 ∆Н) продукты — ∑ (𝘯 ∆Н) реагенты,
где 𝘮 и 𝘯 – число молей каждого вещества в уравнении реакции. Например, теплоту сгорания ацетилена (10) можно рассчитать, зная теплоты образования С2Н2 , СО2 и Н2О (∆Н002 = 0), как ∆Н0 = 2 ∆Н СО2 + ∆НН2О — ∆НС2Н2 = -2 х 393,6 — 281 — (+226,8) = -1295 кДж/моль.
НАЧАЛА ТЕРМОДИНАМИКИ
Среди многообразия химических реакций, термохимические занимают особое положение. Если рассуждать с точки зрения эволюции жизни на Земле, то в конечном итоге, действительно, от этих процессов зависит жизнь на нашей планете. А что касается человеческой цивилизации в целом, то здесь мы имеем прямую зависимость её развития от термохимических явлений. Ведь благодаря именно данным процессам произошёл отрыв человечества в развитии от всех других видов живых организмов, населяющих нашу планету. С древнейших времён, начиная от пассивного использования огня в качестве средства для согревания и приготовления примитивной пищи, человечество пришло к активному использованию этого явления (изготовление гончарных изделий – плавка меди, железа и других металлов – паровые двигатели – двигатели внутреннего сгорания – управление ядерными реакциями)
Если можно было бы предложить создать проект монумента человеческому прогрессу, то на его фронтоне надо было бы начертать уравнение химической реакции
С + О2 = СО2
Именно со сгорания дров, угля, торфа начался отсчёт человеческой цивилизации. В настоящее время наше с вами существование просто немыслимо без тепловых процесов. Но кроме приведённой выше реакции существует великое множество других термодинамических процессов. Почему именно углероду дано такое предпочтение? Может быть его собрату по IV-й группе – кремнию более выгоден данный процесс?
Si + О2 = SiО2
Тем более, что кремний по массе составляет 27,6% земной коры. Это несравненно больше, чем запасы древесины и её ископаемых на нашей планете. Чего же проще? Кидай в топку кремнезём! Его ведь целая планета! Правда надо оговорить тот факт, что чистого кремния в природе не существует. В наличии только его оксид — SiО2. Но на то и химики, чтобы придумать что-нибудь? А может быть для более сильного окислителя, чем кислород – фтору окисление углерода более выгодно термодинамически?
C + 2F2 = СF4
Как во всём этом разобраться? И возможно ли вообще предсказать осуществления того или иного процесса, ведь на бумаге можно написать уравнение любой химической реакции, а возможна ли она практически? Придётся начинать всё по порядку.
Одним из самых важных и очевидных законов природы является закон сохранения энергии: энергия не возникает из ничего и не исчезает бесследно, она только переходит из одной формы в другую. Аналогичным является закон сохранения массы вещества: массы веществ вступивших в реакцию равны массам веществ, образовавшихся в процессе данной реакции.
Поэтому и при экзотермической и при эндотермической обратимых реакциях одного и того же процесса как количество затрачиваемой и расходуемой энергии равны, но противоположны по знаку, так и массы веществ распадающихся и вновь образующихся равны:
СаО + Н2О = Са(ОН)2 + 108 кДж
Mr=56 Mr=18 Mr=74
Са(ОН)2 = СаО + Н2О — 108 кДж
Mr=74 Mr=56 Mr=18
Но всё дело в том, что в приведённых выше двух реакциях уже указано, какая из них экзотермическая, а какая эндотермическая. А можно ли так, как говорится «на вскидку» по одному только уравнению реакции определить: какая это реакция? В принципе, в большинстве случаев, возможно. К экзотермическим реакциям, в основном, относятся реакции соединения и как их разновидность – реакции окисления.(8,11,12,14). А к реакциям эндотермическим, соответственно – реакции разложения (2,4). Ещё раз уточним: в большинстве случаев. Поскольку реакция окисления:
0,5N2 + 0,5O2 = NО — 90 кДж
требует расхода энергии и является эндотермической, а реакция разложения нитрата натрия
2NaNO3 = 2NaNO2 + O2 (+Q)
осуществляется с выделением большого количества теплоты и является экзотермической.
Значит, принцип «на вскидку» не годится. Но каким же принципом тогда следует руководствоваться в определении реакций данного типа? В приводимых выше примерах (10), (14-20) указывалось, что стандартные теплоты образования веществ (∆Н) являются справочными данными. Такие данные скрупулёзно составлялись на протяжении десятилетий для многочисленных термодинамических реакций. С этой целью использовался прибор калориметр. Именно по этим данным в настоящее время мы можем установить, какой является та или иная реакция: экзотермической или эндотермической.
Теперь попробуем заглянуть как бы внутрь термохимической реакции. Как она начинается? Что способствует её осуществлению? В качестве примера приведём ещё раз две реакции (14) и (2):
С(графит) + О2 = СО2 + 393,3 кДж
СаСО3 = СаО + СО2 (-Q)
Представим себе, что химическими символами (С) и (О2) будут обозначаться не элемент «углерод» и простое вещество «кислород», а дрова (или уголь, торф) и воздух (атмосфера). А в качестве соединения СаСО3 — не карбонат кальция, а известное всем вещество: мел (или известняк). Первую реакцию будем проводить для того, чтобы нагреть печь и вскипятить чайник, а вторую – чтобы получить негашёную известь (СаО) в дальнейшем используемую для побелки садовых деревьев. Для разжигания печи приготовим щепки и, поместив сверху них дрова, зажжём огонь спичками.
Во втором случае, поместим в металлическое ведро мелко накрошенный мел, поставим на плиту и такими же действиями, как в случае разжигания огня в печи, разведём костёр под ведром.
Стоп! Тут что-то не так! Ведь мы установили, что первая реакция экзотермическая, протекает с выделением теплоты, а вторая реакция – эндотермическая, протекает с поглощением теплоты. А мы в обоих случаях разводим огонь, т.е. передаём этим процессам извне тепловую энергию. Значит, обе реакции эндотермические – идут с поглощением теплоты! Да, идут с поглощением теплоты, но это только на первом этапе. Некоторым экзотермическим реакциям требуется небольшой «толчок» — первоначальная подача энергии, а спустя некоторое время, когда загорятся дрова, процесс будет сопровождаться с выделением энергии в окружающую среду и во многие сотни, тысячи раз превзойдёт по величине первоначальное значение этой энергии. А второй процесс ка был так и останется эндотермическим. Ведь с прекращением подачи тепловой энергии мел перестанет разлагаться: реакция остановится. И всё-таки, почему в одних случаях процесс окисления (горения) является экзотермическим, а в других – эндотермическим процессом? И что является движущей силой эндотермических реакций, в ходе которых тепловая энергия поступает из окружающей среды? Ни у кого не вызывает удивление такое явление, как остывание со временем горячего чайника. Это нормально. А почему бы этому же чайнику, уже остывшему, холодному, взять, да и нагреться самому по себе? Вот это уже вызовет удивление.
Так вот, эта самая сила связана со стремлением любой системы к наиболее вероятному состоянию, характеризующимся максимальным беспорядком, называемым энтропией. Это одно из важнейших понятий в термодинамике. Энтропия обозначается символом «S». К примеру, при экзотермических реакциях, при проведении процессов плавления, кипения, переходов из жидкостей к газообразному состоянию, энтропия приобретает максимальное значение, поскольку при тепловых явлениях кинетическая энергия атомов, молекул, ионов возрастает, усиливаются беспорядочные колебания этих частиц. И наоборот, самый большой порядок в химических системах – в идеальном кристалле при температуре абсолютного нуля. Энтропия в данном случае равна нулю
Энтропия имеет численные значения, единицей её измерения является Дж/(моль . К); К примеру энтропия алмаза равна 2,4 Дж/(моль . К), пропана – 269,9 Дж/(моль . К). Энтропия газов значительно превышает энтропию жидких и тем более твёрдых тел. Поскольку в газообразных веществах постоянно происходит беспорядочное распределение молекул по всему объёму.
Существуют экспериментальные и теоретические методы определения энтропий различных химических соединений. Используя их, можно количественно рассчитать изменения энтропии при протекании конкретной реакции аналогично тому, как это делается для теплового эффекта реакции. Составлены специальные справочные данные, которые включают сравнительную характеристику этих величин с учётом температуры.
Подтянуть знания по химии можно записавшись на урок к онлайн-репетиторам TutorOnline
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.