Физический смысл этих уравнений состоит в том, что количество ядер 1 убывает за счет их распада, а количество ядер 2 пополняется за счет распада ядер 1 и убывает за счет своего распада. Например, в начальный момент времени t = 0 имеется N01 ядер 1 и N02 ядер 2. С такими начальными условиями решение системы имеет вид:
Система (3.13) значительно упрощается, если T1 >> T2 (λ1 −λt и (1 − e −λt ). При этом ввиду особых свойств функции e −λt очень удобно ординаты кривой строить для значений t, соответствующих T, 2T, … и т.д. (см. таблицу 3.1). Соотношение (3.13.3) и рисунок 3.2 показывают, что количество радиоактивного дочернего вещества возрастает с течением времени и при t >> T2 (λ2t >> 1) приближается к своему предельному значению:
Из таблицы 3.1 видно, что при t > 10T равенство (3.14) выполняется уже с точностью около 0.1%. Обычно оно записывается в форме:
и носит название векового , или секулярного равновесия . Физический смысл векового уравнения очевиден.
 |
λ1N1 = λ2N2, |
| t | e −λt | 1 − e −λt |
| 0 | 1 | 0 |
| 1T | 1/2 = 0.5 | 0.5 |
| 2T | (1/2) 2 = 0.25 | 0.75 |
| 3T | (1/2) 3 = 0.125 | 0.875 |
| . | . | . |
| 10T | (1/2) 10 ≈ 0.001 |
0.999 |
 Рисунок 3.3. Сложный радиоактивный распад. Рисунок 3.3. Сложный радиоактивный распад. |
Так как, согласно уравнению (3.4), λN равно числу распадов в единицу времени, то соотношение λ1N1 = λ2N2 означает, что число распадов дочернего вещества λ2N2 равно числу распадов материнского вещества, т.е. числу образующихся при этом ядер дочернего вещества λ1N1. Вековое уравнение широко используется для определения периодов полураспада долгоживущих радиоактивных веществ. Этим уравнением можно пользоваться при сравнении двух взаимно превращающихся веществ, из которых второе имеет много меньший период полураспада, чем первое (T2 > T2 (T2 226 , испуская с периодом полураспада T1 >> 1600 лет α-частицы, превращается в радиоактивный газ радон (88Rn 222 ), который сам является радиоактивным и испускает α-частицы с периодом полураспада T2 ≈ 3.8 дня. В этом примере как раз T1 >> T2, так что для моментов времени t |
Для дальнейшего упрощения надо, чтобы начальное количество ядер Rn было равно нулю (N02 = 0 при t = 0). Это достигается специальной постановкой опыта, в котором изучается процесс превращения Ra в Rn. В этом опыте препарат Ra помещается в стеклянную колбочку с трубкой, соединенной с насосом. Во время работы насоса выделяющийся газообразный Rn сразу же откачивается, и концентрация его в колбочке равна нулю. Если в некоторый момент при работающем насосе изолировать колбочку от насоса, то с этого момента, который можно принять за t = 0, количество ядер Rn в колбочке начнет возрастать по закону (3.13.3):
Выбирая TRn или
Это условие означает, что с некоторого достаточно большого t (t >> TRn) количество распадающихся ядер Rn равно количеству ядер Rn, возникающих при распаде Ra. Например, при t > 40 дней (t > 10TRn) соотношение (3.17) выполняется с точностью 0.1%.
Три величины из четырех, входящих в равенство (3.17) могут быть измерены непосредственно: NRa и NRn – точным взвешиванием, а λRn – по определению периода полураспада Rn, который имеет удобное для измерений значение 3.8 дня. Таким образом, четвертая величина λRa может быть вычислена. Это вычисление дает для периода полураспада радия TRa ≈ 1600 лет, что совпадает с результатами определения TRa методом абсолютного счета испускаемых α-частиц.
Радиоактивность Ra и Rn была выбрана в качестве эталона при сравнении активностей различных радиоактивных веществ. За единицу радиоактивности – 1 Ки – приняли активность 1 г радия или находящегося с ним в равновесии количества радона. Последнее легко может быть найдено из следующих рассуждений.
Известно, что 1 г радия претерпевает в секунду
3.7∙10 10 распадов. Следовательно:
 |
λRnNRn = λRaNRa = 3.7∙10 10 , |
NRa – число ядер Ra в 1 г, NRn – число ядер Rn, находящихся в равновесии с 1 г радия.
Отсюда:
Чтобы найти весовое выражение NRnнадо вычислить количество ядер Rn в 1 г:
Химия
ОСНОВЫ ТЕОРЕТИЧЕСКОЙ ХИМИИ
3. Строение атома
Ядро атома и радиоактивные превращения. В настоящее время в ядре атома открыто большое число элементарных частиц. Важнейшими из них являются протоны (символ p ) и нейтроны (символ n ). Обе эти частицы рассматриваются как два различных состояния ядерной частицы нуклона. Элементарные частицы характеризуются определенной массой и зарядом. Протон обладает массой 1,0073 а.е.м. и зарядом +1. Масса нейтрона равна 1,0087 а.е.м., а его заряд — нулю (частица электрически нейтральна). Можно сказать, что массы протона и нейтрона почти одинаковы.
Вскоре после открытия нейтрона , была создана протонно-нейтронная теорию строения ядра. Согласно этой теории ядра всех атомов, кроме ядра атома водорода, состоят из Z протонов (А — Z) нейтронов, где Z — порядковый номер элемента, А — массовое число.
Массовое число А указывает суммарное число протонов Z и нейтронов N в ядре атома, т.е.
Силы, удерживающие протоны и нейтроны в ядре, называются ядерными. Это чрезвычайно большие силы, действующие на очень коротких расстояниях (порядка 10 -15 м) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика. В ядре сосредоточена почти вся масса атома. Массой электронов по сравнению с массой ядра можно практически пренебречь. Свойства ядра определяются главным образом числом протонов и нейтронов, т.е. составом ядра. Состав ядер атомов различных химических элементов не одинаков, а потому элементы отличаются по атомной массе. И поскольку в состав ядра входят протоны, ядро заряжено положительно. Так как заряд ядра численно равен порядковому номеру элемента Z , то он определяет число электронов в электронной оболочке атома и ее строение, а тем самым и свойства химического элемента. Поэтому положительный заряд ядра, а не атомная масса является главной характеристикой атома, а значит, и элемента.
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Изотопы. Исследования показали, что в природе существуют атомы одного и того же элемента с разной массой. Так, встречаются атомы хлора с массой 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов.
Атомы одного и того же элемента, имеющие разную массу (массовое число), называют изотопами. Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с массовым числом 12 записывается так: 12 6 С, или 12 С, или словами: “углерод-12”. Эта форма записи распространена и на элементарные частицы: электрон 0 1 е, нейтрон 1 0 n, протон 1 1 p или 1 1 Н, нейтрино 0 0 n . Изотопы известны для всех химических элементов.
Обычно изотопы различных элементов не имеют специальных названий. Единственным исключением является водород, изотопы которого имеют специальные химические символы и названия: 1 H — протий, 2 D — дейтерий, 3 T — тритий. Это связано с тем, что относительное отличие масс изотопов для водорода является максимальным среди всех химических элементов.
Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом их распространенности.
Так, например, природный хлор состоит из 75,4% изотопа с массовым числом 35 и из 24,6% изотопа с массовым числом 37; средняя атомная масса хлора 35,453. Средняя атомная масса природного лития, содержащего 92,7% 7 3 Li и 7,3% 6 3 Li равна 6,94 и т.д. Атомные массы элементов, приводимые в периодической системе Д. И. Менделеева, есть средние массовые числа природных смесей изотопов. Это одна из причин, почему они отличаются от целочисленные значений. Наряду с термином “изотопы” используется термин “нуклид”. Нуклид — это атом со строго определенным значением массового числа, т.е. с фиксированным значением числа протонов и нейтронов в ядре. Радиоактивный нуклид сокращенно называют радионуклид. Термин “изотопы” следует применять только для обозначения стабильных и радиоактивных нуклидов одного элемента.
Устойчивые и неустойчивые изотопы. Все изотопы подразделяются на стабильные и радиоактивные. Стабильные изотопы не подвергаются радиоактивному распаду, поэтому они и сохраняются в природных условиях. Примерами стабильных изотопов являются 16 О, 12 С, 19 F. Большинство природных элементов состоит из смеси двух или большего числа стабильных изотопов. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов). В редких случаях, например у алюминия, в природе встречается только один стабильный изотоп, а остальные изотопы неустойчивы.
Радиоактивные изотопы подразделяются, в свою очередь, на естественные и искусственные — и те и другие самопроизвольно распадаются, испуская при этом a — или b -частипы до тех пор, пока не образуется стабильный изотоп. Химические свойства всех изотопов в основном одинаковы. Эти свойства определяются главным образом зарядом ядра, а не его массой.
С помощью ядерных реакций получают изотопы, обладающие радиоактивностью (радиоактивные изотопы). Все они неустойчивы и в результате радиоактивного распада превращаются в изотопы других элементов.
Радиоактивные изотопы получены для всех химических элементов. Их известно около 1500. Элементы, состоящие только из радиоактивных изотопов, называются радиоактивными. Это элементы с Z = 43, 61 и 84 — 107.
Стабильных (нерадиоактивных) изотопов известно около 300. Из них состоит большинство химических элементов периодической системы элементов Д.И. Менделеева. У некоторых элементов наряду со стабильными имеются и долгоживущие радиоактивные изотопы. Это 40 19 K, 87 37 Rb, 115 49 In и др.
По химическим свойствам радиоактивные изотопы почти не отличаются от стабильных. Поэтому они служат в качестве “меченых” атомов, позволяющих по измерению их радиоактивности следить за поведением всех атомов данного элемента и за их передвижением. Радиоактивные изотопы широко применяются в научных исследованиях, в промышленности, сельском хозяйстве, медицине, биологии и химии. В настоящее время их получают в больших количествах.
Виды радиоактивного распада. Существует три основных вида самопроизвольных ядерных превращений.
1. a — распад. Ядро испускает a — частицу, которая представляет собой ядро атома гелия 4 Не и состоит из двух протонов и двух нейтронов. При a — распаде массовое число изотопа уменьшается на 4, а заряд ядра — на 2 :
2. b -распад. В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электрон ( b -частицу) и антинейтрино:
При b -распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1:
3. g -распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и очень высокой частотой ( g -излучение), при этом энергия ядра уменьшается, массовое число и заряд ядра остаются неизменными.
Радиоактивные превращения . Ядерные реакции — это превращение атомных ядер в результате их взаимодействия с элементарными частицами и друг с другом. Написание уравнений таких реакций основано на законах сохранения массы и заряда. Это означает, что сумма масс и сумма зарядов в левой части уравнения должна быть равна сумме масс и сумме зарядов в правой части уравнения :
Это уравнение показывает, что при взаимодействии атома алюминия с 
Более употребительна краткая запись ядерных реакций. Вначале записывают химический знак исходного ядра, затем (в скобках) кратко обозначают частицу, вызвавшую реакцию, и частицу, образовавшуюся в результате реакции, после чего ставят химический знак конечного ядра. При этом у символов исходного и конечного ядер обычно проставляются только массовые числа, так как заряды ядер легко определять по периодической системе элементов Д.И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая:
где a — обозначение a -частицы ( 4 2 Не); р — протона ( 1 1 Н); черточка означает отсутствие действующей частицы в случае радиоактивного распада.
Важнейшей особенностью ядерных реакций является выделение огромного количества энергии в форме кинетической энергии образующихся частиц или в форме энергии излучения. В химических реакциях энергия выделяется главным образом в форме теплоты. Энергия ядерных реакций превышает энергию химических реакций в миллионы раз. Этим объясняется неразрушимость ядер атомов при протекании химических реакций.
Скорость радиоактивного распада. Период полураспада. Скорости распада радиоактивных элементов сильно отличаются от одного элемента к другому и не зависят от внешних условий, таких, например, как температура (в этом состоит важное отличие ядерных реакций от обычных химических превращений). Каждый радиоактивный элемент характеризуется периодом полураспада t 1/2 , т. е. временем, за которое самопроизвольно распадается половина атомов исходного вещества. Для разных элементов период полураспада имеет сильно отличающиеся значения. Так, для урана 238 U период полураспада t 1/2 = 4,5 × 10 9 лет. Именно поэтому активность урана в течение нескольких лет заметно не меняется. Для радия 226 Ra период полураспада t 1/2 = 1600 лет, поэтому и активность радия больше, чем урана. Ясно, что чем меньше период полураспада, тем быстрее протекает радиоактивный распад. Для разных элементов период полураспада может изменяться от миллионных долей секунды до миллиардов лет.
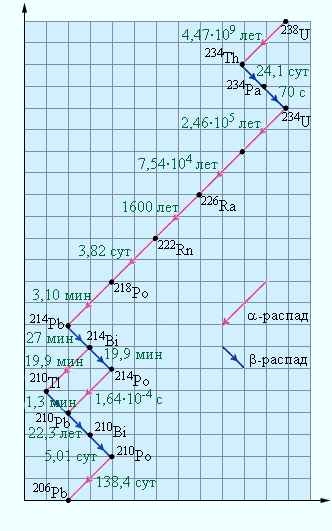
На примере естественного распада урана 238 U показаны превращения, которые через промежуточные радиоактивные элементы приводят к устойчивому элементу — свинцу 206 Р b . Схема хорошо иллюстрирует различие в периодах полураспада t 1/2 для различных элементов (периоды полураспада даны внизу под стрелкой, частицы, испускаемые радиоактивными элементами, — над стрелкой).
Уравнение радиоактивного распада. Математическое уравнение, описывающее закон радиоактивного распада, связывает значение массы m(t) радиоактивного изотопа в момент времени t с начальной массой m 0 :
Кроме приведенного на рисунке естественного ряда радиоактивных элементов (так называемого ряда урана), известны еще два других естественных ряда — это ряд актиния, начинающийся с 235 U и заканчивающийся 208 Р b , и ряд тория, начинающийся с 232 Т h и заканчивающийся 208 Р b . Существует еще и четвертый ряд радиоактивных изотопов, этот ряд получен искусственно.
Искусственные превращения , ядерный синтез. Первая искусственная ядерная реакция была осуществлена Резерфордом путем бомбардировки атомов азота a частицами :
В настоящее время, чтобы осуществить искусственные превращения, чаще используют протоны или нейтроны, например:
В ядерных реакциях (в случае естественного или искусственного превращения элементов) сумма атомных масс (сумма индексов слева вверху) реагентов и продуктов всегда одинакова. Это относится и к зарядам ядер (индексы слева внизу, которые часто опускаются).
В 1930 г. был создан первый в мире циклотрон (ускоритель элементарных частиц — “снарядов” для бомбардировки ядер атомов), после чего было открыто и изучено множество разнообразных ядерных реакций. В настоящее время специальная область химии, ядерная химия, занимается изучением превращений элементов.
Особую важность представлял синтез неизвестных ранее элементов: технеция, франция, астата и др., а также всех трансурановых элементов (элементов, порядковый номер которых превышает 92). В настоящее время получено 17 трансурановых элементов (от Z = 93 до Z = 109 включительно). Работы в этой области проводятся в Объединенном институте ядерных исследований в г. Дубне. Там впервые были синтезированы элементы с порядковыми номерами 102, 103, 104, 105, 106, 107. Ведутся работы по синтезу элементов с более тяжелыми ядрами.
Радиоактивность
Известно 2500 атомных ядер, и 90 % из них являются нестабильными.
Радиоактивность – это способность нестабильных ядер превращаться в другие ядра с испусканием частиц.
Большие ядра получают нестабильность, как результат конкурирования притяжения нуклонов ядерными силами и кулоновского отталкивания протонов. Стабильных ядер с зарядовым числом Z > 83 и массовым числом A > 209 не существует. Однако радиоактивными свойствами могут обладать ядра атомов со значимо меньшими значениями чисел Z и A . Когда в составе ядра количество протонов существенно превышает число нейтронов, нестабильность объясняется излишком энергии кулоновского взаимодействия. Если же ядро содержит больше нейтронов, оно становится нестабильным, как следствие факта, что масса нейтрона больше массы протона. Если увеличивается масса ядра, растет и его энергия.
Явление радиоактивности открыл физик А.Беккерель в 1896 году: было обнаружено, что соли урана испускают неизвестное излучение, имеющее способность проходить сквозь препятствия и вызывать почернение фотоэмульсии. А спустя пару лет физики М. и П. Кюри зафиксировали радиоактивность тория и открыли два новых радиоактивных элемента – полоний Po 84 210 и радий Ra 88 226 .
В дальнейшем за изучение природы радиоактивных излучений принимались многие ученые, например, Э. Резерфорд со своими учениками. Было обнаружено, что радиоактивные ядра способны испускать три вида частиц: положительно заряженные, отрицательно заряженные и нейтральные.
α -, β — и γ -излучения – это излучения, на которые способны радиоактивные ядра (соответственно заряженное положительно, отрицательно и нейтрально).
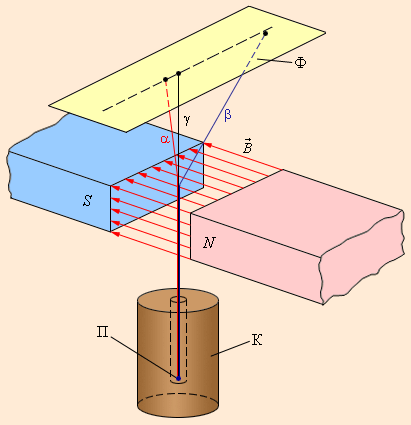
Рис. 6 . 7 . 1 отображает схему опыта, результатом которого стало обнаружение сложного состава радиоактивного излучения. В магнитном поле α — и β -лучи отклоняются в противоположных друг другу направлениях (отклонение β -лучей значимо больше); γ -лучи в магнитном поле вообще не получают отклонения.
Рисунок 6 . 7 . 1 . Схема эксперимента по обнаружению α -, β — и γ -излучений. К – свинцовый контейнер, П – радиоактивный препарат, Ф – фотопластинка, B → – магнитное поле.
Обнаруженные учеными три типа радиоактивных излучений имеют существенные отличия друг от друга в отношении способности ионизировать атомы вещества, а значит и по проникающей способности. Наименьшая проникающая способность характерна для α -излучения. В воздушной среде при нормальных условиях α -лучи проходят путь в несколько сантиметров. β -лучи, в свою очередь, менее поглощаемы веществом. Они имеют возможность проходить сквозь слой алюминия толщиной в несколько м м . Наконец, наибольшая проникающая способность принадлежит γ -лучам, имеющим способность проникать через слой свинца толщиной 5 – 10 с м .
В 20 -х годах XX века, после того, как Э. Резерфорд открыл ядерное строение атомов, появилось твердое утверждение, что радиоактивность является свойством атомных ядер. В ходе изучения было определено, что α -лучи есть поток α -частиц – ядер гелия He 2 4 , β -лучи представляют собой поток электронов, а γ -лучи — это коротковолновое электромагнитное излучение при очень малой длине волны λ 10 – 10 м и, как следствие, ярко выраженных корпускулярных свойствах (эти лучи есть поток частиц – γ -квантов).
Рассмотрим подробнее существующие виды радиоактивного распада.
Альфа-распад
Альфа-распад – это самопроизвольное преобразование атомного ядра с числом протонов Z и нейтронов N в иное (дочернее) ядро, в котором содержится число протонов Z – 2 и нейтронов N – 2 , сопровождающееся испусканием α -частицы – ядра атома гелия He 2 4 .
Образцом альфа-распада может служить α -распад радия:
Ra 88 226 → Rn 86 222 + He 2 4
α -частицы, которые испускают ядра атомов радия, Резерфорд применял, проводя экспериментальное рассеивание на ядрах тяжелых элементов. Измерение по кривизне траектории в магнитном поле установило скорость α -частиц, испускаемых при α -распаде ядер радия: порядка 1 , 5 · 10 7 м / с . Размер кинетической энергии при этом — примерно 7 , 5 · 10 – 13 Д ж (около 4 , 8 М э В ). Эта величина несложно определяется, когда известны значения масс материнского и дочернего ядер и ядра гелия. Скорость испускаемой α -частицы очень велика, однако она равна лишь 5 % от скорости света, т.е. в расчетах допустимо использовать нерелятивистское выражение для кинетической энергии.
Также результатом исследований стал факт, что радиоактивное вещество способно испускать
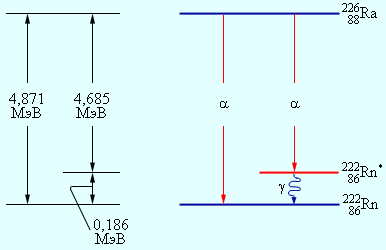
α -частицы с несколькими дискретными значениями энергий. Объяснение этому явлению заключается в способности ядер находиться, аналогично атомам, в различных возбужденных состояниях. В одном из таких состояний может оказаться дочернее ядро при α -распаде. Далее ядро переходит в основное состояние, и испускается γ -квант. Схема α -распада радия с испусканием α -частиц с двумя значениями кинетических энергий указана на рис. 6 . 7 . 2 .
Рисунок 6 . 7 . 2 . Энергетическая диаграмма α -распада ядер радия. Продемонстрировано возбужденное состояние ядра радона Rn * 86 222 . При переходе из возбужденного состояния ядра радона в основное происходит излучение γ -кванта с энергией 0 , 186 М э В .
Итак, α -распад ядра во множестве случаев происходит совместно с γ -излучением.
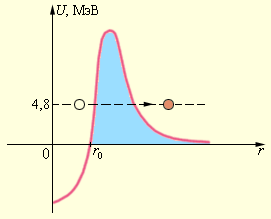
Теория α -распада также содержит предположение о возможном образовании ядер групп, включающих в себя два протона и два нейтрона, т. е. α -частицу. Материнское ядро служит для
α -частиц потенциальной ямой, ограниченной потенциальным барьером. Количество энергии
α -частицы в ядре не хватает, чтобы преодолеть данный барьер (рис. 6 . 7 . 3 ).
Испускание α -частицы из ядра возможно лишь благодаря такому квантово-механическому явлению, как туннельный эффект.
Квантовая механика гласит, что существует неравная нулю вероятность прохождения частицы под потенциальным барьером. Явление туннелирования носит вероятностный характер.
Рисунок 6 . 7 . 3 . Туннелирование α -частицы сквозь потенциальный барьер.
Бета-распад
В процессе бета-распада ядро испускает электрон. Вообще существование в ядре электрона невозможно, т.е. появление электрона – лишь результат β -распада, сопровождающегося превращением нейтрона в протон. Такой процесс происходит как внутри ядра, так и со свободными нейтронами. Среднее время жизни свободного нейтрона равно примерно 15 минутам. При радиоактивном распаде нейтрон n 0 1 превращается в протон p 1 1 и электрон e — 1 0 .
В результате измерений было выявлено, что при бета-распаде наблюдается кажущееся нарушение закона сохранения энергии, поскольку суммарно энергия протона и электрона, появившихся при распаде нейтрона, меньше энергии нейтрона. В 1931 году В. Паули предположил выделение при распаде нейтрона еще одной частицы с нулевыми значениями массы и заряда, уносящей с собой часть энергии.
Нейтрино (маленький нейтрон) – частица с нулевыми значениями массы и заряда, возникающая при распаде нейтрона. Была открыта в 1953 году.
Нейтрино плохо взаимодействует с атомами вещества, поскольку не обладает зарядом и массой, и вследствие этого ее обнаружение в ходе эксперимента очень затруднительно. Ионизирующая способность нейтрино является настолько малой, что один акт ионизации в воздухе приходится приблизительно на 500 к м пути. На данный момент известно, что существует несколько типов нейтрино.
Электронный антинейтрино – частица, возникающая вследствие распада нейтрона и обозначаемая v e
Запись реакции распада нейтрона выглядит так:
n 0 1 → p 1 1 + e — 1 0 + v e
Те же явления происходят внутри ядер при β -распаде. При распаде одного их ядерных нейтронов образуется электрон, сразу же выбрасываемый из «родительского дома» (ядра) с очень большой скоростью, отличающейся от скорости света на небольшую долю процента. Поскольку распределение энергии, выделяющейся при β -распаде, между электроном, нейтрино и дочерним ядром имеет случайный характер, β -электроны способны обладать разными скоростями в широком интервале значений.
β -распад сопровождается увеличением зарядового числа Z на единицу при неизменности массового числа A . Дочернее ядро в данном случае есть ядро одного из изотопов элемента, чей атомный номер в периодической системе Менделеева на единицу превышает атомный номер исходного ядра. В качестве характерного примера β -распада можно рассмотреть преобразование изотона тория
Th 90 234 , возникающего при α -распаде урана U 92 238 , в протактиний Pa 91 234 :
Th 90 234 → Pa 91 234 + e — 1 0 + v e
Совместно с электронным β -распадом было определено такое явление, как позитронный β + -распад: ядро испускает позитрон e + 1 0 и нейтрино v e 0 0 .
Позитрон является частицей-двойником электрона, отличающейся от него лишь знаком заряда.
Существование позитрона предсказывалось еще в 1928 г. великим физиком П. Дираком. Спустя несколько лет позитрон обнаружили, как составляющую космических лучей. Позитроны возникают в результате реакции преобразования протона в нейтрон по следующей схеме:
p 1 1 → n 0 1 + e 1 0 + v e 0 0
Гамма-распад
В отличие от α — и β -радиоактивности, γ -радиоактивность ядер не имеет связи с изменением внутренней структуры ядра, а также при гамма-распаде не изменяется зарядовое или массовое число. При α — или β -распаде дочернее ядро способно войти в некоторое возбужденное состояние и получить излишнюю энергию. Переход ядра из возбужденного состояния в основное происходит совместно с испусканием одного или более γ -квантов, чья энергия способна достигать уровня нескольких М э В .
Закон радиоактивного распада
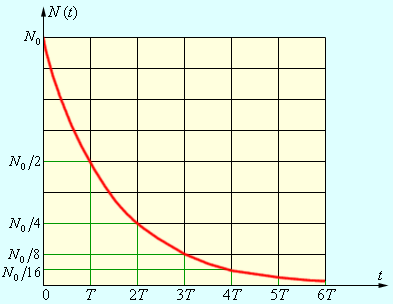
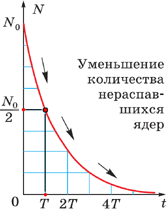
Любой образец радиоактивного вещества имеет в своем составе множество радиоактивных атомов. Поскольку для процесса радиоактивного распада характерна случайность, не зависящая от внешних условий, то закономерность в убывании количества N ( t ) нераспавшихся к данному моменту времени t ядер становится важнейшей статистической характеристикой процесса радиоактивного распада.
Допустим, число нераспавшихся ядер N ( t ) изменилось на Δ N 0 в течение небольшого промежутка времени Δ t . Поскольку вероятность распада каждого ядра неизменна во времени, то количество распадов пропорционально количеству ядер N ( t ) и промежутку времени Δ t :
Коэффициент пропорциональности λ – это вероятность распада ядра за время Δ t = 1 с .
Это выражение означает, что скорость d N d t изменения функции N ( t ) прямо пропорциональна самой функции.
Такая зависимость имеет место во многих физических процессах (к примеру, при разряде конденсатора через резистор). Решение этого уравнения дает возможность записать экспоненциальный закон:
N ( t ) = N 0 e – λ t
Здесь N 0 является начальным числом радиоактивных ядер при t = 0 .
Среднее время жизни радиоактивного ядра, обозначаемое, как τ , и равное: τ = 1 λ — это время, за которое количество нераспавшихся ядер уменьшается в e ≈ 2 , 7 раза.
В целях практического применения закон радиоактивного распада оптимально записать в ином виде, беря за основание число 2 , а не e :
N ( t ) = N 0 · 2 – t T .
Период полураспада, обозначаемый, как Т , – это время, за которое произойдет распад 1 2 первоначального количества радиоактивных ядер.
Величины τ и Т связаны друг с другом соотношением:
T = 1 λ ln 2 = τ ln 2 = 0 , 693 τ
Рисунок 6 . 7 . 4 дает представление о законе радиоактивного распада.
Рисунок 6 . 7 . 4 . Закон радиоактивного распада.
Период полураспада является основной величиной, описывающей скорость радиоактивного распада. Чем меньше Т , тем интенсивность распада выше. Например, для урана T ≈ 4 , 5 млрд лет, а для радия период полураспада составляет примерно 1600 лет: таким образом, активность радия во много раз больше, чем активность урана. Существуют радиоактивные элементы с периодом полураспада в доли секунды.
При α — и β -радиоактивном распаде дочернее ядро тоже может стать нестабильным. Т.е. допустимы серии последовательных радиоактивных распадов, заканчивающихся тем, что образуются стабильные ядра. В природе существует несколько подобных серий. Самая длинная серия — серия
U 92 238 , включающая в себя 14 последовательных распадов ( 8 α -распадов и 6 β -распадов). Эта серия заканчивается стабильным изотопом свинца Pb 82 206 (рис. 6 . 7 . 5 ).
Рисунок 6 . 7 . 5 . Схема распада радиоактивной серии U 92 238 с указанием периодов полураспада.
Известно еще несколько радиоактивных серий, подобных серии U 92 238 . Существует последовательность от нептуния Np 93 237 (не обнаруженного в естественных условиях) до висмута Bi 83 209 . Эта серия радиоактивных распадов характерна для ядерных реакторов.
Радиоактивность была интересным образом использована в методе, который используется для датирования археологических и геологических находок. Датирование производится на основании концентрации радиоактивных изотопов. Чаще применяют радиоуглеродный метод датирования. Нестабильный изотоп углерода C 6 14 появляется в атмосфере в результате ядерных реакций, которые вызываются космическими лучами. Малый процент этого изотопа имеется в воздухе совместно с обычным стабильным изотопом C 6 12 . Растения и прочие организмы потребляют углерод из воздуха, накапливая оба изотопа в такой же пропорции, что и в воздушной среде. Растение гибнет и, естественно, перестает потреблять углерод, тогда нестабильный изотоп в результате β -распада постепенно превращается в азот N 7 14 с периодом полураспада 5730 лет. Точным измерением относительной концентрации радиоактивного углерода C 6 14 в останках древних организмов возможно установить время их гибели.
Радиоактивное излучение всех типов (альфа, бета, гамма, нейтроны), а также электромагнитная радиация (рентгеновское излучение) оказывают сильнейшее биологическое воздействие на живые организмы. Это воздействие включает в себя процессы возбуждения и ионизации атомов и молекул, составляющих живые клеток. Воздействуя на клетки, ионизирующая радиация разрушает сложные молекулы и клеточные структуры, следствием чего является лучевое поражение организма, а потому крайне важны меры радиационной защиты людей, работающих с неким источником радиации и имеющим шанс попасть в зону действия излучения.
Серьезность проблемы в том, что человек может испытать на себе действие ионизирующей радиации и в бытовых условиях. Особую опасность для здоровья человека представляет инертный, бесцветный, радиоактивный газ радон Rn 86 222 . Схема, изображенная на рисунке 6 . 7 . 5 , демонстрирует, что радон — продукт α -распада радия с периодом полураспада T = 3 , 82 сут. Радий в небольших количествах содержится в почве, в камнях, в разного рода строительных конструкциях. Концентрация радона имеет относительно небольшое время жизни, но постоянно пополняется в результате новых распадов ядер радия, поэтому радон может накапливаться в закрытых помещениях. Попав в легкие, радон испускает α -частицы и преобразуется в полоний Po 84 218 , не являющийся химически инертным. Далее происходит цепь радиоактивных преобразований серии урана (рис. 6 . 7 . 5 ). По данным Американской комиссии радиационной безопасности и контроля, человек в среднем получает 55 % ионизирующей радиации за счет радона и только 11 % за счет медицинских процедур. Доля космических лучей здесь — около 8 % . Общая доза облучения, получаемая человеком за жизнь, много меньше предельно допустимой дозы (ПДД), установленной для людей некоторых профессий, которые подвергаются дополнительному облучению ионизирующей радиацией.
источники:
http://bobych.ru/lection/himiya/uch_chem_osnteorhim03.html
http://zaochnik.com/spravochnik/fizika/atomy-jadra/radioaktivnost/
Основными характеристиками ядра являются
заряд и его атомный вес. Обозначим через
Zзаряд ядра, равный
порядковому номеру таблицы Менделеева;
атомный вес – через А, т.к. атомные веса
элементов имеют дробные значения, то
их округляют до целочисленных значений.
Целая часть атомного веса элемента
называется массовым числом М.
Первоначально имеющееся ядро обозначается
символом Х – «материнское» ядро;
получающееся ядро в результате распада
Y– «дочернее» ядро.
Тогда ядро записывается:
Пример: ядро водорода –;
ядро гелия –
;
ядро рубидия –
;
электрон –
.
Последовательная цепь радиоактивных
превращений и образование новых веществ
приводит к образованию радиоактивных
семейств. В настоящее время известны
несколько семейств: 238U,235U,232Thи232Np.
Правила, позволяющие определить
принадлежность ядра-продукта по типу
радиоактивности, называются правилами
смещения.
|
Правила |
|
Выражаемые этими правилами изменения
химических свойств при радиоактивном
распаде полностью подтверждены на
опыте.
Рассмотрим в качестве примера семейство
урана:
|
|
Уран и торий имеют от всех других то
отличие, что их продукты распада в свою
очередь являются радиоактивными и
образуют цепочку до 14-15 звеньев, а
конечный итог – ядро свинца
.
Если внимательно рассмотреть ядра
элементов (при рассмотрении цепочки),
то можно видеть, что, например:
а) ядра одного и того же химического
элемента Pbимеют разные
массовые числа: 214, 210, 206;
б) ядра разных химических элементов
имеют одинаковые массовые числа М:
,
,
.
В первом случае ядра одного элемента
называются изотопами элемента.
Во втором случае ядра разных элементов
называются изобарами.
|
За единицу измерения |
Почти все вещества (элементы) имеют
изотопы:
Олово – 11; Pb– 8;Hg– 3 и т.д. Массы атомов изотопов, выраженные
в а.е.м. являются целочисленными (до
сотых долей).
Пример:
|
Атомный номер |
Химический элемент |
Изотопы |
Атомный вес, а.е.м. |
|
1 |
Водород |
|
1,008985 2,014735 3,017005 |
|
2 |
Гелий |
|
3,016986 4,003873 |
|
6 |
Углерод |
|
12,003803 13,007478 |
|
8 |
Кислород |
|
16,00000 17,004534 18,004855 |
Отсюда вывод: атомные ядра изотопов
всех элементов построены из одних и тех
же частиц.
III.Закон радиоактивного распада.
Теперь рассмотрим вопрос – как быстро
протекает распад ядер?
Этот распад – статистический и для
отдельно взятого ядра можно лишь указать
вероятность распада за данное время.
Закономерность распада большого числа
ядер вскрывается через случайность
распада каждого из них.
Найдем вид основного уравнения
радиоактивного распада. Пусть N– наличное количество атомов радиоактивного
вещества. За времяdtколичество распавшихся атомов –dN– величина, на которую уменьшилосьN.
ПричемdNdtиN, т.е.
dN = –·N·dt,
где – постоянная
радиоактивного распада (постоянная –
т. к. свойства ядер со временем не
меняются);
« – » – указывает на уменьшение Nв процессе распада.
|
Дифференциальный |
|
Величина
–активность препарата– число
распадов за единицу времени.
[а] = 1 Кюри = 3,71010расп/с (беккерель – Бк).
Уравнение (1) применимо, когда dNN.
При dt= 1:– физический смысл
Постоянная равна
вероятности распада одного ядра за
единицу времени.
Интегрируя (2), получим:

где N0– начальное
число распадающихся атомов (t= 0).
|
Основное |
|
Представим этот закон графически (это
экспонента).
|
|
За Т.к. m = N·m1, где m1– масса отдельного атома. |
|
Интегральный |
|
Интегральный закон радиоактивного
распада показывает, какое количество
вещества остаётся не распавшимся через
время t, после начала
наблюдения процесса.
Из основного уравнения радиоактивного
распада (3) можно рассчитать количество
вещества остается не распавшегося за
время t, после начала
наблюдения процесса:
ΔN=N0–N=N0–N0·e—λt=N0·(1 –e—λt)
(5)
– средняя продолжительность жизни
данного радиоактивного элемента –
характеризует скорость распада (дляRa= 2540 лет).
Из уравнения (4), когда t=T, тоm= ½m0или ½ = е—T
λ·Т = ln2 или(6)
Чем меньше T, тем более
радиоактивно вещество.
Примеры: период полураспада4,5109лет;
1,391010лет.
Уже миллиарды лет на Земле идет распад
радиоактивных элементов. Причем
распадаются не только «материнские»,
но и «дочерние» элементы (но периоды
распада разные). Определим равновесное
количество данного радиоактивного
вещества B, возникающего
из «материнского» А:
убыль ядер А: –dN1=λ1·N1·dt;
убыль ядер А = прибыли ядер В;
прибыль ядер В: (dN2)
=λ1·N1·dt;
теперь В само распадается: (–dN2)
=λ2·N2·dt
Равновесие будет, когда убыль и прибыль
станут равны, т.е.
(dN2) = (–dN2)
илиλ1·N1·dt=λ2·N2·dt
и т.д. (7)
|
Данное соотношение |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Появление «ручных» сцинтилляционных счетчиков и, главным образом, счётчиков Гейгера–Мюллера, которые помогли автоматизировать подсчёты частиц (см. § 15-е), привело физиков к важному выводу. Любой радиоактивный изотоп характеризуется самопроизвольным ослабеванием радиоактивности, выражающимся в уменьшении количества распадающихся ядер в единицу времени.
Построение графиков активности различных радиоактивных изотопов приводило учёных к одной и той же зависимости, выражающейся показательной функцией (см. график). По горизонтальной оси отложено время наблюдения, а по вертикальной – количество нераспавшихся ядер. Кривизна линий могла быть различной, однако сама функция, которой выражались описываемые графиками зависимости, оставалась одной и той же:
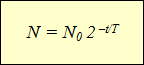 |
N – количество нераспавшихся ядер N0 – начальное количество ядер t – время наблюдения, с T – период полураспада, с |
Эта формула выражает закон радиоактивного распада: количество нераспавшихся с течением времени ядер определяется как произведение начального количества ядер на 2 в степени, равной отношению времени наблюдения к периоду полураспада, взятой с отрицательным знаком.
Как выяснилось в ходе опытов, различные радиоактивные вещества можно охарактеризовать различным периодом полураспада – временем, за которое количество ещё нераспавшихся ядер уменьшается вдвое (см. таблицу).
| Йод-129 | 15 млн лет | Углерод-14 | 5,7 тыс лет | |
| Йод-131 | 8 дней | Уран-235 | 0,7 млрд лет | |
| Йод-135 | 7 часов | Уран-238 | 4,5 млрд лет |
Период полураспада – общепринятая физическая величина, характеризующая скорость радиоактивного распада. Многочисленные опыты показывают, что даже при очень длительном наблюдении за радиоактивным веществом его период полураспада постоянен, то есть не зависит от числа уже распавшихся атомов. Поэтому закон радиоактивного распада нашёл применение в методе определения возраста археологических и геологических находок.
Метод радиоуглеродного анализа. Углерод – очень распространённый на Земле химический элемент, в состав которого входят стабильные изотопы углерод-12, углерод-13 и радиоактивный изотоп углерод-14, период полураспада которого составляет 5,7 тысяч лет (см. таблицу). Живые организмы, потребляя пищу, накапливают в своих тканях все три изотопа. После прекращения жизни организма поступление углерода прекращается, и с течением времени его содержание убывает естественным путём, за счёт радиоактивного распада. Поскольку распадается только углерод-14, с течением веков и тысячелетий изменяется соотношение изотопов углерода в ископаемых останках живых организмов. Измерив эту «углеродную пропорцию», можно судить о возрасте археологической находки.
Метод радиоуглеродного анализа применим и для геологических пород, а также для ископаемых предметов быта человека, но при условии, что соотношение изотопов в образце не было нарушено за время его существования, например, пожаром или действием сильного источника радиации. Неучёт подобных причин сразу после открытия этого метода приводил к ошибкам на несколько веков и тысячелетий. Сегодня применяются «вековые калибровочные шкалы» для изотопа углерода-14, исходя из его распределения в долгоживущих деревьях (например, в американской тысячелетней секвойе). Их возраст можно подсчитать весьма точно – по годовым кольцам древесины.
Предел применения метода радиоуглеродного анализа в начале XXI века составлял 60 000 лет. Для измерения возраста более древних образцов, например горных пород или метеоритов, используют аналогичный метод, но вместо углерода наблюдают за изотопами урана или других элементов в зависимости от происхождения исследуемого образца.