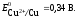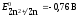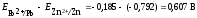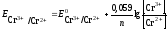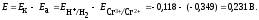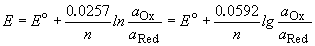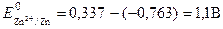Гальванический элемент. Схема гальванического элемента. Токообразующая реакция. Эдс гальванического элемента
Самопроизвольно
идущий окислительно-восстановительный
процесс в определенных условиях может
создавать электрическую энергию.
Процессы превращения химической энергии
в электрическую можно использовать для
создания химических источников тока
(ХИТ), простейший из которых гальванический
элемент.
Гальванический
элемент состоит из двух электродов,
погруженных в электролиты, которые
замыкаются электролитическим ключом.
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ
Металлический
электрод — это металл, погруженный в
раствор собственной соли, не является
инертным, а участвует в электродной
реакции. Cхематично
такой электрод записывают в виде Ме|Меn+,
где вертикальная черта обозначает
границу между металлом и раствором.
Уравнение
Нернста для металлических электродов
имеет вид
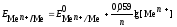
где

моль/л.
Окислительно-восстановительный
(редокс-)
электрод – это инертный металл
(токоподвод), погруженный в электролит,
содержащий одновременно окисленную и
восстановленную формы потенциалопределяющих
частиц. В качестве инертного металла
чаще всего используют платину Pt.
Схематично такой электрод можно записать
в виде Pt│Men+,
Mem+.
На поверхности инертного металла
протекает окислительно-восстановительная
реакция. Например, для
окислительно-восстановительного
электрода Pt│Sn4+,
Sn2+
такими
реакциями могут быть: Sn2+
— 2 ē
→ Sn4+;
Sn4+
+ 2 ē
→ Sn2+
Уравнение Нернста
для редокс- систем включает концентрацию
обоих катионов и имеет вид

где [окисл], [восст]
– концентрации окисленной и восстановленной
форм потенциалопределяющих частиц в
полуреакции.
19
Газовые
электроды состоят из инертного металла,
который находится в одновременном
контакте с газом и раствором, содержащим
ионы этого газа. Представителями газовых
электродов являются водородный,
кислородный, хлорный и другие электроды.
Водородный
электрод
состоит из платиновой пластинки, покрытой
слоем мелкодисперсной платины
(«платиновой черни») и погруженной
в раствор кислоты, содержащий ионы
водорода. Через раствор непрерывно
пропускается поток водорода, водород
адсорбируется на поверхности платины,
и на границе электрод/раствор
устанавливается равновесие:
H+(раствор)
+ ē
↔ ½ H2
(г)
.
При давлении
водорода, равном 101,3 кПа (1 атм), активности
(концентрации) ионов водорода 1 моль/л
и Т=298К
водородный электрод называется
стандартным водородным электродом.
Потенциал такого электрода принимается
за ноль.
Уравнение Нернста
для водородного электрода имеет вид

(6)
где

стандартный электродный потенциал,
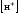
ионов водорода в растворе, моль/л

давление водорода над раствором, атм.
равно 1 атм.
Рассмотрим работу
гальванического элемента на примере
элемента Даниэля-Якоби. Он представляет
собой два сосуда с 1М растворами CuSO4
и ZnSO4,
в которые погружены соответственно
медная и цинковая пластинки, соединенные
проводом. Сосуды соединены между собой
трубкой, которая называется солевым
мостиком, заполненной раствором
электролита (например, KCl). Солевой мостик
является электролитическим ключом.
Электрод с меньшим
значением потенциала заряжается
отрицательно, является анодом. Электрод
с большим значением потенциала заряжается
положительно, является катодом. На
аноде протекает процесс окисления
(отдача электронов),
на катоде – процесс восстановления
(присоединение электронов).
20
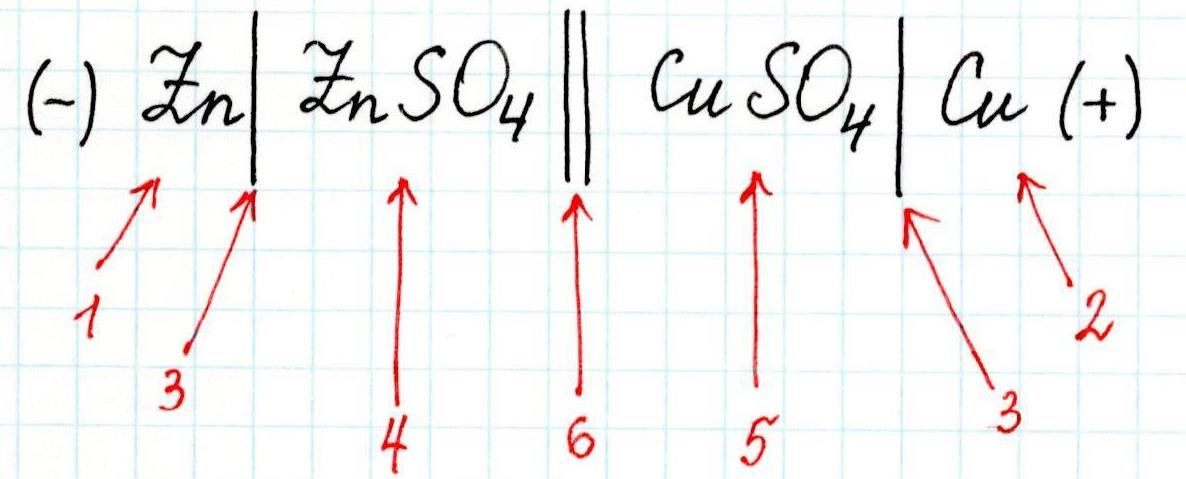
Гальванические
элементы принято записывать в виде
схем. Анод со знаком (-) записывают слева,
катод со знаком (+) записывают справа.
Например, схема медно-цинкового
гальванического элемента Даниэля-Якоби
может быть представлена таким образом:
ē
ē
(-) Zn|ZnSO4||CuSO4|Cu
(+) или (-) Zn|Zn2+||Cu2+|Cu
(+)
Одна вертикальная
черта на схеме обозначает границу между
металлом и раствором электролита, две
черты – границу между растворами
(солевой мостик).
При замыкании цепи
электроны по внешней цепи пойдут от
анода к катоду – от цинка к меди. При
этом на электродах протекают следующие
реакции:
(-) Анод: Zn
– 2
ē → Zn2+
реакция окисления
(+) Катод: Cu2+
+ 2
ē →Cu
реакция восстановления
Суммируя процессы
на катоде и аноде, получаем уравнение
окислительно-восстановительной реакции,
за счет которой в гальваническом элементе
возникает электрический ток:
Zn
+ Cu2+
= Zn2+
+ Cu
Такое уравнение
называется уравнением токообразующей
реакции.
ЭДС гальванического
элемента рассчитывают как разность
потенциалов катода и анода: Е
= Ек
– Еа.
Если концентрация
ионов в растворе составляет 1 моль/л,
то ЭДС называется стандартной. Стандартная
ЭДС медно-цинкового элемента при
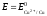
Пример
7. Рассчитайте
ЭДС свинцово-цинкового гальванического
элемента при
Т = 298К, в
котором [Zn2+]=0,1моль/л
и [Pb2+]=0,01моль/л.
Укажите знаки полюсов, напишите уравнения
электродных процессов, составьте схему
гальванического элемента. Укажите
направление движения электронов при
замыкании цепи.
Решение:
ЭДС гальванического элемента
рассчитывают как разность
21
равновесных
потенциалов катода и анода: Е=
Ек
– Еа.
Поскольку
концентрации потенциалопределяющих
ионов отличаются от 1 моль/л, рассчитаем
по уравнению Нернста (ур. 4) значения
электродных потенциалов цинка и свинца:
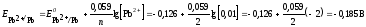
с меньшим значением потенциала является
анодом (цинковый электрод). На нем
протекает реакция окисления:
(-) А: Zn
– 2
ē → Zn2+
Электрод с большим
значением потенциала является катодом
(свинцовый электрод), на нем протекает
реакция восстановления:
(+) К: Pb2+
+ 2
ē → Pb
Уравнение
токообразующей реакции: Zn
+ Pb2+
→ Zn2+
+ Pb.
Схема гальванического
элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb
(+).
Рассчитываем ЭДС
гальванического элемента:
Е=
Ек
– Еа
=
При замыкании
цепи, электроны во внешней цепи пойдут
от отрицательно заряженного электрода
к положительно заряженному электроду,
то есть — от цинка к свинцу.
Пример
8. Для
гальванического элемента
Pt│Cr3+
(0,1 моль/л),
Cr2+(0,01
моль/л)║Н+(рН=2)│Н2,
Pt
рассчитать
ЭДС, написать уравнения электродных
процессов, составить уравнение
токообразующей реакции, указать знаки
полюсов. Определить направление движения
электронов во внешней цепи.
Решение:
данный гальванический элемент составлен
из окислительно-
восстановительного
и водородного электродов.
Потенциал
окислительно-восстановительного
электрода рассчитываем по уравнению
Нернста:
22
Стандартный
потенциал пары Сr3+/Cr2+

Подставив данные условия задачи,
рассчитаем потенциал
окислительно-восстановительного
электрода:
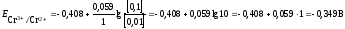
Второй электрод
данного гальванического элемента
является водородным электродом. Потенциал
его, согласно уравнению Нернста:
Определяем
катод и анод. Поскольку
окислительно-восстановительный электрод
имеет меньший потенциал, то в гальваническом
элементе он будет играть роль анода
(отрицательный полюс), а водородный
электрод – катода (положительный полюс).
После замыкания цепи на первом электроде
будет протекать анодный процесс
окисления, на втором – катодный процесс
восстановления:
(-) А : Cr2+
— ē
→ Cr3+
2
(+) К: 2 Н+
+ 2
ē → Н2
Суммарная
токообразующая реакция описывается
уравнением
2 Cr2+
+ 2 Н+
→ 2 Cr3+
+ Н2
Электроны при
замыкании внешней цепи будут двигаться
от отрицательного полюса к положительному:
от хромового окислительно-восстановительного
электрода к водородному.
ЭДС
данного элемента
Пример
9. Какие
процессы протекают на электродах в
концентрационном гальваническом
элементе, имеющем цинковые электроды,
если у одного из электродов концентрация
ионов цинка Zn2+
равна 1 моль/л, а у другого –
0,0001
моль/л? Какова ЭДС этого элемента?
Напишите схему данного ГЭ.
Решение:
Концентрационный гальванический элемент
состоит из одинаковых электродов,
погруженных в растворы своих солей
различной концентрации. Определим
потенциалы обоих электродов. Так как
концентрация ионов цинка
23
у первого электрода
равна 1 моль/л, то потенциал его будет
равен стандартному потенциалу цинкового
электрода:
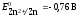
Потенциал второго
электрода рассчитаем по уравнению
Нернста:
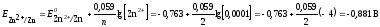
является катодом, на нем после замыкания
цепи протекает реакция восстановления
(+) К: Zn2+
+ 2
ē →Zn
Второй
электрод, имеющий меньший потенциал,
будет анодом, на нем протекает реакция
окисления: (-) А: Zn
— 2
ē →Zn2+
Токообразующая
реакция в гальваническом элементе будет
иметь вид:
Zn
+ Zn2+→
Zn
+ Zn2+
Рассчитываем ЭДС
элемента: Е
= Ек
— Еа
= — 0,763 –(-0,881) = 0,122 В.
Данный
гальванический элемент можно отобразить
схемой:
(-) Zn│Zn2+(0,0001
моль/л)║Zn2+(1
моль/л)│Zn
(+)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Уравнения электродных процессов и токообразующих реакций для гальванических элементов
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
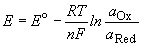
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
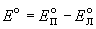
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
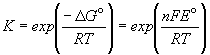
Константа равновесия реакции, протекающей в элементе Даниэля, равна
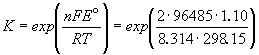
Зная температурный коэффициент ЭДС 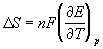




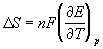
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
Электрод
Электродная реакция
E o , ВLi + /LiLi + + e = Li-3.045K + /KK + + e = K-2.925Ba 2+ /BaBa 2+ + 2e = Ba-2.906Ca 2+ /CaCa 2+ + 2e = Ca-2.866Na + /NaNa + + e = Na-2.714La 3+ /LaLa 3+ + 3e = La-2.522Mg 2+ /MgMg 2+ + 2e = Mg-2.363Be 2+ /BeBe 2+ + 2e = Be-1.847A1 3+ /A1Al 3+ + 3e = Al-1.662Ti 2+ /TiTi 2+ + 2e = Ti-1.628Zr 4+ /ZrZr 4+ + 4e = Zr-1.529V 2+ /VV 2+ + 2e = V-1.186Mn 2+ /MnMn 2+ + 2e = Mn-1.180WO4 2- /WWO4 2- + 4H2O + 6e = W + 8OH —-1.05Se 2- /SeSe + 2e = Se 2—0.77Zn 2+ /ZnZn 2+ + 2e = Zn-0.763Cr 3+ /CrCr 3+ + 3e = Cr-0.744Ga 3+ /GaGa 3+ + 3e = Ga-0.529S 2- /SS + 2e = S 2—0.51Fe 2+ /FeFe 2+ + 2e = Fe-0.440Cr 3+ ,Cr 2+ /PtCr 3+ + e = Cr 2+-0.408Cd 2+ /CdCd 2+ + 2e = Cd-0.403Ti 3+ , Ti 2+ /PtTi 3+ + e = Ti 2+-0.369Tl + /TlTl + + e = Tl-0.3363Co 2+ /CoCo 2+ + 2e = Co-0.277Ni 2+ /NiNi 2+ + 2e = Ni-0.250Mo 3+ /MoMo 3+ + 3e = Mo-0.20Sn 2+ /SnSn 2+ + 2e = Sn-0.136Pb 2+ /PbPb 2+ + 2e = Pb-0.126Ti 4+ , Ti 3+ /PtTi 4+ +e = Ti 3+-0.04D + /D2, PtD + + e = 1 /2 D2-0.0034H + /H2, PtH + + e = 1 /2 H20.000Ge 2+ /GeGe 2+ + 2e = Ge+0.01Br — /AgBr/AgAgBr + e = Ag + Br —+0.0732Sn 4+ , Sn 2+ /PtSn 4+ + 2e = Sn 2++0.15Cu 2+ , Cu + /PtCu 2+ + e = Cu ++0.153Cu 2+ /CuCu 2+ + 2e = Cu+0.337Fe(CN)6 4- , Fe(CN)6 3- /PtFe(CN)6 3- + e = Fe(CN)6 4-+0.36OH — /O2, Ptl /2 O2 + H2O + 2e = 2OH —+0.401Cu + /CuCu + + e = Cu+0.521J — /J2, PtJ2 + 2e = 2J —+0.5355Te 4+ /TeTe 4+ + 4e = Te+0.56MnO4 — , MnO4 2- /PtMnO4 — + e = MnO4 2-+0.564Rh 2+ /RhRh 2+ /Rh+0.60Fe 3+ , Fe 2+ /PtFe 3+ + e = Fe 2++0.771Hg2 2+ /HgHg2 2+ + 2e = 2Hg+0.788Ag + /AgAg + + e = Ag+0.7991Hg 2+ /HgHg 2+ + 2e = Hg+0.854Hg 2+ , Hg + /PtHg 2+ + e = Hg ++0.91Pd 2+ /PdPd 2+ + 2e = Pd+0.987Br — /Br2, PtBr2 + 2e = 2Br —+1.0652Pt 2+ /PtPt 2+ + 2e = Pt+1.2Mn 2+ , H + /MnO2, PtMnO2 + 4H + + 2e = Mn 2+ + 2H2O+1.23Cr 3+ , Cr2O7 2- , H + /PtCr2O7 2- + 14H + + 6e = 2Cr 3+ + 7H2O+1.33Tl 3+ , Tl + /PtTl 3+ + 2e = Tl ++1.25Cl — /Cl2, PtCl2 + 2e = 2Cl —+1.3595Pb 2+ , H + /PbO2, PtPbO2 + 4H + + 2e = Pb 2+ + 2H2O+1.455Au 3+ /AuAu 3+ + 3e = Au+1.498MnO4 — , H + /MnO2, PtMnO4 — + 4H + + 3e = MnO2 + 2H2O+1.695Ce 4+ , Ce 3+ /PtCe 4+ + e = Ce 3++1.61SO4 2- ,H + /PbSO4, PbO2, PbPbO2 + SO4 2- + 4H + + 2e =
PbSO4 + 2H2O+1.682Au + /AuAu + + e = Au+1.691H — /H2, PtH2 + 2e = 2H —+2.2F — /F2, PtF2 + 2e = 2F —+2.87
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
откуда E o = +0.153 В.
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 
Ag | AgBr| Br — || Ag + | Ag
Правый электрод: Ag + + e = Ag E o = 0.7792 В
Левый электрод: AgBr + e = Ag + Br — E o = 0.0732 В
Общая реакция: Ag + + Br — = AgBr E o = 0.7260 В

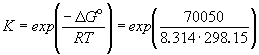
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 



Отсюда, полагая 

Пример 12-3. 

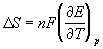



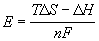
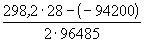
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 

Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
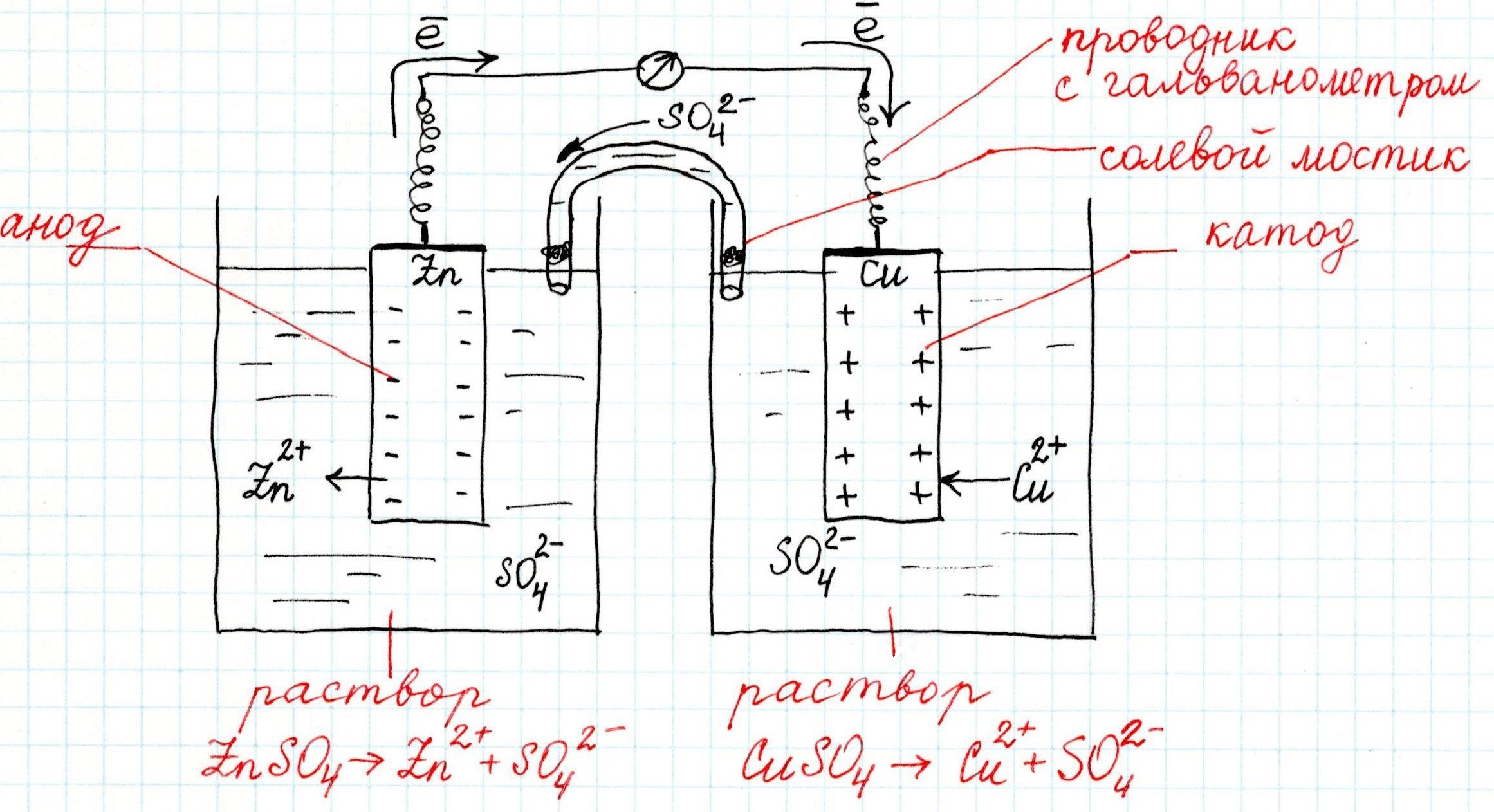
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
источники:
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-elektrodnye-processy-galvanicheskij-element.html
http://himzadacha.ru/sxema-raboty-galvanicheskogo-elementa-i-tipovye-zadachi/
И электродные реакции для некоторых металлов
| Электрод | Электродная реакция | j o , В | Электрод | Электродная реакция | j o , В |
| Li + /Li | Li + + ē = Li | –3,045 | Cd 2+ /Cd | Cd 2+ + 2ē = Cd | –0,403 |
| Rb + /Rb | Rb + + ē = Rb | –2,925 | Co 2+ /Co | Co 2+ + 2ē = Co | –0,277 |
| K + /K | K + + ē = K | –2,924 | Ni 2+ /Ni | Ni 2+ + 2ē = Ni | –0,250 |
| Cs + /Cs | Cs + + ē = Cs | –2,923 | Sn 2+ /Sn | Sn 2+ + 2ē = Sn | –0,136 |
| Ba 2+ /Ba | Ba 2+ + 2ē = Ba | –2,906 | Pb 2+ /Pb | Pb 2+ + 2ē = Pb | –0,126 |
| Ca 2+ /Ca | Ca 2+ + 2ē = Ca | –2,866 | Fe 3+ /Fe | Fe 3+ + 3ē = Fe | –0,036 |
| Na + /Na | Na + + ē = Na | –2,714 | 2H + /H2 | 2H + + 2ē = H2 | 0,000 |
| Mg 2+ /Mg | Mg 2+ + 2ē = Mg | –2,363 | Bi 3+ /Bi | Bi 3+ + 3ē = Bi | +0,215 |
| A1 3+ /A1 | Al 3+ + 3ē = Al | –1,662 | Cu 2+ /Cu | Cu 2+ + 2ē = Cu | +0,337 |
| Ti 2+ /Ti | Ti 2+ + 2ē = Ti | –1,628 | Ag + /Ag | Ag + + ē = Ag | +0,799 |
| Mn 2+ /Mn | Mn 2+ + 2ē = Mn | –1,180 | Hg 2+ /Hg | Hg 2+ + 2ē = Hg | +0,854 |
| Zn 2+ /Zn | Zn 2+ + 2ē = Zn | –0,763 | Pt 2+ /Pt | Pt 2+ + 2ē = Pt | +1,190 |
| Cr 3+ /Cr | Cr 3+ + 3ē = Cr | –0,744 | Au 3+ /Au | Au 3+ + 3ē = Au | +1,498 |
| Fe 2+ /Fe | Fe 2+ + 2ē = Fe | –0,440 | Au + /Au | Au + + ē = Au | +1,691 |
Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы. Каждый металл способен вытеснять из растворов солей только те металлы, которые имеют большее значение электродного потенциала – более активный металл замещает менее активный.
Последовательность металлов в ряду напряжений сохраняется только для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1моль/л. При других концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j 0 + 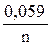
где j 0 − стандартный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе (моль/л).
Если два электрода, погруженные в растворы электролитов, соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементаминазывают устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля – Якоби, схема которого (–) Zn | ZnSO4 || CuSO4 |Cu (+) отражает систему обозначений для гальванических элементов. Слева записывается анод Zn | Zn 2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2ē = Zn 2+ . Справа – катод Cu 2+ | Cu – электрод, имеющий большее значение электродного потенциала, положительный полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu 2+ + 2ē = Cu. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В случае элемента Даниэля – Якоби токообразующая реакция имеет вид Cu 2+ + Zn = Cu + Zn 2+ .
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой(ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода: E = j к – j а
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода:E 0 = j 0 к– j 0 а Так, для элемента Даниэля – Якоби стандартная ЭДС равна: E 0 = j 0 Сu 2+ /Cu – j 0 Zn 2+ /Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае DG 0 х.р. 0 = – nE 0 F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E 0 – стандартная ЭДС.
Гальванический элемент, состоящий из двух электродов одного и того же металла, погруженных в растворы его соли разной концентрации, представляет собой концентрационный элемент. В этом случае электрод, погруженный в раствор электролита с меньшей концентрацией ионов металла, будет анодом. В качестве катода будет выступать электрод, опущенный в электролит с большей концентрацией ионов металла.
Пример 12.1.Определить ЭДС концентрационного серебряного элемента с концентрациями ионов серебра, равными 10 –1 моль/л у одного электрода и
10 –4 моль/л у другого при 298 К.
Решение.Схема такого гальванического элемента Ag½Ag + ||Ag + ½Ag. По уравнению Нернста рассчитываем потенциалы двух серебряных электродов.
Для первого электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -1 = 0,799 + 0,059×(–1) = 0,74 В
Для второго электрода:
j Ag + /Ag = j 0 Ag + /Ag + 0,059 lg10 -4 = 0,799 + 0,059×(–4) = 0,563 В
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле:
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 12.2. Рассчитать ЭДС элемента Cd½Cd 2+ || Ni 2+ ½Ni при концентрации ионов Cd 2+ и Ni 2+ , равных соответственно 0,1 и 0,001 моль/л.
Решение.Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы кадмия и никеля:
j Сd 2+ /Cd = j 0 Сd 2+ /Cd + 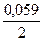
j Ni 2+ /Ni = j 0 Ni 2+ /Ni + 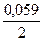
Так как j Сd 2+ /Cd 2+ /Ni , то токообразующей в этом гальваническом элементе является реакция Cd 0 + Ni 2+ = Cd 2+ + Ni 0 . Рассчитываем ЭДС элемента E = j Ni 2+ /Ni – j Сd 2+ /Cd = -0,2795 — (-0,4915) = 0,212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и DG 0 х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb 2+ + Ti = Pb + Ti 2+ . Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом: (–) Ti½Ti 2+ || Pb 2+ ½Pb (+). Уравнения электродных реакций имеют вид:
на аноде: Ti 0 – 2ē ® Ti 2+
на катоде: Pb 2+ + 2ē ® Pb 0
Рассчитываем стандартное значение ЭДС:
Энергию Гиббса рассчитываем по уравнению DG 0 = –nE 0 F=
–2×1,502×96500 = –289,9 кДж. Так как DG 0 2+ + Zn = Cu + Zn 2+
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn 2+ . Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 12.5.Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение.Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий (–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс: Zn – 2ē = Zn 2+
Катодный процесс: в кислом растворе 2Н + + 2ē ® Н2
во влажном воздухе О2 + 2Н2О + 4ē ® 4ОН –
Схема образующегося гальванического элемента во влажном воздухе:
Схема образующегося гальванического элемента в кислом растворе:
Во влажном воздухе ионы Zn 2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn 2+ .
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (НС1)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Решение.По положению в ряду напряжений металлов видно, что хром более активный металл (j 0 Сr 3+ /Cr = –0,744 В), чем медь (j 0 Сu 2+ /Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из НС1.
Анодный процесс: Cr –3ē = Cr 3+
Катодный процесс в кислой среде: 2Н + + 2ē ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr 3+ образуют с хлорид-анионами (из НС1) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
Задачи
№ 12.1. а) Чему равна величина ЭДС гальванического элемента, составленного из стандартных цинкового и серебряного электродов, погруженных в растворы их солей? Привести схему гальванического элемента и реакции, протекающие на электродах при его работе. (Ответ: 1,562 В).
б) Возможна ли электрохимическая коррозия алюминия, контактирующего со свинцом в нейтральном водном растворе, содержащем растворенный кислород? Если да, то написать уравнения реакций анодного и катодного процессов. Составить схему образующегося гальванического элемента.
№ 12.2. а) Чему равна величина ЭДС цинкового концентрационного элемента, составленного из двух цинковых электродов, опущенных в растворы с концентрациями ионов Zn 2+ , равными 10 –2 и 10 –6 моль/л? Привести схему такого элемента и реакции, протекающие на электродах при его работе.
б) Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составить уравнения анодного и катодного процессов. Привести схемы образующихся гальванических элементов.
№ 12.3. а) Имеется гальванический элемент, в котором протекает токообразующая реакция Ni + Cu 2+ = Cu + Ni 2+ . Привести схему такого элемента, написать уравнения электродных процессов.
б) Изделие из алюминия склепано с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду (НСl)? Составить уравнения происходящих при этом процессов, привести схему образующегося гальванического элемента. Определить продукты коррозии.
№ 12.4. а) Составить схему, написать уравнения токообразующей и электродных реакций для гальванического элемента, у которого один из электродов кобальтовый (СCо 2+ = 10 –1 моль/л), а другой – стандартный водородный. Рассчитать ЭДС элемента при 298 К. Как изменится ЭДС, если концентрация ионов Со 2+ уменьшить в 10 раз? (Ответ: 0,307 В; 0,336 В).
б) Составить уравнения анодного и катодного процессов при коррозии пары магний – свинец в кислой среде и во влажном воздухе. Какие продукты коррозии образуются в первом и во втором случаях?
№ 12.5. а)Каково значение ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в растворы солей этих металлов с концентрациями их ионов 1 моль/л? Изменится или нет ЭДС этого элемента и почему, если концентрации ионов металлов будут составлять 0.001 моль/л? Составить уравнения электродных и токообразующей реакций. Привести схему гальванического элемента. (Ответ: 0,463 В).
б) Привести по одному примеру катодного и анодного покрытия для кобальта. Составить уравнения катодных и анодных процессов во влажном воздухе и в растворе соляной кислоты при нарушении целостности покрытия.
№ 12.6. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС концентрационного гальванического элемента, состоящего из медных электродов, опущенных в растворы СuSO4 с концентрациями 0,01 и 0,1 моль/л. (Ответ: 0,0295 В).
б)К какому типу покрытий относятся олово на меди и на железе? Какие процессы будут протекать при атмосферной коррозии указанных пар в нейтральной среде? Написатьуравнения катодных и анодных реакций.
№ 12.7. а)После нахождения в растворах каких из приведенных солей масса кадмиевой пластинки увеличится или уменьшится: а) MgCl2; б) Hg(NO3)2;
в) CuSO4; г) AgNO3; д) CaCl2? Ответ обосновать
б) Медное изделие покрыли серебром. К какому типу относится такое покрытие – к анодному или катодному? Составить уравнения электродных процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Привести схемы образующихся при этом гальванических элементов.
№ 12.8. а) Составить схему, привести уравнения электродных процессов и вычислить ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, которые опущены в растворы своих солей с концентрацией ионов Pb 2+ и Mg 2+ , равных 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить в 100 раз? Ответ обосновать. (Ответ: 2,237 В).
б) В воду, содержащую растворенный кислород, опустили никелевую пластинку и никелевую пластинку, частично покрытую медью. В каком случае процесс коррозии никеля происходит интенсивнее? Почему? Составить уравнения анодного и катодного процессов для пластинки покрытой медью.
№ 12.9. а)В два сосуда с голубым раствором сульфата меди поместили в первый хромовую пластинку, а во второй платиновую. В каком сосуде цвет раствора постепенно исчезает? Почему? Составить электронные и молекулярные уравнения соответствующих реакций.
б) Какой металл целесообразнее выбрать для протекторной защиты железного изделия: цинк, никель или кобальт? Почему? Составить уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.10. а) Составить схемы двух гальванических элементов, в одном из которых оловянная пластинка была бы катодом, а в другом анодом. Написать для каждого из этих элементов уравнения электродных (катодных и анодных) процессов и токообразующих реакций.
б) Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия при атмосферной коррозии? Какое это покрытие катодное или анодное? Составить схему процессов, происходящих на электродах образующегося гальванического элемента.
№ 12.11. а) Составить схему гальванического элемента, в основе работы которого лежит реакция: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Написать уравнения электродных (катодных и анодных) процессов. Вычислить ЭДС этого элемента, если СNi 2+ = 0,01 моль/л, а СPb 2+ = 0,0001 моль/л. (Ответ: 0,065 В).
б) Рассчитать энергию Гиббса реакции
и определить, какой из металлов – магний или медь, интенсивнее будет корродировать во влажном воздухе. Стандартные энергии Гиббса образования D¦G 0 Mg(OH)2, Cu(OH)2, H2O (ж) соответственно равны –833,7; –356,9; –237,3 кДж/моль.
№ 12.12. а) Вычислить электродный потенциал цинка в растворе ZnCl2, в котором концентрация Zn 2+ составляет 0,1 моль/л. Как изменится значение потенциала при разбавлении раствора в 100 раз? (Ответ: –0,79 В; –0,85 В).
б) Какой из металлов – алюминий или золото, будет подвергаться коррозии во влажном воздухе по уравнению: 4Ме + 6Н2О (ж) + 3О2 = 4Ме(ОН)3.
Ответ обосновать, рассчитав энергию Гиббса реакции. Стандартные энергии Гиббса образования D¦G 0 Al(OH)3, Au(OH)3, H2O (ж) соответственно равны
–1139,7; –289,9; –237,3 кДж/моль.
№ 12.13. а) Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. Исходя из величин стандартных электродных потенциалов, рассчитать значения Е 0 и DG 0 . Определить направление протекания токообразующей реакции. (Ответ: 0,473 В; –91,3 кДж).
б)Какие из перечисленных металлов могут быть использованы для протекторной защиты железного изделия в присутствии электролита, содержащего растворенный кислород в нейтральной среде: алюминий, хром, серебро, кадмий? Привести уравнения анодного и катодного процессов атмосферной коррозии таких изделий. Каков состав продуктов коррозии?
№ 12.14. а) Составить схему гальванического элемента, образованного железом и свинцом, погруженными в растворы их солей с концентрациями ионов металлов 0,01 моль/л. Рассчитать ЭДС. (Ответ: 0,314 В).
б) Изделие из хрома спаяно свинцом. Какой из металлов будет корродировать при попадании такого изделия в кислотную среду (НСl)? Привести уравнения анодного и катодного процессов и образующиеся продукты коррозии.
№ 12.15. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и определить, будет ли работать гальванический элемент, в котором на электродах протекают реакции:
(Ответ: –0,98 В; +189,1 кДж).
б) Составить уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого серебром, во влажном воздухе и в кислой среде. Определить тип покрытия – анодное или катодное? Какие продукты образуются в результате коррозии?
№ 12.16. а) Исходя из величин стандартных электродных потенциалов, рассчитать значения ЭДС и DG 0 и сделать вывод о возможности протекания реакции в прямом направлении: Cu + 2Ag + 
(Ответ: 0,462 В; –89,2 кДж).
б) Какие металлы могут быть использованы в качестве анодного покрытия сплава Zn – Cd? Привести уравнения анодного и катодного процессов при коррозии такого сплава во влажном воздухе в отсутствие анодного покрытия.
№ 12.17. а) Как изменится масса хромовой пластинки после нахождения в растворах солей: а) CuSO4; б) MgCl2; в) AgNO3; г) CaCl2? Ответ обосновать.
б) Привести уравнения анодного и катодного процессов при коррозии сплава Fe – Sn во влажном воздухе и в кислой среде. Определить продукты коррозии.
№ 12.18. а) Составить схемы двух гальванических элементов, в одном из которых цинк – отрицательный электрод, а в другом – положительный. Привести уравнения токообразующих реакций и электродных процессов.
б) Привести уравнения анодного и катодного процессов, происходящих при коррозии сплава Al – Ni в атмосфере влажного воздуха и в кислой среде (НС1). Определить продукты коррозии.
№ 12.19. а) Электродные потенциалы железа и серебра соответственно равны –0,44 и +0,799 В. Какая реакция самопроизвольно протекает в железо-серебряном гальваническом элементе?
Fe 0 + 2Ag + = Fe 2+ + 2Ag 0 или 2Ag 0 + Fe 2+ = Fe 0 + 2Ag +
Ответ обосновать, рассчитав энергию Гиббса каждой из приведенных реакций.
б) Хромовую пластинку и пластинку из хрома, частично покрытую серебром, поместили в раствор соляной кислоты. В каком случае процесс коррозии хрома протекает более интенсивно? Почему? Привести уравнения соответствующих процессов.
№ 12.20. а) Вычислить ЭДС гальванического элемента, состоящего из водородного электрода, опущенного в чистую воду, и оловянного электрода, опущенного в раствор с концентрацией ионов олова (II) 1 моль/л. (Ответ: 0,16 В).
б) Составить уравнения самопроизвольно протекающих реакций при атмосферной коррозии цинка и олова, находящихся в контакте. Привести схему образующегося гальванического элемента.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ. ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент.
Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом.
Металлический электрод — это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Ме n + , где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид

где 
Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Me n + , Me m + . На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn 4+ , Sn 2+ такими реакциями могут быть: Sn 2+ — 2 ē → Sn 4+ ; Sn 4+ + 2 ē → Sn 2+
Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид

где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции.
Газовыеэлектроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды.
Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины («платиновой черни») и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие:
При давлении водорода, равном 101,3 кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль.
Уравнение Нернста для водородного электрода имеет вид

где 


Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом.
Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления
(отдача электронов), на катоде – процесс восстановления (присоединение электронов).
Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом:






Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик).
При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции:
(-) Анод: Zn – 2 ē → Zn 2+ реакция окисления
(+) Катод: Cu 2+ + 2 ē →Cu реакция восстановления
Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток:
Zn + Cu 2+ = Zn 2+ + Cu
Такое уравнение называется уравнением токообразующей реакции.
ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек– Еа.
Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при 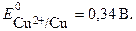


Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn 2+ ]=0,1моль/л и [Pb 2+ ]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи.
Решение: ЭДС гальванического элемента рассчитывают как разность
равновесных потенциалов катода и анода: Е= Ек – Еа.
Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца:

(-) А: Zn – 2 ē → Zn 2+
Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления:
(+) К: Pb 2+ + 2 ē → Pb
Уравнение токообразующей реакции: Zn + Pb 2+ → Zn 2+ + Pb.
Схема гальванического элемента: (-) Zn│Zn 2+ (0,1M)║Pb 2+ (0,01M)│Pb (+).
Рассчитываем ЭДС гальванического элемента:
Е= Ек – Еа =
При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть — от цинка к свинцу.
Пример 8. Для гальванического элемента
Pt│Cr 3+ (0,1 моль/л), Cr 2+ (0,01 моль/л)║Н + (рН=2)│Н2, Pt
рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи.
Решение: данный гальванический элемент составлен из окислительно-
восстановительного и водородного электродов.
Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста:
Стандартный потенциал пары Сr 3+ /Cr 2+ 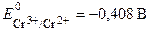

Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста:
Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления:

Суммарная токообразующая реакция описывается уравнением
2 Cr 2+ + 2 Н + → 2 Cr 3+ + Н2
Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному.
ЭДС данного элемента
Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn 2+ равна 1 моль/л, а у другого –
0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ.
Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка
у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: 
Потенциал второго электрода рассчитаем по уравнению Нернста:

Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn — 2 ē →Zn 2+
Токообразующая реакция в гальваническом элементе будет иметь вид:
Zn + Zn 2+ → Zn + Zn 2+
Рассчитываем ЭДС элемента: Е = Ек — Еа = — 0,763 –(-0,881) = 0,122 В.
Данный гальванический элемент можно отобразить схемой:
(-) Zn│Zn 2+ (0,0001 моль/л)║Zn 2+ (1 моль/л)│Zn (+)
Задания
4.Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
1. Fe| Fe +2 (1моль/л) || Ag + (0,1моль/л) |Ag
2. Cr| Cr +3 (2 моль/л ) || Cd +2 (1 моль/л )|Cd
3. Be| Be +2 (0,1моль/л) || Ni +2 (0,01моль/л) |Ni
4. Mn| Mn +2 (0,1 моль/л ) || Sn +2 (0,01 моль/л )|Sn
5. Al| Al +3 (2 моль/л ) || Cd +2 (0,1 моль/л )|Cd
6. Ni| Ni +2 (0,1 моль/л ) || Cu +2 (0,01 моль/л )|Cu
7. Mg| Mg +2 (1 моль/л ) || Zn +2 (0,01 моль/л )|Zn
8. Cd| Cd +2 (0,1 моль/л ) || Pb +2 (0,01 моль/л )|Pb
9. Fe| Fe +2 (0,01 моль/л ) || Fe +2 (1 моль/л )|Fe
10. Co|Co +2 (0,5 моль/л ) || Ni +2 (0,5 моль/л )|Ni
11. Zn| Zn +2 (1 моль/л ) || Cu +2 (0,01 моль/л )|Cu
13. Al|Al +3 (1 моль/л ) ||Al +3 (2 моль/л )|Al
14. Mn|Mn +2 (1 моль/л ) || Ni +2 (0,01 моль/л )|Ni
15. Ca|Ca +2 (0,1 моль/л) || Fe +2 (0,01 моль/л )|Fe
16. Pb|Pb +2 (1 моль/л ) || Ag + (0,1 моль/л )|Ag
17. Be|Be +2 (0,001 моль/л ) || Fe +2 (0,001 моль/л )|Fe
18. Pt|Cr +3 (0,1 моль/л ),Cr +2 (0,1 моль/л) || Fe +3 (0,1 моль/л ), Fe +2 (0,1 моль/л)|Pt
19. Zn|Zn +2 (1 моль/л ) || Fe +2 (0,01 моль/л)|Fe
20. Al|Al +3 (2 моль/л ) || Cu +2 (0,01 моль/л)|Cu
21. Be|Be +2 (1 моль/л ) || Cd +2 (0,01 моль/л )|Cd
22. Mn|Mn +2 (0,01 моль/л ) || Fe +2 (0,01 моль/л )|Fe
23. Fe|Fe +2 (1 моль/л ) || Sn +2 (0,01 моль/л)|Sn
24. Mg|Mg +2 (0,1 моль/л ) || Ni +2 (0,01 моль/л )|Ni
25. Ag|Ag + (0,001 моль/л) || Ag + (0,1 моль/л )|Ag
26. Fe| Fe +2 (0,005 моль/л ) || Pb +2 (0,005 моль/л )|Pb
27. Ca|Ca +2 (1 моль/л ) || Mg +2 (0,01 моль/л)|Mg
28. Mn|Mn +2 (0,01 моль/л ) || Zn +2 (0,01 моль/л )|Zn
29. Pb|Pb +2 (0,1 моль/л ) ||Cu +2 (0,01 моль/л)|Cu
30. Zn|Zn +2 (10 -4 моль/л ) || Sn +2 (10 -2 моль/л )|Sn
31. Cd| Cd +2 (10 -4 моль/л ) || Cu +2 (10 -2 моль/л )|Cu
32. Ni| Ni +2 (0,01 моль/л ) || Ag + (1 моль/л )|Ag
33. Mg| Mg +2 (0,001 моль/л ) || Mg +2 (1 моль/л )|Mg
34. Ca| Ca +2 (1 моль/л )|| Cr +2 (0,01 моль/л )|Cr
35. Mn|Mn +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
36. Al| Al +3 (2 моль/л ) || Cr +2 (0,01 моль/л )|Cr
37. Be| Be +2 (1 моль/л ) || Sn +2 (0,01 моль/л )|Sn
38. Ni| Ni +2 (1 моль/л )|| Fe +3 (2 моль/л )|Fe
39. Pt , H2|H + (pH=4) || Ag + (1 моль/л )|Ag
40. Mg| Mg +2 (10 -2 моль/л ) || Cu +2 (10 -2 моль/л )|Cu
41. Cu| Cu +2 (0,01 моль/л ) || Ag + (0,1 моль/л )|Ag
42. Ca| Ca +2 (0,01 моль/л ) || Be +2 (1 моль/л )|Be
43. Zn| Zn +2 (0,01 моль/л ) || Ni +2 (1 моль/л )|Ni
44. Al| Al +3 (2 моль/л ) || Fe +2 (0,01 моль/л )|Fe
45. Ca| Ca +2 (1 моль/л ) || Al +3 (0,5 моль/л )|Al
46. Fe| Fe +3 (2 моль/л ) || Cu +2 (0,01 моль/л )|Cu
47. Zn| Zn +2 (1 моль/л ) || Pb +2 (0,01 моль/л )|Pb
48. Sn| Sn +2 (0,01 моль/л ) || Ag + (0,1 моль/л )|Ag
49. Zn| Zn +2 (10 -2 моль/л ) || H + (pH=2)|H2,Pt
50. Pt| Sn +4 (0,1 моль/л ),Sn +2 (0,1 моль/л ) || Hg +2 (1 моль/л )|Hg
51. Al| Al +3 (2 моль/л ) || Cd +2 (0,01 моль/л )|Cd
52. Pt|Cr +3 (10 -2 моль/л ),Cr +2 (0,1 моль/л ) || Sn +4 (10 -3 моль/л ),Sn +2 (0,1 моль/л )|Pt
53. Ni| Ni +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
54. Mg| Mg +2 (10 -4 моль/л ) || H + (pH=2)|H2,Pt
55. Cd| Cd +2 (10 -2 моль/л ) || Cd +2 (1 моль/л )|Cd
56. Be| Be +2 (10 -4 моль/л ) || Zn +2 (10 -2 моль/л )|Zn
57. Mn| Mn +2 (1 моль/л ) || Cu +2 (0,1 моль/л)|Cu
58. Ca| Ca +2 (0,01 моль/л ) || Pb +2 (0,01 моль/л )|Pb
59. Sn| Sn +2 (0,01 моль/л ) || Cu +2 (1 моль/л )|Cu
60. Cd| Cd +2 (10 -1 моль/л ) || Sn +2 (10 -1 моль/л )|Sn
61.Pt|Fe +3 (10 -2 моль/л ),Fe +2 (0,1 моль/л ) || Sn +4 (10 -2 моль/л ),Sn +2 (0,1 моль/л )|Pt
62.Pt|Co +3 (10 -2 моль/л ), Co +2 (0,1 моль/л ) ||Sn +4 (0,1 моль/л ),Sn +2 (10 -2 моль/л )|Pt
63. Pt|Fe +3 (0,1 моль/л ), Fe +2 (10 -2 моль/л ) ||Au + (10 -2 моль/л ), Au +3 (0,1 моль/л )|Pt
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
источники:
http://megaobuchalka.ru/1/5007.html
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-elektrodnye-processy-galvanicheskij-element.html
Рекомендуемые сообщения
Решение задач, рефераты, курсовые!
Онлайн сервис помощи учащимся.
Цены в 2-3 раза ниже!
-
- Поделиться
Помогите, пожалуйста!
Даны две полуреакции и их стандартные потенциалы:
ClO3— + 3H2O +6e— = Cl— + 6OH— , φ0 = 0,63 В
MnO42- + 4H2O + 4e— = Mn2+ + 8OH— , φ0 = 0,71 В
Надо написать ионно-молекулярную форму уравнения токообразующей реакции и для этой реакции рассчитать ΔrG0298
Ссылка на комментарий
-
- Поделиться
Полуреакция с большим потенциалом будет выступать в роли окислителя и пойдет в прямом направлении,
полуреакция с меньшим потенциалом будет восстановителем и пойдет в обратном направлении:
MnO42- + 4H2O + 4e— = Mn2+ + 8OH— |
Cl— + 6OH— — 6e— = ClO3— + 3H2O |
===================================
Находим коэф-ты электронного баланса, складываем с учетом этих коэф-тов
две полуреакции и получаем (после сокращения подобных)
ионно-молекулярную форму уравнения токообразующей реакции
Находим ЭДС реакции (φ ок-ля — φ вос-ля) и по ее значению находим ΔrG0298
-
1
Ссылка на комментарий
- Автор
-
- Поделиться
2 часа назад, M_GM сказал:
Полуреакция с большим потенциалом будет выступать в роли окислителя и пойдет в прямом направлении,
полуреакция с меньшим потенциалом будет восстановителем и пойдет в обратном направлении:MnO42- + 4H2O + 4e— = Mn2+ + 8OH— |
Cl— + 6OH— — 6e— = ClO3— + 3H2O |
===================================
Находим коэф-ты электронного баланса, складываем с учетом этих коэф-тов
две полуреакции и получаем (после сокращения подобных)
ионно-молекулярную форму уравнения токообразующей реакции
Находим ЭДС реакции (φ ок-ля — φ вос-ля) и по ее значению находим ΔrG0298
Спасибо огромное! Когда мы домножаем полуреакции, надо ли так же домножать φ? Или просто считаем без домножения φ = 0,71 — 0,63 = 0,08 В? Как нам узнать число электронов, участвующих в реакции? Сложить 4+6? Или их 12, т.к. я домножаю реакции на 3 и 2?
Ссылка на комментарий
-
- Поделиться
16 часов назад, vladik299792458 сказал:
Спасибо огромное! Когда мы домножаем полуреакции, надо ли так же домножать φ?
Нет.
16 часов назад, vladik299792458 сказал:
Как нам узнать число электронов, участвующих в реакции?
Когда вы «домножили» полуреакции, вы узнали сколько электронов отдает восстановитель и сколько принимает окислитель.
Это одни и те же электроны, так что их 12.
-
1
Ссылка на комментарий
- Автор
-
- Поделиться
9 часов назад, M_GM сказал:
Нет.
Когда вы «домножили» полуреакции, вы узнали сколько электронов отдает восстановитель и сколько принимает окислитель.
Это одни и те же электроны, так что их 12.
Спасибо!
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Катодный и анодный процессы
Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
Pt| Sn+4 (0,1 моль/л ), Sn+2 (0,1 моль/л ) || Hg+2 (1 моль/л )|Hg
Решение задачи
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Pt| Sn+4, Sn+2 || Hg+2 |Hg
СSn4+= 0,1 моль/л, СSn2+= 0,1 моль/л, СHg2+= 1 моль/л.
Редокс-электрод представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод (инертный электрод). На поверхности электрода устанавливается равновесие Sn4+ + 2e = Sn2+, которое определяет потенциал электрода (в стандартных условиях 0,15 В). Окислительно-восстановительный процесс протекает в растворе и не связан с выделением или растворением простых веществ.
Пользуясь уравнением Нернста, вычисляем значения электродных потенциалов в растворах заданной концентрации:
E (Sn4+, Sn2+/ Pt) < E (Hg2+/Hg0), следовательно, более активный электрод (Sn4+, Sn2+/ Pt), он будет отрицательным электродом – анодом, а ртуть – катодом. Катодный и анодный процессы
Таким образом, (Sn4+, Sn2+/ Pt) – анод (А) и (Sn4+, Sn2+/ Pt), Hg – катод (K).
(-) Pt| Sn+4, Sn+2 || Hg+2 |Hg (+)
Электроны двигаются от анода к катоду (Hg). Катодный и анодный процессы
Запишем электронные уравнения процессов, протекающих на электродах, и составим суммарное уравнение токообразующей реакции. Катодный и анодный процессы
(-) (А) Sn2+ — 2e = Sn4+ процесс окисления;
(+)(K) Hg2+ + 2e = Hg0— процесс восстановления.
Sn2+ + Hg2+ = Sn4+ + Hg0
Рассчитываем ЭДС гальванического элемента:
Ответ:
ЭДС гальванического элемента 0,7 Вольт.