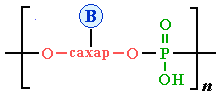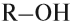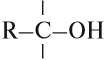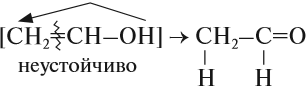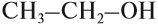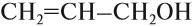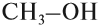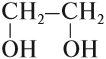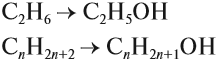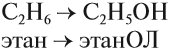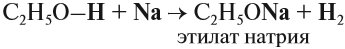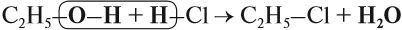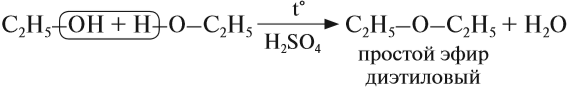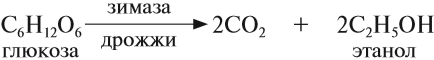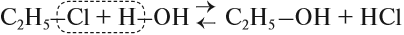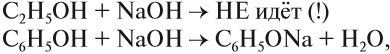Химия. Карбоновые кислоты.
Получение сложного эфира
В пробирку налейте 2 мл изоамило-вого (изопентилового) спирта, 2 мл уксусной кислоты и 0,5 мл концентрированной серной кислоты. Закройте пробирку газоотводной трубкой и нагрейте на водяной бане в течение нескольких минут (рис. 47). После охлаждения добавьте в пробирку несколько миллилитров воды. При этом выделяется слой изоамилового эфира уксусной кислоты (изоамилацетата) с характерным запахом грушевой эссенции.
1. Как называется реакция взаимодействия кислот со спиртами? Напишите уравнения реакций этилового спирта и изоамилового спирта с уксусной кислотой.
2. Для чего в реакционную смесь, содержащую спирт и карбо-новую кислоту, добавляют концентрированную серную кислоту?
Взаимодействие спиртов с карбоновыми кислотами — реакция этерификации, или образование сложного эфира, например:
CH3COOH + HO-C5H11 (t,H2SO4 конц) =
H2O + CH3CO-O-C5H11 (изоамилацетат, или изопентиловый эфир уксусной кислоты) . Серная кислота концентрированная — для связывания образующейся в реакции воды
Этанол: химические свойства и получение
Этанол C2H5OH или CH3CH2OH, этиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Строение этанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
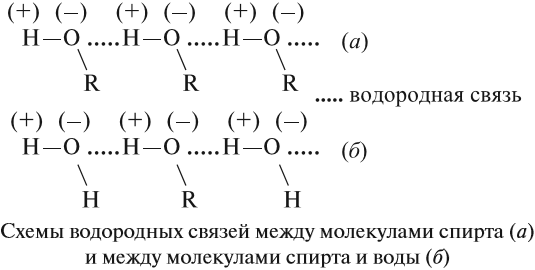
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этанол – жидкость с относительно высокой температурой кипения (температура кипения этанола +78 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Этанол смешивается с водой в любых соотношениях.
Изомерия спиртов
Структурная изомерия
Для этанола характерна структурная изомерия – межклассовая изомерия.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Химические свойства этанола
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии этанола с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными металлами (щелочными и щелочноземельными).
Например, этанол взаимодействует с калием с образованием этилата калия и водорода .
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат :
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир:
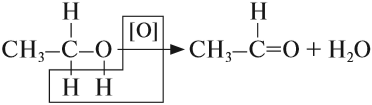
4. Окисление этанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
Например, этанол окисляется оксидом меди до уксусного альдегида
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
Например, уравнение сгорания этанола:
5. Дегидрирование этанола
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
Например, при дегидрировании этанола образуется этаналь
Получение этанола
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорэтана с водным раствором гидроксида натрия образуется этанол
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
4. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
Взаимодействие уксусной кислоты со спиртами. Химия 10 класс Рудзитис задание для самостоятельных выводов 3 параграф 13
Прив! Кто подскажет?) Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
Давай подскажу) Со спиртами уксусная кислота образует сложные эфиры — реакция этерификации.
Идет только в кислой среде. Порешаем с этанолом:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Образуется этиловый эфир уксусной кислоты (этилацетат).
источники:
http://chemege.ru/etanol/
http://class.rambler.ru/temy-gdz/vzaimodeystvie-uksusnoy-kisloty-so-spirtami-himiya-10-klass-rudzitis-zadanie-dlya-samostoyatelnyh-vyvodov-3-paragraf-13-14674.htm
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
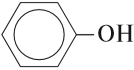
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция практически не идет.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
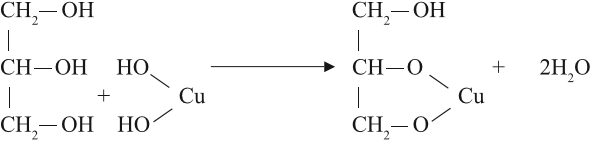
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
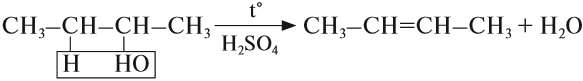
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь
Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)
Образование сложных эфиров
Спирты взаимодействуют с органическими и неорганическимиHO–NO2, (HO)2SO2, (HO)3P=O и т.п. гидроксилсодержащими кислотами, образуя сложные эфиры. Этот процесс называется реакцией этерификации (от древ.греч. αἰθήρ — эфир и лат. facio — делаю).
В реакции с органической кислотой спирт выступает как нуклеофил,Нуклеофил (любящий ядро) — реагент, имеющий неподелённую пару электронов на внешнем электронном уровне и способный предоставить эту пару для образования новой химической связи. отдавая неподелённую электронную пару атома кислорода на связь с электронодефицитным атомом углерода Сδ+ в молекуле кислоты.
Катализатор – сильная кислота (например, конц. H2SO4).
Аналогично происходит нуклеофильная атака молекулами спирта электронодефицитных атомов (N, S, P) в молекулах неорганических кислот
Реакционная способность спиртов при этерификации убывает с увеличением числа и размеров углеводородных радикалов. Первичные спирты активнее вторичных. Третичные и многие вторичные спирты в условиях кислотного катализа вступают в реакции элиминирования (отщепления H2O) с образованием алкенов.
Взаимодействие кислот и спиртов протекает обратимоДля смещения равновесия реакции в сторону образования эфира используют водоотнимающие средства и/или отгоняют образующийся эфир (т.кип. эфира ниже, чем у исходных спирта и кислоты из-за отсутствия ассоциирующих водородных связей). (обратный процесс – гидролиз сложных эфиров).
При использовании вместо кислот их более реакционноспособных производных – галогенангидридовГалогенангидриды — производные кислот, в которых гидроксильные группы заменены атомами галогена. или ангидридовАнгидриды органических кислот RCOOH – продукты (RCO)2O, образующие-ся при отщеплении одной молекулы воды от двух молекул кислоты.
Ангидриды неорганических кислот – кислотные оксиды, которые, присоединив воду, превращаются в кислоту. – реакция образования сложных эфиров практически необратима (пример
Некоторые сложные эфиры, в особенности сложные эфиры третичных спиртов, получают действием хлорангидридов или ангидридов на алкоголяты.
Название сложного эфира строится по названию углеводородного радикала в молекуле спирта (метил, этил и т.д.) с добавлением названия анионного остатка кислоты (ацетат, нитрат, сульфат, фосфат, карбонат и т.п.).
Часто сложные эфиры называют как спиртовые производные кислот, используя тривиальные названия последних. Например:
CH3O–СOCH3 – метиловый эфир уксусной кислоты (метилацетат),
C2H5O–NO2 – этиловый эфир азотной кислоты (этилнитрат) и т.п.
- Сложные эфиры органических кислот подробнее представлены в разделе «Карбоновые кислоты».
- Среди сложных эфиров неорганических кислот важное значение имеют нитраты, сульфаты, фосфаты и карбонаты.
Нитраты получают действием на спирты азотной кислотой или нитрующей смесьюНитрующая смесь — смесь концентрированных азотной и серной кислот, при взаимодействии которых образуется активная нитрующая частица NO2+ (катион нитрония):
2H2SO4 + HNO3 → NO2+ + H3O+ + 2HSO4–..
Эфиры азотной кислоты являются взрывчатыми веществами (BB). На этом основано их использование во взрывотехнике, в производстве компонентов твёрдого ракетного топлива и бездымного пороха. Препараты из группы органических нитратов применяются в медицине как сосудорасширяющие средства при ишемической болезни сердца и стенокардии.
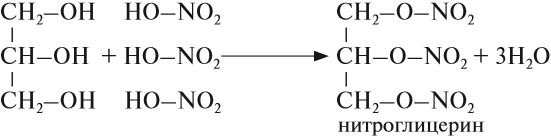
Наибольшее значение в производстве ВВ имеют нитраты многоатомных спиртов – глицерина, целлюлозы, пентаэритрита и т.п.
- Глицерин, в зависимости от условий проведения реакции и соотношения реагентов, может вступать в реакцию с азотной кислотой одной, двумя или тремя ОН-группами и образовывать моно-, ди- и тринитраты.
- Нитраты целлюлозы и пентаэритрита
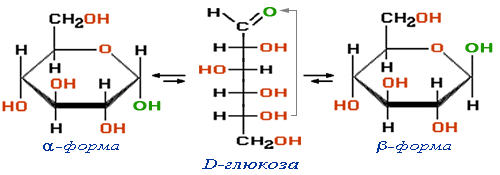
Целлюлоза (клетчатка) – полимер β-глюкозы
Спиртовые группы ОН выделены красным цветом
(зелёным отмечен полуацетальный гидроксил)., в каждом звене которого содержится 3 ОН-группы, при действии нитрующей смесью (HNO3+H2SO4) образует нитроцеллюлозу:В зависимости от условий проведения реакции и соотношения реагентов могут быть получены мононитрат, динитрат или тринитрат целлюлозы.
Нитроцеллюлоза — крупнотоннажный продукт в производстве бездымного пороха, ранее применялась для получения целлулоида и нитроэмалей.
Пентаэритрит (четырёхатомный спирт) при действии 5-ти кратным избытком 93-99% азотной кислоты, свободной от оксидов азота, образует тетранитрат пентаэритрита (пентаэритриттетранитрат, ТЭН).
Пентаэритриттетранитрат (ТЭН) используется в качестве инициирующего (детонирующие шнуры, детонаторы) и бризантного (в кумулятивных снарядах) взрывчатого вещества

Тривиальное название «нитроглицерин» даёт неверное представление о строении этого вещества, так как приставка «нитро» используется в названиях нитросоединений R-NO2 (например, CH3NO2 — нитрометан, C6H5NO2 — нитробензол).
Для устранения опасности самопроизвольного взрыва тринитрат глицерина наносится на твёрдый мелкопористый инертный носитель. Таким способом получают динамит. Создателем и основателем производства этого взрывчатого вещества был знаменитый шведский инженер-химик А.Нобель.
Сульфаты. Серная кислота
, являясь двухосновной, образует со спиртами сложные эфиры двух типов: кислыеКислые эфиры, сохраняющие кислотные функции (группу О-Н), называют также соответствующими кислотами. – алкилсульфаты (алкилсерные кислоты) и средние – диалкилсульфаты.
Алкилсульфаты малостабильны и существуют в виде равновесной смеси:
Равновесие смещается вправо путём отгонки диалкилсульфата.
Сульфаты образуют прежде всего первичные спирты. Для вторичных и третичных спиртов более характерны реакции дегидратации с образованием алкенов.
Для получения сульфатов вместо серной кислоты обычно используют более активные её производные: SO3 (серный ангидрид), SO2Cl2 (хлорангидрид серной кислоты, сульфурилхлорид), HSO3Cl (монохлорангидрид серной кислоты, хлорсульфоновая кислота).
Алкилсульфаты применяются в органическом синтезе как алкилирующие агенты (для введения алкильной группы).
Практическое значение имеют соли высших алкилгидросульфатов (алкилсерных кислот) в качестве поверхностно-активных веществ (ПАВ) различного назначения: моющие средства, эмульгаторы при полимеризации, смачиватели в производстве целлюлозы, мягчители шелка, антистатики полимеров и т.п. Один из наиболее известных представителей ПАВ — лаурилсульфат натрия
(додецилДодецил -С12Н25 — радикал алкана додекан С12Н26 (от греч.числительного додека — 12). В названии радикала заменяется глухая согласная «к» на «ц». сульфат натрия) CH3(CH2)11OSO3Na, который входит в состав большинства моющих средств, шампуней, зубных паст и др. Это соль лаурилсерной кислоты, образованной взаимодействием лаурилового спирта (додеканола-1) и хлорсульфоновой кислоты (монохлорангидрида серной кислоты):
С12Н25ОН + HSO3Cl → C12H25OSO2OH + HCl
Природные органические сульфаты входят в группу биополимеров соединительных тканей животных. К ним относятся сульфаты полисахаридовПолисахариды — высокомолекулярные углеводы, полимеры моносахаридов (например, полисахарид целлюлоза состо-ит из звеньев моносахарида глюкозы).: хиндроитинсульфаты (например, хондроитин-6-сульфат
гепарин
Фосфаты — сложные эфиры трёхосновной фосфорной кислоты H3PO4 трёх видов: кислые RОРО(OН)2, (RО)2РО(OН) и полные (RО)3РО.
Cинтез фосфатов основан на реакции хлорангидрида фосфорной кислоты POCl3 со спиртами или фенолами:
3ROH + POCl3 
Атомы Cl в POCl3 можно последовательно замещать на различные группы RO. Образующиеся первоначально хлорфосфаты при гидролизе превращаются в кислые фосфаты.
Многоатомные спирты способны вступать в реакцию поликонденсации и образовывать сложные полиэфиры фосфорной кислоты (фосфорорганические полимеры):
Применение. Органические фосфаты широко используются в качестве добавок для модификации пластмасс: пластификаторы, антипирены (для повышения огнестойкости) и др.; применяются как экстрагенты радиоактивных элементов из отработанного ядерного горючего и редко-земельных элементов из минерального сырья, флотореагенты, биологически безвредные ингибиторы коррозии металлов, лекарственные средства, пестициды и др. Некоторые фосфаты токсичны, а такие из них как зарин
Роль в природе. Исключительно важное значение имеют фосфаты углеводов (сахаров), являющихся многоатомными спиртами. Фосфаты сахаров содержатся во всех растительных и животных организмах. Они участвуют в биохимических процессах фотосинтеза и обмена веществ. Универсальным источником энергии для реакций, протекающих в живых системах, служит аденозинтрифосфат (АТФ)
АТФ — аккумулятор и переносчик химической энергии в живых клетках..
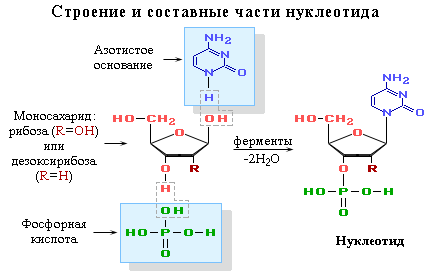
Фосфаты рибозы и дезоксирибозы
Нуклеотиды — мономерные звенья и промежуточные продукты
биосинтеза нуклеиновых кислот (ДНК, РНК) и нуклеотидкоферментов., которые при участии ферментов путём поликонденсации образуют полинуклеотиды (нуклеиновые кислоты
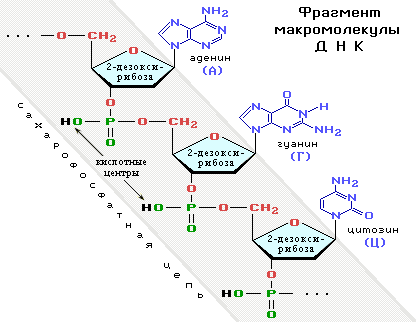
ДНК и РНКДНК — дезоксирибонуклеиновая кислота,
РНК — рибонуклеиновая кислота.). При этом взаимодействуют спиртовая ОН-группа одного нуклеотида с фосфатной группой другого. В результате образуется сахарофосфатная цепь макромолекул ДНК и РНК, состоящая из чередующихся остатков фосфорной кислоты и углевода (рибозы в РНК и дезоксирибозы в ДНК). Таким образом, все макромолекулы нуклеиновых кислот имеют единый сахарофосфатный остов,
а уникальность структур и функций этих биополимеров определяется набором и последовательностью
азотистых оснований
Азотистые основания — N-содержащие гетероциклические соединения: аденин, гуанин, цитозин, входящие в состав ДНК и РНК; тимин содержится только в ДНК, а урацил — только в РНК (подробнее см. Часть IV, «Гетероцикличес-кие соединения»). — боковых заместителей в главной цепи
(схема).
Схематически структуру макромолекул нуклеиновых кислот можно представить формулой:

О-сахар-О — остаток рибозы в РНК или дезоксирибозы в ДНК.
В живых клетках при рН≈7 фосфатные группы ионизированы.
Карбонаты — сложные эфиры угольной кислоты — образуются при взаимодействии фосгена COCl2 (полного хлорангидрида угольной кислоты) со спиртами или фенолами при повышенных температурах.
2ROH + COCl2 → RO–CO–OR + 2HCl
Практическое значение имеет производство поликарбонатовПоликарбонаты — сложные полиэфиры угольной кислоты и двухатомных фенолов или спиртов с общей формулой (-O-R-O-CO-)n., получаемых
при поликонденсации бисфенола АСистематическое название бисфенола А:
2,2-бис(4-гидроксифенил)пропан.
Часто употребляется техническое название – дифенилолпропан. (дианаДиан – название бисфенола А, данное в честь русского химика Александра Дианина, впервые получившего это соединение (1891 г.).) и фосгена:
Поликарбонат отличается высокой светопроницаемостью, ударопрочностью и термостойкостью. Благодаря сочетанию этих свойств, данный полимерный материал нашел широкое применение в строительстве и других отраслях народного хозяйства

Поликарбонат — инновационный материал, который, благодаря своим исключительным характеристикам, (высокая светопроницаемость, ударопрочность и термостойкость), нашел широкое применение в строительной сфере, в производстве светотехнических и оптических изделий и т.п.
Наиболее популярный в России формат применения — листовой поликарбонат: ячеистый (сотовый поликарбонат)


Разнообразность применения листового поликарбоната связана с уникальным комплексом свойств: прозрачность, легкость, прочность, долговечность (при наличии УФ защитного слоя).
Благодаря высокой прочности и ударной вязкости (250-500 кдж/м2), поликарбонат применяется в качестве конструкционного материала в различных отраслях промышленности, используется при изготовлении защитных шлемов для экстремальных дисциплин вело- и мотоспорта. При этом для улучшения механических свойств применяются и наполненные стекловолокном композиции.
Важным фактором является экономичность и технологичность производства поликарбоната на основе диана, получаемого из доступных исходных веществ — фенола и ацетона — продуктов кумольного метода.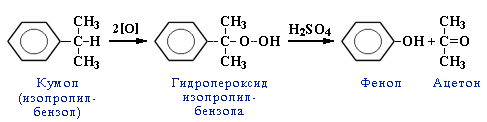
Реакция образования эфиров взаимодействием спирта с кислотой (этерификация) является равновесной и обратимой. [c.173]
Важнейшей из реакций этерификации является взаимодействие карбоновых кислот со спиртами, катализируемое кислотами [c.236]
Сложные эфиры — это вешества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации). [c.593]
Сложные эфиры, в отличие от простых, с большей или меньшей скоростью расщепляются водой — подвергаются гидролизу с образованием вновь кислоты и спирта. Поэтому, как показано в схемах приведенных выше реакций, процесс этерификации обратим и доходит до состояния динамического равновесия. Ионы водорода, как и всякий катализатор, ускоряют протекание не только реакции этерификации, но и обратной ей реакции гидролиза таким образом в присутствии минеральной кислоты быстрее достигается равновесие в процессе этерификации. [c.578]
Из других эфиров неорганических кислот важны эфиры азотной кислоты нитраты). Реакция их образования из азотной кислоты и спиртов обратима, и для повышения степени конверсии, а также во избежание окисления спиртов азотной кислоты, этерификацию проводят смесью серной и азотной кислот [c.268]
Этерификация поливинилового спирта органическими кислотами не представляет каких-либо затруднений. Штаудингер получил из поливинилового спирта поливинилацетат. в котором замещены псе гидроксильные группы и сохранена исходная степень полимеризации. Процесс проводился в среде пиридина при 60°. Эту реакцию обычно применяют для количественного определения идроксильных групп в полимере. Реагентом служит смесь уксусного ангидрида и уксусной кислоты [c.302]
Сложные эфиры — результат взаимодействия спирта с кислотой. Реакция этерификации протекает обратимо и требует для смещения равновесия водоотнимающих веществ [c.457]
Реакция образования эфира из спирта и кислоты называется этерификацией. [c.240]
В дизельных топливах в условиях хранения и эксплуатации при действии растворенного кислорода накапливаются низкомолекулярные продукты окисления (гидропероксиды, спирты, карбоновые кислоты и др.), которые вступают в реакции уплотнения (этерификации, конденсации, полимеризации) с образованием высокомолекулярных соединений, вызывающих осадко- и смолообразование в системе. Осадки загрязняют топливные фильтры и отрицательно влияют на работу топливных насосов высокого давления. При работе двигателя смолы отлагаются на горячих поверхностях распылителей форсунок и впускных клапанов, что приводит к неравномерной подаче топлива и вследствие этого к увеличению дымности и токсичности отработавших газов при повышенном расходе топлива. [c.6]
Образование сложных эфиров. Спирты реагируют с кислотами при этом выделяется вода и образуются сложные эфиры. Взаимодействие спиртов с кислотами называют реакцией этерификации. С органическими карбоновыми кислотами она протекает по схеме [c.108]
Получение этилсерной кислоты. Вследствие легкой доступности реагентов этерификация этилового спирта серной кислотой была одной из первых исследованных органических реакций. Ранняя, несколько противоречивая литература [1-67] очень обширна и может быть упомянута здесь лишь вкратце. Хеннель нашел [167], что при равных весовых количествах спирта и купоросного масла на образование этилсерной кислоты пошло 56% взятой кислоты. Бертло сообш ает [168], что при нагревании 94%-ного спирта с 95%-ной кислотой на паровой бане в течение 20 дней этерификация прошла на 59%. В свете последней работы, медленное превращение, проходившее в течение указанного длительного периода времени, заключалось скорее во вторичных реакциях, чем в образовании кислого эфира. Согласно указаниям третьего автора [34а], прп взаимодействии между 3 молями абсолютного спирта и 1 молем серной кислоты этерифицировалось 77% кислоты и равновесие очень мало изменялось с температурой. Более тщательное исследование этой реакции Креманном [169] показало, что при температурах, лежащих в области 22—96, среднее значение константы равновесия [c.32]
Недавно опубликован новый метод этерификации пространственно затрудненных кислот [20]. В этом случае реакция между спиртом и кислотой катализируется ангидридом трифторуксусной кислоты. Отличные выходы обычно получают с пространственно затрудненными кислотами, такими, как антрацен-9-карбоновая и 2,4,6-три-метилбензойная, и простыми или пространственно затрудненными спиртами или фенолами. Если и фенол, и кислота пространственно затруднены и возможен другой путь протекания реакции, например ацилирование атома углерода фенола, этерификация может не пойти. Согласно предполагаемому механизму, реакция идет по двум направлениям, которые оба включают образование протонированного ангидрида (IV) [c.285]
Реакция этерификации обратима сложный эфир, взаимодействуя с водой, превращается в спирт и кислоту [c.96]
Реакция между спиртом и галоидоводородными кислотами подчиняется другим законам. Спирт чрезвычайно слабо ионизирован для отщепления его гидроксильной группы требуется известное время. Процесс, протекающий между спиртом и кислотой с выделением воды и носящий название этерификации, является поэтому реакцией, протекающей во времени. Этерификация никогда не бывает полной, так как с ней конкурирует другая реакция — разложение образовавшегося галоидного алкила водой процесс образования сложных эфиров является обратимым [c.97]
Хлорангидриды и ангидриды кислот применяются в тех случаях, когда реакция этерификации проходит с трудом или провести ее вообще не удается. Последнее обстоятельство может быть вызвано либо малой реакционной способностью карбоновой кислоты, либо ее неустойчивостью или неустойчивостью соответствующего спирта в условиях этерификации. [c.168]
Характерными, реакциями кислот являются замещение атома водорода карбоксильной группы катионом (образование солей карбоновых кислот) и этерификация при взаимодействии со спиртом [c.270]
Как мы увидим дальше, сложные эфиры легко подвергаются гидролизу, т. е. под действием воды разлагаются на исходные спирт и кислоту, поэтому реакция этерификации обратима и доходит до состояния химического равновесия. Более подробно на этой реакции, так же как и на свойствах сложных эфиров, мы остановимся, когда ознакомимся с органическими кислотами (стр. 181). Здесь лишь отметим, что течение реакции этерификации, как показал [c.108]
Сильно влияют на этерификацию пространственные факторы. С ростом объема алкильных остатков, связанных с карбоксильной группой, а также со спиртовым гидроксилом, скорость этерификации падает. Поэтому разветвленные у а-углеродного атома алифатические, а также орто-замещенные ароматические кислоты вступают в реакцию медленно и с плохими выходами. В ряду от первичных к третичным спиртам реакция также затрудняется кроме того, в условиях реакции (сильнокислая среда) параллельно возрастает и тенденция к превращению спиртов в простые эфиры и олефины (разд. Г, 3.1.1.1 табл. 29). Как следствие последнего, эфиры третичных спиртов прямой этерификацией получаются лишь с очень низкими выходами. [c.75]
Термодинамика реакций этерификации. Взаимодействие спиртов с карбоновыми кислотами в жидкой фазе протекает практически без какого-либо поглощения или выделения тепла (АЯ = 0). Соответствеино, алкоголиз, ацидолиз и переэтерификация также имею тепловой эффект, близкий к нулю. Следовательно, константы равновесия этих реакций ие зависят от температуры. В отличие от этого, этерификация спиртов хлораигидрндами кислот, а также первая стадия этерификации спиртов ангидридами являются экютермическими процессами. [c.205]
Реакция взаимодействия сложного эфира с водой, право-дящая к образованию спирта и кислоты, называется омылением или гидролизом. Она обратна реакции этерификации. [c.393]
Получение галоидпроизводных углеводородов взаимодействием спирто с галоидоводородными кислотами представляет собой частный случай реакции этерификации. Как ранее было упомянуто, соединения, которые получаются при взаимодействии спирта и кислот, носят название сложных эфиров. Поэто [c.141]
Реакция этерификации обратима. При гидролитическом расщеплении сложных эфиров снова образуется спирт и кислота. [c.7]
Имеются различные модификации указанных реакций а) этерификацию никотиновой кислоты ведут различными спиртами изопропиловым [150], метиловым [151], этиловым, пропиловым, изопропиловым, бутиловым, изобутиловым [152], при этом было показано, что с увеличением молекулярной массы спирта выход эфира уменьшается, особенно для спиртов изостроения. В этой же зависимости изменяется выход никотинамида при обработке эфира 30%-ным водным аммиаком для метилового — 63%, этилового — 43%, пропилового — 39,8%, изопропилового — 28,3% б) реакцию амидирования ведут в растворе [150, 151, 153] или в отсутствии раст- [c.199]
Реакция этерификации протекает медленно (быстро протекают ионные реакции). К тому же она обратимая. Обратный процесс называется гидролизом (омылением). Ионы водорода (например, из Н. ЗО , НС1) ускоряют прямую и обратную реакции. Избыток соогветствующего вещества смещает равновесие в нужном направлении избыток воды благоприятствует гидролизу, избыток спирта или кислоты — этерификации. [c.423]
Реакциями этерификации в широком смысле слова иазывают все процессы, ведуш,не к образованию сложных эфиров. Здесь мы ограничим этот термин только реакциями кислот, их ангидридов и хлораигидридов со спиртами и олефинами, а также некоторыми превращениями сложных эфиров. Все эти превращения имеют важноо практическое значение. [c.203]
Механизм сульфатирования спиртов серной кислотой в общем аналогичен рассмотренным ранее процессам этерификации. При этом кислота выполняет одновременно роль и реагента и катализатора, а реакция протекает с разрывом связи S—О, что обусловливает отсутствие изомеризации в алкильной группе [c.318]
Эти соображения показывают, каким образом следует практически осуществлять процесс этерификации, чтобы добиться удовлетворительных выходов галоидного алкила, а также максимально испол4>ао]бать спирт и галоидоводородную кислоту для этой цели необходимо следить за тем, чтобы вода по возможности отсутствовала в реакционной массе. Этого достигают применением безводного спирта и безводного галоидо-аодорода. Во многих случаях оказывается целесообразным связывать образующуюся при реакции воду с помощью водоотнимающих веществ, например серной кислоты или хлористого цинка. Проведенная тйкиМ образом этерификация спиртов галоидоводородными кислотами Представляет собой хороший препаративный метод получения галоидных алкилов. [c.98]
По наблюдению Кохенхаузена [7], холестерин пе этерифи-цируется серной кислотой, а превращается в нерастворимый холестерон. Позднее запатентован способ [21] получения алкил-серной кислоты из спирта этого типа, заключающийся в предварительной этерификации спирта борной кислотой с последующим прибавлением реакционной смеси к 90%-ной серной кислоте. Возможно применение и более концентрированной серной кислоты. Наиболее благоприятной температурой превращения олеилового спирта в эфир действием серной кислоты является 30″» [22]. При более низкой температуре увеличивается значение реакции присоединения по двойной связи. [c.10]
Процесс этерификации можно проводить по непрерывной схеме, отгоняя для полноты реакции либо воду, либо эфир. Лейс и Осмер [29], которые исследовали непрерывный процесс этерификации н-бутилового спирта уксусной кислотой и ректификации продуктов реакции, показали, что не следует стремиться к длительному времени пребывания реагирующих [c.345]
Этерификацию можно вести и в парах над твердыми катализаторами. Было испытано большое число различных контактов, причем самыми активными для этерификации оказались TiiO и ТЮ . Пары спирта и кислоты при 280—300° пропускают через трубку с катализатором, в результате чего получаются такие же выходы сложных эфиров, как и при реакции в гомогенной фазе. Избыток одного из компонентов повышает выход сложного эфира 1 г-мол изомасляной кислоты с 1, 2 и 4 г-мол этилового спирта дает соответственно 71,0, 83,5 и 91,0% иэомасляноэтилового эфира. По этому способу получают с высокими выходами разнообразные сложные эфиры. [c.470]
Интересное практическое применение находят эфиры и о-,1 и в и и и л о в о г о с п [ р т а п т и г а н о в о й к и с л о-т ы. Эфиры титановой кислоты легко вступают в реакцию поре-этерификации, особенно с более высокомолекулярным спиртом. Это свойство эфиров титановой кислоты используют для получения поливипилоиого эфира титановой кислоты. В качестве исход- [c.300]
Анализ ИК-спек гров окисленных образцов ятелыюго топпива показал наличие сложной с.меси кислородсодержащих ароматических структур, состояитих из гидропероксидов, спиртов, фенолов, ароматических и арилароматическнх. эфиров (ароматических альдегидов и карбоновых кислот), сложных эфиров ароматических карбоновых кислот, которые легко. могут вступать в реакции уплотнения (этерификации, конденсации, полимеризации) с образованием высокомолекулярных соединений, часть которых коагулирует в нерастворимые соединения, вызывая осадко- и смолообразование [6]. [c.117]
Поскольку реакция этерификации является обратимой, выход эфира тем больше, чем в большем избытке взят спирт или кислота и чем полнее удаляются из реакционной смеси сложный эфир и вода. Так, например, при получении бензойноэтилового эфира берется избыток спирта при получении уксусноэтилового эфира отгоняется эфир, так как он кипит при температуре, которая ниже температуры кипения воды при получении уксусноизоамилового эфира отгоняется вода, так как ее температура кипения ниже температуры кипения образовавшегося эфира. В последнем случае вода отгоняется в виде азеотропной смеси с темп. кип. 94° С. Такой способ получения эфира называют азеотропной этерификацией. Иногда связывают воду с помощью водоотнимающих средств (И2864, гпСЦ, СаС , А12(804)3 и др.). [c.166]
Реакции этерификации являются прекрасной иллюстрацией влияния строения и молярной массы реагирующих веществ на скорость реакции. С повышением молярной массы спирта или кислоты скорость реакции снижается, что вызвано понижением энтропии активации реакции (затрудняется подход частиц реакционноспособными участками). Теми же причинами объясняется понижение скорости этерификации при переходе от первичных спиртов к третичным. Если скорость этерификации с этанолом СН3СН2ОН (первичный спирт) принять за 1, то скорость этерификации с участием вторичного и третичного спирта [c.83]
Легко рассчитать величину при 298 К для реакции этерификации этилового спирта уксусной кислотой, так как опыт показывает, что если взять моль кислоты и моль спирта, то при равновесии обра-14-1026 [c.209]
Способы получения. Реакция этерификации, Важнейщим методом получения сложных эфиров является реакция этерификации — взаимодействие спирта с кислотой [c.161]
Реакцию проводят или в присутствии растворителей, например бензола, толуола, хлороформа, эфира, уксусной кислоты, или же действуя избытком иодистого алкила непосредственно на соли (например, метиловый эфир пирролкарбоновой-2 кислоты ). Иногда реакция протекает уже на холоду, но чаще приходится нагревать смесь. в течение нескольких часов, причем следует избегать доступа влаги. Известным примером реакции этого типа является получение ацетата гЛиколя из дибромзтана и ацетата калия (см, работу 119, стр, 382). Этот метод применим для этерификации кислот с карбоксильной группой, стоящей при третичном углеродном атоме. Применяется он также для этерификации спиртов и кислот сложного строения, чувствительных к действию минеральных кислот. Однако исходные вещества не должны содержать групп, легко реагирующих с галоидными алкилами, например аминогрупп. [c.355]
ХОТЯ некоторые эфиры бензилового спирта [1] и муравьиной кислоты [2] можно получить в отсутствие катализатора. Если спирт или кислота изменяются под действием кислот, следует предпочесть-эфират трехфтористого бора [3]. Для этерификации ароматических, кислот лучше брать 2 экв трехфтористого бора [4]. Если при прове-. дении реакции нежелательно присутствие кислоты в реакционнойЕ среде, в качестве катализатора можно использовать сильнокислые ионообменные смолы [5]. Скорость образования эфира зависит от площади поверхности ионообменной смолы, а в случае кислот высокого молекулярного веса площадь поверхности может быть еще-больше ограничена плохой диффузией кислоты внутрь смолы. Нижег приведен пример этерификации при помощи кислой ионообменной смолы фурилоЕОго спирта, который при наличии кислоты в реакционной среде полимеризуется (пример а). [c.283]
Реакции алкилгалогенидов, эфиров серной или сульфоновых кислот с анионами карбоновых кислот аналогичны их взаимодействию с аниоиами спиртов или фенолов с образованием связи С—О—С, которая 1в этом случае находится по соседству с карбонильной группой, так что образуется сложный эфир. По своему Механизму эта реакция совершенно отлична от нормальной (ката—1изнруемой кислотами) этерификации карбоновой кислоты спиртом (разд. Г,7.1.5.1) ). [c.271]
Польяни и Сабо, проведя реакцию омыления уксусноамилового эфира тяжеловодородной водой, установили справедливость механизма (9.10). Этот механизм был подтвержден для многих реакций этерификации или гидролиза, однако более детальное исследование показало, что в зависимости от природы кислоты и спирта реакция может протекать и по механизму (9.9), а в ряде. случаев — и по обоим механизмам одновременно. Так, гидролиз уксуснотрифенилметилового эфира СНзСООС(СвНв)з протекает по механизму (9.9). [c.149]
Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение и применение спиртов (на примере этилового спирта)
- Многоатомные спирты
- Понятие о фенолах
- Выводы
Определение
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:
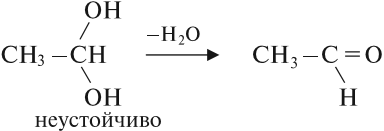
Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:
По строению углеводородного радикала спирты делят на:
- предельные
в углеводородном радикале, все связи простые;
- непредельные
в углеводородном радикале, есть кратная связь;
- ароматические
имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
- одноатомные
в состав молекулы входит одна гидроксогруппа ОН;
- многоатомные
в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:
Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:
Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):
Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.
Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти. Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов. В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.
Свойства одноатомных спиртов
Физические свойства
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
Пищевой и медицинский спирты получают брожением глюкозы:
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.
Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:
Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
- с азотной кислотой;
- с Сu(ОН)2.
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).
Понятие о фенолах
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
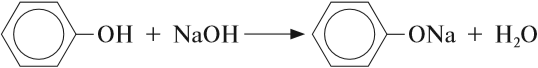
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
или
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
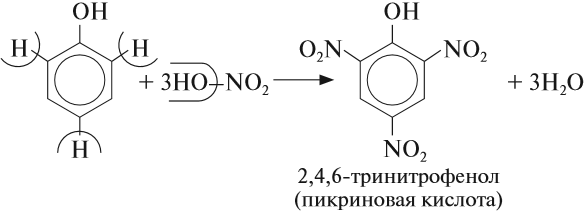
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:
Фенол применяют для дезинфекции и получения красителей и полимеров.
Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.