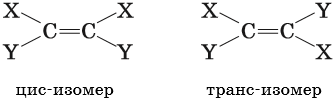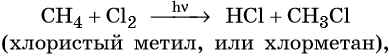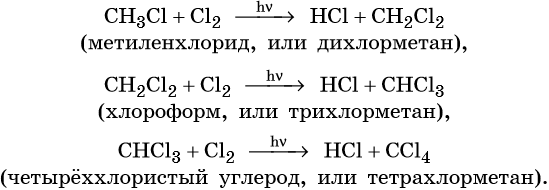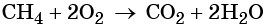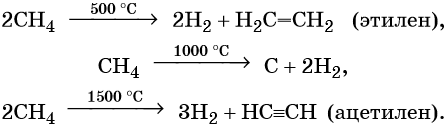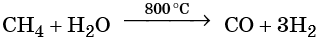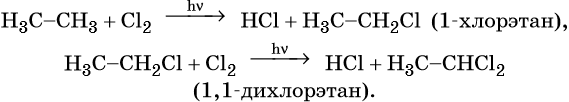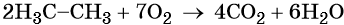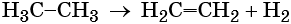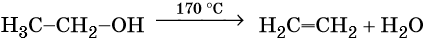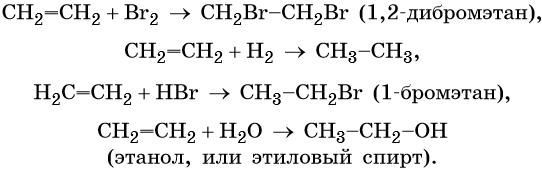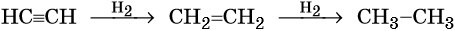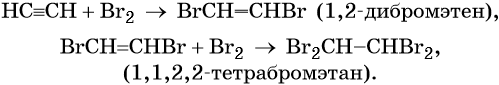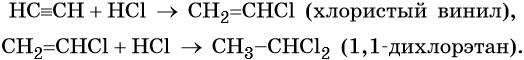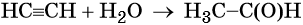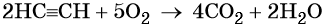В трех сосудах находятся этан, этилен и ацетилен. С помощью каких реакций можно различить эти газы? Составьте уравнения этих реакций.
Ваш ответ
Похожие вопросы
- Все категории
- экономические 43,410
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,042
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Какими способами можно отличить этилен от этана?
Химия | 10 — 11 классы
Какими способами можно отличить этилен от этана?
По обесцвечиванию бромной воды и раствора KMnO4
CH2 = CH2 + Br2 — — — — — — > ; CH2Br — CH2Br
3CH2 = CH2 + 2KMnO4 + 4H2O — — — — — — > ; 3CH2(OH) — CH2(OH) + 2MnO2 + 2KOH
ЭТАН НИЧЕГО НЕ ОБЕСЦВЕЧИВАЕТ.
Реакции какого типа характерны для а)этана б) этилена?
Реакции какого типа характерны для а)этана б) этилена.
Как отличить друг от друга этан и этилен?
Как отличить друг от друга этан и этилен?
Напишите уравнение реакции.
Из ацетилена в этан И из этана в этилен?
Из ацетилена в этан И из этана в этилен.
При помощи какого реактива можно отличить этан от этилена?
При помощи какого реактива можно отличить этан от этилена?
Приведите уравнение реакции и назовите образующийся продукт по систематической номенклатуре.
В цилиндре имеется смесь этилена, этана и углекислого газа, С помощью каких веществ можно из этой смеси выдельть этан?
В цилиндре имеется смесь этилена, этана и углекислого газа, С помощью каких веществ можно из этой смеси выдельть этан?
Напишите уравнения реакций, с помощью которых можно отличить диэтиловый эфир : а) от этана ; б) этилена ; в) ацетилена?
Напишите уравнения реакций, с помощью которых можно отличить диэтиловый эфир : а) от этана ; б) этилена ; в) ацетилена.
Химический способ очистки этана от примеси этилена?
Химический способ очистки этана от примеси этилена?
Получите из этана этилен , из этилена ацетилен ?
Получите из этана этилен , из этилена ацетилен .
Напишите уравнения реакций ?
Как из этана получить этилен ?
Как из этана получить этилен ?
Как узнать в каком сосуде содержится этилен а в каком этан?
Как узнать в каком сосуде содержится этилен а в каком этан?
Вы перешли к вопросу Какими способами можно отличить этилен от этана?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Четыре сигма — связи, sp3 — гибридизация.
Магнитом отделяем железо. Оставшееся высыпаем в воду дерево всплывает. Методом выпаривания испоряем воду остаётся соль.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O Mn + 7 о — ль, Fe + 2 в — ль.
Я на пишу кратко Na2 O = 23 * 2 + 16 = 62 а. Е. м = 0, 741 = 0, 258 C2H6 = 12 * 2 + 6 = 30 а. Е. м = 0, 8 = 0, 2 Fe2O3 = 55 * 2 + 16 * 3 = 158 a. E. m.
(С6Н5)2—СНОН вот ответ.
Находим число атомов воды число атомов воды = 3 N(H2O) = (m / M) * N(A) * n N(H2O) = 9 / 18 * 6. 02 * 10 ^ 23 * 3 = 9. 03 * 10 ^ 23 N(S) = N(H2O) = 9. 03 * 10 ^ 23 атомов число атомов серы = 1, M(S) = 32 g / mol N(S) = m(S) / M(S) * N(A) * n 9. 0..
1 моль любого вещества содержит 6, 02 * 10 ^ 23 частиц, следовательно одинаковое количество разных веществ содержат одинаковое количество частиц. N(H2O) = m / M = 9 / 18 = 0. 5моль m(S) = n * M = 0. 5 моль * 32 г / моль = 16 г.
Ослабевают, а металлические усиливаются.
2Na + 2H2O = NaOH + H2 n(Na) = 230г / 23г / моль = 10 моль n(Na) : n(H2) = 2 : 1 следовательно n(H2) = 5 моль V(H2) = 5 моль * 22, 4 л / моль = 112 л.
1 молекула воды содержит 2 атома водорода и 1 атом кислорода , то есть 3 атома, 1 молекула углекислого газа содержит 1 атом углерода и 2 атома кислорода , то есть 3 атома H2O + CO2 — — >H2CO3 в вместе они содержат 6 атомов.
Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
- Все атомы, образующие молекулы органического вещества, связаны в определённой последовательности согласно их валентностям.
- Свойства веществ зависят от строения молекул, т. е. свойства и строение взаимосвязаны между собой.
- Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического соединения может много сказать о его свойствах.
- Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они непосредственно связаны друг с другом.
Ниже приводятся основные термины, используемые в органической химии.
Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.
Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp 3 -гибридизация. При этой гибридизации происходит смешение одной 2s- и трёх 2p-орбиталей, в результате чего образуются четыре одинаковые sp 3 -гибридные орбитали. Валентный угол 109° 28′. Атом углерода, находящийся в состоянии sp 3 , связан с четырьмя другими атомами простыми (одинарными) связями. Все эти связи являются σ-связями.
sp 2 -гибридизация. При этой гибридизации происходит смешение одной 2s- и двух 2p-орбиталей, в результате чего образуются три одинаковые sp 2 -гибридные орбитали. Валентный угол 120°. Атом углерода, находящийся в состоянии sp 2 , связан с каким-либо другим атомом двойной связью, например: >C=C C=O; >C=N–. Одна из двойных связей является σ-связью, другая — π-связью.
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Родоначальником класса предельных углеводородов является метан, CH4. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –162 °С, а температура плавления — –182 °С. Метан широко распространён в природе. Он образуется в результате разложения без доступа воздуха остатков животных и растительных организмов.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:
При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:
При температуре около 800 °С в присутствии никелевого катализатора метан вступает во взаимодействие с водяными парами с образованием так называемого синтез-газа:
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
Так же, как и метан, этан вступает в реакции замещения:
На воздухе этан горит слабо светящимся пламенем:
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С. Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта. Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
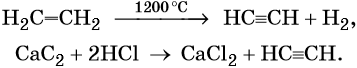
Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
Для ацетилена прежде всего характерны реакции присоединения.
В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии
2) это низкокипящая жидкость, хорошо растворимая в воде
3) это низкокипящий газ, плохо растворимый в воде
4) является основным компонентом природного газа
5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации
2) метан реагирует с парами разбавленной азотной кислоты
3) метан обладает характерным неприятным запахом
4) сгорает на воздухе с образованием угарного газа и воды
5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха
2) это бесцветный газ, немного тяжелее воздуха
3) при его взаимодействии с водой образуется этиловый спирт
4) при его дегидрировании образуется этилен
5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными
2) не реагирует с гидроксидом натрия
3) реагирует с серной кислотой
4) реагирует с метаном
5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации
2) плотность паров этилена равна плотности паров азота
3) не реагирует с водой
4) не сгорает в кислороде
5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде
2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации
3) взаимодействует с водой с образованием уксусной кислоты
4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха
2) при нормальных условиях это газ, пары которого тяжелее воздуха
3) не реагирует с бромом
4) реагирует с водой с образованием этанола
5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp 2 -гибридизации и соединены двойной связью
2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации
3) при его сгорании в кислороде образуется угарный газ и вода
4) при его сгорании в кислороде образуется углекислый газ и вода
5) реагирует с азотом
источники:
http://himia.my-dict.ru/q/4371137_kakimi-sposobami-mozno-otlicit-etilen-ot/
http://himi4ka.ru/ogje-2018-po-himii/urok-20-uglevodorody-predelnye-i-nepredelnye-metan-jetan-jetilen-acetilen.html
Антонина
18 октября, 03:15
Предложите способ, с помощью которого можно различить этан и а цетилен.
-
Петоха
18 октября, 03:55
0
При добавлении бромной воды в этан и ацетилен реакция идёт лишь с ацитиленам, потому что для алкинов свойствены реакции присоединения так как они не насыщеные, бромная вода будет обесцветиваться
- Комментировать
- Жалоба
- Ссылка
-
Николаич
18 октября, 04:29
0
пропустить через бромную воду, в случии с ацетиленом бромная вода обесцветится.
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «Предложите способ, с помощью которого можно различить этан и а цетилен. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » ⭐️ Химия » Предложите способ, с помощью которого можно различить этан и а цетилен.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Этан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
Этан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты.
При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С.
Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета.
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пропионата натрия с гидроксидом натрия при сплавлении образуется этан и карбонат натрия:
CH3–CH2 –COONa + NaOH → CH3–CH2 –H + Na2CO3
3. Гидрирование алкенов и алкинов
Этан можно получить из этилена или ацетилена:
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить этан:
5. Получение этана в промышленности
В промышленности этан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы.
Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен
Органическая химия — это химия углеводородов и их производных.
Основные положения теории строения органических соединений:
- Все атомы, образующие молекулы органического вещества, связаны в определённой последовательности согласно их валентностям.
- Свойства веществ зависят от строения молекул, т. е. свойства и строение взаимосвязаны между собой.
- Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического соединения может много сказать о его свойствах.
- Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они непосредственно связаны друг с другом.
Ниже приводятся основные термины, используемые в органической химии.
Изомерией называют явление существования органических соединений с одинаковым качественным и количественным составом, но с различными свойствами.
Изомерами называют химические соединения, имеющие одинаковый качественный и количественный состав, но разное химическое строение и разные свойства.
Структурной называют изомерию, вызванную наличием химических соединений с одинаковым составом, но с различным порядком связи структурных элементов. Различают изомерию углеродного скелета, изомерию положения заместителя или кратной связи.
Геометрическая, или цис-транс-изомерия, — явление существования веществ с различным расположением заместителей относительно двойной связи.
Геометрическая изомерия возможна как у соединений с двойной связью, так и у алициклических соединений.
Если одинаковые группы атомов располагаются по разные стороны от плоскости π-связи, то такие соединения называют транс-изомерами, если одинаковые группы атомов располагаются по одну сторону от плоскости -связи, то такие соединения называют цис-изомерами.
Вещества, обладающие сходным химическим строением и химическими свойствами, но отличающиеся между собой на одну или несколько CH2-групп, называют гомологами. Гомологи образуют гомологичные ряды. Свой гомологичный ряд существует для каждого класса органических соединений.
Химическую связь, максимальная электронная плотность которой находится на линии связывания ядер, называют σ-связью. Химическую связь, максимальная электронная плотность которой находится вне линии связывания ядер, называют π-связью.
В молекулах органических веществ атом углерода всегда находится в одном из трёх гибридных состояний с различными типами гибридизации:
sp 3 -гибридизация. При этой гибридизации происходит смешение одной 2s- и трёх 2p-орбиталей, в результате чего образуются четыре одинаковые sp 3 -гибридные орбитали. Валентный угол 109° 28′. Атом углерода, находящийся в состоянии sp 3 , связан с четырьмя другими атомами простыми (одинарными) связями. Все эти связи являются σ-связями.
sp 2 -гибридизация. При этой гибридизации происходит смешение одной 2s- и двух 2p-орбиталей, в результате чего образуются три одинаковые sp 2 -гибридные орбитали. Валентный угол 120°. Атом углерода, находящийся в состоянии sp 2 , связан с каким-либо другим атомом двойной связью, например: >C=C C=O; >C=N–. Одна из двойных связей является σ-связью, другая — π-связью.
sp-гибридизация. При этой гибридизации происходит смешение одной 2s- и одной 2p-орбитали, в результате чего образуются две одинаковые sp-гибридные орбитали. Валентный угол 180°. Атом углерода, находящийся в состоянии sp, связан с каким-либо другим атомом тройной связью, например: –C≡C–; –C≡N. Одна из тройных связей является σ-связью, две другие — π-связями.
Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Родоначальником класса предельных углеводородов является метан, CH4. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –162 °С, а температура плавления — –182 °С. Метан широко распространён в природе. Он образуется в результате разложения без доступа воздуха остатков животных и растительных организмов.
Метан — основной компонент природного газа, кроме того, его получают в качестве попутного газа при нефтедобыче.
Метан, как и другие представители предельных углеводородов, достаточно устойчивы химически. Они не взаимодействуют ни со щелочами, ни с кислотами (за исключением азотной), не реагируют с активными металлами.
Для метана прежде всего характерны реакции замещения, которые протекают по радикальному механизму. Этот механизм химической реакции подробнее изучают в курсе органической химии.
Взаимодействие метана с хлором протекает на свету или при температуре 300 °С. Иногда этот процесс может сопровождаться взрывом. При этом происходит последовательное замещение атомов водорода на хлор. В зависимости от соотношения в качестве основного продукта реакции могут образовываться различные хлорпроизводные:
При сгорании метана в кислороде или на воздухе выделяется углекислый газ, вода и значительное количество тепла:
Именно поэтому его используют в качестве дешёвого топлива.
Термическое разложение метана протекает по различным направления в зависимости от температуры:
При температуре около 800 °С в присутствии никелевого катализатора метан вступает во взаимодействие с водяными парами с образованием так называемого синтез-газа:
В дальнейшем из синтез-газа получают многочисленные продукты органического синтеза.
Этан — ближайший гомолог метана. Его брутто-формула C2H6, структурная формула H3C–CH3. Он представляет собой газ без цвета и запаха, очень мало растворим в воде. Его температура кипения равна –89 °С, а температура плавления –183 °С. Этан широко распространен в природе. В составе попутного газа встречается до 10—15% этана.
Так же, как и метан, этан вступает в реакции замещения:
На воздухе этан горит слабо светящимся пламенем:
Реакция дегидрирования, т. е. отщепление водорода, приводит к этилену:
Этан используют как исходное сырье для получения этилена, каучуков и т. д.
Этилен, брутто-формула C2H4, структурная формула H2C=CH2, представляет собой бесцветный газ, малорастворимый в воде. Его температура кипения равна –103,7 °С, а температура плавления –169,1 °С. Этилен в промышленности получают из этана или метана. Эти реакции были описаны выше. В лабораторной практике этилен получают с помощью реакции дегидратации (отщепления воды) от этилового спирта. Одновременно катализатором этого процесса и водоотнимающим средством является концентрированная серная кислота:
Для этилена характерны реакции присоединения. Он легко обесцвечивает раствор брома в воде или четырёххлористом углероде, присоединяет водород (реакция гидрирования), бромоводород (реакция гидробромирования) и воду (реакция гидратации):
Этилен широко применяют для синтеза различных органических веществ: этилового спирта, стирола, галогенпроизводных, полиэтилена, окиси этилена и т. д.
Ацетилен (этин), брутто-формула C2H2, структурная формула HC=CH, представляет собой бесцветный газ, немного растворимый в воде. Его температура кипения равна –83,8 °С.
Ацетилен в промышленности получают из метана (реакция описана выше) или этана. В лабораторной практике ацетилен получают с помощью реакции карбида кальция с водой или кислотами:
Для ацетилена прежде всего характерны реакции присоединения.
В присутствии катализаторов он легко присоединяет водород, образуя вначале этилен, а потом этан:
Ацетилен обесцвечивает раствор брома в воде или четырёххлористом углероде. При этом происходит последовательное присоединение брома по кратным связям:
Присоединение хлороводорода вначале приведет к образованию хлористого винила, а затем 1,1-дихлорэтана:
Ацетилен реагирует с водой с образованием уксусного альдегида (реакция Кучерова). Катализатором в данном процессе выступают соли ртути.
При сгорании ацетилена в кислороде развивается очень высокая температура, поэтому ацетилен-кислородное пламя используют для сварки и резки металлов:
Ацетилен имеет огромное значение как исходное вещество в органическом синтезе. Из ацетилена получают уксусный альдегид, который далее перерабатывают в уксусную кислоту и её различные эфиры; винилацетилен, перерабатываемый в хлоропрен и хлоропреновые каучуки; хлорвинил и поливинилхлорид; дихлорэтан, глицерин, винилацетат, поливинилацетатный клей.
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии
2) это низкокипящая жидкость, хорошо растворимая в воде
3) это низкокипящий газ, плохо растворимый в воде
4) является основным компонентом природного газа
5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации
2) метан реагирует с парами разбавленной азотной кислоты
3) метан обладает характерным неприятным запахом
4) сгорает на воздухе с образованием угарного газа и воды
5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха
2) это бесцветный газ, немного тяжелее воздуха
3) при его взаимодействии с водой образуется этиловый спирт
4) при его дегидрировании образуется этилен
5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными
2) не реагирует с гидроксидом натрия
3) реагирует с серной кислотой
4) реагирует с метаном
5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации
2) плотность паров этилена равна плотности паров азота
3) не реагирует с водой
4) не сгорает в кислороде
5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде
2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации
3) взаимодействует с водой с образованием уксусной кислоты
4) взаимодействует с бромной водой с образованием 1,2-дибромэтана
5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха
2) при нормальных условиях это газ, пары которого тяжелее воздуха
3) не реагирует с бромом
4) реагирует с водой с образованием этанола
5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp 2 -гибридизации и соединены двойной связью
2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации
3) при его сгорании в кислороде образуется угарный газ и вода
4) при его сгорании в кислороде образуется углекислый газ и вода
5) реагирует с азотом
источники:
http://chemege.ru/etan/
http://himi4ka.ru/ogje-2018-po-himii/urok-20-uglevodorody-predelnye-i-nepredelnye-metan-jetan-jetilen-acetilen.html
В трех сосудах находятся этан, этилен, ацетилен. При помощи каких реакций можно различить эти газы? Составте уравнения реакции.
Найдите правильный ответ на вопрос ✅ «В трех сосудах находятся этан, этилен, ацетилен. При помощи каких реакций можно различить эти газы? Составте уравнения реакции. …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » ⭐️ Химия » В трех сосудах находятся этан, этилен, ацетилен. При помощи каких реакций можно различить эти газы? Составте уравнения реакции.
|