Not to be confused with Ahimsa.
| Asthma | |
|---|---|
 |
|
| Peak flow meters are used to measure the peak expiratory flow rate, important in both monitoring and diagnosing asthma.[1] | |
| Pronunciation |
|
| Specialty | Pulmonology |
| Symptoms | Recurring episodes of wheezing, coughing, chest tightness, shortness of breath[4] |
| Complications | Gastroesophageal reflux disease (GERD), sinusitis, obstructive sleep apnea |
| Usual onset | Childhood |
| Duration | Long term[5] |
| Causes | Genetic and environmental factors[4] |
| Risk factors | Air pollution, allergens[5] |
| Diagnostic method | Based on symptoms, response to therapy, spirometry[6] |
| Treatment | Avoiding triggers, inhaled corticosteroids, salbutamol[7][8] |
| Frequency | approx. 262 million (2019)[9] |
| Deaths | approx. 461,000 (2019)[9] |
Asthma is a long-term inflammatory disease of the airways of the lungs.[5] It is characterized by variable and recurring symptoms, reversible airflow obstruction, and easily triggered bronchospasms.[10][11] Symptoms include episodes of wheezing, coughing, chest tightness, and shortness of breath.[4] These may occur a few times a day or a few times per week.[5] Depending on the person, asthma symptoms may become worse at night or with exercise.[5]
Asthma is thought to be caused by a combination of genetic and environmental factors.[4] Environmental factors include exposure to air pollution and allergens.[5] Other potential triggers include medications such as aspirin and beta blockers.[5] Diagnosis is usually based on the pattern of symptoms, response to therapy over time, and spirometry lung function testing.[6] Asthma is classified according to the frequency of symptoms, forced expiratory volume in one second (FEV1), and peak expiratory flow rate.[12] It may also be classified as atopic or non-atopic, where atopy refers to a predisposition toward developing a type 1 hypersensitivity reaction.[13][14]
There is no known cure for asthma, but it can be controlled.[5] Symptoms can be prevented by avoiding triggers, such as allergens and respiratory irritants, and suppressed with the use of inhaled corticosteroids.[7][15] Long-acting beta agonists (LABA) or antileukotriene agents may be used in addition to inhaled corticosteroids if asthma symptoms remain uncontrolled.[16][17] Treatment of rapidly worsening symptoms is usually with an inhaled short-acting beta-2 agonist such as salbutamol and corticosteroids taken by mouth.[8] In very severe cases, intravenous corticosteroids, magnesium sulfate, and hospitalization may be required.[18]
In 2019 asthma affected approximately 262 million people and caused approximately 461,000 deaths.[9] Most of the deaths occurred in the developing world.[5] Asthma often begins in childhood,[5] and the rates have increased significantly since the 1960s.[19] Asthma was recognized as early as Ancient Egypt.[20] The word «asthma» is from the Greek ἆσθμα, âsthma, which means «panting».[21]
Signs and symptoms
The sound of wheezing as heard with a stethoscope.
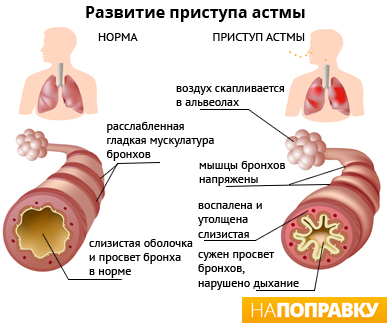
Asthma is characterized by recurrent episodes of wheezing, shortness of breath, chest tightness, and coughing.[22] Sputum may be produced from the lung by coughing but is often hard to bring up.[23] During recovery from an asthma attack (exacerbation), it may appear pus-like due to high levels of white blood cells called eosinophils.[24] Symptoms are usually worse at night and in the early morning or in response to exercise or cold air.[25] Some people with asthma rarely experience symptoms, usually in response to triggers, whereas others may react frequently and readily and experience persistent symptoms.[26]
Associated conditions
A number of other health conditions occur more frequently in people with asthma, including gastroesophageal reflux disease (GERD), rhinosinusitis, and obstructive sleep apnea.[27] Psychological disorders are also more common,[28] with anxiety disorders occurring in between 16 and 52% and mood disorders in 14–41%.[29] It is not known whether asthma causes psychological problems or psychological problems lead to asthma.[30] Current asthma, but not former asthma, is associated with increased all-cause mortality, heart disease mortality, and chronic lower respiratory tract disease mortality.[31] Asthma, particularly severe asthma, is strongly associated with development of chronic obstructive pulmonary disease (COPD).[32][33][34] Those with asthma, especially if it is poorly controlled, are at increased risk for radiocontrast reactions.[35]
Cavities occur more often in people with asthma.[36] This may be related to the effect of beta 2 agonists decreasing saliva.[37] These medications may also increase the risk of dental erosions.[37]
Causes
Asthma is caused by a combination of complex and incompletely understood environmental and genetic interactions.[38][39] These influence both its severity and its responsiveness to treatment.[40] It is believed that the recent increased rates of asthma are due to changing epigenetics (heritable factors other than those related to the DNA sequence) and a changing living environment.[41] Asthma that starts before the age of 12 years old is more likely due to genetic influence, while onset after age 12 is more likely due to environmental influence.[42]
Environmental
Many environmental factors have been associated with asthma’s development and exacerbation, including, allergens, air pollution, and other environmental chemicals.[43] There are some substances that are known to cause asthma in exposed people and they are called asthmagens. Some common asthmagens include ammonia, latex, pesticides, solder and welding fumes, metal or wood dusts, spraying of isocyanate paint in vehicle repair, formaldehyde, glutaraldehyde, anhydrides, glues, dyes, metal working fluids, oil mists, molds.[44][45] Smoking during pregnancy and after delivery is associated with a greater risk of asthma-like symptoms.[46] Low air quality from environmental factors such as traffic pollution or high ozone levels[47] has been associated with both asthma development and increased asthma severity.[48] Over half of cases in children in the United States occur in areas when air quality is below the EPA standards.[49] Low air quality is more common in low-income and minority communities.[50]
Exposure to indoor volatile organic compounds may be a trigger for asthma; formaldehyde exposure, for example, has a positive association.[51] Phthalates in certain types of PVC are associated with asthma in both children and adults.[52][53] While exposure to pesticides is linked to the development of asthma, a cause and effect relationship has yet to be established.[54][55] A meta-analysis concluded gas stoves are a major risk factor for asthma, finding around one in eight cases in the U.S. could be attributed to these.[56]
The majority of the evidence does not support a causal role between paracetamol (acetaminophen) or antibiotic use and asthma.[57][58] A 2014 systematic review found that the association between paracetamol use and asthma disappeared when respiratory infections were taken into account.[59] Maternal psychological stress during pregnancy is a risk factor for the child to develop asthma.[60]
Asthma is associated with exposure to indoor allergens.[61] Common indoor allergens include dust mites, cockroaches, animal dander (fragments of fur or feathers), and mold.[62][63] Efforts to decrease dust mites have been found to be ineffective on symptoms in sensitized subjects.[64][65] Weak evidence suggests that efforts to decrease mold by repairing buildings may help improve asthma symptoms in adults.[66] Certain viral respiratory infections, such as respiratory syncytial virus and rhinovirus,[21] may increase the risk of developing asthma when acquired as young children.[67] Certain other infections, however, may decrease the risk.[21]
Hygiene hypothesis
The hygiene hypothesis attempts to explain the increased rates of asthma worldwide as a direct and unintended result of reduced exposure, during childhood, to non-pathogenic bacteria and viruses.[68][69] It has been proposed that the reduced exposure to bacteria and viruses is due, in part, to increased cleanliness and decreased family size in modern societies.[70] Exposure to bacterial endotoxin in early childhood may prevent the development of asthma, but exposure at an older age may provoke bronchoconstriction.[71] Evidence supporting the hygiene hypothesis includes lower rates of asthma on farms and in households with pets.[70]
Use of antibiotics in early life has been linked to the development of asthma.[72] Also, delivery via caesarean section is associated with an increased risk (estimated at 20–80%) of asthma – this increased risk is attributed to the lack of healthy bacterial colonization that the newborn would have acquired from passage through the birth canal.[73][74] There is a link between asthma and the degree of affluence which may be related to the hygiene hypothesis as less affluent individuals often have more exposure to bacteria and viruses.[75]
Genetic
| Endotoxin levels | CC genotype | TT genotype |
|---|---|---|
| High exposure | Low risk | High risk |
| Low exposure | High risk | Low risk |
Family history is a risk factor for asthma, with many different genes being implicated.[77] If one identical twin is affected, the probability of the other having the disease is approximately 25%.[77] By the end of 2005, 25 genes had been associated with asthma in six or more separate populations, including GSTM1, IL10, CTLA-4, SPINK5, LTC4S, IL4R and ADAM33, among others.[78] Many of these genes are related to the immune system or modulating inflammation. Even among this list of genes supported by highly replicated studies, results have not been consistent among all populations tested.[78] In 2006 over 100 genes were associated with asthma in one genetic association study alone;[78] more continue to be found.[79]
Some genetic variants may only cause asthma when they are combined with specific environmental exposures.[38] An example is a specific single nucleotide polymorphism in the CD14 region and exposure to endotoxin (a bacterial product). Endotoxin exposure can come from several environmental sources including tobacco smoke, dogs, and farms. Risk for asthma, then, is determined by both a person’s genetics and the level of endotoxin exposure.[76]
Medical conditions
A triad of atopic eczema, allergic rhinitis and asthma is called atopy.[80] The strongest risk factor for developing asthma is a history of atopic disease;[67] with asthma occurring at a much greater rate in those who have either eczema or hay fever.[81] Asthma has been associated with eosinophilic granulomatosis with polyangiitis (formerly known as Churg–Strauss syndrome), an autoimmune disease and vasculitis.[82] Individuals with certain types of urticaria may also experience symptoms of asthma.[80]
There is a correlation between obesity and the risk of asthma with both having increased in recent years.[83][84] Several factors may be at play including decreased respiratory function due to a buildup of fat and the fact that adipose tissue leads to a pro-inflammatory state.[85]
Beta blocker medications such as propranolol can trigger asthma in those who are susceptible.[86] Cardioselective beta-blockers, however, appear safe in those with mild or moderate disease.[87][88] Other medications that can cause problems in asthmatics are angiotensin-converting enzyme inhibitors, aspirin, and NSAIDs.[89] Use of acid suppressing medication (proton pump inhibitors and H2 blockers) during pregnancy is associated with an increased risk of asthma in the child.[90]
Exacerbation
Some individuals will have stable asthma for weeks or months and then suddenly develop an episode of acute asthma. Different individuals react to various factors in different ways.[91] Most individuals can develop severe exacerbation from a number of triggering agents.[91]
Home factors that can lead to exacerbation of asthma include dust, animal dander (especially cat and dog hair), cockroach allergens and mold.[91][92] Perfumes are a common cause of acute attacks in women and children. Both viral and bacterial infections of the upper respiratory tract can worsen the disease.[91] Psychological stress may worsen symptoms – it is thought that stress alters the immune system and thus increases the airway inflammatory response to allergens and irritants.[48][93]
Asthma exacerbations in school‐aged children peak in autumn, shortly after children return to school. This might reflect a combination of factors, including poor treatment adherence, increased allergen and viral exposure, and altered immune tolerance. There is limited evidence to guide possible approaches to reducing autumn exacerbations, but while costly, seasonal omalizumab treatment from four to six weeks before school return may reduce autumn asthma exacerbations.[94]
Pathophysiology
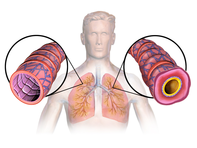
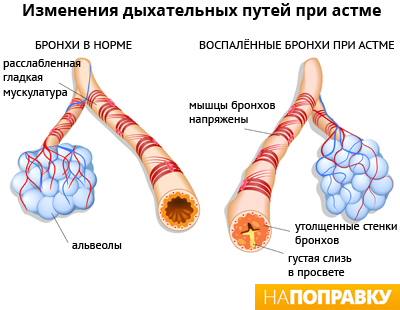
Figure A shows the location of the lungs and airways in the body. Figure B shows a cross-section of a normal airway. Figure C shows a cross-section of an airway during asthma symptoms.
Diagram of asthma
Asthma is the result of chronic inflammation of the conducting zone of the airways (most especially the bronchi and bronchioles), which subsequently results in increased contractability of the surrounding smooth muscles. This among other factors leads to bouts of narrowing of the airway and the classic symptoms of wheezing. The narrowing is typically reversible with or without treatment. Occasionally the airways themselves change.[22] Typical changes in the airways include an increase in eosinophils and thickening of the lamina reticularis. Chronically the airways’ smooth muscle may increase in size along with an increase in the numbers of mucous glands. Other cell types involved include T lymphocytes, macrophages, and neutrophils. There may also be involvement of other components of the immune system, including cytokines, chemokines, histamine, and leukotrienes among others.[21]
Diagnosis
While asthma is a well-recognized condition, there is not one universal agreed upon definition.[21] It is defined by the Global Initiative for Asthma as «a chronic inflammatory disorder of the airways in which many cells and cellular elements play a role. The chronic inflammation is associated with airway hyper-responsiveness that leads to recurrent episodes of wheezing, breathlessness, chest tightness and coughing particularly at night or in the early morning. These episodes are usually associated with widespread but variable airflow obstruction within the lung that is often reversible either spontaneously or with treatment».[22]
There is currently no precise test for the diagnosis, which is typically based on the pattern of symptoms and response to therapy over time.[6][21] Asthma may be suspected if there is a history of recurrent wheezing, coughing or difficulty breathing and these symptoms occur or worsen due to exercise, viral infections, allergens or air pollution.[95] Spirometry is then used to confirm the diagnosis.[95] In children under the age of six the diagnosis is more difficult as they are too young for spirometry.[96]
Spirometry
Spirometry is recommended to aid in diagnosis and management.[97][98] It is the single best test for asthma. If the FEV1 measured by this technique improves more than 12% and increases by at least 200 milliliters following administration of a bronchodilator such as salbutamol, this is supportive of the diagnosis. It however may be normal in those with a history of mild asthma, not currently acting up.[21] As caffeine is a bronchodilator in people with asthma, the use of caffeine before a lung function test may interfere with the results.[99] Single-breath diffusing capacity can help differentiate asthma from COPD.[21] It is reasonable to perform spirometry every one or two years to follow how well a person’s asthma is controlled.[100]
Others
The methacholine challenge involves the inhalation of increasing concentrations of a substance that causes airway narrowing in those predisposed. If negative it means that a person does not have asthma; if positive, however, it is not specific for the disease.[21]
Other supportive evidence includes: a ≥20% difference in peak expiratory flow rate on at least three days in a week for at least two weeks, a ≥20% improvement of peak flow following treatment with either salbutamol, inhaled corticosteroids or prednisone, or a ≥20% decrease in peak flow following exposure to a trigger.[101] Testing peak expiratory flow is more variable than spirometry, however, and thus not recommended for routine diagnosis. It may be useful for daily self-monitoring in those with moderate to severe disease and for checking the effectiveness of new medications. It may also be helpful in guiding treatment in those with acute exacerbations.[102]
Classification
| Severity | Symptom frequency | Night-time symptoms | %FEV1 of predicted | FEV1 variability | SABA use |
|---|---|---|---|---|---|
| Intermittent | ≤2/week | ≤2/month | ≥80% | <20% | ≤2 days/week |
| Mild persistent | >2/week | 3–4/month | ≥80% | 20–30% | >2 days/week |
| Moderate persistent | Daily | >1/week | 60–80% | >30% | daily |
| Severe persistent | Continuously | Frequent (7/week) | <60% | >30% | ≥twice/day |
Asthma is clinically classified according to the frequency of symptoms, forced expiratory volume in one second (FEV1), and peak expiratory flow rate.[12] Asthma may also be classified as atopic (extrinsic) or non-atopic (intrinsic), based on whether symptoms are precipitated by allergens (atopic) or not (non-atopic).[13] While asthma is classified based on severity, at the moment there is no clear method for classifying different subgroups of asthma beyond this system.[103] Finding ways to identify subgroups that respond well to different types of treatments is a current critical goal of asthma research.[103]
Although asthma is a chronic obstructive condition, it is not considered as a part of chronic obstructive pulmonary disease, as this term refers specifically to combinations of disease that are irreversible such as bronchiectasis and emphysema.[104] Unlike these diseases, the airway obstruction in asthma is usually reversible; however, if left untreated, the chronic inflammation from asthma can lead the lungs to become irreversibly obstructed due to airway remodeling.[105] In contrast to emphysema, asthma affects the bronchi, not the alveoli.[106] The combination of asthma with a component of irreversible airway obstruction has been termed the asthma-chronic obstructive disease (COPD) overlap syndrome (ACOS). Compared to other people with «pure» asthma or COPD, people with ACOS exhibit increased morbidity, mortality and possibly more comorbidities.[107]
Asthma exacerbation
| Near-fatal | High PaCO2, or requiring mechanical ventilation, or both |
|---|---|
| Life-threatening (any one of) |
|
| Clinical signs | Measurements |
| Altered level of consciousness | Peak flow < 33% |
| Exhaustion | Oxygen saturation < 92% |
| Arrhythmia | PaO2 < 8 kPa |
| Low blood pressure | «Normal» PaCO2 |
| Cyanosis | |
| Silent chest | |
| Poor respiratory effort | |
| Acute severe (any one of) |
|
| Peak flow 33–50% | |
| Respiratory rate ≥ 25 breaths per minute | |
| Heart rate ≥ 110 beats per minute | |
| Unable to complete sentences in one breath | |
| Moderate | Worsening symptoms |
| Peak flow 50–80% best or predicted | |
| No features of acute severe asthma |
An acute asthma exacerbation is commonly referred to as an asthma attack. The classic symptoms are shortness of breath, wheezing, and chest tightness.[21] The wheezing is most often when breathing out.[109] While these are the primary symptoms of asthma,[110] some people present primarily with coughing, and in severe cases, air motion may be significantly impaired such that no wheezing is heard.[108] In children, chest pain is often present.[111]
Signs occurring during an asthma attack include the use of accessory muscles of respiration (sternocleidomastoid and scalene muscles of the neck), there may be a paradoxical pulse (a pulse that is weaker during inhalation and stronger during exhalation), and over-inflation of the chest.[112] A blue color of the skin and nails may occur from lack of oxygen.[113]
In a mild exacerbation the peak expiratory flow rate (PEFR) is ≥200 L/min, or ≥50% of the predicted best.[114] Moderate is defined as between 80 and 200 L/min, or 25% and 50% of the predicted best, while severe is defined as ≤ 80 L/min, or ≤25% of the predicted best.[114]
Acute severe asthma, previously known as status asthmaticus, is an acute exacerbation of asthma that does not respond to standard treatments of bronchodilators and corticosteroids.[115] Half of cases are due to infections with others caused by allergen, air pollution, or insufficient or inappropriate medication use.[115]
Brittle asthma is a kind of asthma distinguishable by recurrent, severe attacks.[108] Type 1 brittle asthma is a disease with wide peak flow variability, despite intense medication. Type 2 brittle asthma is background well-controlled asthma with sudden severe exacerbations.[108]
Exercise-induced
Exercise can trigger bronchoconstriction both in people with or without asthma.[116] It occurs in most people with asthma and up to 20% of people without asthma.[116] Exercise-induced bronchoconstriction is common in professional athletes. The highest rates are among cyclists (up to 45%), swimmers, and cross-country skiers.[117] While it may occur with any weather conditions, it is more common when it is dry and cold.[118] Inhaled beta2-agonists do not appear to improve athletic performance among those without asthma,[119] however, oral doses may improve endurance and strength.[120][121]
Occupational
Asthma as a result of (or worsened by) workplace exposures is a commonly reported occupational disease.[122] Many cases, however, are not reported or recognized as such.[123][124] It is estimated that 5–25% of asthma cases in adults are work-related. A few hundred different agents have been implicated, with the most common being: isocyanates, grain and wood dust, colophony, soldering flux, latex, animals, and aldehydes. The employment associated with the highest risk of problems include: those who spray paint, bakers and those who process food, nurses, chemical workers, those who work with animals, welders, hairdressers and timber workers.[122]
Aspirin-exacerbated respiratory disease
Aspirin-exacerbated respiratory disease (AERD), also known as aspirin-induced asthma, affects up to 9% of asthmatics.[125] AERD consists of asthma, nasal polyps, sinus disease, and respiratory reactions to aspirin and other NSAID medications (such as ibuprofen and naproxen).[126] People often also develop loss of smell and most experience respiratory reactions to alcohol.[127]
Alcohol-induced asthma
Alcohol may worsen asthmatic symptoms in up to a third of people.[128] This may be even more common in some ethnic groups such as the Japanese and those with aspirin-exacerbated respiratory disease.[128] Other studies have found improvement in asthmatic symptoms from alcohol.[128]
Non-atopic asthma
Non-atopic asthma, also known as intrinsic or non-allergic, makes up between 10 and 33% of cases. There is negative skin test to common inhalant allergens. Often it starts later in life, and women are more commonly affected than men. Usual treatments may not work as well.[129] The concept that «non-atopic» is synonymous with «non-allergic» is called into question by epidemiological data that the prevalence of asthma is closely related to the serum IgE level standardized for age and sex (P<0.0001), indicating that asthma is almost always associated with some sort of IgE-related reaction and therefore has an allergic basis, although not all the allergic stimuli that cause asthma appear to have been included in the battery of aeroallergens studied (the «missing antigen(s)» hypothesis).[130] For example, an updated systematic review and meta-analysis of population-attributable risk (PAR) of Chlamydia pneumoniae biomarkers in chronic asthma found that the PAR for C. pneumoniae-specific IgE was 47%.[131]
Infectious asthma
When queried, asthma patients may report that their first asthma symptoms began after an acute lower respiratory tract illness. This type of history has been labelled the «infectious asthma» (IA) syndrome,[132] or as «asthma associated with infection» (AAWI)[133] to distinguish infection-associated asthma initiation from the well known association of respiratory infections with asthma exacerbations. Reported prevalences of IA for adults range from around 40% in a primary care practice[132] to 70% in a specialty practice treating mainly severe asthma patients.[134] The true population prevalence of IA in adult-onset asthma is unknown because clinicians are not trained to elicit this type of history routinely, and recollection in child-onset asthma is challenging.
Differential diagnosis
Many other conditions can cause symptoms similar to those of asthma. In children, symptoms may be due to other upper airway diseases such as allergic rhinitis and sinusitis, as well as other causes of airway obstruction including foreign body aspiration, tracheal stenosis, laryngotracheomalacia, vascular rings, enlarged lymph nodes or neck masses.[135] Bronchiolitis and other viral infections may also produce wheezing.[136] According to European Respiratory Society, it may not be suitable to label wheezing preschool children with the term «asthma» because there is lack of clinical data on inflammation in airways.[137] In adults, COPD, congestive heart failure, airway masses, as well as drug-induced coughing due to ACE inhibitors may cause similar symptoms. In both populations vocal cord dysfunction may present similarly.[135]
Chronic obstructive pulmonary disease can coexist with asthma and can occur as a complication of chronic asthma. After the age of 65, most people with obstructive airway disease will have asthma and COPD. In this setting, COPD can be differentiated by increased airway neutrophils, abnormally increased wall thickness, and increased smooth muscle in the bronchi. However, this level of investigation is not performed due to COPD and asthma sharing similar principles of management: corticosteroids, long-acting beta-agonists, and smoking cessation.[138] It closely resembles asthma in symptoms, is correlated with more exposure to cigarette smoke, an older age, less symptom reversibility after bronchodilator administration, and decreased likelihood of family history of atopy.[139][140]
Prevention
The evidence for the effectiveness of measures to prevent the development of asthma is weak.[141] The World Health Organization recommends decreasing risk factors such as tobacco smoke, air pollution, chemical irritants including perfume, and the number of lower respiratory infections.[142][143] Other efforts that show promise include: limiting smoke exposure in utero, breastfeeding, and increased exposure to daycare or large families, but none are well supported enough to be recommended for this indication.[141]
Early pet exposure may be useful.[144] Results from exposure to pets at other times are inconclusive[145] and it is only recommended that pets be removed from the home if a person has allergic symptoms to said pet.[146]
Dietary restrictions during pregnancy or when breast feeding have not been found to be effective at preventing asthma in children and are not recommended.[146] Omega-3 consumption, mediterranean diet and anti-oxidants have been suggested by some studies that might help preventing crisis but the evidence is still inconclusive.[147]
Reducing or eliminating compounds known to sensitive people from the work place may be effective.[122] It is not clear if annual influenza vaccinations affects the risk of exacerbations.[148] Immunization, however, is recommended by the World Health Organization.[149] Smoking bans are effective in decreasing exacerbations of asthma.[150]
Management
While there is no cure for asthma, symptoms can typically be improved.[151] The most effective treatment for asthma is identifying triggers, such as cigarette smoke, pets or other allergens, and eliminating exposure to them. If trigger avoidance is insufficient, the use of medication is recommended. Pharmaceutical drugs are selected based on, among other things, the severity of illness and the frequency of symptoms. Specific medications for asthma are broadly classified into fast-acting and long-acting categories.[152][153] The medications listed below have demonstrated efficacy in improving asthma symptoms, however «real world» use-effectiveness is limited as around half of people with asthma worldwide remain sub-optimally controlled, even when treated.[154][155][156] People with asthma may remain sub-optimally controlled either because optimum doses of asthma medications do not work (called «refractory» asthma) or because individuals are either unable (e.g. inability to afford treatment, poor inhaler technique) or unwilling (e.g., wish to avoid side effects of corticosteroids) to take optimum doses of prescribed asthma medications (called «difficult to treat» asthma). In practice, it is not possible to distinguish «refractory» from «difficult to treat» categories for patients who have never taken optimum doses of asthma medications. A related issue is that the asthma efficacy trials upon which the pharmacological treatment guidelines are based have systematically excluded the majority of people with asthma.[157][158] For example, asthma efficacy treatment trials always exclude otherwise eligible people who smoke, and smoking blunts the efficacy of inhaled corticosteroids, the mainstay of asthma control management.[159][160][161]
Bronchodilators are recommended for short-term relief of symptoms. In those with occasional attacks, no other medication is needed. If mild persistent disease is present (more than two attacks a week), low-dose inhaled corticosteroids or alternatively, a leukotriene antagonist or a mast cell stabilizer by mouth is recommended. For those who have daily attacks, a higher dose of inhaled corticosteroids is used. In a moderate or severe exacerbation, corticosteroids by mouth are added to these treatments.[8]
People with asthma have higher rates of anxiety, psychological stress, and depression.[162][163] This is associated with poorer asthma control.[162] Cognitive behavioral therapy may improve quality of life, asthma control, and anxiety levels in people with asthma.[162]
Improving people’s knowledge about asthma and using a written action plan has been identified as an important component of managing asthma.[164] Providing educational sessions that include information specific to a person’s culture is likely effective.[165] More research is necessary to determine if increasing preparedness and knowledge of asthma among school staff and families using home-based and school interventions results in long term improvements in safety for children with asthma.[166][167][168] School-based asthma self-management interventions, which attempt to improve knowledge of asthma, its triggers and the importance of regular practitioner review, may reduce hospital admissions and emergency department visits. These interventions may also reduce the number of days children experience asthma symptoms and may lead to small improvements in asthma-related quality of life.[169] More research is necessary to determine if shared-decision-making is helpful for managing adults with asthma[170] or if a personalized asthma action plan is effective and necessary.[171] Some people with asthma use pulse oximeters to monitor their own blood oxygen levels during an asthma attack. However, there is no evidence regarding the use in these instances.[172]
Lifestyle modification
Avoidance of triggers is a key component of improving control and preventing attacks. The most common triggers include allergens, smoke (from tobacco or other sources), air pollution, non selective beta-blockers, and sulfite-containing foods.[173][174] Cigarette smoking and second-hand smoke (passive smoke) may reduce the effectiveness of medications such as corticosteroids.[175] Laws that limit smoking decrease the number of people hospitalized for asthma.[150] Dust mite control measures, including air filtration, chemicals to kill mites, vacuuming, mattress covers and others methods had no effect on asthma symptoms.[64] There is insufficient evidence to suggest that dehumidifiers are helpful for controlling asthma.[176]
Overall, exercise is beneficial in people with stable asthma.[177] Yoga could provide small improvements in quality of life and symptoms in people with asthma.[178] More research is necessary to determine how effective weight loss is on improving quality of life, the usage of health care services, and adverse effects for people of all ages with asthma.[179][180]
Medications
Medications used to treat asthma are divided into two general classes: quick-relief medications used to treat acute symptoms; and long-term control medications used to prevent further exacerbation.[152] Antibiotics are generally not needed for sudden worsening of symptoms or for treating asthma at any time.[181][182]
Medications of asthma exacerbations
Salbutamol metered dose inhaler commonly used to treat asthma attacks.
- Short-acting beta2-adrenoceptor agonists (SABA), such as salbutamol (albuterol USAN) are the first line treatment for asthma symptoms.[8] They are recommended before exercise in those with exercise induced symptoms.[183]
- Anticholinergic medications, such as ipratropium, provide additional benefit when used in combination with SABA in those with moderate or severe symptoms and may prevent hospitalizations.[8][184][185] Anticholinergic bronchodilators can also be used if a person cannot tolerate a SABA.[104] If a child requires admission to hospital additional ipratropium does not appear to help over a SABA.[186] For children over 2 years old with acute asthma symptoms, inhaled anticholinergic medications taken alone is safe but is not as effective as inhaled SABA or SABA combined with inhaled anticholinergic medication.[187][184] Adults who receive combined inhaled medications that includes short-acting anticholinergics and SABA may be at risk for increased adverse effects such as experiencing a tremor, agitation, and heart beat palpitations compared to people who are treated with SABA by itself.[185]
- Older, less selective adrenergic agonists, such as inhaled epinephrine, have similar efficacy to SABAs.[188] They are however not recommended due to concerns regarding excessive cardiac stimulation.[189]
- Corticosteroids can also help with the acute phase of an exacerbation because of their antiinflamatory properties. The benefit of systemic and oral corticosteroids is well established. Inhaled or nebulized corticosteroids can also be used.[147] For adults and children who are in the hospital due to acute asthma, systemic (IV) corticosteroids improve symptoms.[190][191] A short course of corticosteroids after an acute asthma exacerbation may help prevent relapses and reduce hospitalizations.[192]
- Other remedies, less established, are intravenous or nebulized magnesium sulfate and helium mixed with oxygen. Aminophylline could be used with caution as well.[147]
- Mechanical ventilation is the last resort in case of severe hypoxemia.[147]
- Intravenous administration of the drug aminophylline does not provide an improvement in bronchodilation when compared to standard inhaled beta-2 agonist treatment.[193] Aminophylline treatment is associated with more adverse effects compared to inhaled beta-2 agonist treatment.[193]
Long–term control
- Corticosteroids are generally considered the most effective treatment available for long-term control.[152] Inhaled forms are usually used except in the case of severe persistent disease, in which oral corticosteroids may be needed.[152] Dosage depends on the severity of symptoms.[194] High dosage and long term use might lead to the appearance of common adverse effects which are growth delay, adrenal suppression, and osteoporosis.[147] Continuous (daily) use of an inhaled corticosteroid, rather than its intermitted use, seems to provide better results in controlling asthma exacerbations.[147] Commonly used corticosteroids are budesonide, fluticasone, mometasone and ciclesonide.[147]
- Long-acting beta-adrenoceptor agonists (LABA) such as salmeterol and formoterol can improve asthma control, at least in adults, when given in combination with inhaled corticosteroids.[195][196] In children this benefit is uncertain.[195][197][196] When used without steroids they increase the risk of severe side-effects,[198] and with corticosteroids they may slightly increase the risk.[199][200] Evidence suggests that for children who have persistent asthma, a treatment regime that includes LABA added to inhaled corticosteroids may improve lung function but does not reduce the amount of serious exacerbations.[201] Children who require LABA as part of their asthma treatment may need to go to the hospital more frequently.[201]
- Leukotriene receptor antagonists (anti-leukotriene agents such as montelukast and zafirlukast) may be used in addition to inhaled corticosteroids, typically also in conjunction with a LABA.[17][202][203][204] For adults or adolescents who have persistent asthma that is not controlled very well, the addition of anti-leukotriene agents along with daily inhaled corticosteriods improves lung function and reduces the risk of moderate and severe asthma exacerbations.[203] Anti-leukotriene agents may be effective alone for adolescents and adults, however there is no clear research suggesting which people with asthma would benefit from anti-leukotriene receptor alone.[205] In those under five years of age, anti-leukotriene agents were the preferred add-on therapy after inhaled corticosteroids.[147][206] A 2013 Cochrane systematic review concluded that anti-leukotriene agents appear to be of little benefit when added to inhaled steroids for treating children.[207] A similar class of drugs, 5-LOX inhibitors, may be used as an alternative in the chronic treatment of mild to moderate asthma among older children and adults.[17][208] As of 2013 there is one medication in this family known as zileuton.[17]
- Mast cell stabilizers (such as cromolyn sodium) are safe alternatives to corticosteroids but not preferred because they have to be administered frequently.[152][17]
- Oral Theophyllines are sometimes used for controlling chronic asthma, but their used is minimized because of their side effects.[147]
- Omalizumab, a monoclonal Antibody Against IgE, is a novel way to lessen exacerbations by lessening the levels of circulating IgE that play a significant role at allergic asthma.[147][209]
- Anticholinergic medications such as ipratropium bromide have not been shown to be beneficial for treating chronic asthma in children over 2 years old,[210] but is not suggested for routine treatment of chronic asthma in adults.[211]
- There is no strong evidence to recommend chloroquine medication as a replacement for taking corticosteroids by mouth (for those who are not able to tolerate inhaled steroids).[212] Methotrexate is not suggested as a replacement for taking corticosteriods by mouth («steroid sparing») due to the adverse effects associated with taking methotrexate and the minimal relief provided for asthma symptoms.[213]
- Macrolide antibiotics, particularly the azalide macrolide azithromycin, are a recently added GINA-recommended treatment option for both eosinophilic and non-eosinophilic severe, refractory asthma based on azithromycin’s efficacy in reducing moderate and severe exacerbations combined.[214][215] Azithromycin’s mechanism of action is not established, and could involve pathogen- and/or host-directed anti-inflammatory activities.[216] Limited clinical observations suggest that some patients with new-onset asthma and with «difficult-to-treat» asthma (including those with the asthma-COPD overlap syndrome — ACOS) may respond dramatically to azithromycin.[217][218] However, these groups of asthma patients have not been studied in randomized treatment trials and patient selection needs to be carefully individualized.
For children with asthma which is well-controlled on combination therapy of inhaled corticosteroids (ICS) and long-acting beta2-agonists (LABA), the benefits and harms of stopping LABA and stepping down to ICS-only therapy are uncertain.[219] In adults who have stable asthma while they are taking a combination of LABA and inhaled corticosteroids (ICS), stopping LABA may increase the risk of asthma exacerbations that require treatment with corticosteroids by mouth.[220] Stopping LABA probably makes little or no important difference to asthma control or asthma-related quality of life.[220] Whether or not stopping LABA increases the risk of serious adverse events or exacerbations requiring an emergency department visit or hospitalisation is uncertain.[220]
Delivery methods
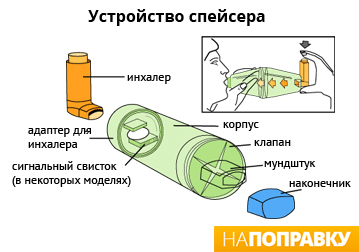
Medications are typically provided as metered-dose inhalers (MDIs) in combination with an asthma spacer or as a dry powder inhaler. The spacer is a plastic cylinder that mixes the medication with air, making it easier to receive a full dose of the drug. A nebulizer may also be used. Nebulizers and spacers are equally effective in those with mild to moderate symptoms. However, insufficient evidence is available to determine whether a difference exists in those with severe disease.[221] For delivering short-acting beta-agonists in acute asthma in children, spacers may have advantages compared to nebulisers, but children with life-threatening asthma have not been studied.[222] There is no strong evidence for the use of intravenous LABA for adults or children who have acute asthma.[223] There is insufficient evidence to directly compare the effectiveness of a metered-dose inhaler attached to a homemade spacer compared to commercially available spacer for treating children with asthma.[224]
Adverse effects
Long-term use of inhaled corticosteroids at conventional doses carries a minor risk of adverse effects.[225] Risks include thrush, the development of cataracts, and a slightly slowed rate of growth.[225][226][227] Rinsing the mouth after the use of inhaled steroids can decrease the risk of thrush.[228] Higher doses of inhaled steroids may result in lower bone mineral density.[229]
Others
Inflammation in the lungs can be estimated by the level of exhaled nitric oxide.[230][231] The use of exhaled nitric oxide levels (FeNO) to guide asthma medication dosing may have small benefits for preventing asthma attacks but the potential benefits are not strong enough for this approach to be universally recommended as a method to guide asthma therapy in adults or children.[230][231]
When asthma is unresponsive to usual medications, other options are available for both emergency management and prevention of flareups. Additional options include:
- Humidified Oxygen to alleviate hypoxia if saturations fall below 92%.[147]
- Corticosteroid by mouth are recommended with five days of prednisone being the same 2 days of dexamethasone.[232] One review recommended a seven-day course of steroids.[233]
- Magnesium sulfate intravenous treatment increases bronchodilation when used in addition to other treatment in moderate severe acute asthma attacks.[18][234][235] In adults intravenous treatment results in a reduction of hospital admissions.[236] Low levels of evidence suggest that inhaled (nebulised) magnesium sulfate may have a small benefit for treating acute asthma in adults.[237] Overall, high quality evidence do not indicate a large benefit for combining magnesium sulfate with standard inhaled treatments for adults with asthma.[237]
- Heliox, a mixture of helium and oxygen, may also be considered in severe unresponsive cases.[18]
- Intravenous salbutamol is not supported by available evidence and is thus used only in extreme cases.[238]
- Methylxanthines (such as theophylline) were once widely used, but do not add significantly to the effects of inhaled beta-agonists.[238] Their use in acute exacerbations is controversial.[239]
- The dissociative anesthetic ketamine is theoretically useful if intubation and mechanical ventilation is needed in people who are approaching respiratory arrest; however, there is no evidence from clinical trials to support this.[240]
- For those with severe persistent asthma not controlled by inhaled corticosteroids and LABAs, bronchial thermoplasty may be an option.[241] It involves the delivery of controlled thermal energy to the airway wall during a series of bronchoscopies.[241][242] While it may increase exacerbation frequency in the first few months it appears to decrease the subsequent rate. Effects beyond one year are unknown.[243]
- Monoclonal antibody injections such as mepolizumab,[244] dupilumab,[245] or omalizumab may be useful in those with poorly controlled atopic asthma.[246] However, as of 2019 these medications are expensive and their use is therefore reserved for those with severe symptoms to achieve cost-effectiveness.[247] Monoclonal antibodies targeting interleukin-5 (IL-5) or its receptor (IL-5R), including mepolizumab, reslizumab or benralizumab, in addition to standard care in severe asthma is effective in reducing the rate of asthma exacerbations. There is limited evidence for improved health-related quality of life and lung function.[248]
- Evidence suggests that sublingual immunotherapy in those with both allergic rhinitis and asthma improve outcomes.[249]
- It is unclear if non-invasive positive pressure ventilation in children is of use as it has not been sufficiently studied.[250]
Alternative medicine
Many people with asthma, like those with other chronic disorders, use alternative treatments; surveys show that roughly 50% use some form of unconventional therapy.[251][252] There is little data to support the effectiveness of most of these therapies.
Evidence is insufficient to support the usage of vitamin C or vitamin E for controlling asthma.[253][254] There is tentative support for use of vitamin C in exercise induced bronchospasm.[255] Fish oil dietary supplements (marine n-3 fatty acids)[256] and reducing dietary sodium[257] do not appear to help improve asthma control. In people with mild to moderate asthma, treatment with vitamin D supplementation may reduce the risk of asthma exacerbations, however, it is not clear if this is only helpful for people who have low vitamin D levels to begin with (low baseline vitamin D).[258] There is no strong evidence to suggest that vitamin D supplements improve day-to-day asthma symptoms or a person’s lung function.[258] There is no strong evidence to suggest that adults with asthma should avoid foods that contain monosodium glutamate (MSG).[259] There have not been enough high-quality studies performed to determine if children with asthma should avoid eating food that contains MSG.[259]
Acupuncture is not recommended for the treatment as there is insufficient evidence to support its use.[260][261] Air ionisers show no evidence that they improve asthma symptoms or benefit lung function; this applied equally to positive and negative ion generators.[262] Manual therapies, including osteopathic, chiropractic, physiotherapeutic and respiratory therapeutic maneuvers, have insufficient evidence to support their use in treating asthma.[263] The Buteyko breathing technique for controlling hyperventilation may result in a reduction in medication use; however, the technique does not have any effect on lung function.[153] Thus an expert panel felt that evidence was insufficient to support its use.[260] There is no clear evidence that breathing exercises are effective for treating children with asthma.[264]
Prognosis
The prognosis for asthma is generally good, especially for children with mild disease.[265] Mortality has decreased over the last few decades due to better recognition and improvement in care.[266] In 2010 the death rate was 170 per million for males and 90 per million for females.[267] Rates vary between countries by 100 fold.[267]
Globally it causes moderate or severe disability in 19.4 million people as of 2004 (16 million of which are in low and middle income countries).[268] Of asthma diagnosed during childhood, half of cases will no longer carry the diagnosis after a decade.[77] Airway remodeling is observed, but it is unknown whether these represent harmful or beneficial changes.[269] Early treatment with corticosteroids seems to prevent or ameliorates a decline in lung function.[270] Asthma in children also has negative effects on quality of life of their parents.[271]
-
Asthma deaths per million persons in 2012
0–10
11–13
14–17
18–23
24–32
33–43
44–50
51–66
67–95
96–251
-
Disability-adjusted life year for asthma per 100,000 inhabitants in 2004.[272]
no data
0-100
100–150
150–200
200–250
250–300
300–350
350–400
400–450
450–500
500–550
550–600
>600
Epidemiology
Rates of asthma in 2017[273]
In 2019, approximately 262 million people worldwide were affected by asthma and approximately 461,000 people died from the disease.[9] Rates vary between countries with prevalences between 1 and 18%.[22] It is more common in developed than developing countries.[22] One thus sees lower rates in Asia, Eastern Europe and Africa.[21] Within developed countries it is more common in those who are economically disadvantaged while in contrast in developing countries it is more common in the affluent.[22] The reason for these differences is not well known.[22] Low and middle income countries make up more than 80% of the mortality.[274]
While asthma is twice as common in boys as girls,[22] severe asthma occurs at equal rates.[275] In contrast adult women have a higher rate of asthma than men[22] and it is more common in the young than the old.[21] In 2010, children with asthma experienced over 900,000 emergency department visits, making it the most common reason for admission to the hospital following an emergency department visit in the US in 2011.[276][277]
Global rates of asthma have increased significantly between the 1960s and 2008[19][278] with it being recognized as a major public health problem since the 1970s.[21] Rates of asthma have plateaued in the developed world since the mid-1990s with recent increases primarily in the developing world.[279] Asthma affects approximately 7% of the population of the United States[198] and 5% of people in the United Kingdom.[280] Canada, Australia and New Zealand have rates of about 14–15%.[281]
The average death rate from 2011 to 2015 from asthma in the UK was about 50% higher than the average for the European Union and had increased by about 5% in that time.[282] Children are more likely see a physician due to asthma symptoms after school starts in September.[283]
Population-based epidemiological studies describe temporal associations between acute respiratory illnesses, asthma, and development of severe asthma with irreversible airflow limitation (known as the asthma-chronic obstructive pulmonary disease «overlap» syndrome, or ACOS).[284][285][286] Additional prospective population-based data indicate that ACOS seems to represent a form of severe asthma, characterised by more frequent hospitalisations, and to be the result of early-onset asthma that has progressed to fixed airflow obstruction.[287]
Economics
From 2000 to 2010, the average cost per asthma-related hospital stay in the United States for children remained relatively stable at about $3,600, whereas the average cost per asthma-related hospital stay for adults increased from $5,200 to $6,600.[288] In 2010, Medicaid was the most frequent primary payer among children and adults aged 18–44 years in the United States; private insurance was the second most frequent payer.[288] Among both children and adults in the lowest income communities in the United States there is a higher rate of hospital stays for asthma in 2010 than those in the highest income communities.[288]
History
1907 advertisement for Grimault’s Indian Cigarettes, promoted as a means of relieving asthma. They contained belladonna and cannabis.
Asthma was recognized in ancient Egypt and was treated by drinking an incense mixture known as kyphi.[20] It was officially named as a specific respiratory problem by Hippocrates circa 450 BC, with the Greek word for «panting» forming the basis of our modern name.[21] In 200 BC it was believed to be at least partly related to the emotions.[29] In the 12th century the Jewish physician-philosopher Maimonides wrote a treatise on asthma in Arabic, based partly on Arabic sources, in which he discussed the symptoms, proposed various dietary and other means of treatment, and emphasized the importance of climate and clean air.[289]
In 1873, one of the first papers in modern medicine on the subject tried to explain the pathophysiology of the disease while one in 1872, concluded that asthma can be cured by rubbing the chest with chloroform liniment.[290][291] Medical treatment in 1880 included the use of intravenous doses of a drug called pilocarpine.[292] In 1886, F. H. Bosworth theorized a connection between asthma and hay fever.[293] Epinephrine was first referred to in the treatment of asthma in 1905.[294] Oral corticosteroids began to be used for this condition in the 1950s while inhaled corticosteroids and selective short acting beta agonist came into wide use in the 1960s.[295][296]
A well-documented case in the 19th century was that of young Theodore Roosevelt (1858–1919). At that time there was no effective treatment. Roosevelt’s youth was in large part shaped by his poor health partly related to his asthma. He experienced recurring nighttime asthma attacks that felt as if he was being smothered to death, terrifying the boy and his parents.[297]
During the 1930s to 1950s, asthma was known as one of the «holy seven» psychosomatic illnesses. Its cause was considered to be psychological, with treatment often based on psychoanalysis and other talking cures.[298] As these psychoanalysts interpreted the asthmatic wheeze as the suppressed cry of the child for its mother, they considered the treatment of depression to be especially important for individuals with asthma.[298]
In January 2021, an appeal court in France overturned a deportation order against a 40-year-old Bangladeshi man, who was a patient of asthma. His lawyers had argued that the dangerous levels of pollution in Bangladesh could possibly lead to worsening of his health condition, or even premature death.[299]
Notes
- ^ GINA 2011, p. 18
- ^ Jones, Daniel (2011). Roach, Peter; Setter, Jane; Esling, John (eds.). Cambridge English Pronouncing Dictionary (18th ed.). Cambridge University Press. ISBN 978-0-521-15255-6.
- ^ Wells, John C. (2008). Longman Pronunciation Dictionary (3rd ed.). Longman. ISBN 978-1-4058-8118-0.
- ^ a b c d Drazen GM, Bel EH (2020). «81. Asthma». In Goldman L, Schafer AI (eds.). Goldman-Cecil Medicine. Vol. 1 (26th ed.). Philadelphia: Elsevier. pp. 527–535. ISBN 978-0-323-55087-1.
- ^ a b c d e f g h i j «Asthma Fact sheet №307». WHO. November 2013. Archived from the original on June 29, 2011. Retrieved 3 March 2016.
- ^ a b c Lemanske RF, Busse WW (February 2010). «Asthma: clinical expression and molecular mechanisms». The Journal of Allergy and Clinical Immunology. 125 (2 Suppl 2): S95-102. doi:10.1016/j.jaci.2009.10.047. PMC 2853245. PMID 20176271.
- ^ a b NHLBI Guideline 2007, pp. 169–72
- ^ a b c d e NHLBI Guideline 2007, p. 214
- ^ a b c d «Asthma–Level 3 cause» (PDF). The Lancet. 396: S108–S109. October 2020.
- ^ NHLBI Guideline 2007, pp. 11–12
- ^ GINA 2011, p. 20,51
- ^ a b c Yawn BP (September 2008). «Factors accounting for asthma variability: achieving optimal symptom control for individual patients» (PDF). Primary Care Respiratory Journal. 17 (3): 138–147. doi:10.3132/pcrj.2008.00004. PMC 6619889. PMID 18264646. Archived (PDF) from the original on 2009-03-26.
- ^ a b Kumar V, Abbas AK, Fausto N, Aster J (2010). Robbins and Cotran pathologic basis of disease (8th ed.). Saunders. p. 688. ISBN 978-1-4160-3121-5. OCLC 643462931.
- ^ Stedman’s Medical Dictionary (28 ed.). Lippincott Williams & Wilkins. 2005. ISBN 978-0-7817-3390-8.
- ^ GINA 2011, p. 71
- ^ GINA 2011, p. 33
- ^ a b c d e Scott JP, Peters-Golden M (September 2013). «Antileukotriene agents for the treatment of lung disease». American Journal of Respiratory and Critical Care Medicine. 188 (5): 538–44. doi:10.1164/rccm.201301-0023PP. PMID 23822826.
- ^ a b c NHLBI Guideline 2007, pp. 373–75
- ^ a b Anandan C, Nurmatov U, van Schayck OC, Sheikh A (February 2010). «Is the prevalence of asthma declining? Systematic review of epidemiological studies». Allergy. 65 (2): 152–67. doi:10.1111/j.1398-9995.2009.02244.x. PMID 19912154. S2CID 19525219.
- ^ a b Manniche L (1999). Sacred luxuries: fragrance, aromatherapy, and cosmetics in ancient Egypt. Cornell University Press. pp. 49. ISBN 978-0-8014-3720-5.
- ^ a b c d e f g h i j k l m n Murray JF (2010). «Ch. 38 Asthma». In Mason RJ, Murray JF, Broaddus VC, Nadel JA, Martin TR, King Jr TE, Schraufnagel DE (eds.). Murray and Nadel’s textbook of respiratory medicine (5th ed.). Elsevier. ISBN 978-1-4160-4710-0.
- ^ a b c d e f g h i GINA 2011, pp. 2–5
- ^ Jindal SK, ed. (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. p. 242. ISBN 978-93-5025-073-0. Archived from the original on 2016-04-24.
- ^ George RB (2005). Chest medicine : essentials of pulmonary and critical care medicine (5th ed.). Philadelphia: Lippincott Williams & Wilkins. p. 62. ISBN 978-0-7817-5273-2. Archived from the original on 2016-05-05.
- ^ British Guideline 2009, p. 14
- ^ GINA 2011, pp. 8–9
- ^ Boulet LP (April 2009). «Influence of comorbid conditions on asthma». The European Respiratory Journal. 33 (4): 897–906. doi:10.1183/09031936.00121308. PMID 19336592.
- ^ Boulet LP, Boulay MÈ (June 2011). «Asthma-related comorbidities». Expert Review of Respiratory Medicine. 5 (3): 377–393. doi:10.1586/ers.11.34. PMID 21702660.
- ^ a b Harver A, Kotses H, eds. (2010). Asthma, Health and Society: A Public Health Perspective. New York: Springer. p. 315. ISBN 978-0-387-78285-0. Retrieved 6 April 2021.
- ^ Thomas M, Bruton A, Moffat M, Cleland J (September 2011). «Asthma and psychological dysfunction». Primary Care Respiratory Journal. 20 (3): 250–256. doi:10.4104/pcrj.2011.00058. PMC 6549858. PMID 21674122.
- ^ He X, Cheng G, He L, Liao B, Du Y, Xie X, et al. (January 2021). «Adults with current asthma but not former asthma have higher all-cause and cardiovascular mortality: a population-based prospective cohort study». Scientific Reports. 11 (1): 1329. Bibcode:2021NatSR..11.1329H. doi:10.1038/s41598-020-79264-4. PMC 7809422. PMID 33446724.
- ^ Silva GE, Sherrill DL, Guerra S, Barbee RA (July 2004). «Asthma as a risk factor for COPD in a longitudinal study». Chest. 126 (1): 59–65. doi:10.1378/chest.126.1.59. PMID 15249443.
- ^ de Marco R, Marcon A, Rossi A, Antó JM, Cerveri I, Gislason T, et al. (September 2015). «Asthma, COPD and overlap syndrome: a longitudinal study in young European adults». The European Respiratory Journal. 46 (3): 671–679. doi:10.1183/09031936.00008615. PMID 26113674. S2CID 2169875.
- ^ Gibson PG, McDonald VM (July 2015). «Asthma-COPD overlap 2015: now we are six». Thorax. 70 (7): 683–691. doi:10.1136/thoraxjnl-2014-206740. PMID 25948695. S2CID 38550372.
- ^ Thomsen HS, Webb JA, eds. (2014). Contrast media : safety issues and ESUR guidelines (Third ed.). Dordrecht: Springer. p. 54. ISBN 978-3-642-36724-3.
- ^ Agostini BA, Collares KF, Costa FD, Correa MB, Demarco FF (August 2019). «The role of asthma in caries occurrence — meta-analysis and meta-regression». The Journal of Asthma. 56 (8): 841–852. doi:10.1080/02770903.2018.1493602. PMID 29972654. S2CID 49694304.
- ^ a b Thomas MS, Parolia A, Kundabala M, Vikram M (June 2010). «Asthma and oral health: a review». Australian Dental Journal. 55 (2): 128–133. doi:10.1111/j.1834-7819.2010.01226.x. PMID 20604752.
- ^ a b Martinez FD (January 2007). «Genes, environments, development and asthma: a reappraisal». The European Respiratory Journal. 29 (1): 179–84. doi:10.1183/09031936.00087906. PMID 17197483.
- ^ Miller RL, Ho SM (March 2008). «Environmental epigenetics and asthma: current concepts and call for studies». American Journal of Respiratory and Critical Care Medicine. 177 (6): 567–73. doi:10.1164/rccm.200710-1511PP. PMC 2267336. PMID 18187692.
- ^ Choudhry S, Seibold MA, Borrell LN, Tang H, Serebrisky D, Chapela R, et al. (July 2007). «Dissecting complex diseases in complex populations: asthma in latino americans». Proceedings of the American Thoracic Society. 4 (3): 226–33. doi:10.1513/pats.200701-029AW. PMC 2647623. PMID 17607004.
- ^ Dietert RR (September 2011). «Maternal and childhood asthma: risk factors, interactions, and ramifications». Reproductive Toxicology. 32 (2): 198–204. doi:10.1016/j.reprotox.2011.04.007. PMID 21575714.
- ^ Tan DJ, Walters EH, Perret JL, Lodge CJ, Lowe AJ, Matheson MC, Dharmage SC (February 2015). «Age-of-asthma onset as a determinant of different asthma phenotypes in adults: a systematic review and meta-analysis of the literature». Expert Review of Respiratory Medicine. 9 (1): 109–23. doi:10.1586/17476348.2015.1000311. PMID 25584929. S2CID 23213216.
- ^ Kelly FJ, Fussell JC (August 2011). «Air pollution and airway disease». Clinical and Experimental Allergy. 41 (8): 1059–71. doi:10.1111/j.1365-2222.2011.03776.x. PMID 21623970. S2CID 37717160.
- ^ «Occupational Asthmagens — New York State Department of Health».
- ^ «Occupational Asthmagens — HSE».
- ^ GINA 2011, p. 6
- ^ GINA 2011, p. 61
- ^ a b Gold DR, Wright R (2005). «Population disparities in asthma». Annual Review of Public Health. 26: 89–113. doi:10.1146/annurev.publhealth.26.021304.144528. PMID 15760282.
- ^ «Urban Air Pollution and Health Inequities: A Workshop Report». Environmental Health Perspectives. 109 (s3): 357–374. 2001. doi:10.1289/ehp.01109s3357. ISSN 0091-6765.
- ^ Brooks N, Sethi R (February 1997). «The Distribution of Pollution: Community Characteristics and Exposure to Air Toxics». Journal of Environmental Economics and Management. 32 (2): 233–50. doi:10.1006/jeem.1996.0967.
- ^ McGwin G, Lienert J, Kennedy JI (March 2010). «Formaldehyde exposure and asthma in children: a systematic review». Environmental Health Perspectives. 118 (3): 313–7. doi:10.1289/ehp.0901143. PMC 2854756. PMID 20064771.
- ^ Jaakkola JJ, Knight TL (July 2008). «The role of exposure to phthalates from polyvinyl chloride products in the development of asthma and allergies: a systematic review and meta-analysis». Environmental Health Perspectives. 116 (7): 845–53. doi:10.1289/ehp.10846. PMC 2453150. PMID 18629304.
- ^ Bornehag CG, Nanberg E (April 2010). «Phthalate exposure and asthma in children». International Journal of Andrology. 33 (2): 333–45. doi:10.1111/j.1365-2605.2009.01023.x. PMID 20059582.
- ^ Mamane A, Baldi I, Tessier JF, Raherison C, Bouvier G (June 2015). «Occupational exposure to pesticides and respiratory health». European Respiratory Review. 24 (136): 306–19. doi:10.1183/16000617.00006014. PMC 9487813. PMID 26028642.
- ^ Mamane A, Raherison C, Tessier JF, Baldi I, Bouvier G (September 2015). «Environmental exposure to pesticides and respiratory health». European Respiratory Review. 24 (137): 462–73. doi:10.1183/16000617.00006114. PMC 9487696. PMID 26324808.
- ^ Gruenwald, Talor; Seals, Brady A.; Knibbs, Luke D.; Hosgood, H. Dean (January 2023). «Population Attributable Fraction of Gas Stoves and Childhood Asthma in the United States». International Journal of Environmental Research and Public Health. 20 (1): 75. doi:10.3390/ijerph20010075. ISSN 1660-4601. PMC 9819315. PMID 36612391.
- ^ Heintze K, Petersen KU (June 2013). «The case of drug causation of childhood asthma: antibiotics and paracetamol». European Journal of Clinical Pharmacology. 69 (6): 1197–209. doi:10.1007/s00228-012-1463-7. PMC 3651816. PMID 23292157.
- ^ Henderson AJ, Shaheen SO (March 2013). «Acetaminophen and asthma». Paediatric Respiratory Reviews. 14 (1): 9–15, quiz 16. doi:10.1016/j.prrv.2012.04.004. PMID 23347656.
- ^ Cheelo M, Lodge CJ, Dharmage SC, Simpson JA, Matheson M, Heinrich J, Lowe AJ (January 2015). «Paracetamol exposure in pregnancy and early childhood and development of childhood asthma: a systematic review and meta-analysis». Archives of Disease in Childhood. 100 (1): 81–9. doi:10.1136/archdischild-2012-303043. PMID 25429049. S2CID 13520462.
- ^ van de Loo KF, van Gelder MM, Roukema J, Roeleveld N, Merkus PJ, Verhaak CM (January 2016). «Prenatal maternal psychological stress and childhood asthma and wheezing: a meta-analysis». The European Respiratory Journal. 47 (1): 133–46. doi:10.1183/13993003.00299-2015. PMID 26541526.
- ^ Ahluwalia SK, Matsui EC (April 2011). «The indoor environment and its effects on childhood asthma». Current Opinion in Allergy and Clinical Immunology. 11 (2): 137–43. doi:10.1097/ACI.0b013e3283445921. PMID 21301330. S2CID 35075329.
- ^ Arshad SH (January 2010). «Does exposure to indoor allergens contribute to the development of asthma and allergy?». Current Allergy and Asthma Reports. 10 (1): 49–55. doi:10.1007/s11882-009-0082-6. PMID 20425514. S2CID 30418306.
- ^ Custovic A, Simpson A (2012). «The role of inhalant allergens in allergic airways disease». Journal of Investigational Allergology & Clinical Immunology. 22 (6): 393–401, qiuz follow 401. PMID 23101182.
- ^ a b Gøtzsche PC, Johansen HK (April 2008). «House dust mite control measures for asthma». The Cochrane Database of Systematic Reviews. 2008 (2): CD001187. doi:10.1002/14651858.CD001187.pub3. PMC 8786269. PMID 18425868.
- ^ Calderón MA, Linneberg A, Kleine-Tebbe J, De Blay F, Hernandez Fernandez de Rojas D, Virchow JC, Demoly P (July 2015). «Respiratory allergy caused by house dust mites: What do we really know?». The Journal of Allergy and Clinical Immunology. 136 (1): 38–48. doi:10.1016/j.jaci.2014.10.012. PMID 25457152.
- ^ Sauni R, Verbeek JH, Uitti J, Jauhiainen M, Kreiss K, Sigsgaard T (February 2015). «Remediating buildings damaged by dampness and mould for preventing or reducing respiratory tract symptoms, infections and asthma». The Cochrane Database of Systematic Reviews. 2015 (2): CD007897. doi:10.1002/14651858.CD007897.pub3. PMC 6769180. PMID 25715323.
- ^ a b NHLBI Guideline 2007, p. 11
- ^ Ramsey CD, Celedón JC (January 2005). «The hygiene hypothesis and asthma». Current Opinion in Pulmonary Medicine. 11 (1): 14–20. doi:10.1097/01.mcp.0000145791.13714.ae. PMID 15591883. S2CID 44556390.
- ^ Bufford JD, Gern JE (May 2005). «The hygiene hypothesis revisited». Immunology and Allergy Clinics of North America. 25 (2): 247–62, v–vi. doi:10.1016/j.iac.2005.03.005. PMID 15878454.
- ^ a b Brooks C, Pearce N, Douwes J (February 2013). «The hygiene hypothesis in allergy and asthma: an update». Current Opinion in Allergy and Clinical Immunology. 13 (1): 70–7. doi:10.1097/ACI.0b013e32835ad0d2. PMID 23103806. S2CID 23664343.
- ^ Rao D, Phipatanakul W (October 2011). «Impact of environmental controls on childhood asthma». Current Allergy and Asthma Reports. 11 (5): 414–20. doi:10.1007/s11882-011-0206-7. PMC 3166452. PMID 21710109.
- ^ Murk W, Risnes KR, Bracken MB (June 2011). «Prenatal or early-life exposure to antibiotics and risk of childhood asthma: a systematic review». Pediatrics. 127 (6): 1125–38. doi:10.1542/peds.2010-2092. PMID 21606151. S2CID 26098640.
- ^ British Guideline 2009, p. 72
- ^ Neu J, Rushing J (June 2011). «Cesarean versus vaginal delivery: long-term infant outcomes and the hygiene hypothesis». Clinics in Perinatology. 38 (2): 321–31. doi:10.1016/j.clp.2011.03.008. PMC 3110651. PMID 21645799.
- ^ Von Hertzen LC, Haahtela T (February 2004). «Asthma and atopy – the price of affluence?». Allergy. 59 (2): 124–37. doi:10.1046/j.1398-9995.2003.00433.x. PMID 14763924. S2CID 34049674.
- ^ a b Martinez FD (July 2007). «CD14, endotoxin, and asthma risk: actions and interactions». Proceedings of the American Thoracic Society. 4 (3): 221–5. doi:10.1513/pats.200702-035AW. PMC 2647622. PMID 17607003.
- ^ a b c Elward G, Douglas KS (2010). Asthma. London: Manson Pub. pp. 27–29. ISBN 978-1-84076-513-7. Archived from the original on 2016-05-17.
- ^ a b c Ober C, Hoffjan S (March 2006). «Asthma genetics 2006: the long and winding road to gene discovery». Genes and Immunity. 7 (2): 95–100. doi:10.1038/sj.gene.6364284. PMID 16395390.
- ^ Halapi E, Bjornsdottir US (January 2009). «Overview on the current status of asthma genetics». The Clinical Respiratory Journal. 3 (1): 2–7. doi:10.1111/j.1752-699X.2008.00119.x. PMID 20298365. S2CID 36471997.
- ^ a b Rapini RP, Bolognia JL, Jorizzo JL (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN 978-1-4160-2999-1.
- ^ GINA 2011, p. 4
- ^ Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. (January 2013). «2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides». Arthritis and Rheumatism. 65 (1): 1–11. doi:10.1002/art.37715. PMID 23045170.
- ^ Beuther DA (January 2010). «Recent insight into obesity and asthma». Current Opinion in Pulmonary Medicine. 16 (1): 64–70. doi:10.1097/MCP.0b013e3283338fa7. PMID 19844182. S2CID 34157182.
- ^ Holguin F, Fitzpatrick A (March 2010). «Obesity, asthma, and oxidative stress». Journal of Applied Physiology. 108 (3): 754–9. doi:10.1152/japplphysiol.00702.2009. PMID 19926826.
- ^ Wood LG, Gibson PG (July 2009). «Dietary factors lead to innate immune activation in asthma». Pharmacology & Therapeutics. 123 (1): 37–53. doi:10.1016/j.pharmthera.2009.03.015. PMID 19375453.
- ^ O’Rourke ST (October 2007). «Antianginal actions of beta-adrenoceptor antagonists». American Journal of Pharmaceutical Education. 71 (5): 95. doi:10.5688/aj710595. PMC 2064893. PMID 17998992.
- ^ Salpeter S, Ormiston T, Salpeter E (2002). «Cardioselective beta-blockers for reversible airway disease». The Cochrane Database of Systematic Reviews. 2011 (4): CD002992. doi:10.1002/14651858.CD002992. PMC 8689715. PMID 12519582.
- ^ Morales DR, Jackson C, Lipworth BJ, Donnan PT, Guthrie B (April 2014). «Adverse respiratory effect of acute β-blocker exposure in asthma: a systematic review and meta-analysis of randomized controlled trials». Chest. 145 (4): 779–786. doi:10.1378/chest.13-1235. PMID 24202435.
- ^ Covar RA, Macomber BA, Szefler SJ (February 2005). «Medications as asthma triggers». Immunology and Allergy Clinics of North America. 25 (1): 169–90. doi:10.1016/j.iac.2004.09.009. PMID 15579370.
- ^ Lai T, Wu M, Liu J, Luo M, He L, Wang X, et al. (February 2018). «Acid-Suppressive Drug Use During Pregnancy and the Risk of Childhood Asthma: A Meta-analysis». Pediatrics. 141 (2): e20170889. doi:10.1542/peds.2017-0889. PMID 29326337.
- ^ a b c d Baxi SN, Phipatanakul W (April 2010). «The role of allergen exposure and avoidance in asthma». Adolescent Medicine. 21 (1): 57–71, viii–ix. PMC 2975603. PMID 20568555.
- ^ Sharpe RA, Bearman N, Thornton CR, Husk K, Osborne NJ (January 2015). «Indoor fungal diversity and asthma: a meta-analysis and systematic review of risk factors». The Journal of Allergy and Clinical Immunology. 135 (1): 110–22. doi:10.1016/j.jaci.2014.07.002. PMID 25159468.
- ^ Chen E, Miller GE (November 2007). «Stress and inflammation in exacerbations of asthma». Brain, Behavior, and Immunity. 21 (8): 993–9. doi:10.1016/j.bbi.2007.03.009. PMC 2077080. PMID 17493786.
- ^ Pike KC, Akhbari M, Kneale D, Harris KM (March 2018). «Interventions for autumn exacerbations of asthma in children». The Cochrane Database of Systematic Reviews. 2018 (3): CD012393. doi:10.1002/14651858.CD012393.pub2. PMC 6494188. PMID 29518252.
- ^ a b NHLBI Guideline 2007, p. 42
- ^ GINA 2011, p. 20
- ^ American Academy of Allergy, Asthma, and Immunology. «Five things physicians and patients should question» (PDF). Choosing Wisely. ABIM Foundation. Archived from the original (PDF) on November 3, 2012. Retrieved August 14, 2012.
- ^ Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma. National Heart, Lung, and Blood Institute (US). 2007. 07-4051 – via NCBI.
- ^ Welsh EJ, Bara A, Barley E, Cates CJ (January 2010). Welsh EJ (ed.). «Caffeine for asthma» (PDF). The Cochrane Database of Systematic Reviews. 2010 (1): CD001112. doi:10.1002/14651858.CD001112.pub2. PMC 7053252. PMID 20091514.
- ^ NHLBI Guideline 2007, p. 58
- ^ Pinnock H, Shah R (April 2007). «Asthma». BMJ. 334 (7598): 847–50. doi:10.1136/bmj.39140.634896.BE. PMC 1853223. PMID 17446617.
- ^ NHLBI Guideline 2007, p. 59
- ^ a b Moore WC, Pascual RM (June 2010). «Update in asthma 2009». American Journal of Respiratory and Critical Care Medicine. 181 (11): 1181–7. doi:10.1164/rccm.201003-0321UP. PMC 3269238. PMID 20516492.
- ^ a b Self T, Chrisman C, Finch C (2009). «22. Asthma». In Koda-Kimble MA, Alldredge BK, et al. (eds.). Applied therapeutics: the clinical use of drugs (9th ed.). Philadelphia: Lippincott Williams & Wilkins. OCLC 230848069.
- ^ Delacourt C (June 2004). «[Bronchial changes in untreated asthma]» [Bronchial changes in untreated asthma]. Archives de Pediatrie. 11 (Suppl 2): 71s–73s. doi:10.1016/S0929-693X(04)90003-6. PMID 15301800.
- ^ Schiffman, George (18 December 2009). «Chronic obstructive pulmonary disease». MedicineNet. Archived from the original on 28 August 2010. Retrieved 2 September 2010.
- ^ Gibson PG, McDonald VM (July 2015). «Asthma-COPD overlap 2015: now we are six». Thorax. 70 (7): 683–691. doi:10.1136/thoraxjnl-2014-206740. PMID 25948695. S2CID 38550372.
- ^ a b c d British Guideline 2009, p. 54
- ^ Current Review of Asthma. London: Current Medicine Group. 2003. p. 42. ISBN 978-1-4613-1095-2. Archived from the original on 2017-09-08.
- ^ Barnes PJ (2008). «Asthma». In Fauci AS, Braunwald E, Kasper DL (eds.). Harrison’s Principles of Internal Medicine (17th ed.). New York: McGraw-Hill. pp. 1596–607. ISBN 978-0-07-146633-2.
- ^ McMahon M (2011). Pediatrics a competency-based companion. Philadelphia, PA: Saunders/Elsevier. ISBN 978-1-4160-5350-7.
- ^ Maitre B, Similowski T, Derenne JP (September 1995). «Physical examination of the adult patient with respiratory diseases: inspection and palpation». The European Respiratory Journal. 8 (9): 1584–93. doi:10.1183/09031936.95.08091584. PMID 8575588. S2CID 30677275. Archived from the original on 2015-04-29.
- ^ Werner HA (June 2001). «Status asthmaticus in children: a review». Chest. 119 (6): 1913–29. doi:10.1378/chest.119.6.1913. PMID 11399724.
- ^ a b Shiber JR, Santana J (May 2006). «Dyspnea». The Medical Clinics of North America. 90 (3): 453–79. doi:10.1016/j.mcna.2005.11.006. PMID 16473100.
- ^ a b Shah R, Saltoun CA (2012). «Chapter 14: Acute severe asthma (status asthmaticus)». Allergy and Asthma Proceedings. 33 (3): 47–50. doi:10.2500/aap.2012.33.3547. PMID 22794687.
- ^ a b Khan DA (Jan–Feb 2012). «Exercise-induced bronchoconstriction: burden and prevalence». Allergy and Asthma Proceedings. 33 (1): 1–6. doi:10.2500/aap.2012.33.3507. PMID 22370526.
- ^ Wuestenfeld JC, Wolfarth B (January 2013). «Special considerations for adolescent athletic and asthmatic patients». Open Access Journal of Sports Medicine. 4: 1–7. doi:10.2147/OAJSM.S23438. PMC 3871903. PMID 24379703.
- ^ GINA 2011, p. 17
- ^ Carlsen KH, Anderson SD, Bjermer L, Bonini S, Brusasco V, Canonica W, et al. (May 2008). European Respiratory, Society; European Academy of Allergy and Clinical, Immunology; GA(2)LEN. «Treatment of exercise-induced asthma, respiratory and allergic disorders in sports and the relationship to doping: Part II of the report from the Joint Task Force of European Respiratory Society (ERS) and European Academy of Allergy and Clinical Immunology (EAACI) in cooperation with GA(2)LEN». Allergy. 63 (5): 492–505. doi:10.1111/j.1398-9995.2008.01663.x. PMID 18394123.
- ^ Kindermann W (2007). «Do inhaled beta(2)-agonists have an ergogenic potential in non-asthmatic competitive athletes?». Sports Medicine. 37 (2): 95–102. doi:10.2165/00007256-200737020-00001. PMID 17241101. S2CID 20993439.
- ^ Pluim BM, de Hon O, Staal JB, Limpens J, Kuipers H, Overbeek SE, et al. (January 2011). «β₂-Agonists and physical performance: a systematic review and meta-analysis of randomized controlled trials». Sports Medicine. 41 (1): 39–57. doi:10.2165/11537540-000000000-00000. PMID 21142283. S2CID 189906919.
- ^ a b c Baur X, Aasen TB, Burge PS, Heederik D, Henneberger PK, Maestrelli P, et al. (June 2012). ERS Task Force on the Management of Work-related, Asthma. «The management of work-related asthma guidelines: a broader perspective». European Respiratory Review. 21 (124): 125–39. doi:10.1183/09059180.00004711. PMC 9487296. PMID 22654084.
- ^ Kunnamo I, ed. (2005). Evidence-based medicine guidelines. Chichester: Wiley. p. 214. ISBN 978-0-470-01184-3.
- ^ Frew AJ (2008). «Chapter 42: Occupational Asthma». In Castro M, Kraft M (eds.). Clinical Asthma. Philadelphia: Mosby / Elsevier. ISBN 978-0-323-07081-2.
- ^ Chang JE, White A, Simon RA, Stevenson DD (2012). «Aspirin-exacerbated respiratory disease: burden of disease». Allergy and Asthma Proceedings. 33 (2): 117–21. doi:10.2500/aap.2012.33.3541. PMID 22525387.
- ^ «Aspirin Exacerbated Respiratory Disease (AERD)». www.aaaai.org. American Academy of Allergy Asthma & Immunology. August 3, 2018. Archived from the original on September 18, 2018. Retrieved August 2, 2018.
- ^ Kennedy JL, Stoner AN, Borish L (November 2016). «Aspirin-exacerbated respiratory disease: Prevalence, diagnosis, treatment, and considerations for the future». American Journal of Rhinology & Allergy. 30 (6): 407–413. doi:10.2500/ajra.2016.30.4370. PMC 5108840. PMID 28124651.
- ^ a b c Adams KE, Rans TS (December 2013). «Adverse reactions to alcohol and alcoholic beverages». Annals of Allergy, Asthma & Immunology. 111 (6): 439–45. doi:10.1016/j.anai.2013.09.016. PMID 24267355.
- ^ Peters SP (2014). «Asthma phenotypes: nonallergic (intrinsic) asthma». The Journal of Allergy and Clinical Immunology. In Practice. 2 (6): 650–652. doi:10.1016/j.jaip.2014.09.006. PMID 25439352.
- ^ Burrows B, Martinez FD, Halonen M, Barbee RA, Cline MG (February 1989). «Association of asthma with serum IgE levels and skin-test reactivity to allergens». The New England Journal of Medicine. 320 (5): 271–277. doi:10.1056/NEJM198902023200502. PMID 2911321.
- ^ Hahn DL (2021). «Chlamydia pneumoniae and chronic asthma: Updated systematic review and meta-analysis of population attributable risk». PLOS ONE. 16 (4): e0250034. Bibcode:2021PLoSO..1650034H. doi:10.1371/journal.pone.0250034. PMC 8055030. PMID 33872336.
- ^ a b Hahn DL (August 1995). «Infectious asthma: a reemerging clinical entity?». The Journal of Family Practice. 41 (2): 153–157. PMID 7636455.
- ^ Hahn DL, Peeling RW, Dillon E, McDonald R, Saikku P (February 2000). «Serologic markers for Chlamydia pneumoniae in asthma». Annals of Allergy, Asthma & Immunology. 84 (2): 227–233. doi:10.1016/S1081-1206(10)62760-3. PMID 10719781.
- ^ Wagshul FA, Brown DT, Schultek NM, Hahn DL (2021). «Outcomes of Antibiotics in Adults with «Difficult to Treat» Asthma or the Overlap Syndrome». Journal of Asthma and Allergy. 14: 703–712. doi:10.2147/JAA.S313480. PMC 8216074. PMID 34163182.
- ^ a b NHLBI Guideline 2007, p. 46
- ^ Lichtenstein R (2013). Pediatric emergencies. Philadelphia: Elsevier. p. 1022. ISBN 978-0-323-22733-9. Archived from the original on 2017-09-08.
- ^ Van Bever HP, Han E, Shek L, Yi Chng S, Goh D (November 2010). «An approach to preschool wheezing: to label as asthma?». The World Allergy Organization Journal. 3 (11): 253–257. doi:10.1097/WOX.0b013e3181fc7fa1. PMC 3651058. PMID 23282943.
- ^ Gibson PG, McDonald VM, Marks GB (September 2010). «Asthma in older adults». Lancet. 376 (9743): 803–13. doi:10.1016/S0140-6736(10)61087-2. PMID 20816547. S2CID 12275555.
- ^ Hargreave FE, Parameswaran K (August 2006). «Asthma, COPD and bronchitis are just components of airway disease». The European Respiratory Journal. 28 (2): 264–7. doi:10.1183/09031936.06.00056106. PMID 16880365.
- ^ Diaz PK (2009). «23. Chronic obstructive pulmonary disease». Applied therapeutics: the clinical use of drugs (9th ed.). Philadelphia: Lippincott Williams & Wilkins.
- ^ a b NHLBI Guideline 2007, pp. 184–85
- ^ «Asthma». World Health Organization. April 2017. Archived from the original on 29 June 2011. Retrieved 30 May 2017.
- ^ Henneberger PK (April 2007). «Work-exacerbated asthma». Current Opinion in Allergy and Clinical Immunology. 7 (2): 146–51. doi:10.1097/ACI.0b013e328054c640. PMID 17351467. S2CID 20728967.
- ^ Lodge CJ, Allen KJ, Lowe AJ, Hill DJ, Hosking CS, Abramson MJ, Dharmage SC (2012). «Perinatal cat and dog exposure and the risk of asthma and allergy in the urban environment: a systematic review of longitudinal studies». Clinical & Developmental Immunology. 2012: 176484. doi:10.1155/2012/176484. PMC 3251799. PMID 22235226.
- ^ Chen CM, Tischer C, Schnappinger M, Heinrich J (January 2010). «The role of cats and dogs in asthma and allergy—a systematic review». International Journal of Hygiene and Environmental Health. 213 (1): 1–31. doi:10.1016/j.ijheh.2009.12.003. PMID 20053584.
- ^ a b Prescott SL, Tang ML (May 2005). Australasian Society of Clinical Immunology and, Allergy. «The Australasian Society of Clinical Immunology and Allergy position statement: Summary of allergy prevention in children». The Medical Journal of Australia. 182 (9): 464–7. doi:10.5694/j.1326-5377.2005.tb06787.x. PMID 15865590. S2CID 8172491.
- ^ a b c d e f g h i j k Bertrand P, Faccin AB (31 January 2020). «Asthma: Treatment». In Bertrand P, Sánchez I (eds.). Pediatric Respiratory Diseases: A Comprehensive Textbook. Springer Nature. pp. 415–428. doi:10.1007/978-3-030-26961-6. ISBN 978-3-03-026961-6. S2CID 210985844.
- ^ Cates CJ, Rowe BH (February 2013). «Vaccines for preventing influenza in people with asthma». The Cochrane Database of Systematic Reviews. 2 (2): CD000364. doi:10.1002/14651858.CD000364.pub4. PMC 6999427. PMID 23450529.
- ^ «Strategic Advisory Group of Experts on Immunization — report of the extraordinary meeting on the influenza A (H1N1) 2009 pandemic, 7 July 2009». Relevé Épidémiologique Hebdomadaire. 84 (30): 301–4. July 2009. PMID 19630186.
- ^ a b Been JV, Nurmatov UB, Cox B, Nawrot TS, van Schayck CP, Sheikh A (May 2014). «Effect of smoke-free legislation on perinatal and child health: a systematic review and meta-analysis». Lancet. 383 (9928): 1549–60. doi:10.1016/S0140-6736(14)60082-9. PMID 24680633. S2CID 8532979.
- ^ Ripoll BC, Leutholtz I (2011). Exercise and disease management (2nd ed.). Boca Raton: CRC Press. p. 100. ISBN 978-1-4398-2759-8. Archived from the original on 2016-05-06.
- ^ a b c d e NHLBI Guideline 2007, p. 213
- ^ a b «British Guideline on the Management of Asthma» (PDF). Scottish Intercollegiate Guidelines Network. 2008. Archived (PDF) from the original on 19 August 2008. Retrieved 2008-08-04.
- ^ Rabe KF, Adachi M, Lai CK, Soriano JB, Vermeire PA, Weiss KB, Weiss ST (July 2004). «Worldwide severity and control of asthma in children and adults: the global asthma insights and reality surveys». The Journal of Allergy and Clinical Immunology. 114 (1): 40–47. doi:10.1016/j.jaci.2004.04.042. PMID 15241342.
- ^ Demoly P, Gueron B, Annunziata K, Adamek L, Walters RD (June 2010). «Update on asthma control in five European countries: results of a 2008 survey». European Respiratory Review. 19 (116): 150–157. doi:10.1183/09059180.00002110. PMC 9682581. PMID 20956184. S2CID 13408225.
- ^ FitzGerald JM, Boulet LP, McIvor RA, Zimmerman S, Chapman KR (2006). «Asthma control in Canada remains suboptimal: the Reality of Asthma Control (TRAC) study». Canadian Respiratory Journal. 13 (5): 253–259. doi:10.1155/2006/753083. PMC 2683303. PMID 16896426.
- ^ Herland K, Akselsen JP, Skjønsberg OH, Bjermer L (January 2005). «How representative are clinical study patients with asthma or COPD for a larger «real life» population of patients with obstructive lung disease?». Respiratory Medicine. 99 (1): 11–19. doi:10.1016/j.rmed.2004.03.026. PMID 15672843.
- ^ Travers J, Marsh S, Williams M, Weatherall M, Caldwell B, Shirtcliffe P, et al. (March 2007). «External validity of randomised controlled trials in asthma: to whom do the results of the trials apply?». Thorax. 62 (3): 219–223. doi:10.1136/thx.2006.066837. PMC 2117157. PMID 17105779.
- ^ Lazarus SC, Chinchilli VM, Rollings NJ, Boushey HA, Cherniack R, Craig TJ, et al. (April 2007). «Smoking affects response to inhaled corticosteroids or leukotriene receptor antagonists in asthma». American Journal of Respiratory and Critical Care Medicine. 175 (8): 783–790. doi:10.1164/rccm.200511-1746OC. PMC 1899291. PMID 17204725.
- ^ Stapleton M, Howard-Thompson A, George C, Hoover RM, Self TH (2011). «Smoking and asthma». Journal of the American Board of Family Medicine. 24 (3): 313–322. doi:10.3122/jabfm.2011.03.100180. PMID 21551404. S2CID 3183714.
- ^ Hayes CE, Nuss HJ, Tseng TS, Moody-Thomas S (2015). «Use of asthma control indicators in measuring inhaled corticosteroid effectiveness in asthmatic smokers: a systematic review». The Journal of Asthma. 52 (10): 996–1005. doi:10.3109/02770903.2015.1065422. PMID 26418843. S2CID 36916271.
- ^ a b c Kew KM, Nashed M, Dulay V, Yorke J (September 2016). «Cognitive behavioural therapy (CBT) for adults and adolescents with asthma». The Cochrane Database of Systematic Reviews. 2016 (9): CD011818. doi:10.1002/14651858.CD011818.pub2. PMC 6457695. PMID 27649894.
- ^ Paudyal P, Hine P, Theadom A, Apfelbacher CJ, Jones CJ, Yorke J, et al. (May 2014). «Written emotional disclosure for asthma». The Cochrane Database of Systematic Reviews (5): CD007676. doi:10.1002/14651858.CD007676.pub2. PMID 24842151.
- ^ Bhogal S, Zemek R, Ducharme FM (July 2006). «Written action plans for asthma in children». The Cochrane Database of Systematic Reviews (3): CD005306. doi:10.1002/14651858.CD005306.pub2. PMID 16856090.
- ^ McCallum GB, Morris PS, Brown N, Chang AB (August 2017). «Culture-specific programs for children and adults from minority groups who have asthma». The Cochrane Database of Systematic Reviews. 2017 (8): CD006580. doi:10.1002/14651858.CD006580.pub5. PMC 6483708. PMID 28828760.
- ^ Kew KM, Carr R, Donovan T, Gordon M (April 2017). «Asthma education for school staff». The Cochrane Database of Systematic Reviews. 2017 (4): CD012255. doi:10.1002/14651858.CD012255.pub2. PMC 6478185. PMID 28402017.
- ^ Welsh EJ, Hasan M, Li P (October 2011). «Home-based educational interventions for children with asthma». The Cochrane Database of Systematic Reviews. 2014 (10): CD008469. doi:10.1002/14651858.CD008469.pub2. PMC 8972064. PMID 21975783.
- ^ Yorke J, Shuldham C (April 2005). «Family therapy for chronic asthma in children». The Cochrane Database of Systematic Reviews. 2005 (2): CD000089. doi:10.1002/14651858.CD000089.pub2. PMC 7038646. PMID 15846599.
- ^ Harris K, Kneale D, Lasserson TJ, McDonald VM, Grigg J, Thomas J, et al. (Cochrane Airways Group) (January 2019). «School-based self-management interventions for asthma in children and adolescents: a mixed methods systematic review». The Cochrane Database of Systematic Reviews. 1 (1): CD011651. doi:10.1002/14651858.CD011651.pub2. PMC 6353176. PMID 30687940.
- ^ Kew KM, Malik P, Aniruddhan K, Normansell R (October 2017). «Shared decision-making for people with asthma». The Cochrane Database of Systematic Reviews. 2017 (10): CD012330. doi:10.1002/14651858.CD012330.pub2. PMC 6485676. PMID 28972652.
- ^ Gatheral TL, Rushton A, Evans DJ, Mulvaney CA, Halcovitch NR, Whiteley G, et al. (April 2017). «Personalised asthma action plans for adults with asthma». The Cochrane Database of Systematic Reviews. 2017 (4): CD011859. doi:10.1002/14651858.CD011859.pub2. PMC 6478068. PMID 28394084.
- ^ Welsh EJ, Carr R, et al. (Cochrane Airways Group) (September 2015). «Pulse oximeters to self monitor oxygen saturation levels as part of a personalised asthma action plan for people with asthma». The Cochrane Database of Systematic Reviews. 2015 (9): CD011584. doi:10.1002/14651858.CD011584.pub2. PMC 9426972. PMID 26410043.
- ^ NHLBI Guideline 2007, p. 69
- ^ Thomson NC, Spears M (February 2005). «The influence of smoking on the treatment response in patients with asthma». Current Opinion in Allergy and Clinical Immunology. 5 (1): 57–63. doi:10.1097/00130832-200502000-00011. PMID 15643345. S2CID 25065026.
- ^ Stapleton M, Howard-Thompson A, George C, Hoover RM, Self TH (2011). «Smoking and asthma». Journal of the American Board of Family Medicine. 24 (3): 313–322. doi:10.3122/jabfm.2011.03.100180. PMID 21551404.
- ^ Singh M, Jaiswal N (June 2013). «Dehumidifiers for chronic asthma». The Cochrane Database of Systematic Reviews (6): CD003563. doi:10.1002/14651858.CD003563.pub2. PMID 23760885.
- ^ Carson KV, Chandratilleke MG, Picot J, Brinn MP, Esterman AJ, Smith BJ (September 2013). «Physical training for asthma». The Cochrane Database of Systematic Reviews. 9 (9): CD001116. doi:10.1002/14651858.CD001116.pub4. PMID 24085631.
- ^ Yang ZY, Zhong HB, Mao C, Yuan JQ, Huang YF, Wu XY, et al. (April 2016). «Yoga for asthma». The Cochrane Database of Systematic Reviews. 4 (11): CD010346. doi:10.1002/14651858.cd010346.pub2. PMC 6880926. PMID 27115477.
- ^ Adeniyi FB, Young T (July 2012). «Weight loss interventions for chronic asthma». The Cochrane Database of Systematic Reviews (7): CD009339. doi:10.1002/14651858.CD009339.pub2. PMID 22786526.
- ^ Cheng J, Pan T, Ye GH, Liu Q (July 2005). «Calorie controlled diet for chronic asthma». The Cochrane Database of Systematic Reviews (3): CD004674. doi:10.1002/14651858.CD004674.pub2. PMID 16034941.
- ^ «QRG 153 • British guideline on the management of asthma» (PDF). SIGN. September 2016. Archived (PDF) from the original on 9 October 2016. Retrieved 6 October 2016.
- ^ Normansell R, Sayer B, Waterson S, Dennett EJ, Del Forno M, Dunleavy A (June 2018). «Antibiotics for exacerbations of asthma». The Cochrane Database of Systematic Reviews. 2018 (6): CD002741. doi:10.1002/14651858.CD002741.pub2. PMC 6513273. PMID 29938789.
- ^ Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, et al. (May 2013). «An official American Thoracic Society clinical practice guideline: exercise-induced bronchoconstriction». American Journal of Respiratory and Critical Care Medicine. 187 (9): 1016–27. doi:10.1164/rccm.201303-0437ST. PMID 23634861.
- ^ a b Griffiths B, Ducharme FM (August 2013). «Combined inhaled anticholinergics and short-acting beta2-agonists for initial treatment of acute asthma in children». The Cochrane Database of Systematic Reviews (8): CD000060. doi:10.1002/14651858.CD000060.pub2. PMID 23966133.
- ^ a b Kirkland SW, Vandenberghe C, Voaklander B, Nikel T, Campbell S, Rowe BH (January 2017). «Combined inhaled beta-agonist and anticholinergic agents for emergency management in adults with asthma». The Cochrane Database of Systematic Reviews. 1 (1): CD001284. doi:10.1002/14651858.CD001284.pub2. PMC 6465060. PMID 28076656.
- ^ Vézina K, Chauhan BF, Ducharme FM (July 2014). «Inhaled anticholinergics and short-acting beta(2)-agonists versus short-acting beta2-agonists alone for children with acute asthma in hospital». The Cochrane Database of Systematic Reviews. 7 (7): CD010283. doi:10.1002/14651858.CD010283.pub2. PMID 25080126.
- ^ Teoh L, Cates CJ, Hurwitz M, Acworth JP, van Asperen P, Chang AB (April 2012). «Anticholinergic therapy for acute asthma in children» (PDF). The Cochrane Database of Systematic Reviews (4): CD003797. doi:10.1002/14651858.CD003797.pub2. PMID 22513916.
- ^ Rodrigo GJ, Nannini LJ (March 2006). «Comparison between nebulized adrenaline and beta2 agonists for the treatment of acute asthma. A meta-analysis of randomized trials». The American Journal of Emergency Medicine. 24 (2): 217–22. doi:10.1016/j.ajem.2005.10.008. PMID 16490653.
- ^ NHLBI Guideline 2007, p. 351
- ^ Smith M, Iqbal S, Elliott TM, Everard M, Rowe BH (2003). «Corticosteroids for hospitalised children with acute asthma». The Cochrane Database of Systematic Reviews. 2003 (2): CD002886. doi:10.1002/14651858.CD002886. PMC 6999806. PMID 12804441.
- ^ Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW (2001). «Early emergency department treatment of acute asthma with systemic corticosteroids». The Cochrane Database of Systematic Reviews (1): CD002178. doi:10.1002/14651858.CD002178. PMC 7025797. PMID 11279756.
- ^ Rowe BH, Spooner CH, Ducharme FM, Bretzlaff JA, Bota GW (July 2007). «Corticosteroids for preventing relapse following acute exacerbations of asthma». The Cochrane Database of Systematic Reviews (3): CD000195. doi:10.1002/14651858.CD000195.pub2. PMID 17636617. S2CID 11992578.
- ^ a b Nair P, Milan SJ, Rowe BH (December 2012). «Addition of intravenous aminophylline to inhaled beta(2)-agonists in adults with acute asthma». The Cochrane Database of Systematic Reviews. 12 (12): CD002742. doi:10.1002/14651858.CD002742.pub2. PMC 7093892. PMID 23235591.
- ^ NHLBI Guideline 2007, p. 218
- ^ a b Ducharme FM, Ni Chroinin M, Greenstone I, Lasserson TJ (May 2010). Ducharme FM (ed.). «Addition of long-acting beta2-agonists to inhaled corticosteroids versus same dose inhaled corticosteroids for chronic asthma in adults and children». The Cochrane Database of Systematic Reviews (5): CD005535. doi:10.1002/14651858.CD005535.pub2. PMC 4169792. PMID 20464739.
- ^ a b Ni Chroinin M, Greenstone I, Lasserson TJ, Ducharme FM (October 2009). «Addition of inhaled long-acting beta2-agonists to inhaled steroids as first line therapy for persistent asthma in steroid-naive adults and children». The Cochrane Database of Systematic Reviews (4): CD005307. doi:10.1002/14651858.CD005307.pub2. PMC 4170786. PMID 19821344.
- ^ Ducharme FM, Ni Chroinin M, Greenstone I, Lasserson TJ (April 2010). Ducharme FM (ed.). «Addition of long-acting beta2-agonists to inhaled steroids versus higher dose inhaled steroids in adults and children with persistent asthma». The Cochrane Database of Systematic Reviews (4): CD005533. doi:10.1002/14651858.CD005533.pub2. PMC 4169793. PMID 20393943.
- ^ a b Fanta CH (March 2009). «Asthma». The New England Journal of Medicine. 360 (10): 1002–14. doi:10.1056/NEJMra0804579. PMID 19264689.
- ^ Cates CJ, Cates MJ (April 2012). Cates CJ (ed.). «Regular treatment with formoterol for chronic asthma: serious adverse events». The Cochrane Database of Systematic Reviews. 4 (4): CD006923. doi:10.1002/14651858.CD006923.pub3. PMC 4017186. PMID 22513944.
- ^ Cates CJ, Cates MJ (July 2008). Cates CJ (ed.). «Regular treatment with salmeterol for chronic asthma: serious adverse events». The Cochrane Database of Systematic Reviews (3): CD006363. doi:10.1002/14651858.CD006363.pub2. PMC 4015854. PMID 18646149.
- ^ a b Chauhan BF, Chartrand C, Ni Chroinin M, Milan SJ, Ducharme FM (November 2015). «Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children». The Cochrane Database of Systematic Reviews. 2015 (11): CD007949. doi:10.1002/14651858.CD007949.pub2. PMC 4167878. PMID 26594816.
- ^ Chauhan BF, Ducharme FM (January 2014). «Addition to inhaled corticosteroids of long-acting beta2-agonists versus anti-leukotrienes for chronic asthma» (PDF). The Cochrane Database of Systematic Reviews (1): CD003137. doi:10.1002/14651858.CD003137.pub5. PMID 24459050.
- ^ a b Chauhan BF, Jeyaraman MM, Singh Mann A, Lys J, Abou-Setta AM, Zarychanski R, Ducharme FM (March 2017). «Addition of anti-leukotriene agents to inhaled corticosteroids for adults and adolescents with persistent asthma». The Cochrane Database of Systematic Reviews. 3 (4): CD010347. doi:10.1002/14651858.CD010347.pub2. PMC 6464690. PMID 28301050.
- ^ Watts K, Chavasse RJ (May 2012). Watts K (ed.). «Leukotriene receptor antagonists in addition to usual care for acute asthma in adults and children». The Cochrane Database of Systematic Reviews. 5 (5): CD006100. doi:10.1002/14651858.CD006100.pub2. PMC 7387678. PMID 22592708.
- ^ Miligkos M, Bannuru RR, Alkofide H, Kher SR, Schmid CH, Balk EM (November 2015). «Leukotriene-receptor antagonists versus placebo in the treatment of asthma in adults and adolescents: a systematic review and meta-analysis». Annals of Internal Medicine. 163 (10): 756–67. doi:10.7326/M15-1059. PMC 4648683. PMID 26390230.
- ^ British Guideline 2009, p. 43
- ^ Chauhan BF, Ben Salah R, Ducharme FM (October 2013). «Addition of anti-leukotriene agents to inhaled corticosteroids in children with persistent asthma». The Cochrane Database of Systematic Reviews (10): CD009585. doi:10.1002/14651858.CD009585.pub2. PMC 4235447. PMID 24089325.
- ^ «Zyflo (Zileuton tablets)» (PDF). United States Food and Drug Administration. Cornerstone Therapeutics Inc. June 2012. p. 1. Archived (PDF) from the original on 13 December 2014. Retrieved 12 December 2014.
- ^ Solèr M (September 2001). «Omalizumab, a monoclonal antibody against IgE for the treatment of allergic diseases». International Journal of Clinical Practice. 55 (7): 480–483. PMID 11594260.
- ^ McDonald NJ, Bara AI (2003). «Anticholinergic therapy for chronic asthma in children over two years of age». The Cochrane Database of Systematic Reviews. 2014 (3): CD003535. doi:10.1002/14651858.CD003535. PMC 8717339. PMID 12917970.
- ^ Westby M, Benson M, Gibson P (2004). «Anticholinergic agents for chronic asthma in adults». The Cochrane Database of Systematic Reviews. 2017 (3): CD003269. doi:10.1002/14651858.CD003269.pub2. PMC 6483359. PMID 15266477.
- ^ Dean T, Dewey A, Bara A, Lasserson TJ, Walters EH (2003). «Chloroquine as a steroid sparing agent for asthma». The Cochrane Database of Systematic Reviews (4): CD003275. doi:10.1002/14651858.CD003275. PMID 14583965.
- ^ Davies H, Olson L, Gibson P (2000). «Methotrexate as a steroid sparing agent for asthma in adults». The Cochrane Database of Systematic Reviews. 1998 (2): CD000391. doi:10.1002/14651858.CD000391. PMC 6483672. PMID 10796540.
- ^ Hiles SA, McDonald VM, Guilhermino M, Brusselle GG, Gibson PG (November 2019). «Does maintenance azithromycin reduce asthma exacerbations? An individual participant data meta-analysis». The European Respiratory Journal. 54 (5). doi:10.1183/13993003.01381-2019. PMID 31515407. S2CID 202567597.
- ^ GINA. «Difficult-to-Treat and Severe Asthma in Adolescent and Adult Patients: Diagnosis and Management». Global Initiative for Asthma. Retrieved 1 August 2021.
- ^ Steel HC, Theron AJ, Cockeran R, Anderson R, Feldman C (2012). «Pathogen- and host-directed anti-inflammatory activities of macrolide antibiotics». Mediators of Inflammation. 2012: 584262. doi:10.1155/2012/584262. PMC 3388425. PMID 22778497.
- ^ Hahn DL (December 2019). «When guideline treatment of asthma fails, consider a macrolide antibiotic». The Journal of Family Practice. 68 (10): 536, 540, 542, 545. PMID 31860697.
- ^ Wagshul FA, Brown DT, Schultek NM, Hahn DL (2021). «Outcomes of Antibiotics in Adults with «Difficult to Treat» Asthma or the Overlap Syndrome». Journal of Asthma and Allergy. 14: 703–712. doi:10.2147/JAA.S313480. PMC 8216074. PMID 34163182.
- ^ Kew KM, Beggs S, Ahmad S (May 2015). «Stopping long-acting beta2-agonists (LABA) for children with asthma well controlled on LABA and inhaled corticosteroids». The Cochrane Database of Systematic Reviews. 2017 (5): CD011316. doi:10.1002/14651858.CD011316.pub2. PMC 6486153. PMID 25997166.
- ^ a b c Ahmad S, Kew KM, Normansell R (June 2015). «Stopping long-acting beta2-agonists (LABA) for adults with asthma well controlled by LABA and inhaled corticosteroids» (PDF). The Cochrane Database of Systematic Reviews (6): CD011306. doi:10.1002/14651858.CD011306.pub2. PMID 26089258.
- ^ NHLBI Guideline 2007, p. 250
- ^ Cates CJ, Welsh EJ, Rowe BH, et al. (Cochrane Airways Group) (September 2013). «Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma». The Cochrane Database of Systematic Reviews. 2013 (9): CD000052. doi:10.1002/14651858.CD000052.pub3. PMC 7032675. PMID 24037768.
- ^ Travers AH, Milan SJ, Jones AP, Camargo CA, Rowe BH (December 2012). «Addition of intravenous beta(2)-agonists to inhaled beta(2)-agonists for acute asthma». The Cochrane Database of Systematic Reviews. 12: CD010179. doi:10.1002/14651858.CD010179. PMID 23235685.
- ^ Rodriguez C, Sossa M, Lozano JM (April 2008). «Commercial versus home-made spacers in delivering bronchodilator therapy for acute therapy in children». The Cochrane Database of Systematic Reviews. 2017 (2): CD005536. doi:10.1002/14651858.CD005536.pub2. PMC 6483735. PMID 18425921.
- ^ a b Rachelefsky G (January 2009). «Inhaled corticosteroids and asthma control in children: assessing impairment and risk». Pediatrics. 123 (1): 353–66. doi:10.1542/peds.2007-3273. PMID 19117903. S2CID 22386752.
- ^ Dahl R (August 2006). «Systemic side effects of inhaled corticosteroids in patients with asthma». Respiratory Medicine. 100 (8): 1307–17. doi:10.1016/j.rmed.2005.11.020. PMID 16412623.
- ^ Thomas MS, Parolia A, Kundabala M, Vikram M (June 2010). «Asthma and oral health: a review». Australian Dental Journal. 55 (2): 128–33. doi:10.1111/j.1834-7819.2010.01226.x. PMID 20604752.
- ^ Domino FJ, Baldor RA, Golding J, Grimes JA (2014). The 5-Minute Clinical Consult Premium 2015. Lippincott Williams & Wilkins. p. 192. ISBN 978-1-4511-9215-5.
- ^ Skoner DP (December 2016). «Inhaled corticosteroids: Effects on growth and bone health». Annals of Allergy, Asthma & Immunology. 117 (6): 595–600. doi:10.1016/j.anai.2016.07.043. PMID 27979015.
- ^ a b Petsky HL, Kew KM, Turner C, Chang AB (September 2016). «Exhaled nitric oxide levels to guide treatment for adults with asthma». The Cochrane Database of Systematic Reviews. 2016 (9): CD011440. doi:10.1002/14651858.CD011440.pub2. PMC 6457753. PMID 27580628.
- ^ a b Petsky HL, Kew KM, Chang AB (November 2016). «Exhaled nitric oxide levels to guide treatment for children with asthma». The Cochrane Database of Systematic Reviews. 11 (5): CD011439. doi:10.1002/14651858.CD011439.pub2. PMC 6432844. PMID 27825189.
- ^ Keeney GE, Gray MP, Morrison AK, Levas MN, Kessler EA, Hill GD, et al. (March 2014). «Dexamethasone for acute asthma exacerbations in children: a meta-analysis». Pediatrics. 133 (3): 493–9. doi:10.1542/peds.2013-2273. PMC 3934336. PMID 24515516.
- ^ Rowe BH, Kirkland SW, Vandermeer B, Campbell S, Newton A, Ducharme FM, Villa-Roel C (March 2017). «Prioritizing Systemic Corticosteroid Treatments to Mitigate Relapse in Adults With Acute Asthma: A Systematic Review and Network Meta-analysis». Academic Emergency Medicine. 24 (3): 371–381. doi:10.1111/acem.13107. PMID 27664401. S2CID 30182169.
- ^ Noppen M (August 2002). «Magnesium treatment for asthma: where do we stand?». Chest. 122 (2): 396–8. doi:10.1378/chest.122.2.396. PMID 12171805.
- ^ Griffiths B, Kew KM (April 2016). «Intravenous magnesium sulfate for treating children with acute asthma in the emergency department» (PDF). The Cochrane Database of Systematic Reviews. 2016 (4): CD011050. doi:10.1002/14651858.CD011050.pub2. PMC 6599814. PMID 27126744.
- ^ Kew KM, Kirtchuk L, Michell CI (May 2014). Kew KM (ed.). «Intravenous magnesium sulfate for treating adults with acute asthma in the emergency department» (PDF). The Cochrane Database of Systematic Reviews. 5 (5): CD010909. doi:10.1002/14651858.CD010909.pub2. PMID 24865567.
- ^ a b Knightly R, Milan SJ, Hughes R, Knopp-Sihota JA, Rowe BH, Normansell R, Powell C (November 2017). «Inhaled magnesium sulfate in the treatment of acute asthma». The Cochrane Database of Systematic Reviews. 2017 (11): CD003898. doi:10.1002/14651858.CD003898.pub6. PMC 6485984. PMID 29182799.
- ^ a b Rodrigo GJ, Rodrigo C, Hall JB (March 2004). «Acute asthma in adults: a review». Chest. 125 (3): 1081–102. doi:10.1378/chest.125.3.1081. PMID 15006973.
- ^ GINA 2011, p. 37
- ^ NHLBI Guideline 2007, p. 399
- ^ a b Castro M, Musani AI, Mayse ML, Shargill NS (April 2010). «Bronchial thermoplasty: a novel technique in the treatment of severe asthma». Therapeutic Advances in Respiratory Disease. 4 (2): 101–16. doi:10.1177/1753465810367505. PMID 20435668.
- ^ Boulet LP, Laviolette M (May–Jun 2012). «Is there a role for bronchial thermoplasty in the treatment of asthma?». Canadian Respiratory Journal. 19 (3): 191–2. doi:10.1155/2012/853731. PMC 3418092. PMID 22679610.
- ^ GINA 2011, p. 70
- ^ «Pulmonary-Allergy Drugs Advisory Committee Meeting». FDA. July 25, 2018. Retrieved May 9, 2019.
- ^ Sastre J, Dávila I (June 2018). «Dupilumab: A New Paradigm for the Treatment of Allergic Diseases». Journal of Investigational Allergology & Clinical Immunology. 28 (3): 139–150. doi:10.18176/jiaci.0254. PMID 29939132.
- ^ Israel E, Reddel HK (September 2017). «Severe and Difficult-to-Treat Asthma in Adults». The New England Journal of Medicine. 377 (10): 965–976. doi:10.1056/NEJMra1608969. PMID 28877019. S2CID 44767865.
- ^ McQueen RB, Sheehan DN, Whittington MD, van Boven JF, Campbell JD (August 2018). «Cost-Effectiveness of Biological Asthma Treatments: A Systematic Review and Recommendations for Future Economic Evaluations». PharmacoEconomics. 36 (8): 957–971. doi:10.1007/s40273-018-0658-x. PMID 29736895. S2CID 13681118.
- ^ Farne HA, Wilson A, Milan S, Banchoff E, Yang F, Powell CV (July 2022). «Anti-IL-5 therapies for asthma». The Cochrane Database of Systematic Reviews. 2022 (7): CD010834. doi:10.1002/14651858.CD010834.pub4. PMC 9285134. PMID 35838542.
- ^ Lin SY, Erekosima N, Kim JM, Ramanathan M, Suarez-Cuervo C, Chelladurai Y, et al. (March 2013). «Sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review». JAMA. 309 (12): 1278–88. doi:10.1001/jama.2013.2049. PMID 23532243.
- ^ Korang SK, Feinberg J, Wetterslev J, Jakobsen JC (September 2016). «Non-invasive positive pressure ventilation for acute asthma in children». The Cochrane Database of Systematic Reviews. 2016 (9): CD012067. doi:10.1002/14651858.CD012067.pub2. PMC 6457810. PMID 27687114.
- ^ Blanc PD, Trupin L, Earnest G, Katz PP, Yelin EH, Eisner MD (November 2001). «Alternative therapies among adults with a reported diagnosis of asthma or rhinosinusitis : data from a population-based survey». Chest. 120 (5): 1461–7. doi:10.1378/chest.120.5.1461. PMID 11713120.
- ^ Shenfield G, Lim E, Allen H (June 2002). «Survey of the use of complementary medicines and therapies in children with asthma». Journal of Paediatrics and Child Health. 38 (3): 252–7. doi:10.1046/j.1440-1754.2002.00770.x. PMID 12047692. S2CID 22129160.
- ^ Milan SJ, Hart A, Wilkinson M (October 2013). «Vitamin C for asthma and exercise-induced bronchoconstriction». The Cochrane Database of Systematic Reviews. 2013 (10): CD010391. doi:10.1002/14651858.CD010391.pub2. PMC 6513466. PMID 24154977.
- ^ Wilkinson M, Hart A, Milan SJ, Sugumar K (June 2014). «Vitamins C and E for asthma and exercise-induced bronchoconstriction». The Cochrane Database of Systematic Reviews. 2014 (6): CD010749. doi:10.1002/14651858.CD010749.pub2. PMC 6513032. PMID 24936673.
- ^ Hemilä H (June 2013). «Vitamin C may alleviate exercise-induced bronchoconstriction: a meta-analysis». BMJ Open. 3 (6): e002416. doi:10.1136/bmjopen-2012-002416. PMC 3686214. PMID 23794586.
- ^ Woods RK, Thien FC, Abramson MJ (2002). «Dietary marine fatty acids (fish oil) for asthma in adults and children». The Cochrane Database of Systematic Reviews. 2019 (3): CD001283. doi:10.1002/14651858.CD001283. PMC 6436486. PMID 12137622.
- ^ Pogson Z, McKeever T (March 2011). «Dietary sodium manipulation and asthma». The Cochrane Database of Systematic Reviews. 2011 (3): CD000436. doi:10.1002/14651858.CD000436.pub3. PMC 7032646. PMID 21412865.
- ^ a b Martineau AR, Cates CJ, Urashima M, Jensen M, Griffiths AP, Nurmatov U, et al. (September 2016). «Vitamin D for the management of asthma» (PDF). The Cochrane Database of Systematic Reviews. 9 (4): CD011511. doi:10.1002/14651858.CD011511.pub2. PMC 6457769. PMID 27595415.
- ^ a b Zhou Y, Yang M, Dong BR (June 2012). «Monosodium glutamate avoidance for chronic asthma in adults and children». The Cochrane Database of Systematic Reviews. 2014 (6): CD004357. doi:10.1002/14651858.CD004357.pub4. PMC 8823518. PMID 22696342.
- ^ a b NHLBI Guideline 2007, p. 240
- ^ McCarney RW, Brinkhaus B, Lasserson TJ, Linde K (2004). McCarney RW (ed.). «Acupuncture for chronic asthma». The Cochrane Database of Systematic Reviews. 2009 (1): CD000008. doi:10.1002/14651858.CD000008.pub2. PMC 7061358. PMID 14973944.
- ^ Blackhall K, Appleton S, Cates CJ (September 2012). Blackhall K (ed.). «Ionisers for chronic asthma». The Cochrane Database of Systematic Reviews. 9 (9): CD002986. doi:10.1002/14651858.CD002986.pub2. PMC 6483773. PMID 22972060.
- ^ Hondras MA, Linde K, Jones AP (April 2005). Hondras MA (ed.). «Manual therapy for asthma». The Cochrane Database of Systematic Reviews (2): CD001002. doi:10.1002/14651858.CD001002.pub2. PMID 15846609.
- ^ Macêdo TM, Freitas DA, Chaves GS, Holloway EA, Mendonça KM (April 2016). «Breathing exercises for children with asthma». The Cochrane Database of Systematic Reviews. 2016 (4): CD011017. doi:10.1002/14651858.CD011017.pub2. PMC 7104663. PMID 27070225.
- ^ Sergel MJ, Cydulka RK (September 2009). «Ch. 75: Asthma». In Wolfson AB, Harwood-Nuss A (eds.). Harwood-Nuss’ Clinical Practice of Emergency Medicine (5th ed.). Lippincott Williams & Wilkins. pp. 432–. ISBN 978-0-7817-8943-1.
- ^ NHLBI Guideline 2007, p. 1
- ^ a b «The Global Asthma Report 2014». Archived from the original on 27 April 2016. Retrieved 10 May 2016.
- ^ The global burden of disease : 2004 update ([Online-Ausg.] ed.). Geneva: World Health Organization. 2008. p. 35. ISBN 978-92-4-156371-0.
- ^ Maddox L, Schwartz DA (2002). «The pathophysiology of asthma». Annual Review of Medicine. 53: 477–98. doi:10.1146/annurev.med.53.082901.103921. PMID 11818486.
- ^ Beckett PA, Howarth PH (February 2003). «Pharmacotherapy and airway remodelling in asthma?». Thorax. 58 (2): 163–74. doi:10.1136/thorax.58.2.163. PMC 1746582. PMID 12554904.
- ^ Silva N, Carona C, Crespo C, Canavarro MC (June 2015). «Quality of life in pediatric asthma patients and their parents: a meta-analysis on 20 years of research». Expert Review of Pharmacoeconomics & Outcomes Research. 15 (3): 499–519. doi:10.1586/14737167.2015.1008459. hdl:10316/45410. PMID 25651982. S2CID 8768325.
- ^ «WHO Disease and injury country estimates». World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved November 11, 2009.
- ^ «Asthma prevalence». Our World in Data. Retrieved 15 February 2020.
- ^ World Health Organization. «WHO: Asthma». Archived from the original on 15 December 2007. Retrieved 2007-12-29.
- ^ Bush A, Menzies-Gow A (December 2009). «Phenotypic differences between pediatric and adult asthma». Proceedings of the American Thoracic Society. 6 (8): 712–719. doi:10.1513/pats.200906-046DP. PMID 20008882.
- ^ Weiss AJ, Wier LM, Stocks C, Blanchard J (June 2014). «Overview of Emergency Department Visits in the United States, 2011». HCUP Statistical Brief #174. Agency for Healthcare Research and Quality. PMID 25144109. Archived from the original on 2014-08-03.
- ^ Martin MA, Press VG, Nyenhuis SM, Krishnan JA, Erwin K, Mosnaim G, et al. (December 2016). «Care transition interventions for children with asthma in the emergency department». The Journal of Allergy and Clinical Immunology. 138 (6): 1518–1525. doi:10.1016/j.jaci.2016.10.012. PMC 5327498. PMID 27931533.
- ^ Grant EN, Wagner R, Weiss KB (August 1999). «Observations on emerging patterns of asthma in our society». The Journal of Allergy and Clinical Immunology. 104 (2 Pt 2): S1-9. doi:10.1016/S0091-6749(99)70268-X. PMID 10452783.
- ^ Bousquet J, Bousquet PJ, Godard P, Daures JP (July 2005). «The public health implications of asthma». Bulletin of the World Health Organization. 83 (7): 548–54. PMC 2626301. PMID 16175830.
- ^ Anderson HR, Gupta R, Strachan DP, Limb ES (January 2007). «50 years of asthma: UK trends from 1955 to 2004». Thorax. 62 (1): 85–90. doi:10.1136/thx.2006.066407. PMC 2111282. PMID 17189533.
- ^ Masoli M (2004). Global Burden of Asthma (PDF). p. 9. Archived from the original (PDF) on 2013-05-02.
- ^ «Asthma-related death rate in UK among highest in Europe, charity analysis finds». Pharmaceutical Journal. 3 May 2018. Archived from the original on 26 July 2020. Retrieved 13 August 2018.
- ^ «Asthma attacks triple when children return to school in September». NHS UK. 3 July 2019. Archived from the original on 26 July 2020. Retrieved 23 August 2019.
- ^ Rantala A, Jaakkola JJ, Jaakkola MS (2011). «Respiratory infections precede adult-onset asthma». PLOS ONE. 6 (12): e27912. Bibcode:2011PLoSO…627912R. doi:10.1371/journal.pone.0027912. PMC 3244385. PMID 22205932.
- ^ Yeh JJ, Wang YC, Hsu WH, Kao CH (April 2016). «Incident asthma and Mycoplasma pneumoniae: A nationwide cohort study». The Journal of Allergy and Clinical Immunology. 137 (4): 1017–1023.e6. doi:10.1016/j.jaci.2015.09.032. PMID 26586037.
- ^ Silva GE, Sherrill DL, Guerra S, Barbee RA (July 2004). «Asthma as a risk factor for COPD in a longitudinal study». Chest. 126 (1): 59–65. doi:10.1378/chest.126.1.59. PMID 15249443.
- ^ de Marco R, Marcon A, Rossi A, Antó JM, Cerveri I, Gislason T, et al. (September 2015). «Asthma, COPD and overlap syndrome: a longitudinal study in young European adults». The European Respiratory Journal. 46 (3): 671–679. doi:10.1183/09031936.00008615. PMID 26113674. S2CID 2169875.
- ^ a b c Barrett ML, Wier LM, Washington R (January 2014). «Trends in Pediatric and Adult Hospital Stays for Asthma, 2000–2010». HCUP Statistical Brief #169. Rockville, MD: Agency for Healthcare Research and Quality. PMID 24624462. Archived from the original on 2014-03-28.
- ^ Rosner F (2002). «The Life of Moses Maimonides, a Prominent Medieval Physician» (PDF). Einstein Quart J Biol Med. 19 (3): 125–28. Archived (PDF) from the original on 2009-03-05.
- ^ Thorowgood JC (November 1873). «On Bronchial Asthma». British Medical Journal. 2 (673): 600. doi:10.1136/bmj.2.673.600. PMC 2294647. PMID 20747287.
- ^ Gaskoin G (March 1872). «On the Treatment of Asthma». British Medical Journal. 1 (587): 339. doi:10.1136/bmj.1.587.339. PMC 2297349. PMID 20746575.
- ^ Berkart JB (June 1880). «The Treatment of Asthma». British Medical Journal. 1 (1016): 917–8. doi:10.1136/bmj.1.1016.917. PMC 2240555. PMID 20749537.
Berkart JB (June 1880). «The Treatment of Asthma». British Medical Journal. 1 (1017): 960–2. doi:10.1136/bmj.1.1017.960. PMC 2240530. PMID 20749546. - ^ Bosworth FH (1886). «Hay Fever, Asthma, and Allied Affections». Transactions of the Annual Meeting of the American Climatological Association. 2: 151–70. PMC 2526599. PMID 21407325.
- ^ Doig RL (February 1905). «Epinephrin; Especially in Asthma». California State Journal of Medicine. 3 (2): 54–5. PMC 1650334. PMID 18733372.
- ^ von Mutius E, Drazen JM (March 2012). «A patient with asthma seeks medical advice in 1828, 1928, and 2012». The New England Journal of Medicine. 366 (9): 827–34. doi:10.1056/NEJMra1102783. PMID 22375974. S2CID 5143546.
- ^ Crompton G (December 2006). «A brief history of inhaled asthma therapy over the last fifty years». Primary Care Respiratory Journal. 15 (6): 326–31. doi:10.1016/j.pcrj.2006.09.002. PMC 6730840. PMID 17092772.
- ^ McCullough D (1981). Mornings on Horseback: The Story of an Extraordinary Family, a Vanished Way of Life and the Unique Child Who Became Theodore Roosevelt. Simon and Schuster. pp. 93–108. ISBN 978-0-7432-1830-6. Archived from the original on 2015-04-07.
- ^ a b Opolski M, Wilson I (September 2005). «Asthma and depression: a pragmatic review of the literature and recommendations for future research». Clinical Practice and Epidemiology in Mental Health. 1: 18. doi:10.1186/1745-0179-1-18. PMC 1253523. PMID 16185365.
- ^ «Bangladeshi man with asthma wins France deportation fight». The Guardian. 12 January 2021. Retrieved 12 January 2021.
References
- National Asthma Education and Prevention Program (2007). «Guidelines for the Diagnosis and Management of Asthma». National Heart Lung and Blood Institute. EPR-3.
- «British Guideline on the Management of Asthma» (PDF). British Thoracic Society. 2012 [2008]. SIGN 101. Archived from the original (PDF) on 2008-08-19. Retrieved 2008-08-04.
- British Guideline on the Management of Asthma. British Thoracic Society. July 2019. ISBN 978-1-909103-70-2. SIGN 158.
- «Global Strategy for Asthma Management and Prevention» (PDF). Global Initiative for Asthma. 2011. Archived Reports.
External links
- Asthma at Curlie
Not to be confused with Ahimsa.
| Asthma | |
|---|---|
 |
|
| Peak flow meters are used to measure the peak expiratory flow rate, important in both monitoring and diagnosing asthma.[1] | |
| Pronunciation |
|
| Specialty | Pulmonology |
| Symptoms | Recurring episodes of wheezing, coughing, chest tightness, shortness of breath[4] |
| Complications | Gastroesophageal reflux disease (GERD), sinusitis, obstructive sleep apnea |
| Usual onset | Childhood |
| Duration | Long term[5] |
| Causes | Genetic and environmental factors[4] |
| Risk factors | Air pollution, allergens[5] |
| Diagnostic method | Based on symptoms, response to therapy, spirometry[6] |
| Treatment | Avoiding triggers, inhaled corticosteroids, salbutamol[7][8] |
| Frequency | approx. 262 million (2019)[9] |
| Deaths | approx. 461,000 (2019)[9] |
Asthma is a long-term inflammatory disease of the airways of the lungs.[5] It is characterized by variable and recurring symptoms, reversible airflow obstruction, and easily triggered bronchospasms.[10][11] Symptoms include episodes of wheezing, coughing, chest tightness, and shortness of breath.[4] These may occur a few times a day or a few times per week.[5] Depending on the person, asthma symptoms may become worse at night or with exercise.[5]
Asthma is thought to be caused by a combination of genetic and environmental factors.[4] Environmental factors include exposure to air pollution and allergens.[5] Other potential triggers include medications such as aspirin and beta blockers.[5] Diagnosis is usually based on the pattern of symptoms, response to therapy over time, and spirometry lung function testing.[6] Asthma is classified according to the frequency of symptoms, forced expiratory volume in one second (FEV1), and peak expiratory flow rate.[12] It may also be classified as atopic or non-atopic, where atopy refers to a predisposition toward developing a type 1 hypersensitivity reaction.[13][14]
There is no known cure for asthma, but it can be controlled.[5] Symptoms can be prevented by avoiding triggers, such as allergens and respiratory irritants, and suppressed with the use of inhaled corticosteroids.[7][15] Long-acting beta agonists (LABA) or antileukotriene agents may be used in addition to inhaled corticosteroids if asthma symptoms remain uncontrolled.[16][17] Treatment of rapidly worsening symptoms is usually with an inhaled short-acting beta-2 agonist such as salbutamol and corticosteroids taken by mouth.[8] In very severe cases, intravenous corticosteroids, magnesium sulfate, and hospitalization may be required.[18]
In 2019 asthma affected approximately 262 million people and caused approximately 461,000 deaths.[9] Most of the deaths occurred in the developing world.[5] Asthma often begins in childhood,[5] and the rates have increased significantly since the 1960s.[19] Asthma was recognized as early as Ancient Egypt.[20] The word «asthma» is from the Greek ἆσθμα, âsthma, which means «panting».[21]
Signs and symptoms
The sound of wheezing as heard with a stethoscope.
Asthma is characterized by recurrent episodes of wheezing, shortness of breath, chest tightness, and coughing.[22] Sputum may be produced from the lung by coughing but is often hard to bring up.[23] During recovery from an asthma attack (exacerbation), it may appear pus-like due to high levels of white blood cells called eosinophils.[24] Symptoms are usually worse at night and in the early morning or in response to exercise or cold air.[25] Some people with asthma rarely experience symptoms, usually in response to triggers, whereas others may react frequently and readily and experience persistent symptoms.[26]
Associated conditions
A number of other health conditions occur more frequently in people with asthma, including gastroesophageal reflux disease (GERD), rhinosinusitis, and obstructive sleep apnea.[27] Psychological disorders are also more common,[28] with anxiety disorders occurring in between 16 and 52% and mood disorders in 14–41%.[29] It is not known whether asthma causes psychological problems or psychological problems lead to asthma.[30] Current asthma, but not former asthma, is associated with increased all-cause mortality, heart disease mortality, and chronic lower respiratory tract disease mortality.[31] Asthma, particularly severe asthma, is strongly associated with development of chronic obstructive pulmonary disease (COPD).[32][33][34] Those with asthma, especially if it is poorly controlled, are at increased risk for radiocontrast reactions.[35]
Cavities occur more often in people with asthma.[36] This may be related to the effect of beta 2 agonists decreasing saliva.[37] These medications may also increase the risk of dental erosions.[37]
Causes
Asthma is caused by a combination of complex and incompletely understood environmental and genetic interactions.[38][39] These influence both its severity and its responsiveness to treatment.[40] It is believed that the recent increased rates of asthma are due to changing epigenetics (heritable factors other than those related to the DNA sequence) and a changing living environment.[41] Asthma that starts before the age of 12 years old is more likely due to genetic influence, while onset after age 12 is more likely due to environmental influence.[42]
Environmental
Many environmental factors have been associated with asthma’s development and exacerbation, including, allergens, air pollution, and other environmental chemicals.[43] There are some substances that are known to cause asthma in exposed people and they are called asthmagens. Some common asthmagens include ammonia, latex, pesticides, solder and welding fumes, metal or wood dusts, spraying of isocyanate paint in vehicle repair, formaldehyde, glutaraldehyde, anhydrides, glues, dyes, metal working fluids, oil mists, molds.[44][45] Smoking during pregnancy and after delivery is associated with a greater risk of asthma-like symptoms.[46] Low air quality from environmental factors such as traffic pollution or high ozone levels[47] has been associated with both asthma development and increased asthma severity.[48] Over half of cases in children in the United States occur in areas when air quality is below the EPA standards.[49] Low air quality is more common in low-income and minority communities.[50]
Exposure to indoor volatile organic compounds may be a trigger for asthma; formaldehyde exposure, for example, has a positive association.[51] Phthalates in certain types of PVC are associated with asthma in both children and adults.[52][53] While exposure to pesticides is linked to the development of asthma, a cause and effect relationship has yet to be established.[54][55] A meta-analysis concluded gas stoves are a major risk factor for asthma, finding around one in eight cases in the U.S. could be attributed to these.[56]
The majority of the evidence does not support a causal role between paracetamol (acetaminophen) or antibiotic use and asthma.[57][58] A 2014 systematic review found that the association between paracetamol use and asthma disappeared when respiratory infections were taken into account.[59] Maternal psychological stress during pregnancy is a risk factor for the child to develop asthma.[60]
Asthma is associated with exposure to indoor allergens.[61] Common indoor allergens include dust mites, cockroaches, animal dander (fragments of fur or feathers), and mold.[62][63] Efforts to decrease dust mites have been found to be ineffective on symptoms in sensitized subjects.[64][65] Weak evidence suggests that efforts to decrease mold by repairing buildings may help improve asthma symptoms in adults.[66] Certain viral respiratory infections, such as respiratory syncytial virus and rhinovirus,[21] may increase the risk of developing asthma when acquired as young children.[67] Certain other infections, however, may decrease the risk.[21]
Hygiene hypothesis
The hygiene hypothesis attempts to explain the increased rates of asthma worldwide as a direct and unintended result of reduced exposure, during childhood, to non-pathogenic bacteria and viruses.[68][69] It has been proposed that the reduced exposure to bacteria and viruses is due, in part, to increased cleanliness and decreased family size in modern societies.[70] Exposure to bacterial endotoxin in early childhood may prevent the development of asthma, but exposure at an older age may provoke bronchoconstriction.[71] Evidence supporting the hygiene hypothesis includes lower rates of asthma on farms and in households with pets.[70]
Use of antibiotics in early life has been linked to the development of asthma.[72] Also, delivery via caesarean section is associated with an increased risk (estimated at 20–80%) of asthma – this increased risk is attributed to the lack of healthy bacterial colonization that the newborn would have acquired from passage through the birth canal.[73][74] There is a link between asthma and the degree of affluence which may be related to the hygiene hypothesis as less affluent individuals often have more exposure to bacteria and viruses.[75]
Genetic
| Endotoxin levels | CC genotype | TT genotype |
|---|---|---|
| High exposure | Low risk | High risk |
| Low exposure | High risk | Low risk |
Family history is a risk factor for asthma, with many different genes being implicated.[77] If one identical twin is affected, the probability of the other having the disease is approximately 25%.[77] By the end of 2005, 25 genes had been associated with asthma in six or more separate populations, including GSTM1, IL10, CTLA-4, SPINK5, LTC4S, IL4R and ADAM33, among others.[78] Many of these genes are related to the immune system or modulating inflammation. Even among this list of genes supported by highly replicated studies, results have not been consistent among all populations tested.[78] In 2006 over 100 genes were associated with asthma in one genetic association study alone;[78] more continue to be found.[79]
Some genetic variants may only cause asthma when they are combined with specific environmental exposures.[38] An example is a specific single nucleotide polymorphism in the CD14 region and exposure to endotoxin (a bacterial product). Endotoxin exposure can come from several environmental sources including tobacco smoke, dogs, and farms. Risk for asthma, then, is determined by both a person’s genetics and the level of endotoxin exposure.[76]
Medical conditions
A triad of atopic eczema, allergic rhinitis and asthma is called atopy.[80] The strongest risk factor for developing asthma is a history of atopic disease;[67] with asthma occurring at a much greater rate in those who have either eczema or hay fever.[81] Asthma has been associated with eosinophilic granulomatosis with polyangiitis (formerly known as Churg–Strauss syndrome), an autoimmune disease and vasculitis.[82] Individuals with certain types of urticaria may also experience symptoms of asthma.[80]
There is a correlation between obesity and the risk of asthma with both having increased in recent years.[83][84] Several factors may be at play including decreased respiratory function due to a buildup of fat and the fact that adipose tissue leads to a pro-inflammatory state.[85]
Beta blocker medications such as propranolol can trigger asthma in those who are susceptible.[86] Cardioselective beta-blockers, however, appear safe in those with mild or moderate disease.[87][88] Other medications that can cause problems in asthmatics are angiotensin-converting enzyme inhibitors, aspirin, and NSAIDs.[89] Use of acid suppressing medication (proton pump inhibitors and H2 blockers) during pregnancy is associated with an increased risk of asthma in the child.[90]
Exacerbation
Some individuals will have stable asthma for weeks or months and then suddenly develop an episode of acute asthma. Different individuals react to various factors in different ways.[91] Most individuals can develop severe exacerbation from a number of triggering agents.[91]
Home factors that can lead to exacerbation of asthma include dust, animal dander (especially cat and dog hair), cockroach allergens and mold.[91][92] Perfumes are a common cause of acute attacks in women and children. Both viral and bacterial infections of the upper respiratory tract can worsen the disease.[91] Psychological stress may worsen symptoms – it is thought that stress alters the immune system and thus increases the airway inflammatory response to allergens and irritants.[48][93]
Asthma exacerbations in school‐aged children peak in autumn, shortly after children return to school. This might reflect a combination of factors, including poor treatment adherence, increased allergen and viral exposure, and altered immune tolerance. There is limited evidence to guide possible approaches to reducing autumn exacerbations, but while costly, seasonal omalizumab treatment from four to six weeks before school return may reduce autumn asthma exacerbations.[94]
Pathophysiology
Figure A shows the location of the lungs and airways in the body. Figure B shows a cross-section of a normal airway. Figure C shows a cross-section of an airway during asthma symptoms.
Diagram of asthma
Asthma is the result of chronic inflammation of the conducting zone of the airways (most especially the bronchi and bronchioles), which subsequently results in increased contractability of the surrounding smooth muscles. This among other factors leads to bouts of narrowing of the airway and the classic symptoms of wheezing. The narrowing is typically reversible with or without treatment. Occasionally the airways themselves change.[22] Typical changes in the airways include an increase in eosinophils and thickening of the lamina reticularis. Chronically the airways’ smooth muscle may increase in size along with an increase in the numbers of mucous glands. Other cell types involved include T lymphocytes, macrophages, and neutrophils. There may also be involvement of other components of the immune system, including cytokines, chemokines, histamine, and leukotrienes among others.[21]
Diagnosis
While asthma is a well-recognized condition, there is not one universal agreed upon definition.[21] It is defined by the Global Initiative for Asthma as «a chronic inflammatory disorder of the airways in which many cells and cellular elements play a role. The chronic inflammation is associated with airway hyper-responsiveness that leads to recurrent episodes of wheezing, breathlessness, chest tightness and coughing particularly at night or in the early morning. These episodes are usually associated with widespread but variable airflow obstruction within the lung that is often reversible either spontaneously or with treatment».[22]
There is currently no precise test for the diagnosis, which is typically based on the pattern of symptoms and response to therapy over time.[6][21] Asthma may be suspected if there is a history of recurrent wheezing, coughing or difficulty breathing and these symptoms occur or worsen due to exercise, viral infections, allergens or air pollution.[95] Spirometry is then used to confirm the diagnosis.[95] In children under the age of six the diagnosis is more difficult as they are too young for spirometry.[96]
Spirometry
Spirometry is recommended to aid in diagnosis and management.[97][98] It is the single best test for asthma. If the FEV1 measured by this technique improves more than 12% and increases by at least 200 milliliters following administration of a bronchodilator such as salbutamol, this is supportive of the diagnosis. It however may be normal in those with a history of mild asthma, not currently acting up.[21] As caffeine is a bronchodilator in people with asthma, the use of caffeine before a lung function test may interfere with the results.[99] Single-breath diffusing capacity can help differentiate asthma from COPD.[21] It is reasonable to perform spirometry every one or two years to follow how well a person’s asthma is controlled.[100]
Others
The methacholine challenge involves the inhalation of increasing concentrations of a substance that causes airway narrowing in those predisposed. If negative it means that a person does not have asthma; if positive, however, it is not specific for the disease.[21]
Other supportive evidence includes: a ≥20% difference in peak expiratory flow rate on at least three days in a week for at least two weeks, a ≥20% improvement of peak flow following treatment with either salbutamol, inhaled corticosteroids or prednisone, or a ≥20% decrease in peak flow following exposure to a trigger.[101] Testing peak expiratory flow is more variable than spirometry, however, and thus not recommended for routine diagnosis. It may be useful for daily self-monitoring in those with moderate to severe disease and for checking the effectiveness of new medications. It may also be helpful in guiding treatment in those with acute exacerbations.[102]
Classification
| Severity | Symptom frequency | Night-time symptoms | %FEV1 of predicted | FEV1 variability | SABA use |
|---|---|---|---|---|---|
| Intermittent | ≤2/week | ≤2/month | ≥80% | <20% | ≤2 days/week |
| Mild persistent | >2/week | 3–4/month | ≥80% | 20–30% | >2 days/week |
| Moderate persistent | Daily | >1/week | 60–80% | >30% | daily |
| Severe persistent | Continuously | Frequent (7/week) | <60% | >30% | ≥twice/day |
Asthma is clinically classified according to the frequency of symptoms, forced expiratory volume in one second (FEV1), and peak expiratory flow rate.[12] Asthma may also be classified as atopic (extrinsic) or non-atopic (intrinsic), based on whether symptoms are precipitated by allergens (atopic) or not (non-atopic).[13] While asthma is classified based on severity, at the moment there is no clear method for classifying different subgroups of asthma beyond this system.[103] Finding ways to identify subgroups that respond well to different types of treatments is a current critical goal of asthma research.[103]
Although asthma is a chronic obstructive condition, it is not considered as a part of chronic obstructive pulmonary disease, as this term refers specifically to combinations of disease that are irreversible such as bronchiectasis and emphysema.[104] Unlike these diseases, the airway obstruction in asthma is usually reversible; however, if left untreated, the chronic inflammation from asthma can lead the lungs to become irreversibly obstructed due to airway remodeling.[105] In contrast to emphysema, asthma affects the bronchi, not the alveoli.[106] The combination of asthma with a component of irreversible airway obstruction has been termed the asthma-chronic obstructive disease (COPD) overlap syndrome (ACOS). Compared to other people with «pure» asthma or COPD, people with ACOS exhibit increased morbidity, mortality and possibly more comorbidities.[107]
Asthma exacerbation
| Near-fatal | High PaCO2, or requiring mechanical ventilation, or both |
|---|---|
| Life-threatening (any one of) |
|
| Clinical signs | Measurements |
| Altered level of consciousness | Peak flow < 33% |
| Exhaustion | Oxygen saturation < 92% |
| Arrhythmia | PaO2 < 8 kPa |
| Low blood pressure | «Normal» PaCO2 |
| Cyanosis | |
| Silent chest | |
| Poor respiratory effort | |
| Acute severe (any one of) |
|
| Peak flow 33–50% | |
| Respiratory rate ≥ 25 breaths per minute | |
| Heart rate ≥ 110 beats per minute | |
| Unable to complete sentences in one breath | |
| Moderate | Worsening symptoms |
| Peak flow 50–80% best or predicted | |
| No features of acute severe asthma |
An acute asthma exacerbation is commonly referred to as an asthma attack. The classic symptoms are shortness of breath, wheezing, and chest tightness.[21] The wheezing is most often when breathing out.[109] While these are the primary symptoms of asthma,[110] some people present primarily with coughing, and in severe cases, air motion may be significantly impaired such that no wheezing is heard.[108] In children, chest pain is often present.[111]
Signs occurring during an asthma attack include the use of accessory muscles of respiration (sternocleidomastoid and scalene muscles of the neck), there may be a paradoxical pulse (a pulse that is weaker during inhalation and stronger during exhalation), and over-inflation of the chest.[112] A blue color of the skin and nails may occur from lack of oxygen.[113]
In a mild exacerbation the peak expiratory flow rate (PEFR) is ≥200 L/min, or ≥50% of the predicted best.[114] Moderate is defined as between 80 and 200 L/min, or 25% and 50% of the predicted best, while severe is defined as ≤ 80 L/min, or ≤25% of the predicted best.[114]
Acute severe asthma, previously known as status asthmaticus, is an acute exacerbation of asthma that does not respond to standard treatments of bronchodilators and corticosteroids.[115] Half of cases are due to infections with others caused by allergen, air pollution, or insufficient or inappropriate medication use.[115]
Brittle asthma is a kind of asthma distinguishable by recurrent, severe attacks.[108] Type 1 brittle asthma is a disease with wide peak flow variability, despite intense medication. Type 2 brittle asthma is background well-controlled asthma with sudden severe exacerbations.[108]
Exercise-induced
Exercise can trigger bronchoconstriction both in people with or without asthma.[116] It occurs in most people with asthma and up to 20% of people without asthma.[116] Exercise-induced bronchoconstriction is common in professional athletes. The highest rates are among cyclists (up to 45%), swimmers, and cross-country skiers.[117] While it may occur with any weather conditions, it is more common when it is dry and cold.[118] Inhaled beta2-agonists do not appear to improve athletic performance among those without asthma,[119] however, oral doses may improve endurance and strength.[120][121]
Occupational
Asthma as a result of (or worsened by) workplace exposures is a commonly reported occupational disease.[122] Many cases, however, are not reported or recognized as such.[123][124] It is estimated that 5–25% of asthma cases in adults are work-related. A few hundred different agents have been implicated, with the most common being: isocyanates, grain and wood dust, colophony, soldering flux, latex, animals, and aldehydes. The employment associated with the highest risk of problems include: those who spray paint, bakers and those who process food, nurses, chemical workers, those who work with animals, welders, hairdressers and timber workers.[122]
Aspirin-exacerbated respiratory disease
Aspirin-exacerbated respiratory disease (AERD), also known as aspirin-induced asthma, affects up to 9% of asthmatics.[125] AERD consists of asthma, nasal polyps, sinus disease, and respiratory reactions to aspirin and other NSAID medications (such as ibuprofen and naproxen).[126] People often also develop loss of smell and most experience respiratory reactions to alcohol.[127]
Alcohol-induced asthma
Alcohol may worsen asthmatic symptoms in up to a third of people.[128] This may be even more common in some ethnic groups such as the Japanese and those with aspirin-exacerbated respiratory disease.[128] Other studies have found improvement in asthmatic symptoms from alcohol.[128]
Non-atopic asthma
Non-atopic asthma, also known as intrinsic or non-allergic, makes up between 10 and 33% of cases. There is negative skin test to common inhalant allergens. Often it starts later in life, and women are more commonly affected than men. Usual treatments may not work as well.[129] The concept that «non-atopic» is synonymous with «non-allergic» is called into question by epidemiological data that the prevalence of asthma is closely related to the serum IgE level standardized for age and sex (P<0.0001), indicating that asthma is almost always associated with some sort of IgE-related reaction and therefore has an allergic basis, although not all the allergic stimuli that cause asthma appear to have been included in the battery of aeroallergens studied (the «missing antigen(s)» hypothesis).[130] For example, an updated systematic review and meta-analysis of population-attributable risk (PAR) of Chlamydia pneumoniae biomarkers in chronic asthma found that the PAR for C. pneumoniae-specific IgE was 47%.[131]
Infectious asthma
When queried, asthma patients may report that their first asthma symptoms began after an acute lower respiratory tract illness. This type of history has been labelled the «infectious asthma» (IA) syndrome,[132] or as «asthma associated with infection» (AAWI)[133] to distinguish infection-associated asthma initiation from the well known association of respiratory infections with asthma exacerbations. Reported prevalences of IA for adults range from around 40% in a primary care practice[132] to 70% in a specialty practice treating mainly severe asthma patients.[134] The true population prevalence of IA in adult-onset asthma is unknown because clinicians are not trained to elicit this type of history routinely, and recollection in child-onset asthma is challenging.
Differential diagnosis
Many other conditions can cause symptoms similar to those of asthma. In children, symptoms may be due to other upper airway diseases such as allergic rhinitis and sinusitis, as well as other causes of airway obstruction including foreign body aspiration, tracheal stenosis, laryngotracheomalacia, vascular rings, enlarged lymph nodes or neck masses.[135] Bronchiolitis and other viral infections may also produce wheezing.[136] According to European Respiratory Society, it may not be suitable to label wheezing preschool children with the term «asthma» because there is lack of clinical data on inflammation in airways.[137] In adults, COPD, congestive heart failure, airway masses, as well as drug-induced coughing due to ACE inhibitors may cause similar symptoms. In both populations vocal cord dysfunction may present similarly.[135]
Chronic obstructive pulmonary disease can coexist with asthma and can occur as a complication of chronic asthma. After the age of 65, most people with obstructive airway disease will have asthma and COPD. In this setting, COPD can be differentiated by increased airway neutrophils, abnormally increased wall thickness, and increased smooth muscle in the bronchi. However, this level of investigation is not performed due to COPD and asthma sharing similar principles of management: corticosteroids, long-acting beta-agonists, and smoking cessation.[138] It closely resembles asthma in symptoms, is correlated with more exposure to cigarette smoke, an older age, less symptom reversibility after bronchodilator administration, and decreased likelihood of family history of atopy.[139][140]
Prevention
The evidence for the effectiveness of measures to prevent the development of asthma is weak.[141] The World Health Organization recommends decreasing risk factors such as tobacco smoke, air pollution, chemical irritants including perfume, and the number of lower respiratory infections.[142][143] Other efforts that show promise include: limiting smoke exposure in utero, breastfeeding, and increased exposure to daycare or large families, but none are well supported enough to be recommended for this indication.[141]
Early pet exposure may be useful.[144] Results from exposure to pets at other times are inconclusive[145] and it is only recommended that pets be removed from the home if a person has allergic symptoms to said pet.[146]
Dietary restrictions during pregnancy or when breast feeding have not been found to be effective at preventing asthma in children and are not recommended.[146] Omega-3 consumption, mediterranean diet and anti-oxidants have been suggested by some studies that might help preventing crisis but the evidence is still inconclusive.[147]
Reducing or eliminating compounds known to sensitive people from the work place may be effective.[122] It is not clear if annual influenza vaccinations affects the risk of exacerbations.[148] Immunization, however, is recommended by the World Health Organization.[149] Smoking bans are effective in decreasing exacerbations of asthma.[150]
Management
While there is no cure for asthma, symptoms can typically be improved.[151] The most effective treatment for asthma is identifying triggers, such as cigarette smoke, pets or other allergens, and eliminating exposure to them. If trigger avoidance is insufficient, the use of medication is recommended. Pharmaceutical drugs are selected based on, among other things, the severity of illness and the frequency of symptoms. Specific medications for asthma are broadly classified into fast-acting and long-acting categories.[152][153] The medications listed below have demonstrated efficacy in improving asthma symptoms, however «real world» use-effectiveness is limited as around half of people with asthma worldwide remain sub-optimally controlled, even when treated.[154][155][156] People with asthma may remain sub-optimally controlled either because optimum doses of asthma medications do not work (called «refractory» asthma) or because individuals are either unable (e.g. inability to afford treatment, poor inhaler technique) or unwilling (e.g., wish to avoid side effects of corticosteroids) to take optimum doses of prescribed asthma medications (called «difficult to treat» asthma). In practice, it is not possible to distinguish «refractory» from «difficult to treat» categories for patients who have never taken optimum doses of asthma medications. A related issue is that the asthma efficacy trials upon which the pharmacological treatment guidelines are based have systematically excluded the majority of people with asthma.[157][158] For example, asthma efficacy treatment trials always exclude otherwise eligible people who smoke, and smoking blunts the efficacy of inhaled corticosteroids, the mainstay of asthma control management.[159][160][161]
Bronchodilators are recommended for short-term relief of symptoms. In those with occasional attacks, no other medication is needed. If mild persistent disease is present (more than two attacks a week), low-dose inhaled corticosteroids or alternatively, a leukotriene antagonist or a mast cell stabilizer by mouth is recommended. For those who have daily attacks, a higher dose of inhaled corticosteroids is used. In a moderate or severe exacerbation, corticosteroids by mouth are added to these treatments.[8]
People with asthma have higher rates of anxiety, psychological stress, and depression.[162][163] This is associated with poorer asthma control.[162] Cognitive behavioral therapy may improve quality of life, asthma control, and anxiety levels in people with asthma.[162]
Improving people’s knowledge about asthma and using a written action plan has been identified as an important component of managing asthma.[164] Providing educational sessions that include information specific to a person’s culture is likely effective.[165] More research is necessary to determine if increasing preparedness and knowledge of asthma among school staff and families using home-based and school interventions results in long term improvements in safety for children with asthma.[166][167][168] School-based asthma self-management interventions, which attempt to improve knowledge of asthma, its triggers and the importance of regular practitioner review, may reduce hospital admissions and emergency department visits. These interventions may also reduce the number of days children experience asthma symptoms and may lead to small improvements in asthma-related quality of life.[169] More research is necessary to determine if shared-decision-making is helpful for managing adults with asthma[170] or if a personalized asthma action plan is effective and necessary.[171] Some people with asthma use pulse oximeters to monitor their own blood oxygen levels during an asthma attack. However, there is no evidence regarding the use in these instances.[172]
Lifestyle modification
Avoidance of triggers is a key component of improving control and preventing attacks. The most common triggers include allergens, smoke (from tobacco or other sources), air pollution, non selective beta-blockers, and sulfite-containing foods.[173][174] Cigarette smoking and second-hand smoke (passive smoke) may reduce the effectiveness of medications such as corticosteroids.[175] Laws that limit smoking decrease the number of people hospitalized for asthma.[150] Dust mite control measures, including air filtration, chemicals to kill mites, vacuuming, mattress covers and others methods had no effect on asthma symptoms.[64] There is insufficient evidence to suggest that dehumidifiers are helpful for controlling asthma.[176]
Overall, exercise is beneficial in people with stable asthma.[177] Yoga could provide small improvements in quality of life and symptoms in people with asthma.[178] More research is necessary to determine how effective weight loss is on improving quality of life, the usage of health care services, and adverse effects for people of all ages with asthma.[179][180]
Medications
Medications used to treat asthma are divided into two general classes: quick-relief medications used to treat acute symptoms; and long-term control medications used to prevent further exacerbation.[152] Antibiotics are generally not needed for sudden worsening of symptoms or for treating asthma at any time.[181][182]
Medications of asthma exacerbations
Salbutamol metered dose inhaler commonly used to treat asthma attacks.
- Short-acting beta2-adrenoceptor agonists (SABA), such as salbutamol (albuterol USAN) are the first line treatment for asthma symptoms.[8] They are recommended before exercise in those with exercise induced symptoms.[183]
- Anticholinergic medications, such as ipratropium, provide additional benefit when used in combination with SABA in those with moderate or severe symptoms and may prevent hospitalizations.[8][184][185] Anticholinergic bronchodilators can also be used if a person cannot tolerate a SABA.[104] If a child requires admission to hospital additional ipratropium does not appear to help over a SABA.[186] For children over 2 years old with acute asthma symptoms, inhaled anticholinergic medications taken alone is safe but is not as effective as inhaled SABA or SABA combined with inhaled anticholinergic medication.[187][184] Adults who receive combined inhaled medications that includes short-acting anticholinergics and SABA may be at risk for increased adverse effects such as experiencing a tremor, agitation, and heart beat palpitations compared to people who are treated with SABA by itself.[185]
- Older, less selective adrenergic agonists, such as inhaled epinephrine, have similar efficacy to SABAs.[188] They are however not recommended due to concerns regarding excessive cardiac stimulation.[189]
- Corticosteroids can also help with the acute phase of an exacerbation because of their antiinflamatory properties. The benefit of systemic and oral corticosteroids is well established. Inhaled or nebulized corticosteroids can also be used.[147] For adults and children who are in the hospital due to acute asthma, systemic (IV) corticosteroids improve symptoms.[190][191] A short course of corticosteroids after an acute asthma exacerbation may help prevent relapses and reduce hospitalizations.[192]
- Other remedies, less established, are intravenous or nebulized magnesium sulfate and helium mixed with oxygen. Aminophylline could be used with caution as well.[147]
- Mechanical ventilation is the last resort in case of severe hypoxemia.[147]
- Intravenous administration of the drug aminophylline does not provide an improvement in bronchodilation when compared to standard inhaled beta-2 agonist treatment.[193] Aminophylline treatment is associated with more adverse effects compared to inhaled beta-2 agonist treatment.[193]
Long–term control
- Corticosteroids are generally considered the most effective treatment available for long-term control.[152] Inhaled forms are usually used except in the case of severe persistent disease, in which oral corticosteroids may be needed.[152] Dosage depends on the severity of symptoms.[194] High dosage and long term use might lead to the appearance of common adverse effects which are growth delay, adrenal suppression, and osteoporosis.[147] Continuous (daily) use of an inhaled corticosteroid, rather than its intermitted use, seems to provide better results in controlling asthma exacerbations.[147] Commonly used corticosteroids are budesonide, fluticasone, mometasone and ciclesonide.[147]
- Long-acting beta-adrenoceptor agonists (LABA) such as salmeterol and formoterol can improve asthma control, at least in adults, when given in combination with inhaled corticosteroids.[195][196] In children this benefit is uncertain.[195][197][196] When used without steroids they increase the risk of severe side-effects,[198] and with corticosteroids they may slightly increase the risk.[199][200] Evidence suggests that for children who have persistent asthma, a treatment regime that includes LABA added to inhaled corticosteroids may improve lung function but does not reduce the amount of serious exacerbations.[201] Children who require LABA as part of their asthma treatment may need to go to the hospital more frequently.[201]
- Leukotriene receptor antagonists (anti-leukotriene agents such as montelukast and zafirlukast) may be used in addition to inhaled corticosteroids, typically also in conjunction with a LABA.[17][202][203][204] For adults or adolescents who have persistent asthma that is not controlled very well, the addition of anti-leukotriene agents along with daily inhaled corticosteriods improves lung function and reduces the risk of moderate and severe asthma exacerbations.[203] Anti-leukotriene agents may be effective alone for adolescents and adults, however there is no clear research suggesting which people with asthma would benefit from anti-leukotriene receptor alone.[205] In those under five years of age, anti-leukotriene agents were the preferred add-on therapy after inhaled corticosteroids.[147][206] A 2013 Cochrane systematic review concluded that anti-leukotriene agents appear to be of little benefit when added to inhaled steroids for treating children.[207] A similar class of drugs, 5-LOX inhibitors, may be used as an alternative in the chronic treatment of mild to moderate asthma among older children and adults.[17][208] As of 2013 there is one medication in this family known as zileuton.[17]
- Mast cell stabilizers (such as cromolyn sodium) are safe alternatives to corticosteroids but not preferred because they have to be administered frequently.[152][17]
- Oral Theophyllines are sometimes used for controlling chronic asthma, but their used is minimized because of their side effects.[147]
- Omalizumab, a monoclonal Antibody Against IgE, is a novel way to lessen exacerbations by lessening the levels of circulating IgE that play a significant role at allergic asthma.[147][209]
- Anticholinergic medications such as ipratropium bromide have not been shown to be beneficial for treating chronic asthma in children over 2 years old,[210] but is not suggested for routine treatment of chronic asthma in adults.[211]
- There is no strong evidence to recommend chloroquine medication as a replacement for taking corticosteroids by mouth (for those who are not able to tolerate inhaled steroids).[212] Methotrexate is not suggested as a replacement for taking corticosteriods by mouth («steroid sparing») due to the adverse effects associated with taking methotrexate and the minimal relief provided for asthma symptoms.[213]
- Macrolide antibiotics, particularly the azalide macrolide azithromycin, are a recently added GINA-recommended treatment option for both eosinophilic and non-eosinophilic severe, refractory asthma based on azithromycin’s efficacy in reducing moderate and severe exacerbations combined.[214][215] Azithromycin’s mechanism of action is not established, and could involve pathogen- and/or host-directed anti-inflammatory activities.[216] Limited clinical observations suggest that some patients with new-onset asthma and with «difficult-to-treat» asthma (including those with the asthma-COPD overlap syndrome — ACOS) may respond dramatically to azithromycin.[217][218] However, these groups of asthma patients have not been studied in randomized treatment trials and patient selection needs to be carefully individualized.
For children with asthma which is well-controlled on combination therapy of inhaled corticosteroids (ICS) and long-acting beta2-agonists (LABA), the benefits and harms of stopping LABA and stepping down to ICS-only therapy are uncertain.[219] In adults who have stable asthma while they are taking a combination of LABA and inhaled corticosteroids (ICS), stopping LABA may increase the risk of asthma exacerbations that require treatment with corticosteroids by mouth.[220] Stopping LABA probably makes little or no important difference to asthma control or asthma-related quality of life.[220] Whether or not stopping LABA increases the risk of serious adverse events or exacerbations requiring an emergency department visit or hospitalisation is uncertain.[220]
Delivery methods
Medications are typically provided as metered-dose inhalers (MDIs) in combination with an asthma spacer or as a dry powder inhaler. The spacer is a plastic cylinder that mixes the medication with air, making it easier to receive a full dose of the drug. A nebulizer may also be used. Nebulizers and spacers are equally effective in those with mild to moderate symptoms. However, insufficient evidence is available to determine whether a difference exists in those with severe disease.[221] For delivering short-acting beta-agonists in acute asthma in children, spacers may have advantages compared to nebulisers, but children with life-threatening asthma have not been studied.[222] There is no strong evidence for the use of intravenous LABA for adults or children who have acute asthma.[223] There is insufficient evidence to directly compare the effectiveness of a metered-dose inhaler attached to a homemade spacer compared to commercially available spacer for treating children with asthma.[224]
Adverse effects
Long-term use of inhaled corticosteroids at conventional doses carries a minor risk of adverse effects.[225] Risks include thrush, the development of cataracts, and a slightly slowed rate of growth.[225][226][227] Rinsing the mouth after the use of inhaled steroids can decrease the risk of thrush.[228] Higher doses of inhaled steroids may result in lower bone mineral density.[229]
Others
Inflammation in the lungs can be estimated by the level of exhaled nitric oxide.[230][231] The use of exhaled nitric oxide levels (FeNO) to guide asthma medication dosing may have small benefits for preventing asthma attacks but the potential benefits are not strong enough for this approach to be universally recommended as a method to guide asthma therapy in adults or children.[230][231]
When asthma is unresponsive to usual medications, other options are available for both emergency management and prevention of flareups. Additional options include:
- Humidified Oxygen to alleviate hypoxia if saturations fall below 92%.[147]
- Corticosteroid by mouth are recommended with five days of prednisone being the same 2 days of dexamethasone.[232] One review recommended a seven-day course of steroids.[233]
- Magnesium sulfate intravenous treatment increases bronchodilation when used in addition to other treatment in moderate severe acute asthma attacks.[18][234][235] In adults intravenous treatment results in a reduction of hospital admissions.[236] Low levels of evidence suggest that inhaled (nebulised) magnesium sulfate may have a small benefit for treating acute asthma in adults.[237] Overall, high quality evidence do not indicate a large benefit for combining magnesium sulfate with standard inhaled treatments for adults with asthma.[237]
- Heliox, a mixture of helium and oxygen, may also be considered in severe unresponsive cases.[18]
- Intravenous salbutamol is not supported by available evidence and is thus used only in extreme cases.[238]
- Methylxanthines (such as theophylline) were once widely used, but do not add significantly to the effects of inhaled beta-agonists.[238] Their use in acute exacerbations is controversial.[239]
- The dissociative anesthetic ketamine is theoretically useful if intubation and mechanical ventilation is needed in people who are approaching respiratory arrest; however, there is no evidence from clinical trials to support this.[240]
- For those with severe persistent asthma not controlled by inhaled corticosteroids and LABAs, bronchial thermoplasty may be an option.[241] It involves the delivery of controlled thermal energy to the airway wall during a series of bronchoscopies.[241][242] While it may increase exacerbation frequency in the first few months it appears to decrease the subsequent rate. Effects beyond one year are unknown.[243]
- Monoclonal antibody injections such as mepolizumab,[244] dupilumab,[245] or omalizumab may be useful in those with poorly controlled atopic asthma.[246] However, as of 2019 these medications are expensive and their use is therefore reserved for those with severe symptoms to achieve cost-effectiveness.[247] Monoclonal antibodies targeting interleukin-5 (IL-5) or its receptor (IL-5R), including mepolizumab, reslizumab or benralizumab, in addition to standard care in severe asthma is effective in reducing the rate of asthma exacerbations. There is limited evidence for improved health-related quality of life and lung function.[248]
- Evidence suggests that sublingual immunotherapy in those with both allergic rhinitis and asthma improve outcomes.[249]
- It is unclear if non-invasive positive pressure ventilation in children is of use as it has not been sufficiently studied.[250]
Alternative medicine
Many people with asthma, like those with other chronic disorders, use alternative treatments; surveys show that roughly 50% use some form of unconventional therapy.[251][252] There is little data to support the effectiveness of most of these therapies.
Evidence is insufficient to support the usage of vitamin C or vitamin E for controlling asthma.[253][254] There is tentative support for use of vitamin C in exercise induced bronchospasm.[255] Fish oil dietary supplements (marine n-3 fatty acids)[256] and reducing dietary sodium[257] do not appear to help improve asthma control. In people with mild to moderate asthma, treatment with vitamin D supplementation may reduce the risk of asthma exacerbations, however, it is not clear if this is only helpful for people who have low vitamin D levels to begin with (low baseline vitamin D).[258] There is no strong evidence to suggest that vitamin D supplements improve day-to-day asthma symptoms or a person’s lung function.[258] There is no strong evidence to suggest that adults with asthma should avoid foods that contain monosodium glutamate (MSG).[259] There have not been enough high-quality studies performed to determine if children with asthma should avoid eating food that contains MSG.[259]
Acupuncture is not recommended for the treatment as there is insufficient evidence to support its use.[260][261] Air ionisers show no evidence that they improve asthma symptoms or benefit lung function; this applied equally to positive and negative ion generators.[262] Manual therapies, including osteopathic, chiropractic, physiotherapeutic and respiratory therapeutic maneuvers, have insufficient evidence to support their use in treating asthma.[263] The Buteyko breathing technique for controlling hyperventilation may result in a reduction in medication use; however, the technique does not have any effect on lung function.[153] Thus an expert panel felt that evidence was insufficient to support its use.[260] There is no clear evidence that breathing exercises are effective for treating children with asthma.[264]
Prognosis
The prognosis for asthma is generally good, especially for children with mild disease.[265] Mortality has decreased over the last few decades due to better recognition and improvement in care.[266] In 2010 the death rate was 170 per million for males and 90 per million for females.[267] Rates vary between countries by 100 fold.[267]
Globally it causes moderate or severe disability in 19.4 million people as of 2004 (16 million of which are in low and middle income countries).[268] Of asthma diagnosed during childhood, half of cases will no longer carry the diagnosis after a decade.[77] Airway remodeling is observed, but it is unknown whether these represent harmful or beneficial changes.[269] Early treatment with corticosteroids seems to prevent or ameliorates a decline in lung function.[270] Asthma in children also has negative effects on quality of life of their parents.[271]
-
Asthma deaths per million persons in 2012
0–10
11–13
14–17
18–23
24–32
33–43
44–50
51–66
67–95
96–251
-
Disability-adjusted life year for asthma per 100,000 inhabitants in 2004.[272]
no data
0-100
100–150
150–200
200–250
250–300
300–350
350–400
400–450
450–500
500–550
550–600
>600
Epidemiology
Rates of asthma in 2017[273]
In 2019, approximately 262 million people worldwide were affected by asthma and approximately 461,000 people died from the disease.[9] Rates vary between countries with prevalences between 1 and 18%.[22] It is more common in developed than developing countries.[22] One thus sees lower rates in Asia, Eastern Europe and Africa.[21] Within developed countries it is more common in those who are economically disadvantaged while in contrast in developing countries it is more common in the affluent.[22] The reason for these differences is not well known.[22] Low and middle income countries make up more than 80% of the mortality.[274]
While asthma is twice as common in boys as girls,[22] severe asthma occurs at equal rates.[275] In contrast adult women have a higher rate of asthma than men[22] and it is more common in the young than the old.[21] In 2010, children with asthma experienced over 900,000 emergency department visits, making it the most common reason for admission to the hospital following an emergency department visit in the US in 2011.[276][277]
Global rates of asthma have increased significantly between the 1960s and 2008[19][278] with it being recognized as a major public health problem since the 1970s.[21] Rates of asthma have plateaued in the developed world since the mid-1990s with recent increases primarily in the developing world.[279] Asthma affects approximately 7% of the population of the United States[198] and 5% of people in the United Kingdom.[280] Canada, Australia and New Zealand have rates of about 14–15%.[281]
The average death rate from 2011 to 2015 from asthma in the UK was about 50% higher than the average for the European Union and had increased by about 5% in that time.[282] Children are more likely see a physician due to asthma symptoms after school starts in September.[283]
Population-based epidemiological studies describe temporal associations between acute respiratory illnesses, asthma, and development of severe asthma with irreversible airflow limitation (known as the asthma-chronic obstructive pulmonary disease «overlap» syndrome, or ACOS).[284][285][286] Additional prospective population-based data indicate that ACOS seems to represent a form of severe asthma, characterised by more frequent hospitalisations, and to be the result of early-onset asthma that has progressed to fixed airflow obstruction.[287]
Economics
From 2000 to 2010, the average cost per asthma-related hospital stay in the United States for children remained relatively stable at about $3,600, whereas the average cost per asthma-related hospital stay for adults increased from $5,200 to $6,600.[288] In 2010, Medicaid was the most frequent primary payer among children and adults aged 18–44 years in the United States; private insurance was the second most frequent payer.[288] Among both children and adults in the lowest income communities in the United States there is a higher rate of hospital stays for asthma in 2010 than those in the highest income communities.[288]
History
1907 advertisement for Grimault’s Indian Cigarettes, promoted as a means of relieving asthma. They contained belladonna and cannabis.
Asthma was recognized in ancient Egypt and was treated by drinking an incense mixture known as kyphi.[20] It was officially named as a specific respiratory problem by Hippocrates circa 450 BC, with the Greek word for «panting» forming the basis of our modern name.[21] In 200 BC it was believed to be at least partly related to the emotions.[29] In the 12th century the Jewish physician-philosopher Maimonides wrote a treatise on asthma in Arabic, based partly on Arabic sources, in which he discussed the symptoms, proposed various dietary and other means of treatment, and emphasized the importance of climate and clean air.[289]
In 1873, one of the first papers in modern medicine on the subject tried to explain the pathophysiology of the disease while one in 1872, concluded that asthma can be cured by rubbing the chest with chloroform liniment.[290][291] Medical treatment in 1880 included the use of intravenous doses of a drug called pilocarpine.[292] In 1886, F. H. Bosworth theorized a connection between asthma and hay fever.[293] Epinephrine was first referred to in the treatment of asthma in 1905.[294] Oral corticosteroids began to be used for this condition in the 1950s while inhaled corticosteroids and selective short acting beta agonist came into wide use in the 1960s.[295][296]
A well-documented case in the 19th century was that of young Theodore Roosevelt (1858–1919). At that time there was no effective treatment. Roosevelt’s youth was in large part shaped by his poor health partly related to his asthma. He experienced recurring nighttime asthma attacks that felt as if he was being smothered to death, terrifying the boy and his parents.[297]
During the 1930s to 1950s, asthma was known as one of the «holy seven» psychosomatic illnesses. Its cause was considered to be psychological, with treatment often based on psychoanalysis and other talking cures.[298] As these psychoanalysts interpreted the asthmatic wheeze as the suppressed cry of the child for its mother, they considered the treatment of depression to be especially important for individuals with asthma.[298]
In January 2021, an appeal court in France overturned a deportation order against a 40-year-old Bangladeshi man, who was a patient of asthma. His lawyers had argued that the dangerous levels of pollution in Bangladesh could possibly lead to worsening of his health condition, or even premature death.[299]
Notes
- ^ GINA 2011, p. 18
- ^ Jones, Daniel (2011). Roach, Peter; Setter, Jane; Esling, John (eds.). Cambridge English Pronouncing Dictionary (18th ed.). Cambridge University Press. ISBN 978-0-521-15255-6.
- ^ Wells, John C. (2008). Longman Pronunciation Dictionary (3rd ed.). Longman. ISBN 978-1-4058-8118-0.
- ^ a b c d Drazen GM, Bel EH (2020). «81. Asthma». In Goldman L, Schafer AI (eds.). Goldman-Cecil Medicine. Vol. 1 (26th ed.). Philadelphia: Elsevier. pp. 527–535. ISBN 978-0-323-55087-1.
- ^ a b c d e f g h i j «Asthma Fact sheet №307». WHO. November 2013. Archived from the original on June 29, 2011. Retrieved 3 March 2016.
- ^ a b c Lemanske RF, Busse WW (February 2010). «Asthma: clinical expression and molecular mechanisms». The Journal of Allergy and Clinical Immunology. 125 (2 Suppl 2): S95-102. doi:10.1016/j.jaci.2009.10.047. PMC 2853245. PMID 20176271.
- ^ a b NHLBI Guideline 2007, pp. 169–72
- ^ a b c d e NHLBI Guideline 2007, p. 214
- ^ a b c d «Asthma–Level 3 cause» (PDF). The Lancet. 396: S108–S109. October 2020.
- ^ NHLBI Guideline 2007, pp. 11–12
- ^ GINA 2011, p. 20,51
- ^ a b c Yawn BP (September 2008). «Factors accounting for asthma variability: achieving optimal symptom control for individual patients» (PDF). Primary Care Respiratory Journal. 17 (3): 138–147. doi:10.3132/pcrj.2008.00004. PMC 6619889. PMID 18264646. Archived (PDF) from the original on 2009-03-26.
- ^ a b Kumar V, Abbas AK, Fausto N, Aster J (2010). Robbins and Cotran pathologic basis of disease (8th ed.). Saunders. p. 688. ISBN 978-1-4160-3121-5. OCLC 643462931.
- ^ Stedman’s Medical Dictionary (28 ed.). Lippincott Williams & Wilkins. 2005. ISBN 978-0-7817-3390-8.
- ^ GINA 2011, p. 71
- ^ GINA 2011, p. 33
- ^ a b c d e Scott JP, Peters-Golden M (September 2013). «Antileukotriene agents for the treatment of lung disease». American Journal of Respiratory and Critical Care Medicine. 188 (5): 538–44. doi:10.1164/rccm.201301-0023PP. PMID 23822826.
- ^ a b c NHLBI Guideline 2007, pp. 373–75
- ^ a b Anandan C, Nurmatov U, van Schayck OC, Sheikh A (February 2010). «Is the prevalence of asthma declining? Systematic review of epidemiological studies». Allergy. 65 (2): 152–67. doi:10.1111/j.1398-9995.2009.02244.x. PMID 19912154. S2CID 19525219.
- ^ a b Manniche L (1999). Sacred luxuries: fragrance, aromatherapy, and cosmetics in ancient Egypt. Cornell University Press. pp. 49. ISBN 978-0-8014-3720-5.
- ^ a b c d e f g h i j k l m n Murray JF (2010). «Ch. 38 Asthma». In Mason RJ, Murray JF, Broaddus VC, Nadel JA, Martin TR, King Jr TE, Schraufnagel DE (eds.). Murray and Nadel’s textbook of respiratory medicine (5th ed.). Elsevier. ISBN 978-1-4160-4710-0.
- ^ a b c d e f g h i GINA 2011, pp. 2–5
- ^ Jindal SK, ed. (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. p. 242. ISBN 978-93-5025-073-0. Archived from the original on 2016-04-24.
- ^ George RB (2005). Chest medicine : essentials of pulmonary and critical care medicine (5th ed.). Philadelphia: Lippincott Williams & Wilkins. p. 62. ISBN 978-0-7817-5273-2. Archived from the original on 2016-05-05.
- ^ British Guideline 2009, p. 14
- ^ GINA 2011, pp. 8–9
- ^ Boulet LP (April 2009). «Influence of comorbid conditions on asthma». The European Respiratory Journal. 33 (4): 897–906. doi:10.1183/09031936.00121308. PMID 19336592.
- ^ Boulet LP, Boulay MÈ (June 2011). «Asthma-related comorbidities». Expert Review of Respiratory Medicine. 5 (3): 377–393. doi:10.1586/ers.11.34. PMID 21702660.
- ^ a b Harver A, Kotses H, eds. (2010). Asthma, Health and Society: A Public Health Perspective. New York: Springer. p. 315. ISBN 978-0-387-78285-0. Retrieved 6 April 2021.
- ^ Thomas M, Bruton A, Moffat M, Cleland J (September 2011). «Asthma and psychological dysfunction». Primary Care Respiratory Journal. 20 (3): 250–256. doi:10.4104/pcrj.2011.00058. PMC 6549858. PMID 21674122.
- ^ He X, Cheng G, He L, Liao B, Du Y, Xie X, et al. (January 2021). «Adults with current asthma but not former asthma have higher all-cause and cardiovascular mortality: a population-based prospective cohort study». Scientific Reports. 11 (1): 1329. Bibcode:2021NatSR..11.1329H. doi:10.1038/s41598-020-79264-4. PMC 7809422. PMID 33446724.
- ^ Silva GE, Sherrill DL, Guerra S, Barbee RA (July 2004). «Asthma as a risk factor for COPD in a longitudinal study». Chest. 126 (1): 59–65. doi:10.1378/chest.126.1.59. PMID 15249443.
- ^ de Marco R, Marcon A, Rossi A, Antó JM, Cerveri I, Gislason T, et al. (September 2015). «Asthma, COPD and overlap syndrome: a longitudinal study in young European adults». The European Respiratory Journal. 46 (3): 671–679. doi:10.1183/09031936.00008615. PMID 26113674. S2CID 2169875.
- ^ Gibson PG, McDonald VM (July 2015). «Asthma-COPD overlap 2015: now we are six». Thorax. 70 (7): 683–691. doi:10.1136/thoraxjnl-2014-206740. PMID 25948695. S2CID 38550372.
- ^ Thomsen HS, Webb JA, eds. (2014). Contrast media : safety issues and ESUR guidelines (Third ed.). Dordrecht: Springer. p. 54. ISBN 978-3-642-36724-3.
- ^ Agostini BA, Collares KF, Costa FD, Correa MB, Demarco FF (August 2019). «The role of asthma in caries occurrence — meta-analysis and meta-regression». The Journal of Asthma. 56 (8): 841–852. doi:10.1080/02770903.2018.1493602. PMID 29972654. S2CID 49694304.
- ^ a b Thomas MS, Parolia A, Kundabala M, Vikram M (June 2010). «Asthma and oral health: a review». Australian Dental Journal. 55 (2): 128–133. doi:10.1111/j.1834-7819.2010.01226.x. PMID 20604752.
- ^ a b Martinez FD (January 2007). «Genes, environments, development and asthma: a reappraisal». The European Respiratory Journal. 29 (1): 179–84. doi:10.1183/09031936.00087906. PMID 17197483.
- ^ Miller RL, Ho SM (March 2008). «Environmental epigenetics and asthma: current concepts and call for studies». American Journal of Respiratory and Critical Care Medicine. 177 (6): 567–73. doi:10.1164/rccm.200710-1511PP. PMC 2267336. PMID 18187692.
- ^ Choudhry S, Seibold MA, Borrell LN, Tang H, Serebrisky D, Chapela R, et al. (July 2007). «Dissecting complex diseases in complex populations: asthma in latino americans». Proceedings of the American Thoracic Society. 4 (3): 226–33. doi:10.1513/pats.200701-029AW. PMC 2647623. PMID 17607004.
- ^ Dietert RR (September 2011). «Maternal and childhood asthma: risk factors, interactions, and ramifications». Reproductive Toxicology. 32 (2): 198–204. doi:10.1016/j.reprotox.2011.04.007. PMID 21575714.
- ^ Tan DJ, Walters EH, Perret JL, Lodge CJ, Lowe AJ, Matheson MC, Dharmage SC (February 2015). «Age-of-asthma onset as a determinant of different asthma phenotypes in adults: a systematic review and meta-analysis of the literature». Expert Review of Respiratory Medicine. 9 (1): 109–23. doi:10.1586/17476348.2015.1000311. PMID 25584929. S2CID 23213216.
- ^ Kelly FJ, Fussell JC (August 2011). «Air pollution and airway disease». Clinical and Experimental Allergy. 41 (8): 1059–71. doi:10.1111/j.1365-2222.2011.03776.x. PMID 21623970. S2CID 37717160.
- ^ «Occupational Asthmagens — New York State Department of Health».
- ^ «Occupational Asthmagens — HSE».
- ^ GINA 2011, p. 6
- ^ GINA 2011, p. 61
- ^ a b Gold DR, Wright R (2005). «Population disparities in asthma». Annual Review of Public Health. 26: 89–113. doi:10.1146/annurev.publhealth.26.021304.144528. PMID 15760282.
- ^ «Urban Air Pollution and Health Inequities: A Workshop Report». Environmental Health Perspectives. 109 (s3): 357–374. 2001. doi:10.1289/ehp.01109s3357. ISSN 0091-6765.
- ^ Brooks N, Sethi R (February 1997). «The Distribution of Pollution: Community Characteristics and Exposure to Air Toxics». Journal of Environmental Economics and Management. 32 (2): 233–50. doi:10.1006/jeem.1996.0967.
- ^ McGwin G, Lienert J, Kennedy JI (March 2010). «Formaldehyde exposure and asthma in children: a systematic review». Environmental Health Perspectives. 118 (3): 313–7. doi:10.1289/ehp.0901143. PMC 2854756. PMID 20064771.
- ^ Jaakkola JJ, Knight TL (July 2008). «The role of exposure to phthalates from polyvinyl chloride products in the development of asthma and allergies: a systematic review and meta-analysis». Environmental Health Perspectives. 116 (7): 845–53. doi:10.1289/ehp.10846. PMC 2453150. PMID 18629304.
- ^ Bornehag CG, Nanberg E (April 2010). «Phthalate exposure and asthma in children». International Journal of Andrology. 33 (2): 333–45. doi:10.1111/j.1365-2605.2009.01023.x. PMID 20059582.
- ^ Mamane A, Baldi I, Tessier JF, Raherison C, Bouvier G (June 2015). «Occupational exposure to pesticides and respiratory health». European Respiratory Review. 24 (136): 306–19. doi:10.1183/16000617.00006014. PMC 9487813. PMID 26028642.
- ^ Mamane A, Raherison C, Tessier JF, Baldi I, Bouvier G (September 2015). «Environmental exposure to pesticides and respiratory health». European Respiratory Review. 24 (137): 462–73. doi:10.1183/16000617.00006114. PMC 9487696. PMID 26324808.
- ^ Gruenwald, Talor; Seals, Brady A.; Knibbs, Luke D.; Hosgood, H. Dean (January 2023). «Population Attributable Fraction of Gas Stoves and Childhood Asthma in the United States». International Journal of Environmental Research and Public Health. 20 (1): 75. doi:10.3390/ijerph20010075. ISSN 1660-4601. PMC 9819315. PMID 36612391.
- ^ Heintze K, Petersen KU (June 2013). «The case of drug causation of childhood asthma: antibiotics and paracetamol». European Journal of Clinical Pharmacology. 69 (6): 1197–209. doi:10.1007/s00228-012-1463-7. PMC 3651816. PMID 23292157.
- ^ Henderson AJ, Shaheen SO (March 2013). «Acetaminophen and asthma». Paediatric Respiratory Reviews. 14 (1): 9–15, quiz 16. doi:10.1016/j.prrv.2012.04.004. PMID 23347656.
- ^ Cheelo M, Lodge CJ, Dharmage SC, Simpson JA, Matheson M, Heinrich J, Lowe AJ (January 2015). «Paracetamol exposure in pregnancy and early childhood and development of childhood asthma: a systematic review and meta-analysis». Archives of Disease in Childhood. 100 (1): 81–9. doi:10.1136/archdischild-2012-303043. PMID 25429049. S2CID 13520462.
- ^ van de Loo KF, van Gelder MM, Roukema J, Roeleveld N, Merkus PJ, Verhaak CM (January 2016). «Prenatal maternal psychological stress and childhood asthma and wheezing: a meta-analysis». The European Respiratory Journal. 47 (1): 133–46. doi:10.1183/13993003.00299-2015. PMID 26541526.
- ^ Ahluwalia SK, Matsui EC (April 2011). «The indoor environment and its effects on childhood asthma». Current Opinion in Allergy and Clinical Immunology. 11 (2): 137–43. doi:10.1097/ACI.0b013e3283445921. PMID 21301330. S2CID 35075329.
- ^ Arshad SH (January 2010). «Does exposure to indoor allergens contribute to the development of asthma and allergy?». Current Allergy and Asthma Reports. 10 (1): 49–55. doi:10.1007/s11882-009-0082-6. PMID 20425514. S2CID 30418306.
- ^ Custovic A, Simpson A (2012). «The role of inhalant allergens in allergic airways disease». Journal of Investigational Allergology & Clinical Immunology. 22 (6): 393–401, qiuz follow 401. PMID 23101182.
- ^ a b Gøtzsche PC, Johansen HK (April 2008). «House dust mite control measures for asthma». The Cochrane Database of Systematic Reviews. 2008 (2): CD001187. doi:10.1002/14651858.CD001187.pub3. PMC 8786269. PMID 18425868.
- ^ Calderón MA, Linneberg A, Kleine-Tebbe J, De Blay F, Hernandez Fernandez de Rojas D, Virchow JC, Demoly P (July 2015). «Respiratory allergy caused by house dust mites: What do we really know?». The Journal of Allergy and Clinical Immunology. 136 (1): 38–48. doi:10.1016/j.jaci.2014.10.012. PMID 25457152.
- ^ Sauni R, Verbeek JH, Uitti J, Jauhiainen M, Kreiss K, Sigsgaard T (February 2015). «Remediating buildings damaged by dampness and mould for preventing or reducing respiratory tract symptoms, infections and asthma». The Cochrane Database of Systematic Reviews. 2015 (2): CD007897. doi:10.1002/14651858.CD007897.pub3. PMC 6769180. PMID 25715323.
- ^ a b NHLBI Guideline 2007, p. 11
- ^ Ramsey CD, Celedón JC (January 2005). «The hygiene hypothesis and asthma». Current Opinion in Pulmonary Medicine. 11 (1): 14–20. doi:10.1097/01.mcp.0000145791.13714.ae. PMID 15591883. S2CID 44556390.
- ^ Bufford JD, Gern JE (May 2005). «The hygiene hypothesis revisited». Immunology and Allergy Clinics of North America. 25 (2): 247–62, v–vi. doi:10.1016/j.iac.2005.03.005. PMID 15878454.
- ^ a b Brooks C, Pearce N, Douwes J (February 2013). «The hygiene hypothesis in allergy and asthma: an update». Current Opinion in Allergy and Clinical Immunology. 13 (1): 70–7. doi:10.1097/ACI.0b013e32835ad0d2. PMID 23103806. S2CID 23664343.
- ^ Rao D, Phipatanakul W (October 2011). «Impact of environmental controls on childhood asthma». Current Allergy and Asthma Reports. 11 (5): 414–20. doi:10.1007/s11882-011-0206-7. PMC 3166452. PMID 21710109.
- ^ Murk W, Risnes KR, Bracken MB (June 2011). «Prenatal or early-life exposure to antibiotics and risk of childhood asthma: a systematic review». Pediatrics. 127 (6): 1125–38. doi:10.1542/peds.2010-2092. PMID 21606151. S2CID 26098640.
- ^ British Guideline 2009, p. 72
- ^ Neu J, Rushing J (June 2011). «Cesarean versus vaginal delivery: long-term infant outcomes and the hygiene hypothesis». Clinics in Perinatology. 38 (2): 321–31. doi:10.1016/j.clp.2011.03.008. PMC 3110651. PMID 21645799.
- ^ Von Hertzen LC, Haahtela T (February 2004). «Asthma and atopy – the price of affluence?». Allergy. 59 (2): 124–37. doi:10.1046/j.1398-9995.2003.00433.x. PMID 14763924. S2CID 34049674.
- ^ a b Martinez FD (July 2007). «CD14, endotoxin, and asthma risk: actions and interactions». Proceedings of the American Thoracic Society. 4 (3): 221–5. doi:10.1513/pats.200702-035AW. PMC 2647622. PMID 17607003.
- ^ a b c Elward G, Douglas KS (2010). Asthma. London: Manson Pub. pp. 27–29. ISBN 978-1-84076-513-7. Archived from the original on 2016-05-17.
- ^ a b c Ober C, Hoffjan S (March 2006). «Asthma genetics 2006: the long and winding road to gene discovery». Genes and Immunity. 7 (2): 95–100. doi:10.1038/sj.gene.6364284. PMID 16395390.
- ^ Halapi E, Bjornsdottir US (January 2009). «Overview on the current status of asthma genetics». The Clinical Respiratory Journal. 3 (1): 2–7. doi:10.1111/j.1752-699X.2008.00119.x. PMID 20298365. S2CID 36471997.
- ^ a b Rapini RP, Bolognia JL, Jorizzo JL (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN 978-1-4160-2999-1.
- ^ GINA 2011, p. 4
- ^ Jennette JC, Falk RJ, Bacon PA, Basu N, Cid MC, Ferrario F, et al. (January 2013). «2012 revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides». Arthritis and Rheumatism. 65 (1): 1–11. doi:10.1002/art.37715. PMID 23045170.
- ^ Beuther DA (January 2010). «Recent insight into obesity and asthma». Current Opinion in Pulmonary Medicine. 16 (1): 64–70. doi:10.1097/MCP.0b013e3283338fa7. PMID 19844182. S2CID 34157182.
- ^ Holguin F, Fitzpatrick A (March 2010). «Obesity, asthma, and oxidative stress». Journal of Applied Physiology. 108 (3): 754–9. doi:10.1152/japplphysiol.00702.2009. PMID 19926826.
- ^ Wood LG, Gibson PG (July 2009). «Dietary factors lead to innate immune activation in asthma». Pharmacology & Therapeutics. 123 (1): 37–53. doi:10.1016/j.pharmthera.2009.03.015. PMID 19375453.
- ^ O’Rourke ST (October 2007). «Antianginal actions of beta-adrenoceptor antagonists». American Journal of Pharmaceutical Education. 71 (5): 95. doi:10.5688/aj710595. PMC 2064893. PMID 17998992.
- ^ Salpeter S, Ormiston T, Salpeter E (2002). «Cardioselective beta-blockers for reversible airway disease». The Cochrane Database of Systematic Reviews. 2011 (4): CD002992. doi:10.1002/14651858.CD002992. PMC 8689715. PMID 12519582.
- ^ Morales DR, Jackson C, Lipworth BJ, Donnan PT, Guthrie B (April 2014). «Adverse respiratory effect of acute β-blocker exposure in asthma: a systematic review and meta-analysis of randomized controlled trials». Chest. 145 (4): 779–786. doi:10.1378/chest.13-1235. PMID 24202435.
- ^ Covar RA, Macomber BA, Szefler SJ (February 2005). «Medications as asthma triggers». Immunology and Allergy Clinics of North America. 25 (1): 169–90. doi:10.1016/j.iac.2004.09.009. PMID 15579370.
- ^ Lai T, Wu M, Liu J, Luo M, He L, Wang X, et al. (February 2018). «Acid-Suppressive Drug Use During Pregnancy and the Risk of Childhood Asthma: A Meta-analysis». Pediatrics. 141 (2): e20170889. doi:10.1542/peds.2017-0889. PMID 29326337.
- ^ a b c d Baxi SN, Phipatanakul W (April 2010). «The role of allergen exposure and avoidance in asthma». Adolescent Medicine. 21 (1): 57–71, viii–ix. PMC 2975603. PMID 20568555.
- ^ Sharpe RA, Bearman N, Thornton CR, Husk K, Osborne NJ (January 2015). «Indoor fungal diversity and asthma: a meta-analysis and systematic review of risk factors». The Journal of Allergy and Clinical Immunology. 135 (1): 110–22. doi:10.1016/j.jaci.2014.07.002. PMID 25159468.
- ^ Chen E, Miller GE (November 2007). «Stress and inflammation in exacerbations of asthma». Brain, Behavior, and Immunity. 21 (8): 993–9. doi:10.1016/j.bbi.2007.03.009. PMC 2077080. PMID 17493786.
- ^ Pike KC, Akhbari M, Kneale D, Harris KM (March 2018). «Interventions for autumn exacerbations of asthma in children». The Cochrane Database of Systematic Reviews. 2018 (3): CD012393. doi:10.1002/14651858.CD012393.pub2. PMC 6494188. PMID 29518252.
- ^ a b NHLBI Guideline 2007, p. 42
- ^ GINA 2011, p. 20
- ^ American Academy of Allergy, Asthma, and Immunology. «Five things physicians and patients should question» (PDF). Choosing Wisely. ABIM Foundation. Archived from the original (PDF) on November 3, 2012. Retrieved August 14, 2012.
- ^ Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma. National Heart, Lung, and Blood Institute (US). 2007. 07-4051 – via NCBI.
- ^ Welsh EJ, Bara A, Barley E, Cates CJ (January 2010). Welsh EJ (ed.). «Caffeine for asthma» (PDF). The Cochrane Database of Systematic Reviews. 2010 (1): CD001112. doi:10.1002/14651858.CD001112.pub2. PMC 7053252. PMID 20091514.
- ^ NHLBI Guideline 2007, p. 58
- ^ Pinnock H, Shah R (April 2007). «Asthma». BMJ. 334 (7598): 847–50. doi:10.1136/bmj.39140.634896.BE. PMC 1853223. PMID 17446617.
- ^ NHLBI Guideline 2007, p. 59
- ^ a b Moore WC, Pascual RM (June 2010). «Update in asthma 2009». American Journal of Respiratory and Critical Care Medicine. 181 (11): 1181–7. doi:10.1164/rccm.201003-0321UP. PMC 3269238. PMID 20516492.
- ^ a b Self T, Chrisman C, Finch C (2009). «22. Asthma». In Koda-Kimble MA, Alldredge BK, et al. (eds.). Applied therapeutics: the clinical use of drugs (9th ed.). Philadelphia: Lippincott Williams & Wilkins. OCLC 230848069.
- ^ Delacourt C (June 2004). «[Bronchial changes in untreated asthma]» [Bronchial changes in untreated asthma]. Archives de Pediatrie. 11 (Suppl 2): 71s–73s. doi:10.1016/S0929-693X(04)90003-6. PMID 15301800.
- ^ Schiffman, George (18 December 2009). «Chronic obstructive pulmonary disease». MedicineNet. Archived from the original on 28 August 2010. Retrieved 2 September 2010.
- ^ Gibson PG, McDonald VM (July 2015). «Asthma-COPD overlap 2015: now we are six». Thorax. 70 (7): 683–691. doi:10.1136/thoraxjnl-2014-206740. PMID 25948695. S2CID 38550372.
- ^ a b c d British Guideline 2009, p. 54
- ^ Current Review of Asthma. London: Current Medicine Group. 2003. p. 42. ISBN 978-1-4613-1095-2. Archived from the original on 2017-09-08.
- ^ Barnes PJ (2008). «Asthma». In Fauci AS, Braunwald E, Kasper DL (eds.). Harrison’s Principles of Internal Medicine (17th ed.). New York: McGraw-Hill. pp. 1596–607. ISBN 978-0-07-146633-2.
- ^ McMahon M (2011). Pediatrics a competency-based companion. Philadelphia, PA: Saunders/Elsevier. ISBN 978-1-4160-5350-7.
- ^ Maitre B, Similowski T, Derenne JP (September 1995). «Physical examination of the adult patient with respiratory diseases: inspection and palpation». The European Respiratory Journal. 8 (9): 1584–93. doi:10.1183/09031936.95.08091584. PMID 8575588. S2CID 30677275. Archived from the original on 2015-04-29.
- ^ Werner HA (June 2001). «Status asthmaticus in children: a review». Chest. 119 (6): 1913–29. doi:10.1378/chest.119.6.1913. PMID 11399724.
- ^ a b Shiber JR, Santana J (May 2006). «Dyspnea». The Medical Clinics of North America. 90 (3): 453–79. doi:10.1016/j.mcna.2005.11.006. PMID 16473100.
- ^ a b Shah R, Saltoun CA (2012). «Chapter 14: Acute severe asthma (status asthmaticus)». Allergy and Asthma Proceedings. 33 (3): 47–50. doi:10.2500/aap.2012.33.3547. PMID 22794687.
- ^ a b Khan DA (Jan–Feb 2012). «Exercise-induced bronchoconstriction: burden and prevalence». Allergy and Asthma Proceedings. 33 (1): 1–6. doi:10.2500/aap.2012.33.3507. PMID 22370526.
- ^ Wuestenfeld JC, Wolfarth B (January 2013). «Special considerations for adolescent athletic and asthmatic patients». Open Access Journal of Sports Medicine. 4: 1–7. doi:10.2147/OAJSM.S23438. PMC 3871903. PMID 24379703.
- ^ GINA 2011, p. 17
- ^ Carlsen KH, Anderson SD, Bjermer L, Bonini S, Brusasco V, Canonica W, et al. (May 2008). European Respiratory, Society; European Academy of Allergy and Clinical, Immunology; GA(2)LEN. «Treatment of exercise-induced asthma, respiratory and allergic disorders in sports and the relationship to doping: Part II of the report from the Joint Task Force of European Respiratory Society (ERS) and European Academy of Allergy and Clinical Immunology (EAACI) in cooperation with GA(2)LEN». Allergy. 63 (5): 492–505. doi:10.1111/j.1398-9995.2008.01663.x. PMID 18394123.
- ^ Kindermann W (2007). «Do inhaled beta(2)-agonists have an ergogenic potential in non-asthmatic competitive athletes?». Sports Medicine. 37 (2): 95–102. doi:10.2165/00007256-200737020-00001. PMID 17241101. S2CID 20993439.
- ^ Pluim BM, de Hon O, Staal JB, Limpens J, Kuipers H, Overbeek SE, et al. (January 2011). «β₂-Agonists and physical performance: a systematic review and meta-analysis of randomized controlled trials». Sports Medicine. 41 (1): 39–57. doi:10.2165/11537540-000000000-00000. PMID 21142283. S2CID 189906919.
- ^ a b c Baur X, Aasen TB, Burge PS, Heederik D, Henneberger PK, Maestrelli P, et al. (June 2012). ERS Task Force on the Management of Work-related, Asthma. «The management of work-related asthma guidelines: a broader perspective». European Respiratory Review. 21 (124): 125–39. doi:10.1183/09059180.00004711. PMC 9487296. PMID 22654084.
- ^ Kunnamo I, ed. (2005). Evidence-based medicine guidelines. Chichester: Wiley. p. 214. ISBN 978-0-470-01184-3.
- ^ Frew AJ (2008). «Chapter 42: Occupational Asthma». In Castro M, Kraft M (eds.). Clinical Asthma. Philadelphia: Mosby / Elsevier. ISBN 978-0-323-07081-2.
- ^ Chang JE, White A, Simon RA, Stevenson DD (2012). «Aspirin-exacerbated respiratory disease: burden of disease». Allergy and Asthma Proceedings. 33 (2): 117–21. doi:10.2500/aap.2012.33.3541. PMID 22525387.
- ^ «Aspirin Exacerbated Respiratory Disease (AERD)». www.aaaai.org. American Academy of Allergy Asthma & Immunology. August 3, 2018. Archived from the original on September 18, 2018. Retrieved August 2, 2018.
- ^ Kennedy JL, Stoner AN, Borish L (November 2016). «Aspirin-exacerbated respiratory disease: Prevalence, diagnosis, treatment, and considerations for the future». American Journal of Rhinology & Allergy. 30 (6): 407–413. doi:10.2500/ajra.2016.30.4370. PMC 5108840. PMID 28124651.
- ^ a b c Adams KE, Rans TS (December 2013). «Adverse reactions to alcohol and alcoholic beverages». Annals of Allergy, Asthma & Immunology. 111 (6): 439–45. doi:10.1016/j.anai.2013.09.016. PMID 24267355.
- ^ Peters SP (2014). «Asthma phenotypes: nonallergic (intrinsic) asthma». The Journal of Allergy and Clinical Immunology. In Practice. 2 (6): 650–652. doi:10.1016/j.jaip.2014.09.006. PMID 25439352.
- ^ Burrows B, Martinez FD, Halonen M, Barbee RA, Cline MG (February 1989). «Association of asthma with serum IgE levels and skin-test reactivity to allergens». The New England Journal of Medicine. 320 (5): 271–277. doi:10.1056/NEJM198902023200502. PMID 2911321.
- ^ Hahn DL (2021). «Chlamydia pneumoniae and chronic asthma: Updated systematic review and meta-analysis of population attributable risk». PLOS ONE. 16 (4): e0250034. Bibcode:2021PLoSO..1650034H. doi:10.1371/journal.pone.0250034. PMC 8055030. PMID 33872336.
- ^ a b Hahn DL (August 1995). «Infectious asthma: a reemerging clinical entity?». The Journal of Family Practice. 41 (2): 153–157. PMID 7636455.
- ^ Hahn DL, Peeling RW, Dillon E, McDonald R, Saikku P (February 2000). «Serologic markers for Chlamydia pneumoniae in asthma». Annals of Allergy, Asthma & Immunology. 84 (2): 227–233. doi:10.1016/S1081-1206(10)62760-3. PMID 10719781.
- ^ Wagshul FA, Brown DT, Schultek NM, Hahn DL (2021). «Outcomes of Antibiotics in Adults with «Difficult to Treat» Asthma or the Overlap Syndrome». Journal of Asthma and Allergy. 14: 703–712. doi:10.2147/JAA.S313480. PMC 8216074. PMID 34163182.
- ^ a b NHLBI Guideline 2007, p. 46
- ^ Lichtenstein R (2013). Pediatric emergencies. Philadelphia: Elsevier. p. 1022. ISBN 978-0-323-22733-9. Archived from the original on 2017-09-08.
- ^ Van Bever HP, Han E, Shek L, Yi Chng S, Goh D (November 2010). «An approach to preschool wheezing: to label as asthma?». The World Allergy Organization Journal. 3 (11): 253–257. doi:10.1097/WOX.0b013e3181fc7fa1. PMC 3651058. PMID 23282943.
- ^ Gibson PG, McDonald VM, Marks GB (September 2010). «Asthma in older adults». Lancet. 376 (9743): 803–13. doi:10.1016/S0140-6736(10)61087-2. PMID 20816547. S2CID 12275555.
- ^ Hargreave FE, Parameswaran K (August 2006). «Asthma, COPD and bronchitis are just components of airway disease». The European Respiratory Journal. 28 (2): 264–7. doi:10.1183/09031936.06.00056106. PMID 16880365.
- ^ Diaz PK (2009). «23. Chronic obstructive pulmonary disease». Applied therapeutics: the clinical use of drugs (9th ed.). Philadelphia: Lippincott Williams & Wilkins.
- ^ a b NHLBI Guideline 2007, pp. 184–85
- ^ «Asthma». World Health Organization. April 2017. Archived from the original on 29 June 2011. Retrieved 30 May 2017.
- ^ Henneberger PK (April 2007). «Work-exacerbated asthma». Current Opinion in Allergy and Clinical Immunology. 7 (2): 146–51. doi:10.1097/ACI.0b013e328054c640. PMID 17351467. S2CID 20728967.
- ^ Lodge CJ, Allen KJ, Lowe AJ, Hill DJ, Hosking CS, Abramson MJ, Dharmage SC (2012). «Perinatal cat and dog exposure and the risk of asthma and allergy in the urban environment: a systematic review of longitudinal studies». Clinical & Developmental Immunology. 2012: 176484. doi:10.1155/2012/176484. PMC 3251799. PMID 22235226.
- ^ Chen CM, Tischer C, Schnappinger M, Heinrich J (January 2010). «The role of cats and dogs in asthma and allergy—a systematic review». International Journal of Hygiene and Environmental Health. 213 (1): 1–31. doi:10.1016/j.ijheh.2009.12.003. PMID 20053584.
- ^ a b Prescott SL, Tang ML (May 2005). Australasian Society of Clinical Immunology and, Allergy. «The Australasian Society of Clinical Immunology and Allergy position statement: Summary of allergy prevention in children». The Medical Journal of Australia. 182 (9): 464–7. doi:10.5694/j.1326-5377.2005.tb06787.x. PMID 15865590. S2CID 8172491.
- ^ a b c d e f g h i j k Bertrand P, Faccin AB (31 January 2020). «Asthma: Treatment». In Bertrand P, Sánchez I (eds.). Pediatric Respiratory Diseases: A Comprehensive Textbook. Springer Nature. pp. 415–428. doi:10.1007/978-3-030-26961-6. ISBN 978-3-03-026961-6. S2CID 210985844.
- ^ Cates CJ, Rowe BH (February 2013). «Vaccines for preventing influenza in people with asthma». The Cochrane Database of Systematic Reviews. 2 (2): CD000364. doi:10.1002/14651858.CD000364.pub4. PMC 6999427. PMID 23450529.
- ^ «Strategic Advisory Group of Experts on Immunization — report of the extraordinary meeting on the influenza A (H1N1) 2009 pandemic, 7 July 2009». Relevé Épidémiologique Hebdomadaire. 84 (30): 301–4. July 2009. PMID 19630186.
- ^ a b Been JV, Nurmatov UB, Cox B, Nawrot TS, van Schayck CP, Sheikh A (May 2014). «Effect of smoke-free legislation on perinatal and child health: a systematic review and meta-analysis». Lancet. 383 (9928): 1549–60. doi:10.1016/S0140-6736(14)60082-9. PMID 24680633. S2CID 8532979.
- ^ Ripoll BC, Leutholtz I (2011). Exercise and disease management (2nd ed.). Boca Raton: CRC Press. p. 100. ISBN 978-1-4398-2759-8. Archived from the original on 2016-05-06.
- ^ a b c d e NHLBI Guideline 2007, p. 213
- ^ a b «British Guideline on the Management of Asthma» (PDF). Scottish Intercollegiate Guidelines Network. 2008. Archived (PDF) from the original on 19 August 2008. Retrieved 2008-08-04.
- ^ Rabe KF, Adachi M, Lai CK, Soriano JB, Vermeire PA, Weiss KB, Weiss ST (July 2004). «Worldwide severity and control of asthma in children and adults: the global asthma insights and reality surveys». The Journal of Allergy and Clinical Immunology. 114 (1): 40–47. doi:10.1016/j.jaci.2004.04.042. PMID 15241342.
- ^ Demoly P, Gueron B, Annunziata K, Adamek L, Walters RD (June 2010). «Update on asthma control in five European countries: results of a 2008 survey». European Respiratory Review. 19 (116): 150–157. doi:10.1183/09059180.00002110. PMC 9682581. PMID 20956184. S2CID 13408225.
- ^ FitzGerald JM, Boulet LP, McIvor RA, Zimmerman S, Chapman KR (2006). «Asthma control in Canada remains suboptimal: the Reality of Asthma Control (TRAC) study». Canadian Respiratory Journal. 13 (5): 253–259. doi:10.1155/2006/753083. PMC 2683303. PMID 16896426.
- ^ Herland K, Akselsen JP, Skjønsberg OH, Bjermer L (January 2005). «How representative are clinical study patients with asthma or COPD for a larger «real life» population of patients with obstructive lung disease?». Respiratory Medicine. 99 (1): 11–19. doi:10.1016/j.rmed.2004.03.026. PMID 15672843.
- ^ Travers J, Marsh S, Williams M, Weatherall M, Caldwell B, Shirtcliffe P, et al. (March 2007). «External validity of randomised controlled trials in asthma: to whom do the results of the trials apply?». Thorax. 62 (3): 219–223. doi:10.1136/thx.2006.066837. PMC 2117157. PMID 17105779.
- ^ Lazarus SC, Chinchilli VM, Rollings NJ, Boushey HA, Cherniack R, Craig TJ, et al. (April 2007). «Smoking affects response to inhaled corticosteroids or leukotriene receptor antagonists in asthma». American Journal of Respiratory and Critical Care Medicine. 175 (8): 783–790. doi:10.1164/rccm.200511-1746OC. PMC 1899291. PMID 17204725.
- ^ Stapleton M, Howard-Thompson A, George C, Hoover RM, Self TH (2011). «Smoking and asthma». Journal of the American Board of Family Medicine. 24 (3): 313–322. doi:10.3122/jabfm.2011.03.100180. PMID 21551404. S2CID 3183714.
- ^ Hayes CE, Nuss HJ, Tseng TS, Moody-Thomas S (2015). «Use of asthma control indicators in measuring inhaled corticosteroid effectiveness in asthmatic smokers: a systematic review». The Journal of Asthma. 52 (10): 996–1005. doi:10.3109/02770903.2015.1065422. PMID 26418843. S2CID 36916271.
- ^ a b c Kew KM, Nashed M, Dulay V, Yorke J (September 2016). «Cognitive behavioural therapy (CBT) for adults and adolescents with asthma». The Cochrane Database of Systematic Reviews. 2016 (9): CD011818. doi:10.1002/14651858.CD011818.pub2. PMC 6457695. PMID 27649894.
- ^ Paudyal P, Hine P, Theadom A, Apfelbacher CJ, Jones CJ, Yorke J, et al. (May 2014). «Written emotional disclosure for asthma». The Cochrane Database of Systematic Reviews (5): CD007676. doi:10.1002/14651858.CD007676.pub2. PMID 24842151.
- ^ Bhogal S, Zemek R, Ducharme FM (July 2006). «Written action plans for asthma in children». The Cochrane Database of Systematic Reviews (3): CD005306. doi:10.1002/14651858.CD005306.pub2. PMID 16856090.
- ^ McCallum GB, Morris PS, Brown N, Chang AB (August 2017). «Culture-specific programs for children and adults from minority groups who have asthma». The Cochrane Database of Systematic Reviews. 2017 (8): CD006580. doi:10.1002/14651858.CD006580.pub5. PMC 6483708. PMID 28828760.
- ^ Kew KM, Carr R, Donovan T, Gordon M (April 2017). «Asthma education for school staff». The Cochrane Database of Systematic Reviews. 2017 (4): CD012255. doi:10.1002/14651858.CD012255.pub2. PMC 6478185. PMID 28402017.
- ^ Welsh EJ, Hasan M, Li P (October 2011). «Home-based educational interventions for children with asthma». The Cochrane Database of Systematic Reviews. 2014 (10): CD008469. doi:10.1002/14651858.CD008469.pub2. PMC 8972064. PMID 21975783.
- ^ Yorke J, Shuldham C (April 2005). «Family therapy for chronic asthma in children». The Cochrane Database of Systematic Reviews. 2005 (2): CD000089. doi:10.1002/14651858.CD000089.pub2. PMC 7038646. PMID 15846599.
- ^ Harris K, Kneale D, Lasserson TJ, McDonald VM, Grigg J, Thomas J, et al. (Cochrane Airways Group) (January 2019). «School-based self-management interventions for asthma in children and adolescents: a mixed methods systematic review». The Cochrane Database of Systematic Reviews. 1 (1): CD011651. doi:10.1002/14651858.CD011651.pub2. PMC 6353176. PMID 30687940.
- ^ Kew KM, Malik P, Aniruddhan K, Normansell R (October 2017). «Shared decision-making for people with asthma». The Cochrane Database of Systematic Reviews. 2017 (10): CD012330. doi:10.1002/14651858.CD012330.pub2. PMC 6485676. PMID 28972652.
- ^ Gatheral TL, Rushton A, Evans DJ, Mulvaney CA, Halcovitch NR, Whiteley G, et al. (April 2017). «Personalised asthma action plans for adults with asthma». The Cochrane Database of Systematic Reviews. 2017 (4): CD011859. doi:10.1002/14651858.CD011859.pub2. PMC 6478068. PMID 28394084.
- ^ Welsh EJ, Carr R, et al. (Cochrane Airways Group) (September 2015). «Pulse oximeters to self monitor oxygen saturation levels as part of a personalised asthma action plan for people with asthma». The Cochrane Database of Systematic Reviews. 2015 (9): CD011584. doi:10.1002/14651858.CD011584.pub2. PMC 9426972. PMID 26410043.
- ^ NHLBI Guideline 2007, p. 69
- ^ Thomson NC, Spears M (February 2005). «The influence of smoking on the treatment response in patients with asthma». Current Opinion in Allergy and Clinical Immunology. 5 (1): 57–63. doi:10.1097/00130832-200502000-00011. PMID 15643345. S2CID 25065026.
- ^ Stapleton M, Howard-Thompson A, George C, Hoover RM, Self TH (2011). «Smoking and asthma». Journal of the American Board of Family Medicine. 24 (3): 313–322. doi:10.3122/jabfm.2011.03.100180. PMID 21551404.
- ^ Singh M, Jaiswal N (June 2013). «Dehumidifiers for chronic asthma». The Cochrane Database of Systematic Reviews (6): CD003563. doi:10.1002/14651858.CD003563.pub2. PMID 23760885.
- ^ Carson KV, Chandratilleke MG, Picot J, Brinn MP, Esterman AJ, Smith BJ (September 2013). «Physical training for asthma». The Cochrane Database of Systematic Reviews. 9 (9): CD001116. doi:10.1002/14651858.CD001116.pub4. PMID 24085631.
- ^ Yang ZY, Zhong HB, Mao C, Yuan JQ, Huang YF, Wu XY, et al. (April 2016). «Yoga for asthma». The Cochrane Database of Systematic Reviews. 4 (11): CD010346. doi:10.1002/14651858.cd010346.pub2. PMC 6880926. PMID 27115477.
- ^ Adeniyi FB, Young T (July 2012). «Weight loss interventions for chronic asthma». The Cochrane Database of Systematic Reviews (7): CD009339. doi:10.1002/14651858.CD009339.pub2. PMID 22786526.
- ^ Cheng J, Pan T, Ye GH, Liu Q (July 2005). «Calorie controlled diet for chronic asthma». The Cochrane Database of Systematic Reviews (3): CD004674. doi:10.1002/14651858.CD004674.pub2. PMID 16034941.
- ^ «QRG 153 • British guideline on the management of asthma» (PDF). SIGN. September 2016. Archived (PDF) from the original on 9 October 2016. Retrieved 6 October 2016.
- ^ Normansell R, Sayer B, Waterson S, Dennett EJ, Del Forno M, Dunleavy A (June 2018). «Antibiotics for exacerbations of asthma». The Cochrane Database of Systematic Reviews. 2018 (6): CD002741. doi:10.1002/14651858.CD002741.pub2. PMC 6513273. PMID 29938789.
- ^ Parsons JP, Hallstrand TS, Mastronarde JG, Kaminsky DA, Rundell KW, Hull JH, et al. (May 2013). «An official American Thoracic Society clinical practice guideline: exercise-induced bronchoconstriction». American Journal of Respiratory and Critical Care Medicine. 187 (9): 1016–27. doi:10.1164/rccm.201303-0437ST. PMID 23634861.
- ^ a b Griffiths B, Ducharme FM (August 2013). «Combined inhaled anticholinergics and short-acting beta2-agonists for initial treatment of acute asthma in children». The Cochrane Database of Systematic Reviews (8): CD000060. doi:10.1002/14651858.CD000060.pub2. PMID 23966133.
- ^ a b Kirkland SW, Vandenberghe C, Voaklander B, Nikel T, Campbell S, Rowe BH (January 2017). «Combined inhaled beta-agonist and anticholinergic agents for emergency management in adults with asthma». The Cochrane Database of Systematic Reviews. 1 (1): CD001284. doi:10.1002/14651858.CD001284.pub2. PMC 6465060. PMID 28076656.
- ^ Vézina K, Chauhan BF, Ducharme FM (July 2014). «Inhaled anticholinergics and short-acting beta(2)-agonists versus short-acting beta2-agonists alone for children with acute asthma in hospital». The Cochrane Database of Systematic Reviews. 7 (7): CD010283. doi:10.1002/14651858.CD010283.pub2. PMID 25080126.
- ^ Teoh L, Cates CJ, Hurwitz M, Acworth JP, van Asperen P, Chang AB (April 2012). «Anticholinergic therapy for acute asthma in children» (PDF). The Cochrane Database of Systematic Reviews (4): CD003797. doi:10.1002/14651858.CD003797.pub2. PMID 22513916.
- ^ Rodrigo GJ, Nannini LJ (March 2006). «Comparison between nebulized adrenaline and beta2 agonists for the treatment of acute asthma. A meta-analysis of randomized trials». The American Journal of Emergency Medicine. 24 (2): 217–22. doi:10.1016/j.ajem.2005.10.008. PMID 16490653.
- ^ NHLBI Guideline 2007, p. 351
- ^ Smith M, Iqbal S, Elliott TM, Everard M, Rowe BH (2003). «Corticosteroids for hospitalised children with acute asthma». The Cochrane Database of Systematic Reviews. 2003 (2): CD002886. doi:10.1002/14651858.CD002886. PMC 6999806. PMID 12804441.
- ^ Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW (2001). «Early emergency department treatment of acute asthma with systemic corticosteroids». The Cochrane Database of Systematic Reviews (1): CD002178. doi:10.1002/14651858.CD002178. PMC 7025797. PMID 11279756.
- ^ Rowe BH, Spooner CH, Ducharme FM, Bretzlaff JA, Bota GW (July 2007). «Corticosteroids for preventing relapse following acute exacerbations of asthma». The Cochrane Database of Systematic Reviews (3): CD000195. doi:10.1002/14651858.CD000195.pub2. PMID 17636617. S2CID 11992578.
- ^ a b Nair P, Milan SJ, Rowe BH (December 2012). «Addition of intravenous aminophylline to inhaled beta(2)-agonists in adults with acute asthma». The Cochrane Database of Systematic Reviews. 12 (12): CD002742. doi:10.1002/14651858.CD002742.pub2. PMC 7093892. PMID 23235591.
- ^ NHLBI Guideline 2007, p. 218
- ^ a b Ducharme FM, Ni Chroinin M, Greenstone I, Lasserson TJ (May 2010). Ducharme FM (ed.). «Addition of long-acting beta2-agonists to inhaled corticosteroids versus same dose inhaled corticosteroids for chronic asthma in adults and children». The Cochrane Database of Systematic Reviews (5): CD005535. doi:10.1002/14651858.CD005535.pub2. PMC 4169792. PMID 20464739.
- ^ a b Ni Chroinin M, Greenstone I, Lasserson TJ, Ducharme FM (October 2009). «Addition of inhaled long-acting beta2-agonists to inhaled steroids as first line therapy for persistent asthma in steroid-naive adults and children». The Cochrane Database of Systematic Reviews (4): CD005307. doi:10.1002/14651858.CD005307.pub2. PMC 4170786. PMID 19821344.
- ^ Ducharme FM, Ni Chroinin M, Greenstone I, Lasserson TJ (April 2010). Ducharme FM (ed.). «Addition of long-acting beta2-agonists to inhaled steroids versus higher dose inhaled steroids in adults and children with persistent asthma». The Cochrane Database of Systematic Reviews (4): CD005533. doi:10.1002/14651858.CD005533.pub2. PMC 4169793. PMID 20393943.
- ^ a b Fanta CH (March 2009). «Asthma». The New England Journal of Medicine. 360 (10): 1002–14. doi:10.1056/NEJMra0804579. PMID 19264689.
- ^ Cates CJ, Cates MJ (April 2012). Cates CJ (ed.). «Regular treatment with formoterol for chronic asthma: serious adverse events». The Cochrane Database of Systematic Reviews. 4 (4): CD006923. doi:10.1002/14651858.CD006923.pub3. PMC 4017186. PMID 22513944.
- ^ Cates CJ, Cates MJ (July 2008). Cates CJ (ed.). «Regular treatment with salmeterol for chronic asthma: serious adverse events». The Cochrane Database of Systematic Reviews (3): CD006363. doi:10.1002/14651858.CD006363.pub2. PMC 4015854. PMID 18646149.
- ^ a b Chauhan BF, Chartrand C, Ni Chroinin M, Milan SJ, Ducharme FM (November 2015). «Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children». The Cochrane Database of Systematic Reviews. 2015 (11): CD007949. doi:10.1002/14651858.CD007949.pub2. PMC 4167878. PMID 26594816.
- ^ Chauhan BF, Ducharme FM (January 2014). «Addition to inhaled corticosteroids of long-acting beta2-agonists versus anti-leukotrienes for chronic asthma» (PDF). The Cochrane Database of Systematic Reviews (1): CD003137. doi:10.1002/14651858.CD003137.pub5. PMID 24459050.
- ^ a b Chauhan BF, Jeyaraman MM, Singh Mann A, Lys J, Abou-Setta AM, Zarychanski R, Ducharme FM (March 2017). «Addition of anti-leukotriene agents to inhaled corticosteroids for adults and adolescents with persistent asthma». The Cochrane Database of Systematic Reviews. 3 (4): CD010347. doi:10.1002/14651858.CD010347.pub2. PMC 6464690. PMID 28301050.
- ^ Watts K, Chavasse RJ (May 2012). Watts K (ed.). «Leukotriene receptor antagonists in addition to usual care for acute asthma in adults and children». The Cochrane Database of Systematic Reviews. 5 (5): CD006100. doi:10.1002/14651858.CD006100.pub2. PMC 7387678. PMID 22592708.
- ^ Miligkos M, Bannuru RR, Alkofide H, Kher SR, Schmid CH, Balk EM (November 2015). «Leukotriene-receptor antagonists versus placebo in the treatment of asthma in adults and adolescents: a systematic review and meta-analysis». Annals of Internal Medicine. 163 (10): 756–67. doi:10.7326/M15-1059. PMC 4648683. PMID 26390230.
- ^ British Guideline 2009, p. 43
- ^ Chauhan BF, Ben Salah R, Ducharme FM (October 2013). «Addition of anti-leukotriene agents to inhaled corticosteroids in children with persistent asthma». The Cochrane Database of Systematic Reviews (10): CD009585. doi:10.1002/14651858.CD009585.pub2. PMC 4235447. PMID 24089325.
- ^ «Zyflo (Zileuton tablets)» (PDF). United States Food and Drug Administration. Cornerstone Therapeutics Inc. June 2012. p. 1. Archived (PDF) from the original on 13 December 2014. Retrieved 12 December 2014.
- ^ Solèr M (September 2001). «Omalizumab, a monoclonal antibody against IgE for the treatment of allergic diseases». International Journal of Clinical Practice. 55 (7): 480–483. PMID 11594260.
- ^ McDonald NJ, Bara AI (2003). «Anticholinergic therapy for chronic asthma in children over two years of age». The Cochrane Database of Systematic Reviews. 2014 (3): CD003535. doi:10.1002/14651858.CD003535. PMC 8717339. PMID 12917970.
- ^ Westby M, Benson M, Gibson P (2004). «Anticholinergic agents for chronic asthma in adults». The Cochrane Database of Systematic Reviews. 2017 (3): CD003269. doi:10.1002/14651858.CD003269.pub2. PMC 6483359. PMID 15266477.
- ^ Dean T, Dewey A, Bara A, Lasserson TJ, Walters EH (2003). «Chloroquine as a steroid sparing agent for asthma». The Cochrane Database of Systematic Reviews (4): CD003275. doi:10.1002/14651858.CD003275. PMID 14583965.
- ^ Davies H, Olson L, Gibson P (2000). «Methotrexate as a steroid sparing agent for asthma in adults». The Cochrane Database of Systematic Reviews. 1998 (2): CD000391. doi:10.1002/14651858.CD000391. PMC 6483672. PMID 10796540.
- ^ Hiles SA, McDonald VM, Guilhermino M, Brusselle GG, Gibson PG (November 2019). «Does maintenance azithromycin reduce asthma exacerbations? An individual participant data meta-analysis». The European Respiratory Journal. 54 (5). doi:10.1183/13993003.01381-2019. PMID 31515407. S2CID 202567597.
- ^ GINA. «Difficult-to-Treat and Severe Asthma in Adolescent and Adult Patients: Diagnosis and Management». Global Initiative for Asthma. Retrieved 1 August 2021.
- ^ Steel HC, Theron AJ, Cockeran R, Anderson R, Feldman C (2012). «Pathogen- and host-directed anti-inflammatory activities of macrolide antibiotics». Mediators of Inflammation. 2012: 584262. doi:10.1155/2012/584262. PMC 3388425. PMID 22778497.
- ^ Hahn DL (December 2019). «When guideline treatment of asthma fails, consider a macrolide antibiotic». The Journal of Family Practice. 68 (10): 536, 540, 542, 545. PMID 31860697.
- ^ Wagshul FA, Brown DT, Schultek NM, Hahn DL (2021). «Outcomes of Antibiotics in Adults with «Difficult to Treat» Asthma or the Overlap Syndrome». Journal of Asthma and Allergy. 14: 703–712. doi:10.2147/JAA.S313480. PMC 8216074. PMID 34163182.
- ^ Kew KM, Beggs S, Ahmad S (May 2015). «Stopping long-acting beta2-agonists (LABA) for children with asthma well controlled on LABA and inhaled corticosteroids». The Cochrane Database of Systematic Reviews. 2017 (5): CD011316. doi:10.1002/14651858.CD011316.pub2. PMC 6486153. PMID 25997166.
- ^ a b c Ahmad S, Kew KM, Normansell R (June 2015). «Stopping long-acting beta2-agonists (LABA) for adults with asthma well controlled by LABA and inhaled corticosteroids» (PDF). The Cochrane Database of Systematic Reviews (6): CD011306. doi:10.1002/14651858.CD011306.pub2. PMID 26089258.
- ^ NHLBI Guideline 2007, p. 250
- ^ Cates CJ, Welsh EJ, Rowe BH, et al. (Cochrane Airways Group) (September 2013). «Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma». The Cochrane Database of Systematic Reviews. 2013 (9): CD000052. doi:10.1002/14651858.CD000052.pub3. PMC 7032675. PMID 24037768.
- ^ Travers AH, Milan SJ, Jones AP, Camargo CA, Rowe BH (December 2012). «Addition of intravenous beta(2)-agonists to inhaled beta(2)-agonists for acute asthma». The Cochrane Database of Systematic Reviews. 12: CD010179. doi:10.1002/14651858.CD010179. PMID 23235685.
- ^ Rodriguez C, Sossa M, Lozano JM (April 2008). «Commercial versus home-made spacers in delivering bronchodilator therapy for acute therapy in children». The Cochrane Database of Systematic Reviews. 2017 (2): CD005536. doi:10.1002/14651858.CD005536.pub2. PMC 6483735. PMID 18425921.
- ^ a b Rachelefsky G (January 2009). «Inhaled corticosteroids and asthma control in children: assessing impairment and risk». Pediatrics. 123 (1): 353–66. doi:10.1542/peds.2007-3273. PMID 19117903. S2CID 22386752.
- ^ Dahl R (August 2006). «Systemic side effects of inhaled corticosteroids in patients with asthma». Respiratory Medicine. 100 (8): 1307–17. doi:10.1016/j.rmed.2005.11.020. PMID 16412623.
- ^ Thomas MS, Parolia A, Kundabala M, Vikram M (June 2010). «Asthma and oral health: a review». Australian Dental Journal. 55 (2): 128–33. doi:10.1111/j.1834-7819.2010.01226.x. PMID 20604752.
- ^ Domino FJ, Baldor RA, Golding J, Grimes JA (2014). The 5-Minute Clinical Consult Premium 2015. Lippincott Williams & Wilkins. p. 192. ISBN 978-1-4511-9215-5.
- ^ Skoner DP (December 2016). «Inhaled corticosteroids: Effects on growth and bone health». Annals of Allergy, Asthma & Immunology. 117 (6): 595–600. doi:10.1016/j.anai.2016.07.043. PMID 27979015.
- ^ a b Petsky HL, Kew KM, Turner C, Chang AB (September 2016). «Exhaled nitric oxide levels to guide treatment for adults with asthma». The Cochrane Database of Systematic Reviews. 2016 (9): CD011440. doi:10.1002/14651858.CD011440.pub2. PMC 6457753. PMID 27580628.
- ^ a b Petsky HL, Kew KM, Chang AB (November 2016). «Exhaled nitric oxide levels to guide treatment for children with asthma». The Cochrane Database of Systematic Reviews. 11 (5): CD011439. doi:10.1002/14651858.CD011439.pub2. PMC 6432844. PMID 27825189.
- ^ Keeney GE, Gray MP, Morrison AK, Levas MN, Kessler EA, Hill GD, et al. (March 2014). «Dexamethasone for acute asthma exacerbations in children: a meta-analysis». Pediatrics. 133 (3): 493–9. doi:10.1542/peds.2013-2273. PMC 3934336. PMID 24515516.
- ^ Rowe BH, Kirkland SW, Vandermeer B, Campbell S, Newton A, Ducharme FM, Villa-Roel C (March 2017). «Prioritizing Systemic Corticosteroid Treatments to Mitigate Relapse in Adults With Acute Asthma: A Systematic Review and Network Meta-analysis». Academic Emergency Medicine. 24 (3): 371–381. doi:10.1111/acem.13107. PMID 27664401. S2CID 30182169.
- ^ Noppen M (August 2002). «Magnesium treatment for asthma: where do we stand?». Chest. 122 (2): 396–8. doi:10.1378/chest.122.2.396. PMID 12171805.
- ^ Griffiths B, Kew KM (April 2016). «Intravenous magnesium sulfate for treating children with acute asthma in the emergency department» (PDF). The Cochrane Database of Systematic Reviews. 2016 (4): CD011050. doi:10.1002/14651858.CD011050.pub2. PMC 6599814. PMID 27126744.
- ^ Kew KM, Kirtchuk L, Michell CI (May 2014). Kew KM (ed.). «Intravenous magnesium sulfate for treating adults with acute asthma in the emergency department» (PDF). The Cochrane Database of Systematic Reviews. 5 (5): CD010909. doi:10.1002/14651858.CD010909.pub2. PMID 24865567.
- ^ a b Knightly R, Milan SJ, Hughes R, Knopp-Sihota JA, Rowe BH, Normansell R, Powell C (November 2017). «Inhaled magnesium sulfate in the treatment of acute asthma». The Cochrane Database of Systematic Reviews. 2017 (11): CD003898. doi:10.1002/14651858.CD003898.pub6. PMC 6485984. PMID 29182799.
- ^ a b Rodrigo GJ, Rodrigo C, Hall JB (March 2004). «Acute asthma in adults: a review». Chest. 125 (3): 1081–102. doi:10.1378/chest.125.3.1081. PMID 15006973.
- ^ GINA 2011, p. 37
- ^ NHLBI Guideline 2007, p. 399
- ^ a b Castro M, Musani AI, Mayse ML, Shargill NS (April 2010). «Bronchial thermoplasty: a novel technique in the treatment of severe asthma». Therapeutic Advances in Respiratory Disease. 4 (2): 101–16. doi:10.1177/1753465810367505. PMID 20435668.
- ^ Boulet LP, Laviolette M (May–Jun 2012). «Is there a role for bronchial thermoplasty in the treatment of asthma?». Canadian Respiratory Journal. 19 (3): 191–2. doi:10.1155/2012/853731. PMC 3418092. PMID 22679610.
- ^ GINA 2011, p. 70
- ^ «Pulmonary-Allergy Drugs Advisory Committee Meeting». FDA. July 25, 2018. Retrieved May 9, 2019.
- ^ Sastre J, Dávila I (June 2018). «Dupilumab: A New Paradigm for the Treatment of Allergic Diseases». Journal of Investigational Allergology & Clinical Immunology. 28 (3): 139–150. doi:10.18176/jiaci.0254. PMID 29939132.
- ^ Israel E, Reddel HK (September 2017). «Severe and Difficult-to-Treat Asthma in Adults». The New England Journal of Medicine. 377 (10): 965–976. doi:10.1056/NEJMra1608969. PMID 28877019. S2CID 44767865.
- ^ McQueen RB, Sheehan DN, Whittington MD, van Boven JF, Campbell JD (August 2018). «Cost-Effectiveness of Biological Asthma Treatments: A Systematic Review and Recommendations for Future Economic Evaluations». PharmacoEconomics. 36 (8): 957–971. doi:10.1007/s40273-018-0658-x. PMID 29736895. S2CID 13681118.
- ^ Farne HA, Wilson A, Milan S, Banchoff E, Yang F, Powell CV (July 2022). «Anti-IL-5 therapies for asthma». The Cochrane Database of Systematic Reviews. 2022 (7): CD010834. doi:10.1002/14651858.CD010834.pub4. PMC 9285134. PMID 35838542.
- ^ Lin SY, Erekosima N, Kim JM, Ramanathan M, Suarez-Cuervo C, Chelladurai Y, et al. (March 2013). «Sublingual immunotherapy for the treatment of allergic rhinoconjunctivitis and asthma: a systematic review». JAMA. 309 (12): 1278–88. doi:10.1001/jama.2013.2049. PMID 23532243.
- ^ Korang SK, Feinberg J, Wetterslev J, Jakobsen JC (September 2016). «Non-invasive positive pressure ventilation for acute asthma in children». The Cochrane Database of Systematic Reviews. 2016 (9): CD012067. doi:10.1002/14651858.CD012067.pub2. PMC 6457810. PMID 27687114.
- ^ Blanc PD, Trupin L, Earnest G, Katz PP, Yelin EH, Eisner MD (November 2001). «Alternative therapies among adults with a reported diagnosis of asthma or rhinosinusitis : data from a population-based survey». Chest. 120 (5): 1461–7. doi:10.1378/chest.120.5.1461. PMID 11713120.
- ^ Shenfield G, Lim E, Allen H (June 2002). «Survey of the use of complementary medicines and therapies in children with asthma». Journal of Paediatrics and Child Health. 38 (3): 252–7. doi:10.1046/j.1440-1754.2002.00770.x. PMID 12047692. S2CID 22129160.
- ^ Milan SJ, Hart A, Wilkinson M (October 2013). «Vitamin C for asthma and exercise-induced bronchoconstriction». The Cochrane Database of Systematic Reviews. 2013 (10): CD010391. doi:10.1002/14651858.CD010391.pub2. PMC 6513466. PMID 24154977.
- ^ Wilkinson M, Hart A, Milan SJ, Sugumar K (June 2014). «Vitamins C and E for asthma and exercise-induced bronchoconstriction». The Cochrane Database of Systematic Reviews. 2014 (6): CD010749. doi:10.1002/14651858.CD010749.pub2. PMC 6513032. PMID 24936673.
- ^ Hemilä H (June 2013). «Vitamin C may alleviate exercise-induced bronchoconstriction: a meta-analysis». BMJ Open. 3 (6): e002416. doi:10.1136/bmjopen-2012-002416. PMC 3686214. PMID 23794586.
- ^ Woods RK, Thien FC, Abramson MJ (2002). «Dietary marine fatty acids (fish oil) for asthma in adults and children». The Cochrane Database of Systematic Reviews. 2019 (3): CD001283. doi:10.1002/14651858.CD001283. PMC 6436486. PMID 12137622.
- ^ Pogson Z, McKeever T (March 2011). «Dietary sodium manipulation and asthma». The Cochrane Database of Systematic Reviews. 2011 (3): CD000436. doi:10.1002/14651858.CD000436.pub3. PMC 7032646. PMID 21412865.
- ^ a b Martineau AR, Cates CJ, Urashima M, Jensen M, Griffiths AP, Nurmatov U, et al. (September 2016). «Vitamin D for the management of asthma» (PDF). The Cochrane Database of Systematic Reviews. 9 (4): CD011511. doi:10.1002/14651858.CD011511.pub2. PMC 6457769. PMID 27595415.
- ^ a b Zhou Y, Yang M, Dong BR (June 2012). «Monosodium glutamate avoidance for chronic asthma in adults and children». The Cochrane Database of Systematic Reviews. 2014 (6): CD004357. doi:10.1002/14651858.CD004357.pub4. PMC 8823518. PMID 22696342.
- ^ a b NHLBI Guideline 2007, p. 240
- ^ McCarney RW, Brinkhaus B, Lasserson TJ, Linde K (2004). McCarney RW (ed.). «Acupuncture for chronic asthma». The Cochrane Database of Systematic Reviews. 2009 (1): CD000008. doi:10.1002/14651858.CD000008.pub2. PMC 7061358. PMID 14973944.
- ^ Blackhall K, Appleton S, Cates CJ (September 2012). Blackhall K (ed.). «Ionisers for chronic asthma». The Cochrane Database of Systematic Reviews. 9 (9): CD002986. doi:10.1002/14651858.CD002986.pub2. PMC 6483773. PMID 22972060.
- ^ Hondras MA, Linde K, Jones AP (April 2005). Hondras MA (ed.). «Manual therapy for asthma». The Cochrane Database of Systematic Reviews (2): CD001002. doi:10.1002/14651858.CD001002.pub2. PMID 15846609.
- ^ Macêdo TM, Freitas DA, Chaves GS, Holloway EA, Mendonça KM (April 2016). «Breathing exercises for children with asthma». The Cochrane Database of Systematic Reviews. 2016 (4): CD011017. doi:10.1002/14651858.CD011017.pub2. PMC 7104663. PMID 27070225.
- ^ Sergel MJ, Cydulka RK (September 2009). «Ch. 75: Asthma». In Wolfson AB, Harwood-Nuss A (eds.). Harwood-Nuss’ Clinical Practice of Emergency Medicine (5th ed.). Lippincott Williams & Wilkins. pp. 432–. ISBN 978-0-7817-8943-1.
- ^ NHLBI Guideline 2007, p. 1
- ^ a b «The Global Asthma Report 2014». Archived from the original on 27 April 2016. Retrieved 10 May 2016.
- ^ The global burden of disease : 2004 update ([Online-Ausg.] ed.). Geneva: World Health Organization. 2008. p. 35. ISBN 978-92-4-156371-0.
- ^ Maddox L, Schwartz DA (2002). «The pathophysiology of asthma». Annual Review of Medicine. 53: 477–98. doi:10.1146/annurev.med.53.082901.103921. PMID 11818486.
- ^ Beckett PA, Howarth PH (February 2003). «Pharmacotherapy and airway remodelling in asthma?». Thorax. 58 (2): 163–74. doi:10.1136/thorax.58.2.163. PMC 1746582. PMID 12554904.
- ^ Silva N, Carona C, Crespo C, Canavarro MC (June 2015). «Quality of life in pediatric asthma patients and their parents: a meta-analysis on 20 years of research». Expert Review of Pharmacoeconomics & Outcomes Research. 15 (3): 499–519. doi:10.1586/14737167.2015.1008459. hdl:10316/45410. PMID 25651982. S2CID 8768325.
- ^ «WHO Disease and injury country estimates». World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved November 11, 2009.
- ^ «Asthma prevalence». Our World in Data. Retrieved 15 February 2020.
- ^ World Health Organization. «WHO: Asthma». Archived from the original on 15 December 2007. Retrieved 2007-12-29.
- ^ Bush A, Menzies-Gow A (December 2009). «Phenotypic differences between pediatric and adult asthma». Proceedings of the American Thoracic Society. 6 (8): 712–719. doi:10.1513/pats.200906-046DP. PMID 20008882.
- ^ Weiss AJ, Wier LM, Stocks C, Blanchard J (June 2014). «Overview of Emergency Department Visits in the United States, 2011». HCUP Statistical Brief #174. Agency for Healthcare Research and Quality. PMID 25144109. Archived from the original on 2014-08-03.
- ^ Martin MA, Press VG, Nyenhuis SM, Krishnan JA, Erwin K, Mosnaim G, et al. (December 2016). «Care transition interventions for children with asthma in the emergency department». The Journal of Allergy and Clinical Immunology. 138 (6): 1518–1525. doi:10.1016/j.jaci.2016.10.012. PMC 5327498. PMID 27931533.
- ^ Grant EN, Wagner R, Weiss KB (August 1999). «Observations on emerging patterns of asthma in our society». The Journal of Allergy and Clinical Immunology. 104 (2 Pt 2): S1-9. doi:10.1016/S0091-6749(99)70268-X. PMID 10452783.
- ^ Bousquet J, Bousquet PJ, Godard P, Daures JP (July 2005). «The public health implications of asthma». Bulletin of the World Health Organization. 83 (7): 548–54. PMC 2626301. PMID 16175830.
- ^ Anderson HR, Gupta R, Strachan DP, Limb ES (January 2007). «50 years of asthma: UK trends from 1955 to 2004». Thorax. 62 (1): 85–90. doi:10.1136/thx.2006.066407. PMC 2111282. PMID 17189533.
- ^ Masoli M (2004). Global Burden of Asthma (PDF). p. 9. Archived from the original (PDF) on 2013-05-02.
- ^ «Asthma-related death rate in UK among highest in Europe, charity analysis finds». Pharmaceutical Journal. 3 May 2018. Archived from the original on 26 July 2020. Retrieved 13 August 2018.
- ^ «Asthma attacks triple when children return to school in September». NHS UK. 3 July 2019. Archived from the original on 26 July 2020. Retrieved 23 August 2019.
- ^ Rantala A, Jaakkola JJ, Jaakkola MS (2011). «Respiratory infections precede adult-onset asthma». PLOS ONE. 6 (12): e27912. Bibcode:2011PLoSO…627912R. doi:10.1371/journal.pone.0027912. PMC 3244385. PMID 22205932.
- ^ Yeh JJ, Wang YC, Hsu WH, Kao CH (April 2016). «Incident asthma and Mycoplasma pneumoniae: A nationwide cohort study». The Journal of Allergy and Clinical Immunology. 137 (4): 1017–1023.e6. doi:10.1016/j.jaci.2015.09.032. PMID 26586037.
- ^ Silva GE, Sherrill DL, Guerra S, Barbee RA (July 2004). «Asthma as a risk factor for COPD in a longitudinal study». Chest. 126 (1): 59–65. doi:10.1378/chest.126.1.59. PMID 15249443.
- ^ de Marco R, Marcon A, Rossi A, Antó JM, Cerveri I, Gislason T, et al. (September 2015). «Asthma, COPD and overlap syndrome: a longitudinal study in young European adults». The European Respiratory Journal. 46 (3): 671–679. doi:10.1183/09031936.00008615. PMID 26113674. S2CID 2169875.
- ^ a b c Barrett ML, Wier LM, Washington R (January 2014). «Trends in Pediatric and Adult Hospital Stays for Asthma, 2000–2010». HCUP Statistical Brief #169. Rockville, MD: Agency for Healthcare Research and Quality. PMID 24624462. Archived from the original on 2014-03-28.
- ^ Rosner F (2002). «The Life of Moses Maimonides, a Prominent Medieval Physician» (PDF). Einstein Quart J Biol Med. 19 (3): 125–28. Archived (PDF) from the original on 2009-03-05.
- ^ Thorowgood JC (November 1873). «On Bronchial Asthma». British Medical Journal. 2 (673): 600. doi:10.1136/bmj.2.673.600. PMC 2294647. PMID 20747287.
- ^ Gaskoin G (March 1872). «On the Treatment of Asthma». British Medical Journal. 1 (587): 339. doi:10.1136/bmj.1.587.339. PMC 2297349. PMID 20746575.
- ^ Berkart JB (June 1880). «The Treatment of Asthma». British Medical Journal. 1 (1016): 917–8. doi:10.1136/bmj.1.1016.917. PMC 2240555. PMID 20749537.
Berkart JB (June 1880). «The Treatment of Asthma». British Medical Journal. 1 (1017): 960–2. doi:10.1136/bmj.1.1017.960. PMC 2240530. PMID 20749546. - ^ Bosworth FH (1886). «Hay Fever, Asthma, and Allied Affections». Transactions of the Annual Meeting of the American Climatological Association. 2: 151–70. PMC 2526599. PMID 21407325.
- ^ Doig RL (February 1905). «Epinephrin; Especially in Asthma». California State Journal of Medicine. 3 (2): 54–5. PMC 1650334. PMID 18733372.
- ^ von Mutius E, Drazen JM (March 2012). «A patient with asthma seeks medical advice in 1828, 1928, and 2012». The New England Journal of Medicine. 366 (9): 827–34. doi:10.1056/NEJMra1102783. PMID 22375974. S2CID 5143546.
- ^ Crompton G (December 2006). «A brief history of inhaled asthma therapy over the last fifty years». Primary Care Respiratory Journal. 15 (6): 326–31. doi:10.1016/j.pcrj.2006.09.002. PMC 6730840. PMID 17092772.
- ^ McCullough D (1981). Mornings on Horseback: The Story of an Extraordinary Family, a Vanished Way of Life and the Unique Child Who Became Theodore Roosevelt. Simon and Schuster. pp. 93–108. ISBN 978-0-7432-1830-6. Archived from the original on 2015-04-07.
- ^ a b Opolski M, Wilson I (September 2005). «Asthma and depression: a pragmatic review of the literature and recommendations for future research». Clinical Practice and Epidemiology in Mental Health. 1: 18. doi:10.1186/1745-0179-1-18. PMC 1253523. PMID 16185365.
- ^ «Bangladeshi man with asthma wins France deportation fight». The Guardian. 12 January 2021. Retrieved 12 January 2021.
References
- National Asthma Education and Prevention Program (2007). «Guidelines for the Diagnosis and Management of Asthma». National Heart Lung and Blood Institute. EPR-3.
- «British Guideline on the Management of Asthma» (PDF). British Thoracic Society. 2012 [2008]. SIGN 101. Archived from the original (PDF) on 2008-08-19. Retrieved 2008-08-04.
- British Guideline on the Management of Asthma. British Thoracic Society. July 2019. ISBN 978-1-909103-70-2. SIGN 158.
- «Global Strategy for Asthma Management and Prevention» (PDF). Global Initiative for Asthma. 2011. Archived Reports.
External links
- Asthma at Curlie
Бронхиальная астма: причины появления, симптомы, диагностика и способы лечения.
Определение
Бронхиальная астма – это хроническое воспалительное заболевание дыхательных путей, которое проявляется приступами одышки, свистящего дыхания, кашля, а в тяжелых случаях – выраженным и даже жизнеугрожающим нарушением функции дыхания. Тактика ведения пациентов и способы лечения бронхиальной астмы достаточно давно исследуются врачами.
В последние годы частота встречаемости бронхиальной астмы неуклонно росла, что привело к успешной разработке новых эффективных препаратов, которые позволяют достичь контроля над клиническими проявлениями заболевания.
На данный момент правильно подобранная терапия в абсолютном большинстве случаев позволяет сохранить хорошее качество жизни пациента и минимизировать симптоматику болезни.
Причины появления бронхиальной астмы
Бронхиальная астма в типичном случае является заболеванием аллергической природы и связана с повышенной восприимчивостью организма конкретного человека к какому-либо веществу-аллергену. Именно поэтому бронхиальная астма часто сочетается с аллергическим ринитом, конъюнктивитом, атопическим дерматитом и другими аллергическими заболеваниями. Контакт с аллергеном активирует клетки иммунной системы особым образом. Это приводит к развитию череды характерных для астмы изменений в стенках бронхов: происходит скопление иммунных клеток, развивается воспалительный отек, наблюдается гиперреактивность гладкомышечных компонентов бронхиальной стенки, повышается выработка слизи (мокроты).
Эти четыре механизма приводят к сужению просвета бронхов, что, в свою очередь, затрудняет прохождение воздуха по дыхательным путям, вызывая характерные приступы одышки.
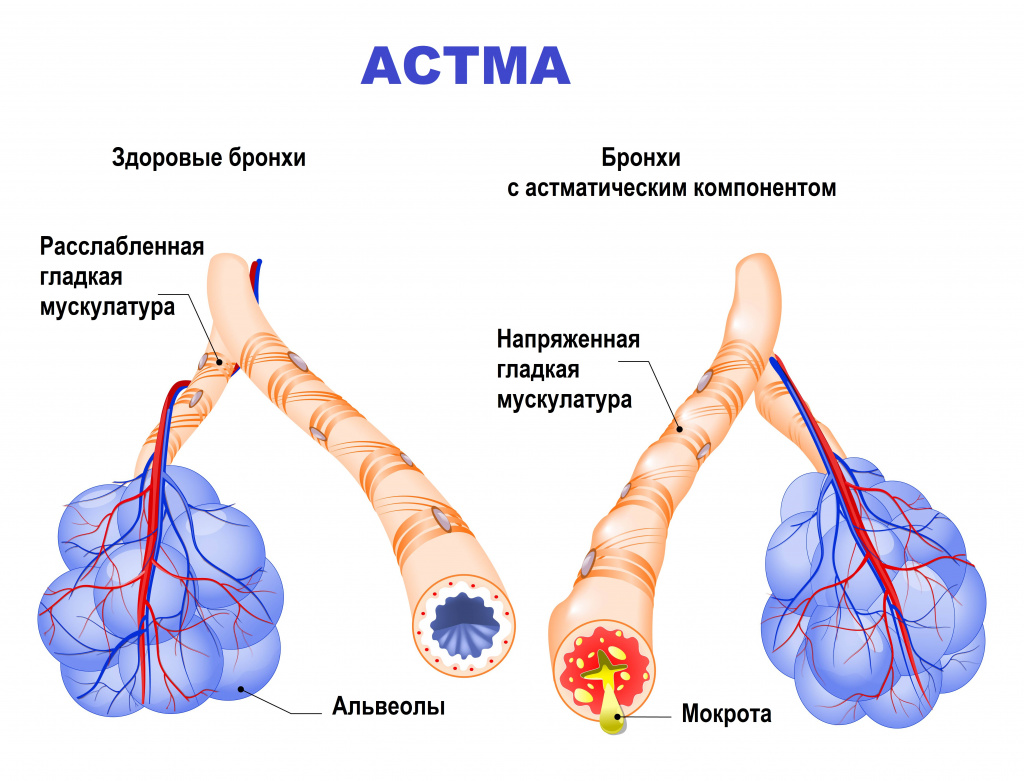
Немаловажную роль в патологических процессах при бронхиальной астме играет функциональное состояние вегетативной нервной системы, наличие хронических заболеваний (особенно дыхательной системы) и вредных привычек. Установлена прямая связь между курением и тяжестью течения заболевания.
Доказано, что вдыхание табачного дыма беременной и младенцем повышает риск развития астмы у ребенка.
Пребывание в среде с повышенным загрязнением воздуха (например, на производстве) провоцирует более тяжелое течение бронхиальной астмы.
Классификация заболевания
При постановке диагноза «бронхиальная астма» врачи стараются максимально уточнить характеристики заболевания у конкретного пациента в соответствии с нижеприведенной классификацией. Это позволяет определять тактику ведения пациента, предположительный ответ на терапию и прогноз.
Бронхиальная астма подразделяется на аллергическую, для которой характерны общие механизмы развития и признаки атопических (аллергических) заболеваний, и неаллергическую. Дополнительно астма характеризуется природой аллергена, вызывающего приступ.
В зависимости от частоты развития приступов и возможности их контролировать с помощью проводимой терапии астма бывает интермиттирующей (преходящей) и персистирующей (постоянной). Последняя, в свою очередь, подразделяется по степени тяжести на легкую, среднетяжелую и тяжелую.
Симптомы бронхиальной астмы
Типичным проявлением астмы является синдром бронхиальной обструкции (сужение просвета бронхов). Приступы одышки поначалу развиваются в основном при контакте с причинно-значимым аллергеном.
У больного возникает сухой кашель, затруднение дыхания (преимущественно на выдохе), дыхание может сопровождаться свистящими хрипами.
Во время приступа человек, как правило, испытывает чувство страха и ощущает нехватку воздуха. Состояние немного облегчается, если принять вынужденное положение — сесть, несколько наклонив туловище вперед, с упором вытянутыми руками на колени или край стула. Визуально отмечается бочкообразное вздутие грудной клетки — она словно застывает в положении глубокого вдоха.
В тяжелых случаях из-за недостаточного обогащения крови кислородом кожа приобретает синеватый оттенок.
По мере прогрессирования заболевания и при отсутствии соответствующего лекарственного контроля приступы астмы начинают развиваться не только в ответ на специфический аллерген, но и при эмоциональной и физической нагрузке, резкой смене температуры окружающего воздуха, в ответ на резкие запахи и т.д.
Диагностика бронхиальной астмы
Диагностика бронхиальной астмы основывается в первую очередь на жалобах пациента, истории болезни и результатах объективного обследования. Для врача крайне важно выяснить, в ответ на что развивается приступ, как долго продолжается, через какое время прекращается, как давно появились первые симптомы заболевания. Для подтверждения диагноза «аллергическая бронхиальная астма» важно выявить наличие у пациента и у его родственников симптомов других аллергических заболеваний.
После постановки предположительного диагноза проводятся специальные инструментальные и лабораторные исследования.
Среди инструментальных методов ведущую роль играют пикфлоуриметрия и спирометрия.
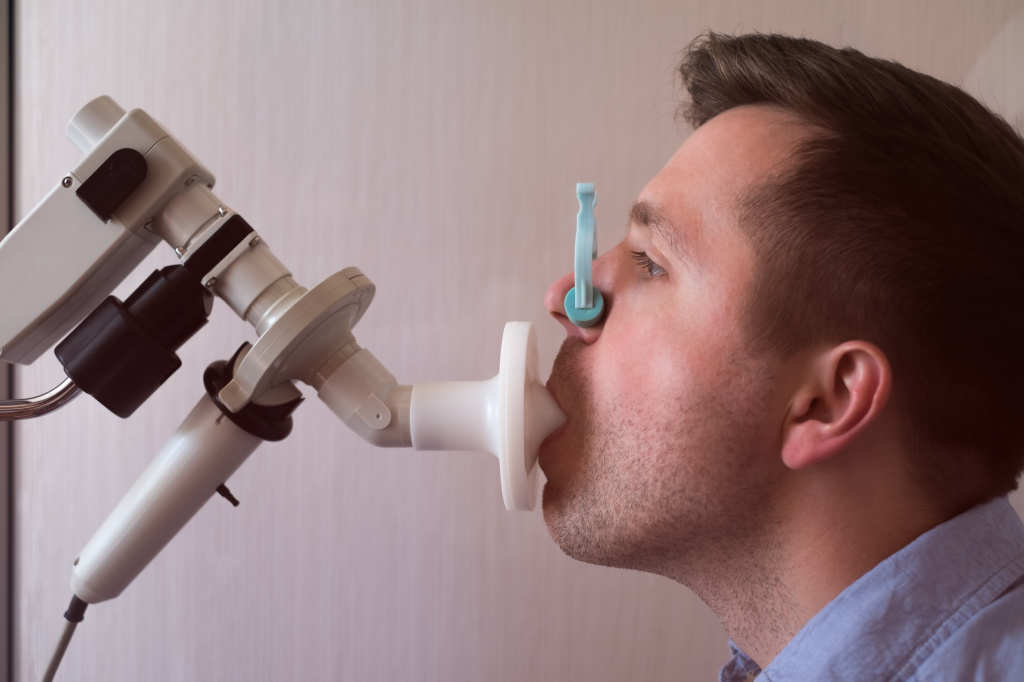
Данные методы позволяют оценить объем вдыхаемого и выдыхаемого воздуха, скорость выдоха и рассчитать специфические индексы (например, индекс Тиффно), которые характеризуют степень нарушения прохождения воздуха через дыхательные пути. Для этого пациента просят сделать вдох и далее выдохнуть в специальный прибор для измерения вышеперечисленных параметров. Поскольку данные исследования требуют координированных действий врача и пациента, их редко проводят детям младше 5 лет.
Для постановки диагноза нужно сделать пробу с лекарственным препаратом (бронхолитиком), поэтому перед спирометрией пациенту проводят медикаментозную ингаляцию. Данная проба показывает ответ бронхов на препараты и позволяет дифференцировать бронхиальную астму от других заболеваний со схожими симптомами.
Из лабораторных анализов наиболее диагностически значимым считается серологическое исследование с целью выявления специфических антител (специфические IgE) к возможным причинно-значимым аллергенам.
Врач-аллерголог может назначить проведение кожного скарификационного теста и других проб с аллергенами, что позволит выявить вещество, к которому у организма развилась повышенная чувствительность.
В клиническом анализе крови с определением лейкоцитарной формулы при бронхиальной астме возможно повышение количества эозинофилов.
Тем не менее данный анализ используется для исключения других заболеваний, протекающих с синдромом бронхиальной обструкции (например, бронхиолит у детей раннего возраста). Также необходимо знать, что обострения бронхиальной астмы могут быть спровоцированы респираторной инфекцией, диагностика которой включает посев мокроты, определение антител к микоплазме, хламидиям, коклюшу, проведение рентгенограммы грудной клетки в двух проекциях.
Anti-Chlamydophila pneumoniae IgA
Маркер текущей или недавней инфекции Chlamydia pneumoniae.
Chlamydia pneumoniae, подобно Chlamydia trachomatis, является бактерией — облигатным внутриклеточным паразитом. Это широко распрос�…
Антитела класса IgG Bordetella pertussis
Коклюш — распространённое инфекционное заболевание, несмотря на повсеместную вакцинацию. Возбудитель коклюша Bordetella pertussis прикрепляется к мерцательному эпителию �…
Антитела класса IgM к Bordetella pertussis
Маркёр первичной инфекции или недавней вакцинации Bordetella pertussis.
Коклюш — распространённое инфекционное заболевание, несмотря на повсеместную вакцинацию. Возбуди…
К каким врачам обращаться
Диагностикой и лечением бронхиальной астмы занимаются врачи-терапевты и педиатры совместно с аллергологами-иммунологами.
Зачастую астма может маскировать другие заболевания, например, сердечную недостаточность, гастроэзофагеальную рефлюксную болезнь, редкие болезни легких. В связи с этим может потребоваться консультация кардиолога, гастроэнтеролога, пульмонолога и др.
Лечение бронхиальной астмы
Лечение бронхиальной астмы комплексное и включает как медикаментозные, так и немедикаментозные средства (так называемые элиминационные режимы и диеты). Задача немедикаментозной терапии – исключить попадание аллергена в организм человека пищевым путем (исключение из диеты продуктов, вызывающих аллергию у конкретного человека), через дыхательные пути (поддержание чистоты в помещении, уборка пыли, отказ от пуховых подушек и одеял, частая стирка постельного белья гипоаллергенными моющими средствами). Если аллергеном является пыльца растений, то в период их цветения стоит ограничить пребывание в районах цветения, попадание пыльцы в жилые помещения (реже открывать окна) и т.д.
Медикаментозные средства включают препараты для быстрого купирования приступов и для базисного лечения, которое обеспечивает длительное снятие воспалительного процесса в стенке бронха.
К основным препаратам базисной терапии относятся ингаляционные препараты глюкокортикостероидов. В более тяжелых случаях кортикостероидные препараты могут быть назначены для приема внутрь или в виде инъекций. К другим средствам базисной терапии относятся антилейкотриеновые, биологические препараты и др.
Отдельно стоит сказать об аллерген-специфической иммунной терапии (АСИТ). Суть метода заключается в развитии толерантности иммунитета к аллергену, что обеспечивается введением в организм постепенно увеличивающихся доз препаратов, содержащих это вещество. В итоге организм перестает реагировать на аллерген, что позволяет достичь ремиссии заболевания.
Осложнения
К наиболее грозному осложнению бронхиальной астмы относится острая дыхательная недостаточность, которая развивается из-за критического сужения просвета бронхов.
Предвестниками очередного обострения течения астмы могут быть более длительные, частые и хуже купируемые лекарственными препаратами приступы, потребность в повышенных дозах и более частом использовании лекарств для купирования приступов. Такие состояния требуют обращения к врачу, не допуская развития жизнеугрожающего осложнения.
Профилактика бронхиальной астмы
Профилактические мероприятия, направленные на предупреждение развития очередного приступа астмы, заключаются в соблюдении элиминационного режима и в медикаментозном контроле, который достигается строгим соблюдением предписаний врача относительно лекарственной терапии.
Необходимо понимать, что в абсолютном большинстве случаев бронхиальная астма становится заболеванием, сопровождающим человека всю жизнь, поэтому большая ошибка – самостоятельно отменять препарат в период ремиссии, когда отсутствуют симптомы заболевания.
Пациентам с атопическими формами астмы, особенно родителям с больным ребенком, рекомендуется проживание в горной местности либо в непосредственной близости от моря, а также в климатических условиях с пониженной влажностью воздуха. Атмосфера, насыщенная хвойным запахом, рекомендуется пациентам, у которых заболевание сопровождается воспалительным процессом дыхательных органов.
Источники
- Клинические рекомендации «Бронхиальная астма». Разраб.: Российское респираторное общество, Российская ассоциация аллергологов и клинических иммунологов, Союз педиатров России. – 2021. – 85 с.
- Жмуров Д.В., Парфентева М.А., Семенова Ю.В. Бронхиальная астма // Coloquium journal. – 2020. – № 14(66). DOI: 10.24411/2520-6990-2020-11894
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
13062
01 Марта
-
13059
23 Февраля
-
4420
21 Февраля
Похожие статьи
Кардиосклероз
Кардиосклероз: причины появления, симптомы, диагностика и способы лечения.
Амилоидоз
Амилоидоз: причины появления, симптомы, диагностика и способы лечения.
Грыжи
Грыжи: причины появления, симптомы, диагностика и способы лечения.
Блефарит
Блефарит: причины появления, симптомы, диагностика и способы лечения.
Бронхиальная астма
Утратил силу — Архив
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Астма (J45), Астматический статус [status asthmaticus] (J46)
Разделы медицины:
Пульмонология
Общая информация
Краткое описание
Российское респираторное общество
Одобрен Научным советом Министерства Здравоохранения Российской Федерации
Клинические рекомендации
Бронхиальная астма
МКБ 10:
J.45, J.46
Год утверждения (частота пересмотра): 2019 (пересмотр каждые 3 года)
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности, и проявляются вместе с вариабельной обструкцией дыхательных путей [1].
Гетерогенность БА проявляется различными фенотипами заболевания, многие из которых возможно выделить в обычной клинической практике (см. раздел «Классификация»).
Кодирование по МКБ 10
Бронхиальная астма (J45):
J45.0 – Бронхиальная астма с преобладанием аллергического компонента
J45.1 – Неаллергическая бронхиальная астма
J45.8 – Смешанная бронхиальная астма
J45.9 – Бронхиальная астма неуточненная
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация БА по степени тяжести
У пациентов с впервые выявленной БА классификация по степени тяжести проводится на основании клинической картины (Табл. 2).
Таблица 2. Классификация впервые выявленной БА по степени тяжести.
*Примечание: Достаточно наличия одного из перечисленных критериев тяжести соответствующей группы, чтобы отнести больного к более тяжелой степени тяжести.
Тяжесть БА у пациентов, получающих лечение, оценивается ретроспективно, исходя из необходимого для контроля симптомов и обострений объема терапии (Табл. 3).
Таблица 3. Классификация БА по степени тяжести у пациентов, уже получающих лечение.
Примечание. *Подробнее описание ступенчатой терапии БА представлено на Рис. 1. ИГКС – ингаляционные глюкокортикостероиды; АЛТР – антилейкотриеновые препараты; БДБА –быстро действуюшие β2-агонисты (сальбутамол и формотерол); ДДБА – длительнодействующие β2-агонисты; СГКС – системные глюкокортикостероиды
Оценку можно проводить после нескольких месяцев терапии, направленной на контроль заболевания, и, по возможности, после попытки снизить интенсивность терапии для определения ее минимального уровня, эффективного у данного пациента. Поскольку течение БА крайне вариабельно, степень тяжести заболевания может меняться на протяжении месяцев и лет.
Классификация БА по уровню контроля
Оценка контроля симптомов БА проводится на основании клинических признаков за последние 4 недели, указанных в Табл. 4.
Таблица 4. Определение уровня контроля симптомов БА.
Классификация обострений БА по степени тяжести
Больные с любой степенью тяжести БА могут иметь легкие, среднетяжелые или тяжелые обострения. У ряда больных с интермиттирующей БА наблюдаются тяжелые и угрожающие жизни обострения на фоне длительных бессимптомных периодов с нормальной легочной функцией.
Степень тяжести обострений БА устанавливается по клиническим критериям, указанным в Табл. 5. Для того, чтобы отнести пациента к более тяжелой категории достаточно наличие хотя бы одного из соответствующих критериев.
Таблица 5. Определение степени тяжести обострений БА
Примечание. ПСВ – пиковая скорость выдоха, SрO2 – насыщение гемоглобина крови кислородом, PaO2 – парциальное напряжение кислорода в артериальной крови, РаСО2 – парциальное напряжение углекислого газа в артериальной крови
Под астматическим статусом понимают эпизод острой дыхательной недостаточности (ОДН) вследствие обострения БА. В современных классификациях астматический статус эквивалентен понятиям «жизнеугрожающая астма» и «астма, близкая к фатальной».
Классификация БА по фенотипам
Определение фенотипических особенностей заболевания является требованием времени, так как персонализированная медицина на основании отбора пациентов (выделение субпопуляций/кластеров/фенотипов БА) предусматривает использование ряда диагностических тестов и при подтверждении предполагаемого фенотипа — таргетную терапию, и персонифицированные методы профилактики [9-11].
Аллергическая БА: наиболее легко распознаваемый фенотип, при котором БА обычно начинается в детстве, связана с наличием других аллергических заболеваний (атопический дерматит, аллергический ринит, пищевая аллергия) у пациента или родственников. Для этого фенотипа характерно эозинофильное воспаление дыхательных путей. Пациенты с аллергической БА обычно хорошо отвечают на терапию ингаляционными глюкокортикостероидами ИГКС.
Неаллергическая БА: встречается у взрослых, не связана с аллергией. Профиль воспаления дыхательных путей у больных с данным фенотипом может быть эозинофильным, нейтрофильным, смешанным или малогранулоцитарным. В зависимости от характера воспаления пациенты с неаллергической астмой могут не отвечать на терапию ИГКС.
БА с поздним дебютом: у некоторых пациентов, особенно женщин, астма развивается впервые уже во взрослом возрасте. Эти больные чаще не имеют аллергии и, как правило, являются относительно рефрактерными к терапии стероидами или им требуются более высокие дозы ИГКС.
БА с фиксированной обструкцией дыхательных путей: у некоторых пациентов с длительным анамнезом БА, по-видимому, вследствие ремоделирования бронхиальной стенки развивается фиксированная обструкция дыхательных путей.
БА у больных с ожирением: пациенты с ожирением и БА часто имеют выраженные респираторные симптомы, не связанные с эозинофильным воспалением.
Трудная для лечения БА это астма, которая не контролируется, несмотря на лечение на ступени 4 или 5 по GINA (например, ИГКС в средней или высокой дозе со вторым контроллером (ДДБА или АЛТР); поддерживающая терапия ОКС)), или для которой требуется такое лечение для поддержания хорошего контроля симптомов и уменьшения риска обострений. Во многих случаях БА может быть трудной для лечения из-за модифицируемых факторов, таких как: неправильная техника ингаляции, плохая приверженность лечению, курение или сопутствующие заболевания, или из-за неправильного диагноза (подробнее см. раздел Информация — Дополнительная информация, влияющая на исход заболевания).
Тяжелая астма является подгруппой трудно поддающейся лечению астмы и означает астму, которая остается неконтролируемой, несмотря на приверженность максимально оптимизированной терапии и лечению сопутствующих заболеваний, или ухудшается когда высокие дозы ГКС уменьшаются. Большая часть больных тяжелой БА относится к T2-эндотипу БА и имеет эозинофильное воспаление в слизистой нижних дыхательных путей в формировании которого участвуют Th2-лимфоциты и врожденные лимфоидные клетки 2 типа (ILC2), генерирующие цитокины Т2-профиля: ИЛ-4, ИЛ-5, ИЛ-13.
Формулировка диагноза
В диагнозе должны быть указаны:
этиология (если установлена);
степень тяжести;
уровень контроля;
сопутствующие заболевания, которые могут оказать влияние на течение БА;
при наличии – обострение с указанием его степени тяжести.
Примеры формулировок диагноза:
Бронхиальная астма алллергическая форма, средней степени тяжести контролируемое течение. Аллергический ринит круглогодичный, легкое течение. Сенсибилизация к аллергенам клещей домашней пыли.
Бронхиальная астма неаллергическая, эозинофильная, средней степени тяжести частично контролируемое течение. Риносинусит полипозный рецидивирующий. Непереносимость нестероидных противовоспалительных препаратов («аспириновая триада»).
Бронхиальная астма аллергическая форма, средней степени тяжести, обострение средней степени тяжести. Аллергический ринит, сезонный, тяжелое течение. Сенсибилизация к пыльцевым аллергенам (деревья).
Бронхиальная астма неаллергическая форма, тяжелое течение; обострение, тяжелое; астматический статус, компенсированная стадия. Ожирение II ст.
Этиология и патогенез
Этиология и патогенез
Факторы, влияющие на развитие и проявления БА, приведены в табл. 1.
Таблица 1. Факторы, влияющие на развитие и проявления БА
| Факторы | Описание |
| Внутренние факторы |
Генетическая предрасположенность к атопии
Генетическая предрасположенность к бронхиальной гиперреактивности Пол (в детском возрасте БА чаще развивается у мальчиков; в подростковом и взрослом – у женщин) Ожирение |
| Факторы окружающей среды |
Аллергены: клещи домашней пыли, аллергены домашних животных, аллергены тараканов, грибковые аллергены, пыльца растений, грибковые аллергены Инфекционные агенты (преимущественно вирусные) Профессиональные факторы Аэрополлютанты: озон, диоксиды серы и азота, продукты сгорания дизельного топлива, табачный дым (активное и пассивное курение) Диета: повышенное потребление продуктов высокой степени обработки, увеличенное поступление омега-6 полиненасыщенной жирной кислоты и сниженное – антиоксидантов (в виде фруктов и овощей) и омега-3 полиненасыщенной жирной кислоты (в составе жирных сортов рыбы) |
Эпидемиология
Эпидемиология
По крайней мере, 300 млн. пациентов во всем мире страдают БА [1]. В РФ, по данным недавно проведенного эпидемиологического исследования, распространенность БА среди взрослых составляет 6,9% [2], а среди детей и подростков – около 10% [3].
Большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию, достигая контроля заболевания. Однако существенная часть больных (20–30%) имеет трудные для терапии фенотипы БА (тяжелая атопическая БА, БА при ожирении, БА курильщика, БА с поздним дебютом, БА с фиксированной бронхиальной обструкцией) и может быть рефрактерна к традиционной терапии. У них отмечается высокая частота обострений и обращений за неотложной медицинской помощью [1].
В приемных отделениях и отделениях неотложной помощи стационаров развитых стран на долю пациентов с обострением БА приходится до 12% всех обращений, из них 20–30% нуждаются в госпитализации в специализированные отделения, и около 4-7% – в отделения реанимации и интенсивной терапии (ОРИТ) [4-7]. Около 5% всех пациентов с обострением БА требуют проведения интубации трахеи и искусственной вентиляции легких (ИВЛ), при этом в случае проведения ИВЛ летальность среди больных БА достигает почти 7% [8].
Клиническая картина
Cимптомы, течение
Клиническая картина
Характерными симптомами БА являются свистящие хрипы, одышка, чувство заложенности в груди и кашель.
Симптомы вариабельны по времени и интенсивности и часто ухудшаются ночью или рано утром. Клинические проявления БА могут провоцировать респираторные вирусные инфекции, физические упражнения, воздействие аллергенов, изменения погоды, контакт с неспецифическими ирритантми [1].
Типичными клиническими симптомами БА у детей являются свистящие хрипы, кашель, одышка, часто усиливающиеся в ночное время или при пробуждении. При развитии обострения БА у детей появляется навязчивый сухой или малопродуктивный кашель (иногда до рвоты), экспираторная одышка, шумное свистящее дыхание.
Диагностика
Диагностика
• Диагноз БА рекомендуется устанавливать на основании жалоб и анамнестических данных пациента, результатов функциональных методов обследования, специфического аллергологического обследования и исключения других заболеваний [1].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1)
Ниже рассмотрена диагностика БА у взрослых (диагностика БА у детей и подростков рассматривается в разделе Диагностика БА у детей).
Жалобы, анамнез
• При сборе анамнеза у пациента с БА рекомендуется выяснять причины возникновения, продолжительность клинических проявлений и разрешения симптомов, наличие аллергических реакций у пациента и его кровных родственников, причинно-следственные особенности возникновения признаков болезни и ее обострений (Табл. 6) [1].
Таблица 6. Клинические признаки, увеличивающие и уменьшающие вероятность наличия БА
| Клинические признаки, повышающие вероятность наличия БА | Клинические признаки, уменьшающие вероятность наличия БА |
|
Наличие более одного из следующих симптомов — хрипы, удушье, чувство заложенности в грудной клетке и кашель, особенно в случаях:
— ухудшения симптомов ночью и рано утром; — возникновения симптомов при физической нагрузке, воздействии аллергенов и холодного воздуха; — возникновения симптомов после приема аспирина или бета-блокаторов. Наличие атопических заболеваний в анамнезе; Наличие БА и/или атопических заболеваний у родственников; Распространенные сухие свистящие хрипы при выслушивании (аускультации) грудной клетки; Низкие показатели ПСВ или ОФВ1 (ретроспективно или в серии исследований), необъяснимые другими причинами; Эозинофилия периферической крови, необъяснимая другими причинами |
Выраженные головокружения, потемнение в глазах, парестезии; Хронический продуктивный кашель при отсутствии свистящих хрипов или удушья; Постоянно нормальные результаты обследования грудной клетки при наличии симптоматики; Изменение голоса; Возникновение симптомов исключительно на фоне простудных заболеваний; Наличие большого стажа курения (более 20 пачек/лет); Заболевания сердца; Нормальные показатели ПСВ или спирометрии при наличии клинических проявлений |
Примечание. ПСВ – пиковая скорость выдоха; ОФВ1 – объем форсированного выдоха за 1 сек
• Для оценки контроля БА рекомендуется использовать вопросник по контролю над астмой (ACQ-5) и тест по контродю над астмой (АСТ) (Приложение Г1-Г2) [12-14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: АСТ используется у взрослых и детей старше 12 лет, с-АСТ – у детей с 4 до 11 лет (Приложение Г3).
Физикальное обследование
Наиболее часто при БА выявляют свистящие хрипы, которые у ряда пациентов выслушиваются только во время форсированного выдоха.
В связи с вариабельностью проявлений БА изменения со стороны дыхательной системы при физикальном обследовании могут отсутствовать.
Инструментальная диагностика
• У всех пациентов с подозрением на БА рекомендуется использовать спирометрию в качестве начального исследования для выявления и оценки степени тяжести обструкции дыхательных путей [1,15].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 3)
Комментарии: Повторные исследования функции легких часто более информативны, чем единичное обследование. Нормальные показатели спирометрии (или пикфлоуметрии) не исключают диагноза БА.
• Всем пациентам с БА рекомендуется выполнять бронходилатационный тест для определения степени обратимости обструкции под влиянием бронхорасширяющих препаратов [16,17].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3)
Комментарии: Бронходилатационный тест считается положительным, если после ингаляции бронходилататора коэффициент бронходилатации по объему форсированного выдоха за 1 сек (ОФВ1) составляет не менее 12%, и при этом абсолютный прирост составляет 200 мл и более.
Исследование бронхиальной гиперреактивности
• У пациентов с нормальными показателями спирометрии и отрицательным бронходилатационным тестом для подтверждения диагноза БА рекомендуется использовать тесты на выявление бронхиальной гиперреактивности (БГР) – бронхоконстрикторные тесты [18,19].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3)
Комментарии: Обычно выявление БГР основано на измерении ответа показателя ОФВ1 на ингаляцию повышающихся концентраций метахолина. Ответ рассчитывается в виде концентрации (или дозы) провокационного агента, вызывающего 20% падение показателя ОФВ1.
• Пациентам с подозрением на т.н. «астму физического усилия», особенно у детей и пациентов младшего возраста, рекомендуется проведение бронхоконстрикторного теста с физической нагрузкой для исключения бронхоспазма, вызванного охлаждением и высушиванием слизистой дыхательных путей при физической нагрузке [20].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3)
Комментарии: Положительный ответ на нагрузку (падение ОФВ1 более чем на 10%) – специфический индикатор БА. Этот тест более специфичен, но менее чувствительный чем исследования с метахолином, для диагностики бронхиальной астмы.
Мониторирование пиковой скорости выдоха
• У пациентов с клиническими симптомами БА, у которых нет возможности провести спирометрию или дополнительные диагностичекие тесты рекомендуется использовать множественные измерения пиковой скорости выдоха (ПСВ), выполняемые в течение по меньшей мере 2-х недель для подтверждения вариабельности скорости воздушного потока (Приложение Г4) [15,21,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
Комментарии: У пациентов с типичными респираторными симптомами выявление повышенной средней суточной вариабельности ПСВ (>10% у взрослых и >13% у детей) подтверждает диагноз БА.
Результаты мониторинга ПСВ должны интерпретироваться с учетом клинической ситуации, поскольку вариабельность ПСВ может быть повышена при заболеваниях, с которыми чаще всего проводится дифференциальная диагностика БА.
Другие методы диагностики
• В качестве маркеров аллергического воспаления при БА рекомендуется исследовать фракцию оксида азота в выдыхаемом воздухе (FENO) и уровень эозинофилов в мокроте (Табл. 5) [23,24,25].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
Комментарии: Повышение эозинофилов в индуцированной мокроте ≥3% наиболее часто рассматривается как критерий эозинофильного воспаления дыхательных путей. Эозинофилия крови и мокроты является фактором риска развития обострений и необратимой бронхиальной обструкции при БА.
Показатель FENO повышен при эозинофильной БА и ассоциируется с хорошим краткосрочным ответом на ИГКС. Уровень FENO также повышен при эозинофильном бронхите, атопии и аллергическом рините, снижен у курильщиков, во время бронхоспазма и ранней фазы аллергической реакции. Нормальные значения FENO, особенно в момент, когда симптоматика отсутствует, не исключают диагноз БА.
Таблица 7. Методы оценки воспаления дыхательных путей
Примечание. ПК20 – провокационная концентрация метахолина, вызывающая 20% падение ОФВ1;
# у нелеченных пациентов;
**при двукратном измерении в течении суток;
***при более чем четырехкратных измерениях
Диагностика БА у детей
• Диагностику БА у детей рекомендуется основывать на оценке клинических симптомов, наличии факторов риска развития БА при исключении других причин бронхиальной обструкции [1].
Уровень GPP
Комментарии: При сборе анамнеза следует обсудить весь набор симптомов за последние 3-4 месяца, обратив особое внимание на те, которые беспокоили в течение 2-х предшествующих недель. Свистящее дыхание должно быть подтверждено врачом, поскольку родители могут неправильно интерпретировать звуки, издаваемые их ребенком при дыхании [30]. При постановке диагноза также следует учитывать ответ на терапию, направленную на контроль заболевания.
Особенности диагностики БА в разные возрастные периоды
Дети первых двух лет жизни
Для детей от 0 до 2 лет с БА характерна наследственная отягощенность по аллергическим заболеваниям (особенно по материнской линии), высокая распространенность аллергических проявлений со стороны кожных покровов и аллергических реакций на пищевые продукты и медикаменты, отчетливый эффект бронхолитической терапии.
Во время острой респираторной вирусной инфекции у таких детей в ранние сроки развивается выраженный бронхообструктивный синдром. Однако на практике ни один из указанных признаков в отдельности, а также уровень общего иммуноглобулина Е (IgE) не может служить достоверным дифференциально-диагностическим критерием острого бронхита с бронхообструктивным синдромом и БА [28,29].
Дети 2–5 лет
Ключевым критерием диагностики БА в этом возрасте является персистирование симптомов на протяжении последнего года, за исключением случаев только пыльцевой сенсибилизации (Прил. Г7).
Наиболее частые триггеры – респираторные вирусы, аллергены (клещи домашней пыли, эпидермальные аллергены, пыльца аллергенных растений, пищевые), а также физическая нагрузка.
Дети 6–12 лет
В данной возрастной группе вирусиндуцированная астма остается частой формой заболевания.
БА может дебютировать в подростковом возрасте. При этом частым проявлением у них является бронхоспазм, вызванный физической нагрузкой.
Следует также учитывать, что пациенты нередко курят, а страх удушья формирует тревожность, чувство отверженности, подкрепляемые переживаниями своего отличия от сверстников.
Пикфлоуметрия
• В качестве метода диагностики и контроля за течением БА у пациентов старше 5 лет рекомендуется пикфлоуметрия (мониторинг ПСВ) [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств -3)
Комментарии: Измеряются утренние и вечерние показатели ПСВ, суточная вариабельность ПСВ (Прил. Г2).
Спирометрия
• Оценку функции внешнего дыхания в условиях форсированного выдоха рекомендуется осуществлять у детей с подозрением на БА в возрасте старше 5-6 лет [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 3)
Комментарии: У детей с контролируемым течением БА показатели функции легких могут быть снижены незначительно или соответствовать нормальным параметрам.
• Обратимость бронхиальной обструкции у детей с БА старше 5-6 лет рекомендуется оценивать в тесте с бронхолитиком (200 мкг сальбутамола**) по приросту ОФВ1 более 12% [16].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 3)
• У детей с подозрением на астму физического усилия для выявления посленагрузочного бронхоспазма рекомендуется использовать 6-минутный протокол нагрузки бегом [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Данный тест имеет диагностическое значение в некоторых сомнительных случаях у пациентов с подозрением на астму физического усилия.
Аллергологическое обследование
• Кожные скарификационные тесты рекомендуется проводить у детей любого возраста кроме пациентов с выраженным атопическим дерматитом/экземой, или при невозможности отмены антигистаминных препаратов, или существовании реальной угрозы развития анафилактической реакции на введение аллергена [32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Кожные пробы у детей раннего возраста менее чувствительны. Ведущую роль в постановке диагноза БА у этих пациентов играет тщательно собранный анамнез.
• Определение аллерген-специфических IgE рекомендуется у детей для уточнения этиологии заболевания, в том числе, когда выполнение кожных проб не представляется возможным [1,33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Прочие методы исследования
• Пациентам детского возраста с БА рекомендуется проведение рентгенографии органов грудной клетки в прямой проекции для исключения альтернативного диагноза [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
В анализах крови при БА характерных изменений нет. Часто выявляется эозинофилия, однако ее нельзя считать патогномоничным симптомом. В мокроте у детей с БА могут выявляться эозинофилы, спирали Куршмана, кристаллы Шарко-Лейдена.
У детей младше 5 лет может быть использована компьютерная бронхофонография.
• Детей в возрасте 5 лет и младше рекомендуется направлять на дополнительные исследования при наличии следующих признаков [34]:
— Отсутствие прибавки массы тела;
— Проявление симптомов в первые месяцы жизни или в очень раннем возрасте (особенно в сочетании с отсутствием прибавки массы тела);
— Рвота, связанная с респираторными симптомами;
— Постоянные свистящие хрипы;
— Отсутствие ответа на лекарственные средства для контроля БА;
— Отсутствие связи симптомов со стандартными провоцирующими факторами, такими как вирусные инфекции верхних дыхательных путей;
— Очаговые легочные или сердечно-сосудистые симптомы или синдром «барабанных палочек»;
— Гипоксемия вне связи с вирусным заболеванием
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Любой из перечисленых признаков указывает на наличие альтернативного диагноза и на необходимость проведения дальнейшего обследования. При проведении дифференциальной диагностики в зависимости от клинической ситуации можно использовать бронхоскопию, компьютерную томографию органов грудной клетки, а также направлять на консультации специалистов (оториноларинголога, гастроэнтеролога, дерматолога).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Обострения БА
Обострения БА представляют собой эпизоды нарастающей одышки, кашля, свистящих хрипов, или заложенности в грудной клетке, требующие изменений обычного режима терапии. Для обострения БА характерно снижение ПСВ и ОФВ1.
Обострения могут развиваться как у пациентов с уже известным диагнозом БА, так и быть первым проявлением БА. Обострения БА могут развиться у любого пациента, независимо от тяжести заболевания, но чаще возникают при трудно контролируемой БА. Скорость развития обострения БА может значительно варьировать у разных пациентов – от нескольких минут или часов до 10-14 дней, равно как и время разрешения обострения – от 5 до 14 дней.
• Пациентов с высоким риском смерти, связанной с БА, рекомендуется обучать обращению за медицинской помощью в самом начале обострения [35-37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: К этой группе относятся пациенты с наличием таких факторов риска как:
— Наличие в анамнезе жизнеугрожающего обострения БА;
— Наличие в анамнезе эпизодов искусственной вентиляции легких ИВЛ по поводу обострения БА;
— Наличие в анамнезе пневмоторакса или пневмомедиастинума;
— Госпитализация по поводу обострения БА в течение последнего года;
— Психологические проблемы (отрицание заболевания);
— Социоэкономические факторы (низкий доход, недоступность медикаментов);
— Недавнее уменьшение дозы или полное прекращение приема глюкокортикостероидов (ГКС);
— Низкий комплайнс к терапии;
— Снижение перцепции (восприятия) одышки.
Причины обострения БА
К обострению БА могут привести различные триггеры, индуцирующие воспаление дыхательных путей или провоцирующие острый бронхоспазм. Данные триггеры могут существенно различаться у разных больных. К основным триггерам относятся инфекции респираторного тракта (в основном, вирусы, чаще всего – риновирусы), аллергены, аэрополлютанты, физическая нагрузка, метеорологические факторы, прием некоторых лекарственных препаратов (бета-блокаторы, у пациентов с «аспириновой БА» — нестероидные противовоспалительные препараты (НПВП)), эмоциональные реакции и др. Другими факторами, которые способны привести к обострению БА, являются обострение риносинусита, гастроэзофагеальный рефлюкс, беременность, и недостаточная терапия.
К факторам риска развития обострений относятся [1]:
— симптомы неконтролируемой БА;
— ИГКС не назначены, плохая приверженность терапии;
— чрезмерное использование короткодействующих β2-агонистов (КДБА);
— низкий ОФВ1, особенно <60 % от должного;
— значительные психологические или социально-экономические проблемы;
— внешние воздействия: курение, воздействие аллергена;
— сопутствующие заболевания: риносинусит, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), подтвержденная пищевая аллергия, ожирение;
— эозинофилия мокроты или крови;
— беременность;
— наличие одного и более тяжелых обострений за последние 12 месяцев.
Клиническая оценка пациента при обострении БА
• При осмотре пациента с обострением БА рекомендуется исследовать историю заболевания, определять степень его тяжести и потенциальные провоцирующие факторы, оценивать наличие осложнений и ответ на терапию [1,38].
Уровень GPP
Комментарии: Клиническая оценка больного с обострением БА, нарастающей одышкой и ухудшением газообмена должна быть проведена очень быстро, при этом сохраняя достаточную тщательность.
• При лечении обострения у всех пациентов с БА рекомендуется регулярно оценивать критерии тяжести обострения, в частности частоту дыхания, частоту сердечных сокращений, ПСВ и показатели пульсоксиметрии (Табл.5) [1,39,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Клиническими признаками тяжелого обострения являются дыхательный дистресс (включая нехватку воздуха для завершения предложения на одном дыхании), тахипноэ, отсутствие дыхательных шумов («немое легкое»), цианоз или снижение уровня сознания. При этом ни один из данных признаков по отдельности или вместе не является специфическим, и их отсутствие не исключает наличия обострения БА.
• Пациентам со снижением сатурации крови кислородом (SpO₂)≤92% и/или другими признаками угрожающей жизни БА, рекомендуется проводить исследование газов артериальной крови [41].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: К признакам угрожающей жизни БА помимо снижения уровня SpO₂ относятся изменение сферы сознания (спутанность сознания, сонливость, оглушение, кома), утомление, цианоз, слабое дыхательное усилие, брадикардия, гипотензия, отсутствие дыхательных шумов («немое легкое»), снижение ПСВ<33%.
• Рентгенографию органов грудной клетки в прямой проекции рекомендуется проводить пациентам с обострением БА для исключения медиастинальной эмфиземы или пневмоторакса, при подозрении на пневмонию, клинических признаках угрожающего жизни обострения, необходимости механической вентиляции легких [42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Дифференциальный диагноз
Дифференциальная диагностика БА
Спектр заболеваний и состояний, с которыми следует проводить дфференциальную диагностику, зависит от наличия или отсутствия бронхиальной обструкции, определяемой как ОФВ1/ФЖЕЛ <0,7 (ФЖЕЛ – форсированная жизненная емкость легких) до применения бронхолитика (Прил. Г5).
У пациентов с БА могут иметь место другие заболевания, являющиеся причинами бронхиальной обструкции, что усложняет интерпретацию проведенных исследований. Особенно часто могут сочетаться БА и хроническая обструктивная болезнь легких (ХОБЛ).
• Пациентам с бронхиальной обструкцией и возможной БА рекомендуется проведение бронходилатационного теста и/или пробной терапии в течение определенного периода (Прил. Г6) [17,26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
Комментарии: У пациентов с высокой вероятностью БА рекомендуется сразу приступать к пробному лечению. При положительном бронходилатационном тесте и достижении положительного эффекта при проведении терапевтической пробы в дальнейшем следует лечить пациента как больного БА.
При отсутствии обратимости бронхиальной обструкции и отсутствии положительного ответа при проведении пробного курса терапии следует продолжить дальнейшее обследование для уточнения диагноза (Прил. Б).
• У пациентов с нормальными показателями спирометрии для подтверждения диагноза БА рекомендуется повторить обследование в период наличия симптомов, или, если позволяет состояние пациента, после отмены бронхолитиков [27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
• Пациентам с клиническими симптомами БА и нормальными показателями спирометрии рекомендуется дополнительное обследование для выявления БГР и/или воспаления дыхательных путей [18,19,24].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4)
Комментарии: Эти тесты достаточно чувствительны, поэтому полученные при их проведении результаты в пределах нормы (Табл. 7) могут служить подтверждением отсутствия БА.
Лечение
Лечение стабильной БА
Современные цели терапии БА [1]:
1. Достижение и поддержание контроля симптомов БА в течение длительного времени.
2. Минимизация рисков будущих обострений БА, фиксированной обструкции дыхательных путей и нежелательных побочных эффектов терапии.
• У каждого пациента с БА рекомендуется оценивать контроль симптомов, риск развития обострений, необратимой бронхиальной обструкции и побочных эффектов лекарств (Прил. Г8) [1,38,43].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Наличие у пациента одного или более из указанных в Прил. Г8 факторов повышает риск обострений, даже если симптомы хорошо контролируются.
Ступенчатая терапия БА у детей, подростков и взрослых
При лечении БА рекомендуется использовать ступенчатый подход, корректируя объем терапии в зависимости от уровня контроля и наличия факторов риска обострений БА [1, 43]. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Каждая ступень включает варианты терапии, которые могут служить альтернативами при выборе поддерживающей терапии БА, хотя и не являются одинаковыми по эффективности (рис. 1). Первоначальный выбор ступени терапии зависит от выраженности клинических проявлений БА.
Увеличение объема терапии (переход на ступень вверх) показано при отсутствии контроля и/или наличии факторов риска обострений. Снижение объема терапии показано при достижении и сохранении стабильного контроля ≥ 3 месяцев и отсутствии факторов риска с целью установления минимального объема терапии и наименьших доз препаратов, достаточных для поддержания контроля.
• При принятии решения, какой препарат снижать первым и с какой скоростью, должны быть приняты во внимание тяжесть БА, побочные эффекты лечения, продолжительность приема текущей дозы, достигнутый положительный эффект и предпочтения пациента [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Снижение дозы ИГКС должно быть медленным в связи с возможностью развития обострения. При достаточном контроле возможно снижение дозы каждые три месяца, примерно на 25-50%.
Рис. 1 Ступенчатая терапия БА
*Фиксированная комбинация будесонид-формотерол Турбухалер® 160/4,5 мкг/доза зарегистрирована в РФ в режиме «по потребности» для купирования приступов и симптомов у взрослых и подростков 12 лет и старше; фиксированная комбинация сальбутамола и беклометазона зарегистрирована в РФ для купирования симптомов и поддерживающей терапии БА у пациентов с 18 летнего возраста
**Тиотропий в ингаляторе, содержащем раствор , зарегистрирован в РФ для лечения пациентов с 6 лет с сохраняющимися симптомами на фоне приема ИГКС или ИГКС/ДДБА
‡Если пациент получает терапию фиксированными комбинациями будесонид-формотерол или беклометазон-формотерол в низких дозах, возможно применение тех же препаратов для купирования симптомов, т.е. в режиме единого ингалятора для пациентов с 18 летнего возраста (для препарата будесонид/формотерол в ингаляторе Турбухалер® – с 12 лет);
***Для детей 6-11 лет теофиллин не рекомендован. Предпочтительная терапия на ступени 3 – средние дозы ИГКС
# — Генно-инженерные биологические препараты (ГИБП)Ступень 1
• У взрослых пациентов (≥18 лет) с легкой БА в качестве предпочтительной терапии БА рекомендуются низкие дозы фиксированной комбинации ингаляционного глюкокортикостероида и быстродействующего бета 2-агониста (ИГКС-БДБА) «по потребности»:
— будесонид-формотерол 160/4,5 мкг Турбухалер® для купирования приступов и симптомов в режиме «по потребности» (у взрослых и подростков 12 лет и старше) [ [44, 45].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• У взрослых пациентов (≥18 лет) с легкой БА рекомендуется фиксированная комбинация сальбутамол/беклометазона дипропионат (БДП), для купирования симптомов и поддерживающей терапии БА [46, 47].
Уровень убедительности рекомендаций А (уровень достоверности доказательств -2)
• Пациентам с БА с наличием факторов риска обострений (Прил. Г8) рекомендуется назначать регулярную терапию низкими дозами ИГКС (Прил. Г9) в дополнение к КДБА по потребности [48, 49].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: В настоящее время всем взрослым и подросткам с БА рекомендуется применять противовоспалительную терапию (низкие дозы ИГКС) симптоматически или регулярно для снижения риска тяжелых обострений БА. Монотерапия КДБА более не рекомендуется [1]. Чрезмерное использование КДБА является небезопасным: выдача ≥3 ингаляторов КДБА в год увеличивает риск обострений БА [170], применение ≥12 ингаляторов КДБА в год связано с повышенным риском смерти по причине БА [171].
Комментарии: У детей до 5 лет регулярная терапия может начинаться с низких доз ИГКС, с 2 лет – монотерапия антилейкотриеновыми препаратами (АЛР), кромонами. Предпочтение в доставке ИГКС отдается небулайзерной терапии у детей (с 6 мес – будесонид суспензия, с 6 лет – также БДП), с 1 года – флутиказона пропионат со спейсером.
Ступень 2
• На ступени 2 рекомендуется регулярное применение низких доз ИГКС в качестве базисной терапии и КДБАдля купирования симптомов [48-50].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Начальная доза ИГКС выбирается согласно тяжести заболевания. У взрослых стартовая доза, как правило, эквипотентна дозе БДП 400 мкг в день, у детей — БДП 200 мкг в день (Прил Г10). У детей в возрасте до пяти лет могут быть необходимы более высокие дозы, если есть проблемы с доставкой лекарственных средств.
Первоначально ИГКС назначаются два раза в день, за исключением циклесонида, мометазона фуроата, будесонида, назначаемых однократно в день. После достижения хорошего контроля ИГКС можно применять один раз в день в той же суточной дозе.
Лечение низкими дозами ИГКС редуцирует симптомы БА, повышает функцию легких, улучшает качество жизни, уменьшает риск обострений, госпитализаций и смертельных исходов из-за БА. ИГКС более эффективны чем АЛР.
• В качестве предпочтительной базисной терапии на ступени 2 также рекомендуются низкие дозы фиксированной комбинации ингаляционного глюкокортикостероида и быстродействующего бета 2-агониста (ИГКС-БДБА) «по потребности»:
• будесонид-формотерол 160/4,5 мкг Турбухалер® для купирования приступов и симптомов в режиме «по потребности» (у взрослых и подростков 12 лет и старше) [44,45]
• АЛТР рекомендуются для терапии БА в сочетании с аллергическим ринитом, при вирусиндуцированной БА, астме физического усилия [51-55].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• У взрослых пациентов с легкой БА, у которых сохраняется контроль на фоне постоянной терапии ИГКС, рекомендуется рассмотреть перевод на использование фиксированной комбинации ИГКС-БДБА только по потребности [44,45,47].
Уровень убедительности рекомендаций А (уровень достоверности доказательств –3)
Комментарии: Указанный режим терапии позволит избежать типичного для больных легкой астмой отказа от ИГКС, сохранив минимальный объем противовоспалительной терапии в период появления симптомов.
• Детям с БА, получающим ≥ 400 мкг в день БДП или его эквивалента (Прил Г10), рекомендуется постоянное наблюдение педиатра и специалиста аллерголога/пульмонолога [1].
Уровень GРP
Комментарии: В плане самоведения у таких пациентв должны быть конкретные письменные рекомендации в случае присоединения интеркуррентного заболевания.
Ступень 3
• Взрослым пациентам с БА на 3-й ступени терапии рекомендуется комбинация низких доз ИГКС (Прил 9) и длительнодействующих β2-агонистов (ДДБА) как поддерживающая терапия и КДБА по потребности (Рис 1) [55].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Ингаляторы, содержащие фиксированные комбинации, гарантируют применение ДДБА только вместе с ИГКС и могут улучшать комплайнс.
При уменьшении объема терапии, включающей комбинацию ИГКС/ДДБА, вероятность сохранения контроля выше при уменьшении дозы ИГКС в составе комбинации и отмене ДДБА после перехода на низкие дозы ИГКС.
Добавление ДДБА к той же самой дозе ИГКС обеспечивает дополнительное улучшение симптомов и легочной функции с редукцией риска обострений, по сравнению с увеличением дозы ИГКС.
• Пациентам с БА старше 18 лет из группы риска по развитию обострений рекомендуется комбинация низких доз ИГКС/формотерол (будесонид или беклометазон) в качестве поддерживающей терапии и для купирования симптомов – т.н. режим единого ингалятора [56-59].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Режим единого ингалятора зарегистрирован для препаратов будесонид/формотерол** (фиксированные комбинации) в виде дозированного порошкового ингалятора (ДПИ) и беклометазон/формотерол** в виде дозированного аэрозольного ингалятора (ДАИ).
Для препарата будесонид/формотерол** в ингаляторе Турбухалер режим единого ингалятора зарегистрирован с 12 лет.
У пациентов групп риска ИГКС/формотерол в качестве единого ингалятора значительно редуцирует обострения и обеспечивает такой же уровень контроля БА на относительно низких дозах ИГКС, по сравнению с фиксированными дозами ИГКС/ДДБА в качестве поддерживающей терапии + КДБА по потребности или по сравнению с высокими дозами ИГКС + КДБА по потребности.
• У детей старше 5 лет на ступени 3 лечения БА в качестве базисной терапии рекомендуются низкие/средние дозы ИГКС (Прил Г10) или в комбинации с ДДБА или в комбинации с АЛТР [55,60,61].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
• У детей младше 5 лет в качестве дополнения к терапии ИГКС рекомендуются АЛТР [1,53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
• При наличии у пациента с БА, получающего терапию ИГКС, ограничений по применению ДДБА (нежелательных эффектов, противопоказаний или индивидуальной непереносимости) в качестве альтернативы ДДБА рекомендуется использовать тиотропия бромид в жидкостном ингаляторе [62].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Тиотропия бромид в ингаляторе, содержащем раствор, зарегистрирован в РФ для лечения больных БА с 6 лет. Препарат назначают при сохранении симптомов на фоне приема ИГКС или ИГКС/ДДБА.
• Назначение тиотропия бромида в жидкостном ингаляторе рекомендуется в дополнение к терапии ИГКС/ДДБА у пациентов с частыми и/или тяжелыми обострениями БА [63-66].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии: Показанием к назначению тиотропия бромида служит наличие 2-х и более обострений в год или наличие хотя бы 1 обострения, потребовавшего назначения СГКС или госпитализации.
Ступень 4
• На 4-й ступени лечения взрослым пациентам с БА рекомендуется назначение комбинации низких доз ИГКС (будесонид или беклометазон)/формотерол в режиме единого ингалятора или комбинации средних доз ИГКС/ДДБА и КДБА по потребности (Прил Г9) [59,67].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• Взрослым и подросткам с БА, имеющим ≥ 1 обострения за предшествующий год, для снижения частоты обострений рекомендуется назначение комбинации низких доз ИГКС (будесонид или беклометазон)/формотерол в качестве поддерживающей терапии и для купирования симптомов [59].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• Пациентам ≥ 6 лет, получающим терапию ступеней 3–4 (Рис. 1), у которых не был достигнут контроль БА или имели место частые и/или тяжелые обострения заболевания рекомендуется назначение тиотропия бромида в жидкостном ингаляторе [63,65].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• У пациентов с БА старше 12 лет при недостаточном контроле БА на фоне использования 800 мкг БДП или его эквивалнента в день в комбинации с ДДБА рекомендуется повышение дозы ИГКС до максимальной в сочетании с ДДБА или добавление АЛТР или добавление теофиллина замедленного высвобождения [68-71].
Комментарии: Высокие дозы ИГКС могут применяться с помощью ДАИ со спейсером или через небулайзер.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• У детей 5-12 лет с неконтролируемым течением БА на фоне терапии 400 мкг БДП или его эквивалнента в день в комбинации с ДДБА рекомендуется увеличение дозы ИГКС до максимальной в сочетании с ДДБА или добавление АЛТР [71-73].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: У детей всех возрастов, которые получают специализированную медицинскую помощь, можно назначить более высокие дозы ИГКС (> 800 мкг/сутки) прежде чем перейти к ступени 5.
Ступень 5
• Всех пациентов, особенно детей, с персистирующими симптомами или обострениями БА, несмотря на правильную технику ингаляции и хорошую приверженность лечению, соответствующему 4-й ступени лечения БА, рекомендуется направлять к специалисту, занимающемуся экспертизой и лечением тяжелой БА [74].
Уровень GPP
• В качестве дополнительной терапии к максимальной дозе ИГКС ≥ 1000 мкг в эквиваленте БДП рекомендуются тиотропия бромид**[65-67]. В случае Т2-астмы: омализумаб**, меполизумаб, реслизумаб, бенрализумаб, дупилумаб [75-78,161-169]. Менее желательным вариантом терапии является минимально возможная доза пероральных ГКС.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• Взрослым пациентам, получающим терапию 4-й ступени лечения БА (Рис 1), у которых не был достигнут контроль БА или сохраняются частые (≥2 в год) и/или тяжелые обострения БА (хотя бы 1 обострение в течение года, потребовавшее назначения системных глюкокортикостероидов (СГКС) или госпитализации) рекомендуется назначение тиотропия бромида в жидкостном ингаляторе [63,65].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• Терапия омализумабом** рекомендуется взрослым, подросткам и детям старше 6 лет с тяжелой аллергической БА, которая не контролируется лечением, соответствующим ступени 4 [75,76].
Комментарии: Для назначения терапии омализумабом у пациентов должно быть наличие клинически значимой атопии с подтвержденной связью между экспозицией аллергенов и развитием симптомов/обострений БА; уровень общего IgЕ крови до начала биологической терапии 30-1500 МЕ/мл; умеренная эозинофилия крови.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• Терапия меполизумабом (анти-ИЛ-5, 100 мг подкожно 1 раз в 4 недели) рекомендуется взрослым пациентами с тяжелой эозинофильной БА (число эозинофилов в периферической крови ≥150 клеток/мкл на момент начала терапии или ≥300 клеток/мкл наблюдавшееся в течение предыдущих 12 месяцев) и обострениями в анамнезе [161-163].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• Терапия реслизумабом (анти-ИЛ-5) рекомендуется взрослым пациентам (≥18 лет) с тяжелой БА и эозинофильным типом воспаления (персистирующая эозинофилия крови ≥400 клеток/мкл) [78].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
• Терапия бенрализумабом (моноклональное антитело против рецептора ИЛ-5, анти-ИЛ-5Ральфа) рекомендуется взрослым пациентам ≥18 лет с тяжелой бронхиальной астмой с эозинофильным фенотипом (уровень эозинофилов крови ≥300 клеток/мкл). Препарат вводится в дозе 30 мг подкожно 1 раз в 4 недели первые 3 инъекции, далее один раз в 8 недель [164,165].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
• Терапия дупилумабом (человеческое рекомбинантное моноклональное антитело к ИЛ-4Рα, ингибирующее передачу сигналов как от ИЛ-4, так и от ИЛ-13; 200 или 300 мг подкожно 1 раз в 2 недели) рекомендуется пациентам в возрасте 12 лет и старше с эозинофильным фенотипом бронхиальной астмы (число эозинофилов в периферической крови ≥150 клеток/мкл) или у пациентов с гормональнозависимой бронхиальной астмой, получающих пероральные глюкокортикостероиды (независимо от числа эозинофилов в периферической крови) [166-169].
Комментарии: дупилумаб значительно снижает частоту обострений, улучшает легочную функцию, контроль бронхиальной астмы и качество жизни, даже у пациентов с гормонозависимой бронхиальной астмой при одновременном снижение дозы пероральных глюкокортикостероидов. Дупилумаб также может рассматриваться как терапевтическая опция для пациентов с сочетанием тяжелой бронхиальной астмы и среднетяжелого, и тяжелого атопического дерматита [169]. Доза препарата не зависит от веса пациента и каких-либо биомаркеров бронхиальной астмы.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Для пациентов с тяжелой эозинофильной астмой, как правило, характерно позднее начало БА, наличие патологии верхних дыхательных путей (хронические риносинуситы часто в сочетании с назальными полипами), наличие фиксированной бронхиальной обструкции, воздушных ловушек и слизистых пробок, обтурирующих мелкие бронхи.
• Взрослым пациентам с БА на пероральных ГКС, которые ранее не получали ингаляционной терапии, рекомендуется постепенная отмена или уменьшения дозы СГКС при применении ИГКС в дозах до 2000 мкг/сутки, если потребуется [79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
• У детей в возрасте от 5 до 12 лет при превышении дозы ИГКС >800 мкг/сутки рекомендуется пробное лечение ДДБА, тиотропия бромидом** в жидкостном ингаляторе (с 6 лет), АЛТР и теофиллинами в течение шести недель [55,70,72,79,80].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Данные препараты должны быть отменены, если не удастся достичь уменьшения дозы стероидов, улучшения симптомов или функции легких.
Ингаляционные устройства
• Рекомендуется назначать ингаляторы только после того, как пациенты прошли обучение по использованию устройства и показали удовлетворительную технику ингаляции [81-83].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
• Выбор ингаляционного устройства для терапии стабильной БА рекомендуется основывать на предпочтении пациента и оценке правильности использования ингалятора [83,84].
Уровень убедительности рекомендаций D (уровень достоверности доказательств – 3)
Комментарии: У взрослых и подростков со стабильным течением заболевания ДАИ + спейсер столь же эффективен, как любой другой ручной ингалятор, хотя пациенты могут предпочесть некоторые виды ДПИ. Многие пациенты не готовы использовать спейсер, предпочитая небулайзер.
• При назначении пациентам с БА тиотропия бромида** в качестве средства доставки рекомендуется использовать жидкостной ингалятор [63].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Несмотря на то, что тиотропия бромид** доступен в виде разных ингаляционных устройств, данные по использованию препарата при БА получены только для жидкостного ингалятора и не могут быть экстраполированы на тиотропия бромид** в виде ДПИ. Для лечения БА из длительнодействующих антихолинергических препаратов зарегистрирован только тиотропия бромид**.
• У детей от 0 до 5 лет в качестве предпочтительного способа доставки бронхолитиков или ИГКС рекомендуется ДАИ + спейсер [85].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Лицевая маска необходима, если ребенок не может дышать из спейсера с использованием мундштука. При неэффективности используется небулайзер. ДПИ обычно проще использовать, однако они требуют определенного усилия вдоха (достижения оптимальной скорости вдоха).
Другие виды терапии
Аллерген-специфическая иммунотерапия
Аллерген-специфическая иммунотерапия (АСИТ) используется у детей старше 5 лет, подростков и взрослых, если аллергия играет ведущую роль в патогенезе БА.
В результате АСИТ ожидается умеренный клинический эффект в отношении симптомов БА, стероид-спаринговый эффект, улучшение качества жизни, уменьшение специфической БГР.
В настоящее время существует два метода АСИТ: подкожная АСИТ (ПКИТ) и сублингвальная АСИТ (СЛИТ).
• АСИТ рекомендуются к применению у пациентов с БА легкой и средней степени тяжести, ассоциированной с аллергическим риноконъюнктивитом, при условии, что БА контролируется фармакотерапией [87].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
• СЛИТ аллергеном клеща домашей пыли рекомендуется в качестве дополнительного варианта терапии на ступени лечения БА 3 и 4 (Рис. 1) у взрослых пациентов с БА и аллергическим ринитом, сенсибилизированных к клещу домашней пыли в случае, если они имеют обострения, несмотря на лечение ИГКС и ОФВ1>70% должного [88-90].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Методы нетрадиционной и альтернативной медицины
• В связи с отсутствием доказательств положительного клинического влияния на течение БА и улучшение функции легких у пациентов с БА не рекомендуется применение таких методов как иглоукалывание, китайская медицина, гомеопатия, гипноз, техники релаксации, применение ионизаторов воздуха [91,92].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
• Дыхание по методу Бутейко (дыхательная техника, направленная на контроль гипервентиляции) рекомендуется как вспомогательное средство снижения уровня восприятия симптомов преимущественно у пациентов с сочетанием БА и гипервентиляционным синдромом и пациентов, необоснованно часто использующих КДБА [93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: В одном исследовании [93] показана возможность некоторого уменьшения симптомов и потребности в КДБА при выполнении дыхательной гимнастики по Бутейко, но без влияния на функцию лёгких и воспаление. Обучение дыхательной гимнастике следует проводить под контролем специалиста.
Лечение обострений БА
Лечение обострений БА у взрослых
Целями лечения обострений БА является как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
Ведение пациентов с обострением БА на догоспитальном этапе
Алгоритм лечения обострения БА на амбулаторном этапе у взрослых, подростков и детей в возрасте от 6 до 11 лет приведен в приложении Б.
• Нетяжелые обострения, для которых характерно снижение ПСВ на 25-50%, ночные пробуждения из-за БА и повышенная потребность в КДБА, рекомендуется лечить в амбулаторных условиях [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: Если пациент отвечает на увеличение дозы бронхолитика уже после первых нескольких ингаляций, необходимость обращения в отделение интенсивной терапии отсутствует, однако дальнейшее лечение следует проводить под наблюдением врача первичного звена.
• При легком и среднетяжелом обострении БА всем пациентам рекомендуется многократное применение ингаляционных КДБА или комбинаций КДБА и ипратропия бромида [94,95].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: После первого часа необходимая доза КДБА будет зависеть от степени тяжести обострения. Легкие обострения купируются 2–4 дозами КДБА с помощью ДАИ каждые 3–4 ч; обострения средней тяжести требуют назначения 6–10 доз КДБА каждые 1–2 ч. Дозы препаратов подбирают в зависимости от ответа конкретного пациента.
Использование комбинации β2-агониста и ипратропия бромида сопровождается снижением частоты госпитализаций и более выраженным улучшением ПСВ и ОФВ1.
• У детей и взрослых с легким и умеренным обострением БА рекомендуется в качестве устройства доставки для короткодействующих бронхолитиков ДАИ + спейсер или небулайзер с подбором дозы в соответствии с эффектом терапии [96].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
• В случае отсутствия ответа или наличия сомнений в ответе на лечение рекомендуется направить пациента в учреждение, где может быть проведена интенсивная терапия [1,97].
Уровень GPP
• СГКС рекомендуется использовать для лечения всех обострений БА, кроме самых легких [98,99].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Назначение СГКС особенно показано, если начальная терапия ингаляционными β2-агонистами не обеспечила длительного улучшения; обострение развилось у пациента, уже получающего пероральные ГКС; предшествующие обострения требовали назначения пероральных ГКС.
Пероральные ГКС обычно не уступают по эффективности внутривенным ГКС и являются предпочтительными средствами.
• Рекомендуется назначение преднизолона (или его эквивалента) в дозе 40-50 мг/сут 1 раз в сутки сроком на 5-7 дней [98,99].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии: Постепенное снижение дозы СГКС в течение нескольких дней не рекомендуется за исключением случаев, когда пациент получал СГКС на постоянной основе до обострения.
Ведение пациентов с обострением БА на госпитальном этапе
Тяжелые обострения БА относятся к опасным для жизни экстренным ситуациям.
• Лечение тяжелых обострений БА рекомендуется проводить в стационарах с с наличием ОРИТ [1,97].
Уровень GPP
Алгоритм ведения пациентов с обострением БА на госпитальном этапе приведен в приложении Б.
• Пациентам с обострением БА и SрО2<90% рекомендуется назначение небольших доз кислорода (1-4 литра в минуту через носовые канюли) [99-101].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3).
Комментарии: Задачей кислородотерапии при обострении БА является поддержание SрО2 в пределах 93-95%.
Невозможность достичь РаО2 выше 60 мм рт.ст. при использовании таких доз кислорода может свидетельствовать о наличии истинного шунта, и, следовательно, предполагает другие причины гипоксемии (чаще всего ателектаз доли или всего легкого вследствие полной закупорки бронхов густой вязкой мокротой, возможно также наличие пневмоторакса, пневмонии, легочной эмболии).
Ингаляционные β2-агонисты являются наиболее эффективными препаратами терапии обострения БА за счет быстроты и выраженности бронхорасширяющего эффекта.
• Всем пациентам с тяжелым обострением БА в качестве препаратов первой линии рекомендуется использовать ингаляционных КДБА или комбинацию КДБА и ипратропия бромида [93,94].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: При использовании небулайзера обычно используют однократные дозы сальбутамола** 2.5 мг на 1 ингаляцию. При тяжелом обострении БА рекомендуется использовать следующую схему терапии: в 1-й час терапии проводится 3 ингаляции сальбутамола** по 2.5 мг каждые 20 минут, затем ингаляции проводят каждый час до значимого улучшения состояния, после чего возможно назначение препарата каждые 4-5 часов.
Однократная доза сальбутамола** при использовании ДАИ со спейсером обычно составляет 400 мкг, кратность введения может значительно варьировать, но, как правило, такая же, как при использовании небулайзера.
Небулайзерная терапия комбинацией β2-агониста и ипратропия бромида может обеспечивать более выраженный бронхорасширяющий эффект, чем применение препаратов по отдельности. Использование комбинации β2-агониста и антихолинергического препарата сопровождается снижением частоты госпитализаций и более выраженным улучшением ПСВ и ОФВ1. При обострении БА рекомендовано использование ипратропия бромида** при помощи небулайзера в дозе 500 мкг каждые 4-6 часов, возможно и более частое использование (каждые 2-4 часа).
• Пациентам с тяжелым обострением БА рекомендуется назначение преднизолона (или его эквивалента) в дозе 40-50 мг/сут 1 раз в сутки сроком на 5-7 дней [97,98].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: Постепенное снижение дозы СГКС в течение нескольких дней не рекомендуется за исключением случаев, когда больной получал СГКС на постоянной основе до обострения.
• У пациентов с тяжелым обострением БА, неспособных принимать препараты per os вследствие выраженной одышки или проведения респираторной поддержки, рекомендуется парентеральное введение ГКС [1,96].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3).
• Отмену назначенных СГКС рекомендуется проводить только на фоне назначения ИГКС [102].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3).
Комментарии: Если пациент получал ИГКС до обострения, прием ИГКС должен быть продолжен в повышенной дозе.
• Назначение теофиллина при лечении тяжелых обострений БА у взрослых пациентов не рекомендуется [103].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: С учетом эффективности и сравнительной безопасности КДБА теофиллин играет минимальную роль в лечении обострений БА. Его применение может сопровождаться тяжелыми и потенциально фатальными побочными эффектами, кроме того, теофиллин уступает β2-агонистам по выраженности бронхорасширяющего действия.
• Подкожное или внутримышечное введение адреналина рекомендуется при неотложном лечении анафилаксии или ангионевротического отека [104,105].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: Адреналин не является стандартным средством для лечения обострения БА.
• Пациентам с тяжелым обострением БА, рефрактерным к назначению КДБА, рекомендуется назначение магния сульфата [106-108].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: На фоне терапии магния сульфатом (2 г внутривенно в течение 20 мин однократно) показано уменьшение продолжительности госпитализации у некоторых пациентов с БА, включая взрослых с ОФВ1 <25-30% от должного на момент поступления, взрослых и детей, у которых нет ответа на начальное лечение и имеется стойкая гипоксемия, а также детей, у которых ОФВ1 не достигает 60% от должного через 1 час после начала лечения. Следует соблюдать осторожность при назначении магния пациентам со снижением функции почек.
• Терапию гелиоксом рекомендуется рассматривать в качестве дополнения к медикаментозной терапии у пациентов с тяжелым обострением БА, не ответивших на стандартное лечение [109].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Проведенные исследования показали, что терапия гелиоксом у больных с тяжелым обострением БА приводит к уменьшению одышки, парадоксального пульса, гиперкапнии, повышению пиковых инспираторного и экспираторного потоков и уменьшению гиперинфляции легких. Терапия гелиоксом может рассматриваться как метод, имеющий точку приложения в начальном периоде лечения, когда в полной мере еще не проявились свойства медикаментозной терапии.
Гелиокс является смесью гелия и кислорода с содержанием гелия от 60 до 80%. Достоинством гелиокса является его более низкая плотность по сравнению с воздухом или кислородом. Дыхание гелиоксом позволяет снизить сопротивление потоку в дыхательных путях, что ведет к снижению работы дыхания и уменьшению риска развития утомления дыхательной мускулатуры.
Данных о пользе применения АЛТР при обострении БА крайне мало. В небольших исследованиях показано улучшение ПСВ, но оценка клинической значимости требует дополнительных исследований [110,111].
• Проведение неинвазивной вентиляции легких (НВЛ) рекомендуется больным с обострением БА при наличии тяжелой одышки, гиперкапнии, клинических признаков повышенной работы дыхательной мускулатуры, но без признаков утомления мышц и без нарушения уровня сознания (оглушение или кома) [112].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Возможность успешного применения НВЛ у больных с обострением БА была продемонстрирована в нескольких проспективных исследованиях [113,114]. В большинстве случаев больные, получавшие НВЛ в этих исследованиях не требовали немедленного проведения интубации трахеи и ИВЛ, и характеризировались меньшей тяжестью ОДН, по сравнению с больными, которым проводилась традиционная ИВЛ.
Проведение ИВЛ требуется больным с обострением БА в тех случаях, когда все другие виды консервативной терапии оказались неэффективными.
• ИВЛ рекомендуется при обострении БА в следующих случаях [115,116]:
— Остановка дыхания;
— Нарушение сознания (сопор, кома);
— Нестабильная гемодинамика (систолическое артериальное давление (АД) <70 мм рт.ст., частота сердечных сокращений (ЧСС) < 50 мин в мин или > 160 мин в мин);
— Общее утомление, «истощение» больного;
— Утомление дыхательных мышц;
— Рефрактерная гипоксемия (парциальное напряжение кислорода в артериальной крови (РаО2) < 60 мм рт.ст. при фракция кислорода во вдыхаемой газовой смеси (FiO2) > 60%).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии: Ценными ориентирами при назначении ИВЛ являются следующие клинические признаки: признаки чрезмерной работы дыхания и утомления дыхательной мускулатуры, тахипноэ, общее истощение, усталость, сонливость больного (маркеры гипоксии головного мозга), так как в данной ситуации существует высокий риск быстрого и неожиданного развития остановки дыхания.
• У больных с обострением БА не рекомендуется применение следующих препаратов и методов: муколитики; тиопентал, кинезиотерапия, введение больших объемов жидкости, антибиотики, бронхоальвеолярный лаваж, плазмаферез [1,117,118].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Введение больших объемов жидкости может быть необходимо у детей первых лет жизни. Антибиотики показаны только в случаях бактериальной инфекции – пневмонии, синусита.
Рекомендации по выписке пациентов из стационара
• Пациентов, у которых достигнут контроль симптомов заболевания (Прил. Г5) и достигнуто повышение ПСВ>80% от лучшего или расчетного результата рекомендуется выписать [118,119].
Уровень GРP
• Пациентов с БА, у которых показатели функции легких (ПСВ и др.) после лечения не достигли нормы, рекомендуется выписать при условии, что им будет обеспечено адекватное медицинское наблюдение в амбулаторных условиях и есть уверенность, что они будут выполнять врачебные рекомендации [118-120].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
• Рекомендуется назначение короткодействующих бронхолитиков по потребности с постепенным переходом на режим терапии β2-агонистами, который был назначен пациентам до начала обострения [118].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Потребность в КДБА определяется выраженностью симптомов и объективными признаками улучшения состояния.
По завершении острой фазы заболевания применение ипратропия бромида** вряд ли даст дополнительный эффект, поэтому можно быстро отменить данный препарат.
• После перенесенного обострения БА рекомендуется назначение или продолжение терапии ИГКС [121,122].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
• Перед выпиской из стационара рекомендуется провести обучение больного и составить индивидуальный план самоведения [123].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 3)
Комментарии: Следует проверить, правильно ли пациент пользуется ингаляторами и пикфлоуметром для мониторирования терапии в домашних условиях.
У пациентов, которых выписывают из отделения неотложной помощи с пикфлоуметром и планом действий, результаты лечения в последующем лучше, чем у пациентов, не имеющих этих инструментов. Необходимо установить, какие факторы вызвали обострение, и принять меры по избеганию воздействия этих факторов в будущем.
• Рекомендуется обеспечить пациента СГКС для короткого курса терапии на случай следующего обострения [118].
Уровень GPP
Комментарии: Необходимо оценить применение противовоспалительной терапии (препаратами, контролирующими течение БА) во время обострения; важно установить, насколько быстро был увеличен объем терапии, до каких доз и почему (если это было необходимо) не был начат прием пероральных ГКС.
• Пациенту рекомендуется обратиться к врачу первичного звена или специалисту по лечению БА в течение 24 ч после выписки [123].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Цель этого визита — обеспечить продолжение терапии до достижения основных показателей контроля заболевания, в том числе наилучших индивидуальных показателей функции легких. У пациентов, пребывавших в отделениях неотложной помощи с обострением БА, предпочтительнее наблюдение у специалиста.
Лечение обострений БА у детей и подростков
Лечение обострения БА у детей старше 2 лет
• В качестве первой линии терапии рекомендуются возрастные дозы сальбутамола** или комбинации КДБА/ипратропия бромида через ДАИ со спейсером или небулайзер [1,95].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Если симптомы не поддаются лечению β2-агонистами, следует добавить ипратропия бромид** (250 мкг/доза смешивается с раствором через небулайзер). Комбинация β2-агонист+ипратропия бромид обеспечивает большее улучшение функции легких и способствует уменьшению риска госпитализации. Повторные дозы ипратропия бромида** используют для лечения детей, которые плохо отвечают на β2-агонисты.
Если ингаляции КДБА требуются чаще чем каждые 4 часа, то следует отменить ДДБА.
• При неэффективности бронходилататоров у детей с 6 мес. возраста рекомендуется назначении суспензиии будесонида** через небулайзер [124-126].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
• Детям с обострением БА, находящимся дома с симптомами, не контролируемыми ингаляциями β2-агониста или его комбинации с ипратропия бромидом через ДАИ со спейсером до 6-8 доз/сутки или от 2,5 до 5 мг β2-агониста или его комбинации с ипратропия бромидом через небулайзер более 3 раз в сутки, рекомендуется госпитализация в стационар по экстренным показаниям [1].
Уровень GPP
Комментарии: Дополнительные дозы бронходилататоров даются по мере необходимости во время ожидания врача при выраженных симптомах.
Во время доставки ребенка с тяжелым приступом БА в отделение неотложной помощи назначается бронхолитик + суспензия будесонида** через небулайзер с кислородом в качестве рабочего газа. Необходимо индивидуализировать дозу препарата в зависимости от тяжести и ответной реакции пациента.
• Детям с угрожающей жизни БА и SрO2 <94% рекомендуется назначение кислорода через плотно прилегающую маску или носовые канюли для достижения нормальной сатурации [1,100].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
• Всем детям старше 2 лет с тяжелым обострением БА показано назначение СГКС [127].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Преднизолон используется в дозе 20 мг для детей в возрасте от 2 до 5 лет и в дозе от 30 до 40 мг для детей старше 5 лет. У детей, уже получающих стероиды перорально, преднизолон назначается из расчета 2 мг/кг до максимальной дозы 60 мг.
Если у ребенка наблюдалась рвота, преднизолон назначается повторно. Возможно внутривенное введение ГКС в случаях, когда пероральный прием препарата затруднен или невозможен. Обычно достаточно лечения пероральным преднизолоном в течение трех дней, но длительность его приема может быть увеличена до 14 дней для полного купирования симптомов.
• Внутривенное введение аминофиллина** рекомендуется детям старше 2 лет только с тяжелой или угрожающей жизни астмой, не отвечающим на максимальные дозы ингаляционных бронхолитиков и стероидов, находящихся на лечении в отделении интенсивной терапии [128].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Аминофиллин** не рекомендуется для лечения детей с легким и среднетяжелым обострением БА.
• Антибиотики детям с обострением БА рекомендуются только по строгим показаниям (пневмония, синусит и др.) [118].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Лечение обострений БА у детей в возрасте младше 2 лет
• Ингаляционный ипратропия бромид в комбинации с ингаляционным β2-агонистом рекомендуются у детей младше 2-х лет с обострением средней и тяжелой степени тяжести и при неудовлектворительном ответе на начальное лечение КДБА [129].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• Для лечения легкого и среднетяжелого обострения БА оптимальным устройством доставки лекарственного средства у детей младше 2-х лет является небулайзер или ДАИ + спейсер [85,130].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• Оральные β2-агонисты не рекомендуются для купирования обострения БА у детей младше 2-х лет [131].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
• Для купирования среднетяжелых и тяжелых приступов БА в условиях стационара у детей до двух лет рекомендуется ингаляционный будесонид** через небулайзер в средних и высоких дозах, СГКС внутрь (преднизолон – 10 мг) продолжитльностью до трех дней [127,132].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Дополнительная информация, влияющая на исход заболевания
Трудная для контроля БА
Перед рассмотрением диагноза тяжелая БА необходимо исключить наиболее часто встречающиеся проблемы [74,81,133]:
— Плохая техника ингаляции (до 80% больных);
— Низкая приверженность лечению (до 50% больных);
— Ошибочный диагноз БА;
— Наличие сопутствующих заболеваний, влияющих на течение БА;
— Продолжающийся контакт с триггером (аллерген при подтвержденной сенсибилизации, профессиональный триггер).
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: У пациентов с БА крайне важно отслеживать соблюдение предписанной терапии, поскольку низкая приверженность лечению может быть одной из причин тяжелого течения заболевания.
Различные сопутствующие заболевания могут определять невозможность достижения контроля БА.
• У пациентов с трудноконтролируемой БА рекомендуется проводить терапию, соответствующую 4–5 ступеням лечения БА [74,134].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Такой объем терапии обусловлен постоянным наличием симптомов и/или частыми обострениями БА
• У пациентов с трудноконтролируемой астмой рекомендуется исследовать эозинофилы в анализе мокроты для коррекции объема стероидной терапии [135].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Работники здравоохранения должны осознавать, что плохо контролируемая астма обычно ассоциируется с большими психологическими проблемами. Психологические проблемы должны рассматриваться как часть трудно-контролируемой БА, у детей это может включать психологические проблемы в семье.
Астма физического усилия
• У пациентов, с астмой физического усилия, занятых физическим трудом/выполняющих физические нагрузки, рекомендуется пересмотреть объем терапии, включая ИГКС [20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: У большинства пациентов астма, индуцированная физической нагрузкой, обусловлена плохим контролем заболевания,
• Пациентам с контролируемым течением БА, принимающих ИГКС, при возникновении симптомов заболевания, индуцированных физической нагрузкой, рекомендуется добавить к терапии один из следующих препаратов — АЛТР, ИГКС-БДБА (в том числе непосредственно перед физической нагрузкой), оральные β2— агонисты, теофиллины [20].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
БА у беременных и у кормящих грудью женщин
Лечение БА во время беременности
Физиологические изменения, происходящие при беременности, могут вызвать как ухудшение, так и улучшение течения БА. Беременность может влиять на течение БА, а сама астма может влиять на беременность.
• Беременным женщинам со среднетяжелой и тяжелой астмой рекомендуется тщательное наблюдение для сохранения хорошего контроля [136].
Уровень GPP
Комментарии: Контроль БА важен во время беременности как для матери, так и для ребенка, уменьшая риск возможных осложнений.
• Беременным женщинам с БА, которые курят, рекомендуется отказ от курения [137].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Важно чтобы женщины, которые курят, знали, что это опасно как для самой женщины, так и для ее ребенка.
• КДБА или их комбинацию с ипратропия бромидом у беременных женщин с БА рекомендуется использовать по обычным показаниям [138,139].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
• ДДБА, ИГКС, теофиллины (оральные и внутривенные) и пероральные ГКС у беременных женщин с БА рекомендуется использовать по обычным показаниям [138,139].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Пероральные ГКС не должны быть исключены из-за беременности.
• Прием АЛТР рекомендуется продолжить у беременных женщин, которые достигли значительного улучшения контроля на этих препаратах до беременности и не могут достичь его на других лекарствах [138].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Лечение обострений БА во время беременности
• Беременным женщинам с обострением БА рекомендуется назначать ту же терапию, как и у небеременных, включая КДБА, СГКС и сульфат магния [140].
Комментарии: Для предотвращения гипоксии плода необходимо как можно быстрее купировать возникающие обострения во время беременности с применением КДБА, кислорода и СГКС на ранних этапах.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
• Тяжелое обострение БА у беременных рекомендуется лечить в стационаре [139].
Комментарии: При тяжелом обострении БА рекомендуется наблюдение за состоянием плода. Для женщин с плохим контролем БА необходим контакт между пульмонологом и акушером для раннего перевода женщины с тяжелым обострением БА в реанимационное отделение.
• При наличии у беременной пациентки с БА гипоксемии рекомендуется немедленное назначение высоких доз кислорода для поддержания сатурации 94-98% [139].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Лечение БА во время родов
Информируйте женщин о следующем:
— приступ БА редко развивается в родах
— необходимо продолжать прием противоастматических препаратов во время родов
• В отсутствие обострения БА кесарево сечение проводится по обычным акушерским показаниям [141].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Если беременной женщине с БА показана анестезия, то региональная блокада более предпочтительна, чем общий наркоз.
• Простагландины F2α рекомендуется использовать с осторожностью из-за риска вызвать бронхоспазм [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
• Женщины, которые получали пероральные ГКС в дозе, превышающей 7,5 мг преднизолона больше 2-х недель перед родами, рекомендуется перевод на гидрокортизон 100 мг парентерально каждые 6-8 часов во время родов [142].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Терапия БА у кормящих грудью женщин
• Пациенткам с БА рекомендуется грудное вскармливание [139].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
• Женщинам, кормящим грудью, рекомендуется использовать базисную противоастматическую терапию как обычно [139].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
БА у подростков
• Врачам, осматривающих подростков (12-18 лет) с любыми кардиореспираторными жалобами, рекомендуется задавать вопросы о симптомах БА с целью ее исключения [143].
Уровень GPP
• Врачу рекомендуется обсудить будущий выбор профессии с подростками, страдающими астмой и указать на профессии, которые увеличивают риск ухудшения симптомов БА [143].
Уровень GPP
• Подросткам с астмой (их родителям и опекунам) рекомендуется избегать воздействия табачного дыма [143].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Подростков с БА следует спросить, курят ли они. Необходимо нформировать о рисках табака дать совет о прекращении курения или рекомендовать не начинать курить.
• Рекомендуется принимать во внимание предпочтения подростков в выборе ингалятора как фактор повышения приверженности к лечению [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Кроме проверки техники ингаляции, необходимо узнать о факторах, которые могут повлиять на использование ингалятора в реальных условиях, таких, как школа. Необходимо рассмотреть возможность более портативного устройства (в качестве альтернативы ДАИ со спейсером) для доставки бронхолитиков вне дома.
Подростки часто используют методы вспомогательной и альтернативной медицины, что может быть маркером низкого комплайнса. Необходимо активно расспрашивать подростков о применении этих методик.
Профессиональная астма
Определение, классификация, основные понятия и ответы на ключевые вопросы, касающиеся рекомендаций по диагностике профессиональной БА, приведенные в данном разделе, сформулированы рабочей группой на основании существующих рекомендаций Британского фонда исследований по медицине труда (British Occupational Health Research Foundation), обзора Американского колледжа пульмонологов (American College of Chest Physicians), руководства Aгентства исследований по здравоохранению и качеству (Agency for Healthcare Research and Quality).
Профессиональная астма – заболевание, характеризующееся наличием обратимой обструкции и/или гиперреактивности воздухоносных путей, которые обусловлены воспалением, вызванным исключительно факторами производственной среды и никак не связанным с раздражителями вне рабочего места. От 5 до 20% случаев вновь возникшей БА у взрослых возможно обусловлены воздействием факторов производственной среды
Классификация профессиональной БА:
1) IgЕ-обусловленная;
2) ирритантная астма, в том числе синдром реактивной дисфункции дыхательных путей, развившийся вследствие контакта с экстремально высокими концентрациями токсических веществ (паров, газов, дыма);
3) астма, обусловленная неизвестными патогенетическими механизмами.
Существует несколько сотен веществ, которые могут вызывать развитие профессиональной БА. При вдыхании в высоких дозах некоторые иммунологически активные сенсибилизаторы ведут себя как ирританты.
Наиболее частыми причинами профессиональной БА являются изоцианаты, мучная и зерновая пыль, канифоль и флюсы, латекс, аллергены животных, альдегиды, металлы, клеи, смолы и древесная пыль. Риск развития сенсибилизации и профессиональной БА увеличивается с повышением концентрации веществ на рабочем месте. Профессиональная астма наиболее часто развивается у животноводов, пекарей, кондитеров, работников химической и пищевой промышленности, парикмахеров, маляров, работающих с краскопультами, медицинских сестер и других медицинских работников, работников деревообрабатывающих производств и сварщиков.
Риск профессиональной БА наиболее высок в первые годы работы с веществами высокой молекулярной массы, преимущественно животного происхождения, а также с агентами с низкой молекулярной массой, как например ангидриды кислот, изоцианаты и другие химические вещества). Наличие в анамнезе атопии является абсолютным фактором риска только для профессиональной БА, обусловленной воздействием аллергенов с высокой молекулярной массой. Наличие аллергического ринита повышает риск развития профессиональной БА в 4,8 раза, преимущественно в первые годы работы.
Диагностика профессиональной БА
• Предварительный (при приеме на работу) и периодические медицинские осмотры рекомендуется проводить всем работникам для предупреждения развития профессиональной БА, своевременного выявления и профилактики потери трудоспособности пациентов [144].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Методы диагностики профессиональной БА аналогичны таковым при непрофессиональной астме. Алгоритм диагностики профессиональной БА приведен в приложении Б.
• С целью диагностики профессиональной БА рекомендуется проводить мониторинг ПСВ не менее 4-х раз в течение рабочей смены на протяжении 3-4-х рабочих недель с последующим сравнением показателей в выходные дни и/или отпускной период [145].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Мониторинг ПСВ обладает высокой степенью чувствительности и специфичности.
• Метахолиновый тест на выявление БГР рекомендуется проводить в периоды экспозиции и элиминации производственных агентов [146].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Результаты теста, как правило, коррелирует с дозой ингалированных веществ и ухудшением течения БА на рабочем месте. Отсутствие БГР не позволяет исключить диагноз профессиональной БА.
• Кожные прик-тесты с производственным антигенами и определение уровня специфического IgE рекомендуется проводить при подозрении на профессиональную астму для выявления сенсибилизации к аллергенам с высокой молекулярной массой [147,148].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
• Специфический бронхопровокационный тест (СБПТ) рекомендуется проводить только в специализированных центрах с использованием экспозиционных камер при отсутствии возможности подтвердить диагноз профессиональной астмы другими методами [149,150].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: СБПТ – «золотой стандарт» определения причинных факторов (индукторов и триггеров) профессиональной БА.
Факторами риска неблагоприятного исхода профессиональной БА являются низкие показатели легочных объемов, высокая степень БГР либо астматический статус при проведении СПБТ.
Тактика ведения больных и профилактика профессиональной БА
• Пациентам с профессиональной астмой рекомендуется перевод на работу вне контакта с причинным фактором [148,149].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Своевременный перевод на другую работу обеспечивает купирование симптомов профессиональной астмы. Медикаментозное лечение профессиональной астмы не способно предотвратить ее прогрессирование в случаях продолжения работы в контакте с причинным фактором. Снижение концентрации агентов в воздухе рабочей зоны, применение средств индивидуальной защиты может привести к улучшению течения БА, однако данные подходы менее эффективны.
Медицинская реабилитация
Реабилитация
• У всех пациентов с БА рекомендуется включать в программу реабилитации обучение пациентов и методы физической реабилитации [151].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Программа обучения пациентов с БА должна включать предоставление информации о заболевании, составление индивидуального плана лечения для пациента, и обучение технике управляемого самоведения.
Физическая реабилитация улучшает сердечно-легочную функцию. В результате проведения тренировки при физической нагрузке увеличивается максимальное потребление кислорода и увеличивается максимальная вентиляция легких. По имеющимся наблюдениям применение тренировки с аэробной нагрузкой, плавание, тренировка инспираторной мускулатуры с пороговой дозированной нагрузкой улучшают течение БА.
Профилактика
Профилактика
• Всем пациентам с БА рекомендуется осуществлять контроль над факторами окружающей среды, выступающими в роли триггеров БА [152,153].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: У значительной части пациентов существует представление о том, что многочисленные экологические, диетические и иные факторы могут быть триггерами БА и исключение этих факторов может улучшить течение заболевания и уменьшить объем медикаментозной терапии.
Обострение БА могут быть вызваны многими факторами, которые иногда называются триггерами; к их числу относятся аллергены, вирусные инфекции, поллютанты и лекарственные препараты.
В настоящее время существуют лишь небольшое количество мероприятий, которые можно рекомендовать для профилактики БА, так как в развитии этого заболевания участвуют сложные и до конца не выясненные механизмы. Доказательств того, что нефармакологическими методами возможно влиять на течение БА недостаточно и требуется проведение широкомасштабных клинических исследований.
• С целью предотвращения развития БА, симптомов БА или обострения БА всем пациентам с БА рекомендуется отказ от курения, выполнение элиминационных мероприятий в отношении причиннозначимых аллергенов, а также снижение массы тела при ожирении [1,154,155].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Уменьшение воздействия на пациентов некоторых категорий факторов/триггеров позволяет улучшить контроль над БА и снизить потребность в лекарствах.
Результаты исследований и рекомендации по профилактике БА приведены в Прил 11-13.
Вакцинация
Респираторные вирусные инфекции, в частности, грипп может приводить к острым тяжелым обострениям БА. Кроме этого, пациенты с БА, особенно дети и пожилые, имеют высокий риск пневмококковых заболеваний.
• Всем пациентам с БА средней и тяжелой степенью тяжести рекомендовано проводить противогриппозную вакцинацию каждый год [156].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Вакцинацию проводят ежегодно в осенний период с применением инактивированных субъединичных и сплит-вакцин. При угрозе возникновения пандемии или ожидания циркуляции новых штаммов вируса гриппа, ранее не входивших в состав вакцины, больным БА целесообразно вводить две дозы вакцины с интервалом 21–28 дней между ними.
Вакцинация против пневмококковой инфекции (ПИ) проводится круглогодично по представленным ниже схемам, возможно совмещение с вакцинацией против гриппа.
• Пациентам с БА, особенно с сопутствующим хроническим бронхитом, эмфиземой легких, частых рецидивах респираторной инфекции, длительным приемом СГКС, рекомендуется проведение вакцинации против ПИ [157,158].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Однако пациенты должны быть предупреждены, что вакцинация не уменьшает частоту и тяжесть обострений БА.
Вакцинацию больных БА против ПИ и гриппа проводят в период ремиссии основного заболевания на фоне базисной терапии БА. В случае обострения БА вакцинацию против ПИ проводят через 2–4 нед. после купирования обострения, на фоне базисной терапии БА.
• Пациентам с БА, не привитым ранее против ПИ, рекомендуется начинать вакцинацию с пневмококковой конъюгированной вакцины (ПКВ-13) [157-159].
Комментарии: Пневмококковую полисахаридную 23-валентную вакцину (ППВ-23) вводят в качестве бустерной дозы для расширения охвата серотипов с интервалом более 2 месяцев после конъюгированной вакцины. Таким образом, не привитым ранее против ПИ пациентам с БА в любом возрасте сначала вводится ПКВ13, через 2 месяца – ППВ23, затем каждые 5 лет ППВ23.
• Пациентам с БА, получившим ранее ППВ23, не ранее чем через 1 год после этого рекомендуется однократное введение ПКВ13 [157-159].
Комментарии: Интервал между вакцинациями ППВ23 должен составлять не менее 5 лет.
Информация
Источники и литература
-
Клинические рекомендации Российского респираторного общества
- 1. Global Initiative for Asthma. GINA 2019. [Электронный ресурс], 05.07.2019. URL: https://ginasthma.org.
2. Chuchalin A.G., Khaltaev N., Аntonov N. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation // International Journal of COPD 2014:9 963–974
3. Национальная программа «Бронхиальная астма у детей. Стратегия лечения и профилактика», IV издание. — М., 2012. — 182 с.
4. Krahn MD Berka C, Langlois P et al direct and indirect costs of asthma in Canada, 1990. Can Med Assoc J 1996; 154:821-831.
5. Weber EJ, Silverman RA, Callaham ML et al A prospective multicenter study factors associated with hospital admission among adults with acute asthma. Am J Med 2002; 113 :371-378
6. Braman SS, Kaermmerhen JT Intensive care of status asthmaticus: a 10-year experience. JAMA 1990; 264: 366-368.
7. Salmeron S, Liard R, Elkharrat D et al. Asthma severity adequacy of management in accident and emergency departments in France: a prospective study. Lancet 2001; 358:629-635.
8. Krishnan V, Diette GB, Rand CS et al Mortality in patients hospitalized for asthma exacerbations in the United States. Am J Respir Crit Care Med 2006 15;174(6):633-8.
9. Ненашева Н.М. Клинические фенотипы атопической бронхиальной астмы: диагностика и лечение. Palmarium Academic Publishing, 2012, 319 p.
10. Moore W, Meyers D., Wenzel S., Teague G., Li H., et al. Identification of Asthma Phenotypes Using Cluster Analysis in the Severe Asthma Research Program. Am J Respir Crit Care Med. 2010 Feb 15; 181(4): 315–323
11. Pearce N., Pekkanen J., Beasley R. How much asthma is really attributable to atopy? Thorax 1999; 54: 268-272
12. O’Byrne PM, Reddel HK, Eriksson G, et al. Measuring asthma control: a comparison of three classification systems. Eur Respir J 2010; 36: 269-76.
13. Thomas M, Kay S, Pike J, et al. The Asthma Control Test (ACT) as a predictor of GINA guideline-defined asthma control: analysis of a multinational cross-sectional survey. Prim Care Respir J 2009; 18: 41-9.
14. Juniper EF, Svensson K, Mork AC, Stahl E. Measurement properties and interpretation of three shortened versions of the asthma control questionnaire. Respir Med 2005; 99: 553-8.
15. Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry. Eur Respir J 2005; 26: 319-38
16. Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26: 948-68.
17. Tan WC, Vollmer WM, Lamprecht B, et al. Worldwide patterns of bronchodilator responsiveness: results from the Burden of Obstructive Lung Disease study. Thorax 2012; 67: 718-26.
18. Crapo RO, Casaburi R, Coates AL, et al. Guidelines for methacholine and exercise challenge testing-1999. Am J Respir Crit Care Med 2000; 161: 309-29.
19. Joos GF, O’Connor B, Anderson SD, et al. Indirect airway challenges. Eur Respir J 2003; 21: 1050-68.
20. Parsons JP, Hallstrand TS, Mastronarde JG, et al. An official American Thoracic Society clinical practice guideline: exerciseinduced bronchoconstriction. Am J Respir Crit Care Med 2013; 187: 1016-27
21. Reddel HK, Taylor DR, Bateman ED, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med 2009;180:59-99.
22. Brouwer AF, Brand PL. Asthma education and monitoring: what has been shown to work. Paediatr Respir Rev 2008;9:193-9.
23. Schleich FN, Manise M, Sele J, Henket M, Seidel L, Louis R. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC Pulm Med. 2013 Feb 26;13:11. doi: 10.1186/1471-2466-13-11.
24. American Thoracic Society, European Respiratory Society. ATS/ERS Recommendations for Standardized Procedures for the Online and Offline Measurement of Exhaled Lower Respiratory Nitric Oxide and Nasal Nitric Oxide, 2005. Am J Respir Crit Care Med 2005;171:912-30.
25. Dweik RA, Boggs PB, Erzurum SC, et al. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med 2011;184:602-15. 2
26. Ait-Khaled N, Enarson DA, Chiang C-Y, Marks G, Bissell K. Management of asthma: a guide to the essentials of good clinical practice. Paris, France: International Union Against Tuberculosis and Lung Disease; 2008. 4
27. Levy ML, Quanjer PH, Booker R, et al. Diagnostic spirometry in primary care: Proposed standards for general practice compliant with American Thoracic Society and European Respiratory Society recommendations: a General Practice Airways Group (GPIAG) document, in association with the Association for Respiratory Technology & Physiology (ARTP) and Education for Health. Prim Care Respir J 2009;18:130-47.
28. Cano Garcinuno A, Mora Gandarillas I, Group SS. Early patterns of wheezing in asthmatic and nonasthmatic children. Eur Respir J 2013;42:1020-8. 404.
29. Just J, Saint-Pierre P, Gouvis-Echraghi R, et al. Wheeze phenotypes in young children have different courses during the preschool period. Ann Allergy Asthma Immunol 2013;111:256-61.e1.
30. Mellis C. Respiratory noises: how useful are they clinically? Pediatr Clin North Am 2009;56:1-17, ix.
31. Brouwer AF, Brand PL. Asthma education and monitoring: what has been shown to work. Paediatr Respir Rev 2008;9:193-9.
32. Bousquet J, Heinzerling L, Bachert C, Papadopoulos NG, Bousquet PJ, Burney PG, et al. Practical guide to skin prick tests in allergy to aeroallergens. Allergy 2012; 67: 18–24.
33. Ahlstedt S, Murray CS. In vitro diagnosis of allergy: how to interpret IgE antibody results in clinical practice. Prim Care Respir J 2006;15:228-36.
34. Doherty G, Bush A. Diagnosing respiratory problems in young children. Practitioner 2007;251:20, 2-5.
35. Gibson PG, Powell H, Coughlan J, et al. Self-management education and regular practitioner review for adults with asthma. Cochrane Database Syst Rev 2003:CD001117.
36. Fishwick D, D’Souza W, Beasley R. The asthma self-management plan system of care: what does it mean, how is it done, does it work, what models are available, what do patients want and who needs it? Patient Educ Couns 1997;32:S21-33.
37. Ramnath VR, Clark S, Camargo CA, Jr. Multicenter study of clinical features of sudden-onset versus slower-onset asthma exacerbations requiring hospitalization. Respir Care 2007;52:1013-20.
38. Reddel HK, Taylor DR, Bateman ED, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med 2009;180:59-99.
39. Geelhoed GC, Landau LI, Le Souef PN. Evaluation of SaO2 as a predictor of outcome in 280 children presenting with acute asthma. Ann Emerg Med 1994;23:1236-41
40. Atta JA, Nunes MP, Fonseca-Guedes CH, et al. Patient and physician evaluation of the severity of acute asthma exacerbations. Braz J Med Biol Res 2004;37:1321-30.
41. Nowak RM, Tomlanovich MC, Sarkar DD, Kvale PA, Anderson JA. Arterial blood gases and pulmonary function testing in acute bronchial asthma. Predicting patient outcomes. JAMA 1983;249:2043-6.
42. White CS, Cole RP, Lubetsky HW, Austin JH. Acute asthma. Admission chest radiography in hospitalized adult patients. Chest 1991;100:14-6.
43. Taylor DR, Bateman ED, Boulet LP, et al. A new perspective on concepts of asthma severity and control. Eur Respir J 2008;32:545-54. Anonymous. Using beta 2-stimulants in asthma. Drug Ther Bull 1997;35:1-4.
44. O’Byrne PM, FitzGerald M, Bateman ED, et al. Inhaled combined budesonide-formoterol as needed in mild asthma [article and supplementary appendix]. N Engl J Med. 2018;378:1865-1876. https://dx.doi.org/doi10.1056/NEJMoa1715274. Accessed May 16, 2018.
45. Bateman ED, Reddel HK, O’Byrne PM, et al. As-needed budesonide-formoterol versus maintenance budesonide in mild asthma [article and supplementary appendix]. N Engl J Med. 2018;378:1877-1887.
46. Papi A., Canonica G.W., Maestrelli P., Paggiaro P., Olivieri D., Pozzi E., Crimi N., Vignola A.M., Morelli P., Nicolini G., Fabbri L.M.; BEST Study Group. Rescue use of beclomethasone and albuterol in a single inhaler for mild asthma. N Engl J Med 2007; 356(20): 2040–2052.
47. С.Н. Авдеев, З.Р. Айсанов, В.В. Архипов, А.С. Белевский, А.А. Визель,И.В. Демко, А.В. Емельянов, Н.И. Ильина, О.М. Курбачева, И.В. Лещенко, Н.М. Ненашева, С.И. Овчаренко, Р.С. Фассахов от лица экспертной группы. Принципы выбора терапии для больных легкой бронхиальной астмой. Согласованные рекомендации РААКИ и РРО. Практическая пульмонология.2017;1:44-54
48. Pauwels RA, Pedersen S, Busse WW, et al. Early intervention with budesonide in mild persistent asthma: a randomised, double-blind trial. Lancet 2003;361:1071-6.
49. O’Byrne PM, Barnes PJ, Rodriguez-Roisin R, et al. Low dose inhaled budesonide and formoterol in mild persistent asthma: the OPTIMA randomized trial. Am J Respir Crit Care Med 2001;164(8 Pt 1):1392-7.
50. Adams NP, Bestall JB, Malouf R, Lasserson TJ, Jones PW. Inhaled beclomethasone versus placebo for chronic asthma. Cochrane Database Syst Rev 2005:CD002738.
51. Philip G, Nayak AS, Berger WE, et al. The effect of montelukast on rhinitis symptoms in patients with asthma and seasonal allergic rhinitis. Curr Med Res Opin 2004;20:1549-58.
52. Wilson AM, Dempsey OJ, Sims EJ, Lipworth BJ. A comparison of topical budesonide and oral montelukast in seasonal allergic rhinitis and asthma. Clin Exp Allergy 2001;31:616-24.
53. Guevara JP, Ducharme FM, Keren R, Nihtianova S, Zorc J. Inhaled corticosteroids versus sodium cromoglycate in children and adults with asthma. Cochrane Database Syst Rev 2006:CD003558.
54. Bisgaard H., Zielen S., Garcia-Garcia M.L. et al. Montelukast reduces asthma exacerbations in 2- to 5-year-old children with intermittent asthma // Am. J. Respir. Crit. Care Med. 2005. Vol. 171. № 4. P. 315–322.
55. Matsuse H., Tsuchida T., Fukahori S. et al. Retrospective cohort study of leukotriene receptor antagonist therapy for preventing upper respiratory infection-induced acute asthma exacerbations // Allergy Rhinol. (Providence). 2013. Vol. 4. № 3. P. e127–131.
56. Ducharme FM, Ni Chroinin M, Greenstone I, Lasserson TJ. Addition of long-acting beta2-agonists to inhaled corticosteroids versus same dose inhaled corticosteroids for chronic asthma in adults and children. Cochrane Database Syst Rev 2010:CD005535.
57. Cates CJ, Karner C. Combination formoterol and budesonide as maintenance and reliever therapy versus current best practice (including inhaled steroid maintenance), for chronic asthma in adults and children. Cochrane Database Syst Rev 2013;4:CD007313.
58. Papi A, Corradi M, Pigeon-Francisco C, et al. Beclometasone–formoterol as maintenance and reliever treatment in patients with asthma: a double-blind, randomised controlled trial. Lancet Respir Med 2013;1:23-31.
59. Patel M, Pilcher J, Pritchard A, et al. Efficacy and safety of maintenance and reliever combination budesonide/formoterol inhaler in patients with asthma at risk of severe exacerbations: a randomised controlled trial. Lancet Respir Med 2013;1:32-42.
60. Bateman ED, Harrison TW, Quirce S, et al. Overall asthma control achieved with budesonide/formoterol maintenance and reliever therapy for patients on different treatment steps. Respir Res 2011;12:38.
61. Ni Chroinin M, Lasserson TJ, Greenstone I, Ducharme FM. Addition of long-acting beta-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database Syst Rev 2009:CD007949.
62. Vaessen-Verberne AA, van den Berg NJ, van Nierop JC, et al. Combination therapy salmeterol/fluticasone versus doubling dose of fluticasone in children with asthma. Am J Respir Crit Care Med 2010;182:1221-7.
63. Peters S.P., Kunselman S.J., Icitovic N. et al. Tiotropium bromide step-up therapy for adults with uncontrolled asthma // N. Engl. J. Med. 2010. Vol. 363. № 18. P. 1715–1726.
64. Rodrigo GJ, Castro-Rodriguez JA. What is the role of tiotropium in asthma?; a systematic review with meta-analysis. Chest 2015;147:388-96.
65. Kerstjens HA, Disse B, Schröder-Babo W, et al. Tiotropium improves lung function in patients with severe uncontrolled asthma: A randomized controlled trial J Allergy Clin Immunol 2011;128:308–314.
66. Kerstjens HA, Engel M, Dahl R. et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med 2012; 367:1198-1207.
67. FitzGerald M, Moroni-Zentgraf P, Engel M. et al. Once-daily tiotropium Respimat® add-on therapy improves symptom control across severtiies of symptomatic asthma, independent of allergic status. Poster 64426 presented at the ATS Conference, 2015, Denver, USA
68. O’Byrne PM, Naya IP, Kallen A, Postma DS, Barnes PJ. Increasing doses of inhaled corticosteroids compared to adding long-acting inhaled beta2-agonists in achieving asthma control. Chest 2008;134:1192-9. 1
69. Virchow JC, Prasse A, Naya I, Summerton L, Harris A. Zafirlukast improves asthma control in patients receiving high-dose inhaled corticosteroids. Am J Respir Crit Care Med 2000;162:578-85.
70. Powell H, Gibson PG. Inhaled corticosteroid doses in asthma: an evidence-based approach. Med J Aust 2003;178:223-5.
71. Rivington RN, Boulet LP, Cote J, et al. Efficacy of Uniphyl, salbutamol, and their combination in asthmatic patients on highdose inhaled steroids. Am J Respir Crit Care Med 1995;151:325-32.
72. Price DB, Hernandez D, Magyar P, et al. Randomised controlled trial of montelukast plus inhaled budesonide versus double dose inhaled budesonide in adult patients with asthma. Thorax 2003;58:211-6.
73. Vaquerizo MJ, Casan P, Castillo J, et al. Effect of montelukast added to inhaled budesonide on control of mild to moderate asthma. Thorax 2003;58:204-10.
74. Tamaoki J, Kondo M, Sakai N, et al. Leukotriene antagonist prevents exacerbation of asthma during reduction of high-dose inhaled corticosteroid. The Tokyo Joshi-Idai Asthma Research Group. Am J Respir Crit Care Med 1997;155:1235-40.
75. Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS Guidelines on Definition, Evaluation and Treatment of Severe Asthma. Eur Respir J 2014;43:343-73.
76. Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and safety of subcutaneous omalizumab vs placebo as addon therapy to corticosteroids for children and adults with asthma: a systematic review. Chest 2011;139:28-35.
77. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014;1:CD003559.
78. Castro M, Zangrilli J, Wechsler ME et al. Reslizumab for inadequately controlledasthma with elevatedblood eosinophil counts: results from multicenter, parallel, double-blind, randomized, placebo-controlled, phase 3 trials. Lancet Respir Med 2015;3:355-66.
79. Oborne J, Mortimer K, Hubbard RB, Tattersfield AE, Harrison TW. Quadrupling the dose of inhaled corticosteroid to prevent asthma exacerbations: a randomized, double-blind, placebo-controlled, parallel-group clinical trial. Am J Respir Crit Care Med 2009;180:598-602.
80. Vogelberg C, Moroni-Zentgraf P., Lronaviciute-Klimantaviciene M, Sigmund R, Hamelmann E. et al. A randomized dose-ranging study of tiotropium Respimat in children with symptomatic asthma despite inhaled corticosteroids. Repir Res. 2015; 16(1):20.
- 1. Global Initiative for Asthma. GINA 2019. [Электронный ресурс], 05.07.2019. URL: https://ginasthma.org.
Информация
Ключевые слова
o бронхиальная астма
o бронхиальная астма у взрослых
o бронхиальная астма у детей и подростков
o диагностика
o лечение
o обострение БА
o пульмонология
Список сокращений
АСТ – тест по контролю над астмой
сАСТ – тест по контролю астмы у детей
ACQ-5 – вопросник по оценке контроля астмы
FiO2 – фракция кислорода во вдыхаемой газовой смеси
IgE – иммуноглобулины класса Е
PaO2 – парциальное напряжение кислорода в артериальной крови
PaСO2 – парциальное напряжение углекислого газа в артериальной крови
SрO2 – насыщение гемоглобина кислородом
АД – артериальное давление
АЛТР – антагонисты лейкотриеновых рецепторов
БА – бронхиальная астма
БГР – бронхиальная гиперреактивность
БДП – беклометазона дипропионат
БДБА – быстро действующие бета2-агонисты (= сальбутамол и формотерол)
ГКС – глюкокортикостероиды
ДАИ – дозированный аэрозольный ингалятор
ДДБА – длительнодействующие β2–агонисты
ДПИ – дозированный порошковый ингалятор
ИВЛ – искусственная вентиляция легких
ИГКС – ингаляционные глюкокортикостероиды
ИЛ-4 – интерлейкин 4
ИЛ-4Рα – альфа-субъединица рецептора ИЛ-4
ИЛ-5 – интерлейкин 5
ИЛ-5Р – рецептор интерлейкина 5
ИЛ-13 – интерлейкин 13
КДБА – короткодействующие β2–агонисты
КТ – компьютерная томография
НВЛ – неинвазивная вентиляция легких
НПВП – нестероидные противовоспалительные препараты
НЯ – нежелательные явления
ОДН – острая дыхательная недостаточность
ОРИТ – отделение реанимации и интенсивной терапии
ОФВ1 – объем форсированного выдоха за 1–ю секунду
ПИ – пневмококковая инфекция
ПКВ – пневмококковая конъюгированная вакцина
ПКИТ – подкожная иммунотерапия
ППВ-23 — пневмококковая полисахаридная 23-валентная вакцина
ПСВ – пиковая скорость выдоха
СБПТ – специфический бронхопровокационный тест
СЛИТ – сублингвальная иммунотерапия
СГКС – системные глюкокортикостероиды
Тh2 – Т лимфоциты хелперы 2 типа
ФЖЕЛ – форсированная жизненная емкость легких
ЧСС – частота сердечных сокращений
ХОБЛ – хроническая обструктивная болезнь легких
Термины и определения
Бронхиальная гиперреактивность – функциональное нарушение, проявляющееся эпизодами бронхиальной обструкции под воздействием стимулов, безопасных для здорового человека.
Фенотип – совокупность характеристик организма, развивающаяся в результате взаимодействия генетических факторов и окружающей среды.
Эндотип — субтип болезни, определяемый отличительным патобиологическим механизмом.
Обострение бронхиальной астмы – эпизоды нарастающей одышки, кашля, свистящих хрипов, или заложенности в грудной клетке, требующие изменений обычного режима терапии.
Астматический статус — эпизод острой дыхательной недостаточности вследствие обострения БА.
Профессиональная астма – заболевание, характеризующееся наличием обратимой обструкции и/или гиперреактивности воздухоносных путей, которые обусловлены воспалением, вызванным исключительно факторами производственной среды и никак не связанным с раздражителями вне рабочего места.
Критерии оценки качества медицинской помощи
Приложение А1. Состав Рабочей группы
Приложение А2. Методология разработки клинических рекомендаций
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 5 лет.
Методы, использованные для оценки качества и силы доказательств:
• Консенсус экспертов;
• Оценка значимости в соответствии с рейтинговой схемой.
1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Методы, использованные для анализа доказательств:
• Обзоры опубликованных мета-анализов;
• Систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств:
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что, в свою очередь, влияет на силу вытекающих из нее рекомендаций.
На процессе оценки, несомненно, может сказываться и субъективный фактор. Для минимизации потенциальных ошибок каждое исследование оценивалось независимо, т.е. по меньшей мере двумя независимыми членами рабочей группы. Какие-либо различия в оценках обсуждались уже всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств заполнялись членами рабочей группы.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Индикаторы доброкачественной практики (Good Practice Points – GPPs):
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
• Внешняя экспертная оценка;
• Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена и участковых терапевтов в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Предварительная версия была выставлена для широкого обсуждения на сайте РРО для того, чтобы лица, не участвующие в конгрессе, имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Проект рекомендаций был рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Сила рекомендаций (A–D) и уровни доказательств (1++, 1+, 1-, 2++, 2+, 2-, 3, 4) приводятся при изложении текста рекомендаций.
Приложение Б. Алгоритмы ведения пациента
Рис. Б1. Алгоритм обследования пациента с подозрением на БА.
Рис. Б2. Алгоритм лечения обострения БА на амбулаторном этапе у взрослых, подростков и детей от 6 до 11 лет.
Рис. Б3. Алгоритм ведения пациентов с обострением БА на госпитальном этапе.
Рис. Б4. Алгоритм диагностики профессиональной БА.
Приложение В. Информация для пациента
Бронхиальная астма (БА) – заболевание, при котором в бронхах происходит воспаление, чаще всего аллергической природы. Это воспаление не вызвано микробами, а возникает в результате контакта человека с аллергенами, раздражающими веществами, профессиональными факторами, а также в результате некоторых иных обстоятельств.
В результате такого воспаления выделаются различные вещества, которые приводит к спазму бронхов, их отеку, накоплению слизи, в результате чего у человека, болеющего астмой, возникает ощущение затруднения дыхания, чувства тяжести в груди, появляются свисты и хрипы в грудной клетке, кашель, иногда даже удушье. Эти симптомы могут усиливаться ночью и/или ранним утром.
Аллергены, которые могут вызывать БА, разнообразны – шерсть, перхоть и слюна животных, пыльца растений, домашняя пыль, грибки, профессиональные аллергены, пищевые продукты и пищевые добавки… Нередко при этом бронхиальной астме сопутствует аллергический насморк (ринит), который возникает также как следствие аллергического воспаление в слизистой оболочке носа.
БА развивается чаще в детстве или у подростков, однако может начаться также в любом возрасте.
Врач диагностирует бронхиальную астму по рассказам пациента о своих ощущениях, на основании осмотра, а также ряда исследований. Важнейшим из них является проведении исследования функции легких (спирометрии), которая выявляет сужение бронхов и часто – их расширение после применения бронх расширяющих препаратов. Также врач может направить пациента к аллергологу, который проведет аллергологическое тестирование – то есть выявит аллерген, на который человек реагирует, и возможно, предложит особый метод лечения (об этом — ниже). Кроме того, анализ крови может показать повышение клеток под названием эозинофилы, что подтвердить аллергический характер процесса. Иногда в крови определяют особый белок — иммуноглобулин Е, который повышается при аллергических заболеваниях. Возможно определение также специфического иммуноглобулина Е – белка, специальным образом настроенного на взаимодействие с аллергеном.
После установления диагноза врач назначает лечение. Оно начинается с ограничения контактов с виновным аллергеном. Рекомендуется избавляться от домашних животных, сухого корма для рыбок, постельные принадлежности рекомендуется использовать только синтетические (пух, перо, шерсть, вата должны быть исключены), не держать цветы в горшках с открытой землей, убирать ковры, книги держать под стеклом, а пылесос использовать только с фильтром HEPA. Во время уборки человеку, страдающему аллергией к домашней пыли, следует уходить из помещения или надевать маску. Болеющему бронхиальной астмой следует обсудить со специалистом возможность профессиональной вредности на рабочем месте.
Важны также общие мероприятия по укреплению здоровья – борьба с курением, избыточным весом, заболеваниями носа, физические тренировки, противогриппозная вакцинация.
Лекарственное лечение бронхиальной астмы состоит из назначения бронх расширяющих препаратов и средств, борющихся с аллергическим воспалением. В качестве препаратов скорой помощи, применяющихся по потребности, применяют аэрозоли, содержащие быстродействующие бронхорасширяющие лекарства. В качестве лечебных, противовоспалительных препаратов применяют ингаляционные кортикостероиды (ингаляционные «гормоны»). Они являются базисными, основными средствами для лечения бронхиальной астмы, которые эффективно подавляют аллергическое воспаление в бронхах. Ингаляционные гормоны безопасны и не вызывают каких-либо значимых осложнений. Основными неприятностями при их применение являются осиплость голоса и молочница во рту. Для профилактики рекомендуется полоскание рта и голоса каждый раз после ингаляции таких лекарств. Ингаляционные гормоны применяются ежедневно и очень долго. Они выпускаются в виде аэрозоля и в виде порошков, упакованных в капсулы или в ингалятор. Как дополнение к ним, для усиления их действия применяются также бронхорасширяющие препараты 12-ти или 24-х часового действия. Комбинации ингаляционных гормонов и таких препаратов помогают более эффективно справляться с болезнью Существуют ингаляторы, которые содержать сразу два таких лекарства. Врач может посоветовать некоторые из таких ингаляторов применять как базисное лечение, а также как препарат скорой помощи по потребности, так называемая терапия единым ингалятором. Такое лечение позволяет справляться с болезнью, которая плохо поддается лечению при применении традиционных схем дозирования. В некоторых случаях применяются дополнительные противовоспалительные препараты, а особо тяжелых – добавляют иные бронхорасширяющие средства, которые в основном применяются при другом заболевании – хронической обструктивной болезни легких. При особо упорных случаях болезни врач может назначить консультацию специалиста, занимающимся особым видом лечения, позволяющим бороться с иммуноглобулином Е путем введения моноклональных антител.
Аллерголог, выявив аллергию, может назначить особый вил лечения – аллергенспецифическую иммунотерапию, когда под кожу вводится в очень малых дозах аллерген, виновный в аллергической реакции.
Обострение БА – грозная ситуация, недооценивать которую нельзя. Если бронхорасшияющие препараты быстрого действия становятся неэффективными, интервал между их приемом начинает сокращаться – необходимо незамедлительно обратиться к врачу или вызвать скорую помощь. Промедление в этом случае чревато серьезными осложнениями.
Залогом успеха лечения бронхиальной астмы является дисциплинированное соблюдение рекомендаций и назначений врача в полном объеме.
Приложение Г1-Г10 Шкалы оценки, опросники и другие дополнительные материалы
Приложение Г1. Тест по контролю над астмой (АСТ)
25 баллов – полный контроль БА; 20-24 балла – частично контролируемая БА; Менее 20 баллов – отсутствие контроля.
Приложение Г2. Тест по контролю над астмой у детей (с-АСТ).
20 баллов или больше – наличие контроля БА, 19 баллов или меньше – отсутствие контроля БА.
Приложение Г3. Опросник по контролю симптомов астмы (ACQ-5).
После ответа пациентом на все вопросы следует сложить все баллы и разделить полученную сумму на 5.
- 1,5 баллов – отсутствие контроля БА;
- 0,75-1,5 балла – частично контролируемая БА;
- < 0,5 баллов – контролируемая БА
Приложение Г4 Методология мониторирования ПСВ (пикфлоуметрии)
• Регистрируется лучший показатель ПСВ после 3 попыток выполнения форсированного маневра с паузой, не превышающей 2 сек после вдоха. Маневр выполняется сидя или стоя. Большее количество измерений выполняется в том случае, если разница между двумя максимальными показателями ПСВ превышает 40 л/мин.
• Повышенная вариабельность может регистрироваться при двукратных измерениях в течение суток. Более частые измерения улучшают оценку. Повышение точности измерений в этом случае достигается в особенности у пациентов со сниженным комплайнсом.
• Регистрация ПСВ на рабочем месте и вне работы важна при подозрении на профессиональную БА.
• Вариабельность ПСВ лучше всего рассчитывается как разница между максимальным и минимальным показателем в процентах по отношению к среднему или максимальному суточному показателю ПСВ.
Приложение Г5. Заболевания, с которыми необходимо дифференцировать БА
Приложение Г6 Методология и интерпретация терапевтических проб и тестов на обратимость бронхиальной обструкции
• Для исследования обратимости обструкции проводится проба с КДБА (сальбутамолом**) в разовой дозе 400 мкг. Дозированные аэрозольные ингаляторы должны использоваться со спейсером. Повторное спирометрическое исследование необходимо провести через 15–30 мин после ингаляции КДБА.
• Бронходилатационный тест считается положительным, если после ингаляции бронходилататора коэффициент бронходилатации (КБД) по ОФВ1 составляет не менее 12%, и при этом абсолютный прирост составляет 200 мл и более.
Формула для расчета КБД:
ККБД = ОФВ1 после (мл) — ОФВ1 исх (мл) / ОФВ1 исх (мл) × 100%
Абсолютный прирост (мл) = ОФВ1 после(мл) — ОФВ1 исх(мл),
где ОФВ1 исх — значение спирометрического показателя до ингаляции бронходилататора, ОФВ1 после — значение показателя после ингаляции бронходилататора.
• В качестве пробной терапии у взрослых чаще всего используется 6-8 недельный курс приема ИГКC в дозе, эквипотентной 200 мкг БДП два раза в день. У больных с выраженной бронхиальной обструкцией может иметь место частичная резистентность к ИГКС. В этом случае более предпочтительно использование терапевтической пробы с пероральным преднизолоном в дозе 30 мг в сутки в течение 2 недель.
• Тесты на обратимость с применением бронходилататоров или терапевтические пробы с применением ИГКС у диагностически неясных пациентов должны проводиться с применением одного и более объективных методов оценки.
• Использование ОФВ1 или ПСВ как основных методов оценки обратимости или ответа на терапию находит более широкое использование у пациентов с исходной бронхиальной обструкцией. Использование данных параметров у пациентов с исходно нормальными показателями легочной функции ограничено в применении, т.к. в этом случае отсутствует резерв улучшения этих параметров.
• Прирост ОФВ1 ≥ 200 мл или 12% в ответ на пробу с β2-агонистом или терапевтический курс кортикостероида может служить подтверждением диагноза БА. Пробное прекращение терапии может оказывать помощь в случае сомнений.
Приложение Г7. Характеристики, позволяющие заподозрить БА у детей в возрасте 5 лет и младше
Приложение Г8. Оценка контроля БА
Приложение Г9 Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии БА у взрослых и подростков старше 12 лет (по GINA 2016 г.)
Примечание: эти лекарственные эквиваленты являются приблизительными и зависят от ряда факторов, в том числе ингаляционной техники.
* Флутиказона фуроат зарегистрирован в РФ в виде фиксированной комбинации флутиказона фуроат/вилантерол, ДПИ
Приложение Г10. Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии БА у детей в возрасте 6–11 лет (по GINA 2016 г.)
Примечание: эти лекарственные эквиваленты являются приблизительными и зависят от ряда факторов, в том числе от ингаляционной техники.
Приложение Г11 Первичная профилактика БА
Приложение Г12. Диетические рекомендации при БА
| Результаты исследований | Рекомендации | |
| Пищевые продукты и добавки | Сульфиты (консерванты, которые часто входят в состав лекарств и таких пищевых продуктов как картофельные чипсы, креветки, сухофрукты, пиво и вино) нередко причастны к развитию тяжелых обострений БА | В случае доказанной аллергии на пищевой продукт или пищевую добавку исключение этого продукта может привести к снижению частоты обострений БА. |
| Ожирение | Исследования показывают взаимосвязь между увеличением массы тела и симптомами БА | Пациентам с избыточной массой тела рекомендуется снижение веса для улучшения состояния здоровья и течения БА. |
Приложение Г13. Вторичная профилактика БА
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Бронхиальная астма ширится в массах, сегодня в мире ею больны почти 300 миллионов взрослых и детей. Именно астма считается самым частым хроническим заболеванием детского возраста, истории жизни почти 15% маленьких россиян помечены этим неприятным диагнозом, и больных детей больше взрослых.

Наш эксперт в этой сфере:

Серебрянский Юрий Евстафьевич
Врач-кардиолог, гериатр, терапевт, профессор, заслуженный врач Российской Федерации, д.м.н
Необычная особенность бронхиальной астмы: максимальная доля заболевания диагностируется в детстве, преимущественно, у мальчиков, к подростковому возрасту соотношение больных мальчиков и девочек выравнивается, а у взрослых астмой болеют преимущественно женщины.
В России болеют астмой десять из сотни взрослых, а всего около 7 миллионов, ежегодно чуть больше 40 тысяч не переживают очередной тяжёлый приступ заболевания. Самая высокая заболеваемость поразила шотландцев. Сырость и холод потворствуют астме, что знал даже Гиппократ, который и придумал называть возникающее приступообразное удушье астмой.
Отмечено, что чистота тоже ведёт к возрастанию частоты аллергии, и астмы как её клинического апогея. Забавный клинический случай произошёл в средневековье, итальянский врач без каких-либо снадобий вылечил епископа от астмы, прописав ему диету с упражнениями и, главное, замену старой перины.
Горожане болеют бронхиальной астмой чаще сельчан, потому что в слишком чистой цивилизации и загазованной урбанизации организм человека не приучается адекватно реагировать на воздействие разнообразных природных аллергенов, зато в воздухе постоянно плавают и летают разнообразные аэрополлютанты — вредные частицы техногенных производств. Замечено, что тяжесть астмы напрямую связана с социальным и нервным статусом пациента, чем нервознее его жизнь, тем сложнее протекает его болезнь.

Сообщение отправлено!
ожидайте звонка, мы свяжемся с вами в ближайшее время
Провокаторы астмы
Причин для возникновения астмы много, её сегодня специалисты определяют как «гетерогенное» заболевание, буквально, разнородное или много причинное. Но точно известно, что на фоне хронического воспаления слизистых дыхательных путей возникает большинство случаев астмы, но отнюдь не все заболевания можно объяснить только этим. При астме организм неадекватно реагирует на какие-то определённые раздражители, когда ответ на присутствие неродного ему фактора больше, чем следует.
В роли запускающего болезнь чаще всего выступают аллергены, наполняющие внешнюю среду. Как правило, это природные аллергены, такие как домашняя пыль, шерсть животных, чешуйки хитинового покрова насекомых, споры грибов. Для возбуждения процесса достаточно микроскопической дозы аллергена, даже грамма не требуется. Кстати, научные исследования подтверждают, что чем реже ребёнок сталкивается с такими аллергенами, то есть чем чище окружающий его мир, тем больше вероятность развития у него астмы при первой встрече с ранее недоступным компонентом внешней среды. Так изгнали из квартир тараканов и у следующих поколений людей, никогда не встречавших домашних тараканов, участилась реакция на их аллергены.
Способствует формированию астмы, но не вызывает её, загазованность, профессиональные вредные вещества, табачный дым, продукты питания. Триггерами считают холодный сырой климат, значительные физические, а по факту почти спортивные у нетренированного человека, нагрузки. Сами по себе все они не являются аллергенами, но помогают аллергенам вредить, тоже сужая просвет бронхов. Существует даже астма физического усилия, проявляющаяся при физической нагрузке, как правило, связанная с неадекватным лечением.
У многих из нас существуют причины для возникновения астмы, связанные с работой, вернее, с обстановкой на рабочем месте. Эта форма так и называется — астма на рабочем месте. Веществ, способных вызвать заболевание — сотни, пыль домашняя совсем не похожа на пыль библиотечную, или уличную, или офисную. При рабочей астме к развитию приступа приводит «трудовая» пыль офиса, по составу не совпадающая с домашней. Аналогично происходит на каком-нибудь производстве, где в пыли имеются частицы красок и химических веществ, отсутствующие в квартирах. И получается, что для астмы всегда найдётся повод.
Внутренний настрой на астму
Но для развития астмы нужна и внутренняя предрасположенность. Предполагают наличие генетической предрасположенности, потому что хотя бы при одном больном астмой родителе в половине случаев ребёнок рискует унаследовать болезнь. Но конкретные гены, ответственные за появление болезни пока не нашли. Способствует развитию астмы избыточный вес, при котором брюшным жиром диафрагма оттесняется в грудную полость, из-за чего объём дыхания уменьшается, нижние отделы лёгких «сжаты» и в тепле и влажности размножаются залетевшие с воздухом бактерии.
Интересна особенность взаимоотношений заболевания с полом. В детстве астме больше подвержены мальчики, но не из-за «мужской» хромосомы или половых гормонов, а просто у них чуть меньше просвет бронхов, поэтому при воспалении бронхи легко перекрываются отёчной слизистой, формируя благоприятную среду для поддержания бактериального воспаления. У взрослых астма — женская болезнь, и тут она, по-видимому, сцеплена с выработкой половых гормонов, потому как приступы часто совпадают с менструациями.
Как возникает астма
Бронхиальная астма зиждется на воспалении дыхательных путей, причём воспаление может вызываться и бактериями, и вирусами, и простейшими микроорганизмами — кем угодно. Но очень часто первый приступ болезни возникает именно после перенесённой инфекции, а поскольку каждый человек в среднем шесть раз за год переносит вирусную инфекцию — простуду, повод для развития астмы возникает довольно часто. Сам приступ удушья возникает непосредственно из-за резкого сужения просвета бронхов, как правило, на фоне уже имеющегося воспалительного сужения.
Слизистая в состоянии воспаления пропитана избытком жидкости и во множестве собираются иммунные клетки, по малейшему поводу выбрасывающие биологически активные вещества. Залетевший с воздушным потоком крохотный аллерген падает на рыхлую отёчную слизистую, и тут же к нему устремляются толпы иммунных клеток, выбрасывающих продукты, которые должны убить аллерген, но аллерген не живой организм, его нельзя убить. Слизистая ещё больше отекает, суживая просвет, и воздух может пройти по бронху только при приложении усилия. Начинается удушье, все нормальные люди боятся смерти от недостатка воздуха, а от выброса «гормонов страха» приступ ещё больше усиливается.
Приступы астмы чаще всего провоцируются стрессами, эмоциональными переживаниями, после психических нагрузок и при переутомлении. Астма — психосоматическая болезнь, она не только возникает на фоне эмоций, приступ усугубляется эмоцией, не проходит бесследно для психики страх встречи с аллергеном и развития приступа. У больных до 40-летнего возраста в девяти из десяти случаев причиной болезни становится давняя аллергия. У пожилых людей астма тоже может развиться астма, потому что благоприятную среду создают эмфизема и лёгочные заболевания.
Позаботьтесь о себе, запишитесь на консультацию сейчас
Записаться на прием

Сообщение отправлено!
ожидайте звонка, мы свяжемся с вами в ближайшее время
Какой бывает астма
Как поняли совсем недавно, бронхиальная астма возникает от множества причин. Но превалирующая причина у большинства — аллергия, этот вариант заболевания так и называется «аллергическая». Он развивается с детства и всегда связан с предшествующими астме, а после и сопровождающими астму дерматитами, аллергическим ринитом или пищевой аллергией. У таких больных в воспалении чрезвычайно активно участвуют эозинофилы, что видно и под микроскопом и по анализу крови. Такая астма хорошо отвечает на лечение.
Бронхиальная астма неаллергической природы, наоборот, плохонько реагирует на лекарства. Есть ещё бронхиальная астма «позднего начала», так отмечается её некоторая необычность. Она характерна для взрослых женщин, не склонных к аллергии. Есть вариант БА при ожирении, когда лучшее средство от болезни — снижение веса пациента.
Специалисты пользуются разделением заболевания по частоте приступов, так если приступы бывают далеко не каждую неделю, обострения болезни кратки, а ночные удушья беспокоят не чаще двух раз ежемесячно, то такой вариант астмы называют интермиттирующим, то есть прерывистый.
Когда приступы удушья беспокоят еженедельно и даже ночью поднимают с постели чаще двух раз за месяц, то предполагается вариант лёгкий персистирующий, то есть постоянный или хронический, но всё-таки лёгкий. А тяжёлая персистирующая форма отличается ежедневной симптоматикой, частыми обострениями, когда приступы удушья развиваются и днём и ночью, резко ограничивая активность пациента. Между лёгким и тяжёлым персистирующими вариантами располагается астма средней тяжести, которая не даёт о себе забыть практически каждый день, по ночью приступы возникают не чаще раза в неделю.
Приступ астмы
Приступ астмы начинается совсем не внезапно, как принято считать, а ему предшествуют определённые симптомы и ощущения, начало которых уже настораживает больного. Во время прелюдия свербит в носоглотке или зудит в носу, начинается череда чиханий, краснеет пятнами кожа, чешутся глаза, и так может продолжаться довольно долго. На начинающееся удушье указывает приступообразный кашель и небольшая одышка. Если в этот момент предпринять терапевтические меры, то приступ может прекратиться в самом зачатке.
Сам приступ проявляется острой нехваткой воздуха, сдавлением в груди, когда можно сделать только очень краткий вдох, а выдох получается очень медленным и каким-то трудным. На выдохе внутри грудной клетки развиваются громкие свистящие хрипы, их слышно на значительном расстоянии. Больной садится, опираясь на край стула, испуганный и растерянный, вены на шее набухшие, на бледном лице синеют губы. Больного буквально бьёт кашель, но мокрота отходит с трудом небольшими слизистыми сгустками.
Длительность приступа может быть разной: от нескольких минут до часов и даже суток. Выраженность симптомов тоже различна. У некоторых пациентов до удушья дело не доходит, приступ самостоятельно разрешается. Чаще приступ происходит по ночам и утром, потому что во время сна нервная система уменьшает просвет бронхов, снижая приток кислорода для углубления сна. После пробуждения бронхи какое-то время пребывают в суженном состоянии, поэтому природой определённый естественный фон сам по себе является предрасполагающим для возникновения приступа.
Как ставится диагноз
Диагноз астмы ставится по рассказу пациента, описывающего приступ. Если картина соответствует определённым клиническим критериям, то ставится диагноз «бронхиальная астма». Если есть сомнения, то проводятся дополнительные исследования, спирометрия с различными сужающими бронхи лекарствами для исключения других лёгочных заболеваний типа ХОБЛ — хронической обструктивной болезни лёгких.
Какие признаки высказываются за астму?
- При приступе настоящей астмы всегда должно быть свистящее дыхание с кашлем, с одышкой и ощущением тяжести в груди. Если всё это начинается в ночные часы и ранним утром, то сомнений меньше. То есть необходимы клинические признаки приступа астмы, пусть не все сразу, но комплекс симптомов должен быть.
- Симптомы появляются не сами по себе, а в строгой связи с чем-то определённым: контактом с аллергеном или при выходе на морозный воздух, во время физической нагрузки или ещё с чем-то определённым.
- У пациента должна быть аллергия, для диагностики лучше, что был явный аллергический ринит или поражения кожи.
- Семейная история помнит об астме у родственника.
- Приступ возникает при приёме аспирина или лекарства от гипертонии.
- А ещё в анализе крови может быть повышенное число эозинофилов, на спирометрии тоже не все показатели вписываются в норму, хотя этот признак вне приступа не обязателен, так же как и хрипы в лёгких.
Заболевание не считается похожим на бронхиальную астму, если симптомы возникают исключительно при простуде, кашель с мокротой происходит без свистящего дыхания и одышки, во время приступа кружится голова и возникают неприятные покалывания кожи или мурашки, меняется голос — осиплость. Не в пользу астмы длительное курение более пачки ежедневно и тяжёлое сердечное заболевание. В этой ситуации углублённое обследование сможет прояснить картину и прийти к правильному диагнозу.
Как лечат астму
Цель лечения бронхиальной астмы, во-первых, быстрое купирование начавшегося приступа, и второе, профилактика нового приступа, что обозначается как контроль заболевания, желательно длительный контроль. Лечение астмы ступенчатое, где каждая ступень включает в себя различные лекарственные варианты, начинаясь с простого и минимально вредного препарата, постепенно продвигаясь в терапии к более сложному сочетанию лекарств и токсичному. Без лекарств астму невозможно вылечить и пока это данность.
Сегодня появились лекарственные средства достаточной эффективности, что даже позволяют многочисленным астматикам норвежских лыжных команд занимать призовые места на всех соревнованиях. И норвежские лыжники и весь мир сегодня для предотвращения и профилактики приступов астмы на первой ступени терапии использует удобные портативные ингаляционные устройства.
В ингаляторе содержится лекарство, расширяющие просвет бронха, и снимающие аллергическую реакцию гормональные компоненты, то есть вся лекарственная начинка воздействует именно на механизм развития патологического процесса. Ингаляторы бывают порошковые и аэрозольные, а клапан позволяет точно дозировать препарат. Это удобное и безопасное устройство, пользоваться им может даже ребёнок, но главное, препарат подаётся именно туда, где происходит неладное.
Таблетки и инъекции используются позже, когда бронхиальная астма тяжелее и плохо реагирует на лечение. Растворы для инъекций и таблетки также расширяют бронхи и снимают аллергический компонент, и конечно, купируют воспалительную реакцию, но как любое лекарство имеют и побочное токсическое действие, чего практически лишены ингаляционные формы.
Когда у пациента впервые диагностируется астма или только подозревается, то сразу же приступают к её лечению. Если реакция на применение ингаляционных средств почти никакая, то продолжают обследование для выяснения истинной причины — другого заболевания.
Когда пациент жалуется на симптомы, но они как бы похожи на астму, но всё-таки не характерны для неё, то есть вероятность астмы по диагностическим критериям невысока, тоже могут назначить ингаляционные средства, и если результата не будет, то тогда с полной уверенностью астму отметают.
Если у пациента фифти-фифти, то есть столько же «за» астму, сколько и «против» астмы, то тоже начинают лечение. В данной ситуации руководствуются принципом: если поможет — астма, не поможет — не астма.
При тяжёлой астме, во время обострения обязательна госпитализация, потому что астма может привести к смерти, и после выписки таких пациентов должны прицельно наблюдать в течение года. Лечение в больнице предлагается и при неэффективности амбулаторной терапии, здесь учитывается и психологический момент — не так страшно на глазах у врачей, что немаловажно для психосоматического заболевания.
Астма у молодых мам
Астма у беременных и кормящих не может ни влиять на женский организм, но как гормональные изменения повлияют на саму астму, загодя никто не скажет. Течение заболевания может, как улучшиться, так и ухудшиться. Хоть ингаляционные гормональные препараты практически не имеют побочных эффектов, и принципиально не влияют на развитие плода, лечение беременной женщины должно проводиться только под врачебным контролем. В родах, несмотря на сильный стресс, приступы астмы бывают очень редко, тем не менее, при оперативном родоразрешении и просто обезболивании родов стараются избегать наркоза, отдавая предпочтение любому варианту местного обезболивания. Грудное вскармливание астматикам не воспрещается.
Материал подготовлен врачом-кардиологом, гериатром, терапевтом, профессором, заслуженным врачом Российской Федерации, доктором медицинских наук международной клиники Медика24 Серебрянским Юрием Евстафьевичем.
Содержание Скрыть
- Особенности бронхиальной астмы
- Степени и формы заболевания
- Причины возникновения
- Симптомы заболевания
- Лечение и профилактика заболевания
Астма — хронический недуг, поражающий бронхи, который часто проявляется в виде отека слизистой оболочки дыхательных путей и спазмов, сопровождающихся нехваткой воздуха. С греческого название болезни переводится, как «удушье», «тяжелое дыхание». Разберемся, что представляет собой эта болезнь, как ее распознать и можно ли вылечить.
Особенности бронхиальной астмы
Главная особенность недуга — быстрое прогрессирование, которое беспокоит человека частыми приступами удушья и приводит к серьезному ухудшению качества жизни. В мире более 100 000 000 людей страдает от этой болезни, а это — примерно 5-9% взрослого населения каждого государства. Каждый год недуг забирает жизни порядка 250 000 людей.
Степени и формы заболевания
Медики выделяют 3 основные формы заболевания:
- Аллергическая. Спровоцирована внешним раздражителем — аллергеном (например, определенным продуктом питания, пылью, шерстью домашних животных и т.д.).
- Неаллергическая. Вызвана каким-либо аллергическим фактором. Может возникать у людей, страдающих хроническими заболеваниями легких инфекционного характера. Или, к примеру, возникает на фоне длительного приема определенных лекарственных средств.
- Смешанная. Включает признаки двух форм, описанных выше.
Независимо от формы заболевания оно может протекать в 4-х стадиях (ступенях, этапах):
- Симптомы бронхиальной астмы наблюдаются у пациента не чаще, чем 1 раз в неделю и не чаще, чем 2 раза в месяц в ночное время.
- Приступы «атакуют» пациента чаще 1 раза в неделю, но не ежедневно. Ночью симптомы наблюдаются не чаще 2 раз в месяц.
- Каждый день человек мучается от приступов астмы, ночью они тревожат его чаще, чем раз в неделю.
- Самая тяжелая ступень болезни, при которой человек мучается от приступов ежедневно. Причем как днем, так и ночью.
Причины возникновения
Развитию недуга способствуют определенные внешние и внутренние факторы. Внутренними могут быть такие, как:
- различные нарушения в функционировании эндокринной системы;
- неправильное функционирование системы дыхания;
- ослабление иммунной защиты организма.
Внешними причинами могут быть
- аллергические реакции;
- частые стрессовые ситуации;
- курение (в том числе электронных сигарет, вейпов и т.д.);
- работа в неблагоприятных условиях.
Аллергия на что-либо и табакокурение — 2 наиболее частых фактора-провокатора бронхиальной астмы.
Симптомы заболевания
Важно понимать, что чем раньше врачи диагностируют заболевание, тем больше шансов на полное выздоровление. Поэтому нужно внимательно следить за своим организмом и при появлении любых признаков, описанных ниже, скорее обращаться к медикам:
- Одышка, чувство нехватки воздуха. Особенно, если состояние возникает не из-за физической нагрузки, а в состоянии покоя. При астме одышка проявляется в виде систематических приступов.
- Кашель. Появляется вместе с одышкой, не приносящий облегчение. Отхождение мокроты наблюдается только в конце приступа.
- Поверхностное дыхание. Проявляется в виде трудности сделать полный вдох грудью.
- Ощущение хрипов при дыхании. Иногда их можно услышать только во время самого приступа, а иногда они наблюдаются постоянно.
- Ортопноэ-поза. Эту позу пациент непроизвольно (инстинктивно) занимает во время астматического приступа — в положении сидя, свисает ноги и крепко хватается руками за предмет, находящийся перед ним.
На ранних стадиях вышеописанная симптоматика может либо проявляться слабо, либо вообще никак не давать о себе знать. Но постепенно симптомы будут становиться все более выраженными, а также приведут к другим не менее приятным ощущениям:
- общему недомоганию;
- синюшности кожных покровов;
- постоянному сухому кашлю;
- затруднительному вдоху;
- постоянной одышке;
- головокружениям;
- головной боли;
- тахикардии.
Лечение и профилактика заболевания
Увы, современная медицина пока не в силах полностью избавить пациента от астмы. Поэтому всем терапевтические методы направлены на облегчение состояния человека и устранении симптомов заболевания. Лечением недуга занимаются пульмонологи и обычно медикаментозная терапия включает прием препаратов 2-х групп:
- Базовых. Способствуют уменьшению воспалительного процесса в бронхах (принимать их необходимо пожизненно).
- Симптоматических. Принимаются во время приступов и направлены на снятие спазма бронхов.
В качестве профилактических мер пульмонологи советуют следовать 6-и простым правилам:
- Каждый день гулять на улице не менее 2-х часов.
- Полностью исключить контакт с аллергенами (если вы – аллергик).
- Заниматься закаливанием организма и принимать меры для профилактики от заболеваний дыхательных органов.
- Полностью отказаться от курения.
- Пользоваться гипоаллергенными средствами бытовой химии, косметикой, постельным бельем и т.д.
- Заниматься физкультурой (как минимум — раз в день делать зарядку).
Также стоит минимум 2 раза в неделю проводить тщательную влажную уборку в доме, стирать белье в машинке не реже раза в неделю на максимально допустимой температуре и не использовать в интерьере ковры с мягкой мебелью, которые накапливают пыль.
Если рассматривать конкретные препараты от бронхиальной астмы, то чаще всего врачи выписывают:
Все лекарства, доступные к продаже в аптеках Вашего города, а также цены на них, Вы можете увидеть
на нашем сайте, введя в поисковой строке название лекарства и запустив поиск.
Обзор
Астма — это распространенное длительно текущее заболевание, которое может вызывать кашель, затруднение дыхания и одышку. Выраженность симптомов может быть различной. Большинству людей удается хорошо контролировать астму на протяжении длительного времени.
Среди взрослых в России бронхиальной астмой в среднем болеет 1 из 16 человек, среди детей — 1 из 11. До 14 лет заболевание чаще встречается у мальчиков, в более позднем возрасте, напротив, чаще болеют женщины.
Астма связана с воспалением дыхательных путей — бронхов (это маленькие трубочки, по которым воздух поступает в легкие и выходит наружу). При развитии бронхиальной астмы бронхи воспаляются и становятся более чувствительными, чем в норме.
При контакте с раздражителем, известным как триггер (см. ниже), дыхательные пути суживаются, мышцы вокруг них напрягаются, и происходит усиленное выделение липкой слизи (мокроты). Такие изменения в легких сопровождаются следующими симптомами:
- затруднение дыхания;
- кашель и хрипы;
- чувство заложенности (стеснения) в груди.
Тяжелое проявление симптомов известно как приступ бронхиальной астмы или обострение заболевания. Приступы астмы могут потребовать лечения в больнице, иногда они угрожают жизни, однако это случается редко.
Хроническое воспаление дыхательных путей у людей с астмой, со временем, может приводит к более постоянному сужению бронхов. Если вам поставили диагноз бронхиальной астмы в детстве, симптомы заболевания могут исчезнуть в подростковом возрасте. Однако, позже, болезнь может вернуться. Если в детстве признаки астмы были умеренными или тяжелыми, высока вероятность, что они сохранятся или появятся вновь на протяжении жизни. Хотя бронхиальная астма может впервые появиться в любом возрасте.
Полностью излечиться от бронхиальной астмы не возможно, однако существует много способов эффективного контроля за ее проявлениями. Лечение и профилактика астмы включают комбинацию лекарств, советы по изменению образа жизни, а также выявление и предотвращение контакта с возможными триггерами.
Симптомы бронхиальной астмы
Проявления бронхиальной астмы варьируют от мягких до тяжелых. Многократное усиление симптомов называется приступом астмы.
Симптомы бронхиальной астмы:
- чувство нехватки воздуха (приступ удушья);
- чувство заложенности (стеснения) в груди (как будто она перетянута веревкой);
- свистящие хрипы при дыхании;
- кашель, особенно сильный ночью и ранним утром;
- появление приступов в ответ на физическую нагрузку, воздействие аллергена или другого триггера.
Вы можете испытывать один или несколько симптомов. Ухудшение состояния ночью или во время физической нагрузки, может говорить о плохом контроле над астмой или об утяжелении ее течения. Необходимо сообщить об этом лечащему врачу.
Приступ бронхиальной астмы
Тяжелый приступ бронхиальной астмы обычно развивается медленно. Прежде чем он достигнет своего апогея, проходит около 6–48 часов. Однако у некоторых людей выраженность симптомов нарастает быстро. Для приступа бронхиальной астмы характерны следующие признаки:
- усиливаются хрипы, заложенность в грудной клетке,
чувство нехватки воздуха; - ингаляторы неотложной помощи (содержащие сальбутамол,
фенотерол, тербуталин) помогает меньше, чем обычно; - уменьшается пиковая скорость выдоха (прочитайте подробнее
в разделе диагностика астмы).
Если вы заметили эти признаки, не игнорируйте их. Обратитесь за медицинской помощью или следуйте ранее полученным для таких случаев рекомендациям врача.
Признаки тяжелого приступа бронхиальной астмы:
- ингалятор неотложной помощи (содержащий сальбутамол, фенотерол, тербуталин) не помогает облегчить симптомы;
- свистящее дыхание, хрипы, кашель и чувство заложенность в груди (удушье) достигают максимума и беспокоят непрерывно;
- не хватает воздуха для того, чтобы говорить;
- учащается пульс;
- вы чувствуете тревогу и беспокойство;
- синеют губы и ногти на пальцах.
Вызовите скорую помощь по телефону 03 (112 или 911 с мобильного телефона), если у вас или у кого-то еще появились признаки тяжелого приступа бронхиальной астмы.
Причины бронхиальной астмы
Не существует единственной причины бронхиальной астмы, но на вероятность ее развития могут влиять факторы окружающей среды и наследственность.
Кто подвержен риску заболеть астмой?
Риск бронхиальной астмы повышается, если:
- у вас в семье были случаи бронхиальной астмы или заболеваний, связанных с аллергией (атопических состояний), таких как экзема, пищевая аллергия или сенная лихорадка;
- вы сами страдаете аллергией, например, на пищевые продукты;
- в детстве вы болели бронхиолитом (распространенное детское заболевание легких);
- в детском возрасте подвергались действию табачного дыма, особенно, если мать курила во время беременности;
- вы родились недоношенным (особенно, если находились на искусственной вентиляции легких);
- имели низкий вес при рождении (меньше 2 кг).
-
Гигиеническая гипотеза
Одни дети имеют меньший риск астмы, чем другие. Например, исследования показали, что у детей, редко принимавших антибиотики или живущих в сельской местности бронхиальная астма развивается реже. Ученые попытались объяснить этот факт с помощью гигиенической гипотезы.
Триггеры бронхиальной астмы
У каждого больного бронхиальной астмой есть свои триггеры (раздражители), которые вызывают появление симптомов. Зная эти триггеры, можно избегать контакта с ними. Виды триггеров:
- Инфекции верхних дыхательных путей и легких, причиной которых часто становится простуда или вирус гриппа.
- Аллергены: пыльца, пылевые клещи, шерсть животных, птичьи перья.
- Раздражители из воздуха: сигаретный дым, пары химических веществ и атмосферные загрязнения.
- Лекарства: обезболивающие, относящиеся к группе нестероидных противовоспалительных средств (НПВС), в частности аспирин и ибупрофен, у некоторых людей вызывают обострение бронхиальной астмы, хотя большинство людей переносят их хорошо. Детям до 16 лет не следует давать аспирин.
- Эмоциональные факторы: стресс или смех, могут провоцировать астму.
- Продукты, содержащие сульфиты. Сульфиты — это природные соединения, содержащиеся в некоторых продуктах и напитках. Также они иногда используются в качестве пищевых консервантов. Большое количество сульфитов содержится в концентрированных фруктовых соках, варенье, креветках и многих полуфабрикатах. Обычно больные бронхиальной астмой не реагирует на подобные триггеры, но есть люди, для которых эта группа раздражителей актуальна. Некоторые вина могут спровоцировать астму у восприимчивых людей.
- Погодные условия: резкое изменение температуры, холодный или загрязненный воздух, ветер, жаркая и влажная погода.
- Домашние условия: плесень и сырость, домашние пылевые клещи и бытовая химия для ковров и напольного покрытия.
- Физическая нагрузка: иногда люди замечают, что симптомы бронхиальной астмы усиливаются при выполнении физических упражнений.
- Пищевые аллергены: некоторые люди испытывают анафилактическую реакцию на орехи и другие продукты. Эти же аллергены могут вызывать серьезные приступы астмы.
Что происходит во время приступа бронхиальной астмы?
Во время приступа бронхиальной астмы:
- мышечные пучки вокруг дыхательных путей сокращаются;
- нарастает воспаление и отек слизистой оболочки дыхательных путей;
- в бронхах образуется липкая слизь (мокрота), за счет чего еще больше суживается их просвет.
Сужение бронхов затрудняет прохождение воздуха во время дыхания, что сопровождается появлением характерных хрипов, однако не у всех больных астмой. Даже во время опасного для жизни приступа не всегда появляются хрипы при дыхании.
Приступ астмы может произойти в любой момент. Но обычно, за несколько дней до обострения можно заметить тревожные сигналы: усиление обычных симптомов, особенно в ночное время, а также частая потребность в использовании ингаляторов неотложной помощи (содержащих сальбутамол, фенотерол, тербуталин и др.).
Диагностика бронхиальной астмы
При обнаружении характерных для бронхиальной астмы симптомов, лечащий врач, скорее всего, сразу поставит диагноз. Он может уточнить, когда и как часто проявляется заболевание, и не заметили ли вы триггеров (раздражителей), которые, возможно, запускают приступ астмы. Для подтверждения поставленного диагноза может быть проведен ряд исследований.
Спирометрия — это метод, позволяющий оценить, насколько эффективно работают легкие. Для исследования вас попросят дышать в аппарат, который называется спирометр.
Спирометр проводит два измерения: объем воздуха, который можно выдохнуть за одну секунду (объем форсированного выдоха за одну секунду — ОФВ1) и общее количество воздуха, которое вы выдыхаете (форсированная жизненная емкость легких — ФЖеЛ).
Для получения точных показателей, возможно, понадобиться сделать несколько выдохов. Результаты теста оценивают, сравнивая полученные данные с нормальными показателями дыхания для вашего возраста. Это позволяет выявить наличие препятствий в ваших дыхательных путях.
Иногда, после начальных изменений, вам дают воспользоваться ингалятором неотложной помощи (содержащим расширяющие бронхи вещества), а затем снова проводят измерения. Улучшение показателей после приема лекарства служит подтверждением диагноза.
Измерение пиковой скорости выдоха (пикфлоуметрия). Пикфлуометр — небольшое переносное устройство, которое используется для измерения того, как быстро вы можете выдохнуть (пиковой скорости выдоха ПСВ). При помощи пикфлоуметра можно самостоятельно вести дневник измерений ПСВ дома, а также дополнительно записывать в него свое самочувствие и выраженность симптомов. Эти наблюдения помогают выяснить, что провоцирует ухудшение астмы.
-
Можно ли полностью вылечить бронхиальную астму?
Если бронхиальная астма развилась в детстве, то симптомы могут стать почти незаметными или полностью исчезнуть в подростковом возрасте. В дальнейшем (но не всегда) симптомы бронхиальной астмы могут снова вернуться. Если заболевание развилось у взрослого человека, то, скорее всего, оно будет проявляться в той или иной степени до конца жизни.
Некоторые люди нуждаются в проведении дополнительных исследований, которые подтвердят диагноз бронхиальной астмы или выявят другие заболевания. Это поможет вам и вашему врачу правильно подобрать лечение.
Исследование чувствительности дыхательных путей показывает, как реагируют ваши дыхательные пути на контакт с триггером астмы. Вам могут предложить пройти провокационный тест с порошком маннитола, который основан на вдыхании возрастающих доз вещества. При бронхиальной астме маннитол вызывает спазм дыхательных путей. У детей в качестве провоцирующего фактора иногда используют физическую нагрузку.
После воздействия раздражителя при помощи спирометра измеряют ОФВ1 и ФЖЕЛ. Значительное уменьшение этих показателей свидетельствует о наличии бронхиальной астмы.
Оценка воспаления дыхательных путей складывается из двух этапов:
- Анализ мокроты. Врач может взять образец мокроты для проверки наличия воспаления в легочной ткани.
- Определение концентрации оксида азота. Высокий уровень оксида азота в выдыхаемом воздухе может быть признаком воспаления дыхательных путей.
Аллергические пробы: кожные пробы или анализ крови позволят подтвердить связь бронхиальной астмы с аллергией, например, на пылевых клещей, пыльцу или продукты питания.
Профессиональная бронхиальная астма
Если ваше состояние заметно улучшается в отпуске или в выходные дни, возможно, у вас профессиональная бронхиальная астма. Вероятность развития профессиональной астмы наиболее высока у работников таких специальностей, как:
- маляры;
- пекари и кондитеры;
- медсестры;
- работники химической отрасли;
- работающие с животными;
- сварщики;
- работники пищевой промышленности;
- профессии, связанные с деревообработкой.
Для установления диагноза профессиональной бронхиальной астмы врач может попросить пациента измерить пиковую скорость выдоха на работе и дома. Для подтверждения диагноза может потребоваться осмотр специалиста, занимающегося профессиональной патологией (профпатолога). Возможно проведение дополнительных исследований для выявления аллергии на вещества, вызывающие профессиональную бронхиальную астму.
Лечение бронхиальной астмы
Цель лечения заключается в том, чтобы постоянно держать астму под контролем. Все люди, страдающие бронхиальной астмой, могут вести полноценную жизнь без ограничений. Для этого существует доступное и эффективное лечение, способное избавить вас от симптомов болезни.
Лечащий врач должен подобрать лечение индивидуально, в соответствии с выраженностью ваших симптомов. В некоторых случаях вам потребуется использовать более сильные препараты, чем обычно. Вам должны предложить:
- направление на консультацию к специалистам, которые занимаются лечением и диагностикой бронхиальной астмы (пульмонолога, возможно, аллерголога и профпатолога);
- доступную и полную информацию о заболевании и о том, как его контролировать;
- возможность участвовать в выборе схемы лечения;
- регулярное обследование (не реже одного раза в год) для контроля за вашим состоянием и эффективностью лечения астмы;
- письменный план действий при астме, составленный совместно с вашим врачом.
Также важно, чтобы врач объяснил, как правильно пользоваться ингалятором, поскольку это является неотъемлемым условием эффективного лечения.
Индивидуальный план действий при бронхиальной астме
Во время первых посещений лечащий врач должен составить для вас индивидуальный план контроля за бронхиальной астмой. Если вы находились в больнице из-за приступа астмы, ваш план действий должен быть скорректирован перед выпиской домой.
Индивидуальный план действий при астме должен содержать информацию о лекарствах, которые необходимо принимать. В нем должны быть перечислены признаки ухудшения состояния и ваши действия при развитии приступа астмы. Этот план должен корректироваться лечащим врачом в зависимости от вашего состояния, по крайней мере, один раз в год. При ухудшении самочувствия — чаще.
Если у вас есть пикфлуометр, это облегчит самоконтроль за астмой. Тогда, вы должны регулярно измерять и записывать пиковую скорость выдоха (ПСВ), что дает более достоверные данные о состоянии дыхательных путей, чем симптомы.
Прием противоастматических лекарств
Ингаляторы обычно используют для лечения бронхиальной астмы. Это устройства, которые доставляют лекарства непосредственно в дыхательные пути через рот, при вдохе. Это очень эффективно, так как большая часть лекарственного средства сразу попадает в легкие, и только остаточные количества (следы) препарата могут распространяться по организму.
Ингаляторы несколько отличаются друг от друга по механизму действия. Врач должен обучить вас правильно пользоваться выбранным устройством. Подобная консультация должна проводиться не реже одного раза в год.
Спейсеры — устройства, который улучшают работу ингаляторов. Многие ингаляторы выпускают струю аэрозоля во время нажатия. Они работают лучше, если снабжены спейсером, который увеличивает количество препарата, достигающего легких, и снижает риск побочных эффектов. У некоторых людей использование ингаляторов вызывает трудности, и спейсеры помогают им. Спейсер часто рекомендуют и тем, кто хорошо справляется с применением ингаляторов, поскольку это приспособление улучшают поступление препарата в легкие.
Спейсеры — это пластиковые или металлические контейнеры с мундштуком на одном конце и отверстием для ингалятора на другом. Препарат сначала распыляется внутри спейсера, а затем вдыхается через мундштук. Спейсеры также понижают вероятность развития молочницы во рту и горле — одного из побочных эффектов противоастматических лекарств.
Ингаляторы неотложной помощи необходимы для быстрого облегчения симптомов астмы. Такие ингаляторы обычно содержат препараты группы β2-агонистов. Их действие заключается в расслаблении мышц, окружающих дыхательные пути. После контакта с лекарством дыхательные пути расширяются, что облегчает прохождение по ним воздуха. К лекарствам быстрого действия относятся, например, сальбутамол и тербуталин.
Они являются достаточно безопасными средствами с немногими побочными эффектами, если ими не злоупотреблять. Однако, при хорошем контроле над астмой, потребность в этих препаратах возникает редко. Если вы пользуетесь ингаляторами для неотложной помощи чаще трех раз в неделю, необходимо пересмотреть ваше лечение. Каждый страдающий бронхиальной астмой должен иметь с собой ингалятор неотложной помощи (часто имеют синюю маркировку).
Ингаляторы для поддерживающего лечения действуют длительно, уменьшая воспаление и снижая чувствительность дыхательных путей, что препятствует развитию приступов астмы. Такие препараты вы должны использовать ежедневно. Максимальный эффект развивается спустя некоторое время от начала приема. В этот период, может иногда возникать потребность в ингаляторах неотложной помощи (сальбутамол, тербуталин и др.), чтобы снять симптомы астмы. Однако если такие случаи участились, необходимо пересмотреть схему лечения.
Ингаляторы для поддерживающего лечения обычно содержат лекарства, которые называются ингаляционные глюкокортикостероиды. Например: беклометазон, будесонид, флутиказон и мометазон. Ингаляционные препараты для поддерживающего лечения часто выпускают во флаконах с коричневой, красной или оранжевой маркировкой.
Поддерживающее лечение обычно назначается, если вы:
- ощущаете симптомы бронхиальной астмы чаще, чем два раза в неделю;
- хотя бы раз в неделю просыпаетесь ночью из-за астмы;
- испытываете потребность в ингаляторе неотложной помощи чаще, чем два раза в неделю.
Курение может снизить эффективность лекарств для базисной терапии.
Ингаляционные кортикостероиды в редких случаях могут стать причиной развития грибковой инфекции (молочницы) в ротовой полости и горле, поэтому необходимо тщательно промывать рот после использования лекарства.
Дополнительные препараты и методы лечения
Бронхолитики длительного действия. В случаях, когда бронхиальная астма не поддается лечению, врач может увеличить дозы препаратов для поддерживающего лечения. Если это не помогает, может быть дополнительно назначен ингалятор, содержащий лекарство, расширяющее бронхи — бронхолитик длительного действия (β2-агонист длительного действия), например, формотерол, сальметерол. Эти лекарства действуют также, как ингаляторы неотложной помощи, но их эффект длиться дольше — до 12 часов.
Бронхолитики длительного действия используются только в сочетании с ингаляционными кортикостероидами, и никогда не применяются для лечения в качестве единственного препарата. Исследования подтвердили, что использование только бронхолитиков длительного действия увеличивает вероятность возникновения приступа бронхиальной астмы и частоту смертельных случаев. Врач может назначить вам комбинированный ингалятор, который содержит сразу ингаляционный кортикостероид и бронхолитик длительного действия. К таким средствам относятся: серетид, симбикорт и фостер.
Другие препараты для базисной терапии. Если лечение бронхиальной астмы по-прежнему остается неэффективным, назначают дополнительные препараты. Существует две альтернативные группы средств:
- антагонисты лейкотриеновых рецепторов (монтелукаст) — таблетки, которые блокируют химические процессы, вызывающие воспаление в легочной ткани;
- теофиллины — таблетки, которые расширяют просвет дыхательных путей, расслабляя мышцы вокруг них.
Если бронхиальная астма не поддается лечению, могут быть назначены системные кортикостероиды (гормональные таблетки для приема внутрь). Такое лечение должно проходить только под контролем пульмонолога. Длительное применение подобных средств может вызвать серьезные побочные эффекты, поэтому лечение системными кортикостероидами используется только после того, как все другие средства оказались неэффективными. Ниже приведена информация о побочных эффектах препаратов этой группы.
Непостоянный прием системных кортикостероидов. Большинству людей требуется прием системных кортикостероидов только в течение 1–2 недель. Как только наступит улучшение, можно возвращаться к прежнему лечению.
Омализумаб, также известный как ксолар, — это один из первых препаратов нового поколения. Он связывается с белком, участвующим в иммунном ответе, уменьшает его концентрацию в крови. Это приводит к снижению вероятности развития иммунной реакции. Согласно GINA-2011 (Глобальной стратегии лечения и профилактики бронхиальной астмы) при поддержке Российского респираторного общества, омализумаб (Ксолар) рекомендуется людям с тяжелым течение аллергической бронхиальной астмы, принимающим ингаляционные кортикостероиды.
Омализумаб вводят в виде инъекций каждые две-четыре недели. Препарат может быть назначен только врачом. Если в течение 16 недель омализумаб не привел к улучшению состояния больного, лечение следует прекратить.
Бронхиальная термопластика — новый метод лечения астмы, который пока не получил широкого распространения (в Российских клиниках не проводится). В некоторых случаях используется для лечения тяжелой бронхиальной астмы и позволят бороться с сужением дыхательных путей.
Процедура проводится после приема успокаивающих (седативных) препаратов или под общей анестезией. Бронхоскоп — полую трубку, содержащий зонд, вводят через рот или нос в дыхательные пути. Зонд касается стенок бронхов и нагревается. Как правило, для достижения эффекта бывает достаточно 3 сеансов термопластики, с промежутками между ними не менее 3 недель.
Существует ряд доказательств, что термопластика снижает вероятность приступов и улучшает качество жизни больных тяжелой астмой. Однако отдаленный риск и польза от процедуры пока не достаточно изучены. Обсудите подробности проведения термопластики с врачом.
Побочные эффекты от лечения
Препараты для неотложной помощи (β2-агонисты бымтрого действия) — безопасные и эффективные лекарства, которые имеют немного побочных действия, при умеренном использовании. Основные нежелательные эффекты включают: легкое дрожание рук, головную боль, мышечные спазмы. Чаще они возникают при приеме больших доз препаратов неотложной помощи и длятся в течение нескольких минут.
Лекарства для поддерживающего лечения (ингаляционные кортикостероиды) являются безопасными в небольших количествах, однако могут вызывать побочные действия при длительном приеме высоких доз. Основной побочный эффект — это грибковая инфекция (кандидоз) полости рта или горла. Также может возникнуть осиплость голоса. Чтобы избежать этих побочных действий, используйте спейсер или ополаскивайте полость рта водой после применения ингалятора.
Врач должен подобрать для вас лечебную программу, польза от которой будет превышать риск побочного действия препаратов. Также врач расскажет, как свести возможные негативные эффекты от лечения к минимуму.
Бронхолитики длительного действия могут вызывать побочные эффекты, схожие с лекарствами для неотложной помощи: легкое дрожание рук, головную боль и мышечные спазмы. Врач обсудит с вами риск и пользу от приема данных препаратов. Перед началом лечения врач обследует вас и, в дальнейшем, будет наблюдать за вашим состоянием. В случае если бронхолитик длительного действия оказался неэффективным, следует прекратить его применение.
Известно, что таблетки теофиллина вызывают у некоторых людей такие побочные действия, как головную боль, тошноту, бессонницу, рвоту, раздражительность и расстройство желудка. Этих негативных эффектов можно избежать, уменьшая дозу.
Антагонисты лейкотриеновых рецепторов (например, монтелукаст), как правило, не вызывают побочных эффектов, хотя сообщалось о случаях расстройства желудка, возникновении жажды и головной боли.
Системные кортикостероиды становятся опасными для здоровья при длительном (более трех месяцев) или частом применении (три или четыре курса за год). Побочные эффекты включают:
- остеопороз (хрупкость костей);
- повышение артериального давления (артериальная гипертензия);
- диабет;
- увеличение веса;
- катаракта и глаукома (заболевания глаз);
- истончение кожи;
- легкие кровоподтеки (синяки);
- мышечная слабость.
Для снижения вероятности побочных действий:
- соблюдайте сбалансированную диету, с большим содержанием кальция;
- поддерживайте нормальный вес;
- прекратите курить (если курите);
- регулярно выполняйте физические упражнения. Кроме того, необходимо периодически проходить обследование у врача для проверки артериального давления, исключения диабета и остеопороза.
Лечение профессиональной астмы
При подозрении на профессиональную бронхиальную астму вас должны направить к пульмонологу или специалисту по профессиональной патологии, чтобы подтвердить диагноз. Информация о профессиональном заболевании должна быть передана в федеральную инспекцию труда при Министерстве труда и социальной защиты Российской Федерации.
Работодатель несет ответственность за профилактику профессиональных заболеваний. В ряде случаев, можно избежать контакта с веществом, виновным в развитии у вас симптомов или предпринять другие меры. Однако, вам, возможно, придется сменить работу или должность, чтобы оказаться как можно дальше от той среды, в которой появились первые признаки заболевания. Сделать это нужно как можно быстрее, в течение 12 месяцев с момента появления первых очевидных симптомов бронхиальной астмы.
Некоторые заболевшие профессиональной бронхиальной астмой имеют право на страховые выплаты по закону «Об обязательном социальном страховании от несчастных случаев на производстве и профессиональных заболеваний».
Приступ бронхиальной астмы: что делать?
Что делать в случае развития приступа астмы, и как распознать его приближение, должно быть написано в вашем индивидуальном плане действий при астме.
Лечение приступа бронхиальной астмы, как правило, заключается в принятии одной или нескольких доз препарата неотложной помощи. Если состояние продолжает ухудшаться, необходима госпитализация в больницу. Для лечения в больнице используют кислород, препараты для неотложной помощи (бронхолитики быстрого действия) и лекарства для поддерживающей терапии, чтобы вновь взять астму под контроль.
О том, что делать, если во время приступа астмы под рукой нет лекарства, читайте здесь.
После развития приступа астмы, нужно пересмотреть индивидуальный план действий, чтобы выяснить причину ухудшения и скорректировать лечение.
Вспомогательные методы лечения
Для лечения бронхиальной астмы предложено много дополнительных способов:
- дыхательные упражнения;
- традиционная китайская медицина;
- акупунктура;
- ионизаторы воздуха — устройства, которые превращают молекулы воздуха в ионы при помощи электрического тока;
- техника Александера — комплекс упражнений, обучающий правильным движениям тела;
- гомеопатия;
- пищевые добавки.
Однако существует мало доказательств эффективности перечисленных методов лечения, кроме дыхательных упражнений. Есть множество примеров того, что дыхательные упражнения, в том числе и те, которые описаны физиотерапевтами, в йоге и методе Бутейко (технике поверхностного дыхания), уменьшают выраженность симптомов и необходимость препаратов для неотложной помощи.
Образ жизни с бронхиальной астмой
Бронхиальная астма имеет непостоянное течение: состояние может то ухудшаться, то улучшаться. Бывает так, что на протяжении многих лет человек чувствует себя хорошо и только во время приступов испытывает симптомы астмы. Держать астму под контролем вам помогут приведенные ниже советы.
Забота о своем здоровье — это неотъемлемая часть повседневной жизни. Это то, что вы делаете каждый день, чтобы сохранить хорошую физическую форму и душевное равновесие, предотвратить болезнь и избежать несчастного случая, вовремя справиться с легким недомоганием или длительной болезнью. Люди, страдающие хроническими заболеваниями, значительно улучшают свое качество жизни, если следят за здоровьем. Это помогает им уменьшить боль, беспокойство, депрессию и усталость, долгие годы вести активный образ жизни и быть независимыми.

Поскольку бронхиальная астма — это длительно протекающее заболевание, вам придется часто обращаться к врачу. Доверительные отношения с ним дадут возможность легко обсуждать все симптомы и проблемы. Чем больше информации о своем здоровье вы расскажете врачу, тем лучше он сможет вам помочь.
Всем людям с хроническими заболеваниями, такими как бронхиальная астма, рекомендовано каждую осень делать прививку от гриппа. Также рекомендуется пройти пневмококковую вакцинацию, предотвращающую развитие серьезного заболевания легких — пневмококковую пневмонию.
Если вы курите и имеете астму, необходимо отказаться от курения. Это позволит значительно снизить тяжесть и частоту симптомов заболевания. Курение также уменьшает эффективность лечения бронхиальной астмы. Если вы не курите и имеете астму, постарайтесь избегать воздействия табачного дыма.
Исследования показали, что используя специальные препараты (например, никотиновые пластыри, жевательные пастилки и др.), бросить курить легче. Помощь в борьбе с курением может оказать Консультативный центр помощи в отказе от потребления табака (КТЦ). Чтобы позвонить туда наберите бесплатный номер 8-800-200-0-200 и попросите переключить вас на специалистов КТЦ. Кроме того, в последние годы помощь в борьбе с вредными привычками бесплатно оказывают врачи центров «Здоровье», расположенных во всех городах России, а также в кабинетах по борьбе с потреблением табака, которые создаются на базе территориальных поликлиник.
Симптомы бронхиальной астмы часто усиливаются ночью, заставляя вас просыпаться из-за кашля и чувства стеснения (заложенности) в груди. Врач должен назначить вам лечение, которое уменьшит симптомы, поможет контролировать астму и улучшит ваш сон.
Если симптомы бронхиальной астмы возникают у вас во время физической нагрузки, сообщите об этом своему лечащему врачу. Он может пересмотреть ваш индивидуальный план действий при астме с учетом новых симптомов, чтобы сохранить контроль за заболеванием.
Врач может дать следующие рекомендации:
- использовать ингалятор для неотложной помощи (обычно, флакон с голубой маркировкой) за 10–15 минут до нагрузки и, повторно, спустя 2 часа непрерывных упражнений, либо после окончания тренировки;
- отдавать предпочтение интенсивным, но кратковременным нагрузкам, при этом не забывать о полноценной разминке;
- тренироваться в помещениях с влажнным воздухом, например, в бассейне;
- дышать через нос для того, чтобы избежать гипервентиляции (слишком глубокого и быстрого дыхания).
Большинство людей с бронхиальной астмой могут питаться здоровой пищей без каких-либо ограничений. Но, в редких случаях, в основе развития болезни лежит пищевая аллергия. Тогда приходится исключать из своего рациона: коровье молоко, яйца, рыбу, моллюски, дрожжевые продукты, орехи, некоторые красители и консерванты. Однако такие ситуации возникают редко.
Внимательно наблюдая за своим самочувствием, а также, пользуясь пикфлуометром, постарайтесь определить триггеры, которые вызывают ухудшение астмы. Безусловно, некоторых триггеров, например загрязнения воздуха, вирусных инфекций или погодных условий избежать крайне сложно. Однако, свести к минимуму контакты с другими раздражителями, такими как пылевые клещи, споры грибков или шерсть домашнего питомца, под силу каждому.
Астма и беременность
Противоастматические препараты безопасны для беременных женщин и не угрожают внутриутробному развитию ребенка. В связи с изменениями, которые происходят в организме при беременности, бронхиальная астма тоже может менять свое течение. Выраженность симптомов может усиливаться, снижаться или оставаться неизменной.
Женщины испытывают наиболее тяжелые проявления астмы, как правило, между 24 и 36 неделями беременности. В течение последнего месяца беременности симптомы значительно уменьшаются. Только у 10% женщин бронхиальная астма дает о себе знать во время родов, но в таких ситуациях обычно бывает достаточно использования ингаляторов для неотложной помощи.
Вы должны придерживаться того же лечения, которое было эффективно до наступления беременности, поскольку безвредность противоастматических препаратов при беременности и при кормлении грудью доказана. Исключением являются только антагонисты лейкотриеновых рецепторов, безопасность которых еще не подтверждена.
Однако, в особых случаях, лечащий врач может назначить вам и антагонисты лейкотриеновых рецепторов, если их прием ранее помогал контролировать астму. Считается, что риск от этих лекарств меньше, чем опасность для здоровья женщины и плода при развитии обострения бронхиальной астмы.
Осложнения бронхиальной астмы
Запущенная бронхиальная астма может негативно повлиять на качество вашей жизни и привести к:
- усталости;
- снижению или потере трудоспособности;
- психологическим проблемам, в том числе стрессу, повышенной тревожности и депрессии.
Если астма значительно снижает качество жизни, обратитесь к врачу. Возможно необходимо внести изменения в лечение и ваш индивидуальный план действий при астме, для усиления контроля над заболеванием.
В редких случаях бронхиальная астма может иметь тяжелые осложнения:
- пневмония (воспаление легких);
- коллапс (сжатие) части или целого легкого;
- дыхательная недостаточность (содержание кислорода в крови становится опасно низким или уровень углекислого газа — слишком высоким);
- астматический статус (тяжелый приступ астмы, который не поддается лечению).
Все перечисленные осложнения опасны для жизни и требуют лечения.
От Бронхиальной астмы умирает 250 000 человек в год во всем мире. В России один из самых высоких коэффициентов смертности от этого заболевания — 1,5–2 на 100 000 населения.
К какому врачу обратиться при астме?
С помощью сервиса НаПоправку вы можете выбрать пульмонолога для лечения и даигностики астмы.