From Wikipedia, the free encyclopedia
An explanation of the superscripts and subscripts seen in atomic number notation. Atomic number is the number of protons, and therefore also the total positive charge, in the atomic nucleus.
The Rutherford–Bohr model of the hydrogen atom (Z = 1) or a hydrogen-like ion (Z > 1). In this model it is an essential feature that the photon energy (or frequency) of the electromagnetic radiation emitted (shown) when an electron jumps from one orbital to another be proportional to the mathematical square of atomic charge (Z2). Experimental measurement by Henry Moseley of this radiation for many elements (from Z = 13 to 92) showed the results as predicted by Bohr. Both the concept of atomic number and the Bohr model were thereby given scientific credence.
The atomic number or nuclear charge number (symbol Z) of a chemical element is the charge number of an atomic nucleus. For ordinary nuclei, this is equal to the proton number (np) or the number of protons found in the nucleus of every atom of that element. The atomic number can be used to uniquely identify ordinary chemical elements. In an ordinary uncharged atom, the atomic number is also equal to the number of electrons.
For an ordinary atom, the sum of the atomic number Z and the neutron number N gives the atom’s atomic mass number A. Since protons and neutrons have approximately the same mass (and the mass of the electrons is negligible for many purposes) and the mass defect of the nucleon binding is always small compared to the nucleon mass, the atomic mass of any atom, when expressed in unified atomic mass units (making a quantity called the «relative isotopic mass»), is within 1% of the whole number A.
Atoms with the same atomic number but different neutron numbers, and hence different mass numbers, are known as isotopes. A little more than three-quarters of naturally occurring elements exist as a mixture of isotopes (see monoisotopic elements), and the average isotopic mass of an isotopic mixture for an element (called the relative atomic mass) in a defined environment on Earth, determines the element’s standard atomic weight. Historically, it was these atomic weights of elements (in comparison to hydrogen) that were the quantities measurable by chemists in the 19th century.
The conventional symbol Z comes from the German word Zahl ‘number’, which, before the modern synthesis of ideas from chemistry and physics, merely denoted an element’s numerical place in the periodic table, whose order was then approximately, but not completely, consistent with the order of the elements by atomic weights. Only after 1915, with the suggestion and evidence that this Z number was also the nuclear charge and a physical characteristic of atoms, did the word Atomzahl (and its English equivalent atomic number) come into common use in this context.
History[edit]
The periodic table and a natural number for each element[edit]
Loosely speaking, the existence or construction of a periodic table of elements creates an ordering of the elements, and so they can be numbered in order.
Dmitri Mendeleev claimed that he arranged his first periodic tables (first published on March 6, 1869) in order of atomic weight («Atomgewicht»).[1] However, in consideration of the elements’ observed chemical properties, he changed the order slightly and placed tellurium (atomic weight 127.6) ahead of iodine (atomic weight 126.9).[1][2] This placement is consistent with the modern practice of ordering the elements by proton number, Z, but that number was not known or suspected at the time.
A simple numbering based on periodic table position was never entirely satisfactory, however. Besides the case of iodine and tellurium, later several other pairs of elements (such as argon and potassium, cobalt and nickel) were known to have nearly identical or reversed atomic weights, thus requiring their placement in the periodic table to be determined by their chemical properties. However the gradual identification of more and more chemically similar lanthanide elements, whose atomic number was not obvious, led to inconsistency and uncertainty in the periodic numbering of elements at least from lutetium (element 71) onward (hafnium was not known at this time).
The Rutherford-Bohr model and van den Broek[edit]
In 1911, Ernest Rutherford gave a model of the atom in which a central nucleus held most of the atom’s mass and a positive charge which, in units of the electron’s charge, was to be approximately equal to half of the atom’s atomic weight, expressed in numbers of hydrogen atoms. This central charge would thus be approximately half the atomic weight (though it was almost 25% different from the atomic number of gold (Z = 79, A = 197), the single element from which Rutherford made his guess). Nevertheless, in spite of Rutherford’s estimation that gold had a central charge of about 100 (but was element Z = 79 on the periodic table), a month after Rutherford’s paper appeared, Antonius van den Broek first formally suggested that the central charge and number of electrons in an atom was exactly equal to its place in the periodic table (also known as element number, atomic number, and symbolized Z). This proved eventually to be the case.
Moseley’s 1913 experiment[edit]
The experimental position improved dramatically after research by Henry Moseley in 1913.[3] Moseley, after discussions with Bohr who was at the same lab (and who had used Van den Broek’s hypothesis in his Bohr model of the atom), decided to test Van den Broek’s and Bohr’s hypothesis directly, by seeing if spectral lines emitted from excited atoms fitted the Bohr theory’s postulation that the frequency of the spectral lines be proportional to the square of Z.
To do this, Moseley measured the wavelengths of the innermost photon transitions (K and L lines) produced by the elements from aluminum (Z = 13) to gold (Z = 79) used as a series of movable anodic targets inside an x-ray tube.[4] The square root of the frequency of these photons (x-rays) increased from one target to the next in an arithmetic progression. This led to the conclusion (Moseley’s law) that the atomic number does closely correspond (with an offset of one unit for K-lines, in Moseley’s work) to the calculated electric charge of the nucleus, i.e. the element number Z. Among other things, Moseley demonstrated that the lanthanide series (from lanthanum to lutetium inclusive) must have 15 members—no fewer and no more—which was far from obvious from known chemistry at that time.
Missing elements[edit]
After Moseley’s death in 1915, the atomic numbers of all known elements from hydrogen to uranium (Z = 92) were examined by his method. There were seven elements (with Z < 92) which were not found and therefore identified as still undiscovered, corresponding to atomic numbers 43, 61, 72, 75, 85, 87 and 91.[5] From 1918 to 1947, all seven of these missing elements were discovered.[6] By this time, the first four transuranium elements had also been discovered, so that the periodic table was complete with no gaps as far as curium (Z = 96).
The proton and the idea of nuclear electrons[edit]
In 1915, the reason for nuclear charge being quantized in units of Z, which were now recognized to be the same as the element number, was not understood. An old idea called Prout’s hypothesis had postulated that the elements were all made of residues (or «protyles») of the lightest element hydrogen, which in the Bohr-Rutherford model had a single electron and a nuclear charge of one. However, as early as 1907, Rutherford and Thomas Royds had shown that alpha particles, which had a charge of +2, were the nuclei of helium atoms, which had a mass four times that of hydrogen, not two times. If Prout’s hypothesis were true, something had to be neutralizing some of the charge of the hydrogen nuclei present in the nuclei of heavier atoms.
In 1917, Rutherford succeeded in generating hydrogen nuclei from a nuclear reaction between alpha particles and nitrogen gas,[7] and believed he had proven Prout’s law. He called the new heavy nuclear particles protons in 1920 (alternate names being proutons and protyles). It had been immediately apparent from the work of Moseley that the nuclei of heavy atoms have more than twice as much mass as would be expected from their being made of hydrogen nuclei, and thus there was required a hypothesis for the neutralization of the extra protons presumed present in all heavy nuclei. A helium nucleus was presumed to be composed of four protons plus two «nuclear electrons» (electrons bound inside the nucleus) to cancel two of the charges. At the other end of the periodic table, a nucleus of gold with a mass 197 times that of hydrogen was thought to contain 118 nuclear electrons in the nucleus to give it a residual charge of +79, consistent with its atomic number.
The discovery of the neutron makes Z the proton number[edit]
All consideration of nuclear electrons ended with James Chadwick’s discovery of the neutron in 1932. An atom of gold now was seen as containing 118 neutrons rather than 118 nuclear electrons, and its positive nuclear charge now was realized to come entirely from a content of 79 protons. Since Moseley had previously shown that the atomic number Z of an element equals this positive charge, it was now clear that Z is identical to the number of protons of its nuclei.
Chemical properties[edit]
Each element has a specific set of chemical properties as a consequence of the number of electrons present in the neutral atom, which is Z (the atomic number). The configuration of these electrons follows from the principles of quantum mechanics. The number of electrons in each element’s electron shells, particularly the outermost valence shell, is the primary factor in determining its chemical bonding behavior. Hence, it is the atomic number alone that determines the chemical properties of an element; and it is for this reason that an element can be defined as consisting of any mixture of atoms with a given atomic number.
New elements[edit]
The quest for new elements is usually described using atomic numbers. As of 2023, all elements with atomic numbers 1 to 118 have been observed. Synthesis of new elements is accomplished by bombarding target atoms of heavy elements with ions, such that the sum of the atomic numbers of the target and ion elements equals the atomic number of the element being created. In general, the half-life of a nuclide becomes shorter as atomic number increases,[citation needed] though undiscovered nuclides with certain «magic» numbers of protons and neutrons may have relatively longer half-lives and comprise an island of stability.
A hypothetical element composed only of neutrons has also been proposed and would have atomic number 0.
See also[edit]
- Atomic theory
- Chemical element
- Effective atomic number (disambiguation)
- Even and odd atomic nuclei
- Exotic atom
- History of the periodic table
- List of elements by atomic number
- Mass number
- Neutron number
- Neutron–proton ratio
- Prout’s hypothesis
References[edit]
- ^ a b The Periodic Table of Elements, American Institute of Physics
- ^ The Development of the Periodic Table, Royal Society of Chemistry
- ^ Ordering the Elements in the Periodic Table, Royal Chemical Society
- ^ Moseley, H.G.J. (1913). «XCIII.The high-frequency spectra of the elements». Philosophical Magazine. Series 6. 26 (156): 1024–1034. doi:10.1080/14786441308635052. Archived from the original on 22 January 2010.
- ^ Eric Scerri, A tale of seven elements, (Oxford University Press 2013) ISBN 978-0-19-539131-2, p.47
- ^ Scerri chaps. 3–9 (one chapter per element)
- ^ Ernest Rutherford | NZHistory.net.nz, New Zealand history online. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.
From Wikipedia, the free encyclopedia
An explanation of the superscripts and subscripts seen in atomic number notation. Atomic number is the number of protons, and therefore also the total positive charge, in the atomic nucleus.
The Rutherford–Bohr model of the hydrogen atom (Z = 1) or a hydrogen-like ion (Z > 1). In this model it is an essential feature that the photon energy (or frequency) of the electromagnetic radiation emitted (shown) when an electron jumps from one orbital to another be proportional to the mathematical square of atomic charge (Z2). Experimental measurement by Henry Moseley of this radiation for many elements (from Z = 13 to 92) showed the results as predicted by Bohr. Both the concept of atomic number and the Bohr model were thereby given scientific credence.
The atomic number or nuclear charge number (symbol Z) of a chemical element is the charge number of an atomic nucleus. For ordinary nuclei, this is equal to the proton number (np) or the number of protons found in the nucleus of every atom of that element. The atomic number can be used to uniquely identify ordinary chemical elements. In an ordinary uncharged atom, the atomic number is also equal to the number of electrons.
For an ordinary atom, the sum of the atomic number Z and the neutron number N gives the atom’s atomic mass number A. Since protons and neutrons have approximately the same mass (and the mass of the electrons is negligible for many purposes) and the mass defect of the nucleon binding is always small compared to the nucleon mass, the atomic mass of any atom, when expressed in unified atomic mass units (making a quantity called the «relative isotopic mass»), is within 1% of the whole number A.
Atoms with the same atomic number but different neutron numbers, and hence different mass numbers, are known as isotopes. A little more than three-quarters of naturally occurring elements exist as a mixture of isotopes (see monoisotopic elements), and the average isotopic mass of an isotopic mixture for an element (called the relative atomic mass) in a defined environment on Earth, determines the element’s standard atomic weight. Historically, it was these atomic weights of elements (in comparison to hydrogen) that were the quantities measurable by chemists in the 19th century.
The conventional symbol Z comes from the German word Zahl ‘number’, which, before the modern synthesis of ideas from chemistry and physics, merely denoted an element’s numerical place in the periodic table, whose order was then approximately, but not completely, consistent with the order of the elements by atomic weights. Only after 1915, with the suggestion and evidence that this Z number was also the nuclear charge and a physical characteristic of atoms, did the word Atomzahl (and its English equivalent atomic number) come into common use in this context.
History[edit]
The periodic table and a natural number for each element[edit]
Loosely speaking, the existence or construction of a periodic table of elements creates an ordering of the elements, and so they can be numbered in order.
Dmitri Mendeleev claimed that he arranged his first periodic tables (first published on March 6, 1869) in order of atomic weight («Atomgewicht»).[1] However, in consideration of the elements’ observed chemical properties, he changed the order slightly and placed tellurium (atomic weight 127.6) ahead of iodine (atomic weight 126.9).[1][2] This placement is consistent with the modern practice of ordering the elements by proton number, Z, but that number was not known or suspected at the time.
A simple numbering based on periodic table position was never entirely satisfactory, however. Besides the case of iodine and tellurium, later several other pairs of elements (such as argon and potassium, cobalt and nickel) were known to have nearly identical or reversed atomic weights, thus requiring their placement in the periodic table to be determined by their chemical properties. However the gradual identification of more and more chemically similar lanthanide elements, whose atomic number was not obvious, led to inconsistency and uncertainty in the periodic numbering of elements at least from lutetium (element 71) onward (hafnium was not known at this time).
The Rutherford-Bohr model and van den Broek[edit]
In 1911, Ernest Rutherford gave a model of the atom in which a central nucleus held most of the atom’s mass and a positive charge which, in units of the electron’s charge, was to be approximately equal to half of the atom’s atomic weight, expressed in numbers of hydrogen atoms. This central charge would thus be approximately half the atomic weight (though it was almost 25% different from the atomic number of gold (Z = 79, A = 197), the single element from which Rutherford made his guess). Nevertheless, in spite of Rutherford’s estimation that gold had a central charge of about 100 (but was element Z = 79 on the periodic table), a month after Rutherford’s paper appeared, Antonius van den Broek first formally suggested that the central charge and number of electrons in an atom was exactly equal to its place in the periodic table (also known as element number, atomic number, and symbolized Z). This proved eventually to be the case.
Moseley’s 1913 experiment[edit]
The experimental position improved dramatically after research by Henry Moseley in 1913.[3] Moseley, after discussions with Bohr who was at the same lab (and who had used Van den Broek’s hypothesis in his Bohr model of the atom), decided to test Van den Broek’s and Bohr’s hypothesis directly, by seeing if spectral lines emitted from excited atoms fitted the Bohr theory’s postulation that the frequency of the spectral lines be proportional to the square of Z.
To do this, Moseley measured the wavelengths of the innermost photon transitions (K and L lines) produced by the elements from aluminum (Z = 13) to gold (Z = 79) used as a series of movable anodic targets inside an x-ray tube.[4] The square root of the frequency of these photons (x-rays) increased from one target to the next in an arithmetic progression. This led to the conclusion (Moseley’s law) that the atomic number does closely correspond (with an offset of one unit for K-lines, in Moseley’s work) to the calculated electric charge of the nucleus, i.e. the element number Z. Among other things, Moseley demonstrated that the lanthanide series (from lanthanum to lutetium inclusive) must have 15 members—no fewer and no more—which was far from obvious from known chemistry at that time.
Missing elements[edit]
After Moseley’s death in 1915, the atomic numbers of all known elements from hydrogen to uranium (Z = 92) were examined by his method. There were seven elements (with Z < 92) which were not found and therefore identified as still undiscovered, corresponding to atomic numbers 43, 61, 72, 75, 85, 87 and 91.[5] From 1918 to 1947, all seven of these missing elements were discovered.[6] By this time, the first four transuranium elements had also been discovered, so that the periodic table was complete with no gaps as far as curium (Z = 96).
The proton and the idea of nuclear electrons[edit]
In 1915, the reason for nuclear charge being quantized in units of Z, which were now recognized to be the same as the element number, was not understood. An old idea called Prout’s hypothesis had postulated that the elements were all made of residues (or «protyles») of the lightest element hydrogen, which in the Bohr-Rutherford model had a single electron and a nuclear charge of one. However, as early as 1907, Rutherford and Thomas Royds had shown that alpha particles, which had a charge of +2, were the nuclei of helium atoms, which had a mass four times that of hydrogen, not two times. If Prout’s hypothesis were true, something had to be neutralizing some of the charge of the hydrogen nuclei present in the nuclei of heavier atoms.
In 1917, Rutherford succeeded in generating hydrogen nuclei from a nuclear reaction between alpha particles and nitrogen gas,[7] and believed he had proven Prout’s law. He called the new heavy nuclear particles protons in 1920 (alternate names being proutons and protyles). It had been immediately apparent from the work of Moseley that the nuclei of heavy atoms have more than twice as much mass as would be expected from their being made of hydrogen nuclei, and thus there was required a hypothesis for the neutralization of the extra protons presumed present in all heavy nuclei. A helium nucleus was presumed to be composed of four protons plus two «nuclear electrons» (electrons bound inside the nucleus) to cancel two of the charges. At the other end of the periodic table, a nucleus of gold with a mass 197 times that of hydrogen was thought to contain 118 nuclear electrons in the nucleus to give it a residual charge of +79, consistent with its atomic number.
The discovery of the neutron makes Z the proton number[edit]
All consideration of nuclear electrons ended with James Chadwick’s discovery of the neutron in 1932. An atom of gold now was seen as containing 118 neutrons rather than 118 nuclear electrons, and its positive nuclear charge now was realized to come entirely from a content of 79 protons. Since Moseley had previously shown that the atomic number Z of an element equals this positive charge, it was now clear that Z is identical to the number of protons of its nuclei.
Chemical properties[edit]
Each element has a specific set of chemical properties as a consequence of the number of electrons present in the neutral atom, which is Z (the atomic number). The configuration of these electrons follows from the principles of quantum mechanics. The number of electrons in each element’s electron shells, particularly the outermost valence shell, is the primary factor in determining its chemical bonding behavior. Hence, it is the atomic number alone that determines the chemical properties of an element; and it is for this reason that an element can be defined as consisting of any mixture of atoms with a given atomic number.
New elements[edit]
The quest for new elements is usually described using atomic numbers. As of 2023, all elements with atomic numbers 1 to 118 have been observed. Synthesis of new elements is accomplished by bombarding target atoms of heavy elements with ions, such that the sum of the atomic numbers of the target and ion elements equals the atomic number of the element being created. In general, the half-life of a nuclide becomes shorter as atomic number increases,[citation needed] though undiscovered nuclides with certain «magic» numbers of protons and neutrons may have relatively longer half-lives and comprise an island of stability.
A hypothetical element composed only of neutrons has also been proposed and would have atomic number 0.
See also[edit]
- Atomic theory
- Chemical element
- Effective atomic number (disambiguation)
- Even and odd atomic nuclei
- Exotic atom
- History of the periodic table
- List of elements by atomic number
- Mass number
- Neutron number
- Neutron–proton ratio
- Prout’s hypothesis
References[edit]
- ^ a b The Periodic Table of Elements, American Institute of Physics
- ^ The Development of the Periodic Table, Royal Society of Chemistry
- ^ Ordering the Elements in the Periodic Table, Royal Chemical Society
- ^ Moseley, H.G.J. (1913). «XCIII.The high-frequency spectra of the elements». Philosophical Magazine. Series 6. 26 (156): 1024–1034. doi:10.1080/14786441308635052. Archived from the original on 22 January 2010.
- ^ Eric Scerri, A tale of seven elements, (Oxford University Press 2013) ISBN 978-0-19-539131-2, p.47
- ^ Scerri chaps. 3–9 (one chapter per element)
- ^ Ernest Rutherford | NZHistory.net.nz, New Zealand history online. Nzhistory.net.nz (19 October 1937). Retrieved on 2011-01-26.
Загрузить PDF
Загрузить PDF
Атомный номер элемента — это число протонов в ядре одного атома этого элемента. Атомный номер элемента или изотопа остается постоянным, поэтому с его помощью можно узнать другие величины, например, количество электронов и нейтронов в атоме.
-
1
Найдите периодическую систему химических элементов (таблицу Менделеева). Если хотите, воспользуйтесь таблицей в этой статье. У каждого элемента свой атомный номер, а элементы в таблице упорядочены по атомным номерам. Найдите таблицу Менделеева или просто запомните ее.
- Таблицу Менделеева можно найти в большинстве учебников по химии.
-
2
Найдите нужный элемент. В таблице приводится полное название элемента и его химический символ (например, Hg для ртути). Если у вас не получается найти элемент, в поисковой системе введите «химический символ <название элемента>».
-
3
Найдите атомный номер. Как правило, он находится в верхнем левом или верхнем правом углу ячейки элемента, но может быть и в другом месте. Атомный номер всегда выражен целым числом.
- Если вы видите десятичную дробь, это атомная масса.
-
4
Убедитесь, что нашли атомный номер. Элементы таблицы упорядочены по возрастанию атомных номеров. Если атомный номер нужного элемента равен «33», то атомный номер предыдущего элемента должен быть равен «32», а следующего элемента — «34». Если это так, вы нашли атомный номер.
- Иногда таблица выглядит так, что после бария (56) и радия (88) есть пустые ячейки. На самом деле они не пустые — соответствующие элементы расположены внизу таблицы. Это сделано для того, чтобы записать таблицу в определенной форме.
-
5
Запомните, что такое атомный номер. Атомный номер — это число протонов в ядре одного атома элемента.[1]
Это фундаментальная величина, характеризующая элемент. Количество протонов определяет общий электрический заряд ядра, который указывает на число электронов, вращающихся вокруг атома. Поскольку электроны участвуют почти во всех химических взаимодействиях, атомный номер косвенно устанавливает большинство физических и химических свойств элемента.- Другими словами, любой атом с восемью протонами является атомом кислорода. Два атома кислорода могут иметь разное количество нейтронов или электронов (если один из атомов является ионом), но у них всегда будет по восемь протонов.
Реклама
-
1
Выясните атомный вес. В таблице атомный вес находится под названием элемента и представляет собой десятичную дробь с двумя или тремя знаками после десятичной запятой. Атомный вес — это средняя масса одного атома элемента по отношению к массе элемента, который находится в природе. Атомный вес измеряется в «атомных единицах массы» (а.е.м.).
- В некоторых учебниках и статьях атомный вес называется «относительной атомной массой».[2]
- В некоторых учебниках и статьях атомный вес называется «относительной атомной массой».[2]
-
2
Округлите атомный вес, чтобы найти массовое число. Массовое число — это общее количество протонов и нейтронов в одном атоме элемента. Это число легко найти: посмотрите в таблице атомный вес и округлите его до ближайшего целого числа. [3]
- Этот метод работает, потому что атомный вес нейтронов и протонов приблизительно равен 1 а.е.м., а атомный вес электронов приблизительно равен 0 а.е.м. Атомный вес измеряется довольно точно, поэтому в нем присутствуют цифры после десятичной запятой, но нас интересует только целое число, которое позволит узнать количество протонов и нейтронов.
- Помните, что атомный вес представляет собой усредненное значение. Например, среднее массовое число брома равно 80, но, как оказалось, массовое число одного атома брома практически всегда равно 79 или 81.[4]
-
3
Найдите количество электронов. Атом состоит из одинакового количества протонов и электронов, поэтому число электронов равно числу протонов. Электроны заряжены отрицательно, поэтому они уравновешивают и нейтрализуют протоны, которые заряжены положительно.[5]
- Если атом теряет или приобретает электроны, он превращается в ион, то есть становится электрически заряженным атомом.
-
4
Найдите количество нейтронов. Так как атомный номер = количество протонов, а массовое число = количество протонов + количество нейтронов, то число нейтронов = массовое число — атомный номер. Вот пара примеров:
- Один атом гелия (He) имеет массовое число 4 и атомный номер 2. Поэтому в нем 4 — 2 = 2 нейтрона.
- Атом серебра (Ag) имеет среднее массовое число 108 (из таблицы Менделеева) и атомный номер 47. Поэтому в атоме серебра 108 — 47 = 61 нейтрон.
-
5
Запомните, что такое изотопы. Изотоп — это разновидность атома с определенным количеством нейтронов. Если в химической задаче упоминается «Бор-10» или 10B, речь идет об элементах бора с массовым числом 10.[6]
Используйте это массовое число вместо массового числа бора из таблицы Менделеева.- Атомный номер изотопов никогда не меняется. Изотоп элемента имеет такое же количество протонов, как и сам элемент.
Реклама
Советы
- Атомный вес тяжелых элементов приводится в скобках. Это означает, что атомный вес вычислен на основе наиболее стабильного изотопа, а не среднего числа нескольких изотопов.[7]
(Это не влияет на атомный номер элемента.)
Реклама
Об этой статье
Эту страницу просматривали 14 660 раз.
Была ли эта статья полезной?
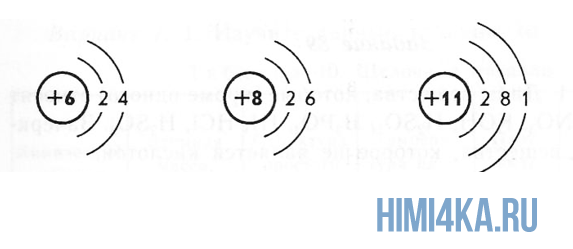
Порядковый номер и атомный номер химического элемента — синонимы, совпадающие понятия. В Периодической системе Менделеева элементы располагаются в порядке возрастания их номеров, начиная с водорода Н, порядковый или атомный номер, которого равен единице. Порядковый номер элемента равен заряду ядер его атомов в единицах элементарного электрического заряда или числу протонов в ядре, а для нейтрального атома — числу электронов в нем.
Термин «порядковый номер элемента» впервые ввел в употребление английский химик Ньюлендс в 1875 г. без какого-либо физического смысла. Этот термин вначале не имел никакого отношения к Периодической системе Менделеева. Термин «атомный номер элемента» ввел в употребление английский физик Эрнст Резерфорд в 1913 г. вместо термина «порядковый номер элемента» и настойчиво его внедрял. Так как Периодическая система Менделеева — это система химических элементов, а не атомов, их составляющих, то в настоящее время предпочтение отдается термину «порядковый номер элемента».
Если символ элемента Э, то порядковый номер элемента Z обозначается подстрочным индексом слева от символа, а массовое число А, или число нуклонов в ядрах элемента — надстрочным индексом слева, например AZЭ. Для изотопа золота-197 обозначение будет таким: 19779Аu, где 197 —массовое число А, 79 — порядковый номер Z.
«Вымирают» ли химические элементы?
Все вещества Земли образовались преимущественно из устойчивых атомов химических элементов. Но кроме них в земной коре, гидросфере и атмосфере присутствуют исчезающе малые количества радиоактивных элементов, таких как франций Fr, актиний Ас, технеций Тс, радон Rn, астат At, полоний Ро и некоторых других, которые относят к «вымершим» элементам. На ранних этапах формирования Земли их было много, но вследствие радиоактивного распада они постепенно превратились в устойчивые атомы ныне существующих элементов. В частности, технеций, элемент VIIБ группы Периодической системы, существовавший около 4 млрд. лет тому назад, исчез в результате радиоактивного распада: Тс-99 (е) Ru-99. Обнаруживаемые в некоторых минералах следы технеция порядка 10-9 г/кг — результат радиоактивного распада урана U и воздействия космических нейтронов n° на минералы, содержащие молибден Мо, ниобий Nb и рений Re.
Свои последние дни доживают в современную эпоху атомы калия-40, урана-235, актиния-235, астата-211 и некоторых других радиоактивных элементов.
В частности, было подсчитано, что в каждом килограмме урана через 100 млн. лет образуется 13 г свинца РЬ и 2 г гелия Не. А через 4 млрд. лет урана на Земле не останется. В бывших месторождениях его минералов найдут только соединения свинца, а атмосфера станет богаче гелием.
А Б В Г Д Е Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
а́томный
Рядом по алфавиту:
а́том , -а
атома́рный
атомиза́тор , -а
атомиза́ция , -и
атоми́зм , -а
атоми́ст , -а
атоми́стика , -и
атомисти́ческий
атомифика́ция , -и
атоми́ческий
а́томник , -а
а́томно-абсорбцио́нный
а́томно-водоро́дный
а́томно-молекуля́рный
а́томно-структу́рный
а́томный
атомохо́д , -а
а́томщик , -а
атона́льность , -и
атона́льный
атони́ческий
атони́я , -и
атофа́н , -а
атравмати́ческий
атрази́н , -а (гербицид)
атрамента́рный , (свойство вина)
атрези́я , -и
атрениро́ванность , -и
атрениро́ванный , кр. ф. -ан, -ана
атрепси́я , -и
атрибу́т , -а
- Порядковый номер элемента
-
Заря́довое число́ атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) — количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому номеру соответствующего ядру химического элемента в таблице Менделеева.
Термин «атомный» или «порядковый» номер обычно используется в атомной физике и химии, тогда как эквивалентный термин «зарядовое число» — в физике ядра. В неионизированном атоме количество электронов в электронных оболочках совпадает с зарядовым числом.
Зарядовое число обычно обозначается буквой Z. Ядра с одинаковым зарядовым числом, но различным массовым числом A (которое равно сумме числа протонов Z и числа нейтронов N) являются различными изотопами одного и того же химического элемента, поскольку именно заряд ядра определяет структуру электронной оболочки атома и, следовательно, его химические свойства.
Wikimedia Foundation.
2010.
Смотреть что такое «Порядковый номер элемента» в других словарях:
-
порядковый номер элемента — атомное число … Cловарь химических синонимов I
-
ПОРЯДКОВЫЙ НОМЕР — элемента, то же, что (см. АТОМНЫЙ НОМЕР). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983. ПОРЯДКОВЫЙ НОМЕР … Физическая энциклопедия
-
Порядковый номер — Термин, используемый, где необходима упорядоченость информации; Может означать: Порядковый номер элемента в таблице Менделеева, равный зарядовому числу. Порядковый номер единицы … Википедия
-
порядковый номер порождающего элемента — — [http://www.iks media.ru/glossary/index.html?glossid=2400324] Тематики электросвязь, основные понятия EN child sequence number … Справочник технического переводчика
-
ПОРЯДКОВЫЙ НОМЕР — химического элемента то же, что атомный номер … Большой Энциклопедический словарь
-
ПОРЯДКОВЫЙ НОМЕР — хим. элемента то же, что (см.) … Большая политехническая энциклопедия
-
Порядковый номер — номер места, занимаемого химическим элементом в периодической системе элементов (См. Периодическая система элементов) Д. И. Менделеева; то же, что Атомный номер элемента … Большая советская энциклопедия
-
Порядковый номер химического элемента — Зарядовое число атомного ядра (синонимы: атомный номер, атомное число, порядковый номер химического элемента) количество протонов в атомном ядре. Зарядовое число равно заряду ядра в единицах элементарного заряда и одновременно равно порядковому… … Википедия
-
порядковый номер — химического элемента, то же, что атомный номер. * * * ПОРЯДКОВЫЙ НОМЕР ПОРЯДКОВЫЙ НОМЕР химического элемента, то же, что атомный номер (см. АТОМНЫЙ НОМЕР) … Энциклопедический словарь
-
ПОРЯДКОВЫЙ НОМЕР — хим. элемента, то же, что атомный номер … Естествознание. Энциклопедический словарь

Слова русского языка,
поиск и разбор слов онлайн
- Слова русского языка
- А
- атом
Правильно слово пишется: а́том
Ударение падает на 1-й слог с буквой а.
Всего в слове 4 буквы, 2 гласных, 2 согласных, 2 слога.
Гласные: а, о;
Согласные: т, м.
Номера букв в слове
Номера букв в слове «атом» в прямом и обратном порядке:
- 4
а
1 - 3
т
2 - 2
о
3 - 1
м
4
Разбор по составу
Разбор по составу (морфемный разбор) слова атом делается следующим образом:
атом
Морфемы слова: атом — корень, нулевое окончание, атом — основа слова.
- Слова русского языка
- Русский язык
- О сайте
- Подборки слов
- Поиск слов по маске
- Составление словосочетаний
- Словосочетаний из предложений
- Деление слов на слоги
- Словари
- Орфографический словарь
- Словарь устаревших слов
- Словарь новых слов
- Орфография
- Орфограммы
- Проверка ошибок в словах
- Исправление ошибок
- Лексика
- Омонимы
- Устаревшие слова
- Заимствованные слова
- Новые слова
- Диалекты
- Слова-паразиты
- Сленговые слова
- Профессиональные слова
- Интересные слова
Срок регистрации для домена закончился.
АТОМНЫЙ НОМЕР
- АТОМНЫЙ НОМЕР
- АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома.
Современная энциклопедия.
2000.
Смотреть что такое «АТОМНЫЙ НОМЕР» в других словарях:
-
АТОМНЫЙ НОМЕР — (обозначение Z), число протонов в ядре атома элемента, равное числу электронов, движущихся вокруг этого ядра. Атомный номер ставят в виде нижнего индекса перед символом элемента; например, атомный номер углерода записывается как 6С. Атомный номер … Научно-технический энциклопедический словарь
-
АТОМНЫЙ НОМЕР — (порядковый номер) Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома … Большой Энциклопедический словарь
-
АТОМНЫЙ НОМЕР — (порядковый номер) номер элемента в периодической системе элементов. Равен числу протонов в ат. ядре. Определяет химические и большинство физических св в атома. Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А … Физическая энциклопедия
-
Атомный номер — Atomic number номер химического элемента в периодической системе элементов; равен числу протонов в атомном ядре. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
-
Атомный номер — АТОМНЫЙ НОМЕР, порядковый номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре, определяет химические и большинство физических свойств атома. … Иллюстрированный энциклопедический словарь
-
АТОМНЫЙ НОМЕР — порядковый номер хим. элемента в Периодической системе элементов (см.). А н. равен числу протонов в атомном ядре, которое, в свою очередь, равно числу электронов (см.). А. н. определяет хим. и большинство физ. свойств атома … Большая политехническая энциклопедия
-
атомный номер — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN atomic number … Справочник технического переводчика
-
атомный номер — порядковый номер, Z, номер химического элемента в периодической системе элементов. Равен числу протонов в атомном ядре и определяет химические и большинство физических свойств атома. * * * АТОМНЫЙ НОМЕР АТОМНЫЙ НОМЕР (порядковый номер), Z, номер… … Энциклопедический словарь
-
атомный номер — atominis skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Cheminio elemento eilės numeris periodinėje elementų sistemoje. Apibūdina atomo branduolio protonų skaičių, taip pat atitinkamo neutraliojo atomo elektronų skaičių.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
-
атомный номер — atominis skaičius statusas T sritis Standartizacija ir metrologija apibrėžtis Protonų skaičius atomo branduolyje. atitikmenys: angl. atomic number; charge number; ordinal number; proton number vok. Atomnummer, f; Atomzahl, f; Kernladungszahl, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Содержание
- Основы строения атома
- Состав ядра атома
- Атомная единица массы
- Порядковый номер атома и атомная масса элемента
Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
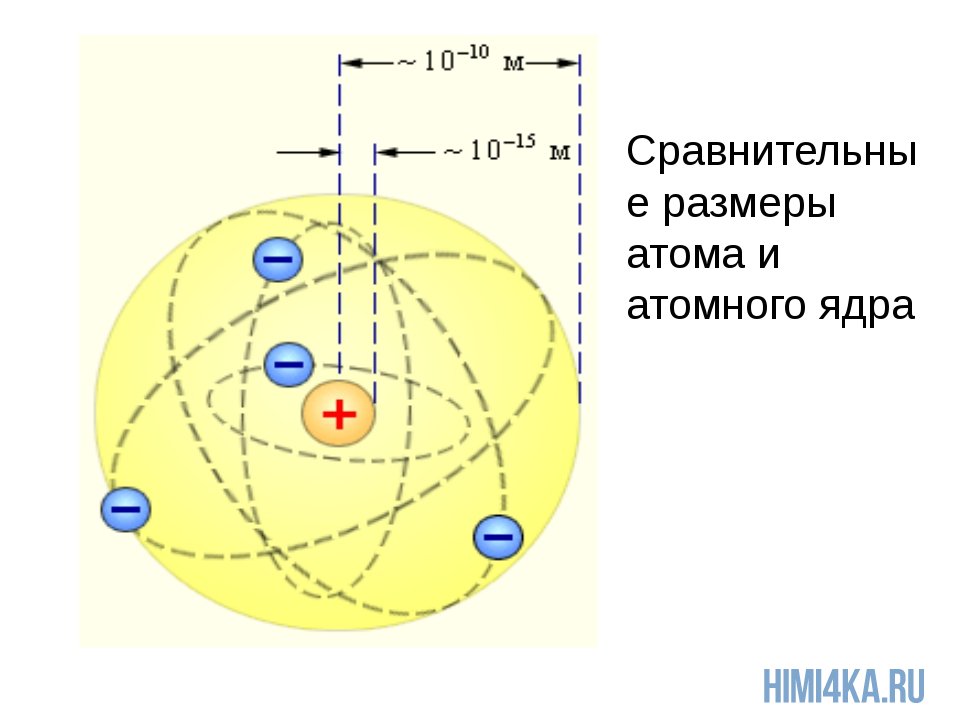
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×1023 а.е.м и наоборот 1 а.е.м. = 1,66×10-24 г. Число 6,022×1023 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10-19 | 1,67·10-24 | 1,00728 |
| Нейтрон | 0 | 1,67·10-24 | 1,00866 |
| Электрон | -1,6·10-19 | 9,10·10-28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
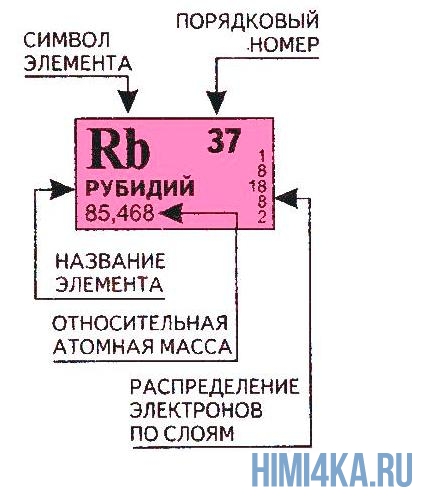
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Download Article
Download Article
An element’s atomic number is the number of protons in the nucleus of a single atom of that element. The atomic number of an element or isotope cannot change, so you can use the atomic number to help figure out other characteristics, such as the number of electrons and neutrons in an atom.
-
1
Find a copy of the periodic table. We’ve got one here if you don’t have one handy. Every single element has a different atomic number, and the elements are ordered on the table according to their atomic numbers. It’s either find a copy of the periodic table, or memorize one.[1]
- Most chemistry textbooks have a periodic table printed on the inside cover.
-
2
Find the element you’re studying. Most periodic tables include the full name of the elements, as well as the chemical symbol (such as Hg for Mercury). If you’re having trouble finding it, search online for «chemical symbol» followed by the name of the element.
Advertisement
-
3
Look for the atomic number. The atomic number is usually in the top left or top right corner of the element’s box, but it could be in a different spot. This is always a whole number.
- If the number includes a decimal point, you’re probably looking at atomic mass instead.
-
4
Confirm based on nearby elements. The periodic table is arranged in order of atomic number. If your element’s atomic number is «33,» the element to the left should be «32» and the element to the right should have a «34.» If this pattern holds true, you have definitely found the atomic number.
- You may see gaps after elements 56 (Barium) and 88 (Radium). There’s no actual gap; the elements with those atomic numbers are located in two rows below the rest of the chart. They are only separated like this to fit the periodic table in a more narrow shape.
-
5
Understand atomic number. An element’s atomic number has a simple definition: the number of protons in one atom of that element.[2]
This is the fundamental definition of an element. The number of protons determines the total electric charge of the nucleus, which determines how many electrons the atom can support. Because electrons are responsible for almost all chemical interactions, the atomic number indirectly sets almost all of the element’s physical and chemical properties.- To put it another way, every atom with eight protons is an oxygen atom. Two oxygen atoms might have different numbers of neutrons or (if one is an ion) different numbers of electrons, but they will always have eight protons each.
Advertisement
-
1
Find the atomic weight. The atomic weight is typically printed below the element name on the periodic table, usually to two or three decimal places. This is the average mass of one atom of the element, weighted to what you would expect to find in nature. This number is in «atomic mass units» (AMU).[3]
- Some scientists prefer the term «relative atomic mass» instead of atomic weight.
-
2
Round to the mass number. The mass number is the total number of protons and neutrons in one atom of an element. This is easy to find: just take the atomic weight printed on the periodic table, and round to the nearest whole number.[4]
- This works because neutrons and protons are both very close to 1 AMU, and electrons are very close to 0 AMU. The atomic weight uses precise measurements to get the decimal value, but we’re only interested in the whole numbers that tell us the number of protons and neutrons.
- Remember, if you use the atomic weight, you’re getting an average for a typical sample. A bromine sample has an average mass number of 80, but as it turns out, a single bromine atom almost always has a mass number of 79 or 81.[5]
-
3
Find the number of electrons. Atoms contain the same number of protons and electrons, so these numbers will be the same. Electrons are negatively charged, so they balance out and neutralize the protons, which are positively charged.[6]
- If an atom loses or gains electrons, it becomes an ion, which means that it is an electrically charged atom.
-
4
Calculate the number of neutrons. Now you know that atomic number = number of protons, and mass number = number of protons + number of neutrons. To find the number of neutrons in an element, subtract the atomic number from the mass number.[7]
Here are a couple example:- A single helium (He) atom has a mass number of 4 and an atomic number of 2. It must have 4 — 2 = 2 neutrons.
- A sample of silver (Ag) has an average mass number of 108 (based on the periodic table) and an atomic number of 47. On average, each silver atom in the sample has 108 — 47 = 61 neutrons.
-
5
Understand isotopes. An isotope is a specific form of an element, with a certain number of neutrons. If a chemistry problem mentions «boron-10» or «10B,» it’s talking about boron elements with a mass number of 10.[8]
Use this mass number instead of the values for «typical» boron.- Isotopes never change the atomic number. Every isotope of an element has the same number of protons.
Advertisement
Add New Question
-
Question
How do I find the atomic mass number?
shardaja sanders
Community Answer
Together, the number of protons and the number of neutrons determine an element’s mass number: mass number = protons + neutrons. If you want to calculate how many neutrons an atom has, you can simply subtract the number of protons, or atomic number, from the mass number.
-
Question
Where are the neutrons and protons on a periodic table?
The number of protons in one atom of an element is indicated by the atomic number, printed at the top of an element’s box on the periodic table. The number of neutrons is not listed on the periodic table. However, you can calculate the number of neutrons in an atom of an element. First, find the atomic weight, listed in the bottom of the element’s box. Round this number to the nearest whole number to obtain the mass number. Finally, subtract the atomic number from the mass number.
-
Question
What are the protons for gold?
The atomic number represents both electrons and protons, so the number of protons for gold is 79.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Some heavier elements have an atomic weight inside parentheses or brackets. This means the atomic weight is the exact mass of the most stable isotope, instead of an average of several isotopes. (This has no effect on the element’s atomic number.)
Advertisement
Video
References
About This Article
Article SummaryX
To find the atomic number of an element or isotope, look in a textbook or online to find a copy of the periodic table. Since most periodic tables only list chemical symbols, find a chart that lists the chemical symbol of the element you’re studying, like Ag for Silver or O for Oxygen, then find that symbol on the periodic table. The atomic number is usually in the top left or top right corner of the element’s box, and it should be a whole number. For more tips from our Science reviewer, including how to find the atomic weight or mass number, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 298,464 times.
Reader Success Stories
-
«The atomic number, the atomic weight and mass, protons,neutrons and electron are well understood. More power to…» more