Одноосновная кислота, в которой азот имеет степень окисления +3. Эта кислота слабая. Соли ее называются нитритами.
Формула
HNO2
Свойства азотистой кислоты
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Голубоватая жидкость в водном растворе, в чистом виде – газ |
| Молярная масса, г/моль | 47,013 |
| Плотность при 20°С, г/см3 | 1,685 |
| Температура разложения, °С | 0 |
| Температура кипения, °С | 82,6 |
| Растворимость в воде при 20°С, г/100 г | 548 |
Азотистая кислота крайне нестойка и ее растворы окрашены в голубой цвет из-за присутствия азотистого ангидрида (оксида азота (III)) N2O3. Существует в виде двух таутомерных формах. Для каждой из них известны свои ряды комплексных соединений и органических производных, содержащих соответственно нитрогруппу NO2 и нитритогруппу ONO. При 298 К равновесная смесь содержит 0,309 мольных долей I и 0,691 мольных долей II.
Химические свойства
В водных растворах азотистая кислота диссоциирует на ионы:
HNO2 ⇄ H+ + NO2—.
Азотистая кислота крайне нестойка и в водных растворах существует равновесие:
2HNO2 ⇄ H2O + N2O3 ⇄ H2O + NO + NO2.
При нагревании раствор HNO2 распадается:
3HNO2 = HNO3 + H2O + 2NO↑.
При действии окислителей азотистая кислота окисляется до азотной кислоты:
HNO2 + Cl2 + H2O = HNO3 + 2HCl;
HNO2 + H2O2 = HNO3 + H2O.
Азотистая кислота может проявлять окислительные свойства. В зависимости от природы восстановителя она может восстанавливаться до NO, N2O, NH2OH, NH3, например:
2HNO2 + 2HI = 2NO + I2 + 2H2O,
HNO2 + 4[H] = NH2OH + H2O.
При реакции с гидразином получается азотистоводородная кислота:
HNO2 + N2H4 = HN3 + 2H2O.
С ароматическими аминами при действии азотистой кислоты образуются соли диазония:
C6H5NH2 + HNO2 + HCl = [C6H5—N=N]Cl + H2O.
Получение
Лабораторные способы получения
Азотистую кислоту в лаборатории получают из оксида азота (III):
N2O3 + H20 = 2HNO2.
Другой способ получения – взаимодействие нитритов с сильными кислотами:
NaNO2 + HCI = NaCI + HNO2.
Получение в промышленности
Необходимости в промышленном получении нет, так как она крайне неустойчива, поэтому в тех случаях, когда она необходима для органического синтеза, ее получают непосредственно реакцией между нитритом натрия и соляной кислотой.
Применение
Азотистая кислота применяется при производстве азокрасителей.
Соли диазония легко обменивают диазогруппу на многие другие, что позволяет получать простые эфиры, фенолы, галогенпроизводные, нитрилы и др. Это позволяет получать из ароматических аминов эти соединения при органическом синтезе
Пример решения задачи
Осуществите следующие превращения:
NaNO2 → HNO2 → HN3 → NaN3.
Решение
NaNO2+HCI = NaCI+HNO2;
HNO2 + N2H4 = HN3 + 2H2O;
HN3 + NaOH = NaN3+ Н2О.
Тест по теме «Азотистая кислота»
From Wikipedia, the free encyclopedia
«Hono» redirects here. For Hönö, see Hönö.

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Nitrous acid |
|
| Systematic IUPAC name
Hydroxidooxidonitrogen |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| 3DMet |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.057 |
| EC Number |
|
|
Gmelin Reference |
983 |
| KEGG |
|
| MeSH | Nitrous+acid |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
HNO2 |
| Molar mass | 47.013 g/mol |
| Appearance | Pale blue solution |
| Density | Approx. 1 g/ml |
| Melting point | Only known in solution or as gas |
| Acidity (pKa) | 3.15 |
| Conjugate base | Nitrite |
| Hazards | |
| NFPA 704 (fire diamond) |
4 0 2 OX |
| Flash point | Non-flammable |
| Related compounds | |
|
Other anions |
Nitric acid |
|
Other cations |
Sodium nitrite Potassium nitrite Ammonium nitrite |
|
Related compounds |
Dinitrogen trioxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nitrous acid (molecular formula HNO
2) is a weak and monoprotic acid known only in solution, in the gas phase and in the form of nitrite (NO−
2) salts.[1] Nitrous acid is used to make diazonium salts from amines. The resulting diazonium salts are reagents in azo coupling reactions to give azo dyes.
Structure[edit]
In the gas phase, the planar nitrous acid molecule can adopt both a syn and an anti form. The anti form predominates at room temperature, and IR measurements indicate it is more stable by around 2.3 kJ/mol.[1]
-
syn form
Preparation[edit]
Nitrous acid is usually generated by acidification of aqueous solutions of sodium nitrite with a mineral acid. The acidification is usually conducted at ice temperatures, and the HNO2 is consumed in situ.[2][3] Free nitrous acid is unstable and decomposes rapidly.
Nitrous acid can also be produced by dissolving dinitrogen trioxide in water according to the equation
- N2O3 + H2O → 2 HNO2
Reactions[edit]
Nitrous acid is the main chemphore in the Liebermann reagent, used to spot-test for alkaloids.
Decomposition[edit]
Gaseous nitrous acid, which is rarely encountered, decomposes into nitrogen dioxide, nitric oxide, and water:
- 2 HNO2 → NO2 + NO + H2O
Nitrogen dioxide disproportionates into nitric acid and nitrous acid in aqueous solution:[4]
- 2 NO2 + H2O → HNO3 + HNO2
In warm or concentrated solutions, the overall reaction amounts to production of nitric acid, water, and nitric oxide:
- 3 HNO2 → HNO3 + 2 NO + H2O
The nitric oxide can subsequently be re-oxidized by air to nitric acid, making the overall reaction:
- 2 HNO2 + O2 → 2 HNO3
Reduction[edit]
With I− and Fe2+ ions, NO is formed:[5]
- 2 HNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 HNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + K2SO4
With Sn2+ ions, N2O is formed:
- 2 HNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 3 H2O + 2 KCl
With SO2 gas, NH2OH is formed:
- 2 HNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
With Zn in alkali solution, NH3 is formed:
- 5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn(OH)2
With N
2H+
5, both HN3 and (subsequently) N2 gas are formed:
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
Oxidation by nitrous acid has a kinetic control over thermodynamic control, this is best illustrated that dilute nitrous acid is able to oxidize I− to I2, but dilute nitric acid cannot.
- I2 + 2 e− ⇌ 2 I− Eo = +0.54 V
- NO−
3 + 3 H+ + 2 e− ⇌ HNO2 + H2O Eo = +0.93 V
- HNO2 + H+ + e− ⇌ NO + H2O Eo = +0.98 V
It can be seen that the values of Eo
cell for these reactions are similar, but nitric acid is a more powerful oxidizing agent. Base on the fact that dilute nitrous acid can oxidize iodide into iodine, it can be deduced that nitrous is a faster, rather than a more powerful, oxidizing agent than dilute nitric acid.[5]
Organic chemistry[edit]
Nitrous acid is used to prepare diazonium salts:
- HNO2 + ArNH2 + H+ → ArN+
2 + 2 H2O
where Ar is an aryl group.
Such salts are widely used in organic synthesis, e.g., for the Sandmeyer reaction and in the preparation azo dyes, brightly colored compounds that are the basis of a qualitative test for anilines.[6] Nitrous acid is used to destroy toxic and potentially explosive sodium azide. For most purposes, nitrous acid is usually formed in situ by the action of mineral acid on sodium nitrite:[7]
It is mainly blue in colour
- NaNO2 + HCl → HNO2 + NaCl
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Reaction with two α-hydrogen atoms in ketones creates oximes, which may be further oxidized to a carboxylic acid, or reduced to form amines. This process is used in the commercial production of adipic acid.
Nitrous acid reacts rapidly with aliphatic alcohols to produce alkyl nitrites, which are potent vasodilators:
- (CH3)2CHCH2CH2OH + HNO2 → (CH3)2CHCH2CH2ONO + H2O
The carcinogens called nitrosamines are produced, usually not intentionally, by the reaction of nitrous acid with secondary amines:
- HNO2 + R2NH → R2N-NO + H2O
Atmosphere of the Earth[edit]
Nitrous acid is involved in the ozone budget of the lower atmosphere, the troposphere. The heterogeneous reaction of nitric oxide (NO) and water produces nitrous acid. When this reaction takes place on the surface of atmospheric aerosols, the product readily photolyses to hydroxyl radicals.[8][9]
See also[edit]
- Demjanov rearrangement
- Nitric acid (HNO3)
- Nitrosyl-O-hydroxide
- Tiffeneau-Demjanov rearrangement
References[edit]
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. p. 462.
- ^ Y. Petit, M. Larchevêque (1998). «Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate». Org. Synth. 75: 37. doi:10.15227/orgsyn.075.0037.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser (2002). «Synthesis of 4-, 5-, and 6-methyl-2,2′-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2′-bipyridine». Org. Synth. 78: 51. doi:10.15227/orgsyn.078.0051.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^
Kameoka, Yohji; Pigford, Robert (February 1977). «Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous». Ind. Eng. Chem. Fundamen. 16 (1): 163–169. doi:10.1021/i160061a031. - ^ a b Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 15: The group 15 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 449. ISBN 978-0-13-175553-6.
- ^ Clarke, H. T.; Kirner, W. R. «Methyl Red» Organic Syntheses, Collected Volume 1, p.374 (1941). «Archived copy» (PDF). Archived from the original (PDF) on 2007-09-30. Retrieved 2007-07-26.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. doi:10.17226/4911. ISBN 978-0-309-05229-0.
- ^ Spataro, F; Ianniello, A (November 2014). «Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects». Journal of the Air & Waste Management Association. 64 (11): 1232–1250. doi:10.1080/10962247.2014.952846. PMID 25509545.
- ^ Anglada, Josef M.; Solé, Albert (November 2017). «The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals». The Journal of Physical Chemistry A. 121 (51): 9698–9707. Bibcode:2017JPCA..121.9698A. doi:10.1021/acs.jpca.7b10715. PMID 29182863.
From Wikipedia, the free encyclopedia
«Hono» redirects here. For Hönö, see Hönö.

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Nitrous acid |
|
| Systematic IUPAC name
Hydroxidooxidonitrogen |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| 3DMet |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.057 |
| EC Number |
|
|
Gmelin Reference |
983 |
| KEGG |
|
| MeSH | Nitrous+acid |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
HNO2 |
| Molar mass | 47.013 g/mol |
| Appearance | Pale blue solution |
| Density | Approx. 1 g/ml |
| Melting point | Only known in solution or as gas |
| Acidity (pKa) | 3.15 |
| Conjugate base | Nitrite |
| Hazards | |
| NFPA 704 (fire diamond) |
4 0 2 OX |
| Flash point | Non-flammable |
| Related compounds | |
|
Other anions |
Nitric acid |
|
Other cations |
Sodium nitrite Potassium nitrite Ammonium nitrite |
|
Related compounds |
Dinitrogen trioxide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Nitrous acid (molecular formula HNO
2) is a weak and monoprotic acid known only in solution, in the gas phase and in the form of nitrite (NO−
2) salts.[1] Nitrous acid is used to make diazonium salts from amines. The resulting diazonium salts are reagents in azo coupling reactions to give azo dyes.
Structure[edit]
In the gas phase, the planar nitrous acid molecule can adopt both a syn and an anti form. The anti form predominates at room temperature, and IR measurements indicate it is more stable by around 2.3 kJ/mol.[1]
-
syn form
Preparation[edit]
Nitrous acid is usually generated by acidification of aqueous solutions of sodium nitrite with a mineral acid. The acidification is usually conducted at ice temperatures, and the HNO2 is consumed in situ.[2][3] Free nitrous acid is unstable and decomposes rapidly.
Nitrous acid can also be produced by dissolving dinitrogen trioxide in water according to the equation
- N2O3 + H2O → 2 HNO2
Reactions[edit]
Nitrous acid is the main chemphore in the Liebermann reagent, used to spot-test for alkaloids.
Decomposition[edit]
Gaseous nitrous acid, which is rarely encountered, decomposes into nitrogen dioxide, nitric oxide, and water:
- 2 HNO2 → NO2 + NO + H2O
Nitrogen dioxide disproportionates into nitric acid and nitrous acid in aqueous solution:[4]
- 2 NO2 + H2O → HNO3 + HNO2
In warm or concentrated solutions, the overall reaction amounts to production of nitric acid, water, and nitric oxide:
- 3 HNO2 → HNO3 + 2 NO + H2O
The nitric oxide can subsequently be re-oxidized by air to nitric acid, making the overall reaction:
- 2 HNO2 + O2 → 2 HNO3
Reduction[edit]
With I− and Fe2+ ions, NO is formed:[5]
- 2 HNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 HNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + K2SO4
With Sn2+ ions, N2O is formed:
- 2 HNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 3 H2O + 2 KCl
With SO2 gas, NH2OH is formed:
- 2 HNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
With Zn in alkali solution, NH3 is formed:
- 5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn(OH)2
With N
2H+
5, both HN3 and (subsequently) N2 gas are formed:
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
Oxidation by nitrous acid has a kinetic control over thermodynamic control, this is best illustrated that dilute nitrous acid is able to oxidize I− to I2, but dilute nitric acid cannot.
- I2 + 2 e− ⇌ 2 I− Eo = +0.54 V
- NO−
3 + 3 H+ + 2 e− ⇌ HNO2 + H2O Eo = +0.93 V
- HNO2 + H+ + e− ⇌ NO + H2O Eo = +0.98 V
It can be seen that the values of Eo
cell for these reactions are similar, but nitric acid is a more powerful oxidizing agent. Base on the fact that dilute nitrous acid can oxidize iodide into iodine, it can be deduced that nitrous is a faster, rather than a more powerful, oxidizing agent than dilute nitric acid.[5]
Organic chemistry[edit]
Nitrous acid is used to prepare diazonium salts:
- HNO2 + ArNH2 + H+ → ArN+
2 + 2 H2O
where Ar is an aryl group.
Such salts are widely used in organic synthesis, e.g., for the Sandmeyer reaction and in the preparation azo dyes, brightly colored compounds that are the basis of a qualitative test for anilines.[6] Nitrous acid is used to destroy toxic and potentially explosive sodium azide. For most purposes, nitrous acid is usually formed in situ by the action of mineral acid on sodium nitrite:[7]
It is mainly blue in colour
- NaNO2 + HCl → HNO2 + NaCl
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
Reaction with two α-hydrogen atoms in ketones creates oximes, which may be further oxidized to a carboxylic acid, or reduced to form amines. This process is used in the commercial production of adipic acid.
Nitrous acid reacts rapidly with aliphatic alcohols to produce alkyl nitrites, which are potent vasodilators:
- (CH3)2CHCH2CH2OH + HNO2 → (CH3)2CHCH2CH2ONO + H2O
The carcinogens called nitrosamines are produced, usually not intentionally, by the reaction of nitrous acid with secondary amines:
- HNO2 + R2NH → R2N-NO + H2O
Atmosphere of the Earth[edit]
Nitrous acid is involved in the ozone budget of the lower atmosphere, the troposphere. The heterogeneous reaction of nitric oxide (NO) and water produces nitrous acid. When this reaction takes place on the surface of atmospheric aerosols, the product readily photolyses to hydroxyl radicals.[8][9]
See also[edit]
- Demjanov rearrangement
- Nitric acid (HNO3)
- Nitrosyl-O-hydroxide
- Tiffeneau-Demjanov rearrangement
References[edit]
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8. p. 462.
- ^ Y. Petit, M. Larchevêque (1998). «Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate». Org. Synth. 75: 37. doi:10.15227/orgsyn.075.0037.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser (2002). «Synthesis of 4-, 5-, and 6-methyl-2,2′-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2′-bipyridine». Org. Synth. 78: 51. doi:10.15227/orgsyn.078.0051.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^
Kameoka, Yohji; Pigford, Robert (February 1977). «Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous». Ind. Eng. Chem. Fundamen. 16 (1): 163–169. doi:10.1021/i160061a031. - ^ a b Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 15: The group 15 elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 449. ISBN 978-0-13-175553-6.
- ^ Clarke, H. T.; Kirner, W. R. «Methyl Red» Organic Syntheses, Collected Volume 1, p.374 (1941). «Archived copy» (PDF). Archived from the original (PDF) on 2007-09-30. Retrieved 2007-07-26.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. doi:10.17226/4911. ISBN 978-0-309-05229-0.
- ^ Spataro, F; Ianniello, A (November 2014). «Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects». Journal of the Air & Waste Management Association. 64 (11): 1232–1250. doi:10.1080/10962247.2014.952846. PMID 25509545.
- ^ Anglada, Josef M.; Solé, Albert (November 2017). «The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals». The Journal of Physical Chemistry A. 121 (51): 9698–9707. Bibcode:2017JPCA..121.9698A. doi:10.1021/acs.jpca.7b10715. PMID 29182863.
Как пишется в виде формулы азотная кислота
- пишется
- формулы
- азотная
- кислота
- 5 — 9 классы
- химия
спросил
12 Май, 18
от
200897_zn
(17 баллов)
в категории Химия
2 Ответы
0 голосов
ответил
12 Май, 18
от
Лера7575_zn
Начинающий
(108 баллов)
Лучший ответ
HNo3 вот формула вещества
ответил
12 Май, 18
от
Kutsenckosofia_zn
Начинающий
(417 баллов)
Один атом водорода, один атом азота, три атома кислорода (HNO3)
Добро пожаловать на сайт Ответы онлайн, где вы можете задавать вопросы и получать ответы от других членов сообщества.
…
Правильный ответ на вопрос 👍 «Как пишется в виде формулы азотная кислота …» по предмету 📗 Химия. Развернутая система поиска нашего сайта обязательно приведёт вас к нужной информации. Как вариант — оцените ответы на похожие вопросы. Но если вдруг и это не помогло — задавайте свой вопрос знающим оппонентам, которые быстро дадут на него ответ!
Искать готовые ответы
При сжигании этана образовался углекислый газ объемом 32 л. Какие объемы исходных газов было использовано? (н. у.)
Ответы (1)
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg (OH) 2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
Ответы (1)
Осуществите превращения Cu—CuO—CuSo4—Cu (OH) 2—CuCl2
Ответы (1)
Ксилол 100% консентрация, чем разбавить чтоб получить 40%
Ответы (1)
Запишите схемы образования химических связей для веществ состав которых отображают формулами kcl и cl2
Ответы (1)
Определите степень полимеризации полибутадиена, молекулярная масса которого 13500 г/моль.
Ответы (1)
Дано: BaCl2, NaOH, Na2SO4, AlCl3, HCl, K2CO3, CuSO3, Ba (NO3) 2 Нужно составить возможные реакции ионного обмена.
Ответы (1)
Опишите физические свойства присущие для веществ с молекулярными кристаллическими решетками Приведите примеры
Ответы (1)
Степень окисления J2
Ответы (1)
Определите массовую 10% раствора H2SO4 (плотность раствора H2SO4=1,069 г/мл)
Ответы (1)
Главная » ⭐️ Химия » Как пишется в виде формулы азотная кислота
ОТВЕТЫ
Один атом водорода, один атом азота, три атома кислорода (HNO3)
HNo3 вот формула вещества
138
Отв. дан
2019-04-14 10:45:23
Cerad
Автор 4eLoVeK задал вопрос в разделе Школы
Подскажите общие уравнения азотной кислоты. Напишите плз в ответы. и получил лучший ответ
Ответ от Вася Потанин[активный]
HNO3 азотная кислота
HNO2 fpjnbcnfz
Ответ от Геннадий[гуру]
Взаимодействие азотной кислоты с металлами:
Концентрированная — пассивирует железо, хром, алюминий. Не действует на платину, иридий, тантал, золото
С другими тяжёлыми металлами восстанавливается до NO2; с щелочными и щелочно-земельными металлами восстанавливается до N2O.
Разбавленная — с щелочно — земельными металлами с железом и цинком восстанавливается до аммиака;
с тяжёлыми металлами восстанавливается до NO.
Ответ от 3 ответа[гуру]
Привет! Вот подборка тем с похожими вопросами и ответами на Ваш вопрос: Подскажите общие уравнения азотной кислоты. Напишите плз в ответы.
Азотная кислота на Википедии
Посмотрите статью на википедии про Азотная кислота
- Как правильно пишется слово «азотный»
- Как правильно пишется слово «кислота»
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова предбанничек:
Ассоциации к словосочетанию «азотная кислота»
Синонимы к словосочетанию «азотная кислота»
Предложения со словосочетанием «азотная кислота»
- И берут его из почвы в виде солей азотной кислоты и аммония.
- Он промыл поверхность известняка в растворе азотной кислоты, надеясь, что кислота вытравит камень везде, кроме участков, защищённых восковой краской.
- При попадании в воду тетраоксид вызывает реакцию, результатом которой является образование азотной кислоты – химического соединения бурого цвета.
- (все предложения)
Цитаты из русской классики со словосочетанием «азотная кислота»
- Через две минуты Александров спрашивает самого себя с удивлением: «Где же моя усталость, недовольство и кислота?» Их нет, исчезли.
- В течение пяти недель доктор Любомудров не мог с достаточной ясностью определить болезнь пациента, а пациент не мог понять, физически болен он или его свалило с ног отвращение к жизни, к людям? Он не был мнительным, но иногда ему казалось, что в теле его работает острая кислота, нагревая мускулы, испаряя из них жизненную силу. Тяжелый туман наполнял голову, хотелось глубокого сна, но мучила бессонница и тихое, злое кипение нервов. В памяти бессвязно возникали воспоминания о прожитом, знакомые лица, фразы.
- Меня лично она возмущала, как живое воплощение всевозможной кислоты.
- (все
цитаты из русской классики)
Значение словосочетания «азотная кислота»
-
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. (Википедия)
Все значения словосочетания АЗОТНАЯ КИСЛОТА
| Азотистая кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Азотистая кислота |
| Химическая формула | HNO2 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 47.0134 а. е. м. |
| Молярная масса | 47.0134 г/моль |
| Плотность | 1.685 (жидк) г/см³ |
| Термические свойства | |
| Температура плавления | 42.35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 3.4 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7782-77-6] |
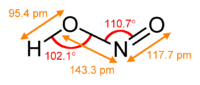
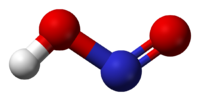
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Содержание
- 1 Строение
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Физиологическое действие
- 6 Источники
- 7 Ссылки
Строение
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
Вторая структура является более устойчивой. Так, для цис-HNO2(г) DG°f = −42,59 кДж/моль, а для транс-HNO2(г) DG = −44,65 кДж/моль.
Химические свойства
В водных растворах существует равновесие:
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
В то же время она способна окислять вещества, обладающие восстановительными свойствами:
Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:
Также она получается при растворении в воде оксида азота (IV) NO2:
Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
Физиологическое действие
Азотистая кислота токсична, причём обладает ярко выраженным мутагенным действием, поскольку является деаминирующим агентом.
Источники
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Ссылки
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Азотистая кислота
Брутто-формула:
HNO2
CAS# 7782-77-6
Названия
Русский:
- Азотистая кислота(IUPAC) [Wiki]
English:
- Hydroxidooxidonitrogen(IUPAC)
- Nitrous acid(IUPAC) [Wiki]
German:
- Hydrogennitrit
- Salpetrige Säure(IUPAC) [Wiki]
- Stickstoff(III)-säure
Español:
- Espíritu de nitro
- Espíritu de salitre
- Nitrato (III) de hidrógeno
- Nitrito de hidrógeno
- Stickstoff (III)-säure
- Ácido azotoso
- Ácido de Chile
- Ácido de nitro
- Ácido de salitre
- Ácido dioxonítrico (III)(IUPAC)
- Ácido nitroso [Wiki]
French:
- Acide nitreux(IUPAC) [Wiki]
- nitrite d’hydrogène(IUPAC)
Italiano:
- Acido nitroso [Wiki]
- acido diossonitrico(IUPAC)
日本語:
中文:
Варианты формулы:
H/$dots(LuTRu)O$dots(B)N//$dots(TBrRb)O
Реакции, в которых участвует Азотистая кислота
-
H{R} <=> H^+ + {R}^-
, где R =
F Cl Br I NO3 NO2 -
2HNO2 -> NO2 + NO + H2O
-
N2O3 + H2O -> 2HNO2
-
HN(CH3)2 + HNO2 -> ONN(CH3)2 + H2O
-
NOCl + H2O -> HNO2 + HCl
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O












