For the leavening agent of which baking soda is a common ingredient, see Baking powder.

|
||
|
||
Crystal structure |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
sodium hydrogencarbonate |
||
| Other names
Baking soda, bicarb (laboratory slang), bicarbonate of soda, nahcolite, natrium hydrogen carbonate, natron |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
4153970 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| EC Number |
|
|
| E number | E500(ii) (acidity regulators, …) | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Sodium+bicarbonate | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaHCO 3 |
|
| Molar mass | 84.0066 g mol−1 | |
| Appearance | White crystals | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | (Decomposes to sodium carbonate starting at 50 °C[1][6]) | |
|
Solubility in water |
|
|
| Solubility | 0.02 wt% acetone, 2.13 wt% methanol @22 °C.[4] insoluble in ethanol | |
| log P | −0.82 | |
| Acidity (pKa) |
|
|
|
Refractive index (nD) |
nα = 1.377 nβ = 1.501 nγ = 1.583 | |
| Structure | ||
|
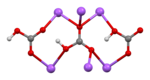
Crystal structure |
Monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
87.6 J/mol K[7] | |
|
Std molar |
101.7 J/mol K[7] | |
|
Std enthalpy of |
−950.8 kJ/mol[7] | |
|
Gibbs free energy (ΔfG⦵) |
−851.0 kJ/mol[7] | |
| Pharmacology | ||
|
ATC code |
B05CB04 (WHO) B05XA02 (WHO), QG04BQ01 (WHO) | |
|
Routes of |
Intravenous, oral | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Causes serious eye irritation | |
| NFPA 704 (fire diamond) |
2 0 1 |
|
| Flash point | Incombustible | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
4220 mg/kg (rat, oral)[8] | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Other anions |
Sodium carbonate | |
|
Other cations |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cupcakes baked with baking soda as a raising agent
Sodium bicarbonate (IUPAC name: sodium hydrogencarbonate[9]), commonly known as baking soda or bicarbonate of soda, is a chemical compound with the formula NaHCO3. It is a salt composed of a sodium cation (Na+) and a bicarbonate anion (HCO3−). Sodium bicarbonate is a white solid that is crystalline, but often appears as a fine powder. It has a slightly salty, alkaline taste resembling that of washing soda (sodium carbonate). The natural mineral form is nahcolite. It is a component of the mineral natron and is found dissolved in many mineral springs.[10]
Nomenclature[edit]
Because it has long been known and widely used, the salt has many different names such as baking soda, bread soda, cooking soda, and bicarbonate of soda and can often be found near baking powder in stores. The term baking soda is more common in the United States, while bicarbonate of soda is more common in Australia, United Kingdom and Ireland.[11] Abbreviated colloquial forms such as sodium bicarb, bicarb soda, bicarbonate, and bicarb are common.[12]
The word saleratus, from Latin sal æratus (meaning «aerated salt»), was widely used in the 19th century for both sodium bicarbonate and potassium bicarbonate.[13]
Its E number food additive code is E500.[14]
The prefix bi in bicarbonate comes from an outdated naming system predating molecular knowledge in reference to the two molar equivalents of carbon dioxide (known as carbonic acid in the ancient chemistry language) that potassium hydrocarbonate/bicarbonate releases upon decomposition to (di)potassium carbonate and to potassium oxide (potash).[15] The modern chemical formulas of these compounds now express their precise chemical compositions which were unknown when the name bi-carbonate of potash was coined (see also: bicarbonate).
Uses[edit]
Cooking[edit]
Leavening[edit]
In cooking, baking soda is primarily used in baking as a leavening agent. When it reacts with acid, carbon dioxide is released, which causes expansion of the batter and forms the characteristic texture and grain in cakes, quick breads, soda bread, and other baked and fried foods. The acid–base reaction can be generically represented as follows:[16]
- NaHCO3 + H+ → Na+ + CO2 + H2O
Acidic materials that induce this reaction include hydrogen phosphates, cream of tartar, lemon juice, yogurt, buttermilk, cocoa, and vinegar. Baking soda may be used together with sourdough, which is acidic, making a lighter product with a less acidic taste.[17]
Heat can also by itself cause sodium bicarbonate to act as a raising agent in baking because of thermal decomposition, releasing carbon dioxide at temperatures above 80 °C (180 °F), as follows:[18]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
When used this way on its own, without the presence of an acidic component (whether in the batter or by the use of a baking powder containing acid), only half the available CO2 is released (one CO2 molecule is formed for every two equivalents of NaHCO3). Additionally, in the absence of acid, thermal decomposition of sodium bicarbonate also produces sodium carbonate, which is strongly alkaline and gives the baked product a bitter, «soapy» taste and a yellow color. Since the reaction occurs slowly at room temperature, mixtures (cake batter, etc.) can be allowed to stand without rising until they are heated in the oven.[citation needed]
Baking powder[edit]
Baking powder, also sold for cooking, contains around 30% of bicarbonate, and various acidic ingredients which are activated by the addition of water, without the need for additional acids in the cooking medium.[19][20][21] Many forms of baking powder contain sodium bicarbonate combined with calcium acid phosphate, sodium aluminium phosphate, or cream of tartar.[22] Baking soda is alkaline; the acid used in baking powder avoids a metallic taste when the chemical change during baking creates sodium carbonate.[23]
Pyrotechnics[edit]
Sodium bicarbonate is one of the main components of the common «black snake» firework. The effect is caused by the thermal decomposition, which produces carbon dioxide gas to produce a long snake-like ash as a combustion product of the other main component, sucrose.[24] Sodium bicarbonate is also used to delay combustion reactions by releasing CO2 and H2O when heated, both of which are flame retardants.
Mild disinfectant[edit]
It has weak disinfectant properties,[25][26] and it may be an effective fungicide against some organisms.[27] Because baking soda will absorb musty smells, it has become a reliable method for used book sellers when making books less malodorous.[28]
Fire extinguisher[edit]
Sodium bicarbonate can be used to extinguish small grease or electrical fires by being thrown over the fire, as heating of sodium bicarbonate releases carbon dioxide.[29] However, it should not be applied to fires in deep fryers; the sudden release of gas may cause the grease to splatter.[29] Sodium bicarbonate is used in BC dry chemical fire extinguishers as an alternative to the more corrosive monoammonium phosphate in ABC extinguishers. The alkaline nature of sodium bicarbonate makes it the only dry chemical agent, besides Purple-K, that was used in large-scale fire suppression systems installed in commercial kitchens. Because it can act as an alkali, the agent has a mild saponification effect on hot grease, which forms a smothering, soapy foam.[citation needed]
Neutralization of acids[edit]
Sodium bicarbonate reacts spontaneously with acids, releasing CO2 gas as a reaction product. It is commonly used to neutralize unwanted acid solutions or acid spills in chemical laboratories.[30] It is not appropriate to use sodium bicarbonate to neutralize base[31] even though it is amphoteric, reacting with both acids and bases.[citation needed]
Agriculture[edit]
Sodium bicarbonate when applied on leaves, can prevent the growth of fungi; however, it does not kill the fungus. Excessive amount of sodium bicarbonate can cause discolouration of fruits (two percent solution) and chlorosis (one percent solution).[32]
Medical uses and health[edit]
Sodium bicarbonate mixed with water can be used as an antacid to treat acid indigestion and heartburn.[33] Its reaction with stomach acid produces salt, water, and carbon dioxide:
- NaHCO3 + HCl → NaCl + H2O + CO2(g)
A mixture of sodium bicarbonate and polyethylene glycol such as PegLyte,[34] dissolved in water and taken orally, is an effective gastrointestinal lavage preparation and laxative prior to gastrointestinal surgery, gastroscopy, etc.[citation needed]
Intravenous sodium bicarbonate in an aqueous solution is sometimes used for cases of acidosis, or when insufficient sodium or bicarbonate ions are in the blood.[35] In cases of respiratory acidosis, the infused bicarbonate ion drives the carbonic acid/bicarbonate buffer of plasma to the left, and thus raises the pH. For this reason, sodium bicarbonate is used in medically supervised cardiopulmonary resuscitation. Infusion of bicarbonate is indicated only when the blood pH is markedly low (< 7.1–7.0).[36]
HCO3− is used for treatment of hyperkalemia, as it will drive K+ back into cells during periods of acidosis.[37] Since sodium bicarbonate can cause alkalosis, it is sometimes used to treat aspirin overdoses. Aspirin requires an acidic environment for proper absorption, and a basic environment will diminish aspirin absorption in cases of overdose.[38] Sodium bicarbonate has also been used in the treatment of tricyclic antidepressant overdose.[39] It can also be applied topically as a paste, with three parts baking soda to one part water, to relieve some kinds of insect bites and stings (as well as accompanying swelling).[40]
Some alternative practitioners, such as Tullio Simoncini, have promoted baking soda as a cancer cure, which the American Cancer Society has warned against due to both its unproven effectiveness and potential danger in use.[41] Edzard Ernst has called the promotion of sodium bicarbonate as a cancer cure «one of the more sickening alternative cancer scams I have seen for a long time».[42]
Sodium bicarbonate can be added to local anesthetics, to speed up the onset of their effects and make their injection less painful.[43] It is also a component of Moffett’s solution, used in nasal surgery.[citation needed]
It has been proposed that acidic diets weaken bones.[44] One systematic meta-analysis of the research shows no such effect.[45] Another also finds that there is no evidence that alkaline diets improve bone health, but suggests that there «may be some value» to alkaline diets for other reasons.[46]
Antacid (such as baking soda) solutions have been prepared and used by protesters to alleviate the effects of exposure to tear gas during protests.[failed verification][47]
Similarly to its use in baking, sodium bicarbonate is used together with a mild acid such as tartaric acid as the excipient in effervescent tablets: when such a tablet is dropped in a glass of water, the carbonate leaves the reaction medium as carbon dioxide gas (HCO3− + H+ → H2O + CO2↑ or, more precisely, HCO3− + H3O+ → 2 H2O + CO2↑). This makes the tablet disintegrate, leaving the medication suspended and/or dissolved in the water together with the resulting salt (in this example, sodium tartrate).[48]
Personal hygiene[edit]
Sodium bicarbonate is also used as an ingredient in some mouthwashes. It has anticaries and abrasive properties.[49] It works as a mechanical cleanser on the teeth and gums, neutralizes the production of acid in the mouth, and also acts as an antiseptic to help prevent infections.[50][51] Sodium bicarbonate in combination with other ingredients can be used to make a dry or wet deodorant.[52][53] Sodium bicarbonate may be used as a buffering agent, combined with table salt, when creating a solution for nasal irrigation.[54]
It is used in eye hygiene to treat blepharitis. This is done by addition of a teaspoon of sodium bicarbonate to cool water that was recently boiled, followed by gentle scrubbing of the eyelash base with a cotton swab dipped in the solution.[55][56]
Veterinary uses[edit]
Sodium bicarbonate is used as a cattle feed supplement, in particular as a buffering agent for the rumen.[57]
Cleaning agent[edit]
Sodium bicarbonate is used in a process for removing paint and corrosion called sodablasting. As a blasting medium, sodium bicarbonate is used to remove surface contamination from softer and less resilient substrates such as aluminium, copper or timber which could be damaged by silica sand abrasive media.[58]
A manufacturer recommends a paste made from baking soda with minimal water as a gentle scouring powder,[29] and is useful in removing surface rust, as the rust forms a water-soluble compound when in a concentrated alkaline solution;[59] cold water should be used, as hot-water solutions can corrode steel.[60] Sodium bicarbonate attacks the thin protective oxide layer that forms on aluminium, making it unsuitable for cleaning this metal.[61] A solution in warm water will remove the tarnish from silver when the silver is in contact with a piece of aluminium foil.[61][62] Baking soda is commonly added to washing machines as a replacement for water softener and to remove odors from clothes. It is also almost as effective in removing heavy tea and coffee stains from cups as sodium hydroxide, when diluted with warm water.
During the Manhattan Project to develop the nuclear bomb in the early 1940s, the chemical toxicity of uranium was an issue. Uranium oxides were found to stick very well to cotton cloth, and did not wash out with soap or laundry detergent. However, the uranium would wash out with a 2% solution of sodium bicarbonate. Clothing can become contaminated with toxic dust of depleted uranium (DU), which is very dense, hence used for counterweights in a civilian context, and in armour-piercing projectiles. DU is not removed by normal laundering; washing with about 6 ounces (170 g) of baking soda in 2 gallons (7.5 L) of water will help to wash it out.[63]
Odor control[edit]
It is often claimed that baking soda is an effective odor remover,[64][better source needed] and it is often recommended that an open box be kept in the refrigerator to absorb odor.[65] This idea was promoted by the leading U.S. brand of baking soda, Arm & Hammer, in an advertising campaign starting in 1972.[66] Though this campaign is considered a classic of marketing, leading within a year to more than half of American refrigerators containing a box of baking soda,[67][68] there is little evidence that it is in fact effective in this application.[69][70]
Hydrogen gas production[edit]
Sodium bicarbonate can be used as a catalyst in gas production. Its performance for this application is «good», however not usually used.[citation needed] Hydrogen gas is produced via electrolysis of water, process in which electric current is applied through a volume of water, which causes the hydrogen atoms to separate from the oxygen atoms. This demonstration is usually done in high school chemistry classes to show electrolysis.
Chemistry[edit]
Sodium bicarbonate is an amphoteric compound. Aqueous solutions are mildly alkaline due to the formation of carbonic acid and hydroxide ion:
- HCO−
3 + H2O → H
2CO
3 + OH−
Sodium bicarbonate can often be used as a safer alternative to sodium hydroxide, and as such can be used as a wash to remove any acidic impurities from a «crude» liquid, producing a purer sample. Reaction of sodium bicarbonate and an acid produces a salt and carbonic acid, which readily decomposes to carbon dioxide and water:
- NaHCO3 + HCl → NaCl + H2O+CO2
- H2CO3 → H2O + CO2(g)
Sodium bicarbonate reacts with acetic acid (found in vinegar), producing sodium acetate, water, and carbon dioxide:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(g)
Sodium bicarbonate reacts with bases such as sodium hydroxide to form carbonates:
- NaHCO3 + NaOH → Na2CO3 + H2O
Thermal decomposition[edit]
At temperatures from 80–100 °C (176–212 °F), sodium bicarbonate gradually decomposes into sodium carbonate, water, and carbon dioxide. The conversion is faster at 200 °C (392 °F):[71]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Most bicarbonates undergo this dehydration reaction. Further heating converts the carbonate into the oxide (above 850 °C/1,560 °F):[71]
- Na2CO3 → Na2O + CO2
These conversions are relevant to the use of NaHCO3 as a fire-suppression agent («BC powder») in some dry-powder fire extinguishers.[citation needed]
Stability and shelf life[edit]
If kept cool (room temperature) and dry (an airtight container is recommended to keep out moist air), sodium bicarbonate can be kept without a significant amount of decomposition for at least two or three years.[72][73][74][75]
History[edit]
The word natron has been in use in many languages throughout modern times (in the forms of anatron, natrum and natron) and originated (like Spanish, French and English natron as well as ‘sodium’) via Arabic naṭrūn (or anatrūn; cf. the Lower Egyptian “Natrontal” Wadi El Natrun, where a mixture of sodium carbonate and sodium hydrogen carbonate for the dehydration of mummies was used [76]) from Greek nítron (νίτρον) (Herodotus; Attic lítron (λίτρον)), which can be traced back to ancient Egyptian ntr. The Greek nítron (soda, saltpeter) was also used in Latin (sal) nitrum and in German Salniter (the source of Nitrogen, Nitrat etc.).[77][78]
In 1791, French chemist Nicolas Leblanc produced sodium carbonate, also known as soda ash. The pharmacist Valentin Rose the Younger is credited with the discovery of sodium bicarbonate in 1801 in Berlin. In 1846, two American bakers, John Dwight and Austin Church, established the first factory in the United States to produce baking soda from sodium carbonate and carbon dioxide.[79]
Saleratus, potassium or sodium bicarbonate, is mentioned in the novel Captains Courageous by Rudyard Kipling as being used extensively in the 1800s in commercial fishing to prevent freshly caught fish from spoiling.[80]
In 1919, US Senator Lee Overman declared that bicarbonate of soda could cure the Spanish flu. In the midst of the debate on 26 January 1919, he interrupted the discussion to announce the discovery of a cure. «I want to say, for the benefit of those who are making this investigation,» he reported, «that I was told by a judge of a superior court in the mountain country of North Carolina they have discovered a remedy for this disease.» The purported cure implied a critique of modern science and an appreciation for the simple wisdom of simple people. «They say that common baking soda will cure the disease,» he continued, «that they have cured it with it, that they have no deaths up there at all; they use common baking soda, which cures the disease.»[81]
Production[edit]
Sodium bicarbonate is produced industrially from sodium carbonate:[82]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
It is produced on the scale of about 100,000 tonnes/year (as of 2001)[dubious – discuss][83] with a worldwide production capacity of 2.4 million tonnes per year (as of 2002).[84] Commercial quantities of baking soda are also produced by a similar method: soda ash, mined in the form of the ore trona, is dissolved in water and treated with carbon dioxide. Sodium bicarbonate precipitates as a solid from this solution.[citation needed]
Regarding the Solvay process, sodium bicarbonate is an intermediate in the reaction of sodium chloride, ammonia, and carbon dioxide. The product however shows low purity (75pc).[citation needed]
- NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Although of no practical value, NaHCO3 may be obtained by the reaction of carbon dioxide with an aqueous solution of sodium hydroxide:[citation needed]
- CO2 + NaOH → NaHCO3
Mining[edit]
Naturally occurring deposits of nahcolite (NaHCO3) are found in the Eocene-age (55.8–33.9 Mya) Green River Formation, Piceance Basin in Colorado. Nahcolite was deposited as beds during periods of high evaporation in the basin. It is commercially mined using common underground mining techniques such as bore, drum, and longwall mining in a fashion very similar to coal mining.[citation needed]
It is also produced by solution mining, pumping heated water through nahcolite beds and crystalizing the dissolved nahcolite through a cooling crystallization process.
In popular culture[edit]
Sodium bicarbonate, as «bicarbonate of soda», was a frequent source of punch lines for Groucho Marx in Marx Brothers movies. In Duck Soup, Marx plays the leader of a nation at war. In one scene, he receives a message from the battlefield that his general is reporting a gas attack, and Groucho tells his aide: «Tell him to take a teaspoonful of bicarbonate of soda and a half a glass of water.»[85] In A Night at the Opera, Groucho’s character addresses the opening night crowd at an opera by saying of the lead tenor: «Signor Lassparri comes from a very famous family. His mother was a well-known bass singer. His father was the first man to stuff spaghetti with bicarbonate of soda, thus causing and curing indigestion at the same time.»[86]
In the Joseph L. Mankewicz classic All About Eve, the Max Fabian character (Gregory Ratoff) has an extended scene with Margo Channing (Bette Davis) in which, suffering from heartburn, he requests and then drinks bicarbonate of soda, eliciting a prominent burp. Channing promises to always keep a box of bicarb with Max’s name on it.
See also[edit]
- Carbonic acid
- List of ineffective cancer treatments
- List of minerals
- Natron
- Natrona (disambiguation)
- Trona
References[edit]
- ^ a b Haynes, p. 4.90
- ^ a b c Haynes, p. 5.194
- ^ a b c «Sodium Bicarbonate» (PDF). United Nations Environment Programme. Archived from the original (PDF) on 16 May 2011.
- ^ Ellingboe JL, Runnels JH (1966). «Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures». J. Chem. Eng. Data. 11 (3): 323–324. doi:10.1021/je60030a009.
- ^ a b Haynes, p. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). «Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions». Journal of Thermal Analysis and Calorimetry. 90 (3): 903–907. doi:10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ a b c d Haynes, p. 5.19
- ^ Chambers M. «Sodium bicarbonate [USP:JAN]». ChemIDplus. U.S. National Library of Medicine.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, p. 137, archived (PDF) from the original on 18 May 2017
- ^ «Mineral Springs – an overview | ScienceDirect Topics».
- ^ «What’s the difference between bicarbonate of soda, baking soda and baking powder?». ThatsLife! Pacific Network.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 25 January 2021.
- ^ «Definition of SALERATUS». www.merriam-webster.com. Retrieved 6 December 2020.
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 7 December 2020.
- ^ Wollaston, WH (January 1814). «I. A Synoptic scale of chemical equivalents». Philosophical Transactions of the Royal Society of London. 104: 1–22. doi:10.1098/rstl.1814.0001. S2CID 96774986.
- ^ Bent AJ, ed. (1997). The Technology of Cake Making (6 ed.). Springer. p. 102. ISBN 9780751403497. Retrieved 12 August 2009.
- ^ Cascio J. «Sourdough» (PDF). University of Alaska Fairbanks Cooperative Extension Service. FNH-00061. Archived from the original (PDF) on 27 March 2016. Retrieved 2 May 2017.
- ^ «The Many Practical Uses of Baking Soda in the Kitchen». About.com Food. Retrieved 22 January 2017.
- ^ Czernohorsky JH, Hooker R. «The Chemistry of Baking» (PDF). New Zealand Institute of Chemistry. Archived from the original (PDF) on 27 November 2016. Retrieved 22 January 2017.
- ^ «Baking Soda and Baking Powder». FineCooking.com. Archived from the original on 2 February 2017. Retrieved 22 January 2017.
- ^ «Baking Soda FAQs». Arm & Hammer Multi-Brand. Church & Dwight Company. What is the difference baking soda and baking powder?. Archived from the original on 27 June 2017. Retrieved 20 July 2017.
- ^ «Glossary Ingredients». Cooking.com. Archived from the original on 15 September 2008.
- ^ «Sodium Bicarbonate». BRP Adhikary. 11 July 2016. Retrieved 25 January 2021.
- ^ «Sugar snake». MEL Science. MEL Science 2015–2019. Archived from the original on 6 October 2019. Retrieved 28 October 2019.
- ^ Malik YS, Goyal SM (May 2006). «Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate». International Journal of Food Microbiology. 109 (1–2): 160–3. doi:10.1016/j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (January 2000). «Antimicrobial activity of home disinfectants and natural products against potential human pathogens». Infection Control and Hospital Epidemiology. 21 (1): 33–8. doi:10.1086/501694. PMID 10656352. S2CID 34461187.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). «Evaluation of antifungal activity of carbonate and bicarbonate salts alone or in combination with biocontrol agents in control of citrus green mold». Communications in Agricultural and Applied Biological Sciences. 72 (4): 773–7. PMID 18396809.
- ^ Altman G (22 May 2006). «Book Repair for BookThinkers: How To Remove Odors From Books». The BookThinker (69).
- ^ a b c «Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda». armandhammer.com. Archived from the original on 31 August 2009. Retrieved 30 July 2009.
- ^ «Prepare for Emergencies from Uncontrolled Hazards». American Chemical Society.
- ^ Hurum D. «Laboratory Safety» (PDF). Civil Engineering. Northwestern University.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 August 2019. Retrieved 18 October 2021.
- ^ «Sodium Bicarbonate». Jackson Siegelbaum Gastroenterology. 1998. Archived from the original on 5 October 2016. Retrieved 4 October 2016.
- ^ «PegLyte». Pendo Phama.
- ^ «Sodium Bicarbonate Intravenous Infusion» (PDF). Consumer Medicine Information. Better Health Channel. 13 July 2004. Archived from the original (PDF) on 22 August 2008.
- ^ «Respiratory Acidosis: Treatment & Medication». emedicine. 26 March 2020.
- ^ Dart RC (2004). Medical Toxicology. Lippincott Williams & Wilkins. pp. 910–. ISBN 978-0-7817-2845-4.
- ^ Cloth Diapers. Donald C. Cooper PhD. pp. 46–.
- ^ [old info]Knudsen K, Abrahamsson J (April 1997). «Epinephrine and sodium bicarbonate independently and additively increase survival in experimental amitriptyline poisoning». Critical Care Medicine. 25 (4): 669–74. doi:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Insect bites and stings: First aid». Mayo Clinic. 15 January 2008.
- ^ «Sodium Bicarbonate». American Cancer Society. 28 November 2008. Archived from the original on 19 February 2013. Retrieved 19 February 2013.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Ernst E (3 February 2017). «This must be the most sickening cancer scam I have seen for a while».
- ^ Edgcombe H, Hocking G, Radcliffe J (2005). «Anaesthesia UK : Local Anaesthetic Pharmacology». John Radcliffe Hospital, Oxford, UK.
- ^ Fox D (15 December 2001). «Hard cheese». New Scientist. Retrieved 20 July 2017.
- ^ Fenton, T. R.; Tough, S. C.; Lyon, A. W.; Eliasziw, M.; Hanley, D. A. (2011). «Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill’s epidemiologic criteria for causality». Nutrition Journal. 10: 41. doi:10.1186/1475-2891-10-41. PMC 3114717. PMID 21529374.
- ^ Schwalfenberg, Gerry K. (2012). «The Alkaline Diet: Is There Evidence That an Alkaline pH Diet Benefits Health?». Journal of Environmental and Public Health. 2012: 1–7. doi:10.1155/2012/727630. PMC 3195546. PMID 22013455.
- ^ «Medical information from Prague 2000». Archived from the original on 18 October 2014.
- ^ Shirsand, S. B.; Suresh, Sarasija; Jodhana, L. S.; Swamy, P. V. (2010). «Formulation Design and Optimization of Fast Disintegrating Lorazepam Tablets by Effervescent Method». Indian Journal of Pharmaceutical Sciences. 72 (4): 431–436. doi:10.4103/0250-474X.73911. ISSN 0250-474X. PMC 3013557. PMID 21218052.
- ^ Storehagen S, Ose N, Midha S. «Dentifrices and mouthwashes ingredients and their use» (PDF). Institutt for klinisk odontologi. Universitetet i Oslo.
- ^ US 4132770A, Barth J, «Oral Product», issued 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (July 2011). «Role of different ingredients of tooth pastes and mouthwashes in oral health» (PDF). Journal of Pakistan Dental Association. 20 (3): 163–70.
- ^ Lamb JH (1946). «Sodium Bicarbonate: An Excellent Deodorant». The Journal of Investigative Dermatology. 7 (3): 131–133. doi:10.1038/jid.1946.13.
- ^ «Bicarb soda: natural body deodorant». sustainableecho.com. 10 March 2009.
- ^ Metson RB (2005). The Harvard Medical School Guide to Healing Your Sinues. McGraw Hill. p. 68. ISBN 9780071444699.
- ^ «Blepharitis : Information for patients leaflet» (PDF). Ouh.nhs.uk. Retrieved 28 February 2022.
- ^ «Blepharitis. Treatment and Causes. Eyelid inflammation | Patient». Patient. Archived from the original on 5 December 2015. Retrieved 31 May 2016.
- ^ Paton LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Use of sodium bicarbonate, offered free choice or blended into the ration, to reduce the risk of ruminal acidosis in cattle». Canadian Journal of Animal Science. 86 (3): 429–437. doi:10.4141/A06-014.
- ^ «Blast Away Grime With Baking Soda». Popular Mechanics. 5 August 2013. Retrieved 2 August 2020.
- ^ Housecroft CE, Sharpe AG (2008). «Chapter 22: d-block metal chemistry: the first row elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 716. ISBN 978-0-13-175553-6.
- ^ «Science Lab.com». MSDS- Sodium carbonate. sciencelab.com. Archived from the original on 5 September 2012.
- ^ a b «Finishing Techniques in Metalwork». Philadelphia Museum of Art.
- ^ «Put a Shine on It». scifun.chem.wisc.edu. Archived from the original on 31 July 2012. Retrieved 6 March 2011.
- ^ Orcutt JA. «Depleted Uranium and Health: Facts and Helpful Suggestions». Pharmacology and Toxicology of Uranium Compounds. McGraw-Hill. Archived from the original on 17 January 2013. Retrieved 21 March 2012.
- ^ Raymond J (10 June 2016). «Kitchen Odor Eliminating Candles, Products, and Tricks». cravedujour.com. Archived from the original on 7 August 2020. Retrieved 29 June 2016.
- ^
Vicki Lansky, Martha Campbell, Baking Soda: Over 500 Fabulous, Fun, and Frugal Uses You’ve Probably Never Thought Of, 2009, ISBN 1931863733, p. 28 - ^ «A trusted solution for more than 170 years. Pure and simple.», Arm & Hammer «About Us» page
- ^ Keith Sawyer, Group Genius: The Creative Power of Collaboration, 2017, ISBN 0465093582, «keep food tasting fresh»
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Marketing Malpractice: The Cause and the Cure, Harvard Business Review, December 2005, [1]
- ^ «Myth #100: An Open Box of Baking Soda in the Fridge absorbs Odors», Bruce Weinstein, Mark Scarbrough, Lobsters Scream When You Boil Them; And 100 Other Myths About Food and Cooking, 2011, ISBN 1439195382, p. 312
- ^ «Baking Soda as Odor Absorber | Cook’s Illustrated». Cooksillustrated.com. Retrieved 28 February 2022.
- ^ a b «Decomposition of Carbonates». General Chemistry Online. Archived from the original on 2 October 1999. Retrieved 16 March 2010.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 16 May 2021.
- ^ «Sodium bicarbonate (S300) batch numbering and shelf life statement – Solvay Chemicals, Inc» (PDF). 31 January 2019.
- ^ «Re: Shelf Life – Sodium Bicarbonate (all grades) – Tronox Alkali Corporation» (PDF). 1 April 2015.
- ^ «Does Baking Soda Go Bad? How to Know If It’s Still Good». The Spruce Eats. Retrieved 16 May 2021.
- ^ Renate Gerner: Instruments and substances used in mummification. In: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. A multidisciplinary research project in Hanover. Special exhibition of the Kestner Museum Hanover from September 26, 1991 to January 19, 1992. Kestner Museum, Hanover 1991, ISBN 3-924029-17-2, p. 28 f.
- ^ Franz Dornseiff: «The Greek words in German.» Walter de Gruyter & Co, Berlin 1950, p. 44.
- ^ Friedrich Kluge, Alfred Götze (Philologist): Etymological Dictionary of the German Language. 20th edition, ed. by Walther Mitzka, De Gruyter, Berlin / New York 1967; Reprint (“21st unchanged edition”) ibid 1975, ISBN 3-11-005709-3, p. 504.
- ^ «Company History». Church & Dwight Co. Archived from the original on 16 October 2011.
- ^ Kipling R (1897). Captains Courageous. p. 25.
- ^ Bristow, Nancy K. (2012), American Pandemic: The Lost Worlds of the 1918 Influenza Epidemic, Oxford University Press, p. 178, ISBN 978-0199811342
- ^ Thieme C (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 3527306730.
- ^ Holleman AF, Wiberg E (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Page 45, section 3.6.2.1 of «Process Best Practices Reference Document (BREF) for Soda Ash,» report produced by the European Soda Ash Producer’s Association Archived 3 October 2006 at the Wayback Machine, March 2004.
- ^ «Duck Soup (1933)». IMDb. Retrieved 4 August 2015.
- ^ «A Night at the Opera (1935)». IMDb. Retrieved 4 August 2015.
Bibliography[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 1044
For the leavening agent of which baking soda is a common ingredient, see Baking powder.

|
||
|
||

Crystal structure |
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
sodium hydrogencarbonate |
||
| Other names
Baking soda, bicarb (laboratory slang), bicarbonate of soda, nahcolite, natrium hydrogen carbonate, natron |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
|
Beilstein Reference |
4153970 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| EC Number |
|
|
| E number | E500(ii) (acidity regulators, …) | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
| MeSH | Sodium+bicarbonate | |
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
NaHCO 3 |
|
| Molar mass | 84.0066 g mol−1 | |
| Appearance | White crystals | |
| Odor | Odorless | |
| Density |
|
|
| Melting point | (Decomposes to sodium carbonate starting at 50 °C[1][6]) | |
|
Solubility in water |
|
|
| Solubility | 0.02 wt% acetone, 2.13 wt% methanol @22 °C.[4] insoluble in ethanol | |
| log P | −0.82 | |
| Acidity (pKa) |
|
|
|
Refractive index (nD) |
nα = 1.377 nβ = 1.501 nγ = 1.583 | |
| Structure | ||
|
Crystal structure |
Monoclinic | |
| Thermochemistry | ||
|
Heat capacity (C) |
87.6 J/mol K[7] | |
|
Std molar |
101.7 J/mol K[7] | |
|
Std enthalpy of |
−950.8 kJ/mol[7] | |
|
Gibbs free energy (ΔfG⦵) |
−851.0 kJ/mol[7] | |
| Pharmacology | ||
|
ATC code |
B05CB04 (WHO) B05XA02 (WHO), QG04BQ01 (WHO) | |
|
Routes of |
Intravenous, oral | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Causes serious eye irritation | |
| NFPA 704 (fire diamond) |
2 0 1 |
|
| Flash point | Incombustible | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
4220 mg/kg (rat, oral)[8] | |
| Safety data sheet (SDS) | External MSDS | |
| Related compounds | ||
|
Other anions |
Sodium carbonate | |
|
Other cations |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cupcakes baked with baking soda as a raising agent
Sodium bicarbonate (IUPAC name: sodium hydrogencarbonate[9]), commonly known as baking soda or bicarbonate of soda, is a chemical compound with the formula NaHCO3. It is a salt composed of a sodium cation (Na+) and a bicarbonate anion (HCO3−). Sodium bicarbonate is a white solid that is crystalline, but often appears as a fine powder. It has a slightly salty, alkaline taste resembling that of washing soda (sodium carbonate). The natural mineral form is nahcolite. It is a component of the mineral natron and is found dissolved in many mineral springs.[10]
Nomenclature[edit]
Because it has long been known and widely used, the salt has many different names such as baking soda, bread soda, cooking soda, and bicarbonate of soda and can often be found near baking powder in stores. The term baking soda is more common in the United States, while bicarbonate of soda is more common in Australia, United Kingdom and Ireland.[11] Abbreviated colloquial forms such as sodium bicarb, bicarb soda, bicarbonate, and bicarb are common.[12]
The word saleratus, from Latin sal æratus (meaning «aerated salt»), was widely used in the 19th century for both sodium bicarbonate and potassium bicarbonate.[13]
Its E number food additive code is E500.[14]
The prefix bi in bicarbonate comes from an outdated naming system predating molecular knowledge in reference to the two molar equivalents of carbon dioxide (known as carbonic acid in the ancient chemistry language) that potassium hydrocarbonate/bicarbonate releases upon decomposition to (di)potassium carbonate and to potassium oxide (potash).[15] The modern chemical formulas of these compounds now express their precise chemical compositions which were unknown when the name bi-carbonate of potash was coined (see also: bicarbonate).
Uses[edit]
Cooking[edit]
Leavening[edit]
In cooking, baking soda is primarily used in baking as a leavening agent. When it reacts with acid, carbon dioxide is released, which causes expansion of the batter and forms the characteristic texture and grain in cakes, quick breads, soda bread, and other baked and fried foods. The acid–base reaction can be generically represented as follows:[16]
- NaHCO3 + H+ → Na+ + CO2 + H2O
Acidic materials that induce this reaction include hydrogen phosphates, cream of tartar, lemon juice, yogurt, buttermilk, cocoa, and vinegar. Baking soda may be used together with sourdough, which is acidic, making a lighter product with a less acidic taste.[17]
Heat can also by itself cause sodium bicarbonate to act as a raising agent in baking because of thermal decomposition, releasing carbon dioxide at temperatures above 80 °C (180 °F), as follows:[18]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
When used this way on its own, without the presence of an acidic component (whether in the batter or by the use of a baking powder containing acid), only half the available CO2 is released (one CO2 molecule is formed for every two equivalents of NaHCO3). Additionally, in the absence of acid, thermal decomposition of sodium bicarbonate also produces sodium carbonate, which is strongly alkaline and gives the baked product a bitter, «soapy» taste and a yellow color. Since the reaction occurs slowly at room temperature, mixtures (cake batter, etc.) can be allowed to stand without rising until they are heated in the oven.[citation needed]
Baking powder[edit]
Baking powder, also sold for cooking, contains around 30% of bicarbonate, and various acidic ingredients which are activated by the addition of water, without the need for additional acids in the cooking medium.[19][20][21] Many forms of baking powder contain sodium bicarbonate combined with calcium acid phosphate, sodium aluminium phosphate, or cream of tartar.[22] Baking soda is alkaline; the acid used in baking powder avoids a metallic taste when the chemical change during baking creates sodium carbonate.[23]
Pyrotechnics[edit]
Sodium bicarbonate is one of the main components of the common «black snake» firework. The effect is caused by the thermal decomposition, which produces carbon dioxide gas to produce a long snake-like ash as a combustion product of the other main component, sucrose.[24] Sodium bicarbonate is also used to delay combustion reactions by releasing CO2 and H2O when heated, both of which are flame retardants.
Mild disinfectant[edit]
It has weak disinfectant properties,[25][26] and it may be an effective fungicide against some organisms.[27] Because baking soda will absorb musty smells, it has become a reliable method for used book sellers when making books less malodorous.[28]
Fire extinguisher[edit]
Sodium bicarbonate can be used to extinguish small grease or electrical fires by being thrown over the fire, as heating of sodium bicarbonate releases carbon dioxide.[29] However, it should not be applied to fires in deep fryers; the sudden release of gas may cause the grease to splatter.[29] Sodium bicarbonate is used in BC dry chemical fire extinguishers as an alternative to the more corrosive monoammonium phosphate in ABC extinguishers. The alkaline nature of sodium bicarbonate makes it the only dry chemical agent, besides Purple-K, that was used in large-scale fire suppression systems installed in commercial kitchens. Because it can act as an alkali, the agent has a mild saponification effect on hot grease, which forms a smothering, soapy foam.[citation needed]
Neutralization of acids[edit]
Sodium bicarbonate reacts spontaneously with acids, releasing CO2 gas as a reaction product. It is commonly used to neutralize unwanted acid solutions or acid spills in chemical laboratories.[30] It is not appropriate to use sodium bicarbonate to neutralize base[31] even though it is amphoteric, reacting with both acids and bases.[citation needed]
Agriculture[edit]
Sodium bicarbonate when applied on leaves, can prevent the growth of fungi; however, it does not kill the fungus. Excessive amount of sodium bicarbonate can cause discolouration of fruits (two percent solution) and chlorosis (one percent solution).[32]
Medical uses and health[edit]
Sodium bicarbonate mixed with water can be used as an antacid to treat acid indigestion and heartburn.[33] Its reaction with stomach acid produces salt, water, and carbon dioxide:
- NaHCO3 + HCl → NaCl + H2O + CO2(g)
A mixture of sodium bicarbonate and polyethylene glycol such as PegLyte,[34] dissolved in water and taken orally, is an effective gastrointestinal lavage preparation and laxative prior to gastrointestinal surgery, gastroscopy, etc.[citation needed]
Intravenous sodium bicarbonate in an aqueous solution is sometimes used for cases of acidosis, or when insufficient sodium or bicarbonate ions are in the blood.[35] In cases of respiratory acidosis, the infused bicarbonate ion drives the carbonic acid/bicarbonate buffer of plasma to the left, and thus raises the pH. For this reason, sodium bicarbonate is used in medically supervised cardiopulmonary resuscitation. Infusion of bicarbonate is indicated only when the blood pH is markedly low (< 7.1–7.0).[36]
HCO3− is used for treatment of hyperkalemia, as it will drive K+ back into cells during periods of acidosis.[37] Since sodium bicarbonate can cause alkalosis, it is sometimes used to treat aspirin overdoses. Aspirin requires an acidic environment for proper absorption, and a basic environment will diminish aspirin absorption in cases of overdose.[38] Sodium bicarbonate has also been used in the treatment of tricyclic antidepressant overdose.[39] It can also be applied topically as a paste, with three parts baking soda to one part water, to relieve some kinds of insect bites and stings (as well as accompanying swelling).[40]
Some alternative practitioners, such as Tullio Simoncini, have promoted baking soda as a cancer cure, which the American Cancer Society has warned against due to both its unproven effectiveness and potential danger in use.[41] Edzard Ernst has called the promotion of sodium bicarbonate as a cancer cure «one of the more sickening alternative cancer scams I have seen for a long time».[42]
Sodium bicarbonate can be added to local anesthetics, to speed up the onset of their effects and make their injection less painful.[43] It is also a component of Moffett’s solution, used in nasal surgery.[citation needed]
It has been proposed that acidic diets weaken bones.[44] One systematic meta-analysis of the research shows no such effect.[45] Another also finds that there is no evidence that alkaline diets improve bone health, but suggests that there «may be some value» to alkaline diets for other reasons.[46]
Antacid (such as baking soda) solutions have been prepared and used by protesters to alleviate the effects of exposure to tear gas during protests.[failed verification][47]
Similarly to its use in baking, sodium bicarbonate is used together with a mild acid such as tartaric acid as the excipient in effervescent tablets: when such a tablet is dropped in a glass of water, the carbonate leaves the reaction medium as carbon dioxide gas (HCO3− + H+ → H2O + CO2↑ or, more precisely, HCO3− + H3O+ → 2 H2O + CO2↑). This makes the tablet disintegrate, leaving the medication suspended and/or dissolved in the water together with the resulting salt (in this example, sodium tartrate).[48]
Personal hygiene[edit]
Sodium bicarbonate is also used as an ingredient in some mouthwashes. It has anticaries and abrasive properties.[49] It works as a mechanical cleanser on the teeth and gums, neutralizes the production of acid in the mouth, and also acts as an antiseptic to help prevent infections.[50][51] Sodium bicarbonate in combination with other ingredients can be used to make a dry or wet deodorant.[52][53] Sodium bicarbonate may be used as a buffering agent, combined with table salt, when creating a solution for nasal irrigation.[54]
It is used in eye hygiene to treat blepharitis. This is done by addition of a teaspoon of sodium bicarbonate to cool water that was recently boiled, followed by gentle scrubbing of the eyelash base with a cotton swab dipped in the solution.[55][56]
Veterinary uses[edit]
Sodium bicarbonate is used as a cattle feed supplement, in particular as a buffering agent for the rumen.[57]
Cleaning agent[edit]
Sodium bicarbonate is used in a process for removing paint and corrosion called sodablasting. As a blasting medium, sodium bicarbonate is used to remove surface contamination from softer and less resilient substrates such as aluminium, copper or timber which could be damaged by silica sand abrasive media.[58]
A manufacturer recommends a paste made from baking soda with minimal water as a gentle scouring powder,[29] and is useful in removing surface rust, as the rust forms a water-soluble compound when in a concentrated alkaline solution;[59] cold water should be used, as hot-water solutions can corrode steel.[60] Sodium bicarbonate attacks the thin protective oxide layer that forms on aluminium, making it unsuitable for cleaning this metal.[61] A solution in warm water will remove the tarnish from silver when the silver is in contact with a piece of aluminium foil.[61][62] Baking soda is commonly added to washing machines as a replacement for water softener and to remove odors from clothes. It is also almost as effective in removing heavy tea and coffee stains from cups as sodium hydroxide, when diluted with warm water.
During the Manhattan Project to develop the nuclear bomb in the early 1940s, the chemical toxicity of uranium was an issue. Uranium oxides were found to stick very well to cotton cloth, and did not wash out with soap or laundry detergent. However, the uranium would wash out with a 2% solution of sodium bicarbonate. Clothing can become contaminated with toxic dust of depleted uranium (DU), which is very dense, hence used for counterweights in a civilian context, and in armour-piercing projectiles. DU is not removed by normal laundering; washing with about 6 ounces (170 g) of baking soda in 2 gallons (7.5 L) of water will help to wash it out.[63]
Odor control[edit]
It is often claimed that baking soda is an effective odor remover,[64][better source needed] and it is often recommended that an open box be kept in the refrigerator to absorb odor.[65] This idea was promoted by the leading U.S. brand of baking soda, Arm & Hammer, in an advertising campaign starting in 1972.[66] Though this campaign is considered a classic of marketing, leading within a year to more than half of American refrigerators containing a box of baking soda,[67][68] there is little evidence that it is in fact effective in this application.[69][70]
Hydrogen gas production[edit]
Sodium bicarbonate can be used as a catalyst in gas production. Its performance for this application is «good», however not usually used.[citation needed] Hydrogen gas is produced via electrolysis of water, process in which electric current is applied through a volume of water, which causes the hydrogen atoms to separate from the oxygen atoms. This demonstration is usually done in high school chemistry classes to show electrolysis.
Chemistry[edit]
Sodium bicarbonate is an amphoteric compound. Aqueous solutions are mildly alkaline due to the formation of carbonic acid and hydroxide ion:
- HCO−
3 + H2O → H
2CO
3 + OH−
Sodium bicarbonate can often be used as a safer alternative to sodium hydroxide, and as such can be used as a wash to remove any acidic impurities from a «crude» liquid, producing a purer sample. Reaction of sodium bicarbonate and an acid produces a salt and carbonic acid, which readily decomposes to carbon dioxide and water:
- NaHCO3 + HCl → NaCl + H2O+CO2
- H2CO3 → H2O + CO2(g)
Sodium bicarbonate reacts with acetic acid (found in vinegar), producing sodium acetate, water, and carbon dioxide:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(g)
Sodium bicarbonate reacts with bases such as sodium hydroxide to form carbonates:
- NaHCO3 + NaOH → Na2CO3 + H2O
Thermal decomposition[edit]
At temperatures from 80–100 °C (176–212 °F), sodium bicarbonate gradually decomposes into sodium carbonate, water, and carbon dioxide. The conversion is faster at 200 °C (392 °F):[71]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Most bicarbonates undergo this dehydration reaction. Further heating converts the carbonate into the oxide (above 850 °C/1,560 °F):[71]
- Na2CO3 → Na2O + CO2
These conversions are relevant to the use of NaHCO3 as a fire-suppression agent («BC powder») in some dry-powder fire extinguishers.[citation needed]
Stability and shelf life[edit]
If kept cool (room temperature) and dry (an airtight container is recommended to keep out moist air), sodium bicarbonate can be kept without a significant amount of decomposition for at least two or three years.[72][73][74][75]
History[edit]
The word natron has been in use in many languages throughout modern times (in the forms of anatron, natrum and natron) and originated (like Spanish, French and English natron as well as ‘sodium’) via Arabic naṭrūn (or anatrūn; cf. the Lower Egyptian “Natrontal” Wadi El Natrun, where a mixture of sodium carbonate and sodium hydrogen carbonate for the dehydration of mummies was used [76]) from Greek nítron (νίτρον) (Herodotus; Attic lítron (λίτρον)), which can be traced back to ancient Egyptian ntr. The Greek nítron (soda, saltpeter) was also used in Latin (sal) nitrum and in German Salniter (the source of Nitrogen, Nitrat etc.).[77][78]
In 1791, French chemist Nicolas Leblanc produced sodium carbonate, also known as soda ash. The pharmacist Valentin Rose the Younger is credited with the discovery of sodium bicarbonate in 1801 in Berlin. In 1846, two American bakers, John Dwight and Austin Church, established the first factory in the United States to produce baking soda from sodium carbonate and carbon dioxide.[79]
Saleratus, potassium or sodium bicarbonate, is mentioned in the novel Captains Courageous by Rudyard Kipling as being used extensively in the 1800s in commercial fishing to prevent freshly caught fish from spoiling.[80]
In 1919, US Senator Lee Overman declared that bicarbonate of soda could cure the Spanish flu. In the midst of the debate on 26 January 1919, he interrupted the discussion to announce the discovery of a cure. «I want to say, for the benefit of those who are making this investigation,» he reported, «that I was told by a judge of a superior court in the mountain country of North Carolina they have discovered a remedy for this disease.» The purported cure implied a critique of modern science and an appreciation for the simple wisdom of simple people. «They say that common baking soda will cure the disease,» he continued, «that they have cured it with it, that they have no deaths up there at all; they use common baking soda, which cures the disease.»[81]
Production[edit]
Sodium bicarbonate is produced industrially from sodium carbonate:[82]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
It is produced on the scale of about 100,000 tonnes/year (as of 2001)[dubious – discuss][83] with a worldwide production capacity of 2.4 million tonnes per year (as of 2002).[84] Commercial quantities of baking soda are also produced by a similar method: soda ash, mined in the form of the ore trona, is dissolved in water and treated with carbon dioxide. Sodium bicarbonate precipitates as a solid from this solution.[citation needed]
Regarding the Solvay process, sodium bicarbonate is an intermediate in the reaction of sodium chloride, ammonia, and carbon dioxide. The product however shows low purity (75pc).[citation needed]
- NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Although of no practical value, NaHCO3 may be obtained by the reaction of carbon dioxide with an aqueous solution of sodium hydroxide:[citation needed]
- CO2 + NaOH → NaHCO3
Mining[edit]
Naturally occurring deposits of nahcolite (NaHCO3) are found in the Eocene-age (55.8–33.9 Mya) Green River Formation, Piceance Basin in Colorado. Nahcolite was deposited as beds during periods of high evaporation in the basin. It is commercially mined using common underground mining techniques such as bore, drum, and longwall mining in a fashion very similar to coal mining.[citation needed]
It is also produced by solution mining, pumping heated water through nahcolite beds and crystalizing the dissolved nahcolite through a cooling crystallization process.
In popular culture[edit]
Sodium bicarbonate, as «bicarbonate of soda», was a frequent source of punch lines for Groucho Marx in Marx Brothers movies. In Duck Soup, Marx plays the leader of a nation at war. In one scene, he receives a message from the battlefield that his general is reporting a gas attack, and Groucho tells his aide: «Tell him to take a teaspoonful of bicarbonate of soda and a half a glass of water.»[85] In A Night at the Opera, Groucho’s character addresses the opening night crowd at an opera by saying of the lead tenor: «Signor Lassparri comes from a very famous family. His mother was a well-known bass singer. His father was the first man to stuff spaghetti with bicarbonate of soda, thus causing and curing indigestion at the same time.»[86]
In the Joseph L. Mankewicz classic All About Eve, the Max Fabian character (Gregory Ratoff) has an extended scene with Margo Channing (Bette Davis) in which, suffering from heartburn, he requests and then drinks bicarbonate of soda, eliciting a prominent burp. Channing promises to always keep a box of bicarb with Max’s name on it.
See also[edit]
- Carbonic acid
- List of ineffective cancer treatments
- List of minerals
- Natron
- Natrona (disambiguation)
- Trona
References[edit]
- ^ a b Haynes, p. 4.90
- ^ a b c Haynes, p. 5.194
- ^ a b c «Sodium Bicarbonate» (PDF). United Nations Environment Programme. Archived from the original (PDF) on 16 May 2011.
- ^ Ellingboe JL, Runnels JH (1966). «Solubilities of Sodium Carbonate and Sodium Bicarbonate in Acetone-Water and Methanol-Water Mixtures». J. Chem. Eng. Data. 11 (3): 323–324. doi:10.1021/je60030a009.
- ^ a b Haynes, p. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). «Thermal behaviour of diclofenac, diclofenac sodium and sodium bicarbonate compositions». Journal of Thermal Analysis and Calorimetry. 90 (3): 903–907. doi:10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ a b c d Haynes, p. 5.19
- ^ Chambers M. «Sodium bicarbonate [USP:JAN]». ChemIDplus. U.S. National Library of Medicine.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, p. 137, archived (PDF) from the original on 18 May 2017
- ^ «Mineral Springs – an overview | ScienceDirect Topics».
- ^ «What’s the difference between bicarbonate of soda, baking soda and baking powder?». ThatsLife! Pacific Network.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 25 January 2021.
- ^ «Definition of SALERATUS». www.merriam-webster.com. Retrieved 6 December 2020.
- ^ «Approved additives and E numbers». Food Standards Agency. Retrieved 7 December 2020.
- ^ Wollaston, WH (January 1814). «I. A Synoptic scale of chemical equivalents». Philosophical Transactions of the Royal Society of London. 104: 1–22. doi:10.1098/rstl.1814.0001. S2CID 96774986.
- ^ Bent AJ, ed. (1997). The Technology of Cake Making (6 ed.). Springer. p. 102. ISBN 9780751403497. Retrieved 12 August 2009.
- ^ Cascio J. «Sourdough» (PDF). University of Alaska Fairbanks Cooperative Extension Service. FNH-00061. Archived from the original (PDF) on 27 March 2016. Retrieved 2 May 2017.
- ^ «The Many Practical Uses of Baking Soda in the Kitchen». About.com Food. Retrieved 22 January 2017.
- ^ Czernohorsky JH, Hooker R. «The Chemistry of Baking» (PDF). New Zealand Institute of Chemistry. Archived from the original (PDF) on 27 November 2016. Retrieved 22 January 2017.
- ^ «Baking Soda and Baking Powder». FineCooking.com. Archived from the original on 2 February 2017. Retrieved 22 January 2017.
- ^ «Baking Soda FAQs». Arm & Hammer Multi-Brand. Church & Dwight Company. What is the difference baking soda and baking powder?. Archived from the original on 27 June 2017. Retrieved 20 July 2017.
- ^ «Glossary Ingredients». Cooking.com. Archived from the original on 15 September 2008.
- ^ «Sodium Bicarbonate». BRP Adhikary. 11 July 2016. Retrieved 25 January 2021.
- ^ «Sugar snake». MEL Science. MEL Science 2015–2019. Archived from the original on 6 October 2019. Retrieved 28 October 2019.
- ^ Malik YS, Goyal SM (May 2006). «Virucidal efficacy of sodium bicarbonate on a food contact surface against feline calicivirus, a norovirus surrogate». International Journal of Food Microbiology. 109 (1–2): 160–3. doi:10.1016/j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (January 2000). «Antimicrobial activity of home disinfectants and natural products against potential human pathogens». Infection Control and Hospital Epidemiology. 21 (1): 33–8. doi:10.1086/501694. PMID 10656352. S2CID 34461187.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). «Evaluation of antifungal activity of carbonate and bicarbonate salts alone or in combination with biocontrol agents in control of citrus green mold». Communications in Agricultural and Applied Biological Sciences. 72 (4): 773–7. PMID 18396809.
- ^ Altman G (22 May 2006). «Book Repair for BookThinkers: How To Remove Odors From Books». The BookThinker (69).
- ^ a b c «Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda». armandhammer.com. Archived from the original on 31 August 2009. Retrieved 30 July 2009.
- ^ «Prepare for Emergencies from Uncontrolled Hazards». American Chemical Society.
- ^ Hurum D. «Laboratory Safety» (PDF). Civil Engineering. Northwestern University.
- ^ «Horticulture myths». University of Vermont Extension Department of Plant and Soil Science. Archived from the original on 7 August 2019. Retrieved 18 October 2021.
- ^ «Sodium Bicarbonate». Jackson Siegelbaum Gastroenterology. 1998. Archived from the original on 5 October 2016. Retrieved 4 October 2016.
- ^ «PegLyte». Pendo Phama.
- ^ «Sodium Bicarbonate Intravenous Infusion» (PDF). Consumer Medicine Information. Better Health Channel. 13 July 2004. Archived from the original (PDF) on 22 August 2008.
- ^ «Respiratory Acidosis: Treatment & Medication». emedicine. 26 March 2020.
- ^ Dart RC (2004). Medical Toxicology. Lippincott Williams & Wilkins. pp. 910–. ISBN 978-0-7817-2845-4.
- ^ Cloth Diapers. Donald C. Cooper PhD. pp. 46–.
- ^ [old info]Knudsen K, Abrahamsson J (April 1997). «Epinephrine and sodium bicarbonate independently and additively increase survival in experimental amitriptyline poisoning». Critical Care Medicine. 25 (4): 669–74. doi:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Insect bites and stings: First aid». Mayo Clinic. 15 January 2008.
- ^ «Sodium Bicarbonate». American Cancer Society. 28 November 2008. Archived from the original on 19 February 2013. Retrieved 19 February 2013.
{{cite web}}: CS1 maint: unfit URL (link) - ^ Ernst E (3 February 2017). «This must be the most sickening cancer scam I have seen for a while».
- ^ Edgcombe H, Hocking G, Radcliffe J (2005). «Anaesthesia UK : Local Anaesthetic Pharmacology». John Radcliffe Hospital, Oxford, UK.
- ^ Fox D (15 December 2001). «Hard cheese». New Scientist. Retrieved 20 July 2017.
- ^ Fenton, T. R.; Tough, S. C.; Lyon, A. W.; Eliasziw, M.; Hanley, D. A. (2011). «Causal assessment of dietary acid load and bone disease: A systematic review & meta-analysis applying Hill’s epidemiologic criteria for causality». Nutrition Journal. 10: 41. doi:10.1186/1475-2891-10-41. PMC 3114717. PMID 21529374.
- ^ Schwalfenberg, Gerry K. (2012). «The Alkaline Diet: Is There Evidence That an Alkaline pH Diet Benefits Health?». Journal of Environmental and Public Health. 2012: 1–7. doi:10.1155/2012/727630. PMC 3195546. PMID 22013455.
- ^ «Medical information from Prague 2000». Archived from the original on 18 October 2014.
- ^ Shirsand, S. B.; Suresh, Sarasija; Jodhana, L. S.; Swamy, P. V. (2010). «Formulation Design and Optimization of Fast Disintegrating Lorazepam Tablets by Effervescent Method». Indian Journal of Pharmaceutical Sciences. 72 (4): 431–436. doi:10.4103/0250-474X.73911. ISSN 0250-474X. PMC 3013557. PMID 21218052.
- ^ Storehagen S, Ose N, Midha S. «Dentifrices and mouthwashes ingredients and their use» (PDF). Institutt for klinisk odontologi. Universitetet i Oslo.
- ^ US 4132770A, Barth J, «Oral Product», issued 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (July 2011). «Role of different ingredients of tooth pastes and mouthwashes in oral health» (PDF). Journal of Pakistan Dental Association. 20 (3): 163–70.
- ^ Lamb JH (1946). «Sodium Bicarbonate: An Excellent Deodorant». The Journal of Investigative Dermatology. 7 (3): 131–133. doi:10.1038/jid.1946.13.
- ^ «Bicarb soda: natural body deodorant». sustainableecho.com. 10 March 2009.
- ^ Metson RB (2005). The Harvard Medical School Guide to Healing Your Sinues. McGraw Hill. p. 68. ISBN 9780071444699.
- ^ «Blepharitis : Information for patients leaflet» (PDF). Ouh.nhs.uk. Retrieved 28 February 2022.
- ^ «Blepharitis. Treatment and Causes. Eyelid inflammation | Patient». Patient. Archived from the original on 5 December 2015. Retrieved 31 May 2016.
- ^ Paton LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Use of sodium bicarbonate, offered free choice or blended into the ration, to reduce the risk of ruminal acidosis in cattle». Canadian Journal of Animal Science. 86 (3): 429–437. doi:10.4141/A06-014.
- ^ «Blast Away Grime With Baking Soda». Popular Mechanics. 5 August 2013. Retrieved 2 August 2020.
- ^ Housecroft CE, Sharpe AG (2008). «Chapter 22: d-block metal chemistry: the first row elements». Inorganic Chemistry, 3rd Edition. Pearson. p. 716. ISBN 978-0-13-175553-6.
- ^ «Science Lab.com». MSDS- Sodium carbonate. sciencelab.com. Archived from the original on 5 September 2012.
- ^ a b «Finishing Techniques in Metalwork». Philadelphia Museum of Art.
- ^ «Put a Shine on It». scifun.chem.wisc.edu. Archived from the original on 31 July 2012. Retrieved 6 March 2011.
- ^ Orcutt JA. «Depleted Uranium and Health: Facts and Helpful Suggestions». Pharmacology and Toxicology of Uranium Compounds. McGraw-Hill. Archived from the original on 17 January 2013. Retrieved 21 March 2012.
- ^ Raymond J (10 June 2016). «Kitchen Odor Eliminating Candles, Products, and Tricks». cravedujour.com. Archived from the original on 7 August 2020. Retrieved 29 June 2016.
- ^
Vicki Lansky, Martha Campbell, Baking Soda: Over 500 Fabulous, Fun, and Frugal Uses You’ve Probably Never Thought Of, 2009, ISBN 1931863733, p. 28 - ^ «A trusted solution for more than 170 years. Pure and simple.», Arm & Hammer «About Us» page
- ^ Keith Sawyer, Group Genius: The Creative Power of Collaboration, 2017, ISBN 0465093582, «keep food tasting fresh»
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Marketing Malpractice: The Cause and the Cure, Harvard Business Review, December 2005, [1]
- ^ «Myth #100: An Open Box of Baking Soda in the Fridge absorbs Odors», Bruce Weinstein, Mark Scarbrough, Lobsters Scream When You Boil Them; And 100 Other Myths About Food and Cooking, 2011, ISBN 1439195382, p. 312
- ^ «Baking Soda as Odor Absorber | Cook’s Illustrated». Cooksillustrated.com. Retrieved 28 February 2022.
- ^ a b «Decomposition of Carbonates». General Chemistry Online. Archived from the original on 2 October 1999. Retrieved 16 March 2010.
- ^ PubChem. «Sodium bicarbonate». pubchem.ncbi.nlm.nih.gov. Retrieved 16 May 2021.
- ^ «Sodium bicarbonate (S300) batch numbering and shelf life statement – Solvay Chemicals, Inc» (PDF). 31 January 2019.
- ^ «Re: Shelf Life – Sodium Bicarbonate (all grades) – Tronox Alkali Corporation» (PDF). 1 April 2015.
- ^ «Does Baking Soda Go Bad? How to Know If It’s Still Good». The Spruce Eats. Retrieved 16 May 2021.
- ^ Renate Gerner: Instruments and substances used in mummification. In: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. A multidisciplinary research project in Hanover. Special exhibition of the Kestner Museum Hanover from September 26, 1991 to January 19, 1992. Kestner Museum, Hanover 1991, ISBN 3-924029-17-2, p. 28 f.
- ^ Franz Dornseiff: «The Greek words in German.» Walter de Gruyter & Co, Berlin 1950, p. 44.
- ^ Friedrich Kluge, Alfred Götze (Philologist): Etymological Dictionary of the German Language. 20th edition, ed. by Walther Mitzka, De Gruyter, Berlin / New York 1967; Reprint (“21st unchanged edition”) ibid 1975, ISBN 3-11-005709-3, p. 504.
- ^ «Company History». Church & Dwight Co. Archived from the original on 16 October 2011.
- ^ Kipling R (1897). Captains Courageous. p. 25.
- ^ Bristow, Nancy K. (2012), American Pandemic: The Lost Worlds of the 1918 Influenza Epidemic, Oxford University Press, p. 178, ISBN 978-0199811342
- ^ Thieme C (2000). «Sodium Carbonates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a24_299. ISBN 3527306730.
- ^ Holleman AF, Wiberg E (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Page 45, section 3.6.2.1 of «Process Best Practices Reference Document (BREF) for Soda Ash,» report produced by the European Soda Ash Producer’s Association Archived 3 October 2006 at the Wayback Machine, March 2004.
- ^ «Duck Soup (1933)». IMDb. Retrieved 4 August 2015.
- ^ «A Night at the Opera (1935)». IMDb. Retrieved 4 August 2015.
Bibliography[edit]
- Haynes WM, ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- International Chemical Safety Card 1044
Гидрокарбонат натрия NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета.
Химическая формула
Содержание
- 1 Безопасность
- 2 Химические свойства
- 2.1 Реакция с кислотами
- 3 Термическое разложение
- 4 Применение
- 4.1 Кулинария
- 4.2 Медицина
- 4.3 Пожаротушение
- 5 Производство
- 6 Хранение
- 7 См. также
- 8 Примечания
- 9 Ссылки
Безопасность
Двууглекилый натрий не токсичен, пожаро- и взрывобезопасен.
Представляет собой мелкокристаллический порошок, который при попадании на слизистые оболочки вызывает раздражение. При постоянной работе в атмосфере, загрязненной пылью двууглекислого натрия, может возникнуть раздражение дыхательных путей.[1]
Химические свойства
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты.
Молекулярная масса (по международным атомным массам 1971 г.) — 84,00.[1]
Реакция с кислотами
Гидрокарбонат натрия реагирует с кислотами, с образованием соли и угольной кислоты, которая тут же распадается на углекислый газ и воду:
- NaHCO3 + HCl → NaCl + H2CO3
- H2CO3 → H2O + CO2↑
в кулинарии чаще встречается такая реакция с уксусной кислотой, с образованием ацетата натрия:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Термическое разложение
При температуре 60 °C гидрокарбонат натрия распадается на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C):
- 2NaHCO3 → Na2CO3 + H2O + CO2↑
При дальнейшем нагревании до 1000 °C (например при тушении пожара порошковыми системами) полученный карбонат натрия распадается на углекислый газ и оксид натрия:
- Na2CO3 → Na2O + CO2
Применение
Гидрокарбонат натрия
Двууглекислый натрий (бикарбонат), применяется в химической, пищевой, легкой, медицинской, фармацевтической промышленности, цветной металлургии, поставляется в розничную торговлю.
Зарегистрирован в качестве пищевой добавки E500.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях, для отделения двуокиси углерода, сероводорода из газовых смесей (газ поглощается в растворе гидрокарбоната при повышенном давлении и пониженной температуре, раствор восстанавливается при подогреве и пониженном давлении).
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и хлопчатобумажных тканей).
- в пищевой промышленности — хлебопечении, производстве кондитерских изделий, приготовлении напитков.
Кулинария
Основное применение питьевой соды — кулинария, где она применяется, преимущественно, в качестве основного или дополнительного разрыхлителя при выпечке (так как при нагревании выделяет углекислый газ), самостоятельно или в составе комплексных разрыхлителей (например, пекарского порошка, в смести с карбонатом аммония), например, в бисквитном и песочном тесте.
Медицина
Раствор питьевой соды используется в качестве слабого антисептика для полосканий, а также как традиционное кислотонейтрализующее средство от изжоги и болей в желудке (современная медицина не рекомендует применять из-за побочных эффектов, в том числе, из-за «кислотного рикошета») или для устранения ацидоза и т. п.
Пожаротушение
Гидрокарбонат натрия входит в состав порошка, применяемого в порошковых системах пожаротушения, утилизируя тепло и оттесняя кислород от очага горения выделяемым углекислым газом.
Производство
В РФ производят соду по ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[2]
Хранение
Хранить в закрытых упаковках, не допуская попадания влаги.
Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления.
Срок годности не ограничен.
См. также
- Карбонат натрия
- Пищевые добавки
Примечания
- ↑ 1 2 ГОСТ 2156-76 «Натрий двууглекислый. Технические условия».[1]
Ссылки
- http://www.infrahim.ru/pfm/187.html
- http://www.uk-him.ru/rus/catalogue/3/43
Wikimedia Foundation.
2010.
Химическое соединение
 |
||
|
||
 |
||
| Названия | ||
|---|---|---|
| Название IUPAC Гидрокарбонат натрия | ||
| Другие названия Пищевая сода, бикарбонат (лабораторный сленг), бикарбонат соды, нахколит | ||
| Идентификаторы | ||
| Номер CAS |
|
|
| 3D-модель (JSmol ) |
|
|
| Ссылка Beilstein | 4153970 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| Номер ЕС |
|
|
| Номер E | E500 (ii) (регуляторы кислотности,…) | |
| IUPHAR / BPS |
|
|
| KEGG |
|
|
| MeSH | Натрий + бикарбонат | |
| PubChem CID |
|
|
| номер RTECS |
|
|
| UNII |
|
|
| Панель управления CompTox (EPA ) |
|
|
InChI
|
||
УЛЫБКИ
|
||
| Свойства | ||
| Химическая формула | NaHCO. 3 | |
| Молярная масса | 84,0066 г / моль | |
| Внешний вид | Белые кристаллы | |
| Запах | Без запаха | |
| Плотность |
|
|
| Температура плавления | (Разлагается до натрия карбонат начиная с 50 ° C) | |
| Растворимость в воде |
|
|
| Растворимость | 0,02 мас.% ацетона, 2,13 мас.% метанола при 22 ° C. не растворим в этаноле | |
| log P | -0,82 | |
| Кислотность (pKa) |
|
|
| Показатель преломления (nD) | nα = 1,377 nβ = 1,501 nγ = 1,583 | |
| Структура | ||
| Кристаллическая структура | Моноклинная | |
| Термохимия | ||
| Теплоемкость (C) | 87,6 Дж / моль K | |
| Стандартный молярный. энтропия (S 298) | 101,7 Дж / моль K | |
| Стандартная энтальпия. образования (ΔfH298) | -950,8 кДж / моль | |
| свободная энергия Гиббса (ΔfG˚) | -851,0 кДж / моль | |
| Фармакология | ||
| Код ATC | B05CB04 (WHO ) B05XA02 (WHO ), QG04BQ01 (ВОЗ ) | |
| Пути. введения | Внутривенно, перорально | |
| Опасности | ||
| Основные опасности | Вызывает серьезное раздражение глаз | |
| Паспорт безопасности | Внешний паспорт безопасности материала | |
| NFPA 704 (огненный алмаз) |  0 2 1 0 2 1 |
|
| Температура вспышки | Негорючий | |
| Смертельная доза или концентрация (LD, LC): | ||
| LD50(средняя доза ) | 4220 мг / кг (крыса, перорально) | |
| Родственные соединения | ||
| Другие анионы | Карбонат натрия | |
| Другие катионы |
|
|
| Родственные соединения |
|
|
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки в ink | ||

Бикарбонат натрия (название ИЮПАК : гидрокарбонат натрия ), широко известный как пищевая сода (особенно в Северной Америке и Новой Зеландии ) или бикарбонат натрия, представляет собой химическое соединение с формулой NaHCO 3. Это соль, состоящая из катиона натрия (Na ) и бикарбонатного аниона (HCO 3 ). Бикарбонат натрия представляет собой белое твердое вещество, кристаллическое, но часто выглядит как мелкий порошок. Он имеет слегка соленый, щелочной вкус, напоминающий вкус стиральной соды (карбонат натрия ). Природная минеральная форма — нахколит. Он входит в состав минерала натрон и растворен во многих минеральных источниках.
Содержание
- 1 Номенклатура
- 2 Использование
- 2.1 Приготовление
- 2.1.1 Закваска
- 2.1.2 Разрыхлитель
- 2.1.3 Другое
- 2.2 Фунгициды и борьба с вредителями
- 2.3 Повышение щелочности / pH
- 2.4 Пиротехника
- 2.5 Мягкое дезинфицирующее средство
- 2.6 Огнетушитель
- 2.7 Нейтрализация кислот
- 2.8 Применение в медицине и здоровье
- 2.8.1 Личная гигиена
- 2.8.2 Использование в ветеринарии
- 2.9 В спорте
- 2.10 Чистящее средство
- 2.11 Контроль запаха
- 2.1 Приготовление
- 3 Химия
- 3.1 Термическое разложение
- 4 История
- 5 Производство
- 5.1 Горнодобывающая промышленность
- 6 В популярной культуре
- 6.1 Фильм
- 7 См. Также
- 8 Ссылки
- 9 Библиография
- 10 Внешние ссылки
Номенклатура
Потому что это давно известно и широко используется, соль имеет много родственных названий, таких как пищевая сода, пищевая сода, пищевая сода и бикарбонат соды . Термин пищевая сода более распространен в Соединенных Штатах, тогда как бикарбонат соды более распространен в Австралии и Великобритании. В разговорной речи названия бикарбонат натрия и бикарбонат соды часто сокращаются; распространены такие формы, как бикарбонат натрия, бикарбонат натрия, бикарбонат и бикарбонат.
Слово saleratus, от латинского sal æratus (что означает «газированная соль»), широко использовалось в 19 век как для бикарбоната натрия, так и для бикарбоната калия.
Он известен как одна из E number пищевых добавок E500 .
Приставка bi в бикарбонате от устаревшей системы именования и основывается на наблюдении, что на один натрий в бикарбонате натрия (NaHCO 3) содержится вдвое больше карбоната (CO 3), чем присутствует в карбонате натрия (Na 2CO3). Современные химические формулы этих соединений выражают их точный химический состав (который был неизвестен, когда были придуманы названия карбонат натрия и бикарбонат натрия) как гидрокарбонат натрия (NaHCO 3) и карбонат натрия (Na 2CO3).. Эти названия однозначны, поскольку натрий всегда имеет степень окисления +1 , а карбонат — степень окисления -2.
Использует
Варка
Закваска
В кулинарии пищевая сода в основном используется в выпечке как разрыхлитель. Когда он вступает в реакцию с кислотой, выделяется углекислый газ, который вызывает расширение жидкого теста и формирует характерную текстуру и зерно в пирогах, быстром хлебе, содовом хлебе и других выпеченных и жареных продукты. Кислотно-основная реакция может быть в общих чертах представлена следующим образом:
- NaHCO 3 + H → Na + CO 2 + H 2O
Кислотные материалы, которые вызывают эту реакцию, включают гидрофосфаты, винный камень, лимонный сок, йогурт, пахта, какао, и уксус. Пищевая сода может использоваться вместе с закваской, которая является кислой, что позволяет получить более легкий продукт с менее кислым вкусом.
Тепло также само по себе может заставить бикарбонат натрия действовать как разрыхлитель в выпекание из-за термического разложения с выделением диоксида углерода при температурах выше 80 ° C (180 ° F) следующим образом:
- 2 NaHCO 3 → Na 2CO3+ H 2 O + CO 2
При использовании таким способом самостоятельно, без присутствия кислотного компонента (будь то тесто или разрыхлитель, содержащий кислоту), только половина доступного CO 2 (одна молекула CO 2 образуется на каждые два эквивалента NaHCO 3). Кроме того, в отсутствие кислоты термическое разложение бикарбоната натрия также дает карбонат натрия, который является сильно щелочным и придает выпеченному продукту горький, «мыльный» вкус и желтый цвет. Поскольку реакция протекает медленно при комнатной температуре, смеси (тесто для пирогов и т. Д.) Можно выдерживать, не поднимаясь, пока они не нагреются в духовке.
При добавлении кислоты, щелочных ингредиентов, таких как цельное молоко или Обработанное голландцами какао часто добавляют в выпечку, чтобы избежать чрезмерно кислого привкуса из-за добавленной кислоты.
Разрыхлитель
Разрыхлитель, также продается для приготовления пищи, содержит около 30% бикарбоната и различные кислотные ингредиенты, которые активируются при добавлении воды без необходимости добавления кислот в среду для приготовления пищи. Многие формы разрыхлителя содержат бикарбонат натрия в сочетании с кислым фосфатом кальция, фосфатом натрия-алюминия или кремом от зубного камня. Пищевая сода щелочная; кислота, используемая в разрыхлителе, избегает металлического привкуса, когда химические изменения во время выпечки создают карбонат натрия.
Другое
Бикарбонат натрия иногда использовался при приготовлении зеленых овощей, так как он придает им ярко-зеленый цвет — который был описан как искусственно выглядящий — из-за его реакции с хлорофиллом с образованием хлорофиллина. Однако это имеет тенденцию влиять на вкус, текстуру и содержание питательных веществ и больше не является распространенным явлением.
Пищевая сода используется для смягчения бобовых (горох, фасоль) до и во время приготовления, как в традиционный британский мягкий горох рецепт замачивания гороха. Основным действием бикарбоната натрия является изменение pH раствора для замачивания и воды для приготовления пищи; это смягчает твердую внешнюю оболочку, сокращает время приготовления и может изменить процентное содержание питательных веществ в блюде, его вкус и консистенцию.
Пищевая сода может вступать в реакцию с кислотами в пище, включая витамин C (L-аскорбиновая кислота).
Используется в азиатской и латиноамериканской кухне для смягчения мяса. Он также используется в панировке, например, для жареной пищи, для повышения хрустящей корочки и обеспечения выхода пара, чтобы панировка не сдувалась во время приготовления.
Фунгициды и борьба с вредителями.
Бикарбонат натрия может быть эффективным способом контроля роста грибков и в США зарегистрирован Агентством по охране окружающей среды как биопестицид.
Повышение щелочности / pH
Бикарбонат натрия можно добавлять в бассейны, спа и садовые пруды для повышения общей щелочности (увеличения pH).
Пиротехника
Натрий бикарбонат — один из основных компонентов распространенного фейерверка «черная змея». Эффект вызван термическим разложением, в результате которого образуется углекислый газ с образованием длинного змееподобного пепла в качестве продукта сгорания другого основного компонента, сахарозы.
мягкого дезинфицирующего средства
Он обладает слабыми дезинфицирующими свойствами и может быть эффективным фунгицидом против некоторых организмов. Поскольку пищевая сода впитывает затхлый запах, она стала для продавцов подержанных книг надежным методом уменьшения неприятного запаха в книгах.
Огнетушитель
Бикарбонат натрия можно использовать для тушите небольшое возгорание жира или электрического тока, бросая его на огонь, поскольку нагревание бикарбоната натрия выделяет углекислый газ. Однако его нельзя применять при пожарах во фритюрницах ; внезапный выброс газа может вызвать разбрызгивание смазки. Бикарбонат натрия используется в огнетушителях BC сухих химикатов в качестве альтернативы более агрессивному диаммонийфосфату в огнетушителях ABC. Щелочная природа бикарбоната натрия делает его единственным сухим химическим агентом, помимо Purple-K, который использовался в крупномасштабных системах пожаротушения, установленных на коммерческих кухнях. Поскольку он может действовать как щелочь, агент оказывает умеренное омыление горячей смазки, которое образует удушающую мыльную пену.
Нейтрализация кислот
Бикарбонат натрия самопроизвольно реагирует с кислотами, выделяя газ CO 2 в качестве продукта реакции. Он обычно используется для нейтрализации нежелательных кислотных растворов или разливов кислоты в химических лабораториях. Нецелесообразно использовать бикарбонат натрия для нейтрализации основания, даже если он амфотерный, реагирующий как с кислотами, так и с основаниями.
Применение в медицине и здоровье
Бикарбонат натрия, смешанный с воду можно использовать в качестве антацида для лечения кислотного несварения и изжоги. Его реакция с желудочной кислотой дает соль, воду и двуокись углерода :
- NaHCO 3 + HCl → NaCl + H 2 O + CO 2 (г)
Смесь бикарбоната натрия и полиэтиленгликоля, такого как PegLyte, растворенная в воде и принимаемая перорально, является эффективным препаратом для промывания желудочно-кишечного тракта и слабительное перед операцией на желудочно-кишечном тракте, гастроскопией и т. Д.
внутривенное введение бикарбоната натрия в водном растворе иногда используется в случаях ацидоза или при недостаточном количестве ионов натрия или бикарбоната в крови. В случае респираторного ацидоза введенный ион бикарбоната сдвигает углекислотный / бикарбонатный буфер плазмы влево и, таким образом, повышает pH. По этой причине бикарбонат натрия используется в сердечно-легочной реанимации под медицинским наблюдением. Инфузия бикарбоната показана только в том случае, если pH крови заметно низок (< 7.1–7.0).
HCO 3 используется для лечения гиперкалиемии, так как он будет возвращать K обратно в клетки в периоды ацидоза..Поскольку бикарбонат натрия может вызвать алкалоз, его иногда используют для лечения передозировки аспирина. Для правильного всасывания аспирина требуется кислая среда, а щелочная среда снижает абсорбцию аспирина в случае передозировки. Бикарбонат натрия также оказывает использовался при лечении передозировки трициклическим антидепрессантом. Его также можно применять местно в виде пасты, с тремя частями пищевой соды на одну часть воды, для облегчения некоторых видов укусов и укусов насекомых (а также сопутствующих
Некоторые практикующие альтернативные методы, такие как Туллио Симончини, продвигали пищевую соду как лекарство от рака, от чего Американское онкологическое общество предостерегало из-за обоих его недоказанная эффективность и потенциальная опасность в использовании. Эдзард Эрнс назвал продвижение бикарбоната натрия в качестве лекарства от рака «одной из самых отвратительных альтернативных схем, которые я видел в течение долгого времени».
Бикарбонат натрия можно добавлять к местным анестетикам, чтобы ускорить наступление эффекта и сделать инъекцию менее болезненной. Он также является компонентом раствора Моффетта, используемого в назальной хирургии.
Было высказано предположение, что кислая диета ослабляет кости. Один систематический мета-анализ исследования не показывает такого эффекта. Другой также считает, что нет доказательств того, что щелочная диета улучшает здоровье костей, но предполагает, что щелочная диета «может иметь некоторую ценность» по другим причинам.
Растворы антацидов (например, пищевой соды) были приготовлены и используется протестующими для смягчения последствий воздействия слезоточивого газа во время протестов.
Подобно его использованию в выпечке, бикарбонат натрия используется вместе с мягкой кислотой, такой как винная кислота, в качестве вспомогательного вещества. в шипучих таблетках: когда такую таблетку бросают в стакан с водой, карбонат покидает реакционную среду в виде газообразного диоксида углерода (HCO 3 + H → H 2 O + CO 2 ↑ или, точнее, HCO 3 + H 3 O → 2 H 2 O + CO 2 ↑), оставляя лекарство растворенным в воде вместе с образовавшейся солью (в данном примере тартратом натрия).
Личная гигиена
Зубная паста, содержащая бикарбонат натрия, в нескольких исследованиях показала, что лучшее отбеливание и налет Эффект удаления, чем зубные пасты без него.
Бикарбонат натрия также используется в качестве ингредиента в некоторых жидкостях для полоскания рта. Обладает противокариесными и абразивными свойствами. Он действует как механическое очищающее средство для зубов и десен, нейтрализует выработку кислоты во рту, а также действует как антисептик для предотвращения инфекций. Бикарбонат натрия в сочетании с другими ингредиентами можно использовать для приготовления сухого или влажного дезодоранта. Бикарбонат натрия можно использовать в качестве буферного агента в сочетании с поваренной солью при создании раствора для орошения носа.
. Он используется в гигиене глаз для лечения блефарита. Это делается путем добавления чайной ложки бикарбоната натрия в прохладную воду, которая была недавно кипячена, с последующей осторожной очисткой основания ресниц ватным тампоном, смоченным в растворе.
Использование в ветеринарии
Бикарбонат натрия используется в качестве добавки к корму для крупного рогатого скота, в частности в качестве буферного агента для рубца.
В спорте
Хотя небольшие дозы бикарбоната натрия использовались в качестве добавка для спортсменов в соревнованиях на скорость, таких как бег на средние дистанции, доказательств ее пользы недостаточно, а передозировка представляет собой риск для здоровья, поскольку бикарбонат натрия может вызвать раздражение желудочно-кишечного тракта.
Очистка агент
Бикарбонат натрия используется в процессе удаления краски и коррозии, называемом гидробластинг. В качестве абразивной среды бикарбонат натрия используется для удаления поверхностных загрязнений с более мягких и менее эластичных субстратов, таких как алюминий, медь или дерево, которые могут быть повреждены абразивным материалом из кварцевого песка.
A производитель рекомендует пасту из пищевой соды с минимальным количеством воды в качестве мягкого чистящего порошка, которая полезна для удаления поверхностной ржавчины, так как ржавчина образует водорастворимое соединение в концентрированном щелочном растворе; следует использовать холодную воду, так как растворы горячей воды могут вызвать коррозию стали. Бикарбонат натрия разрушает тонкий защитный оксидный слой, который образуется на алюминии, что делает его непригодным для очистки этого металла. Раствор в теплой воде удалит налет с серебра при контакте серебра с куском алюминиевой фольги. Пищевая сода обычно добавляется в стиральные машины в качестве замены смягчителя воды и для удаления запахов с одежды. Он также эффективен для удаления тяжелых пятен от чая и кофе с чашек при разбавлении теплой водой.
Во время Манхэттенского проекта по разработке ядерной бомбы в начале 1940-х годов химическая токсичность урана была проблемой. Было обнаружено, что оксиды урана очень хорошо прилипают к хлопковой ткани и не смываются мылом или стиральным порошком. Однако уран вымывается 2% -ным раствором бикарбоната натрия. Одежда может быть загрязнена токсичной пылью обедненного урана (DU), которая очень плотная и поэтому используется в качестве противовесов в гражданском контексте и в бронебойных снарядах. DU не удаляется обычной стиркой; промывка примерно 6 унциями (170 г) пищевой соды в 2 галлонах (7,5 л) воды поможет вымыть ее.
Контроль запаха
Часто утверждают, что пищевая сода неэффективна. эффективное средство для удаления запаха, и часто рекомендуется хранить открытую коробку в холодильнике для поглощения запаха. Эту идею продвигал ведущий американский бренд пищевой соды Arm Hammer в рекламной кампании, начавшейся в 1972 году. Хотя эта кампания считается классикой маркетинга, ведущей в более чем в половине американских холодильников, содержащих коробку пищевой соды, мало доказательств того, что он действительно эффективен в этом приложении.
Химия
Бикарбонат натрия — это амфотерный соединение. Водные растворы являются умеренно щелочными из-за образования угольной кислоты и иона гидроксида :
- HCO. 3+ H 2 O → H. 2CO. 3+ OH
Бикарбонат натрия можно использовать в качестве промывки для удаления любых кислотных примесей из «сырой» жидкости, что позволяет получить более чистый образец. Взаимодействие бикарбоната натрия и кислоты дает соль и угольную кислоту, которая легко разлагается до диоксида углерода и воды:
- NaHCO 3 + HCl → NaCl + H 2CO3
- H2CO3→ H 2 O + CO 2 (г)
Бикарбонат натрия реагирует с уксусной кислотой (обнаруженной в уксусе ), образуя ацетат натрия, вода и диоксид углерода :
- NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2 (г)
Бикарбонат натрия реагирует с основаниями, такими как гидроксид натрия, с образованием карбонатов:
- NaHCO 3 + NaOH → Na 2CO3+ H 2O
Термическое разложение
При температурах 80–100 ° C (176–212 ° F) бикарбонат натрия постепенно разлагается на карбонат натрия, воду и углерод. диоксид. Преобразование происходит быстрее при 200 ° C (392 ° F):
- 2 NaHCO 3 → Na 2CO3+ H 2 O + CO 2
Большинство бикарбонатов подвергаются этому реакция дегидратации. Дальнейшее нагревание превращает карбонат в оксид (выше 850 ° C / 1560 ° F):
- Na2CO3→ Na 2 O + CO 2
Эти преобразования актуальны для использования NaHCO 3 в качестве огнетушащего вещества («порошок BC») в некоторых порошковых огнетушителях.
История
В 1791 году французский химик Николя Леблан производил карбонат натрия, также известный как кальцинированная сода. В 1846 году два американских пекаря, Джон Дуайт и Остин Черч, основали первый в США завод по производству пищевой соды из карбоната натрия и диоксида углерода.
Saleratus., бикарбонат калия или натрия, упоминается в романе Captains Courageous Редьярда Киплинга как широко используемый в 1800-х годах в коммерческом рыболовстве для предотвращения порчи только что пойманной рыбы.
В 1919 году сенатор США заявил, что бикарбонат соды может вылечить испанский грипп… В разгар дебатов 26 января 1919 года сенатор Оверман прервал дискуссию, чтобы объявить об открытии лекарства. «Я хочу сказать для тех, кто проводит это расследование, — сообщил он, — что мне сказал судья вышестоящего суда в горной стране Северной Каролины, что они открыли лекарство от этой болезни». Предполагаемое лекарство предполагало критику современной науки и признание простой мудрости простых людей. «Они говорят, что обычная пищевая сода вылечит болезнь, — продолжил он, — что они вылечили ее с ее помощью, что у них вообще нет смертей; они используют обычную пищевую соду, которая лечит болезнь». — Американская пандемия: затерянные миры эпидемии гриппа 1918 г., Oxford University Press, 15 марта 2012 г., стр. 178
Производство
Бикарбонат натрия промышленно производится из карбоната натрия :
- Na2CO3+ CO 2 + H 2 O → 2 NaHCO 3
Производится в масштабе около 100000 тонн / год (по состоянию на 2001 год). Коммерческие количества пищевой соды также производятся аналогичным способом: кальцинированная сода, добываемая в виде руды трона, растворяется в воде и обрабатывается диоксидом углерода. Бикарбонат натрия выпадает в осадок из этого раствора в виде твердого вещества.
Что касается процесса Сольвея, бикарбонат натрия является промежуточным продуктом в реакции хлорида натрия, аммиака и диоксид углерода. Однако продукт имеет низкую чистоту (75%).
- NaCl + CO2 + NH3 + H2O → NaHCO 3 + NH4Cl
Несмотря на отсутствие практической ценности, NaHCO 3 может быть получен реакцией диоксида углерода с водным раствор гидроксида натрия:
- CO2+ NaOH → NaHCO 3
Добыча
Природные месторождения нахколита (NaHCO 3) обнаружены в эоцене — возраст (55,8–33,9 млн лет назад) Формация Грин-Ривер, Бассейн Писенс в Колорадо. Нахколит отлагался пластами в периоды сильного испарения в бассейне. Он добывается в промышленных масштабах с использованием обычных методов подземной добычи, таких как буровая, барабанная и длинная забойная разработка, аналогично добыче угля.
Ограниченное количество продукта дополнительно получают путем добычи раствора, прокачивая нагретую воду через ранее добытые слои нахколита и восстановление растворенного нахколита над землей в процессе кристаллизации при естественном охлаждении. В настоящее время только компания Genesis Alkali (ранее Tronox, ранее FMC) в бассейне Грин-Ривер, штат Вайоминг, успешно добыла продукт в коммерческих растворах.
В популярной культуре
Film
Бикарбонат натрия, как «гидрокарбонат соды», был частым источником изюминки для Граучо Маркса в фильмах братьев Маркс. В Утиный суп Маркс играет лидера нации, находящейся в состоянии войны. В одной из сцен он получает сообщение с поля боя, что его генерал сообщает о газовой атаке, и Граучо говорит своему помощнику: «Скажите ему, чтобы он выпил чайную ложку соды и полстакана воды». В Ночь в Опере персонаж Граучо обращается к толпе на открытии оперы, говоря о ведущем теноре: «Синьор Ласспарри происходит из очень известной семьи. Его мать была известной бас-певицей. Его отец был первым человеком, который заправил спагетти бикарбонатом соды, тем самым вызвав и вылечив одновременно несварение желудка ».
См. Также
Ссылки
Библиография
Внешние ссылки
Бикарбонат натрия ГОСТ 4201-79
NaHCO3
Гидрокарбонат натрия (Natrii hydrocarbonas) NaHCO3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый) — кислая соль угольной кислоты и натрия. Обыкновенно представляет собой мелкокристаллический порошок белого цвета. Используется в пищевой промышленности, в кулинарии, в медицине как нейтрализатор ожогов кожи и слизистых оболочек человека кислотами и снижения кислотности желудочного сока. Также — в буферных растворах, так как в широком диапазоне концентраций растворов его pH незначительно изменяется.
| Физические свойства | |
|---|---|
| Состояние |
твёрдое |
| Молярная масса |
84.007 г/моль |
| Плотность |
2,159 г/см³ |
| Термические свойства | |
| Т. разл. |
60-200 °C |
| Химические свойства | |
| Растворимость в воде |
9,59 г/100 мл |
Чтобы узнать о разрыхлителе, обычным ингредиентом которого является пищевая сода, см. Порошок для выпечки.
|
|
эта статья нужны дополнительные цитаты для проверка. Пожалуйста помоги улучшить эту статью от добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален. |
 |
||
|
||
 |
||
| Имена | ||
|---|---|---|
| Название ИЮПАК
Гидрокарбонат натрия |
||
| Другие имена
Пищевая сода, бикарбонат (лабораторный сленг), бикарбонат соды, нахолит |
||
| Идентификаторы | ||
|
Количество CAS |
|
|
|
3D модель (JSmol ) |
|
|
|
Ссылка на Beilstein |
4153970 | |
| ЧЭБИ |
|
|
| ЧЭМБЛ |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.005.122 |
|
| Номер ЕС |
|
|
| Номер E | E500 (ii) (регуляторы кислотности, …) | |
|
IUPHAR / BPS |
|
|
| КЕГГ |
|
|
| MeSH | Натрий + бикарбонат | |
|
PubChem CID |
|
|
| Номер RTECS |
|
|
| UNII |
|
|
|
Панель управления CompTox (EPA) |
|
|
|
ИнЧИ
|
||
|
Улыбки
|
||
| Свойства | ||
|
Химическая формула |
NaHCO 3 |
|
| Молярная масса | 84,0066 г моль−1 | |
| Внешность | Белые кристаллы | |
| Запах | Без запаха | |
| Плотность |
|
|
| Температура плавления | (Разлагается на карбонат натрия начиная с 50 ° C[1][6]) | |
|
Растворимость в воде |
|
|
| Растворимость | 0,02 мас.% Ацетона, 2,13 мас.% Метанола при 22 ° C.[4] не растворим в этиловый спирт | |
| журнал п | −0.82 | |
| Кислотность (пKа) |
|
|
|
Показатель преломления (пD) |
nα = 1,377 nβ = 1,501 nγ = 1,583 | |
| Структура | ||
|
Кристальная структура |
Моноклиника | |
| Термохимия | ||
|
Теплоемкость (C) |
87,6 Дж / моль К[7] | |
|
Стандартный моляр |
101,7 Дж / моль К[7] | |
|
Станд. Энтальпия |
-950,8 кДж / моль[7] | |
|
Свободная энергия Гиббса (Δжг˚) |
-851,0 кДж / моль[7] | |
| Фармакология | ||
|
Код УВД |
B05CB04 (КТО) B05XA02 (КТО), QG04BQ01 (КТО) | |
|
Маршруты |
Внутривенно, перорально | |
| Опасности | ||
| Основной опасности | Вызывает серьезное раздражение глаз | |
| Паспорт безопасности | Внешний паспорт безопасности материалов | |
| NFPA 704 (огненный алмаз) |
0 2 1 |
|
| точка возгорания | Негорючий | |
| Смертельная доза или концентрация (LD, LC): | ||
|
LD50 (средняя доза ) |
4220 мг / кг (крыса, перорально)[8] | |
| Родственные соединения | ||
|
Другой анионы |
Карбонат натрия | |
|
Другой катионы |
|
|
|
Родственные соединения |
|
|
|
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
||
| Ссылки на инфобоксы | ||
Кексы, запеченные с пищевой содой в качестве разрыхлителя
Бикарбонат натрия (Название ИЮПАК: гидрокарбонат натрия), широко известный как пищевая сода или бикарбонат соды, это химическое соединение с формулой NaHCO3. Это поваренная соль состоит из натрий катион (Na+ ) и бикарбонат анион (HCO3− ). Бикарбонат натрия — белое твердое вещество, которое кристаллический, но часто выглядит как мелкий порошок. Имеет слегка соленый, щелочной вкус напоминающий стиральную соду (карбонат натрия ). Природная минеральная форма нахколит. Это компонент минерала Натрон и растворяется во многих минеральных источниках. [9]
Номенклатура
Поскольку соль известна давно и широко используется, она имеет много родственных названий, таких как пищевая сода, хлебная сода, кулинарная сода, и бикарбонат соды. Период, термин пищевая сода чаще встречается в США, тогда как бикарбонат соды чаще встречается в Австралии и Великобритании.[10] В разговорной речи названия бикарбонат натрия и бикарбонат соды часто сокращаются; распространены такие формы, как бикарбонат натрия, бикарбонат натрия, бикарбонат и бикарбонат.[нужна цитата ]
Слово Saleratus, от латинский Sal æratus (что означает «газированная соль»), широко использовалась в 19 век как для бикарбоната натрия, так и для бикарбонат калия.[11]
Он известен как один из Номер E пищевые добавки E500.[нужна цитата ]
Префикс би в бикарбонат исходит из устаревшей системы именования и основан на наблюдении, что в два раза больше карбонат (CO3) на натрий в бикарбонате натрия (NaHCO3) как есть в карбонат натрия (Na2CO3). Современные химические формулы этих соединений выражают их точный химический состав (который был неизвестен, когда названия карбонат натрия и бикарбонат натрия были придуманы) как гидрокарбонат натрия (NaHCO3) и карбонат натрия (Na2CO3). Эти названия однозначны, так как натрий всегда имеет +1 степень окисления и карбонат в степени окисления -2.[нужна цитата ]
Использует
Готовка
Закваска
В кулинарии пищевая сода в основном используется в выпечка как разрыхлитель. Когда он вступает в реакцию с кислотой, выделяется углекислый газ, который вызывает расширение жидкого теста и формирование характерной текстуры и зерна в тортах. быстрый хлеб, содовый хлеб, а также другие печеные и жареные продукты. Кислотно-щелочная реакция в общих чертах может быть представлена следующим образом:[12]
- NaHCO3 + H+ → Na+ + CO2 + H2О
Кислотные материалы, которые вызывают эту реакцию, включают: гидрофосфаты, соус тартар, лимонный сок, йогурт, пахта, какао, и уксус. Пищевая сода может использоваться вместе с закваска, который является кислым, что делает продукт более легким и менее кислым.[13]
Тепло само по себе может привести к тому, что бикарбонат натрия станет разрыхлителем при выпечке из-за термическое разложение, выделяя диоксид углерода при температуре выше 80 ° C (180 ° F), а именно:[14]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
При использовании таким способом самостоятельно, без присутствия кислотного компонента (будь то жидкое тесто или использование разрыхлителя, содержащего кислоту), только половина доступного CO2 выпущен (один СО2 молекула образуется на каждые два эквивалента NaHCO3). Кроме того, в отсутствие кислоты термическое разложение бикарбоната натрия также дает карбонат натрия, который является сильнощелочным и придает выпечке горький, «мыльный» вкус и желтый цвет. Поскольку реакция протекает медленно при комнатной температуре, смеси (тесто для пирогов и т. Д.) Можно выдерживать, не поднимаясь, пока они не нагреются в духовке.[нужна цитата ]
При добавлении кислоты, щелочных ингредиентов, таких как цельное молоко или Обработанный по-голландски какао часто добавляют в выпечку, чтобы избежать кислого привкуса.[15]
Порошок для выпечки
Порошок для выпечки, также продаваемый для приготовления пищи, содержит около 30% бикарбоната и различных кислотных ингредиентов, которые активируются при добавлении воды, без необходимости добавления кислот в среду для приготовления пищи.[16][17][18] Многие формы разрыхлителя содержат бикарбонат натрия в сочетании с кислый фосфат кальция, фосфат натрия-алюминия, или соус тартар.[19] Пищевая сода щелочная; кислота, используемая в разрыхлителе, позволяет избежать металлического привкуса, когда химические изменения во время выпечки создают карбонат натрия.[нужна цитата ]
Другой
Бикарбонат натрия иногда использовали при приготовлении зеленых овощей,[когда? ] поскольку он придает им ярко-зеленый цвет — который был описан как искусственно выглядящий — из-за его реакции с хлорофилл производить хлорофиллин.[20] Однако это имеет тенденцию влиять на вкус, текстуру и содержание питательных веществ и больше не встречается.[21][нужен лучший источник ]
Пищевая сода используется для смягчения импульсы (горох, фасоль) до и во время приготовления, как в традиционном британском пюре из гороха рецепт замачивания гороха. Основным действием бикарбоната натрия является изменение pH раствора для замачивания и воды для приготовления пищи; это смягчает твердую внешнюю оболочку, сокращает время приготовления и может изменить процентное содержание питательных веществ в блюде, его вкус и консистенцию.[нужна цитата ]
Пищевая сода может вступать в реакцию с кислотами в продуктах питания, в том числе с витамин C (L-аскорбиновая кислота).[нужна цитата ]
Он используется в азиатской и латиноамериканской кухне для смягчать мясо. Он также используется в панировка, например, для жареных продуктов, чтобы сделать их более хрустящими и пропустить пар, чтобы панировка не сдувалась во время приготовления.[нужна цитата ]
Фунгициды и борьба с вредителями
Бикарбонат натрия может быть эффективным способом борьбы с ростом грибков,[22] и в США зарегистрирован Агентство по охране окружающей среды как биопестицид.[23]
Повышение щелочности / pH
Бикарбонат натрия можно добавлять в бассейны, спа и садовые пруды для увеличения общего количества щелочность (увеличьте pH).[24]
Пиротехника
Бикарбонат натрия — один из основных компонентов обычного фейерверк «черная змея». Эффект вызван термическим разложением, в результате которого образуется углекислый газ с длительным змея -подобный зола как продукт сгорания другого основного компонента, сахароза.[нужна цитата ] Бикарбонат натрия также используется для замедления реакций горения за счет выделения CO.2 и H2O при нагревании, оба из которых являются антипиренами.
Мягкое дезинфицирующее средство
Имеет слабый дезинфицирующее средство свойства,[25][26] и это может быть эффективным фунгицид против некоторых организмов.[27] Поскольку пищевая сода впитывает затхлый запах, она стала надежным средством подержанная книга продавцы, делая книги менее неприятными.[28]
Огнетушитель
Бикарбонат натрия можно использовать для тушения небольших пожаров, связанных с жиром или электрическим током, если его бросить на огонь, поскольку при нагревании бикарбоната натрия выделяется диоксид углерода.[29] Однако его не следует применять при пожарах в фритюрницы; внезапный выброс газа может вызвать разбрызгивание смазки.[29] Бикарбонат натрия используется в Британской Колумбии. сухой химический огнетушители как альтернатива более агрессивным диаммонийфосфат в огнетушителях ABC. Щелочная природа бикарбоната натрия делает его единственным сухим химическим агентом, кроме Фиолетовый-К, который использовался в крупномасштабных системах пожаротушения, установленных на коммерческих кухнях. Поскольку он может действовать как щелочь, средство имеет мягкий омыление действует на горячую смазку, образуя удушающую мыльную пену.[нужна цитата ]
Нейтрализация кислот
Бикарбонат натрия самопроизвольно реагирует с кислотами с выделением CO.2 газ как продукт реакции. Он обычно используется для нейтрализации нежелательных кислотных растворов или разливов кислоты в химических лабораториях.[30] Не рекомендуется использовать бикарбонат натрия для нейтрализации основания.[31] хотя это амфотерный, реагируя как с кислотами, так и с основаниями.[нужна цитата ]
Использование в медицине и здоровье
Бикарбонат натрия, смешанный с водой, может использоваться как антацид лечить изжога и изжога.[32] Его реакция с желудочной кислоты производит соль, воду и углекислый газ:
- NaHCO3 + HCl → NaCl + H2O + CO2(г)
Смесь бикарбоната натрия и полиэтиленгликоль такие как PegLyte,[33] растворенный в воде и принимаемый внутрь, является эффективным промывание желудочно-кишечного тракта подготовка и слабительное перед операцией на желудочно-кишечном тракте, гастроскопия, так далее.[нужна цитата ]
Бикарбонат натрия внутривенно в водном растворе иногда используется при ацидоз, или когда в крови недостаточно ионов натрия или бикарбоната.[34] В случае респираторного ацидоза введенный ион бикарбоната сдвигает буфер углекислоты / бикарбоната плазмы влево и, таким образом, повышает pH. По этой причине бикарбонат натрия используется под медицинским наблюдением. сердечно-легочная реанимация. Инфузия бикарбоната показана только в том случае, если pH крови заметно низок (<7,1–7,0).[35]
HCO3− используется для лечения гиперкалиемия, так как он будет вести K+ обратно в клетки в периоды ацидоза.[36] Поскольку бикарбонат натрия может вызвать алкалоз, его иногда используют для лечения передозировки аспирина. Аспирин требует кислой среды для правильного всасывания, а щелочная среда уменьшает абсорбцию аспирина в случае передозировки.[37] Бикарбонат натрия также использовался при лечении передозировка трициклическим антидепрессантом.[38] Его также можно наносить местно в виде пасты, состоящей из трех частей пищевой соды и одной части воды, чтобы облегчить некоторые виды укусов насекомых (а также сопутствующего отека).[39]
Некоторые альтернативные практики, такие как Туллио Симончини продвигали пищевую соду как рак лекарство, против которого предостерегает Американское онкологическое общество из-за его недоказанной эффективности и потенциальной опасности при использовании.[40] Эдзард Эрнст назвал продвижение бикарбоната натрия в качестве лекарства от рака «одной из самых отвратительных альтернативных афер, которые я видел в течение долгого времени».[41]
Бикарбонат натрия можно добавлять в местные анестетики, чтобы ускорить наступление их эффекта и сделать инъекцию менее болезненной.[42] Это также компонент Решение Моффетта, используется в носовой хирургия.[нужна цитата ]
Было высказано предположение, что кислая диета ослабляет кости.[43] Один систематический мета-анализ исследования не показывает такого эффекта.[44] Другой также обнаружил, что нет никаких доказательств того, что щелочные диеты улучшают здоровье костей, но предполагает, что щелочные диеты «могут иметь некоторую ценность» по другим причинам.[45]
Антацид (например, пищевая сода) были приготовлены и использованы протестующими для смягчения последствий воздействия слезоточивый газ во время протестов.[46][неудачная проверка ][47]
Как и в выпечке, бикарбонат натрия используется вместе с слабой кислотой, такой как Винная кислота в качестве наполнителя в шипучих таблетках: когда такую таблетку бросают в стакан с водой, карбонат покидает реакционную среду в виде газообразного диоксида углерода (HCO3− + H+ → H2O + CO2↑ или, точнее, HCO3− + H3О+ → 2 H2O + CO2↑), оставляя лекарство растворенным в воде вместе с образовавшейся солью (в этом примере тартрат натрия ).[48]
Личная гигиена
Зубная паста содержащие бикарбонат натрия, в нескольких исследованиях показали, что они лучше отбеливают[49][50][51] и эффект удаления налета[52][53] чем зубные пасты без него.[нужна цитата ]
Бикарбонат натрия также используется в качестве ингредиента в некоторых жидкостях для полоскания рта. Обладает противокариесными и абразивными свойствами.[54] Он действует как механическое очищающее средство для зубов и десен, нейтрализует выработку кислоты во рту, а также действует как антисептик чтобы предотвратить инфекции.[55][56] Бикарбонат натрия в сочетании с другими ингредиентами можно использовать для приготовления сухого или влажного дезодорант.[57][58] Бикарбонат натрия можно использовать в качестве буферного агента в сочетании с поваренной солью при создании раствора для орошение носа.[59]
Он используется в гигиене глаз для лечения блефарит. Это делается путем добавления чайной ложки бикарбоната натрия в прохладную воду, которая была недавно кипячена, с последующим нежным протиранием основы ресниц ватным тампоном, смоченным в растворе.[60]
Ветеринарное использование
Бикарбонат натрия используется в качестве добавки к корму для крупного рогатого скота, в частности, как буферный агент для рубец.[61]
В спорте
Хотя небольшие дозы бикарбоната натрия использовались в качестве добавки для спортсменов в соревнованиях, основанных на скорости, таких как бег на средние дистанции, доказательств его пользы недостаточно, а передозировка — это серьезная проблема. риск для здоровья потому что бикарбонат натрия может вызвать раздражение желудочно-кишечного тракта.[62]
Чистящее средство
Бикарбонат натрия используется в процессе удаления краски и коррозии, называемого губительный. В качестве абразивоструйной среды используется бикарбонат натрия для удаления поверхностных загрязнений с более мягких и менее эластичных субстраты например, алюминий, медь или дерево, которые могут быть повреждены абразивным материалом из кварцевого песка.[63]
Производитель рекомендует пасту из пищевой соды с минимальным количеством воды в качестве мягкого чистящего порошка.[29] и полезен при удалении поверхностной ржавчины, поскольку ржавчина образует водорастворимое соединение в концентрированном щелочном растворе;[64] следует использовать холодную воду, так как растворы горячей воды могут вызвать коррозию стали. [65] Бикарбонат натрия разрушает тонкий защитный оксидный слой, который образуется на алюминии, что делает его непригодным для очистки этого металла.[66] Раствор в теплой воде удалит тускнеть из серебра, когда серебро соприкасается с куском алюминиевая фольга.[66][67] Пищевая сода обычно добавляется в стиральные машины в качестве замены смягчителя воды и для удаления запахов с одежды. Он также эффективен для удаления тяжелых пятен от чая и кофе с чашек при разбавлении теплой водой.
В течение Манхэттенский проект При разработке ядерной бомбы в начале 1940-х химическая токсичность урана была проблемой. Было обнаружено, что оксиды урана очень хорошо прилипают к хлопковой ткани и не смываются мылом или стиральным порошком. Однако уран вымывается 2% -ным раствором бикарбоната натрия. Одежда может быть загрязнена токсичной пылью обедненный уран (DU), который очень плотный, поэтому используется для противовесов в гражданском контексте и в бронебойных снарядах. DU не удаляется обычной стиркой; промывание с помощью примерно 170 г пищевой соды в 2 галлонах (7,5 л) воды поможет вымыть ее.[68]
Контроль запаха
Часто утверждают, что пищевая сода является эффективным средством для удаления запаха,[69][нужен лучший источник ] и часто рекомендуется хранить открытую коробку в холодильнике для поглощения запаха.[70] Эту идею продвигал ведущий американский бренд пищевой соды, Рука и молот в рекламной кампании, начатой в 1972 году.[71] Хотя эта кампания считается классикой маркетинг, что за год привело к тому, что более половины американских холодильников содержали ящик пищевой соды,[72][73] мало доказательств того, что он действительно эффективен в этом приложении.[74][75]
Химия
Бикарбонат натрия — это амфотерный соединение. Водные растворы мягко щелочной из-за образования угольная кислота и гидроксид ион:
- HCO−
3 + H2O → ЧАС
2CO
3 + ОН−
Бикарбонат натрия можно использовать в качестве промывки для удаления любых кислотных примесей из «сырой» жидкости, что позволяет получить более чистый образец. Реакция бикарбоната натрия и кислота производит соль и угольную кислоту, которая легко разлагается на диоксид углерода и воду:
- NaHCO3 + HCl → NaCl + H2CO3
- ЧАС2CO3 → H2O + CO2(г)
Бикарбонат натрия реагирует с уксусная кислота (нашел в уксус ), производя ацетат натрия, вода и углекислый газ:
- NaHCO3 + CH3COOH → CH3COONa + H2O + CO2(г)
Бикарбонат натрия реагирует с базы такие как гидроксид натрия с образованием карбонатов:
- NaHCO3 + NaOH → Na2CO3 + H2О
Термическое разложение
При температуре от 80 до 100 ° C (176–212 ° F) бикарбонат натрия постепенно разлагается на карбонат натрия, воду и диоксид углерода. Преобразование происходит быстрее при 200 ° C (392 ° F):[76]
- 2 NaHCO3 → Na2CO3 + H2O + CO2
Большинство бикарбонатов подвергаются этому реакция дегидратации. Дальнейшее нагревание превращает карбонат в окись (выше 850 ° C / 1560 ° F):[76]
- Na2CO3 → Na2O + CO2
Эти преобразования относятся к использованию NaHCO3 в качестве огнетушащего вещества («порошок BC») в виде сухого порошка. огнетушители.[нужна цитата ]
История
В 1791 г. французский химик Николя Леблан произвел карбонат натрия, также известный как кальцинированной соды. В 1846 году два американских пекаря, Джон Дуайт и Остин Черч, основал первый в США завод по производству пищевой соды из карбоната натрия и углекислый газ.[77]
Салератус, бикарбонат калия или натрия, упоминается в романе Отважные капитаны от Редьярд Киплинг как широко использовавшийся в 1800-х годах в коммерческом рыболовстве, чтобы предотвратить порчу свежевыловленной рыбы.[78]
В 1919 году сенатор США заявил, что бикарбонат соды может вылечить испанский грипп … В разгар дебатов 26 января 1919 года сенатор Оверман прервал дискуссию, объявив об открытии лекарства. «Я хочу сказать для тех, кто проводит это расследование, — сообщил он, — что мне сказал судья вышестоящего суда в горной стране Северной Каролины, что они открыли лекарство от этой болезни». Предполагаемое лекарство предполагало критику современной науки и признание простой мудрости простых людей. «Они говорят, что обычная пищевая сода вылечит болезнь, — продолжил он, — что они вылечили ее с ее помощью, что у них вообще нет смертей; они используют обычную пищевую соду, которая лечит болезнь». — Американская пандемия: Затерянные миры эпидемии гриппа 1918 г., Oxford University Press, 15 марта 2012 г., стр. 178
Производство
Бикарбонат натрия промышленно производится из карбонат натрия:[79]
- Na2CO3 + CO2 + H2O → 2 NaHCO3
Производится в масштабе около 100 000 тонн / год (по состоянию на 2001 год).[сомнительный – обсудить] [80] с мировой производственной мощностью 2,4 миллиона тонн в год (по состоянию на 2002 год).[81] Коммерческое количество пищевой соды также производится аналогичным методом: кальцинированная сода добывается в виде руды. трона, растворяется в воде и обрабатывается диоксидом углерода. Бикарбонат натрия выпадает в осадок из этого раствора.[нужна цитата ]
Взяв во внимание Сольвеевский процесс, бикарбонат натрия является промежуточным продуктом реакции хлорид натрия, аммиак, и углекислый газ. Однако продукт имеет низкую чистоту (75%).[нужна цитата ]
- NaCl + CO2 + NH3 + ЧАС2О → NaHCO3 + NH4Cl
Хотя не имеет практического значения, NaHCO3 может быть получен реакцией диоксида углерода с водный раствор гидроксида натрия:[нужна цитата ]
- CO2 + NaOH → NaHCO3
Добыча
Встречающиеся в природе месторождения нахколита (NaHCO3) находятся в эоцен — возраст (55,8–33,9 млн лет назад) Формация Грин Ривер, Piceance Basin в Колорадо. Нахколит отлагался пластами в периоды сильного испарения в бассейне. В промышленных масштабах он добывается с использованием обычных методов подземной добычи, таких как буровая, барабанная и длинная забоя, аналогично добыче угля.[нужна цитата ]
Ограниченные количества продукта дополнительно получают путем добычи раствора, прокачки нагретой воды через ранее добытые пласты нахколита и восстановления растворенного нахколита над землей посредством процесса кристаллизации с естественным охлаждением. В настоящее время только компания Genesis Alkali (ранее Tronox, ранее FMC) в бассейне реки Грин-Ривер, штат Вайоминг, успешно добыла этот продукт на коммерческой основе.[нужна цитата ][82]
В популярной культуре
Фильм
Бикарбонат натрия, как «бикарбонат соды», был частым источником изюминки для Граучо Маркс в Братья маркс фильмы. В Утиный суп, Маркс играет лидера нации в состоянии войны. В одной из сцен он получает сообщение с поля боя, что его генерал сообщает о газовой атаке, и Граучо говорит своему помощнику: «Скажите ему, чтобы он выпил чайную ложку соды и полстакана воды».[83] В Ночь в опере, Персонаж Граучо обращается к публике на премьере оперы, говоря о ведущем теноре: «Синьор Ласспарри происходит из очень известной семьи. Его мать была известной бас-певицей. Его отец был первым человеком, который начал начинять спагетти бикарбонатом натрия. соды, вызывая и вылечивая одновременно несварение желудка «.[84]
Смотрите также
- Угольная кислота
- Список неэффективных методов лечения рака
- Список минералов
- Натрон
- Натрона (значения)
- Трона
использованная литература
- ^ а б Хейнс, стр. 4,90
- ^ а б c Хейнс, стр. 5,194
- ^ а б c «Бикарбонат натрия» (PDF). Программа ООН по окружающей среде. Архивировано из оригинал (PDF) на 2011-05-16.
- ^ Эллингбоу Дж. Л., Руннелс Дж. Х. (1966). «Растворимость карбоната натрия и бикарбоната натрия в смесях ацетон-вода и метанол-вода». J. Chem. Англ. Данные. 11 (3): 323–324. Дои:10.1021 / je60030a009.
- ^ а б Хейнс, стр. 7,23
- ^ Паскуали I, Беттини Р., Джордано Ф. (2007). «Температурное поведение композиций диклофенака, диклофенака натрия и бикарбоната натрия». Журнал термического анализа и калориметрии. 90 (3): 903–907. Дои:10.1007 / s10973-006-8182-1. S2CID 95695262.
- ^ а б c d Хейнс, стр. 5,19
- ^ Чемберс М. «Бикарбонат натрия [USP: JAN]». ChemIDplus. Национальная медицинская библиотека США.
- ^ https://www.sciencedirect.com/topics/engineering/mineral-springs
- ^ «В чем разница между бикарбонатом соды, пищевой содой и разрыхлителем?». Такова жизнь! Тихоокеанская сеть.
- ^ «Определение SALERATUS». www.merriam-webster.com. Получено 2020-12-06.
- ^ Бент А.Дж., изд. (1997). Технология изготовления тортов (6 изд.). Springer. п. 102. ISBN 9780751403497. Получено 2009-08-12.
- ^ Cascio J. «Закваска» (PDF). Университет Аляски в Фэрбенксе Совместная служба поддержки. FNH-00061. Архивировано из оригинал (PDF) 27 марта 2016 г.. Получено 2 мая 2017.
- ^ «Практическое применение пищевой соды на кухне». About.com Food. Получено 2017-01-22.
Короче говоря, использование пищевой соды их много: он дезодорирует, нейтрализует и очищает все без токсичного беспорядка большинства коммерческих продуктов.
- ^ «Выпечка 101: разница между пищевой содой и разрыхлителем». Радость пекаря. Получено 2015-08-04.
- ^ Черногорский JH, Хукер Р. «Химия выпечки» (PDF). Новозеландский институт химии. Архивировано из оригинал (PDF) на 2016-11-27. Получено 2017-01-22.
- ^ «Пищевая сода и разрыхлитель». FineCooking.com. Получено 2017-01-22.
- ^ «Часто задаваемые вопросы о пищевой соде». Arm & Hammer, мультибрендовые. Компания Черч и Дуайт. В чем разница пищевая сода и разрыхлитель ?. Архивировано из оригинал 27 июня 2017 г.. Получено 20 июля 2017.
- ^ «Глоссарий ингредиенты». Cooking.com. Архивировано из оригинал 15 сентября 2008 г.
- ^ Шрилакшми Б. (2003). Наука о еде. New Age International. п. 188. ISBN 978-81-224-1481-3.
- ^ Сукхадвала С. «Бикарбонат соды рецепты». BBC Food. Получено 20 июля 2017.
- ^ Бикарбонат калия (073508) и бикарбонат натрия (073505) Информационный бюллетень. Агентство по охране окружающей среды США. Обновлено 17 февраля 2011 г. Проверено 25 ноября 2011 г.
- ^ Зарегистрированный биофунгицид 29.04.02 Агентство по охране окружающей среды США. Обновлено 29 марта 2002 г. Проверено 25 ноября 2011 г.
- ^ «Руководство для владельцев бассейнов от Arm & Hammer Baking soda» (PDF). Armandhammer.com. Архивировано из оригинал (PDF) 7 сентября 2012 г.. Получено 30 июля 2009.
- ^ Малик Ю.С., Гоял С.М. (май 2006 г.). «Вирулицидная эффективность бикарбоната натрия на поверхности контакта с пищей против калицивируса кошек, суррогата норовируса». Международный журнал пищевой микробиологии. 109 (1–2): 160–3. Дои:10.1016 / j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (январь 2000 г.). «Антимикробная активность домашних дезинфицирующих средств и натуральных продуктов против потенциальных патогенов человека». Инфекционный контроль и больничная эпидемиология. 21 (1): 33–8. Дои:10.1086/501694. PMID 10656352.
- ^ Замани М., Шарифи Теграни А., Али Абади А.А. (2007). «Оценка противогрибковой активности карбонатных и бикарбонатных солей отдельно или в сочетании с агентами биологического контроля в борьбе с зеленой плесенью цитрусовых». Коммуникации в сельскохозяйственных и прикладных биологических науках. 72 (4): 773–7. PMID 18396809.
- ^ Альтман Г (22 мая 2006 г.). «Ремонт книг для мыслителей: как удалить запахи из книг». Книжный мыслитель (69).
- ^ а б c «Пищевая сода Arm & Hammer — Основы — Магия пищевой соды Arm & Hammer». armandhammer.com. Архивировано из оригинал 31 августа 2009 г.. Получено 30 июля 2009.
- ^ «Подготовка к чрезвычайным ситуациям от неконтролируемых опасностей». Американское химическое общество.
- ^ Хурум Д. «Лабораторная безопасность» (PDF). Гражданское строительство. Северо-Западный университет.
- ^ «Бикарбонат натрия». Джексон Сигельбаум Гастроэнтерология. 1998. Архивировано с оригинал на 2016-10-05. Получено 2016-10-04.
- ^ «ПегЛайт». Пендо Фама.
- ^ «Внутривенное вливание бикарбоната натрия» (PDF). Информация о потребительской медицине. Лучший канал здоровья. 2004-07-13. Архивировано из оригинал (PDF) на 22 августа 2008 г.
- ^ «Респираторный ацидоз: лечение и лекарства». эмедицина. 26 марта 2020.
- ^ Дарт RC (2004). Медицинская токсикология. Липпинкотт Уильямс и Уилкинс. С. 910–. ISBN 978-0-7817-2845-4.
- ^ Тканевые подгузники. Дональд С. Купер, доктор философии С. 46–.
- ^ [старая информация ]Кнудсен К., Абрахамссон Дж. (Апрель 1997 г.). «Адреналин и бикарбонат натрия независимо и аддитивно увеличивают выживаемость при экспериментальном отравлении амитриптилином». Реанимационная медицина. 25 (4): 669–74. Дои:10.1097/00003246-199704000-00019. PMID 9142034.
- ^ «Укусы и укусы насекомых: первая помощь». Клиника Майо. 2008-01-15.
- ^ «Бикарбонат натрия». Американское онкологическое общество. 28 ноября 2008. Архивировано 19 февраля 2013 года.. Получено 19 февраля 2013.CS1 maint: неподходящий URL (ссылка на сайт)
- ^ Эрнст Э (3 февраля 2017 г.). «Это должно быть самая отвратительная афера с раком, которую я когда-либо видел».
- ^ Эдгкомб Х., Хокинг Дж., Рэдклифф Дж. (2005). «Anesthesia UK: Местная анестезиологическая фармакология». Больница Джона Рэдклиффа, Оксфорд, Великобритания.
- ^ Фокс Д (15 декабря 2001 г.). «Твердый сыр». Новый ученый. Получено 20 июля 2017.
- ^ Танис Р. Фентон, Сюзанна С. Таф, Эндрю В. Лайон, Миша Элиашив, Дэвид А. Хэнли, «Причинно-следственная оценка кислотной нагрузки с пищей и болезней костей: систематический обзор и метаанализ с применением эпидемиологических критериев Хилла для определения причинной связи», Журнал питания 10: 41 (апрель 2011 г.), Дои:10.1186/1475-2891-10-41, полный текст
- ^ Джерри К. Швальфенберг, Щелочная диета: есть ли доказательства того, что щелочная диета приносит пользу здоровью?, Журнал окружающей среды и общественного здоровья 2012:727630, Дои:10.1155/2012/727630
- ^ Фергюсон Д. (2011-09-28). «‘Раствор маалокса и воды, используемый протестующими в качестве средства против слезоточивого газа «. Сырая история.
- ^ «Медицинская справка из Праги 2000». Архивировано из оригинал 2014-10-18.
- ^ Shirsand, S. B .; Суреш, Сарасиджа; Jodhana, L. S .; Свами, П. В. (2010). «Разработка рецептуры и оптимизация быстро распадающихся таблеток лоразепама шипучим методом». Индийский журнал фармацевтических наук. 72 (4): 431–436. Дои:10.4103 / 0250-474X.73911. ISSN 0250-474X. ЧВК 3013557. PMID 21218052. Получено 6 декабря 2020.
- ^ Клебер CJ, Мур MH, Нельсон BJ (1998). «Лабораторная оценка отбеливания зубов средствами для чистки зубов бикарбонатом натрия». Журнал клинической стоматологии. 9 (3): 72–5. PMID 10518866.
- ^ Koertge TE, Brooks CN, Sarbin AG, Powers D, Gunsolley JC (1998). «Продольное сравнение отбеливания зубов в результате использования средства для ухода за зубами». Журнал клинической стоматологии. 9 (3): 67–71. PMID 10518865.
- ^ Янкелл С.Л., Эмлинг Р.К., Петроне М.Э., Рустоги К., Вольпе А.Р., ДеВизио В. и др. (1999). «Шестинедельное клиническое исследование эффективности четырех имеющихся в продаже средств для чистки зубов для удаления внешних пятен на зубах». Журнал клинической стоматологии. 10 (3 Спец. №): 115–8. PMID 10825858.
- ^ Манкоди С, Берковиц Х, Дурбин К., Нельсон Б. (1998). «Оценка влияния чистки зубов на удаление зубного налета». Журнал клинической стоматологии. 9 (3): 57–60. PMID 10518862.
- ^ Патт М.С., Миллеман К.Р., Гассеми А., Форверк Л.М., Хупер В.Дж., Сопаркар П.М. и др. (2008). «Повышение эффективности удаления зубного налета при чистке зубов зубными средствами с пищевой содой: результаты пяти клинических исследований». Журнал клинической стоматологии. 19 (4): 111–9. PMID 19278079.
- ^ Сторехаген С., Осе Н., Мидха С. «Ингредиенты средств для чистки зубов и жидкостей для полоскания рта и их применение» (PDF). Институт стоматологической клиники. Universitetet i Oslo.
- ^ США 4132770A, Barth J, «Oral Product», выпущенный в 1979 г.
- ^ Икбал К., Асмат М., Джавед С., Муштак А., Мохсин Ф., Ханиф С. и др. (Июль 2011 г.). «Роль различных ингредиентов зубных паст и жидкостей для полоскания рта в здоровье полости рта» (PDF). JPDA (Журнал Пакистанской стоматологической ассоциации). 20 (3): 163–70.
- ^ Лэмб Дж. Х. (1946). «Бикарбонат натрия: отличный дезодорант». Журнал следственной дерматологии. 7 (3): 131–133. Дои:10.1038 / jid.1946.13.
- ^ «Бикарбонатная сода: натуральный дезодорант для тела». stableecho.com.
- ^ Мецон РБ (2005). Руководство Гарвардской медицинской школы по исцелению пороков. Макгроу Хилл. п. 68. ISBN 9780071444699.
- ^ «Блефарит. Лечение и причины. Воспаление век | Пациент». Терпеливый. Получено 2016-05-31.
- ^ Патон LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). «Использование бикарбоната натрия, предлагаемого по выбору или добавленного в рацион, для снижения риска рубцевого ацидоза у крупного рогатого скота». Канадский журнал зоотехники. 86 (3): 429–437. Дои:10.4141 / A06-014.
- ^ Хаджич, Миралем; Экштейн, Макс Леннарт; Шугардт, Моник (2019-06-01). «Влияние бикарбоната натрия на результативность в зависимости от продолжительности упражнений у спортсменов: систематический обзор». Журнал спортивной науки и медицины. 18 (2): 271–281. ISSN 1303-2968. ЧВК 6544001. PMID 31191097.
- ^ «Удалите грязь с помощью пищевой соды». Популярная механика. 5 августа 2013 г.. Получено 2 августа 2020.
- ^ Housecroft CE, Sharpe AG (2008). «Глава 22: d-блочная химия металлов: элементы первого ряда ». Неорганическая химия, 3-е издание. Пирсон. п. 716. ISBN 978-0-13-175553-6.
- ^ «Science Lab.com». MSDS — карбонат натрия. sciencelab.com. Архивировано из оригинал 5 сентября 2012 г.
- ^ а б «Методы отделки в металлоконструкциях». Художественный музей Филадельфии.
- ^ «Положи на него блеск». scifun.chem.wisc.edu. Архивировано из оригинал 31 июля 2012 г.. Получено 2011-03-06.
- ^ Orcutt JA. «Обедненный уран и здоровье: факты и полезные предложения». Фармакология и токсикология соединений урана. Макгроу-Хилл. Архивировано из оригинал 17 января 2013 г.. Получено 21 марта 2012.
- ^ Раймонд Дж (10 июня 2016 г.). «Свечи, продукты и хитрости для устранения запаха на кухне». cravedujour.com.
- ^ Вики Лански, Марта Кэмпбелл, Пищевая сода: более 500 невероятных, забавных и экономных способов применения, о которых вы, вероятно, никогда не задумывались, 2009, ISBN 1931863733, п. 28
- ^ «Надежное решение более 170 лет. Чисто и просто», Arm & Hammer «О нас» страница
- ^ Кейт Сойер, Групповой гений: творческая сила сотрудничества, 2017, ISBN 0465093582, «держать еду свежей»
- ^ Клейтон М. Кристенсен, Скотт Кук, Тэдди Холл, Маркетинговая халатность: причина и лекарство, Harvard Business Review, Декабрь 2005 г., [1]
- ^ «Миф № 100: открытая коробка с пищевой содой в холодильнике поглощает запахи», Брюс Вайнштейн, Марк Скарбро, Омары кричат, когда вы их варите; И 100 других мифов о еде и кулинарии, 2011, ISBN 1439195382, п. 312
- ^ «Пищевая сода как поглотитель запаха», Иллюстрированные повара, [2]
- ^ а б «Разложение карбонатов». Общая химия в Интернете. Архивировано из оригинал на 1999-10-02. Получено 2010-03-16.
- ^ «История компании». Church & Dwight Co. Архивировано из оригинал 16 октября 2011 г.
- ^ Киплинг Р. (1897). Отважные капитаны. п. 25.
- ^ Тим С (2000). «Карбонаты натрия». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a24_299. ISBN 3527306730.
- ^ Холлеман А.Ф., Виберг Э. (2001). Неорганическая химия. Сан-Диего: Academic Press. ISBN 0-12-352651-5.
- ^ Стр. 45, раздел 3.6.2.1 из «Справочный документ по передовым методам обработки (BREF) для кальцинированной соды», отчет, подготовленный Европейская ассоциация производителей кальцинированной соды, Март 2004 г. Архивировано на WebCite с этот исходный URL на 2008-03-01.
- ^ Бестген, Майкл (2019). «Разработка раствора с использованием методов подземного бурения». Патент США 10280726: US 20180038213 A1.
- ^ «Утиный суп (1933)». IMDb. Получено 4 августа 2015.
- ^ «Ночь в опере (1935)». IMDb. Получено 4 августа 2015.
Список используемой литературы
- Хейнс WM, изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press. ISBN 978-1439855119.
внешние ссылки
- Международная карта химической безопасности 1044
Некоторые неорганические химические соединения широко применяются в быту, медицине и в производстве чистящих средств. Одним из таких веществ является популярное средство под названием бикарбонат натрия. Что это такое и где применяется? Вот несколько основных фактов.

Карбонат натрия и пищевая сода
Многие люди не видят разницы между карбонатом натрия и бикарбонатом натрия. Оба соединения имеют схожее наименование и состав, однако существенно отличаются между собой свойствами и возможными сферами применения.
Что такое бикарбонат натрия? Этим термином называют обычную пищевую соду! Другие наименования этого вещества: двууглекислый натрий или натрия гидрокарбонат, а его общая формула: NaHCO3. Карбонат натрия или Na2CO3, также называемый кальцинированной содой, представляет собой натриевую соль угольной кислоты и широко используется в быту в качестве чистящего средства или средства для стирки.
Бикарбонат натрия: физические и химические свойства
Физические и химические свойства NaHCO3 бикарбоната натрия Это неорганическое соединение имеет щелочной pH. Это мелкий белый порошок без запаха, слабо растворимый в воде и хорошо нейтрализующий кислоты. Пищевая сода обладает пенящими и разрыхляющими свойствами. В высокой температуре (около 180-200°C) превращается в карбонат натрия.
Бикарбонат натрия: полезные для здоровья свойства
Уже более 100 лет пищевая сода широко применяется в медицине, причем в фармацевтической отрасли она функционирует под названием гидрокарбоната натрия. Стоит обратить внимание на полезные для здоровья свойства этого соединения: помогает, в том числе, убрать закисление и очистить организм, а также избавиться или уменьшить симптомы целого ряда заболеваний, включая:
- запоры,
- галитоз (неприятный запах изо рта),
- грибковые заболевания,
- бактерийные инфекции,
- воспалительные процессы.
В медицине бикарбонат натрия является проверенным средством при лечении повышенного давления и при сужении кровеносных сосудов. Пациенты с заболеваниями горла, афтами или воспалительными процессами десен применяют средства для полоскания на базе соды с целью уменьшения боли и снятия воспалительного процесса. Принятие ванн с содой помогает при обширном микозе, зуде или укусах.
Бикарбонат натрия: применение в косметических средствах
Пищевая сода также широко применяется в косметических средствах. Кристалический бикарбонат натрия входит в состав зубных паст, дезодорантов, масок, пен или гелей для очистки лица и тела. Это также ценное вспомогательное вещество косметических присыпок, шипучих шаров для ванны, средств для полоскания и антисептических таблеток для ухода за ортодентическими аппаратами или зубными протезами.
Сода успокаивает кожу и осветляет эпидермис, поэтому ее применяют, в том числе с целью:
- полоскания стоп и ладоней перед процедурами в косметическом кабинете и в домашних условиях,
- изготовления кремов для рук и ног,
- приготовления масок для волос против перхоти.
На основе соды постоянно разрабатываются новые косметические средства для женщин, мужчин и детей. Это неорганическое соединение входит в состав жидкостей для полоскания ротовой полости, отбеливающих паст и регенерирующих лосьонов.
Применение соды в домашнем хозяйстве и клининговой отрасли
Другие сферы применения пищевой соды Бикарбонат натрия является одним из наилучших и наиболее дешевых чистящих и отбеливающих средств. С его помощью можно быстро очистить кухонную посуду, керамику, пригоревший гриль, плитку, а также смесители и раковины в ванной комнате. Пищевая сода отлично поглощает неприятные запахи и нейтрализует опасные для здоровья микроорганизмы. Сторонники экологически чистого выращивания растений применяют соду в качестве нетоксичного средства по борьбе с вредителями и грибковыми заболеваниями.
В чистящих средствах и средствах для стирки бикарбонат натрия часто является активным заполнителем, который повышает уровень pH и облегчает стирку. Примером препарата для стирки рабочей одежды, в состав которого входит активный заполнитель, является паста ROKEM. Информация о ней представлена в каталоге продуктов на сайте Группы PCC.
В клининговой отрасли и химии для автомобилей препараты с добавлением пищевой соды применяются для удаления трудновыводимых пятен, потеков, отбеливания обивки, полов и других поверхностей. Смесь соды и воды позволяет избавиться от неприятных запахов в ванных комнатах и подвалах, а также лежанках для собак, кюветах для котов, багажниках или мусорных баках.
Сода в пожарном деле и обработке материалов
О применении соды можно писать без конца! Это белое негорючее соединение также используется в пожарном деле. Сода является основным ингредиентом сухих огнетушителей и ручных универсальных огнетушителей, предназначенных для тушения различного вида пожаров транспортных средств, а также в жилых домах и офисах.
В последние годы к пищевой соде также проявляют интерес производители и пользователи пескоструйных аппаратов. Сыпучий отбеливающий бикарбонат натрия является отличным абразивным материалом для ухода или удаления верхнего слоя с различных поверхностей, например, металлов или древесины.