From Wikipedia, the free encyclopedia

|
|
|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.246 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
|
| Molar mass | 184.113 g/mol (anhydrous) 292.204 g/mol (hexahydrate) |
| Appearance | white hygroscopic hexagonal crystals (anhydrous) colorless monoclinic crystals (hexahydrate) |
| Density | 3.72 g/cm3 (anhydrous) 2.07 g/cm3 (hexahydrate) |
| Melting point | 711 °C (1,312 °F; 984 K) 172.4 °C, decomposes (hexahydrate) |
| Boiling point | 1,250 °C (2,280 °F; 1,520 K) |
|
Solubility in water |
102 g/(100 mL) (anhydrous) 316 g/(100 mL) (0 °C, hexahydrate) |
| Solubility | ethanol: 6.9 g/(100 mL) methanol: 21.8 g/(100 mL) |
|
Magnetic susceptibility (χ) |
−72.0·10−6 cm3/mol |
| Structure | |
|
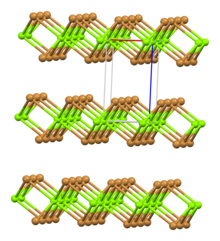
Crystal structure |
Rhombohedral, hP3 |
|
Space group |
P-3m1, No. 164 |
|
Coordination geometry |
octahedral |
| Thermochemistry | |
|
Heat capacity (C) |
70 J/(mol·K) |
|
Std molar |
117.2 J·mol−1·K−1 |
|
Std enthalpy of |
−524.3 kJ·mol−1 |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Safety data sheet (SDS) | External SDS |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium bromide is a chemical compound of magnesium and bromine, with the chemical formula MgBr2. It is white and deliquescent crystalline solid. It is often used as a mild sedative and as an anticonvulsant for treatment of nervous disorders.[2] It is water-soluble and somewhat soluble in alcohol. It can be found naturally in small amounts in some minerals such as: bischofite and carnallite, and in sea water, such as that of the Dead Sea.[3][4]
Synthesis[edit]
Magnesium bromide can be synthesized by treating with magnesium oxide (and related basic salts) with hydrobromic acid.[4] It can also be made by reacting magnesium carbonate and hydrobromic acids, and collecting the solid left after evaporation.[3]
As suggested by its easy conversion to various hydrates, anhydrous MgBr2 is a Lewis acid. In the coordination polymer with the formula MgBr2(dioxane)2, Mg2+ adopts an octahedral geometry.[5]
Uses[edit]
Magnesium bromide is used as a Lewis acid catalyst in some organic synthesis, e.g., in aldol reaction.[6] In organosilicon chemistry, magnesium bromide forms adducts R2SiXMgBr2.[7]
Magnesium bromide also has been used as a tranquilizer.[3]
Magnesium bromide modifies the catalytic properties of palladium on charcoal.[8]
Magnesium bromide hexahydrate has properties as a flame retardant. It was found that if 0.125 mol/L of magnesium bromide hexahydrate was added to a cotton material it acted as a flame retardant.[9]
References[edit]
- ^
Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 4–67. ISBN 0-8493-0594-2. - ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c Gruyter, W. Concise Encyclopedia Chemistry, Walter de Gruyter & Company: Berlin, 1993; 612
- ^ a b Lewis, R.J. Hawley’s Condensed Chemical Dictionary, 15th ed.; John Wiley &Sons Inc.:New York, 2007; 777
- ^ Fischer, Reinald; Görls, Helmar; Meisinger, Philippe R.; Suxdorf, Regina; Westerhausen, Matthias (2019). «Structure–Solubility Relationship of 1,4‐Dioxane Complexes of Di(hydrocarbyl)magnesium». Chemistry – A European Journal. 25 (55): 12830–12841. doi:10.1002/chem.201903120. PMC 7027550. PMID 31328293.
- ^ Evans, David A.; Tedrow, Jason S.; Shaw, Jared T.; Downey, C. Wade (2002). «Diastereoselective Magnesium Halide-Catalyzed anti-Aldol Reactions of Chiral N-Acyloxazolidinones». Journal of the American Chemical Society. 124 (3): 392–393. doi:10.1021/ja0119548. PMID 11792206.
- ^ Lim, Young Mook; Cho, Hyeon Mo; Lee, Myong Euy; Baeck, Kyoung Koo (2006). «A Stable Magnesium Bromosilylenoid: Transmetalation of a Lithium Bromosilylenoid by Magnesium Bromide». Organometallics. 25 (21): 4960. doi:10.1021/om060589w.
- ^ Bouzide, Abderrahim (2002). «Magnesium Bromide Mediated Highly Diastereoselective Heterogeneous Hydrogenation of Olefins». Organic Letters. 4 (8): 1347–50. doi:10.1021/ol020032m. PMID 11950359.
- ^ Mostashari, S. M.; Fayyaz, F. (2008). «XRD characterization of the ashes from a burned cellulosic fabric impregnated with magnesium bromide hexahydrate as flame-retardant». Journal of Thermal Analysis and Calorimetry. 92 (3): 845. doi:10.1007/s10973-007-8928-4. S2CID 94416902.
From Wikipedia, the free encyclopedia

|
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.246 |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
|
| Molar mass | 184.113 g/mol (anhydrous) 292.204 g/mol (hexahydrate) |
| Appearance | white hygroscopic hexagonal crystals (anhydrous) colorless monoclinic crystals (hexahydrate) |
| Density | 3.72 g/cm3 (anhydrous) 2.07 g/cm3 (hexahydrate) |
| Melting point | 711 °C (1,312 °F; 984 K) 172.4 °C, decomposes (hexahydrate) |
| Boiling point | 1,250 °C (2,280 °F; 1,520 K) |
|
Solubility in water |
102 g/(100 mL) (anhydrous) 316 g/(100 mL) (0 °C, hexahydrate) |
| Solubility | ethanol: 6.9 g/(100 mL) methanol: 21.8 g/(100 mL) |
|
Magnetic susceptibility (χ) |
−72.0·10−6 cm3/mol |
| Structure | |
|
Crystal structure |
Rhombohedral, hP3 |
|
Space group |
P-3m1, No. 164 |
|
Coordination geometry |
octahedral |
| Thermochemistry | |
|
Heat capacity (C) |
70 J/(mol·K) |
|
Std molar |
117.2 J·mol−1·K−1 |
|
Std enthalpy of |
−524.3 kJ·mol−1 |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Safety data sheet (SDS) | External SDS |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium bromide is a chemical compound of magnesium and bromine, with the chemical formula MgBr2. It is white and deliquescent crystalline solid. It is often used as a mild sedative and as an anticonvulsant for treatment of nervous disorders.[2] It is water-soluble and somewhat soluble in alcohol. It can be found naturally in small amounts in some minerals such as: bischofite and carnallite, and in sea water, such as that of the Dead Sea.[3][4]
Synthesis[edit]
Magnesium bromide can be synthesized by treating with magnesium oxide (and related basic salts) with hydrobromic acid.[4] It can also be made by reacting magnesium carbonate and hydrobromic acids, and collecting the solid left after evaporation.[3]
As suggested by its easy conversion to various hydrates, anhydrous MgBr2 is a Lewis acid. In the coordination polymer with the formula MgBr2(dioxane)2, Mg2+ adopts an octahedral geometry.[5]
Uses[edit]
Magnesium bromide is used as a Lewis acid catalyst in some organic synthesis, e.g., in aldol reaction.[6] In organosilicon chemistry, magnesium bromide forms adducts R2SiXMgBr2.[7]
Magnesium bromide also has been used as a tranquilizer.[3]
Magnesium bromide modifies the catalytic properties of palladium on charcoal.[8]
Magnesium bromide hexahydrate has properties as a flame retardant. It was found that if 0.125 mol/L of magnesium bromide hexahydrate was added to a cotton material it acted as a flame retardant.[9]
References[edit]
- ^
Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 4–67. ISBN 0-8493-0594-2. - ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c Gruyter, W. Concise Encyclopedia Chemistry, Walter de Gruyter & Company: Berlin, 1993; 612
- ^ a b Lewis, R.J. Hawley’s Condensed Chemical Dictionary, 15th ed.; John Wiley &Sons Inc.:New York, 2007; 777
- ^ Fischer, Reinald; Görls, Helmar; Meisinger, Philippe R.; Suxdorf, Regina; Westerhausen, Matthias (2019). «Structure–Solubility Relationship of 1,4‐Dioxane Complexes of Di(hydrocarbyl)magnesium». Chemistry – A European Journal. 25 (55): 12830–12841. doi:10.1002/chem.201903120. PMC 7027550. PMID 31328293.
- ^ Evans, David A.; Tedrow, Jason S.; Shaw, Jared T.; Downey, C. Wade (2002). «Diastereoselective Magnesium Halide-Catalyzed anti-Aldol Reactions of Chiral N-Acyloxazolidinones». Journal of the American Chemical Society. 124 (3): 392–393. doi:10.1021/ja0119548. PMID 11792206.
- ^ Lim, Young Mook; Cho, Hyeon Mo; Lee, Myong Euy; Baeck, Kyoung Koo (2006). «A Stable Magnesium Bromosilylenoid: Transmetalation of a Lithium Bromosilylenoid by Magnesium Bromide». Organometallics. 25 (21): 4960. doi:10.1021/om060589w.
- ^ Bouzide, Abderrahim (2002). «Magnesium Bromide Mediated Highly Diastereoselective Heterogeneous Hydrogenation of Olefins». Organic Letters. 4 (8): 1347–50. doi:10.1021/ol020032m. PMID 11950359.
- ^ Mostashari, S. M.; Fayyaz, F. (2008). «XRD characterization of the ashes from a burned cellulosic fabric impregnated with magnesium bromide hexahydrate as flame-retardant». Journal of Thermal Analysis and Calorimetry. 92 (3): 845. doi:10.1007/s10973-007-8928-4. S2CID 94416902.
| Бромид магния | |
|---|---|
| Систематическое наименование |
Бромид магния |
| Традиционные названия | Бромистый магний |
| Хим. формула | MgBr2 |
| Состояние | Бесцветные гигроскопические кристаллы |
| Молярная масса | 184,13 г/моль |
| Плотность | 3,72 г/см³ |
| Температура | |
| • плавления | 711 °C |
| • кипения | 1250 °C |
| Мол. теплоёмк. | 73 Дж/(моль·К) |
| Энтальпия | |
| • образования | -526,0 кДж/моль |
| Растворимость | |
| • в воде | 10120; 125,4100 г/100 мл |
| • в этаноле | 6,90 г/100 мл |
| • в метаноле | 21.820 г/100 мл |
| Кристаллическая структура | тригональная |
| Рег. номер CAS | 7789-48-2 |
| PubChem | 522691 |
| Рег. номер EINECS | 232-170-9 |
| SMILES |
[Mg+2].[Br-].[Br-] |
| InChI |
1S/2BrH.Mg/h2*1H;/q;;+2/p-2 OTCKOJUMXQWKQG-UHFFFAOYSA-L |
| ChemSpider | 74219 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромид магния — бинарное неорганическое соединение магния и брома с формулой MgBr2. Бесцветные гигроскопичные кристаллы. Образует несколько кристаллогидратов.
Получение
- Бромид магния присутствует в морской воде и многих минералах (напр. бишофит).
- Безводную соль получают непосредственно из простых веществ при нагревании:
-
- Mg + Br2 →τoC MgBr2
- или действием бромида серы на оксид магния
-
- 2 MgO + 2 S2Br2 →600oC 2 MgBr2 + 3 S + SO2
- Действуя бромистоводородной кислотой, оксид магния, его гидроксид или карбонат:
-
- MgO + 2 HBr → MgBr2 + H2O
- Mg(OH)2 + 2 HBr → MgBr2 + 2 H2O
- MgCO3 + 2 HBr → MgBr2 + CO2 ↑ + H2O
- можно получить кристаллогидраты.
Физические свойства
Бромид магния образует бесцветные диамагнитные кристаллы гексагональной сингонии, пространственная группа P 3m1, параметры ячейки a = 0,3815 нм, c = 0,6256 нм, Z = 1. При кристаллизации из водных растворов с температурой ниже 0,83°С образуется MgBr2•10H2O, выше — MgBr2•6H2O. Из неводных растворов выделены разнообразные сольваты, например MgBr2•6NH3, MgBr2•6CH3CH2OH.
Химические свойства
- Бромид магния реагирует с плавиковой кислотой:
-
- MgBr2 + 2 HF → MgF2 + 2 HBr
- С оксидом магния образует основные бромиды:
-
- MgBr2 + MgO + (n + 1) H2O → MgBr2 ⋅ Mg(OH)2 ⋅ n H2O
Применение
- Бромид магния используется для получения бромидов других металлов.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Бромид магния
Брутто-формула:
Br2Mg
CAS# 7789-48-2
Названия
Русский:
- Бромид магния [Wiki]
- Бромистый магний
English:
- EINECS:232-170-9
- Magnesium bromide [Wiki]
- Magnesium dibromide
- Magnesiumbromide (8CI)
- magnesium;dibromide(IUPAC)
Варианты формулы:
Реакции, в которых участвует Бромид магния
-
{M}O + 2H{X} -> {M}{X}2 + H2O
, где M =
Cu Ca Mg Sr Ba Hg Mn Cr Ni Fe Cd Zn Pb; X =
Cl F Br I -
{M} + 2H{X} -> {M}{X}2 + H2″|^»
, где M =
Ca Mg Ba Sr Cd Zn; X =
Cl F Br I -
{M} + {Hal}2 = {M}{Hal}2
, где M =
Mg Ca Ba Sr Cd Zn; Hal =
F Cl Br I -
{M}(OH)2 + 2H{X} -> {M}{X}2 + 2H2O
, где M =
Ca Mg Ba Sr Cd Fe Ni Zn Mn; X =
F Cl Br I -
{M}CO3 + 2H{X} -> {M}{X}2 + CO2″|^» + H2O
, где M =
Ca Mg Ba Sr Cd Zn Be Mn Pb; X =
F Cl Br I
Бромид магния
| Бромид магния | |
|---|---|
| Систематическое наименование |
Бромид магния |
| Традиционные названия | Бромистый магний |
| Хим. формула | MgBr2 |
| Состояние | Бесцветные гигроскопические кристаллы |
| Молярная масса | 184,13 г/моль |
| Плотность | 3,72 г/см³ |
| Температура | |
| • плавления | 711 °C |
| • кипения | 1250 °C |
| Мол. теплоёмк. | 73 Дж/(моль·К) |
| Энтальпия | |
| • образования | -526,0 кДж/моль |
| Растворимость | |
| • в воде | 101 20 ; 125,4 100 г/100 мл |
| • в этаноле | 6,9 0 г/100 мл |
| • в метаноле | 21.8 20 г/100 мл |
| Кристаллическая структура | тригональная |
| Рег. номер CAS | 7789-48-2 |
| PubChem | 522691 |
| Рег. номер EINECS | 232-170-9 |
| SMILES | |
| ChemSpider | 74219 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромид магния — бинарное неорганическое соединение магния и брома с формулой MgBr2. Бесцветные гигроскопичные кристаллы. Образует несколько кристаллогидратов.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
Получение
- Бромид магния присутствует в морской воде и многих минералах (напр. бишофит).
- Безводную соль получают непосредственно из простых веществ при нагревании:
Mg + Br2 → τoC MgBr2
- или действием бромида серы на оксид магния
2 MgO + 2 S2Br2 → 600oC 2 MgBr2 + 3 S + SO2
- Действуя бромистоводородной кислотой, оксид магния, его гидроксид или карбонат:
MgO + 2 HBr → MgBr2 + H2O Mg(OH)2 + 2 HBr → MgBr2 + 2 H2O MgCO3 + 2 HBr → MgBr2 + CO2 ↑ + H2O можно получить кристаллогидраты.
Физические свойства
Бромид магния образует бесцветные диамагнитные кристаллы гексагональной сингонии, пространственная группа P 3 m1, параметры ячейки a = 0,3815 нм, c = 0,6256 нм, Z = 1. При кристаллизации из водных растворов с температурой ниже 0,83°С образуется MgBr2•10H2O, выше — MgBr2•6H2O. Из неводных растворов выделены разнообразные сольваты, например MgBr2•6NH3, MgBr2•6CH3CH2OH.
Напишите уравнения реакций взаимодействия: а) магния с бромом; б) магний оксида с соляной кислотой в) магний гидроксида с нитратной кислотой
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://www.soloby.ru/287831/%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%B2%D0%B7%D0%B0%D0%B8%D0%BC%D0%BE%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D0%B8%D1%8F-%D0%B3%D0%B8%D0%B4%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B0-%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82%D0%BD%D0%BE%D0%B9 http://acetyl.ru/o/nmg11br12.php |
 |
|
| Идентификаторы | |
|---|---|
|
Количество CAS |
|
|
3D модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.246 |
|
PubChem CID |
|
| UNII |
|
|
Панель управления CompTox (EPA) |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Характеристики | |
|
Химическая формула |
MgBr2 (безводный) MgBr2· 6H2О (гексагидрат) |
| Молярная масса | 184,113 г / моль (безводный) 292,204 г / моль (гексагидрат) |
| Внешность | белый гигроскопичный шестиугольник кристаллы (безводные) бесцветные моноклинический кристаллы (гексагидрат) |
| Плотность | 3,72 г / см3 (безводный) 2,07 г / см3 (гексагидрат) |
| Температура плавления | 711 ° C (1312 ° F, 984 K) 172,4 ° C, разлагается (гексагидрат) |
| Точка кипения | 1250 ° С (2280 ° F, 1520 К) |
|
Растворимость в воде |
102 г / 100 мл (безводный) 316 г / 100 мл (0 ° C, гексагидрат) |
| Растворимость | этиловый спирт: 6,9 г / 100 мл метанол: 21,8 г / 100 мл |
|
Магнитная восприимчивость (χ) |
−72.0·10−6 см3/ моль |
| Структура | |
|
Кристальная структура |
Ромбоэдрический, hP3 |
|
Космическая группа |
П-3м1, №164 |
|
Координационная геометрия |
восьмигранный |
| Термохимия | |
|
Теплоемкость (C) |
70 Дж / моль К |
|
Стандартный моляр |
117,2 Дж · моль−1· K−1 |
|
Станд. Энтальпия |
-524,3 кДж · моль−1 |
| Опасности | |
| Паспорт безопасности | Внешний SDS |
| NFPA 704 (огненный алмаз) |
0 1 0 |
| Родственные соединения | |
|
Другой анионы |
фторид магния хлорид магния йодид магния |
|
Другой катионы |
Бериллий бромид Бромид кальция Бромид стронция Бромид бария Бромид радия |
|
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Бромид магния (MgBr2) это химическое соединение из магний и бром это белый и расплывающийся. Часто используется как легкое успокаивающее и как противосудорожное средство для лечения нервных расстройств.[2] Он растворим в воде и немного растворим в спирте. В небольших количествах он естественным образом содержится в некоторых минералах, таких как: бишофит и карналлит, и в морской воде, такой как Мертвое море.[3][4]
Синтез
Бромид магния может быть синтезирован путем реакции бромистоводородная кислота с оксид магния и кристаллизация продукта.[4] Его также можно получить путем реакции карбоната магния и бромистоводородной кислоты и сбора твердого вещества, оставшегося после выпаривания.[3]
Использует
Бромид магния используется в качестве катализатора для многих реакций, первая из которых представляет собой синтез дигидропиримидинонов в одной емкости без растворителя, которые часто используются в фармацевтическом мире в таких лекарствах, как блокаторы кальциевых каналов и ингибиторы HIVgp-120-CD4.[5] Он также использовался как транквилизатор.[3] Бромид магния в сочетании с CH2Cl2 катализирует реакцию, которая вызывает специфическую симметрию и хиральные центры через гидрирование алкенов.[6] Бромид магния, когда он связан с другими функциональными группами, показал более практическое применение, помимо катализирования реакций. Когда он связан с этильной группой, он используется для региоспецифического анализа триглицеринов.[7] Гексагидрат бромида магния разрабатывается для использования в качестве антипирена. Было обнаружено, что при добавлении 0,125 моль / л гексагидрата бромида магния к хлопковому материалу он действует как антипирен.[8] Бромид магния был использован для синтеза первого стабильного магния. силиленоид. Силиленоид — это соединение, содержащее R2SiMИкс (М представляет собой металл, а R представляет собой органический фрагмент). Только по традиции литий, калий, и натрий может быть использован. Силиленоид магния синтезируется путем добавления бромида магния к метилбромсилиленоиду лития-лития. Атом магния замещает литий в комплексе и имеет присоединенный к нему бромид. Этот комплекс устойчив при комнатной температуре.[9]
Рекомендации
- ^ Лиде, Дэвид Р. (1998). Справочник по химии и физике (87 изд.). Бока-Ратон, Флорида: CRC Press. С. 4–67. ISBN 0-8493-0594-2.
- ^ Прадёт Патнаик. Справочник неорганических химикатов. Макгроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ а б c Gruyter, W. Concise Encyclopedia Chemistry, Walter de Gruyter & Company: Берлин, 1993; 612
- ^ а б Льюис, Р.Дж. Краткий химический словарь Хоули, 15-е изд .; John Wiley & Sons Inc.: Нью-Йорк, 2007 г .; 777
- ^ Салехи, Ходжатолла; Го, Цин-Сян (2004). «Простой и эффективный синтез дигидропиримидинонов в одной емкости, катализируемый бромидом магния в условиях отсутствия растворителей». Синтетические коммуникации. 34 (1): 171. Дои:10.1081 / SCC-120027250. S2CID 98003817.
- ^ Бузид, Абдеррахим (2002). «Бромид магния, опосредованный высоко диастереоселективным гетерогенным гидрированием олефинов». Органические буквы. 4 (8): 1347–50. Дои:10.1021 / ol020032m. PMID 11950359.
- ^ Андо, Y; Томита, Y; Хаба, Ю. Приготовление этилмагния бромида для региоспецифического анализа триацилглицеринов Журнал Oleo Science, 2008, 57, 459
- ^ Мосташари, С. М .; Файяз, Ф. (2008). «Рентгеноструктурный анализ золы сгоревшей целлюлозной ткани, пропитанной гексагидратом бромида магния в качестве антипирена». Журнал термического анализа и калориметрии. 92 (3): 845. Дои:10.1007 / s10973-007-8928-4. S2CID 94416902.
- ^ Лим, Молодой Мук; Чо, Хён Мо; Ли, Мён Эй; Бэк, Кён Ку (2006). «Стабильный бромосилиленоид магния: трансметаллирование бромсилиленоида лития бромидом магния». Металлоорганические соединения. 25 (21): 4960. Дои:10.1021 / om060589w.
| Бромид магния | |

|
|
| __ Mg 2+ __ Br — | |
| Идентификация | |
|---|---|
| Название ИЮПАК | Бромид магния |
| Н о CAS | 7789-48-2 |
| N о ИК | 100 029 246 |
| N о ЕС | 232-170-9 |
| PubChem | 82241 |
| Появление | сплошной белый |
| Химические свойства | |
| Грубая формула | MgBr 2 |
| Молярная масса | 184,113 ± 0,003 г / моль Br 86,8%, Mg 13,2%, |
| Физические свойства | |
| Т ° плавления | 711 ° С |
| Растворимость |
1015 г · л -1 (вода, 20 ° C) Слабо растворим в спирте |
| Объемная масса | 3,72 г · см -3 ( 25 ° C ) |
| Кристаллография | |
| Кристаллическая система | тригональный |
| Символ Пирсона | hP3 |
| Кристаллический класс или космическая группа | P 3 m1, № 164 |
| Меры предосторожности | |
| SGH | |
|
H315, H319, H335, P261, P305 + P351 + P338, |
|
| NFPA 704 | |
|
0 2 0 |
|
|
|
|
| Единицы СИ и STP, если не указано иное. | |
Бромид магния (MgBr 2 ) представляет собой неорганическое соединение из магния и бромид .
Характеристики
Бромид магния представляет собой гигроскопичное твердое вещество белого цвета . Он растворим в воде и мало растворим в этаноле.
Вхождение
Бромид магния естественным образом присутствует в небольших количествах в некоторых минералах, таких как бишофит и карналлит . Он также присутствует в морской воде (в концентрации около 70 г м 3 , откуда он может быть получен путем испарения . Он особенно присутствует в воде Мертвого моря .
Синтез
Бромид магния можно синтезировать различными способами путем реакции между соединениями магния и брома, в частности бромистоводородной кислотой . Мы можем отметить
- реакция с гидроксидом магния (полученным из хлорида магния ):
- Mg (OH) 2 + 2 HBr → MgBr 2 + 2 H 2 O
- реакция с оксидом магния , где конечный продукт получают кристаллизацией:
- MgO + 2 HBr → MgBr 2 + H 2 O
- реакция с карбонатом магния . В этом случае продукт представляет собой твердое вещество, собранное после выпаривания:
- MgCO 3 + 2 HBr → MgBr 2 + H 2 O + CO 2
Также возможно производить его непосредственно из металлического магния и диброма . Эта реакция должна протекать в безводном эфире , потому что в противном случае реакция при добавлении диброма будет бурной.
- Mg + Br 2 → MgBr 2
Примечания и ссылки
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ а б и в лист Sigma-Aldrich соединения бромид магния , см. 14 ноября 2015 г.
- ↑ « Список соединений бромида магния » на Acros (по состоянию на 16 ноября 2015 г. ) .
- ↑ (из) статьи «Brom» о Seilnacht .
- ↑ a и b Gruyter, W. Concise Encyclopedia Chemistry, Walter de Gruyter & Company: Берлин, 1993; 612
- ↑ a и b Льюис, Краткий химический словарь Р. Дж. Хоули, 15-е изд .; John Wiley & Sons Inc.: Нью-Йорк, 2007; 777




