бутен
→
бутен — существительное, именительный п., муж. p., ед. ч.
↳
бутен — существительное, винительный п., муж. p., ед. ч.
Часть речи: существительное
| Единственное число | Множественное число | |
|---|---|---|
| Им. |
бутен |
бутены |
| Рд. |
бутена |
бутенов |
| Дт. |
бутену |
бутенам |
| Вн. |
бутен |
бутены |
| Тв. |
бутеном |
бутенами |
| Пр. |
бутене |
бутенах |
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
From Wikipedia, the free encyclopedia
Butene, also known as butylene, is an alkene with the formula C4H8. The word butene may refer to any of the individual compounds. They are colourless gases that are present in crude oil as a minor constituent in quantities that are too small for viable extraction. Butene is therefore obtained by catalytic cracking of long-chain hydrocarbons left during refining of crude oil. Cracking produces a mixture of products, and the butene is extracted from this by fractional distillation.[1]
Butene can be used as the monomer for polybutene, but this polymer is more expensive than alternatives with shorter carbon chains such as polypropylene. Polybutene is therefore used in more specialized applications. Butenes are more commonly used to make copolymer (mixed with another monomer such as ethylene).
Isomers[edit]
Among the molecules which have the chemical formula C4H8 four isomers are alkenes. All four of these hydrocarbons have four carbon atoms and one double bond in their molecules, but have different chemical structures. The IUPAC and common names, respectively, of these chemical compounds are:
| Common name(s) | IUPAC name | Structure | Skeletal formula | 3D model |
|---|---|---|---|---|
| α-butylene, 1-butene | But-1-ene | 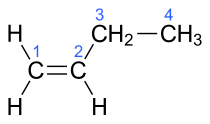
|

|
|
| cis-2-butene, cis-β-butylene | (2Z)-but-2-ene | 
|

|

|
| trans-2-butene, trans-β-butylene | (2E)-but-2-ene | 
|

|
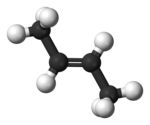
|
| isobutylene, isobutene | 2-methylprop-1-ene | 
|

|

|
In the chemical structures above, the small blue numbers in the structure images are the numbering of the atoms in the main backbone chain of the molecules. Other organic compounds have the formula C4H8, namely cyclobutane and methylcyclopropane, but are not alkenes and do not fall under the name butene. There are also cyclic alkenes with four carbon atoms overall such as cyclobutene and two isomers of methylcyclopropene, but they do not have the formula C4H8 and are not discussed here.
Properties[edit]
All four of these isomers are gases at room temperature and pressure, but can be liquefied by lowering the temperature or raising the pressure on them, in a manner similar to pressurised butane. These gases are colourless, but do have distinct odours, and are highly flammable. Although not naturally present in petroleum in high percentages, they can be produced from petrochemicals or by catalytic cracking of petroleum. Although they are stable compounds, the carbon-carbon double bonds make them more reactive than similar alkanes, which are more inert compounds in various ways.
Because of the double bonds, these 4-carbon alkenes can act as monomers in the formation of polymers, as well as having other uses as petrochemical intermediates. They are used to slay in the production of synthetic rubber. But-1-ene is a linear or normal alpha-olefin and isobutylene is a branched alpha-olefin. In a rather low percentage, but-1-ene is used as one of the comonomers, along with other alpha-olefins, in the production of high-density polyethylene and linear low-density polyethylene. Butyl rubber is made by cationic polymerisation of isobutylene with about 2 — 7% isoprene. Isobutylene is also used for the production of methyl tert-butyl ether (MTBE) and isooctane, both of which improve the combustion of gasoline.
See also[edit]
- 1,3-Butadiene
- Alkene
References[edit]
- ^ Geilen, Frank M.A.; Stochniol, Guido; Peitz, Stephan; Schulte-Koerne, Ekkehard (2014). «Butenes». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_483.pub3.
External links[edit]
- MSDS for isobutylene
From Wikipedia, the free encyclopedia
Butene, also known as butylene, is an alkene with the formula C4H8. The word butene may refer to any of the individual compounds. They are colourless gases that are present in crude oil as a minor constituent in quantities that are too small for viable extraction. Butene is therefore obtained by catalytic cracking of long-chain hydrocarbons left during refining of crude oil. Cracking produces a mixture of products, and the butene is extracted from this by fractional distillation.[1]
Butene can be used as the monomer for polybutene, but this polymer is more expensive than alternatives with shorter carbon chains such as polypropylene. Polybutene is therefore used in more specialized applications. Butenes are more commonly used to make copolymer (mixed with another monomer such as ethylene).
Isomers[edit]
Among the molecules which have the chemical formula C4H8 four isomers are alkenes. All four of these hydrocarbons have four carbon atoms and one double bond in their molecules, but have different chemical structures. The IUPAC and common names, respectively, of these chemical compounds are:
| Common name(s) | IUPAC name | Structure | Skeletal formula | 3D model |
|---|---|---|---|---|
| α-butylene, 1-butene | But-1-ene | 
|

|
|
| cis-2-butene, cis-β-butylene | (2Z)-but-2-ene | 
|

|

|
| trans-2-butene, trans-β-butylene | (2E)-but-2-ene | 
|

|

|
| isobutylene, isobutene | 2-methylprop-1-ene | 
|

|

|
In the chemical structures above, the small blue numbers in the structure images are the numbering of the atoms in the main backbone chain of the molecules. Other organic compounds have the formula C4H8, namely cyclobutane and methylcyclopropane, but are not alkenes and do not fall under the name butene. There are also cyclic alkenes with four carbon atoms overall such as cyclobutene and two isomers of methylcyclopropene, but they do not have the formula C4H8 and are not discussed here.
Properties[edit]
All four of these isomers are gases at room temperature and pressure, but can be liquefied by lowering the temperature or raising the pressure on them, in a manner similar to pressurised butane. These gases are colourless, but do have distinct odours, and are highly flammable. Although not naturally present in petroleum in high percentages, they can be produced from petrochemicals or by catalytic cracking of petroleum. Although they are stable compounds, the carbon-carbon double bonds make them more reactive than similar alkanes, which are more inert compounds in various ways.
Because of the double bonds, these 4-carbon alkenes can act as monomers in the formation of polymers, as well as having other uses as petrochemical intermediates. They are used to slay in the production of synthetic rubber. But-1-ene is a linear or normal alpha-olefin and isobutylene is a branched alpha-olefin. In a rather low percentage, but-1-ene is used as one of the comonomers, along with other alpha-olefins, in the production of high-density polyethylene and linear low-density polyethylene. Butyl rubber is made by cationic polymerisation of isobutylene with about 2 — 7% isoprene. Isobutylene is also used for the production of methyl tert-butyl ether (MTBE) and isooctane, both of which improve the combustion of gasoline.
See also[edit]
- 1,3-Butadiene
- Alkene
References[edit]
- ^ Geilen, Frank M.A.; Stochniol, Guido; Peitz, Stephan; Schulte-Koerne, Ekkehard (2014). «Butenes». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_483.pub3.
External links[edit]
- MSDS for isobutylene
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Значение слова «БУТЕНЫ» найдено в 14 источниках
БУТЕНЫ
бутилены, ненасыщенные углеводороды C4H8; бесцветные газы. Известны три структурных изомера: нормальный бутен-1 (α-бутилен), CH2=CH—CH2—CH3, нормальный бутен-2 (β-бутилен, псевдобутилен), CH3—CH=CH—CH3, существующий в транс- и цис-формах, и изобутен (Изобутилен), (CH3)2C=CH2, с tkип —6,25, 1,0—3,72 и —6,90°С соответственно. Б. хорошо растворимы во многих органических растворителях и очень плохо в воде; обладают всеми свойствами алкенов (см. Олефины). Смеси с воздухом, содержащие 1,7—9% Б., взрывоопасны. В промышленности Б. выделяют из бутан-бутиленовой фракции газов нефтепереработки и получают синтетически каталитические дегидратацией бутиловых спиртов. Б. применяют для получения Бутадиена, Бутилкаучука (оппанола), полиизобутилена (См. Полиизобутилены), Изооктана, смазочных масел и др.
Найдено 3 изображения:
Изображения из описаний на этой странице
(бутилены) С 4 Н 8, мол. м. 56,11. Существуют 1-Б. (

НЕКОТОРЫЕ СВОЙСТВА БУТЕНОВ 
Б. очень плохо раств. в воде, хорошо — в спирте и эфире. Образуют азеотропные смеси: транс-2-Б.-с н-бутаном (20,5% 2-Б.; т. кип. 0,3
1) Орфографическая запись слова: бутены
2) Ударение в слове: бут`ены
3) Деление слова на слоги (перенос слова): бутены
4) Фонетическая транскрипция слова бутены : [бт’`эн]
5) Характеристика всех звуков:
б [б] — согласный, твердый, звонкий, парный
у у — гласный, безударный
т [т’] — согласный, мягкий, глухой, парный
е [`э] — гласный, ударный
н [н] — согласный, твердый, звонкий, непарный, сонорный
ы ы — гласный, безударный
6 букв, 4 звук
бутилен ы, — бесцветные газы. Известны 3 изомера: нормальный Б.-1 (а-бутилен) СН2=СНСН2СН3 (Ьсип 6.3 °С), норм. Б.-2 (бета-бутнлен) СН3СН=СНСНз (tкип 3,7 и 0,9 °С соответственно для цис- и транс-изомера) и изобутен (изобутилен) СН2=С(СН3)2 (tкип — 7 °С). Содержатся в газах нефтепереработки. Из норм. Б. получают бутадиен, малеиновый ангидрид и др., из изобутиле-на — изопрен, полиизобутилен, бутилкаучук.
(гр.) то же, что бутилены.
Новый словарь иностранных слов.- by EdwART, ,2009.
(бутилены), ненасыщенные углеводороды, бесцв. газы: 1-Б. (СН2=СНСН2СН3, tкип -6,25 0С), 2-Б. [СН3СН=СНСН3, tкип 3,72 °С (цис-) и 0,880С (транс-)]и изобутилеп. Содержатся в газах нефтепереработки. 1-Б. применяется для получения бутадиена.
БУТЕНЫ (бутилены), бесцветные газы: 1-бутен (CH2=CHCH2CH3, tкип ?6, 25 °С), 2-бутен [CH3CH=CHCH3, tкип 3, 72 °С (цис-) и 0, 88 °С (транс-)] и изобутилен. Содержатся в газах нефтепереработки. 1-бутен применяется для получения бутадиена.
Ударение в слове: бут`ены
Ударение падает на букву: е
Безударные гласные в слове: бут`ены
БУТЕНЫ (бутилены) — бесцветные газы: 1-бутен (CH2=CHCH2CH3, tкип ?6,25 .С), 2-бутен БУТИК (франц. вoutique) — небольшой магазин, в котором продается фирменная модная одежда и всевозможные аксессуары.
— (бутилены) — бесцветные газы: 1-бутен (CH2=CHCH2CH3, tкип ?6,25.С), 2-бутен БУТИК (франц. вoutique) — небольшой магазин, в которомпродается фирменная модная одежда и всевозможные аксессуары.
бутены бут`ены, -ов, ед. бут`ен, -а
БУТЕН
- БУТЕН
-
БУТЕН (бутилен), название любого из трех углеводородных газов, имеющих общую формулу С4Н8: бутен-1 (СН3СН2СН=СН), бутен-2 (СН3СН=СНСН3) и изобутен ([СН3]2С=СН2) или 2-метилпропен). Получают из нефти и используют как исходное сырье для других органических соединений.
Научно-технический энциклопедический словарь.
Синонимы:
Смотреть что такое «БУТЕН» в других словарях:
-
бутен — сущ., кол во синонимов: 1 • бутилен (3) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
-
Бутенёв, Аполлинарий Петрович — Эта страница требует существенной переработки. Возможно, её необходимо викифицировать, дополнить или переписать. Пояснение причин и обсуждение на странице Википедия:К улучшению/26 сентября 2012. Дата постановки к улучшению 26 сентября 2012.… … Википедия
-
Бутен — Бутилен (бутен) C4H8 непредельный углеводород. Физические свойства Бутилен бесцветный газ с характерным запахом, температура кипения −6.6 °C, смеси бутилена с воздухом взрывоопасны. Получение В промышленности бутилен получают каталитической… … Википедия
-
бутенін — у, ч. Те саме, що вінілацетилен … Український тлумачний словник
-
1-бутен — 1 butenas statusas T sritis chemija formulė CH₂=CHCH₂CH₃ atitikmenys: angl. butylene; 1 butene rus. бутилен; 1 бутен ryšiai: sinonimas – butilenas … Chemijos terminų aiškinamasis žodynas
-
Президентские выборы во Франции (2012) — ← 2007 2017 → Президентские выборы во Франции 22 апреля и 6 мая 2012 года Явка избирателей … Википедия
-
ПЕНТЕНЫ — (амилены) C5H10, мол. м. 70,14. Существуют 1 П. (a амилен, пропилэтилен) CH3CH2CH2CH=CH2; 2 П. (b амилен, сим метилэтилэтилен) C2H5CH=CHCH3 (в виде цис и транс изомеров); 2 метил 1 бутен (g изоамилен, 1 метил 1 этилэтилен) C2H5(CH3)C=CH2; З метил … Химическая энциклопедия
-
Алкены — У этого термина существуют и другие значения, см. Алкен (значения). Пространственная структура этилена. Алкены (олефины, этиленовые углеводороды) ациклические непредельные углеводороды … Википедия
-
бутены — (бутилены), бесцветные газы: 1 бутен (СН2=СНСН2СН3, tкип –6,25°C), 2 бутен [СН3СН=СНСН3, tкип 3,72°C (цис–) и 0,88°C (транс–)] и изобутилен. Содержатся в газах нефтепереработки. 1 бутен применяется для получения бутадиена. * * * БУТЕНЫ БУТЕНЫ… … Энциклопедический словарь
-
Поварская улица — Москва Поварская улица, вид в … Википедия
Бутен, также известный как бутилен, является алкеном по формуле C 4H 8. Слово бутен может относиться к любому из отдельных соединений. Это бесцветные газы, которые присутствуют в сырой нефти в качестве второстепенного компонента в количествах, которые слишком малы для эффективной экстракции. Таким образом, бутен получают путем каталитического крекинга длинноцепочечных углеводородов, оставшихся при переработке сырой нефти. При крекинге образуется смесь продуктов, и бутен извлекается из нее фракционной перегонкой.
Бутен может использоваться в качестве мономера для полибутена, но это полимер дороже, чем альтернативы с более короткими углеродными цепями, такие как полипропилен. Поэтому полибутен используется в более специализированных областях. Бутены чаще используются для получения сополимера (смешанного с другим мономером, таким как этилен).
Содержание
- 1 Изомеры
- 2 Свойства
- 3 См. Также
- 4 Ссылки
- 5 Внешние ссылки
Изомеры
Среди молекул, имеющих химическая формула C 4H 8четыре изомера представляют собой алкены. Все четыре из этих углеводородов имеют четыре атома углерода и одну двойную связь в своих молекулах, но имеют разные химические структуры. ИЮПАК и общепринятые названия этих химических соединений соответственно:
| Общепринятое название | название ИЮПАК | Структура | Формула скелета | 3D-модель |
|---|---|---|---|---|
| α-бутилен, 1-бутен | Бут-1-ен |  |
 |
|
| цис-2-бутен, цис-β-бутилен | (2Z) -бут-2-ен |  |
 |
 |
| транс-2-бутен, транс-β-бутилен | (2E) -бут-2-ен |  |
 |
 |
| изобутилен, изобутен | 2-метилпроп-1-ен |  |
 |
 |
В химических структурах, представленных выше, маленькие синие числа на изображениях структур представляют собой нумерацию атомов в основной основной цепи молекул. Другие органические соединения имеют формулу C 4H8, а именно циклобутан и метилциклопропан, но не являются алкенами и не подпадают под название бутен. Существуют также циклические алкены с четырьмя атомами углерода, такие как циклобутен и два изомера метилциклопропена, но они не имеют формулы C 4H8и здесь не обсуждаются.
Свойства
Все четыре изомера являются газами при комнатной температуре и давлении, но могут сжижаться при понижении температура или повышение давления на них, аналогично сжатому бутану. Эти газы бесцветны, но имеют отчетливый запах и легко воспламеняются. Хотя они не присутствуют в естественных условиях в нефти в высоких процентах, они могут быть получены из нефтехимии или посредством каталитического крекинга нефти. Хотя они являются стабильными соединениями, двойные связи углерод-углерод делают их более активными, чем аналогичные алканы, которые являются более инертными соединениями во многих отношениях.
Благодаря двойным связям эти 4-углеродные алкены могут действовать как мономеры при образовании полимеров, а также находить другое применение в качестве нефтехимических промежуточные продукты. Их используют при производстве синтетического каучука. Бут-1-ен представляет собой линейный или нормальный альфа-олефин, а изобутилен представляет собой разветвленный альфа-олефин. В довольно низком процентном отношении бут-1-ен используется в качестве одного из сомономеров наряду с другими альфа-олефинами при производстве полиэтилена высокой плотности и линейного полиэтилена низкой плотности. Бутилкаучук получают катионной полимеризацией изобутилена с примерно 2-7% изопрена. Изобутилен также используется для производства метил-трет-бутилового эфира (МТБЭ ) и изооктана, которые улучшают сгорание бензина.
См. Также
- 1,3-Бутадиен
- Алкен
Ссылки
Внешние ссылки
- MSDS для изобутилена
.
