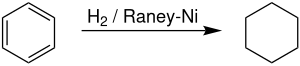From Wikipedia, the free encyclopedia
Not to be confused with Benzene.
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Cyclohexane[2] |
||
| Other names
Hexanaphthene (archaic)[1] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1900225 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.003.461 |
|
|
Gmelin Reference |
1662 | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1145 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C6H12 | |
| Molar mass | 84.162 g·mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Sweet, gasoline-like | |
| Density | 0.7739 g/mL, liquid; Density = 0.996 g/mL, solid | |
| Melting point | 6.47 °C (43.65 °F; 279.62 K) | |
| Boiling point | 80.74 °C (177.33 °F; 353.89 K) | |
|
Solubility in water |
Immiscible | |
| Solubility | Soluble in ether, alcohol, acetone | |
| Vapor pressure | 78 mmHg (20 °C)[3] | |
|
Magnetic susceptibility (χ) |
−68.13·10−6 cm3/mol | |
|
Refractive index (nD) |
1.42662 | |
| Viscosity | 1.02 cP at 17 °C | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H225, H304, H315, H336 | |
|
Precautionary statements |
P210, P233, P240, P241, P242, P243, P261, P264, P271, P273, P280, P301+P310, P302+P352, P303+P361+P353, P304+P340, P312, P321, P331, P332+P313, P362, P370+P378, P391, P403+P233, P403+P235, P405, P501 | |
| NFPA 704 (fire diamond) |
1 3 0 |
|
| Flash point | −20 °C (−4 °F; 253 K) | |
|
Autoignition |
245 °C (473 °F; 518 K) | |
| Explosive limits | 1.3–8%[3] | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
12705 mg/kg (rat, oral) 813 mg/kg (mouse, oral)[4] |
|
|
LCLo (lowest published) |
17,142 ppm (mouse, 2 h) 26,600 ppm (rabbit, 1 h)[4] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 300 ppm (1050 mg/m3)[3] | |
|
REL (Recommended) |
TWA 300 ppm (1050 mg/m3)[3] | |
|
IDLH (Immediate danger) |
1300 ppm[3] | |
| Thermochemistry | ||
|
Std enthalpy of |
−156 kJ/mol | |
|
Std enthalpy of |
−3920 kJ/mol | |
| Related compounds | ||
|
Related cycloalkanes |
Cyclopentane Cycloheptane |
|
|
Related compounds |
Cyclohexene Benzene |
|
| Supplementary data page | ||
| Cyclohexane (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cyclohexane is a cycloalkane with the molecular formula C6H12. Cyclohexane is non-polar. Cyclohexane is a colourless, flammable liquid with a distinctive detergent-like odor, reminiscent of cleaning products (in which it is sometimes used). Cyclohexane is mainly used for the industrial production of adipic acid and caprolactam, which are precursors to nylon.[5]
Cyclohexyl (C6H11) is the alkyl substituent of cyclohexane and is abbreviated Cy.[6]
Production[edit]
Modern[edit]
On an industrial scale, cyclohexane is produced by hydrogenation of benzene in the presence of a Raney nickel catalyst.[7] Producers of cyclohexane account for approximately 11.4% of global demand for benzene.[8] The reaction is highly exothermic, with ΔH(500 K) = -216.37 kJ/mol. Dehydrogenation commenced noticeably above 300 °C, reflecting the favorable entropy for dehydrogenation.[9]
Early[edit]
Unlike benzene, cyclohexane is not found in natural resources such as coal. For this reason, early investigators synthesized their cyclohexane samples.[10]
Failure[edit]
- In 1867 Marcellin Berthelot reduced benzene with hydroiodic acid at elevated temperatures.[11][12]
- In 1870, Adolf von Baeyer repeated the reaction[13] and pronounced the same reaction product «hexahydrobenzene»
- in 1890 Vladimir Markovnikov believed he was able to distill the same compound from Caucasus petroleum, calling his concoction «hexanaphtene».
Surprisingly, their cyclohexanes boiled higher by 10 °C than either hexahydrobenzene or hexanaphthene, but this riddle was solved in 1895 by Markovnikov, N.M. Kishner, and Nikolay Zelinsky when they reassigned «hexahydrobenzene» and «hexanaphtene» as methylcyclopentane, the result of an unexpected rearrangement reaction.
Success[edit]
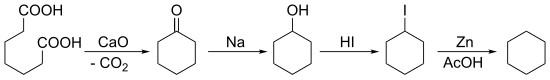
In 1894, Baeyer synthesized cyclohexane starting with a ketonization of pimelic acid followed by multiple reductions:
In the same year, E. Haworth and W.H. Perkin Jr. (1860–1929) prepared it via a Wurtz reaction of 1,6-dibromohexane.
Reactions and uses[edit]
Although rather unreactive, cyclohexane undergoes catalytic oxidation to produce cyclohexanone and cyclohexanol. The cyclohexanone–cyclohexanol mixture, called «KA oil«, is a raw material for adipic acid and caprolactam, precursors to nylon. Several million kilograms of cyclohexanone and cyclohexanol are produced annually.[9]
It is used as a solvent in some brands of correction fluid. Cyclohexane is sometimes used as a non-polar organic solvent, although n-hexane is more widely used for this purpose. It is frequently used as a recrystallization solvent, as many organic compounds exhibit good solubility in hot cyclohexane and poor solubility at low temperatures.
Cyclohexane is also used for calibration of differential scanning calorimetry (DSC) instruments, because of a convenient crystal-crystal transition at −87.1 °C.[14]
Cyclohexane vapour is used in vacuum carburizing furnaces, in heat treating equipment manufacture.
Conformation[edit]
The 6-vertex edge ring does not conform to the shape of a perfect hexagon. The conformation of a flat 2D planar hexagon has considerable angle strain because its bonds are not 109.5 degrees; the torsional strain would also be considerable because all of the bonds would be eclipsed bonds. Therefore, to reduce torsional strain, cyclohexane adopts a three-dimensional structure known as the chair conformation, which rapidly interconvert at room temperature via a process known as a chair flip. During the chair flip, there are three other intermediate conformations that are encountered: the half-chair, which is the most unstable conformation, the more stable boat conformation, and the twist-boat, which is more stable than the boat but still much less stable than the chair. The chair and twist-boat are energy minima and are therefore conformers, while the half-chair and the boat are transition states and represent energy maxima. The idea that the chair conformation is the most stable structure for cyclohexane was first proposed as early as 1890 by Hermann Sachse, but only gained widespread acceptance much later. The new conformation puts the carbons at an angle of 109.5°. Half of the hydrogens are in the plane of the ring (equatorial) while the other half are perpendicular to the plane (axial). This conformation allows for the most stable structure of cyclohexane. Another conformation of cyclohexane exists, known as boat conformation, but it interconverts to the slightly more stable chair formation. If cyclohexane is mono-substituted with a large substituent, then the substituent will most likely be found attached in an equatorial position, as this is the slightly more stable conformation.
Cyclohexane has the lowest angle and torsional strain of all the cycloalkanes; as a result cyclohexane has been deemed a 0 in total ring strain.
Solid phases[edit]
Cyclohexane has two crystalline phases. The high-temperature phase I, stable between 186 K and the melting point 280 K, is a plastic crystal, which means the molecules retain some rotational degree of freedom. The low-temperature (below 186 K) phase II is ordered. Two other low-temperature (metastable) phases III and IV have been obtained by application of moderate pressures above 30 MPa, where phase IV appears exclusively in deuterated cyclohexane (application of pressure increases the values of all transition temperatures).[15]
| No | Symmetry | Space group | a (Å) | b (Å) | c (Å) | Z | T (K) | P (MPa) |
|---|---|---|---|---|---|---|---|---|
| I | Cubic | Fm3m | 8.61 | 4 | 195 | 0.1 | ||
| II | Monoclinic | C2/c | 11.23 | 6.44 | 8.20 | 4 | 115 | 0.1 |
| III | Orthorhombic | Pmnn | 6.54 | 7.95 | 5.29 | 2 | 235 | 30 |
| IV | Monoclinic | P12(1)/n1 | 6.50 | 7.64 | 5.51 | 4 | 160 | 37 |
Here Z is the number structure units per unit cell; the unit cell constants a, b and c were measured at the given temperature T and pressure P.
See also[edit]
- The Flixborough disaster, a major industrial accident caused by an explosion of cyclohexane.
- Hexane
- Ring flip
- Cyclohexane (data page)
References[edit]
- ^ Hexanaphthene Archived 2018-02-12 at the Wayback Machine, dictionary.com
- ^ «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. «#0163». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Cyclohexane». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Campbell, M. Larry (2011). «Cyclohexane». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_209.pub2. ISBN 978-3527306732.
- ^ «Standard Abbreviations and Acronyms» (PDF). The Journal of Organic Chemistry.
- ^ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng «On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day» Lunds Tekniska Högskola 2008
- ^ Ceresana. «Benzene — Study: Market, Analysis, Trends 2021 — Ceresana». www.ceresana.com. Archived from the original on 21 December 2017. Retrieved 4 May 2018.
- ^ a b Michael Tuttle Musser (2005). «Cyclohexanol and Cyclohexanone». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_217. ISBN 978-3527306732.
- ^ Warnhoff, E. W. (1996). «The Curiously Intertwined Histories of Benzene and Cyclohexane». J. Chem. Educ. 73 (6): 494. Bibcode:1996JChEd..73..494W. doi:10.1021/ed073p494.
- ^ Bertholet (1867) «Nouvelles applications des méthodes de réduction en chimie organique» (New applications of reduction methods in organic chemistry), Bulletin de la Société chimique de Paris, series 2, 7 : 53-65.
- ^ Bertholet (1868) «Méthode universelle pour réduire et saturer d’hydrogène les composés organiques» (Universal method for reducing and saturating organic compounds with hydrogen), Bulletin de la Société chimique de Paris, series 2, 9 : 8-31. From page 17: «En effet, la benzine, chauffée à 280° pendant 24 heures avec 80 fois son poids d’une solution aqueuse saturée à froid d’acide iodhydrique, se change à peu près entièrement en hydrure d’hexylène, C12H14, en fixant 4 fois son volume d’hydrogène: C12H6 + 4H2 = C12H14 … Le nouveau carbure formé par la benzine est un corps unique et défini: il bout à 69°, et offre toutes les propriétés et la composition de l’hydrure d’hexylène extrait des pétroles.» (In effect, benzene, heated to 280° for 24 hours with 80 times its weight of an aqueous solution of cold saturated hydroiodic acid, is changed almost entirely into hydride of hexylene, C12H14, [Note: this formula for hexane (C6H14) is wrong because chemists at that time used the incorrect atomic mass for carbon.] by fixing [i.e., combining with] 4 times its volume of hydrogen: C12H6 + 4H2 = C12H14 The new carbon compound formed by benzene is a unique and well-defined substance: it boils at 69° and presents all the properties and the composition of hydride of hexylene extracted from oil.)
- ^ Adolf Baeyer (1870) «Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium» (On the reduction of aromatic compound by phosphonium iodide [H4IP]), Annalen der Chemie und Pharmacie, 155 : 266-281. From page 279: «Bei der Reduction mit Natriumamalgam oder Jodphosphonium addiren sich im höchsten Falle sechs Atome Wasserstoff, und es entstehen Abkömmlinge, die sich von einem Kohlenwasserstoff C6H12 ableiten. Dieser Kohlenwasserstoff ist aller Wahrscheinlichkeit nach ein geschlossener Ring, da seine Derivate, das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können.» (During the reduction [of benzene] with sodium amalgam or phosphonium iodide, six atoms of hydrogen are added in the extreme case, and there arise derivatives, which derive from a hydrocarbon C6H12. This hydrocarbon is in all probability a closed ring, since its derivatives — hexahydromesitylene [1,3,5 — trimethyl cyclohexane] and hexahydromellithic acid [cyclohexane-1,2,3,4,5,6-hexacarboxylic acid] — can be converted with ease again into benzene derivatives.)
- ^ Price, D. M. (1995). «Temperature Calibration of Differential Scanning Calorimeters». Journal of Thermal Analysis. 45 (6): 1285–1296. doi:10.1007/BF02547423. S2CID 97402835.
- ^ a b Mayer, J.; Urban, S.; Habrylo, S.; Holderna, K.; Natkaniec, I.; Würflinger, A.; Zajac, W. (1991). «Neutron Scattering Studies of C6H12 and C6D12 Cyclohexane under High Pressure». Physica Status Solidi B. 166 (2): 381. Bibcode:1991PSSBR.166..381M. doi:10.1002/pssb.2221660207.
External links[edit]
- International Chemical Safety Card 0242
- National Pollutant Inventory – Cyclohexane fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Cyclohexane@3Dchem
- Hermann Sachse and the first suggestion of a chair conformation.
- NLM Hazardous Substances Databank – Cyclohexane
- Methanol Discovered in Space
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of cyclohexane
- Cyclohexane production process flowsheet, benzene hydrogenation technique
From Wikipedia, the free encyclopedia
Not to be confused with Benzene.
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Cyclohexane[2] |
||
| Other names
Hexanaphthene (archaic)[1] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1900225 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| DrugBank |
|
|
| ECHA InfoCard | 100.003.461 |
|
|
Gmelin Reference |
1662 | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1145 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C6H12 | |
| Molar mass | 84.162 g·mol−1 | |
| Appearance | Colourless liquid | |
| Odor | Sweet, gasoline-like | |
| Density | 0.7739 g/mL, liquid; Density = 0.996 g/mL, solid | |
| Melting point | 6.47 °C (43.65 °F; 279.62 K) | |
| Boiling point | 80.74 °C (177.33 °F; 353.89 K) | |
|
Solubility in water |
Immiscible | |
| Solubility | Soluble in ether, alcohol, acetone | |
| Vapor pressure | 78 mmHg (20 °C)[3] | |
|
Magnetic susceptibility (χ) |
−68.13·10−6 cm3/mol | |
|
Refractive index (nD) |
1.42662 | |
| Viscosity | 1.02 cP at 17 °C | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
   
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H225, H304, H315, H336 | |
|
Precautionary statements |
P210, P233, P240, P241, P242, P243, P261, P264, P271, P273, P280, P301+P310, P302+P352, P303+P361+P353, P304+P340, P312, P321, P331, P332+P313, P362, P370+P378, P391, P403+P233, P403+P235, P405, P501 | |
| NFPA 704 (fire diamond) |
1 3 0 |
|
| Flash point | −20 °C (−4 °F; 253 K) | |
|
Autoignition |
245 °C (473 °F; 518 K) | |
| Explosive limits | 1.3–8%[3] | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
12705 mg/kg (rat, oral) 813 mg/kg (mouse, oral)[4] |
|
|
LCLo (lowest published) |
17,142 ppm (mouse, 2 h) 26,600 ppm (rabbit, 1 h)[4] |
|
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 300 ppm (1050 mg/m3)[3] | |
|
REL (Recommended) |
TWA 300 ppm (1050 mg/m3)[3] | |
|
IDLH (Immediate danger) |
1300 ppm[3] | |
| Thermochemistry | ||
|
Std enthalpy of |
−156 kJ/mol | |
|
Std enthalpy of |
−3920 kJ/mol | |
| Related compounds | ||
|
Related cycloalkanes |
Cyclopentane Cycloheptane |
|
|
Related compounds |
Cyclohexene Benzene |
|
| Supplementary data page | ||
| Cyclohexane (data page) | ||
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cyclohexane is a cycloalkane with the molecular formula C6H12. Cyclohexane is non-polar. Cyclohexane is a colourless, flammable liquid with a distinctive detergent-like odor, reminiscent of cleaning products (in which it is sometimes used). Cyclohexane is mainly used for the industrial production of adipic acid and caprolactam, which are precursors to nylon.[5]
Cyclohexyl (C6H11) is the alkyl substituent of cyclohexane and is abbreviated Cy.[6]
Production[edit]
Modern[edit]
On an industrial scale, cyclohexane is produced by hydrogenation of benzene in the presence of a Raney nickel catalyst.[7] Producers of cyclohexane account for approximately 11.4% of global demand for benzene.[8] The reaction is highly exothermic, with ΔH(500 K) = -216.37 kJ/mol. Dehydrogenation commenced noticeably above 300 °C, reflecting the favorable entropy for dehydrogenation.[9]
Early[edit]
Unlike benzene, cyclohexane is not found in natural resources such as coal. For this reason, early investigators synthesized their cyclohexane samples.[10]
Failure[edit]
- In 1867 Marcellin Berthelot reduced benzene with hydroiodic acid at elevated temperatures.[11][12]
- In 1870, Adolf von Baeyer repeated the reaction[13] and pronounced the same reaction product «hexahydrobenzene»
- in 1890 Vladimir Markovnikov believed he was able to distill the same compound from Caucasus petroleum, calling his concoction «hexanaphtene».
Surprisingly, their cyclohexanes boiled higher by 10 °C than either hexahydrobenzene or hexanaphthene, but this riddle was solved in 1895 by Markovnikov, N.M. Kishner, and Nikolay Zelinsky when they reassigned «hexahydrobenzene» and «hexanaphtene» as methylcyclopentane, the result of an unexpected rearrangement reaction.
Success[edit]
In 1894, Baeyer synthesized cyclohexane starting with a ketonization of pimelic acid followed by multiple reductions:
In the same year, E. Haworth and W.H. Perkin Jr. (1860–1929) prepared it via a Wurtz reaction of 1,6-dibromohexane.
Reactions and uses[edit]
Although rather unreactive, cyclohexane undergoes catalytic oxidation to produce cyclohexanone and cyclohexanol. The cyclohexanone–cyclohexanol mixture, called «KA oil«, is a raw material for adipic acid and caprolactam, precursors to nylon. Several million kilograms of cyclohexanone and cyclohexanol are produced annually.[9]
It is used as a solvent in some brands of correction fluid. Cyclohexane is sometimes used as a non-polar organic solvent, although n-hexane is more widely used for this purpose. It is frequently used as a recrystallization solvent, as many organic compounds exhibit good solubility in hot cyclohexane and poor solubility at low temperatures.
Cyclohexane is also used for calibration of differential scanning calorimetry (DSC) instruments, because of a convenient crystal-crystal transition at −87.1 °C.[14]
Cyclohexane vapour is used in vacuum carburizing furnaces, in heat treating equipment manufacture.
Conformation[edit]
The 6-vertex edge ring does not conform to the shape of a perfect hexagon. The conformation of a flat 2D planar hexagon has considerable angle strain because its bonds are not 109.5 degrees; the torsional strain would also be considerable because all of the bonds would be eclipsed bonds. Therefore, to reduce torsional strain, cyclohexane adopts a three-dimensional structure known as the chair conformation, which rapidly interconvert at room temperature via a process known as a chair flip. During the chair flip, there are three other intermediate conformations that are encountered: the half-chair, which is the most unstable conformation, the more stable boat conformation, and the twist-boat, which is more stable than the boat but still much less stable than the chair. The chair and twist-boat are energy minima and are therefore conformers, while the half-chair and the boat are transition states and represent energy maxima. The idea that the chair conformation is the most stable structure for cyclohexane was first proposed as early as 1890 by Hermann Sachse, but only gained widespread acceptance much later. The new conformation puts the carbons at an angle of 109.5°. Half of the hydrogens are in the plane of the ring (equatorial) while the other half are perpendicular to the plane (axial). This conformation allows for the most stable structure of cyclohexane. Another conformation of cyclohexane exists, known as boat conformation, but it interconverts to the slightly more stable chair formation. If cyclohexane is mono-substituted with a large substituent, then the substituent will most likely be found attached in an equatorial position, as this is the slightly more stable conformation.
Cyclohexane has the lowest angle and torsional strain of all the cycloalkanes; as a result cyclohexane has been deemed a 0 in total ring strain.
Solid phases[edit]
Cyclohexane has two crystalline phases. The high-temperature phase I, stable between 186 K and the melting point 280 K, is a plastic crystal, which means the molecules retain some rotational degree of freedom. The low-temperature (below 186 K) phase II is ordered. Two other low-temperature (metastable) phases III and IV have been obtained by application of moderate pressures above 30 MPa, where phase IV appears exclusively in deuterated cyclohexane (application of pressure increases the values of all transition temperatures).[15]
| No | Symmetry | Space group | a (Å) | b (Å) | c (Å) | Z | T (K) | P (MPa) |
|---|---|---|---|---|---|---|---|---|
| I | Cubic | Fm3m | 8.61 | 4 | 195 | 0.1 | ||
| II | Monoclinic | C2/c | 11.23 | 6.44 | 8.20 | 4 | 115 | 0.1 |
| III | Orthorhombic | Pmnn | 6.54 | 7.95 | 5.29 | 2 | 235 | 30 |
| IV | Monoclinic | P12(1)/n1 | 6.50 | 7.64 | 5.51 | 4 | 160 | 37 |
Here Z is the number structure units per unit cell; the unit cell constants a, b and c were measured at the given temperature T and pressure P.
See also[edit]
- The Flixborough disaster, a major industrial accident caused by an explosion of cyclohexane.
- Hexane
- Ring flip
- Cyclohexane (data page)
References[edit]
- ^ Hexanaphthene Archived 2018-02-12 at the Wayback Machine, dictionary.com
- ^ «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. «#0163». National Institute for Occupational Safety and Health (NIOSH).
- ^ a b «Cyclohexane». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Campbell, M. Larry (2011). «Cyclohexane». Ullmann’s Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a08_209.pub2. ISBN 978-3527306732.
- ^ «Standard Abbreviations and Acronyms» (PDF). The Journal of Organic Chemistry.
- ^ Fred Fan Zhang, Thomas van Rijnman, Ji Soo Kim, Allen Cheng «On Present Methods of Hydrogenation of Aromatic Compounds, 1945 to Present Day» Lunds Tekniska Högskola 2008
- ^ Ceresana. «Benzene — Study: Market, Analysis, Trends 2021 — Ceresana». www.ceresana.com. Archived from the original on 21 December 2017. Retrieved 4 May 2018.
- ^ a b Michael Tuttle Musser (2005). «Cyclohexanol and Cyclohexanone». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_217. ISBN 978-3527306732.
- ^ Warnhoff, E. W. (1996). «The Curiously Intertwined Histories of Benzene and Cyclohexane». J. Chem. Educ. 73 (6): 494. Bibcode:1996JChEd..73..494W. doi:10.1021/ed073p494.
- ^ Bertholet (1867) «Nouvelles applications des méthodes de réduction en chimie organique» (New applications of reduction methods in organic chemistry), Bulletin de la Société chimique de Paris, series 2, 7 : 53-65.
- ^ Bertholet (1868) «Méthode universelle pour réduire et saturer d’hydrogène les composés organiques» (Universal method for reducing and saturating organic compounds with hydrogen), Bulletin de la Société chimique de Paris, series 2, 9 : 8-31. From page 17: «En effet, la benzine, chauffée à 280° pendant 24 heures avec 80 fois son poids d’une solution aqueuse saturée à froid d’acide iodhydrique, se change à peu près entièrement en hydrure d’hexylène, C12H14, en fixant 4 fois son volume d’hydrogène: C12H6 + 4H2 = C12H14 … Le nouveau carbure formé par la benzine est un corps unique et défini: il bout à 69°, et offre toutes les propriétés et la composition de l’hydrure d’hexylène extrait des pétroles.» (In effect, benzene, heated to 280° for 24 hours with 80 times its weight of an aqueous solution of cold saturated hydroiodic acid, is changed almost entirely into hydride of hexylene, C12H14, [Note: this formula for hexane (C6H14) is wrong because chemists at that time used the incorrect atomic mass for carbon.] by fixing [i.e., combining with] 4 times its volume of hydrogen: C12H6 + 4H2 = C12H14 The new carbon compound formed by benzene is a unique and well-defined substance: it boils at 69° and presents all the properties and the composition of hydride of hexylene extracted from oil.)
- ^ Adolf Baeyer (1870) «Ueber die Reduction aromatischer Kohlenwasserstoffe durch Jodphosphonium» (On the reduction of aromatic compound by phosphonium iodide [H4IP]), Annalen der Chemie und Pharmacie, 155 : 266-281. From page 279: «Bei der Reduction mit Natriumamalgam oder Jodphosphonium addiren sich im höchsten Falle sechs Atome Wasserstoff, und es entstehen Abkömmlinge, die sich von einem Kohlenwasserstoff C6H12 ableiten. Dieser Kohlenwasserstoff ist aller Wahrscheinlichkeit nach ein geschlossener Ring, da seine Derivate, das Hexahydromesitylen und Hexahydromellithsäure, mit Leichtigkeit wieder in Benzolabkömmlinge übergeführt werden können.» (During the reduction [of benzene] with sodium amalgam or phosphonium iodide, six atoms of hydrogen are added in the extreme case, and there arise derivatives, which derive from a hydrocarbon C6H12. This hydrocarbon is in all probability a closed ring, since its derivatives — hexahydromesitylene [1,3,5 — trimethyl cyclohexane] and hexahydromellithic acid [cyclohexane-1,2,3,4,5,6-hexacarboxylic acid] — can be converted with ease again into benzene derivatives.)
- ^ Price, D. M. (1995). «Temperature Calibration of Differential Scanning Calorimeters». Journal of Thermal Analysis. 45 (6): 1285–1296. doi:10.1007/BF02547423. S2CID 97402835.
- ^ a b Mayer, J.; Urban, S.; Habrylo, S.; Holderna, K.; Natkaniec, I.; Würflinger, A.; Zajac, W. (1991). «Neutron Scattering Studies of C6H12 and C6D12 Cyclohexane under High Pressure». Physica Status Solidi B. 166 (2): 381. Bibcode:1991PSSBR.166..381M. doi:10.1002/pssb.2221660207.
External links[edit]
- International Chemical Safety Card 0242
- National Pollutant Inventory – Cyclohexane fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Cyclohexane@3Dchem
- Hermann Sachse and the first suggestion of a chair conformation.
- NLM Hazardous Substances Databank – Cyclohexane
- Methanol Discovered in Space
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of cyclohexane
- Cyclohexane production process flowsheet, benzene hydrogenation technique
циклогексан
- циклогексан
-
циклогекса/н, -а
Слитно. Раздельно. Через дефис..
.
Синонимы:
Смотреть что такое «циклогексан» в других словарях:
-
циклогексан — циклогексан … Орфографический словарь-справочник
-
Циклогексан — Циклогексан … Википедия
-
ЦИКЛОГЕКСАН — (С6Н12), бесцветный жидкий углеводород, в природе встречается в составе сырой нефти, но для промышленных применений производится посредством реакции между водородом и бензолом в присутствии катализатора. Циклогексан относится к типу соединений,… … Научно-технический энциклопедический словарь
-
ЦИКЛОГЕКСАН — С6Н12, бесцветная жидкость, tкип 80,74 .С. Содержится в нефти, образуется при гидрогенизации бензола. Сырье для получения капролактама, растворитель … Большой Энциклопедический словарь
-
циклогексан — сущ., кол во синонимов: 5 • гексаметилен (3) • нафтен (4) • растворитель (67) … Словарь синонимов
-
циклогексан — бесцветная жидкость, tкип 80,74°C. Содержится в нефти, образуется при гидрировании бензола. Сырьё для получения капролактама, растворитель. * * * ЦИКЛОГЕКСАН ЦИКЛОГЕКСАН, С6Н12, бесцветная жидкость, tкип 80,74 °С. Содержится в нефти, образуется… … Энциклопедический словарь
-
ЦИКЛОГЕКСАН — бесцв. жидкость; tкип 80,7 °С. Содержится в нефти, образуется при гидрогенизации бензола. Сырьё для получения адипиновой к ты, капролактама, растворитель. См. рис. Циклогексан … Большой энциклопедический политехнический словарь
-
ЦИКЛОГЕКСАН — циклоалкан; бесцв. жидкость, t,шп 80,74 °С. Содержится нефти, образуется при гидрировании бензола. Сырьё для получения капролактама, растворитель … Естествознание. Энциклопедический словарь
-
циклогексан — (цикла… гр. hex шесть) органическое соединение, углеводород алицикли ческого ряда; жидкость; примем, как сырьё в синтезе нек рых мономеров и как растворитель. Новый словарь иностранных слов. by EdwART, , 2009. циклогексан а, мн. нет, м. ( … Словарь иностранных слов русского языка
-
циклогексан — cikloheksanas statusas T sritis chemija formulė Formulę žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. cyclohexane rus. циклогексан … Chemijos terminų aiškinamasis žodynas
-
Циклогексан — гексаметилен, гексагидробензол, насыщенный углеводород алициклического ряда (циклоалкан (См. Циклоалканы)); бесцветная, с характерным запахом жидкость, tпл 6,55 °С, tкип 80,74, плотность 0,778 г/см3 (20 °C); нерастворим в воде,… … Большая советская энциклопедия
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Циклогексан
Брутто-формула:
C6H12
CAS# 110-82-7
Названия
Русский:
English:
- Benzene, hexahydro-
- Benzenehexahydride
- Cyclohexane [Wiki]
- EINECS:203-806-2
- EPA Pesticide Chemical Code 025901
- hexahydrobenzene
Варианты формулы:
$L(1.2)_(A60,W+)_(A-20)_(A20,W-)_(A-120)_(A160)_#1
_(x.6,y1)_(x2)_(x.6,y-1)_(x-1,y.5)_(x-1.2)_#1
CC|C`/C`C`|C/$slope(60)<`H>/H; H/#4H; H`/#2-H; H`#3-H; H/#5`-H; H#6`-H
C_(x1.5)C_q6C_q6C_q6C_q6C_q6;$L(.8)H|#1|H; H|#2|H; H|#3|H; H|#4|H; H|#5|H; H|#6|H
циклогексан
→
циклогексан — существительное, именительный п., муж. p., ед. ч.
↳
циклогексан — существительное, винительный п., муж. p., ед. ч.
Часть речи: существительное
| Единственное число | Множественное число | |
|---|---|---|
| Им. |
циклогексан |
|
| Рд. |
циклогексана |
|
| Дт. |
циклогексану |
|
| Вн. |
циклогексан |
|
| Тв. |
циклогексаном |
|
| Пр. |
циклогексане |
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Циклогексан
| Циклогексан | |
|---|---|
 |
|
 |
|
| Общие | |
| Хим. формула | C6H12 |
| Физические свойства | |
| Молярная масса | 84,16 г/моль |
| Плотность | 0,779 г/см³ |
| Энергия ионизации | 9,88 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | +6,5 °C |
| Т. кип. | +80,74 °C |
| Т. всп. | 0 ± 1 градус Фаренгейта[1] |
| Пр. взрв. | 1,3 ± 0,1 об.%[1] |
| Давление пара | 78 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 110-82-7 |
| PubChem | 8078 |
| Рег. номер EINECS | 203-806-2 |
| SMILES |
C1CCCCC1 |
| InChI |
1S/C6H12/c1-2-4-6-5-3-1/h1-6H2 XDTMQSROBMDMFD-UHFFFAOYSA-N |
| RTECS | GU6300000 |
| ChEBI | 29005 и 41506 |
| ChemSpider | 7787 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Циклогекса́н — органическое соединение из класса циклоалканов. Химическая формула — C6H12.
Получение
Получают гидрированием бензола в газовой фазе при t °С = 200–275 и Р = 2,5–3 МПа (выход циклогексана около 99,9 %), а также выделяют ректификацией из нефтепродуктов.
Получение циклогексана из бензола:

Применение
Сырье для получения капролактама, адипиновой кислоты и циклогексанона; растворитель эфирных масел, восков, лаков, красок, экстрагент в фармацевтической промышленности.
Изображения
Конформации шестичленных циклов на примере циклогексана:
1 — «кресло»; 3, 5 — «твист»-конформации; 4 — «ванна»; 2 — «полукресло», или «конверт»
Примечания
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0163.html
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН, С6Н12, бесцветная жидкость, tкип 80, 74 °С. Содержится в нефти, образуется при гидрогенизации бензола. Сырье для получения капролактама, растворитель.
ЦИКЛОГЕКСАНОЛ →← ЦИКЛОАЛКАНЫ
Синонимы слова «ЦИКЛОГЕКСАН»:
НАФТЕН, РАСТВОРИТЕЛЬ, УГЛЕВОДОРОД, ГЕКСАМЕТИЛЕН, ЦИКЛОАЛКАН
Смотреть что такое ЦИКЛОГЕКСАН в других словарях:
ЦИКЛОГЕКСАН
находится готовым в бакинской (Марковников), в восточно- (Юнг, Фортей) и западноамериканской (калифорнийской) нефти (Мабери и Гудзон), равно как в рум… смотреть
ЦИКЛОГЕКСАН
гексаметилен, гексагидробензол, насыщенный углеводород алициклического ряда (циклоалкан (См. Циклоалканы)); бесцветная, с характерным запахом ж… смотреть
ЦИКЛОГЕКСАН
циклогексан
сущ., кол-во синонимов: 5
• гексаметилен (3)
• нафтен (4)
• растворитель (67)
• углеводород (77)
• циклоалкан (5)
Словарь синонимов ASIS.В.Н. Тришин.2013.
.
Синонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан… смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН, гексаметилен,
гексагидробензол, насыщенный углеводород алициклич. ряда (циклоалкан);
бесцветная,
с характерным запахом жидкость, tпл 6,… смотреть
ЦИКЛОГЕКСАН
Циклогексан — находится готовым в бакинской (Марковников), в восточно- (Юнг, Фортей) и западноамериканской (калифорнийской) нефти (Мабери и Гудзон), равно как в румынской (Пони) и галицийской (Фортей). Может быть получен восстановлением йодциклогексана C <sub>6</sub>H<sub>11</sub> J цинком и уксусной кисл. (Байер), цинком и соляной кислотой (Зелинский), соляной кислотою в спиртовом (СН <sub>3</sub>.ОН или C <sub>2</sub>H<sub>5</sub>.OH) растворе в присутствии цинк-палладиевой пары (Зелинский), цинком в водно-спиртовом растворе (Зелинский). Он же образуется при нагревании в метаксилольном растворе 1,6-дибромгексана: BrH <sub>2</sub>C.[CH<sub>2</sub>]<sub>4</sub>.CH<sub>2</sub> Br с мелко раздробленным натрием (Перкин мл.) и при гидрогенизации бензола водородом в присутствии мелко раздробленного никеля (Сабатье и Сендеренс). Для выделения из бакинской нефти фракцию 80 — 82° хлорируют, превращают С <sub>6</sub> Н <sub>11</sub> Сl действием HJ в C <sub>6</sub>H<sub>11</sub> J и затем последний восстановляют (Марковников). Чистый углеводород может быть получен только из синтетического кетогексаметилена (кетона пимелиновой кислоты, см.), переходя через циклогексанол С <sub>6</sub> Н <sub>11</sub> (ОН) и йодюр (Зелинский). Ц. плав. при 6,4° [Из бакинской нефти Марковникову удалось выделить Ц. с темп. плавл. — 11°; углеводород Юнга и Фортея плав. при + 4,7°. Ц. плавится, следовательно, выше бензола (темп. плав. + 5,4° Линебаргер), но кипит при одной с ним температуре (80,2° — Лугинин); уд. вес С <sub>6</sub> Η <sub>6</sub> — d<sub>4</sub><sup>20</sup> = 0,8779 (Брюль).] и кипит при 80,8 — 80,9°; его уд. вес d <sub>4</sub><sup>19,5</sup> = 0,7788; коэфф. светопреломления для линии <i>D </i> (натриевой) <i>n<sub>D</sub><sup>19,5</sup></i> = 1,4266; молекулярное лучепреломление МR <sub>2</sub> = 27,67 (теория для Ц. — 27,62) [Зелинский], запах не неприятный, но не напоминающий бензола. Крепкая азотная кислота растворяет Ц. на холоду, окисляя его (Зелинский) и образуя при нагревании адипиновую кислоту — НО <sub>2</sub> С.[СН <sub>2</sub>]<sub>4</sub>.СО <sub>2</sub> Н (Марковников, Аскан); при нагревании (150 — 200°) Ц. дает с бромом симм. 1,2-4,5-тетрабромбензол: C<sub>6</sub>H<sub>12</sub> + 7Вr <sub>2</sub> = C<sub>6</sub>H<sub>2</sub>Br<sub>4</sub> + 10НВr (Зелинский). Несмотря на замкнутое строение, Ц. по химическому характеру гораздо энергичнее парафинов (ср. Полиметиленовые углеводороды) и, как показывает образование С <sub>6</sub> Н <sub>2</sub> Вr <sub>4</sub>, может быть непосредственно связан с бензолом. Из циклических изомеров Ц. известны: метилциклопентан и два триметилциклопропана. <i>Метилциклопентан </i> заключается в порции, кипящей при 69° — 71°, кавказской (Марковников), пенсильванской (Юнг) и калифорнийской нефти (Мабери и Гудзон [Последние неправильно называют свой углеводород гексаметиленом.]); он образуется при гидрогенизации йодистым водородом бензола (Вреден, Знатович, Кижнер; ср. Нафтены), почему и принимался вначале за гексагидробензол, т. е. за Ц.; изомерия выяснена работами Кижнера, Перкина мл., Зелинского и Марковникова с М. Коноваловым; он может быть еще получен восстановлением HJ-ом анилина (Кижнер), циклогексанона при 230° (Зелинский) и (при 210° — 250°) аминопентаметилена (Марковников); β-йодметилциклогексан дает его при действии цинк-медной пары (Марковников). Ц. — жидок, кип. при 71,5 — 72,5°, <i>d<sub>4</sub><sup>21</sup></i> = 0,7501 (Зелинский), <i>d</i><sub>0</sub><sup>20</sup> = 0,7489 (Кижнер), пахнет подобно бензину, сильно реагирует с красной азотной кислотой, образуя глутаровую, уксусную, муравьиную и янтарную кислоты (Кижнер); при нагревании со слабой азотной кислотой (d = l,075) при 100° образует третичный мононитропродукт, кипящий при 180 — 18 3° (Кижнер; ср. Нитронафтены), а при кипячении с обыкновенной азотной кислотой образуется небольшое количество нитробензола (Аскан [Так как Аскан нитровал погон нефти, кип. при 70°, то, вероятно, что нитробензол у него явился вследствие примеси бензола (Марковников).]) <i>Триметилциклопропан асимметричный</i> (1,1,2-триметилтриметилен) получается (Зелинский и Целиков) из диацетонамина (CH <sub>3</sub>)<sub>2</sub>C(NH<sub>2</sub>).CH<sub>2</sub>.CO.CH<sub>3</sub>, переходя через гликоль (СН <sub>3</sub>)<sub>2</sub>.С(ОН).СН <sub>2</sub>.СH(ОН).СН <sub>3 </sub> и бромюр (СН <sub>3</sub>)<sub>2</sub>. CBr. CH<sub>2</sub>.СНВr.СН <sub>3 </sub> и действуя на последний цинковой пылью в присутствии 80%-го спирта (метод Густавсона — см. Циклопропан). жидок. кип. 56 — 57°; уд. вес <i>d</i><sub>4</sub><sup>19,5</sup> = 0,6822. Марганцовокалиевой солью (1%-м раствором) окисляется очень медленно; с бромом реагирует легко; прямые опыты показали, что он не тождествен с углеводородами, получающимися при действии КОН на хлорюр пинаколинового спирта и описанными Кутюрье, как один углеводород формулы (СН <sub>3</sub>)<sub>3</sub> C:СН:СН, с темп. кипения 57 — 59°. <i>Триметилциклопропан симметричный</i> (1,2,3 триметилтриметилен) получен тем же методом Густавсона (Зелинский и Целиков) из метилацетилацетона СН <sub>3</sub>.СО.СН(СН <sub>3</sub>).СО.СН <sub>3 </sub> через гликол и бромюр. кип. при 65 — 66°; уд вес <i>d</i><sub>4</sub><sup>72</sup><i> </i> = 0,6921, с 1%-м раствором КМnО <sub>4</sub> реагирует очень медленно, но каждая капля сухого брома реагирует с углеводородом с треском, причем заметно выделение бромистого водорода. <i> А. И. Горбов.</i> Δ <i>. </i><br><br><br>… смотреть
ЦИКЛОГЕКСАН
циклогекса́н
(цикла… гр. hex шесть) органическое соединение, углеводород алицикли-ческого ряда; жидкость; примем, как сырьё в синтезе нек-рых мономе… смотреть
ЦИКЛОГЕКСАН
Лагос Лаг Кси Косица Косинка Косина Косилка Косец Косенка Кос Конка Коник Конец Конек Конак Кон Колка Колика Колесница Колесник Коленка Кола Кол Кокс Кокаин Кок Коан Кница Книга Клон Клок Клица Клион Клио Клинок Клинекс Клин Клико Клик Клецк Кленок Клен Клек Клан Клаксон Кисло Кислеца Киска Киса Киоск Кино Кинг Кина Кило Кил Кикс Кик Киек Кианг Кен Кекс Кек Кеа Кацик Каско Касик Каон Каолин Канск Канклес Кан Калонг Калин Кали Каленик Кале Кал Како Каки Каин Каик Каг Иск Исак Иса Ион Иол Инок Инко Инк Инга Илона Икс Икос Иконка Икона Иена Иголка Иго Игла Енол Елкин Елка Елико Госцена Гос Гонка Гонец Гон Голица Голик Голец Гол Гоацин Гнилец Глинка Глина Гласно Глас Гко Гик Гиена Генка Ген Гелиос Гелио Геликон Гексан Гекс Геккон Гасконец Гас Ганс Ганец Галс Гало Галкин Галеон Гален Лагосец Лак Лакец Ланец Ланкиец Лаос Гак Лаосец Легинса Легион Легко Лек Лексика Лексикон Лен Аск Аон Лена Леникс Ленка Ленск Анк Аник Англо Ангелок Ангел Алкин Леса Алин Ален Алексин Аксен Акно Акие Аки Аил Агнец Агенс Лесин Аксон Алик Алкен Лесик Анголец Леон Анис Анолис Ленца… смотреть
ЦИКЛОГЕКСАН
1) Орфографическая запись слова: циклогексан2) Ударение в слове: циклогекс`ан3) Деление слова на слоги (перенос слова): циклогексан4) Фонетическая тран… смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН (С6Н12), бесцветный жидкий углеводород, в природе встречается в составе сырой нефти, но для промышленных применений производится посредство… смотреть
ЦИКЛОГЕКСАН
циклоалкан; бесцв. жидкость, t,шп 80,74 °С. Содержится нефти, образуется при гидрировании бензола. Сырьё для получения капролактама, растворитель. Сино… смотреть
ЦИКЛОГЕКСАН
бесцв. жидкость; tкип 80,7 °С. Содержится в нефти, образуется при гидрогенизации бензола. Сырьё для получения адипиновой к-ты, капролактама, растворите… смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСА́Н, у, ч.Органічна сполука, безбарвна рухлива рідина; застосовують як розчинник і проміжний продукт у виробництві синтетичних волокон.
ЦИКЛОГЕКСАН
циклогекса/н, -а
Синонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
Ударение в слове: циклогекс`анУдарение падает на букву: аБезударные гласные в слове: циклогекс`ан
ЦИКЛОГЕКСАН
-у, ч. Органічна сполука, безбарвна рухлива рідина; застосовують як розчинник і проміжний продукт у виробництві синтетичних волокон.
ЦИКЛОГЕКСАН
м. cicloesano m, esametilene m, esaidrobenzolo m
ЦИКЛОГЕКСАН
мол. м. 84,16; бесцв. жидкость с характерным запахом; т. пл. 6,5 Синонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
циклогексан [цикла… + гр. hex шесть]- органическое соединение, углеводород алицикли-ческого ряда; жидкость; примем, как сырье в синтезе нек-рых мономеров и как растворитель. <br><br><br>… смотреть
ЦИКЛОГЕКСАН
циклогекса́нСинонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
циклогекса́н
(від цикло… і грец. εξάς – шість)
органічна сполука, безбарвна рухлива рідина. Застосовують як розчинник і проміжний продукт у виробництві синтетичних волокон…. смотреть
ЦИКЛОГЕКСАН
циклогекс’ан, -аСинонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
циклогексан; ч.
(цикло… і гр., шість)
органічна сполука, безбарвна рухлива рідина.
Застосовують як розчинник і проміжний продукт у виробництві синтетичних волокон…. смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН — С6Н12, бесцветная жидкость, tкип 80,74 .С. Содержится в нефти, образуется при гидрогенизации бензола. Сырье для получения капролактама, растворитель.<br>… смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН , С6Н12, бесцветная жидкость, tкип 80,74 °С. Содержится в нефти, образуется при гидрогенизации бензола. Сырье для получения капролактама, растворитель…. смотреть
ЦИКЛОГЕКСАН
ЦИКЛОГЕКСАН, С6Н12, бесцветная жидкость, tкип 80,74 °С. Содержится в нефти, образуется при гидрогенизации бензола. Сырье для получения капролактама, растворитель…. смотреть
ЦИКЛОГЕКСАН
(2 м)Синонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
cyclohexaneСинонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
cyclohexaneСинонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
циклогексанСинонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
-у, ч. Органічна сполука, безбарвна рухлива рідина; застосовують як розчинник і проміжний продукт у виробництві синтетичних волокон.
ЦИКЛОГЕКСАН
[化] 环已烷Синонимы:
гексаметилен, нафтен, растворитель, углеводород, циклоалкан
ЦИКЛОГЕКСАН
Начальная форма — Циклогексан, винительный падеж, единственное число, мужской род, неодушевленное
ЦИКЛОГЕКСАН
cyclohexane, hexahydrobenzène, hexaméthylène, naphtène
ЦИКЛОГЕКСАН С6Н12,
— бесцветная жидкость, tкип 80,74 .С. Содержится внефти, образуется при гидрогенизации бензола. Сырье для получениякапролактама, растворитель.