From Wikipedia, the free encyclopedia

|
||
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Cyclopropane[2] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.771 |
|
| KEGG |
|
|
|
PubChem CID |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C3H6 | |
| Molar mass | 42.08 g/mol | |
| Appearance | Colorless gas | |
| Odor | Sweet smelling | |
| Density | 1.879 g/L (1 atm, 0 °C) | |
| Melting point | −128 °C (−198 °F; 145 K) | |
| Boiling point | −33 °C (−27 °F; 240 K) | |
| Acidity (pKa) | ~46 | |
|
Magnetic susceptibility (χ) |
-39.9·10−6 cm3/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Highly flammable Asphyxiant |
|
| NFPA 704 (fire diamond) |
1 4 0 |
|
| Safety data sheet (SDS) | External MSDS | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cyclopropane is the cycloalkane with the molecular formula (CH2)3, consisting of three methylene groups (CH2) linked to each other to form a ring. The small size of the ring creates substantial ring strain in the structure. Cyclopropane itself is mainly of theoretical interest but many of its derivatives are of commercial or biological significance.[3]
History[edit]
Cyclopropane was discovered in 1881 by August Freund, who also proposed the correct structure for the substance in his first paper.[4] Freund treated 1,3-dibromopropane with sodium, causing an intramolecular Wurtz reaction leading directly to cyclopropane.[5] The yield of the reaction was improved by Gustavson in 1887 with the use of zinc instead of sodium.[6] Cyclopropane had no commercial application until Henderson and Lucas discovered its anaesthetic properties in 1929;[7] industrial production had begun by 1936.[8] In modern anaesthetic practice, it has been superseded by other agents.
Anaesthesia[edit]
Cyclopropane was introduced into clinical use by the American anaesthetist Ralph Waters who used a closed system with carbon dioxide absorption to conserve this then-costly agent.
Cyclopropane is a relatively potent, non-irritating and sweet smelling agent with a minimum alveolar concentration of 17.5%[9] and a blood/gas partition coefficient of 0.55. This meant induction of anaesthesia by inhalation of cyclopropane and oxygen was rapid and not unpleasant. However at the conclusion of prolonged anaesthesia patients could suffer a sudden decrease in blood pressure, potentially leading to cardiac dysrhythmia: a reaction known as «cyclopropane shock».[10] For this reason, as well as its high cost and its explosive nature,[11] it was latterly used only for the induction of anaesthesia, and has not been available for clinical use since the mid 1980s.
Cylinders and flow meters were coloured orange.
Pharmacology[edit]
Cyclopropane is inactive at the GABAA and glycine receptors, and instead acts as an NMDA receptor antagonist.[12][13] It also inhibits the AMPA receptor and nicotinic acetylcholine receptors, and activates certain K2P channels.[12][13][14]
Structure and bonding[edit]
Orbital overlap in the bent bonding model of cyclopropane
The triangular structure of cyclopropane requires the bond angles between carbon-carbon covalent bonds to be 60°. The molecule has D3h molecular symmetry. The C-C distances are 151 pm versus 153-155 pm.[15][16]
Despite their shortness, the C-C bonds in cyclopropane are weakened by 34 kcal/mol vs ordinary C-C bonds. In addition to ring strain, the molecule also has torsional strain due to the eclipsed conformation of its hydrogen atoms. The C-H bonds in cyclopropane are stronger than ordinary C-H bonds as reflected by NMR coupling constants.
Bonding between the carbon centres is generally described in terms of bent bonds.[17] In this model the carbon-carbon bonds are bent outwards so that the inter-orbital angle is 104°.
The unusual structural properties of cyclopropane have spawned many theoretical discussions. One theory invokes σ-aromaticity: the stabilization afforded by delocalization of the six electrons of cyclopropane’s three C-C σ bonds to explain why the strain of cyclopropane is «only» 27.6 kcal/mol as compared to cyclobutane (26.2 kcal/mol) with cyclohexane as reference with Estr=0 kcal/mol,[18] [19][20] in contrast to the usual π aromaticity, that, for example, has a highly stabilizing effect in benzene. Other studies do not support the role of σ-aromaticity in cyclopropane and the existence of an induced ring current; such studies provide an alternative explanation for the energetic stabilization and abnormal magnetic behaviour of cyclopropane.[21]
Synthesis[edit]
Cyclopropane was first produced via a Wurtz coupling, in which 1,3-dibromopropane was cyclised using sodium.[4] The yield of this reaction can be improved by the use of zinc as the dehalogenating agent and sodium iodide as a catalyst.[22]
- BrCH2CH2CH2Br + 2 Na → (CH2)3 + 2 NaBr
The preparation of cyclopropane rings is referred to as cyclopropanation.
Derivatives[edit]
Cyclopropane derivatives are numerous.[24] Many biomolecules and pharmaceutical drugs feature the cyclopropane ring. Famous example is aminocyclopropane carboxylic acid, which is the precursor to ethylene, a plant hormone. The pyrethroids are the basis of many insecticides.[3] Several cyclopropane fatty acids are known.
Reactions[edit]
Owing to the increased π-character of its C-C bonds, cyclopropane can react like an alkene in certain cases. For instance it undergoes hydrohalogenation with mineral acids to give linear alkyl halides. Substituted cyclopropanes also react, following Markovnikov’s rule.[25] Substituted cyclopropanes can oxidatively add to transition metals, in a process referred to as C–C activation.
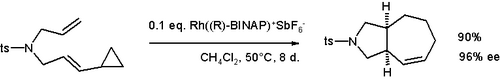
Cyclopropyl groups adjacent to vinyl groups can undergo ring expansion reactions. Examples include the vinylcyclopropane rearrangement and the divinylcyclopropane-cycloheptadiene rearrangement. This reactivity can be exploited to generate unusual cyclic compounds, such as cyclobutenes,[26] or bicyclic species such as the cycloheptene shown below.[27]
Safety[edit]
Cyclopropane is highly flammable. However, despite its strain energy it is not substantially more explosive than other alkanes.
See also[edit]
- Tetrahedrane contains four fused cyclopropane rings that form the faces of a tetrahedron
- Propellane contains three cyclopropane rings that share a single central carbon-carbon bond.
- Cyclopropene
- Methylenecyclopropane
References[edit]
- ^ Merck Index, 11th Edition, 2755.
- ^ «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 137. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b Faust, Rüdiger (2001). «Fascinating Natural and Artificial Cyclopropane Architectures». Angewandte Chemie International Edition. 40 (12): 2251–2253. doi:10.1002/1521-3773(20010618)40:12<2251::AID-ANIE2251>3.0.CO;2-R. PMID 11433485.
- ^ a b August Freund (1881). «Über Trimethylen» [On trimethylene]. Journal für Praktische Chemie. 26 (1): 367–377. doi:10.1002/prac.18820260125.
- ^ August Freund (1882). «Über Trimethylen» [On trimethylene]. Monatshefte für Chemie. 3 (1): 625–635. doi:10.1007/BF01516828. S2CID 197767176.
- ^ G. Gustavson (1887). «Ueber eine neue Darstellungsmethode des Trimethylens» [On a new method of preparing trimethylene]. Journal für Praktische Chemie. 36: 300–305. doi:10.1002/prac.18870360127.
- ^ G. H. W. Lucas; V. E. Henderson (1 August 1929). «A New Anesthetic: Cyclopropane : A Preliminary Report». Can Med Assoc J. 21 (2): 173–5. PMC 1710967. PMID 20317448.
- ^ H. B. Hass; E. T. McBee; G. E. Hinds (1936). «Synthesis of Cyclopropane». Industrial & Engineering Chemistry. 28 (10): 1178–81. doi:10.1021/ie50322a013.
- ^ Eger, Edmond I.; Brandstater, Bernard; Saidman, Lawrence J.; Regan, Michael J.; Severinghaus, John W.; Munson, Edwin S. (1965). «Equipotent Alveolar Concentrations of Methoxyflurane, Halothane, Diethyl Ether, Fluroxene, Cyclopropane, Xenon and Nitrous Oxide in the Dog». Anesthesiology. 26 (6): 771–777. doi:10.1097/00000542-196511000-00012. PMID 4378907.
- ^ JOHNSTONE, M; Alberts, JR (July 1950). «Cyclopropane anesthesia and ventricular arrhythmias». British Heart Journal. 12 (3): 239–44. doi:10.1136/hrt.12.3.239. PMC 479392. PMID 15426685.
- ^ MacDonald, AG (June 1994). «A short history of fires and explosions caused by anaesthetic agents». British Journal of Anaesthesia. 72 (6): 710–22. doi:10.1093/bja/72.6.710. PMID 8024925.
- ^ a b Hugh C. Hemmings; Philip M. Hopkins (2006). Foundations of Anesthesia: Basic Sciences for Clinical Practice. Elsevier Health Sciences. pp. 292–. ISBN 978-0-323-03707-5.
- ^ a b Hemmings, Hugh C. (2009). «Molecular Targets of General Anesthetics in the Nervous System». Suppressing the Mind: 11–31. doi:10.1007/978-1-60761-462-3_2. ISBN 978-1-60761-463-0.
- ^ Hara K, Eger EI, Laster MJ, Harris RA (December 2002). «Nonhalogenated alkanes cyclopropane and butane affect neurotransmitter-gated ion channel and G-protein-coupled receptors: differential actions on GABAA and glycine receptors». Anesthesiology. 97 (6): 1512–20. doi:10.1097/00000542-200212000-00025. PMID 12459679. S2CID 21160239.[permanent dead link]
- ^ Allen, Frank H.; Kennard, Olga; Watson, David G.; Brammer, Lee; Orpen, A. Guy; Taylor, Robin (1987). «Tables of bond lengths determined by X-ray and neutron diffraction. Part 1. Bond lengths in organic compounds». Journal of the Chemical Society, Perkin Transactions 2 (12): S1–S19. doi:10.1039/P298700000S1.
- ^ Boulatov, Roman, ed. (2015). Polymer Mechanochemistry. Springer. p. 9. ISBN 978-3-319-22824-2.
- ^ Eric V. Anslyn and Dennis A. Dougherty. Modern Physical Organic Chemistry. 2006. pages 850-852
- ^ S. W. Benson, Thermochemical Kinetics, S. 273, J. Wiley & Sons, New York, London, Sydney, Toronto 1976
- ^ Dewar, M. J. (1984). «Chemical Implications of σ Conjugation». J. Am. Chem. Soc. 106 (3): 669–682. doi:10.1021/ja00315a036.
- ^ Cremer, D. (1988). «Pros and Cons of σ-Aromaticity». Tetrahedron. 44 (2): 7427–7454. doi:10.1016/s0040-4020(01)86238-4.
- ^ Wu, Wei; Ma, Ben; Wu, Judy I-Chia; von Ragué, Schleyer; Mo, Yirong (2009). «Is Cyclopropane Really the σ-Aromatic Paradigm?». Chemistry: A European Journal. 15 (38): 9730–9736. doi:10.1002/chem.200900586. PMID 19562784.
- ^ Wollweber, Hartmund (2000). «Anesthetics, General». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_289.
- ^ Kende H (1993). «Ethylene biosynthesis». Annu. Rev. Plant Physiol. 44: 283–307. doi:10.1146/annurev.pp.44.060193.001435.
- ^ Rappoport, Zvi, ed. (1995). The Chemistry of the Cyclopropyl Group. The Chemistry of Functional Groups. Vol. 2. doi:10.1002/0470023481. ISBN 0471940747.
- ^ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 0-471-85472-7
- ^ Fürstner, Alois; Aïssa, Christophe (2006). «PtCl-Catalyzed Rearrangement of Methylenecyclopropanes». Journal of the American Chemical Society. 128 (19): 6306–6307. doi:10.1021/ja061392y. hdl:11858/00-001M-0000-0025-AE20-3. PMID 16683781.
- ^ Wender, Paul A.; Haustedt, Lars O.; Lim, Jaehong; Love, Jennifer A.; Williams, Travis J.; Yoon, Joo-Yong (May 2006). «Asymmetric Catalysis of the [5 + 2] Cycloaddition Reaction of Vinylcyclopropanes and π-Systems». Journal of the American Chemical Society. 128 (19): 6302–6303. doi:10.1021/ja058590u. PMID 16683779. S2CID 197039161.
External links[edit]
- Synthesis of Cyclopropanes and related compounds
- Carbon triangle
From Wikipedia, the free encyclopedia

|
||
|
||
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
Cyclopropane[2] |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.771 |
|
| KEGG |
|
|
|
PubChem CID |
|
|
| UNII |
|
|
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C3H6 | |
| Molar mass | 42.08 g/mol | |
| Appearance | Colorless gas | |
| Odor | Sweet smelling | |
| Density | 1.879 g/L (1 atm, 0 °C) | |
| Melting point | −128 °C (−198 °F; 145 K) | |
| Boiling point | −33 °C (−27 °F; 240 K) | |
| Acidity (pKa) | ~46 | |
|
Magnetic susceptibility (χ) |
-39.9·10−6 cm3/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
Highly flammable Asphyxiant |
|
| NFPA 704 (fire diamond) |
1 4 0 |
|
| Safety data sheet (SDS) | External MSDS | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cyclopropane is the cycloalkane with the molecular formula (CH2)3, consisting of three methylene groups (CH2) linked to each other to form a ring. The small size of the ring creates substantial ring strain in the structure. Cyclopropane itself is mainly of theoretical interest but many of its derivatives are of commercial or biological significance.[3]
History[edit]
Cyclopropane was discovered in 1881 by August Freund, who also proposed the correct structure for the substance in his first paper.[4] Freund treated 1,3-dibromopropane with sodium, causing an intramolecular Wurtz reaction leading directly to cyclopropane.[5] The yield of the reaction was improved by Gustavson in 1887 with the use of zinc instead of sodium.[6] Cyclopropane had no commercial application until Henderson and Lucas discovered its anaesthetic properties in 1929;[7] industrial production had begun by 1936.[8] In modern anaesthetic practice, it has been superseded by other agents.
Anaesthesia[edit]
Cyclopropane was introduced into clinical use by the American anaesthetist Ralph Waters who used a closed system with carbon dioxide absorption to conserve this then-costly agent.
Cyclopropane is a relatively potent, non-irritating and sweet smelling agent with a minimum alveolar concentration of 17.5%[9] and a blood/gas partition coefficient of 0.55. This meant induction of anaesthesia by inhalation of cyclopropane and oxygen was rapid and not unpleasant. However at the conclusion of prolonged anaesthesia patients could suffer a sudden decrease in blood pressure, potentially leading to cardiac dysrhythmia: a reaction known as «cyclopropane shock».[10] For this reason, as well as its high cost and its explosive nature,[11] it was latterly used only for the induction of anaesthesia, and has not been available for clinical use since the mid 1980s.
Cylinders and flow meters were coloured orange.
Pharmacology[edit]
Cyclopropane is inactive at the GABAA and glycine receptors, and instead acts as an NMDA receptor antagonist.[12][13] It also inhibits the AMPA receptor and nicotinic acetylcholine receptors, and activates certain K2P channels.[12][13][14]
Structure and bonding[edit]
Orbital overlap in the bent bonding model of cyclopropane
The triangular structure of cyclopropane requires the bond angles between carbon-carbon covalent bonds to be 60°. The molecule has D3h molecular symmetry. The C-C distances are 151 pm versus 153-155 pm.[15][16]
Despite their shortness, the C-C bonds in cyclopropane are weakened by 34 kcal/mol vs ordinary C-C bonds. In addition to ring strain, the molecule also has torsional strain due to the eclipsed conformation of its hydrogen atoms. The C-H bonds in cyclopropane are stronger than ordinary C-H bonds as reflected by NMR coupling constants.
Bonding between the carbon centres is generally described in terms of bent bonds.[17] In this model the carbon-carbon bonds are bent outwards so that the inter-orbital angle is 104°.
The unusual structural properties of cyclopropane have spawned many theoretical discussions. One theory invokes σ-aromaticity: the stabilization afforded by delocalization of the six electrons of cyclopropane’s three C-C σ bonds to explain why the strain of cyclopropane is «only» 27.6 kcal/mol as compared to cyclobutane (26.2 kcal/mol) with cyclohexane as reference with Estr=0 kcal/mol,[18] [19][20] in contrast to the usual π aromaticity, that, for example, has a highly stabilizing effect in benzene. Other studies do not support the role of σ-aromaticity in cyclopropane and the existence of an induced ring current; such studies provide an alternative explanation for the energetic stabilization and abnormal magnetic behaviour of cyclopropane.[21]
Synthesis[edit]
Cyclopropane was first produced via a Wurtz coupling, in which 1,3-dibromopropane was cyclised using sodium.[4] The yield of this reaction can be improved by the use of zinc as the dehalogenating agent and sodium iodide as a catalyst.[22]
- BrCH2CH2CH2Br + 2 Na → (CH2)3 + 2 NaBr
The preparation of cyclopropane rings is referred to as cyclopropanation.
Derivatives[edit]
Cyclopropane derivatives are numerous.[24] Many biomolecules and pharmaceutical drugs feature the cyclopropane ring. Famous example is aminocyclopropane carboxylic acid, which is the precursor to ethylene, a plant hormone. The pyrethroids are the basis of many insecticides.[3] Several cyclopropane fatty acids are known.
Reactions[edit]
Owing to the increased π-character of its C-C bonds, cyclopropane can react like an alkene in certain cases. For instance it undergoes hydrohalogenation with mineral acids to give linear alkyl halides. Substituted cyclopropanes also react, following Markovnikov’s rule.[25] Substituted cyclopropanes can oxidatively add to transition metals, in a process referred to as C–C activation.
Cyclopropyl groups adjacent to vinyl groups can undergo ring expansion reactions. Examples include the vinylcyclopropane rearrangement and the divinylcyclopropane-cycloheptadiene rearrangement. This reactivity can be exploited to generate unusual cyclic compounds, such as cyclobutenes,[26] or bicyclic species such as the cycloheptene shown below.[27]
Safety[edit]
Cyclopropane is highly flammable. However, despite its strain energy it is not substantially more explosive than other alkanes.
See also[edit]
- Tetrahedrane contains four fused cyclopropane rings that form the faces of a tetrahedron
- Propellane contains three cyclopropane rings that share a single central carbon-carbon bond.
- Cyclopropene
- Methylenecyclopropane
References[edit]
- ^ Merck Index, 11th Edition, 2755.
- ^ «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 137. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b Faust, Rüdiger (2001). «Fascinating Natural and Artificial Cyclopropane Architectures». Angewandte Chemie International Edition. 40 (12): 2251–2253. doi:10.1002/1521-3773(20010618)40:12<2251::AID-ANIE2251>3.0.CO;2-R. PMID 11433485.
- ^ a b August Freund (1881). «Über Trimethylen» [On trimethylene]. Journal für Praktische Chemie. 26 (1): 367–377. doi:10.1002/prac.18820260125.
- ^ August Freund (1882). «Über Trimethylen» [On trimethylene]. Monatshefte für Chemie. 3 (1): 625–635. doi:10.1007/BF01516828. S2CID 197767176.
- ^ G. Gustavson (1887). «Ueber eine neue Darstellungsmethode des Trimethylens» [On a new method of preparing trimethylene]. Journal für Praktische Chemie. 36: 300–305. doi:10.1002/prac.18870360127.
- ^ G. H. W. Lucas; V. E. Henderson (1 August 1929). «A New Anesthetic: Cyclopropane : A Preliminary Report». Can Med Assoc J. 21 (2): 173–5. PMC 1710967. PMID 20317448.
- ^ H. B. Hass; E. T. McBee; G. E. Hinds (1936). «Synthesis of Cyclopropane». Industrial & Engineering Chemistry. 28 (10): 1178–81. doi:10.1021/ie50322a013.
- ^ Eger, Edmond I.; Brandstater, Bernard; Saidman, Lawrence J.; Regan, Michael J.; Severinghaus, John W.; Munson, Edwin S. (1965). «Equipotent Alveolar Concentrations of Methoxyflurane, Halothane, Diethyl Ether, Fluroxene, Cyclopropane, Xenon and Nitrous Oxide in the Dog». Anesthesiology. 26 (6): 771–777. doi:10.1097/00000542-196511000-00012. PMID 4378907.
- ^ JOHNSTONE, M; Alberts, JR (July 1950). «Cyclopropane anesthesia and ventricular arrhythmias». British Heart Journal. 12 (3): 239–44. doi:10.1136/hrt.12.3.239. PMC 479392. PMID 15426685.
- ^ MacDonald, AG (June 1994). «A short history of fires and explosions caused by anaesthetic agents». British Journal of Anaesthesia. 72 (6): 710–22. doi:10.1093/bja/72.6.710. PMID 8024925.
- ^ a b Hugh C. Hemmings; Philip M. Hopkins (2006). Foundations of Anesthesia: Basic Sciences for Clinical Practice. Elsevier Health Sciences. pp. 292–. ISBN 978-0-323-03707-5.
- ^ a b Hemmings, Hugh C. (2009). «Molecular Targets of General Anesthetics in the Nervous System». Suppressing the Mind: 11–31. doi:10.1007/978-1-60761-462-3_2. ISBN 978-1-60761-463-0.
- ^ Hara K, Eger EI, Laster MJ, Harris RA (December 2002). «Nonhalogenated alkanes cyclopropane and butane affect neurotransmitter-gated ion channel and G-protein-coupled receptors: differential actions on GABAA and glycine receptors». Anesthesiology. 97 (6): 1512–20. doi:10.1097/00000542-200212000-00025. PMID 12459679. S2CID 21160239.[permanent dead link]
- ^ Allen, Frank H.; Kennard, Olga; Watson, David G.; Brammer, Lee; Orpen, A. Guy; Taylor, Robin (1987). «Tables of bond lengths determined by X-ray and neutron diffraction. Part 1. Bond lengths in organic compounds». Journal of the Chemical Society, Perkin Transactions 2 (12): S1–S19. doi:10.1039/P298700000S1.
- ^ Boulatov, Roman, ed. (2015). Polymer Mechanochemistry. Springer. p. 9. ISBN 978-3-319-22824-2.
- ^ Eric V. Anslyn and Dennis A. Dougherty. Modern Physical Organic Chemistry. 2006. pages 850-852
- ^ S. W. Benson, Thermochemical Kinetics, S. 273, J. Wiley & Sons, New York, London, Sydney, Toronto 1976
- ^ Dewar, M. J. (1984). «Chemical Implications of σ Conjugation». J. Am. Chem. Soc. 106 (3): 669–682. doi:10.1021/ja00315a036.
- ^ Cremer, D. (1988). «Pros and Cons of σ-Aromaticity». Tetrahedron. 44 (2): 7427–7454. doi:10.1016/s0040-4020(01)86238-4.
- ^ Wu, Wei; Ma, Ben; Wu, Judy I-Chia; von Ragué, Schleyer; Mo, Yirong (2009). «Is Cyclopropane Really the σ-Aromatic Paradigm?». Chemistry: A European Journal. 15 (38): 9730–9736. doi:10.1002/chem.200900586. PMID 19562784.
- ^ Wollweber, Hartmund (2000). «Anesthetics, General». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_289.
- ^ Kende H (1993). «Ethylene biosynthesis». Annu. Rev. Plant Physiol. 44: 283–307. doi:10.1146/annurev.pp.44.060193.001435.
- ^ Rappoport, Zvi, ed. (1995). The Chemistry of the Cyclopropyl Group. The Chemistry of Functional Groups. Vol. 2. doi:10.1002/0470023481. ISBN 0471940747.
- ^ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 0-471-85472-7
- ^ Fürstner, Alois; Aïssa, Christophe (2006). «PtCl-Catalyzed Rearrangement of Methylenecyclopropanes». Journal of the American Chemical Society. 128 (19): 6306–6307. doi:10.1021/ja061392y. hdl:11858/00-001M-0000-0025-AE20-3. PMID 16683781.
- ^ Wender, Paul A.; Haustedt, Lars O.; Lim, Jaehong; Love, Jennifer A.; Williams, Travis J.; Yoon, Joo-Yong (May 2006). «Asymmetric Catalysis of the [5 + 2] Cycloaddition Reaction of Vinylcyclopropanes and π-Systems». Journal of the American Chemical Society. 128 (19): 6302–6303. doi:10.1021/ja058590u. PMID 16683779. S2CID 197039161.
External links[edit]
- Synthesis of Cyclopropanes and related compounds
- Carbon triangle
циклопропан
- циклопропан
-
циклопропа/н, -а
Слитно. Раздельно. Через дефис..
.
Синонимы:
Смотреть что такое «циклопропан» в других словарях:
-
циклопропан — циклопропан … Орфографический словарь-справочник
-
Циклопропан — Циклопропан … Википедия
-
ЦИКЛОПРОПАН — ( Cyclopropanum ). Синоним: Cyclopropane. Безцветный горючий газ с характерным запахом, напоминающим запах петролейного эфира, едкого вкуса. Относительная плотность 1,879. При температуре 4 20 С и давлении 5 атм переходит в жидкое состояние;… … Словарь медицинских препаратов
-
ЦИКЛОПРОПАН — (триметилен) бесцветный газ, tкип 32,7 .С. Средство для наркоза … Большой Энциклопедический словарь
-
циклопропан — сущ., кол во синонимов: 2 • анестетик (12) • триметилен (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
-
циклопропан — (триметилен), бесцветный газ, tкип 32,7°C. Средство для наркоза. * * * ЦИКЛОПРОПАН ЦИКЛОПРОПАН (триметилен), бесцветный газ, tкип 32,7 °С. Средство для наркоза … Энциклопедический словарь
-
Циклопропан — (триметилен) пробовал получить, но безуспешно Ребуль из бромистого триметилена отнятием брома: получился обыкновенный пропилен; в 1882 г. Фрейнд, однако, показал, что если нагревать бромистый триметилен с натрием (лучше в присутствии ксилола;… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
циклопропан — (см. цикла… + пропан) органическое соединение, углеводород алицикли ческого ряда; газ; примен. в хирургии как общий анестетик. Новый словарь иностранных слов. by EdwART, , 2009. циклопропан а, мн. нет, м. ( … Словарь иностранных слов русского языка
-
циклопропан — ciklopropanas statusas T sritis chemija formulė Formulę žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. cyclopropane rus. циклопропан … Chemijos terminų aiškinamasis žodynas
-
Циклопропан — триметилен, углеводород алициклического ряда; бесцветный газ, tкип 32,8 °С, плотность 0,720 г/см3 ( 79 °С); нерастворим в воде, растворим в спирте, эфире. Ц. первый член гомологического ряда циклоалканов (См.… … Большая советская энциклопедия
-
ЦИКЛОПРОПАН — (триметилен), мол. м. 42,08; бесцв. газ, т. пл. 127 … Химическая энциклопедия
Синонимы слова «ЦИКЛОПРОПАН»:
ТРИМЕТИЛЕН, АНЕСТЕТИК
Смотреть что такое ЦИКЛОПРОПАН в других словарях:
ЦИКЛОПРОПАН
(триметилен) —
пробовал получить, но безуспешно Ребуль из бромистого триметилена отнятием брома: получился обыкновенный пропилен; в 1882 г. Фрейнд, о… смотреть
ЦИКЛОПРОПАН
триметилен, углеводород алициклического ряда; бесцветный газ, tкип 32,8 °С, плотность 0,720 г/см3 (—79 °С); нерастворим в воде, растворим в спи… смотреть
ЦИКЛОПРОПАН
циклопропан
сущ., кол-во синонимов: 2
• анестетик (12)
• триметилен (1)
Словарь синонимов ASIS.В.Н. Тришин.2013.
.
Синонимы:
триметилен
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН, триметилен, углеводород
алициклич. ряда; бесцветный газ, tкип 32,8 °С, плотность 0,720 г /см3(-79
°С); нерастворим в воде, растворим в с… смотреть
ЦИКЛОПРОПАН
Циклопропан (триметилен) — пробовал получить, но безуспешно Ребуль из бромистого триметилена отнятием брома: получился обыкновенный пропилен; в 1882 г. Фрейнд, однако, показал, что если нагревать бромистый триметилен с натрием (лучше в присутствии ксилола; Волков и Б. Меншуткин), то образуется Ц. Удобнее получается углеводород, как нашел Густавсон в 1887 г., при действии на бромистый триметилен цинковой пыли в присутствии 75%-го спирта. Насколько можно судить (по работам Волкова и Б. Меншуткина, Танатара, Густавсона за последние годы) до сих пор еще неизвестны условия для получения чистого Ц.; зависит ли это от того, что не найдены требуемая температура и концентрация реагирующих тел, или же от нечистоты бромистого триметилена, или, наконец, от способности Ц. изомеризоваться в пропилен — вопрос, пока не решенный; во всяком случае, в полученном газе всегда имеется некоторое количество пропилена СН <sub>3</sub>.СН:СН <sub>2</sub>, который приходится удалять бромом (пользуясь медленной реакцией брома с Ц.; Волков и Б. Меншуткин), или же, отбрасывая первые порции получающегося газа (Густавсон); окончательно Ц. очищается действием 1% — 2% раствора KMnO<sub>4</sub>, на который, по наблюдениям Е. Вагнера, Ц. не действует. Ц. — газ; сжиженный кипит около — 35°, плав. около — 126° (Ланденбург, Крюгель; пропилен, по их наблюдениям, кип. при — 50,2° и жидок еще при — 372°); он стоек до температуры темно-красного каления (Волков и Меншуткин), но несколько выше (ок. 600°) превращается отчасти в пропилен (Танатар). Если наблюдение верно, то ближе всего явление напоминает переход пара красного фосфора в пары белого фосфора (ср. соотв. статью); по крайней мере, такое сопоставление объясняет почему газ должен проходить нагретую трубку быстро и быстро же успевать охладиться (на это условие обращает внимание Танатар); но тогда следовало бы ожидать, что и при долговременном нагревании, но медленном охлаждении, не будет наблюдаться никакого превращения Ц. в пропилен, и что, напротив, в этих условиях пропилен будет превращаться в циклопропан; такого наблюдения пока не имеется, и процесс изомеризации остается пока не объясненным. От пропилена, кроме приведенных выше физических свойств, Ц. отличается малой скоростью взаимодействия с HJ и Вr и отсутствием реакции с раствором КМnО <sub>4</sub>. Реагируя с дымящейся йодистоводородной кислотой, Ц. образует нормальный йодистый пропил: ; с бромом на свету (в темноте реакция идет слишком медленно) Ц. образует обратно довольно чистый бромистый триметилен (Танатар); по Густавсону, одновременно образуются и из вполне чистого Ц. заметные количества бромистого пропилена, т. е. СН <sub>3</sub>.СНВr.СH <sub>2</sub> Вr [Что такое превращение возможно, указывает быстрое образование (Густавсон) при обыкн. темп. бромистого пропилена из бромистого триметилена под каталитическим влиянием бромистого алюминия.]. С хлором Ц. реагирует очень легко, почти не образуя продукта присоединения, а, главным образом, различные продукты замещения и между ними дихлортриметилен (Густавсон) С <sub>3</sub> Н <sub>4</sub>Cl<sub>2</sub>, бесцветную жидкость, кипящую при 75°—76°, уд. веса <i>d<sup>15 = </sup> </i> 1,206, соединяющуюся на солнечном свету с бромом в С <sub>3</sub> Н <sub>4</sub> Сl <sub>2</sub> Вr <sub>2</sub>. В серной кислоте Ц. мало растворяется, образуя, наряду с продуктами уплотнения, нормальную пропилсерную кислоту (Густавсон, Бертело), дающую при перегонке со щелочами нормальный пропиловый спирт. В свое время неполучение Ребулем (в 1878 г.) триметилена послужило одним из доводов в пользу положения, что два одновалентных атома или остатка могут отниматься одновременно только от двух соседних атомов углерода; теперь известно, что это положение, на котором построены формулы большого числа непредельных углеводородов — неверно. <i> А. И. Г.</i> Δ <i>. </i><br><br><br>… смотреть
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН ( Cyclopropanum ). Синоним: Cyclopropane. Безцветный горючий газ с характерным запахом, напоминающим запах петролейного эфира, едкого вкуса. Относительная плотность 1,879. При температуре 4 — 20 С и давлении 5 атм переходит в жидкое состояние; температура кипения циклопропана при атмосферном давлении — 347 С. Мало растворим в воде (один объем газа при + 20 С растворим в 2,85 объема воды). Легко растворим в спирте, петролейном эфире, хлороформе и жирных маслах. Циклопропан оказывает сильное общеобезболивающее действие. Чрезвычайно огнеопасен; его смеси с кислородом, закисью азота и воздухом могут взрываться при соприкосновении с пламенем, электрической искрой и другими источниками, которые могут вызывать воспламенение. При использовании циклопропана необходимо принимать все меры, исключающие возможность взрыва, в том числе меры предосторожности, связанные с применением электрои рентгеноаппаратуры и исключающие образование статического электричества. В связи с этими особенностями, а также с появлением новых способов и средств общего обезболивания циклопропан в настоящее время крайне редко используется в качестве средства для наркоза. Действует циклопропан быстро. В концентрации 4 об. % вызывает аналгезию, 6 об. % — выключает сознание, 8 — 10 об. % — вызывает наркоз (III стадии), в концентрации 20 -30 об. % — глубокий наркоз. В организме циклопропан не разрушается и выделяется в неизменном виде почти полностью через 10 мин после прекращения ингаляции. Циклопропан не оказывает выраженного влияния на функции печени и почек; несколько понижает диурез. Иногда при наркозе циклопропаном наступает кратковременная гипергликемия, связанная с возбуждением адренореактивных систем. Этот эффект менее выражен, чем при применении эфира. Циклопропан оказывает возбуждающее влияние на холинореактивные системы организма и вызывает некоторое замедление пульса, возможны аритмии. Под влиянием циклопропана сильно повышается чувсвительность миокарда к адреналину; введение адреналина при наркозе циклопропаном может вызвать фибрилляцию желудочков.Артериальное давление во время наркоза несколько повышается, что может привести к некоторому усилению кровоточивости. Циклопропан используется для вводного и основного наркоза (циклопропан с кислородом); чаще применяется в комбинации с другими средствами для наркоза (закись азота, эфир) и с мышечными релаксантами. Показан больным с заболеваниями легких, так как не вызывает раздражения слизистых оболочек дыхательных путей. Его можно назначать при болезнях печени и при диабете. Циклопропановый наркоз может применяться для кратковременных оперативных вмешательств. Циклопропан применяют в смеси с кислородом по закрытой и полузакрытой системе (иногда по полуоткрытой) с использованием наркозных аппаратов с дозиметрами. Для поддержания наркоза используют 15 — 18 % циклопропана. Введение в наркоз осуществляется более высокими концентрациями циклопропана. К моменту окончания операции подачу циклопропана прекращают, и через 2 — 5 мин. вдыхания чистого кислорода больные просыпаются. Подача кислорода должна производиться непрерывно. Необходимо следить за тем, чтобы сохранялась достаточная вентиляция легких и происходило освобождение организма от углекислоты. Иногда циклопропан применяют как составную часть . После вводного внутривенного наркоза тиопентал-натрием подают (по полузакрытому способу) смесь газов в следующем соотношении: закись азота — 1 часть, кислород — 2 части, циклопропан — 0,4 части. При использовании этой смеси необходимо после окончания обезболивания исключать наркотизирующие компоненты в определенной последовательности (во избежание развития гипоксии): сначала прекращают подачу циклопропана, через 2 — 3 мин — закиси азота и еще через такой же срок — кислорода. При правильном дозировании циклопропана наркоз протекает без осложнений, больные быстро просыпаются после окончания ингаляции. В случае передозировки возможны остановка дыхания и угнетение сердечной деятельности вплоть до остановки сердца. В связи с быстрым пробуждением после прекращения наркоза больные могут ощущать после операции сильную боль, поэтому до окончания операции рекомендуется ввести анальгетик. После наркоза относительно часто наблюдается головная боль, в отдельных случаях — послеоперационная рвота, парез кишечника. Поэтому больные после пробуждения от наркоза нуждаются в тщательном наблюдении. При циклопропановом наркозе противопоказано введение адреналина и норадреналина. Форма выпуска: в стальных цельнотянутых баллонах вместимостью 1 и 2 л жидкого циклопропана, находящегося под давлением 5 атм; баллоны окрашены в оранжевый цвет и имеют надпись . К применению циклопропана допускается только медицинский персонал, прошедший соответствующий инструктаж. Хранение: в прохладном месте вдали от источников огня.
Словарь медицинских препаратов.2005.
Синонимы:
триметилен… смотреть
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН (Cyclopropanum).
Синоним: Cyclopropane.
Безцветный горючий газ с характерным запахом, напоминающим запах петролейного эфира, едкого вкуса. Относительная плотность 1, 879. При температуре 4 — 20 С и давлении 5 атм переходит в жидкое состояние; температура кипения циклопропана при атмосферном давлении — 347 С. Мало растворим в воде (один объем газа при + 20 С растворим в 2, 85 объема воды). Легко растворим в спирте, петролейном эфире, хлороформе и жирных маслах.
Циклопропан оказывает сильное общеобезболивающее действие. Чрезвычайно огнеопасен; его смеси с кислородом, закисью азота и воздухом могут взрываться при соприкосновении с пламенем, электрической искрой и другими источниками, которые могут вызывать воспламенение. При использовании циклопропана необходимо принимать все меры, исключающие возможность взрыва, в том числе меры предосторожности, связанные с применением электро- и рентгеноаппаратуры и исключающие образование статического электричества. В связи с этими особенностями, а также с появлением новых способов и средств общего обезболивания циклопропан в настоящее время крайне редко используется в качестве средства для наркоза. Действует циклопропан быстро. В концентрации 4 об. % вызывает аналгезию, 6 об. % — выключает сознание, 8 — 10 об. % — вызывает наркоз (III стадии), в концентрации 20 -30 об. % — глубокий наркоз.
В организме циклопропан не разрушается и выделяется в неизменном виде почти полностью через 10 мин после прекращения ингаляции.
Циклопропан не оказывает выраженного влияния на функции печени и почек; несколько понижает диурез. Иногда при наркозе циклопропаном наступает кратковременная гипергликемия, связанная с возбуждением адренореактивных систем. Этот эффект менее выражен, чем при применении эфира.
Циклопропан оказывает возбуждающее влияние на холинореактивные системы организма и вызывает некоторое замедление пульса, возможны аритмии. Под влиянием циклопропана сильно повышается чувсвительность миокарда к адреналину; введение адреналина при наркозе циклопропаном может вызвать фибрилляцию желудочков.
Артериальное давление во время наркоза несколько повышается, что может привести к некоторому усилению кровоточивости.
Циклопропан используется для вводного и основного наркоза (циклопропан с кислородом); чаще применяется в комбинации с другими средствами для наркоза (закись азота, эфир) и с мышечными релаксантами. Показан больным с заболеваниями легких, так как не вызывает раздражения слизистых оболочек дыхательных путей. Его можно назначать при болезнях печени и при диабете.
Циклопропановый наркоз может применяться для кратковременных оперативных вмешательств.
Циклопропан применяют в смеси с кислородом по закрытой и полузакрытой системе (иногда по полуоткрытой) с использованием наркозных аппаратов с дозиметрами. Для поддержания наркоза используют 15 — 18 % циклопропана. Введение в наркоз осуществляется более высокими концентрациями циклопропана. К моменту окончания операции подачу циклопропана прекращают, и через 2 — 5 мин. вдыхания чистого кислорода больные просыпаются.
Подача кислорода должна производиться непрерывно. Необходимо следить за тем, чтобы сохранялась достаточная вентиляция легких и происходило освобождение организма от углекислоты.
Иногда циклопропан применяют как составную часть . После вводного внутривенного наркоза тиопентал-натрием подают (по полузакрытому способу) смесь газов в следующем соотношении: закись азота — 1 часть, кислород — 2 части, циклопропан — 0, 4 части.
При использовании этой смеси необходимо после окончания обезболивания исключать наркотизирующие компоненты в определенной последовательности (во избежание развития гипоксии): сначала прекращают подачу циклопропана, через 2 — 3 мин — закиси азота и еще через такой же срок — кислорода.
При правильном дозировании циклопропана наркоз протекает без осложнений, больные быстро просыпаются после окончания ингаляции. В случае передозировки возможны остановка дыхания и угнетение сердечной деятельности вплоть до остановки сердца.
В связи с быстрым пробуждением после прекращения наркоза больные могут ощущать после операции сильную боль, поэтому до окончания операции рекомендуется ввести анальгетик. После наркоза относительно часто наблюдается головная боль, в отдельных случаях — послеоперационная рвота, парез кишечника. Поэтому больные после пробуждения от наркоза нуждаются в тщательном наблюдении.
При циклопропановом наркозе противопоказано введение адреналина и норадреналина.
Форма выпуска: в стальных цельнотянутых баллонах вместимостью 1 и 2 л жидкого циклопропана, находящегося под давлением 5 атм; баллоны окрашены в оранжевый цвет и имеют надпись .
К применению циклопропана допускается только медицинский персонал, прошедший соответствующий инструктаж.
Хранение: в прохладном месте вдали от источников огня…. смотреть
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН (Cyclopropanum).
C3H6 Мол. м. 42,1
CH2
H2C CH2
АФІ синтетичного походжен… смотреть
ЦИКЛОПРОПАН
циклопропа́н
(см. цикла… + пропан) органическое соединение, углеводород алицикли-ческого ряда; газ; примен. в хирургии как общий анестетик.
Новый сл… смотреть
ЦИКЛОПРОПАН
Орало Опцион Опор Опока Опилка Опарник Опарин Опанк Опалин Опал Опак Опа Оон Онко Олин Окрол Окопница Окоп Околица Око Окно Окапи Ока Оао Нпо Норка Нора Нолик Нок Нло Ниц Нил Николо Ника Наци Нарко Нарк Напор Напилок Налицо Нал Накр Накол Лоро Лорина Лори Лор Лоно Локон Локо Лок Лицо Лира Липко Липка Липа Лион Линц Линкор Линк Лина Лик Ларион Ларин Лапник Лак Кропило Крон Крица Крип Крио Крин Крапп Крап Кранц Кран Кппа Корп Корона Корнил Корн Корица Коран Кора Копра Копна Копир Копал Копа Кооп Кон Колпица Колпино Колон Коло Кола Кол Коир Коан Кнр Кноп Кница Клоп Клон Клица Клир Клип Клион Клио Клин Клан Кира Кипр Кипп Кипа Кино Кина Кило Кил Карп Карло Карл Капрон Капролон Капор Капонир Капо Кап Каон Каолин Каноп Кан Калин Кали Кал Каир Каин Ирон Ирка Иран Ирак Иппон Ионол Ион Иол Инок Инкор Инко Инк Илона Орион Орк Икра Икона Икар Орка Орлан Орлик Арон Орлица Орлон Орн Орок Арно Арник Арк Пак Арион Арин Апк Паки Панир Панк Папик Аон Парник Пиан Пиано Анри Аник Алкин Алин Алик Акрил Акр Акно Аки Аир Аил Пиар Анк Парк Парик Пари Папин Пани Пан… смотреть
ЦИКЛОПРОПАН
1) Орфографическая запись слова: циклопропан2) Ударение в слове: циклопроп`ан3) Деление слова на слоги (перенос слова): циклопропан4) Фонетическая тран… смотреть
ЦИКЛОПРОПАН
ЦИКЛОПРОПА́Н, у, ч.Найпростіший циклопарафін. Застосовують для наркозу.Подібну наркотичну дію на організм людини чинять циклопропан і важкі благородні … смотреть
ЦИКЛОПРОПАН
простейший циклоалкан; бесцв. газ, tкип — 33 °С, взрывоопасен. Треугольная молекула Ц. имеет значит. напряжение (см. Напряжение молекул), поэтому Ц. пр… смотреть
ЦИКЛОПРОПАН
Ударение в слове: циклопроп`анУдарение падает на букву: аБезударные гласные в слове: циклопроп`ан
ЦИКЛОПРОПАН
-у, ч. Горючий газ, який разом із киснем використовують для загального наркозу під час хірургічних операцій.
ЦИКЛОПРОПАН
(cycloproрапе) общий анестетик; применяется в ингаляциях при всех видах хирургических операций. Может вызвать послеоперационную тошноту, рвоту и головную боль…. смотреть
ЦИКЛОПРОПАН
циклопропан [см. цикла… + пропан] — органическое соединение, углеводород алицикли-ческого ряда; газ; примен. в хирургии как общий анестетик.
ЦИКЛОПРОПАН
(триметилен), мол. м. 42,08; бесцв. газ, т. пл. -127 Синонимы: триметилен
ЦИКЛОПРОПАН
-у, ч. Горючий газ, який разом із киснем використовують для загального наркозу під час хірургічних операцій.
ЦИКЛОПРОПАН
Начальная форма — Циклопропан, винительный падеж, единственное число, мужской род, неодушевленное
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН (триметилен), бесцветный газ, tкип -32, 7 °С. Средство для наркоза.
ЦИКЛОПРОПАН
ЦИКЛОПРОПАН (триметилен) — бесцветный газ, tкип -32,7 .С. Средство для наркоза.
ЦИКЛОПРОПАН
— (триметилен) — бесцветный газ, tкип -32,7 .С. Средство длянаркоза.
ЦИКЛОПРОПАН (CYCLOPROРАПЕ)
общий анестетик; применяется в ингаляциях при всех видах хирургических операций. Может вызвать послеоперационную тошноту, рвоту и головную боль.
Источник: «Медицинский словарь»… смотреть
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Слова русского языка,
поиск и разбор слов онлайн
циклопропан
Правильно слово пишется: циклопропа́н
Ударение падает на 4-й слог с буквой а.
Всего в слове 11 букв, 4 гласных, 7 согласных, 4 слога.
Гласные: и, о, о, а;
Согласные: ц, к, л, п, р, п, н.
Номера букв в слове
Номера букв в слове «циклопропан» в прямом и обратном порядке:
- 11
ц
1 - 10
и
2 - 9
к
3 - 8
л
4 - 7
о
5 - 6
п
6 - 5
р
7 - 4
о
8 - 3
п
9 - 2
а
10 - 1
н
11
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Циклопропан
Брутто-формула:
C3H6
CAS# 75-19-4
Категории:
Циклоалканы
PubChem CID: 6351
| ChemSpider ID: 6111
| CHEBI:30365
| CHEMBL1796999
Названия
Русский:
- Циклопропан(IUPAC) [Wiki]
English:
- Cyclopropane(IUPAC) [Wiki]
- EINECS:200-847-8
Варианты формулы:
-_q3_q3
C_(x1.3)C_q3C_q3; H_(A-20,w-)#1_(A110,d+)H; H_(A-160,w-)#2_(A80,d+)H; H_(A65,w-)#3_(A-65,d+)H
H2C_(x1.4)CH2_q3CH2_q3
Вещества, имеющие отношение…
Следущий гомолог:
Циклобутан
Химический состав