From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| IUPAC name
sodium tetrahydroxozincate(II) |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ECHA InfoCard | 100.032.117 |
| EC Number |
|
|
PubChem CID |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2ZnO2 |
| Molar mass | 179.418 g/mol |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium zincate refers to anionic zinc oxides or hydroxides, depending on conditions. In the applications of these materials, the exact formula is not necessarily important and it is likely that aqueous zincate solutions consist of mixtures.[1]
Hydroxyzincates[edit]
Solutions of sodium zincate may be prepared by dissolving zinc, zinc hydroxide, or zinc oxide in an aqueous solution of sodium hydroxide.[2] Simplified equations for these complex processes are:
- ZnO + H2O + 2 NaOH → Na2Zn(OH)4
- Zn + 2 H2O + 2 NaOH → Na2Zn(OH)4 + H2
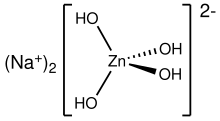
From such solutions, one can crystallize salts of containing the anions Zn(OH)42−, Zn2(OH)62−, and Zn(OH)64−. Na2Zn(OH)4 consists of tetrahedral zincate ion and octahedral sodium cations.[3]
The salt Sr2Zn(OH)6 features zinc in an octahedral coordination sphere.
Oxozincates[edit]
Related oxides are also known such as Na2ZnO2,[4] Na2Zn2O3,[5] Na10Zn4O9.[6]
References[edit]
- ^ Glenn O. Mallory, Juan B. Hajdu, (1990), Electroless Plating: Fundamentals and Applications, American Electroplaters and Surface Finishers Society, , William Andrew Inc., ISBN 0-936569-07-7
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Synthese und Kristallstruktur von Na2Zn(OH)4, R. Stahl , R. Niewa , H. Jacobs, Zeitschrift für anorganische und allgemeine Chemie, volume 625, pp. 48 — 50, doi:10.1002/(SICI)1521-3749(199901)625:1<48::AID-ZAAC48>3.0.CO;2-L
- ^ D. Trinschek, M. Jansen (1996): «Na2ZnO2, ein neues Natriumzinkat». Zeitschrift für Naturforschung B, volume 51, issue 5, pages 711-714. doi:10.1515/znb-1996-0515
- ^ Eine neue Modifikation von Na2Zn2O3, D. Trinschek, M. Jansen: , Z. Naturforschung 51b, (1996), 917-21
- ^ Ein neues Oxozinkat mit trigonal-planar koordiniertem Zink, D. Trinschek, M. Jansen: Na10Zn4O9, Zeitschrift für anorganische und allgemeine Chemie volume 622 (1996), pp. 245-50
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
sodium tetrahydroxozincate(II) |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ECHA InfoCard | 100.032.117 |
| EC Number |
|
|
PubChem CID |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Na2ZnO2 |
| Molar mass | 179.418 g/mol |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium zincate refers to anionic zinc oxides or hydroxides, depending on conditions. In the applications of these materials, the exact formula is not necessarily important and it is likely that aqueous zincate solutions consist of mixtures.[1]
Hydroxyzincates[edit]
Solutions of sodium zincate may be prepared by dissolving zinc, zinc hydroxide, or zinc oxide in an aqueous solution of sodium hydroxide.[2] Simplified equations for these complex processes are:
- ZnO + H2O + 2 NaOH → Na2Zn(OH)4
- Zn + 2 H2O + 2 NaOH → Na2Zn(OH)4 + H2
From such solutions, one can crystallize salts of containing the anions Zn(OH)42−, Zn2(OH)62−, and Zn(OH)64−. Na2Zn(OH)4 consists of tetrahedral zincate ion and octahedral sodium cations.[3]
The salt Sr2Zn(OH)6 features zinc in an octahedral coordination sphere.
Oxozincates[edit]
Related oxides are also known such as Na2ZnO2,[4] Na2Zn2O3,[5] Na10Zn4O9.[6]
References[edit]
- ^ Glenn O. Mallory, Juan B. Hajdu, (1990), Electroless Plating: Fundamentals and Applications, American Electroplaters and Surface Finishers Society, , William Andrew Inc., ISBN 0-936569-07-7
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Synthese und Kristallstruktur von Na2Zn(OH)4, R. Stahl , R. Niewa , H. Jacobs, Zeitschrift für anorganische und allgemeine Chemie, volume 625, pp. 48 — 50, doi:10.1002/(SICI)1521-3749(199901)625:1<48::AID-ZAAC48>3.0.CO;2-L
- ^ D. Trinschek, M. Jansen (1996): «Na2ZnO2, ein neues Natriumzinkat». Zeitschrift für Naturforschung B, volume 51, issue 5, pages 711-714. doi:10.1515/znb-1996-0515
- ^ Eine neue Modifikation von Na2Zn2O3, D. Trinschek, M. Jansen: , Z. Naturforschung 51b, (1996), 917-21
- ^ Ein neues Oxozinkat mit trigonal-planar koordiniertem Zink, D. Trinschek, M. Jansen: Na10Zn4O9, Zeitschrift für anorganische und allgemeine Chemie volume 622 (1996), pp. 245-50
- География
- История
- Общество
- Персоны
- Религия
- Спорт
- Техника
- Наука
- Искусство
- Философия
Цинкат натрия
Что такое 24wiki.ru
Наш сайт — это статьи из сайта википедии, написанные на более понятном языке. Он открыт для любого пользователя. 24wiki.ru это библиотека, которая является общественной.
Основа этой страницы находится в 24wiki.ru. Текст доступен по лицензии CC BY-SA 3.0 Unported License.
Wiki® — зарегистрированный товарный знак организации Wiki Foundation, Inc. 24wiki.ru является независимой компанией и не аффилирована с Фондом Викимедиа (Wikimedia Foundation). 24wiki.ru — НЕофициальный сайт Википедии!
E-mail: admin@24wiki.ru
Цинкат натрия — неорганическое соединение, комплексный оксид металлов натрия и цинкас формулой Na2ZnO2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
| Цинкат натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
Цинкат натрия |
| Хим. формула | Na2ZnO2 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 143,388 г/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 75.230 г/100 мл |
| Классификация | |
| Рег. номер CAS | 37224-32-1 |
| PubChem | 56842982 |
| SMILES |
[O-2].[O-2].[Na+].[Na+].[Zn+2] |
| InChI |
1S/2Na.2O.Zn/q2*+1;2*-2;+2 NECNAXWJIQPTKG-UHFFFAOYSA-N |
| ChemSpider | 57450748 |
Получение
- Растворение гидроксида цинка в растворе едкого натра:
-
- с последующим нагреванием:
- Взаимодействие гидроксида цинка с натрием:
- Сплавление оксида или гидроксида цинка и едкого натра:
Физические свойства
Цинкат натрия образует бесцветные кристаллы.
Растворяется в воде.
Образует кристаллогидрат состава Na2ZnO2•4H2O.
| Цинкат натрия | |
|---|---|
| Систематическое наименование |
Цинкат натрия |
| Хим. формула | Na2ZnO2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 143,37 г/моль |
| Растворимость | |
| • в воде | 75.230 г/100 мл |
| Рег. номер CAS | 37224-32-1 |
| PubChem | 56842982 |
| SMILES |
[O-2].[O-2].[Na+].[Na+].[Zn+2] |
| InChI |
1S/2Na.2O.Zn/q2*+1;2*-2;+2 NECNAXWJIQPTKG-UHFFFAOYSA-N |
| ChemSpider | 57450748 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Цинкат натрия — неорганическое соединение, комплексный оксид металлов натрия и цинка с формулой Na2ZnO2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
- Растворение гидроксида цинка в растворе едкого натра:
-
- Zn(OH)2 + 2 NaOH ⟶ Na2[Zn(OH)4]
- с последующим нагреванием:
- Na2[Zn(OH)4] →T Na2ZnO2 + 2H2O
- Сплавление оксида или гидроксида цинка и едкого натра:
-
- ZnO + 2 NaOH →TNa2ZnO2 + H2O
- Zn(OH)2 + 2 NaOH →TNa2ZnO2 + 2H2O
Физические свойства
Цинкат натрия образует бесцветные кристаллы.
Растворяется в воде.
Образует кристаллогидрат состава Na2ZnO2•4H2O.
| Имена | |
|---|---|
| Название IUPAC тетрагидроксоцинкат натрия (II) | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ECHA InfoCard | 100.032.117 |
| Номер EC |
|
| PubChem CID |
|
| Панель управления CompTox (EPA ) |
|
InChI
|
|
УЛЫБАЕТСЯ
|
|
| Свойства | |
| Химическая формула | Na2Zn (OH) 4 |
| Молярная масса | 179,418 г / моль |
| За исключением случаев, когда n При этом данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Цинкат натрия относится к анионным оксидам или гидроксидам цинка в зависимости от условий. При применении этих материалов точная формула не обязательно важна, и вполне вероятно, что водные растворы цинката состоят из смесей.
Гидроксицинкаты
Растворы натрия цинката могут быть получен растворением цинка, гидроксида цинка или оксида цинка в водном растворе гидроксида натрия. Упрощенные уравнения для этих сложных процессов:
- ZnO + H 2 O + 2 NaOH → Na 2 Zn (OH) 4
- Zn + 2 H 2 O + 2 NaOH → Na 2 Zn (OH) 4 + H 2
Из таких растворов можно кристаллизовать соли, содержащие анионы Zn (OH) 4, Zn 2 (OH) 6 и Zn (OH) 6. Na 2 Zn (OH) 4 состоит из тетраэдрического иона цинката и октаэдрических катионов натрия.. Соль Sr 2 Zn (OH) 6 содержит цинк в октаэдрической координационной сфере.
Оксоцинкаты
Родственные оксиды также известны, как Na 2 ZnO 2, Na 2Zn2O3, Na 10Zn4O9.
Ссылки
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Цинкат натрия
Брутто-формула:
Na2O2Zn
CAS# 37224-32-1
Категории:
Неорганические соли
, Оксиды
PubChem CID: 56842982
Названия
Русский:
- Цинкат натрия [Wiki]
English:
- Sodium zinc oxide
- disodium;zinc;oxygen(2-)(IUPAC)
Варианты формулы:
Na2ZnO2
$slope(45)$L(1.2)Na`^+/hO`^-ZnO^-/hNa^+
$slope(45)$L(1.4)Zn^2+<`O^2-><`/0Na^+><O^2-></0Na^+>
Химический состав
Реакции, в которых участвует Цинкат натрия
-
Na2[Zn(OH)4] «T»-> Na2ZnO2 + 2H2O
-
ZnO + 2NaOH «T»-> Na2ZnO2 + H2O
