Рак шейки матки
Версия: Клинические протоколы МЗ РК — 2018 (Казахстан)
Категории МКБ:
Злокачественное новообразование шейки матки (C53)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «1» марта 2019 года
Протокол №56
Рак шейки матки — это злокачественное новообразование шейки матки.
ВВОДНАЯ ЧАСТЬ:
Название протокола: Рак шейки матки
Код (ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| C53 | Злокачественное новообразование шейки матки |
| C53.0 | Внутренней части |
| C53.1 | Наружной части |
| C53.8 | Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций |
| C53.9 | Шейки матки неуточненной части |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| АЧТВ | активированное частичное тромбопластиновое время |
| в/в | внутривенно |
| в/м | внутримышечно |
| ВОЗ | Всемирная Организация Здравоохранения |
| ВПЧ | вирус папилломы человека |
| ЖКТ | желудочно – кишечный тракт |
| ЗНО | злокачественное новообразование |
| ИФА | иммуноферментный анализ |
| КТ | компьютерная томография |
| ЛТ | лучевая терапия |
| МНО | международное нормализованное отношение |
| МРТ | магнитно-резонансная томография |
| ОАК | общий анализ крови |
| ОАМ | общий анализ мочи |
| п/к | подкожно |
| ПАП — тест | цитологическое исследование мазков методом окраски по Папаниколау, применяемое для определения состояния шейки матки |
| ПТИ | протромбиновый индекс |
| ПЭТ | позитронно –эмиссионная томография |
| РОД | разовая очаговая доза |
| РШМ | рак шейки матки |
| СОД | суммарно-очаговая доза |
| ССС | сердечно- сосудистая система |
| УЗДГ | ультразвуковое допплерография |
| УЗИ | ультразвуковое исследование |
| ЭКГ | электрокардиограмма |
| ЭхоКГ | эхокардиография |
| FIGO | International Federation Gynecology and Obstetrics |
| TNM | Tumor Nodulus Metastasis — международная классификация стадий злокачественных новообразований |
| CIN | цервикальная интраэпителиальная неоплазия |
Пользователи протокола: онкологи, онкогинекологи, акушер-гинекологи, хирурги, врачи общей практики, терапевты.
Категория пациентов: взрослые.
Шкала уровней доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Стадирование РШМ
Для определения стадии РШМ во всем мире используется клиническая классификация Международной Федерации Гинекологов и Акушеров (таблица 2), случаи подвергнутые хирургическому стадированию также классифицируются по TNM. В некоторых странах также используется классификация AJCC, однако несмотря на кажущееся многоообразие систем стадирования, все они идентичны и изменения в одной из них, непременно приводят к соответствующим изменениям в другой.
Таблица 2. Рак шейки матки – стадирование FIGO (2009) и TNM (8-е издание, 2017)
|
Стадия FIGO |
Категор ия по TNM |
|
| Первичная опухоль не может быть определена | Tx | |
| Нет проявлений первичной опухоли | T0 | |
| Преинвазивный рак (карцинома in situ) | Tis | |
| I | Опухоль ограничена маткой (распространение на тело матки не принимается во внимание) | T1 |
| IА | Инвазивный рак диагностируется только микроскопически (все макроскопически видимые поражения даже с поверхностной инвазией относятся к стадии 1В) | T1a |
| I А1 | Стромальная инвазия не более 3 мм в глубину и горизонтальное распространение не более 7 мм* | T1a1 |
| I А2 | Стромальная инвазия не более 5 мм в глубину и горизонтальное распространение не более 7 мм | T1a2 |
| IВ | Клинически видимые поражения шейки матки или микроскопическое поражение большее, чем 1А2/Т1А2 | T1b |
| I В1 | Клинически видимые поражения в наибольшем измерении не превышающие 4 см | T1b1 |
| I В2 |
Клинически видимые поражения в наибольшем измерении превышающие 4 см |
T1b2 |
| II | Опухоль ограничена телом матки без вовлечения стенок таза и нижней трети влагалища | T2 |
| II А | Без вовлечения параметриев | T2a |
| II А1 | Опухоль менее 4 см в наибольшем измерении | T2a1 |
| II А2 | Опухоль более 4 см в наибольшем измерении | T2a2 |
| II В | С вовлечением параметриев | T2b |
| III | Опухоль, достигающая костей таза и/или нижней трети влагалища и/или наличием гидронефроза или нефункционирующей почки | T3 |
| III А | Вовлечение нижней трети влагалища без вовлечения стенок таза | T3a |
| III В | Распространение до костей таза и/или наличием гидронефроза и/или немой почки | T3b |
| IV А | Прорастание слизистой оболочки мочевого пузыря и/или прямой кишки без выхода за пределы малого таза* | T4a |
| IV В | Отдаленные метастазы | T4b |
FIGO в 2006 году предложило внести изменения в стадирование, которые заключаются на делении стадии IIA по принципу стадии IB, которые вступили в силу с 1 января 2010 года.
Стадия 0 исключена из классификации FIGO в новой редакции.
Для выставления pN0 – необходимо исследование как минимум 6 лимфатических узлов, при отсутствии метастазов и меньшем количестве лимфатических узлов, также выставляется N0. Примечание: глубина инвазии не должна превышать мм от базальной мембраны плоского эпителия или поверхности железы, из которой она исходит. Глубина инвазии определяется измерением опухоли от места соединения эпителия и стромы от самого поверхностного участка до наиболее глубокого места инвазии. Инвазия в лимфо-васкулярное пространство не влияет на стадию.
Наличие буллезного отека слизистой оболочки не достаточно для отнесения заболевания к стадии Т4.
Правила стадирования РШМ
Стадирование рака шейки матки основано исключительно на клинической оценке, поэтому необходимо тщательное клиническое обследование абсолютно во всех случаях, в некоторых случаях в условиях анестезии. Следует помнить, что клиническая стадия не меняется в зависимости от последующих диагностических находок. При сомнении в выборе стадии, предпочтение отдается в пользу меньшей стадии. Для стадирования используются следующие методы обследования:
- Стадирование FIGO основано на использовании исключительно клинических данных (данные осмотра и кольпоскопии), рентгенографии грудной клетки, внутривенной урографии, биопсии и кюретажа цервикального канала и полости матки.
- Цистоскопия и ректоскопия могут использоваться для клинического стадирования, при подозрении на прорастание: морфологическое подтверждение обязательно.
- Лимфография, КТ, МРТ, ПЭТ, лапароскопия не могут быть использованы для клинического стадирования.
- При выявлении патологических изменений на внутривенной урографии случай должен быть отнесен к стадии IIIB.
- Региональными лимфатическими узлами для шейки матки являются парацервикальные, параметральные, под- чревные, запирательные, внутренние, наружные и общие подвздошные, пресакральные, сакральные.
- Находки, обнаруженные при дополнительных методах обследования, таких как лапароскопия, ультразвуковое исследование, КТ, МРТ, ПЭТ ценны для выбора метода лечения, но в связи с тем, что они не везде выполняются и интерпретация их зависит от квалификации врача, они не используются для клинического стадирования и их данные не меняют стадию заболевания.
Патоморфологическое (хирургическое) стадирование TNM.
Данные, полученные при тщательном морфологическом исследовании тканей, удаленных во время операции должны быть использованы для наиболее точной оценки распространенности процесса. Эти находки не позволяют вносить изменения в клиническую стадию, но должны быть использованы и отражены в протоколе патоморфологического стадирования. Для этих целей используется номенклатура TNM. Иногда РШМ может быть случайной находкой после гистерэктомия по иным показаниям – в подобных случаях клиническое стадирование не может быть проведено и эти случаи не включаются в терапевтическую статистику, но желательно, чтобы они сообщались отдельно. Первоначально установленная стадия не меняется при возникновении рецидива.
Сопоставление результатов лечения между клиниками и различными методами лечения возможно только при тщательном соблюдении всех правил стадирования.
Особенности стадирования
Диагноз стадий IAl и IA2 основывается исключительно на данных микроскопического исследования удаленных тканей (биопсийного материала – предпочтительно конуса шейки матки, который должен захватывать весь пораженный участок ). Глубина инвазии не должна быть > 5 мм от базальной мембраны либо от поверхности железы, из которой исходит образование. Горизонтальное распростра- нение не должно превышать 7 мм. Наличие васкулярной и/ или лимфатической инвазии не повышает стадию заболевания, но должно отражаться в диагнозе, поскольку может повлиять на выбор метода лечения в будущем.
Большие по размеру образования, видимые глазом, стадируются как IB. Как правило, невозможно оценить на глаз, имеется ли распространение на тело матки. Поэтому распространение на тело матки, подозреваемое клинически не должно приниматься в расчет.
Пациенты с распространением опухоли по направлению к стенке таза, которое определяется в виде короткого уплотненного участка, должны стадироваться как IIB. При клиническом стадировании невозможно достоверно оценить является ли укорочение влагалищных сводов и плотная инфильтрация в параметрии действительно опухолевой или воспалительной природы.
Третья стадия выставляется тогда, когда имеется инфильтрация до костей таза, либо непосредственный рост опухоли достигает костей таза. Наличие гидронефроза или нефункционирующей почки является следствием стеноза мочеточников опухолью и в таких случаях выставляется III стадия , даже если по данным других методов исследования опухоль может быть отнесена к I или II стадии.
Наличие буллезного отека не дает оснований отнести заболевание к IV стадии. Выдающиеся в просвет мочевого пузыря образования в виде гребней и борозд часто являются следствием во- влечения в опухолевый рост подслизистого слоя мочевого пузыря.
Наличие опухолевых клеток в смывах с мочевого пузыря требует дополнительного морфологического исследования для отнесения случая к стадии IVA.Определение степени дифференцировки
Определение степени дифференцировки инвазивного плоскоклеточного РШМ напрямую зависит от типа клеток и их морфологии, дифференцировки и строения опухоли . Определение степени дифференцировки аденокарцином основано на степени архитектоники опухоли, которая характеризуется количеством железистых структур (таблица 3).
Таблица 3. Градация плоскоклеточного рака и аденокарцином шейки матки
| Градация | Плоскоклеточный рак | Аденокарцинома |
|
Высокая степень дифференцировки G1 |
Основной клетончыйсостав– типичные ороговевающие крупные клетки. Большинство клеток (>75%) хорошо дифференцированы. Митотическая актиность низкая. Опухоль состоит из папиллярных и солидных экзофитных структур; Границы выполнены соединительными клетками. |
Опухоль содержит хорошо сформированные железы с сосочками. Клетки вытянутые с одинаковыми овальными ядрами; минимальная стратификация (менее трехрядов клеток в толщину). Митозы не частые. |
|
Умеренная дифференцировка G2 |
Тип клеток обычно – Неороговевающие крупные.Около 50% клеток хорошо дифференцированы; отдельные клетки имеют ороговение. Митотическая активность возрастает. Опухоли имеют инфильтрирующие границы; часто встречается нетипичное воспаление. |
Опухоли содержат сложные железы с частыми формированиями мостиков и крибр. Солидные участки встречаются часто, но все Еще занимают менее половины опухоли. Ядра более округленные и не равномерные; имеются микронуклеолы. Более частые митозы. |
|
Низкая дифференцировка G3 |
Основной клеточный состав – мелкие клетки. Клетки имеют базофильную цитоплазму с большим ядерно-цитоплазматическим соотношением. Размеры клеток и ядер одинаковые. Менее 25% клеток дифференцированы. Большое количество митозов, имеются патологические митозы. Опухоли обычно инфильтративные, со злокачественными клетками на границе. |
Опухоль содержит поля злокачественных клеток; видны редкие железы (<50%). Клетки крупные и неравномерные с плеоморфными ядрами. Встречаются случайные перстневидные клетки. Много митозов, в том числе аномальных. Выраженная десмоплазия и часты некрозы. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы:
- Некоторые пациенты отмечают наличие в анамнезе преинвазивных заболеваний шейки матки, ВПЧ инфекцию высокого онкогенного риска;
- Водянистые и кровянистые выделения из половых путей;
- Боли внизу живота и в поясничной области тянущего характера;
- Наличие образования во влагалище.
Анамнез
Не существует патогномоничных жалоб для карциномы шейки матки. Как правило болезнь имеет выраженную преинвазивную стадию, которая может длиться от 1 года до 5 лет и более. Микроинвазивная карцинома шейки матки обнаруживается чаще всего при случайном обращении. Причиной обращения женщин с диагнозом рак шейки матки в стадии Ib1- IIa2 к гинекологу являются кровянистые выделения из половых путей. При более поздних стадиях (IIb-IVa) присоединяются жалобы на боли в поясничной области, внизу живота.
Физикальные обследования:
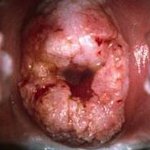
- Гинекологический осмотр: осмотр шейки матки на зеркалах (обнаружение опухоли шейки матки, визуальная оценка размеров);
- Кольпоскопия;
- Бимануальное исследование (оценка распространености опухоли).
Лабораторные исследования:
- цитологическое исследование (изменения эпителия шейки матки, выражающиеся в нарушении слоев эпителия, дис-комплексации его, появлении различных по величине и форме клеток с крупными гиперхромными ядрами и четко различимыми ядрышками. Иногда в цитоплазме таких клеток накапливается кератогиалин и они начинают ороговевать.);
- гистологическое исследование (для ороговевающего плоскоклеточного рака шейки матки характерно образование опухолевыми клетками керато -гиалиновых гранул и раковых жемчужин Фигуры митоза относительно редки. В неороговевающем плоскоклеточном раке клетки опухоли обычно овальные или полигональные, с эозинофильной цитоплазмой. Ядра могут быть довольно мономорфными или, напротив, иметь выраженный полиморфизм. Межклеточные мостики обычно не определяются. Фигуры митоза, в том числе атипичного, встречаются часто).
Цитологического исследования недостаточно для установления диагноза «рак шейки матки», всегда необходима гистологическая верификация.
Основные лабораторные методы исследования:
- общий анализ крови;
- общий анализ мочи;
- биохимическое исследование крови (общий белок, общий билирубин, АЛТ, АСТ, мочевина, креатинин, глюкоза, тимоловая проба);
- коагулограмма (протромбиновый индекс, время рекальцификации, тромботест, фибриноген, фибринолитическая активность, АЧТВ);
- анализ крови на ВИЧ;
- анализ крови на гепатиты В и С, сифилис.
Дополнительные лабораторные исследования:
- анализ крови на опухолевый маркер СА-125;
- бактериологическое исследование мазка из зева либо смывов из трахео-бронхиального дерева при наличии воспалительных заболеваний верхних и нижних дыхательных путей перед плановым оперативном вмешательстве.
Основные инструментальные исследования:
- взятие мазков на ПАП – тест. Оценка мазка по системе Бетесда:
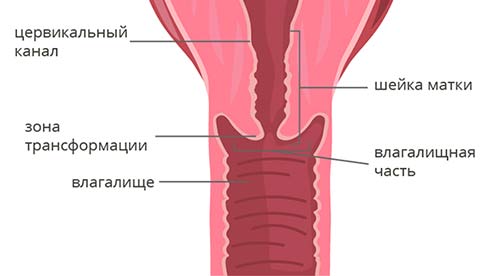
- биопсия опухоли из зоны трансформации;
- УЗИ органов малого таза (образование шейки матки с возможной оценкой распространнености процесса в тело матки, во влагалище, мочевой пузырь или прямую кишку, определение размеров опухоли, повышенной васкуляризации);
- МРТ ОМТ: опухолевое образование шейки матки с оценкой размеров опухоли, распространенности процесса в тело матки, влагалище, мочевой пузярь, прямую кишку; оценка пораженности регионарных (тазовых, парааортальных) лимфоузлов.
- гинекологический осмотр: осмотр шейки матки на зеркалах;
- цитологическое исследование: рак/предрак шейки матки диагностируется во время профилактического осмотра/скрининга, когда при цитологическом исследовании определяется наличие атипичного мазка. Акушерка смотрового кабинета всех женщин с заключением цитологического исследования ASC, HSIL, AGC направляет на консультацию к врачу акушеру-гинекологу;
- кольпоскопия;
- биопсия шейки матки: биопсия со всех подозрительных участков;
- ЭКГ исследование;
- рентгенография органов грудной клетки в двух проекциях;
- УЗИ органов брюшной полости и забрюшинного пространства (для исключения патологии органов брюшной полости и забрюшинного пространства).
Дополнительные инструментальные исследования:
- цистоскопия (при подозрение на прорастание опухоли в мочевой пузырь);
- колоноскопия (при подозрение на прорастание опухоли в прямую кишку);
- магнитно-резонансная томография (определение распространнености);
- компьютерная томография (определение увеличенных забрюшинных лимфоузлов);
- сцинтиграфия (исключение метастатического поражения костей);
- позитро-эмиссионная томография;
- КТ органов грудной клетки с контрастированием (при наличии метастазов в легких);
- УЗИ органов брюшной полости и забрюшинного пространства (для исключения патологии органов брюшной полости и забрюшинного пространства);
- ЭхоКГ (по показаниям);
- УДЗГ (при сосудистых поражениях).
Показания для консультации специалистов:
Наличие в анамнезе сопутствующих заболеваний, которые могут оказать существенное влияние на выбор лечебной тактики , либо наличие конкурирующих медицинских состояний является показанием для проведения консультаций соответствующих узких специалистов для оценки рисков, разработки плана совместного ведения больных, а также проведения соответствующей коррекции в случае необходимости. Наиболее часто требуемые консультации:
- консультация кардиолога;
- консультация сосудистого хирурга;
- консультация гастроэнтеролога;
- консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
- консультация торакального хирурга (при наличии метастазов в легких);
- консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов).
Диагностический алгоритм: (схема)
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Эктопия шейки матки |
-Выделения из половых путей -Участок псевдоэрозии ярко-красного цвета |
кольпоскопия взятие мазков на ПАП – тест |
Участок, покрытый множеством округлых или продолговатых красных сосочков, что создает эффект бархатистой поверхности . Ярко-красный цвет обусловлен сосудами подлежащей стромы, просвечивающими через один ряд цилиндрическихклеток. «Зонатрансформации» метаплазированный и незрелый многослойный плоский эпителий в зоне эктопии, открытые и закрытые протоки желез. |
| CIN |
-Видимые участки изменения шейки матки -Безболезненное -Выделения из половых путей. |
-кольпоскопия -взятие мазков на ПАП – тест -биопсия |
Кольпоскопическая картина: йоднегативная зона в виде белесоватой блестящей пленки с гладкой или бугристой поверхностью за счет развития рогового слоя эпителия. Окончательный диагноз устанавливают на основании гистологического исследования. |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Амброксол (Ambroxol) |
| Амикацин (Amikacin) |
| Аминокапроновая кислота (Aminocaproic acid) |
| Аминофиллин (Aminophylline) |
| Апрепитант (Aprepitant) |
| Ацетилсалициловая кислота (Acetylsalicylic acid) |
| Бевацизумаб (Bevacizumab) |
| Бромгексин (Bromhexine) |
| Винорелбин (Vinorelbine) |
| Гемцитабин (Gemcitabine) |
| Гепарин (Heparin) |
| Глицирризиновая кислота (Glycyrrhizinic acid) |
| Гранисетрон (Granisetron) |
| Дарбэпоэтин альфа (Darbepoetin alfa) |
| Дексаметазон (Dexamethasone) |
| Декстран (Dextran) |
| Декстроза (Dextrose) |
| Диклофенак (Diclofenac) |
| Дифенгидрамин (Diphenhydramine) |
| Доцетаксел (Docetaxel) |
| Железа (III) гидроксид декстран (Ferric (III) hydroxide destrane) |
| Железа (III) гидроксид полимальтозат (Ferric (III) hydroxide polymaltosate) |
| Железа (III) гидроксид сахарозный комплекс (Ferric (III) hydroxide sacharose complex) |
| Железа карбоксимальтозат (Ferric carboxymaltosate) |
| Имипенем (Imipenem) |
| Инсулин человеческий (Insulin human) |
| Иринотекан (Irinotecan) |
| Ифосфамид (Ifosfamide) |
| Карбоплатин (Carboplatin) |
| Кетопрофен (Ketoprofen) |
| Комплекс аминокислот для парентерального питания (Complex of amino acids for parenteral nutrition) |
| Ленограстим (Lenograstim) |
| Липэгфилграстим (Lipegfilgrastim) |
| Метронидазол (Metronidazole) |
| Митомицин (Mitomycin) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия хлорид (Sodium chloride) |
| Неостигмина метилсульфат (Neostigmine methylsulfate) |
| Нетупитант (Netupitant) |
| Оланзапин (Olanzapine) |
| Ондансетрон (Ondansetron) |
| Офлоксацин (Ofloxacin) |
| Паклитаксел (Paclitaxel) |
| Палоносетрон (Palonosetron) |
| Парацетамол (Paracetamol) |
| Пеметрексед (Pemetreksed) |
| Преднизолон (Prednisolone) |
| Пэгфилграстим (Pegfilgrastim) |
| Ролапитант (rolapitant) |
| Спиронолактон (Spironolactone) |
| Теофиллин (Theophylline) |
| Топотекан (Topotecan) |
| Тофизопам (Tofisopam) |
| Трамадол (Tramadol) |
| Трописетрон (Tropisetron) |
| Филграстим (Filgrastim) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Фосапрепитант (Fosaprepitant) |
| Фторурацил (Fluorouracil) |
| Фуросемид (Furosemide) |
| Цефазолин (Cefazolin) |
| Цефепим (Cefepime) |
| Цефтазидим (Ceftazidime) |
| Цефтриаксон (Ceftriaxone) |
| Цефуроксим (Cefuroxime) |
| Цианокобаламин (Cyanocobalamin) |
| Циластатин (Cilastatin) |
| Ципрофлоксацин (Ciprofloxacin) |
| Цисплатин (Cisplatin) |
| Эмпэгфилграстим (Empegfilgrastimum) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эпоэтин альфа (Epoetin alfa) |
| Эпоэтин бета (Epoetin Beta) |
| Эпоэтин тета (Epoetin theta) |
| Этамзилат (Etamsylate) |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение:
- Диета при отсутствии сопутствующих заболеваний, ограничивающих питание — №15.
- При микроинвазивном раке шейки матки и CINIII проведение широкой конизации шейки матки с гистологическим исследованием краев резекции.
Медикаментозное лечение:
- Антикоагулянтная терапия у пациентов после полостных операций в течение 6 месяцев с целью профилактики тромбоэмболических осложнений.
- Надропарин кальция 0,3 мл, по 0,3 мл 1 раз в день п/к; или
- Эноксапарин натрия 0,2 мл, по 0,2 мл 1 раз в день п/к;
- Обработка шейки матки антисептическими растворами.
- Глицирризиновая кислота активированная спрей, гель вагинально 10 дней.
Хирургическое вмешательство: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Цель лечения при карциноме шейки матки зависит от степени распространенности опухолевого процесса:
- При ранних и локализованных формах болезни основной задачей является ирадикация опухоли с максимальной терапевтической и экономической эффективностью при минимуме осложнений и сохранением качества жизни.
- При местно-распространенных и метастатических формах болезни необходимо стремиться соблюдать баланс между интенсивностью терапевтических воздействий и ожидаемой продолжительностью жизни, ожидаемой безрецидивной выживаемостью и самое главное – качеством жизни.
Таблица 4
| Стадия | Вид лечения |
| CIN III | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА1 | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА2 |
Тотальная гистерэктомия с/без придатков +тазовая лимфодиссекция (II тип по Priver)/ трахелэктомия+тазовая лимфодиссекция/ При противоказаниях к хирургическому лечению – лучевая терапия |
| IВ1 |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип по Priver) у молодых женщин с транспозицией яичников / ЛТ илиХЛТ по радикальной программе Группа высокого риска прогрессирования – адъювантная ХЛТ Группа промежуточного риска – адъювантная ЛТ Группа низкого риска – адъювантное лечение не проводится |
| IВ2- IIA |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип по Priver) у молодых женщин с транспозицией яичников / ХЛТ по радикальной программе / неоадъювантная ХТ+ Радикальная гистерэктомия III тип Группа высокого риска прогрессирования – адъювантная ХЛТ Группа промежуточного риска – адъювантная ЛТ Группа низкого риска – адъювантное лечение не проводится |
| IIВ-IVА | Химиолучевая терапия |
| IVА | Системная ХТ |
Немедикаментозное лечение:
- Режим больного при проведении консервативного лечения – общий.
- В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
- Диета стол – №15, после хирургического лечения – №1.
Лучевая терапия.
Виды лучевой терапии:
- дистанционная лучевая терапия;
- брахитерапия;
- 3D-конформное облучение;
- модулированная по интенсивности лучевая терапия (IMRT);
- подвижная дистанционная лучевая терапия;
- томотерапия на томоаппаратах;
- интраоперационная лучевая терапия;
- стереотаксическая радиохирургия и радиотерапия метастатических очагов.
Показания к лучевой терапии:
- опухоли в стадии IIа1-IVa;
- метастазы в регионарных лимфатических узлах и метастазами в общие подвздошные и парааортальные лимфоузлы;
- GOG более 120 (Табл. 8;)
- отказа пациента от операции;
- рецидив опухоли.
Лучевая терапия: стандартом лучевой терапии рака шейки матки стадии IB1/IIA1 (< 4 см в диаметре) является сочетанная лучевая терапия.
Адъювантное лечение после операции: риск возникновения рецидивов после радикального хирургического лечения высокий при наличии метастазов в лимфатических узлах, положительных краях резекции и наличии опухолевыхэлементов в параметриях (парацервикальных тканях). Адъювантная конкурентная химиолучевая терапия (используется 5FU + Cisplatin или Cisplatin) улучшает результаты лечения по сравнению с сочетанной лучевой терапией у данной категории больных [12] (УД –A).
Риск возникновения рецидивов увеличивается у пациентов с невовлеченными лимфатическими узлами при больших размерах опухоли, вовлечением лимфова-скулярного пространства и инвазией более 1/3 стромы шейки матки. У данной группы больных облучение малого таза снижает риск рецидивирования и увеличивает безрецидивную выживаемость по сравнению с больными, не получавшими адъювантное лечение после операции. Кроме того, послеоперационная лучевая терапия предпочтительна у больных с аденокарциномой шейки матки и железисто-плоскоклеточным раком шейки матки (УД – A).
Две кооперированные группы исследователей сообщили о приемлемых результатах послеоперационной лучевой терапии малыми полями, захватывающими область культи влагалища и параметральные ткани . Верхней границей облучения в данном случае является уровень S1-2, а не L5-S1 как при обычных полях (УД–C).
Томотерапия на томоаппаратах. Одним из вариантов высокотехнологичной лучевой терапии РТМ является Томотерапия – спиральное (гелическое “helical”) облучение, проводимое на специализированных линейных ускорителях – томоаппаратах. При их работе происходит одновременное ротационное движение во время сеанса облучения головки аппарата и лепестков (секторное IMRT) с одновременным поступательным продольным смещением стола. Спиральная томотерапия это сверхточная лучевая терапия управляемая по изображениям (IGRT), с помощью, которой осуществляется прецизионное подведение луча вращающего радиационного пучка к опухоли с одновременной защитой окружающих здоровых тканей, за счет визуализации и локализации анатомическихструктур на протяжении процесса лечения.Используемые в каждом направлении модулированные пучки, не только сверхточно фокусируется, но и характеризуется высокой конформностью. Существует много систем, которые позволяют создать сферическое распределение мелких доз, но томотерапия, позволяет изменить форму этой дозы при несферических и даже весьма сложных, вогнутых мишенях. Используются как стандартные методики фракционирования при подведении разовых и суммарных очаговых доз. Однако упор при томотерапии делается на гипофракционирование при РОД
<2,5 Гр.
Принципиально вопрос о назначении адъювантной лучевой/химиолучевой терапии при 1 стадии РШМ решается на основании бальной шкалы GOG, разработанной на основании крупного патолого-хирургического исследования (таблица 6).
Стадия IB2, IIA2 (опухоль > 4 см).
Методами выбора являются:
- Первичная конкурентная химиолучевая терапия (УД –А).
- Радикальная гистерэктомия с тазовой лимфаденэктомией (операция III типа), которая обычно дополняется адъювантной лучевой терапией.
- Неоадъювантная химиотерапия (2-3 курса химиотерапии на основе препаратов платины) с последующей радикальной гистерэктомией с тазовой лимфаденэктомией ± адъювантная послеоперационная лучевая или конкурентная химиолучевая терапия [17] (УД –C).
Стадия IVA
Возможно выполнение тазовой экзентерации на первом этапе, особенно при наличии пузырного или прямокишечного свища, что однако не является противопоказанием к проведению химиолучевой терапии по радикальной программе. (УД – С).
Стадия IVB и рецидивы
Рецидив может находиться в малом тазу (местные рецидивы), так и вне органов малого таза (отдаленные метастазы). При больших размерах первичной опухоли увеличивается количество пациентов с рецидивами в малом тазу и отдаленными метастазами. Большинство рецидивов возникает в первые два года и прогноз у данной категории больных неблагоприятный, большинство их них умирает от прогрессирования заболевания. Медиана выживаемости составляет семь месяцев. Основными симптомами РШМ при прогрессировании являются боли, отеки на ногах, анорексия, кровянистые выделения из половых путей, кахексия, психологические и другие проблемы. При выборе метода лечения и ведения данного контингента больных оптимальным является объединение усилий целой группы специалистов: онкогинекологов, радиологов, химиотерапевтов, психологов, нутриционистов, специально подготовленных медицинских сестер. Избавление от боли и других симптомов наряду со всесторонней поддержкой является основной задачей медицинского персонала.
Лучевая терапия по стадиям:
IB2, IIA2 (опухоль > 4 см)
Конкурентная химиолучевая терапия: наиболее широко используемый метод лечения – сочетанная лучевая терапия в сочетании с еженедельной конкурентной химиотерапией препаратами платины.
Рекомендуемые дозы лучевой терапии на точку А 85 – 90 Грей, на точку В 55 – 60 Грей. Цисплатин назначается в дозе 40 мг/м2 еженедельно на фоне дистанционного компонента лучевой терапии. У пациентов с метастазами в парааортальные и общие подвздошные лимфатические узлы необходимо расширение поля облучения до парааортальных зон. В настоящее время данные по токсичности конкурентной химиолучевой терапии, ассоциированной с расширением полей облучения малочисленны (УД –А).
Местнораспространенный рак шейки матки (включает стадии заболевания IIB, III и IVA)
Стандартным лечением является сочетанная лучевая терапия с конкурентной химиотерапией (УД – А).
При стадии IVA возможно выполнение тазовой экзентерации на первом этапе, особенно при наличии пузырного или прямокишечного свища, что однако не является противопоказанием к проведению химиолучевой терапии по радикальной программе (УД –С).
Лечение местнораспространенного рака шейки матки.
| Стадия | II B – IV A |
| Стадирование |
данные осмотра и кольпоскопии рентгенография грудной клетки внутривенная урография биопсия и кюретаж цервикального канала и полости матки Цистоскопия и ректоскопия (по показаниям), при подозрении на прорастание, последнее должно быть подтверждено морфологически МРТ, КТ, ПЭТ используются для выявления возможных метастазов в регионарных и парааортальных лимфатических узлах, данные МРТ не влияют на клиническую стадию заболевания |
|
Техника лучевой Терапии |
А. Первичная мишень: опухоль + матка B. Б. Вторичная мишень: тазовые и общие подвздошные лимфатические узлы Техника: 4-х польная Границы полей для дистанционного облучения: А. Опухоль определяется пальпаторно и при КТ (если возможно) + 2 см от края В. A-P поля: Латерально: 2 см латерально от костных границ таза Верхнее: граница позвонков L5 и S1 Нижнее: 2 см ниже запирательного отверстия либо 2 см ниже определяемой границы опухоли С. Латеральные поля: Переднее = индивидуально, определяется границами опухоли Заднее = индивидуально, определяется границами опухоли |
|
Дозы на первичную опухоль |
Дистанционное облучение в СОД 50 Грей/5-6 недель + внутриполостная терапия 30-35 Грей на точку А (для стадий IIB — IVA, 35-40 Грей) |
| Дозы на регионарные зоны метастазирования | Дистанционное облучение в СОД 50 Грей/5 недель |
| Общее время лечения | 6-7 недель |
| Конкурентная химиотерапия | Цисплатин 40 мг/м2 |
Техника и дозы облучения: дозы и поля облучения представлены в таблице 9. Облучение должно проводиться соответствующей энергией с равномерным распределением дозы (± 5%) между первичной опухолью и регионарными зонами метастазирования. Объем облучаемой опухоли должен определяться с помощью клинических методов исследования и КТ, где это возможно. Техника облучения состоит в использовании как минимум 4 полей. Брахитерапия может осуществляться как источниками низкой, так и высокой мощности. Стандартным лечением является сочетанная лучевая терапия с конкурентной химиотерапией на основе препаратов платинового ряда. Цисплатин назначается в дозе 40 мг/м2 1 раз в неделю на фоне проведения дистанционной лучевой терапии. Рекомендуемые дозы составляют от 85 до 90 Грей на точку А и от 55 до 60 Грей на точку В. У пациентов с метастазами в общих подвздошных и/или парааортальных лимфатиче- ских узлах необходимо решение вопроса о расширении полей облучения на парааортальную область (УД – C).
Стадия IVB и рецидивы
Возможные методы лечения рецидивов после первичной радикальной гистерэктомии (таблица 10): рецидивы в малом тазу после радикальной гистерэктомии могут лечиться как лучевой терапией, так и хирургически (тазовая экзентерация). Облучение по радикальной программе (± конкурентная химиотерапия) локализованных тазовых рецидивов после первичного хирургического лечения эффективно у значительного количества больных. Дозы и объем лучевой терапии должны определяться распространенностью заболевания.
Так, при микроскопических размерах опухоли обычная доза составляет 50 Грей при РОД 1,8 – 2,0 Грей с уменьшенными размерами полей облучения, а при больших по размеру опухолях доза составляет 64 – 66 Грей.
Местные рецидивы после хирургического лечения РШМ
| Рекомендации |
Уровень доказательности |
|
Лучевая терапия показана пациентам с местными рецидивами после радикальной гистерэктомии |
С |
|
Конкурентная химиолучевая терапия с включением Цисплатина с/без 5-Фторурацила улучшает результаты лечения |
В |
|
Тазовая экзентерация может быть альтернативой лучевои и химиолучевой терапии у больных с рецидивами, не распространяющимися на стенки таза, особенно при наличии свищей |
С |
Местные рецидивы после радикального курса лучевой терапии (таблица 9):
Радикальная гистерэктомия выполняется у пациентов с небольшими рецидивами (< 2 см в диаметре), ограниченными шейкой матки. Несмотря на увеличение количества осложнений при операциях после первичной лучевой терапии, в большинстве случаев нет необходимости накладывать колостомы.
Пациентки с центрально-локализованным рецидивом, вовлечением мочевого пузыря и прямой кишки при отсутствии интраперитонеальной диссеминации и отдаленных метастазов, наличии свободного пространства между шейкой матки и стенками таза являются потенциальными кандидатами для проведения тазовой экзентерации.
Триада симптомов – билатеральные лимфатические отеки нижних конечностей, ишиалгия, обструкция мочевыводящих путей свидетельствуют о неоперабельном процессе. Этой группе больных показано паллиативное и симптоматическое лечение.
Наиболее благоприятный прогноз при безрецидивном периоде более 6 месяцев, размере опухоли менее 3 см и отсутствии инфильтратов в параметриях. Показатели 5-летней выживаемости у данной группы больных колеблются в пределах от 30 до 60 %, а периоперационная летальность не превышает 10%.
Местные рецидивы после лучевой терапии РШМ
| Рекомендации |
Уровень доказательности |
|
Часть пациентов с небольшими размерами опухоли (< 2 см), ограниченными шейкой матки являются кандидатами для радикальной гистерэктомии |
С |
|
Пациенты с локализованными рецидивами при отсутствии отдаленных метастазов являются кандидатами для тазовой экзентерации |
С |
Отдаленные метастазы: лучевая терапия показана при симптомных метастазах опухоли в качестве паллиативного лечения, к примеру, при костных метастазах [37], увеличенных парааортальных, подключичных лимфатических узлах для купирования болевого синдрома или при метастазах в головной мозг. С точки зрения меньшей продолжительности жизни у пациентов с метастазами РШМ паллиативную радиотерапию следует проводить укрупненными фракциями в более короткие сроки по сравнению с радикальными курсами лучевой терапии.
Медикаментозное лечение
Химиотерапия
| Рекомендации | Уровень доказательности |
| Цисплатин/ Паклитаксел/ Бевацизумаб | А |
| Цисплатин/ Паклитаксел | |
| Топотекан/ Паклитаксел/ Бевацизумаб | |
| Карбоплатин/ Паклитаксел | С |
| Цисплатин/ Топотекан | |
| Топотекан/ Паклитаксел | |
| Цисплатин/ Гемцитабин | |
| Препараты для монохимиотерапии в качестве первой линии: | С |
| Цисплатин | |
| Карбоплатин | |
| Паклитаксел | |
| Препараты для монохимиотерапии в качестве второй линии: | С |
| Бевацизумаб | |
| Доцетаксел | |
| Фторурацил | |
| Гемцитабин | |
| Ифосфамид | |
| Иринотекан | |
| Митомицин | |
| Топотекан | |
| Пеметрексед | |
| Винорелбин |
Существует несколько видов химиотерапии, которые отличаются по цели назначения:
- неоадъювантная химиотерапия опухолей назначается до операции, с целью уменьшения неоперабельной опухоли для проведения операции, а так же для выявления чувствительности раковых клеток к препаратам для дальнейшего назначения после операции. Теоретическими предпосылками служат лучшая доставка лекарств к опухоли сосудами, неповрежденными вследствие лучевой терапии и операции.
- адъювантная химиотерапия назначается после хирургического лечения для предотвращения метастазирования и снижения риска рецидивов;
- самостоятельная химиотерапия назначается для уменьшения метастатических раковых опухолей;
- конкурентная — используется параллельно с облучением для достижения радиосенсибилизирующего эффекта; Таблица 6. Возможные препараты и варианты их комбинаций при распространенном и метастатическом раке шейки матки.
Антибактериальная терапия:
Цефазолин 1,0 гр, по 1,0 гр в/м 3 раза в день, 7 дней;
Цефтазидим 100мг, по 100мг в/м 3 раза в день, 7 дней;
Цефтриаксон 1,0 гр, по 1,0 гр в/м 2 раза в день, 7 дней;
Цефуроксим натрия 1,0гр, по 1,0гр в/м 2 раза в день, 7 дней;
Цефепим 1,0 гр, по 1,0 гр в/м 2 раза в день, 7 дней;
Имипенем + циластатин 500мг, по в/м 2 раза в день, 5-7 дней;
Амикацин 500мг, из расчета 10мг/кг в/м 2 раза в день, 7 дней;
Ципрофолоксацин 100мг, по 100мг в/в 2 раза в день, 5 – 7 дней;
Офлоксацин 0,2гр, по 0,2 гр в/в 2 раза в день, 7 дней;
Метронидазол 100 мл, по 100 мл в/в 2 раза в день, 5 дней.
Противогрибковая терапия:
Флуконазол 100 мг, по 100мг в/в – однократно.
Плазмозаменящая терапия:
Декстран 400мл, по 400 мл в/в 2 раза в день 2 – 3 дня.
Парентеральное питание:
Комплекс аминокислот для парентерального питания 500мл, по 500мл в/в 1 раз в день, 5 – 7 дней;
Декстроза 5% — 400мл, по 400мл в/в 2 раза в день, 5 – 7 дней.
Регидратационная терапия:
Натрия хлорид 0,9% — 400мл, по 400 мл в/в 2 – 3 раза в день. 5 – 7 дней.
Аналгетическая терапия:
Кетопрофен 1мл, по 1 мл, в/м 2 – 3 раза в день 5 – 7 дней;
Диклофенак натрия в/м 2 – 3 раза в день 7 – 10 дней;
Трамадола гидрохлорид 1 мл, по 1мл в/м 2 – 3 раза в день.
Гормональные терапия:
Преднизолон 30мг, по 30 – 60 – 90 мг в/в 1 раз в день 1 – 5 дней;
Дексаметазон 4 мг, по 4 – 8 – 12 – 16 – 20 мг 1 раз в день 1 – 5 дней;
Инсулин человеческий 40 ЕД, 4 – 6 ЕД 1 раз в день 2 – 10 дней.
Бронхолитиеская терапия:
Аминофиллин 10мл, по 6 – 10мг/кг/сут в/м 3 раза в день,10 дней;
Теофиллин 0,2гр, по 0,2 гр per os 2 – 4 раза в день, 10 – 15 дней.
Антикоагулянтная терапия:
Надропарин кальция 0,3 мл, по 0,3 мл 1 раз в день п/к;
Эноксапарин натрия 0,2 мл, по 0,2 мл 1 раз в день п/к;
Гепарин 10тысЕД, по 5000-10000 ЕД в/в или п/к 1 раз в день.
Муколитическая терапия:
Бромгексин 8 мг, по 8 мг per os 3 раза в день, 7 – 10 дней;
Амброксол 2 мл, по 2 мл в/м, 3 раза в день, 7 – 10 дней.
Седативная терапия:
Тофизопам 50 мг, по 50 мг per os 1 – 2 раза в день, 1 – 5 дней;
Неостигмина метилсульфат 1,0мл, по 1мл в/м 1 – 2 раза в день, 1 – 10 дней.
Жаропонижающая терапия:
Ацетилсалициловая кислота 0,5 гр, по 0,5 гр per os 2 раза в день;
Парацетамол 0,5гр, по 0,5 гр per os, 3 раза в день.
Гемостатическая терапия:
Аминокапроновая кислота 5% — 100мл, по 100 мл в/в 1 раз в день, 1 – 5 дней.
Этамзилат 12,5% — 2мл, по 2 мл в/м 2 раза в день, 1 – 5 дней.
Дицинон 1 мл, по 1,0 мл в/м 1 – 2 раза в день.
Диуретическая терапия:
Фуросемид 1% — 2 мл, по 2 мл в/м, в/в 1-3 раза в день, 1 –5 дней;
Спиронолактон 100мг, по 100 мг per os 1 раз в день, 5 – 14 дней.
Антианемическая терапия:
Железа (III) гидроксид полиизомальтозад по 100-200 мг в/м, в/в 3-5 раз в неделю;
Железа (III) гидроксид декстран по 100-200 мг в/м, в/в 3-5 раз в неделю;
Гемопоэтическая терапия
Представлена в разделе 5.3.6.
Антигистаминная терапия
Дифенгидрамин 1 мл – 10 мг, 10 мг в/м 1 – 2 раз в день;
Седативная терапия
Тофизопам 50 мг, по 50 мг per os 1 – 2 раза в день, 1 – 5 дней;
Неостигмина метилсульфат 1,0мл, по 1мл в/м 1 – 2 раза в день, 1 – 10 дней;
Сопроводительная терапия с целью профилактики и лечения побочных эффектов лекарственной терапии представлено в приложении 1.
Хирургическое вмешательство
Виды хирургических вмешательств:
- Широкая конизация шейки матки;
- Тотальная абдоминальная или влагалищная гистерэктомия;
- Абдоминальная модифицированная или радикальная гистерэктомия с тазовой/парааортальной лимфаденоэктомией;
- Влагалищная трахелэктомия;
- Хирургическое (лапароскопическое) стадирование;
- Радикальная трахелэктомия, дополненная экстраперитонеальным, трансперитонеальным либо лапароскопическим удалением тазовых лимфоузлов;
- Модифицированная экстраперитонеальная тотальная (задняя или передняя) экзентерация органов малого таза;
- Латерально-расширенная внутритазовая резекция.
Показания к хирургическому лечению:
- цитологически или гистологически верифицированные ЗНО шейки матки;
- при отсутствии противопоказании к хирургическому лечению.
Лечение в зависимости от стадии
Микроинвазивный рак
Диагноз рака шейки матки стадии IA1 или IA2 ставится исключительно на основании морфологического исследования конуса шейки матки с негативными краями резекции или на основе удаленного макропрепарата после трахелэктомии либо гистерэктомии. В случае обнаружения в краях резекции после конизации шейки матки CIN III или инвазивного рака необходима повторная конизация или лечение пациента как при стадии заболевания IB1. Вагиноскопия (кольпоскопом!) выполняется для исключения сопутствующей вагинальной интраэпитеальной неоплазии (VAIN) перед выбором метода лечения.
Стадия IA1
Основным методом лечения РШМ в данной стадии является тотальная абдоминальная или влагалищная гистерэктомия. При наличии влагалищной интраэпитеальной неоплазии необходимо удаление соответсвующей части влагалищной трубки. При необходимости сохранения фертильности возможно наблюдение после широкой конизации шейки матки с негативными краями резекции при условии проведения Пап -теста. Пап-тест проводится в сроки 6, 12 месяцев и в последующем ежегодно, если предыдущие два теста были отрицательными УД –B).
Стадия IA2
Существует определенная потенция к лимфогенному метастазированию у больных со стадией заболевания IA2, в связи с этим необходимо выполнение тазовой лимфаденэктомии во время хирургического лечения. Адекватной операцией для данных клинических случаев является модифицированная радикальная гистерэктомия (операция 2 типа) дополненная двусторонней тазовой лимфаденэктомией. При отсутствии лимфоваскулярной инвазии по данным предварительной биопсии возможно выполнение экстрафасциальной экстирпации (операция 1 типа) с тазовой лимфаденэктомией [11] (УД –С).
При желании сохранения фертильности возможными вариантами лечения являются:
- широкая конизация шейки матки, дополненная экстраперитонеальным либо лапароскопическим удалением тазовых лимфоузлов;
- радикальная трахелэктомия, дополненная экстраперитонеальным, трансперитонеальным либо лапароскопическим удалением тазовых лимфоузлов. Наблюдение данной группы больных главным образом основано на ежегодном Пап-тесте после двух отрицательных тестов в сроках 6 и 12 месяцев.
Относительный риск развития рецидива при 1 стадии РШМ после радикальной гистерэктомии.
| Признак | Значение | Относительный риск |
| Глубина инвазии в строму, в мм | ||
| Поверхностная | 3 | 1.0 |
| 4 | 3.0 | |
| 5 | 7.2 | |
| 6 | 14 | |
| 7 | 21 | |
| 8 | 26 | |
| 10 | 31 | |
| Средняя | 5 | 20 |
| 6 | 22 | |
| 7 | 23 | |
| 8 | 25 | |
| 10 | 28 | |
| 12 | 32 | |
| 14 | 36 | |
| Глубокая | 7 | 28 |
| 8 | 30 | |
| 10 | 34 | |
| 12 | 37 | |
| 14 | 41 | |
| 16 | 45 | |
| 18 | 49 | |
| 20 | 54 | |
| Клинический размер опухоли |
Не видимый |
1.0 |
| 1 | 1.6 | |
| 2 | 1.9 | |
| 3 | 2.4 | |
| 4 | 2.9 | |
| 6 | 4.4 | |
| 8 | 6.6 | |
| Лимфо-васкулярная инвазия | Есть | 1.7 |
| Нет | 1.0 |
- Сумма баллов GOG расчитывается умножением показателей относительного риска для глубины инвазии, размера опухоли и лимфо-васкулярной инвазии. Например, поверхностная опухоль с глубиной инвазии 7.0 мм, размером 2.0 см, с наличием ЛВИ будет иметь балл: 21 x 1.9 x 1.7 = 67.8
- Количество баллов ≤ 40 имеет низкий риск развития рецидива и поэтому не требует адъювантного облучения, количество баллов от 40 до 120 имеет средний риск, а более 120 – высокий риск и в таких случаях необходимо решить вопрос о адъювантной терапии.
Патоморфологическое исследование препарата при РШМ описано в приложении 2.
Случайные находки РШМ
Данные находки в основном относятся к случаям инвазивного РШМ, диагностированного после простой гистерэктомии, выполненной по иным показаниям. До начала лечения в таких ситуациях необходимо дополнительное обследование в объеме: КТ или МРТ органов малого таза и брюшной полости, рентгенография органов грудной клетки для уточнения распространенности процесса. Метод лечения должен определяться на основании данных морфологического исследования и рентгенологических находок. При отсутствии патологических находок:
- при стадии IA1 дополнительное лечение не проводиться.
- при стадии IA2 и выше, необходимо следующее лечение:
а) при положительных краях резекции, глубокой стромальной инвазии, вовлечении лимфоваскулярного пространства назначается конкурентная химиолучевая терапия (38).
б) у больных без глубокой стромальной инвазии, отрицательных краях резекции и отсутствии вовлечения лимфоваскулярного пространства выполняется радикальная параметрэктомия с верхней третью влагалища и лимфаденэктомией как альтернатива конкурентной химиолучевой терапии (УД –С).
РШМ во время беременности
В целом, лечение РШМ во время беременности основано на тех же принципах, что у небеременных женщин . Существует лишь несколько специальных рекомендаций. Конизация шейки матки выполняется только при подозрении на инвазивный рост по данным цитологического исследования и кольпоскопии в связи с высоким риском кровотечения, прерывания беременности или преждевременных родов . Важнейшим условием в определении тактики ведения беременных женщин с РШМ является мультидисциплинарный подход с привлечением неонатолога и акушера-гинеколога помимо радиолога и химиотерапевта. Необходимо участие самой женщины и ее партнера в принятии решения, следует учитывать их желание сохранить беременность.
У пациенток с подозрением на микроинвазивный РШМ отсрочка в лечении не наносит ущерба матери и проявляется достоверным повышением жизнеспособности плода.
Женщины со стадией заболевания IA1, подтвержденной при конизации и отрицательными краями резекции могут донашивать беременность и рожать через естественные родовые пути.
Метод родоразрешения при микроинвазивной карциноме шейке матки не влияет на исход заболевания.
При стадии заболевания IA2 и выше лечение необходимо подбирать индивидуально, главным образом решение о методе лечения и его сроках основано на стадии заболевания и сроке беременности. МРТ проводится с целью оценки распространенности процесса. В случае установления диагноза до 20 недель гестации лечение должно начинаться безотлагательно. Методом выбора является радикальная гистерэктомия с плодом in situ. При проведении химиолучевой терапии, как правило, прерывание беременности не проводиться, так как после начала лечения происходит самопроизвольный выкидыш.
При выявлении РШМ после 28 недельного срока беременности рекомендуется отсрочка лечения до получения жизнеспособного плода . Лечение РШМ в сроках от 20 до 28 недель беременности при стадии IA2 и IBI может быть отложено до получения жизнеспособного плода без значимого влияния на прогноз для матери. При стадии заболевания выше, чем IBI отсрочка в лечении значительно ухудшает прогноз и влияет на выживаемость.
Следует отметить, что не существует стандартов по определению срока, на которое можно отложить начало лечения. На практике период отсрочки зависит от стадии заболевания, морфологических находок, сроке беременности и желании родителей. При планировании сроков родоразрешения при местнораспространенном РШМ возможно принятие решения о назначении неоадъювантной химиотерапии с целью предупреждения дальнейшей прогрессии заболевания – требуется динамическое наблюдение! Родоразрешение проводиться не позднее 34 недель гестации.
Если образование шейки матки не было удалено во время диагностической конизации, предпочтительным методом родоразрешения является классическое кесарево сечение, несмотря на то, что несколько ретроспективных исследований продемонстрировали отсутствие влияния метода родоразрешения на прогноз РШМ.
Дальнейшее ведение:
Наибольшее количество рецидивов после лечения РШМ возникают в первые 3 года , этим обусловлена необходимость частого наблюдения больных после лечения. При наличии возможности “Follow up” визиты проводятся ежемесячно на протяжении первого года, раз в два месяца на втором году, раз в три месяца на третьем году, раз в четыре месяца на четвертом году и далее не реже чем один раз в полгода. При невозможности соблюдения плотного режима визитов “Follow up” допускаются визиты не реже одного раза в три месяца в течение первых трех лет, и каждые полгода с четвертого года наблюдения.
Минимальный объем исследований во время визита женщины состоит из:
- Осмотр в зеркалах;
- Гинекологический осмотр;
- Пап-тест;
- УЗИ малого таза – не чаще 1 раза в 3-6 месяцев.
Данные обследования проводятся при каждом “Follow up” визите. В течение первых трех лет наблюдения рекомендуется МРТ малого таза не реже 1-2 раз в год, КТ сканирование области забрюшинных лимфатических узлов брюшной полости и малого таза, рентгенография ОГК — не реже одного раза в год. Возможно использование ПЭТ/КТ при подозрении на прогрессирование болезни.
Всем пациентам обязательно участие в скрининговых программах, предоставляемых системой здравоохранения в соответствии с рекомендациями по возрасту.
Профилактика тромбоэмболичесих осложнений: эластическое бинтование нижних конечностей, продолжение антикоагулянтной терапии.
Инцентивная спирометрия у больных старшего возраста, дыхательная гимнастика и ЛФК в послеоперационном периоде, особенно в случаях ограничения физической активности.
Проведение послеоперационных перевязок по мере необходимости.
Индивидуальная работа с психологом.
Индикаторы эффективности лечения:
- «ответ опухоли» — регрессия опухоли после проведенного лечения;
- безрецидивная выживаемость (трех и пятилетняя);
- «качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
- Морфологически верифицированные злокачественные опухоли шейки матки при необходимости проведения специализированного лечения, паллиативного лечения и/или реабилитации.
Плановая госпитализация так же может осуществляться при необходимости реабилитационной и поддерживающей терапии в другие учреждения.
Показания для экстренной госпитализации:
Экстренные показания к госпитализации могут возникнуть при кровотечении, острой кишечной непроходимости и некоторых других более редких осложнениях опухолевого процесса.
- Кровотечение из половых путей;
- Острая кишечная непроходимость;
- Выраженный болевой синдром;
- Острая почечная недостаточность и др.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2018
- 1. Australian Institute of Health and Welfare 2008. Cervical screening in Australia 2005– 2006. Cancer series no. 41. Cat. no. CAN 36. Canberra: AIHW.
2. Webb JC, Key CR, Qualls CR, Smith HO. Population-based study of microinvasive adenocarcinoma of the uterine cervix. Obstet Gynecol 2001;97:701-706
3. Elliott P, Coppleson M, Russell P, Liouros P, Carter J. Macleod C et al. Early invasive (FIGO Stage IA) carcinoma of the cervix: a clinicopathologic study of 476 cases. Int J Gynecol Cancer 2000;10:42-52
6. Shepherd JH, Spencer C, Herod J, Ind TEJ. Radical vaginal trachelectomy as a fertility sparing procedure in women with early stage cervical cancer – cumulative pregnancy rate in a series of 123 women. BJOG 2006;113:719-7247. Landoni F, Maneo A, Colombo A, et al: Randomized study of radical surgery versus radiotherapy for stage IB-IIA cervical cancer. Lancet 1997;350:535-40
8. Querleu D, Morrow CP. Classification of radical hysterectomy. Lancet Oncol 2008;9:297.
9. Cibula D, Abu-Rustum NR, Benedetti-Panici P, et al. New classification system of radical hysterectomy: emphasis on a three-dimensional anatomic template for 3parametrial resection. Gynecol Oncol 2011;122:264-268.
10. Steed H, Rosen B, Murphy J. et al. Acomparison of laparoscopic-assisted radical vaginal hysterectomy and radical abdominal hysterectomy in the treatment of cervical cancer. Gynecol Oncol 2004;93:588-593
11. Peters III WA, Liu PY, Barrett II RJ et al: Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 2000;18(8):1606-13
12. Rotman M, Sedlis A, Piedmonte MR, Bundy B, Lentz SS, Muderspach LI, Zaino RJ: A phase III randomized trial of pelvic post-operative irradiation in Stage IB cervical carcinoma with poor prognostic features: Follow-up of a Gynecologic Oncology Group Study. Int J Rad Oncol Biol Phys 2006;65:169-176
13. Ohara K, Tsunoda M, Nishida M, Sugahara S, Hashimoto T, Shioyama Y et al. Use of small pelvic field instead of whole pelvic field in post-operative radiotherapy for nodenegative, high-risk stages I and II cervical squamous cell carcinoma. Int J Gynecol Cancer 2003;13:170-176
14. Adam E, Kaufman RH, Adler-Storthz K, et al. A prospective study of association of herpes simplex virus and human papillomavirus infection with cervical neoplasia in women exposed to diethylstilbestrol in utero. Int J Cancer. 1985;35:19-26.
15. American Cancer Society. Cancer Facts and Figures 2018. Atlanta, Ga: American Cancer Society; 2018.
16. American Joint Committee on Cancer. Cervix Uteri. In: AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010:395-402.
17. Anderson TA, Schick V, Herbenick D, Dodge B, Fortenberry JD. A study of human papillomavirus on vaginally inserted sex toys, before and after cleaning, among women who have sex with women and men. Sex Transm Infect. 2014 Apr 16. [Epub ahead of print]
18. Arbyn M, Kyrgiou M, Simoens C, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: meta-analysis. BMJ. 2008;337: a1284.
19. Ault KA. Future II study group. Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: A combined analysis of four randomised clinical trials. Lancet. 2007;369:1861-1868.
20. Bentivegna E, Maulard A, Pautier P, et al. Fertility results and pregnancy outcomes after conservative treatment of cervical cancer: A systematic review of the literature. Fertil Steril. 2016;106:1195-1211.
21. Castellsagué X, Bosch FX, Muñoz N, et al. Male circumcision, penile human papilloma virus infection, and cervical cancer in female partners. N Engl J Med. 2002;346:1105-1112.
22. Castellsagué X, Díaz M, Vaccarella S, et al. Intrauterine device use, cervical infection with human papillomavirus, and risk of cervical cancer: A pooled analysis of 26 epidemiological studies. Lancet Oncol. 2011;12:1023-1031.
23. Chaturvedi AK, Engels EA, Gilbert ES, et al. Second cancers among 104760 survivors of cervical cancer: Evaluation of long-term risk. J Natl Cancer Inst. 2007; 99:1634-1643.
24. Chaturvedi AK, Kleinerman RA, Hildesheim A, et al. Second cancers after squamous cell carcinoma and adenocarcinoma of the cervix. J Clin Oncol. 2009;27:967-973.
25. Cuzick J, Myers O, Hunt WC, et al. A population-based evaluation of cervical screening in the United States: 2008-2011. Cancer Epidemiol Biomarkers Prev. 2014;23:765-73.
26. Del Priore G, Gudipudi DK, Montemarano N, et al. Oral diindolylmethane (DIM): pilot evaluation of a nonsurgical treatment for cervical dysplasia. Gynecol Oncol. 2010;116:464-467
27. Klopp AH, Eifel PJ, Berek JS, Konstantinopoulos PA. Chapter 72: Cancer of the cervix, vagina, and vulva. In: DeVita VT, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology 10th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2015.
28. Ghosh C, Baker JA, Moysich KB, et al. Dietary intakes of selected nutrients and food groups and risk of cervical cancer. Nutr Cancer. 2008;60:331-341.
29. Gray RH, Serwadda D, Kong X, et al. Male circumcision decreases acquisition and increases clearance of high-risk human papillomavirus in HIV-negative men: A randomized trial in Rakai, Uganda. J Infect Dis. 2010;201:1455-1462.
30. Grimm C, Polterauer S, Natter C, et al. Treatment of cervical intraepithelial neoplasia with topical imiquimod: a randomized controlled trial. Obstet Gynecol. 2012;120:152-159.
31. Hatch EE, Herbst AL, Hoover RN, et al. Incidence of squamous neoplasia of the cervix and vagina in women exposed prenatally to diethylstilbestrol (United States). Cancer Causes Control. 2001;12:837-845.
32. Hernandez BY, Wilkens LR, Zhu X, et al. Transmission of human papillomavirus in heterosexual couples. Emerg Infect Dis. 2008;14:888-894.
33. Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2014, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2014/, based on November 2016 SEER data submission, posted to the SEER web site, April 2017.
34. International Collaboration of Epidemiological Studies of Cervical Cancer. Cervical cancer and reproductive factors: Collaborative reanalysis of individual data on 16,563 women with cervical carcinoma and 33,542 women without cervical carcinoma from 25 epidemiological studies. Int J Cancer. 2006; 119:1108-1124.
35. International Collaboration of Epidemiological Studies of Cervical Cancer. Appleby P, Beral V, Berrington de González A, et al. Cervical cancer and hormonal contraceptives: Collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet. 2007;370:1609-1621.
36. Jhingran A, Russel AH, Seiden MV, et al. Cancers of the cervix, vagina and vulva. In: Abeloff MD, Armitage JO, Lichter AS, et al. Clinical Oncology. 5th ed. Philadelphia, Pa; Elsevier; 2008: 1534-1574.
37. Kataja V, Syrjänen S, Yliskoski M, et al. Risk factors associated with cervical human papillomavirus infections: a case-control study. Am J Epidemiol. 1993;138:735-745.
38. Kleinerman RA, Kosary C, Hildesheim A. New Malignancies Following Cancer of the Cervix Uteri, Vagina, and Vulva. In: Curtis RE, Freedman DM, Ron E, Ries LAG, Hacker DG, Edwards BK, Tucker MA, Fraumeni JF Jr. (eds). New Malignancies Among Cancer Survivors: SEER Cancer Registries, 1973-2000. National Cancer Institute. NIH Publ. No. 05-5302. Bethesda, MD, 2006. Accessed at http://seer.cancer.gov/archive/publications/mpmono/MPMonograph_complete.pdf on November 8, 2016.
39. Kosary CL. Cancer of the uterine cervix. In: Ries LAG, Young JL, Keel GE, Eisner MP, Lin YD, Horner M-J (editors). SEER Survival Monograph: Cancer Survival Among Adults: U.S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, SEER Program, NIH Pub. No. 07-6215, Bethesda, MD, 2007.
40. Kreimer AR, González P, Katki HA, et al. Efficacy of a bivalent HPV 16/18 vaccine against anal HPV 16/18 infection among young women: A nested analysis within the Costa Rica Vaccine Trial. Lancet Oncol. 2011;12:862-870.
41. Kushi LH, Doyle C, McCullough M, Rock CL, et al. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: Reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin. 2012;62:30-67.
42. Kyrgiou M, Koliopoulos G, Martin-Hirsch P, et al. Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: Systematic review and meta-analysis. Lancet. 2006;367:489-498.
42. Krishnansu S. Tewari, M.D., Michael W. Sill, Ph.D., Harry J. Long, III, M.D., Richard T. Penson, M.D., Helen Huang, M.S., Lois M. Ramondetta, M.D., Lisa M. Landrum, M.D., Ana Oaknin, M.D., Thomas J. Reid, M.D., Mario M. Leitao, M.D., Helen E. Michael, M.D., and Bradley J. Monk, M.D. Improved Survival with Bevacizumab in Advanced Cervical Cancer. N Engl J Med 2014; 370:734-743; DOI: 10.1056/NEJMoa1309748
43. Committee F. FIGO staging for carcinoma of the vulva, cervix, and corpus uteri.Int J Gynaecol Obstet. 2014;125(2):97–8. doi:10.1016/j.ijgo.2014.02.003.
- 1. Australian Institute of Health and Welfare 2008. Cervical screening in Australia 2005– 2006. Cancer series no. 41. Cat. no. CAN 36. Canberra: AIHW.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков:
- Кайдарова Диляра Радиковна – доктор медицинских наук, академик НАН РК, председатель правления АО «Казахский НИИ онкологии и радиологии» МЗ РК, президент Ассоциации онкологов РК.
- Чингисова Жанна Казбековна – доктор медицинских наук, заместитель председателя правления по клинической работе, АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Кукубасов Ерлан Каирлыевич – кандидат медицинских наук, руководитель центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Тельгузиева Жаннат Ахметбековна – доктор медицинских наук, радиолог центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Курманова Анар Амангельдиевна, радиолог центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Шалбаева Раш Шарипбаевна – доктор медицинских наук, онколог-гинеколог центра онкогинекологии, АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Уколова Елена Андреевна – онколог-химиотерапевт АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Сатанова Алима Ринатовна – онколог-гинеколог АО «Казахский научно – исследовательский институт онкологии и радиологии.
- Бабажанова Анар Бейбитовна – клинический фармаколог Мангыстауского областного онкологического диспансера.
Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
- Манамбаева Зухра Алпысбаевна – доктор медицинских наук, профессор кафедры онкологии НАО»Национальный медицинский университет».
- Есенкулова Сауле Аскеровна – доктор медицинских наук, доцент кафедры онкологии НАО «Национальный медицинский университет».
- Кудайбергенов Талгат Капаевич – доктор медицинских наук, профессор, директор по науке ИРМ.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и вступления в действие или при наличии новых рекомендаций с уровнем доказательности.
Приложение 1
СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ
Антиэметическая терапия
Тошнота и рвота являются одним из наиболее частых побочных эффектов химио- терапии (ХТ) и существенно ухудшают качество жизни больных.
Тошнота и рвота, сопутствующие химиотерапии, относятся к числу наиболее неприятных аспектов этого вида лечения (1,2). Не будучи самым серьезным побочным эффектом химиотерапии, рвота, тем не менее, сильно ухудшает качество жизни и снижает ощущение благополучия (1,3). В некоторых случаях пациенты откладывают или полностью прекращают химиотерапию из-за непереносимой тошноты и рвоты (1).
Кроме того, рвота, как таковая, может представлять угрозу здоровью, поскольку неконтролируемая рвота приводит к обезвоживанию, нарушению баланса метаболитов и к анорексии (4,5).
Факторы, связанные с терапией:
Высокая эметогенная способность некоторых препаратов,
Комбинированная терапия
Режим и способ введения препаратов
Высокие дозы химиотерапевтических препаратов (6).
Под уровнем эметогенности понимается риск развития рвоты у больных, получающих тот или иной цитостатик в монорежиме без противорвотной терапии. Например, высокий уровень эметогенности означает, что после введения препарата рвота будет развиваться более чем у 90 % больных. Классификация противоопухолевых препаратов в зависимости от уровня эметогенности по рекомендациям MASCC / ESMO представлена в табл. 1.
Таблица 1. Классификация противоопухолевых препаратов в зависимости от уровня эметогенности по рекомендациям MASCC / ESMO.
| Уровень эметогенности | Противоопухолевые препараты для внутривенного введения | Противоопухолевые препараты для приема per os |
| Высокий (рвота у 90 % больных и более) |
Цисплатин Мехлорэтамин Стрептозоцин Циклофосфан ≥ 1500 мг / м2 Кармустин (BCNU) Дакарбазин |
Гексаметилмеламин Прокарбазин |
|
Схема «АС»: • эпирубицин 100 мг / м2 или • доксорубицин 60 мг / м2 + – циклофосфамид 600 мг / м2 . 2) Режимы на основе карбоплатина |
||
| Умеренный (рвота у 30–90 % больных) |
Оксалиплатин Цитарабин > 1 г / м2 Карбоплатин Ифосфамид Циклофосфамид < 1500 мг / м2 Доксорубицин Даунорубицин Эпирубицин Идарубицин Иринотекан Азацитидин Бендамустиин Клофарабин Алемтузумаб Трабектидин Ромидепсин Тиотепа |
Циклофосфамид Темозоломид Винорельбин Иматиниб Кризотиниб Церитиниб Босутиниб |
| Низкий (рвота у 10–30 %) |
(Nab-) Паклитаксел Доцетаксел Митоксантрон Доксорубицин липосомальный Иксабепилон Топотекан Этопозид Пеметрексед Метотрексат Митомицин Гемцитабин Цитарабин ≤ 1000 мг / м2 5-фторурацил Винфлунин Темсиролимус Бортезомиб Цетуксимаб Трастузумаб(-эмтанзин) Панитумумаб Катумаксумаб Пертузумаб Афлиберцепт Ипилимумаб |
Капецитабин Тегафур Флюдарабин Этопозид Сунитиниб Эверолимус Лапатиниб Леналидомид Талидомид Афатиниб Дабрафениб Дазатиниб Ибрутиниб Олапариб Нилотиниб Пвзопаниб Регорафениб Вандетаниб Вариностат |
| Минимальный (< 10 % больных) |
Блеомицин Бусульфан 2-хлордеоксиаденозин Флюдарабин Винбластин Винкристин Винорельбин Бевацизумаб Офатумумаб Ниволумаб Пембролизумаб Пискантрон Пралатрексат |
Хлорамбуцил Гидроксиуреа L-фенилаланин мустард 6-тиогуанин Метотрексат Гефитиниб Эрлотиниб Сорафениб Мелфалан Вемурафениб Помалидомид Руксолитинб Висмодегиб |
ТИПЫ ТОШНОТЫ И РВОТЫ
По срокам и механизму развития выделяют 3 основных типа тошноты и рвоты, вызванной цитостатиками: острую, отсроченную и условно-рефлекторную (anticipatory – переводят также как «предшествующую», «преждевременную», «рвоту ожидания»), дополнительно выделяют неконтролируемую (breakthrough – «прорывную») и рефрактерную (7, 8).
Острая рвота развивается в первые 24 ч после химиотерапии, отличается высокой интенсивностью, редко сопровождается тошнотой.
Отсроченная рвота развивается на 2-е–5-е сутки после начала химиотерапии, менее интенсивна, чем острая, и, как правило, сопровождается постоянной тошнотой. Механизмы развития остаются неясными. Ведущая роль отводится субстанции P, серотонин имеет меньшее значение.
Условно-рефлекторная рвота представляет собой классический условный рефлекс на химиотерапию и / или сопутствующие ей манипуляции и окружающую обстановку. Формируется в тех случаях, когда противоопухолевая терапия сопровождается тошнотой и рвотой. Риск ее развития увеличивается пропорционально числу проведенных курсов и может сохраняться в течение длительного времени после окончания химиотерапии. Ведущую роль в формировании условного рефлекса играет многодневная умеренная или тяжелая тошнота. Лучшим методом профилактики условно-рефлекторной тошноты и рвоты является адекватная антиэметическая защита пациента уже с первого курса химиотерапии.
Неконтролируемая (breakthrough – «прорывная») тошнота и рвота развивается на фоне адекватной антиэметической профилактики и требует дополнительной коррекции. Рефрактерная рвота возникает на последующих циклах химиотерапии при неэффективности противорвотной профилактики и / или препаратов резерва на предыдущих курсах лечения.
ПРИНЦИПЫ СОВРЕМЕННОЙ ПРОТИВОРВОТНОЙ ТЕРАПИИ
1. Обязательность проведения, начиная с первого курса химиотерапии.
2. Введение антиэметиков до начала введения первого цитостатика.
3. Применение наиболее эффективных стандартных противорвотных комбинаций.
4. Применение каждого антиэметика, входящего в комбинацию, в адекватных дозах.
5. Соблюдение адекватной продолжительности противорвотной терапии.
6. Соблюдение необходимых для сохранения эффективной концентрации интервалов между приемами антиэметиков.
Критерием эффективности противорвотной терапии является полное отсутствие (полный контроль) рвоты и тошноты в течение 24 часов (период развития острой рвоты) с момента введения противоопухолевых препаратов.
Алгоритм профилактики и терапии тошноты и рвоты
1. Определить эметогенный потенциал назначенного режима ХТ.
2. Назначить профилактическую терапию, исходя из эметогенности режима ХТ.
3. Назначить лечение в случае развития тошноты и рвоты на фоне профилактической терапии.
4. Внести изменения в профилактическую терапию тошноты / рвоты на последующих циклах ХТ.
Антиэметики:
I. Антагонисты серотониновых рецепторов (5-HT3):
- Ондансетрон (УД — А)
- Гранисетрон (УД — А)
- Трописетрон (УД — А)
- Палоносетрон (УД — А)
II. Кортикостероиды: Дексаметазон (УД — А)
III. Антагонисты рецепторов NK1 :
- Апрепитант (УД — А)
- Фосапрепитант (УД — А)
- Ролапитант (УД — А)
- Нетупитант (УД — А)
IV. Антипсихотическое средство (нейролептик):
- Оланзапин (УД — А) (проявляет антагонизм в отношении серотониновых 5-НТ-, допаминовых и холинорецепторов).
Профилактика острой и отсроченной тошноты и рвоты при высокоэметогенной однодневной химиотерапии и при умеренно эметогенной однодневной химиотерапии.
В настоящее время наиболее эффективной антиэметической комбинацией при высокоэметогенной однодневной химиотерапии является комбинация противорвотных препаратов, включающая антагонистов NK1-рецепторов + антагонистов рецепторов серотонина (5-HT3) + дексаметазон.
Профилактика тошноты и рвоты, возникающей при проведении химиотерапии с умеренно эметогенным потенциалом, должна начинаться до начала химиотерапии и проводиться не менее 3 дней после проведения химиотерапии. Наиболее эффективной антиэметической комбинацией является комбинация противорвотных препаратов, включающая антагонистов рецепторов серотонина (5-HT3) + дексаметазон (табл 2,3) (9, 10).
Таблица 2. Обновленные рекомендации MASCC/ESMO 2016 ТРВХ.
Острая тошнота и рвота.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | 5-НТ3 + DEX+NK 1 |
| Высокий (АС) | 5-НТ3 + DEX+NK 1 |
| Карбоплатин | 5-НТ3 + DEX+NK 1 |
| Умеренный (кроме карбоплатина) | 5-НТ3 + DEX |
| Низкий | 5-НТ3 или DEX или DOP |
| Минимальный | Нет рутинной профилактики |
ТРВХ – тошноты и рвота, вызванная химиотерапией
MASCC — Multinational Association of Supportive Care in Cancer; ESMO – European Society for Medical Oncology
5-НТ3 — антогонисты серотиновых рецепторов
DEX— дексаметазон
NK 1 — антагонисты рецепторов нейрокинина такие как Апрепитант или
Фосапрепитант или
Ролапитант или NEPA (комбинация нетупитант и палоносетрон).
DOP— антогонист допаминовых рецепторов
ВНИМАНИЕ: Если антагонисты NK1 рецепторов недоступны при использовании схемы AC, палоносетрон является предпочтительным антагонистом 5-НТ3 рецепторов.
Таблица 3. Обновленные рекомендации MASCC/ESMO 2016 ТРВХ.
Отсроченная тошнота и рвота.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | DEX или (если APR 125мг для острой: (МСР+DEX) или (DEX+APR) |
| Высокий (АС) | Нет или (если APR 125мг для острой:APR+DEX) |
| Карбоплатин | Нет или (если APR 125мг для острой:APR) |
| Средний (не карбоплатин) | DEX можно использовать |
| Низкий | Профилактика не предусмотрена |
| Минимальный | Профилактика не предусмотрена |
DEX — дексаметазон
APR — апрепитант
MCP — метоклопромид
Ключевые обновления в рекомендациях по контролю ТРВХ, NCCN 2017:
Карбоплатин категоризируется как высокоэметогенный препарат при введении с площадью под кривой (ППК) ≥4, при введении с ППК <4, является умеренноэметогенным препаратом.
Инъекция подкожного гранисетрона пролонгированного действия теперь включена в рекомендации по профилактике тошноты и рвоты при высокоэмегоненной и умеренноэметогенной ХТ.
Новая схема профилактики ТРВХ из четырех препаратов теперь включена в рекомендации по профилактике ТРВХ при высокоэметогенной ХТ (11, 12).
Ключевые обновления в рекомендациях по контролю ТРВХ, ASCO 2017:
Взрослым пациентам, получающим высокоэметогенную химиотерапию цисплатином, либо комбиницией циклофосфамидов и антрациклина, к стандартному антиэметическому режиму (комбинация антагонистов рецепторов 5-НТ3 + антагонисты рецепторов NK1 + dex) следует добавить оланзапин.
Взрослым пациентам, получающим карбоплатин содержащую химиотерапию, а также детям, получающим высокоэметогенную химиотерапию, антагонисты рецепторов NK1 должны быть добавлены к стандартному антиэметическому режиму (комбинация антагонистов рецепторов 5-НТ3 + dex).
Если пациенты получают комбинацию антрациклина и циклофосфамида, прием дексаметазона можно ограничить с первым днем химиотерапии.Экспертная комиссия рекомендует начинать антиэметическую терапию с самой эффективной схемы, подходящей к химио- и радиотерапии, вместо того чтобы оценивать эметический ответ пациента на менее эффективную антиэметическую терапию (13).
Таблица 4. Обновленные рекомендации ASCO 2017.
Взрослые пациенты.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | 5-НТ3 + DEX* +NK 1+Olanzapine* |
| Высокий (АС) | 5-НТ3 + DEX* +NK 1+Olanzapine* |
| Карбоплатин | 5-НТ3 + DEX+NK 1 |
| Умеренный (кроме карбоплатина) | 5-НТ3 + DEX |
| Низкий | 5-НТ3 или DEX или DOP |
| Минимальный | Нет рутинной профилактики |
* — дексаметазон и оланзапин нужно продолжать на 2-4 день
Таблица 5. Рекомендуемые дозы антогонистов серотониновых рецепторов (5-НТ) для острой тошноты и рвоты.
| Препарат | Путь введения | Доза |
| Ондансетрон | в/в | 8мг или 0,15мг/кг |
| пероральный | 16мг* | |
| Гранисетрон | в/в | 1мг или 0,01мг/кг |
| пероральный | 2мг (или 1мг**) | |
| Трописетрон | в/в | 5мг |
| пероральный | 5мг | |
| Палоносетрон | в/в | 0,25мг |
| пероральный | 0,5мг |
* В рандомизированных исследованиях был протестирован режим 8 мг два раза в день.
** Некоторыми панелистами доза 1 мг более предпочтительна
Таблица 6. Рекомендуемые дозы кортикостероидов (дексаметазон)*
| Дексаметазон | Дозы и Кратность | |
| Высокий риск | Острая рвота | 20мг однократно (12мг когда используется апрепитант или нетупитант) )** |
| Отсроченная рвота | 8мг в течение 3-4 дней (8мг один раз в день когда используется апрепитант или нетупитант ) | |
| Умеренный риск | Острая рвота | 8 мг однократно |
| Отсроченная рвота |
8 мг ежедневно в течение 2-3 дней |
|
| Низкий риск | Острая рвота | 4-8 мг один раз в день |
* Несмотря на то, что другие кортикостероиды также являются эффективными антиэметиками, режим дозирования для дексаметазона, как препарата выбора, основан на широком распространении препарата, с несколькими формами дозирования
** Только 12 мг дексаметазона было исследовано с (фос) апрепитантами/нетупитантами в рандомизированных исследованиях
Таблица 7. Рекомендуемые дозы антагонистов NK1 рецепторов.
| Антагонисты NK1 Рецепторов | Дозы и кратность |
|
Апрепитант* и фосапрепитант острая рвота |
Апрепитант 125мг внутрь однократно в день химиотерапии* -или- Фосапрепитант 150 в/в, однократно в день химиотерапии |
|
Апрепитант* и фосапрепитант отсроченная рвота |
Апрепитант 80мг внутрь однократно в течении 2-х дней после химиотерапии |
| Ролапитант | 180мг внутрь однократно в день химиотерапии |
| Нетупитант | 300 мг нетупитант / 0,5 мг палоносетрон перорально один раз в день химиотерапии |
* Апрепитант 165 мг, одна доза перед химиотерапией (не применяется на 2-3 день). Рекомендовано ЕМА и другими органами.
Рекомендации по профилактики преждевременной тошноты и рвоты
Наилучший подход для профилактики преждевременной рвоты это наилучший контроль над острой и отсроченной рвотой.
Психотерапия, особенно прогрессивное обучение мышечной релаксации, систематическая десенситизация и гипноз, могут быть использованы для лечения преждевременной тошноты и рвоты.
Только бензодиазепины уменьшают частоту преждевременной тошноты и рвоты, но их эффективность имеет тенденцию к снижению при продолжающейся химиотерапии.
Кардиотоксичность
Кардиотоксичность возникает в основном при лечении антрациклинами- доксорубицин, фарморубицин, даунорубицин- и редко при использовании других препаратов: циклофосфамид, фторурацил, этопозид, тенипозид, паклитаксел, трастузумаб, лапатиниб. Различные препараты по разному воздействуют на сердечно- сосудистую систему в связи с неодинаковым механизмом кардиотоксичости: препараты, вызывающие снижение сократительной или расслабляющей функции миокарда(антрациклины), препараты, вызыващие или обостряющие ишемию(фторурацил, винкристин, винбластин, цисплатин), препараты, влияющие на проводящую систему, в результате чего возникает аритмия/ блокада проводимости(антрациклины, паклитаксел).
Основной способ предупреждения развития кардиотоксичности I типа(необратимые повреждения) при лечени анрациклинами- соблюдение предельных суммарных доз препаратов(доксорубицин ˃550мг/м2, фарморубицин ˃720мг/м2), использование пегилированного липосомного доксорубиина (келикс ˃900мг /м2). Необходмио раннее выявление кардиотоксичности с помощью Эхо КГ и ЭКГ(для пациентов всех возрастов при планировании системной ХТ препаратами антрациклинового ряда, трастузумабом- перед каждым введением, при назначении препаратов таксанового ряда, циклофосфамид, лапатиниб, этопозид, фторурацил- каждые 3 месяца).
При снижении Фракции выброса до 55-50%, необходима отсрочка введения химиопрепаратов до восстановления ФВ в норму, консультация кардиолога.
При снижении ФВ 50% и менее необходима отсрочка системного лечения до 3 месяцев, проведение коррегирующего лечения по назначению кардиолога.
Колониестимулирующая терапия:
Целесообразность назначения Г-КСФ для стимуляции кроветворения и преодоления миелосупрессии при фебрильной нейтропении (ФН) изучалась в нескольких рандомизированных исследованиях. На основании имеющихся данных сделаны следующие выводы относительно роли Г-КСФ в период ФН:
- Г-КСФ статистически значимо снижает длительность нейтропении на 1–2 дня;
- Г-КСФ не сокращает продолжительность лихорадки и длительность антибактериальной (АБ) терапии в случае развития ФН;
- Г-КСФ не снижает стоимости лечения одного эпизода ФН.
- Г-КСФ могут применяться в случае высокого риска ФН при состояниях, сопровождающихся повышенной смертностью, таких как гипотония, сепсис, пневмония, инфекции тканей, системная грибковая инфекция, длительная нейтропении (>7 дней) или глубокой нейтропении.
Большинство медицинских онкологических сообществ (NCCN, ASCO, EORTC, RUSSCO) рекомендуют использовать следующие Г-КСФ: липэгфилграстим, эмпэгфилграстим, пэгфилграстим (филграстим, соединенный с полиэтиленгликолем), филграстим (негликозилированный Г-КСФ), ленограстим (гликозилированный Г-КСФ). Липэгфилграстим, эмпэгфилграстим и пэгфилграстим представляют собой препараты пролонгированного действия и вводятся однократно после курса ХТ. Пролонгированное действие обусловлено тем, что препарат не выводится с мочой и дольше циркулирует в крови.
Таблица 8. Перечень препаратов Г-КСФ
| МНН | Группа КСФ | Режим введения |
|
Филграстим (УД — А) |
Рекомбинантный человеческий негликолизированный Г-КСФ | 5 мкг/кг массы тела 1 раз/сут. п/к или в/в ежедневно через 24–72 часа после последнего дня ХТ до необходимого стабильного АЧН |
|
Пэгфилграстим (УД — А) |
Рекомбинантный пегилированный Г-КСФ (филграстим), конъюгированный с полиэтиленгликолем, пролонгированного действия | 6 мг (без учета массы тела) однократно п/к не ранее чем через 24 часа и не позднее 14-ых сут. после курса ХТ |
|
Липэгфилграстим (УД — А) |
Гликопегилированный Г-КСФ пролонгированного действия | 100 мкг/кг или 6 мг (без учета массы тела) п/к однократно через 24 ч после окончания цикла ХТ |
|
Эмпэгфилграстим (УД — А) |
Ковалентный коньюгат филграстима с одной молекулой полиэтиленгликоля, пролонгированного действия | 7,5 мг (без учета массы тела) п/к однократно не ранее чем через 24 часа и не позднее 14-ых сут. после курса ХТ |
|
Ленограстим (УД — А) |
Рекомбинантный человеческий гликолизированный Г-КСФ | 19,2 млн. МЕ (или 150 мкг) на м² поверхности тела (0,64 млн. МЕ или 5 мкг на кг массы тела) в день п/к или в/в ежедневно через 24–72 часа после последнего дня ХТ до достижения необходимого стабильного АЧН |
(УД — А)
Таблица 9. Показания для назначения колониестимулирующих факторов
| Первичная профилактика | Вторичная профилактика |
|
|
|
!!! Первичная профилактика Г-КСФ не показана во время ХЛТ на область грудной клетки, так как увеличивает частоту миелосупрессии и риск осложнений и смерти. |
Коррекция анемии:
Анемия при новообразованиях (В63.0 код по МКБ 10) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и ее лечением. Слабая степень анемии представляет собой снижение концентрации Hb в диапазоне от 100 до 119 г/л, анемия средней степени – концентрация Hb от 80 до 99 г/л, тяжелая анемия – концентрация Hb ниже 80 г/л.
Таблица 10. Препараты рекомендованные для лечения анемии у онкологических больных
| Группа препарата | Препарат, рекомендованная доза |
| Эритропоэзстимулирующие препараты (УД — А) |
Эпоэтин альфа 150 МЕ/кг × 3 раза в нед. п/к 12 000 МЕ × 3 раза в нед. п/к 40 000 МЕ × 1 раз в нед. п/к |
| Эпоэтин бета 30 000 МЕ × 1 раз в нед. п/к | |
| Эпоэтин тета 20 000 МЕ × 1 раз в нед. п/к | |
|
Дарбэпоэтин альфа 2,25 мкг/кг × 1 раз в нед. п/к 500 мкг × 1 раз в 3 нед. п/к |
|
| Препараты железа (УД — А) |
Железа [III] гидроксид сахарозный комплекс 200 мг × 3 раза в нед. в/в струйно 7 мг железа/кг массы тела, в однократной дозе не более 500 мг железа, в/в инфузия не менее 3,5 часов |
|
Железа карбоксимальтозат 200 мг железа × 3 раза в нед. в/в струйно 20 мг максимального железа/кг массы тела в однократной дозе не более 1000 мг, в/в капельно не менее 15 мин. |
|
|
Железа [III] гидроксид декстран 100–200 мг × 2–3 раза в нед. в/в струйно 20 мг/кг железа в/в инфузия 4–6 часов |
|
| Витамины | Цианкобаламин (Витамин В12) 0,5 мг/мл – 1,0 мл, п/к через день |
| Фолиевая кислота 2 мг/сут. внутрь |
Медикаментозное лечение, оказываемое на этапе скорой медицинской помощи:
Гемостатическая терапия;
Аминокапроновая кислота 5% -100мл, по 100 мл в/в 1 раз в день;
Этамзилат 12,5%-2мл, по 2 мл в/м 2 раза в день;
Дицинон 1 мл, по 1,0 мл в/м 1 – 2 раза в день.
Жаропонижающая терапия;
Ацетилсалициловая кислота 0,5 гр, по 0,5 гр peros2 раза в день;
Парацетамол0,5гр, по 0,5 гр peros, 3 раза в день.
Аналгетическая терапия;
Кетопрофен 1мл, по 1 мл, в/м 2-3 раза в день;
Диклофенак натрия в/м 2 – 3 раза;
Трамадола гидрохлорид 1 мл, по 1мл в/м 2 – 3 раза в день;
Гормональные терапия
Преднизолон 30мг, по 30 – 60 – 90 мг в/в 1 раз в день;
Дексаметазон 4 мг, по 4 – 8 – 12 – 16 – 20 мг 1 раз в день;
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Рак шейки матки
Рак шейки матки – опухолевое поражение нижнего отдела матки, характеризующееся злокачественной трансформацией покровного эпителия (экто- или эндоцервикса). Специфическим проявлениям рака шейки матки предшествует бессимптомное течение; в дальнейшем появляются контактные и межменструальные кровянистые выделения, боли в животе и крестце, отеки нижних конечностей, нарушения мочеиспускания и дефекации. Диагностика при раке шейки матки включает проведение осмотра в зеркалах, расширенной кольпоскопии, исследования цитологического соскоба, биопсии с гистологическим заключением, эндоцервикального кюретажа. Лечение рака шейки матки проводят с учетом гистологической формы и распространенности с помощью хирургического вмешательства, лучевой терапии, химиотерапии или их комбинации.
Общие сведения
Рак шейки матки (цервикальный рак) составляет около 15% среди всех злокачественных поражений женской репродуктивной системы, занимая третье место вслед за раком молочной железы и раком эндометрия. Несмотря на то, что рак шейки матки относится к заболеваниям «визуальной локализации», у 40% женщин эта патология диагностируется на поздней (III — IV) стадии. В России ежегодно выявляется около 12000 случаев цервикального рака. Основной категорией служат пациентки в возрасте 40-50 лет, хотя в последние годы отмечается рост заболеваемости раком шейки матки среди женщин младше 40 лет.
Рак шейки матки
Причины РШМ
Ключевая роль в канцерогенезе отводится папилломавирусной инфекции, обладающей тропностью к эпителию шейки матки. Серотипы ВПЧ высокого онкогенного риска (16, 18) обнаруживаются в 95% случаев рака шейки матки: при плоскоклеточном цервикальном раке чаще выявляется ВПЧ 16 типа; при аденокарциноме и низкодифференцированной форме — ВПЧ 18 типа. Серотипы ВПЧ «низкого» онкогенного риска (6, 11, 44) и среднего риска (31, 33, 35) преимущественно вызывают образование плоских и остроконечных кондилом, дисплазию и редко – рак шейки матки.
Среди других ИППП, повышающих риски развития рака шейки матки, выделяют генитальный герпес, цитомегаловирусную инфекцию, хламидиоз, ВИЧ. Из всего вышесказанного следует, что вероятность развития рака шейки матки больше у женщин, часто меняющих половых партнеров и пренебрегающих барьерными методами контрацепции. Кроме того, при раннем начале сексуальной жизни (в возрасте 14-18 лет) незрелый эпителий шейки матки обладает особой восприимчивостью к воздействию повреждающих агентов.
Факторы риска
К факторам риска по развитию рака шейки матки относят ослабление функции иммунной системы, курение, возраст старше 40 лет, диеты с малым содержанием фруктов и овощей, ожирение, недостаток витаминов А и С. Также доказано, что вероятность развития рака шейки матки увеличивается при длительном (свыше 5 лет) приеме оральных контрацептивов, многочисленных родах, частых абортах. Одним из факторов позднего обнаружения рака шейки матки является низкая медицинская культура, нерегулярное прохождение женщинами профилактических осмотров с исследованием мазка из цервикального канала на онкоцитологию.
К фоновым заболеваниям, предрасполагающим к развитию рака шейки матки, в гинекологии относят лейкоплакию (интраэпителиальную неоплазию, CIN), эритроплакию, кондиломы, полипы, истинную эрозию и псевдоэрозию шейки матки, цервициты.
Классификация
По гистологическому типу, в соответствии с двумя видами эпителия, выстилающего шейку матки, различают плоскоклеточный цервикальный рак с локализацией в эктоцервиксе (85-95%) и аденокарциному, развивающуюся из эндоцервикса (5-15%). Плоскоклеточный рак шейки матки, в зависимости от степени дифференцировки, может быть ороговевающим, неороговевающим и низкодифференцированным. К редким гистотипам рака шейки матки относятся светлоклеточная, мелкоклеточная, мукоэпидермоидная и др. формы. С учетом типа роста различают экзофитные формы рака шейки матки и эндофитные, встречающиеся реже и имеющие худший прогноз.
Для оценки распространенности в клинической гинекологии используются классификации рака шейки матки по двум системам: FIGO, принятой Международной федерацией акушеров и гинекологов, и ТNМ (где T – распространенность опухоли; N – вовлеченность регионарных лимфоузлов; M – наличие отдаленных метастазов).
Стадия 0 (FIGO) или Тis (ТNМ) расценивается как преинвазивный или внутриэпителиальный рак шейки матки (in situ).
Стадия I (FIGO) или T1 (ТNМ) — опухолевая инвазия ограничивается шейкой матки, без перехода на ее тело.
- I A1 (T1 А1) – микроскопически определяемый рак шейки матки с глубиной инвазии до 3 мм с горизонтальным распространением до 7 мм;
- I A2 (T1 А2) – прорастание опухоли в шейку матки на глубину от 3 до 5 мм с горизонтальным распространением до 7 мм.
- I B1 (T1 В1) – макроскопически определяемый цервикальный рак, ограниченный шейкой матки, либо микроскопически выявляемые поражения, превышающие IA2 (T1А), не превышающее в максимальном измерении 4 см;
- I B2 (T1 В2) — макроскопически определяемое поражение, превышающее в максимальном измерении 4 см.
Стадия II (FIGO) или T2 (ТNМ) характеризуется распространением рака за пределы шейки матки; нижняя треть влагалища и стенки таза интактны.
- II A (T2 А) – опухоль инфильтрирует верхнюю и среднюю треть влагалища или тело матки без прорастания параметрия;
- II B (T2 В) – опухоль инфильтрирует параметрий, но не доходит до стенок таза.
Стадия III (FIGO) или T3 (ТNМ) характеризуется распространением рака за пределы шейки матки с прорастанием параметрия до стенок таза либо вовлечением нижней трети влагалища, либо развитием гидронефроза.
- III A (T3 А) – опухоль захватывает нижнюю треть влагалища, но не прорастает в стенки таза;
- III B (T3 В) – опухоль переходит на стенки таза либо вызывает гидронефроз, или вторичное поражение почки.
Стадия IV А (FIGO) или T4 (ТNМ) характеризуется распространением рака шейки матки в смежные органы либо распространением за пределы таза. Стадия IV B (T4 M1) свидетельствует о наличии отдаленных метастазов.
Симптомы рака шейки матки
Клинические проявления при карциноме in situ и микроинвазивном раке шейки матки отсутствуют. Появление жалоб и симптоматики свидетельствует о прогрессировании опухолевой инвазии. Наиболее характерным проявлением рака шейки матки служат кровянистые выделения и кровотечения: межменструальные, постменопаузальные, контактные (после полового акта, осмотра гинекологом, спринцевания и т. д.), меноррагии. Больные отмечают появление белей — жидких, водянистых, желтоватого или прозрачного цвета влагалищных выделений, обусловленных лимфореей. При распаде раковой опухоли выделения принимают гноевидных характер, иногда имеют цвет «мясных помоев» и зловонный запах.
При прорастании опухоли в стенки таза или нервные сплетения появляются боли в животе, под лоном, в крестце в покое или во время полового акта. В случае метастазирования рака шейки матки в тазовые лимфоузлы и сдавливания венозных сосудов могут наблюдаться отеки ног и наружных гениталий.
Если опухолевая инфильтрация затрагивает кишечник или мочевой пузырь, развиваются нарушения дефекации и мочеиспускания; появляется гематурия или примесь крови в кале; иногда возникают влагалищно-кишечные и влагалищно-пузырные свищи. Механическая компрессия метастатическими лимфоузлами мочеточников приводит к задержке мочи, формированию гидронефроза с последующим развитием анурии и уремии. К общим симптомам рака шейки матки относятся общая слабость, повышенная утомляемость, лихорадка, похудание.
Диагностика
Основу раннего выявления микроинвазивного цервикального рака составляют регулярные онкопрофилактические осмотры с цитологическим исследование соскоба шейки матки. Пап-тест (мазок по Папаниколау) позволяет выявлять предраковые процессы, раковые клетки при преинвазивном росте опухоли. Схема обследования включает:
- Осмотр шейки матки в зеркалах. Визуальный гинекологический осмотр в ранней стадии позволяет обнаружить или заподозрить РШМ по внешнем признакам: изъязвлениям, изменению окраски шейки матки. В инвазивной стадии при экзофитном типе роста рака на поверхности шейки матки определяются фибринозные наложения, опухолевидные разрастания красноватого, белесоватого, розовато-серого цвета, которые легко кровоточат при прикосновении. В случае эндофитного роста цервикального рака шейка становится увеличенной, приобретает бочковидную форму, неровную бугристую поверхность, неравномерную розово-мраморную окраску. При ректо-вагинальном исследовании в параметрии и малом тазу могут определяться инфильтраты.
- Кольпоскопия. С помощью кольпоскопии при увеличении изображения в 7,5- 40 раз возможно более детально изучить шейку матки, обнаружить фоновые процессы (дисплазию, лейкоплакию) и начальные проявления рака шейки матки. Для исследования зоны трансформации эпителия используют проведение пробы с уксусной кислотой и Шиллер-теста (йодной пробы). Атипия при раке шейки матки выявляется по характерной извитости сосудов, менее интенсивному окрашиванию патологических йоднегативных очагов. При подозрении на рак шейки матки показано исследование опухолеассоциированного антигена плоскоклеточных карцином – онкомаркера SCC (в норме не превышает 1,5 нг/мл).
- Биопсия шейки матки. Кольпоскопия дает возможность выявить участок трансформации и произвести прицельную биопсию шейки матки для гистологического исследования забранных тканей. Ножевая биопсия шейки матки с выскабливанием цервикального канала обязательна при подозрении на цервикальный рак. Для определения степени инвазии рака производится конизация шейки матки – конусовидное иссечение кусочка тканей. Решающим и окончательным методом в диагностике рака шейки матки является морфологическая интерпретация результатов биопсии.
Дополнительно при раке шейки матки проводится УЗИ малого таза, позволяющее стадировать опухолевый процесс и планировать объем вмешательства. Для исключения прорастания опухоли в смежные органы и отдаленного метастазирования прибегают к выполнению УЗИ мочевого пузыря и почек, цистоскопии, внутривенной урографии, УЗИ брюшной полости, рентгенографии легких, ирригоскопии, ректоскопии. При необходимости пациентки с выявленным раком шейки матки должны быть проконсультированы урологом, пульмонологом, проктологом.
МРТ таза. Рак шейки матки с переходом на тело матки.
Лечение рака шейки матки
Хирургическое лечение
Все операции при раке шейки матки делятся на органосохраняющие и радикальные. Выбор тактики зависит от возраста женщины, репродуктивных планов, распространенности онкопроцесса. В онкогинекологии применяется:
- Органосохраняющая тактика. При преинвазивном раке у молодых женщин, планирующих деторождение, выполняются щадящие вмешательства с удалением начально измененных участков шейки матки в пределах здоровых тканей. К таким операциям относят конусовидную ампутацию (конизацию) шейки матки, электрохирургическую петлевую эксцизию, высокую ампутацию шейки матки. Экономные резекции при раке шейки матки позволяют соблюсти онкологическую радикальность и сохранить репродуктивную функцию.
- Радикальная тактика. При более выраженных изменениях и распространенности опухолевого процесса показано удаление матки с транспозицией яичников (выведением их за пределы таза) или с овариэктомией. При раке шейки матки в стадии I B1 стандартным хирургическим объемом является пангистерэктомия – экстирпация матки с аднексэктомией и тазовой лимфодиссекцией. При переходе опухоли на влагалище показано проведение радикальной гистерэктомии с удалением части влагалища, яичников, маточных труб, измененных лимфоузлов, парацервикальной клетчатки.
Противоопухолевое лечение
Хирургический этап лечения рака шейки матки может сочетаться с лучевой или химиотерапией, либо с их комбинацией. Химио- и радиотерапия могут проводиться на дооперационном этапе для уменьшения размеров опухоли (неоадъювантная терапия) или после операции для уничтожения возможно оставшихся опухолевых тканей (адъювантная терапия). При запущенных формах рака шейки матки выполняются паллиативные операции – выведение цистостомы, колостомы, формирование обходных кишечных анастомозов.
Прогноз
Лечение рака шейки матки, начатое на I стадии, обеспечивает 5-летнюю выживаемость у 80-90% пациенток; при II ст. выживаемость через пять лет составляет 60-75%; при III ст. — 30-40%; при IV ст. – менее 10%. При осуществлении органосберегающих операций по поводу рака шейки матки шансы на деторождение сохраняются. В случае проведения радикальных вмешательств, неоадъювантной или адъювантной терапии фертильность полностью утрачивается.
При выявлении рака шейки матки при беременности, тактика зависит от сроков гестации и распространенности опухолевого процесса. Если срок гестации соответствует II-III триместру, беременность возможно сохранить. Ведение беременности при раке шейки матки осуществляется под повышенным медицинским наблюдением. Методом родоразрешения в этом случае обычно служит кесарево сечение с одновременным удалением матки. При сроке гестации менее 3-х месяцев производится искусственное прерывание беременности с немедленным началом лечения рака шейки матки.
Профилактика
Основной профилактической мерой рака является массовый онкологический скрининг с помощью цитологического исследования соскобов с шейки матки и из цервикального канала. Обследование рекомендуется начинать после начала половой жизни, но не позднее возраста 21 года. В течение первых двух лет мазок сдается ежегодно; затем, при отрицательных результатах – 1 раз в 2-3 года.
Профилактика рака шейки матки требует раннего выявления и лечения фоновых заболеваний и половых инфекций, ограничения числа сексуальных партнеров, использования барьерной контрацепции при случайных половых связях. Пациенткам групп риска необходимо прохождения осмотра гинеколога не реже 1 раза в полгода с проведением расширенной кольпоскопии и цитологического мазка. Девочкам и молодым женщинам в возрасте от 9 до 26 лет показано проведение профилактической вакцинации против ВПЧ и рака шейки матки препаратами Церварикс или Гардасил.
Рак шейки матки — лечение в Москве
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
- 1 Рак шейки матки: стадии
- 1.1 0 стадия
- 1.2 1 стадия рака шейки матки
- 1.3 2 стадия рака
- 1.4 3 стадия
- 1.5 4 стадия рака шейки матки
- 2 Стадии рака шейки матки: прогноз
- 3 Почему лечить рак шейки матки нужно в Израиле?
Определение стадии рака шейки матки – важная часть онкологического диагноза, которая зависит от размера опухоли и вовлеченности в онкологический процесс близлежащих и отдаленных органов и тканей. Диагностируется с помощью методов медицинской визуализации:
- ПЭТ-КТ;
- компьютерной томографии;
- УЗИ;
- МРТ.
От стадии болезни зависит тактика лечения рака. Если ранняя стадия рака шейки матки лечится с помощью хирургической операции, то при последней стадии специалисты онкоцентра Ихилов используют химиотерапию и современные биологические препараты.
В этой статье изложены лишь общие принципы диагностики и лечения заболевания. Программа лечения рака шейки матки в Израиле всегда составляется индивидуально, с учетом стадии болезни и других факторов.
Онкологи выделяют 4 стадии рака шейки матки. Иногда в медицинской литературе можно встретить также упоминания о 0 стадии заболевания.
Рак шейки матки: стадии
0 стадия
Это самая ранняя стадия рака, на которой клетки злокачественной опухоли присутствуют только в поверхностном слое шейки матки. 0-ю стадию иногда называют «рак in situ». Ее считают серьезным предраковым состоянием: при отсутствии лечения такая опухоль превращается в рак шейки матки.
На этой стадии женщина не ощущает никаких симптомов, и опухоль обычно обнаруживается случайно или во время планового профилактического осмотра. Ранняя диагностика рака шейки матки проводится также с помощью мазка по Папаниколау. На медицинских форумах гинекологи советуют женщинам проходить такой анализ каждые несколько лет.
Лечение рака шейки матки 0 стадии в Израиле обычно предполагает конизацию – удаление части тканей шейки матки вместе с опухолью. Это позволяет женщине в дальнейшем забеременеть и родить ребенка. У женщин нерепродуктивного возраста возможно проведение гистерэктомии – удаления матки.
Получить диагностики бесплатно
1 стадия рака шейки матки
Это начальная стадия рака, когда процесс не выходит за пределы шейки матки. Размер опухоли составляет не более 4 см. На этой стадии рак уже пророс в шейку матки, но еще не распространился на близлежащие ткани. Симптомы рака в начале болезни чаще всего отсутствуют. В некоторых случаях у женщины могут появиться:
- аномальные выделения из половых путей, не связанные с менструальным циклом;
- боль и дискомфорт в области таза.
1-я стадия рака шейки матки диагностируется во время гинекологического осмотра. На начальном этапе заболевания опухоль не видна глазом и обнаружить ее можно только при помощи кольпоскопии – осмотра шейки матки с помощью специального микроскопа.
Лечение рака шейки матки 1 стадии в Израиле также предполагает конизацию. Если женщина не планирует беременность, может быть проведена гистерэктомия. В некоторых случаях, если удалить все раковые клетки во время операции было невозможно, может быть назначена химиотерапия или лучевая терапия, в том числе брахитерапия – облучение опухоли с помощью капсул с радиоактивным веществом, внедряемых в ткани рядом с опухолью.
2 стадия рака
О 2 стадии рака говорят, когда опухоль проросла во влагалище и другие близлежащие ткани; ее размер составляет 4 см и более. Опухоль может распространяться на параметрий – часть клетчатки малого таза, окружающей матку. Хотя эта стадия также считается начальной, на ней обычно проявляются первые симптомы болезни:
- маточные кровотечения – в том числе после полового акта;
- удлинение времени менструаций;
- необычные выделения из влагалища;
- боли в нижней части живота.
Лечение рака шейки матки 2 стадии может быть начато с химиотерапии или лучевой терапии. После этого проводится гистерэктомия – удаление матки.
Получить программу лечения бесплатно
3 стадия
На этой стадии раковые клетки проникают в ткани тазовой области. Опухоль может распространяться на мочеточники и другие тазовые органы, а также на тазовые лимфатические узлы. При этом у рака отсутствуют отдаленные метастазы.
Для диагностики распространенности опухоли могут быть назначены УЗИ органов малого таза, МРТ малого таза, компьютерная томография брюшной полости и забрюшинного пространства. 3 стадия рака шейки матки вызывает более серьезные симптомы:
- затруднения при мочеиспускании и дефекации;
- отеки ног;
- появление крови в моче;
- боли во время полового акта;
- боль в спине;
- немотивированную потеря массы тела.
Лечение рака шейки матки 3-й стадии обычно начинается с химиотерапии. При этом может быть проведена оценка лимфоузлов путем биопсии. После этого может быть выполнена хирургическая операция. Кроме химиотерапии, пациентке могут быть назначены лучевая терапия и таргетная терапия.
4 стадия рака шейки матки
Последняя стадия рака диагностируется в тех случаях, если опухоль имеет отдаленные метастазы.
На этой стадии рак вызывает тяжелые симптомы. Их характер зависит от того, какие органы и системы поражены метастазами. Это могут быть:
- постоянная слабость и чувство усталости;
- головокружения и неврологические симптомы (при метастазировании опухоли в головной мозг);
- переломы и боль в костях (если имеются метастазы в костной ткани);
- кашель, одышка (при метастазах в легких).
Чтобы обнаружить отдаленные метастазы опухоли, пациентке может быть назначена ПЭТ-КТ. Этот метод визуализации представляет собой сочетание позитронно-эмиссионной и компьютерной томографии. Он дает возможность обнаружить очаги опухоли даже в тех случаях, когда их размер не превышает нескольких миллиметров.
Рак шейки матки 4 стадии в Израиле лечат с помощью химиотерапии и лучевой терапии. При этом применяется как дистанционная, так и местная лучевая терапия – брахитерапия. Назначается также комбинация химиотерапии и облучения – химиолучевая терапия. Химиотерапия может использоваться в паллиативных целях – не для полного излечения рака, а для борьбы с его симптомами. При последней стадии рака шейки матки применяются химиопрепараты:
- доцетаксел;
- ифосфамид;
- митомицин;
- гемцитабин;
- иринотекан.
Протоколы лечения могут включать также биологические препараты ниволумаб и тизотумаб-ведотин.
Стадии рака шейки матки: прогноз
Если рак шейки матки обнаружен на 1-й стадии, у 92% женщин будет шанс прожить 5 лет и более. Прогноз может быть хуже при поражении тазовых лимфатических узлов.
При 2-й стадии болезни 5-летняя выживаемость составляет 61% – при условии своевременного начатого лечения, включающего химиотерапию и лучевую терапию.
5-летняя выживаемость при обнаружении опухоли на 3-й стадии составляет 32-35%.
При 4-й стадии рака шейки матки в большинстве случаев прогноз неблагоприятный. Однако 17% больных живут 5 лет и более даже с метастатической стадией болезни.
Почему лечить рак шейки матки нужно в Израиле?
Как мы видим, программы лечения разных стадий рака шейки матки значительно различаются. Поэтому назначить лечение рака в Израиле возможно лишь после тщательной диагностики, в ходе которой будет точно установлена стадия заболевания. Опыт наших пациенток из-за рубежа показывает, что нередко в определении стадии рака шейки матки допускаются ошибки. На форумах немало рассказов о том, как израильские врачи ставят другой диагноз, отличающийся от того, который им поставили в стране проживания.
- Симптомы и проявления
- Причины возникновения
- Разновидности рака шейки матки
- Распространение в организме
- Диагностика рака шейки матки
- Лечение рака шейки матки
- Профилактика
- Прогноз
- Цены на лечение рака шейки матки
Рак шейки матки представляет собой чрезвычайно опасное злокачественное онкологическое заболевание, сокращающее жизнь пациенток в среднем на 24–30 лет.
Симптомы и проявления
На ранних стадиях рака шейки матки и при предраковых изменениях женщину ничего не беспокоит. Обычно возникновение симптомов говорит о том, что опухоль уже проросла в соседние органы.
Проявления заболевания неспецифичны и могут встречаться при других патологиях, например, урогенитальных инфекциях:
- Обильные, длительные месячные. Этот симптом имеет значение, если месячные изменились недавно, если прежде они были нормальными.
- Вагинальные кровотечения в промежутках между месячными, после полового акта, после наступления менопаузы.
- Необычные выделения из влагалища: обильные, розового цвета, с неприятным запахом.
- Тазовые боли во время полового акта.
В большинстве случаев эти проявления вызваны не онкологическим заболеванием. Но риск, пусть и небольшой, есть всегда, поэтому при возникновении первых симптомов нужно посетить врача.
На более поздних стадиях к перечисленным симптомам присоединяются такие признаки, как резкая беспричинная потеря веса, боли в пояснице и в ногах, постоянное чувство усталости, патологические переломы костей (признак костных метастазов), подтекание мочи из влагалища.
К сожалению, на начальных стадиях распространения злокачественной опухоли инвазивный рак может протекать бессимптомно, особенно если женщина не ведет половой жизни. Такие проявления, как выделения из влагалища, нарушения месячных и вагинальные кровотечения, обычно свидетельствуют о том, что опухоль распространилась только в пределах матки. Частые мочеиспускания, уменьшение объема мочеиспусканий, подтекание мочи и кала, сильные боли в животе и спине, потеря веса и одышка свидетельствуют о том, что инвазивный рак распространился на соседние органы или метастазировал.
Причины возникновения
Точные причины рака шейки матки назвать сложно. Но известны факторы риска, которые повышают вероятность возникновения рака шейки матки.
Наиболее значимый фактор риска – папилломавирусная инфекция. По разным данным, до 99% случаев рака шейки матки связаны с вирусами папилломы человека (ВПЧ). До 80% женщин в течение жизни оказываются инфицированы этим возбудителем. Всего существует около 100 типов ВПЧ, из них 30–40 передаются половым путем, лишь 165 повышают риск рака. Но это не значит, что они гарантированно вызовут рак. Типы вируса 16, 18, 31, 33, 35, 39, 45, 51, 52, 56 и 58 относят к высокоонкогенным, 6, 11, 42, 43 и 44 – к низкоонкогенным. Чаще всего виновниками рака шейки матки становятся ВПЧ 16 и 18 типов. Наиболее уязвима к ним зона трансформации (см. ниже). Помимо рака шейки матки, ВПЧ вызывают злокачественные опухоли других органов репродуктивной системы, глотки, ротовой полости, анального канала.
Другие факторы риска:
- Ослабленная иммунная система. Если иммунитет женщины работает нормально, ее организм избавляется от вируса папилломы в течение 12–18 месяцев. Но если защитные силы ослаблены, инфекция сохраняется дольше и повышает риск рака.
- Беспорядочные половые связи. Частая смена партнеров повышает вероятность заражения ВПЧ.
- Акушерский анамнез. Если у женщины было три или более беременностей, либо если первая беременность была до 17 лет, риски повышены в два раза.
- Наследственность. Если у матери или родной сестры женщины диагностирован рак шейки матки, ее риски повышены в 2–3 раза.
- Курение. Вредная привычка также повышает риски вдвое.
- Применение оральных контрацептивов в течение 5 лет и дольше. После прекращения их приема риски снижаются в течение нескольких лет.
Разновидности рака шейки матки
Чтобы понять классификацию рака шейки матки, в первую очередь нужно немного разобраться в ее анатомическом и гистологическом строении. Шейка матки имеет длину 2–3 см и состоит из двух частей:
- Влагалищная часть (экзоцервикс) выступает во влагалище, это то, что гинеколог видит во время осмотра на зеркалах. Слизистая оболочка эндоцервикса состоит из многослойного плоского эпителия.
- Цервикальный канал (эндоцервикс) находится внутри и соединяет влагалище с маткой. Он выстлан цилиндрическим эпителием.
Граница между влагалищной частью и цервикальным каналом называется зоной трансформации.
В 70–90% случаев злокачественные опухоли шейки матки представлены плоскоклеточным раком. Он развивается из многослойного плоского эпителия. Чаще всего злокачественное перерождение происходит в зоне трансформации. В зависимости от того, как выглядит опухолевая ткань под микроскопом, плоскоклеточный рак шейки матки делят на ороговевающий и неороговевающий:
- Ороговевающий плоскоклеточный рак шейки матки называется так потому, что клетки, из которых он состоит, склонны к ороговению. Они крупные, имеют неправильную форму, относительно низкую интенсивность деления. При микроскопическом исследовании обнаруживаются образования, которые называются кератогиалиновыми гранулами и “раковыми жемчужинами”.
- При неороговевающем плоскоклеточном раке шейки матки клетки не склонны к ороговению. Они крупные, имеют форму овала или многоугольника, размножаются более интенсивно.
В зависимости от того, насколько раковые клетки отличаются от нормальных, злокачественные опухоли шейки матки делят на высоко-, умеренно- и низкодифференцированные. Последние ведут себя наиболее агрессивно. Плоскоклеточный ороговевающий рак относят к зрелым формам, он встречается примерно в 20% случаев. Неороговевающий рак – это опухоли средней степени зрелости, они составляют 60-70%. Незрелая форма – это низкодифференцированный рак.
В остальных случаях рак шейки матки представлен аденокарциномой. Она развивается из железистых клеток, продуцирующих слизь. За последние 20–30 лет этот тип злокачественных опухолей стал более распространенным.
Намного реже встречаются аденосквамозные карциномы. Эти опухоли сочетают в себе черты плоскоклеточного рака и аденокарциномы. Чтобы определить тип злокачественной опухоли, нужно провести биопсию.
Инвазивным раком шейки матки называются злокачественные опухоли, которые распространяются за пределы места своей изначальной локализации, вторгаются в окружающие ткани. Фактически это синоним диагноза «рак шейки матки», так как он включает все стадии заболевания, кроме 0. В большинстве случаев его развитие связано с инфекцией, вызываемой вирусами папилломы человека: по некоторым данным эти возбудители обнаруживаются в 99,7% злокачественных опухолях.
На гистологическом уровне в 70% случаев инвазивная форма рака шейки матки представлена плоскоклеточными карциномами. В 25% случаев встречаются аденокарциномы.
Способность к инвазивному росту – вторжению в окружающие ткани – является одной из характерных особенностей, отличающих злокачественные новообразования от доброкачественных. Именно после того, как опухоль значительно распространяется за пределы изначального места своего возникновения, женщину начинают беспокоить симптомы. Выявить заболевание на самых ранних стадиях и своевременно начать лечение помогают скрининговые исследования, поэтому их регулярно нужно проходить всем женщинам, начавшим половую жизнь.
Распространение в организме
По мере роста, рак шейки матки распространяется на соседние органы. В первую очередь поражаются регионарные лимфатические узлы, окружающая клетчатка (параметрий).
Часто отмечается поражение верхней трети влагалища, что неудивительно, так как оно находится в непосредственном контакте с шейкой матки. Распространение раковых клеток происходит прямым путем при прорастании опухоли во влагалище, лимфогенно (через лимфатические сосуды), путем контактной имплантации – там, где стенка влагалища соприкасается с опухолью. Также вовлекается тело матки.
Распространение опухолевых клеток в прямую кишку, мочевой пузырь и мочеточники, как правило, происходит контактным путем.
Отдаленные метастазы чаще всего встречаются в забрюшинных лимфатических узлах, легких, костях, печени. Менее чем в 1% случаев метастазирование происходит в селезенку, почки, головной мозг.
Диагностика рака шейки матки
Высокие показатели смертности от рака шейки матки связаны с поздним выявлением заболевания: в 35–40% случаев в России диагноз впервые ставится пациенткам с III–IV стадиями болезни.
Так как рак шейки матки может долго протекать бессимптомно, своевременная диагностика возможно только при регулярном прохождении специальных обследований у гинеколога.
Согласно исследованиям ученых из Кильского университета (Великобритания), возрастных ограничений для регулярного скрининга на рак шейки матки не существует. Вопреки сложившемуся мнению, у женщин сохраняется риск развития опухоли и после 65 лет, так как вирус папилломы человека, который в подавляющем большинстве случаев становится причиной онкологического заболевания, может попасть в организм еще в период сексуальной активности, долго «дремать» и в пожилом возрасте привести к развитию рака.
Инвазивные опухоли успешно поддаются лечению, если они диагностированы на ранних стадиях. Иногда женщина сама обращается к врачу из-за симптомов, а в случае бессимптомного течения патологические изменения обнаруживаются во время скрининга. Окончательный диагноз всегда устанавливается с помощью биопсии, процедуры, во время которой врач получает образец ткани злокачественной опухоли, и затем его изучают в лаборатории под микроскопом.
Анализы на вирус папилломы человека
Проведение ПЦР-анализа на наличие вируса папилломы человека может лишь выявить наличие в организме соответствующего вируса. Для определения его способности провоцировать развитие рака шейки матки (онкогенности) и степени активности вируса в организме требуются дополнительные исследования, также проводимые методом ПЦР.
Но даже выявление ВПЧ высокого онкогенного риска не превращает рак шейки матки в нечто фатальное.Во-первых, болезнь может вообще не развиться.Во-вторых, современные технологии позволяют выявлять данную форму рака на самых ранних стадиях и с успехом лечить его, не допуская превращения предраковых изменений в собственно онкологическое заболевание. Следовательно, положительные результаты анализа на ВПЧ должны рассматриваться только как основание для регулярного наблюдения у гинеколога, знакомого с эффективными алгоритмами ведения пациенток из групп риска.
Гинекологический осмотр с кольпоскопией
Иногда рак шейки матки выявляется непосредственно во время осмотра на гинекологическом кресле. Однако так определяется, как правило, запущенный онкологический процесс. И напротив, ранние стадии заболевания обычно проходят без каких-либо заметных изменений, поэтому для своевременной диагностики рака шейки матки используются дополнительные исследования. Во время кольпоскопии влагалищную часть шейки матки осматривают с помощью кольпоскопа – прибора, напоминающего бинокль с источником освещения.
Цитологический мазок (ПАП-тест, тест Папаниколау)
Классический метод цитологического исследования шейки матки, или ПАП-тест, предполагает осторожное «соскабливание» материала особым шпателем с поверхности органа и «размазывание» его по предметному стеклу. Данный метод был разработан в начале прошлого века, в 1923 году. Для своего времени ПАП-тест демонстрировал прекрасные результаты, однако годы использования выявили ряд недостатков метода. Избирательность захвата клеток и неравномерное их распределение по стеклу могут существенно исказить результаты цитологического анализа. Таким образом, чувствительность метода составляет всего 85–95%, причем на ранних стадиях заболевания, характеризующихся небольшим количеством раковых клеток, данный показатель может быть даже ниже.
Метод жидкостной цитологии
Метод жидкостной цитологии предполагает использование специальной «щеточки», позволяющей получить материал для исследования со всей поверхности шейки матки, а не с отдельных ее фрагментов, как это происходит во время ПАП-теста.
Затем материал со «щеточки» переходит в специальный раствор, проходит обработку в особом аппарате и лишь после этого равномерно наносится на предметное стекло. Все это повышает чувствительность метода практически до 100% и исключает вероятность возникновения ошибок, характерных для ПАП-теста.
Также полученный в ходе этого анализа материал может быть использован для определения активности ВПЧ, которая является важным фактором прогноза и может влиять на тактику лечения. И, наконец, раствор с находящимися в нем клетками пригоден для проведения анализа на определение особого белка (Р16ink4a), появляющегося в клетках еще до начала непосредственно онкологического процесса. Таким образом, метод жидкостной цитологии способен не только выявить рак шейки матки, но и предупредить о повышении риска его развития. После одной-единственной процедуры в распоряжении врача появляются результаты трех точных и информативных анализов, позволяющих определить тактику и стратегию ведения конкретной пациентки.
В профилактических целях (при отсутствии жалоб) данные анализы рекомендуется проводить 1 раз в год.
Лечение рака шейки матки
Исходя из опыта клиники, сохранить матку и возможность деторождения возможно при предраковых изменениях шейки матки. При инвазивном раке одинаково широко используют лучевую терапию и хирургическое лечение — расширенная экстирпация матки с придатками.
Для борьбы с инвазивными опухолями применяются хирургические вмешательства, химиотерапия и лучевая терапия, нередко эти методы комбинируются. Лечение зависит от стадии заболевания. При ранних стадиях рака шейки матки проводится преимущественно хирургическое лечение. Во время операции производится удаление матки. Иногда операцию необходимо дополнять удалением лимфатических узлов малого таза. Вопрос об удалении яичников решается индивидуально, при ранней стадии опухоли у молодых женщин возможно оставление яичников. Не менее значимым является лучевое лечение. Лучевая терапия может как дополнять хирургическое лечение, так и являться самостоятельным методом. При ранних стадиях рака шейки матки результаты хирургического и лучевого лечения практически одинаковы. В лечении рака шейки матки может применяться химиотерапия, но к сожалению, возможности химиотерапии при инвазивном раке значительно ограничены.
При 0 стадии раковые клетки не распространяются за пределы поверхностного слоя шейки матки. Иногда эту стадию даже рассматривают как предраковое состояние. Такая опухоль может быть удалена разными способами, но при органосохраняющих вмешательствах в дальнейшем сохраняется риск рецидива, поэтому после операции показаны регулярные сдачи цитологических мазков.
Методы лечения плоскоклеточного рака шейки матки, стадия 0:
- Криохирургия – уничтожение опухоли с помощью низкой температуры.
- Лазерная хирургия.
- Конизация шейки матки – иссечение участка в виде конуса.
- Петлевая электроконизация шейки матки.
- Гистерэктомия. К ней прибегают в том числе при рецидиве злокачественной опухоли после вышеперечисленных вмешательств.
Методы лечения аденокарциномы шейки матки, стадия 0:
- Гистерэктомия.
- В некоторых случаях, если женщина планирует иметь детей, может быть выполнена конизация. При этом важным условием является негативный край резекции по данным биопсии. Впоследствии женщина должна наблюдаться у гинеколога, после родов выполняют гистерэктомию.
Выбор метода лечения всегда осуществляется индивидуально лечащим врачом.
При 1а стадии — микроинвазивный рак шейки матки — выполняют экстирпацию матки с придатками. В случаях, когда опухоль прорастает в кровеносные и лимфатические сосуды, также показано удаление тазовых лимфатических узлов. Если женщина планирует иметь детей, возможны органосохраняющие операции. При стадии Iб — рак ограничен шейкой матки — проводят дистанционное или внутриполостное облучение (брахитерапию) с последующей расширенной экстирпацией матки с придатками. В ряде случаев первоначально проводят операцию, а затем дистанционную гамма-радиотерапию.
При 2-й стадии рака шейки матки — вовлечение верхней части влагалища, возможен переход на тело матки и инфильтрация параметрия без перехода на стенки таза — основным методом лечения является лучевая терапия. Также может быть назначена химиотерапия, обычно препаратом цисплатином или его сочетанием с фторурацилом. В этом случае хирургическое лечение проводится редко.
При 3-й стадии рака шейки матки — переход на нижнюю часть влагалища, инфильтрация параметрия с переходом на кости таза — показана лучевая терапия.
При 4-й стадии (переход рака на мочевой пузырь, прямую кишку или отдаленное метастазирование) применяют лишь паллиативное облучение. У пациентов на поздних стадиях рака шейки матки с метастазами лечение носит паллиативный характер, возможно применение химиотерапевтического лечения. В большинстве случаев схема химиотерапии предусматривает применение одного из препаратов платины (карбоплатин или цисплатин) в сочетании с гемцитабином (Гемзар), паклитакселом (Таксол) или топотеканом.
Профилактика
Один из главных факторов риска рака шейки матки — вирус папилломы человека. Поэтому меры профилактики в первую очередь должны быть направлены на предотвращение заражения:
- Беспорядочные половые связи нежелательны, особенно с мужчинами, у которых было много партнерш. Это не защищает от заражения на 100%, но все же помогает сильно снизить риски.
- Презервативы помогут защититься не только от ВПЧ, но и от ВИЧ-инфекции. Стопроцентную защиту они тоже не обеспечивают, потому что не могут полностью исключить контакт с инфицированной кожей.
- Вакцины против ВПЧ — хорошее средство профилактики, но они работают лишь в случае, если женщина пока еще не инфицирована. Если вирус уже проник в организм, вакцина не поможет. Девочек начинают прививать с 9–12 лет.
Второй фактор риска, который связан с образом жизни, и на который можно повлиять — курение. Если вы страдаете этой вредной привычкой, от нее лучше отказаться.
Огромное значение имеет скрининг — он помогает вовремя выявить предраковые изменения и рак шейки матки на ранних стадиях. Нужно регулярно являться на осмотры к гинекологу, проходить PAP-тест и сдавать анализы на ВПЧ.
Основным прогностическим фактором выживаемости пациенток при раке шейки является степень распространенности процесса. Поэтому самым эффективным средством против развития рака являются регулярные профилактические осмотры у специалистов.
Прогноз
Ориентировочный прогноз определяют на основании статистики. Среди женщин, у которых был диагностирован рак шейки матки, подсчитывают процент выживших в течение определенного времени, как правило, пяти лет. Этот показатель называют пятилетней выживаемостью. Он зависит от того, на какой стадии было выявлено онкологическое заболевание. Чем раньше диагностирован рак и начато лечение — тем лучше прогноз:
- При локализованных опухолях (рак не распространяется за пределы шейки матки, соответствует I стадии) пятилетняя выживаемость составляет 92%.
- При опухолях, которые распространились на близлежащие структуры (стадии II, III и IVA) — 56%.
- При метастатическом раке (стадия IVB) — 17%.
- Средняя пятилетняя выживаемость при всех стадиях рака шейки матки — 66%.
Несмотря на низкие показатели пятилетней выживаемости, рак с метастазами — это не повод опускать руки. Существуют методы лечения, которые помогают затормозить прогрессирование заболевания, продлить жизнь, справиться с мучительными симптомами. Врачи сети клиник «Евроонко» знают, как помочь.
Цены на лечение рака шейки матки
- Консультация онколога — 5 100 руб.
- Консультация химиотерапевта — 6 900 руб.
- Конизация шейки матки — 42 900 руб.
- Влагалищная экстирпация матки — 254 600 руб.
- Проведение иммунотерапии (без стоимости лекарственных препаратов) — 24 700 руб.
Список литературы:
- https://www.cancer.gov
- https://www.ncbi.nlm.nih.gov
- https://www.uptodate.com
- https://www.medicinenet.com
Результат цитологии при различных злокачественных заболеваниях зависит от их стадии и ткани, из которой развилась опухоль.
Виды рака шейки матки, обнаруживаемого с помощью анализа на цитологию
На шейке матки чаще всего образуются два вида рака:
- Плоскоклеточная карцинома развивается из многослойного плоского эпителия.
- Железистые опухоли (аденокарциномы) развиваются из эпителия цервикального канала, проходящего внутри шейки. Эти злокачественные новообразования развиваются гораздо быстрее и агрессивнее плоскоклеточного рака.
Плоскоклеточная карцинома в свою очередь делится на два типа рака:
- Плоскоклеточный ороговевающий, содержащий ороговевшие клетки – дискератоциты.
- Плоскоклеточный неороговевающий – в таких опухолях дискератоциты отсутствуют.
Существуют также переходные формы онкологии, происходящие из нескольких типов тканей шейки матки. Могут обнаруживаться и другие виды злокачественных опухолей. Некоторые из них – саркома, меланома возникают на здоровой шейке, не поражённой дисплазией.
Врачи-цитологи выявляют рак по картине мазка. Специалист оценивает количество клеток, их расположение, форму, размер, строение и сравнивает со здоровыми. Это позволяет выявить злокачественные клетки, которые отличаются от нормы по строению, размеру и другим признакам . Сведения заносятся в бланк результатов цитологии, который потом нужно расшифровать у врача-онколога.
Чем отличаются клетки с признаками атипии от злокачественных
В отличие от клеток с признаками атипии – незначительными изменениями, которые могут быть вызваны воспалением или другими заболеваниями, злокачественные клетки значительно отличаются от здоровых.
Иногда они настолько изменены, что врачу-цитологу сложно определить из какой ткани образовалась опухоль.
Как выглядят раковые клетки при проведении цитологии шейки матки
Раковые клетки отличаются от нормальных. У них наблюдаются:
- Полиморфизм. В мазке обнаруживаются клетки одной ткани, имеющие разные размеры, форму и строение.
- Анизоцитоз. Уменьшение или увеличение размера клеток.
- Анизокариоз. Увеличение или уменьшение размера ядер – центрального клеточного элемента, который содержит генетический материал и необходим для деления клеток.
- Изменение формы и количества ядер в клетке. При раке они могут быть неправильными, бесформенными, с неровными контурами. Обнаруживаются двухъядерные и многоядерные клетки. Иногда могут наблюдаться только ядра «потерявшие» остальные клеточные элементы.
- Изменения в цитоплазме. При окрашивании жидкая часть клетки (цитоплазма) имеет неравномерную окраску.
Поскольку раковые опухоли характеризуются усиленным ростом, в образце, взятом на цитологию шейки матки, обнаруживаются делящиеся клетки, причём деление часто происходят с нарушениями. Такое явление называется атипичным митозом.
Чем менее зрелые клеточные структуры обнаруживаются в мазке, тем ниже дифференцировка опухоли. Этот показатель обозначается буквой G, а стоящая рядом цифра указывает на степень дифференцировки. Чем она больше, тем злокачественнее рак.
Основные характеристики клеток, обнаруживаемых при основных типах рака шейки матки
| Тип рака | Плоскоклеточный (карцинома) | Железистый (аденокарцинома | Прогноз |
| Высокодифференцированный (G1) | Более 75% клеток крупные, хорошо сформированные. Делящихся мало | Опухоль содержит не менее 75% хорошо сформированных одинаковых овальных клеток. Делящихся мало | Самый благоприятный вариант – высокодифференцированный плоскоклеточный рак, сформированный из клеток наружной поверхности шейки матки.
Аденокарцинома, происходящая из цилиндрического эпителия цервикального канала более агрессивна, но при своевременном обнаружении достаточно успешно лечится |
| Умереннодифференцированный (G2) | Опухоль состоит из крупных клеток, не менее 50% которых хорошо сформированы.
В мазке обнаруживается больше делящихся клеток, чем при высокодифференцированном раке |
В опухоли находится более половины хорошо сформированных клеток.
Обнаруживаются делящиеся клетки, в том числе, с нарушением деления |
Прогноз при такой форме рака хуже, чем при высокодифференцированном раке, но на ранних стадиях такие опухоли успешно лечатся |
| Низкодифференцированный G3 | В мазке обнаруживаются мелкие неправильно развитые клетки с деформированными клеточными структурами. Дифференцированных среди них не более 25%. Большое количество клеток в стадии деления, в том числе неправильного | Клетки крупные с деформированными неравномерно окрашенными ядрами.
Много делящихся, в том числе, с нарушением процесса деления |
Прогноз неблагоприятный. Полностью вылечить такую опухоль можно только на самой ранней стадии |
Существуют также более редкие опухоли шейки матки, например саркома или меланома. Их клетки имеют определенное строение, по которому их обнаруживают при проведении цитологии. Некоторые новообразования настолько редки, что их может выявить только опытный цитолог с большим стажем работы. Такие образования могут иметь самую разную степень злокачественности – от крайне низкой, до очень высокой.
Злокачественные клетки в мазке располагаются в виде скоплений-комплексов или пучков. При этом они могут наслаиваться друг на друга. Скопления злокачественных клеток имеют разную форму, напоминающую пчелиные соты, розетки, шары, пласты. Иногда наблюдаются бесформенные комплексы.
У женщины с раком шейки матки в мазке обнаруживаются примеси крови, белые кровяные тельца (лейкоциты), слизь и микроорганизмы. Такой фон мазка врачи-цитологи называют “грязным”.
При обнаружении рака в заключении указывается наличие клеток с выраженными признаками атипии или дистрофическими изменениями. Врач перечисляет, какие клетки обнаружены, указывая среди них злокачественные. При отсутствии медицинского образования, разобраться в таком заключении очень сложно. Для расшифровки результата нужны знания в области цитологии и гинекологии. Поэтому правильную интерпретацию может дать только врач гинеколог-онколог.
Диагноз, выставленный в бланке результатов цитологии подтверждается с помощью биопсии – взятия фрагмента ткани на анализ. Такой образец проходит другое клеточное исследование – гистологию, при которой исследуется не только строение клеток, но и всей ткани. Это позволяет поставить правильный диагноз.
Продолжение статьи
- Интерпретация (расшифровка) результатов цитологии
- Расшифровка цитологии: интерпретация лицевой стороны единого бланка
- Расшифровка цитологии: интерпретация данных по результатам цитологического анализа
- Расшифровка цитологии: интерпретация результатов цитологического анализа согласно их классификации по Папаниколау
- Интерпретация зарубежной терминологии, используемой для расшифровки цитологии
- Расшифровка цитологии: интерпретация протокола цитологического обследования при дисплазии шейки матки
- Расшифровка результатов цитологии при предраковых патологиях
- Расшифровка цитологии: что делать, если анализ на цитологию шейки матки выявил предрак
- Расшифровка цитологии: дальнейшие действия при плохой интерпретации анализов
Вам поставили диагноз: рак шейки матки?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор рака шейки матки.Его подготовили высоко квалифицированные специалисты онкогинекологического отделения МНИОИ имени П.А. Герцена под редакцией д.м.н., профессора Елены Новиковой и отделения новых медицинских технологий с группой лечения заболеваний молочной железы МРНЦ имени А.Ф. Цыба под редакцией д.м.н., профессора Марины Киселёвой.
Данная брошюра содержит информацию о диагностике и лечении рака шейки матки. Здесь собраны основные методики лечения данного заболевания, в том числе, последние разработки отечественных и зарубежных ученых-онкологов.
Ежегодно в России выявляется более 17 тысяч новых случаев заболевания раком шейки матки, данное заболевание поддаётся полному излечению, если болезнь выявлена на ранних стадиях.
Мы хотим Вам помочь победить рак!
Введение
Несмотря на визуальную локализацию, наличие сформировавшихся классических подходов в профилактике, диагностике и лечении, рак шейки матки остаётся одной из самых актуальных проблем современной онкогинекологии.
Анатомия органа — Анатомия матки
Шейка матки представляет собой полый цилиндр, длиной 2-4 см, относящийся к нижнему сегменту матки.
Выделяют надвлагалищную и влагалищную порции шейки матки.На приеме у гинеколога проводится осмотр в зеркалах влагалищной порции шейки матки.
Статистика (эпидемиология) рака шейки матки
Выделяют следующие гистологические типы:
1. Цервикальная интраэпителиальная неоплазия III степени.
2. Плоскоклеточная карцинома in situ.
3. Инвазивная плоскоклеточная карцинома:
ороговевающая;
неороговевающая;
веррукозная.
4. Аденокарцинома in situ.
5. Инвазивная аденокарцинома.
6. Эндометриоидная аденокарцинома.
7. Светлоклеточная аденокарцинома.
8. Аденоплоскоклеточная аденокарцинома.
9. Аденокистозная карцинома.
10. Аденоидная базальная карцинома.
11. Мелкоклеточная карцинома.
12. Нейроэндокринная опухоль.
13. Недифференцированная карцинома.
Степень дифференцировки
G0 – степень дифференцировки не может быть определена.
G1 – высокая степень дифференцировки.
G2 – умеренная степень дифференцировки.
G3 – низкая степень дифференцировки.
G4 – недифференцированная опухоль.
Стадии и симптоматика рака шейки матки
Клинические проявления начальных форм рака шейки матки отсутствуют. Патогномоничными симптомами являются контактные кровяные выделения из половых путей и ациклические кровотечения. На более поздних стадиях заболевания па¬циентки могут предъявлять жалобы на гноевидные, зловонные вы¬деления из половых путей, боли в поясничной области, лихорадку, похудание и нарушение функции соседних органов.
| TNM (8й пересмотр) | FIGO (2009) | КРИТЕРИИ |
|---|---|---|
| Tx | Недостаточно данных для оценки первичной опухоли | |
| T0 | Первичная опухоль не определена | |
| Tis | 0 | Преинвазивная карцинома (карцинома in situ) |
| T1 | I | Опухоль ограничена шейкой матки |
| T1a | IA | Инвазивная карцинома, диагностирующаяся микроскопически, с наибольшей глубиной инвазии ≤ 5 мм и наибольшей протяженностью ≤ 7 мм |
| T1a1 | IA1 | Стромальная инвазия ≤ 3 мм и протяженность ≤ 7 мм |
| T1a2 | IA2 | Стромальная инвазия >3 мм и ≤ 5 мм и протяженность ≤ 7 мм |
| T1b | IB | Клинически видимая опухоль или преклиническая опухоль более чем стадия IA |
| T1b1 | IB1 | Клинически видимая опухоль ≤ 4 см при наибольшем измерении |
| T1b2 | IB2 | Клинически видимая опухоль > 4 см при наибольшем измерении |
| T2 | II | Опухоль шейки матки выходит за пределы матки, но не вовлекает стенку малого таза или нижнюю треть влагалища |
| T2a | IIA | Параметральная инвазия отсутствует |
| T2a1 | IIA1 | Клинически видимая опухоль ≤ 4 см при наибольшем измерении |
| T2a2 | IIA2 | Клинически видимая опухоль > 4 см при наибольшем измерении |
| T2b | IIB | Опухоль с параметральной инвазией |
| T3 | III | Опухоль распространяется на стенку малого таза и/или вовлекает нижнюю треть влагалища и/или является причиной гидронефроза или нефункционирующей почки |
| T3a | IIIA | Опухоль вовлекает нижнюю треть влагалища, но не распространяется на стенку малого таза |
| T3b | IIIB | Опухоль распространяется на стенку малого таза и/или является причиной гидронефроза или нефункционирующей почки |
| T4 и/или М1 | IV | Опухоль распространяется за пределы малого таза или вовлекает слизистую оболочку мочевого пузыря или прямой кишки (биопсия). Буллезный отек не является признаками IV стадии |
| T4 | IVA | Опухоль распространяется на смежные органы |
| M1 | IVB | Опухоль распространяется на отдаленные органы |
| N — регионарные лимфатические узлы | ||
| Nx | Недостаточно данных для оценки состояния лимфатических узлов | |
| N0 | Нет признаков поражения метастазами регионарных лимфатических узлов | |
| N1 | IIIB | Метастазы в регионарных лимфатических узлах |
| М — отдаленные метастазы | ||
| Mx | Отдаленные метастазы не могут быть оценены | |
| M0 | Нет признаков отдаленных метастазов | |
| M1 | IVB | Имеются отдаленные метастазы |
Причины возникновения и факторы риска рака шейки матки
В последние годы на острие проблемы вирусного канцерогенеза шейки матки переместилась папилломовирусная инфекция человека, по распространённости в развитых странах расцениваемая как наиболее частый вид инфекции, передающаяся половым путём, уровень инфицированности которой превосходит таковую гонококками, хламидиями и дрожжевой инфекцией.
В настоящее время идентифицировано более 200 штаммов вируса папилломы человека (ВПЧ). На основании вероятности вызывать предраковые изменения и инвазивный рак типы ВПЧ сгруппированы следующим образом: вирусы низкого онкологического риска – 6, 11, 40, 42–44, 61; среднего риска – 30, 35, 39, 45, 52, 53, 56, 58; высокого риска – 16, 18, 31, 33.
Вирусы низкого онкологического риска выявляют преимущественно при остроконечных и плоских кондиломах, слабой дисплазии и редко при инвазивном раке. Вирусы высокого онкологического риска обнаруживают в 95–100% преинвазивных и инвазивных форм рака шейки матки.
При плоскоклеточном раке чаще всего (более чем в 50% наблюдений) находят ВПЧ типа 16, при аденокарциноме и низкодифференцированном раке шейки матки – ВПЧ типа 18.
Скрининг рака шейки матки
Локализация рака шейки матки удовлетворяет всем требованиям для проведения популяционного скрининга. Цитологическое исследование мазков с шейки матки и из цервикального канала – надёжный скрининг-тест. Применение скрининговых программ обследования населения позволяет выявлять заболевание на стадии предрака или в начальной форме рака. Материал для цитологического исследования получают с влагалищной порции шейки матки, из зоны переходного эпителия, из цервикального канала таким образом, чтобы в нём оказались клетки не только поверхностного, но и подлежащих слоёв.
Скрининг рака шейки матки необходимо начинать после первого полового контакта. Периодичность скрининга: ежегодно в течение первых 2 лет, при отрицательных мазках далее каждые 2–3 года. Прекращение скрининга возможно у женщин 70 лет и старше с интактной шейкой матки, имевших 3 и более зарегистрированных последовательных отрицательных результатов цитологических исследования в последние 10 лет.
Диагностика рака шейки матки
Шейка матки доступна для визуальных и инвазивных методов диагностики, что способствует обнаружению рака на ранних стадиях заболевания. Применение скрининговых программ обследования населения (цитологическое исследование мазков с шейки матки и из цервикального канала) позволяет выявлять заболевание на стадии предрака или в начальном проявлении.
Следующий этап диагностики – кольпоскопическое исследование, которое позволяет изучать состояния эпителия шейки матки при 7,5–40-кратном увеличении. Правильно оценённая кольпоскопическая картина позволяет выявить зону поражения и выполнить прицельную биопсию подозрительного участка. При проведении биопсии необходимо соблюдать ряд условий: биопсию выполняют после кольпоскопии и сопровождают выскабливанием шеечного канала, которому предшествует цервикоскопия, позволяющая визуально оценить эндоцервикс.
С помощь этих манипуляций при наличии рака определяют уровень поражения (инвазию) и стадию опухолевого процесса. Биопсию необходимо производить скальпелем или петлей аппарата «Сургитрон. При выполнении биопсии нужно по возможности удалить весь подозрительный участок, отступя от его границ, не повреждая эпителиальный пласт, захватывая строму шейки матки не менее чем на 5 мм. По гистологической структуре преобладают плоскоклеточые формы (70-75%), аденокарциномы составляют около 20%, низкодифференцированный рак – 10%. (Гистологическая классификация см выше).
В диагностический алгоритм, определяющий стадию опухолевого процесса, входят УЗИ, рентгенография лёгких, цистоскопия, ирригоскопия, определение уровня опухолевого маркёра SCC. В качестве уточняющей диагностики выполняют КТ, МРТ, ПЭТ КТ.
Профилактика рака шейки матки
Основной способ профилактики рака шейки матки – своевременное выявление фоновых, особенно предраковых, процессов и их лечение. Наиболее подвержены раку шейки матки пациентки с предраковыми заболеваниями, инфицированные ВПЧ.
Не менее важно использование барьерных средств контрацепции, препятствующих распространению инфекций, передающихся половым путём, к которым относят и папилломовирусную инфекцию.
Учитывая этиологический фактор рака шейки матки, трудно переоценить актуальность вакцинопроцилактики HPV -инфекции. В Российской Федерации зарегистрировано 2 вакцины: Гардасил и Церварикс. Первая содержит вирусоподобные частицы против 6, 11, 16, 18 онкогенных типов, а вторая – против 16 и 18. Общепринятой тактикой вакцинации является: введение вакцины девочкам от 9 до 13 лет (до начала половой жизни), введение вакцины молодым женщинам, ведущим активную половую жизнь (20 лет и старше). В тоже время введение вакцины всем пациенткам заболевшим раком шейки матки обсуждается и не лишено смысла.
При высоких цифрах охвата вакцинацией (Великобритания, Австралия и др.) отмечен очень высокий противоопухолевый эффект в течение около 8 лет (фактически отсутствие случаев ВПЧ-ассоциированного рака шейки матки). В России вакцина вводится по желанию пациентки (или согласию матери девочки), в список обязательной вакцинации последняя пока не включена.
Хирургическое лечение рака шейки матки
Рак шейки матки in situ – IA1 без сосудистой инвазии: в молодом возрасте показана конизация шейки матки с удалением дополнительного конуса вверх по ходу цервикального канала. Операция может быть выполнена радиоволновым скальпелем – LEEP, «эксцизия» с последующим выскабливанеим цервикального канала. Возможно выполнение высокой ножевой ампутации шейки матки с наложением швов на культю.
Рак шейки матки in situ – IA1 с признаками сосудистой инвазии, IA2 – IB1 (опухоль менее 2 см): выполняется радикальная трахелэктомия у молодых пациенток, желающих сохранить репродуктивную функцию. Объем удаления параметральных тканей должен соответствовать таковому при операции типа Вертгейма, однако с целью сохранения репродуктивной функции остается матка с придатками. Наложенный маточно-влагалищный анастомоз позволяет восстановить «анатомическую проходимость» из влагалища в матку. Операция может быть выполнена абдоминальным, влагалищным, влагалищным в комбинацией с абдоминальным доступами, в том числе и лапароскопически.
Имеются строгие критерии отбора больных для осуществления данной операции:
• Мотивация пациентки к органосохранному лечению
• Сохраненный овариальный резерв
• Размер опухоли ≤ 20 мм, стромальная инвазия ≤ 10 мм
• Плоскоклеточный рак или аденокарциинома
• Интактность верхней трети шеечного канала
• Отсутствие признаков метастатического поражения регионарных лимфатических узлов
• Возможность динамического наблюдения
Больным раком шейки матки IB — IIA стадиями показано выполнение радикальной гистерэктомии С2 типа и тазовой лимфодиссекции. Это хирургическое вмешательство является общепринятым стандартом хирургического лечения инвазивного рака шейки матки. Возможно, выполнение радикальной гистерэктомии С1 типа и тазовой лимфодиссекции. Эта операция предотвращает нейрогенную дисфункцию мочевого пузыря и прямой кишки, вследствие сохранения всей целостности вегетативных нервных сплетений малого таза.
Лучевая терапия рака шейки матки
Дистанционная лучевая терапия – наружное облучение малого таза. Применение методик дистанционной лучевой терапии зависит от стадии заболевания, распространенности процесса, конституционных особенностей больной и дифференцированного лучевого воздействия, как на первичный очаг, так и на зоны регионарного метастазирования.
Проводится одновременное облучение, как первичного опухолевого очага, так и путей распространения опухоли. Облучение ежедневное, 5 раз в неделю. Разовая очаговая доза – 2,0 – 2,2 гр., в неделю – 10,0 – 11,0 гр. облучение проводится в течение 4-6 недель, при достижении суммарной очаговой дозы (СОД) до 50-60 Гр.
Внутриполостная гамма-терапия проводится на брахитерапевтических аппаратах высокой мощности дозы, на культю влагалища 2-3 раза в неделю, СОД – 21-25Гр.
Химиолучевая терапия — при местно-распространенном раке шейки матки в настоящее время является стандартом лечения. По оценкам исследователей использование цистостатиков с целью радиосенсибилизации опухоли улучшает показатели общей выживаемости на 10% для I-II стадий и на 3% для III/IVА стадий.
Лекарственное противоопухолевое лечение рака шейки матки
Роль химиотерапии (ХТ) при данной локализации изучена менее полно и чаще всего она применяется у больных с рецидивирующим и метастатическим раком шейки матки (с метастазами в тазовые и парааортальные лимфоузлы, отдаленные органы, имеющих малые шансы на излечение стандартными методами). В настоящее время той или иной активностью в отношении рака шейки матки обладают не более 50 цитостатиков. Самым активным препаратом в отношении местно-распространенного рака является цисплатин.
Осложнения противоопухолевого лечения и их коррекция:
интраоперационные осложнения включают в себя травму кровеносных сосудов малого таза, мочеточника, мочевого пузыря, прямой кишки или обтураторного нерва. Целостность поврежденных органов должна быть восстановлена интраоперационно. Полное пересечение обтураторного нерва не несет серьезных проблем для восстановления его целостности.
К ранним послеоперационным осложнениям в первую очередь следует отнести инфекционные осложнения со стороны мочевыделительной системы. Наиболее часто диагностируются послеоперационный цистит и пиелонефрит, что является следствием длительной катетеризации мочевого пузыря.
По данным современной периодической литературы мочеполовые свищи: пузырно-влагалищные, мочеточниково-влагалищные и наружные мочеточниковые, встречаются приблизительно в 0,4% – 5,4% наблюдений.
Фебрильная лихорадка в ранние сроки после операции связана с развитием ателектаза или раневой инфекцией.
Тромбоз вен нижних конечностей в среднем диагностируется в 2,6% наблюдений. Необходимо подчеркнуть, что при проведении профилактического ультразвукового исследования сосудов нижних конечностей риск развития тромбоэмболии легочной артерии является крайне низким.
Нейрогенная дисфункция мочевого пузыря относится к наиболее частым, тревожащим пациентов, поздним послеоперационным осложнениям. Женщины предъявляют жалобы на необходимость почасового опорожнения мочевого пузыря с использованием мышц живота, эпизоды недержания мочи, не возможность самостоятельного мочеиспускания с применением самостоятельной катетеризации мочевого пузыря.
Внутриартериальная химиотерапия рака шейки матки — запатентованный метод лечения МНИО им. Герцена
Лекарственное противоопухолевое лечение
В Отделение интервенционной онкологии и эндоваскулярной хирургии МНИОИ имени П.А. Герцена — филиала ФГБУ «НМИЦ радиологии» Минздрава России применяется запатентованный метод – « Способ комбинированного лекарственного лечения пациенток с первично нерезектабельным местно-распространённым плоскоклеточным раком шейки матки IB2 и III b. Данная стадия опухоли является неоперабельной. Однако изобретение позволяет создать максимальную концентрацию цитостатика непосредственно в опухолевой ткани и одновременно реализовать системное воздействие химиотерапии, в результате чего происходит резорбция опухоли и перевод процесса в резектабельное состояние.
Плюс внутриартериальной химиотерапи рака шейки матки : *достигается уменьшение объема опухоли; *снижение болевого синдрома; *прекращение или уменьшение кровотечения из наружных половых путей; *возможность перевода нерезектабельной стадии в резектабельную, с выполнением радикального хирургического лечения.
Данный метод лечения хорошо себя зарекомендовал и имеет хорошие прогнозы выживаемости и улучшение качества жизни пациентов – более 3-х лет и даже 5 лет.
Клинический пример:
Пациентка Г., 54 года. У гинеколога наблюдалась с 2008 года (патологии со слов больной не выявлено). С июля 2015 г. на фоне 3 лет менопаузы появились обильные выделения из половых путей серозного характера с неприятным запахом. Пациентка обратилась к гинекологу по месту жительства, заподозрен рак шейки матки, выполнена биопсия. Гистологическое исследование — инфильтративный плоскоклеточный неороговевающий рак. Для дообследования и лечения обратилась в МНИОИ им. П.А. Герцена.
По данным МРТ малого таза шейка матки баллонообразно расширена, в ней определяется неоднородной структуры образование р-ми 48×34×38 мм, распространяющееся на задний свод и верхние отделы стенки влагалища, преимущественно в правых отделах, на небольшом протяжении — на передний свод, строма шейки и цервикальный канал практически не дифференцируются. Наружные контуры шейки четкие, но на небольшом протяжении отсутствует жировая прослойка между ней и прямой кишкой (нельзя исключить прорастание опухоли). Увеличенных лимфоузлов в зоне исследования не выявлено. Признаков инфильтрации параметрия на момент исследования не выявлено. В остальном — без патологии.
В декабре 2015 г. проведен консилиум. С учетом распространенности опухолевого процесса и невозможности операции выработан план условно комбинированного лечения с проведением на первом этапе химиотерапии с использованием комбинированного суперселективного внутриартериального введения препаратов и внутривенное введение таксанов.
После соответствующей предоперационной подготовки согласно клиническим рекомендациям Европейского общества онкологов. Внутриартериально поочередно в левую и правую маточные артерии вводили цисплатин. После премедикации вводили внутривенно паклитаксел.
Интервал между курсами внутриартериальной химиотерапии 21 день.
Лечение пациентака перенесла удовлетворительно.
Спустя 3 недели по данным МРТ органов малого таза после реализации регионарного лечения: шейка матки с ровными и четкими контурами, размерами 31×28×18 мм (ранее 48×34×38 мм), структура миометрия однородная. В остальном — без патологии.
Заключение : выраженная положительная динамика в сравнении с описательными данными — полная резорбция опухоли.
Опухолевый ответ оценивался по критериям RECIST 1.1. Отмечена полная регрессия опухоли.
Через 21 день после проведения регионарной химиотерапия пациентка поступила в отделение онкогинекологии МНИОИ им. П.А. Герцена, где выполнено хирургическое лечение.
При контрольном наблюдении через 1 год после проведенного комбинированного лечения по описанной выше методике — рецидива опухоли не наблюдается.
Новые методы лечения рака шейки матки
Фотодинамическая терапия (ФДТ) — возможности ФДТ в лечении CIN стали исследовать с 90-х годов прошлого столетия, когда стали проводить попытки оптимизации режимов фотодинамического воздействия на патологический эпителий в качестве альтернативного метода селективного разрушения ткани с сохранением фертильности женщин. Во всех исследованиях были получены высокие результаты ФДТ в лечении CIN различной степени выраженности (более 90%). В то же самое время метод обладает и значительной противовирусной эффективностью по сравнению с альтернативными методами лечения ПВИ (диатермо- и радиокоагуляция, криодеструкция, лазерная вапоризация), где процент эрадикации ВПЧ составляет от 7 до 77%.
Высокие результаты противоопухолевой и противовирусной направленности фотодинамического воздействия обусловлены методикой лечения, заключающейся в облучении цервикального канала на всем его протяжении и всей площади влагалищной порции шейки матки с захватом сводов влагалища. Такой подход позволяет достичь деструкции очагов предрака и начального рака в 94% наблюдений и элиминации генитальных типов ВПЧ у 95,6% женщин.
ФДТ следует проводить после органосохранного лечения предопухолевых и начальных опухолевых изменений в шейке матки с целью эрадикации ВПЧ и профилактики рецидивов заболевания. Методика облучения заключается в фотодинамическом воздействии не только на культю шейки матки, но и на цервикальный канал, своды и верхнюю треть стенок влагалища.
Такой подход обеспечивает эффективное воздействие на папилломавирусы, персистирующие не только в зоне первичного поражения, некроза, но и во внешне неизмененных тканях, прилежащих или окружающих край резекции или деструкции. Таким образом, ФДТ вирус-ассоциированого предрака и начального рака является «минимальным вариантом» органосберегающего лечения с одновременным противоопухолевым и противовирусным воздействием.
Особенности реабилитации рака шейки матки
Для большинства больных раком шейки матки ведущим методом лечения является радикальная операция. Использование современных методик, направленных на предотвращение нарушений функции мочевого пузыря и прямой кишки приобретают большую роль в раннем послеоперационном периоде, улучшая сроки восстановления после хирургического вмешательства и повышая качество жизни пациенток.
Зачастую женщины со злокачественными новообразованиями женской половой сферы сталкиваются с развитием психогенных реакций. В связи с чем, крайнюю значимость приобретает включение в комплекс реабилитационных мероприятий консультации психолога, которые необходимо проводить не только в период обследования и лечения, но и в течение длительного времени после выписки больного из стационара.
Прогноз заболевания: рака шейки матки
Выживаемость пациенток непосредственно связана со стадией заболевания, 5-летняя выживаемость при I стадии составляет 88,8%, при II – 74%, при III – 51,4%, при IV – 7,8%, при всех стадиях – 81,9%. После комбинированного лечения 5-летняя выживаемость больных раком шейки матки достигает высоких цифр, что связано с совершенствованием методов терапии, а также соблюдением принципов дифференцированного подхода к выбору метода лечения. Вместе с тем степень распространения опухолевого процесса остаётся одним из основных прогностических факторов. Поэтому улучшение результатов лечения достигают в основном за счёт увеличения продолжительности жизни больных раком I и II стадии, в то время как показатели таковой при III стадии остаются стабильными.
Рак шейки матки: причины появления, симптомы, диагностика и способы лечения.
Определение
Рак шейки матки (РШМ) — это заболевание женской репродуктивной системы, характеризующееся развитием на шейке матки злокачественной опухоли, прорастающей из слизистой оболочки шейки матки (цервикального канала или эктоцервикса).
Шейка матки – это мышечно-соединительнотканный орган, покрытый эпителиальной тканью, который соединяет влагалище с телом матки, и представляющий собой полый цилиндр размером 2-6 см. Его нормальное функционирование влияет на сексуальную жизнь, способность к зачатию, протекание беременности и нормальные роды. Шейка матки состоит из плотной мышечной ткани, которая расслабляется к моменту овуляции, чтобы сперматозоиды свободно проникли к яйцеклетке, и плотно смыкается во время беременности, чтобы ребенок не родился раньше времени.
На сегодняшний день РШМ входит в пятерку самых распространенных онкологических заболеваний и занимает 5-е место среди поражений женской половой сферы.
В России ежегодно выявляется около 18 000 новых случаев, причем до 40% патологический процесс определяется на поздних (III–IV) стадиях заболевания. В последние годы в нашей стране отчетливо выражена тенденция роста заболеваемости РШМ у женщин моложе 35 лет.
Причины появления рака шейки матки
Развитие рака шейки матки не связано с наличием известных наследственных синдромов. Врачи считают основной причиной заболевания вирус папилломы человека (ВПЧ) онкогенных генотипов.
В России у большинства пациенток с РШМ обнаруживаются преимущественно вирусы 16 и/или 18 типов.
ВПЧ привносит свои гены в строение клеток ДНК, они перестают созревать и могут активно делиться. В результате на месте мутировавшей клетки появляется злокачественная опухоль. Со временем она увеличивается и метастазирует.
В качестве факторов риска развития данной патологии рассматриваются:
- раннее начало половой жизни;
- беспорядочная смена сексуальных партнеров;
- отказ от барьерных контрацептивов;
- длительное применение гормональной контрацепции;
- иммуносупрессивная терапия при аутоиммунных заболеваниях и лечении онкологических заболеваний других локализаций;
- инфекции, передающиеся половым путем: генитальный герпес, ВИЧ, хламидиоз;
- длительная зависимость от курения.
Наибольший процент инфицирования и, соответственно, заболеваемости РШМ наблюдается среди молодых женщин, скорее всего, ввиду их большей сексуальной активности.
Классификация заболевания
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем МКБ-10: C53 – Злокачественное новообразование шейки матки.
Клиническая стадия РШМ устанавливается до начала специальной терапии, что необходимо для выбора метода и планирования лечения.
Стадия 0
. Раковые клетки находятся только на поверхности канала шейки матки. На этом этапе они еще не образуют опухоль и не проникают вглубь тканей.
Стадия I
. Опухоль локализована в шейке, может прорастать в матку и близлежащие лимфоузлы. Новообразование не выходит за пределы органа и не распространяется на другие внутренние органы.
Стадия II
. Новообразование проникает в тело матки или выходит за ее пределы, распространяется на верхние отделы влагалища. В опухолевый процесс не вовлечены стенка таза и нижняя треть влагалища, не затронуты окружающие органы и лимфоузлы.
Стадия III
. Опухоль поражает нижнюю треть влагалища и стенки таза, может блокировать мочеточники, достигать крупных размеров и поражать ближайшие лимфоузлы.
Стадия IV
. Опухоль широко распространена вокруг шейки матки, поражены лимфоузлы, мочевой пузырь, прямая кишка, другие отдаленные органы.
У каждой стадии есть несколько подстадий – А1, А2, В1 и т. д. Их используют врачи при постановке точного диагноза.
Гистологически различают 2 основные группы РШМ: плоскоклеточный рак (70-80%), железистый, или аденокарцинома (10-20%). Приблизительно в 10% случаев выявляют низкодифференцированный рак. Другие гистологические типы злокачественных опухолей этой локализации составляют не более 1%. Наиболее злокачественный и крайне редкий тип РШМ – саркома.
Симптомы рака шейки матки
На начальных стадиях онкологический процесс протекает бессимптомно и обнаруживается только при расширенном гинекологическом осмотре. К признакам того, что опухоль проросла через верхний слой слизистой в подлежащие ткани, можно отнести:
- кровянистые выделения или влагалищные кровотечения – контактные (после полового акта) и спонтанные;
- водянистые обильные бели (лейкорея);
- продолжительные, обильные и болезненные менструации;
- вагинальные кровотечения в менопаузе;
- боль при половом акте;
- болезненные мочеиспускания;
- продолжительные спазмические боли внизу живота и области матки, отдающие в поясницу.
Нередко наблюдаются и общие симптомы: резкая потеря веса, присутствие крови в моче и учащение мочеиспускания, отечность конечностей, слабость, быстрая утомляемость, беспричинное обильное потоотделение, повышение температуры без признаков простуды до 37,5-37,8℃.
При распространенной злокачественной опухоли пациентки жалуются на дизурию (нарушение мочеиспускательного процесса) и трудности в процессе дефекации.
Мутные выделения, имеющие неприятный запах, характерны для присоединения бактериальной инфекции. Также наблюдаются метастатическое изменение подключичных и паховых лимфоузлов.
Диагностика рака шейки матки
При постановке диагноза врач принимает во внимание данные анамнеза, физикального обследования, которое включает ректовагинальное исследование, пальпацию органов брюшной полости и всех групп периферических лимфатических узлов, аускультацию и перкуссию легких, пальпацию молочных желез, а также результаты лабораторных и инструментальных исследований.
Лабораторная диагностика
:
- общий (клинический) анализ крови развернутый;
Гемостазиограмма (коагулограмма), скрининг
Синонимы: Гемостазиограмма, коагулограмма.
Coagulation studies (coagulation profile, coag panel, coagulogram).
Состав профиля:
№ 2 Протромбин (протромбиновое время, протромбин (по Квику), МНО…
Дифференцированное определение ДНК ВПЧ 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) с контролем взятия материала (КВМ) в соскобе эпителиальных клеток урогенитального тракта (Human Papillomavirus, HPV DNA, Scr
Синонимы: Анализ урогенитального соскоба на ВПЧ. HPV DNA, 21 Types, Scrape of Urogenital Epithelial Cells.
Количественное определение ДНК ВПЧ 21 типа (6, 11, 16, 18, 26, 31, 33, 35, 39, 44, 45, 51, 52, 5…
Дифференцированное определение ДНК ВПЧ (Вирус папилломы человека, Human papillomavirus, HPV) высокого онкогенного риска 14 типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68) + КВМ в соскобе эпителиальных клеток урогенитального тракта
Синонимы: Анализ урогенитального соскоба на ВПЧ. HPV DNA, 14 Types, Scrape of Urogenital Epithelial Cells.
Краткое описание исследования «Дифференцированное определение ДНК ВПЧ…
:
- расширенная кольпоскопия (аппаратный осмотр слизистой шейки матки под увеличением) с целью оценки текущей клинической ситуации и выявления наиболее информативного паталогически-измененного участка для биопсии шейки матки;
Диагноз «РШМ» устанавливается только на основании гистологических результатов биопсии.
Всем пациенткам с РШМ в целях определения распространенности опухолевого процесса рекомендуются
:
- ультразвуковое исследование органов малого таза, брюшной полости, пахово-бедренных, забрюшинных и надключичных лимфоузлов;
УЗИ лимфатических узлов одной группы
Ультразвуковое сканирование группы лимфатических узлов для оценки их размеров и структуры с целью выявления воспалительных или онкологических заболеваний.
МРТ органов малого таза
Исследование, позволяющее получить данные о состоянии органов малого таза, выявить патологические изменения и опухоли.
МРТ головного мозга
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
КТ головного мозга и черепа
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
К каким врачам обращаться
При обнаружении признаков заболевания следует обратиться к
врачу-гинекологу
. Для подбора методов лечения могут потребоваться консультации гинеколога-онколога (врача, который специализируется на лечении рака женских половых органов, в том числе операциях по его удалению), радиационного онколога (врача, который использует радиацию для лечения различных видов онкологии), медицинского
онколога
– специалиста по применению химиотерапии, других медицинских методов лечения.
Лечение рака шейки матки
Выбор метода лечения определяется индивидуально и зависит от распространенности процесса и тяжести сопутствующей соматической патологии. При лечении рака шейки матки используют хирургические методы, лучевую и химиотерапию, таргетную (целевую) терапию, а также их комбинации.
На нулевой стадии онкологии обычно применяют хирургический метод в качестве единственного и самостоятельного терапевтического подхода. Предраковые клетки удаляются под местной анестезией. На первой стадии без признаков сосудистой инвазии рекомендована конизация шейки матки – иссечение клиновидного лоскута с опухолью и окружающими здоровыми тканями.
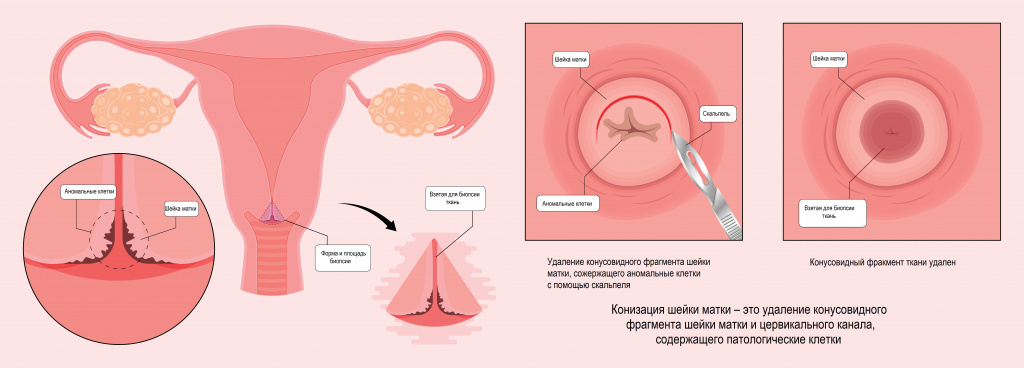
При инвазивном РШМ показана радикальная гистерэктомия с тазовой лимфодиссекцией – хирургическое иссечение матки с шейкой, придатками и регионарными лимфоузлами.
В зависимости от стадии рака используют лучевую дистанционную терапию или внутреннее облучение с влагалищным аппликатором.
- Для некоторых стадий лучевая терапия назначается как самостоятельный метод или как дополнение к хирургическому лечению. В большинстве случаев лучевую и химиотерапию проводятся совместно, поскольку химиопрепараты усиливают действие облучения.
- Для лечения рака шейки матки на поздних стадиях (с метастазами) или при рецидиве опухоли.
Химиотерапия рака шейки матки направлена на облегчение течения болезни или замедление ее развития. Таргетные препараты действует иначе, чем стандартная химиотерапия. Они препятствуют развитию опухолевых клеток, но не повреждают здоровые ткани, что является существенным преимуществом методики. Это позволяет эффективнее атаковать опухоль, вызывая меньше побочных эффектов.
В настоящее время активно изучается вопрос сохранения иммунитета при лучевой и химиотерапии с целью обеспечения организму возможности задействовать собственные противоопухолевые механизмы. Считается, что относительно эффективным является введение интерферонов.
При распространении рака за пределы матки хирургическое лечение противопоказано. Стандартная терапевтическая схема для таких больных включает лучевую, химио- или паллиативную терапию. Разовые и суммарные дозы, периодичность сеансов определяют на основании клинической картины.
Осложнения
При оперативном лечении рака шейки матки описаны случаи инфицирования ракового очага. В литературе отмечается, что осложнения чаще всего встречаются при неоперабельных стадиях рака.
Болевой синдром появляется на поздних стадиях заболевания, когда опухоль прорастает в тазовые нервные сплетения, тазовую брюшину и сдавливает соседние органы. Как правило, боли характеризуются как постоянные, ноющие и зачастую плохо поддающиеся терапии.
Синдром сдавления органов малого таза заключается в нарушении работы мочевыводящей системы и прямой кишки. Опухоль может приводить к ухудшению проходимости мочеточников, что приводит к гидронефрозу и нарушению функций почек. Нарушение функции прямой кишки проявляется болью при дефекации, изменениями формы стула и запорами.
Сдавление вен и лимфатических сосудов может приводить к отекам нижних конечностей.
Кровянистые выделения из половых путей могут появиться и на ранних стадиях, но на поздних они становятся обильными, сложно купируются и часто становятся причиной смерти больных раком шейки матки.
На поздних стадиях возможно формирование свищей между влагалищем и мочевым пузырем или влагалищем и прямой кишкой, которые проявляются в виде выделения мочи или каловых масс из половых путей.
Непосредственной причиной смерти в запущенных случаях, как правило, становятся:
- тяжелая местная инфекция, переходящая в сепсис и перитонит;
- инфекция мочевых путей (пиелонефрит, уремия);
- тромбоз сосудов (легких, брыжейки);
- острая анемия в результате обильных кровотечений; метастатическая пневмония.
Профилактика рака шейки матки
Развитие РШМ рассматривается как последовательный многоступенчатый процесс: от неизмененного эпителия шейки матки через предраковые заболевания (дисплазию) и преинвазивный рак до инвазивного рака. Длительность перерождения, как правило, занимает около 10 лет, поэтому раннее выявление и лечение предраковых поражений шейки матки является наиболее важным аспектом профилактики, позволяющим предотвратить развитие заболевания.
Основным методом скрининга и ранней диагностики считается доступный, простой и весьма информативный метод — исследование мазка с наружной части шейки матки и цервикального канала для выявления патологических клеток.
В Российской Федерации цитологическое исследование обязательно для всех женщин, самостоятельно обратившихся в смотровой кабинет.
С целью предотвращения заболевания ВПЧ, являющегося основной причиной развития рака шейки матки, проводится вакцинация.
- минимум раз в полгода проходить осмотр у гинеколога;
- один раз в год выполнять кольпоскопию, чтобы оценить состояние шейки матки и исключить патологии;
- отказаться от курения (оно нарушает кровообращение в органах малого таза).
Источники:
- Клинические рекомендации. Рак шейки матки. Ассоциация онкологов России, Российское общество клинической онкологии, Российское общество специалистов по профилактике и лечению опухолей репродуктивной системы. 2020. – 66 с.
- Минкина Г.Н. Цитологический скрининг рака шейки матки: от традиционного ПАП-теста к компьютерным технологиям // Акушерство, гинекология и репродукция. 2017; 11 (1): 56-63. DOI: 10.17749/2313-7347.2017.11.1.056-063.
- Клиническая онкогинекология : руководство / под ред. В. П. Козаченко. — 2-е изд., перераб. и доп. – Москва: БИНОМ, 2016. – 424 с.
- Рак шейки матки / под ред. И. В. Берлева, А. Ф. Урманчеевой. – Санкт-Петербург: ЭкоВектор, 2018. – 437 с.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
13062
01 Марта
-
13059
23 Февраля
-
4420
21 Февраля
Похожие статьи
Герпес
Герпес: причины появления, симптомы, диагностика и способы лечения.
Сепсис
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Цервицит
Цервицит: причины появления, симптомы, диагностика и способы лечения.
Саркома Капоши
Саркома Капоши: причины появления, симптомы, диагностика и способы лечения.
Гингивит
Гингивит: причины появления, симптомы, диагностика и способы лечения.