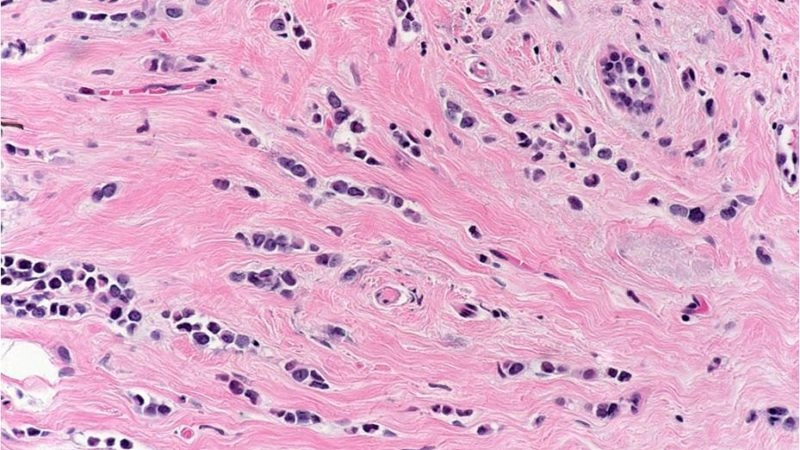
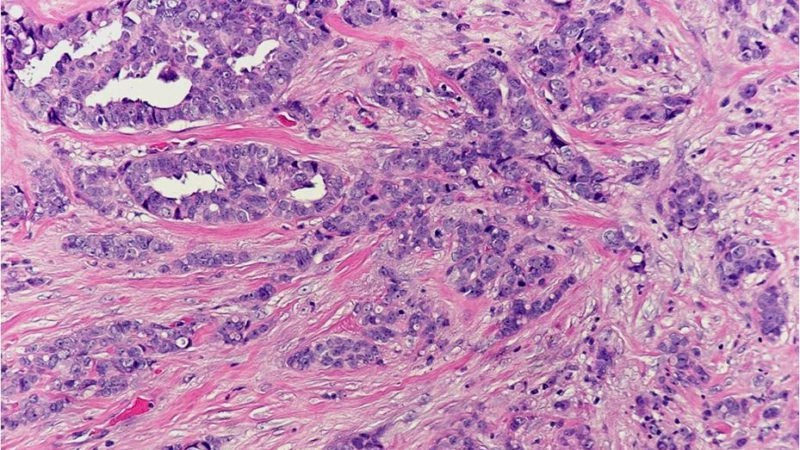
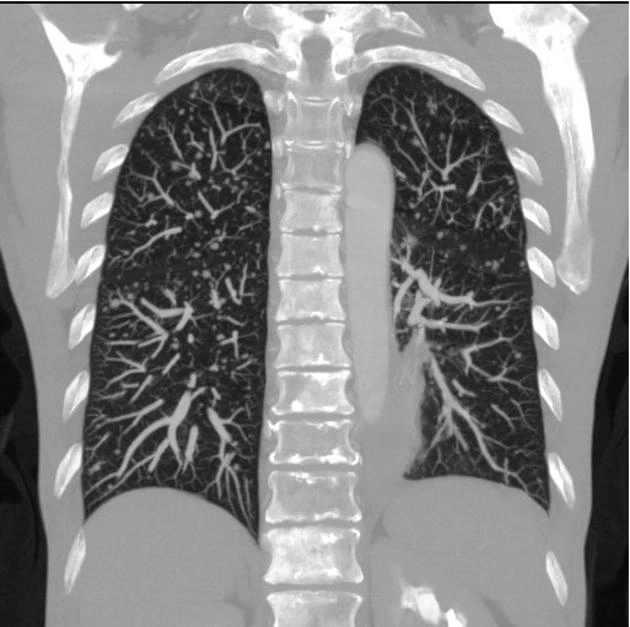
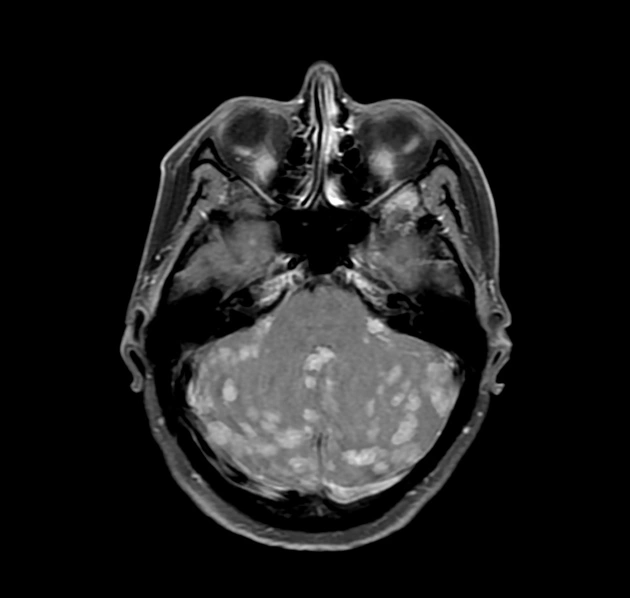
Рак молочной железы — опасная болезнь, которая ежегодно уносит тысячи жизней. В России смертность от него остается крайне высокой. Каждый год более 55 000 женщин узнают об этом страшном диагнозе, и лишь половине удается побороть рак. Данная патология в большинстве случаев поражает железистые клетки протоков или долек молочной железы.
Появление первых признаков рака груди не всегда удается уловить, так как в большинстве случаев на начальном этапе это заболевание протекает бессимптомно. Иногда может наблюдаться болезненность молочных желез и боли во время менструального цикла. Нередко новообразование обнаруживается при осмотре или скрининговой маммографии. Лечение обычно включает хирургическое иссечение, часто с лучевой терапией, с адъювантной химиотерапией или гормональной терапией.
Причины и факторы риска
Ежегодно только в России злокачественные опухоли в данном органе обнаруживаются у 50 тысяч женщин. А во всем мире это число превышает миллион. И статистика по выживаемости также пока что неутешительна. Почти половина случаев заболевания у женщин оканчивается летальным исходом. К факторам риска, способным спровоцировать развитие опухоли, относятся:
- нарушения гормонального баланса;
- бездетность и многодетность;
- очень поздние первые роды;
- частые аборты;
- раннее начало и позднее прекращение менструаций;
- наличие мастопатий;
- возраст старше 40 лет;
- пристрастие к курению и алкоголю;
- ожирение, а также частые стрессы;
- гипертоническая болезнь;
- воспаления матки и яичников;
- атеросклероз;
- гипотиреоз;
- заболевания печени.
Но бывает, что рак обнаруживают у пациенток, не входящих ни в одну из этих групп риска.
Код рака молочных желез по МКБ 10
При постановке диагноза женщинам, у которых выявлен рак молочной железы, отражается стадия рака, его локализация. Рак молочной железы по МКБ имеет общий код С50. Онкологические заболевания груди подразделяются на подгруппы, которым присвоена дополнительная степень:
- С50.0 – злокачественная опухоль ареолы и соска;
- С50.1 – поражение центральной части
- С50.2 – рак верхневнутреннего квадрата;
- С50.3 – злокачественная опухоль нижневнутреннего квадрата;
- С50.4 – поражение верхненаружного квадрата;
- С50.5 — опухоль, локализованная в нижненаружном квадрате;
- С50.8 – поражение злокачественной опухолью нескольких локализаций;
- С50.9 –пораженная опухолью часть молочной железы не уточнена.
Многие женщины, обращаются к врачу-онкологу с вопросом о том, какой код имеет рак левой молочной железы в системе МКБ 10. Для данной разновидности злокачественной опухоли представлен общий код С50, которому присваивается дополнительная степень в зависимости от его расположения.
Мнение эксперта
Рак молочной железы много лет является наиболее распространенной формой онкологических заболеваний. Во всем мире насчитывается более 1,5 млн женщин, страдающих от патологии. Несмотря на проводимое лечение, треть случаев заканчивается летальным исходом. В России статистика такова: каждая 10 женщина из 1000 страдает от рака молочных желез. Нельзя исключить появление патологии у мужчин. По данным статистики соотношение мужчин и женщин в структуре заболеваемости составляет 1:100.
На распространенность патологии оказывают влияние внутренние и внешние факторы. Поэтому важно вовремя проводить скрининг, особенно женщинам с отягощенной наследственностью. Врачи рекомендуют заниматься самообследованием и проходить маммографию 1 раз в 2 года. При появлении патологических признаков требуется сразу обращаться к врачу. Агрессивное течение рака молочных желез характеризуется стремительным прогрессированием. Прогноз на выздоровление благоприятен, если диагноз установлен на ранних стадиях.
Врачи Юсуповской больницы выявляют опухолевые очаги на любом этапе развития. Это позволяет проводить корректную терапию и облегчить симптомы болезни. Для лечения используются современные препараты, входящие в состав последних мировых рекомендаций по терапии онкологических заболеваний.
Классификация опухолей
В современной медицине классификация рака молочной железы осуществляется по различным основаниям. Так, по степени распространенности выделяется три разновидности: первичная опухоль, рак с поражением региональных лимфоузлов, злокачественная опухоль с отдаленными метастазами.
Специалистами разработана обширная классификация по стадиям, которая применяется при постановке диагноза во всем мире. Выделяется 4 стадии развития злокачественной опухоли груди, от которых зависит тактика лечения и прогноз.
Главными показателями эффективности врача-онколога является его опыт и сотрудничество с медицинским сообществом. Современные врачи-онкологи не только классифицируют рак груди МКБ, но и разрабатывают схемы терапии с учетом сопутствующих заболеваний и особенностями течения болезни.
Рак молочной железы: стадии
Стадия рака молочной железы определяется, исходя из характеристик конкретной болезни. Определение стадии помогает выбрать лучшие варианты лечения.
Обычно стадия рака молочной железы обозначается цифрой по шкале от 0 до IV, при этом стадия 0 описывает неинвазивный рак (рак in situ), а стадия IV — инвазивную болезнь, распространившуюся в другие части тела.
Рак молочной железы развивается постепенно. Врачи выделяют следующие стадии рака молочной железы:
- Нулевая стадия — неинвазивный рак молочной железы. Это означает, что за пределами опухоли раковых клеток нет;
- Первая стадия — инвазивный рак молочной железы, при котором раковые клетки появляются в соседних с опухолью тканях. На этой стадии опухоль может достигать двух сантиметров в диаметре, но при пальпации обнаружить ее еще трудно;
- Вторая стадия наступает, когда опухоль разрастается до пяти сантиметров в диаметре, а раковые клетки проникли в лимфатические узлы, окружающие молочную железу;
- Третья стадия рака груди разделяется на две подкатегории: IIIA и IIIB. IIIA — инвазивный рак с опухолью более пяти сантиметров в диаметре и значительным количеством патологических клеток в лимфатических узлах. Стадия IIIB определяется опухолью в молочной железе любого размера, которая разрослась на кожу груди, внутренние лимфатические узлы и грудную стенку;
- Четвертая стадия — это опухоль, которая разрослась за пределы молочной железы, подмышечной впадины, а также на лимфатические узлы, расположенные у основания шеи, легких или печени.
Нулевая, первая и вторая стадии считаются ранними, на этих этапах шансы на успешное излечение достаточно велики. Если же рак был обнаружен на третьей или четвертой стадии, процент выживаемости значительно ниже.
Кроме клинических четырех стадий, существует четыре гистологические степени рака молочной железы, в зависимости от злокачественности:
- Gх – невозможно определить степень злокачественности.
- G1 – гистологическая степень низкая комбинированная. Прогноз для жизни – благоприятный.
- G2 – средняя гистологическая комбинирования степень. Прогноз – умеренно благоприятный.
- G3 – высокая комбинированная гистологическая степень, обладающая неблагоприятным прогнозом.
Стадии TNM
Во всем мире принята классификация рака молочной железы по ТНМ, которая включает размер опухоли, состояние лимфатических узлов, наличие или отсутствие метастазов. Система определения стадий TNM дает полную информацию о развитии опухоли:
- буква T – обозначает размер злокачественного образования;
- буква N – описание распространения рака на лимфатическую систему;
- буква M – описание распространения новообразования на другие ткани и органы.
Метастазы при раке молочной железы
Злокачественные клетки способны распространяться по организму. При раке груди они способны «мигрировать» по организму двумя основными способами – с током крови и по лимфатическим путям.
Метастазы при раке груди, распространяющиеся в организме лимфогенным путем, обнаруживаются в региональных лимфатических узлах (окологрудинных, под- и надключичных, подмышечных).
Лечение метастазирующего рака молочной железы проводят при помощи следующих методов:
- локальной терапии;
- системной терапии;
- обезболивающей терапии.
Локальная терапия направлена на уничтожение клеток опухоли и ее метастазов. С этой целью используют лучевую терапию, оперативное вмешательство, а также курс приема стероидных препаратов.
Системная терапия подразумевает химио- и гормонотерапию, а также различные дополнительные инновационные методики лечения. Эффективность такого лечения проявляется не сразу. Когда метастазы поражают головной и спинной мозг, печень, кости, с целью остановки развития злокачественных клеток в сочетании с системной терапией применяют лучевую.
Симптомы
Многие случаи рака молочной железы обнаруживаются как объемные образования самим пациентом или во время рутинного объективного обследования или маммографии. Реже встречаются симптомы в виде болей, набухания или неясного уплотнения в молочных железах.
Симптомы рака молочной железы:
- уплотнение в груди, отличающееся от окружающих тканей;
- изменение размера, формы или внешнего вида молочной железы;
- изменения кожи, шелушение, втяжение определенного участка;
- втянутый сосок;
- покраснение молочной железы или ее части;
- патологические выделения из соска;
- увеличение лимфатических узлов;
- кожа, напоминающая апельсиновую корку
Диагностика рака молочной железы
Примерно в 70% случаев опухолей груди, подозрительные образования первоначально были обнаружены самими пациентками, а не выявлены при медицинском осмотре. Любая женщина должна взять за правило проводить самостоятельный осмотр своих грудных желез. Эта процедура несложна и должна проводиться каждый месяц после окончания менструаций.
При обследовании первоочередное внимание необходимо обращать на следующие параметры:
- симметричность грудей;
- их размер;
- цвет кожи;
- состояние кожи.
Если обнаружен подозрительный симптом или образование непонятной природы, то следует обратиться к врачу-маммологу. Он проведет мануальное обследование груди и может назначить дополнительные процедуры такие, как УЗИ, маммография (рентгенография области грудных желез), дуктография (маммография с контрастным веществом).
Все женщины от 40 до 49 лет должны проходить маммографию раз в 1-2 года, а женщинам после 50 лет врачи настоятельно рекомендуют обследоваться ежегодно. Если подозрения в злокачественности образования все еще остаются, то проводится биопсия с последующим исследованием клеточного материала.
Чтобы оценить распространение болезни в организме в клинике онкологии Юсуповской больницы могут назначаться:
- УЗИ;
- компьютерная томография;
- остеосцинтиграфия;
- ПЭТ-КТ;
- МРТ.
Иммуногистохимический анализ рака молочной железы: расшифровка и показания
Иммуногистохимическое исследование – вид изучения тканей при использовании определенных реактивов. После проведения биопсии или операции, взятый материал подвергается окрашиванию для гистологического метода исследования.
При иммуногистохимии рака молочной железы реактивы, которые используют, содержат в себе антитела, меченные определенными веществами. Антитело-белковое соединение, которое образует специфическую реакцию при соединении с другими участками. В результате такого метода можно судить о присутствии разных веществ в тканях.
В теле человека каждый день происходят иммуногистохимические реакции, суть которых основано на взаимодействии антиген-антитело. Например, при болезни, когда вирусы и бактерии попадают в организм человека, в крови образуются антитела, которые захватывают чужеродные вещества. По такому принципу работает и вакцинация, когда в ответ на вводимые антигены вырабатываются антитела, которые при болезни захватывают чужеродные микроорганизмы.
Материалом для исследования является опухолевая ткань, забор которой производится во время биопсии или же во время операции. Стоит отметить, что материал должен обязательно браться перед началом курса терапии, иначе результат окажется недостоверным.
Взятый материал помещают в формалин (дезинфицирующее средство) и отправляют в лабораторию. Там проводят его обезжиривание, а затем заливают специальным парафином. Далее образец тонко нарезают на пластины до 1 мкм, раскладывают на предметных стеклах и окрашиваются реактивами необходимой концентрации.
Интенсивность окраски реактивов с опухолевыми клетками зависит от содержания рецепторов. Чем больше их находится в материале, тем интенсивнее будет окраска. Гистологи интерпретирует результаты окраски по специальной шкале:
- 0-1+ обозначает отсутствие онкологического процесса;
- 2+ означает среднюю концентрацию HER2-белка в образце и отрицательное новообразование;
- 3+ свидетельствует о повышенном содержании HER2-белка, а онкологическое образование положительное.
Получить результаты можно уже через одну-две недели.
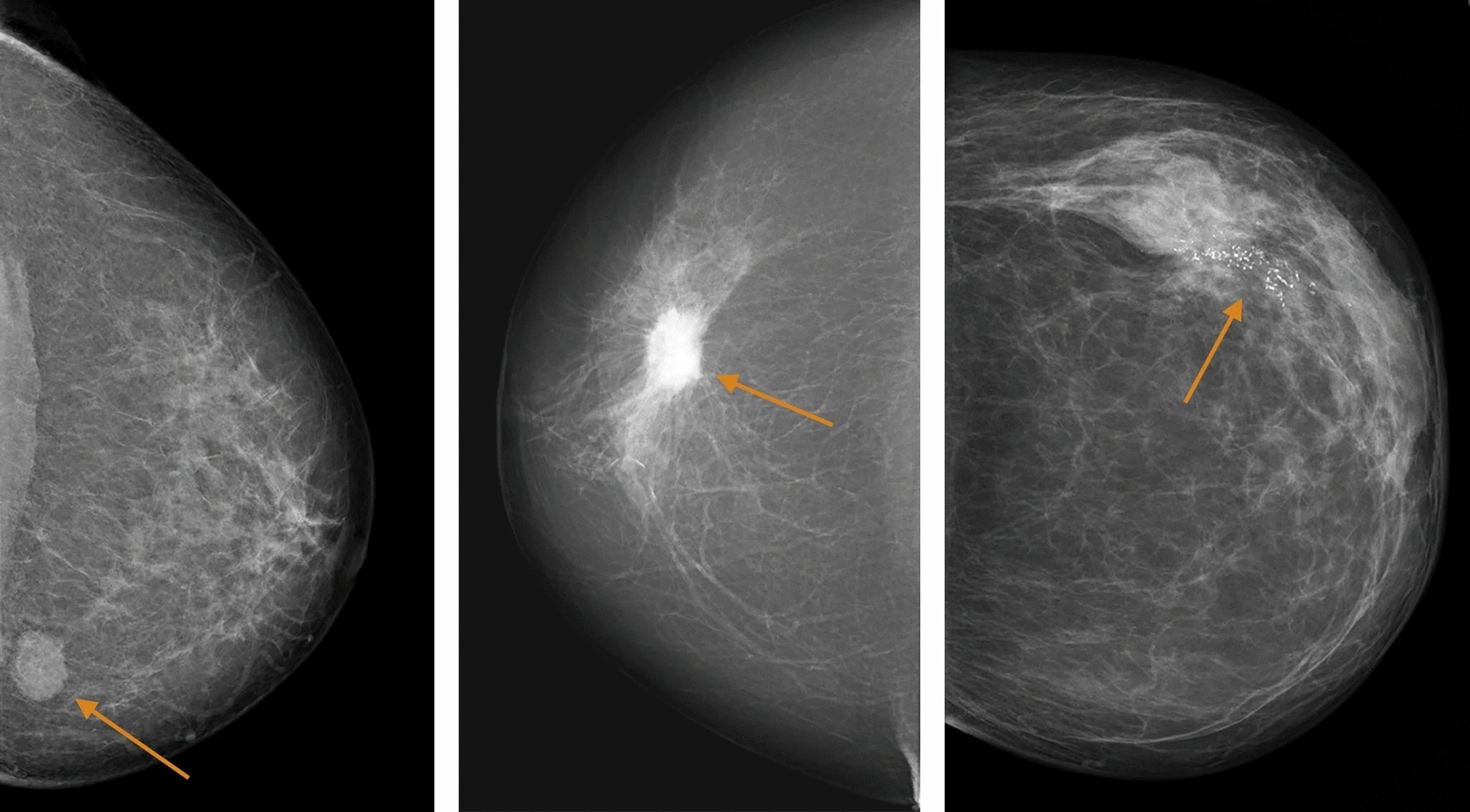
Как выглядит рак груди на УЗИ
В Юсуповской больнице пациент проходит диагностическое исследование в кратчайшие сроки, сразу после консультации онколога. Чтобы сэкономить время пациента и своевременно начать лечение результаты получают в день осмотра.
Рак груди на УЗИ характеризуется, как:
- Объемное образование с центрально расположенным гипоэхогенным (участок ткани, обладающий относительно низкой плотностью, по сравнению с остальной тканью) участком;
- Имеет неоднородную структуру;
- Вокруг опухоли может визуализироваться гиперэхогенная окантовка. Это место соответствует клеточной инфильтрации.
Нечеткость наружного контура при раке молочной железы на УЗИ является главной особенностью ее злокачественности. Все опухоли, способные к малигнизации имеют плотную структуру. При надавливании датчиком они не изменяют свою форму, а только смещаются и деформируют близкорасположенные мягкие ткани.
При цветном допплеровском картирование рак молочной железы, как и все опухоли, выглядит на УЗИ округлым образованием с признаками неоваскуляризации. Образование новых сосудов служит дополнительных признаком озлокачествления опухоли.
Многие пациенты сомневаются, видно ли рак молочной железы на УЗИ? Ведь КТ либо МРТ в сто раз лучше визуализирует опухоль, и определить ее локализацию. Безусловно, с этим нельзя не согласиться. Но УЗИ – диагностика, как скрининг-метод рака молочной железы во много раз превосходит все вышеперечисленные инструментальные методы. Его преимущество заключается в том, что он:
- Неинвазивен;
- Сэкономить пациенту приличную сумму денег;
- Быстр в выполнении;
- В процессе диагностики не используется ионизирующее облучение, как при маммографии, КТ и МРТ;
- Может определить опухоли размером 5 -6 мм.
Онкомаркер на рак молочной железы
Специфический анализ крови при раке груди позволяет определить вид злокачественных клеток, что необходимо для правильного подбора лечения онкологии. В крови определяются онкомаркеры – вещества, которые сигнализируют о развитии злокачественного процесса. О том, какие анализы нужны при раке груди, следует обязательно уточнить у своего лечащего врача. Не следует заниматься самодеятельностью и устанавливать себе диагноз без консультации специалиста.
При развитии злокачественной опухоли в организме человека начинает концентрироваться особое вещество, которое называют онкомаркер. Оно синтезируется либо самой опухолью, либо иммунной системой человека в ответ на заболевание.
Онкомаркеры на рак груди позволяют уточнить диагноз, определить тип рака, его поведение. Это важно для составления правильного лечения.
Выделяют три основных способа выявления онкомаркеров:
- Сывороточный;
- Тканевой;
- Генетический.
Для определения сывороточного онкомаркера используют сыворотку крови. Это наиболее простой и информативный метод диагностики, отражающий состояние онкологического процесса.
Для исследования опухоли в молочной железе оцениваются следующие показатели:
- Гликопротеиды семейства MUC-1: CA 15-3, CMA, CA 27.29, CA 549;
- Раково-эмбриональный антиген (РЭА);
- Онкомаркер М 20;
- Онкобелок HER-2;
- Цитокератины (TPA, TPS).
Наиболее чувствительным белком в диагностике рака молочной железы выступает СА 15-3. Его чаще всего исследуют для выявления онкологии. Дополнительно назначают анализ на уровень РЭА в крови, что в сочетании с СА 15-3 даст более ясную картину происходящего.
Лечение рака молочной железы
Эффективное лечение рака груди проводят врачи Юсуповской больницы, которая работает круглосуточно и без выходных. Для лечения рака молочных желез применяют:
- оперативное лечение,
- лучевую терапию,
- химиотерапию,
- гормональную терапию,
- иммунотерапию,
- таргетную терапию.
При нулевой, первой и второй стадии рака молочной железы по ТНМ целью лечения становится полное выздоровление. В случае третьей и терминальной стадии вероятность полного избавления от рака намного ниже, а цель – улучшение качества жизни и продление ремиссии. Третья, четвертая стадии рака молочной железы по классификации чаще всего требуют комбинированного лечения, которое направлено еще и на профилактику рецидива.
Хирургическое лечение может быть органосохраняющим, носить косметический характер. В запущенных случаях целесообразно полностью удалять молочную железу вместе с лимфоузлами и некоторыми мышцами.
Рецидив рака молочной железы
Рецидив рака молочной железы – злокачественное новообразование, которое развивается через полгода и более после радикального лечения первичной опухоли. Рецидив может возникнуть как на той же молочной железе, так и поражать другую грудь, лимфатические узлы и органы. Вероятность рецидива рака молочной железы зависит от:
- Морфологического строения клеток опухоли;
- Скорости роста новообразования;
- Степени вовлечения в онкологический процесс других органов;
- Изменение гормонального фона;
- наличия метастатического поражения регионарных лимфатических узлов при обнаружении первичного рака;
- Метода лечения первичной опухоли.
Как и для первичной опухоли, для рецидива характерны общие симптомы раковой интоксикации. К ним относятся:
- Общая слабость;
- Вялость;
- Апатия;
- Усталость;
- Плохой аппетит или полное его отсутствие;
- Снижение массы тела вплоть до анорексии и др.
Признаки рецидива опухоли груди зависят от локализации новообразования. В случае местного метастаза, при самоосмотре или осмотре врачом обнаруживают изменение формы молочной железы, ее контуров. При пальпации возможно обнаружение инфильтрата, как правило, безболезненного, но он плотный, неподвижный и спаян с кожей и прилежащими тканями. Кожа над уплотнением гиперемирована, может шелушиться, а в случае прогрессирования – втягивается, морщинится. Симптом «лимонной корки» является характерным для рецидива рака молочной железы, а далее — на коже развиваются разрастания.
Реабилитация после рака молочной железы
Реабилитация после рака молочной железы имеет свои особенности. Так как хирургическая операция, радио- и химиотерапия являются самыми эффективными методами борьбы с раком молочной железы, то необходимо устранять осложнения, непосредственно связанные с патологическим действием опухоли на организм, а также с побочным действием лечения.
Наиболее эффективными методами реабилитации после рака молочной железы являются:
- Физиотерапия;
- Психоэмоциональная коррекция;
- Лечебная физкультура;
- Акупунктура.
Такие мероприятия способствуют возобновлению двигательной активности и устранению наиболее распространенных послеоперационных осложнений.
Осложнения после операции по удалению рака молочной железы имеют разный характер и степень выраженности, в зависимости от стадии рака и режима реабилитации. Бывают ранние осложнения (первые две недели после операции) и поздние (месяца, годы). К наиболее часто возникающим ранним осложнениям относятся:
- Отек;
- Лимфорея (вытекание лимфы в результате повреждения сосудов);
- Инфицирование раны;
- Некроз тканей.
Чтобы минимизировать вероятность возникновения таких побочных явлений, необходима комплексная работа не только онколога и врача-реабилитолога, но и других смежных специалистов, таких как: кардиолог, невролог, психолог, эндокринолог и т.д.
При раке молочной железы всем ли дают инвалидность?
Удаление молочной железы или постановка диагноза «рак молочной железы» не являются весомыми причинами для установления группы инвалидности. Инвалидность при раке 1 стадии не присваивается — опухоль лечится консервативным путем, нет метастазирования опухоли, отсутствует поражение соседних тканей и органов, отсутствуют осложнения, не нарушена трудоспособность, больная не потеряла навыков к самообслуживанию.
Группа инвалидности при онкологии молочной железы 2 стадии может присваиваться, если наступает умеренное ограничение жизнедеятельности в связи с утратой способности работать на работах с тяжелой физической нагрузкой на плечевой сустав в полном объеме. Третья группа инвалидности присваивается при выраженной и резко выраженной контрактуре плечевого сустава, постмастэктомическом синдроме, при лимфостазе 2 степени, который развивается как последствие лечения, при рецидивирующих рожистых воспалениях из-за необходимости переквалифицироваться или значительно уменьшить объемы выполняемых работ.
Инвалидность 2 группы наступает у больных с выраженным ограничением жизнедеятельности и неспособностью к трудовой деятельности в полном объеме:
- С разрастающейся опухолью (3A и 3Б стадий), сомнительным прогнозом и радикально проведенным лечением, низкодифференцированной опухолью и центральной локализацией злокачественного новообразования.
- Перенесших радикальную операцию (2 и 3 стадия рака), находящихся на лечении с помощью химиотерапии, плохо переносящих лечение рака.
- При проведении гормональной терапии метастазирующего инволютивного рака, отсутствии осложнений и необходимости в постоянном уходе.
- При воспалительном типе рака молочной железы, при отсутствии необходимости в постоянном уходе.
- При развитии рецидива опухоли, появлении отдаленных метастазов и необходимости лечения рака.
При отсутствии способности к самообслуживанию и выраженном ограничении жизнедеятельности присваивается 1 группа инвалидности. Показанием для присвоения этой группы служат следующие состояния:
- Тяжелое состояние пациентки после паллиативного лечения рака молочной железы.
- Развитие генерализованного злокачественного процесса на фоне лечения рака. Генерализованный процесс – это поражение раком всего организма, распространение метастазов опухоли в головной мозг, кости и другие ткани и органы.
Оформление инвалидности начинается с посещения врача-онколога. Врач онкологической клиники Юсуповской больницы направляет пациентку на определенные исследования:
- Биохимический и общий анализ крови.
- УЗИ печени.
- Электрокардиография.
- Рентген грудной клетки.
- Анализ на основные гемодинамические показатели.
В некоторых случаях требуется консультация и заключение психолога, помощь которого можно получить в больнице. Дают ли инвалидность при онкологии молочной железы в вашем индивидуальном случае можно узнать у лечащего врача. Решение по назначению инвалидности принимает бюро МСЭ.
Опухоли молочной железы. (Международный противораковый союз. Седьмая редакция, 2009. Редакторы: L.H.Sobin, M.K.Gospodarowicz, Ch.Wittekind. A John Willey & Sons. Ltd., Publication. Перевод С.М.Портного).
«Мудрыми называют тех, кто правильно определяет порядок вещей»
Фома Аквинский
Предварительные замечания
Описание представлено под следующими заголовками:
- Правила по классификации с процедурами оценки категорий T, N и M; дополнительные методы могут использоваться, когда они повышают точность оценки до лечения
- Анатомические подразделы
- Определение регионарных лимфатических узлов
- TNM Клиническая классификация
- pTNM Патологоанатомическая классификация
- G Гистологическое определение степени злокачественности
- R Классификация
- Группировка по стадиям
- Заключение
Правила классификации
Классификация относится к карциномам как мужской, так и женской молочной железы. Необходимо гистологическое подтверждение диагноза. Анатомическая локализация первичной опухоли должна быть указана, но она не учитывается в классификации. В случае множественных первичных опухолей в одной молочной железе для классификации используется опухоль с максимальной категорией T. Множественные двусторонние раки молочных желёз следует классифицировать независимо, используя возможность дифференцировать опухоли по гистологическому типу.
Для оценки категорий T, N и M используются следующие процедуры:
- категории T – врачебный осмотр и методы получения изображения, например, маммография;
- категории N – врачебный осмотр и методы получения изображения;
- категории M – врачебный осмотр и методы получения изображения.
Анатомические подразделы
- Сосок (С50.0)
- Центральный отдел (С50.1)
- Верхне-внутренний квадрант (С50.2)
- Нижне-внутренний квадрант (С50.3)
- Верхне-наружный квадрант (С50.4)
- Нижне-наружный квадрант (С50.5)
- Хвостовая доля (С50.6)
Регионарные лимфатические узлы
К регионарным лимфатическим узлам относятся:
- Подмышечные (ипсилатеральные): интерпекторальные узлы (Роттера) и лимфатические узлы, расположенные вдоль подмышечной вены и её притоков, которые могут быть разделены на следующие уровни:
- I уровня (нижние подмышечные): лимфатические узлы, расположенные латеральнее латерального края малой грудной мышцы;
- II уровня (средние подмышечные): лимфатические узлы, расположенные между медиальным и латеральным краями малой грудной мышцы, а также интерпекторальные лимфатические узлы (Роттера);
- III уровня (апикальные подмышечные): апикальные подмышечные лимфатические узлы и лимфатические узлы, расположенные медиальнее медиального края малой грудной мышцы, за исключением лимфатических узлов, обозначаемых как подключичные.
Примечание: интрамаммарные лимфатические узлы кодируются как подмышечные лимфатические узлы I уровня.
- Подключичные (ипсилатеральные).
- Внутренние грудные (ипсилатеральные): лимфатические узлы, расположенные в межрёберных промежутках вдоль края грудины на внутригрудной фасции.
- Надключичные (ипсилатеральные).
Примечание: метастазы в любых других лимфатических узлах кодируются как отдалённые метастазы (M1), включая шейные или контралатеральные внутренние грудные лимфатические узлы.
Клиническая классификация TNM
- T – первичная опухоль
- TX – первичная опухоль не может быть оценена
- T0 – первичная опухоль не обнаружена
- Tis carcinoma in situ – неинвазавный рак
- Tis (DCIS) – протоковый неинвазавный рак
- Tis (LCIS) – дольковый неинвазивный рак
- Tis (Paget) – болезнь Педжета соска не сочетающаяся с инвазивным раком или неинвазивным раком (протоковым и/или дольковым) в подлежащей ткани молочной железы. Раки в ткани молочной железы, сочетающиеся с болезнью Педжета, классифицируются на основании размера и характеристик этих опухолей, наличие болезни Педжета также должно быть отмечено.
- T1 – опухоль 2 см или меньше в максимальном измерении.
- T1mi – микроинвазия 0,1 см или меньше в максимальном измерении*
Примечание:* микроинвазия есть распространение раковых клеток через базальную мембрану в подлежащие ткани без формирования фокуса большего, чем 0,1см в наибольшем измерении. Когда имеются множественные фокусы микроинвазии, для стадирования используется только размер самого крупного фокуса. (Не следует суммировать размеры всех отдельных фокусов). Наличие множественных очагов микроинвазии должно быть отмечено, так же, как их сочетание с множественными более крупными инвазивными раками. - T1a – более 0,1 см, но не более 0,5 см в максимальном измерении
- T1b – более 0,5 см, но не более 1 см в максимальном измерении
- T1c – более 1 см, но не более 2 см в максимальном измерении
- T1mi – микроинвазия 0,1 см или меньше в максимальном измерении*
- T2 – Опухоль более 2 см, но не более 5 см в максимальном измерении
- T3 – Опухоль более 5 см в максимальном измерении
- T4 – Опухоль любого размера с прямым распространением на грудную стенку и/или кожу (изъязвление или кожные узелки)
Примечание: просто врастание в кожу не квалифицируется как T4. Под грудной стенкой понимаются рёбра, межрёберные мышцы, передняя зубчатая мышца, но не грудная мышца.- T4a – распространение на грудную стенку (это не относится к изолированному врастанию в грудную мышцу)
- T4b – изъязвление, ипсилатеральные кожные сателлиты или отёк кожи (включая симптом апельсиновой корки)
- T4c – сочетание характеристик, описанных в T4a и T4b
- T4d – отёчно-инфильтративная форма рака
Примечание: отёчно-инфильтративная форма рака молочной железы характеризуется выраженным уплотнением кожи с краем, подобным таковому при рожистом воспалении кожи, обычно без подлежащей опухоли. Клинически классифицируемая отёчно-инфильтративная форма рака (T4d) в случаях отсутствия признаков опухолевого поражения кожи при её биопсии и отсутствии измеряемой первичной опухоли, при патологоанатомическом стадировании оценивается как pTX. Втяжение кожи, ретракция соска или другие кожные симптомы, за исключением таковых, указанных в пунктах T4b и T4d; могут наблюдаться при T1, T2 или T3 не влияя на классифицирование.
- N – регионарные лимфатические узлы
- NX – регионарные лимфатические узлы не могут быть оценены (например, удалены ранее)
- N0 – отсутствуют метастазы в регионарных лимфатических узлах
- N1 – метастазы в подвижных ипсилатеральных подмышечных лимфатических узлах (узле) I, II уровней
- N2 – метастазы в ипсилатеральных подмышечных лимфатических узлах (узле) I, II уровней, которые по клиническим данным фиксированы или спаяны между собой; или клинически определяемые* метастазы (метастаз) в ипсилатеральных внутренних грудных лимфатических узлах (узле) при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах
- N2a – метастазы в подмышечных лимфатических узлах (узле), фиксированные между собой или с другими структурами
- N2b – клинически определяемые* метастазы (метастаз) только во внутренних грудных лимфатических узлах (узле) при отсутствии клинически определяемых метастазов в подмышечных лимфатических узлах
- N3 – метастазы в ипсилатеральных подключичных (подмышечных III уровня) лимфатических узлах (узле) с или без поражения подмышечных лимфатических узлов I, II уровней; или клинически определяемые* метастазы (метастаз) в ипсилатеральных внутренних грудных лимфатических узлах (узле) с клиническими признаками метастазов в подмышечных лимфатических узлах I, II уровней; или метастазы в ипсилатеральных надключичных лимфатических узлах (узле) с или без поражения подмышечных или внутренних грудных лимфатических узлов.
- N3a – метастазы в подключичных лимфатических узлах (узле)
- N3b – метастазы во внутренних грудных и в подмышечных лимфатических узлах
- N3c – метастазы в надключичных лимфатических узлах (узле)
Примечание:*Под клинически определяемым понимается как действительно определяемый только клинически, так и определяемый с помощью методов получения изображения (исключая лимфосцинтиграфию) и имеющий характеристики в высокой степени подозрительные на злокачественность, либо подтверждённый при тонкоигольной биопсии с цитологическим исследованием. Подтверждение клинически определяемого метастаза путём тонкоигольной биопсии без эксцизионной биопсии обозначается дополнением (f), например, cN3a(f). Эксцизионная биопсия лимфатического узла или биопсия сигнального лимфатического узла при отсутствии оценки pT дает возможность классифицировать cN, например, cN1.Патологоанатомическая классификация (pN) применяется при удалении или биопсии сигнального лимфатического узла только в сочетании с патологоанатомической оценкой T.
- M – отдалённые метастазы
- M0 – отдалённых метастазов нет
- M1 – есть отдалённые метастазы
Категории M1 и pM1 могут быть уточнены в соответствии с локализацией метастазов:
- Лёгкие: PUL
- Костный мозг: BRA
- Кости: OSS
- Плевра: PLE
- Печень: HEP
- Брюшная полость: PER
- Головной мозг: BRA
- Надпочечники: ADR
- Лимфатические узлы: LYM
- Кожа: SKI
- Прочие: OTH
pTNM патологоанатомическая классификация
- pT – первичная опухоль
Патологоанатомическая классификация требует оценки первичной опухоли при отсутствии макроскопически определяемой опухоли по краю резекции. Случай может классифицироваться если опухоль по краю резекции определяется только микроскопически. pT категории соответствуют категориям T.
Примечание: Для классифицирования pT учитывается размер инвазивного компонента опухоли. Если существует большой неинвазивный компонент (in situ) (например, 4 см) и небольшой инвазивный компонент (например, 0,5 см), опухоль кодируется как pT1a. - pN – Регионарные лимфатические узлы
Патологоанатомическая классификация требует удаления и исследования по крайней мере нижних лимфатических узлов (I уровня) (смотри стр. «Регионарные лимфатические узлы»). При такой операции обычно исследуются 6 или больше лимфатических узлов. Если лимфатические узлы негативны, но их число меньше обычного, случай классифицируется как pN0. - pNx – Состояние регионарных лимфатических узлов не может быть оценено (например, удалены ранее или не удалены)
- pN0 – нет метастазов в регионарных лимфатических узлах*
Примечание: *под кластером изолированных опухолевых клеток (isolated tumor cells – ITC) понимаются одиночные опухолевые клетки или маленькие скопления опухолевых клеток не более 0,2 мм в наибольшем измерении, которые могут быть определены при обычном окрашивании гематоксилином и эозином или иммуногистохимически. Дополнительным критерием ITC может быть оценка количества клеток: скопление не более 200 клеток в одном гистологическом срезе. Узлы, содержащие только ITC, исключаются из счёта числа поражённых узлов для целей квалификации N и включаются в общее число исследованных узлов. Изолированные опухолевые клетки обычно не проявляют метастатической активности (например, пролиферации или стромальной реакции) или распространения за пределы стенки лимфатического сосуда или синуса. Случаи с ITC в лимфатических узлах или в отдалённых органах следует классифицировать как N0 или M0 соответственно. Такой же подход применяется к случаям обнаружения опухолевых клеток или их компонентов не морфологическими методами, такими как проточная цитометрия или анализ ДНК. Эти случаи рассматриваются отдельно. Их классифицируют следующим образом:- pN0 – Нет метастазов в лимфатических узлах при гистологическом исследовании, поиск ITC не производился
- pN0(i-) – Нет метастазов в лимфатических узлах при гистологическом исследовании, ITC при морфологическом исследовании не обнаружены
- pN0(i+) – Нет метастазов в лимфатических узлах при гистологическом исследовании, обнаружены ITC при морфологическом исследовании
- pN0(mol-) – Нет метастазов в лимфатических узлах при гистологическом исследовании, ITC при неморфологическом исследовании не обнаружены
- pN0(mol+) – Нет метастазов в лимфатических узлах при гистологическом исследовании, обнаружены ITC при неморфологическом исследовании
Случаи с поиском ITC в сигнальных лимфатических узлах могут классифицироваться следующим образом:
- pN0(i-)(sn) – Нет метастазов в сигнальных лимфатических узлах при гистологическом исследовании, ITC при морфологическом исследовании не обнаружены
- pN0(i+)(sn) – Нет метастазов в сигнальных лимфатических узлах при гистологическом исследовании, обнаружены ITC при морфологическом исследовании
- pN0(mol-)(sn) – Нет метастазов в сигнальных лимфатических узлах при гистологическом исследовании, ITC при неморфологическом исследовании не обнаружены
- pN0(mol+)(sn) – Нет метастазов в сигнальных лимфатических узлах при гистологическом исследовании, обнаружены ITC при неморфологическом исследовании
- pN0(mol+) – Нет метастазов в лимфатических узлах при гистологическом исследовании, обнаружены ITC при неморфологическом исследовании
- pN1 – Микрометастазы; или метастазы в 1-3 подмышечных лимфатических узлах; и/или во внутренних грудных лимфатических узлах с метастазами, определяемыми по данным биопсии сигнального лимфатического узла, но не определяемые клинически1
- pN1mi – Микрометастазы (больше, чем 0,2 мм и/или больше, чем 200 клеток, но не больше, чем 2,0 мм)
- pN1a – Метастазы в 1-3 подмышечных лимфатических узлах, включая по-крайней мере, 1 более 2 мм в наибольшем измерении
- pN1b – внутренние грудные лимфатические узлы с микроскопическими или макроскопическими метастазами, определяемые по данным биопсии сигнального лимфатического узла, но не определяемые клинически1
- pN1c – Метастазы в 1-3 подмышечных лимфатических узлах и внутренних грудных лимфатических узлах с микроскопическими или макроскопическими метастазами, определяемые по данным биопсии сигнального лимфатического узла, но не определяемые клинически1
- pN2 – метастазы в 4-9 ипсилатеральных подмышечных лимфатических узлах или в клинически1 выявляемых ипсилатеральных внутренних грудных лимфатических узлах при отсутствии метастазов в подмышечных лимфатических узлах
- pN2a – метастазы в 4-9 ипсилатеральных подмышечных лимфатических узлах, включая по-крайней мере, один более 2 мм в наибольшем измерении
- pN2b – метастазы в клинически1 выявляемых ипсилатеральных внутренних грудных лимфатических узлах при отсутствии метастазов в подмышечных лимфатических узлах
- pN3 – Метастазы в:
- pN3a метастазы в 10 или более подмышечных лимфатических узлах, включая, по-крайней мере, один более 2 мм в наибольшем измерении или метастазы подключичных лимфатических узлах
- pN3b метастазы в клинически1 выявляемых ипсилатеральных внутренних грудных лимфатических узлах при наличии метастазов в подмышечных лимфатических узлах; или метастазы более, чем в 3 подмышечных лимфатических узлах и во внутренних грудных лимфатических узлах с микроскопическими или макроскопическими метастазами, определяемыми при биопсии сигнальных лимфатических узлов, но не выявляемых клинически
- pN3c метастазы в ипсилатеральных надключичных лимфатических узлах
- ypN после лечения. ypN после лечения оценивается так же, как описано выше при оценке клинического N (до лечения). Если после лечения производилась оценка состояния сигнального лимфатического узла, используется подпись sn. Если такая подпись отсутствует, значит, оценка подмышечных лимфатических узлов производилась по удалённым подмышечным лимфатическим узлам. X используется (ypNX) в тех случаях, когда не производилось ни биопсии сигнального лимфатического узла, ни подмышечной лимфаденэктомии. Категории N такие же, как и для pN.
Примечание: 1 – Под клинически определяемым понимается определяемый с помощью методов получения изображения (исключая лимфосцинтиграфию) или путем клинического обследования, и имеющий характеристики в высокой степени подозрительные на злокачественность, либо предполагаемый макрометастаз на основании тонкоигольной биопсии с цитологическим исследованием. Под клинически не определяемым понимается не определяемый с помощью методов получения изображения (исключая лимфосцинтиграфию) или путем клинического обследования. - pM – отдалённые метастазы
- pM1 – отдалённые метастазы подтверждены при микроскопии
Примечание: pM0 и pMX не являются правомерными категориями. Категория pM1 может быть уточнена так же, как M1 в соответствии с локализацией метастазов. Изолированные опухолевые клетки (ITC), найденные в костном мозге морфологическими методами, классифицируются по схеме, описанной для N, то есть, M0(i+). Для неморфологических методов обнаружения ITC, используется добавление к М “mol”, например, M0(mol+).
G гистопатологическая степень злокачественности.
Для определения гистопатологической степени злокачественности смотри: Elston C.W., Ellis I.O. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991; 19:403-410.
R классификация остаточной опухоли
Наличие или отсутствие остаточной опухоли описывается символом R (residual). TNM и pTNM описывают анатомическую распространённость опухоли в целом, без учёта лечения. Они могут быть дополнены классификацией R, которая описывает статус опухоли после лечения. Она отражает эффект лечения, влияет на последующее лечение и является сильным фактором прогноза.
Определения категорий R следующие:
- RX – Наличие остаточной опухоли не может быть оценено
- R0 – Остаточная опухоль отсутствует
- R1 – Микроскопическая остаточная опухоль
- R2 – Макроскопическая остаточная опухоль
Группировка по стадиям
- Стадия IA: T1*: N0: M0
- Стадия IB: T0, T1*: Nmi: M0
- Стадия IIA: T0, T1*: N1: M0; T2: N0: M0
- Стадия IIB: T2: N1: M0; T3: N0: M0
- Стадия IIIA: T0, T1*,T2: N2: M0; T3: N1, N2: M0
- Стадия IIIB: T4: N0, N1, N2: M0
- Стадия IIIC: любое T: N3: M0
- Стадия IV: любое T: любое N: M1
Примечание: *T1 включает T1mi.
Обобщение
- T1: ≤ 2 см
- T1mi: ≤ 0,1 см
- T1a: >0,1 см до 0,5 см
- T1b: >0,5 см до 1,0 см
- TT1c : >1,0 см до 2,0 см
- T2: >2,0 см до 5см
- T3: >5 см
- T4: Грудная стенка, изъязвление кожи, кожные сателлиты, отёк кожи
- T4a : Грудная стенка
- T4b: Изъязвление кожи, кожные сателлиты, отёк кожи
- T4c: Сочетание симптомов T4a и T4b
- T4d: Отёчно-инфильтративная форма
- N1: Подвижные подмышечные
- pN1mi: микрометастазы >0,2 до 2,0 мм
- pN1a: 1-3 подмышечных узла
- pN1b: внутренние грудные узлы с микроскопическими или макроскопическими метастазами в сигнальных узлах, но не определявшиеся клинически
- pN1c: 1-3 подмышечных узла и внутренние грудные узлы с микроскопическими или макроскопическими метастазами в сигнальных узлах, но не определявшиеся клинически
- N2a: Фиксированные подмышечные
- pN2a: 4-9 подмышечных узлов
- N2b: внутренние грудные, клинически несомненные
- pN2b: внутренние грудные узлы, клинически определяемые без подмышечных узлов
- N3a: подключичные
- pN3a: ≥10 подмышечных узлов или
- N3b: внутренние грудные и подмышечные
- pN3b: клинически выявляемые внутренние грудные узлы с подмышечным узлом (узлами) или более чем 3 подмышечных узла с микроскопическими метастазами, определяемыми при биопсии сигнальных лимфатических узлов, но не выявляемых клинически
- N3c: Надключичные
- pN3c: Надключичные
Рак молочной железы
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Злокачественное новообразование молочной железы (C50), Карцинома in situ молочной железы (D05)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Общероссийская общественная организация «Российское общество онкомаммологов»
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Рак молочной железы
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D05, C50
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023 ID: 379
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Рак молочной железы (РМЖ) – злокачественная опухоль, исходящая из эпителия ткани молочной железы.
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Карцинома in situ молочной железы (D05):
D05.0 – Дольковая карцинома in situ.
D05.1 – Внутрипротоковая карцинома in situ.
D05.7 – Другая карцинома in situ молочной железы.
D05.9 – Карцинома in situ молочной железы неуточненная.
Злокачественное новообразование молочной железы (С50):
C50.0 – соска и ареолы.
C50.1 – центральной части молочной железы.
C50.2 – верхневнутреннего квадранта молочной железы.
C50.3 – нижневнутреннего квадранта молочной железы.
C50.4 – верхненаружного квадранта молочной железы.
C50.5 – нижненаружного квадранта молочной железы.
C50.6 – подмышечной задней части молочной железы.
C50.8 – поражение молочной железы, выходящее за пределы одной и более вышеуказанных локализаций.
C50.9 – молочной железы неуточненной части.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1. Международнаягистологическаяклассификация
В настоящее время используется международная гистологическая классификация РМЖ Всемирной Организации Здравоохранения (ВОЗ) 2019 года [3] согласно которой выделяют:
1.5.2. Ста
дирование
Для стадирования РМЖ следует использовать TNM-8 классификацию Союза по международному противораковому контролю (Union for International Cancer Control, UICC) [4]. Выделяют клиническую и патоморфологическую стадии РМЖ, которые могут существенно различаться. Клиническое стадирование осуществляют на основании результатов клинического обследования, патоморфологическое – на основании заключения морфолога после операции.
Т – первичная опухоль;
Тх – недостаточно данных для оценки опухоли;
T0 – нет признаков первичной опухоли;
Тis (DCIS) – протоковый рак in situ;
Тis (Paget) – рак Педжета (соска) без признаков опухоли (при наличии опухоли оценку проводят по ее размеру);
Т1mic – микроинвазия[
1
] ≤0,1 см в наибольшем измерении.
Примечание:
Т1а – опухоль >1 мм, но ≤5 мм в наибольшем измерении;
Т1б – опухоль >5 мм, но ≤10 мм в наибольшем измерении;
Т1с – опухоль >10 мм, но ≤20 мм в наибольшем измерении;
Т2 – опухоль >20 мм, но ≤50 мм в наибольшем измерении;
ТЗ – опухоль >50 мм в наибольшем измерении;
Т4 – опухоль любого размера с прямым распространением на грудную стенку[
2
] и/или кожу;
Т4а – прорастание грудной стенки, исключая инвазию только в грудные мышцы;
Т4б – отек (включая «апельсиновую корочку») или изъязвление кожи молочной железы либо сателлиты в коже железы;
Т4с – признаки, перечисленные в пунктах Т4а и Т4б;
Т4d – воспалительный (отечный) рак[
3
];
N – регионарные лимфатические узлы[
4
];
Nх – недостаточно данных для оценки поражения регионарных лимфатических узлов;
N0 – нет признаков поражения метастазами регионарных лимфатических узлов;
N1 – метастазы в смещаемых подмышечных лимфатических узлах (на стороне поражения);
N2 – метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные, либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при отсутствии клинически явного поражения подмышечных лимфатических узлов;
N2а – метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные;
N2b – клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при отсутствии клинически явного поражения подмышечных лимфатических узлов;
N3 – метастазы в подключичных лимфатических узлах на стороне поражения, либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при наличии клинически явного поражения подмышечных лимфатических узлов, либо метастазы в надключичных лимфатических узлах на стороне поражения (независимо от состояния подмышечных и внутренних маммарных лимфатических узлов);
N3а – метастазы в подключичных лимфатических узлах на стороне поражения;
N3b – метастазы во внутренних маммарных (парастернальных) лимфатических узлах при наличии клинически явного поражения подмышечных лимфатических узлов;
N3c – метастазы в надключичных лимфатических узлах на стороне поражения.
М – отдаленные метастазы;
М0 – нет признаков отдаленных метастазов;
М1 – имеются отдаленные метастазы[
5
].
Патологоанатомическая классификация
рТ – первичная опухоль:
- для патологоанатомической классификации необходимо исследование первичной опухоли; по краю производимой резекции не должно быть опухолевой ткани;
- если по краю резекции имеется лишь микроскопическое распространение опухолевой ткани, то случай может классифицироваться как рТ;
- при классификации рТ обязательно измеряют инвазивный компонент;
рN – регионарные лимфатические узлы.
Для определения патологоанатомической классификации необходимо выполнение подмышечной лимфаденэктомии (уровень I). В подобном эксцизионном материале обычно около 6 лимфатических узлов. Для уточнения патоморфологической классификации исследуют один или несколько сторожевых лимфатических узлов. Если классификация основывается только на данных биопсии сторожевых лимфатических узлов (БСЛУ) без дополнительного исследования подмышечных лимфатических узлов, то она кодируется (sn), например, рN1(sn);
рNх – недостаточно данных (не найдено лимфатических узлов, не удалены);
рN0 – нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом исследовании, дополнительные методы определения изолированных опухолевых клеток не проводились;
рN0 (I-) – нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом и иммуногистохимических (ИГХ) исследованиях;
рN0 (I+) – нет признаков поражения метастазами регионарных лимфатических узлов при гистологическом исследовании;
рN1 – микрометастазы или метастазы в 1–3 подмышечных лимфатических узлах и/или микроскопическое поражение внутренних маммарных (парастернальных) лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов;
рN1miс – микрометастазы (более 0,2 мм, но менее 2,0 мм);
рN1а – метастазы в 1–3 подмышечных лимфатических узлах, один из которых более 2 мм в наибольшем измерении;
рN1b – микроскопическое поражение внутренних маммарных (парастернальных) лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов;
рN1с – метастазы в 1–3 подмышечных лимфатических узлах и микроскопическое поражение внутренних маммарных (парастернальных) лимфатических узлов, выявленное по методике исследования (клинически не определяемых) «сторожевых» лимфатических узлов;
рN2 – метастазы в 4–9 подмышечных лимфатических узлах или клинически определяемое поражение внутренних маммарных (парастернальных) лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов;
рN2а – метастазы в 4–9 подмышечных лимфатических узлах (как минимум одно скопление ≥2 мм);
рN2b – клинически определяемое поражение внутренних маммарных (парастернальных) лимфатических узлов при отсутствии поражения подмышечных лимфатических узлов;
рN3 – метастазы в 10 и более подмышечных лимфатических узлах или подключичных лимфатических узлах, или клинически определяемое поражение внутренних маммарных (парастернальных) и подмышечных лимфатических узлов, или поражение 4 и более подмышечных лимфатических узлов с микроскопическим поражением клинически интактных внутренних маммарных (парастернальных) лимфатических узлов, либо поражение надключичных лимфатических узлов;
рN3а – метастазы в 10 и более подмышечных лимфатических узлах (>2 мм) или в подключичных лимфатических узлах;
рN3b – клинически определяемое поражение внутренних маммарных (парастернальных) и подмышечных лимфатических узлов, или поражение более 3 подмышечных лимфатических узлов с микроскопическим поражением клинически интактных внутренних маммарных (парастернальных) лимфатических узлов;
рN3с – метастазы в надключичных лимфатических узлах на стороне поражения; рМ – отдаленные метастазы;
рМ – категории, соответствующие категории М; G – степень дифференцировки ткани опухоли;
Gх – степень дифференцировки нельзя установить;
G1 – высокая степень дифференцировки ткани, 3–5 баллов по шкале SBR[
6
];
G2 – умеренная степень дифференцировки ткани, 6–7 баллов по шкале SBR;
G3 – низкая степень дифференцировки ткани, 8–9 баллов по шкале SBR;
G4 – недифференцированная опухоль;
ypT – состояние первичной опухоли после лекарственного лечения;
ypN – состояние регионарных лимфатических узлов после лекарственного лечения;
ypN – после лечения должно быть оценено так же, как и до лечения (клинически N).
Обозначение (sn) используют в том случае, если оценка «сторожевого» узла была проведена после лечения. Если обозначение (sn) отсутствует, то предполагают, что оценка подмышечных узлов была выполнена после их диссекции.
Рубрикацию Х (ypNХ) нужно использовать, если не была выполнена оценка ypN после лечения (sn) или диссекции подмышечных лимфатических узлов.
Категория N аналогична тем, которые используют для рN.
Клиническое (анатомическое) стадирование РМЖ представлено в таблице 1.
Таблица 1. Группировка рака молочной железы по стадиям
- Микроинвазия – распространение опухолевых клеток через базальную мембрану в прилежащие ткани фокусом не более 0,1 см в наибольшем измерении. При наличии множественных фокусов классификацию проводят по наибольшему измерению. Нельзя использовать сумму размеров фокусов. Наличие множественных фокусов должно быть отмечено так же, как это делается при множественных инвазивных карциномах.
- Грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но без грудных мышц.
- Воспалительная форма РМЖ характеризуется диффузным утолщением кожи с плотными краями, обычно без подлежащей пальпируемой массы. Если биопсия кожи отрицательна и нет локализованной опухолевой массы, при патологической классификации употребляют категорию рТх, а при клинической – Т4d. При оценке категории рТ определяют инвазивный компонент. Втяжение кожи, ретракция соска или другие кожные изменения, за исключением относящихся к Т4б и Т4d, могут оцениваться как Т1, Т2 и Т3, не влияя на стадирование.
- Индексы (sn) или (f) должны быть добавлены к категории N для обозначения способа подтверждения метастатического поражения лимфоузлов — с помощью БСЛУ (sn) или тонкогоигольной аспирационной/core-биопсии (f) (без последующего удаления лимфоузлов) соответственно
- Легкое – pul, кости – oss, печень – hep, плевра – ple, брюшина – per, костный мозг – mar, головной мозг – bra, кожа – ski, надпочечники – adr, лимфатические узлы – lym, другие – оth.
- SBR – шкала Scarff-Bloom-Richardson, Ноттингемская модификация
Этиология и патогенез
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Не существует единого этиологического фактора развития рака молочной железы. У 3–10 % пациентов с РМЖ развитие заболевания связано с наличием мутаций в генах рака молочной железы (breast cancer gene) (BRCA)1, BRCA2, CHEK, NBS1, TP53. У остальных пациентов РМЖ имеет спорадический характер.
В качестве факторов риска развития данной патологии рассматриваются раннее менархе, поздняя менопауза, отсутствие родов, наличие абортов, курение, алкоголь, наличие сахарного диабета, ожирение или повышенный индекс массы тела, низкая физическая активность [1].
Эпидемиология
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Рак молочной железы – наиболее частое злокачественное заболевание у женщин в РФ. В 2018 году зарегистрировано 70 682 новых случая, что составляет 20,9 % в структуре заболеваемости злокачественными новообразованиями у женщин. Средний возраст заболевших составил 61,5 года. Среднегодовой темп прироста заболеваемости (стандартизованный показатель) составил 1,97 % за последние 10 лет. Кумулятивный риск развития РМЖ в 2018 году составил 5,87 % при продолжительности жизни 74 года. В последние годы увеличивается количество пациентов, у которых заболевание диагностировано в I–II стадиях. Так, в 2018 году этот показатель составил 71,2 %, тогда как 10 лет назад равнялся 62,7 %. Стандартизованный показатель смертности снизился с 2008 по 2018 гг. с 17,05 до 14,02 соответственно. Риск умереть от рака молочной железы у женщин в 2018 г. составил 1,6 %. Доля женщин, состоящих на учете 5 и более лет, составляет 59,8 %.
В структуре смертности женского населения РМЖ также находится на первом месте, составляя 16,2 %.
РМЖ у мужчин составляет менее 1 % опухолей этой локализации, занимая 0,3 % в структуре заболеваемости. Принципы диагностики и лечения РМЖ у мужчин не отличаются от таковых у женщин [2].
Клиническая картина
Cимптомы, течение
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Различают несколько клинических форм РМЖ: узловую, диффузную (отечно- инфильтративную, рожистоподобную, маститоподобную и панцирную), а также рак Педжета соска.
Основным клиническим проявлением узловой формы является наличие узлового образования в ткани молочной железы, хотя клиническая картина чрезвычайно многообразна и, в первую очередь, зависит от стадии заболевания. Условно симптомы узловой формы РМЖ можно разделить на характерные для ранних и поздних стадий заболевания.
К клиническим симптомам ранних форм относятся следующие:
- наличие опухолевого узла в ткани молочной железы;
- плотная консистенция опухоли (опухоль может быть деревянистой или даже каменистой плотности);
- ограниченная подвижность либо полное ее отсутствие; как правило, безболезненность опухоли, наличие симптома «умбиликации» – втяжения кожи над опухолью, определяемого при сдвигании кожи;
- наличие одиночного плотного подвижного лимфатического узла в подмышечной области на стороне опухоли, либо нескольких аналогичных лимфоузлов, не спаянных между собой;
- возможны кровянистые выделения из соска, которые встречаются лишь при внутрипротоковом раке и внутрипротоковой папилломе.
К симптомам, характерным для более распространенных форм опухоли, относятся:
- заметная на глаз деформация кожи молочной железы над определяемой опухолью (особенно при осмотре с поднятыми вверх руками);
- выраженный симптом «умбиликации» (втяжения) кожи над опухолью;
- явления лимфостаза – симптом «лимонной корочки» над опухолью или за ее пределами;
- прорастание кожи опухолью и/или изъязвление опухоли;
- выраженное утолщение соска и складки ареолы (симптом Краузе);
- втяжение и фиксация соска;
- деформация молочной железы, уменьшение или увеличение ее размеров, подтягивание ее вверх, фиксация к грудной стенке;
- множественные плотные малоподвижные или неподвижные лимфатические узлы в подмышечной области на стороне опухоли, иногда сливающиеся в конгломераты;
- плотные надключичные лимфатические узлы на стороне поражения.
Диффузные формы
характеризуются диффузным уплотнением всей ткани молочной железы, обусловленным опухолевой инфильтрацией, увеличением ее размеров, гиперемией кожи молочной железы и местной гипертермией (при маститоподобных и рожистоподобных формах возможна общая температурная реакция), выраженным симптомом «лимонной корки» по всей поверхности молочной железы, резким утолщением соска и складки ареолы, втяжением и прочной фиксацией соска, в подавляющем большинстве случаев имеются пораженные подмышечные лимфатические узлы. В ряде случаев необходим дифференциальный диагноз с маститом и рожистым воспалением кожи. Различают первичные диффузные формы рака, когда опухолевый узел в железе не определяется, и вторичные – с наличием опухоли, чаще больших размеров, при которых отек и инфильтрация ткани железы и кожи обусловлены блоком отводящей лимфосистемы за счет массивного поражения регионарных лимфатических коллекторов.
Рак Педжета начинается с появления сухих или мокнущих корок в области соска, покраснения и утолщения соска. Процесс может распространяться на ареолу. Постепенно сосок уплощается, может возникнуть изъязвление, процесс распространяется на кожу молочной железы за пределы ареолы. Одновременно процесс может распространяться по крупным млечным протокам вглубь молочной железы с формированием в ее ткани опухолевого узла. Позже появляются метастазы в регионарных лимфатических узлах.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза или состояния:
- данные анамнеза;
- данные физикального обследования и в ряде случаев инструментальных исследований (рекомендации по применению самих медицинских вмешательств представлены в соответствующих разделах);
- данные морфологического исследования.
2.1. Жалобы и анамнез
- Рекомендуется сбор у пациента врачом-онкологом жалоб и анамнеза с целью выявления клинико-анамнестических особенностей заболевания и факторов, которые могут повлиять на тактику дальнейшего обследования и лечения [5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: у 3–10 % пациентов с РМЖ развитие заболевания имеет наследственный характер и может быть связано с наличием мутаций в генах BRCA1, BRCA2, CHECK и других.
2.2. Физикальное обследование
- Рекомендуется пациентам с подозрением на рак молочной железы выполнять физикальный осмотр в объеме общего осмотра, пальпации, перкуссии и аускультации внутренних органов, пальпации молочных желез и зон регионарного метастазирования (подмышечных, над-, подключичных) с целью оценки общего состояния пациента и определения клинической стадии заболевания [6].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: при осмотре необходимо обратить внимание на симметрию молочных желез, состояние сосково-ареолярного комплекса, наличие отека кожи, других кожных симптомов. При пальпации необходимо обратить внимание на наличие узловых образований, уплотнений, определить их подвижность, наличие инфильтрации окружающих тканей, размер и консистенцию лимфоузлов.
2.3. Лабораторные диагностические исследования
- Рекомендуется выполнять всем пациентам на этапе установления диагноза общий (клинический) анализ крови развернутый и анализ крови биохимический общетерапевтический, включая показатели функции печени (билирубин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ)), исследование свертывающей системы крови (коагулограмма (ориентировочное исследование системы гемостаза)), общий (клинический) анализ мочи для оценки функции внутренних органов [7–12].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: при гормонозависимом РМЖ у пациенток моложе 60 лет с отсутствием менструаций для оценки функции яичников и планирования гормонотерапии (ГТ) проводится исследование уровня фолликулостимулирующего гормона (ФСГ) в сыворотке крови и уровня общего эстрадиола в крови (подробно см. в разделе 3.2.4.4).
- Рекомендуется всем пациентам выполнять патолого-анатомическое исследование биопсийного (операционного) материала молочной железы с применением иммуногистохимических методов для определения биологических характеристик опухоли, патоморфологической стадии РМЖ, степени лечебного патоморфоза [5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: при исследовании биопсийного материала в заключении должны быть указаны гистологический вариант, степень дифференцировки и результат определения рецепторов эстрогенов (РЭ)/ рецепторов прогестерона (РП), 2-го рецептора эпидермального фактора роста человека (human epidermal growth factor receptor 2) (HER2) и антигена, определяющегося в делящихся клетках (Ki67).
При исследовании операционного материала в заключении должны быть указаны:
- расстояние до ближайшего края резекции;
- состояние краев резекции;
- размеры опухоли в трех взаимно-перпендикулярных измерениях;
- гистологическое строение опухоли;
- степень дифференцировки опухоли;
- рТ;
- рN (с указанием общего количества исследованных и пораженных лимфоузлов);
- наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
- при наличии предшествующего комбинированного лечения степень патоморфологического ответа опухоли предпочтительно определять по шкале RCB (бесплатный онлайн калькулятор доступен на сайте http://www.mdanderson.org/education-and-research/resources- for-professionals/clinical-tools- and-resources/clinical-calculators/calculators-cellularity-guide.pdf) (см. приложение Г2).
Определение в опухоли и/или в пораженных опухолью лимфатических узлах уровня экспрессии РЭ и РП является обязательным; предпочтение отдают ИГХ методу [13]. Результат определения рецепторного статуса должен включать данные о процентном содержании РЭ+ и РП+ клеток и интенсивности окрашивания. Одновременно ИГХ методом должны быть определены уровни экспрессии HER2 и Ki67, которые также учитываются при планировании терапии. Определение HER2 рекомендуется проводить только в инвазивном компоненте опухоли. При спорном результате ИГХ анализа HER2 следует провести определение амплификации гена HER2/neu методом in situ гибридизации (FISH или CISH) [14].
У пациентов с метастатическим тройным негативным РМЖ, не получавших лечение по поводу метастатической болезни, целесообразно определение с помощью теста SP142 уровня экспрессии PD-L1 на иммунокомпетентных клетках (первичной опухоли или, предпочтительно, биопсийного материала из метастатического очага) для определения возможности назначения «паклитаксела + альбумин» в комбинации с #атезолизумабом**(режим дозирования представелен в разделе по лечению) [15].
У пациентов с распространенным гормонозависимым HER2-отрицательным раком молочной железы целесообразно определение в образце ткани первичной опухоли или метастатического очага мутаций в гене PIK3CA для решения вопроса о назначении комбинации алпелисиба с фулвестрантом** (режим дозирования представлен в разделе по лечению) [16].
- Рекомендуется выполнять всем пациентам цитологическое исследование микропрепарата тканей молочной железы и цитологическое исследование препарата тканей лимфоузла для уточнения стадии заболевания [5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: показания к выполнению пункции см. в разделе 2.5. В случаях подозрения на рак Педжета рекомендуется выполнять соскоб изменений в области соска и сосково-ареолярного комплекса с последующим цитологическим исследованием.
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии оценивать функцию яичников перед началом ГТ (см. критерии менопаузы) [17–21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
2.4. Инструментальные диагностические исследования
- Рекомендуется выполнить всем пациентам билатеральную маммографию для оценки местного распространения РМЖ [5, 22].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
- Рекомендуется выполнить всем пациентам ультразвуковое исследование (УЗИ) молочных желез и регионарных лимфатических узлов для оценки местного распространения РМЖ [5, 22].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
- Рекомендуется при наличии показаний выполнить магниторезонансную томографию (МРТ) молочных желез для оценки местного распространения РМЖ [22].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
Комментарии: показания к выполнению МРТ молочных желез:
- возраст до 30 лет;
- наличие мутаций в генах BRCA1, BRCA2;
- высокая рентгенологическая плотность молочных желез;
- наличие имплантатов молочных желез при невозможности выполнения качественного маммографического исследования;
- наличие долькового рака in situ
- Рекомендуется выполнить всем пациентам УЗИ органов брюшной полости (комплексное), забрюшинного пространства [5, 23, 24].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
- Рекомендуется выполнить всем пациентам УЗИ малого таза (комплексное) для уточнения степени распространенности РМЖ [25].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется выполнить компьютерную томографию (КТ) или МРТ органов брюшной полости с внутривенным (в/в) контрастированием в том случае, если результаты УЗИ органов брюшной полости неоднозначны или мало информативны [26].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется выполнить всем пациентам рентгенографию грудной клетки в двух проекциях либо КТ органов грудной клетки для исключения отдаленного метастазирования [5, 23].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: КТ органов грудной клетки и является стандартом уточняющей диагностики при РМЖ в большинстве развитых стран для исключения метастазов в легких, лимфоузлах средостения. В рутинной практике данное исследование может быть заменено рентгенологическим исследованием у пациентов с небольшой местной распространенностью опухолевого процесса.
- Рекомендуется выполнить сцинтиграфию костей всего тела при подозрении на метастатическое поражение костей скелета для оценки степени распространенности РМЖ [5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при операбельном РМЖ сцинтиграфия костей всего тела выполняется в случае наличия болей в костях либо повышенном уровне ЩФ. При местно-распространенном и метастатическом РМЖ выполнение данного исследования показано всем пациентам.
- Рекомендуется выполнить всем пациентам прицельную пункционную биопсию новообразования молочной железы (желательно под навигационным контролем рентгенографическим или ультразвуковуковым) для морфологической верификации диагноза и составления плана лечения [27].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется выполнить всем пациентам патолого-анатомическое исследование биопсийного (операционного) материала молочной железы с применением иммуногистохимических методов (определение экспрессии рецепторов к эстрогенам и прогестерону, исследование белка к рецепторам HER2, индекса пролиферативной активности экспрессии Ki-67) для морфологической верификации диагноза и составления плана лечения [28–30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: патоморфологический диагноз устанавливают с помощью исследования биопсийного материала, который должен быть получен до всех видов лечебных воздействий. Трепанобиопсия выполняется с использованием автоматической или полуавтоматической системы с диаметром иглы 14-18 G либо вакуум-ассистированной системой с диаметром иглы 8-12 G. Должно быть получено не менее трех столбиков ткани. Заключительный патоморфологический диагноз устанавливается в соответствии с действующими классификациями ВОЗ и TNM после изучения всех удаленных тканей. При назначении предоперационной системной терапии до начала лечения должно быть проведено полноценное клиническое стадирование; трепанбиопсию опухоли желательно выполнять, даже если на первом этапе планируется оперативное лечение.
- Рекомендуется выполнить тонкоигольную аспирационную биопсию (пункцию) опухоли (желательно под навигационным контролем) с цитологическим исследованием микропрепарата в случае невозможности выполнения трепанобиопсии опухоли для морфологического подтверждения диагноза [5, 27, 31–33].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
- Рекомендуется в случае начала лечения с неоадъювантной лекарственной терапии для правильного стадирования по системе TNM выполнение тонкоигольной аспирационной биопсии (пункции) регионарных лимфатических узлов (желательно под навигационным контролем) с цитологическим исследованием микропрепарата для исключения (или подтверждения) их метастатического поражении при наличии клинических подозрений [5, 34].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
- Рекомендуется для уточнения степени распространения РМЖ выполнить биопсию очагов в органах и тканях под контролем УЗИ/КТ при подозрении на метастатический характер, в случаях, когда их подтверждение принципиально меняет тактику лечения [5, 35].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется выполнить биопсию и патолого-анатомическое исследование биопсийного (операционного) материала первичной опухоли и/или метастатических очагов в органах и тканях (во всех возможных случаях при прогрессировании после первичного лечения раннего и местно-распространенного РМЖ) с применением иммуногистохимических методов (определение экспрессии рецепторов к эстрогенам и прогестерону, исследование белка к рецепторам HER2, индекса пролиферативной активности экспрессии Ki-67), определение амплификации гена HER2 методом флюоресцентной (FISH) или хромогенной (CISH) гибридизации in situ – при необходимости [5, 36–38]; определение экспрессии белка PD-L1 иммуногистохимическим методом – при метастатическом тройном негативном фенотипе РМЖ [15], а также определение мутаций в гене PIK3CA у пациентов с метастатическим гормонозависимым HER2-отрицательным РМЖ [16, 39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией с туморотропными РФП (с или без контрастирования) (ПЭТ- КТ) для оценки степени распространения РМЖ в случаях, когда стандартные методы стадирующих обследований неоднозначны, особенно при местно-распространенном процессе, когда обнаружение метастазов принципиально меняет тактику лечения [40].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется выполнить МРТ или КТ головного мозга с в/в контрастированием для исключения метастатического поражения при подозрении на наличие метастазов в головном мозге [40].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуется выполнить всем пациентам электрокардиографию (ЭКГ) для исключения патологии сердечно-сосудистой системы [41].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
2.5. Иные диагностические исследования
- Рекомендуется определение методом ПЦР в лимфоцитах крови наиболее частых герминальных мутаций в генах BRCA1/2 и консультация врача-генетика для определения тактики лечения в следующих случаях:
- у женщин с подтвержденным РМЖ при отягощенном семейном анамнезе (наличие РМЖ у близких родственников в возрасте ≤50 лет, рака яичников или маточных труб, рака поджелудочной железы, РМЖ у мужчины, метастатического рака предстательной железы);
- у женщин с подтвержденным РМЖ в возрасте <45 лет;
- у женщин < 60 лет с тройным негативным фенотипом РМЖ;
- при первично-множественном РМЖ (включая, но не ограничиваясь установленным диагнозом рака контрлатеральной молочной железы, рака яичников или маточных труб, рака поджелудочной железы);
- при РМЖ у мужчин [1].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: пациенток, имеющих личный/наследственный анамнез, у которых не выявлены частые наследственные мутации, следует направлять на расширенное исследование герминальных и/или соматических мутаций с использованием высокопроизводительного секвенирования (NGS).
- Рекомендуется с целью предотвращения нежелательной беременности информировать пациенток детородного возраста о необходимости использовать надежные средства контрацепции в период противоопухолевой лекарственной терапии и в ближайшее время после нее [42, 43].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью сохранения репродуктивной функции на этапе обследования информировать пациенток о возможном негативном влиянии лекарственного лечения на функцию яичников и фертильность [42-44].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 3).
- Рекомендуется до начала лечения по поводу РМЖ провести консультацию врача акушера-гинеколога/репродуктолога для обсуждения возможных вариантов вспомогательных репродуктивных технологий при желании пациентки в будущем иметь детей [42, 45, 46].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется при выявлении РМЖ у беременной женщины при желании сохранения ею беременности направить пациентку в онкологическое учреждение, имеющее опыт лечения подобных пациенток. Тактика лечения должна обсуждаться на консилиуме с участием врача-акушера-гинеколога [42].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется при подготовке к хирургическому лечению пациенток с сопутствующими заболеваниями с целью оценки функционального состояния внутренних органов по показаниям проводить дополнительное обследование [47]:
- эхокардиография (ЭхоКГ);
- холтеровское мониторирование сердечного ритма;
- исследование функции внешнего дыхания;
– дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока;
- ультразвуковая допплерография (УЗДГ) сосудов (артерий и вен) нижних конечностей;
- консультации врача-кардиолога, врача-эндокринолога, врача-невролога и врачей других специальностей по показаниям.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется для оптимального локального и системного контроля над заболеванием перед началом неоадъювантной лекарственной терапии провести полноценное клинико- лабораторное обследование (см. раздел 2 «Диагностика»), в том числе биопсию опухоли (выполняется врачом-хирургом или врачом-онкологом) с патолого-анатомическим исследованием биопсийного (операционного) материала с применением иммуногистохимических методов (выполняется врачом-патологоанатомом) [36].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется пациентам гормонозависимым РМЖ, получающим длительно ингибиторы ароматазы, а также пациентам, которым проводится овариальная супрессия или у которых в результате противоопухолевого лечения наступила ранняя менопауза, контроль минеральной плотности костей (рентгеноденситометрия) 1 раз в год [48].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Общие принципы лечения
Целесообразно составлять план лечения на консилиуме с участием врача-хирурга, врача- онколога и врача-радиотерапевта. При необходимости рекомендуется привлекать врачей иных специальностей (врача-патологоанатома, врача-анестезиолога-реаниматолога и др.) Рекомендуемый алгоритм лечебно-диагностических мероприятий при РМЖ представлен на рис. 1.
При невозможности проведения (наличие противопоказаний) рекомендованных методов лечения необходимо составить индивидуальный план лечения. Общие противопоказания: случаи тяжелых соматических заболеваний в стадии декомпенсации, когда риск возможных осложнений для жизни в процессе лечения выше риска прогрессирования РМЖ. Выбор варианта операции определяется необходимостью соблюдения принципов абластики, с учетом возможного проведения лучевой терапии (ЛТ) и лекарственной терапии, а также желания пациентки.
Целесообразно консилиуму с участием врача-хирурга, врача-онколога и врача- радиотерапевта план системной (лекарственной) терапии составлять с учетом степени распространенности заболевания (стадии) и принадлежности опухоли к одному из биологических подтипов (см. разделы 3.2 и 3.4) [49].
- Рекомендуется у пациентов раком молочной железы проведение противоопухолевой лекарственной терапии в соответствие с общими принципами, изложенными в «Практических рекомендациях по общим вопросам проведения противоопухолевой лекарственной терапии» Российского общества клинической онкологии (коллектив авторов: Трякин А. А., Бесова Н. С., Волков Н. М., Гладков С. А., Карасева В. В., Сакаева Д. Д. Практические рекомендации по общим принципам проведения противоопухолевой лекарственной терапии. Злокачественные опухоли. Практические рекомендации RUSSCO #3s2, 2020 (том 10). 01. DOI: 10.18027 / 2224‑5057‑2020‑10‑3s2–01).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств 5)
- Рекомендуется для полноценного локального контроля проводить высокотехнологичную 3D конформную дистанционную ЛТ после выполнения предлучевой подготовки на компьютерном томографе или рентгеновском симуляторе с КТ-приставкой. При объемном 3D планировании рекомендуется оконтуривание лечебных объемов и органов риска [50, 51].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: расчет дозы в заданной мишени целесообразно проводить с учетом толерантности нормальных тканей [52]. Доза для сердца, контрлатеральной молочной железы, легких и других нормальных тканей должна быть сведена к минимуму. Колебания уровня доз в запланированном лечебном объеме не должны превышать 7 %, а 95 % запланированного лечебного объема должны получить не менее 95 % запланированной дозы согласно рекомендациям Международной комиссии по радиационным единицам и измерениям (МКРЕ)-50, 62 и 83. Объем ткани молочной железы, получающий более 105 % от предписанной дозы, должен быть минимизирован [53].
Для полноценного локального контроля 3D конформную целесообразно ЛТ проводить на линейных ускорителях электронов с многолепестковыми коллиматорами диафрагмы фотонами 6 или 18 МэВ, электронами различных энергий или на протонном ускорителе с использованием протонного пучка 70-230 МэВ. Целесообразно регулярно проводить верификацию укладок пациенток и лечебных программ на аппарате для проведения ЛТ [53].
При отсутствии линейных ускорителей электронов для полноценного локального контроля проводить дистанционную ЛТ на дистанционных гамма-терапевтических аппаратах [53].
- Рекомендуется для точного воспроизведения укладки пациентов на протяжении всего курса ЛТ использовать специальные фиксирующие приспособления – позиборды, подголовники, подставки под колени [53].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется проводить ЛТ 5 дней в неделю [54 ,55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: не рекомендуется начинать ЛТ в пятницу, а заканчивать в понедельник, т.к. это снижает эффективность проводимой терапии.
Клинические группы РМЖ:
- первично операбельный (резектабельный) РМЖ (0, I, IIA, IIB, IIIA (T3N1M0) стадии);
- местно-распространенный (первично не операбельный/не резектабельный) РМЖ (IIIA (кроме T3N1M0), IIIВ, IIIС стадии);
- метастатический РМЖ или рецидив болезни.
Алгоритм лечебно-диагностических мероприятий при различных стадиях и клинических группах РМЖ представлен на рис. 1, 2.
3.2. Первично операбельный рак молочной железы (0, I, IIA, IIB, IIIA стадии)
3.2.1. Стадия 0 (ТisN0М0), протоковый рак in situ
- Рекомендуется пациентам для обеспечения оптимального локального контроля над болезнью и сохранения органа предпочтительно выполнять органосохраняющее хирургическое вмешательство (секторальная резекция, лампэктомия) [55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: при необходимости целесообразно выполнение срочного интраоперационного патолого-анатомического (в том числе цитологического) исследования краев резекции.
- При обнаружении элементов опухоли в краях резекции рекомендуется повторная операция: ререзекция или мастэктомия для достижения «чистоты» краев резекции с целью обеспечения локального контроля над заболеванием [56, 57].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
Комментарии: «чистым» считается отсутствие неинвазивного рака на расстоянии >2 мм от края резекции [56, 57].
- Рекомендуется пациентам при необходимости выполнение с эстетической целью симметризирующей операции на контралатеральной молочной железе [57].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется при выполнении органосохраняющей операции маркировать ложе удаленной опухоли рентгенпозитивными клипсами для визуализации зоны операции во время адъювантной лучевой терапии [58].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: использование 5 и более клипс позволяют оптимальным образом визуализировать зону для последующей лучевой терапии.
- Рекомендуется при невозможности выполнения органосохраняющей операции для обеспечения оптимального локального контроля над болезнью и достижения удовлетворительного косметического эффекта выполнение мастэктомии с первичной реконструкцией молочной железы, одномоментной/отсроченной реконструкцией молочной железы или без нее [59 ,60].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: при выполнении подкожной мастэктомии обязателен гистологический контроль состояния протоков железы, пересеченных за соском. Обнаружение элементов опухоли в этой зоне является показанием к удалению сосково-ареолярного комплекса. При необходимости возможна симметризирующая операция на контралатеральной молочной железе.
- Рекомендуется в случае обнаружения инвазивного компонента при плановом гистологическом исследовании выполнение БСЛУ для определения степени распространения РМЖ [61].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- При технической невозможности выполнения БСЛУ рекомендовано выполнение подмышечной лимфаденэктомии (I уровня) для обеспечения оптимального локального контроля [61].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: при подозрении на наличие инвазивного компонента в опухоли молочной железы целесообразно выполнять БСЛУ.
- Не рекомендуется в случаях обнаружения микрометастаза в «сторожевом» лимфатическом узле выполнение пациентам лимфаденэктомии [61–63].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Не рекомендуется после мастэктомии проводить ЛТ [64] .
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 3).
- Рекомендуется всем пациентам, которым выполнена органосохраняющая операция, проведение адъювантной ЛТ для снижения риска местного рецидива [65].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: для обеспечения оптимального локального контроля после органосохраняющей операции определять показания к ЛТ на консилиуме с участием врача-хирурга и врача- радиотерапевта, исходя из индивидуального риска прогрессирования опухолевого процесса. Адъювантная ЛТ не влияет на выживаемость. Вся оперированная молочная железа должна получить дозу 46-50 Гр за 23-25 фракций или 40-42,5 Гр за 15-16 фракций. Лечение проводится 5 раз в неделю.
- Рекомендуется всем пациентам начать послеоперационный курс дистанционной ЛТ в сроки до 12 недель от даты операции при условии полного заживления операционной раны [66].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется при положительных РЭ и РП для профилактики развития вторых опухолей в контралатеральной или резецированной (в случае органосохраняющей операции) молочной железе рассмотреть для пациентов в пре- и постменопаузе назначение ГТ тамоксифеном** (табл. 7) [67, 68].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: при адъювантной терапии рака in situ (протоковом или дольковом) химиотерапия и овариальная супрессия не показаны.
- Рекомендуется при положительных РЭ и РП для пациентов в постменопаузе рассмотреть назначение ГТ ингибиторами ароматазы (см. раздел 3.2.4.4) для профилактики развития вторых опухолей в контралатеральной или резецированной (в случае органосохраняющей операции) молочной железе [68 ,69].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: при адъювантной терапии рака in situ (протоковом или дольковом) химиотерапия и овариальная супрессия не показаны.
3.2.2. Ста
дии I (Т1N0М0) и IIА (Т2N0М0) (локальная терапия)
- Рекомендуется для обеспечения оптимального локального контроля над болезнью и сохранения органа предпочтительно выполнять органосохраняющее хирургическое вмешательство (секторальная резекция, лампэктомия) [54, 55].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: при необходимости целесообразно выполнение срочного интраоперационного патологоанатомического (в том числе, цитологического) исследования краев резекции.
- Рекомендуется выполнять хирургическое вмешательство в сочетании с БСЛУ [70].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- При обнаружении элементов опухоли в краях резекции рекомендуется повторная операция: ререзекция или мастэктомия для достижения «чистоты» краев резекции [70– 73].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется при выполнении органосохраняющей операции маркировать ложе удаленной опухоли рентгенпозитивными клипсами для визуализации зоны операции во время адъювантной лучевой терапии [58, 60].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: использование 5 и более клипс позволяют оптимальным образом визуализировать зону для последующей лучевой терапии.
- Рекомендуется при невозможности выполнения БСЛУ или при выявлении метастатического поражения сторожевого лимфатического узела (СЛУ) выполнить подмышечную лимфаденэктомию (I-II уровни) [70].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарий: при необходимости возможна симметризирующая операция на контралатеральной молочной железе.
- Рекомендуется пациентам выполнение подкожной или кожесохраняющей мастэктомии с одномоментной или отсроченной реконструкцией (метод реконструкции определяет врач-хирург) с БСЛУ для достижения оптимального локального контроля над болезнью и удовлетворительных косметических результатов [70, 71].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется пациентам выполнение мастэктомии с БСЛУ. При невозможности выполнения БСЛУ или при выявлении метастатического поражения СЛУ рекомендуется выполнение подмышечной лимфаденэктомии (I-II уровни) для достижения оптимального локального контроля над болезнью [70, 71].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: объем оперативного вмешательства определяет врач-хирург или врач-онколог в зависимости от расположения опухоли и соотношения размера опухоли и объема молочной железы. Объем подмышечной лимфаденэктомии: предпочтительным является БСЛУ. В случаях обнаружения микрометастазов в 1–2 сторожевых лимфатических узлах выполнение лимфаденэктомии не обязательно [74]. В случаях обнаружения метастаза при плановом гистологическом исследовании в одном из исследованных сторожевых лимфатических узлов проведение лучевой терапии на аксиллярную зону в дозе 50 Гр может служить альтернативой подмышечной лимфаденэктомии [56].
- Рекомендуется проводить ЛТ после мастэктомии в случае наличия опухолевых клеток по краю резекции или на расстоянии менее 1 мм от края резекции для достижения оптимального локального контроля над болезнью [75].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: передняя грудная стенка + зоны лимфооттока на стороне поражения должны получить дозу 46–50Гр за 23–25 фракций, лечение проводится 5 дней в неделю. При наличии показаний показано подведение «буста» (дополнительное локальное лучевое воздействие) на область послеоперационного рубца в дозе 2 Гр за фракцию до дозы 60 Гр за весь курс ЛТ (электронным или фотонным пучком) [54,76, 77]. При отсутствии показаний к адъювантной полихимиотерапии послеоперационный курс дистанционной ЛТ рекомендовано начать в сроки 12 недель от даты операции при при условии полного заживления операционной раны.
- Рекомендуется проводить курс послеоперационной дистанционной ЛТ после выполнения органосохраняющих операций для достижения оптимального локального контроля над болезнью [78–80].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: вся оперированная молочная железа должна получить дозу 46–50 Гр за 23–25 фракций или 40-42,5 Гр за 15-16 фракций [54].
При отсутствии показаний к адъювантной полихимиотерапии (ПХТ) послеоперационный курс дистанционной ЛТ рекомендовано начать в сроки до 16 недель от даты операции при условии полного заживления операционной раны.
При назначении адъювантной ПХТ лучевую терапию рекомендовано начать по завершении всей запланированной полихимиотерапии после восстановления нормальных показателей крови (обычно через 3–4 недели) (вне зависимости от длительности курса ХТ).
Следует рассмотреть целесообразность лучевой терапии на зоны лимфооттока на стороне поражения у пациентов с непораженными лимфатическими узлами с центральной/медиальной локализацией опухоли или размером опухоли более 2 см при наличии факторов высокого риска развития рецидива (молодой возраст, сосудистая инвазия, трижды негативный подтип опухоли).
Не рекомендуется проводить ускоренную частичную ЛТ отдельно отобранным пациентам после органосохраняющих операций вне рамок крупных исследовательских протоколов.
- Рекомендуется для достижения оптимального локального контроля над болезнью подводить («буст» на ложе удаленной опухоли молочной железы у пациенток с высоким риском локального рецидива (молодой возраст, в возрасте старше 50 лет с G3, при опухолевых клетках в краях резекции) [81 ,82].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Комментарии: «буст» может быть проведен методом дистанционной ЛТ электронным или фотонным излучением дозой 10-16 Гр за 4-8 фракций, лечение 5 дней в неделю, интраоперационно на ускорителях электронов или фотонов, либо при помощи низкоэнергетического рентгеновского излучения разовой очаговой дозой (РОД) 5-12 Гр, либо методом внутритканевой ЛТ в дозе 15 Гр, особенно в случаях, когда первичная опухоль располагалась в молочной железе глубже 28 мм от кожи [81, 83].
- Рекомендуется при назначении ГТ и/или анти-HER2 терапии ЛТ проводить одновременно с ГТ и/или анти-НER2 терапией [54, 80, 84, 85].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: у пациентов РМЖ старше 70 лет с T1N0M0 и положительном по рецепторам эстрогенов статусом опухоли при отсутствии других факторов риска возможно рассмотреть отказ от проведения лучевой терапии на оставшуюся часть молочной железы после органосохраняющей операции при условии проведения в дальнейшем длительной гормонотерапии [54 ,86].
3.2.3. Ста
дии IIА (Т1N1М0), IIВ (Т2N1М0, Т3N0М0), IIIA (Т3N1М0) (локальнаятерапия)
- Рекомендуется пациентам выполнение резекции молочной железы с подмышечной лимфаденэктомией для достижения оптимального локального контроля над болезнью [72, 87–89].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: возможно выполнение срочного интраоперационного патолого-анатоического (в том числе, цитологического) исследования краев резекции. При необходимости возможна симметризирующая операция на контралатеральной молочной железе. При обнаружении элементов опухоли в краях резекции рекомендуется повторная операция: ререзекция или мастэктомия для достижения «чистоты» краев резекции.
- Рекомендуется при выполнении органосохраняющей операции маркировать ложе удаленной опухоли рентгенпозитивными клипсами для визуализации зоны операции во время адъювантной лучевой терапии [60].
Уровень убедительности рекомендаций – 4 (уровень достоверности доказательств – С).
Комментарии: использование 5 и более клипс позволяют оптимальным образом визуализировать зону для последующей лучевой терапии.
- Рекомендуется для достижения оптимального локального контроля над болезнью при невозможности органосохраняющей операции выполнение подкожной или кожесохраняющей мастэктомии с одномоментной или отсроченной реконструкцией с подмышечной лимфаденэктомией (метод реконструкции определяет врач-хирург или врач-онколог). При необходимости возможна симметризирующая операция на контралатеральной молочной железе [78].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется при невозможности выполнения органосохраняющей операции либо подкожной мастэктомии выполнение мастэктомии с подмышечной лимфаденэктомией для достижения оптимального локального контроля над болезнью [78, 87].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется при стадии T3N0 выполнение БСЛУ для уточнения степени распространения РМЖ [61].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- При выявлении метастатического поражения СЛУ рекомендуется выполнение подмышечной лимфаденэктомии для достижения оптимального локального контроля над болезнью [90].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: объем хирургического вмешательства определяет врач-хирург в зависимости от расположения опухоли и соотношения размера опухоли и объема молочной железы. При лимфаденэктомии на усмотрение врача-хирурга удаляют лимфатические узлы I-II или I-III уровней.
- Рекомендуется для достижения оптимального локального контроля над болезнью проведение ЛТ после мастэктомии [54, 76, 77, 87, 91].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: ЛТ после мастэктомии проводится в дозе 46–50 Гр за 23–25 фракций в соответствии со следующими показаниями:
- при поражении 1-3 лимфоузлов – на мягкие ткани передней грудной стенки +/- «буст» на область послеоперационного рубца в дозе 10 Гр за 5 фракций, над-/подключичную зону, ипсилатеральные парастернальные лимфатические узлы, любую часть подмышечной области (как зону риска) (ЛТ можно не проводить пациенткам с 1 пораженным лимфатическим узлом при отсутствии факторов высокого риска рецидива опухоли);
- при рN0, размере опухоли >5 см – на мягкие ткани передней грудной стенки + зоны лимфооттока;
- при рN0, размере опухоли <5 см и наличии опухолевых клеток на расстоянии <1 мм от края резекции – рассмотреть проведение ЛТ на мягкие ткани передней грудной стенки + зоны лимфооттока [54, 64, 70].
- Рекомендуется для достижения оптимального локального контроля над болезнью проведение ЛТ после органосохраняющих операций [54, 80, 87].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарии: ЛТ после органосохраняющих операций проводится в соответствии со следующими принципами:
- при отсутствии пораженных лимфатических узлов (N0) только на оставшуюся часть молочной железы дозой 46-50 Гр за 23-25 фракций или 40-42,5 Гр за 15-16 фракций + «буст» на ложе удаленной опухоли (10-16 Гр за 5-8 фракций) по показаниям (см. выше);
- при N0 рассмотреть целесообразность облучения оперированной молочной железы и надподключичной и парастернальной зон у пациентов при медиальной /центральной локализации опухоли или размере опухоли >2см в сочетании с факторами неблагоприятного прогноза (молодой возраст, лимфоваскулярная инвазия, РОД 2 Гр, СОД 46–50 Гр;
- при поражении 1-3 лимфатических узлов (N1) проводить ЛТ на оперированную молочную железу, над-/подключичную, ипсилатеральную парастернальную и часть подмышечной зоны (как зону особого риска) РОД 2 Гр, СОД 45-50 Гр;
- послеоперационный курс дистанционной ЛТ при отсутствии в плане лечения адъювантной ХТ рекомендовано начать в сроки до 12 недель от даты операции при условии полного заживления операционной раны;
- послеоперационный курс дистанционной ЛТ в случае проведения адъювантной ХТ рекомендовано начать после окончания ХТ при восстановлении показателей анализа крови (в среднем через 3-4 недели) ЛТ возможно проводить одновременно с ГТ и анти-HER2 терапией [54, 90].
При планировании подкожной или кожесохраняющей мастэктомии с одномоментной реконструкцией пациентку до операции должен проконсультировать врач-радиотерапевт. При наличии показаний к ЛТ рекомендовано выполнить отсроченную реконструктивную операцию после завершения курса ЛТ для снижения частоты возможных осложнений [80, 87].
3.2.4. Лекарственная терапия (адъювантная/неоадъювантная)
- Рекомендуется для снижения риска рецидива и смерти проводить лекарственную (адъювантную/неоадъювантную) терапию [37].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется для назначения оптимальной адъювантной лекарственной терапии учитывать прогноз заболевания, ожидаемую пользу и возможные побочные эффекты адъювантной лекарственной терапии, сопутствующую патологию, а также предпочтения пациента. Возраст сам по себе не является ограничением для лекарственной терапии при отсутствии сопутствующей патологии [37].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при опухолях небольших размеров (< 5 мм) в сочетании c N0, являющихся прогностически благоприятными, адъювантная лекарственная терапия обладает минимальной эффективностью. Назначение адъювантной гормонотерапии (при гормонозависимых опухолях) в такой ситуации имеет целью профилактику вторых (контралатеральных) гормонозависимых опухолей.
При проведении адъювантной лекарственной терапии соблюдать следующие принципы:
- план адъювантной лекарственной терапии основывать на принадлежности опухоли к одному из молекулярно-биологических подтипов (табл. 2, 3) [37];
- адъювантную лекарственную терапию начинать с ХТ, если таковая показана; ХТ таксанами рекомендуется проводить одновременно с анти-HER2-терапией, если таковая показана [37];
- адъювантную ГТ, если таковая показана, рекомендуется начинать после завершения ХТ и проводить одновременно с анти-HER2-терапией и ЛТ, если таковые показаны;
- адъювантную ЛТ, если таковая показана, рекомендуется начинать после завершения ХТ и проводить одновременно с ГТ и анти-HER2-терапией, если таковые показаны [37];
- при проведении ХТ использовать стандартные режимы с соблюдением рекомендуемой дозовой интенсивности и избегать необоснованной (в отсутствие токсичности) редукции доз препаратов и увеличения интервалов между курсами [36];
- при проведении ХТ использовать последовательное (а не одновременное!) введение антрациклинов и родственных соединений и таксанов; при назначении паклитаксела** предпочтительно еженедельное введение, особенно при тройном негативном варианте РМЖ [92].
Последовательность различных методов адъювантной терапии представлена на рис. 3 [37].
Таблица 2. Суррогатное определение молекулярно-биологических подтипов рака молочной железы [36, 37]
Примечания:
1значение Ki67 следует оценивать, исходя из опыта локальной патоморфологической лаборатории: например, если медиана значений Ki67 при гормонозависимом РМЖ составляет в данной лаборатории 20 %, то значение этого показателя, равное ≤10 %, следует расценивать как однозначно низкое, а ≥30 % − как однозначно высокое; при уровне Ki67 от 20 до 30 % при решении вопроса о тактике лечения следует учитывать другие, клинико- морфологические факторы прогноза (стадию, степень злокачественности, морфологический вариант и др.) [93];
2пороговым значением при определении РП считается 20 %[94].
Таблица 3. Рекомендуемый алгоритм назначения адъювантной системной терапии в зависимости от молекулярно-биологического подтипа и стадии рака молочной железы [38, 95–97]
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии при HER2-отрицательном РМЖ применять режимы адъювантной ХТ на основе антрациклинов и родственных соединений и таксанов [38, 92, 95–107], см. табл. 4.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии пациентам РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II-III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от выраженности патоморфоза в первичной опухоли в молочной железе) или при инвазивной резидуальной опухоли в молочной железе, соответствующей 0-II степени лекарственного патоморфоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) использовать #капецитабин** в дозе 2000 мг/м2 внутрь в 1–14-й дни каждые 3 нед в течение 6 мес [54, 108, 109], см. табл. 4.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Таблица 4. Рекомендуемые режимы адъювантной химиотерапии HER2-отрицательного рака молочной железы [38, 92, 95–97, 108, 110–114]
1доксорубицин** может быть заменен на #эпирубицин** в курсовой дозе 90мг/м2 (режим ЕС [115]);
2требуется профилактическое назначение гранулоцитарного колониестимулирующего фактора (Г-КСФ): #филграстим** 5 мкг/кг подкожно (п/к) через 24–72 часа после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира или #пэгфилграстим** в дозе 6 мг или #эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения химиопрепаратов [95, 116–118];
3режим с уплотненным введением химиопрепаратов следует рассмотреть при быстро пролиферирующих (с высоким Ki67) вариантах РМЖ;
4при использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы – дексаметазон 10 мг в/м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30–60 мин до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30–60 мин до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в/в за 30–60 мин до введения паклитаксела, а введение блокаторов H1/H2 гистаминовых рецепторов – только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥1,0×109/л и количестве тромбоцитов ≥100,0×109/л [119];
5режим введения паклитаксела** 175 мг/м2 1 раз в 3 недели является менее эффективным, особенно при тройном негативном подтипе РМЖ [92];
6при противопоказаниях к назначению антрациклинов и родственных соединений и таксанов;
7пациентам РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в стандартном объеме, при наличии инвазивной резидуальной опухоли согласно выше приведенной рекомендации [108].
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии в схему лечения HER2-положительного РМЖ включать ХТ, анти-HER2 терапию и ГТ (при наличии в опухоли РЭ и РП) [37, 54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии HER2-положительного РМЖ использовать режимы адъювантной лекарственной терапии на основе антрациклинов и родственных соединений и/или таксанов и анти-HER2 терапии, приведенные в табл. 5. [38, 54, 95–97, 109].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии больным, получившим неоадъювантную ХТ антрациклинами и/или таксанами и трастузумабом** (± пертузумаб**) в стандартном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов), назначать трастузумаб эмтанзин** 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов [114], см. табл. 5.
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: при досрочном прекращении введения трастузумаба-эмтанзина в связи с токсичностью следует продолжить введение трастузумаба до общей продолжительности анти-HER2 терапии 1 год, включая дооперационный этап [114].
Таблица 5. Рекомендуемые режимы адъювантной лекарственной терапии HER2- положительного рака молочной железы [54, 95, 104, 106, 109, 120–123]
Примечания:
1доксорубицин** может быть заменен на #эпирубицин** в курсовой дозе 90 мг/м2 (режим ЕС) [115]; не рекомендуется одновременное введение антрациклинов и родственных соединений (доксорубицина** и #эпирубицина**) и анти-HER2 препаратов (трастузумаба**, пертузумаба**) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и родственными соединениями и/или трастузумабом** необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес (или чаще при наличии показаний);
2введение анти-HER2 препаратов (трастузумаба**, пертузумаба**) целесообразно начинать одновременно с безантрациклиновым таксан-содержащим режимом;
3возможно использование лекарственной формы трастузумаба** для подкожного введения в дозе 600 мг/5 мл (независимо от массы тела пациента) 1 раз в 3 нед; нагрузочная доза не требуется [125, 126];
4длительность адъювантной терапии #трастузумабом** составляет 12 мес, включая дооперационный этап в случае проведения неоадъювантной терапии; общая длительность применения #трастузумаба** не должна превышать 12 мес, включая длительность предоперационной терапии;
5при использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1–2-й курсы – дексаметазон 10 мг в/м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30–60 мин до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30–60 мин до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в/в за 30–60 мин до введения паклитаксела, а введение блокаторов H1/H2 гистаминовых рецепторов – только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥1,0 × 109/л и количестве тромбоцитов ≥100,0 × 109/л [119];
6целесообразно рассмотреть применение данного режима при T1b,c (>5 мм, но ≤20 мм) и N0;
7показано профилактическое назначение Г-КСФ: #филграстим** 5 мкг/кг подкожно (п/к) через 24–72 часа после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира или #пэгфилграстим** в дозе 6 мг или #эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения химиопрепаратов [95, 116–118];
8режим с уплотненным введением химиопрепаратов целесообразно рассмотреть при быстро пролиферирующих (с высоким Ki67) вариантах РМЖ;
9режим показан при сочетании следующих признаков: не проводилась неоадъювантная лекарственная терапия, N≥2; пертузумаб** вводится в сочетании с трастузумабом** в течение 12 мес;
10рекомендуется пациентам, получившим неоадъювантную ХТ антрациклинами и/или таксанами и трастузумабом** (± пертузумаб**) в стандартном объеме, при наличии инвазивной резидуальной опухоли согласно выше приведенной рекомендации [114].
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии проводить адъювантную ГТ всем пациентам с гормонозависимыми опухолями независимо от возраста, функции яичников, стадии заболевания, HER2 статуса, проведения адъювантной ХТ или анти-HER2 терапии [17].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: гормонозависимыми считаются опухоли с определяемой экспрессией РЭ и/или РП в ≥1 % клеток инвазивного РМЖ [17]. Выбор режима ГТ зависит от функции яичников (см. табл. 6, 7).
- Рекомендуется для проведения оптимальной адъювантной лекарственной терапии использовать режимы, приведенные в таблицах 6, 7 [109, 127, 128].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Таблица 6. Лекарственные препараты, рекомендуемые для адъювантной гормонотерапии рака молочной железы
Примечания:
1могут использоваться независимо от функции яичников; овариальная супрессия в дополнение к антиэстрогенам рекомендуется пациентам с сохранной функцией яичников при наличии факторов высокого риска рецидива (см. табл. 7); определение мутаций гена CYP2D6 для решения вопроса о назначении тамоксифена** в рутинной практике не рекомендуется;
2показано использовать только у пациентов в менопаузе; у пациентов с сохранной функцией яичников для назначения ингибиторов ароматазы требуется овариальная супрессия;
3показано использовать только у пациентов с сохранной функцией яичников при необходимости овариальной супрессии; назначаются в сочетании с антиэстрогенами или ароматазы ингибиторами; гонадотропин-рилизинг-гормон (ГРГ) рекомендуется вводить 1 раз в 28 дней.
Таблица 7. Рекомендуемые режимы адъювантной гормонотерапии рака молочной железы в зависимости от функции яичников
Примечания:
1к факторам неблагоприятного прогноза относятся Т3−4, N+, G3, гиперэкспрессия/ амплификация HER2, высокий Ki67, выраженная лимфоваскулярная инвазия;
2рекомендуемая продолжительность овариальной супрессии составляет 5 лет;
3овариальная супрессия необходима в течение всего срока приема ароматазы ингибиторов;
4при промежуточном прогнозе (T2N0 и G2) в случае назначения овариальной супрессии (в сочетании с тамоксифеном** или ароматазы ингибиторами) возможен отказ от адъювантной ХТ.
Тамоксифен** может использоваться как у пациентов в менопаузе, так и при сохранной функции яичников.
Ароматазы ингибиторы противопоказаны при сохранной функции яичников и могут назначаться только пациентам, достигшим стойкой физиологической менопаузы (см. критерии менопаузы) или получающим овариальную супрессию. Терапия ароматазы ингибиторами ассоциируется с меньшей частотой тромбоэмболических осложнений и рака эндометрия и с большей частотой остеопороза (и связанных с ним переломов костей) и осложнений со стороны сердечно-сосудистой системы по сравнению с тамоксифеном**. Ароматазы ингибиторы третьего поколения (летрозол, анастрозол**, эксеместан) равно эффективны.
Критерии менопаузы [54]:
- билатеральная овариэктомия;
- возраст ≥60 лет;
- возраст <60 лет:
- в отсутствие ХТ, ГТ тамоксифеном** или торемифеном и ОС: аменорея в течение ≥12 мес в сочетании с постменопаузальными уровнями ФСГ и эстрадиола;
- в процессе терапии тамоксифеном** или торемифеном: постменопаузальные уровни ФСГ и эстрадиола.
При сохранной функции яичников на момент начала ХТ (нео-/адъювантной) аменорея не является достаточным признаком достижения менопаузы, и для назначения препаратов, разрешенных к применению только у пациентов в менопаузе, необходима овариальная супрессия с помощью любого доступного способа либо регулярное определение уровней ФСГ и эстрадиола.
Для достижения овариальной супрессии могут быть использованы следующие методы:
- лекарственный (аналоги ГРГ; см. табл. 6):
- вызывает обратимое подавление функции яичников;
- не всегда обеспечивает полное подавление функции яичников, особенно у женщин молодого возраста; для подтверждения полной овариальной супрессии необходимо определение эстрадиола в сыворотке крови, особенно у женщин, получающих ингибиторы ароматазы; определение ФСГ в период лечения аналогами ГРГ неинформативно; прием ингибиторов ароматазы следует начинать через 6−8 недель после первого введения аналогов ГРГ;
- аналоги ГРГ рекомендуется вводить ежемесячно;
- хирургический (билатеральная овариэктомия); вызывает необратимое выключение функции яичников;
- лучевой; вызывает необратимое выключение функции яичников (наименее предпочтительный вариант).
Оптимальный метод овариальной супрессии не определен.
- Рекомендуется для сохранения функции яичников и фертильности у молодых женщин, не завершивших репродуктивную функцию, с целью овариальной супрессии использовать аналоги ГРГ, подавляющие функцию яичников обратимо [17].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 2).
- Рекомендуется для оптимального локального и системного контроля над заболеванием проведение неоадъювантной лекарственной терапии [138–140].
Уровень убедительности рекомендаций − A (уровень достоверности доказательств – 1).
Комментарий: неоадъювантная лекарственная терапия проводится при соблюдении всех следующих условий:
-
доказанный инвазивный первично операбельный РМЖ (T2N0M0, T2N1M0, T3N0M0, T3N1M0);
- тройной негативный фенотип или HER2-положительный статус с целью выполнения органосохраняющей операции, а также определения прогноза и проведения дополнительной адъювантной терапии в случае наличия резидуальной опухоли;
- может быть рассмотрена у пациентов с люминальным В раком высокого риска (G3, высокий Ki67) при наличии четких показаний для проведения химиотерапии данного объема и желании пациента выполнить органосохраняющую операцию;
- наличие всех критериев, за исключением размеров опухолевого узла, свидетельствующих о возможности выполнения органосохраняющей операции;
- согласие пациента на выполнение органосохраняющей операции; с пациенткой должны быть обсуждены необходимость ЛТ в случае выполнения органосохраняющего лечения, а также вероятность повторной операции при обнаружении резидуальной опухоли в краях резекции;
-
абсолютные показания к проведению данного вида лекарственной терапии по результатам дооперационного обследования; при отсутствии достаточной информации (например, о размерах опухолевого узла, состоянии подмышечных лимфоузлов, наличии инвазивного компонента при внутрипротоковом РМЖ) на первом этапе рекомендуется оперативное лечение с изучением удаленной опухоли и патоморфологическим стадированием.
- Рекомендуется для проведения оптимальной системной неоадъювантной терапии первично операбельного РМЖ использовать алгоритм лечебно-диагностических мероприятий, представленный на рис. 4, 5 [36, 141–148].
Уровень убедительности рекомендаций − С (уровень достоверности доказательств – 5).
Комментарии: очередность лекарственного и хирургического лечения не влияет на безрецидивную и общую выживаемость. Неоадъювантная лекарственная терапия при первично операбельном РМЖ позволяет:
- выполнить органосохраняющую операцию и улучшить косметический эффект;
- выявить пациентов с более благоприятным прогнозом (в случае достижения полного патоморфологического ответа) и индивидуализировать адъювантную терапию;
- оценить эффект лекарственной терапии и своевременно прекратить ее в случае прогрессирования (с выполнением хирургического лечения).
- Рекомендуется перед началом неоадъювантной лекарственной терапии выполнить разметку опухоли для возможности визуализации при последующем хирургическом лечении [96, 149].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: в качестве разметки возможно использование рентегеноконтрастных и/или радиоактивных меток или татуаж.
-
Рекомендуется для проведения оптимальной неоадъювантной лекарственной терапии использовать стандартные режимы ХТ и анти-HER2 терапии (см. табл.
[36, 54, 55].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Не рекомендуется неоадъювантная ХТ при первично операбельном люминальном А варианте РМЖ [36, 38, 150].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется при отсутствии противопоказаний проведение хирургического лечения в срок до 7 недель после окончания неоадъювантной химиотерапии [151 ,152].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Таблица 8. Рекомендуемые режимы неоадъювантной лекарственной терапии рака молочной железы [36, 95–97]
Примечания:
1доксорубицин** может быть заменен на эпирубицин** в курсовой дозе 90 мг/м2 (режим ЕС) [115];
2при использовании еженедельных введений #паклитаксела** объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1-2-й курсы – дексаметазон 10 мг в/м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30-60 мин до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30-60 мин до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в/в за 30-60 мин до введения паклитаксела, а введение блокаторов H1/H2 гистаминовых рецепторов – только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥1,0 × 109/л и количестве тромбоцитов ≥100,0 × 109/л [119];
3режим с уплотненным введением химиопрепаратов следует рассмотреть при быстро пролиферирующих (с высоким Ki67) вариантах РМЖ [160];
4показано профилактическое назначение Г-КСФ: #филграстим** 5 мкг/кг подкожно (п/к) через 24-72 часа после окончания введения химиопрепаратов и до восстановления нормального числа нейтрофилов после надира или #пэгфилграстим** в дозе 6 мг или #эмпэгфилграстим** в дозе 7,5 мг подкожно, однократно, не менее чем через 24 часа после окончания введения химиопрепаратов [95, 116–118];
5режимы с включением соединений платины могут быть использованы при тройном негативном фенотипе;
6при противопоказаниях к назначению антрациклинов и родственных соединений и таксанов;
7не рекомендуется одновременное введение антрациклинов и родственных соединений (доксорубицина**, эпирубицина**) и анти-HER2 препаратов (#трастузумаба**, #пертузумаба**) ввиду высокого риска кардиотоксичности; до и в процессе терапии антрациклинами и родственными соединениями и/или трастузумабом необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес (или чаще при наличии показаний) [161];
8введение анти-HER2 препаратов (трастузумаба**, пертузумаба**) должно начинаться одновременно с безантрациклиновым таксан-содержащим режимом;
9возможно использование лекарственной формы трастузумаба** для п/к введения в дозе 600 мг/5 мл (независимо от массы тела пациента) 1 раз в 3 нед; нагрузочная доза не требуется [125, 126];
10режим может быть использован в качестве неоадъювантной терапии при опухолях ≥Т2 или N+.
Комментарии: основные принципы неоадъювантной лекарственной терапии:
- следует использовать препараты и режимы с наибольшей ожидаемой эффективностью;
- все необходимые курсы ХТ рекомендуется проводить до операции, так как это повышает вероятность достижения полной морфологической регрессии [23];
- если все запланированные курсы ХТ проведены до операции, адъювантная ХТ не рекомендуется; если по каким-либо причинам на дооперационном этапе не удалось провести все запланированные курсы ХТ, то недостающие курсы рекомендуется провести после операции; у пациентов РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получивших неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в полном объеме, при наличии резидуальной опухоли рекомендуется рассмотреть назначение адъювантной ХТ #капецитабином** (2000 мг/м2 внутрь в 1–14-й дни каждые 3 нед в течение 6 мес) [108]; у пациентов HER2-положительным РМЖ – трастузумаб эмтанзин** (3,6 мг/кг в/в в 1-й день 1 раз в 3 недели, до 14 циклов) [114];
- оптимальный интервал времени от начала лечения до оценки эффекта зависит от вида лечения, но не должен превышать 6–8 недель. Оценку эффекта рекомендуется производить с помощью осмотра и инструментальных методов, зафиксировавших патологические изменения в молочной железе и регионарных зонах до начала лечения;
- при получении «быстрого» (в результате 2–4 курсов ХТ) клинического эффекта не рекомендуется сокращать объем ХТ менее чем до 6-8 курсов;
- при отсутствии достаточных материальных ресурсов, гарантирующих проведение стандартной неоадъювантной лекарственной терапии (антрациклины и родственные соединения, таксаны, трастузумаб**, пертузумаб**, Г-КСФ если таковые показаны), рекомендуется на первом этапе выполнить хирургическое лечение.
-
Рекомендуется с целью профилактики остеопороза и снижения риска рецидива болезни назначить препараты, влияющие на структуру и минерализацию костей, колекальциферол, кальция карбонат, пациентам гормонозависимым РМЖ, получающим длительно ингибиторы ароматазы, а также пациентам, которым проводится овариальная супрессия или у которых в результате противоопухолевого лечения наступила ранняя менопауза [162]:
- препараты, влияющие на структуру и минерализацию костей (бисфосфонаты) (#золедроновая кислота** 4 мг в/в 1 раз в 6 мес) в течение 2-3 лет (в зависимости от минеральной плотности костной ткани);
- колекальциферол 400—800 МЕ/ сутки внутрь ежедневно + кальция карбонат 500—1000 мг/ сутки внутрь ежедневно длительно [162].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
3.3. Местнораспространенный первично не операбельный инвазивный рак молочной железы
-
Рекомендуется при РМЖ стадий IIIA (кроме T3N1M0), IIIB и IIIC, в т.ч. инфильтративно- отечной форме с целью уменьшения размеров опухоли и достижения операбельного состояния на первом этапе проводить лекарственную терапию [163].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется при местнораспространенном первично не операбельном РМЖ стадий IIIA (кроме T3N1M0), IIIB и IIIC, в т.ч. инфильтративно-отечной форме соблюдать принципы лечения, представленные на рис. 5, 6 [37].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
3.3.1. Лекарственная терапия
-
Рекомендуется с целью проведения оптимальной неоадъювантной лекарственной терапии при первично не операбельном РМЖ руководствоваться теми же правилами, что и при первично операбельном (см. раздел 3.2.4.5; см. рис. 5, 6; табл.
[54].
Уровень убедительности рекомендаций – 5 (уровень достоверности доказательств – 5).
- Рекомендуется с целью проведения оптимальной неоадъювантной лекарственной терапии пациентам в менопаузе с люминальным А подтипом РМЖ проводить неоадъювантную терапию ароматазы ингибиторами [164].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: терапию ингибиторами ароматазы целесообразно проводить в течение 4–8 мес или до достижения максимального эффекта.
- Не рекомендуется адъювантная ХТ, если все запланированные курсы проведены до операции [54, 96, 165].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется у пациентов РМЖ с тройным негативным фенотипом, получивших неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в полном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе), или при резидуальной опухоли в молочной железе, соответствующей 0—II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) адъювантная ХТ #капецитабином** 2000 мг/м2 в 1– 14-й дни каждые 3 нед в течение 6 мес [54, 108, 109].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется адъювантная ГТ всем пациентам с гормонозависимыми опухолями (см. табл. 6, 7,231).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется адъювантная анти-HER2 терапия всем пациентам при HER2- положительных опухолях [37, 166].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Рекомендуется у пациентов с HER2-положительным РМЖ, получивших неоадъювантную лекарственную терапию антрациклинами и родственными соединениями и/или таксанами в сочетании с трастузумабом** (± пертузумаб**), при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе), или при резидуальной опухоли в молочной железе, соответствующей 0—II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) в качестве адъювантной терапии назначение трастузумаба эмтанзина** 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов [114].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: при досрочном прекращении введения трастузумаба-эмтанзина в связи с токсичностью следует продолжить введение трастузумаба до общей продолжительности анти-HER2 терапии 1 год, включая дооперационный этап [114].
3.3.2. Хирургическое лечение
- Рекомендуется при отсутствии противопоказаний проведение хирургического лечения в срок до 7 недель после окончания неоадъювантной химиотерапии [151, 152].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- Рекомендуется c целью оптимального локального контроля над заболеванием и сохранения органа выполнить органосохраняющую операцию с подмышечной, подлопаточной и подключичной лимфаденэктомией при стадиях IIIA и IIIC при получении хорошего эффекта после неоадъювантной лекарственной терапии [167–169].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется при невозможности выполнения органосохраняющей операции c целью оптимального локального контроля над заболеванием выполнить мастэктомию [168, 169].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарии: объем оперативного вмешательства определяет врач-хирург в зависимости от расположения опухоли, соотношения объема опухоли и объема молочной железы. Желательно рассмотреть возможность выполнения подкожной или кожесохраняющей мастэктомии с подмышечной, подлопаточной и подключичной лимфаденэктомией с одномоментной или отсроченной реконструкцией. При подрастании опухоли к большой грудной мышце выполняется частичная резекция мышцы. При необходимости дефект замещается перемещенным кожно-мышечным лоскутом.
Метод и сроки реконструкции определяются на консилиуме в составе врача-хирурга/ пластического хирурга и радиотерапевта с учетом необходимости ЛТ; при наличии показаний к ЛТ рекомендуется выполнять отсроченную реконструктивно-пластическую операцию после завершения курса ЛТ.
3.3.3. Лучевая терапия
- Рекомендуется с целью оптимального локального контроля над заболеванием проводить ЛТ после радикальной мастэктомии (РМЭ) или органосохраняющих операций у пациентов местно-распространенными формами РМЖ вне зависимости от степени лечебного патоморфоза опухоли после неоадъювантной лекарственной терапии [49, 170].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: начало ЛТ – через 4-12 недель после операции (при условии полного заживления операционной раны); в случае проведения адъювантной ХТ – через 3-4 недели после ее завершения.
- Рекомендуется пациентам с целью оптимального локального контроля над заболеванием после РМЭ или органосохраняющих операций проводить ЛТ на мягкие ткани передней грудной стенки и зоны лимфооттока, при необходимости — «буст» на послеоперационный рубец или ложе удаленной опухоли [87].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
Комментарии:
- над-/подключичную, цепочку ипсилатеральных парастернальных лимфатических узлов – РОД 2 Гр, СОД 48-50 Гр;
- «буст» на послеоперационный рубец или ложе удаленной опухоли до СОД 60 Гр за весь курс лечения;
- при наличии остаточных метастазов в над- или подключичных лимфоузлах — СОД 60-64 Гр за весь курс ЛТ (при выборе локальных полей облучения необходимо выполнение УЗИ или КТ- исследований);
- при наличии врастания опухоли в кожу молочной железы ЛТ целесообразно проводить с использованием тканеэквивалентных болюсов для создания адекватного дозового распределения.
- Рекомендуется с целью оптимального локального контроля над заболеванием при неоперабельном/нерезектабельном опухолевом процессе после завершения лекарственного лечения или отказе пациент от операции провести курс дистанционной ЛТ [49, 171].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: ЛТ проводится в период от 2 до 4 недель после завершения лекарственной терапии, возможно одновременно с лекарственной терапией (после консилиума в составе врача-радиотерапевта, врача-хирурга и врача-онколога).
- Рекомендуется с целью оптимального локального контроля над заболеванием проводить ЛТ на молочную железу дозу 50 Гр за 25 фракций, на зоны лимфооттока на стороне поражения 50 Гр за 25 фракций [49, 171].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: после проведения ЛТ на молочную железу и зоны лимфооттока необходимо проводить оценкуой эффекта и повторным обсуждением тактики лечения на консилиуме в составе хирурга-онколога и радиотерапевта. При возможности выполнения хирургического лечения предпочтительна РМЭ [49].
- Рекомендуется с целью оптимального локального контроля над заболеванием при невозможности выполнения операции или отказе пациентки от нее ЛТ проводить по радикальной программе [172].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: суммарная доза за весь курс лечения на молочную железу 60–66 Гр локально на опухоль – до 60–70 Гр (65–70 Гр) в зависимости от количества курсов и эффективности предшествующей ХТ; локально на отдельные определяемые метастатические лимфоузлы до 60—66 Гр при разовой дозе облучения 2 Гр. При выборе локальных полей облучения необходимо УЗИ или КТ-исследование [49]. В зависимости от конктретной клинической ситуации разовая доза может быть увеличена до 2,5 Гр с учетом пересчета суммарных изоэффективных доз.
3.4. Рецидивный и метастатический рак молочной железы
3.4.1. Лечение изолированных местных рецидивов
С целью уменьшения риска рецидива РМЖ и смерти после удаления изолированного местного рецидива лекарственная терапия проводится в соответствии со следующими принципами [37]:
- при тройном негативном фенотипе – адъювантная ХТ (необходимо учесть суммарную дозу антрациклинов и родственных соединений, если они назначались ранее);
- при люминальном HER2-отрицательном фенотипе – только адъювантная ГТ; выбор препарата определяется предшествующей ГТ, если таковая проводилась, и функцией яичников;
- при HER2-положительном фенотипе – ХТ + анти-HER2 терапия ± ГТ (в зависимости от уровня экспрессии РЭ и РП);
- рассмотреть назначение ЛТ во всех случаях, когда она не проводилась ранее, а также при наличии возможности дополнительного безопасного облучения пораженной зоны.
- Рекомендуется с целью излечения местных рецидивов проводить лечение аналогично лечению первичной опухоли с подключением необходимых методов диагностики (в т.ч. с определением РЭ, РП, HER2 и Ki67 в рецидивной опухоли) и лечения (см. раздел 3.2.4) [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: выбор варианта лекарственной терапии должен быть индивидуальным и учитывать иммунофенотип первичной и рецидивной опухоли, предшествующее адъювантное лечение и срок ремиссии, общее состояние пациента, в т.ч. остаточные явления токсичности ранее проведенного лечения.
3.4.2. Лечение диссеминированного рака молочной железы
- Рекомендуется с целью улучшения качества жизни и увеличения ее продолжительности проводить лекарственное лечение пациентам диссеминированным РМЖ [173].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью оптимального лекарственного лечения диссеминированной болезни осуществлять выбор варианта терапии с учетом биологических маркеров (РЭ и РП, HER2, Ki67), PD-L1 на иммунокомпетентных клетках (в случае тройного негативного РМЖ), мутаций в гене PIK3CA (в случае гормонозависимого HER2-отрицательного РМЖ), клинико-анамнестических особенностей пациента [15, 174].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: единого стандарта лечения диссеминированного РМЖ не существует. Основным методом лечения является лекарственная терапия, которая включает химио- и/или гормонотерапию, которые рекомендуется дополнять таргетной терапией по показаниям.
- Рекомендуется для решения вопроса о назначении пациентам с гормонозависимым HER2-отрицательным раком молочной железы при прогрессировании на фоне моно- или комбинированной ГТ комбинации алпелисиба с фулвестрантом** (табл. 9) определение мутаций в гене PIK3CA в образце ткани первичной опухоли или метастатического очага [16, 39].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется для решения вопроса о назначении «#паклитаксел + альбумин» в комбинации с #атезолизумабом** (табл. 10) у пациентов с метастатическим тройным негативным РМЖ, не получавших лечение по поводу метастатической болезни, определение уровня экспрессии PD-L1 на иммунокомпетентных клетках (первичной опухоли или, предпочтительно, биопсийного материала из метастатического очага) с применением реагента SP142 для иммуногистохимической оценки лиганда-1 белка программируемой смерти в in vitro диагностике [15].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
- Рекомендуется для оптимального лечения диссеминированной болезни и улучшения качества жизни пациента при наличии показаний в дополнение к системной терапии рассмотреть проведение локальных видов лечения (лучевого или хирургического) [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью предотвращения осложнений костного метастазирования в дополнение к основной противоопухолевой системной терапии пациентам с диссеминированным РМЖ при наличии не менее 1 метастаза в кости и ожидаемой продолжительностью жизни от 3 месяцев и более рутинное назначение препаратов, влияющих на минерализацию костей: деносумаб** 120 мг п/к 1 раз в месяц или бифосфонаты (золедроновая кислота** 4 мг в/в 1 раз в 1-3 месяца [175], памидроновая кислота 90 мг 1 раз в месяц [176], ибандроновая кислота 6 мг 1 раз в месяц [177], клодроновая кислота 1500 мг в/в 1 раз в месяц [178]. На фоне применения любого ОМА необходим прием колекальциферол** 400-800 МЕ/ сутки внутрь ежедневно + кальция карбонат 500-1000 мг/сутки внутрь ежедневно длительно [178, 179].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: прогрессирование метастатического процесса в костях не является показанием к отмене препаратов, влияющих на минерализацию костей. Смена терапии бифосфонатами на терапию деносумабом** целесообразна в следующих клинических ситуациях: невозможность назначения или продолжения терапии бифосфонатами из‑за нарушения функции почек; неэффективность терапии бифосфонатами (возникновение новых множественных костных осложнений, усугубление болевого синдрома и пр.); невозможность выполнения внутривенных инфузий.
- Рекомендуется с целью проведения оптимальной лекарственной терапии и снижения токсичности лечения проводить ГТ гормонозависимого (люминального) РМЖ даже при наличии висцеральных метастазов [180, 181].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарии: исключение составляют быстропрогрессирующие варианты РМЖ, сопровождающиеся висцеральным кризом, в том числе развившимся в процессе предшествующих линий гормонотерапии, а также гормонорезистентные случаи. Признаками висцерального криза является множественное метастатическое поражение внутренних органов; клинические и/или лабораторные признаки нарушения функции внутренних органов, создающие угрозу жизни пациента и требующие быстрого достижения противоопухолевого эффекта.
- Рекомендуется пациентам с гормонозависимым HER2-положительным РМЖ, не нуждающимся в немедленном начале ХТ, начинать ГТ (ароматазы ингибиторами, тамоксифеном** или фулвестрантом**) в сочетании с анти-HER2 препаратом (табл. 11) [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется ГТ одной линии проводить до прогрессирования болезни (данные осмотра и инструментального обследования или появление/усиление симптомов, связанных с опухолевым ростом) или признаков неприемлемой токсичности. В отсутствие признаков висцерального криза рекомендуется последовательное назначение всех возможных линий ГТ (рис. 7,
[181].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется во время проведения горомонотерапии каждые 1-3 месяца оценивать симптомы болезни и общее состояния пациента, каждые 2-6 месяцев проводить объективную оценку эффективности проводимой гормонотерапии при помощи КТ [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Коментарии: сцинтиграфию следует выполнять каждые 4—6 месяцев, выполнение ПЭТ-КТ и определение уровня опухолевых маркеров является опциональным [54].
- Рекомендуется пациентам с сохранной функцией яичников выполнить овариальную супрессию любым доступным способом (см. раздел 3.2.1.3.) и назначить ГТ, рекомендованную пациентам в менопаузе (см. табл. 9, рис. 7) [182].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 1).
Комментарии: в отдельных случаях (например, при отказе пациентки от овариальной супрессии) назначаются селективные модуляторы РЭ (см. табл. 9).
- Не рекомендуется использовать одновременно ХТ и ГТ [174].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется при неэффективности трех последовательных линий ГТ (это свидетельствует об устойчивости к данному виду лечения) назначать ХТ [181].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: при выборе варианта ГТ следует учитывать функцию яичников, предшествующую ГТ и ее эффективность, сопутствующую патологию. Алгоритм гормонотерапии пациентов в менопаузе представлен на рис. 7.
Таблица 9. Рекомендуемые эндокринные препараты и режимы гормонотерапии метастатического HER2-отрицательного рака молочной железы [16, 36–38, 180–196]
Примечания:
1только для пациентов с сохранной функцией яичников при необходимости овариальной супрессии; назначаются в сочетании с другими средствами ГТ (селективными модуляторами эстрогеновых рецепторов, антагонистами рецепторов эстрогенов, ароматазы ингибиторами, прогестагенами); ГРГ рекомендуется вводить 1 раз в 28 дней;
2для пациентов в пременопаузе и менопаузе; определение мутаций гена CYP2D6 для решения вопроса о назначении тамоксифена** в рутинной практике не рекомендуется;
3только для пациентов в менопаузе; у пациентов с сохранной функцией яичников требуется овариальная супрессия (назначение аналогов ГРГ или овариэктомия);
4при развитии токсичности рекомендуется редукция доз палбоциклиба** до 100 мг/сутки и 75 мг/сутки, рибоциклиба** – до 400 мг/сутки и 200 мг/сутки, абемациклиба** – до 200 мг/сутки и 100 мг/сутки внутрь (в два приема) (см. инструкции по применению препаратов);
5для пациентов в удовлетворительном общем состоянии, с нормальной функцией внутренних органов (в том числе при нормальном уровне глюкозы в крови) при наличии признаков резистентности к нестероидным ароматазы ингибиторам (прогрессирование в процессе адъювантной или лечебной терапии летрозолом/анастрозолом** или в ближайшие 12 мес после завершения приема этих препаратов ± одна линия ХТ); нет данных об эффективности другой линии ГТ с включением эверолимуса** при прогрессировании на фоне терапии эксеместаном и эверолимусом**;
6при прогрессировании на фоне ГТ и одной или нескольких линий ХТ;
7при развитии токсичности возможна редукция дозы абемациклиба** до 300 мг/сутки, 200 мг/ сутки и 100 мг/сутки внутрь (в два приема) (см. инструкцию по применения препарата);
8комбинация ингибиторов протеинкиназы 4/6 с ароматазы ингибиторами или фулвестрантом** является предпочтительной опцией 1 и 2 линий лечения, учитывая значимый выигрыш в БРВ и приемлемый профиль токсичности;
9комбинация ингибитора фосфатидилинозитол-3-киназы (PI3K) алпелисиба с фулвестрантом** рекомендуется при наличии мутаций в гене PIK3CA пациентам с распространенным гормонозависимым HER2-отрицательным РМЖ при прогрессировании на моно- или комбинированной ГТ. Алпелисиб не следует назначать пациентам с сахарным диабетом I типа, а также неконтролируемым диабетом II типа. До начала применения алпелисиба следует определить уровень глюкозы плазмы натощак и уровень HbA1c (гликированного гемоглобина). При уровне HbA1c >7,0 % перед назначением терапии алпелисибом требуется консультация эндокринолога;
10при развитии токсичности возможна редукция дозы алпелисиба до 250 мг/сутки или 200 мг/ сутки (см. инструкцию по медицинскому применению препарата).
- Рекомендуется с целью проведения оптимальной лекарственной терапии проводить ХТ следующим категориям пациентов:
- РМЖ с отрицательными РЭ и РП;
- люминальный РМЖ, резистентный к ГТ;
- люминальный РМЖ с признаками висцерального криза [34, 35].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: стандарта ХТ первой линии рецидивного и метастатического РМЖ нет. Выбор режима должен быть индивидуальным и учитывать особенности опухоли и клинико- анамнестические особенности пациента, а также состав и эффективность предшествующей, в т.ч. адъювантной/неоадъювантной ХТ, если таковая проводилась.
- Рекомендуется пациентам с целью проведения оптимальной лекарственной терапии использовать антрациклины/антрациклин-содержащие режимы в первой линии, если они не назначались ранее [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с целью проведения оптимальной лекарственной терапии последовательное назначение химиопрепаратов в монотерапии [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью проведения оптимальной лекарственной терапии в качестве комбинированной терапии использовать антрациклин-содержащие режимы (АС/ЕС), режим CMF/метрономный режим (циклофосфамид**/#метотрексат**), а также режимы, включающие соединения платины (в комбинации с таксанами, #гемцитабином**) (см. табл. 10) [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Не рекомендуется комбинировать между собой антрациклины и родственные соединения, таксаны, винорелбин**, капецитабин** [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью проведения оптимальной лекарственной терапии при рецидивном и метастатическом РМЖ использовать режимы ХТ, приведенные в табл. 10 [36, 37, 186–216].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Таблица 10. Режимы химиотерапии, рекомендуемые при рецидивном и метастатическом раке молочной железы [24]
Примечания:
1суммарная доза антрациклинов и родственных соединений с учетом всех линий терапии, включая адъювантную, не должна превышать 450—500 мг/м2 для доксорубицина** и 900 мг/м2 для эпирубицина**;
2до и в процессе терапии антрациклинами и родственными соединениями необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес (или чаще при наличии показаний);
3предпочтительно еженедельное введение паклитаксела**; при использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1—2-й курсы – дексаметазон 10 мг в/м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30—60 мин до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30—60 мин до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в/в за 30—60 мин до введения паклитаксела, а введение блокаторов H1/H2 гистаминовых рецепторов – только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥1,0 × 109/л и количестве тромбоцитов ≥100,0 × 109/л [119];
4рекомендуется при HER2-негативном РМЖ, в т.ч. при РМЖ с тройным негативным фенотипом;
5для пациентов с тройным негативным РМЖ в качестве первой линии лечения при установленной с помощью теста Ventana SP142 экспрессии PD-L1 на ≥1 % иммунокомпетентных клеток;
6при неэффективности предшествующей терапии таксанами и антрациклинами и родственными соединениями; не следует назначать данный режим при повышении АЛТ/АСТ более 2,5 ВГН и/или билирубина выше ВГН.
7рекомендуется при HER2-негативном раке молочной железы у взрослых пациентов с герминальными мутациями в генах BRCA, получавших ранее неоадъювантную или адъювантную химиотерапию либо химиотерапию по поводу метастатического заболевания.
- Рекомендуется пациентам с целью проведения оптимальной лекарственной терапии и снижения токсичности продолжать ХТ с использованием одной и той же комбинации до прогрессирования болезни, доказанного клинически и/или с помощью методов инструментальной диагностики, или неприемлемой/дозолимитирующей токсичности. Длительная стабилизация болезни расценивается как положительный эффект лечения и не является основанием для прекращения или смены терапии в отсутствие неприемлемой/дозолимитирующей токсичности [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: не существует стандартных подходов к проведению второй и последующих линий ХТ, равно как и каких-либо данных, свидетельствующих о преимуществах того или иного препарата или режима. Продолжение ХТ после третьей линии может обсуждаться для пациентов в удовлетворительном общем состоянии, ответивших на предшествующие линии ХТ.
- Рекомендуется с целью проведения оптимальной лекарственной терапии пациентам HER2-положительным РМЖ назначать анти-HER2-терапию в сочетании с химио- или гормонотерапией (при люминальных опухолях) и использовать режимы, представленные в табл. 11 [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется с целью проведения оптимальной лекарственной терапии пациентам HER2-положительным РМЖ в качестве первой линии терапии предпочтительней использовать комбинацию пертузумаб** + трастузумаб** + таксаны (см. табл. 11).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Комментарии: режим может быть рекомендован пациентам, не получавшим пертузумаб** нео-/адъювантно, а также получавшим пертузумаб** нео-/адъювантно, если с момента завершения терапии пертузумабом** до прогрессирования болезни прошло не менее 1 года.
- Рекомендуется с целью проведения оптимальной лекарственной терапии при первом эпизоде прогрессирования на фоне терапии трастузумабом** ± пертузумаб** продолжать анти-HER2 терапию в прежнем режиме со сменой химио-/гормонотерапевтического компонента [36].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Таблица 11. Режимы лекарственной терапии HER2-положительного рецидивного и метастатического рака молочной железы
Примечания:
1возможно использование лекарственной формы трастузумаба** для п/к введения в дозе 600 мг/ 5 мл (независимо от массы тела пациента) 1 раз в 3 нед; нагрузочная доза не требуется [125, 126];
2до и в процессе терапии трастузумабом** необходим контроль ФВлж с помощью ЭхоКГ с частотой 1 раз в 3 мес (или чаще при наличии показаний);
3при использовании еженедельных введений паклитаксела объем стандартной премедикации может быть сокращен (на усмотрение лечащего врача) и проводиться по схеме: 1—2-й курсы – дексаметазон 10 мг в/м или внутрь за 12 и 6 часов до введения паклитаксела, блокаторы рецепторов H1 (дифенгидрамин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30-60 мин до введения паклитаксела, блокаторы рецепторов H2 (фамотидин 50 мг или эквивалентные дозы аналогов) в/в струйно за 30—60 мин до введения паклитаксела. При отсутствии реакций гиперчувствительности на первых двух курсах в дальнейшем возможно введение дексаметазона 8 мг в/в за 30—60 мин до введения паклитаксела, а введение блокаторов H1/H2 гистаминовых рецепторов – только в случае предшествовавших реакций гиперчувствительности. Введение паклитаксела может проводиться при АЧН ≥1,0 × 109/л и количестве тромбоцитов ≥100,0 × 109/л.
4увеличение количества курсов доцетаксела** свыше 6 не приводит к улучшению безрецидивной и общей выживаемости [241];
5режим может быть рекомендован пациентам, не получавшим пертузумаб** нео-/адъювантно, а также получавшим пертузумаб нео-/адъювантно, если с момента завершения терапии пертузумабом до прогрессирования болезни прошло не менее 1 года;
6для пациентов, получавших трастузумаб**;
7в отсутствие признаков висцерального криза;
8все препараты используются в стандартных дозах и режимах; назначение ароматазы ингибиторов и #фулвестранта** возможно женщинам в состоянии менопаузы.
- Рекомендуется во время проведения лекарственной терапии перед каждым циклом оценивать симптомы болезни и общее состояния пациента, каждые 2-4 цикла проводить объективную оценку эффективности проводимой химиотерапии при помощи КТ [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Коментарии: сцинтиграфию следует выполнять каждые 4 цикла, выполнение ПЭТ-КТ и определение уровня опухолевых маркеров является опциональным [54].
- Рекомендуется с целью оптимального лечения и улучшения качества жизни пациентов диссеминированным РМЖ обсуждать использование лучевого и хирургического методов лечения на консилиуме с участием врача-хирурга и врача-радиотерапевта [95].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: стандартных подходов к использованию этих методов лечения при рецидивном и метастатическом раке молочной железы нет.
- Рекомендуется с целью снижения токсичности и риска развития вторичных радиоиндуцированных опухолей при необходимости повторного облучения применение протонной терапии [242, 243].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
3.5. Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов с раком молочной железы с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи».
3.6. Наблюдение в процессе лечения. Оценка эффекта
Для оценки эффекта и осложнений (токсичности) лекарственной терапии необходимо осуществлять наблюдение в процессе лечения и вносить необходимые коррективы (смена режима, редукция доз, отмена лечения, назначение симптоматической терапии и т.д.).
Для оценки эффекта и осложнений (токсичности) лекарственной терапии целесообразно проводить периодический осмотр и оценку различных симптомов, лабораторных данных (прежде всего, клинического анализа крови и печеночных ферментов) и результатов инструментального обследования с соблюдением следующего регламента: при проведении химиотерапии осмотр, оценка симтомов и анализ лабораторных данных проводятся перед каждым курсом, а при проведении гормонотерапии – каждые 1-3 месяца; инструментальное обследование при химиотерапии проводиться каждые 2-4 курса, а при гормонотерапии –
каждые 2-3 месяца. Интервалы между обследованиями могут быть изменены в зависимости от конкретной клинической ситуации [38]. Выполнение ПЭТ-КТ и определение уровня опухолевых маркеров не яявляется обзательным.
Результаты осмотра и обследования классифицируются следующим образом:
- объективный эффект: существенное уменьшение размеров и/или количества опухолевых очагов; является показанием для продолжения проводимой терапии в отсутствие серьезной токсичности;
- стабилизация болезни: отсутствие значимых изменений размеров и количества опухолевых очагов; при удовлетворительном общем состоянии и хорошей переносимости лечение может быть продолжено;
- прогрессирование заболевания является показанием к смене лечения.
При подозрении на прогрессирование болезни по данным осмотра необходимо выполнить уточняющие обследования, в т.ч. с оценкой зон, не обследовавшихся до начала терапии.
Признаками прогрессирования являются:
- появление и/или усугубление симптомов, обусловленных опухолевым ростом (например, боли или одышки);
- существенное увеличение размеров или появление новых опухолевых очагов, выявляемых при осмотре;
- ухудшение общего состояния (дифференцировать с токсичностью лечения);
- немотивированная потеря веса (дифференцировать с токсичностью лечения);
- повышение ЩФ, АЛТ, АСТ, билирубина (дифференцировать с токсичностью лечения);
- гиперкальциемия.
Появление новых и/или существенное увеличение имевшихся ранее очагов по данным объективных методов обследования; при оценке данных радиоизотопных методов обследования (сканирование костей, позитронно-эмиссионная томография (ПЭТ)) следует иметь ввиду, что репарация метастазов в костях, начавшаяся в результате эффективной противоопухолевой терапии (в сочетании с препаратами, влияющими на структуру и минерализацию костей) и сопровождающаяся повышенным метаболизмом, может создавать формальную картину прогрессирования за счет появления на сканограммах новых очагов и увеличения накопления радиофармпрепарата в имевшихся очагах, особенно при первом оценочном исследовании [36–38].
3.7. Сопроводительная терапия у пациентов раком молочной железы
Принципы лечения и профилактики тошноты и рвоты
у пациентов РМЖ соответствуют принципам, изложенным в рекомендациях «Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных.» (коллектив авторов: Владимирова Л.Ю., Гладков О.А., Королева И.А., Румянцев А.А., Семиглазова Т.Ю., Трякин А. А. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).37, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-37.pdf).
Принципы лечения и профилактики костных осложнений у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Использование остеомодифицирующих агентов для профилактики и лечения патологии костной ткани при злокачественных новообразованиях» (коллектив авторов: Багрова С.Г., Копп М.В., Кутукова С.И., Манзюк Л.В., Семиглазова Т.Ю. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).38, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-38.pdf).
Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по диагностике и лечению фебрильной нейтропении» (коллектив авторов: Сакаева Д.Д., Курмуков И.А., Орлова Р.В., Шабаева М.М Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).39, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-39.pdf).
Принципы профилактики и лечения гепатотоксичности у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Клинические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой терапией» (коллектив авторов: Ткаченко П.Е., Ивашкин В.Т., Маевская М.В. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).40, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-40.pdf).
Принципы профилактики и лечения сердечно-сосудистых осложнений у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии» (коллектив авторов: Виценя М.В., Агеев Ф.Т., Гиляров М.Ю., Овчинников А.Г., Орлова Р.В., Полтавская М.Г. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).41, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-41.pdf).
Принципы профилактики и лечения кожных осложнений у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по лекарственному лечению дерматологических реакций у пациентов, получающих противоопухолевую лекарственную терапию» (коллектив авторов: Королева И. А., Болотина Л.В., Гладков О.А., Горбунова В.А., Круглова Л.С., Манзюк Л.В. и соавт. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).42, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-42.pdf).
Принципы нутритивной поддержки у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по нутритивной поддержке онкологических больных» (коллектив авторов: Сытов А.В., Зузов С.А., Лейдерман И.Н., Хотеев А.Ж. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).43, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-43.pdf).
Принципы профилактики и лечения нефротоксичности у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по коррекции нефротоксичности противоопухолевых препаратов» (коллектив авторов: : Громова Е.Г., Бирюкова Л.С., Джумабаева Б.Т., Курмуков И.А. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).46, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-46.pdf).
Принципы профилактики и лечения тромбоэмболических осложнений у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных» (коллектив авторов: Сомонова О.В., Антух Э.А., Долгушин Б.И., Елизарова А.Л., Сакаева Д.Д., Сельчук В.Ю., Трякин А.А., Черкасов В.А. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).47, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-47.pdf).
Принципы профилактики и лечения последствий экстравазации лекарственных препаратов у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Рекомендации по лечению последствий экстравазации противоопухолевых препаратов» (автор: Буйденок Ю.В. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).48, https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-48.pdf).
Принципы профилактики и лечения иммуноопосредованных нежелательных явлений у пациентов РМЖ соответствуют принципам, изложенным в методических рекомендациях «Практические рекомендации по управлению иммуноопосредованными нежелательными явлениями» (коллектив авторов: Проценко С.А., Антимоник Н.Ю., Берштейн Л.М., Жукова Н.В., Новик А.В., Носов Д.А., Петенко Н.Н., Семенова А.И., Чубенко В.А., Харкевич Г.Ю., Юдин Д.И. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020 (том 10).50, http s://rosoncoweb.ru/standarts/RUSSCO/2020/2020-50.p df).
3.8. Диетотерапия
К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть раком молочной железы, или на риск рецидива, или прогрессирования этого заболевания у лиц с уже установленным диагнозом. Имеются сведения о том, что диета, обогащенная фруктами и овощами, минимальное потребление сахара, а также снижение потребления алкоголя, могут быть связаны со снижением риска развития рака молочной железы. В этой связи не целесообразны какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции коморбидных состояний, купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого).
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
В данном разделе нет информации.
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Рекомендуется всем пациентам использовать психосоциальные методы реабилитации в рамках трех категорий:
- психообразовательные мероприятия [244, 245];
- когнитивно-поведенческая психотерапия [246];
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
-
поддерживающая психотерапия [247].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется всем пациентам начинать раннее выполнение комплекса лечебной физической культуры (ЛФК) с целью увеличения объема движений, уменьшения болевого синдрома и улучшения качества жизни после операции на молочной железе и аксиллярной зоне [248].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 3).
- Рекомендуется с целью увеличения объема движений, уменьшения болевого синдрома и улучшения качества жизни после операции на молочной железе и аксиллярной зоне применять низкоинтенсивное лазерное облучение на область операции, подмышечную область (при наличии возможности) [249].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
- Рекомендуется для профилактики лимфедемы верхней конечности проведение следующих мероприятий [250, 251]:
- дренажный медицинский массаж верхней конечности в послеоперационном периоде;
- раннее начало выполнения комплекса ЛФК;
- контроль веса, профилактика ожирения;
- профилактика рожистого воспаления, уход за кожными покровами.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
-
Рекомендуется при возникновении лимфедемы верхней конечности (см. приложение Г1) с целью уменьшения её проявлений использовать:
- противоотечную терапию, включающая в себя мануальный лимфодренаж;
- ношение компрессионного трикотажа;
- выполнение комплекса ЛФК;
- уход за кожей [252];
- перемежающуюся дозированную пневмокомпрессию верхней конечности в сочетании с полной противоотечной терапией [253].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
-
Рекомендуется при возникновении лимфедемы верхней конечности (см. приложение Г1) с целью уменьшения его проявлений проводить следующие мероприятия:
- низкоинтенсивная лазеротерапия в сочетании с противоотечной терапией [254, 255];
- электротерапия в сочетании с противоотечной терапией [256];
- глубокая осцилляция (в сочетании с противоотечной терапией, медицинским массажем) [257];
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
- низкочастотная магнитотерапия в сочетании с противоотечной терапией [258];
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендовано обратить внимание пациента на необходимость снижения веса [259].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Госпитализация
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом- онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований полости рта, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования полости рта или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования полости рта (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально- техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания для госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю «онкология», определяются консилиумом врачей- онкологов и врачей-радиотерапевтов, с привлечением при необходимости других врачей- специалистов.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
- наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами- специалистами медицинской организации, в которую планируется перевод.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется у пациентов с РМЖ с целью профилактики развития рака контралатеральной молочной железы и рака яичников при выявлении с помощью ПЦР клинически значимых патогенных мутаций BRCA1 и BRCA2 обсуждение рисков развития вторых опухолей и возможности выполнения профилактических и скрининговых мероприятий:
- тщательный динамический контроль;
- хирургическая профилактика (профилактическая мастэктомия с одномоментной реконструкцией и профилактическая тубовариэктомия) [54, 93, 174].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: решение вопроса о выполнении профилактической мастэктомии и тубовариэктомии должно осуществляться на консилиуме с участием врача медицинского генетика, врача-хируга/пластического хирурга, врача онколога и медицинского психолога; проведение процедур хирургической профилактики наследственного РМЖ и яичников должно осуществляться в специализированном онкологическом учреждении, имещего опыт проведения подобных вмешательств. При отказе пациентки от реконструкции после консультации медицинского психолога возможно провдение простой мастэктомии.
- Рекомендуется с целью максимально раннего выявления местных рецидивов и рака контралатеральной молочной железы и их радикального лечения осуществлять диспансерное наблюдение пациентов с соблюдением следующего регламента:
- осмотр от 1 до 4 раз в год (в зависимости от конкретной клинической ситуации) в течение первых 5 лет, далее – ежегодно [38, 54, 260];
- ежегодное выполнение двухсторонней (в случае органосохраняющей операции) или контралатеральной маммографии (врачами-радиологами) в сочетании с УЗИ регионарных зон и области послеоперационного рубца (врачами ультразвуковой диагностики [38, 54, 260].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Не рекомендуется при отсутствии жалоб и симптомов, подозрительных в отношении прогрессирования болезни, рутинное лабораторное и/или инструментальное обследование (рентгенологическое, УЗИ, радиоизотопное, в т.ч. КТ, МРТ, ПЭТ-КТ, а также определение опухолевых маркеров СА 15.3, СА 125, РЭА) [38, 54, 260].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется ежегодно проводить осмотр врачом-гинекологом женщин с не удаленной маткой, получающих адъювантно тамоксифен**, с целью выявления рака эндометрия [38, 54, 260].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: любые патологические состояния, подозрительные в отношении рака эндометрия, требуют своевременной диагностики. Рутинное выполнение УЗИ органов малого таза и биопсии эндометрия (диагностическое выскабливание) в отсутствие жалоб не рекомендуется.
- Рекомендуется обращать особое внимание на отдаленные нежелательные эффекты, в частности остеопороз, особенно у женщин, длительно получающих ингибиторы ароматазы, а также достигших ранней менопаузы в результате противоопухолевой терапии либо при проведении овариальной супрессии. Этой категории пациенток рекомендуется ежегодное выполнение денситометрии и профилактическое назначение препаратов кальция (1200-1500 мг/сутки) и витамина D (400-800 МЕ/сутки), а также препаратов, влияющих на структуру и минеральизацию костей (бисфосфонаты, деносумаб), по показаниям [38, 54, 261].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется информировать пациенток о пользе здорового образа жизни, включающего рациональную диету, достижение и поддержание идеальной массы тела, ведение активного образа жизни [36–38, 262].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- 1. Высоцкая И.В. Эндокринно-чувствительные опухоли репродуктивной системы: руководство для врачей. М.: Спец. изд-во мед. кн. (СИМК). 2014. 126 p.
2. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2018. 250 p.
3. Agarwal I., Blanco L. WHO classification. PathologyOutlines.com website. http://www.pathologyoutlines.com/topic/breastmalignantwhoclassification.html.
4. Brierley J.D., Gospodarowicz M.K., Wittekind C. TNM Classification of Malignant Tumours, 8th Edition (UIJCC).
5. Gradishar W.J., Anderson B.O., Blair S.L. et al. Breast cancer version 3.2014. J Natl Compr Canc Netw 2014;12(4):542–590.
6. Hassan L.M. et al. Evaluation of effect of self-examination and physical examination on breast cancer. Breast Edinb Scotl 2015;24(4):487–490.
7. Liu X., Meng Q.H., Ye Y. Prognostic significance of pretreatment serum levels of albumin, LDH and total bilirubin in patients with non-metastatic breast cancer.PubMed NCBI 2015;36(2):243– 248.
8. Elyasinia F., Keramati M.R., Ahmadi F. Neutrophil-Lymphocyte Ratio in Different Stages of Breast Cancer. Acta Med Iran 2017;55(4):228–232.
9. Vernieri C., Mennitto A.3., Prisciandaro M., Prisciandaro M. The neutrophil-to-lymphocyte and platelet-to-lymphocyte ratios predict efficacy of platinum-based chemotherapy in patients with metastatic triple negative breast cancer. Sci Rep 2018;8(1):8703.
10. Lindkær-Jensen S. et al. Positive effects on hematological and biochemical imbalances in patients with metastatic breast cancer stage IV, of BP-C1, a new anticancer substance. Drug Des Devel Ther 2015;9:1481–1490.
11. Tas F., Kilic L., Duranyildiz D. Coagulation tests show significant differences in patients with breast cancer. Tumour Biol J Int Soc Oncodevelopmental Biol Med 2014;35(6):5985–5992.
12. Pedersen L.M., Sørensen P.G. Increased urinary albumin excretion rate in breast cancer patients. Acta Oncol Stockh Swed 2000;39(2):145–149.
13. Hammond M.E.H. et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version). Arch Pathol Lab Med 2010;134(7):e48–72.
14. Wolff A.C. et al. HER2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update Summary. J Oncol Pract 2018;14(7):437–441.
15. Schmid P. et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med 2018;379(22):2108–2121.
16. Andre F. et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor–Positive Advanced Breast Cancer. N Engl J Med 2019;380:1929–40. DOI: 10.1056/NEJMoa1813904.
17. Regan M.M. Predicting Benefit of Endocrine Therapy for Early Breast Cancer. Breast Edinb Scotl 2015;24(0 2):S129–S131.
18. Tevaarwerk A.J. et al. Phase III comparison of tamoxifen versus tamoxifen plus ovarian function suppression in premenopausal women with node-negative, hormone receptor-positive breast cancer (E-3193, INT-0142): a trial of the Eastern Cooperative Oncology Group. J Clin Oncol Off J Am Soc Clin Oncol 2014;32(35):3948–3958.
19. Bernhard J. et al. Patient-reported endocrine symptoms, sexual functioning, and quality of life (QoL) in the IBCSG TEXT and SOFT trials: Adjuvant treatment with exemestane (E) plus ovarian function suppression (OFS) versus tamoxifen (T) plus OFS in premenopausal women with hormone receptor-positive (HR+) early breast cancer (BC). J Clin Oncol 2014;32:557–557.
20. Bernhard J. et al. Patient-reported endocrine symptoms, sexual functioning, and quality of life (QoL) in the IBCSG TEXT and SOFT trials: Adjuvant treatment with exemestane (E) plus ovarian function suppression (OFS) versus tamoxifen (T) plus OFS in premenopausal women with hormone receptor-positive (HR+) early breast cancer (BC). J Clin Oncol 2014;32(15_suppl):557– 557.
21. Viale G. et al. Which patients benefit most from adjuvant aromatase inhibitors? Results using a composite measure of prognostic risk in the BIG 1-98 randomized trial. Ann Oncol 2011;22(10):2201–2207.
109. Стенина М.Б., Жукова Л.Г., Королева И.А., Пароконная А.А., Семиглазова Т.Ю., Тюляндин С.А. и соавт. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2 2019;(9):128–163.
118. Итоговый отчет о результатах клинического исследования «Международное многоцентровое двойное слепое рандомизированное исследование эффективности и безопасности однократного применения препарата BCD-017 по сравнению с ежедневным введением филграстима с целью профилактики нейтропении у больных раком молочной железы, получающих миелосупрессивную химиотерапию, с двойным маскированием». 31.10.2014.
258. Грушина Т.И. Реабилитация пациенток после радикального лечения первичного рака молочной железы с помощью методов физической терапии. Физиотерапия Бальнеология Реабилитация 2011;2:11–17.
- 1. Высоцкая И.В. Эндокринно-чувствительные опухоли репродуктивной системы: руководство для врачей. М.: Спец. изд-во мед. кн. (СИМК). 2014. 126 p.
Информация
Список сокращений
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
БСЛУ – биопсия сторожевых лимфатических узлов
в/в – внутривенно
в/м – внутримышечно
ВГН – верхняя граница нормы
КСФ – колониестимулирующие факторы
ГРГ – гонадотропин-рилизинг-гормон
ГТ – гормонотерапия
ИГХ – иммуногистохимическое (исследование)
КТ – компьютерная томография
ЛТ – лучевая терапия
ЛФК – лечебная физическая культура
МЕ – международные единицы
МРТ – магниторезонансная томография
п/к – подкожно
ПЦР – полимеразная цепная реакция
ПЭТ – позитронно-эмиссионная томография
РМЖ – рак молочной железы
РМЭ – радикальная мастэктомия
РОД – разовая очаговая доза
РП – рецепторы прогестерона
РЭ – рецепторы эстрогенов
СЛУ – сторожевой лимфатический узел (узлы)
СОД – суммарная очаговая доза
УЗДГ – ультразвуковая допплерография
УЗИ – ультразвуковое исследование
ФСГ – фолликулостимулирующий гормон
ХТ – химиотерапия
ЩФ – щелочная фосфатаза
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
BRCA – гены рака молочной железы (breast cancer gene)
CDK – циклинзависимые киназы (сyclin-dependent kinases)
HER2 – 2-й рецептор эпидермального фактора роста человека (human epidermal growth factor receptor 2)
Ki67 – антиген, определяющийся в делящихся клетках
NGS – метод высокопроизводительного секвенирования (next generation sequencing)
PI3K – фосфатидилинозитол-3-киназа (phosphatidylinositol 3-kinase)
PIK3CA – ген, кодирующий PI3K
Термины и определения
ECOG (Eastern Cooperative Oncology Group) – шкала оценки общего состояния онкологического пациента до начала лечения, в процессе и после его окончания по 5- степенной системе (рекомендована Восточной кооперативной онкологической группой).
Биологическая терапия – терапия, включающая таргетную и иммунотерапию, оказывающая цитотоксическое действие на опухолевые клетки, компоненты противоопухолевой системы, а также блокирование различных этапов онкогенеза.
Биопсия сторожевого лимфатического узла (сторожевых лимфатических узлов) – метод получения гистологического материала из лимфатического узла (узлов), который считается первым/первыми на пути лимфогенного распространения опухоли. Желательно удаление не менее 2-х лимфатических узлов. Наличие или отсутствие метастазов определяет показания к выполнению лимфаденэктомии в полном объеме.
Буст – дополнительное облучение опухоли или ложа удаленной опухоли.
Восстановительные (реконструктивные) операции – операции, направленные на полное восстановление или замену неработающего органа таким же органом, а также восстанавливающие физиологическую сущность, которая была нарушена в процессе хирургического вмешательства.
Линия химиотерапии – порядок введения химиотерапевтических препаратов, применяемый в зависимости от отношения к существующим стандартным протоколам.
Цикл химиотерапии – введение химиотерапевтического препарата в определенной дозе, режиме и методике введения, с учетом интервала между введениями.
Курс химиотерапии – совокупность циклов химиотерапии; назначение противоопухолевых препаратов по определенной, запланированной схеме с соблюдением различных временных интервалов между введениями лекарственных средств.
Адъювантная химиотерапия – химиотерапия, применяемая после локального воздействия на опухоль с целью эрадикации или длительного подавления микрометастазов.
Неоадъювантная химиотерапия – химиотерапия, применяемая до локального воздействия на опухоль с целью уменьшения массы опухоли, снижения стадии заболевания, уменьшения объема дальнейшего хирургического или лучевого вмешательства либо определения чувствительности опухоли к проводимому лекарственному лечению.
Системная химиотерапия – введение препаратов внутрь, подкожно, внутривенно, внутримышечно и ректально, рассчитанное на общий противоопухолевый эффект.
Гормонотерапия (эндокринотерапия) – лечение новообразований препаратами, воздействующими на эндокринную систему, а также их синтетическими аналогами, действующими на гормональные рецепторы.
Иммуногистохимическое исследование – метод микроскопического исследования тканей, обеспечивающий наиболее специфическое выявление в них искомых веществ и основанный на обработке срезов маркированными специфическими антителами к выявляемому веществу (антигену).
Радикальная лучевая терапия – курабельная доза ионизирующего воздействия на зону клинического распространения опухоли и профилактическое облучение зон возможного субклинического поражения, приводящее к полному уничтожению опухоли и регионарных метастазов.
Радикальное хирургическое лечение – стандартное, разработанное для каждой конкретной локализации опухоли, вмешательство, предполагающее удаление пораженного опухолью органа или его части единым блоком с зонами регионарного метастазирования в пределах здоровых тканей при отсутствии отдаленных метастазов.
Морфологическое исследование – определение гистологического или цитологического строения опухоли и степени дифференцировки.
Поддерживающая терапия – терапия, целью которой является профилактика и облегчение симптомов заболевания или симптомов, связанных с токсическим воздействием лечебных мероприятий, поддержание хорошего качества жизни пациентов, независимо от стадии заболевания и потребности в других видах терапии.
Схема лечения – режимы или протоколы лекарственного лечения, как правило, сочетающие несколько противоопухолевых.
Таргетная (молекулярно-нацеленная) терапия – противоопухолевые препараты, направленно действующие на молекулы, участвующие в процессе канцерогенеза и определяющие способность опухоли к прогрессированию и метастазированию.
Прогрессирование – увеличение более чем на 25 % одной или более опухолей либо появление новых очагов поражения.
Операбельная опухоль – опухоль, локализация которой, а также анатомо-функциональные нарушения в пораженном органе, степень распространения, наличие отдаленных метастазов, тип роста и ее гистологическое строение позволяют выполнить хирургическое лечение.
Органосохраняющая операция – операция, которая предполагает удаление опухолевого узла с небольшим количеством окружающей здоровой ткани, с возможным проведением в дальнейшем одного из видов дополнительного (адъювантного) лечения.
Резектабельная опухоль – опухоль, которую возможно удалить технически с учетом степени ее распространения.
Ремиссия – период течения болезни, который проявляется значительным ослаблением (неполная ремиссия) или исчезновением (полная ремиссия) симптомов (признаков) заболевания.
Локальный рецидив – возникновение той же опухоли в том же органе или на месте ее хирургического иссечения или лучевого лечения.
Регионарный рецидив – возникновение той же опухоли в зоне регионарного лимфооттока после оперативного иссечения или лучевого лечения.
Локо-регионарный рецидив – возникновение той же опухоли в зоне регионарного лимфооттока и в том же органе или на месте ее хирургического иссечения или лучевого лечения.
Диссеминированный рак = генерализованный рак = метастатический рак – опухоль с отдаленными метастазами.
Местно-распространенный рак – выход опухоли за пределы пораженного органа, с вовлечением окружающих тканей и/или лимфатических узлов, но без образования отдаленных метастазов.
Первичная опухоль (tumour) – первичный очаг злокачественного новообразования, основными характеристиками которого являются размеры и местное распространение.
Метастазы регионарные (nodulus) – метастазы опухоли по лимфатической системе в регионарные лимфатические узлы.
Метастазы отдаленные (metastasis) – метастазы опухоли, распространяющиеся гематогенным путем в отдаленные органы и ткани.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Жукова Людмила Григорьевна, доктор медицинских наук, заместитель директора ГБУЗ «Московский клинический научный центр имени А.С. Логинова ДЗМ», Москва.
- Андреева Юлия Юрьевна, доктор медицинских наук, профессор кафедры патологической анатомии РМАНПО, Москва.
- Завалишина Лариса Эдуардовна, доктор биологических наук, профессор кафедры патологической анатомии РМАНПО, Москва.
- Закиряходжаев Азиз Дильшодович, доктор медицинских наук, руководитель отделения онкологии реконструктивно-пластической хирургии молочной железы и кожи, Московский научно-исследовательский онкологический институт имени П.А. Герцена, Москва.
- Королева Ирина Альбертовна, доктор медицинских наук, профессор кафедры клинической медицины последипломного образования Медицинского университета «Реавиз», врач-онколог, Самара.
- Назаренко Алексей Витальевич, кандидат медицинских наук, старший научный сотрудник отдела общей онкологии ГБУЗ «Московский клинический научный центр имени А.С. Логинова ДЗМ», Москва.
- Палтуев Руслан Маликович, генеральный директор Общероссийской общественной организации «Российское общество онкомаммологов», старший научный сотрудник отделения опухолей молочной железы ФБГУ «НМИЦ онкологии им. Н.Н. Петрова», Санкт- Петербург.
- Пароконная Анастасия Анатольевна, доктор медицинских наук, старший научный сотрудник отделения радиохирургии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии и лучевой терапии ФГБОУ ВПО «РНИМУ им Н.И. Пирогова» Минздрава России, Москва.
- Петровский Александр Валерьевич, кандидат медицинских наук, заместитель директора по развитию онкологической помощи в регионах «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
- Портной Сергей Михайлович, доктор медицинских наук, ООО «Фрау Клиник», онколог- маммолог, Москва.
- Семиглазов Владимир Федорович, академик РАЕН, член-корреспондент РАН, доктор медицинских наук, профессор, руководитель хирургического отдела ФБГУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России, Санкт-Петербург.
- Семиглазова Татьяна Юрьевна, доктор медицинских наук, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры онкологии ГБОУ ВПО «СЗГМУ им. И.И. Мечникова» Минздрава России, Санкт-Петербург.
- Стенина Марина Борисовна, доктор медицинских наук, ведущий научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
- Степанова Александра Михайловна, кандидат медицинских наук, главный реабилитолог центра диагностики и реабилитации «Восстановление», Москва.
- Трофимова Оксана Петровна, доктор медицинских наук, ведущий научный сотрудник отделения радиологического НИИ КиЭР ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГБОУ ДПО РМА НПО Минздрава России, Москва.
- Тюляндин Сергей Алексеевич, доктор медицинских наук, профессор, руководитель отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
- Франк Георгий Авраамович, академик РАН, профессор, заведующий кафедрой патологической анатомии РМАНПО, Москва.
- Фролова Мона Александровна, кандидат медицинских наук, старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва.
- Шатова Юлиана Сергеевна, доктор медицинских наук, ведущий научный сотрудник отдела опухолей мягких тканей и костей, Ростовский научно-исследовательский онкологический институт.
- Невольских Алексей Алексеевич, доктор медицинских наук, заместитель директора по лечебной МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Московская область, Обнинск.
- Иванов Сергей Анатольевич, профессор РАН, доктор медицинских наук, директор МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Московская область, Обнинск.
- Хайлова Жанна Владимировна, кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России, Московская область, Обнинск.
- Геворкян Тигран Гагикович, заместитель директора НИИ КЭР ФГБУ «НМИЦ онкологии им.Н.Н. Блохина», Москва.
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- врачи-онкологи;
- врачи-хирурги;
- врачи-радиотерапевты;
- врачи-генетики;
- студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных, анализ современных научных разработок по проблеме РМЖ в РФ и за рубежом, обобщение практического опыта российских и зарубежных специалистов.
Методы, использованные для формулирования рекомендаций – консенсус экспертов.
Экономический анализ: анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которых попросили прокомментировать, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в рекомендации изменения регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка
Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность
интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций
Актуализация проводится не реже чем один раз в 3 года и не чаще, чем 1 раз в 6 мес с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих РМЖ, но не чаще чем раз в 6 месяцев. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций как потенциальных источников доказательств использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности.
Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу вытекающих из нее рекомендаций.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| Уровень достоверности доказательств | Расшифровка |
| 1 | Систематический обзор рандомизированных контролируемых исследований с применением метаанализа |
| 2 | Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай – контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| Уровень убедительности рекомендаций | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно- правовых документов:
- Приказ Минздрава России от 15.11.2012 № 915н «Об утверждении Порядка оказания медицинской помощи населению по профилю «Онкология».
- Приказ Минздрава России от 10.05.2017 № 203н «Об утверждении критериев оценки качества медицинской помощи».
- Приказ Минздрава России от 09.11.2012 N 782н «Об утверждении стандарта специализированной медицинской помощи при злокачественных новообразованиях молочной железы IIIB, C стадии (хирургическое лечение)».
- Приказ Министерства здравоохранения Российской Федерации от 07.11.2012 № 612н «Об утверждении стандарта специализированной медицинской помощи при первично- генерализованных и рецидивных формах злокачественных новообразованиях молочной железы IV стадии — первично; I — IV стадии — прогрессирование (системное лекарственное, в том числе химиотерапевтическое, лечение)».
-
Распоряжение Пр авительства РФ от 10.12.2018 г. № 2738-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2019 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи».
- Приказ Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588).
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б. Алгоритмы действий врача
Рис. 1. Блок-схема диагностики и лечения пациента раком молочной железы
Рис. 2. Рекомендуемый алгоритм лечебно-диагностических мероприятий в зависимости от клинической группы рака молочной железы
Примечания:
1неоадъювантная лекарственная терапия при I стадии рекомендуется только в рамках клинических исследований. Неоадъювантную ХТ рекомендуется проводить с использованием стандартных режимов (см. табл. 4, 5) и обязательным соблюдением рекомендуемой дозовой интенсивности (стандартные дозы и интервалы между курсами). При отсутствии необходимых материальных ресурсов, гарантирующих проведение рекомендуемой неоадъювантной лекарственной терапии (антрациклины и родственные соединения, таксаны, трастузумаб**, пертузумаб**, #Г-КСФ**), при первично операбельном РМЖ рекомендуется на первом этапе выполнить хирургическое лечение;
2адъювантная ХТ не рекомендуется пациентам, получившим неоадъювантную ХТ в полном объеме. В тех случаях, когда неоадъювантная ХТ по каким-либо причинам не была полностью проведена до операции, рекомендуется проведение недостающих циклов в послеоперационном периоде. Пациентам РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в полном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) может быть назначена адъювантная ХТ #капецитабином** (2000 мг/м2 в 1–14-й дни каждые 3 нед в течение 6 мес) [108];
3пациентам HER2-положительным РМЖ, получившим неоадъювантную лекарственную терапию антрациклинами и родственными соединениями и/или таксанами в сочетании с трастузумабом** (± пертузумаб**), при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) в качестве адъювантной терапии может быть назначен трастузумаб-эмтанзин** 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов [114].
Рис. 3.
Рекомендуемая последовательность различных методов адъювантной терапии
Рис. 4. Рекомендуемая тактика лечения первично операбельного РМЖ (T2N0M0, T2N1M0, T3N0M0, T3N1M0) в случае неоадъювантной лекарственной терапии
Примечания:
1адъювантная ХТ не рекомендуется пациентам, получившим неоадъювантную ХТ в полном объеме; в отдельных случаях, когда на дооперационном этапе ХТ по каким-либо причинам не была полностью завершена, рекомендуется проведение недостающих циклов в послеоперационном периоде. Пациентам РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в полном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) может быть назначена адъювантная ХТ #капецитабином** (2000 мг/м2 в 1–14-й дни каждые 3 нед в течение 6 мес) [108];
2пациентам с HER2-положительным РМЖ, получившим неоадъювантную лекарственную терапию антрациклинами и родственными соединениями и/или таксанами в сочетании с трастузумабом** (± пертузумаб**), при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов в качестве адъювантной терапии может быть назначен #трастузумаб-эмтанзин** 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов [114];
3патоморфологическое исследование должно включать оценку степени выраженности патоморфологического ответа;
4желательно ИГХ исследование резидуальной опухоли с коррекцией адъювантной терапии при необходимости.
Рис. 5.
Рекомендуемая последовательность использования различных видов лечения в случае неоадъювантной терапии
Рис. 6. Рекомендуемая тактика лечения местнораспространенного первично неоперабельного РМЖ (T0N2M0, T1N2M0, T2N2M0, T3N2M0, T4N0-2M0, T1-4N3M0)
Примечания:
1неоадъювантная ГТ может быть рекомендована пациентам в менопаузе с люминальным А подтипом РМЖ;
2адъювантная ХТ не рекомендуется пациентам, получившим неоадъювантную ХТ в полном объеме. В отдельных случаях, когда на дооперационном этапе ХТ по каким-либо причинам не была полностью завершена, рекомендуется проведение недостающих циклов в послеоперационном периоде. Пациентам РМЖ с тройным негативным фенотипом (отрицательные РЭ, РП и HER2), получившим неоадъювантную ХТ антрациклинами и родственными соединениями и таксанами в полном объеме, при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0–II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) может быть назначена адъювантная ХТ #капецитабином** (2000 мг/м2 в 1–14-й дни каждые 3 нед в течение 6 мес) [108];
3пациентам HER2-положительным РМЖ, получившим неоадъювантную лекарственную терапию антрациклинами и родственными соединениями и/или таксанами в сочетании с трастузумабом** (± пертузумаб**), при наличии инвазивной резидуальной опухоли, соответствующей RCB II–III или, при невозможности оценки по RCB, при резидуальной опухоли в регионарных лимфатических узлах (независимо от степени патоморфоза в первичной опухоли в молочной железе) или при резидуальной опухоли в молочной железе, соответствующей 0-II степени лекарственного патоморофоза по Лавниковой (независимо от состояния регионарных лимфатических узлов) в качестве адъювантной терапии может быть назначен трастузумаб-эмтанзин** 3,6 мг/кг в/в в 1-й день 1 раз в 3 нед, до 14 циклов [114];
4патоморфологическое исследование должно включать оценку степени выраженности патоморфологического ответа;
5желательно ИГХ исследование резидуальной опухоли с коррекцией адъювантной терапии при необходимости;
6оперативное лечение не показано, если в результате лекарственной и лучевой терапии не достигнуто операбельное состояние, за исключением случаев, когда хирургическое лечение может улучшить качество жизни.
Рис. 7.
Алгоритм выбора терапии люминального РМЖ у пациентов в менопаузе и женщин репродуктивного возраста, получающих овариальную супрессию, в зависимости от предшествующего лечения и его эффективности
Примечания:
1 ≤12 мес после завершения адъювантной ГТ; 2 ≥12 мес после завершения адъювантной ГТ; 3 вариант ГТ зависит от предшествующего лечения и его эффективности.
Рис. 8. Рекомендуемый алгоритм лекарственной терапии при метастатическом гормонозависимом раке молочной железы
Приложение В. Информация для пациента
Рекомендации при осложнениях химиотерапии: связаться с врачом-онкологом; при отсутствии возможности связаться с врачом-онкологом обратиться к врачу общей практики:
-
при повышении температуры тела ≥38 °C:
- обратиться к врачу-онкологу/врачу общей практики,
- осуществлять контроль температуры каждые 3 часа;
-
при стоматите:
- диета: механически, химически и термически щадящая пища,
- обратиться к врачу-онкологу;
-
при диарее:
- диета: исключить жирное, жареное, острое, копченое, сладкое, молочное, клетчатку; можно нежирное мясо, мучное, кисломолочное, рисовый отвар,
- обильное питье,
- обратиться к врачу-онкологу/врачу общей практики;
-
при тошноте:
- обратиться к врачу-онкологу/врачу общей практики.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки степени и стадии лимфедемы
В зависимости от этапов развития осложнения в России было предложено выделять следующие стадии вторичной лимфедемы: преходящий (I стадия), мягкий (II стадия), плотный (III стадия) и деформирующий (IV стадия) отек [180, 181].
Международным обществом лимфологов (International Society of Lymphology – ISL) [145] было выделено 4 степени тяжести и 3 стадии течения лимфедемы.
Степени лимфедемы
1 степень: разница в окружности или объеме между здоровой и пораженной конечностью 5– 10 %. Отмечается изменение обычного контура и архитектоники конечности (в сравнении со здоровой конечностью). Отек характеризуется формированием ямки при нажатии. Отек уменьшается при подъеме конечности или при ношении компрессионного трикотажа. Рука незначительно уплотненная и упругая.
2 степень: разница между здоровой и пораженной конечностью составляет 10–30 %. Значительное заметное изменение формы, исчезновение кожной складки. Отек более плотный и упругий, кожа натянутая.
3 степень: разница между здоровой и пораженной конечностью более 30 %; рука деформирована, функция ее нарушена. Может иметь место лимфорея через дефекты кожных покровов. Отек плотный, упругий. Кожа натянутая, блестит.
4 степень: рука «афункциональная». Возможно формирование лимфосаркомы.
Стадии лимфедемы
Стадия 0 (субклиническая, латентная стадия): характеризуется отсутствием видимого отека, отсутствием ямки в коже при нажатии, ощущением тяжести или местного отека (могут присутствовать в течение нескольких месяцев или лет до появления видимого отека).
Стадия I (легкой степени течения): видимый отек. Может формироваться ямка, но ее может и не быть.
Стадия II (средней степени тяжести): видимый отек с формированием ямки. Кожа уплотнена, истончена.
Стадия III (тяжелой степени): видимый отек тканей, значительное увеличение иизменение формы конечности. Кожа и подлежащие ткани уплотнены, утолщены, ямка не образуется. Возможна лимфорея через дефекты кожных покровов.
Степень лимфедемы по рекомендациям ISL оценивают по разнице окружностей конечностей.
В зависимости от разницы в окружностях конечностей в России предложена классификация, согласно которой выделяют следующие степени отека [180, 181]:
I – увеличение окружности пораженной конечности до 1–2 см
II – от 2 до 6 см
III – от 6 до 10 см IV – более 10 см
Рекомендуется при установке диагноза постмастэктомической лимфедемы верхней конечности использовать классификации лимфедемы конечности по степени и стадии.
Приложение Г2. Оценка степени патоморфологического ответа опухоли на предшествующую терапию (система RCB)
Название на русском языке: оценка степени патоморфологического ответа опухоли на предшествующую терапию (система RCB).
Оригинальное название (если есть): Residual cancer burden.
Источник (официальный сайт разработчиков, публикация с валидацией): Symmans W. F. et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy //Journal of Clinical Oncology. – 2007. – Т. 25. – №. 28. – С. 4414–4422.
Тип: индекс.
Назначение: оценка степени патоморфологического ответа опухоли на предшествующую терапию.
Содержание (шаблон):
Система RCB — математическая модель, предложенная W. F Symmans и соавт. в 2007 г. на основании оценки некоторых характеристик остаточной опухоли и кривых безрецидивной выживаемости пациентов. В результате проведенного исследования авторами была предложена формула:
RCB = 1,4 (finvdprim)0,17 + [4 (1 – 0,75LN) dmet]0,17,
где dprim = âd1d2, где d1, d2 – микроскопические размеры ложа опухоли;
finv = (1 – (%CIS/100)) (%CA/100) – выраженность инвазивного компонента, рассчитанная на основании процента карциномы in situ (CIS) и инвазивного рака (CA) в опухоли;
LN – число лимфатических узлов с метастазами,
dmet – наибольший диаметр метастаза в лимфатическом узле.
Ключ (интерпретация):
Результатом вычислений является класс остаточной опухоли (остаточная опухолевая нагрузка), ранжированный от 0 до III:
- RCB–0 (pCR, полный патоморфологический ответ) – значение индекса 0;
- RCB–I (минимальная остаточная опухоль) – значение индекса <1,36, низкий риск прогрессирования заболевания;
- RCB–II (умеренная остаточная опухоль) – значение индекса 1,36–3,28, промежуточный риск прогрессирования заболевания;
- RCB–III (выраженная остаточная опухоль) – значение индекса >3,28, высокий риск прогрессирования заболевания.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Понимание основных частей отчета о патологии помогает пациенту лучше узнать свой диагноз.
На что обратить внимание при анализе отчета по результатам обследования опухоли груди
Различные лаборатории патологии могут использовать разные термины для описания одной и той же информации. Таким образом, отчет может иметь немного другую формулировку, чем приведенная в данной статье.
Отчеты об тонкоигольной игольной биопсии могут содержать меньше информации, чем отчеты о хирургической биопсии.
Кроме того, некоторые тесты проводятся только при обнаружении инвазивного рака груди или определенных типов рака груди. Если в исследуемой ткани нет рака или если диагноз – протоковая карцинома in situ (DCIS), многие из описанных ниже разделов не будут в него включены.
Диагноз или окончательный диагноз
Это самый важный раздел отчета. Он дает окончательный диагноз патолога и может включать следующую информацию об опухоли:
- размер;
- тип;
- степень;
- статус гормональных рецепторов;
- статус HER2/neu.
Если во время хирургической операции была проведена диссекция лимфатических узлов, статус этих лимфатических узлов также будет включен в отчет.
Эта информация может отображаться сгруппировано или в виде отдельных разделов.
Микроскопическое описание по результатам биопсии опухоли
В микроскопическом описании подробно описано, что патолог увидел и измерил, когда исследовал биопсийную ткань под микроскопом.
Здесь приводится подробная оценка:
- клеток образования;
- структуры стромы;
- структуры паренхимы;
- любых изменений или отклонений от нормы.
Размер опухоли
Размер опухоли чаще всего указывается в сантиметрах или миллиметрах. Этот показатель связан с прогнозом (шансами на выживание) и является частью стадии рака. В большинстве случаев, чем меньше новообразование, тем лучше прогноз.
Маммолог может оценить размер опухоли, почувствовав ее во время физического осмотра. Также для оценки размера опухоли могут быть использованы изображения с УЗИ молочной железы или маммограммы. Однако лучший способ определить размер опухоли – измерить под микроскопом всю опухоль после того, как ее удалили из груди. Патологоанатом запишет данные в отчет о патологии.
Наибольшая длина опухоли в образце (ткань, удаленная во время операции) указывается как размер опухоли. Размер опухоли может быть намного меньше размера образца ткани (измерение всего образца приведено в общем описании).
Отличие инвазивной опухоли от неинвазивной
К неинвазивному раку относят протоковую карциному in situ (DCIS). В случае DCIS опухолевые клетки содержатся только в протоках. Это называется «in situ» (что означает «на месте»), и означает что они не распространились на близлежащие ткани молочной железы.
Инвазивная опухоль уже распространилась из исходного места (из молочных протоков или долек) не только в близлежащие ткани, но и, возможно, по лимфатической системе и/или в другие органы.
Степень злокачественности опухоли
В случае инвазивного рака молочной железы патолог отмечает форму раковых клеток и присваивает гистологическую оценку, используя систему счисления или слова. То есть проводится градирование только инвазивного (не in situ) образования/компонента.
Степень опухоли описывает структуру клеток и отличается от стадии опухоли. Степень – это способ классификации образований, основанный на определенных особенностях их клеток. Она связана с прогнозом и является частью стадии рака.
В целом, чем больше раковые клетки похожи на нормальные клетки груди, тем ниже оценка и тем лучше прогноз.
Самая распространенная система оценок – Ноттингемская. Другое название системы: Ноттингемская градирующая; Ноттингемская модификация Скарфа-Блума-Ричардсона. Она рекомендована многочисленными американскими и европейскими организациями, в том числе ВОЗ.
Согласно ей опухоли присваивается:
- 1 степень. Опухолевые клетки больше всего похожи на нормальную ткань и медленно растут (хорошо дифференцируются).
- Степень 2. Опухолевые клетки находятся где-то между 1 и 3 степенью (умеренно дифференцированные).
- Степень 3. Опухолевые клетки выглядят очень ненормально и быстро растут (плохо дифференцируются).
С помощью микроскопа патологоанатом изучает опухолевую ткань, удаленную во время биопсии, и проверяет ее:
- На предмет атипии. Насколько раковые клетки похожи на нормальные клетки (чем больше раковые клетки похожи на нормальные клетки, тем ниже степень опухоли).
- На количество митозов. Сколько раковых клеток находится в процессе деления (чем меньше раковых клеток в процессе деления, тем ниже степень опухоли. Это означает, что опухоль также, скорее всего, будет медленно расти).
- На ядерный полиморфизм.
Вместе эти факторы определяют степень злокачественности опухоли.
При оценке ткани необходимо соблюдать следующие правила:
- Препарат должен быть надлежащего качества:
-
- Своевременно и адекватно зафиксирован;
- Исследовать необходимо несколько участков образования, периферической части обязательно (количество участков зависит от размера опухоли, но должно быть не менее четырех);
- Должна быть оптимальная толщина – 4-5 микрон. Если препарат будет слишком толстый, тяжело будет рассмотреть детали.
2. Оценка ядерного полиморфизма и количества митозов проводится в самых “худших”, “ненормальных” участках. Такие участки часто находятся ближе или непосредственно на периферии опухоли.
3. В разных участках (особенно если опухоль смешанная) могут быть разные показатели/характеристики.
4. Всегда и в любом участке образования оценивается состояние железистых структур.
Ядерный полиморфизм
Ядерный полиморфизм описывает, насколько близко ядра раковых клеток похожи на ядра нормальных клеток груди.
В целом, чем выше ядерная степень, тем более аномальными являются ядра и тем более агрессивными становятся опухолевые клетки. Чтобы исследование было объективным, клетки сравнивают с эпителиальными нормальными клетками прилежащих тканей молочной железы. Это позволит исключить возможную ошибку (субъективное мнение специалиста).
Ядерная степень злокачественности является частью общей степени злокачественности.
Число митозов
Число митозов показывает пролиферативную активность образования. Является составной частью общей степени злокачественности и влияет на прогноз патологии.
При определении количества митозов также соблюдают некоторые правила:
- подсчитывают в десяти полях зрения;
- исследуют периферические участки, так как они наиболее пролиферативны;
- в смешанной опухоли частота митозов может быть разная. Если это наблюдается, тогда количество определяют в наиболее митотически активных участках.
После определения этих трех показателей (оценки железистых/тубулярных структур на степень отклонения от нормальной ткани+количество митозов+ядерный полиморфизм) устанавливают степень злокачественности. Напомним, что анализ проводится только инвазивной области. В отчете должен быть представлен как общий балл, так и каждый из трех исследований.
| Образование составляют тубулярные/канальцевые или железистые структуры | Баллы |
| > 75% | 1 |
| 10-75% | 2 |
| <10% | 3 |
| Ядерный полиморфизм (наиболее анапластическая область) | Баллы |
| Маленькие, правильные, однородные ядра, однородный хроматин | 1 |
| Умеренная вариабельность по размеру и форме, ядра везикулярные с видимыми ядрышками | 2 |
| Выраженная вариабельность (явные значительные различия формы и размера), ядра везикулярные, часто с множественными ядрышками | 3 |
| Количество митотических фигур в 10 полях. Увеличение 40x или другое (зависит от площади поля, см. ключ ниже). мм2 – единица площади | Баллы | ||||
| 0,096 мм2 | 0,12 мм2 | 0,16 мм2 | 0,27 мм2 | 0,31 мм2 | |
| 0-3 | 0-4 | 0-5 | 0-9 | 0-11 | 1 |
| 4-7 | 5-8 | 6-10 | 10-19 | 12-22 | 2 |
| >7 | >8 | >10 | >19 | >22 | 3 |
- Olympus BX50, BX40, BH2, AO или Nikon с окуляром 15x: 0,096 мм2;
- АО с окуляром 10x: 0,12 мм2;
- Nikon или Olympus с окуляром 10x: 0,16 мм2;
- Leitz Ortholux: 0,27 мм2;
- Diaplan Leitz: 0.31 мм2.
Цифры митотического счета основаны на оригинальных данных, представленных для Leitz Ortholux Elston and Ellis 1991, с модификациями, основанными на измеренных областях зрения. Оцениваются области наиболее активного роста, обычно в клеточных областях на периферии. Для идентификации митотических фигур используют строгие критерии.
| Сумма вышеперечисленных трех составляющих | Общая оценка злокачественности |
| 3-5 баллов | Степень I (хорошо дифференцированный) |
| 6-7 баллов | Степень II (умеренно дифференцированный) |
| 8-9 баллов | Степень III (плохо дифференцированный) |
Продолжение статьи
- Часть 1. Расшифровка отчета о патологии опухолей молочных желез. Диагноз, степень злокачественности.
- Часть 2. Расшифровка отчета о патологии опухолей молочных желез. Статус гормональных рецепторов, HER2/neu.
- Часть 3. Отчет о патологии опухолей молочных желез. Оценка лимфатических узлов. Другая информация.
Рак молочной железы на протяжении нескольких последних десятилетий занимает лидирующие позиции в статистике смертности женщин по всему миру. Борьбу с ним затрудняют многие особенности болезни, включая разнообразие видов. С усовершенствованием методов диагностики ситуация начала меняться к лучшему.

Параметры классификации РМЖ
Основными элементами груди являются дольки с железками, продуцирующими материнское молоко, а также протоки, доставляющие его к соску. Ткани пронизаны кровеносными, лимфатическими сосудами, ответственными за снабжение молочной железы (МЖ) питательными веществами, вывод продуктов распада. Заболевание начинается, когда нормальные клетки организма женщины начинают бесконтрольно делиться, при этом процесс их отмирания нарушен. Виды рака молочной железы классифицируются по разным признакам.
По локализации первичного узла онкологические патологии делят на новообразования:
- соска;
- ареолы;
- подмышечной области.
В зависимости от квадранта расположения злокачественные узлы бывают:
- верхневнутренними;
- верхненаружными;
- нижневнутренними;
- нижненаружными.
До 50% первичных новообразований у женщин образуются в верхненаружнем квадранта молочной железы, около 20% — в области ареолы или центральной части груди.
В отдельные группы специалисты выделяют рак молочной железы неуточненного местоположения, и выходящий за границы отдельных областей.
Опухолевые первичные узлы бывают протоковыми или дольковыми, исходя из того, ткани какого элемента структуры органа начали перерождаться.
Помимо местоположения, большую диагностическую ценность имеет классификация болезни по таким параметрам, как:
- гистологическое строение;
- стадия развития;
- форма;
- молекулярная таксономия.
Злокачественные новообразования также дифференцируются по степени агрессивности воздействия, скорости распространения.
Метастазирование
Вне зависимости от расположения первичного узла, онкологическое заболевание может быть:
- неинвазивное — опухоль разрастается, но не покидает границы пораженной части органа;
- инвазивное — злокачественное новообразование разрастается за границы дольки (или молочного протока), его метастазы сначала «захватывают» здоровые части груди, затем, другие органы и системы.
Злокачественные клетки «разносятся» по организму из железы двумя путями:
- лимфогенным — по лимфатическим сосудам;
- гематогенным — с кровотоком.
Сначала метастазы поражают региональные лимфоузлы под лопатками, подмышками, районе грудины или ключиц. Затем появляются в отдаленных участках лимфатической системы, прорастают в кожу, мягкие и костные ткани.
При терминальной стадии злокачественные клетки обнаруживаются практически во всех внутренних органах человеческого тела. Метастазы из первичного узла чаще распространяются гематогенным путем в:
- печень;
- головной мозг;
- позвоночник;
- плевру;
- легкие;
- яичники;
- кости таза, бедер.
Когда развитие РМЖ заканчивается тем, что аномальные ткани отделяются от «материнского» узла, переносятся на другие части организма женщины, болезнь называется метастатической.
Если первичный патогенный узел вновь формируется после лечения во второй грудной железе, на прежнем месте, близко расположенных тканях или органах, речь идет о рецидивирующем виде онкологического заболевания.
Обе формы патологии относятся к заболеваниям поздней стадии, метастазы могут проявиться спустя месяцы или даже годы после окончания лечения. Рецидив случается примерно у 30% женщин, прошедших терапию на ранних стадиях болезни. Среднее время локального «возвращения» онкологии — пять лет. Особенно высок риск повторного появления новообразования — первые 24 месяца.
Неинвазивный РМЖ по мере увеличения размера новообразования может приобретать инвазивную форму. Очень важно отслеживать интенсивность ее роста, успеть вовремя приступить к лечению, купировать метастазирование.
Специалисты выделяют три степени удвоения размера карцином у женщин:
- высокая – аномальный первичный узел разрастается двукратно за три месяца и меньше;
- средняя – удваивается за период времени от 3 до 12 месяцев;
- низкий – удвоение длится больше года.
Отдельной дифференциации подвергаются клетки опухоли. В медицинских документах параметр обозначается латинской буквой «G». Врачи выделяют три степени опасности РМЖ:
- высокодифференцированный (G1) — злокачественные клетки похожи на естественные, медленно делятся, имеют низкий потенциал к метастазированию;
- умереннодифференцированный (G2) — патологически измененные структуры сохраняют признаки нормальных, размножаются со средней скоростью, более склонны к распространению, чем предыдущая группа;
- низкодифференцированный (G3) — клетки практически лишены признаков здоровых, быстро делятся, обладают высоким потенциалом к формированию метастазов. Выступают признаком онкологической болезни с агрессивным, стремительным, жизнеугрожающим течением.
Определение типа злокачественных клеток, локализации первичного новообразования помогает спрогнозировать возможное распространение метастазов.
Гистотипы рака груди
Гистологическая форма болезни определяется по месту ее формирования, характеру распространения. Чаще всего у женщин появляются карциномы — образования из злокачественных эпителиальных тканей органов.
Онкологи выделяют несколько основных видов карцином молочной железы по гистотипу:
- внутрипротоковая карцинома — начальная стадия онкологического заболевания, разрастается из эпителиальных клеток, из-за маленького размера не пальпируется, бывает случайной находкой во время профосмотра. Она дополнительно обозначается латинским термином in situ (в переводе это означает «на своем месте»). Форма успешно поддается лечению, однако вероятность рецидива в первые 10 лет составляет около 30%.
- дольковая карцинома in situ – формируется из железистой ткани, остается в границах одной дольки. Также как предыдущий вид имеет маленький размер, прощупывается только при подкожном расположении;
- инфильтрирующая внутрипротоковая карцинома – самый распространенный вид рака молочной железы у женщин. На его долю приходится около 80% от общего числа выявляемых случаев онкологии органа. Очаг зарождается в молочном протоке, разрастается за его границы, поражает окружающие ткани, затем лимфоузлы. Чаще развивается у дам старше 55 лет, но может появиться у молодой девушки;
- инфильтрирующая лобулярная карцинома — берет начало из дольки, атакует грудь, затем кожу, мышцы, костную ткань. Диагностируется у 20% женщин с РМЖ;
- медуллярная карцинома – объемное, мягкое новообразование с четко очерченными границами, относится к протоковой группе онкологических болезней. Оно встречается редко (на него приходится 3-5% случаев). Прогноз очень благоприятный. Опухоль медленно растет, почти никогда не переходит на лимфоузлы, поддается лечению;
- воспалительная карцинома – редкий вид заболевания. Оно занимает 2% общей структуры РМЖ, обычно развивается у юных женщин. Названием обязано особенностям течения, схожими с воспалительным процессом. Инфильтрация сопровождается болью, повышением температуры тела, отечностью, покраснением кожи. Опухоль крайне агрессивна, распространяется молниеносно, требует немедленного хирургического вмешательства;
- секретирующая карцинома (или ювенильный рак) развивается у детей либо подростков. Выглядит как узел с четкими границами, достигает размера 3 см в диаметре. Метастазы распространяет редко;
- папиллярная карцинома — еще одна редкая форма (1-2% случаев), характерна для женщин во время пост-менопаузы. Образование мягкое, образуется около соска, растет в просвет молочного протока, почти никогда не дает метастазы;
- апокриновая карцинома (1% случаев РМЖ). Развивается медленно, но часто поражает региональные лимфоузлы.
Помимо карцином, у женщин могут образовываться саркомы. Опухоли этого вида формируются не из тканей эпителия. Они встречаются гораздо реже карцином, отличаются быстрым ростом, высоким уровнем злокачественности и смертности.
Науке известны разные виды сарком, различных по происхождению:
- липосаркома — представляет собой сгусток перерожденных жировых клеток;
- фибросаркома — формируется из соединительной ткани органа, имеет гладкую поверхность, вырастает до очень крупных размеров. Диагностируется чаще других разновидностей;
- рабдомиосаркома — появляется вследствие озлокачествления волокон поперечно-полосатых мышц. Обычно развивается у молодых женщин, стремительно распространяет метастазы;
- хондросаркома, остеосаркома — в груди образуются редко. Относятся к категории «возрастных» онкологических заболеваний;
- ангиосаркома — состоит из злокачественных клеток лимфоузлов, кровеносных сосудов. Обладает высокой вероятностью рецидивирования.
Это далеко не полный список разновидностей РМЖ у женщин. Каждый из них подразделяется на подтипы, встречаются также смешанные формы.
Типы рака груди по форме опухоли
По структуре новообразований врачи выделяют две их формы:
- узловая — представляет собой обособленное злокачественное уплотнение, степенью твердости сопоставимое с камнем. Иногда оно спаивается с кожей, другими структурами органа, провоцирует деформацию окружности или соска. Если опухоль образуется из одного узла, она является уницентрической, когда из нескольких — мультицентрической;
- диффузная — встречается гораздо реже узловой. Не имеет четких границ, «расползается» по всему органу, быстро растет, метастазирует. Первичный очаг увеличивается, покрывается сеточкой сосудов, отекает. Кожа становится бугристой, грубой. Этот вид характерен для молодых пациенток, может появиться во время беременности или кормления грудью.
Особняком в общей классификации стоит редкая, атипичная форма злокачественной патологии — болезнь Педжета, при которой измененные клетки сосредотачиваются под соском. Основным признаком онкологического заболевания выступают деформации этой части груди (втягивание, изъязвление, набухание).
Среди других симптомов:
- мокнущие, шелушащиеся участки на ареоле;
- зуд;
- жжение;
- незначительные покалывания;
- покраснение кожи над опухолью.
У специалистов нет единого мнения по поводу этого заболевания. Часть врачей относят ее к предраковым состояниям, поскольку озлокачествление клеток происходит только в 3-5% случаев. Период перерождения иногда занимает 10 лет и дольше. Затем поражение может распространиться на сам орган, подмышечные лимфоузлы.
Молекулярная таксономия
Современная медицина делит РМЖ на четыре молекулярных формы:
- люминальный, подтип А — гормонозависимый, отличается малой агрессивностью, встречается чаще других (примерно 40% от всех случаев). Хорошо поддается консервативному лечению;
- люминальный, подтип В — обладает выраженной зависимостью от синтеза эстрогенов, диагностируется у 15% пациенток. Исход лечения зависит от того, на какой стадии развития болезни оно началось;
- HER2-позитивный — гормононезависимая форма злокачественных опухолей молочной железы, отличается высокой агрессивностью, смертностью больных. На его долю приходится около 10% от выявленных типов онкологических заболеваний МЖ;
- трижды негативный — очень опасное новообразование. Оно стремительно распространяется, плохо поддается лечению, имеет крайне негативный прогноз выживаемости. У первичного узла отсутствуют эстрогеновые, прогестероновые рецепторы, Her2. Гормоны не оказывают влияния на рост новообразования в размерах, соответственно таргетная, гормонотерапия бессмысленны. Такой вид заболевания занимает второе место по распространенности. Оно регистрируется в 35% случаев.
Перечисленные молекулярные подтипы, из-за огромного количества различий, фактически являются отдельными патологиями, требуют индивидуального подхода к лечению.
Стадии болезни
Классификация рака молочной железы по стадии развития осуществляется в соответствии с международной системой, которая учитывает размер, состояние первичного злокачественного очага, наличие ближайших, отдаленных метастазов.
Всего выделяют 4 стадии:
- 0 — клетки узла не выходит за границы пораженного органа. К этой категории относятся неинфильтрирующие протоковая, дольковая карциномы, а также болезнь Педжета до появления признаков опухоли;
- 1 — размер новообразования не больше 2 см, метастазы отсутствуют;
- 2 — образование разрастается до 5 см, возможно поражение ближайших лимфоузлов (грудных либо подмышечных) при меньших размерах узла;
- 3 — размер первичного злокачественного очага превышает 5 см, обнаруживаются региональные метастазы, новообразование прорастает в кожу, грудную стенку, проявляются дерматологические признаки онкологического заболевания. Иногда присутствуют одиночные отдаленные поражения;
- 4 — размер опухоли на этой стадии значения не имеет. Она легко пальпируется за границами грудного новообразования, на теле появляются изъязвления. Метастазы поражают не только отдаленные лимфоузлы, но также различные внутренние органы, где формируются вторичные злокачественные новообразования, состоящие из клеток первичных узлов.
При определении стадии болезни учитывают не только размер первичного очага РМЖ, но и особенности его роста, локализации. Так, микроинвазией считают проникновение аномальных клеток в базальную мембрану груди максимум на 2 мм. Мультицентричный рак предполагает множественные уплотнения в одной железе, билатеральный – в обеих.
Рак груди у мужчин
РМЖ принято считать женским онкологическим заболеванием, однако оно встречается также у представителей сильного пола. До периода полового созревания грудь мальчиков и девочек имеет схожее строение. В подростковом возрасте женские железы начинают расти под влиянием половых гормонов, мужские остаются зачаточными. В итоге у юношей остаются молочные протоки, а также несколько недоразвитых долек. Клетки этих структур озлокачествляются, формируют первичные опухоли. Происходит это крайне редко. На долю мужского РМЖ приходится менее 1% от всех выявленных случаев данной болезни.
У мужчин чаще встречаются инвазивные или неинвазивные протоковые карциномы грудных желез. Дольковые формы опухолей диагностируются реже — эти элементы мужской груди недостаточно сформированы. Также у представителей сильного пола выявляют болезнь Педжета, воспалительный рак.
Основными признаками онкологической патологии являются:
- вытяжение или западение соска;
- высыпания, раздражения в области ареолы;
- деформация, набухание, уплотнение тканей органа;
- асимметричность грудей;
- пальпируемые уплотнения;
- выделения из сосков;
- увеличение лимфоузлов подмышками. Иногда по размеру они могут превосходить первичный узел опухоли.
Симметричное укрупнение обеих грудей обычно является не признаком злокачественной патологии, а избыточным скоплением жировой клетчатки.
Мужской РМЖ более агрессивный, чем женский. Из-за маленького размера желез, близкого прилегания здоровых тканей, он быстрее метастазирует. К тому же мужчины не предполагают, что у них может быть такое заболевание. Негативные изменения списывают на травмы, аллергию, другие причины. Даже заподозрив онкологический характер проблемы, парни стесняются обратиться к маммологу. Приходят на прием, когда уже поздно что-либо предпринимать, кроме паллиативной помощи. Смертность мужчин от РМЖ достаточно высока, несмотря на то, что при обнаружении на ранних стадиях болезнь возможно победить. До 85% мужских опухолей являются гормонозависимыми, поддающимися специфическому лечению.
Диагностика видов РМЖ
Из-за многообразия морфологических, гистологических форм онкологических заболевания, диагноз «рак молочной железы» нельзя поставить по одному-двум анализам. Для этого требуется комплексное обследование.
В него входят такие манипуляции, как:
- УЗИ — необходимо для визуализации локализации, размера новообразования;
- МРТ с контрастированием — помогает выяснить форму уплотнения;
- маммография;
- ПЭТ КТ — с высокой точностью определяет степень проникновения метастазов в окружающие ткани, лимфоузлы, внутренние органы;
- сцинтиграфия;
- лабораторные анализы крови на биохимию, на содержание онкомаркеров, концентрацию гормонов;
- рентгенография;
Итоговым методом выявления онкологических патологий выступает пункционная биопсия — забор подозрительного биоматериала (участков тканей, жидкостей и прочего) через прокол.
Полученные вещества отправляются на гистологическое исследование, по результатам которого пациентке ставится диагноз, описываются характеристики опухоли. На основании полученных данных врач разрабатывает дальнейшую тактику лечения.
Рак молочной железы имеет множество «лиц». Он успешно маскируется под другие заболевания, проявляется на поздних стадиях. Однако, современная медицина располагает достаточным количеством средств, методов для раннего обнаружения онкологических патологий любого вида, успешного лечения. Сегодня диагноз РМЖ не является приговором. Главное — как можно раньше обратиться к маммологу. От того, насколько своевременно женщине или мужчине будет проведено лечение , зависит насколько далеко проникнут метастазы, поразят ли они жизненноважные органы пациента.
Ориентировочная стоимость лечения рака молочной железы
| Опухоль молочной железы: оперативное лечение | Стоимость*, евро |
|---|---|
| Германия | от 5 000 до 15 000 |
| Израиль | от 15 000 до 25 000 |
| Франция | от 12 000 |
Точную стоимость никто не сможет сказать. Она зависит от многих факторов, и все их предусмотреть невозможно. Прежде всего, на цене скажется способ терапии и используемые препараты.
Компания «Пациент менеджмент» на протяжении многих лет занимается организацией индивидуального медицинского обслуживания высокого качества.
За годы работы мы накопили статистику по ведущим зарубежным клиникам и готовы рекомендовать пациентам для лечения различных стадий молочной железы только те медицинские центры, где действительно окажут наиболее эффективную помощь.
Содержание статьи:
- Что такое рак молочной железы
- Код заболевания по МКБ-10
- Причины и факторы риска развития РМЖ
- Признаки онкологии молочной железы
- Виды рака груди
- Стадирование рака молочной железы
- Классификация по стадиям
- Классификация TNM
- Метастазы при раке молочной железы
- Диагностика рака груди
- Лечение рака молочной железы
- Хирургическое лечение РМЖ
- Химиотерапия
- Лучевая терапия
- Гормонотерапия
- Таргетная терапия
- Иммунотерапия
- Лечение РМЖ при отдаленных метастазах
- Прогнозы при раке молочной железы
- Профилактика РМЖ
Рак молочной железы (РМЖ, рак груди) – злокачественная опухоль, которая развивается из эпителия молочных (грудных) желез. РМЖ находится на первом месте по частоте распространения среди всех злокачественных новообразований у женщин и на втором месте среди онкопатологий в целом. Согласно данным статистики, в общем объеме злокачественных опухолей, выявляемых ежегодно, доля рака груди занимает 20-25 %. У мужчин рак грудных желез также встречается, но очень редко, составляя около 0,3-1 % в общем объеме выявляемых раковых опухолей.
Наиболее часто РМЖ диагностируется у жительниц экономически развитых стран Европы и Северной Америки, где показатель заболеваемости в несколько раз выше, чем в развивающихся странах Азии и Латинской Америки.
Средний возраст пациенток с раком груди составляет 61,5 года. При этом около 30 % случаев заболевания приходятся на женщин трудоспособного и социально активного возраста (40-49 лет).
За последние 10 лет (согласно данным на 2021 год) среднегодовой темп прироста заболеваемости составил 1,97 %. В это же время, в том числе благодаря скрининговым программам диагностики РМЖ, увеличивается число пациентов, у которых заболевание выявлено на I-II стадиях. Однако количество случаев рака груди, выявленных на второй стадии, все еще значительно больше, чем на первой.
В структуре женской смертности рак молочной железы находится на первом месте – около 16 % от всех смертей, но в последние годы показатель несколько снизился.
РМЖ – один из наиболее изученных видов рака. Успешность лечения этого заболевания зависит от стадии, на которой выявлена опухоль, семейного анамнеза, а также HER2-статуса – позитивного или негативного, свидетельствующего, соответственно, о наличии или отсутствии рецептора HER2 (второго эпидермального человеческого фактора роста), играющего определенную роль в развитии рака груди.
Код рака молочной железы по МКБ-10
В Международной классификации болезней (МКБ) злокачественным новообразованиям молочной железы присвоен общий код C50. В него не входят раковые опухоли кожи грудных желез, закодированные в МКБ-10 под кодами C43.5, C44.5.
В свою очередь код C50 разделен на подгруппы:
- C50.0 – новообразования соска и ареолы молочной железы;
- C50.1 – центральной части МЖ;
- C50.2 – верхневнутреннего квадранта МЖ;
- C50.3 – нижневнутреннего квадранта МЖ;
- C50.4 – верхненаружного квадранта МЖ;
- C50.5 – нижненаружного квадранта МЖ;
- C50.6 – подмышечной задней части МЖ;
- C50.8 – поражение МЖ, выходящее за пределы одной или более описанных локализаций;
- C50.9 – злокачественная опухоль МЖ неуточненной локализации.
Причины и факторы риска развития рака молочной железы
Единственной или главной причины возникновения рака груди не выявлено. Определенную часть случаев РМЖ (от 3 до 10 %) исследователи объясняют наличием мутаций в генах BRCA1, BRCA2 (наиболее распространенные), CHEK, NBS1, TP53 и др. (мутации в этих генах встречаются реже).
Значимый фактор риска развития рака грудных желез – нарушения в эндокринной системе организма, прямо или косвенно влияющие на повышение уровня гормона эстрогена. Это сахарный диабет, ожирение, заболевания щитовидной железы, дисгормональная дисплазия молочных желез. Уровень эстрогенов также может повышаться в результате длительной заместительной гормональной терапии этим гормоном без назначения прогестерона.
К другим факторам риска, связанным с гормональным фоном, относятся:
- раннее начало менструаций;
- поздний климакс;
- отсутствие родов либо слишком большое их количество;
- аборты в анамнезе;
- бесплодие.
Свою роль играют и внешние факторы. В их числе:
- злоупотребление спиртными напитками, курение;
- низкая физическая активность;
- воздействие химических канцерогенов, ионизирующего облучения;
- избыточное потребление животных жиров.
Некоторые исследователи отмечают внушительную роль наследственности в развитии заболевания, примерно у 25 % пациенток имеются случаи рака груди среди близких родственниц.
Симптомы рака молочной железы у женщин
Ранние признаки РМЖ женщина может выявить при самодиагностике – пальпации (ощупывании) груди, которую рекомендуется выполнять ежемесячно, в первые несколько дней после окончания менструации. Чаще всего первым симптомом заболевания является уплотнение в груди. Оно может быть плотным, безболезненным, иметь неровные очертания. Обратиться к врачу нужно сразу же после обнаружения уплотнения.
Другими ранними симптомами рака груди являются:
- отечность железы целиком или ее части, деформация груди вследствие отека;
- асимметрия молочных желез, сосков;
- втянутая, напоминающая апельсиновую корку, кожа в области груди;
- боли в области соска, всей железы;
- втянутость соска;
- изменение окраски, плотности кожи груди, соска, появление сухости, шелушений;
- выделения из соска.
Не всегда присутствуют все симптомы, и не обязательно они свидетельствуют о злокачественном процессе. Однако при их появлении необходимо посетить врача для своевременной постановки диагноза и назначения лечения любой патологии. Обнаружение РМЖ на ранних стадиях может спасти жизнь женщины.
Иногда первым проявлением рака молочной железы становится увеличение близлежащих лимфатических узлов (подмышечных, располагающихся возле ключицы) еще до появления всех вышеописанных признаков. Поэтому любое увеличение лимфоузлов, их болезненность также должны стать поводом для обращения к врачу.
На поздних стадиях, когда РМЖ дает метастазы в лимфоузлы и отдаленные органы, могут присоединяться общие симптомы:
- слабость, вялость;
- симптоматика со стороны органов и систем, пораженных метастазами;
- отсутствие аппетита, тошнота, рвота, нарушения стула;
- истощение;
- болевой синдром.
Признаки, позволяющие отличить рак молочной железы от доброкачественной опухоли
|
Признак |
Злокачественная опухоль |
Доброкачественное образование |
|
Положение молочных желез |
На больной стороне грудь находится выше |
Расположены на одном уровне |
|
Кожа над опухолью |
Спаяна с новообразованием, может быть втянута, иметь вид апельсиновой корки или пупка. Возможно просвечивание сосудов |
Без изменений: обычного цвета, подвижна |
|
Время появления болевых ощущений |
Появляются поздно |
Появляются на ранних стадиях, связаны с менструацией |
|
Ощущение при пальпации (прощупывании опухоли) |
Образование плотное, хрящевидное, узловатое. Опухоль спаяна с окружающими тканями, не смещается при пальпации. Нет четко очерченных границ. Кожа над опухолью с трудом собирается в складку |
Новообразование менее плотной консистенции, могут пальпироваться одновременно мягкие и более твердые участки. Поверхность уплотнения ровная, гладкая, округлая или мелкобугристая. Опухоль в основном четко отграничена, не спаяна с окружающими тканями. Кожа над ней не изменена |
|
Положение ареолы и соска |
Сосок пораженной железы деформирован, располагается выше горизонтальной линии, проведенной через здоровый сосок. Область ареолы сужена, деформирована |
Не изменено |
|
Влияние менструации |
Нет влияния |
Некоторые образования увеличиваются во время месячных, а затем – уменьшаются |
|
Расширение вен над опухолью |
Есть |
Нет |
|
Характер роста |
Быстрый, без регрессирования |
Медленный, в некоторых случаях опухоль может частично регрессировать (уменьшаться) |
|
Состояние жировой ткани над новообразованием |
Атрофирована |
Без изменений |
Классификация рака молочной железы
По форме рака груди:
- Узловая – отдельное уплотнение, которое может развиваться из одного узла (уницентрическое) или нескольких (мультицентрическое).
- Диффузная – не имеет четких границ, быстро разрастается «сеткой» по всей молочной железе. Встречается реже узловой формы. Подразделяется на:
- отечно-инфильтративную форму, характеризующуюся увеличением, отечностью груди, выраженной гиперемией, мраморной окраской кожи;
- рожистоподобную, для которой характерны очаги изъязвления, напоминающие симптомы рожистого воспаления;
- маститоподобную, проявляющуюся уплотнением пораженной железы, повышением температуры тела;
- панцирную, отличающуюся появлением множества узлов, из-за чего происходит деформация и сморщивание груди.
- Атипичная (рак Педжета) – экземоподобное поражение соска и ареолы. Может разрастаться по протокам вглубь железы с формированием в тканях опухолевого узла.
Гистологическая классификация:
- инвазивные карциномы молочной железы;
- редкие опухоли;
- нейроэндокринные опухоли;
- эпителиально-миоэпителиальные новообразования;
- папиллярные опухоли;
- неинвазивные дольковые опухоли;
- протоковая карцинома in situ;
- мезенхимальные опухоли;
- фиброэпителиальные опухоли;
- опухоли соска;
- злокачественные лимфомы;
- метастатические опухоли;
- РМЖ у мужчин.
Каждый из этих типов имеет свои подтипы. Также встречаются смешанные формы.
Инвазивная дольковая карцинома молочной железы. Гистология
Классификация рака молочной железы по биологическим подтипам:
- Люминальный, или гормоночувствительный – присутствуют рецепторы к эстрогену и прогестерону. Рецепторы к человеческому эпидермальному фактору роста (HER2) присутствуют (HER2-позитивный РМЖ) либо отсутствуют (HER2-негативный). Этот тип опухоли чувствителен к гормонотерапии.
- Нелюминальный HER2-позитивный. Этот вид рака молочной железы характеризуется отсутствием рецепторов к эстрогену и прогестерону, присутствуют рецепторы к человеческому эпидермальному фактору роста (HER2). В его лечении применяется таргетная терапия.
- Трижды негативный. Наиболее неблагоприятный вид РМЖ, в опухоли нет гормональных рецепторов и рецепторов HER2. Не поддается ни таргетной, ни гормонотерапии.
Инвазивная протоковая карцинома молочной железы. Гистология
Стадии рака молочной железы, включая стадирование TNM
Классификация по стадиям:
- 0 – опухоль in situ;
- 1 – размер опухоли не более 2 см, метастазы отсутствуют;
- 2 – новообразование размером от 2 до 5 см, возможно поражение регионарных лимфоузлов, при условии, что оно меньше размера опухоли;
- 3 – опухоль размером более 5 см, поражение регионарных лимфоузлов, прорастание новообразования в кожу груди, грудную стенку, возможны единичные отдаленные поражения;
- 4 – размер опухоли не имеет значения, имеются изъязвления кожи груди, метастазы в регионарные и отдаленные лимфоузлы, органы.
Классификация TNM
Для стадирования рака груди используется TNM-классификация. Критерий T описывает размеры и инвазию опухоли, N – состояние лимфоузлов, M – отсутствие или наличие отдаленных метастазов.
Стадирование по критерию T
|
Стадия |
Признаки |
|
Tx |
Недостаточно данных для оценки опухоли |
|
T0 |
Признаки первичной опухоли отсутствуют |
|
Tis (DCIS) |
Протоковый рак in situ |
|
Tis (Pedget) |
Рак Педжета (поражение сока и/или ареолы) без признаков опухоли |
|
T1mic |
Микроинвазия – опухоль в наибольшем измерении менее или равна 0,1 см |
|
T1a |
Размер новообразования в наибольшем измерении от 0,1 до 0,5 см |
|
T1b |
Опухоль в наибольшем измерении от 0,5 до 1 см |
|
T1c |
Размер злокачественного образования – от 1 до 2 см в наибольшем измерении |
|
T2 |
Размер опухоли в наибольшем измерении от 2 до 5 см |
|
T3 |
Новообразование размером более 5 см в наибольшем измерении |
|
T4 |
Опухоль любого размера, прямо распространяющаяся на грудную стенку – ребра, межреберные мышцы, переднюю зубчатую мышцу (без грудных мышц), и/или кожу |
|
T4a |
Прорастание грудной стенки, исключая инвазию только в грудные мышцы |
|
T4b |
Отек (включая «апельсиновую корку») или изъязвление кожи молочной железы либо сателлиты в коже железы |
|
T4c |
Сочетание признаков T4a и T4b |
|
T4d |
Воспалительный (отечный) рак груди |
Стадирование по критерию N
|
Стадия |
Признаки |
|
Nx |
Не хватает данных для оценки поражения регионарных л/узлов |
|
N0 |
Нет признаков метастатического поражения регионарных л/узлов |
|
N1 |
Метастазы в смещаемых подмышечных лимфоузлах (на стороне поражения) |
|
N2 |
Метастазы в подмышечных л/узлах на стороне поражения, спаянные между собой или фиксированные; или Клинически определяемые метастазы во внутренних маммарных (парастернальных) л/узлах при отсутствии клинически явного поражения подмышечных лимфоузлов |
|
N2a |
Метастазы в подмышечных л/узлах на стороне поражения, спаянные между собой или фиксированные |
|
N2b |
Клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфоузлах при отсутствии клинически явного поражения подмышечных лимфоузлов |
|
N3 |
Метастазы в подключичных л/узлах на стороне поражения; или Клинически определяемые метастазы во внутренних маммарных (парастернальных) л/узлах при наличии клинически явного поражения подмышечных л/узлов; или Метастазы в надключичных л/узлах на стороне поражения (независимо от состояния подмышечных и внутренних маммарных л/узлов) |
|
N3a |
Метастазы в подключичных лимфоузлах на стороне поражения |
|
N3b |
Метастазы во внутренних маммарных (парастернальных) лимфоузлах при наличии клинически явного поражения подмышечных лимфоузлов |
|
N3c |
Метастазы в надключичных л/узлах на стороне поражения |
Стадирование по критерию M
|
Стадия |
Признаки |
|
M0 |
Нет отдаленных метастазов |
|
M1 |
Есть отдаленные метастазы |
Группировка РМЖ по стадиям
|
Стадия |
T |
N |
M |
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1, включая T1mic |
N0 |
M0 |
|
IB |
T0, T1, включая T1mic |
N1mic |
M0 |
|
IIA |
T0 T1, включая T1mic T2 |
N1 N1 N0 |
M0 M0 M0 |
|
IIB |
T2 T3 |
N1 N0 |
M0 M0 |
|
IIIA |
T0 T1, включая T1mic T2 T3 |
N2 N2 N2 N1, N2 |
M0 M0 M0 M0 |
|
IIIB |
T4 |
N0, N1, N2 |
M0 |
|
IIIC |
любая T |
N3 |
M0 |
|
IV |
любая T |
любая N |
M1 |
Метастазирование рака молочной железы
Ранние метастазы обнаруживаются в близлежащих (регионарных) лимфоузлах – в подмышечной области. При метастазировании опухолевых клеток в лимфоузлы они увеличиваются в размерах, могут сливаться между собой, спаиваться с окружающими тканями. При нарушении тока лимфы возникает отек, припухлость мягких тканей, окружающих область лимфоузлов – при метастазировании в подмышечные л/узлы страдает рука с соответствующей стороны, возможно распространение отека на верхнюю часть груди, шею.
Типичными для РМЖ являются метастазы в кости. Они могут возникнуть как изолированно, так и одновременно с метастатическими очагами в других органах и тканях. Часто сопутствуют гормонально зависимым видам рака грудных желез. Костным метастазам свойственны боли, припухлости около места метастазирования, патологические переломы. Несмотря на то, что метастазы в костях трудно поддаются лечению, продолжительность жизни при них дольше, чем при метастатических очагах в других органах.
Также нередко рак молочной железы метастазирует в легкие. Этому способствуют анатомическая близость молочной железы и легких, их хорошее кровоснабжение. Метастазы распространяются в легкие гематогенным и лимфогенным путем. Симптомы метастазов в легкие – слабость, одышка, боли в грудной клетке, упорный хронический кашель, иногда с примесью крови, повышение температуры тела.
Легочные и скелетные метастазы при инвазивной протоковой карциноме молочной железы. Источник: radiopaedia.org
Метастазы в головной мозг редко возникают в первую волну диссеминации раковых клеток, чаще всего они свидетельствуют о запущенном процессе. Не исключено их появление даже после курсов химиотерапии. Метастатические очаги в этой области приводят к мучительным затяжным головным болям, не исключены неврологические нарушения, в зависимости от того, в каком участке мозга располагаются метастазы – нарушение слуха, зрения, головокружение, судороги, изменение сознания, расстройства личности.
Метастазы рака молочной железы в головной мозг. Источник: radiopaedia.org
Метастазы в печень также свидетельствуют о том, что РМЖ возник достаточно давно. Изолированное метастатическое поражение печени обнаруживается редко, обычно оно встречается вместе с метастазами в кости. Для метастазов в печень характерны желтуха кожи, слизистых, кожный зуд, боли в животе, нарушения пищеварения – тошнота, рвота, запоры или диарея. В тяжелых случаях развиваются асцит – скопление жидкости в брюшной полости, кровотечение из вен пищевода.
Крайне редко обнаруживаются метастазы РМЖ в щитовидную железу. Такие метастатические очаги очень ухудшают прогноз заболевания. При их обнаружении показано удаление щитовидной железы.
Диагностика рака молочной железы
Если женщина при самообследовании обнаружит уплотнение или другие симптомы, которые могут свидетельствовать о развитии злокачественной опухоли, нужно срочно обратиться к врачу.
Первый этап обследования – беседа с пациенткой и осмотр. Врач уточнит анамнез жизни – особенности, касающиеся менструального цикла, наличия родов, абортов, сопутствующих заболеваний, факторов риска, в частности, обратит внимание на отягощенную наследственность; и анамнез заболевания – какие именно жалобы пациентка предъявляет на данный момент, как давно они появились, попросит подробно описать имеющиеся симптомы.
Сбор физикальных данных включает в себя общий осмотр – состояние кожи, слизистых, измерение веса пациентки, а также пальпацию молочных желез и лимфоузлов. Затем доктор назначит необходимые анализы и обследования. В их список входят:
- ОАК, ОАМ;
- биохимический анализ крови;
- анализ крови на онкомаркер РМЖ;
- УЗИ, маммография или МРТ молочных желез – для подтверждения наличия опухоли, определения ее размера;
- галактография, дуктография – для оценки состояния протоков железы;
- биопсия с последующим морфологическим, гистологическим, молекулярно-генетическим анализом ткани опухоли;
- ЭКГ, рентген, УЗИ различных областей тела, ПЭТ-сканирование – для выявления метастатических поражений, оценки состояния органов и систем.
Маммографические признаки опухоли молочной железы
Окончательный диагноз рака молочной железы устанавливается только по результатам исследования биоптата. Он может быть получен разными способами:
- мазок-отпечаток выделений из соска;
- тонкоигольная биопсия под контролем маммографии или УЗИ;
- трепанобиопсия (CORE-биопсия) – забор ткани с помощью толстой полой иглы;
- стереотаксическая вакуум-биопсия с помощью инструмента Bard Magnum и вакуум-аппарата;
- эксцизионная биопсия при проведении хирургического вмешательства;
- сентинель-биопсия – исследование иссеченного сторожевого лимфоузла.
Помимо окончательного подтверждения диагноза, биопсия и последующее исследование биоматериала играют еще одну важную роль – определение гистологического типа, стадии опухоли, возможных генетических мутаций, статуса гормонозависимости для подбора оптимальной схемы лечения.
Лечение рака молочной железы
Оперативное лечение
Основной метод лечения РМЖ in situ или на ранних стадиях опухолевого процесса – хирургическое вмешательство. При раке in situ зачастую достаточно иссечения опухоли в пределах здоровых тканей с сохранением молочной железы. При I-III стадиях показаны органосохраняющие операции – лампэктомия, квадрантэктомия, сегментарная, частичная мастэктомия, или тотальная мастэктомия одной или обеих желез с последующей маммопластикой. После органосохраняющих операций требуется проведение лучевой или химиотерапии.
При подозрении на распространение процесса в регионарные лимфоузлы выполняется сентинель-биопсия и, при подтверждении метастазов в лимфоузлах, – тотальная лимфодиссекция.
На IV стадии по показаниям проводятся паллиативные операции: удаление крупных первичных очагов для облегчения симптоматики, по возможности – иссечение крупных метастазов. Однако при запущенном процессе хирургическое лечение показано и возможно далеко не всегда.
Химиотерапия
Применяется в комплексной терапии рака молочной железы до и/или после оперативного лечения – при нечувствительности опухоли к гормонотерапии, неэффективности или невозможности выполнения таргетной терапии, для уменьшения размеров первичного очага, метастазов в лимфоузлы, предотвращения рецидивов.
Лучевая терапия
Адъювантная лучевая терапия выполняется после органосохраняющих операций, а также после мастэктомии, если опухоль имела размер более 5 см. При метастатическом РМЖ лучевая терапия применяется как основной вид паллиативного лечения, она помогает разрушить основной очаг, метастазы, замедлить их рост, облегчить состояние пациентки, продлить срок жизни.
Гормональная терапия
Показана при гормонозависимых видах РМЖ. Гормональная терапия делится на неоадъювантную – назначается до операции для уменьшения размера опухоли, и адъювантную – применяется после оперативного лечения с целью окончательного уничтожения раковых клеток. Также она применяется для предотвращения рецидивов опухоли и при метастатическом раке.
Таргетная терапия
Один из наиболее современных методов лечения рака молочной железы. Назначается после молекулярно-генетического исследования клеток опухоли и определения их чувствительности к тому или иному препарату. Поскольку средства таргетной терапии прицельно воздействуют на раковые клетки, она имеет меньше побочных эффектов, чем химио- или лучевая терапия. Таргетная терапия показана при неэффективности химиотерапии либо в дополнение к ней.
Иммунотерапия
Использование средств, активирующих собственную иммунную систему организма для борьбы с опухолевыми клетками. Иммунотерапия показана при невозможности хирургического лечения, а также при трижды негативном РМЖ.
Методы лечения рака груди могут сочетаться. Схема терапии для каждого пациента подбирается индивидуально, в зависимости от разных факторов (тип рака, течение заболевания, наличие у пациента сопутствующих патологий, возможности клиники, в которой проходит лечение), в ее подборе участвуют несколько специалистов – онколог, онколог-хирург, радиолог, маммолог, эндокринолог и др.
Лечение РМЖ при отдаленных метастазах
На последних стадиях заболевания операция возможна только при метастазировании в регионарные подмышечные узлы – совместно с иссечением первичного очага выполняется лимфаденэктомия с последующей химио- или лучевой терапией. Хирургическое лечение при метастазах в отдаленные органы не применяется. На поздних стадиях РМЖ с отдаленными метастатическими очагами показаны химио- или гормонотерапия. При метастазах в кости, головной мозг возможно проведение лучевой терапии.
Также пациентам на поздних стадиях рака молочной железы показана паллиативная терапия – обезболивание, в том числе наркотическими анальгетиками, купирование тошноты, рвоты, нормализация водного баланса организма, лекарства, улучшающие состояние костной ткани, другие симптоматические препараты.
Прогноз заболевания
Пятилетняя выживаемость без лечения при раке молочной железы, обнаруженном на I-II стадии, составляет 10-15 %. Ухудшают прогноз общие факторы (возраст, сопутствующие заболевания), негативные типы злокачественного новообразования – к гормонам, HER-2-негативный РМЖ, трижды негативный рак.
При начатом вовремя лечении (на I-II стадиях) около 80 % пациенток преодолевают рубеж пятилетней выживаемости. На III стадии показатель значительно снижается – примерно до 40 %.
При IV стадии рака груди пятилетняя выживаемость при условии проводимой терапии составляет около 22 %. Изредка – примерно у 2 % пациентов – наступает стойкая ремиссия. Без лечения пятилетняя выживаемость на IV стадии колеблется от 0 до 10 %, десятилетняя – от 0 до 5 %.
Рак молочной железы способен рецидивировать, поэтому женщины, даже успешно завершившие лечение, должны состоять на диспансерном учете у онколога и периодически проходить обследование.
Профилактика рака груди
Профилактика этого опасного заболевания заключается в минимизации факторов риска или их исключении, ежемесячном самообследовании груди всеми женщинами, начиная с 18-20 лет, диспансерном наблюдении у гинеколога и маммолога, прохождении скрининговых обследований, начиная с определенного возраста. Выявление РМЖ на ранних стадиях дает шанс на полное излечение, существенно снижает риск осложнений, повышает выживаемость пациентов в отдаленном периоде. Поэтому важно следить за своим здоровьем и обращаться к врачу при появлении любых подозрительных признаков.
Источники:
- Бит-Сава Е.М. Наследственный рак молочной железы / Е.М. Бит-Сава, М.Б. Белогурова // Сибирский онкологический журнал. — 2013. — № 1 (55). — С. 75-81.
- Бухарова Т.Н. Профилактика рака молочной железы / Т.Н. Бухарова, О.Н. Панина // Опухоли женской репродуктивной системы. — 2007. — № 4. — С. 11-13.
- Жукова Л.Г. Рак молочной железы. Клинические рекомендации / Л.Г. Жукова [и др.] // Современная онкология. — 2021. — № 23 (1). — С. 5-40.
- Каллистов В.Е. Метастазирование в кости рака молочной железы / В.Е. Каллистов [и др.] // Клиническая геронтология. — 2011. — № 3-4. — С. 53-56.
- Керимов Р.А. Рак молочной железы — не приговор / Р.А. Керимов // Медицинская сестра. — 2015. — № 1. — С. 3-8.
- Корженкова Г.П. Скрининг рака молочной железы / Г.П. Корженкова // Вестник рентгенологии и радиологии. — 2013. — № 1. — С. 46-49.
- Крылов Н. Профилактика рака молочной железы / Н. Крылов, Е. Пятенко // Врач. — 2016. — № 11. — С. 2-5.
- Кучеренко А.д. Рак молочной железы у мужчин / А.Д. Кучеренко [и др.] // Вестник Национального медико-хирургического Центра им. Н. И. Пирогова. — 2019. — Т. 14. — № 4. — С. 128-130.
- Насруллаев М.М. Комплексная лучевая диагностика рака молочной железы / М.М. Насруллаев, М.Н. Насруллаев // Поволжский онкологический вестник. — 2018. — № 2 (34). — С. 49-53.
- Пак Д.Д. Подтипы рака молочной железы / Д.Д. Пак [и др.] // Опухоли женской репродуктивной системы. — 2012. — № 3-4. — С. 13-18.
- Портной С.М. Основные риски развития рака молочной железы и предложения по его профилактике / С.М. Портной // Опухоли женской репродуктивной системы. — 2018. — Т. 14. — № 3. — С. 25-39.
- Рудых З.А. Персонализированный подход в лечении рака молочной железы / З.А. Рудых [и др.] // Дальневосточный медицинский журнал. — 2018. — С. 99-106.
- Семиглазов В.Ф. Общие рекомендации по лечению рака молочной железы (позиция Панели экспертов St. Gallen 16-й Международной конференции по терапии рака молочной железы) / В.Ф. Семиглазов [и др.] // Опухоли женской репродуктивной системы. — 2019. — Т. 15. — № 4. — С. 50-57.
- Семиглазов В.Ф. Перспективы иммунотерапии рака молочной железы / В.Ф. Семиглазов [и др.] // Медицинский совет. — 2018. — № 19. — С. 12-16.
- Харченко В.П. Онкогенетика и рак молочной железы / В.П. Харченко [и др.] // Вестник Российского университета дружбы народов. Серия: Медицина. — 2006. — № 2 (34). — С. 172 — 175.
4.25 из 5. Голосов: 4
Спасибо за вашу оценку.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
21 ноября 2020
56682 
Показать содержание статьи
Содержание:
- Размер опухоли: T = Tumor, опухоль
- Лимфатические узлы: N = Nodes, лимфоузлы
- Метастазы: M = Metastasis
- Дифференцировка: G = Grade, оценка
- 0 стадия рака молочной железы
- 1 Стадия рака молочной железы
- 2 Стадия рака молочной железы
- 3 Стадия рака молочной железы
- 4 Стадия рака молочной железы
Скрыть содержание
Написано людьми для людей.
Теми, кто боролся, для тех, кому эта борьба предстоит.
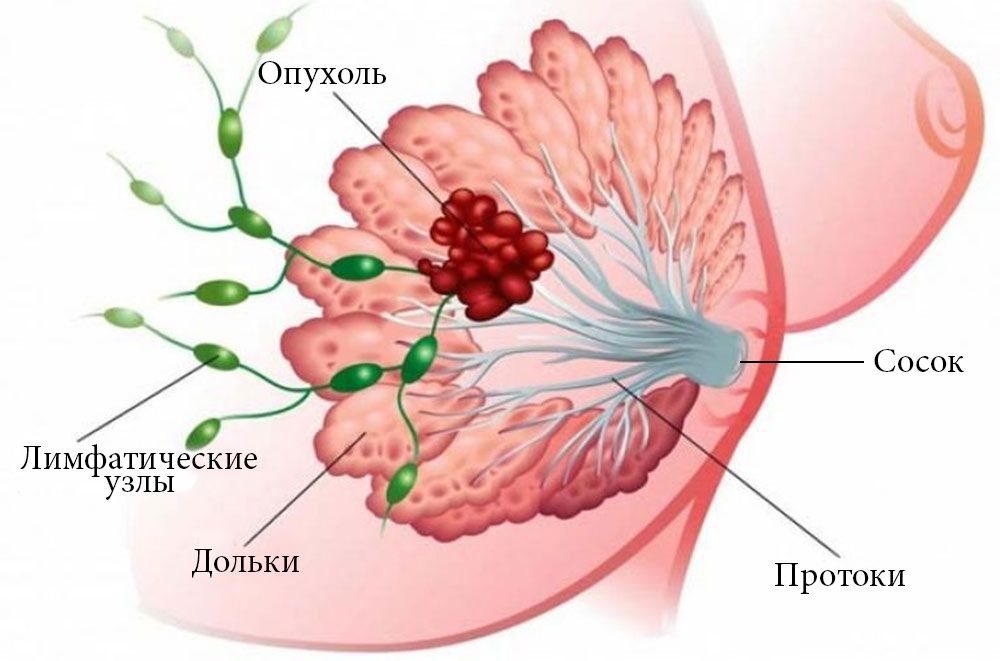
В чем отличие 0, 1, 2, 3 и 4 стадии рака молочной железы у женщин? Как растут метастазы при этом виде онкологии и какие органы они поражают? Как классифицируется рак молочной железы по ТНМ? Как он развивается? Как сильно пострадал организм? Как расшифровать медицинские диагнозы?
Ответы на все эти вопросы есть в нашей статье.
Диагноз «рак молочной железы» имеет номер МКБ С50. МКБ – это международная статистическая классификация болезней и проблем, связанных со здоровьем. В данный момент применяется ее 10 версия (МКБ 10).
Для оценки прогноза заболевания и выбора подходящего лечения применяется стадирование по системе Американского объединенного комитета по изучению рака. Именно эта классификация по ТНМ используется в клинических рекомендациях Минздрава РФ от 2020 года.
Характеристики роста опухоли закодированы тремя буквами: T, N и M. Каждая из них (размер опухоли, количество пораженных лимфоузлов, наличие или отсутствие метастазов) влияет на прогноз течения заболевания и на схему лечения.
Размер опухоли: T = Tumor, опухоль
Буквой Т в сочетании с цифрами и буквами врачи обозначают наличие или отсутствие первичной опухоли, ее размер, количество пораженных тканей и органов
Tx — данных для оценки опухоли недостаточно.
T0 — признаков первичной опухоли нет.
Tis (DLCIS) — протоковый ракраковые клетки обнаружены в протоках молочной железы.
Tis (LCIS) — дольковый ракраковые клетки обнаружены в дольках молочной железы.
Tis (Paget) — рак Педжета (соска) без признаков опухоли. При наличии опухоли оценку проводят по ее размеру.
T1mic — опухоль размером до 0,1 см.
T1a — опухоль размером от 0,1 см до 0,5 см.
T1b — опухоль размером от 0,5 до 1 см.
T1c — опухоль размером от 1 до 2 см.
T2 — опухоль от 2 до 5 см.
T3 — опухоль более 5 см.
T4 — опухоль любого размера, распространившаяся на кожу или грудную стенку:
T4a — опухоль проросла в грудную стенку (ребра, межреберные мышцы, передняя зубчатая мышца).
T4b — отек, язвы или дочерние опухоли в коже молочной железы, включая симптом «лимонной корочки»Симптом «лимонной корочки» — это утолщение и отек кожи, при этом потовые железы сильно выступают.
T4c — все перечисленные в T4a и T4b признаки.
T4d — воспалительный или отечный рак: утолщение кожи с плотными краями.
Буква Т без буквенных и цифровых уточнений не содержит никакой информации.
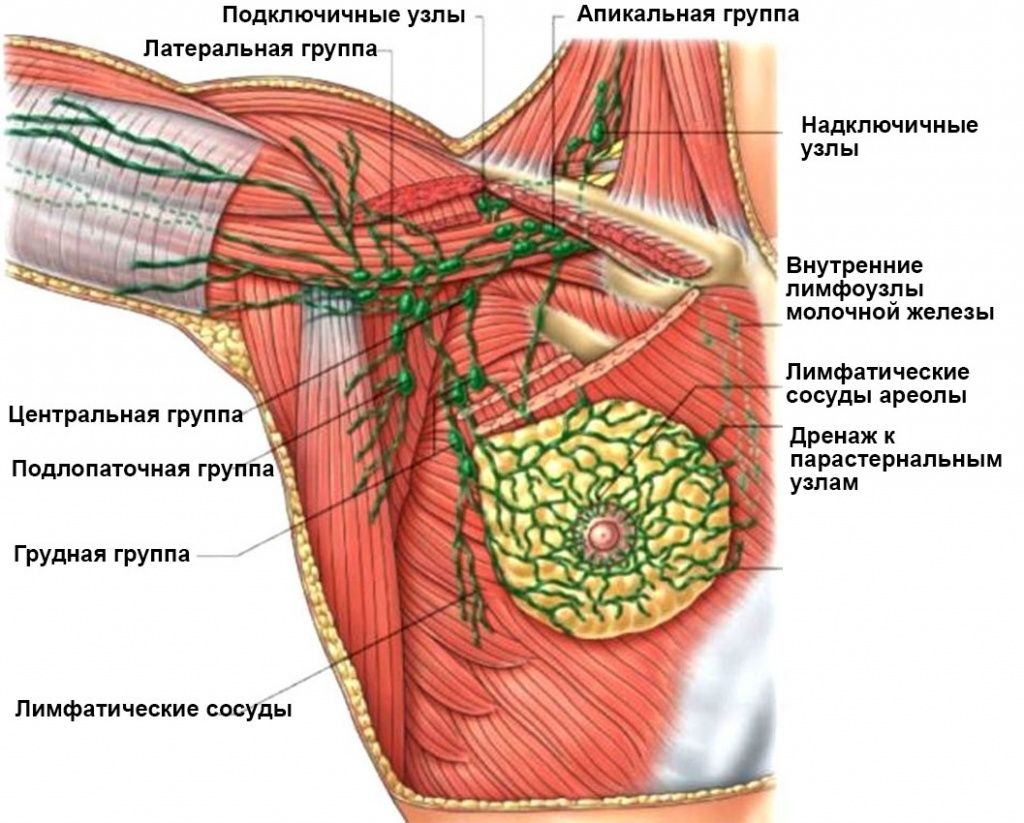
Лимфатические узлы: N = Nodes, лимфоузлы
Лимфатические узлы (лимфоузлы) работают как фильтры, помогая бороться с инфекцией и удаляя вредные вещества из организма. В теле человека их сотни.
Очень важно знать, поразил ли рак лимфоузлы — это значительно влияет на схему и тактику лечения.
Для описания количества и типа пораженных лимфоузлов врачи используют буквенное обозначение «N» в сочетании с цифрами и буквами
NX означает, что состояние лимфатических узлов оценить невозможно.
N0 — лимфатические узлы не поражены.
N1 — метастазы есть в смещаемых подмышечных лимфатических узлах на стороне поражения.
— N1mic — микрометастазы размером больше 0,2, но меньше 2 мм есть в смещаемых подмышечных лимфатических узлах на стороне поражения.
N2 — метастазы в подмышечных лимфатических узлах со стороны поражения, спаянные между собой или фиксированные. Либо метастазы в внутригрудных лимфатических узлах, при этом подмышечные лимфатические узлы не поражены:
— N2a — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные.
— N2b — метастазы во внутригрудных лимфатических узлах, при этом подмышечные лимфоузлы не поражены.
N3 — метастазы в подключичных лимфоузлах со стороны поражения, либо во внутригрудных + подмышечных лимфоузлах, либо метастазы в надключичные лимфоузлы с пораженной стороны (независимо от состояния подмышечных и внутригрудных лимфоузлов).
— N3a — метастазы в подключичных лимфатических узлах на стороне поражения.
— N3b — метастазы во внутригрудных + подмышечных лимфатических узлах.
— N3c — метастазы в надключичных лимфатических узлах со стороны поражения.
Буква «N» без буквенных и цифровых обозначений информации не содержит.
Метастазы: M = Metastasis
Каждая здоровая клетка организма имеет свое определенное место в ткани или органе. Раковые клетки могут перемещаться по организму, создавая опухоль в разных частях тела.
Опухоль, созданная в результате деления этих клеток, называется метастазом.
Для описания наличия или отсутствия метастаз используется обозначение «M» в сочетании с цифрами или буквами
MX означает, что оценить насколько далеко распространился рак невозможно.
М0 — отдаленных метастазов нет.
M1 — отдаленные метастазы есть. «М1» означает, что у вас 4 стадия рака молочной железы.
— Mpul метастазы в легкое,
— Moss метастазы в кости,
— Mhep метастазы в печень,
— Mple метастазы плевру,
— Mper метастазы в брюшину,
— Mmar метастазы в костный мозг,
— Mbra метастазы в головной мозг,
— Mski метастазы в коже,
— Madr метастазы в надпочечниках,
— Mlym метастазы в лимфатические узлы,
— Moth метастазы в другие органы.
Без уточняющих букв и цифр «M» информации о течении заболевания не содержит.
рN: Пораженные регионарные лимфатические узлы (рN)
Для определения рN нужно выполнить удаление подмышечных лимфоузлов. Возможно потребуется биопсия (забор клеток) сентинальных (сторожевых) лимфоузлов.
Сторожевыми называют первые на пути оттока лимфы из первичного очага раковой опухоли лимфоузлы.
Регионарными — лимфоузлы определенного участка (подмышечные, паховые, грудные
и т. д.
)
рNx — означает, что данных о пораженных регионарных лимфоузлах нет (не найдено лимфатических узлов, или они еще не удалены).
рN0 — признаков поражения метастазами регионарных лимфоузлов не обнаружено при исследовании. Дополнительные методы определения раковых клеток не использовались.
рN0 (I-) — признаков поражения метастазами регионарных лимфатических узлов по данным гистологического и ИГХ (иммуногистохимического) исследований нет.
рN0(I+) — раковые клетки размером 0,2 мм и меньше найдены в регионарных лимфатических узлах (по данным гистологического и ИГХ исследований).
рN1:
— рN1mic — микрометастазы больше 0,2, но меньше 2 мм.
— рN1a — метастазы найдены в от одного до трех подмышечных лимфатических узлах, один из которых больше 2 мм.
— рN1b — метастазы в лимфоузлах молочной железы в сочетании с микро- или макрометастазами, выявленными при биопсии.
— рN1c — метастазы в от одного до трех подмышечных лимфатических узлах во внутренних лимфатических узлах молочной железы в сочетании с микро- или макрометастазами, выявленными при биопсии.
рN2:
— рN2a — метастазы в от четырех до девяти подмышечных лимфатических узлах размерами 2 мм и больше.
— рN2b — поражены внутренние лимфоузлы молочной железы. Метастазов в подмышечных лимфатических узлах нет.
рN3:
— рN3a — метастазы размером 2 или более мм в десяти или более подмышечных лимфатических узлах. Либо метастазы в подключичных лимфатических узлах.
— рN4b — метастазы во внутренних лимфатических узлах молочной железы + метастазы в одном или более подмышечных лимфатических узлах. Либо метастазы трех или более подмышечных лимфатических узлах + микро- или макрометастазы сторожевых лимфатических узлов.
— рN3c — метастазы в надключичных лимфатических узлах.
Дифференцировка: G = Grade, оценка
Дифференцировка опухоли нужна для того, чтобы врач смог предположить, как быстро она будет развиваться и насколько хорошо поддастся лечению. Опухоль, клетки которой очень похожи на здоровые, медленно растут и хорошо поддаются лечению. Такое новообразование называется высокодифференцированным раком груди. Клетки, которые совсем не похожи на здоровые, растут быстро, а лечатся — плохо. Такие опухоли называют недифференцированным раком груди.
Для определения дифференцировки лечащий врач передает часть ткани опухоли на лабораторное исследование.
Патоморфологическое исследование устанавливает, насколько сильно раковые клетки отличаются от нормальных. Чем сильнее отличие, тем, предположительно, быстрее будет распространяться рак.
GX — нельзя определить степень различия (возможно
из-за
недостаточного количества материала).
G1 — раковые клетки выглядят похожими на здоровые клетки. Такие опухоли, как правило, растут медленно. Это высокодифференцированный рак молочной железы.
G2 — раковые клетки немного отличаются от здоровых. Это умеренно-дифференцированная опухоль.
G3 — раковые клетки сильно отличаются от здоровых. Такая опухоль называется низкодифференцированной.
G4 — раковые клетки совершенно не похожи на здоровые. Это недифференцированная опухоль. Вероятнее всего, она будет развиваться очень быстро
Вместо указания буквы «G» в диагнозе врач может описать степень дифференцировки (отличия от нормальных) клеток опухоли словами.
Рак молочной железы стадируется на основе информации о T, N и M.
В стадиях I–IV дополнительно используются уточняющие буквенные обозначения.
Важно понимать, что одинаковое обозначение стадии не означает одинаковую ситуацию.
Например, стадия IIA может кодироваться как T0N1M0, T1N1M0 и T2N0M0. То есть при разных размерах опухоли, разном количестве пораженных лимфоузлов может быть указана одна стадия.
0 стадия рака молочной железы
Три формы 0 стадии рака молочной железы кодируются как: Tis(DCIS)N0M0, Tis(LCIS)N0M0, Tis(Paget)N0M0
Tis(DCIS)N0M0, протоковый рак молочной железы. На данной стадии раковые клетки найдены только в протоках молочной железы, лимфатические узлы не поражены, и метастазов в отдаленные органы нет.
Tis(LCIS)N0M0, дольковый рак. При этой форме онкологии раковые клетки найдены только в дольках молочной железы. Лимфоузлы здоровы, клетки из долек не успели распространиться по организму и создать дополнительные опухоли в других органах — метастазы.
Tis(Paget)N0M0, рак соска. На этой стадии раковые клетки найдены только в соске. Лимфатические узлы здоровы, и метастазов в отдаленные органы нет.
Классификация по ТНМ. Эта стадия рака груди может иметь много вариантов течения заболевания: размеры опухоли от минимальных до 2 см. Лимфоузлы на этой стадии не поражены, метастазов в другие органы нет. У 1 стадии рака молочной железы есть две подстадии: 1a и 1b. Размеры поражения организма у них отличаются. Ниже указаны врачебные диагнозы и их расшифровки:
1А Стадия рака молочной железы: кодируется как T1micN0M0, T1aN0M0, T1bN0M0, T1cN0M0
T1micN0M0:
- опухоль размером не более 0,1 см,
- лимфоузлы не поражены раковыми клетками,
- метастазов в отдаленные органы нет.
T1aN0M0:
- опухоль размером от 0,1 см до 0,5 см,
- лимфоузлы раковыми клетками не поражены,
- метастазов в отдаленные органы нет.
T1bN0M0:
- опухоль размером от 0,5 см до 1 см,
- лимфоузлы раковыми клетками не поражены,
- метастазов в отдаленные органы нет.
T1cN0M0:
- опухоль размером от 1 см до 2 см,
- лимфоузлы раковыми клетками не поражены,
- метастазов в отдаленные органы нет.
1В Стадия рака молочной железы: кодируется как T0N1micM0, T1micN1micM0, T1aN1micM0, T1bNmicMo, T1cNmicM0
T0N1micM0:
- признаков первичной опухоли нет,
- метастазы в лимфоузлы размером от 0,2 мм до 2 мм,
- метастазов в отдаленных органах нет.
T1micN1micM0:
- опухоль размером не более 0,1 см,
- микрометастазы в лимфоузлы размером от 0,2 мм до 2 мм,
- метастазов в отдаленных органах нет.
T1aN1micM0:
- опухоль размером от 0,1 см до 0,5 см,
- микрометастазы в лимфоузлах размером от 0,2 мм до 2 мм,
- метастазов в отдаленные органы нет.
T1bNmicMo:
- опухоль размером от 0,5 см до 1 см,
- микрометастазы в лимфатических узлах размером от 0,2 мм до 2 мм,
- метастазов в отдаленные органы нет.
T1cNmicM0:
- опухоль от 1 см до 2 см,
- микрометастазы в лимфатических узлах размером от 0,2 мм до 2 мм,
- метастазов в отдаленные органы нет.
2 Стадия рака молочной железы
К данной стадии рака груди причисляют восемь вариантов течения заболевания: размеры опухоли от минимальной до превышающей 5 см, возможно наличие пораженных подмышечных лимфоузлов. В то же время метастазов в отдаленные органы нет. В медицинской документации не указывается просто «2 стадия» — на этом этапе заболевания есть две подстадии — 2а и 2b. Размеры поражения организма у них отличаются. Ниже приведены описание и расшифровка подстадий и врачебных кодировок:
2А Стадия рака груди: кодируется как T0N1M0, T1micN1M0, T1aN1M0, T1bN1M0, T1cN1M0, T2N0M0
T0N1M0:
- признаков первичной опухоли нет,
- метастазы в смещаемых лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1micN1M0:
- опухоль размером не более 0,1 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1aN1M0:
- опухоль размером от 0,1 см до 0,5 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1bN1M0:
- размер опухоли от 0,5 см до 1 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1cN1M0:
- размер опухоли от 1 см до 2 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T2N0M0:
- опухоль размером от 2 см до 5 см,
- лимфоузлы раковыми клетками не поражены, метастазов в отдаленные органы нет.
2В Стадия рака груди: кодируется как T2N1M0, T3N0M0
T2N1M0:
- опухоль размером от 2 до 5 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T3N0M0:
- опухоль размером более 5 см,
- лимфоузлы метастазами не поражены,
- метастазов в отдаленные органы нет.
3 Стадия рака молочной железы
Классификация по ТНМ. К данной стадии рака груди причисляют более десяти вариантов течения заболевания: основная опухоль от минимальной до разрастания ее в кожу, поражены различные лимфоузлы. При этом метастазов в отдаленные ткани нет, то есть раковые клетки из молочной железы не успели распространиться в другие органы и создать там новые опухоли. У 3 стадии рака молочной железы есть три подстадии: 3а, 3b и 3с. Степень поражения организма на каждой из них отличается. Ниже приведены описание и расшифровка и врачебных кодировок:
3А Стадия рака молочной железы: кодируется как T0N2M0, T1micN2M0, T1aN2M0, T1bN2M0, T1cN2M0, T2N2M0, T3N1M0, T3N2M0
T0N2M0:
- признаков первичной опухоли нет,
- спаянные между собой или фиксированные метастазы в подмышечные лимфатические узлы на стороне поражения. Либо метастазы во внутригрудные лимфатические узлы при не пораженных подмышечных лимфоузлах,
- метастазов в отдаленные органы нет.
T1micN1M0 значит, что:
- опухоль размером не более 0,1 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1aN1M0:
- опухоль размером от 0,1 до 0,5 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1bN1M0 означает:
- опухоль размером от 0,5 до 1 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T1cN1M0:
- размер опухоли от 1 до 2 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные органы нет.
T2N2M0:
- опухоль размером от 2 до 5 см,
- спаянные между собой или фиксированные метастазы в подмышечных лимфатических узлах на стороне поражения. Либо метастазы во внутригрудные лимфатические узлы при не пораженных подмышечных лимфоузлах,
- метастазов в отдаленные органы нет.
T3N1M0:
- опухоль размером более 5 см,
- метастазы в смещаемых подмышечных лимфатических узлах на стороне поражения,
- отдаленных метастазов нет.
T3N2M0:
- опухоль размером более 5 см,
- спаянные между собой или фиксированные метастазы в подмышечных лимфатических узлах на стороне поражения. Либо метастазы во внутригрудные лимфатические узлы при не пораженных подмышечных лимфоузлах,
- отдаленных метастазов нет.
3В Стадия рака груди: кодируется как T4N0M0, T4N1M0, T4N2M0
T4N0M0 означает:
- опухоль любого размера, распространившаяся на кожу или грудную стенкуребра, межреберные мышцы, переднюю зубчатую мышцу. Грудные мышцы не поражены;
- регионарные лимфатические узлы не поражены;
- метастазов в отдаленные органы нет.
T4N1M0:
- опухоль любого размера, распространившаяся на кожу или грудную стенкуребра, межреберные мышцы, переднюю зубчатую мышцу. Грудные мышцы не поражены,
- метастазы найдены в смещаемых подмышечных лимфатических узлах на стороне поражения,
- метастазов в отдаленные ткани нет.
T4N2M0 значит, что:
- опухоль любого размера, распространившаяся на кожу или грудную стенку (ребра, межреберные мышцы, переднюю зубчатую мышцу. При этом грудные мышцы не поражены),
- спаянные между собой или фиксированные метастазы в подмышечных лимфатических узлах на стороне поражения. Либо метастазы во внутригрудные лимфатические узлы без поражения подмышечных,
- метастазов в отдаленные ткани нет.
3С Стадия рака молочной железы: кодируется как TлюбаяN3M0 (T1micN3aM0, T1aN3aM0, T1bN3aM0, T1cN3aM0, T2N3aM0, T3N3aM0, T4aN3aM0, T4bN3aM0, T4cN3aM0, T4dN3aM0, T1micN3bM0, T1aN3bM0, T1bN3bM0, T1cN3bM0, T2N3bM0, T3N3bM0, T4aN3bM0, T4bN3bM0, T4cN3bM0, T4dN3bM0, T1micN3cM0, T1aN3cM0, T1bN3cM0, T1cN3cM0, T2N3cM0, T3N3cM0, T4aN3cM0, T4bN3cM0, T4cN3cM0, T4dN3cM0)
Это означает:
- основная опухоль любого размера,
- метастазы в подключичных лимфатических узлах на стороне поражения. Либо во внутригрудных + подмышечных лимфоузлах. Либо в надключичных лимфатических узлах на стороне поражения,
- метастаз в отдаленные ткани нет.
4 Стадия рака молочной железы
Классификация по ТНМ. Это единственная стадия, при которой в диагнозе будет указано «М1», а не «М0».
На 4 стадии рака молочной железы лечение не всегда возможно.
М1 означает, что у вас появились метастазы – новые раковые поражения в других органах, расположенных далеко от груди. Они образуются из клеток основной опухоли, которые переносятся с кровью или лимфой, попадают в здоровые ткани, прикрепляются там и размножаются.
Когда рак нельзя вылечить полностью, врачи предлагают паллиативную терапию. Это не лечение как таковое, ведь оно не может продлить жизнь. Да в его задачи это и не входит. Главной целью паллиатива является снижение страданий и улучшение качества жизни человека, организм которого сильно пострадал от болезни. Химиотерапия, лучевая терапия, обезболивание и прием снимающих симптомы препаратов является частью паллиативного лечения. Химия и лучи могут тяжело восприниматься организмом и давать серьезные побочные эффекты, без шансов вылечить.
Несмотря на то, что каждый человек и его организм уникальны, для разных стадий рака существует свой примерный прогноз. Ваш врач его знает. Вы можете узнать свои прогнозы и решить, хотите ли принимать тот или иной вид лечения.
Кодируется как ТлюбаяNлюбаяM1 (T1micN0M1, T1aN0M1, T1bN0M1, T1cN0M1, T2N0M1, T3N0M1, T4aN0M1, T4bN0M1, T4cN0M1, T4dN0M1, T1micN1M1, T1aN1M1, T1bN1M1, T1cN1M1, T2N1M1, T3N1M1, T4aN1M1, T4bN1M1, T4cN1M1, T4dN1M1,
T1micN2aM1, T1aN2aM1, T1bN2aM1, T1cN2aM1, T2N2aM1, T3N2aM1, T4aN2aM1, T4bN2aM1, T4cN2aM1, T4dN2aM1, T1micN2bM1, T1aN2bM1, T1bN2bM1, T1cN2bM1, T2N2bM1, T3N2bM1, T4aN2bM1, T4bN2bM1, T4cN2bM1, T4dN2bM1, T1micN3aM1, T1aN3aM1, T1bN3aM1, T1cN3aM1, T2N3aM1, T3N3aM1, T4aN3aM1, T4bN3aM1, T4cN3aM1, T4dN3aM1, T1micN3bM1, T1aN3bM1, T1bN3bM1, T1cN3bM1, T2N3bM1, T3N3bM1, T4aN3bM1, T4bN3bM1, T4cN3bM1, T4dN3bM1, T1micN3cM1, T1aN3cM1, T1bN3cM1, T1cN3cM1, T2N3сM1, T3N3сM1, T4aN3сM1, T4bN3сM1, T4cN3сM1, T4dN3сM1).
Такой набор кодировок означает, что:
- После буквы «Т» может стоять любая цифра от T1mic до T4d, то есть опухоль может быть любого размера — от минимальной до повреждений расположенных рядом органов;
- После буквы «N» может быть указана любая цифра от N1 до N3c. Это значит, что региональные лимфатические узлы могут быть как здоровыми, так и очень пострадать от рака;
- Раковые клетки из молочной железы распространились в другие органы и создали там дополнительные опухоли — метастазы. Метастазы при раке груди обычно бывают в легких, костях, печени, плевре, брюшине, костном мозге, головном мозге, коже, надпочечниках, лимфатических узлах.
|
Стадии рака молочной железы |
|||
|
Стадия 0 |
Tis |
N0 |
M0 |
|
Стадия IA |
T1mic, T1a, T1b, T1c |
N0 |
M0 |
|
Стадия IB |
T0, T1mic, T1a, T1b, T1c |
N1mic |
M0 |
|
Стадия IIA |
T0 |
N1 |
M0 |
|
T1mic, T1a, T1b, T1c |
N1 |
M0 |
|
|
T2 |
N0 |
M0 |
|
|
Стадия IIB |
T2 |
N1 |
M0 |
|
T3 |
N0 |
M0 |
|
|
Стадия IIIA |
T0 |
N2 |
M0 |
|
T1mic, T1a, T1b, T1c |
N2 |
M0 |
|
|
T2 |
N2 |
M0 |
|
|
T3 |
N1, N2 |
M0 |
|
|
Стадия IIIB |
T4 |
N0, N1, N2 |
M0 |
|
Стадия IIIC |
T любая |
N3 |
M0 |
|
Стадия IV |
T любая |
N любая |
M1 |

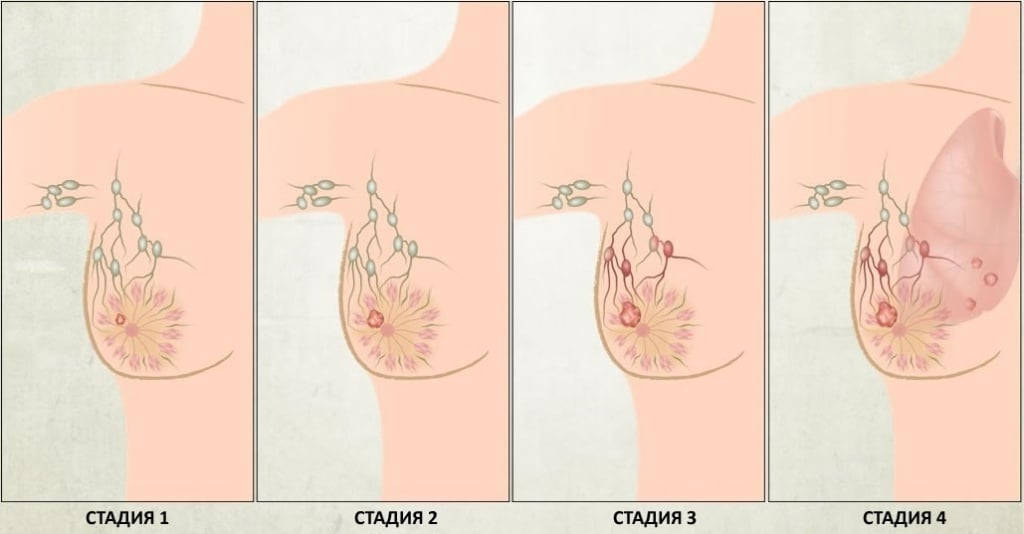















 [36, 54, 55].
[36, 54, 55].