Экзотермическая реакция
- Экзотермическая реакция
-
Экзотермическая реакция
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Полное количество энергии в химической системе чрезвычайно трудно измерить или подсчитать. С другой стороны, изменение энтальпии ΔH в химической реакции гораздо легче измерить или сосчитать. Для этих целей используют калориметры. Измеренное значение ΔH соотносится с энергией связи молекул следующим образом:
ΔH = энергия, потраченная на разрыв связей — энергия, выделенная при образовании связей продуктов реакции.
Для экзотермических реакций эта формула даёт отрицательное значение для ΔH, так как большее значение вычитается из меньшего значения. При сгорании водорода, например:
2H2 + O2 → 2 H2O
изменение энтальпии равно ΔH = −483.6 кДж на один моль O2.
Примеры
- Горение топлива в кислороде воздуха.
- Горение пороха.
- Добавление концентрированной серной кислоты в воду.
- Окисление жиров и углеводов в живых организмах.
См. также
- Экзотермическое превращение // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб.: 1890—1907.
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое «Экзотермическая реакция» в других словарях:
-
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ, ХИМИЧЕСКАЯ РЕАКЦИЯ, при которой вырабатывается тепло и поднимается температура. Наглядным примером такой реакции является ГОРЕНИЕ. см. также ЭНДОТЕРМИЧЕСКАЯ РЕАКЦИЯ … Научно-технический энциклопедический словарь
-
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — химическая реакция, сопровождающаяся выделением теплоты (напр., горение). См. также Эндотермическая реакция … Российская энциклопедия по охране труда
-
ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ — (от экзо… и греч. therme тепло) химическая реакция (напр., горение), при которой из реагирующей системы в окружающую среду выделяется тепло … Большой Энциклопедический словарь
-
экзотермическая реакция — Химическая реакция, сопровождающаяся выделением теплоты. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики термодинамика Обобщающие термины определения… … Справочник технического переводчика
-
экзотермическая реакция — (от экзо… и греч. thérmē тепло), химическая реакция (например, горение), при которой в реагирующей системе выделяется теплота. * * * ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ, химическая реакция (например, горение), при которой из… … Энциклопедический словарь
-
Экзотермическая реакция — Exothermic reaction Экзотермическая реакция. Реакция, с выделением тепла, типа горения топлива или в результате химического взаимодействия полимеров на основе смол. (Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО… … Словарь металлургических терминов
-
экзотермическая реакция — egzoterminė reakcija statusas T sritis chemija apibrėžtis Reakcija, kurios metu išsiskiria šiluma. atitikmenys: angl. exothermic reaction rus. экзотермическая реакция … Chemijos terminų aiškinamasis žodynas
-
экзотермическая реакция — egzoterminė reakcija statusas T sritis fizika atitikmenys: angl. exothermal reaction; exothermic reaction vok. exotherme Reaktion, f; wärmeabgebende Reaktion, f; wärmegebende Reaktion, f rus. экзотермическая реакция, f pranc. réaction… … Fizikos terminų žodynas
-
экзотермическая реакция — egzoterminė reakcija statusas T sritis Energetika apibrėžtis Cheminė reakcija, kuriai vykstant į aplinką išsiskiria šiluma. Tai kuro deginimas, cheminių junginių susidarymo reakcijos. atitikmenys: angl. exothermic reaction vok. exotherme Reaktion … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
-
Экзотермическая реакция — (от Экзо… и греч. thérmó тепло, жар) химическая реакция, сопровождающаяся выделением теплоты. Э. р. являются, например, Горение, Нейтрализация, большинство реакций образования химических соединений из простых веществ (См. Простое… … Большая советская энциклопедия
Экзо-
и эндотермические реакции.
—
Экзотермическая реакция (от
экзо… вне и греч. thérmó
— тепло, жар) , химическая реакция,
сопровождающаяся выделением теплоты.
Экзотермическая реакция являются,
например, горение, нейтрализация,
большинство реакций образования
химических соединений из простых
веществ. Количество выделяющейся при
экзотермическая реакция теплоты зависит
от массы реагентов и их природы,
агрегатного состояния исходных веществ
и продуктов взаимодействия, типа реакции
и условий её осуществления (температуры,
давления и др.) .
По тепловому эффекту экзотермическая
реакция противоположны эндотермическим
реакциям.
—
Эндотермическая реакция (от
эндо… внутри и греч. thérme
— тепло, жар) , химическая реакция,
сопровождающаяся поглощением теплоты.
К эндотермическим реакциям относятся
диссоциация (в частности, разложение
молекул на свободные атомы) , восстановление
металлов из руд, фотосинтез в растениях,
образование некоторых соединений из
простых веществ.
Реакции
и их тепловой эффект
Все
реакции можно разделить на те, в ходе
которых тепло поглощается, или, наоборот,
тепло выделяется. Представьте пробирку,
охлаждающуюся или нагревающуюся в вашей
руке — это и есть тот самый тепловой
эффект. Иногда тепла выделяется так
много, что реакции сопровождаются
воспламенением или взрывом (натрий с
водой).
-
Экзотермические
реакции
Экзотермические
реакции
(греч. exo
— вне) — химические реакции, сопровождающиеся
потерей энергии системой и выделением
тепла (той самой энергии) во внешнюю
среду. При написании химических реакций
в конце экзотермических ставят «+ Q»
(Q
— тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg
+ O2 =
2MgO
+ Q
NaOH
+ HCl
= NaCl
+ H2O
+ 56 кДж
К
экзотермическим реакциям часто относятся
реакции горения, соединения. Исключением
является взаимодействие азота и
кислорода, при котором тепло поглощается:
N2 +
O2 ⇄
2NO
— Q
Как
уже было отмечено выше, если тепло
выделяется во внешнюю среду, значит,
система реагирующих веществ потеряло
это тепло. Поэтому не должно казаться
противоречием, что внутренняя энергия
веществ в результате экзотермической
реакции уменьшается.
Энтальпией
называют
(обозначение Н), количество термодинамической
(тепловой) энергии, содержащееся в
веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q
при экзотермической реакции могут
написать
ΔH
<0.
Например:
2Na
+ 2H2O
= 2NaOH
+ H2;
ΔH
< 0 (это значит, что тепло выделяется —
реакция экзотермическая)
-
Эндотермические
реакции
Эндотермические
реакции
(греч. ἔνδον
— внутри) — химические реакции,
сопровождающиеся поглощением тепла, в
результате которых образуются вещества
с более высоким энергетическим уровнем
(их внутренняя энергия увеличивается).
К
таким реакциям наиболее часто относятся
реакции разложения. При написании
эндотермических реакций в конце ставят
«-Q»,
либо указывают точное количество
поглощенной энергии. Примеры таких
реакций:
2HgO
= Hg
+ O2 —
Q
4NH3 +
5O2 =
4NO
+ 6H2O
— Q
CaCO3 =
CaO
+ CO2↑
— Q
С
целью «запутывания» может быть
дана энтальпия, она при таких реакциях
всегда: ΔH
> 0, так как внутренняя энергия веществ
увеличивается.
Например:
CaCO3 =
CaO
+ CO2↑
; ΔH
> 0 (значит реакция эндотермическая,
так как внутренняя энергия увеличивается)
-Как
понять, что химическое уравнение
экзотермическое или эндотермическое?
—
Берете
справочник, находите
стандартные энтальпии образования
продуктов, складываете с учетом
стехиометрических коэффициентов. Там
же находите энтальпии продуктов, их
тоже складываете с учетом стехиометрических
коэффициентов.
Находите разницу.
Если
разница положительная,
значит, теплота
выделяется.
Реакция экзотермическая.
Если
отрицательная — то эндотермическая.
Пример.
C
+ O2
= CO2
Стандартная
энтальпия образования углекислого газа
−393,51 кДж/моль (минус, не тире). Энтальпия
образования графита и кислорода — 0.
0-393,51
< 0 , реакция экзотермическая
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Explosions are some of the most violent exothermic reactions.
In thermodynamics, an exothermic process (from Greek έξω (exō) ‘outwards’, and θερμικός (thermikόs) ‘thermal’[1]) is a thermodynamic process or reaction that releases energy from the system to its surroundings, usually in the form of heat, but also in a form of light (e.g. a spark, flame, or flash), electricity (e.g. a battery), or sound (e.g. explosion heard when burning hydrogen). The term exothermic was first coined by 19th-century French chemist Marcellin Berthelot.
The opposite of an exothermic process is an endothermic process, one that absorbs energy usually in the form of heat. The concept is frequently applied in the physical sciences to chemical reactions where chemical bond energy is converted to thermal energy (heat).
Two types of chemical reactions[edit]
Exothermic and endothermic describe two types of chemical reactions or systems found in nature, as follows:
Exothermic[edit]
After an exothermic reaction, more energy has been released to the surroundings than was absorbed to initiate and maintain the reaction. An example would be the burning of a candle, wherein the sum of calories produced by combustion (found by looking at radiant heating of the surroundings and visible light produced, including the increase in temperature of the fuel (wax) itself, which is converted to hot CO2 and water vapor) exceeds the number of calories absorbed initially in lighting the flame and in the flame maintaining itself (some energy is reabsorbed and used in melting, then vaporizing the wax, etc. but is far outstripped by the energy released when in CO2 and H2O are produced).
Endothermic[edit]
In an endothermic reaction or system, energy is taken from the surroundings in the course of the reaction, usually driven by a favorable entropy increase in the system. An example of an endothermic reaction is a first aid cold pack, in which the reaction of two chemicals, or dissolving of one in another, requires calories from the surroundings, and the reaction cools the pouch and surroundings by absorbing heat from them.
Photosynthesis, the process that allows plants to convert carbon dioxide and water to sugar and oxygen, is an endothermic process: plants absorb radiant energy from the sun and use it in an endothermic, otherwise non-spontaneous process. The chemical energy stored can be freed by the inverse (spontaneous) process: combustion of sugar, which gives carbon dioxide, water and heat (radiant energy).
Energy release[edit]
Exothermic refers to a transformation in which a closed system releases energy (heat) to the surroundings, expressed by
When the transformation occurs at constant pressure and without exchange of electrical energy, heat Q is equal to the enthalpy change, i.e.
[2]
while at constant volume, according to the first law of thermodynamics it equals internal energy (U) change, i.e.
In an adiabatic system (i.e. a system that does not exchange heat with the surroundings), an otherwise exothermic process results in an increase in temperature of the system.[3][page needed]
In exothermic chemical reactions, the heat that is released by the reaction takes the form of electromagnetic energy or kinetic energy of molecules. The transition of electrons from one quantum energy level to another causes light to be released. This light is equivalent in energy to some of the stabilization energy of the energy for the chemical reaction, i.e. the bond energy. This light that is released can be absorbed by other molecules in solution to give rise to molecular translations and rotations, which gives rise to the classical understanding of heat. In an exothermic reaction, the activation energy (energy needed to start the reaction) is less than the energy that is subsequently released, so there is a net release of energy.
Examples[edit]
An exothermic thermite reaction using iron(III) oxide. The sparks flying outwards are globules of molten iron trailing smoke in their wake.
Some examples of exothermic processes are:[4]
- Combustion of fuels such as wood, coal and oil/petroleum
- The thermite reaction[5]
- The reaction of alkali metals and other highly electropositive metals with water
- Condensation of rain from water vapor
- Mixing water and strong acids or strong bases
- The reaction of acids and bases
- Dehydration of carbohydrates by sulfuric acid
- The setting of cement and concrete
- Some polymerization reactions such as the setting of epoxy resin
- The reaction of most metals with halogens or oxygen
- Nuclear fusion in hydrogen bombs and in stellar cores (to iron)
- Nuclear fission of heavy elements
- The reaction between zinc and hydrochloric acid
- Respiration (breaking down of glucose to release energy in cells)
Implications for chemical reactions[edit]
Chemical exothermic reactions are generally more spontaneous than their counterparts, endothermic reactions.
In a thermochemical reaction that is exothermic, the heat may be listed among the products of the reaction.
See also[edit]
- Calorimetry
- Chemical thermodynamics
- Differential scanning calorimetry
- Endergonic
- Endergonic reaction
- Exergonic
- Exergonic reaction
- Endothermic reaction
References[edit]
- ^ «Gate for the Greek language» on-line dictionary Archived 2017-12-05 at the Wayback Machine. greek-language.gr
- ^ Oxtoby, D. W; Gillis, H.P., Butler, L. J. (2015).Principles of Modern Chemistry, Brooks Cole. p. 617. ISBN 978-1305079113
- ^ Perrot, Pierre (1998). A to Z of Thermodynamics. Oxford University Press. ISBN 0-19-856552-6.
- ^ Exothermic – Endothermic examples Archived 2006-09-01 at the Wayback Machine. frostburg.edu
- ^ «T510: Exothermic Reaction – Thermite». 23 December 2015.
External links[edit]
Look up exothermic in Wiktionary, the free dictionary.
- http://chemistry.about.com/b/a/184556.htm Observe exothermic reactions in a simple experiment
From Wikipedia, the free encyclopedia
Explosions are some of the most violent exothermic reactions.
In thermodynamics, an exothermic process (from Greek έξω (exō) ‘outwards’, and θερμικός (thermikόs) ‘thermal’[1]) is a thermodynamic process or reaction that releases energy from the system to its surroundings, usually in the form of heat, but also in a form of light (e.g. a spark, flame, or flash), electricity (e.g. a battery), or sound (e.g. explosion heard when burning hydrogen). The term exothermic was first coined by 19th-century French chemist Marcellin Berthelot.
The opposite of an exothermic process is an endothermic process, one that absorbs energy usually in the form of heat. The concept is frequently applied in the physical sciences to chemical reactions where chemical bond energy is converted to thermal energy (heat).
Two types of chemical reactions[edit]
Exothermic and endothermic describe two types of chemical reactions or systems found in nature, as follows:
Exothermic[edit]
After an exothermic reaction, more energy has been released to the surroundings than was absorbed to initiate and maintain the reaction. An example would be the burning of a candle, wherein the sum of calories produced by combustion (found by looking at radiant heating of the surroundings and visible light produced, including the increase in temperature of the fuel (wax) itself, which is converted to hot CO2 and water vapor) exceeds the number of calories absorbed initially in lighting the flame and in the flame maintaining itself (some energy is reabsorbed and used in melting, then vaporizing the wax, etc. but is far outstripped by the energy released when in CO2 and H2O are produced).
Endothermic[edit]
In an endothermic reaction or system, energy is taken from the surroundings in the course of the reaction, usually driven by a favorable entropy increase in the system. An example of an endothermic reaction is a first aid cold pack, in which the reaction of two chemicals, or dissolving of one in another, requires calories from the surroundings, and the reaction cools the pouch and surroundings by absorbing heat from them.
Photosynthesis, the process that allows plants to convert carbon dioxide and water to sugar and oxygen, is an endothermic process: plants absorb radiant energy from the sun and use it in an endothermic, otherwise non-spontaneous process. The chemical energy stored can be freed by the inverse (spontaneous) process: combustion of sugar, which gives carbon dioxide, water and heat (radiant energy).
Energy release[edit]
Exothermic refers to a transformation in which a closed system releases energy (heat) to the surroundings, expressed by
When the transformation occurs at constant pressure and without exchange of electrical energy, heat Q is equal to the enthalpy change, i.e.
[2]
while at constant volume, according to the first law of thermodynamics it equals internal energy (U) change, i.e.
In an adiabatic system (i.e. a system that does not exchange heat with the surroundings), an otherwise exothermic process results in an increase in temperature of the system.[3][page needed]
In exothermic chemical reactions, the heat that is released by the reaction takes the form of electromagnetic energy or kinetic energy of molecules. The transition of electrons from one quantum energy level to another causes light to be released. This light is equivalent in energy to some of the stabilization energy of the energy for the chemical reaction, i.e. the bond energy. This light that is released can be absorbed by other molecules in solution to give rise to molecular translations and rotations, which gives rise to the classical understanding of heat. In an exothermic reaction, the activation energy (energy needed to start the reaction) is less than the energy that is subsequently released, so there is a net release of energy.
Examples[edit]
An exothermic thermite reaction using iron(III) oxide. The sparks flying outwards are globules of molten iron trailing smoke in their wake.
Some examples of exothermic processes are:[4]
- Combustion of fuels such as wood, coal and oil/petroleum
- The thermite reaction[5]
- The reaction of alkali metals and other highly electropositive metals with water
- Condensation of rain from water vapor
- Mixing water and strong acids or strong bases
- The reaction of acids and bases
- Dehydration of carbohydrates by sulfuric acid
- The setting of cement and concrete
- Some polymerization reactions such as the setting of epoxy resin
- The reaction of most metals with halogens or oxygen
- Nuclear fusion in hydrogen bombs and in stellar cores (to iron)
- Nuclear fission of heavy elements
- The reaction between zinc and hydrochloric acid
- Respiration (breaking down of glucose to release energy in cells)
Implications for chemical reactions[edit]
Chemical exothermic reactions are generally more spontaneous than their counterparts, endothermic reactions.
In a thermochemical reaction that is exothermic, the heat may be listed among the products of the reaction.
See also[edit]
- Calorimetry
- Chemical thermodynamics
- Differential scanning calorimetry
- Endergonic
- Endergonic reaction
- Exergonic
- Exergonic reaction
- Endothermic reaction
References[edit]
- ^ «Gate for the Greek language» on-line dictionary Archived 2017-12-05 at the Wayback Machine. greek-language.gr
- ^ Oxtoby, D. W; Gillis, H.P., Butler, L. J. (2015).Principles of Modern Chemistry, Brooks Cole. p. 617. ISBN 978-1305079113
- ^ Perrot, Pierre (1998). A to Z of Thermodynamics. Oxford University Press. ISBN 0-19-856552-6.
- ^ Exothermic – Endothermic examples Archived 2006-09-01 at the Wayback Machine. frostburg.edu
- ^ «T510: Exothermic Reaction – Thermite». 23 December 2015.
External links[edit]
Look up exothermic in Wiktionary, the free dictionary.
- http://chemistry.about.com/b/a/184556.htm Observe exothermic reactions in a simple experiment
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
- Разложения
- Замещения
- Обмена
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно
сложное вещество. Примеры:
4Na + O2 = 2Na2O
P2O5 + 3H2O = 2H3PO4
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
2KMnO4 = K2MnO4 + MnO2 + 2O2
Сa(OH)2 = CaO + H2O
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
CuSO4 + Fe = FeSO4 + Cu
2KI + Cl2 = 2KCl + I2
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами.
Часто обмен происходит анионами/катионами:
2KOH + MgCl2 = Mg(OH)2↓ + 2KCl
AgF + NaCl = AgCl↓ + NaF
Реакция нейтрализации — реакция обмена между основанием и кислотой, в ходе которой получаются соль и вода:
KOH + H2SO4 = K2SO4 + H2O

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав
исходных веществ. ОВР подразделяются на:
- Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
- Внутримолекулярные — атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
- Диспропорционирование — один и тот же атом является и окислителем, и восстановителем
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
K2SO3 + K2Cr2O7 + H2SO4 → K2SO4
+ Cr2(SO4)3 + H2O
KMnO4 → K2MnO4 + MnO2 + O2
KClO3 → KCl + O2
KOH + Cl2 → (t) KCl + KClO3 + H2O
KOH + Cl2 → KCl + KClO + H2O

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО,
принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив
эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном.
При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
N2 + 3H2 ⇆ 2NH3
CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от
обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение.
В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl (выпадает осадок)
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому
составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой,
твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на
границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество,
твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Zn(тв.) + 2HCl(р-р.) = ZnCl2(р-р.) + H2(газ.)↑

Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером
такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
NaOH(р-р.) + CH3COOH(р-р.) = CH3COONa(р-р.) + H2O(р-р.)

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся
или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются
воспламенением или взрывом (натрий с водой).
- Экзотермические реакции
- Эндотермические реакции
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой
энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное
количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
Большинство реакций нейтрализации относятся к экзотермическим:
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
4NH3 + 5O2 = 4NO + 6H2O + Q
Исключением является взаимодействие азота и кислорода, при
котором тепло поглощается:
N2 + O2 ⇄ 2NO — Q
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому
не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания»
в реакции вместо явного +Q при экзотермической реакции могут написать ΔH < 0. Например:
2Na + 2H2O = 2NaOH + H2; ΔH < 0 (это значит, что тепло выделяется — реакция экзотермическая)

Эндотермические реакции (греч. ἔνδον — внутри) — химические реакции, сопровождающиеся поглощением тепла, в результате которых образуются
вещества с более высоким энергетическим уровнем (их внутренняя энергия увеличивается).
К таким реакциям наиболее часто относятся реакции разложения. При написании эндотермических реакций в конце ставят «-Q», либо указывают точное
количество поглощенной энергии. Примеры таких реакций:
2HgO = Hg + O2 — Q
CaCO3 = CaO + CO2↑ — Q
С целью «запутывания» может быть дана энтальпия, она при таких реакциях всегда: ΔH > 0, так как внутренняя
энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик»)
является примером экзотермического разложения, при котором тепло выделяется.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ЭКЗОТЕРМИ́ЧЕСКИЙ, —ая, —ое. Хим. Связанный с выделением тепла, отдачей теплоты. Экзотермическая реакция. Экзотермические процессы.
Все значения слова «экзотермический»
РЕА́КЦИЯ1, -и, ж. 1. Действие или состояние, возникающее в ответ на то или иное воздействие.
РЕА́КЦИЯ2, -и, ж. Политика жестокого подавления революционного движения и всякого общественного прогресса, которую ведут отживающие или побежденные революцией эксплуататорские классы в борьбе за сохранение или возврат своих прав и политического господства.
Все значения слова «реакция»
-
Здесь свечение является результатом протекания экзотермической реакции, в которой энергия выделяется не в форме теплоты, а в форме света (это бывает не так часто).
-
Экзотермическая реакция токсичных газов и алюминия поддерживает температуру реактора постоянной и приводит к образованию солей и оксидов (AlCl3, Al2O3 и т.д.).
-
Может быть, это какая-то необычная микроволновая пушка или профессор принял внутрь некий химический раствор, который вызвал экзотермическую реакцию.
- (все предложения)
- реакция синтеза
- реакции разложения
- вступает в химическую реакцию
- продукты реакции
- в результате реакции
- (ещё синонимы…)
- химия
- реактивы
- реагенты
- распадок
- ответ
- (ещё ассоциации…)
- экзотермическая реакция
- (полная таблица сочетаемости…)
- ответная реакция
- реакция людей
- скорость реакции
- реакция оказалась
- вызвать реакцию
- (полная таблица сочетаемости…)
- Как правильно пишется слово «экзотермический»
- Как правильно пишется слово «реакция»
Определение теплового эффекта химической реакции
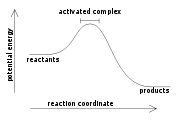
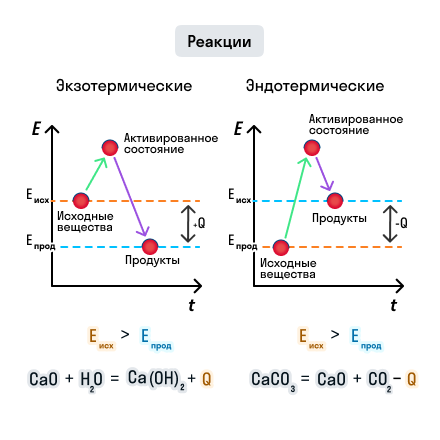
В процессе химической реакции связи в исходных веществах разрываются и образуются новые связи, благодаря чему образуются новые вещества — продукты реакции. Разрыв связи протекает с поглощением энергии, а образование — с выделением, то есть химические реакции сопровождаются энергетическими эффектами.
Как правило, энергия выделяется или поглощается в виде теплоты, поэтому мы говорим, что протекание химической реакции сопровождается тепловым эффектом.
Тепловой эффект химической реакции — это количество теплоты, которое поглощается или выделяется в результате протекания химической реакции.
Если исходные вещества были менее устойчивыми (поглощается небольшое количество энергии), а образуются устойчивые (выделяется большое количество энергии), то в результате химической реакции выделяется тепловой эффект.
И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты.
Рассмотрим эти процессы на рисунке:
В зависимости от того, выделяется или поглощается теплота, различают два типа химических реакций: экзотермические и эндотермические.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Экзотермические реакции
Экзотермические реакции протекают с выделением теплоты.
Запоминаем
Q — обозначение теплового эффекта химической реакции.
Единица измерения — килоджоули (кДж) или джоули (Дж).
1 кДж = 1 000 Дж.
В экзотермических реакциях количество выделившейся теплоты указывают со знаком «+».
Например, при сгорании угля:
C(тв) + O2 (г) = CO2 (г) + Q.
Чтобы запустить эту и некоторые другие реакции, нужна инициация, или, проще говоря, пинок. В случае с реакцией горения угля это нагрев (поджигание).
К экзотермическим реакциям относятся реакции горения и реакции соединения.
Реакции горения
Пример — реакция горения метана в атмосфере кислорода:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Реакции соединения
Пример — образование воды из двух простых веществ, при этом выделяется 484 кДж:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж.
Исключение
При образовании оксида азота (II) и йодоводорода реакции протекают с поглощением теплоты:
N2 (г) + O2 (г) = 2NO (г) − 180 кДж.
Эндотермические реакции
Эндотермические реакции протекают с поглощением теплоты. Количество поглощенной теплоты указывают со знаком «−».
К эндотермическим реакциям чаще всего относят реакции разложения.
Например, реакции разложения нитрата калия и карбоната кальция:
2KNO3(тв) → 2KNO2(тв) + O2 (г) – Q;
CaCO3(тв) = CaO(тв) + CO2 (г) − 170 кДж.
Термохимические уравнения
Уравнения реакций, в которых указано количество выделившейся теплоты, называют термохимическими.
В термохимических уравнениях всегда указывают агрегатные состояния веществ, так как от этого зависит значение теплового эффекта.
Важно
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
Рассмотрим термохимическое уравнение сгорания газа метана:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Глядя на уравнение, можно сделать вывод, что при сгорании 1 моля газообразного метана в 2 молях газообразного кислорода выделяется 802 кДж теплоты сгорания.
Теплота сгорания — это количество теплоты, выделяющееся при горении 1 моля вещества.
Если в реакцию вступит в 5 раз больше метана, чем в представленном термохимическом уравнении, то есть не 1 моль метана, а 5, то тепловой эффект будет пропорционально больше, то есть не 802 кДж, а 802 ⨯ 5 = 4 010 кДж.
Практика
Рассмотрим несколько термохимических расчетов для типовых заданий.
Задача 1
Рассчитайте количество теплоты, выделившейся в результате реакции образования метана, термохимическое уравнение которой —
C(тв) + 2H2 (г) = CH4 (г) + 76 кДж,
из: а) 0,3 моля углерода; б) 2,4 г углерода; в) 2,24 л водорода.
Решение.
Важно помнить, что количество теплоты, которая выделяется в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется x кДж.
Составим уравнение и решим его:
1 моль × х = 76 кДж × 0,3 моля;
.
б) Для начала найдем количество вещества прореагировавшего углерода. Для этого разделим его массу m на молярную массу M:
.
Молярная масса углерода равна 12 г/моль (значение из таблицы Менделеева).
Тогда
.
В соответствии с термохимическим уравнением при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,2 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,2 моля;
.
в) Для начала найдем количество вещества вступившего в реакцию водорода. Для этого разделим его объем V на молярный объем Vm:
.
Молярный объем любого вещества равен 22,4 л/моль.
Тогда
.
В соответствии с термохимическим уравнением при взаимодействии 2 молей H выделяется 76 кДж, тогда при взаимодействии 0,1 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,1 моля;
.
Задача 2
В результате реакции, термохимическое уравнение которой —
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж,
выделилось 1 360 кДж. Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
Решение.
а) В соответствии с термохимическим уравнением при взаимодействии
1 моля кислорода выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
1 моль × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
V = n(H) × Vm, где Vm — молярный объем;
V(H) = 2,81 моля × 22,4 л/моль = 62,95 л.
б) В соответствии с термохимическим уравнением при взаимодействии
2 молей воды выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
2 моля × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
m(H2O) = n(H2O) × M(H2O), где M — молярная масса;
M(H2O) = 1 × 2 + 16 × 1 = 18 г/моль;
m(H2O) = 5,62 моля × 18 г/моль = 101,16 г.
Еще больше задач, да еще и в интерактивном формате — на онлайн-курсах по химии в школе Skysmart.
Вопросы для самопроверки
-
Что такое тепловой эффект?
-
На какие типы делятся реакции по тепловому эффекту?
-
Приведите примеры реакций, которые протекают с выделением теплоты.
-
Какие уравнения называют термохимическими?
-
Рассчитайте количество теплоты, которая выделится при сгорании 0,7 моля метана. Термохимическое уравнение реакции:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.