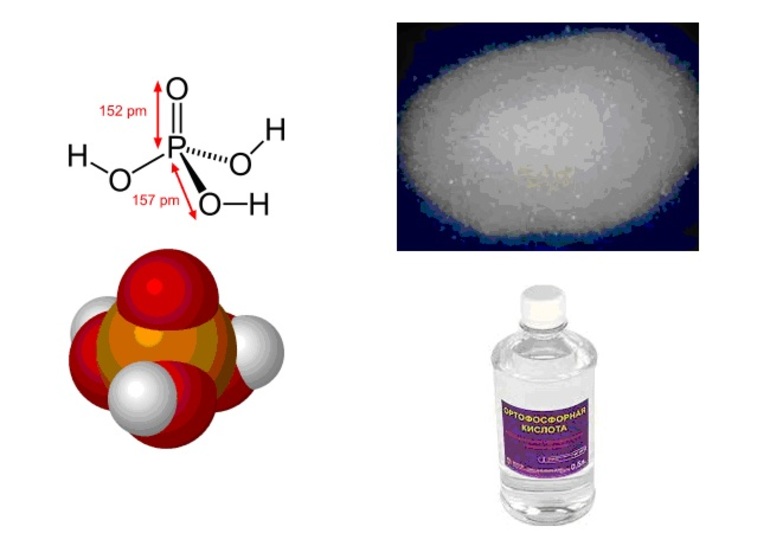
Кислота средней силы. Ее соли – фосфаты плохо растворимы в воде, кроме фосфатов щелочных металлов и аммония.
Альтернативные названия
Ортофосфорная кислота, гидроксид фосфора (V)
Формула
H3PO4
Свойства фосфорной кислоты
Физические свойства
Фосфорная кислота самая устойчивая при комнатной температуре фосфорных кислот. Кроме ортофосфорной кислоты H3PO4 существует метафосфорная кислота HPO3, пирофосфорная H4P2O7, трифосфорная H3P3O9 и тетрафосфорная H4P4O12. Последние три намного сильнее ортофосфорной кислоты (K1 = 7 ⋅cdot 10-3).
| Свойство | Описание |
|---|---|
| Внешний вид | Бесцветная жидкость в водном растворе, в чистом виде – гигроскопичные кристаллы |
| Молярная масса, г/моль | 98,0 |
| Плотность при 20°С, г/см3 | 1,83 |
| Температура плавления, °С | +42,35 |
| Температура кипения, °С | 213 (разл.) |
Химические свойства
В водных растворах фосфорная кислота диссоциирует на ионы:
H3PO4 ⇄rightleftarrows H+ + H2PO4—, ⇄rightleftarrows 2H+ + HPO42- ⇄rightleftarrows 3H+ + PO43-.
K1 = 7,1·10-3,
K2 = 6,2·10-8,
K3 = 5,0·10-13.
При комнатной температуре фосфорная кислота реагирует лишь с активными металлами, оксидами и гидроксидами:
6Li + 2H3PO4 = 2Li3PO4 + 3H2↑,
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O,
3KOH + H3PO4 = K3PO4 + 3H2O.
При нагревании она более активна:
3Zn + 2H3PO4 = 2Zn3(PO4)2 ↓+ 3H2↑,
Fe2O3 +2H3PO4 = 2FePO4↓+ 3H2O.
Фосфорная кислота разлагается при нагревании:
4H3PO4 = 2H4P2O7 + 2H2O.
Фосфорная кислота вступает в реакцию с хлорной кислотой, образуя соли фосфорила:
H3PO4 + HClO4= P(OH)4ClO4.
Поэтому можно считать фосфорную кислоту амфотерным гидроксидом фосфора (V) с преобладанием кислотных свойств.
Получение
Лабораторные способы получения
Фосфорную кислоту в лабораторных условиях получают из оксида фосфора (V):
P2O5 + 3H2O = 2H3PO4.
Реакция протекает бурно, поэтому ее лучше получать таким способом в промышленности.
Можно получить фосфорную кислоту из фосфатов действием соляной или серной кислоты:
Na3PO4 + 3HCI = 3NaCI + H3PO4.
Наконец, можно подвергнуть гидролизу хлорид фосфора (V):
2PCl5+ 8H2O = 2H3PO4 + 10HCl.
Получение в промышленности
В промышленности наиболее чистую фосфорную кислоту получают термическим способом, для чего фосфор сжигают:
4P +5O2 = 2P2O5.
Фосфорный ангидрид взаимодействует с водой слишком бурно, поэтому фосфорный ангидрид смешивают с нагретой до 200°С фосфорной кислотой в концентрации 50-60%. Полученную кислоту разводят и частично запускают вновь в процесс.
Есть экстракционный метод получения фосфорной кислоты непосредственно из руд, например, из апатита:
Ca5(PO4)3F + 5H2SO4 + n H3PO4 + 3H2O = (n+3) H3PO4+ 5CaSO4·H2O + HF.
Применение
Фосфорная кислота используется при производстве высококонцентрированных фосфорных удобрений, полифосфатов, синтетических моющих средств, умягчителей воды, а также в качестве катализатора.
В стекольном производстве ее добавляют при варке специальных стекол.
В медицине ее применяют при производстве многих лекарственных препаратов.
В химическом анализе из фосфорной кислоты и фосфатов готовят буферные растворы.
Пример решения задачи
Осуществите следующие превращения:
Na3PO4 → H3PO4 → HPO3 → KPO3→ AgPO3.
Решение
Na3PO4+3HCI = 3NaCI+H3PO4;
H3PO4 + P2O5 = 3HPO3;
HPO3 + KOH = KPO3 + Н2О,
KPO3 + AgNO3 = AgPO3↓ + KNO3.
Тест по теме «Фосфорная кислота»
Фосфорная кислота
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 + P → H3PO4 + 5NO2↑ + H2O
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая).
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
H3PO4 ⇄ H+ + H2PO4–
H2PO4– ⇄ H+ + HPO42–
HPO42– ⇄ H+ + PO43–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, фосфорная кислота взаимодействует с оксидом магния:
2H3PO4 + 3MgO → Mg3(PO4)2 + 3H2O
Еще пример: при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
H3PO4 + КОН → KH2РО4 + H2O
H3PO4 + 2КОН → К2НРО4 + 2H2O
H3PO4 + 3КОН → К3РО4 + 3H2O
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например, фосфорная кислота взаимодействует с гидрокарбонатом натрия:
Н3PO4 + 3NaHCO3 → Na3PO4 + CO2 + 3H2O
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
2H3PO4 → H2P2O7 + H2O
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, фосфорная кислота реагирует с магнием:
2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
2H3PO4 + 3NH3 → NH4H2PO4 + (NH4)2HPO4
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Н3PO4 + 3AgNO3 → Ag3PO4↓ + 3НNO3
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфорная (ортофосфорная) кислота
H3PO4
представляет собой твёрдое прозрачное кристаллическое вещество. Она очень хорошо растворяется в воде (смешивается в любых соотношениях) и обычно применяется в виде растворов.
Рис. (1). Раствор фосфорной кислоты
В водных растворах фосфорная кислота диссоциирует ступенчато:
Диссоциация на каждой следующей ступени протекает слабее, чем на предыдущей. Полностью на ионы фосфорная кислота не распадается и относится к кислотам средней силы. Она менее активна в химических реакциях по сравнению с серной, азотной, соляной кислотами.
Фосфорная кислота вступает в реакции:
- с металлами, расположенными в ряду активности до водорода:
;
- с основными оксидами:
- с основаниями:
- с солями, если выделяется газ или осадок:
;
- с аммиаком:
В реакциях могут образовываться не только средние соли фосфаты с кислотным остатком
PO43−
, но и кислые: гидрофосфаты (HPO42−) и дигидрофосфаты (
H2PO4−
). В названиях кислых солей приставка гидро- обозначает атом водорода, а дигидро- — два атома водорода. Состав соли зависит от мольных соотношений кислоты и реагирующего с ней вещества:
,
Средние соли фосфорной кислоты фосфаты (например,
Ca3(PO4)2
) нерастворимы в воде, кроме фосфатов щелочных металлов. Характерную жёлтую окраску имеет фосфат серебра. Это свойство используется для качественного определения растворимых фосфатов. При добавлении к ним раствора нитрата серебра выпадает жёлтый осадок, растворимый в азотной кислоте:
Рис. (2). Фосфат серебра
Большинство дигидрофосфатов (
CaH2PO4
и др.) растворяется в воде хорошо. Гидрофосфаты (
Ca(HPO4)2
и др.) растворяются лучше, чем фосфаты, но хуже по сравнению с дигидрофосфатами.
Фосфорная кислота используется:
- для производства минеральных удобрений,
- в качестве пищевой добавки в напитках,
- в производстве синтетических моющих средств,
- на производстве кормовых добавок для животных.
Соли фосфорной кислоты применяются в качестве минеральных удобрений.
Рис. (3). Суперфосфат
Источники:
Рис. 1. Раствор фосфорной кислоты https://www.shutterstock.com/ru/image-photo/selective-focus-phosphoric-acid-solution-brown-1806002407
Рис. 2. Фосфат серебра © ЯКласс
Рис. 3. Суперфосфат https://cdn.pixabay.com/photo/2017/12/28/12/29/fertilizer-3045121_960_720.jpg
From Wikipedia, the free encyclopedia
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 42.35 °C (108.23 °F; 315.50 K) anhydrous[12] 29.32 °C (84.78 °F; 302.47 K) hemihydrate[13] |
|
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[14] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [15] [15]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[15] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[15] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[16] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[17]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[18][19][20]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[21]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[22]
Properties[edit]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Eutectic system[edit]
The phase diagram of the H3PO4·H2O system is complicated. Solutions up to 62.5% H3PO4 are eutectic, exhibiting freezing-point depression as low as -85°C. Beyond this freezing-point increases, reaching 21°C by 85% H3PO4 (w/w) and a local maximum at 91.6% which corresponds to the hemihydrate 2H3PO4•H2O, freezing at 29.32°C.[23][24] There is a second smaller eutectic depression at a concentration of 94.75% which will not freeze down to 23.5°C. At higher concentrations the freezing point rapidly increases. Concentrated phosphoric acid tends to supercool before crystallization occurs, and may be relatively resistant to crystallisation even when stored below the freezing point.[13] For many industrial uses 85% represents a practical upper limit, where higher concentrations risk the entire mass freezing solid when transported inside of tankers and having to be melted out, although some crystallisation can still occur in sub-zero temperatures.
Self condensation[edit]
Phosphoric acid is commercially available as aqueous solutions of various concentrations, not usually exceeding 85%. If concentrated further it undergoes slow self-condensation, forming an equilibrium with pyrophosphoric acid:
- 2 H3PO4 ⇌ H2O + H4P2O7
Even at 90% concentration the amount of pyrophosphoric acid present is negligible, but beyond 95% it starts to increase, reaching 15% at what would have otherwise been 100% orthophosphoric acid.[25]
Due to the self-condensation, pure orthophosphoric acid can only be obtained by a careful fractional freezing/melting process.[13][12] As the concentration is increased higher acids are formed, culminating in the formation of polyphosphoric acids.[26] It is not possible to fully dehydrate phosphoric acid to phosphorus pentoxide, instead the polyphosphoric acid becomes increasingly polymeric and viscous.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[27]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[28]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[29] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[30] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[31]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[32]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[33]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[34]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[35]
- as a sanitizing agent in the dairy, food, and brewing industries[36]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[37]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[38]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ a b Greenwood, N. N.; Thompson, A. (1959). «701. The mechanism of electrical conduction in fused phosphoric and trideuterophosphoric acids». Journal of the Chemical Society (Resumed): 3485. doi:10.1039/JR9590003485.
- ^ a b c Ross, Wm. H.; Jones, R. M.; Durgin, C. B. (October 1925). «The Purification of Phosphoric Acid by Crystallization». Industrial & Engineering Chemistry. 17 (10): 1081–1083. doi:10.1021/ie50190a031. ISSN 0019-7866.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Gilmour, Rodney (2014). Phosphoric acid: purification, uses, technology, and economics. Boca Raton: CRC Press. pp. 44–61. ISBN 9781439895108.
- ^ Jupp, Andrew R.; Beijer, Steven; Narain, Ganesha C.; Schipper, Willem; Slootweg, J. Chris (2021). «Phosphorus recovery and recycling – closing the loop». Chemical Society Reviews. 50 (1): 87–101. doi:10.1039/D0CS01150A. PMID 33210686.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Ross, William H.; Jones, Russell M. (August 1925). «The Solubility and Freezing-Point Curves of Hydrated and Anhydrous Orthophosphoric Acid». Journal of the American Chemical Society. 47 (8): 2165–2170. doi:10.1021/ja01685a015.
- ^ «Purified Phosphoric Acid H3PO4 Technical Information Bulletin» (PDF). PotashCorp. Retrieved 11 February 2023.
- ^ Korte, Carsten; Conti, Fosca; Wackerl, Jürgen; Lehnert, Werner (2016), Li, Qingfeng; Aili, David; Hjuler, Hans Aage; Jensen, Jens Oluf (eds.), «Phosphoric Acid and its Interactions with Polybenzimidazole-Type Polymers», High Temperature Polymer Electrolyte Membrane Fuel Cells, Cham: Springer International Publishing, pp. 169–194, doi:10.1007/978-3-319-17082-4_8, ISBN 978-3-319-17081-7, retrieved 12 February 2023
- ^ Jameson, R. F. (1 January 1959). «151. The composition of the «strong» phosphoric acids». Journal of the Chemical Society (Resumed): 752–759. doi:10.1039/JR9590000752.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «Star San» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
From Wikipedia, the free encyclopedia
This article is about orthophosphoric acid. For other acids commonly called «phosphoric acid», see Phosphoric acids and phosphates.

|
||
|
||
| Names | ||
|---|---|---|
| IUPAC name
Phosphoric acid |
||
| Other names
Orthophosphoric acid |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.028.758 |
|
| EC Number |
|
|
| E number | E338 (antioxidants, …) | |
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 1805 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
H3PO4 | |
| Molar mass | 97.994 g·mol−1 | |
| Appearance | Colorless solid | |
| Odor | Odorless | |
| Density | 1.6845 g/cm3 (25 °C, 85%),[1] 1.834 g/cm3 (solid)[2] | |
| Melting point | 42.35 °C (108.23 °F; 315.50 K) anhydrous[12] 29.32 °C (84.78 °F; 302.47 K) hemihydrate[13] |
|
| Boiling point |
|
|
|
Solubility in water |
|
|
| Solubility | Soluble in ethanol | |
| log P | −2.15[7] | |
| Vapor pressure | 0.03 mmHg (20 °C)[8] | |
| Conjugate base | Dihydrogen phosphate | |
|
Magnetic susceptibility (χ) |
−43.8·10−6 cm3/mol[10] | |
|
Refractive index (nD) |
|
|
| Viscosity | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
|
| Structure | ||
|
Crystal structure |
Monoclinic | |
|
Molecular shape |
Tetrahedral | |
| Thermochemistry[14] | ||
|
Heat capacity (C) |
145.0 J/(mol⋅K) | |
|
Std molar |
150.8 J/(mol⋅K) | |
|
Std enthalpy of |
−1271.7 kJ/mol | |
|
Gibbs free energy (ΔfG⦵) |
−1123.6 kJ/mol | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [15] [15]
|
|
|
Signal word |
Danger | |
|
Hazard statements |
H290, H314[15] | |
|
Precautionary statements |
P280, P305+P351+P338, P310[15] | |
| NFPA 704 (fire diamond) |
3 0 0 |
|
| Flash point | Non-flammable | |
| Lethal dose or concentration (LD, LC): | ||
|
LD50 (median dose) |
1530 mg/kg (rat, oral)[16] | |
| NIOSH (US health exposure limits): | ||
|
PEL (Permissible) |
TWA 1 mg/m3[8] | |
|
REL (Recommended) |
TWA 1 mg/m3 ST 3 mg/m3[8] | |
|
IDLH (Immediate danger) |
1000 mg/m3[8] | |
| Safety data sheet (SDS) | ICSC 1008 | |
| Related compounds | ||
|
Related phosphorus oxoacids |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Phosphoric acid (orthophosphoric acid, monophosphoric acid or phosphoric(V) acid) is a colorless, odorless phosphorus-containing solid, and inorganic compound with the chemical formula H3PO4. It is commonly encountered as an 85% aqueous solution, which is a colourless, odourless, and non-volatile syrupy liquid. It is a major industrial chemical, being a component of many fertilizers.
The compound is an acid. Removal of all three H+ ions gives the phosphate ion PO3−4. Removal of one or two protons gives dihydrogen phosphate ion H2PO−4, and the hydrogen phosphate ion HPO2−4, respectively. Phosphoric acid forms esters, called organophosphates.[17]
The name «orthophosphoric acid» can be used to distinguish this specific acid from other «phosphoric acids», such as pyrophosphoric acid. Nevertheless, the term «phosphoric acid» often means this specific compound; and that is the current IUPAC nomenclature.
Production[edit]
Phosphoric acid is produced industrially by one of two routes, wet processes and dry.[18][19][20]
Wet process[edit]
In the wet process, a phosphate-containing mineral such as calcium hydroxyapatite and fluorapatite are treated with sulfuric acid.[21]
- Ca5(PO4)3OH + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + H2O
- Ca5(PO4)3F + 5 H2SO4 → 3 H3PO4 + 5 CaSO4 + HF
Calcium sulfate (gypsum, CaSO4) is a by-product, which is removed as phosphogypsum. The hydrogen fluoride (HF) gas is streamed into a wet (water) scrubber producing hydrofluoric acid. In both cases the phosphoric acid solution usually contains 23–33% P2O5 (32–46% H3PO4). It may be concentrated to produce commercial- or merchant-grade phosphoric acid, which contains about 54–62% P2O5 (75–85% H3PO4). Further removal of water yields superphosphoric acid with a P2O5 concentration above 70% (corresponding to nearly 100% H3PO4). The phosphoric acid from both processes may be further purified by removing compounds of arsenic and other potentially toxic impurities.
Dry process[edit]
To produce food-grade phosphoric acid, phosphate ore is first reduced with coke in an electric arc furnace, to give elemental phosphorus. Silica is also added, resulting in the production of calcium silicate slag. Elemental phosphorus is distilled out of the furnace and burned with air to produce high-purity phosphorus pentoxide, which is dissolved in water to make phosphoric acid.[22]
Properties[edit]
Acidic properties[edit]
In aqueous solution phosphoric acid behaves as a triprotic acid.
- H3PO4 ⇌ H2PO−4 + H+, pKa1 = 2.14
- H2PO−4 ⇌ HPO2−4 + H+, pKa2 = 7.20
- HPO2−4 ⇌ PO3−4 + H+, pKa3 = 12.37
The difference between successive pKa values is sufficiently large so that salts of either monohydrogen phosphate, HPO2−4 or dihydrogen phosphate, H2PO−4, can be prepared from a solution of phosphoric acid by adjusting the pH to be mid-way between the respective pK values.
Eutectic system[edit]
The phase diagram of the H3PO4·H2O system is complicated. Solutions up to 62.5% H3PO4 are eutectic, exhibiting freezing-point depression as low as -85°C. Beyond this freezing-point increases, reaching 21°C by 85% H3PO4 (w/w) and a local maximum at 91.6% which corresponds to the hemihydrate 2H3PO4•H2O, freezing at 29.32°C.[23][24] There is a second smaller eutectic depression at a concentration of 94.75% which will not freeze down to 23.5°C. At higher concentrations the freezing point rapidly increases. Concentrated phosphoric acid tends to supercool before crystallization occurs, and may be relatively resistant to crystallisation even when stored below the freezing point.[13] For many industrial uses 85% represents a practical upper limit, where higher concentrations risk the entire mass freezing solid when transported inside of tankers and having to be melted out, although some crystallisation can still occur in sub-zero temperatures.
Self condensation[edit]
Phosphoric acid is commercially available as aqueous solutions of various concentrations, not usually exceeding 85%. If concentrated further it undergoes slow self-condensation, forming an equilibrium with pyrophosphoric acid:
- 2 H3PO4 ⇌ H2O + H4P2O7
Even at 90% concentration the amount of pyrophosphoric acid present is negligible, but beyond 95% it starts to increase, reaching 15% at what would have otherwise been 100% orthophosphoric acid.[25]
Due to the self-condensation, pure orthophosphoric acid can only be obtained by a careful fractional freezing/melting process.[13][12] As the concentration is increased higher acids are formed, culminating in the formation of polyphosphoric acids.[26] It is not possible to fully dehydrate phosphoric acid to phosphorus pentoxide, instead the polyphosphoric acid becomes increasingly polymeric and viscous.
Uses[edit]
The dominant use of phosphoric acid is for fertilizers, consuming approximately 90% of production.[27]
| Application | Demand (2006) in thousands of tons | Main phosphate derivatives |
|---|---|---|
| Soaps and detergents | 1836 | STPP |
| Food industry | 309 | STPP (Na5P3O10), SHMP, TSP, SAPP, SAlP, MCP, DSP (Na2HPO4), H3PO4 |
| Water treatment | 164 | SHMP, STPP, TSPP, MSP (NaH2PO4), DSP |
| Toothpastes | 68 | DCP (CaHPO4), IMP, SMFP |
| Other applications | 287 | STPP (Na3P3O9), TCP, APP, DAP, zinc phosphate (Zn3(PO4)2), aluminium phosphate (AlPO4), H3PO4 |
Food-grade phosphoric acid (additive E338[28]) is used to acidify foods and beverages such as various colas and jams, providing a tangy or sour taste. The phosphoric acid also serves as a preservative.[29] Soft drinks containing phosphoric acid, which would include Coca-Cola, are sometimes called phosphate sodas or phosphates. Phosphoric acid in soft drinks has the potential to cause dental erosion.[30] Phosphoric acid also has the potential to contribute to the formation of kidney stones, especially in those who have had kidney stones previously.[31]
Specific applications of phosphoric acid include:
- in anti-rust treatment by phosphate conversion coating or passivation
- to prevent iron oxidation by means of the Parkerization process
- as an external standard for phosphorus-31 nuclear magnetic resonance
- in phosphoric acid fuel cells
- in activated carbon production[32]
- in compound semiconductor processing, to etch Indium gallium arsenide selectively with respect to indium phosphide[33]
- in microfabrication to etch silicon nitride selectively with respect to silicon dioxide[34]
- in microfabrication to etch aluminum
- as a pH adjuster in cosmetics and skin-care products[35]
- as a sanitizing agent in the dairy, food, and brewing industries[36]
Safety[edit]
Phosphoric acid is not a strong acid. However, at moderate concentrations phosphoric acid solutions are irritating to the skin. Contact with concentrated solutions can cause severe skin burns and permanent eye damage.[37]
A link has been shown between long-term regular cola intake and osteoporosis in later middle age in women (but not men).[38]
See also[edit]
- Phosphate fertilizers, such as ammonium phosphate fertilizers
References[edit]
- ^ Christensen, J. H.; Reed, R. B. (1955). «Design and Analysis Data—Density of Aqueous Solutions of Phosphoric Acid Measurements at 25 °C». Ind. Eng. Chem. 47 (6): 1277–1280. doi:10.1021/ie50546a061.
- ^ «CAMEO Chemicals Datasheet – Phosphoric Acid». Archived from the original on 15 August 2019. Retrieved 15 August 2019.
- ^ «Phosphoric acid». www.chemspider.com. Archived from the original on 12 March 2020. Retrieved 3 March 2020.
- ^ Brown, Earl H.; Whitt, Carlton D. (1952). «Vapor Pressure of Phosphoric Acids». Industrial & Engineering Chemistry. 44 (3): 615–618. doi:10.1021/ie50507a050.
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Archived from the original on 11 March 2020. Retrieved 2 June 2014.
- ^ Haynes, p. 4.80
- ^ «phosphoric acid_msds». Archived from the original on 4 July 2017. Retrieved 2 May 2018.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. «#0506». National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, p. 5.92
- ^ Haynes, p. 4.134
- ^ Edwards, O. W.; Dunn, R. L.; Hatfield, J. D. (1964). «Refractive Index of Phosphoric Acid Solutions at 25 C.». J. Chem. Eng. Data. 9 (4): 508–509. doi:10.1021/je60023a010.
- ^ a b Greenwood, N. N.; Thompson, A. (1959). «701. The mechanism of electrical conduction in fused phosphoric and trideuterophosphoric acids». Journal of the Chemical Society (Resumed): 3485. doi:10.1039/JR9590003485.
- ^ a b c Ross, Wm. H.; Jones, R. M.; Durgin, C. B. (October 1925). «The Purification of Phosphoric Acid by Crystallization». Industrial & Engineering Chemistry. 17 (10): 1081–1083. doi:10.1021/ie50190a031. ISSN 0019-7866.
- ^ Haynes, p. 5.13
- ^ a b c Sigma-Aldrich Co., Phosphoric acid.
- ^ «Phosphoric acid». Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Westheimer, F.H. (6 June 1987). «Why nature chose phosphates». Science. 235 (4793): 1173–1178 (see pp. 1175–1176). Bibcode:1987Sci…235.1173W. CiteSeerX 10.1.1.462.3441. doi:10.1126/science.2434996. PMID 2434996.
- ^ Becker, Pierre (1988). Phosphates and phosphoric acid. New York: Marcel Dekker. ISBN 978-0824717124.
- ^ Gilmour, Rodney (2014). Phosphoric acid: purification, uses, technology, and economics. Boca Raton: CRC Press. pp. 44–61. ISBN 9781439895108.
- ^ Jupp, Andrew R.; Beijer, Steven; Narain, Ganesha C.; Schipper, Willem; Slootweg, J. Chris (2021). «Phosphorus recovery and recycling – closing the loop». Chemical Society Reviews. 50 (1): 87–101. doi:10.1039/D0CS01150A. PMID 33210686.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 520–522. ISBN 978-0-08-037941-8.
- ^ Geeson, Michael B.; Cummins, Christopher C. (2020). «Let’s Make White Phosphorus Obsolete». ACS Central Science. 6 (6): 848–860. doi:10.1021/acscentsci.0c00332. PMC 7318074. PMID 32607432.
- ^ Ross, William H.; Jones, Russell M. (August 1925). «The Solubility and Freezing-Point Curves of Hydrated and Anhydrous Orthophosphoric Acid». Journal of the American Chemical Society. 47 (8): 2165–2170. doi:10.1021/ja01685a015.
- ^ «Purified Phosphoric Acid H3PO4 Technical Information Bulletin» (PDF). PotashCorp. Retrieved 11 February 2023.
- ^ Korte, Carsten; Conti, Fosca; Wackerl, Jürgen; Lehnert, Werner (2016), Li, Qingfeng; Aili, David; Hjuler, Hans Aage; Jensen, Jens Oluf (eds.), «Phosphoric Acid and its Interactions with Polybenzimidazole-Type Polymers», High Temperature Polymer Electrolyte Membrane Fuel Cells, Cham: Springer International Publishing, pp. 169–194, doi:10.1007/978-3-319-17082-4_8, ISBN 978-3-319-17081-7, retrieved 12 February 2023
- ^ Jameson, R. F. (1 January 1959). «151. The composition of the «strong» phosphoric acids». Journal of the Chemical Society (Resumed): 752–759. doi:10.1039/JR9590000752.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ «Current EU approved additives and their E Numbers». Foods Standards Agency. 14 March 2012. Archived from the original on 21 August 2013. Retrieved 22 July 2012.
- ^ «Why is phosphoric acid used in some Coca‑Cola drinks?| Frequently Asked Questions | Coca-Cola GB». www.coca-cola.co.uk. Archived from the original on 2 August 2021. Retrieved 31 August 2021.
- ^ Moynihan, P. J. (23 November 2002). «Dietary advice in dental practice». British Dental Journal. 193 (10): 563–568. doi:10.1038/sj.bdj.4801628. PMID 12481178.
- ^ Qaseem, A; Dallas, P; Forciea, MA; Starkey, M; et al. (4 November 2014). «Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians». Annals of Internal Medicine. 161 (9): 659–67. doi:10.7326/M13-2908. PMID 25364887.
- ^ Toles, C.; Rimmer, S.; Hower, J. C. (1996). «Production of activated carbons from a washington lignite using phosphoric acid activation». Carbon. 34 (11): 1419. doi:10.1016/S0008-6223(96)00093-0.
- ^ Wet chemical etching. Archived 25 September 2012 at the Wayback Machine umd.edu.
- ^ Wolf, S.; R. N. Tauber (1986). Silicon processing for the VLSI era: Volume 1 – Process technology. p. 534. ISBN 978-0-9616721-6-4.
- ^ «Ingredient dictionary: P». Cosmetic ingredient dictionary. Paula’s Choice. Archived from the original on 18 January 2008. Retrieved 16 November 2007.
- ^ «Star San» (PDF). Five Star Chemicals. Archived (PDF) from the original on 8 February 2016. Retrieved 17 August 2015.
- ^ «Phosphoric Acid, 85 wt.% SDS». Sigma-Aldrich. 5 May 2016. Archived from the original on 18 January 2017. Retrieved 16 January 2017.
- ^ Tucker KL, Morita K, Qiao N, Hannan MT, Cupples LA, Kiel DP (1 October 2006). «Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study». American Journal of Clinical Nutrition. 84 (4): 936–942. doi:10.1093/ajcn/84.4.936. PMID 17023723.
Cited sources[edit]
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
External links[edit]
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 сентября 2019 года; проверки требуют 4 правки.
При взаимодействии фосфорной кислоты с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:
При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:
Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота[1] H3PO4 (которую часто называют просто фосфорная[2]). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
Фосфорную кислоту и её соли (дигидрофосфаты, гидрофосфаты и фосфаты) широко используют при производстве минеральных удобрений. Наиболее распространёнными фосфорными удобрениями являются простой суперфосфат, преципитат и фосфоритная мука.
Существуют также полифосфорные кислоты Hn+2PnO3n+1 и ультрафосфорные кислоты с отношением H2O/P2O5, меньшим 1.
См. также[править | править код]
- Фосфор
- Фосфорные удобрения
Примечания[править | править код]
Литература[править | править код]
- Ерёмина Е. А., Рыжова О. Н. Справочник школьника по химии. — М.: Издательство «Экзамен», 2009. — С. 203—204. — 512 с. — ISBN 978-5-377-01472-0.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
фосфористая кислота, также называется ортофосфорной кислотой, представляет собой химическое соединение формулы H3ПО3. Это одна из нескольких кислородсодержащих кислот фосфора, и ее структура представлена на рисунке 1 (EMBL-EBI, 2015).
Учитывая формулу соединения, оно может быть переписано как HPO (OH)2. Этот вид существует в равновесии с меньшим таутомером P (OH)3 (Рисунок 2).
Рекомендации IUPAC, 2005 года заключаются в том, что последняя называется фосфорной кислотой, а дигидрокси форма называется фосфоновой кислотой. Только восстановленные соединения фосфора пишутся с окончанием «медведь».
Фосфорная кислота является дипротоновой кислотой, это означает, что она обладает способностью давать только два протона. Это потому, что большинство таутомеров является H3ПО3. Когда эта форма теряет протон, резонанс стабилизирует образующиеся анионы, как показано на рисунке 3.
Таутомер P (OH) 3 (фиг.4) не обладает преимуществом стабилизации резонанса. Это значительно затрудняет удаление третьего протона (почему фосфорная кислота дипротична, а не трипротонна?, 2016).
Фосфорная кислота (H3ПО3) образует соли, называемые фосфитами, которые используются в качестве восстановителей (Britannica, 1998). Его готовят растворением тетрафосфорного гексаоксида (P4О6) согласно уравнению:
P4О6 + 6 ч2O → 4 HPO (OH)2
Чистая фосфористая кислота, ч3ПО3, лучше всего готовится гидролизом трихлорида фосфора, PCl3.
PCl3 + 3H2O → HPO (OH)2 + 3HCl
Полученный раствор нагревают для удаления HCl, а оставшаяся вода испаряется, пока не появится 3ПО3 бесцветный кристаллический при охлаждении. Кислота также может быть получена действием воды на PBr3 или PI3 (Zumdahl, 2018).
индекс
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 2.1 Реакционная способность
- 2.2 Опасности
- 2.3 Действия в случае повреждения
- 3 использования
- 4 Ссылки
Физико-химические свойства
Фосфорная кислота — это гигроскопичные белые или желтые тетраэдрические кристаллы с чесночным ароматом (Национальный центр биотехнологической информации, 2017).
H3ПО3 он имеет молекулярную массу 82,0 г / моль и плотность 1,665 г / мл. Соединение имеет температуру плавления 73 ° С и разлагается выше 200 ° С. Фосфорная кислота растворима в воде, способна растворять 310 грамм на 100 мл этого растворителя. Он также растворим в этаноле.
Кроме того, это сильная кислота с pKa между 1,3 и 1,6 (Royal Society of Chemistry, 2015).
Нагрев фосфористой кислоты до приблизительно 200 ° C приводит к ее диспропорционированию в фосфорной кислоте и фосфине (PH3). Фосфины, газ, который обычно самовозгорается в воздухе.
4H3ПО3 + тепло → PH3 + 3H3ПО4
Реактивность и опасности
реактивность
- Фосфорная кислота не является стабильным соединением.
- Поглощает кислород из воздуха с образованием фосфорной кислоты.
- Образуют желтые отложения в водном растворе, которые самовоспламеняются при высыхании.
- Экзотермически реагирует с химическими основаниями (например, аминами и неорганическими гидроксидами) с образованием солей.
- Эти реакции могут генерировать опасно большое количество тепла в небольших помещениях.
- Растворение в воде или разбавление концентрированного раствора дополнительной водой может привести к значительному выделению тепла..
- Реагирует в присутствии влаги с активными металлами, включая конструкционные металлы, такие как алюминий и железо, с выделением водорода, горючего газа.
- Вы можете начать полимеризацию определенных алкенов. Реагирует с цианистыми соединениями с выделением газообразного цианистого водорода..
- Может генерировать легковоспламеняющиеся и / или токсичные газы при контакте с дитиокарбаматами, изоцианатами, меркаптанами, нитридами, нитрилами, сульфидами и сильными восстановителями.
- Дополнительные газогенерирующие реакции происходят с сульфитами, нитритами, тиосульфатами (для получения H2S и SO3), дитионитами (для получения SO2) и карбонатами (для выделения CO2) (PHOSPHOROUS ACID, 2016).
опасность
- Вещество разъедает глаза и кожу.
- Контакт с глазами может привести к повреждению роговицы или слепоте.
- Контакт с кожей может вызвать воспаление и волдыри.
- Вдыхание пыли вызовет раздражение желудочно-кишечного тракта или дыхательных путей, для которого характерны жжение, чихание и кашель..
- Сильное передержка может вызвать повреждение легких, асфиксию, потерю сознания или смерть (Паспорт безопасности материала, Фосфорная кислота, 2013).
Действие в случае повреждения
- Убедитесь, что медицинский персонал осведомлен о материалах, участвующих и принять меры предосторожности, чтобы защитить себя.
- Пострадавшего следует перевести в прохладное место и вызвать скорую медицинскую помощь.
- Искусственное дыхание следует давать, если пострадавший не дышит.
- Метод «рот-в-рот» не следует использовать, если жертва проглотила или вдохнула вещество.
- Искусственное дыхание выполняется с помощью карманной маски, оснащенной однонаправленным клапаном или другим подходящим респираторным медицинским устройством..
- Кислород следует назначать при затрудненном дыхании.
- Загрязненную одежду и обувь необходимо снять и изолировать.
- В случае контакта с веществом, немедленно промойте кожу или глаза проточной водой в течение не менее 20 минут..
- Для меньшего контакта с кожей следует избегать распространения материала на незатронутую кожу.
- Держите жертву тихой и горячей.
- Последствия воздействия (вдыхания, проглатывания или контакта с кожей) вещества могут быть отсрочены.
приложений
Наиболее важным применением фосфористой кислоты является производство фосфитов, которые используются при обработке воды. Фосфорная кислота также используется для приготовления фосфитных солей, таких как фосфит калия.
Фосфиты показали свою эффективность в борьбе с различными заболеваниями растений.
В частности, лечение инъекцией ствола или листвы, содержащей соли фосфористой кислоты, показано в ответ на заражение фитопатогенными растениями фитофторами и питием (производят разложение корня).
Фосфорная кислота и фосфиты используются в качестве восстановителей в химическом анализе. Новый удобный и масштабируемый синтез фенилуксусных кислот посредством катализируемого йодидом восстановления миндальных кислот основан на получении иодистоводородной кислоты in situ из каталитического йодида натрия. Для этого в качестве стехиометрического восстановителя используется фосфорная кислота (Jacqueline E. Milne, 2011).
Он используется в качестве ингредиента для производства добавок, используемых в поливинилхлоридной промышленности (Фосфорная кислота (CAS RN 10294-56-1), 2017). Также сложные эфиры фосфористой кислоты используются в различных реакциях органического синтеза (Blazewska, 2009).
ссылки
- Blazewska, K. (2009). Наука Синтеза: Houben-Weyl Методы Молекулярных Преобразований Том 42. Нью-Йорк: Тим.
- (1998, 20 июля). Фосфорная кислота (H3PO3). Получено от Британской энциклопедии: britannica.com.
- EMBL-EBI. (2015, 20 июля). фосфоновая кислота. Восстановлено с ebi.ac.uk: ebi.ac.uk.
- Жаклин Э. Милн, Т. С. (2011). Катализированные йодом восстановления: развитие синтеза фенилуксусных кислот. Org. Chem. 76, 9519-9524. organic-chemistry.org.
- Паспорт безопасности материала Фосфорная кислота. (2013, 21 мая). Получено с sciencelab: sciencelab.com.
- Национальный центр биотехнологической информации. (2017, 11 марта). База данных PubChem Compound; CID = 107909. Получено из PubChem: ncbi.nlm.nih.gov.
- Фосфорная кислота (CAS RN 10294-56-1). (2017, 15 марта). Восстановлено с gov.uk/trade-tariff:gov.uk.
- ФОСФОРНАЯ КИСЛОТА. (2016). Получено из Cameochemicals: cameochemicals.noaa.gov.
- Королевское химическое общество. (2015). ФОСФОРНАЯ КИСЛОТА. Получено с chemspider: chemspider.com.
- Почему фосфорная кислота дипротична, а не трипротонна? (2016 г., 11 марта). Извлечено из химии..
- Zumdahl, S.S. (2018, 15 августа). Оксикислоты. Восстановлено с britannica.com.
Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 0 | 1,633 |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO43- и молекулами воды H2O.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4— = H+ + HPO42-.
- HPO42- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.
При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.