Гидроксид кальция
4.3
Средняя оценка: 4.3
Всего получено оценок: 98.
4.3
Средняя оценка: 4.3
Всего получено оценок: 98.
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Характеристика гидроксида кальция
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но практически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом:
CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 98.
А какая ваша оценка?
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Calcium hydroxide |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.762 |
| EC Number |
|
| E number | E526 (acidity regulators, …) |
|
Gmelin Reference |
846915 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ca(OH)2 |
| Molar mass | 74.093 g/mol |
| Appearance | White powder |
| Odor | Odorless |
| Density | 2.211 g/cm3, solid |
| Melting point | 580 °C (1,076 °F; 853 K) (loses water, decomposes) |
|
Solubility in water |
|
|
Solubility product (Ksp) |
5.02×10−6 [1] |
| Solubility |
|
| Acidity (pKa) | 12.63 (first OH−), 11.57 (second OH−)[2][3] [clarification needed] |
|
Magnetic susceptibility (χ) |
−22.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.574 |
| Structure | |
|
Crystal structure |
Hexagonal, hP3[4] |
|
Space group |
P3m1 No. 164 |
|
Lattice constant |
a = 0.35853 nm, c = 0.4895 nm |
| Thermochemistry | |
|
Std molar |
83 J·mol−1·K−1[5] |
|
Std enthalpy of |
−987 kJ·mol−1[5] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H335, H402 |
|
Precautionary statements |
P261, P280, P305+P351+P338 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
7340 mg/kg (oral, rat) 7300 mg/kg (mouse) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (total) 5 mg/m3 (resp.)[7] |
|
REL (Recommended) |
TWA 5 mg/m3[7] |
|
IDLH (Immediate danger) |
N.D.[7] |
| Safety data sheet (SDS) | [6] |
| Related compounds | |
|
Other cations |
Magnesium hydroxide Strontium hydroxide Barium hydroxide |
|
Related bases |
Calcium oxide |
| Supplementary data page | |
| Calcium hydroxide (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium hydroxide (traditionally called slaked lime) is an inorganic compound with the chemical formula Ca(OH)2. It is a colorless crystal or white powder and is produced when quicklime (calcium oxide) is mixed with water. It has many names including hydrated lime, caustic lime, builders’ lime, slaked lime, cal, and pickling lime. Calcium hydroxide is used in many applications, including food preparation, where it has been identified as E number E526. Limewater, also called milk of lime, is the common name for a saturated solution of calcium hydroxide.
Properties[edit]
Calcium hydroxide is poorly soluble in water, with a retrograde solubility increasing from 0.66 g/L at 100 °C to 1.89 g/L at 0 °C. With a solubility product Ksp of 5.02×10−6 at 25 °C[1][clarification needed], its dissociation in water is large enough that its solutions are basic according to the following dissolution reaction:
- Ca(OH)2 → Ca2+ + 2 OH−
At ambient temperature, calcium hydroxide (portlandite) dissolves in water to produce an alkaline solution with a pH of about 12.5. Calcium hydroxide solutions can cause chemical burns. At high pH values due to a common-ion effect with the hydroxide anion, its solubility drastically decreases. This behavior is relevant to cement pastes. Aqueous solutions of calcium hydroxide are called limewater and are medium-strength bases, which react with acids and can attack some metals such as aluminium (amphoteric hydroxide dissolving at high pH), while protecting other metals, such as iron and steel, from corrosion by passivation of their surface. Limewater turns milky in the presence of carbon dioxide due to the formation of insoluble calcium carbonate, a process called carbonatation:
- Ca(OH)2 + CO2 → CaCO3 + H2O
When heated to 512 °C, the partial pressure of water in equilibrium with calcium hydroxide reaches 101 kPa (normal atmospheric pressure), which decomposes calcium hydroxide into calcium oxide and water:[8]
- Ca(OH)2 → CaO + H2O
Calcium hydroxide reacts with hydrogen chloride to first give calcium hydroxychloride and then calcium chloride.
Structure, preparation, occurrence[edit]
SEM image of fractured hardened cement paste, showing plates of calcium hydroxide and needles of ettringite (micron scale)
Calcium hydroxide adopts a polymeric structure, as do all metal hydroxides. The structure is identical to that of Mg(OH)2 (brucite structure); i.e., the cadmium iodide motif. Strong hydrogen bonds exist between the layers.[9]
Calcium hydroxide is produced commercially by treating (slaking) lime with water:
- CaO + H2O → Ca(OH)2
In the laboratory it can be prepared by mixing aqueous solutions of calcium chloride and sodium hydroxide. The mineral form, portlandite, is relatively rare but can be found in some volcanic, plutonic, and metamorphic rocks. It has also been known to arise in burning coal dumps.
The positively charged ionized species CaOH+ has been detected in the atmosphere of S-type stars.[10]
Retrograde solubility[edit]
According to Hopkins and Wulff (1965),[11] the decrease of calcium hydroxide solubility with temperature was known since the works of Marcellin Berthelot (1875)[12] and Julius Thomsen (1883)[13] (see Thomsen–Berthelot principle), when the presence of ions in aqueous solutions was still questioned. Since, it has been studied in detail by many authors, a.o., Miller and Witt (1929)[14] or Johnston and Grove (1931)[15] and refined many times (e.g., Greenberg and Copeland (1960);[16] Hopkins and Wulff (1965);[11] Seewald and Seyfried (1991);[17] Duchesne and Reardon (1995)[18]).
The reason for this rather uncommon behavior is that the dissolution of calcium hydroxide in water is an exothermic process. Thus, according to Le Chatelier’s principle, a lowering of temperature favours the elimination of the heat liberated through the process of dissolution and increases the equilibrium constant of dissolution of Ca(OH)2, and so increases its solubility at low temperature. This counter-intuitive temperature dependence of the solubility is referred to as «retrograde» or «inverse» solubility. The variably hydrated phases of calcium sulfate (gypsum, bassanite and anhydrite) also exhibit a retrograde solubility for the same reason because their dissolution reactions are exothermic.
Uses[edit]
Calcium hydroxide is commonly used to prepare lime mortar.
One significant application of calcium hydroxide is as a flocculant, in water and sewage treatment. It forms a fluffy charged solid that aids in the removal of smaller particles from water, resulting in a clearer product. This application is enabled by the low cost and low toxicity of calcium hydroxide. It is also used in fresh-water treatment for raising the pH of the water so that pipes will not corrode where the base water is acidic, because it is self-regulating and does not raise the pH too much.
It is also used in the preparation of ammonia gas (NH3), using the following reaction:
- Ca(OH)2 + 2 NH4Cl → 2 NH3 + CaCl2 + 2 H2O
Another large application is in the paper industry, where it is an intermediate in the reaction in the production of sodium hydroxide. This conversion is part of the causticizing step in the Kraft process for making pulp.[9] In the causticizing operation, burned lime is added to green liquor, which is a solution primarily of sodium carbonate and sodium sulfate produced by dissolving smelt, which is the molten form of these chemicals from the recovery furnace.
In orchard crops, calcium hydroxide is used as a fungicide. Applications of ‘lime water’ prevent the development of cankers caused by the fungal pathogen Neonectria galligena. The trees are sprayed when they are dormant in winter to prevent toxic burns from the highly reactive calcium hydroxide. This use is authorised in the European Union and the United Kingdom under Basic Substance regulations.[19]
Calcium hydroxide is used in dentistry, primarily in the specialty of endodontics.
Food industry[edit]
Because of its low toxicity and the mildness of its basic properties, slaked lime is widely used in the food industry:
- In USDA certified food production in plants and livestock[20]
- To clarify raw juice from sugarcane or sugar beets in the sugar industry, (see carbonatation)
- To process water for alcoholic beverages and soft drinks
- Pickle cucumbers and other foods
- To make Chinese century eggs
- In maize preparation: removes the cellulose hull of maize kernels (see nixtamalization)
- To clear a brine of carbonates of calcium and magnesium in the manufacture of salt for food and pharmaceutical uses
- In fortifying (Ca supplement) fruit drinks, such as orange juice, and infant formula
- As a digestive aid (called Choona, used in India in paan, a mixture of areca nuts, calcium hydroxide and a variety of seeds wrapped in betel leaves)
- As a substitute for baking soda in making papadam
- In the removal of carbon dioxide from controlled atmosphere produce storage rooms
- In the preparation of mushroom growing substrates[21]
Native American uses[edit]
Dry untreated maize (left), and treated maize (right) after boiling in water with calcium hydroxide (15 ml, or 1 tbsp, lime for 500 g of corn) for 15 minutes
In Nahuatl, the language of the Aztecs, the word for calcium hydroxide is nextli. In a process called nixtamalization, maize is cooked with nextli to become nixtamal, also known as hominy. Nixtamalization significantly increases the bioavailability of niacin (vitamin B3), and is also considered tastier and easier to digest. Nixtamal is often ground into a flour, known as masa, which is used to make tortillas and tamales.
In chewing coca leaves, calcium hydroxide is usually chewed alongside to keep the alkaloid stimulants chemically available for absorption by the body. Similarly, Native Americans traditionally chewed tobacco leaves with calcium hydroxide derived from burnt mollusc shells to enhance the effects. It has also been used by some indigenous American tribes as an ingredient in yopo, a psychedelic snuff prepared from the beans of some Anadenanthera species.[22]
Asian uses[edit]
Calcium hydroxide is typically added to a bundle of areca nut and betel leaf called «paan» to keep the alkaloid stimulants chemically available to enter the bloodstream via sublingual absorption.
It is used in making naswar (also known as nass or niswar), a type of dipping tobacco made from fresh tobacco leaves, calcium hydroxide (chuna or soon), and wood ash. It is consumed most in the Pathan diaspora, Afghanistan, Pakistan, India and Bangladesh. Villagers also use calcium hydroxide to paint their mud houses in Afghanistan, Pakistan and India.
Health risks[edit]
Unprotected exposure to Ca(OH)2 can cause severe skin irritation, chemical burns, blindness, lung damage or rashes.[6]
See also[edit]
- Baralyme (carbon dioxide absorbent)
- Cement
- Lime mortar
- Lime plaster
- Plaster
- Magnesium hydroxide (less alkaline due to a lower solubility product)
- Soda lime (carbon dioxide absorbent)
- Whitewash
References[edit]
- ^ a b John Rumble (18 June 2018). CRC Handbook of Chemistry and Physics (99 ed.). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ^ «Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. – Das Periodensystem online».
- ^ ChemBuddy dissociation constants pKa and pKb
- ^ Petch, H. E. (1961). «The hydrogen positions in portlandite, Ca(OH)2, as indicated by the electron distribution». Acta Crystallographica. 14 (9): 950–957. doi:10.1107/S0365110X61002771.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b «MSDS Calcium hydroxide» (PDF). Archived from the original (PDF) on 25 March 2012. Retrieved 21 June 2011.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0092». National Institute for Occupational Safety and Health (NIOSH).
- ^ Halstead, P. E.; Moore, A. E. (1957). «The Thermal Dissociation of Calcium Hydroxide». Journal of the Chemical Society. 769: 3873. doi:10.1039/JR9570003873.
- ^ a b Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Jørgensen, Uffe G. (1997), «Cool Star Models», in van Dishoeck, Ewine F. (ed.), Molecules in Astrophysics: Probes and Processes, International Astronomical Union Symposia. Molecules in Astrophysics: Probes and Processes, vol. 178, Springer Science & Business Media, p. 446, ISBN 079234538X.
- ^ a b Hopkins, Harry P.; Wulff, Claus A. (1965). «The solution thermochemistry of polyvalent electrolytes. I. Calcium hydroxide». The Journal of Physical Chemistry. 69 (1): 6–8. doi:10.1021/j100885a002. ISSN 0022-3654.
- ^ Berthelot, M. (1875). Dissolution des acides et des alcalis. [Dissolution of acids and alkalis]. In: Annales de Chimie et de Physique. Vol. 4, pp. 445–536.
- ^ Thomsen J. (1883). Thermochemische untersuchungen [Thermochemical studies]. Vol. III, Johann Ambrosius Barth Verlag, Leipzig.
- ^ Miller, L. B.; Witt, J. C. (1929). «Solubility of calcium hydroxide». The Journal of Physical Chemistry. 33 (2): 285–289. doi:10.1021/j150296a010. ISSN 0092-7325.
- ^ Johnston, John.; Grove, Clinton. (1931). «The solubility of calcium hydroxide in aqueous salt solutions». Journal of the American Chemical Society. 53 (11): 3976–3991. doi:10.1021/ja01362a009. ISSN 0002-7863.
- ^ Greenberg, S. A.; Copeland, L. E. (1960). «The thermodynamic functions for the solution of calcium hydroxide in water». The Journal of Physical Chemistry. 64 (8): 1057–1059. doi:10.1021/j100837a023. ISSN 0022-3654.
- ^ Seewald, Jeffrey S.; Seyfried, William E. (1991). «Experimental determination of portlandite solubility in H2O and acetate solutions at 100–350 °C and 500 bars: Constraints on calcium hydroxide and calcium acetate complex stability». Geochimica et Cosmochimica Acta. 55 (3): 659–669. Bibcode:1991GeCoA..55..659S. doi:10.1016/0016-7037(91)90331-X. ISSN 0016-7037.
- ^ Duchesne, J.; Reardon, E.J. (1995). «Measurement and prediction of portlandite solubility in alkali solutions». Cement and Concrete Research. 25 (5): 1043–1053. doi:10.1016/0008-8846(95)00099-X. ISSN 0008-8846.
- ^ European Union (13 May 2015). «COMMISSION IMPLEMENTING REGULATION (EU) 2015/762 of 12 May 2015 approving the basic substance calcium hydroxide in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market, and amending the Annex to Commission Implementing Regulation (EU) No 540/2011». Retrieved 12 May 2022.
- ^ Pesticide Research Institute for the USDA National Organic Program (23 March 2015). «Hydrated Lime: Technical Evaluation Report» (PDF). Agriculture Marketing Services. Retrieved 17 July 2019.
- ^ «Preparation of Mushroom Growing Substrates». North American Mycological Association. North American Mycological Association. Retrieved 8 July 2021.
- ^ de Smet, Peter A. G. M. (1985). «A multidisciplinary overview of intoxicating snuff rituals in the Western Hemisphere». Journal of Ethnopharmacology. 3 (1): 3–49. doi:10.1016/0378-8741(85)90060-1. PMID 3887041.
External links[edit]
- National Lime Association. «Properties of typical commercial lime products. Solubility of calcium hydroxide in water» (PDF). lime.org. Retrieved 18 June 2021.
- National Organic Standards Board Technical Advisory Panel (4 April 2002). «NOSB TAP Review: Calcium Hydroxide» (PDF). Organic Materials Review Institute. Archived from the original (.PDF) on 31 October 2007. Retrieved 5 February 2008.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Calcium Hydroxide
- MSDS Data Sheet
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Calcium hydroxide |
|
Other names
|
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.762 |
| EC Number |
|
| E number | E526 (acidity regulators, …) |
|
Gmelin Reference |
846915 |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Ca(OH)2 |
| Molar mass | 74.093 g/mol |
| Appearance | White powder |
| Odor | Odorless |
| Density | 2.211 g/cm3, solid |
| Melting point | 580 °C (1,076 °F; 853 K) (loses water, decomposes) |
|
Solubility in water |
|
|
Solubility product (Ksp) |
5.02×10−6 [1] |
| Solubility |
|
| Acidity (pKa) | 12.63 (first OH−), 11.57 (second OH−)[2][3] [clarification needed] |
|
Magnetic susceptibility (χ) |
−22.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.574 |
| Structure | |
|
Crystal structure |
Hexagonal, hP3[4] |
|
Space group |
P3m1 No. 164 |
|
Lattice constant |
a = 0.35853 nm, c = 0.4895 nm |
| Thermochemistry | |
|
Std molar |
83 J·mol−1·K−1[5] |
|
Std enthalpy of |
−987 kJ·mol−1[5] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H314, H335, H402 |
|
Precautionary statements |
P261, P280, P305+P351+P338 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
7340 mg/kg (oral, rat) 7300 mg/kg (mouse) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (total) 5 mg/m3 (resp.)[7] |
|
REL (Recommended) |
TWA 5 mg/m3[7] |
|
IDLH (Immediate danger) |
N.D.[7] |
| Safety data sheet (SDS) | [6] |
| Related compounds | |
|
Other cations |
Magnesium hydroxide Strontium hydroxide Barium hydroxide |
|
Related bases |
Calcium oxide |
| Supplementary data page | |
| Calcium hydroxide (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Calcium hydroxide (traditionally called slaked lime) is an inorganic compound with the chemical formula Ca(OH)2. It is a colorless crystal or white powder and is produced when quicklime (calcium oxide) is mixed with water. It has many names including hydrated lime, caustic lime, builders’ lime, slaked lime, cal, and pickling lime. Calcium hydroxide is used in many applications, including food preparation, where it has been identified as E number E526. Limewater, also called milk of lime, is the common name for a saturated solution of calcium hydroxide.
Properties[edit]
Calcium hydroxide is poorly soluble in water, with a retrograde solubility increasing from 0.66 g/L at 100 °C to 1.89 g/L at 0 °C. With a solubility product Ksp of 5.02×10−6 at 25 °C[1][clarification needed], its dissociation in water is large enough that its solutions are basic according to the following dissolution reaction:
- Ca(OH)2 → Ca2+ + 2 OH−
At ambient temperature, calcium hydroxide (portlandite) dissolves in water to produce an alkaline solution with a pH of about 12.5. Calcium hydroxide solutions can cause chemical burns. At high pH values due to a common-ion effect with the hydroxide anion, its solubility drastically decreases. This behavior is relevant to cement pastes. Aqueous solutions of calcium hydroxide are called limewater and are medium-strength bases, which react with acids and can attack some metals such as aluminium (amphoteric hydroxide dissolving at high pH), while protecting other metals, such as iron and steel, from corrosion by passivation of their surface. Limewater turns milky in the presence of carbon dioxide due to the formation of insoluble calcium carbonate, a process called carbonatation:
- Ca(OH)2 + CO2 → CaCO3 + H2O
When heated to 512 °C, the partial pressure of water in equilibrium with calcium hydroxide reaches 101 kPa (normal atmospheric pressure), which decomposes calcium hydroxide into calcium oxide and water:[8]
- Ca(OH)2 → CaO + H2O
Calcium hydroxide reacts with hydrogen chloride to first give calcium hydroxychloride and then calcium chloride.
Structure, preparation, occurrence[edit]
SEM image of fractured hardened cement paste, showing plates of calcium hydroxide and needles of ettringite (micron scale)
Calcium hydroxide adopts a polymeric structure, as do all metal hydroxides. The structure is identical to that of Mg(OH)2 (brucite structure); i.e., the cadmium iodide motif. Strong hydrogen bonds exist between the layers.[9]
Calcium hydroxide is produced commercially by treating (slaking) lime with water:
- CaO + H2O → Ca(OH)2
In the laboratory it can be prepared by mixing aqueous solutions of calcium chloride and sodium hydroxide. The mineral form, portlandite, is relatively rare but can be found in some volcanic, plutonic, and metamorphic rocks. It has also been known to arise in burning coal dumps.
The positively charged ionized species CaOH+ has been detected in the atmosphere of S-type stars.[10]
Retrograde solubility[edit]
According to Hopkins and Wulff (1965),[11] the decrease of calcium hydroxide solubility with temperature was known since the works of Marcellin Berthelot (1875)[12] and Julius Thomsen (1883)[13] (see Thomsen–Berthelot principle), when the presence of ions in aqueous solutions was still questioned. Since, it has been studied in detail by many authors, a.o., Miller and Witt (1929)[14] or Johnston and Grove (1931)[15] and refined many times (e.g., Greenberg and Copeland (1960);[16] Hopkins and Wulff (1965);[11] Seewald and Seyfried (1991);[17] Duchesne and Reardon (1995)[18]).
The reason for this rather uncommon behavior is that the dissolution of calcium hydroxide in water is an exothermic process. Thus, according to Le Chatelier’s principle, a lowering of temperature favours the elimination of the heat liberated through the process of dissolution and increases the equilibrium constant of dissolution of Ca(OH)2, and so increases its solubility at low temperature. This counter-intuitive temperature dependence of the solubility is referred to as «retrograde» or «inverse» solubility. The variably hydrated phases of calcium sulfate (gypsum, bassanite and anhydrite) also exhibit a retrograde solubility for the same reason because their dissolution reactions are exothermic.
Uses[edit]
Calcium hydroxide is commonly used to prepare lime mortar.
One significant application of calcium hydroxide is as a flocculant, in water and sewage treatment. It forms a fluffy charged solid that aids in the removal of smaller particles from water, resulting in a clearer product. This application is enabled by the low cost and low toxicity of calcium hydroxide. It is also used in fresh-water treatment for raising the pH of the water so that pipes will not corrode where the base water is acidic, because it is self-regulating and does not raise the pH too much.
It is also used in the preparation of ammonia gas (NH3), using the following reaction:
- Ca(OH)2 + 2 NH4Cl → 2 NH3 + CaCl2 + 2 H2O
Another large application is in the paper industry, where it is an intermediate in the reaction in the production of sodium hydroxide. This conversion is part of the causticizing step in the Kraft process for making pulp.[9] In the causticizing operation, burned lime is added to green liquor, which is a solution primarily of sodium carbonate and sodium sulfate produced by dissolving smelt, which is the molten form of these chemicals from the recovery furnace.
In orchard crops, calcium hydroxide is used as a fungicide. Applications of ‘lime water’ prevent the development of cankers caused by the fungal pathogen Neonectria galligena. The trees are sprayed when they are dormant in winter to prevent toxic burns from the highly reactive calcium hydroxide. This use is authorised in the European Union and the United Kingdom under Basic Substance regulations.[19]
Calcium hydroxide is used in dentistry, primarily in the specialty of endodontics.
Food industry[edit]
Because of its low toxicity and the mildness of its basic properties, slaked lime is widely used in the food industry:
- In USDA certified food production in plants and livestock[20]
- To clarify raw juice from sugarcane or sugar beets in the sugar industry, (see carbonatation)
- To process water for alcoholic beverages and soft drinks
- Pickle cucumbers and other foods
- To make Chinese century eggs
- In maize preparation: removes the cellulose hull of maize kernels (see nixtamalization)
- To clear a brine of carbonates of calcium and magnesium in the manufacture of salt for food and pharmaceutical uses
- In fortifying (Ca supplement) fruit drinks, such as orange juice, and infant formula
- As a digestive aid (called Choona, used in India in paan, a mixture of areca nuts, calcium hydroxide and a variety of seeds wrapped in betel leaves)
- As a substitute for baking soda in making papadam
- In the removal of carbon dioxide from controlled atmosphere produce storage rooms
- In the preparation of mushroom growing substrates[21]
Native American uses[edit]
Dry untreated maize (left), and treated maize (right) after boiling in water with calcium hydroxide (15 ml, or 1 tbsp, lime for 500 g of corn) for 15 minutes
In Nahuatl, the language of the Aztecs, the word for calcium hydroxide is nextli. In a process called nixtamalization, maize is cooked with nextli to become nixtamal, also known as hominy. Nixtamalization significantly increases the bioavailability of niacin (vitamin B3), and is also considered tastier and easier to digest. Nixtamal is often ground into a flour, known as masa, which is used to make tortillas and tamales.
In chewing coca leaves, calcium hydroxide is usually chewed alongside to keep the alkaloid stimulants chemically available for absorption by the body. Similarly, Native Americans traditionally chewed tobacco leaves with calcium hydroxide derived from burnt mollusc shells to enhance the effects. It has also been used by some indigenous American tribes as an ingredient in yopo, a psychedelic snuff prepared from the beans of some Anadenanthera species.[22]
Asian uses[edit]
Calcium hydroxide is typically added to a bundle of areca nut and betel leaf called «paan» to keep the alkaloid stimulants chemically available to enter the bloodstream via sublingual absorption.
It is used in making naswar (also known as nass or niswar), a type of dipping tobacco made from fresh tobacco leaves, calcium hydroxide (chuna or soon), and wood ash. It is consumed most in the Pathan diaspora, Afghanistan, Pakistan, India and Bangladesh. Villagers also use calcium hydroxide to paint their mud houses in Afghanistan, Pakistan and India.
Health risks[edit]
Unprotected exposure to Ca(OH)2 can cause severe skin irritation, chemical burns, blindness, lung damage or rashes.[6]
See also[edit]
- Baralyme (carbon dioxide absorbent)
- Cement
- Lime mortar
- Lime plaster
- Plaster
- Magnesium hydroxide (less alkaline due to a lower solubility product)
- Soda lime (carbon dioxide absorbent)
- Whitewash
References[edit]
- ^ a b John Rumble (18 June 2018). CRC Handbook of Chemistry and Physics (99 ed.). CRC Press. pp. 5–188. ISBN 978-1138561632.
- ^ «Sortierte Liste: pKb-Werte, nach Ordnungszahl sortiert. – Das Periodensystem online».
- ^ ChemBuddy dissociation constants pKa and pKb
- ^ Petch, H. E. (1961). «The hydrogen positions in portlandite, Ca(OH)2, as indicated by the electron distribution». Acta Crystallographica. 14 (9): 950–957. doi:10.1107/S0365110X61002771.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ a b «MSDS Calcium hydroxide» (PDF). Archived from the original (PDF) on 25 March 2012. Retrieved 21 June 2011.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0092». National Institute for Occupational Safety and Health (NIOSH).
- ^ Halstead, P. E.; Moore, A. E. (1957). «The Thermal Dissociation of Calcium Hydroxide». Journal of the Chemical Society. 769: 3873. doi:10.1039/JR9570003873.
- ^ a b Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Jørgensen, Uffe G. (1997), «Cool Star Models», in van Dishoeck, Ewine F. (ed.), Molecules in Astrophysics: Probes and Processes, International Astronomical Union Symposia. Molecules in Astrophysics: Probes and Processes, vol. 178, Springer Science & Business Media, p. 446, ISBN 079234538X.
- ^ a b Hopkins, Harry P.; Wulff, Claus A. (1965). «The solution thermochemistry of polyvalent electrolytes. I. Calcium hydroxide». The Journal of Physical Chemistry. 69 (1): 6–8. doi:10.1021/j100885a002. ISSN 0022-3654.
- ^ Berthelot, M. (1875). Dissolution des acides et des alcalis. [Dissolution of acids and alkalis]. In: Annales de Chimie et de Physique. Vol. 4, pp. 445–536.
- ^ Thomsen J. (1883). Thermochemische untersuchungen [Thermochemical studies]. Vol. III, Johann Ambrosius Barth Verlag, Leipzig.
- ^ Miller, L. B.; Witt, J. C. (1929). «Solubility of calcium hydroxide». The Journal of Physical Chemistry. 33 (2): 285–289. doi:10.1021/j150296a010. ISSN 0092-7325.
- ^ Johnston, John.; Grove, Clinton. (1931). «The solubility of calcium hydroxide in aqueous salt solutions». Journal of the American Chemical Society. 53 (11): 3976–3991. doi:10.1021/ja01362a009. ISSN 0002-7863.
- ^ Greenberg, S. A.; Copeland, L. E. (1960). «The thermodynamic functions for the solution of calcium hydroxide in water». The Journal of Physical Chemistry. 64 (8): 1057–1059. doi:10.1021/j100837a023. ISSN 0022-3654.
- ^ Seewald, Jeffrey S.; Seyfried, William E. (1991). «Experimental determination of portlandite solubility in H2O and acetate solutions at 100–350 °C and 500 bars: Constraints on calcium hydroxide and calcium acetate complex stability». Geochimica et Cosmochimica Acta. 55 (3): 659–669. Bibcode:1991GeCoA..55..659S. doi:10.1016/0016-7037(91)90331-X. ISSN 0016-7037.
- ^ Duchesne, J.; Reardon, E.J. (1995). «Measurement and prediction of portlandite solubility in alkali solutions». Cement and Concrete Research. 25 (5): 1043–1053. doi:10.1016/0008-8846(95)00099-X. ISSN 0008-8846.
- ^ European Union (13 May 2015). «COMMISSION IMPLEMENTING REGULATION (EU) 2015/762 of 12 May 2015 approving the basic substance calcium hydroxide in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market, and amending the Annex to Commission Implementing Regulation (EU) No 540/2011». Retrieved 12 May 2022.
- ^ Pesticide Research Institute for the USDA National Organic Program (23 March 2015). «Hydrated Lime: Technical Evaluation Report» (PDF). Agriculture Marketing Services. Retrieved 17 July 2019.
- ^ «Preparation of Mushroom Growing Substrates». North American Mycological Association. North American Mycological Association. Retrieved 8 July 2021.
- ^ de Smet, Peter A. G. M. (1985). «A multidisciplinary overview of intoxicating snuff rituals in the Western Hemisphere». Journal of Ethnopharmacology. 3 (1): 3–49. doi:10.1016/0378-8741(85)90060-1. PMID 3887041.
External links[edit]
- National Lime Association. «Properties of typical commercial lime products. Solubility of calcium hydroxide in water» (PDF). lime.org. Retrieved 18 June 2021.
- National Organic Standards Board Technical Advisory Panel (4 April 2002). «NOSB TAP Review: Calcium Hydroxide» (PDF). Organic Materials Review Institute. Archived from the original (.PDF) on 31 October 2007. Retrieved 5 February 2008.
- CDC – NIOSH Pocket Guide to Chemical Hazards – Calcium Hydroxide
- MSDS Data Sheet
| Гидроксид кальция | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид кальция |
| Отн. молек. масса | 74.093 а. е. м. |
| Молярная масса | 74.093 г/моль |
| Физические свойства | |
| Плотность вещества | 2.211 г/см³ |
| Состояние (ст. усл.) | белые кристаллы |
| Термические свойства | |
| Температура плавления | 512 °C |
| Химические свойства | |
| Растворимость в воде | 0.185 г/100 мл |
| Классификация | |
| номер CAS | [1305-62-0] |
Гидрокси́д ка́льция — химическое вещество, сильное основание, формула Ca(OH)2. Представляет собой порошок белого цвета, плохо растворимый в воде.
Содержание
- 1 Тривиальные названия
- 2 Получение
- 3 Свойства
- 4 Применение
- 5 См. также
Тривиальные названия
- гашёная известь — так как получают путём «гашения» (то есть взаимодействия с водой) «негашёной» извести оксида кальция;
- известковая вода — прозрачный (близкий к насыщенному) водный раствор;
- известковое молоко — водная суспензия.
- пушонка — сухой гидроксид кальция.
Часто называют просто известь или извёстка (так же называют и оксид кальция).
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Свойства
Внешний вид — белый порошок, мало растворимый в воде:
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет щелочную реакцию.
Как и все гидроксиды, реагирует с кислотами (см. реакция нейтрализации) с образованием соответствующих солей кальция:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O,
по этой же причине раствор гидроксида кальция мутнеет на воздухе, так как гидроксид кальция, как и другие сильные основания, реагирует с растворённым в воде углекислым газом:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Если продолжить барботацию углекислого газа, выпавший осадок растворится, так как образуется кислая соль — гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2,
причём при нагревании раствора гидрокарбонат снова разрушается и выпадает осадок карбоната кальция:
Ca(HCO3)2 →(t) CaCO3↓ + CO2↑ + H2O
Гидроксид кальция реагирует с монооксидом углерода при температуре около 400°C:
Ca(OH)2 + CO →(t) CaCO3 + H2↑
Применение
- при побелке помещений;
- для приготовления известкового строительного раствора. Известь применялась для строительной кладки с древних времён. Смесь обычно приготавливают в такой пропорции: к 1 части смеси оксида кальция (негашёной извести) с водой добавляют 3—4 части песка (по массе). При этом происходит затвердевание смеси по реакции:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Это экзотермическая реакция, выделение энергии составляет 27 ккал (113 кДж). Одновременно происходит и образование силиката кальция:
CaCO3 + SiO2 → CaSiO3 + CO2↑
Как видно из реакции, в ходе её выделяется вода. Это является отрицательным фактором, так как в помещениях, построенных с помощью известкового строительного раствора долгое время сохраняется повышенная влажность. В связи с этим, а также благодаря ряду других преимуществ перед гидроксидом кальция, цемент практически вытеснил его в качестве связующего строительных растворов;
- для приготовления силикатного бетона. Состав силикатного бетона одинаков с составом известкового строительного раствора, однако он готовится другим методом — смесь оксида кальция и кварцевого песка обрабатывается не водой, а перегретым (174,5—197,4°C) водяным паром в автоклаве при давлении 9—15 атмосфер;
- для устранения карбонатной жёсткости воды (умягчение воды). Реакция идёт по уравнению:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O;
- для производства хлорной извести;
- для производства известковых удобрений;
- каустификация карбоната натрия и калия;
- дубление кож;
- получение других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч;
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Известковая вода — прозрачный раствор гидроксида кальция. Она используется для обнаружения углекислого газа. При взаимодействии с ним она мутнеет, так как образуется нерастворимый карбонат кальция:
Ca(OH)2 + CO2 → CaCO3↓ + H2O - Известковое молоко — взвесь (суспензия) гидроксида кальция в воде, белая и непрозрачная. Она используется для производства сахара и приготовления смесей для борьбы с болезнями растений, побелки стволов
См. также
- Кальций
- Оксид кальция
- Сульфат кальция
- Карбид кальция
- Пищевые добавки
Wikimedia Foundation.
2010.
| Гидроксид кальция | |
|---|---|
| Систематическое наименование |
Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | Ca(OH)2 |
| Состояние | белые кристаллы |
| Молярная масса | 74.093 г/моль |
| Плотность | 2.211 г/см³ |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0.185 г/100 мл |
| ГОСТ | ГОСТ 9262-77 |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
| Рег. номер EINECS | 215-137-3 |
| SMILES |
[OH-].[OH-].[Ca+2] |
| InChI |
1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 AXCZMVOFGPJBDE-UHFFFAOYSA-L |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидроксид кальция (гашёная известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
Содержание
- 1 Некоторые распространённые названия
- 2 Получение
- 3 Физические свойства
- 4 Химические свойства
- 5 Применение
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
- CaO + H2O → Ca(OH)2 .
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C | Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
- Ca(OH)2 →600oC CaO + H2O .
Кристаллизуется в гексагональной кристаллической структуре.
Химические свойства
Гидроксид кальция является довольно сильным основанием, из-за чего водный раствор имеет сильнощелочную реакцию.
Как и все основания, реагирует с кислотами; как щелочь участвует в реакциях нейтрализации кислот (см. реакция нейтрализации) с образованием соответствующих солей кальция, например:
- Ca(OH)2 + H2SO4 → CaSO4↓ + 2H2O .
Реакцией нейтрализации обусловлено постепенное помутнение раствора гидроксида кальция при стоянии на воздухе, так как гидроксид кальция, взаимодействует с поглощённым из воздуха углекислым газом, как и растворы других сильных оснований, эта же реакция происходит при пропускании углекислого газа через известковую воду, — реакции качественного анализа на углекислый газ:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа через известковую воду раствор снова становится прозрачным, так как при этом образуется кислая соль — гидрокарбонат кальция, имеющий более высокую растворимость в воде, причём при нагревании раствора гидрокарбоната кальция он снова разлагается с выделением углекислого газа и при этом выпадает осадок карбоната кальция:
- CaCO3 + H2O + CO2 ⇄ Ca(HCO3)2 .
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
- Ca(OH)2 + CO →400oC CaCO3 + H2 .
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
- Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH .
Применение
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды).
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.
Гидроксид кальция – формула, количество вещества и молярная масса
На чтение 2 мин Просмотров 35
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Характеристика гидроксида кальция
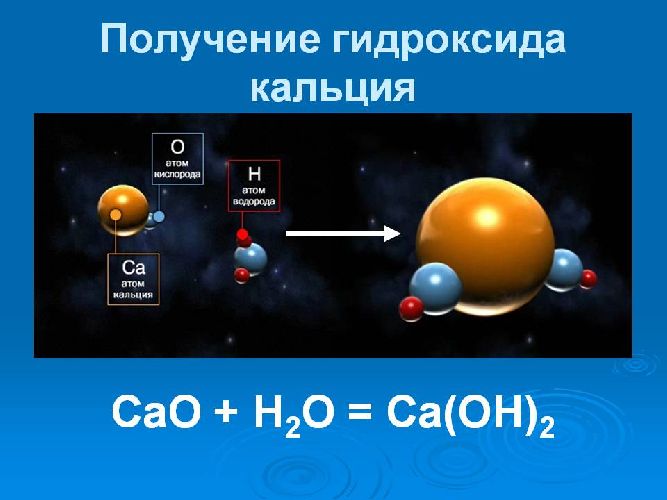
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но практически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
Рис. 1. Уравнение образование гидроксида кальция.
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.
Рис. 2. Гидроксид кальция.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:
Рис. 3. Гашеная известь.
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом:
CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Беликова Ирина
Учитель физики, информатики и вычислительной техники. Победитель конкурса лучших учителей Российской Федерации в рамках Приоритетного Национального Проекта «Образование».

Содержание
- Некоторые распространённые названия
- Получение
- Физические свойства
- Применение
Гидроксид кальция» title=»Известь»>известь, едкая) — химическое вещество с формулой Ca(OH)2, сильное основание. Представляет собой мелкокристаллический порошок белого цвета, малорастворимый в воде.
| Гидроксид кальция | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидроксид кальция |
| Традиционные названия | гашёная (едкая) известь |
| Хим. формула | Ca(OH)2 |
| Рац. формула | HO-Ca-OH |
| Физические свойства | |
| Состояние | белые кристаллы |
| Молярная масса | 74,093 г/моль |
| Плотность | 2,211 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 512 °C |
| • разложения | 580 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,185 г/100 мл |
| Классификация | |
| Рег. номер CAS | [1305-62-0] |
| PubChem | 6093208 |
| Рег. номер EINECS | 215-137-3 |
| SMILES |
[OH-].[OH-].[Ca+2] |
| InChI |
1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 AXCZMVOFGPJBDE-UHFFFAOYSA-L |
| Кодекс Алиментариус | E526 |
| RTECS | EW2800000 |
| ChEBI | 31341 |
| ChemSpider | 14094 и 21170965 |
| Безопасность | |
| NFPA 704 |
Некоторые распространённые названия
- Гашёная известь — так как её получают путём «гашения» (то есть взаимодействия с водой) «негашеной» извести (оксида кальция).
- Известковое молоко — взвесь (суспензия), образуемая при смешивании избытка гашёной извести с водой. Внешне похожа на молоко.
- Известковая вода — прозрачный бесцветный раствор гидроксида кальция, получаемый при фильтровании или отстаивании известкового молока.
- Известь-пушонка — при гашении негашёной извести ограниченным количеством воды образуется белый рассыпающийся мелкокристаллический пылевидный порошок.
Получение
Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
Эта реакция сильно экзотермическая, происходит с выделением 16 ккал на моль (67 кДж на моль).
Физические свойства
| Температура, °C |
Растворимость, г Ca(OH)2/100 г H2O |
|---|---|
| 0 | 0,173 |
| 20 | 0,166 |
| 50 | 0,13 |
| 100 | 0,08 |
По внешнему виду представляет собой белый порошок, малорастворимый в воде. Растворимость в воде падает с ростом температуры.
При нагреве вещества до температуры 512 °C парциальное давление водяного пара, находящегося в равновесии с гидроксидом кальция становится равным атмосферному давлению (101,325 кПа) и гидроксид кальция начинает терять воду, превращаясь в оксид кальция, при температуре 600 °C процесс потери воды практически полностью завершается:
Гидроксид кальция реагирует с оксидом углерода при температуре около 400 °C:
Реагирует с некоторыми солями, но реакция происходит только в том случае, если в результате реакции одно из образующихся веществ плохо растворимое и выпадает в осадок, например:
Применение
- Известковое молоко применяется при побелке стен, заборов, стволов деревьев.
- Для приготовления известкового строительного раствора. Гашёная известь применялась для строительной каменной кладки с древних времён. Такой строительный раствор обычно состоит по массе из одной части гашёной извести и трёх-четырёх частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси происходит химическая реакция компонентов с образованием силикатов кальция, в этой реакции выделяется вода. Это является недостатком такого раствора, так как в помещениях, построенных с применением такого раствора, долгое время сохраняется повышенная влажность. В том числе поэтому в современном строительстве цемент практически полностью вытеснил гашёную известь как связующее в строительных растворах.
- Для приготовления силикатного бетона и силикатного кирпича. Состав силикатного бетона аналогичен составу известкового строительного раствора, однако его отвердевание происходит на несколько порядков быстрее, так как смесь гашёной извести и кварцевого песка обрабатывают перегретым (174—197 °C) водяным паром в автоклаве при повышенном давлении 9—15 атмосфер.
- Для устранения карбонатной жёсткости воды (умягчение воды).
- Для производства хлорной извести.
- Для производства известковых удобрений и снижения кислотности кислых почв.
- В производстве методом каустификации соды и поташа.
- При дублении кож.
- Для получения других соединений кальция, нейтрализация кислых растворов (в том числе сточных вод производств), получение органических кислот и проч.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E526.
- Как реактив качественной реакции на углекислый газ.
- Известковое молоко — суспензия гидроксида кальция в воде используется для рафинирования сахара в сахарном производстве.
- В Латинской Америке в известковом молоке отваривают зёрна кукурузы для размягчения мякины, активизации клейковины и улучшения перевариваемости — т. н. «никстамализация».
- Для приготовления смесей для борьбы с болезнями и вредителями растений, например, входит в состав классического фунгицида — бордоской жидкости.
- В стоматологии для дезинфекции корневых каналов зубов.
- В электротехнике — при устройстве заземления в грунтах с высоким электрическим сопротивлением — в качестве добавки в грунт, для снижения удельного электрического сопротивления грунта.