Физические свойства
Оксид натрия Na2O — бинарное неорганическое вещество. Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород:
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
2Na2O2 = 2Na2O + O2
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Na2O2 + 2Na = 2Na2O
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами:
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия:
2Na2O + O2 = 2Na2O2
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой. Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
Na2O + CO2 = Na2CO3
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
Na2O + NO + NO2 = 2NaNO2
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Na2O + Al2O3 = 2NaAlO2
| Оксид натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Традиционные названия | окись натрия, натр |
| Хим. формула | Na2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| Номер ООН | 1825 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 |
0 3 3
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O. Типичный представитель основных оксидов. Бурно реагирует с водой.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 80 % оксида натрия и 20 % пероксида натрия:
-
- [math]displaystyle{ mathsf{6 Na + 2 O_2 longrightarrow 2 Na_2O + Na_2O_2} }[/math]
2. Взаимодействие металлического натрия с нитратом натрия:
-
- [math]displaystyle{ mathsf{10 Na + 2 NaNO_3 longrightarrow 6 Na_2O + N_2} }[/math]
3. Прокаливание пероксида натрия с избытком натрия:
-
- [math]displaystyle{ mathsf{Na_2O_2 + 2 Na longrightarrow 2 Na_2O} }[/math]
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
[math]ce{ NaHCO_3 ->[{T = 200}][{H_2O + CO_2}] Na_2CO3->[{T=1000}][{CO_2}] Na_2O }[/math]
5. Разложением нитрита натрия.
[math]displaystyle{ mathsf{4NaNO_2 rightarrow 2Na_2O + 4NO + O_2} }[/math]
Химические свойства
1. При нагревании разлагается до пероксида натрия[2]:
-
- [math]displaystyle{ mathsf{2Na_2O xrightarrow{700^oC} Na_2O_2 + 2Na} }[/math]
2. Взаимодействие с водой с образованием щёлочи:
-
- [math]displaystyle{ mathsf{Na_2O + H_2O longrightarrow 2 NaOH} }[/math]
- Данная реакция сильно экзотермична, вода при реакции с окисью натрия закипает.
3. Взаимодействие с кислотными оксидами с образованием соли:
-
- [math]displaystyle{ mathsf{Na_2O + CO_2 xrightarrow{450-550^oC} Na_2CO_3} }[/math]
4. Взаимодействие с кислотами с образованием соли и воды:
-
- [math]displaystyle{ mathsf{Na_2O + 2 HCl longrightarrow 2 NaCl + H_2O} }[/math]
5. Взаимодействие с жидким аммиаком с образованием амида:
-
- [math]displaystyle{ mathsf{Na_2O + NH_3 xrightarrow{-50^oC} NaNH_2 + NaOH} }[/math]
6. Окисление кислородом до пероксида[2]:
-
- [math]displaystyle{ mathsf{2Na_2O + O_2 xrightarrow{250-350^oC, p} 2Na_2O_2} }[/math]
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия, динептуната(VI) натрия и других веществ[1].
Примечания
- ↑ 1,0 1,1 [www.xumuk.ru/encyklopedia/2/2773.html XuMuK.Ru — сайт о химии]
- ↑ 2,0 2,1 Лидин, 2000, с. 20.
Литература
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
From Wikipedia, the free encyclopedia
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium oxide |
||
| Other names
Disodium oxide |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ECHA InfoCard | 100.013.827 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| UNII |
|
|
| UN number | 1825 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Na2O | |
| Molar mass | 61.979 g·mol−1 | |
| Appearance | white solid | |
| Density | 2.27 g/cm3 | |
| Melting point | 1,132 °C (2,070 °F; 1,405 K) | |
| Boiling point | 1,950 °C (3,540 °F; 2,220 K) sublimates | |
|
Sublimation |
sublimates at 1275 °C | |
|
Solubility in water |
Reacts to form NaOH | |
| Solubility | Reacts with ethanol | |
|
Magnetic susceptibility (χ) |
−19.8·10−6 cm3/mol | |
| Structure | ||
|
Crystal structure |
Antifluorite (face centered cubic), cF12 | |
|
Space group |
Fm3m, No. 225 | |
|
Coordination geometry |
Tetrahedral (Na+); cubic (O2−) | |
| Thermochemistry | ||
|
Heat capacity (C) |
72.95 J/(mol·K) | |
|
Std molar |
73 J/(mol·K)[1] | |
|
Std enthalpy of |
−416 kJ/mol[1] | |
|
Gibbs free energy (ΔfG⦵) |
−377.1 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
corrosive, reacts violently with water | |
| GHS labelling: | ||
|
Pictograms |
 [2] [2]
|
|
|
Hazard statements |
H314 | |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| NFPA 704 (fire diamond) |
3 0 1
|
|
| Flash point | nonflammable | |
| Safety data sheet (SDS) | ICSC 1653 | |
| Related compounds | ||
|
Other anions |
Sodium sulfide Sodium selenide Sodium telluride Sodium polonide |
|
|
Other cations |
Lithium oxide Potassium oxide Rubidium oxide Caesium oxide |
|
|
Related sodium oxides |
Sodium peroxide Sodium superoxide Sodium ozonide |
|
|
Related compounds |
Sodium hydroxide | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium oxide is a chemical compound with the formula Na2O. It is used in ceramics and glasses. It is a white solid but the compound is rarely encountered. Instead «sodium oxide» is used to describe components of various materials such as glasses and fertilizers which contain oxides that include sodium and other elements.
Structure[edit]
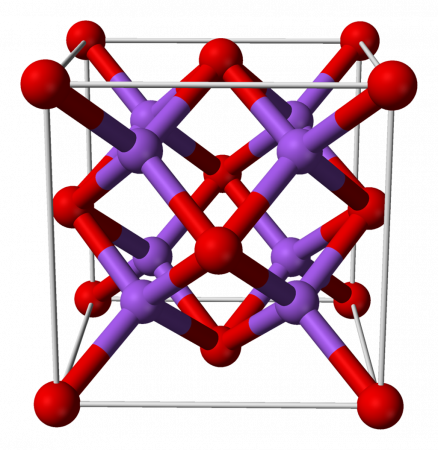
The structure of sodium oxide has been determined by X-ray crystallography. Most alkali metal oxides M2O (M = Li, Na, K, Rb) crystallise in the antifluorite structure. In this motif the positions of the anions and cations are reversed relative to their positions in CaF2, with sodium ions tetrahedrally coordinated to 4 oxide ions and oxide cubically coordinated to 8 sodium ions.[3][4]
Preparation[edit]
Sodium oxide is produced by the reaction of sodium with sodium hydroxide, sodium peroxide, or sodium nitrite:[5]
- 2 NaOH + 2 Na → 2 Na2O + H2
To the extent that NaOH is contaminated with water, correspondingly greater amounts of sodium are employed. Excess sodium is distilled from the crude product.[6]
A second method involves heating a mixture of sodium azide and sodium nitrate:[6]
- 5 NaN3 + NaNO3 → 3 Na2O + 8 N2
Burning sodium in air produces a mixture of Na2O and sodium peroxide (Na2O2).
Applications[edit]
Glassmaking[edit]
Glasses are often described in terms of their sodium oxide content although they do not really contain Na2O. Furthermore, such glasses are not made from sodium oxide, but the equivalent of Na2O is added in the form of «soda» (sodium carbonate), which loses carbon dioxide at high temperatures:
- Na2CO3 → Na2O + CO2
- Na2O + SiO2 → Na2SiO3
- Na2CO3 + SiO2 → Na2SiO3 + CO2
A typical manufactured glass contains around 15% sodium oxide, 70% silica (silicon dioxide), and 9% lime (calcium oxide). The sodium carbonate «soda» serves as a flux to lower the temperature at which the silica mixture melts. Such soda-lime glass has a much lower melting temperature than pure silica and has slightly higher elasticity. These changes arise because the Na2[SiO2]x[SiO3]-based material is somewhat more flexible.
Reactions[edit]
Sodium oxide reacts readily and irreversibly with water to give sodium hydroxide:
- Na2O + H2O → 2 NaOH
Because of this reaction, sodium oxide is sometimes referred to as the base anhydride of sodium hydroxide (more archaically, «anhydride of caustic soda»).
References[edit]
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ Sigma-Aldrich Co., Sodium oxide. Retrieved on 2014-05-25.
- ^ Zintl, E.; Harder, A.; Dauth B. (1934). «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 40 (8): 588–93. doi:10.1002/bbpc.19340400811. S2CID 94213844.
- ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press ISBN 0-19-855370-6
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b E. Dönges (1963). «Sodium Oxide (IV)». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 1pages=975-6. NY,NY: Academic Press.
From Wikipedia, the free encyclopedia
|
||
| Names | ||
|---|---|---|
| IUPAC name
Sodium oxide |
||
| Other names
Disodium oxide |
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| ECHA InfoCard | 100.013.827 |
|
| EC Number |
|
|
|
PubChem CID |
|
|
| UNII |
|
|
| UN number | 1825 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
Na2O | |
| Molar mass | 61.979 g·mol−1 | |
| Appearance | white solid | |
| Density | 2.27 g/cm3 | |
| Melting point | 1,132 °C (2,070 °F; 1,405 K) | |
| Boiling point | 1,950 °C (3,540 °F; 2,220 K) sublimates | |
|
Sublimation |
sublimates at 1275 °C | |
|
Solubility in water |
Reacts to form NaOH | |
| Solubility | Reacts with ethanol | |
|
Magnetic susceptibility (χ) |
−19.8·10−6 cm3/mol | |
| Structure | ||
|
Crystal structure |
Antifluorite (face centered cubic), cF12 | |
|
Space group |
Fm3m, No. 225 | |
|
Coordination geometry |
Tetrahedral (Na+); cubic (O2−) | |
| Thermochemistry | ||
|
Heat capacity (C) |
72.95 J/(mol·K) | |
|
Std molar |
73 J/(mol·K)[1] | |
|
Std enthalpy of |
−416 kJ/mol[1] | |
|
Gibbs free energy (ΔfG⦵) |
−377.1 kJ/mol | |
| Hazards | ||
| Occupational safety and health (OHS/OSH): | ||
|
Main hazards |
corrosive, reacts violently with water | |
| GHS labelling: | ||
|
Pictograms |
 [2] [2]
|
|
|
Hazard statements |
H314 | |
|
Precautionary statements |
P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 | |
| NFPA 704 (fire diamond) |
3 0 1
|
|
| Flash point | nonflammable | |
| Safety data sheet (SDS) | ICSC 1653 | |
| Related compounds | ||
|
Other anions |
Sodium sulfide Sodium selenide Sodium telluride Sodium polonide |
|
|
Other cations |
Lithium oxide Potassium oxide Rubidium oxide Caesium oxide |
|
|
Related sodium oxides |
Sodium peroxide Sodium superoxide Sodium ozonide |
|
|
Related compounds |
Sodium hydroxide | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Sodium oxide is a chemical compound with the formula Na2O. It is used in ceramics and glasses. It is a white solid but the compound is rarely encountered. Instead «sodium oxide» is used to describe components of various materials such as glasses and fertilizers which contain oxides that include sodium and other elements.
Structure[edit]
The structure of sodium oxide has been determined by X-ray crystallography. Most alkali metal oxides M2O (M = Li, Na, K, Rb) crystallise in the antifluorite structure. In this motif the positions of the anions and cations are reversed relative to their positions in CaF2, with sodium ions tetrahedrally coordinated to 4 oxide ions and oxide cubically coordinated to 8 sodium ions.[3][4]
Preparation[edit]
Sodium oxide is produced by the reaction of sodium with sodium hydroxide, sodium peroxide, or sodium nitrite:[5]
- 2 NaOH + 2 Na → 2 Na2O + H2
To the extent that NaOH is contaminated with water, correspondingly greater amounts of sodium are employed. Excess sodium is distilled from the crude product.[6]
A second method involves heating a mixture of sodium azide and sodium nitrate:[6]
- 5 NaN3 + NaNO3 → 3 Na2O + 8 N2
Burning sodium in air produces a mixture of Na2O and sodium peroxide (Na2O2).
Applications[edit]
Glassmaking[edit]
Glasses are often described in terms of their sodium oxide content although they do not really contain Na2O. Furthermore, such glasses are not made from sodium oxide, but the equivalent of Na2O is added in the form of «soda» (sodium carbonate), which loses carbon dioxide at high temperatures:
- Na2CO3 → Na2O + CO2
- Na2O + SiO2 → Na2SiO3
- Na2CO3 + SiO2 → Na2SiO3 + CO2
A typical manufactured glass contains around 15% sodium oxide, 70% silica (silicon dioxide), and 9% lime (calcium oxide). The sodium carbonate «soda» serves as a flux to lower the temperature at which the silica mixture melts. Such soda-lime glass has a much lower melting temperature than pure silica and has slightly higher elasticity. These changes arise because the Na2[SiO2]x[SiO3]-based material is somewhat more flexible.
Reactions[edit]
Sodium oxide reacts readily and irreversibly with water to give sodium hydroxide:
- Na2O + H2O → 2 NaOH
Because of this reaction, sodium oxide is sometimes referred to as the base anhydride of sodium hydroxide (more archaically, «anhydride of caustic soda»).
References[edit]
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ Sigma-Aldrich Co., Sodium oxide. Retrieved on 2014-05-25.
- ^ Zintl, E.; Harder, A.; Dauth B. (1934). «Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums». Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 40 (8): 588–93. doi:10.1002/bbpc.19340400811. S2CID 94213844.
- ^ Wells, A. F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press ISBN 0-19-855370-6
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b E. Dönges (1963). «Sodium Oxide (IV)». In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 1pages=975-6. NY,NY: Academic Press.
Физические свойства
Оксид натрия Na2O — бинарное неорганическое вещество. Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород:
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
2Na2O2 = 2Na2O + O2
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Na2O2 + 2Na = 2Na2O
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами:
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия:
2Na2O + O2 = 2Na2O2
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой. Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
Na2O + CO2 = Na2CO3
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
Na2O + NO + NO2 = 2NaNO2
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Na2O + Al2O3 = 2NaAlO2
Как получить оксид натрия
Оксид натрия имеет химическую формулу Na2O, представляет собою бесцветные кристаллы. Характерный представитель оксидов щелочных металлов, обладает всеми их свойствами. Исключительно активен, поэтому хранить его рекомендуется в безводных органических растворителях. Как получить это вещество?

Инструкция
Казалось бы, самый простой и естественный способ – окисление кислородом металлического натрия! Однако тут есть своя специфика. Дело в том, что окисление щелочных металлов протекает так бурно и быстро, что при этом наряду с оксидами образуются перекиси. Например:
2Na + O2 = Na2O2 (перекись натрия).
Причем ее образуется гораздо больше, чем оксида натрия (в соотношении примерно 4:1). И для того, чтобы превратить перекись в оксид натрия, потребуется осторожный нагрев в присутствии металлического натрия. Реакция идет таким образом:
Na2O2 + 2Na = 2Na2O
Поэтому используют другие способы получения этого вещества. Например, путем реакции металлического натрия с натрием азотнокислым (нитратом натрия, натриевой селитрой). Она протекает так:
2NaNO3 + 10Na = 6Na2O + N2В ходе этой реакции металлический натрий восстанавливает азот, имеющий в нитрат-ионе степень окисления +5, до чистого азота.
Оксид натрия можно получить также путем прокаливания натрия углекислого (карбоната) при высоких температурах (не ниже 1000 градусов). Реакция идет следующим образом:
Na2CO3 = Na2O + CO2
Весьма экзотический и к тому же небезопасный, поэтому не рекомендуемый способ получения этого вещества: нагреванием смеси азид натрия – нитрат натрия в вакууме, при температуре не ниже 350 градусов. Реакция протекает так:
5NaN3 + NaNO3 = 8N2+3Na2O
Обратите внимание
Учитывая, что все азиды – взрывоопасные вещества, эту реакцию можно проводить, только имея большой опыт обращения с подобными соединениями! Но лучше воздержаться.
Полезный совет
Бурно реагирует с водой, образуя раствор гидроксида натрия (едкого натра):
Na2O + H2O = 2NaOH
Легко вступает в реакцию с кислотами, образуя соль и воду:
Na2O + H2SO4 = Na2SO4 + H2O
Реагирует с кислотными оксидами, образуя соль:
Na2O + CO2 = Na2CO3
Используется главным образом в лабораторной практике, для демонстрационных опытов, а также в качестве реактива. Иногда применяется в производстве масел, в качестве катализатора.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
| Оксид натрия | |
|---|---|
 |
|
 |
|
| Общие | |
| Традиционные названия | окись натрия, натр |
| Хим. формула | Na2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| Номер ООН | 1825 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 |
0 3 3
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O. Типичный представитель основных оксидов. Бурно реагирует с водой.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 80 % оксида натрия и 20 % пероксида натрия:
-
- [math]displaystyle{ mathsf{6 Na + 2 O_2 longrightarrow 2 Na_2O + Na_2O_2} }[/math]
2. Взаимодействие металлического натрия с нитратом натрия:
-
- [math]displaystyle{ mathsf{10 Na + 2 NaNO_3 longrightarrow 6 Na_2O + N_2} }[/math]
3. Прокаливание пероксида натрия с избытком натрия:
-
- [math]displaystyle{ mathsf{Na_2O_2 + 2 Na longrightarrow 2 Na_2O} }[/math]
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
[math]ce{ NaHCO_3 ->[{T = 200}][{H_2O + CO_2}] Na_2CO3->[{T=1000}][{CO_2}] Na_2O }[/math]
5. Разложением нитрита натрия.
[math]displaystyle{ mathsf{4NaNO_2 rightarrow 2Na_2O + 4NO + O_2} }[/math]
Химические свойства
1. При нагревании разлагается до пероксида натрия[2]:
-
- [math]displaystyle{ mathsf{2Na_2O xrightarrow{700^oC} Na_2O_2 + 2Na} }[/math]
2. Взаимодействие с водой с образованием щёлочи:
-
- [math]displaystyle{ mathsf{Na_2O + H_2O longrightarrow 2 NaOH} }[/math]
- Данная реакция сильно экзотермична, вода при реакции с окисью натрия закипает.
3. Взаимодействие с кислотными оксидами с образованием соли:
-
- [math]displaystyle{ mathsf{Na_2O + CO_2 xrightarrow{450-550^oC} Na_2CO_3} }[/math]
4. Взаимодействие с кислотами с образованием соли и воды:
-
- [math]displaystyle{ mathsf{Na_2O + 2 HCl longrightarrow 2 NaCl + H_2O} }[/math]
5. Взаимодействие с жидким аммиаком с образованием амида:
-
- [math]displaystyle{ mathsf{Na_2O + NH_3 xrightarrow{-50^oC} NaNH_2 + NaOH} }[/math]
6. Окисление кислородом до пероксида[2]:
-
- [math]displaystyle{ mathsf{2Na_2O + O_2 xrightarrow{250-350^oC, p} 2Na_2O_2} }[/math]
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия, динептуната(VI) натрия и других веществ[1].
Примечания
- ↑ 1,0 1,1 [www.xumuk.ru/encyklopedia/2/2773.html XuMuK.Ru — сайт о химии]
- ↑ 2,0 2,1 Лидин, 2000, с. 20.
Литература
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
| Оксид натрия | |
|---|---|
 |
|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
-
- 4 Na + O2 ⟶ 2Na2O
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
-
- 6 Na + 2 O2 ⟶ 2Na2O + Na2O2
2. Взаимодействие металлического натрия с нитратом натрия:
-
- 10 Na + 2NaNO3 ⟶ 6Na2O + N2
3. Прокаливание пероксида натрия с избытком натрия:
-
- Na2O2 + 2 Na ⟶ 2Na2O
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
-
- Na2O + H2O ⟶ 2 NaOH
2. Взаимодействие с кислотными оксидами с образованием соли:
-
- Na2O + CO2 ⟶ Na2CO3
3. Взаимодействие с кислотами с образованием соли и воды:
-
- Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Поиск химических веществ по названиям или формулам.
Что мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше.
Оксид натрия
Из Википедии — свободной энциклопедии
Окси́д на́трия (окись натрия) — бинарное неорганическое бесцветное вещество, имеющее химическую формулу Na2O. Типичный представитель основных оксидов. Бурно реагирует с водой.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 80 % оксида натрия и 20 % пероксида натрия:
2. Взаимодействие металлического натрия с нитратом натрия:
3. Прокаливание пероксида натрия с избытком натрия:
4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
![{displaystyle {ce {NaHCO_{3}->[{T=200}][{H_{2}O+CO_{2}}]Na_{2}CO3->[{T=1000}][{CO_{2}}]Na_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a8745afe18b26884d2274af7ff87d73943dfbabd)
5. Разложением нитрита натрия.

Химические свойства
1. При нагревании разлагается до пероксида натрия[2]:
2. Взаимодействие с водой с образованием щёлочи:
-
- Данная реакция сильно экзотермична, вода при реакции с окисью натрия закипает.
3. Взаимодействие с кислотными оксидами с образованием соли:
4. Взаимодействие с кислотами с образованием соли и воды:
5. Взаимодействие с жидким аммиаком с образованием амида:
6. Окисление кислородом до пероксида[2]:
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия, динептуната(VI) натрия и других веществ[1].
Примечания
- ↑ 1 2 [www.xumuk.ru/encyklopedia/2/2773.html XuMuK.Ru — сайт о химии]
- ↑ 1 2 Лидин, 2000, с. 20.
Литература
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
| п • <abbr title=»Обсуждение этого шаблона»>о</abbr> • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Эта страница в последний раз была отредактирована 7 декабря 2022 в 19:48.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
Оксид натрия
Окси́д на́трия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
| Оксид натрия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Термические свойства | |
| Т. плав. | 1132 °C |
| Т. кип. | 1950 °C |
| Энтальпия образования | −416 кДж/моль |
| Классификация | |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Безопасность | |
| Токсичность |
0 3 3
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии[1]. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:

Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:

2. Взаимодействие металлического натрия с нитратом натрия:

3. Прокаливание пероксида натрия с избытком натрия:

4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:

2. Взаимодействие с кислотными оксидами с образованием соли:

3. Взаимодействие с кислотами с образованием соли и воды:

Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ[1].
Примечания
- ↑ 1 2 XuMuK.Ru — сайт о химии
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
| Оксид натрия | |
|---|---|
 |
|
| Систематическое наименование |
Оксид натрия |
| Традиционные названия | Окись натрия |
| Хим. формула | Na2O |
| Рац. формула | Na2O |
| Состояние | твёрдое |
| Молярная масса | 61,979 г/моль |
| Плотность | 2,27 (20 °C) |
| Температура | |
| • плавления | 1132 °C |
| • кипения | 1950 °C |
| Энтальпия | |
| • образования | −416 кДж/моль |
| Рег. номер CAS | 1313-59-3 |
| PubChem | 73971 |
| Рег. номер EINECS | 215-208-9 |
| SMILES |
[O-2].[Na+].[Na+] |
| InChI |
1S/2Na.O/q2*+1;-2 KKCBUQHMOMHUOY-UHFFFAOYSA-N |
| Номер ООН | 1825 |
| ChemSpider | 66599 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид натрия — бинарное неорганическое вещество, имеющее формулу Na2O и относящееся к классу основных оксидов.
Описание
Оксид натрия представляет собой бесцветные кристаллы кубической сингонии. Хранить оксид натрия Na2O лучше всего в безводном бензоле.
Получение
1. Взаимодействие металлического натрия с кислородом:
-
- 4 Na + O2 ⟶ 2Na2O
Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:
-
- 6 Na + 2 O2 ⟶ 2Na2O + Na2O2
2. Взаимодействие металлического натрия с нитратом натрия:
-
- 10 Na + 2NaNO3 ⟶ 6Na2O + N2
3. Прокаливание пероксида натрия с избытком натрия:
-
- Na2O2 + 2 Na ⟶ 2Na2O
Химические свойства
1. Взаимодействие с водой с образованием щёлочи:
-
- Na2O + H2O ⟶ 2 NaOH
2. Взаимодействие с кислотными оксидами с образованием соли:
-
- Na2O + CO2 ⟶ Na2CO3
3. Взаимодействие с кислотами с образованием соли и воды:
-
- Na2O + 2 HCl ⟶ 2 NaCl + H2O
Применение
Оксид натрия применяется, в основном, в качестве реактива для различных синтезов, для приготовления гидроксида натрия и других веществ.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Оксид натрия
Брутто-формула:
Na2O
CAS# 1313-59-3
Категории:
Оксиды
PubChem CID: 73971
| ChemSpider ID: 66599
Названия
Русский:
- Окись натрия
- Оксид натрия [Wiki]
English:
- EINECS:215-208-9
- Sodium oxide [Wiki]
- disodium;oxygen(2-)(IUPAC)
German:
- Dinatriumoxid
- Natriummonoxid
- Natriumoxid [Wiki]
العربية:
- أكسيد الصوديوم(IUPAC) [Wiki]
- أكسيد ثنائي الصوديوم(IUPAC)
Español:
- Óxido de sodio(IUPAC) [Wiki]
French:
- Oxyde de sodium(IUPAC) [Wiki]
Italiano:
- Monossido di sodio
- Monossido disodico
- Ossido di disodio(IUPAC)
- Ossido di sodio [Wiki]
- Ossido disodico
日本語:
- 酸化ナトリウム(IUPAC) [Wiki]
Português:
- Óxido de sódio(IUPAC) [Wiki]
中文:
- 氧化钠 [Wiki]
Варианты формулы:
Na2O
Na-O-Na
NaO/Na
Na^+$L(1.5)O^2-/0Na^+
Химический состав
Реакции, в которых участвует Оксид натрия
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
{M}2O + H2O -> 2{M}OH
, где M =
Li Na K Rb Cs -
{M}2O + 2H{X} = 2{M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 ClO4 BrO4 -
10Na + 2NaNO3 -> 6Na2O + N2
-
2NaNO2 + 6Na -> 4Na2O + N2
И ещё 19 реакций…









