| Сульфат алюминия | |
|---|---|
 |
|
| Традиционные названия | сернокислый алюминий |
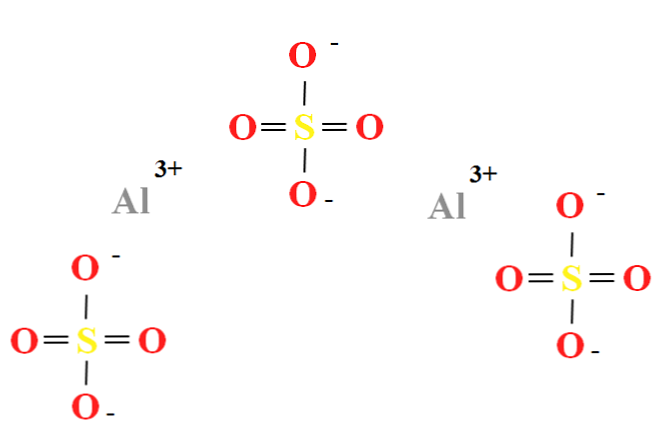
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Температура | |
| • плавления | 700 °C |
| • кипения | 1600 °C |
| • разложения | 580 °C |
| ГОСТ | ГОСТ 3758-75 |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат алюминия — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре.
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид:
- Al2(SO4)3 →580∘C Al2O3 + 3 SO3
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины.
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
- 2 Al(OH)3 + 3 H2SO4 ⟶ Al2(SO4)3 + 6 H2O
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
- 2 Al + 3 H2SO4 ⟶ Al2(SO4)3 + 3 H2
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520.
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей.
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Aluminium sulfate |
|
| Other names
Aluminum sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.110 |
| EC Number |
|
| E number | E520 (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
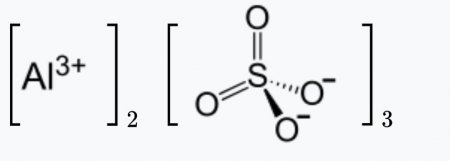
Al2(SO4)3 |
| Molar mass | 342.15 g/mol (anhydrous) 666.44 g/mol (octadecahydrate) |
| Appearance | white crystalline solid hygroscopic |
| Density | 2.672 g/cm3 (anhydrous) 1.62 g/cm3 (octadecahydrate) |
| Melting point | 770 °C (1,420 °F; 1,040 K) (decomposes, anhydrous) 86.5 °C (octadecahydrate) |
|
Solubility in water |
31.2 g/100 mL (0 °C) 36.4 g/100 mL (20 °C) 89.0 g/100 mL (100 °C) |
| Solubility | slightly soluble in alcohol, dilute mineral acids |
| Acidity (pKa) | 3.3–3.6 |
|
Magnetic susceptibility (χ) |
−93.0×10−6 cm3/mol |
|
Refractive index (nD) |
1.47[1] |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Thermochemistry | |
|
Std enthalpy of |
-3440 kJ/mol |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[2] |
|
REL (Recommended) |
2 mg/m3[2] |
|
IDLH (Immediate danger) |
N.D.[2] |
| Related compounds | |
|
Other cations |
Gallium sulfate Magnesium sulfate |
|
Related compounds |
See Alum |
| Supplementary data page | |
| Aluminium sulfate (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium sulfate is a salt with the formula Al2(SO4)3. It is soluble in water and is mainly used as a coagulating agent (promoting particle collision by neutralizing charge) in the purification of drinking water[3][4] and wastewater treatment plants, and also in paper manufacturing.
The anhydrous form occurs naturally as a rare mineral millosevichite, found for example in volcanic environments and on burning coal-mining waste dumps. Aluminium sulfate is rarely, if ever, encountered as the anhydrous salt. It forms a number of different hydrates, of which the hexadecahydrate Al2(SO4)3·16H2O and octadecahydrate Al2(SO4)3·18H2O are the most common. The heptadecahydrate, whose formula can be written as [Al(H2O)6]2(SO4)3·5H2O, occurs naturally as the mineral alunogen.
Aluminium sulfate is sometimes called alum or papermaker’s alum in certain industries. However, the name «alum» is more commonly and properly used for any double sulfate salt with the generic formula XAl(SO
4)
2·12H
2O, where X is a monovalent cation such as potassium or ammonium.[5]
Production[edit]
In the laboratory[edit]
Aluminium sulfate may be made by adding aluminium hydroxide, Al(OH)3, to sulfuric acid, H2SO4:
> + 3 H2SO4 → Al2(SO4)3 + 6 H2O
or by heating aluminium metal in a sulfuric acid solution:
- 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2↑
From alum schists[edit]
The alum schists employed in the manufacture of aluminium sulfate are mixtures of iron pyrite, aluminium silicate and various bituminous substances, and are found in upper Bavaria, Bohemia, Belgium, and Scotland. These are either roasted or exposed to the weathering action of the air. In the roasting process, sulfuric acid is formed and acts on the clay to form aluminium sulfate, a similar condition of affairs being produced during weathering. The mass is now systematically extracted with water, and a solution of aluminium sulfate of specific gravity 1.16 is prepared. This solution is allowed to stand for some time (in order that any calcium sulfate and basic iron(III) sulfate may separate), and is then evaporated until iron(II) sulfate crystallizes on cooling; it is then drawn off and evaporated until it attains a specific gravity of 1.40. It is now allowed to stand for some time, and decanted from any sediment.[6]
From clays or bauxite[edit]
In the preparation of aluminium sulfate from clays or from bauxite, the material is gently calcined, then mixed with sulfuric acid and water and heated gradually to boiling; if concentrated acid is used no external heat is generally required as the formation of aluminium sulfate is exothermic. It is allowed to stand for some time, and the clear solution is drawn off.
From cryolite[edit]
When cryolite is used as the ore, it is mixed with calcium carbonate and heated. By this means, sodium aluminate is formed; it is then extracted with water and precipitated either by sodium bicarbonate or by passing a current of carbon dioxide through the solution. The precipitate is then dissolved in sulfuric acid.[6]
Uses[edit]
Sediment core sampled from a Minnesota lake. Aluminium sulfate flocs are depicted as white clumps near the sediment surface.
Aluminium sulfate is sometimes used in the human food industry as a firming agent, where it takes on E number E520, and in animal feed as a bactericide. In the USA, the FDA lists it as «generally recognized as safe» with no limit on concentration.[7] Aluminium sulfate may be used as a deodorant, an astringent, or as a styptic for superficial shaving wounds.[8] Aluminium sulfate is used as a mordant in dyeing and printing textiles.
It is a common vaccine adjuvant and works «by facilitating the slow release of antigen from the vaccine depot formed at the site of inoculation.»[8]
Aluminium sulfate is used in water purification and for chemical phosphorus removal from wastewater. It causes suspended impurities to coagulate into larger particles and then settle to the bottom of the container (or be filtered out) more easily. This process is called coagulation or flocculation. Research suggests that in Australia, aluminium sulfate used in this way in drinking water treatment is the primary source of hydrogen sulfide gas in sanitary sewer systems.[9] An improper and excess application incident in 1988 polluted the water supply of Camelford in Cornwall.
Aluminium sulfate has been used as a method of eutrophication remediation for shallow lakes. It works by reducing the phosphorus load in the lakes.[10][11]
When dissolved in a large amount of neutral or slightly alkaline water, aluminium sulfate produces a gelatinous precipitate of aluminium hydroxide, Al(OH)3. In dyeing and printing cloth, the gelatinous precipitate helps the dye adhere to the clothing fibers by rendering the pigment insoluble.
Aluminium sulfate is sometimes used to reduce the pH of garden soil, as it hydrolyzes to form the aluminium hydroxide precipitate and a dilute sulfuric acid solution. An example of what changing the pH level of soil can do to plants is visible when looking at Hydrangea macrophylla. The gardener can add aluminium sulfate to the soil to reduce the pH which in turn will result in the flowers of the Hydrangea turning a different color (blue). The aluminium is what makes the flowers blue; at a higher pH, the aluminium is not available to the plant.[12]
In the construction industry, it is used as waterproofing agent and accelerator in concrete. Another use is a foaming agent in fire fighting foam.
It can also be very effective as a molluscicide,[13] killing spanish slugs.
Mordants aluminium triacetate and aluminium sulfacetate can be prepared from aluminium sulfate, the product formed being determined by the amount of lead(II) acetate used:[14]
- Al
2(SO
4)
3 + 3 Pb(CH
3CO
2)
2 → 2 Al(CH
3CO
2)
3 + 3 PbSO
4
- Al
2(SO
4)
3 + 2 Pb(CH
3CO
2)
2 → Al
2SO
4(CH
3CO
2)
4 + 2 PbSO
4
Chemical reactions[edit]
The compound decomposes to γ-alumina and sulfur trioxide when heated between 580 and 900 °C. It combines with water forming hydrated salts of various compositions.
Aluminium sulfate reacts with sodium bicarbonate to which foam stabilizer has been added, producing carbon dioxide for fire-extinguishing foams:
- Al2(SO4)3 + 6 NaHCO3 → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2
The carbon dioxide is trapped by the foam stabilizer and creates a thick foam which will float on top of hydrocarbon fuels and seal off access to atmospheric oxygen, smothering the fire. Chemical foam was unsuitable for use on polar solvents such as alcohol, as the fuel would mix with and break down the foam blanket. The carbon dioxide generated also served to propel the foam out of the container, be it a portable fire extinguisher or fixed installation using hoselines. Chemical foam is considered obsolete in the United States and has been replaced by synthetic mechanical foams, such as AFFF which have a longer shelf life, are more effective, and more versatile, although some countries such as Japan and India continue to use it.[citation needed]
References[edit]
Footnotes[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0024». National Institute for Occupational Safety and Health (NIOSH).
- ^ Global Health and Education Foundation (2007). «Conventional Coagulation-Flocculation-Sedimentation». Safe Drinking Water is Essential. National Academy of Sciences. Archived from the original on 2007-10-07. Retrieved 2007-12-01.
- ^ Kvech S, Edwards M (2002). «Solubility controls on aluminum in drinking water at relatively low and high pH». Water Research. 36 (17): 4356–4368. doi:10.1016/S0043-1354(02)00137-9. PMID 12420940.
- ^ Austin, George T. (1984). Shreve’s Chemical process industries (5th ed.). New York: McGraw-Hill. p. 357. ISBN 9780070571471. Archived from the original on 2014-01-03.
- ^ a b Chisholm 1911, p. 767.
- ^ 21 CFR 182.1125, 2020-04-01, retrieved 2021-02-22
- ^ a b «Compound Summary for CID 24850 — Aluminum Sulfate Anhydrous». PubChem.
- ^ Ilje Pikaar; Keshab R. Sharma; Shihu Hu; Wolfgang Gernjak; Jürg Keller; Zhiguo Yuan (2014). «Reducing sewer corrosion through integrated urban water management». Science. 345 (6198): 812–814. Bibcode:2014Sci…345..812P. doi:10.1126/science.1251418. PMID 25124439. S2CID 19126381.
- ^ Kennedy, Robert H.; Cook, G. Dennis (June 1982). «Control of Lake Phosphorus with Aluminum Sulfate: Dose Determination and Application Techniques». Journal of the American Water Resources Association. 18 (3): 389–395. Bibcode:1982JAWRA..18..389K. doi:10.1111/j.1752-1688.1982.tb00005.x. ISSN 1093-474X.
- ^ Martyn, Huser, Brian J. Egemose, Sara Harper, Harvey Hupfer, Michael Jensen, Henning Pilgrim, Keith M. Reitzel, Kasper Rydin, Emil Futter (2016). Longevity and effectiveness of aluminum addition to reduce sediment phosphorus release and restore lake water quality. Uppsala universitet, Limnologi. OCLC 1233676585.
- ^ Kari Houle (2013-06-18). «Blue or Pink — Which Color is Your Hydrangea». University of Illinois Extension. Retrieved 2018-09-03.
- ^ Council, British Crop Protection; Society, British Ecological; Biologists, Association of Applied (1994). Field margins: integrating agriculture and conservation : proceedings of a symposium organised by the British Crop Protection Council in association with the British Ecological Society and the Association of Applied Biologists and held at the University of Warwick, Coventry on 18–20 April 1994. British Crop Protection Council. ISBN 9780948404757.
- ^ Georgievics, Von (2013). The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books. ISBN 9781447486121. Archived from the original on 2017-12-05.
Notations[edit]
- Chisholm, Hugh, ed. (1911). «Aluminium» . Encyclopædia Britannica. Vol. 1 (11th ed.). Cambridge University Press. p. 767.
- Pauling, Linus (1970). General Chemistry. W.H. Freeman: San Francisco. ISBN 978-0-486-65622-9.
External links[edit]
- International Chemical Safety Card 1191
- NIOSH Pocket Guide to Chemical Hazards
- WHO Food Additive Series No. 12
- Aluminum and health
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Aluminium sulfate |
|
| Other names
Aluminum sulfate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.110 |
| EC Number |
|
| E number | E520 (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Al2(SO4)3 |
| Molar mass | 342.15 g/mol (anhydrous) 666.44 g/mol (octadecahydrate) |
| Appearance | white crystalline solid hygroscopic |
| Density | 2.672 g/cm3 (anhydrous) 1.62 g/cm3 (octadecahydrate) |
| Melting point | 770 °C (1,420 °F; 1,040 K) (decomposes, anhydrous) 86.5 °C (octadecahydrate) |
|
Solubility in water |
31.2 g/100 mL (0 °C) 36.4 g/100 mL (20 °C) 89.0 g/100 mL (100 °C) |
| Solubility | slightly soluble in alcohol, dilute mineral acids |
| Acidity (pKa) | 3.3–3.6 |
|
Magnetic susceptibility (χ) |
−93.0×10−6 cm3/mol |
|
Refractive index (nD) |
1.47[1] |
| Structure | |
|
Crystal structure |
monoclinic (hydrate) |
| Thermochemistry | |
|
Std enthalpy of |
-3440 kJ/mol |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
none[2] |
|
REL (Recommended) |
2 mg/m3[2] |
|
IDLH (Immediate danger) |
N.D.[2] |
| Related compounds | |
|
Other cations |
Gallium sulfate Magnesium sulfate |
|
Related compounds |
See Alum |
| Supplementary data page | |
| Aluminium sulfate (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium sulfate is a salt with the formula Al2(SO4)3. It is soluble in water and is mainly used as a coagulating agent (promoting particle collision by neutralizing charge) in the purification of drinking water[3][4] and wastewater treatment plants, and also in paper manufacturing.
The anhydrous form occurs naturally as a rare mineral millosevichite, found for example in volcanic environments and on burning coal-mining waste dumps. Aluminium sulfate is rarely, if ever, encountered as the anhydrous salt. It forms a number of different hydrates, of which the hexadecahydrate Al2(SO4)3·16H2O and octadecahydrate Al2(SO4)3·18H2O are the most common. The heptadecahydrate, whose formula can be written as [Al(H2O)6]2(SO4)3·5H2O, occurs naturally as the mineral alunogen.
Aluminium sulfate is sometimes called alum or papermaker’s alum in certain industries. However, the name «alum» is more commonly and properly used for any double sulfate salt with the generic formula XAl(SO
4)
2·12H
2O, where X is a monovalent cation such as potassium or ammonium.[5]
Production[edit]
In the laboratory[edit]
Aluminium sulfate may be made by adding aluminium hydroxide, Al(OH)3, to sulfuric acid, H2SO4:
> + 3 H2SO4 → Al2(SO4)3 + 6 H2O
or by heating aluminium metal in a sulfuric acid solution:
- 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2↑
From alum schists[edit]
The alum schists employed in the manufacture of aluminium sulfate are mixtures of iron pyrite, aluminium silicate and various bituminous substances, and are found in upper Bavaria, Bohemia, Belgium, and Scotland. These are either roasted or exposed to the weathering action of the air. In the roasting process, sulfuric acid is formed and acts on the clay to form aluminium sulfate, a similar condition of affairs being produced during weathering. The mass is now systematically extracted with water, and a solution of aluminium sulfate of specific gravity 1.16 is prepared. This solution is allowed to stand for some time (in order that any calcium sulfate and basic iron(III) sulfate may separate), and is then evaporated until iron(II) sulfate crystallizes on cooling; it is then drawn off and evaporated until it attains a specific gravity of 1.40. It is now allowed to stand for some time, and decanted from any sediment.[6]
From clays or bauxite[edit]
In the preparation of aluminium sulfate from clays or from bauxite, the material is gently calcined, then mixed with sulfuric acid and water and heated gradually to boiling; if concentrated acid is used no external heat is generally required as the formation of aluminium sulfate is exothermic. It is allowed to stand for some time, and the clear solution is drawn off.
From cryolite[edit]
When cryolite is used as the ore, it is mixed with calcium carbonate and heated. By this means, sodium aluminate is formed; it is then extracted with water and precipitated either by sodium bicarbonate or by passing a current of carbon dioxide through the solution. The precipitate is then dissolved in sulfuric acid.[6]
Uses[edit]
Sediment core sampled from a Minnesota lake. Aluminium sulfate flocs are depicted as white clumps near the sediment surface.
Aluminium sulfate is sometimes used in the human food industry as a firming agent, where it takes on E number E520, and in animal feed as a bactericide. In the USA, the FDA lists it as «generally recognized as safe» with no limit on concentration.[7] Aluminium sulfate may be used as a deodorant, an astringent, or as a styptic for superficial shaving wounds.[8] Aluminium sulfate is used as a mordant in dyeing and printing textiles.
It is a common vaccine adjuvant and works «by facilitating the slow release of antigen from the vaccine depot formed at the site of inoculation.»[8]
Aluminium sulfate is used in water purification and for chemical phosphorus removal from wastewater. It causes suspended impurities to coagulate into larger particles and then settle to the bottom of the container (or be filtered out) more easily. This process is called coagulation or flocculation. Research suggests that in Australia, aluminium sulfate used in this way in drinking water treatment is the primary source of hydrogen sulfide gas in sanitary sewer systems.[9] An improper and excess application incident in 1988 polluted the water supply of Camelford in Cornwall.
Aluminium sulfate has been used as a method of eutrophication remediation for shallow lakes. It works by reducing the phosphorus load in the lakes.[10][11]
When dissolved in a large amount of neutral or slightly alkaline water, aluminium sulfate produces a gelatinous precipitate of aluminium hydroxide, Al(OH)3. In dyeing and printing cloth, the gelatinous precipitate helps the dye adhere to the clothing fibers by rendering the pigment insoluble.
Aluminium sulfate is sometimes used to reduce the pH of garden soil, as it hydrolyzes to form the aluminium hydroxide precipitate and a dilute sulfuric acid solution. An example of what changing the pH level of soil can do to plants is visible when looking at Hydrangea macrophylla. The gardener can add aluminium sulfate to the soil to reduce the pH which in turn will result in the flowers of the Hydrangea turning a different color (blue). The aluminium is what makes the flowers blue; at a higher pH, the aluminium is not available to the plant.[12]
In the construction industry, it is used as waterproofing agent and accelerator in concrete. Another use is a foaming agent in fire fighting foam.
It can also be very effective as a molluscicide,[13] killing spanish slugs.
Mordants aluminium triacetate and aluminium sulfacetate can be prepared from aluminium sulfate, the product formed being determined by the amount of lead(II) acetate used:[14]
- Al
2(SO
4)
3 + 3 Pb(CH
3CO
2)
2 → 2 Al(CH
3CO
2)
3 + 3 PbSO
4
- Al
2(SO
4)
3 + 2 Pb(CH
3CO
2)
2 → Al
2SO
4(CH
3CO
2)
4 + 2 PbSO
4
Chemical reactions[edit]
The compound decomposes to γ-alumina and sulfur trioxide when heated between 580 and 900 °C. It combines with water forming hydrated salts of various compositions.
Aluminium sulfate reacts with sodium bicarbonate to which foam stabilizer has been added, producing carbon dioxide for fire-extinguishing foams:
- Al2(SO4)3 + 6 NaHCO3 → 3 Na2SO4 + 2 Al(OH)3 + 6 CO2
The carbon dioxide is trapped by the foam stabilizer and creates a thick foam which will float on top of hydrocarbon fuels and seal off access to atmospheric oxygen, smothering the fire. Chemical foam was unsuitable for use on polar solvents such as alcohol, as the fuel would mix with and break down the foam blanket. The carbon dioxide generated also served to propel the foam out of the container, be it a portable fire extinguisher or fixed installation using hoselines. Chemical foam is considered obsolete in the United States and has been replaced by synthetic mechanical foams, such as AFFF which have a longer shelf life, are more effective, and more versatile, although some countries such as Japan and India continue to use it.[citation needed]
References[edit]
Footnotes[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0024». National Institute for Occupational Safety and Health (NIOSH).
- ^ Global Health and Education Foundation (2007). «Conventional Coagulation-Flocculation-Sedimentation». Safe Drinking Water is Essential. National Academy of Sciences. Archived from the original on 2007-10-07. Retrieved 2007-12-01.
- ^ Kvech S, Edwards M (2002). «Solubility controls on aluminum in drinking water at relatively low and high pH». Water Research. 36 (17): 4356–4368. doi:10.1016/S0043-1354(02)00137-9. PMID 12420940.
- ^ Austin, George T. (1984). Shreve’s Chemical process industries (5th ed.). New York: McGraw-Hill. p. 357. ISBN 9780070571471. Archived from the original on 2014-01-03.
- ^ a b Chisholm 1911, p. 767.
- ^ 21 CFR 182.1125, 2020-04-01, retrieved 2021-02-22
- ^ a b «Compound Summary for CID 24850 — Aluminum Sulfate Anhydrous». PubChem.
- ^ Ilje Pikaar; Keshab R. Sharma; Shihu Hu; Wolfgang Gernjak; Jürg Keller; Zhiguo Yuan (2014). «Reducing sewer corrosion through integrated urban water management». Science. 345 (6198): 812–814. Bibcode:2014Sci…345..812P. doi:10.1126/science.1251418. PMID 25124439. S2CID 19126381.
- ^ Kennedy, Robert H.; Cook, G. Dennis (June 1982). «Control of Lake Phosphorus with Aluminum Sulfate: Dose Determination and Application Techniques». Journal of the American Water Resources Association. 18 (3): 389–395. Bibcode:1982JAWRA..18..389K. doi:10.1111/j.1752-1688.1982.tb00005.x. ISSN 1093-474X.
- ^ Martyn, Huser, Brian J. Egemose, Sara Harper, Harvey Hupfer, Michael Jensen, Henning Pilgrim, Keith M. Reitzel, Kasper Rydin, Emil Futter (2016). Longevity and effectiveness of aluminum addition to reduce sediment phosphorus release and restore lake water quality. Uppsala universitet, Limnologi. OCLC 1233676585.
- ^ Kari Houle (2013-06-18). «Blue or Pink — Which Color is Your Hydrangea». University of Illinois Extension. Retrieved 2018-09-03.
- ^ Council, British Crop Protection; Society, British Ecological; Biologists, Association of Applied (1994). Field margins: integrating agriculture and conservation : proceedings of a symposium organised by the British Crop Protection Council in association with the British Ecological Society and the Association of Applied Biologists and held at the University of Warwick, Coventry on 18–20 April 1994. British Crop Protection Council. ISBN 9780948404757.
- ^ Georgievics, Von (2013). The Chemical Technology of Textile Fibres – Their Origin, Structure, Preparation, Washing, Bleaching, Dyeing, Printing and Dressing. Read Books. ISBN 9781447486121. Archived from the original on 2017-12-05.
Notations[edit]
- Chisholm, Hugh, ed. (1911). «Aluminium» . Encyclopædia Britannica. Vol. 1 (11th ed.). Cambridge University Press. p. 767.
- Pauling, Linus (1970). General Chemistry. W.H. Freeman: San Francisco. ISBN 978-0-486-65622-9.
External links[edit]
- International Chemical Safety Card 1191
- NIOSH Pocket Guide to Chemical Hazards
- WHO Food Additive Series No. 12
- Aluminum and health
- Government of Canada Fact Sheets and Frequently Asked Questions: Aluminum Salts
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат алюминия
Брутто-формула:
Al2O12S3
CAS# 10043-01-3
Категории:
Неорганические соли
PubChem CID: 24850
Названия
Русский:
- Сульфат алюминия
English:
- Aluminium sulfate
- Aluminium sulphate
- Aluminum alum
- Aluminum sulfate (2:3)
- Aluminum sulphate
- Alunogenite
- Cake alum
- Dialuminum sulfate
- Dialuminum trisulfate
- E520
- Filter alum
- Papermaker’s alum
- Pearl Alum
- Pickle Alum
- aluminum salt (3:2)
- dialuminum;trisulfate(IUPAC)
Варианты формулы:
Al2(SO4)3
Al(+3)2(S(+6)O(-2)4)3
$slope(45)O^-`/S`O`/O/O^-/0Al^3+/0O`^-S`/O/c/O`/O^-/0Al^3+/0O`^-S/O`/O«/O`^-
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат алюминия
-
2Al + 3H2SO4 «T»-> Al2(SO4)3 + 3H2″|^»
-
8Al + 15H2SO4 «T»-> 4Al2(SO4)3 + 3H2S»|^» + 12H2O
-
2Al(OH)3 + 3H2SO4 -> Al2(SO4)3 + 6H2O
-
2Al2(SO4)3 «770-860^oC»—> 2Al2O3 + 6SO2″|^» + 3O2″|^»
-
Al2(SO4)3 + 6NaHCO3 -> 3Na2SO4 + 2Al(OH)3 + 6CO2
И ещё 11 реакций…
| Сульфат алюминия | |
|---|---|
[math]displaystyle{ mathrm{ Biggl[} }[/math]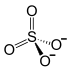 [math]displaystyle{ mathrm{ ! Biggr]_3} }[/math] [math]displaystyle{ mathrm{ ! Biggr]_3} }[/math] |
|
 |
|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| Безопасность | |
| Токсичность | малотоксично |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[1][2].
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[1]:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства
- Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[1]:
- [math]displaystyle{ mathsf{Al_2(SO_4)_3 xrightarrow{580 ^circ C} Al_2O_3 + 3SO_3} }[/math]
- Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[2][3].
- Гидролизуется горячей водой:
- [math]displaystyle{ mathsf{Al_2(SO_4)_3 + 6H_2O xrightarrow{100^oC} 2Al(OH)_3downarrow + 3H_2SO_4} }[/math]
- При сплавлении со щелочами образует алюминаты:
- [math]displaystyle{ mathsf{Al_2(SO_4)_3 + 8NaOH xrightarrow{900-1000^oC} 2NaAlO_2 + 3Na_2SO_4 + 4H_2O} }[/math]
- В холодном концентрированном растворе аммиака образует осадок гидроксида, а в горячем – метагидроксида алюминия[4]:
- [math]displaystyle{ mathsf{Al_2(SO_4)_3 + 6NH_3*H_2O xrightarrow{} 2Al(OH)_3downarrow + 3(NH_4)_2SO_4} }[/math]
- [math]displaystyle{ mathsf{Al_2(SO_4)_3 + 6NH_3*H_2O xrightarrow{t} 2AlO(OH)downarrow + 3(NH_4)_2SO_4 + 2H_2O} }[/math]
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
- [math]displaystyle{ mathsf{2Al(OH)_3 + 3H_2SO_4 longrightarrow Al_2(SO_4)_3 + 6H_2O} }[/math]
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
- [math]displaystyle{ mathsf{2Al + 3H_2SO_4 longrightarrow Al_2(SO_4)_3 + 3H_2uparrow} }[/math]
Применение
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[5].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[2].
Примечания
- ↑ 1,0 1,1 1,2 Волохов, 1988.
- ↑ 2,0 2,1 2,2 Гурлев, 1988, с. 285.
- ↑ Джеймс, 1980, с. 83.
- ↑ Лидин, 2000, с. 85.
- ↑ E-520 (Е-520) Сульфат алюминия. Дата обращения: 30 марта 2010. Архивировано 15 сентября 2011 года.
Литература
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Морфемный разбор слова:
Однокоренные слова к слову:
Сульфат алюминия
| Сульфат алюминия | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Сульфат алюминия |
| Химическая формула | Al2(SO4)3 |
| Физические свойства | |
| Молярная масса | 342,15 г/моль |
| Плотность | 1,62—2,672 г/см³ |
| Термические свойства | |
| Температура плавления | 770 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| Регистрационный номер EC | 233-135-0 |
Содержание
Описание
Сульфат алюминия — это соль белого цвета с серым, голубым или розовым оттенком, при обычных условиях существует в виде кристаллогидрата Al2(SO4)3·18H2O — бесцветных кристаллов. При нагревании теряет воду не плавясь, при прокаливании распадается на Al2O3 и SO3. Хорошо растворяется в воде. Технический сульфат алюминия можно получить, обрабатывая серной кислотой боксит или глину, а чистый продукт, — растворяя Al(OH)3 в горячей концентрированной H2SO4.
Сульфат алюминия применяется для очистки воды хозяйственно-питьевого и промышленного назначения и для использования в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E-520. [1]
Химические свойства
Сульфат алюминия разлагается при температурах от 770 до 860 °C:
Получение
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают при соединении алюминия с серной кислотой:
Источник
Сульфат алюминия
Сульфат алюминия растворим в воде и, в основном, используется в качестве флокулянта для очистки питьевой и технической воды станциями очистки сточных вод, а также в производстве бумаги.
Сульфат алюминия иногда упоминается как серная кислота, квасцы алюмоаммиачные или пищевая добавка Е 523. Безводная форма встречается в природе как редкий минерал Миллозевичит, содержащийся в вулканических средах, а также получается при сжигании угольных отходов. Сульфат алюминия образует множество различных гидратов, в числе которых кристаллогидрат Al2(SO4)3*16H2O и октадекагидрат Al2(SO4)3*18H2O.
Сульфат алюминия обладает способностью поглощать и удерживать молекулы воды из окружающей атмосферы.
Получение сульфата алюминия технического возможно путем добавления гидроксида алюминия Al(OH)3 в серную кислоту H2SO 4.
Также возможно получение сульфата алюминия из тетрагидроксоалюмината натрия.
Сульфат алюминия – это белое или почти белое кристаллической формы или в виде порошка соединение без запаха. Он растворим в воде, не летуч и легковоспламеняем. Сульфат алюминия обладает чрезвычайно кислым вкусом.
Применение сульфата алюминия
Раствор сульфата алюминия используется для очистки воды и как краситель в обработке текстиля. В процессе очистки воды раствор сульфата алюминия приводит к коагулированию, нежелательные примеси и загрязненные частицы оседают на дно сосуда и легко отфильтровываются.
При растворении в большом количестве нейтральной или слегка щелочной воды, раствор сульфата алюминия образует студенистый осадок гидроксида алюминия Al(OH)3, который используется при печати и окрашивании тканей, так как является нерастворимым пигментом.
Сульфат алюминия иногда используется для снижения pH почвы сада, что в свою очередь приводит при выращивании некоторых видов цветов (Гортензии) к их повторному цветению.
Сульфат алюминия является активным ингредиентом некоторых антиперспирантов.
В строительстве он используется в качестве гидроизолятора и ускорителя в производстве бетона.
Сульфат алюминия может быть использован в борьбе с моллюсками, насекомыми и слизняками.

В медицине сульфат алюминия входит в состав лекарств, облегчающих боль и дискомфорт, вызванные укусами насекомых. Он помогает разрушить токсичные химические вещества, содержащиеся в укусах, и помогает уменьшить их воздействие на кожу. Эти препараты выпускается в виде спреев, которые наносятся непосредственно на пораженные участки кожи и эффективнее помогают, если будут использованы сразу же после укуса.
Вред сульфата алюминия
Сульфат алюминия вреден при проглатывании или вдыхании. Вдыхание паров сульфата алюминия вызывает кашель и, возможно, одышку.
При контакте с кожей или глазами сульфат алюминия вызывает раздражение, покраснение, зуд и боль. Употребление сульфата алюминия внутрь приводит к сильному раздражению кишечника и желудка, сопровождаемое рвотой, тошнотой и диареей.
Это соединение может вызывать сильные ожоги, если контактирует с открытыми участками кожи.
Первая помощь при отравлении сульфатом алюминия
При попадании сульфата алюминия на кожу или в глаза необходимо промыть пораженный участок водой. В случае вдыхания паров необходимо выйти из токсичной области и медленно отдышаться. Если сульфат алюминия был применен внутрь, необходимо выпить стакан молока, а затем спровоцировать рвоту.
При отравлении сульфатом алюминия ни в коем случае нельзя использовать бикарбонаты, так как такое сочетание в буквальном смысле является взрывным.
Хранение сульфата алюминия
Сульфат алюминия необходимо хранить в прохладном, сухом месте в плотно закрытой таре, не смешивая с другими веществами.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Кровь человека «бегает» по сосудам под огромным давлением и при нарушении их целостности способна выстрелить на расстояние до 10 метров.
Наши почки способны очистить за одну минуту три литра крови.
Печень – это самый тяжелый орган в нашем теле. Ее средний вес составляет 1,5 кг.
Для того чтобы сказать даже самые короткие и простые слова, мы задействуем 72 мышцы.
Самое редкое заболевание – болезнь Куру. Болеют ей только представители племени фор в Новой Гвинее. Больной умирает от смеха. Считается, что причиной возникновения болезни является поедание человеческого мозга.
Раньше считалось, что зевота обогащает организм кислородом. Однако это мнение было опровергнуто. Ученые доказали, что зевая, человек охлаждает мозг и улучшает его работоспособность.
Большинство женщин способно получать больше удовольствия от созерцания своего красивого тела в зеркале, чем от секса. Так что, женщины, стремитесь к стройности.
Если улыбаться всего два раза в день – можно понизить кровяное давление и снизить риск возникновения инфарктов и инсультов.
В стремлении вытащить больного, доктора часто перегибают палку. Так, например, некий Чарльз Йенсен в период с 1954 по 1994 гг. пережил более 900 операций по удалению новообразований.
В нашем кишечнике рождаются, живут и умирают миллионы бактерий. Их можно увидеть только при сильном увеличении, но, если бы они собрались вместе, то поместились бы в обычной кофейной чашке.
Общеизвестный препарат «Виагра» изначально разрабатывался для лечения артериальной гипертонии.
74-летний житель Австралии Джеймс Харрисон становился донором крови около 1000 раз. У него редкая группа крови, антитела которой помогают выжить новорожденным с тяжелой формой анемии. Таким образом, австралиец спас около двух миллионов детей.
Стоматологи появились относительно недавно. Еще в 19 веке вырывать больные зубы входило в обязанности обычного парикмахера.
Существуют очень любопытные медицинские синдромы, например, навязчивое заглатывание предметов. В желудке одной пациентки, страдающей от этой мании, было обнаружено 2500 инородных предметов.
Кариес – это самое распространенное инфекционное заболевание в мире, соперничать с которым не может даже грипп.
Полиоксидоний относится к иммуномодулирующим препаратам. Он воздействует на определенные звенья иммунитета, благодаря чему способствует повышению устойчивости о.
Источник
Алюминий. Химия алюминия и его соединений
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 



Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Источник
Структура сульфата алюминия (Al2 (SO4) 3), применение, виды, токсичность
сульфат алюминия неорганическая соль алюминия формулы Al2(SO4)3, это обычно выглядит как белое твердое вещество с блестящими кристаллами. Цвет соединения будет зависеть от его концентрации железа и любых других примесей. Существует два основных типа сульфата алюминия: A и B.
На нижнем изображении показаны белые кристаллы гидратированного сульфата алюминия. Можно отметить отсутствие коричневых окрасок, указывающих на ионы железа в кристаллической решетке..
Кроме того, он может образовывать двойные соли с калием и аммонием, соединения, известные как квасцы. Частично это может быть связано со сродством воды в гидратах удерживать другие ионы, кроме алюминия.
Сульфат алюминия может разлагаться под действием воды в гидроксиде алюминия и серной кислоте. Это свойство позволило использовать его в качестве подкислителя почв.
Это также токсичное соединение, особенно при контакте с его порошком. Тем не менее, он имеет бесконечное число применений и применений, которые идут от очистки воды с помощью метода коагуляции, происходящего через его использование в нескольких отраслях промышленности, до его использования в терапевтических целях..
структура
Сульфат алюминия имеет соотношение двух катионов Al 3+ на каждые три аниона ТАК4 2- (верхнее изображение), что можно наблюдать непосредственно в его химической формуле Al2(SO4)3.
Обратите внимание, что Аль 3+ они сероватые, а ТАК4 2- они желтые (для атома серы) и красные (для атомов кислорода).
Сульфат алюминия может иметь много структур, хотя его гидраты имеют тенденцию принимать моноклинную кристаллическую систему.
Физико-химические свойства
внешний вид
Он выглядит как твердое вещество с блестящими белыми кристаллами, гранулами или порошком.
Молекулярный вес
342,31 г / моль (безводный).
запах
аромат
Сладкий вкус умеренно вяжущий.
Точка плавления
770ºС безводная форма (86,5ºС октадекагидратада)
Растворимость в воде
31,2 г / 100 мл при 0 ° С; 36,4 г / 100 мл при 20 ° С и 89 г / 100 мл при 100 ° С.
плотность
растворимость
Слабо растворим в этиловом спирте.
Давление пара
стабильность
Стабильный в воздухе.
разложение
При нагревании примерно до точки плавления он может разлагаться, выделяя, в частности, оксид серы, токсичный газ..
коррозионная активность
Растворы сульфата алюминия вызывают коррозию алюминия. Также соединение может разъедать металлы в присутствии влаги.
рКа
3,3 до 3,6. И его pH составляет 2,9 или более в 5% водном растворе.
Для чего это (использует)
Коагуляция или флокуляция воды
-При смешивании с водой (пригодной для питья, подачи или отходов) сульфат алюминия вызывает образование гидроксида алюминия, который образует комплексы с соединениями и частицами в растворе, ускоряя их осаждение, что в отсутствие обработки сульфатом алюминия может привести к долгое время.
-Сульфат алюминия также используется при очистке воды в бассейне, что делает его более привлекательным для использования.
-Благодаря использованию сульфата алюминия вода получается без мутности и цвета, что повышает ее способность к обработке за счет облегчения очистки воды. К сожалению, этот метод очистки может привести к незначительному увеличению концентрации алюминия в воде..
-Алюминий является очень токсичным металлом, который накапливается в коже, мозге и легких, вызывая серьезные нарушения. Кроме того, неизвестно, какую функцию он выполняет в живых существах..
-Европейский Союз требует, чтобы максимально допустимый предел содержания алюминия в воде не превышал 0,2 мг / л. Между тем, Агентство по охране окружающей среды США требует, чтобы максимальный предел загрязнения воды алюминием не превышал 0,05-0,2 мг / л..
-Очистка сточных вод или использование сульфата алюминия позволяет экономно удалять или уменьшать содержание фосфора в них..
Использование в качестве протравы чернил и при разработке бумаги
-Сульфат алюминия использовался в качестве протравы для красителей или чернил, помогая закрепиться на красящем материале. Его фиксирующее действие обусловлено Al (OH)3, чья желатиновая консистенция способствует адсорбции красителей на текстиле.
-Хотя он использовался примерно с 2000 г. до н.э. для описанной цели, только органические красители требуют морилки. Синтетические красители, с другой стороны, не требуют протравы для выполнения своей функции.
-Это было вытеснено из производства бумаги, но это все еще используется в производстве бумажной массы. Удаляет примеси, а также используется для связывания материалов, нейтрализации зарядов и калибровки канифоли.
Промышленное использование
-Он используется в строительной промышленности для ускорения схватывания бетона. Кроме того, он используется в гидроизоляции зданий.
-В производстве мыла и жиров он используется в производстве глицерина.
-Он используется в нефтяной промышленности при производстве синтетических катализаторов, которые используются во время эксплуатации.
-Он используется в фармацевтической промышленности в качестве вяжущего при приготовлении лекарств и косметики.
-Вмешивается в производство красителей, таких как кармин. Он также используется в качестве красителя при производстве синтетических каучуков бутадиен-стирола..
-В сахарной промышленности его используют в качестве очистителя мелассы для сахарного тростника..
-Используется при изготовлении дезодорантов. Почему? Потому что это вызывает сужение протоков потовых желез, ограничивая тем самым накопление пота, необходимой среды для роста бактерий, вызывающих запах.
-Используется при дублении кожи, необходим процесс его использования. Кроме того, он используется в производстве удобрений.
-Используется в качестве добавки при приготовлении красок, адгезивов и герметиков, а также в средствах для чистки и ухода за мебелью..
Лечебное и терапевтическое использование
-Сульфат алюминия является иммунологическим адъювантом. Следовательно, он выполняет функцию обработки антигенов таким образом, что при высвобождении в месте их действия они производят большую продукцию антител к антигенам, которые были инокулированы..
-Адъювант Фрейнда и БЦЖ, а также другие адъюванты, в том числе эндогенные, такие как интерлейкины, неспецифичны для антигенов, что позволяет увеличить радиус действия иммунитета. Это позволило разработать вакцины против многочисленных заболеваний.
-Коагулирующее действие сульфата алюминия позволило устранить многочисленные вирусы в очищенной воде, среди прочего: Q бета, MS2, T4 и P1. Результаты показывают, что обработка воды сульфатом алюминия приводит к инактивации таких вирусов..
-Сульфат алюминия используется в форме карандаша или в виде порошка при лечении мелких поверхностных ран или ссадин, возникающих при бритье.
-Он используется в производстве ацетата алюминия, соединения, используемого при лечении некоторых заболеваний уха. Он также использовался без особого успеха для смягчения последствий укусов муравьев..
-Растворы сульфата алюминия используются в концентрации от 5 до 10% при местном лечении язв, что позволяет контролировать их секрецию.
-Вяжущее действие сульфата алюминия сокращает поверхностные слои кожи, коагулируя белки и заживляя раны.
Другое использование
-Сульфат алюминия помогает контролировать чрезмерный рост водорослей в прудах, озерах и в потоках воды. Он также используется для удаления моллюсков, в том числе испанского слизняка.
-Садовники применяют это соединение для подкисления щелочных почв. При контакте с его водой сульфат алюминия разлагается на гидроксид алюминия и разбавленную серную кислоту. Затем гидроксид алюминия выпадает в осадок, оставляя серную кислоту в растворе.
-Подкисление почв из-за серной кислоты визуализируется очень творчески, благодаря наличию растения под названием гортензия, чьи цветы становятся синими в присутствии кислой почвы; то есть они чувствительны и реагируют на изменения pH.
-Сульфат алюминия участвует в производстве пены для борьбы с огнем и борьбы с ним. Как? Реагирует с бикарбонатом натрия с выделением СО2. Этот газ блокирует доступ O2 до места сгорания материала; и, следовательно, прекращение огня, которое развивалось.
Производство сульфата алюминия
Сульфат алюминия синтезируется путем взаимодействия обогащенного алюминием соединения, такого как бокситовая руда, с серной кислотой при повышенных температурах. Следующее химическое уравнение представляет реакцию:
Сульфат алюминия также может образовываться в результате реакции нейтрализации между гидроксидом алюминия и серной кислотой в соответствии со следующей реакцией:
Серная кислота вступает в реакцию с алюминием, образуя сульфат аммония и выделяя молекулы водорода в виде газа. Реакция схематизируется следующим образом:
тип
Сульфат алюминия подразделяется на два типа: тип A и тип B. В сульфате алюминия типа A твердые вещества имеют белый цвет и имеют концентрацию железа менее 0,5%..
В сульфате алюминия типа B твердые вещества коричневые и имеют концентрацию железа менее 1,5%..
Есть отрасли, производящие сульфат алюминия, которые имеют различные критерии для их классификации. Так, промышленность сообщает, что для его приготовления сульфата алюминия типа А максимальная концентрация железа составляет 0,1% в виде оксида железа. В то время как для типа B они указывают максимальную концентрацию железа 0,35%.
токсичность
-В глазах это вызывает сильное раздражение, даже вызывает постоянные травмы..
-Вдыхание вызывает раздражение носа и горла, что может вызвать кашель и сыпь.
-Его прием вызывает раздражение желудка, тошноту и рвоту.
-Существуют токсические эффекты, которые, хотя они не связаны непосредственно с сульфатом алюминия, косвенно связаны с их использованием. Это случай определенных токсических эффектов алюминия, вызванных использованием сульфата алюминия при очистке воды..
-Пациенты, которые подвергаются хроническому диализу с использованием солей, приготовленных в очищенной воде, с использованием сульфата алюминия, испытывают очень серьезные нарушения здоровья. Среди этих нарушений у нас есть анемия, деменция при диализе и рост заболеваний костей..
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется сульфат алюминия в химии формула, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется сульфат алюминия в химии формула», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Сомневаетесь в ответе?
Найдите правильный ответ на вопрос ✅ «Как пишется сульфат алюминия …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Правильный ответ на вопрос 👍 «Как пишется сульфат алюминия …» по предмету 📗 Химия. Развернутая система поиска нашего сайта обязательно приведёт вас к нужной информации. Как вариант — оцените ответы на похожие вопросы. Но если вдруг и это не помогло — задавайте свой вопрос знающим оппонентам, которые быстро дадут на него ответ!
Искать готовые ответы
При сжигании этана образовался углекислый газ объемом 32 л. Какие объемы исходных газов было использовано? (н. у.)
Ответы (1)
Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO3; б) Mg (OH) 2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
Ответы (1)
Осуществите превращения Cu—CuO—CuSo4—Cu (OH) 2—CuCl2
Ответы (1)
Ксилол 100% консентрация, чем разбавить чтоб получить 40%
Ответы (1)
Запишите схемы образования химических связей для веществ состав которых отображают формулами kcl и cl2
Ответы (1)
Определите степень полимеризации полибутадиена, молекулярная масса которого 13500 г/моль.
Ответы (1)
Дано: BaCl2, NaOH, Na2SO4, AlCl3, HCl, K2CO3, CuSO3, Ba (NO3) 2 Нужно составить возможные реакции ионного обмена.
Ответы (1)
Опишите физические свойства присущие для веществ с молекулярными кристаллическими решетками Приведите примеры
Ответы (1)
Степень окисления J2
Ответы (1)
Определите массовую 10% раствора H2SO4 (плотность раствора H2SO4=1,069 г/мл)
Ответы (1)
Определение и формула сульфата алюминия

Формула –
Молярная масса равна г/моль.
Физические свойства – белое вещество (может иметь разные оттенки), плавящееся с разложением.
В обычных условиях образует кристаллогидрат с формулой .
Химические свойства сульфата алюминия
- Сульфат алюминия хорошо растворяется в воде (происходит гидролиз по катиону):
- При нагревании до температуры
протекает окислительно-восстановительная реакция диспропорционирования (сульфат алюминия разлагается на оксид алюминия, оксид серы
и кислород):
- Реагирует с кипящей водой:
- Взаимодействует с растворами разбавленных щелочей:
- Вступает в реакцию с растворами концентрированных щелочей:
- Реагирует с гидроксидом аммония:
- Вступает в реакцию обмена с солями с образованием осадков:
Получение
Сульфат алюминия можно получить при взаимодействии оксида алюминия с кислым сульфатом калия при высокой температуре ():
Применение
Сульфат алюминия находит применение в качестве коагулянта для очистки воды хозяйственно-питьевого и промышленного назначения. Он также применяется во многих отраслях промышленности, например, в бумажной. Кроме того, используется как пищевая добавка .
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июня 2020 года; проверки требуют 6 правок.
| Сульфат алюминия | |
|---|---|
 |
|
 |
|
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Температура | |
| • плавления | 700 °C[1] |
| • кипения | 1600 °C[2] |
| • разложения | 580 °C |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
InChI=1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Токсичность | малотоксично |
| NFPA 704 |
1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства[править | править код]
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[3][4].
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[3]:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства[править | править код]
Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[3]:
Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[4][5].
Получение[править | править код]
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение[править | править код]
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[6].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[4].
Примечания[править | править код]
Литература[править | править код]
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
0 интересует
0 не интересует
15 просмотров
Как пишется сульфат алюминия
- пишется
- сульфат
- алюминия
- 10 — 11 классы
- химия
спросил
26 Апр, 18
от
Ksu111113_zn
(14 баллов)
в категории Химия
2 Ответы
0 интересует
0 не интересует
ответил
26 Апр, 18
от
alinavin62_zn
Начинающий
(236 баллов)
Al2(SO4)3 сульфат алюминия
0 интересует
0 не интересует
ответил
26 Апр, 18
от
nata073_zn
Начинающий
(314 баллов)
Алюминия
сульфат Al2(SO4)3
Добро пожаловать на сайт Школьные решения и ответы. У нас вы можете задавать задачи и получать решения от других членов сообщества.