| Фосфат алюминия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Фосфат алюминия |
| Традиционные названия | Фосфат алюминия, ортофосфат алюминия, алюминий фосфорнокислый |
| Химическая формула | AlPO4 |
| Эмпирическая формула | AlPO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 121,95 г/моль |
| Плотность | 2,566 г/см³ |
| Термические свойства | |
| Температура плавления | 1800 °C |
| Молярная теплоёмкость (ст. усл.) | 93,24 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −1735 кДж/моль |
| Удельная теплота испарения | − Дж/кг |
| Классификация | |
| Рег. номер CAS | 7784-30-7 |
| SMILES | O=P12O[Al](O1)O2 |
| RTECS | TB6450000 |
Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде минерала берлинита. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
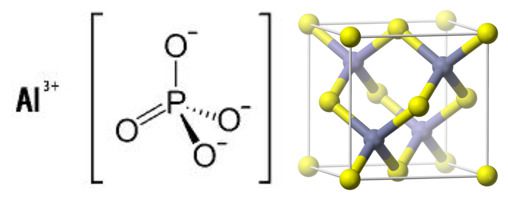
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теполёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83·10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении их водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x=2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Аугелит
Лазулит
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Примечания
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
|
Соединения алюминия |
|---|
|
Алюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3) |
Шаблон:АТХ код A02
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде минерала берлинита. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теполёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83·10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении их водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x=2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Аугелит
Лазулит
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Примечания
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
Шаблон:АТХ код A02
Фосфат алюминия, триалюминийфосфат, алюминий фосфорнокислый нейтральный) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое нетоксичное вещество, плохо растворимое в воде. Относится к IV классу опасности. Встречается в природе в виде многочисленных минералов. Образуется в виде студенистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
| Фосфат алюминия | |
|---|---|
| Систематическое наименование |
Фосфат алюминия(III) |
| Традиционные названия | Фосфат алюминия нейтральный, «триалюминийфосфат», ортофосфат алюминия, алюминий фосфорнокислый (орто-), трёхзамещённый |
| Хим. формула | AlPO4 |
| Рац. формула | AlPO4 |
| Состояние | твёрдое |
| Молярная масса | 121,95 г/моль |
| Плотность | 2,566 г/см³ |
| Температура | |
| • плавления | 1800 °C |
| Мол. теплоёмк. | 93,24 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1735 кДж/моль |
| Удельная теплота испарения | − |
| Рег. номер CAS | 7784-30-7 |
| PubChem | 16693906 |
| Рег. номер EINECS | 232-056-9 |
| SMILES |
O=P12O[Al](O1)O2 |
| InChI |
1S/Al.H3O4P/c;1-5(2,3)4/h;(H3,1,2,3,4)/q+3;/p-3 ILRRQNADMUWWFW-UHFFFAOYSA-K |
| RTECS | TB6450000 |
| ChemSpider | 58204 |
| ЛД50 | 6780-36500 мг/кг |
| Токсичность | 6 мг/см³ |
| NFPA 704 |
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Физические свойства
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте. Хуже всего соль растворима в воде при pH 4,07—6,93.
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x = 2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Кислые фосфаты алюминия
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Минералы фосфата алюминия
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Сферы использования
- В качестве флюса в производстве керамики
- Добавка для цемента.
- Катализатор в органическом синтезе.
- Разрыхлитель в кондитерском деле.
- Антацид, и другие.
Безопасность
Фосфат алюминия неядовит. Среднесмертельная доза (ЛД50) для белых мышей при пероральном введении составляет 6780-36500 мг/кг.
В соответствии с ГОСТ 12.1.007-76 ПДК в рабочей зоне для фосфата алюминия составляет 6 мг/см³.
ALUMINIUM PHOSPHATE — латинское название действующего вещества АЛЮМИНИЯ ФОСФАТ
A02AB03 (Aluminium phosphate)
Перед использованием препарата АЛЮМИНИЯ ФОСФАТ вы должны проконсультироваться с врачом.
Данная инструкция по применению предназначена исключительно для ознакомления.
Для получения более полной информации просим обращаться к аннотации производителя.
Клинико-фармакологическая группа
11.008 (Антацидный препарат)
Фармакологическое действие
Антацидное средство. Нейтрализует соляную кислоту желудочного сока и уменьшает протеолитическую активность пепсина. Практически не всасывается из ЖКТ и не вызывает алкалоз. Адсорбируясь на слизистой оболочке желудка в виде гидрофильных коллоидных мицелл, алюминия фосфат создает защитный мукоидный слой, предохраняющий слизистую от воздействия соляной кислоты, пепсина, эндогенных и экзогенных токсических веществ.
Не вызывает дефицита фосфата в организме.
Фармакокинетика
При приеме внутрь обладает низкой абсорбцией. Большая часть алюминия фосфата нерастворима, незначительная часть преципитируется в кишечнике в виде оксидов и нерастворимых карбонатов.
АЛЮМИНИЯ ФОСФАТ: ДОЗИРОВКА
Индивидуальный. Дозу устанавливают в зависимости от применяемой лекарственной формы и показаний.
Лекарственное взаимодействие
Препараты алюминия, которые применяются как антациды, взаимодействуют с большинством лекарственных средств для приема внутрь как путем изменения pH желудочного сока и быстрого опорожнения желудка, так и путем адсорбции с образованием комплексов, которые не абсорбируются.
При одновременном применении цитраты, аскорбиновая кислота повышают абсорбцию алюминия из ЖКТ.
Беременность и лактация
При необходимости возможно применение при беременности и в период лактации (грудного вскармливания).
АЛЮМИНИЯ ФОСФАТ: ПОБОЧНЫЕ ДЕЙСТВИЯ
Со стороны пищеварительной системы: запор (особенно у пожилых и лежачих больных), тошнота, рвота, изменение вкусовых ощущений.
Со стороны лабораторных показателей: при длительном применении в высоких дозах — гипофосфатемия, гипокальциемия, повышение содержания алюминия в крови.
Со стороны костно-мышечной системы: остеомаляция, остеопороз.
Со стороны ЦНС: энцефалопатия.
Со стороны мочевыделительной системы: гиперкальциурия, нефрокальциноз, почечная недостаточность.
Показания
Язвенная болезнь желудка и двенадцатиперстной кишки в фазе обострения, хронический гастрит с повышенной и нормальной секреторной функцией желудка в фазе обострения, острый гастрит, острый дуоденит, симптоматическая язва различного генеза, эрозия слизистой оболочки ЖКТ, рефлюкс-эзофагит, грыжа пищеводного отверстия диафрагмы, энтероколит, сигмоидит, проктит, дивертикулит, диарея у пациентов после гастрэктомии, диспептические явления (в т.ч. невротического генеза, после погрешностей в диете, приема лекарственных препаратов, химиотерапии), острый панкреатит, хронический панкреатит в фазе обострения, отравления и интоксикации.
С целью профилактики для уменьшения абсорбции радиоактивных элементов.
Противопоказания
Почечная недостаточность, болезнь Альцгеймера, гипофосфатемия, повышенная чувствительность к алюминия фосфату.
Особые указания
С осторожностью применять в высоких дозах у пациентов пожилого возраста и у больных с нарушениями функции почек (из-за возможного риска кумуляции алюминия фосфата, приводящей к запорам).
У пациентов с сопутствующей почечной недостаточностью возможны жажда, снижение АД, снижение рефлексов.
Применение при нарушении функции почек
С осторожностью применять в высоких дозах у больных с нарушениями функции почек (из-за возможного риска кумуляции алюминия фосфата, приводящей к запорам).
Содержание
Структурная формула
Русское название
Алюминия фосфат
Английское название
Aluminium phosphate
Латинское название вещества Алюминия фосфат
Aluminii phosphas (род. Aluminii phosphatis)
Фармакологическая группа вещества Алюминия фосфат
Фармакологическое действие
—
адсорбирующее, антацидное, обволакивающее, противоязвенное.
Фармакология
В желудке в течение 10 мин повышает pH до 3,5–5 и снижает протеолитическую активность пепсина. Антацидный эффект не сопровождается ощелачиванием желудочного сока и вторичной гиперсекрецией соляной кислоты. Благодаря адсорбирующим свойствам, удаляет из ЖКТ бактерии, вирусы, газы, эндо- и экзотоксины.
Применение вещества Алюминия фосфат
Для взрослых: язвенная болезнь желудка и двенадцатиперстной кишки, гастрит с нормальной или повышенной секреторной функцией, диафрагмальная грыжа, рефлюкс-эзофагит, синдром неязвенной диспепсии, функциональная диарея, желудочные и кишечные расстройства, вызванные интоксикацией, приемом лекарственных препаратов, раздражающих веществ (кислоты, щелочи), алкоголя.
Для детей: эзофагит, гастроэзофагеальный рефлюкс, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки.
Противопоказания
Гиперчувствительность, тяжелая почечная недостаточность.
Ограничения к применению
Пожилой возраст, нарушения функции почек (возможно увеличение концентрации алюминия в плазме крови), беременность, грудное вскармливание.
Применение при беременности и кормлении грудью
Возможно применение при беременности и в период грудного вскармливания по показаниям, в терапевтических дозах.
Побочные действия вещества Алюминия фосфат
Запор (особенно у людей пожилого возраста и ведущих малоподвижный образ жизни).
Взаимодействие
Снижает всасывание фуросемида, тетрациклинов, дигоксина, изониазида, индометацина, ранитидина.
Передозировка
Проявляется снижением моторики кишечника. Устраняется назначением слабительных средств.
Способ применения и дозы
Внутрь, схема приема и доза зависят от характера заболевания.
Меры предосторожности
Не следует принимать длительно без назначения врача. С осторожностью применяют при заболеваниях почек, циррозе печени, выраженной сердечной недостаточности. У пожилых пациентов и больных с нарушением функции почек при применении в рекомендованных дозах возможно увеличение концентрации ионов Al3+ в сыворотке крови.
При запоре, возникающем при приеме препарата, рекомендуется увеличить количество ежедневно потребляемой воды.
Торговые названия с действующим веществом Алюминия фосфат
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 декабря 2017 года; проверки требуют 10 правок.
| Фосфат алюминия | |
|---|---|
 |
|
| Систематическое наименование |
Фосфат алюминия(III) |
| Традиционные названия | Фосфат алюминия нейтральный, «триалюминийфосфат», ортофосфат алюминия, алюминий фосфорнокислый (орто-), трёхзамещённый |
| Хим. формула | AlPO4 |
| Рац. формула | AlPO4 |
| Состояние | твёрдое |
| Молярная масса | 121,95 г/моль |
| Плотность | 2,566 г/см³ |
| Температура | |
| • плавления | 1800 °C |
| Мол. теплоёмк. | 93,24 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1735 кДж/моль |
| Удельная теплота испарения | − |
| Рег. номер CAS | 7784-30-7 |
| PubChem | 16693906 |
| Рег. номер EINECS | 232-056-9 |
| SMILES |
O=P12O[Al](O1)O2 |
| InChI |
InChI=1S/Al.H3O4P/c;1-5(2,3)4/h;(H3,1,2,3,4)/q+3;/p-3 ILRRQNADMUWWFW-UHFFFAOYSA-K |
| RTECS | TB6450000 |
| ChemSpider | 58204 |
| ЛД50 | 6780-36500 мг/кг |
| Токсичность | 6 мг/см³ |
| NFPA 704 |
2 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фосфат алюминия (ортофосфат алюминия(III), триалюминийфосфат, алюминий фосфорнокислый нейтральный) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое нетоксичное вещество, плохо растворимое в воде. Относится к IV классу опасности. Встречается в природе в виде многочисленных минералов. Образуется в виде студенистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе.
Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе[править | править код]
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Физические свойства[править | править код]
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x = 2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Кислые фосфаты алюминия[править | править код]
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Минералы фосфата алюминия[править | править код]
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства[править | править код]
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Сферы использования[править | править код]
- В качестве флюса в производстве керамики
- Добавка для цемента.
- Катализатор в органическом синтезе.
- Разрыхлитель в кондитерском деле.
- Антацид, и другие.
Безопасность[править | править код]
Фосфат алюминия неядовит. Среднесмертельная доза (ЛД50) для белых мышей при пероральном введении составляет 6780-36500 мг/кг.
В соответствии с ГОСТ 12.1.007-76 ПДК в рабочей зоне для фосфата алюминия составляет 6 мг/см³.
Примечания[править | править код]
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8.
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
Aluminum phosphate is one of the chemical compounds. It contains 1 Phosphorous atom, 4 Oxygen atoms, (3 shared with single bond & 1 with double bond), and 1 Aluminum atom, Generally it appears as dihydrate means Aluminum phosphate along with 2 water ions as well as pentahydrate means Aluminum phosphate along with 5 water ions.
Aluminum phosphate has many uses in general life, now let us see what is Aluminum Phosphate, its Structure, Properties, and its uses of Aluminum Phosphate.
What is Aluminum Phosphate?
Aluminum phosphate is an amorphous form of aluminum hydroxy phosphate in this some of the hydroxyl groups of aluminum hydroxide are replaced by phosphate groups and it has many uses like flame retardant, Antacid, fungicide, catalyst food added substance, etc.
- The chemical formula of Aluminum Phosphate is AlPO4.
- It is generally occurring as an anhydrous salt and contains dihydrate and Pentahydrate structures.
- Dihydrate: AlPO4.2H2O
- Pentahydrate: AlPO4.5H2O
Structure of Aluminum Phosphate
Aluminum phosphate dihydrate has a group of phosphate anions, aluminum cations, and water. It contains 1 Phosphorous atom, 4 Oxygen atoms, (3 shared with single bond & 1 with double bond), and 1 Aluminum atom, Generally it appears as dihydrate means Aluminum phosphate along with 2 water ions as well as pentahydrate means Aluminum phosphate along with 5 water ions.
Structure of Aluminum Phosphate
Properties of Aluminum Phosphate
Physical Properties of Aluminum Phosphate
- Aluminum phosphate is a white crystalline powder (A colorless liquid in aqueous form) with a foul odour).
- The density of Aluminum phosphate is 2.56 g.cm3 in solid-state.
- The Melting point of Aluminum phosphate is 1800°C.
- The Aluminum phosphate is decomposed at its Boiling point.
- Aluminum phosphate is Insoluble in water and very slightly soluble in HCl & HNO3.
- The molar mass of Aluminum phosphate is 121.9529 g/mol as a white crystalline powder.
- The refractive index of Aluminum phosphate is 1.546.
Chemical Properties of Aluminum Phosphate
- Aluminum phosphate reacts with Hydrochloric acid (HCL) and forms Aluminum trichloride (AlPO4) and Phosphoric acid (H3PO4).
AlPO4 + 3HCl ⇢ AlCl3 + H3PO4
- Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate (Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
Uses of Aluminum Phosphate
Aluminum phosphate is used in Electronic and Electrical ventures, manufacturing of rubber and Adhesive, assembling Chemotherapeutic medications, and immunizations to improve immunogenicity.
Also, aluminum phosphate is used as a Flame retardant, Antacid, Food added substance, Fungicide, Catalyst, and a white colorant for a very long time, concrete, dental concrete, erosion inhibitors.
Sample Questions
Question 1: Draw the Structure of Aluminum Phosphate.
Answer:
Aluminum phosphate dihydrate has a group of tetra-and octahedral units of phosphate anions, aluminum cations, and water. Al3+ particles are 6-coordinate and PO43-particles are 4-coordinate.
Structure of Aluminum Phosphate
Question 2: What are the Physical Properties of Aluminum Phosphate?
Answer:
Following are the Physical Properties of Aluminum Phosphate:
- Aluminum phosphate is a white crystalline powder (A colorless liquid in aqueous form) with a foul odour).
- The density of Aluminum phosphate is 2.56 g.cm3 in solid-state.
- The Melting point of Aluminum phosphate is 1800°C.
- The Aluminum phosphate is decomposed at its Boiling point.
- Aluminum phosphate is Insoluble in water and very slightly soluble in HCl & HNO3.
- The molar mass of Aluminum phosphate is 121.9529 g/mol as a white crystalline powder.
- The refractive index of Aluminum phosphate is 1.546.
Question 3: What are the Chemical Properties of Aluminum Phosphate?
Answer:
- Aluminum phosphate reacts with Hydrochloric acid (HCL) and forms Aluminum trichloride (AlPO4) and Phosphoric acid (H3PO4).
AlPO4 + 3HCl ⇢ AlCl3 + H3PO4
- Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate (Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
Question 4: What are the uses of Aluminum Phosphate?
Answer:
The uses of Aluminum Phosphate are:
- Aluminum phosphate is used in Electronic and Electrical ventures, manufacturing of rubber and Adhesive, assembling Chemotherapeutic medications, and immunizations to improve immunogenicity.
- Also, aluminum phosphate is used as a Flame retardant, Antacid, Food added substance, Fungicide, Catalyst, and a white colorant for a very long time, concrete, dental concrete, erosion inhibitors.
Question 5: What happens when Magnesium chloride reacts with Aluminum Phosphate?
Answer:
Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
Aluminum phosphate is one of the chemical compounds. It contains 1 Phosphorous atom, 4 Oxygen atoms, (3 shared with single bond & 1 with double bond), and 1 Aluminum atom, Generally it appears as dihydrate means Aluminum phosphate along with 2 water ions as well as pentahydrate means Aluminum phosphate along with 5 water ions.
Aluminum phosphate has many uses in general life, now let us see what is Aluminum Phosphate, its Structure, Properties, and its uses of Aluminum Phosphate.
What is Aluminum Phosphate?
Aluminum phosphate is an amorphous form of aluminum hydroxy phosphate in this some of the hydroxyl groups of aluminum hydroxide are replaced by phosphate groups and it has many uses like flame retardant, Antacid, fungicide, catalyst food added substance, etc.
- The chemical formula of Aluminum Phosphate is AlPO4.
- It is generally occurring as an anhydrous salt and contains dihydrate and Pentahydrate structures.
- Dihydrate: AlPO4.2H2O
- Pentahydrate: AlPO4.5H2O
Structure of Aluminum Phosphate
Aluminum phosphate dihydrate has a group of phosphate anions, aluminum cations, and water. It contains 1 Phosphorous atom, 4 Oxygen atoms, (3 shared with single bond & 1 with double bond), and 1 Aluminum atom, Generally it appears as dihydrate means Aluminum phosphate along with 2 water ions as well as pentahydrate means Aluminum phosphate along with 5 water ions.
Structure of Aluminum Phosphate
Properties of Aluminum Phosphate
Physical Properties of Aluminum Phosphate
- Aluminum phosphate is a white crystalline powder (A colorless liquid in aqueous form) with a foul odour).
- The density of Aluminum phosphate is 2.56 g.cm3 in solid-state.
- The Melting point of Aluminum phosphate is 1800°C.
- The Aluminum phosphate is decomposed at its Boiling point.
- Aluminum phosphate is Insoluble in water and very slightly soluble in HCl & HNO3.
- The molar mass of Aluminum phosphate is 121.9529 g/mol as a white crystalline powder.
- The refractive index of Aluminum phosphate is 1.546.
Chemical Properties of Aluminum Phosphate
- Aluminum phosphate reacts with Hydrochloric acid (HCL) and forms Aluminum trichloride (AlPO4) and Phosphoric acid (H3PO4).
AlPO4 + 3HCl ⇢ AlCl3 + H3PO4
- Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate (Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
Uses of Aluminum Phosphate
Aluminum phosphate is used in Electronic and Electrical ventures, manufacturing of rubber and Adhesive, assembling Chemotherapeutic medications, and immunizations to improve immunogenicity.
Also, aluminum phosphate is used as a Flame retardant, Antacid, Food added substance, Fungicide, Catalyst, and a white colorant for a very long time, concrete, dental concrete, erosion inhibitors.
Sample Questions
Question 1: Draw the Structure of Aluminum Phosphate.
Answer:
Aluminum phosphate dihydrate has a group of tetra-and octahedral units of phosphate anions, aluminum cations, and water. Al3+ particles are 6-coordinate and PO43-particles are 4-coordinate.
Structure of Aluminum Phosphate
Question 2: What are the Physical Properties of Aluminum Phosphate?
Answer:
Following are the Physical Properties of Aluminum Phosphate:
- Aluminum phosphate is a white crystalline powder (A colorless liquid in aqueous form) with a foul odour).
- The density of Aluminum phosphate is 2.56 g.cm3 in solid-state.
- The Melting point of Aluminum phosphate is 1800°C.
- The Aluminum phosphate is decomposed at its Boiling point.
- Aluminum phosphate is Insoluble in water and very slightly soluble in HCl & HNO3.
- The molar mass of Aluminum phosphate is 121.9529 g/mol as a white crystalline powder.
- The refractive index of Aluminum phosphate is 1.546.
Question 3: What are the Chemical Properties of Aluminum Phosphate?
Answer:
- Aluminum phosphate reacts with Hydrochloric acid (HCL) and forms Aluminum trichloride (AlPO4) and Phosphoric acid (H3PO4).
AlPO4 + 3HCl ⇢ AlCl3 + H3PO4
- Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate (Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
Question 4: What are the uses of Aluminum Phosphate?
Answer:
The uses of Aluminum Phosphate are:
- Aluminum phosphate is used in Electronic and Electrical ventures, manufacturing of rubber and Adhesive, assembling Chemotherapeutic medications, and immunizations to improve immunogenicity.
- Also, aluminum phosphate is used as a Flame retardant, Antacid, Food added substance, Fungicide, Catalyst, and a white colorant for a very long time, concrete, dental concrete, erosion inhibitors.
Question 5: What happens when Magnesium chloride reacts with Aluminum Phosphate?
Answer:
Aluminum phosphate reacts with Magnesium chloride (MgCl2) and forms Aluminum trichloride (AlCl3) and Magnesium phosphate Mg3(PO4)2.
2AlPO4 + 3MgCl2 ⇢ Mg3(PO4)2 + 2AlCl3
| Фосфат алюминия | |
|---|---|
| Систематическое наименование |
Фосфат алюминия |
| Традиционные названия | Фосфат алюминия III, ортофосфат алюминия, алюминий фосфорнокислый |
| Хим. формула | AlPO4 |
| Рац. формула | AlPO4 |
| Состояние | твёрдое |
| Молярная масса | 121,95 г/моль |
| Плотность | 2,566 г/см³ |
| Температура | |
| • плавления | 1800 °C |
| Мол. теплоёмк. | 93,24 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1735 кДж/моль |
| Удельная теплота испарения | − |
| Рег. номер CAS | 7784-30-7 |
| PubChem | 16693906 |
| Рег. номер EINECS | 232-056-9 |
| SMILES |
O=P12O[Al](O1)O2 |
| InChI |
1S/Al.H3O4P/c;1-5(2,3)4/h;(H3,1,2,3,4)/q+3;/p-3 ILRRQNADMUWWFW-UHFFFAOYSA-K |
| RTECS | TB6450000 |
| ChemSpider | 58204 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде многочисленных минералов. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x=2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
- 4 AlPO4 → 2 Al2O3 + P4O10
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
- NaAlO2 + H3PO4 →t∘ AlPO4 + NaOH + H2O
- 2 Na3PO4 + Al2(SO4)3 → 2 AlPO4 ↓ + 3 Na2SO4
|
Соединения алюминия |
|---|
|
| Фосфат алюминия | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Фосфат алюминия(III) |
| Традиционные названия | Фосфат алюминия нейтральный, «триалюминийфосфат», ортофосфат алюминия, алюминий фосфорнокислый (орто-), трёхзамещённый |
| Хим. формула | AlPO4 |
| Рац. формула | AlPO4 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 121,95 г/моль |
| Плотность | 2,566 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1800 °C |
| Мол. теплоёмк. | 93,24 Дж/(моль·К) |
| Энтальпия | |
| • образования | −1735 кДж/моль |
| Удельная теплота испарения | − |
| Классификация | |
| Рег. номер CAS | 7784-30-7 |
| SMILES |
O=P12O[Al](O1)O2 |
| RTECS | TB6450000 |
| Безопасность | |
| ЛД50 | 6780-36500 мг/кг |
| Токсичность | 6 мг/см³ |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфат алюминия (ортофосфат алюминия(III), триалюминийфосфат, алюминий фосфорнокислый нейтральный) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое нетоксичное вещество, плохо растворимое в воде. Относится к IV классу опасности. Встречается в природе в виде многочисленных минералов. Образуется в виде студенистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе.
Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы[1]:
- α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
- β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Физические свойства
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте[2]. Хуже всего соль растворима в воде при pH 4,07—6,93[3].
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x = 2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Кислые фосфаты алюминия
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Минералы фосфата алюминия
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
- [math]displaystyle{ mathsf{2AlPO_4 rightarrow Al_2O_3+P_2O_{5}} }[/math]
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
- [math]displaystyle{ mathsf{NaAlO_2+H_3PO_4 xrightarrow{t ^circ} AlPO_4+NaOH+H_2O} }[/math]
- [math]displaystyle{ mathsf{2Na_3PO_4+Al_2(SO_4)_3 rightarrow2AlPO_4!downarrow+ 3Na_2SO_4} }[/math]
Сферы использования
- В качестве флюса в производстве керамики
- Добавка для цемента.
- Катализатор в органическом синтезе.
- Разрыхлитель в кондитерском деле.
- Антацид, и другие.
Безопасность
Фосфат алюминия неядовит. Среднесмертельная доза (ЛД50) для белых мышей при пероральном введении составляет 6780-36500 мг/кг.
В соответствии с ГОСТ 12.1.007-76 ПДК в рабочей зоне для фосфата алюминия составляет 6 мг/см³.
Примечания
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8.
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
Фосфат алюминия – это неорганическое вещество, широко применяемое в медицине, тяжёлой промышленности, отрасли производства продуктов питания, а также химии. Фосфат алюминия проявляет каталитическую активность, обладает выраженными фармацевтическими свойствами, за счёт чего активно используется для выпуска лекарственных препаратов. Особая формула алюминия фосфорнокислого позволяет использовать его в органическом синтезе и как улучшитель разрыхлителей в хлебопечении.
Содержание
- Что такое фосфат алюминия, виды, формула
- Физические свойства, внешний вид
- Химические свойства, уравнение, реакции
- Производство и получение
- Применение
- Применение алюминия фосфата в медицине
- Применение алюминия фосфата в химпроме и других сферах
- Инструкция по применению
- Показания
- Противопоказания, побочные эффекты, передозировка
- Способ применения и дозы
- Опасность, токсичность, меры предосторожности
- Где купить и сколько стоит
- Заключение
Что такое фосфат алюминия, виды, формула
Фосфат алюминия представляет собой алюминиевую соль фосфорной кислоты. Она состоит из атомов фосфора, который находится в степени окисления +5, алюминия, заряженного как +3 и кислорода с отрицательным зарядом -2. Химическая формула алюминия фосфата – AlPO4. По расположению составляющих компонентов выделяют два варианта вещества:
- альфа- AlPO4 – менее устойчив к температурным воздействиям, шестиугольный;
- бета- AlPO4 – высокая термоустойчивость, элементарная ячейка – куб.
По количеству атомов водорода, входящих в состав соединения, различают кислые и основные соли фосфатов алюминия. Они отличаются по свойствам и описываются разными формулами:
- формула алюминия трифосфата Al2(PO4)(OH)3;
- формула алюминия дигидрофосфата Al(H2PO4)3;
- формула алюминия монофостфата AlH3(PO4)2.
В природе фосфат алюминия чрезвычайно распространён. Он входит в состав более чем 15 минералов, месторождения которых расположены по всему миру. Один из них – лазулит – железно-алюминиевый фосфат представлен пирамидальными кристаллами небесно-синего цвета (формула – (Mg, Fe)Al2(OH,PO4)2). Иногда яркая окраска может отсутствовать, что обусловлено примесью магния. Характеризуется стеклянным блеском, излом неровный, черта надлома – белая. Лазулит не отличается крепкостью, его твёрдость по шкале Мооса составляет 5,5-6,5.
Химическая формула и структура фосфата алюминия
Фосфат алюминия находят в амблигонитах, которые формируют массивные агрегаты и зернистые высокоплотные массы (формула – (Li, Na)AlPO4(F,OH)). Для них характерна небольшая желтоватая люминесценция, цвет образований золотисто-жёлтый, иногда они не окрашены. Прозрачность крайне высокая, иногда минерал просвечивает, блестит. Внешне амблигонит можно перепутать с полевым шпатом, он довольно хрупкий. Его находят зачастую в литиевых рудах, в обогащённых фосфором пегматитовых жилах. Редко его подвергают огранке, такие экземпляры добывают в Бразилии, Намибии, США, Франции.
Физические свойства, внешний вид
Фосфат алюминия — это белый мелкокристаллический порошок без вкуса и запаха плотностью 2,566 г/см3. Свойство алюминия фосфата растворяться в воде выражено слабо, практически не растворим в ней и спиртах (этанол, метанол), показатель может меняться в зависимости от кислотности среды (хуже всего при pH – 4-6). Растворимость повышается в органических растворителях, таких как эфиры, фенол и бензол.
Фосфат алюминия формирует кристаллогидраты при выпаривании из водного раствора. Их общая формула – AlPO4 ∙ хH2O, где х = 2, 3, 5. При нагревании до 1800 °С вещество плавится, при достижении температурного режима 1300 °С происходит обезвоживание. Термолиз протекает при температуре 2000 °С.
Химические свойства, уравнение, реакции
Фосфат алюминия реагирует с ограниченным количеством веществ, по своим свойствам он довольно устойчив и малореактивен. При разогревании протекает реакция термического разложения:
2AlPO4 → Al2O3 + P2O5
Фосфат алюминия реагирует с хлоридом водорода, при этом образуется трёххлористый алюминий и фосфорная кислота:
AlPO4 + 3HCl → AlCl3 + H3PO4
По схожему механизму фосфат алюминия реагирует с азотной кислотой:
AlPO4 + 3HNO3 → Al(NO3)3 + H3PO4
При взаимодействии фосфата алюминия с хлористым магнием выделяется магниевый фосфат:
AlPO4 + 3MgCl2 → Mg3(PO4)2 + 2AlCl3
Производство и получение
В лабораторных условиях получение фосфата алюминия ведётся путём реакции ионного обмена, происходит замена алюминия натрием:
AlCl3 + Na3PO4 → AlPO4↓ + 3NaCl
Синтез ведётся и посредством прямой реакции воздействия на алюминий кислоты:
2Al + 2H3PO4 → 2AlPO4↓ + 3H2↑
Фосфат алюминия синтезируют в ходе реакции нейтрализации:
Al(OH)3 + H3PO4 → AlPO4↓ + 3H2O
В промышленности сырьём для добычи фосфата алюминия служит алюминат натрия либо сульфат алюминия, выделение происходит в процессе реакции обмена:
NaAlO2 + H3PO4 → AlPO4↓ + NaOH + H2O
2Na3PO4 + Al2(SO4)3 → 2AlPO4↓ + 3Na2SO4
Применение
Фосфат алюминия используется в производстве керамических изделий и выступает важной добавкой для затвердевания готовой смеси. Кроме того, он важен для выпуска строительных материалов, смесей для кондитерского дела, лекарств.
Применение алюминия фосфата в медицине
Фосфат алюминия обладает собственной фармакологической активностью. Благодаря специфическим свойствам алюминий фосфат способен впитывать в себя аллергены, тяжёлые металлы, токсины и патогены. Он проявляет комплексное действие и характеризуется следующими действиями:
- Адсорбирующее: способность поглощать инородные для организма частицы, понижая негативный эффект интоксикации и уменьшая проявление симптомов отравления.
- Антацидное: попадая в желудок, фосфат алюминия связывается с желудочным соком, основным компонентом которого является соляная кислота. При этом он понижает общее значение pH, инактивируя хлористый водород через формирование трихлорида алюминия. В результате реакция среды повышается до 3,5-5. Кроме того, применение алюминия фосфата позволяет затормозить пепсин, расщепляющий белки.
- Противоязвенное: понижает кровоточивость язв, способствует заживлению ранок через адсорбцию патогенных вирусов и бактерий, а также газов и эндо-, экзотоксинов, раздражающих слизистую оболочку, которая легко травмируется при язвенной болезни.
- Обволакивающее: покрывает стенки желудка защитной плёнкой, предохраняя от повреждения ткани, которые находятся также под защитой слоя естественно секретируемой слизи.
Применение алюминия фосфата в химпроме и других сферах
Большое значение имеет фосфат алюминия для изготовления керамических вещей. Он является флюсом – вспомогательным веществом, необходимым для стеклообразования после перемешивания с глиной. Без добавления фосфата алюминия керамика становится менее привлекательной и более хрупкой.
Фосфат алюминия – пластификатор для цементных смесей. Он улучшает замешивание цемента, повышает его морозостойкость, воздухопроницаемость и твёрдость. При замешивании его в состав продлевается срок службы стройматериала, его устойчивость к плесневым грибкам и разрушению.
В органическом синтезе реагент ценят за его низкий реакционный потенциал, он может ускорять реакции других соединений, сам при этом не вступая в взаимосвязь с ними и не расходуясь. Он выступает как составной компонент разрыхлителей при выпекании сдоб и хлеба (кроме алюминия – натрий, либо другие фосфаты металлов), усиливая выработку углекислого газа в процессе подъёма теста, делая его более мягким и воздушным с сохранением хрустящей корочки.
Инструкция по применению
Показания
Фосфат алюминия назначают при наличии таких заболеваний, как:
- язвы желудка и двенадцатиперстной кишки;
- гастрит;
- рефлюкс-эзофагит;
- грыжа диафрагмы;
- диарея;
- диспепсия;
- интоксикация, сопровождающаяся выраженными желудочно-кишечными расстройствами.
Противопоказания, побочные эффекты, передозировка
Главное противопоказание фосфата алюминия – это индивидуальная непереносимость вещества. Она выражается в аллергии, кашле, тошноте, боли в животе. Приём лекарства противопоказан при тяжёлой печеночной недостаточности, с осторожностью его принимают люди пожилого возраста, при беременности и в период лактации.
Способ применения и дозы
Фосфат алюминия применяют в форме суспензии, геля внутрь сразу либо после предварительного размешивания в стакане воды. Взрослым и детям после 6 лет нужно употреблять 16-32 г средства 2-3 раза в день при возникновении неприятных ощущений для устранения дискомфорта. Детям до 6 месяцев назначают по 4 мг препарата после каждого из кормлений.
Опасность, токсичность, меры предосторожности
Фосфат алюминия относится к 4 классу опасности – малоопасные вещества. Тем не менее, при попадании на кожу порошка он может вызывать раздражение, покраснение и зуд. При работе с солью нужно надевать защитную одежду (перчатки), соблюдать основные гигиенические правила.
Где купить и сколько стоит
Фосфат алюминия продают заводы-производители по оптовым ценам, стоимость 1 кг – 116 рублей. Медикамент продают в аптеках по цене от 225 рублей. Реагент можно приобрести в специализированных интернет-магазинах от 400 рублей за 100 грамм.
Заключение
Фосфат алюминия – это неорганическое вещество, востребованное во многих сферах деятельности Основная масса производимого фосфата уходит на нужды фармацевтики, где он применяется как антацид и адсорбент.
Читайте также:
- Фосфат натрия: описание, реакции, вред, применение
- Фосфат калия: получение, свойства, реакции, польза и вред, применение
- Хлорид алюминия: свойства, применение
- Нитрат алюминия: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…