From Wikipedia, the free encyclopedia
|
|

|
|
| Names | |
|---|---|
| IUPAC name
ammonium phosphate |
|
| Other names
triammonium phosphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.709 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
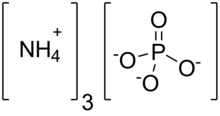
(NH4)3PO4 |
| Molar mass | 149.09 g/mol |
| Appearance | White, tetrahedral crystals |
|
Solubility in water |
58.0 g/100 mL (25 °C) |
| Solubility | Insoluble in acetone[2] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H319 |
|
Precautionary statements |
P264, P270, P280, P301+P312, P305+P351+P338, P330, P337+P313, P501 |
| NFPA 704 (fire diamond) |
2 0 0 |
| Thermochemistry | |
|
Std enthalpy of |
−1671.9 kJ/mol |
| Related compounds | |
|
Other cations |
Trisodium phosphate Tripotassium phosphate |
|
Related compounds |
Diammonium phosphate Monoammonium phosphate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ammonium phosphate is the inorganic compound with the formula (NH4)3PO4. It is the ammonium salt of orthophosphoric acid. A related «double salt», (NH4)3PO4.(NH4)2HPO4 is also recognized but is impractical to use. Both triammonium salts evolve ammonia. In contrast to the unstable nature of the triammonium salts, the diammonium phosphate (NH4)2HPO4 and monoammonium salt (NH4)H2PO4 are stable materials that are commonly used as fertilizers to provide plants with fixed nitrogen and phosphorus.[3]
Preparation of triammonium phosphate[edit]
Triammonium phosphate can be prepared in the laboratory by treating 85% phosphoric acid with 30% ammonia solution:[citation needed]
- H3PO4 + 3 NH3 → (NH4)3PO4
(NH4)3PO4 is a colorless, crystalline solid. The solid, which has the odor of ammonia, is readily soluble in water. The salt converts to diammonium hydrogen phosphate (NH4)2HPO4.
See also[edit]
- Ammonium polyphosphate
- Monoammonium phosphate
- Diammonium phosphate
References[edit]
- ^
Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 4–42, 5–19. ISBN 978-0-8493-0594-8. - ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
ammonium phosphate |
|
| Other names
triammonium phosphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.709 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
(NH4)3PO4 |
| Molar mass | 149.09 g/mol |
| Appearance | White, tetrahedral crystals |
|
Solubility in water |
58.0 g/100 mL (25 °C) |
| Solubility | Insoluble in acetone[2] |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H319 |
|
Precautionary statements |
P264, P270, P280, P301+P312, P305+P351+P338, P330, P337+P313, P501 |
| NFPA 704 (fire diamond) |
2 0 0 |
| Thermochemistry | |
|
Std enthalpy of |
−1671.9 kJ/mol |
| Related compounds | |
|
Other cations |
Trisodium phosphate Tripotassium phosphate |
|
Related compounds |
Diammonium phosphate Monoammonium phosphate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Ammonium phosphate is the inorganic compound with the formula (NH4)3PO4. It is the ammonium salt of orthophosphoric acid. A related «double salt», (NH4)3PO4.(NH4)2HPO4 is also recognized but is impractical to use. Both triammonium salts evolve ammonia. In contrast to the unstable nature of the triammonium salts, the diammonium phosphate (NH4)2HPO4 and monoammonium salt (NH4)H2PO4 are stable materials that are commonly used as fertilizers to provide plants with fixed nitrogen and phosphorus.[3]
Preparation of triammonium phosphate[edit]
Triammonium phosphate can be prepared in the laboratory by treating 85% phosphoric acid with 30% ammonia solution:[citation needed]
- H3PO4 + 3 NH3 → (NH4)3PO4
(NH4)3PO4 is a colorless, crystalline solid. The solid, which has the odor of ammonia, is readily soluble in water. The salt converts to diammonium hydrogen phosphate (NH4)2HPO4.
See also[edit]
- Ammonium polyphosphate
- Monoammonium phosphate
- Diammonium phosphate
References[edit]
- ^
Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, Florida: CRC Press. pp. 4–42, 5–19. ISBN 978-0-8493-0594-8. - ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
Фосфат аммония
Поиск химических веществ по названиям или формулам.
Категории веществ
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы). Введите часть названия или формулу для поиска: Языки: По умолчанию | Все возможные | Из списка | Фосфат аммония
Брутто-формула: Категории: PubChem CID: 159282 Названия Русский:
English:
Варианты формулы:
|
 |
|
 |
|
| Имена | |
|---|---|
| Название IUPAC фосфат аммония | |
| Другие имена фосфат триаммония | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.709 |
| Номер EC |
|
| PubChem CID |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБАЕТСЯ
|
|
| Свойства | |
| Химическая формула | (NH 4)3PO4 |
| Молярная масса | 149,09 г / моль |
| Внешний вид | Белые, тетраэдрические кристаллы |
| Растворимость в воде | 58,0 г / 100 мл (25 ° C) |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| GH S характеристики опасности | H302, H319 |
| Меры предосторожности GHS | P264, P270, P280, P301 + 312, P305 + 351 + 338, P330, P337 + 313, P501 |
| NFPA 704 (огненный алмаз) |  0 2 0 0 2 0 |
| Термохимия | |
| Стандартная энтальпия. образования (ΔfH298) | −1671,9 кДж / моль |
| Родственные соединения | |
| Другие катионы | Тринатрийфосфат. Трикалия фосфат |
| Родственные соединения | Диаммонийфосфат. Моноаммонийфосфат |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F ], 100 кПа). | |
| Ссылки в ink | |
Фосфат аммония представляет собой аммонийную соль ортофосфорной кислоты. Это очень нестабильное соединение с формулой (NH 4)3PO4. Из-за своей нестабильности оно неуловимо и не имеет коммерческой ценности. Родственная «двойная соль», (NH 4)3PO4(NH 4)2HPO 4 также известен, но он слишком нестабилен для практического использования. Обе соли триаммония выделяют аммиак. В отличие от нестабильной природы солей триаммония, диаммонийфосфат (NH 4)2HPO 4моноаммониевая соль (NH 4)H2PO4,- стабильные материалы, которые обычно используются в качестве удобрений для обеспечения растений фиксированным азотом и фосфором.
Получение триаммонийфосфата
Фосфат триаммония можно получить в лаборатории, обработав 85% фосфорную кислоту 30% раствором аммиака:
- H3PO4+ 3 NH 3 → (NH 4)3PO4
(NH 4)3PO4- бесцветное кристаллическое твердое вещество. Твердое вещество, имеющее запах аммиака, легко растворимо в воде. Соль превращается в гидрофосфат диаммония (NH 4)2HPO 4.
См. Также
- полифосфат аммония
- моноаммонийфосфат
- диаммоний фосфат
Ссылки
.
- Справочник
- Справочник структурных формул
- ф
- Фосфат аммония
Фосфат аммония
(NH4)3PO4
(N(-3)H(+1)4)3P(+5)O(-2)4
H-N^+<`|H><|H>-H-0O`^-# -P|O`|<`|O^-`|0H`|N^+<`-H><-H>`|H>-O^-# -0H-N^+<`|H><|H>-H
Брутто-формула: H12N3O4P
Молекулярная масса: 149.087
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород (Hydrogen) | 1.008 | 12 | 8.1% |
| N | Азот (Nitrogen) | 14.007 | 3 | 28.2% |
| O | Кислород (Oxygen) | 15.999 | 4 | 42.9% |
| P | Фосфор (Phosphorus) | 30.974 | 1 | 20.8% |
Синонимы
- Ортофосфат аммония
- Фосфат аммония
- триаммонийфосфат
- AC1L4LKC
- Ammonium phosphate
- EINECS 233-793-9
- EINECS 270-200-2
- LS-192343
- Phosphoric acid, ammonium salt (1:3)(CAS)
- Phosphoric acid, di-C4-18-alkyl esters, ammonium salts
- Phosphoric acid, triammonium salt
- Triammonium orthophosphate
- triammonium phosphate
- triazanium phosphate
- triazanium;phosphate(IUPAC)
Входит в группы
Неорганические соли
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Фосфат аммония: состав, свойства, получение, применение
Фосфат аммония: состав, свойства, получение, применение — Наука
Содержание:
В фосфат аммония Это семейство солевых соединений, которые образуются в результате реакции между фосфорной кислотой и аммиаком. Согласно неорганической номенклатуре, это название соответствовало бы соли, химическая формула которой (NH4)3PO4, состоящий из катионов аммония, NH4 + , и фосфат-анионы PO4 3- .
Изображение этих ионов показано на нижнем изображении. (NH4)3PO4 он также известен как трехосновный фосфат аммония или фосфат триаммония. Эти названия связаны с тем, что, как уже отмечалось, ЗП4 3- имеет три отрицательных атома кислорода, способных принимать протоны, H + , от окружающей кислоты.
Именно это и происходит с NH4 + собственной структуры. Следовательно, фосфат аммония нестабилен, разлагается на NH.4ЧАС2PO4 и NH3. Поэтому эта соль источает сильный запах аммиака.
Другие соли фосфата аммония более стабильны и полезны. Например, они используются в сельском хозяйстве в качестве удобрений, а кристаллы некоторых из них даже имеют оптическое и физическое применение.
Это семейство солей простое, но разнообразное при изменении кислотности среды, в которой они находятся.
Состав
Фосфат аммония состоит из ионов NH.4 + и ПО4 3- , обе геометрии тетраэдра. Электроны ПО4 3- распределены между тремя атомами кислорода связей P-O – , отрицательный заряд которого сильно притягивает NH4 + . Следовательно, можно было подумать, что кристаллическая структура (NH4)3PO4 сильный.
В нем ионы NH4 + и ПО4 3- Они находятся в соотношении 3: 1, что означает, что в их кристаллах в три раза больше ионов NH.4 + что ионов ПО4 3- . Таким образом, их электростатические взаимодействия в конечном итоге определяют тетрагональный кристалл.
То же самое происходит частично и с другими солями этого фосфата: (NH4)2HPO4 и NH4ЧАС2PO4, в котором ПО4 3- выиграл один или два H + соответственно. В его кристаллах, в основном тетрагональных, электростатические взаимодействия слабее из-за меньшего ионного заряда.
Однако они более энергетически устойчивы, особенно NH4ЧАС2PO4, так как он имеет самую высокую температуру плавления.
С другой стороны, соли фосфата аммония также могут образовывать гидраты, включая молекулы воды в свои кристаллические структуры.
Свойства фосфата аммония
Имена
(NH4)3PO4
Эта формула, строго следуя неорганической номенклатуре, соответствует соли фосфата аммония. Другие допустимые имена:
-Тиблоосновный фосфат аммония
-Триаммоний или триаммоний фосфат
(NH4)2HPO4
У этой соли есть несколько наименований согласно номенклатуре предпочтений. Наиболее распространенными, помимо диаммонийфосфата, являются:
-Фосфат аммонийной кислоты
-Двухосновной фосфат аммония
В отличие от (NH4)3PO4, состоит из ионов NH4 + и HPO4 2- в соотношении 2: 1.
NH4ЧАС2PO4
Эта соль соответствует «наиболее кислой версии» фосфата аммония. В нем ПО4 3- выиграл два H + , уменьшая его ионный заряд до H2PO4 – . Поэтому их наиболее распространенные названия:
-Одноосновной фосфат аммония (потому что в нем почти нет кислорода, способного принимать протоны)
-Диацид фосфат аммония
Некоторые из приведенных выше имен также можно изменить на:
Как видно, возможных названий много. Важно знать, как соотнести их непосредственно с формулами любой из трех солей, соответствующих семейству фосфатов аммония.
Молярные массы
Внешность
Соли фосфата аммония объединяет то, что все они белые. За исключением триаммонийного или трехосновного фосфата аммония, другие соли не выделяют запаха аммиака при нормальных условиях.
Точки плавления
(NH4)3PO4 он ломается, прежде чем сможет расплавиться. Между тем, (NH4)2HPO4 плавится при 155 ºC, а NH4ЧАС2PO4 при 190 ° С. Самая высокая температура плавления NH4ЧАС2PO4 указывает на большую стабильность и более прочную ионную связь.
Точки кипения
Безмерно, так как они разлагаются при плавлении.
Растворимость
Соли фосфата аммония хорошо растворимы в воде, так как (NH4)3PO4 гигроскопичное твердое вещество. Однако они нерастворимы в этаноле, ацетоне и жидком аммиаке.
Разложение
Все соли фосфата аммония могут выделять аммиак при разложении. Кроме того, в зависимости от интенсивности тепла они разлагаются на фосфорную кислоту, в конечном итоге выделяя вредные газы оксидов азота и фосфора.
Получение
Соли фосфата аммония получают в результате реакции нейтрализации между фосфорной кислотой и аммиаком:
Как можно видеть, если желательно получить «менее основные» фосфаты аммония, что означает то же самое, что и «более кислые», необходимо изменять пропорции реагентов, которые добавляют в реактор. Обычно оксид фосфора, P2ИЛИ5, как источник фосфора для соответствующей кислоты.
На самом деле они NH4ЧАС2PO4 (MAP, аббревиатура на английском языке: моноаммонийфосфат) и (NH4)2HPO4 (DAP) соли фосфата аммония, имеющие самую высокую коммерческую ценность. Между тем, (NH4)3PO4 он наименее коммерциализирован именно потому, что он наиболее нестабилен и, возможно, самый дорогой в приготовлении.
Приложения
Одним из непосредственных последствий предыдущего абзаца является то, что большинство случаев использования солей фосфата аммония связано с NH4ЧАС2PO4 и (NH4)2HPO4. (NH4)3PO4С другой стороны, от него почти нет никакой пользы, так как он быстро разлагается.
Удобрения
Соли фосфата аммония — хорошие удобрения, так как они обеспечивают два важных питательных вещества для развития растений: азот и фосфор. Кроме того, они растворимы в воде, поэтому быстро становятся доступными в почве для правильного поглощения корнями.
Они хранятся без каких-либо проблем, и, если нет пожара, они не выделяют аммиак — газ, который может повредить ткани растений.
Антипирены
При разложении солей фосфата аммония выделяются различные газы, которые, хотя и вредны, вытесняют кислород из воздуха при полном пожаре. Именно поэтому их используют как антипирены. Таким образом, распространение пламени замедляется или замедляется.
Оптика и физика
NH4ЧАС2PO4 Он используется в оптических приложениях, потому что его кристаллы демонстрируют двойное лучепреломление, то есть имеют двойное лучепреломление. Они также обладают пьезоэлектрическими свойствами, поэтому используются в преобразователях.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e21ac087c4d9717 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
источники:
http://ru1.warbletoncouncil.org/fosfato-amonio-4643
http://gomolog.ru/reshebniki/9-klass/rudzitis-i-feldman-2019/26/zadanie-3.html
Аммония фосфаты
- Аммония фосфаты
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
Смотреть что такое «Аммония фосфаты» в других словарях:
-
АММОНИЯ ФОСФАТЫ — Дигидроортофосфат (моноаммонийфосфат) NH4H2PO4 бесцв. кристаллы (см. табл.) с тетрагон. решеткой ( а =0,750 нм, с= 0,755 нм); Н о пл35,6 кДж/моль; S о298 152 Дж/(моль*К); разлагается с выделением NH3; давление разложения (Па): 8,0 (125,1 … Химическая энциклопедия
-
Фосфаты — соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат анионов, метафосфаты с кольцеобразным (циклическим) фосфат анионом и… … Большая советская энциклопедия
-
Фосфаты — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
-
ФОСФАТЫ КОНДЕНСИРОВАННЫЕ — соли конденсированных фосфорных K T (см. Фосфора кислоты, Фосфаты неорганические), в к рых степень окисления фосфора +5. Подобно к там образуют гомологич. ряды с цепочечным, циклич. и разветвленным строением аниона. Построены из тетраэдров PO4,… … Химическая энциклопедия
-
Фосфаты аммония — аммониевые соли фосфорных кислот (См. Фосфорные кислоты), см. в ст. Фосфаты … Большая советская энциклопедия
-
Ортофосфат аммония-магния — Общие Систематическое наименование Ортофосфат аммония магния Химическая формула NH4MgPO4 Физические свойства Состояние (ст. ус … Википедия
-
Дигидроортофосфат аммония — Дигидроортофосфат аммония … Википедия
-
Гидрофосфат аммония — Гидрофосфат аммония … Википедия
-
цитратно-растворимые фосфаты удобрения — Фосфаты удобрения, растворимые в щелочном растворе лимоннокислого аммония. [ГОСТ 20432 83] Тематики удобрения Обобщающие термины минеральные удобрения … Справочник технического переводчика
-
КАЛЬЦИЯ ФОСФАТЫ — бесцв. кристаллы. Ортофосфат (трикальцийфосфат) Са 3 (РО 4)2 существует в двух модификациях a и b (см. табл.); в воде плохо раств. (0,0025% по массе при 20 °С); легко взаимод. с к тами, образуя гидрофосфаты. Входит в состав минералов… … Химическая энциклопедия
