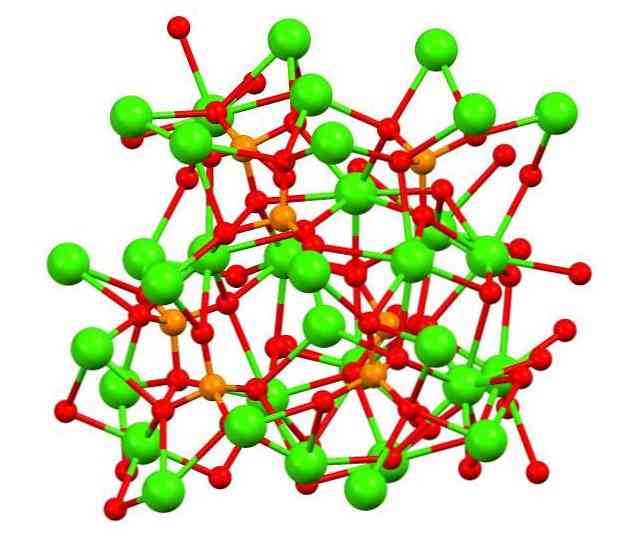
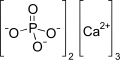
Неорганическое вещество, соль металла кальция и ортофосфорной кислоты.
Формула
Ca3(PO4)2
Альтернативные названия
Трикальцийфосфат, фосфорнокислый кальций.
Ортофосфат кальция часто встречается в природе, входя в состав таких минералов, как апатит, гидроксиапатит и фосфорит.
Свойства фосфата кальция
Физические свойства
Фосфат кальция представляет собой бесцветное или белое кристаллическое вещество (абразив), чрезвычайно плохо растворимое в воде. Может существовать в двух модификациях:
- Моноклинная сингония.
- Гексагональная сингония.
| Свойство | Описание |
|---|---|
| Молярная масса вещества | 310,17 г/моль |
| Плотность | 2,81 г/см3 |
| Температура плавления | 1670 оC |
Легко вступает в реакцию с кислотами, образуя при этом более растворимые гидрофосфаты.
Химические свойства
Фосфат кальция легко вступает в реакцию с сильными кислотами:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
При температурном воздействии (нагревании) – разлагается с образованием оксида фосфора:
Ca3(PO4)2=P2O5+3CaO
Также вступает в реакцию с солями с образованием нерастворимого осадка:
Ca3(PO4)2 + 3Li2SO4 = 2Li3PO4↓ + 3CaSO4
Возможна реакция с оксидом азота при участии воды:
Ca3(PO4)2+ 3NO2 + H2O → Ca(NO3)2 + 2CaHPO4 + NO
При высоких температурах (более 1000 оC) вступает в реакцию с углеродом:
Ca3(PO4)2 + 8C = Ca3P2 + 8CO
Получение
В основе главных способов получения фосфата кальция лежат реакции ионного обмена:
3Ca(NO3)2 + 2Na2HPO4 = Ca3(PO4)2 +4NaNO3 +2HNO3
На известь воздействуют ортофосфорной кислотой:
3Ca(OH)2 +2H3PO4 = Ca3(PO4)2 + 6H2O.
Применение
Фосфат кальция активно применяется во многих отраслях жизни человека. Он часто используется как добавка в корм животных и птиц с целью восполнения недостатка кальция. Его добавляют как компонент в многие лекарственные препараты в фармацевтике и фармакологии. Используют также при производстве стекла и абразивов.
В пищевой промышленности он получил кодовое название – добавка Е341. Используют его как разрыхлитель, для фиксации цвета, в качестве стабилизатора.
Добавка Е431 применяется при производстве сухого молока, плавленных сырков, мороженого, хлебобулочных и ликероводочных изделий, рыбной и мясной продукции, спортивного пита-ния, сухих завтраков, травяных чаев, консервов, рафинированных масел, выпечки и многого другого. Полезна или вредна данная пищевая добавка для организма человека – сказать однозначно нельзя. Несмотря на то, что она составляющая костной ткани и является источником кальция, все же некоторые ученые активно говорят о ее вреде, который главным образом может быть нанесен бесперебойной работе желудочно-кишечного тракта.
В сельском хозяйстве он эффективен в качестве минерального удобрения, особенно для кислых грунтов.
Состав многих зубных паст и порошков также содержит фосфат кальция.
С целью получения фосфора, а также фосфорной кислоты его применяют как основное сырье.
Строительным материалом для костей и зубов человека также является фосфат кальция.
Тест по теме «Фосфат кальция»
| Фосфат кальция | |
| Общие | |
|---|---|
| Систематическое наименование | Фосфат (ортофосфат) кальция |
| Химическая формула | Ca3(PO4)2 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 310,18 г/моль |
| Плотность | 2,81 г/см³ |
| Термические свойства | |
| Температура плавления | >1200 °C |
| Молярная теплоёмкость (ст. усл.) | 231,6 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -4112,9 кДж/моль |
Фосфат (ортофосфат) кальция Ca3(PO4)2 — неорганическое вещество, соль кальция и ортофосфорной кислоты.
Свойства
Ортофосфат кальция ещё называется фосфорнокислый кальций. Ортофосфат кальция представляет собой бесцветное кристаллическое вещество. Существует в двух модификациях — α (моноклинная сингония) и β (гексагональная сингония). В воде растворяется плохо — 0,0025 % (масс.) при 20 °C.
При действии кислот переходит в более растворимые гидрофосфаты.
Нахождение в природе
Ортофосфат кальция широко распространён в природе. Входит в состав минералов фосфорита, апатита, гидроксилапатита.
Биологическая роль
Является основным строительным материалом для костей и зубов позвоночных.
Применение
Применяется как источник кальция для подкормки скота и птиц. В составе фосфоритной муки используется как удобрение для кислых почв. Применяют в производстве керамики и стекла, абразивов. Является исходным сырьём для получения фосфорной кислоты и фосфора.
См. также
- Гидрофосфат кальция
- Дигидрофосфат кальция
- Фосфорные удобрения
Литература
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения кальция |
|---|
|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2Ca) • Бисульфид кальция (Ca(HS)2) • Борат кальция (Ca3(BO3)2) • Бромид кальция (CaBr2) • Вольфрамат кальция (CaWO4) • Гексаборид кальция (CaB6) • Гексафторсиликат кальция (CaSiF6) • Гидрид кальция (CaH2) • Гидроксид кальция (Ca(OH)2) • Гидроортофосфат кальция (CaHPO4) • Гипофосфит кальция (Ca(PH2O2)) • Гипохлорит кальция (Ca(ClO)2) • Глицерофосфат кальция (C3H7CaO6P) • Глюконат кальция (C12H22CaO14) • Дигидрокарбонат кальция (Ca(HCO3)2) • 2,5-дигидроксибензолсульфонат кальция (C12H10CaO10S2) • Дигидроортофосфат кальция (Ca(H2PO4)2) • Иодат кальция (Ca(IO3)2) • Иодид кальция (CaI2) • Карбид кальция (CaC2) • Карбонат кальция (CaCO3) • Моносилицид кальция (CaSi) • Нитрат кальция (Са(NО3)2) • Нитрид кальция (Ca3N2) • Оксалат кальция (СаС2О4) • Оксид кальция (CaO) • Ортофосфат кальция (Ca3(PO4)2) • Перманганат кальция (Ca(MnO4)2) • Пероксид кальция (CaO2) • Пирофосфат кальция (Ca2P2O7) • Силикат кальция (CaSiO3) • Силицид дикальция (Ca2Si) • Силицид кальция (CaSi2) • Сульфат кальция (CaSO4) • Сульфид кальция (CaS) • Сульфит кальция (CaSO3) • Тетрагидроалюминат кальция (Ca(AlH4)2) • Титанат кальция (CaTiO3) • Триметафосфат кальция (Ca3(P3O9)2) • Флюорит (CaF2) • Формиат кальция (Ca(HCOO)2) • Фосфид кальция (Ca3P2) • Фторид кальция (CaF2) • Хлорат кальция (Ca(ClO3)2) • Хлорид кальция (CaCl2) • Хлорная известь (Ca(Cl)OCl) • Хромат кальция (CaCrO4) • Цианамид кальция (CaCN2) • Цианид кальция (Ca(CN)2) • Цитрат кальция (Ca3(C6H5O7)2) • |
From Wikipedia, the free encyclopedia
For the function of calcium phosphate in organisms, see Calcium metabolism.
Calcium Phosphate nanowires seen in SEM
The term calcium phosphate refers to a family of materials and minerals containing calcium ions (Ca2+) together with inorganic phosphate anions. Some so-called calcium phosphates contain oxide and hydroxide as well. Calcium phosphates are white solids of nutritious value[1] and are found in many living organisms, e.g., bone mineral and tooth enamel.[2] In milk, it exists in a colloidal form in micelles bound to casein protein with magnesium, zinc, and citrate–collectively referred to as colloidal calcium phosphate (CCP).[3] Various calcium phosphate minerals are used in the production of phosphoric acid and fertilizers. Overuse of certain forms of calcium phosphate can lead to nutrient-containing surface runoff and subsequent adverse effects upon receiving waters such as algal blooms and eutrophication (over-enrichment with nutrients and minerals).[citation needed]
Orthophosphates, di- and monohydrogen phosphates[edit]
These materials contain Ca2+ combined with PO3−
4, HPO2−
4, or H
2PO−
4:
- Monocalcium phosphate, E341 (CAS# 7758-23-8 for anhydrous; CAS#10031-30-8 for monohydrate: Ca(H2PO4)2 and Ca(H2PO4)2(H2O)
- Dicalcium phosphate (dibasic calcium phosphate), E341(ii) (CAS# 7757-93-9): CaHPO4 (mineral: monetite), dihydrate CaHPO4(H2O)2 (mineral: brushite) and monohydrate CaHPO4(H2O)
- Tricalcium phosphate (tribasic calcium phosphate or tricalcic phosphate, sometimes referred to as calcium phosphate or calcium orthophosphate, whitlockite), E341(iii) (CAS#7758-87-4): Ca3(PO4)2
- Octacalcium phosphate (CAS# 13767-12-9): Ca8H2(PO4)6·5H2O
- Amorphous calcium phosphate, a glassy precipitate of variable composition that may be present in biological systems.
Di- and polyphosphates[edit]
These materials contain Ca2+ combined with the polyphosphates, such as P
2O4−
7 and triphosphate P
3O5−
10:
- Dicalcium diphosphate (CAS#7790-76-3]: Ca2P2O7
- Calcium triphosphate (CAS# 26158-70-3): Ca5(P3O10)2
Hydroxy- and oxo-phosphates[edit]
These materials contain other anions in addition to phosphate:
- Hydroxyapatite Ca5(PO4)3(OH)
- Apatite Ca10(PO4)6(OH,F,Cl,Br)2
- Tetracalcium phosphate (CAS#1306-01-0): Ca4(PO4)2O
References[edit]
- ^ Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ «What Substances Make Up Your Teeth? – Affordable Dental Care». www.towncaredental.com. 2015-07-15. Retrieved 2021-01-29.
- ^ A. Y. Tamime, ed. (2006). Brined cheeses — The Society of Dairy Technology (SDT). Wiley-Blackwell. ISBN 978-1-4051-2460-7.
From Wikipedia, the free encyclopedia
For the function of calcium phosphate in organisms, see Calcium metabolism.
Calcium Phosphate nanowires seen in SEM
The term calcium phosphate refers to a family of materials and minerals containing calcium ions (Ca2+) together with inorganic phosphate anions. Some so-called calcium phosphates contain oxide and hydroxide as well. Calcium phosphates are white solids of nutritious value[1] and are found in many living organisms, e.g., bone mineral and tooth enamel.[2] In milk, it exists in a colloidal form in micelles bound to casein protein with magnesium, zinc, and citrate–collectively referred to as colloidal calcium phosphate (CCP).[3] Various calcium phosphate minerals are used in the production of phosphoric acid and fertilizers. Overuse of certain forms of calcium phosphate can lead to nutrient-containing surface runoff and subsequent adverse effects upon receiving waters such as algal blooms and eutrophication (over-enrichment with nutrients and minerals).[citation needed]
Orthophosphates, di- and monohydrogen phosphates[edit]
These materials contain Ca2+ combined with PO3−
4, HPO2−
4, or H
2PO−
4:
- Monocalcium phosphate, E341 (CAS# 7758-23-8 for anhydrous; CAS#10031-30-8 for monohydrate: Ca(H2PO4)2 and Ca(H2PO4)2(H2O)
- Dicalcium phosphate (dibasic calcium phosphate), E341(ii) (CAS# 7757-93-9): CaHPO4 (mineral: monetite), dihydrate CaHPO4(H2O)2 (mineral: brushite) and monohydrate CaHPO4(H2O)
- Tricalcium phosphate (tribasic calcium phosphate or tricalcic phosphate, sometimes referred to as calcium phosphate or calcium orthophosphate, whitlockite), E341(iii) (CAS#7758-87-4): Ca3(PO4)2
- Octacalcium phosphate (CAS# 13767-12-9): Ca8H2(PO4)6·5H2O
- Amorphous calcium phosphate, a glassy precipitate of variable composition that may be present in biological systems.
Di- and polyphosphates[edit]
These materials contain Ca2+ combined with the polyphosphates, such as P
2O4−
7 and triphosphate P
3O5−
10:
- Dicalcium diphosphate (CAS#7790-76-3]: Ca2P2O7
- Calcium triphosphate (CAS# 26158-70-3): Ca5(P3O10)2
Hydroxy- and oxo-phosphates[edit]
These materials contain other anions in addition to phosphate:
- Hydroxyapatite Ca5(PO4)3(OH)
- Apatite Ca10(PO4)6(OH,F,Cl,Br)2
- Tetracalcium phosphate (CAS#1306-01-0): Ca4(PO4)2O
References[edit]
- ^ Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2008). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ «What Substances Make Up Your Teeth? – Affordable Dental Care». www.towncaredental.com. 2015-07-15. Retrieved 2021-01-29.
- ^ A. Y. Tamime, ed. (2006). Brined cheeses — The Society of Dairy Technology (SDT). Wiley-Blackwell. ISBN 978-1-4051-2460-7.
Морфемный разбор слова:
Однокоренные слова к слову:
Фосфат кальция
| Фосфат кальция | |
| Общие | |
|---|---|
| Систематическое наименование | Фосфат (ортофосфат) кальция |
| Химическая формула | Ca3(PO4)2 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 310,18 г/моль |
| Плотность | 2,81 г/см³ |
| Термические свойства | |
| Температура плавления | >1200 °C |
| Молярная теплоёмкость (ст. усл.) | 231,6 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -4112,9 кДж/моль |
Содержание
Свойства
Ортофосфат кальция ещё называется фосфорнокислый кальций. Ортофосфат кальция представляет собой бесцветное кристаллическое вещество. Существует в двух модификациях — α (моноклинная сингония) и β (гексагональная сингония). В воде растворяется плохо — 0,0025 % (масс.) при 20 °C.
При действии кислот переходит в более растворимые гидрофосфаты.
Нахождение в природе
Ортофосфат кальция широко распространён в природе. Входит в состав минералов фосфорита, апатита, гидроксилапатита.
Биологическая роль
Является основным строительным материалом для костей и зубов позвоночных.
Применение
Применяется как источник кальция для подкормки скота и птиц. В составе фосфоритной муки используется как удобрение для кислых почв. Применяют в производстве керамики и стекла, абразивов. Является исходным сырьём для получения фосфорной кислоты и фосфора.
См. также
Литература
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Фосфат кальция» в других словарях:
ФОСФАТ — ФОСФАТ, фосфата, муж. (от слова фосфор). 1. Соль фосфорной кислоты, применяемая в технике, медицине и (как составная часть удобрения) в агрономии (хим.). Фосфат кальция. Фосфат алюминия. 2. Минерал, содержащий фосфорную кислоту (минер.). Толковый … Толковый словарь Ушакова
кальция вторичный кислый фосфат — kalcio hidrofosfatas statusas T sritis chemija formulė CaHPO₄ atitikmenys: angl. calcium biphosphate; calcium hydrogen phosphate rus. кальций вторичный кислый фосфорнокислый; кальция биросфат; кальция вторичный кислый фосфат; кальция гидрофосфат… … Chemijos terminų aiškinamasis žodynas
кальция биросфат — kalcio hidrofosfatas statusas T sritis chemija formulė CaHPO₄ atitikmenys: angl. calcium biphosphate; calcium hydrogen phosphate rus. кальций вторичный кислый фосфорнокислый; кальция биросфат; кальция вторичный кислый фосфат; кальция гидрофосфат… … Chemijos terminų aiškinamasis žodynas
кальция гидрофосфат — kalcio hidrofosfatas statusas T sritis chemija formulė CaHPO₄ atitikmenys: angl. calcium biphosphate; calcium hydrogen phosphate rus. кальций вторичный кислый фосфорнокислый; кальция биросфат; кальция вторичный кислый фосфат; кальция гидрофосфат… … Chemijos terminų aiškinamasis žodynas
Фосфат алюминия — Фосфат алюминия … Википедия
КАЛЬЦИЯ ФОСФАТ — Calcii phosphas. Синоним: фосфорнокислый кальций. Свойства. Мелкокристаллический, легкий, белый, без запаха и вкуса порошок. Почти нерастворимый в воде и спирте, трудно растворим в уксусной кислоте, легко в разбавленных соляной и азотной кислота … Отечественные ветеринарные препараты
кальция первичный кислый фосфат — kalcio dihidrofosfatas statusas T sritis chemija formulė Ca(H₂PO₄)₂ atitikmenys: angl. calcium acid phosphate; calcium dihydrogen phosphate; calcium dihydrophosphate rus. кальций первичный кислый фосфорнокислый; кальция дигидрофосфат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция дигидрофосфат — kalcio dihidrofosfatas statusas T sritis chemija formulė Ca(H₂PO₄)₂ atitikmenys: angl. calcium acid phosphate; calcium dihydrogen phosphate; calcium dihydrophosphate rus. кальций первичный кислый фосфорнокислый; кальция дигидрофосфат; кальция… … Chemijos terminų aiškinamasis žodynas
Фосфат — Фосфаты соли и эфиры фосфорных кислот, основное применение фосфорные удобрения. Фосфаты широко используются в синтетических моющих средствах для связывания ионов кальция и магния. Важное место фосфаты занимают и в биохимии, а именно в синтезе… … Википедия
Источник
Фосфат кальция
Характеристики и физические свойства фосфата кальция
Существует в виде двух полиморфных модификаций: моноклинной и гексагональной.
Рис. 1. Фосфат кальция. Внешний вид.
Основные характеристики фосфата кальция приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Растворимость в воде (20 o С), % (масс.)
Получение фосфата кальция
Лабораторные способы получения фосфата кальция предполагают действие ортофосфорной кислоты на соли кальция (1) или гидроксид кальция (2):
Химические свойства фосфата кальция
Фосфат кальция – это средняя соль, образованная сильным основанием – гидроксидом кальция (Ca(OH)2) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3Ca 2+ + 2PO4 3- + HOH ↔ HPO4 2- + 3Ca 2+ + OH — ;
Для фосфата кальция характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата кальция
Фосфат кальция нашел применение в качестве добавки при производстве кормов для КРС и домашних птиц. Его используют при производстве минеральных удобрений, керамики и стекла. В пищевой промышленности фосфат кальция известен как добавка Е341 – разрыхлитель.
Примеры решения задач
| Задание | Вычислите массу фосфата кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 100 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,1 × 1,168 = 0,1168 кг = 116,8г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 116,8 = 39,712 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 39,712 / 36,5 = 1,088 моль.
Согласно уравнению реакции n (HCl) :n (Ca3(PO4)2) =6: 1. Значит,
Тогда масса фосфата кальция, вступившего в реакцию будет равна (молярная масса – 310 г/моль):
Ответ Масса фосфата кальция равна 62 г.
| Задание | Какая масса оксида фосфора (V) образуется в ходе реакции термического разложения фосфата кальция массой 46 г? |
| Решение | Запишем уравнение реакции термического разложения фосфата кальция: |
Рассчитаем количество вещества фосфата кальция (молярная масса – 310 г/моль):
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
Источник
Структура фосфата кальция (Ca3 (PO4) 2), свойства, образование и использование
С другой стороны, фосфат кальция относится к ряду солей, которые варьируются в зависимости от соотношения Ca / P, а также от степени гидратации и pH. На самом деле существует много типов фосфатов кальция, которые существуют и могут быть синтезированы. Однако, буквально следуя номенклатуре, фосфат кальция относится только к трикальцию, упомянутому выше..
Все фосфаты кальция, включая Са3(РО4)2, Они однотонные с легкими сероватыми тонами. Они могут быть зернистыми, мелкими, кристаллическими и иметь размеры частиц около микрометров; и даже были получены наночастицы этих фосфатов, с помощью которых были разработаны биосовместимые материалы для костей..
Эта биосовместимость связана с тем, что эти соли находятся в зубах и, короче, в костных тканях млекопитающих. Например, гидроксиапатит представляет собой кристаллический фосфат кальция, который, в свою очередь, взаимодействует с аморфной фазой той же соли.
Это означает, что существуют аморфные и кристаллические фосфаты кальция. По этой причине разнообразие и множество вариантов не удивительны при синтезе материалов на основе фосфатов кальция; материалы, свойства которых исследователи интересуются каждый день во всем мире, чтобы сосредоточиться на восстановлении костей.
Структура фосфата кальция
Верхнее изображение показывает структуру трехосновного каликофосфата в странном минерале whitlockite, который может содержать магний и железо в качестве примесей.
Хотя на первый взгляд это может показаться сложным, необходимо уточнить, что модель предполагает ковалентное взаимодействие между атомами кислорода фосфатов и металлическими центрами кальция.
В результате истинная структура АШП становится более сложной, состав ее ионов которой представлен формулой: Ca9(РО4)6-х(HPO4)х(ОН)х. «Х» указывает на степень гидратации, так как если х = 1, то формула будет такой: Ca9(РО4)5(HPO4) (ОН).
Различные структуры, которые могут иметь PCA, зависят от молярных отношений Ca / P; то есть относительного количества кальция и фосфата, которые изменяют весь их результирующий состав.
Остальная часть семьи
На самом деле фосфаты кальция представляют собой семейство неорганических соединений, которые, в свою очередь, могут взаимодействовать с органической матрицей..
Ниже приведены некоторые фосфаты и их соответствующие структуры и химические формулы:
-Водород кальций фосфат дигидрат, CaHPO4H 2H2O: моноклинный.
-Кальция дигидрофосфат моногидрат, Ca (H)2ПО4)2∙ H2O: триклиника.
-Безводный кислый фосфат, Ca (H)2ПО4)2: триклиника.
-Ocalcium гидрофосфат (OCP), Ca8H2(РО4)6: триклиника Является предшественником в синтезе гидроксиапатита.
Источник
Фосфат кальция
Характеристики и физические свойства фосфата кальция
Существует в виде двух полиморфных модификаций: моноклинной и гексагональной.
Рис. 1. Фосфат кальция. Внешний вид.
Основные характеристики фосфата кальция приведены в таблице ниже:
Молярная масса, г/моль
Температура плавления, o С
Растворимость в воде (20 o С), % (масс.)
Получение фосфата кальция
Лабораторные способы получения фосфата кальция предполагают действие ортофосфорной кислоты на соли кальция (1) или гидроксид кальция (2):
Химические свойства фосфата кальция
Фосфат кальция – это средняя соль, образованная сильным основанием – гидроксидом кальция (Ca(OH)2) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН — свидетельствует о щелочном характере среды.
3Ca 2+ + 2PO4 3- + HOH ↔ HPO4 2- + 3Ca 2+ + OH — ;
Для фосфата кальция характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
— разложение при нагревании
Применение фосфата кальция
Фосфат кальция нашел применение в качестве добавки при производстве кормов для КРС и домашних птиц. Его используют при производстве минеральных удобрений, керамики и стекла. В пищевой промышленности фосфат кальция известен как добавка Е341 – разрыхлитель.
Примеры решения задач
| Задание | Вычислите массу фосфата кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 100 мл (массовая доля HCl 34%, плотность 1,168 кг/л). |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,1 × 1,168 = 0,1168 кг = 116,8г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 116,8 = 39,712 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 39,712 / 36,5 = 1,088 моль.
Согласно уравнению реакции n (HCl) :n (Ca3(PO4)2) =6: 1. Значит,
Тогда масса фосфата кальция, вступившего в реакцию будет равна (молярная масса – 310 г/моль):
Ответ Масса фосфата кальция равна 62 г.
| Задание | Какая масса оксида фосфора (V) образуется в ходе реакции термического разложения фосфата кальция массой 46 г? |
| Решение | Запишем уравнение реакции термического разложения фосфата кальция: |
Рассчитаем количество вещества фосфата кальция (молярная масса – 310 г/моль):
Найдем массу образовавшегося оксида фосфора (V) (молярная масса – 284 г/моль):
Источник
Структура фосфата кальция (Ca3 (PO4) 2), свойства, образование и использование
С другой стороны, фосфат кальция относится к ряду солей, которые варьируются в зависимости от соотношения Ca / P, а также от степени гидратации и pH. На самом деле существует много типов фосфатов кальция, которые существуют и могут быть синтезированы. Однако, буквально следуя номенклатуре, фосфат кальция относится только к трикальцию, упомянутому выше..
Все фосфаты кальция, включая Са3(РО4)2, Они однотонные с легкими сероватыми тонами. Они могут быть зернистыми, мелкими, кристаллическими и иметь размеры частиц около микрометров; и даже были получены наночастицы этих фосфатов, с помощью которых были разработаны биосовместимые материалы для костей..
Эта биосовместимость связана с тем, что эти соли находятся в зубах и, короче, в костных тканях млекопитающих. Например, гидроксиапатит представляет собой кристаллический фосфат кальция, который, в свою очередь, взаимодействует с аморфной фазой той же соли.
Это означает, что существуют аморфные и кристаллические фосфаты кальция. По этой причине разнообразие и множество вариантов не удивительны при синтезе материалов на основе фосфатов кальция; материалы, свойства которых исследователи интересуются каждый день во всем мире, чтобы сосредоточиться на восстановлении костей.
Структура фосфата кальция
Верхнее изображение показывает структуру трехосновного каликофосфата в странном минерале whitlockite, который может содержать магний и железо в качестве примесей.
Хотя на первый взгляд это может показаться сложным, необходимо уточнить, что модель предполагает ковалентное взаимодействие между атомами кислорода фосфатов и металлическими центрами кальция.
В результате истинная структура АШП становится более сложной, состав ее ионов которой представлен формулой: Ca9(РО4)6-х(HPO4)х(ОН)х. «Х» указывает на степень гидратации, так как если х = 1, то формула будет такой: Ca9(РО4)5(HPO4) (ОН).
Различные структуры, которые могут иметь PCA, зависят от молярных отношений Ca / P; то есть относительного количества кальция и фосфата, которые изменяют весь их результирующий состав.
Остальная часть семьи
На самом деле фосфаты кальция представляют собой семейство неорганических соединений, которые, в свою очередь, могут взаимодействовать с органической матрицей..
Ниже приведены некоторые фосфаты и их соответствующие структуры и химические формулы:
-Водород кальций фосфат дигидрат, CaHPO4H 2H2O: моноклинный.
-Кальция дигидрофосфат моногидрат, Ca (H)2ПО4)2∙ H2O: триклиника.
-Безводный кислый фосфат, Ca (H)2ПО4)2: триклиника.
-Ocalcium гидрофосфат (OCP), Ca8H2(РО4)6: триклиника Является предшественником в синтезе гидроксиапатита.
Источник
Теперь вы знаете какие однокоренные слова подходят к слову Как пишется фосфат кальция, а так же какой у него корень, приставка, суффикс и окончание. Вы можете дополнить список однокоренных слов к слову «Как пишется фосфат кальция», предложив свой вариант в комментариях ниже, а также выразить свое несогласие проведенным с морфемным разбором.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Фосфат кальция
Брутто-формула:
Ca3O8P2
CAS# 7758-87-4
Категории:
Неорганические соли
PubChem CID: 24456
Названия
Русский:
- Фосфат кальция
- кальция фосфат
- ортофосфат кальция(IUPAC)
- фосфорнокислый кальций
English:
- Calcigenol simple
- Calcium orthophosphate
- Calcium phosphate
- Calcium phosphate tribasic
- E341(iii)
- Phosphoric acid, calcium salt (2:3)(IUPAC)(CAS)
- Tricalcium diphosphate(IUPAC)
- tricalcium;diphosphate(IUPAC)(CAS)
German:
- Calciumphosphate
- Tricalciumphosphat
Español:
- Fosfato de calcio
- Fosfato de tricalcio(IUPAC)
French:
- Phosphate de calcium(IUPAC)
- Phosphate tricalcique
日本語:
- リン酸カルシウム
Варианты формулы:
Ca3(PO4)2
Ca(+2)3(P(+5)O(-2)4)2
$slope(45)$L(1.2)Ca^++hO`^-/P<`O`^-`/h>/O`/O^-/hCa^++/hO`^-P`/O/<O^->/O^-hCa^++`/h#-3
$L(1.2)Ca^2+O`^-_(A-15,d-)P<_(A105,w+)O`^->`|O|O^-/0Ca^2+O`^-/P`|O|<_(A75,w+)O^->_(A15,d+)O^-/0Ca^2+
Вещества, имеющие отношение…
Анион:
Фосфаты
Химический состав
Реакции, в которых участвует Фосфат кальция
-
Ca3(PO4)2 + 3H2SO4 -> 2H3PO4 + 3CaSO4
-
Ca3(PO4)2 + 6HNO3 + 3H2O -> 2H3PO4 + 3Ca(NO3)2 + 3H2O
-
3{R}{X}2 + 2{M}3PO4 -> {R}3(PO4)2″|v» + 6{M}{X}
, где R =
Be Mg Ca Sr Ba; X =
F Cl Br I; M =
Na K Li Rb Cs -
Ca(PH2O2)2 + 2Ca(OH)2 «100^oC»—> Ca3(PO4)2 + 4H2″|^»
-
4Na2HPO4 + 3CaCl2 -> Ca3(PO4)2″|v» + 6NaCl + 2NaH2PO4
И ещё 5 реакций…
А Б В Г Д Е Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
кальций-фосфа́тный
Рядом по алфавиту:
кальсо́нчики , -ов
кальсо́ны , -о́н
ка́льцекс , -а
кальцеоля́рия , -и
кальцеферо́л , -а
кальцефи́лы , -ов, ед. -фи́л, -а
кальцефи́льный
кальцефо́бный
кальцефо́бы , -ов, ед. -фо́б, -а
ка́льциевый
ка́льций , -я
ка́льций-оксала́тный
кальций-фосфа́тный
кальцийдефици́т , -а
кальцийоргани́ческий
кальцийсодержа́щий
кальци́на , -ы
кальцина́ция , -и
кальцини́рование , -я
кальцини́рованный , кр. ф. -ан, -ана
кальцини́ровать(ся) , -рую, -рует(ся)
кальцино́з , -а
кальци́т , -а
кальцитони́н , -а
кальциферо́л , -а
кальцифи́р , -а
калья́н , -а
калья́нный , (от калья́н)
калья́нщик , -а
каля́зинский , (от Каля́зин)
каля́зинцы , -ев, ед. -нец, -нца, тв. -нцем
Характеристики и физические свойства фосфата кальция
Существует в виде двух полиморфных модификаций: моноклинной и гексагональной.
Рис. 1. Фосфат кальция. Внешний вид.
Основные характеристики фосфата кальция приведены в таблице ниже:
|
Молекулярная формула |
Ca3(PO4)2 |
|
Молярная масса, г/моль |
310 |
|
Плотность, г/см3 |
2,81 |
|
Температура плавления, oС |
>1200 |
|
Растворимость в воде (20oС), % (масс.) |
0,0025 |
Получение фосфата кальция
Лабораторные способы получения фосфата кальция предполагают действие ортофосфорной кислоты на соли кальция (1) или гидроксид кальция (2):
3CaCO3 + 2H3PO4 = Ca3(PO4)2 + 3CO2↑ + 3H2O (1);
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O (2).
Химические свойства фосфата кальция
Фосфат кальция – это средняя соль, образованная сильным основанием – гидроксидом кальция (Ca(OH)2) и слабой кислотой – ортофосфорной (H3PO4). В водном растворе гидролизуется. Гидролиз протекает по аниону (теоретически возможны вторая и третья ступень). Наличие анионов ОН— свидетельствует о щелочном характере среды.
Первая ступень:
Ca3(PO4)2↔ 3Ca2+ + 2PO43-;
3Ca2+ + 2PO43- + HOH ↔ HPO42- + 3Ca2+ + OH—;
Ca3(PO4)2 + HOH ↔ CaHPO4 + Ca(OH)2.
Вторая ступень:
CaHPO4 ↔ Ca2+ + HPO42-;
Ca2+ + HPO42- + HOH ↔ H2PO4— + Ca2+ + OH—;
CaHPO4 + HOH ↔ Ca(H2PO4)2 + Ca(OH)2.
Третья ступень:
Ca(H2PO4)2 ↔ Ca2+ + H2PO4—;
Ca2+ + H2PO4— + HOH ↔ H3PO4 + Ca2+ + OH—;
Ca(H2PO4)2 + HOH ↔ H3PO4 + Ca(OH)2.
Для фосфата кальция характерны все свойства солей:
— взаимодействие с сильными минеральными кислотами
Ca3(PO4)2 + 6HCl = 3CaCl2 + 2H3PO4;
— взаимодействие с солями, в результате которого одним из продуктов реакции является нерастворимое в воде соединение
Ca3(PO4)2 + 3Li2SO4 = 2Li3PO4↓ + 3CaSO4;
— разложение при нагревании
Ca3(PO4)2 = P2O5 + 3CaO.
Применение фосфата кальция
Фосфат кальция нашел применение в качестве добавки при производстве кормов для КРС и домашних птиц. Его используют при производстве минеральных удобрений, керамики и стекла. В пищевой промышленности фосфат кальция известен как добавка Е341 – разрыхлитель.
Примеры решения задач
Фосфат (ортофосфат) кальция Ca3(PO4)2 — неорганическое вещество, соль кальция и ортофосфорной кислоты.
Свойства
Ортофосфат кальция ещё называется фосфорнокислый кальций. Ортофосфат кальция представляет собой бесцветное кристаллическое вещество. Существует в двух модификациях — α (моноклинная сингония) и β (гексагональная сингония). В воде растворяется плохо — 0,0025 % (масс.) при 20 °C.
При действии кислот переходит в более растворимые гидрофосфаты.
Нахождение в природе
Ортофосфат кальция широко распространён в природе. Входит в состав минералов фосфорита, апатита, гидроксилапатита.
Биологическая роль
Является основным строительным материалом для костей и зубов позвоночных.
Применение
Применяется как источник кальция для подкормки скота и птиц. В составе фосфоритной муки используется как удобрение для кислых почв. Применяют в производстве керамики и стекла, абразивов. Является исходным сырьём для получения фосфорной кислоты и фосфора.
См. также
- Гидрофосфат кальция
- Дигидрофосфат кальция
- Фосфорные удобрения
Литература
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.
|
|
В этой статье не хватает ссылок на источники информации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. |
Химическое название
Кальция фосфат, фосфорнокислый Ca.
Химические свойства
Неорганическое соединение, соль, образованная Сa и ортофосфорной кислотой. Формула Фосфата Кальция: Ca3(PO4)2. Обычно – это бесцветный мелкий кристаллический порошок, который плохо растворяется в воде. При воздействии кислот вещество преобразуется в гидрофосфат. Молярная масса соединения = 310,2 грамма на моль.
Получение Фосфата Кальция. Средство широко распространено в виде минералов в природе, находится в фосфорите, гидроксиапатите и апатите. Содержится в больших количествах, буквально составляет основу зубов и костей у позвоночных животных. Из школьного курса химии можно вспомнить реакцию образования Кальция Фосфата из фосфата натрия и хлорида Ca. В результате реакции обмена необходимое вещество выпадает в осадок.
Средство применяют в качестве основного источника кальция для подкормки птиц и скота; добавляют в состав фосфоритной муки для удобрения кислой почвы; используют при производстве абразивов, керамических изделий и стекла; применяют в пищевой промышленности; используют в медицине.
Фармакологическое действие
Источник кальция.
Фармакодинамика и фармакокинетика
Элемент принимает активное участие в процессах остеогенеза и роста костной ткани, в процессах передачи нервных импульсов, в механизме свертывания крови, способствует нормальной работе сердца и сосудов, опорно-двигательного аппарата. Кальция Фосфат полностью усваивается организмом.
Показания к применению
Препараты, содержащие данное вещество рекомендуют принимать:
- в периоды интенсивного роста и развития скелета в детском возрасте;
- для защиты и укрепления костей, зубов;
- пациентам, которые не переносят молоко и молочные продукты;
- во время лечения остеопороза, остеомиелита, рахита, кариеса, пародонтита, бурсита, вывихов и переломов костей.
Противопоказания
Средство противопоказано к приему:
- при гиперкальциурии, гиперкальциемии;
- у пациентов с тяжелой почечной недостаточностью;
- детям до 3 лет;
- при аллергии на вещество.
Побочные действия
Кальция Фосфат пациенты хорошо переносят. Редко может возникнуть аллергия, побочные реакции со стороны пищеварительного тракта.
Инструкция по применению (Способ и дозировка)
Лекарство назначают внутрь в комбинации с некоторыми другими витамина и микроэлементами. Суточная дозировка зависит от лекарственной формы, возраста пациента, тяжести заболевания.
Передозировка
При передозировке может возникнуть гиперкальциемия или гиперкальциурия. Лечение – симптоматическое.
Взаимодействие
Кальция Фосфат может замедлить абсорбцию фторида натрия и антибиотиков тетрациклинового ряда. Рекомендуется соблюдать 3-х часовой интервал между применением этих средств.
Условия продажи
Лекарство можно приобретать без рецепта от врача.
Детям
Вещество часто назначают детям. В зависимости от возраста используют разные лекарственные формы и схемы лечения средством.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Торговое название лекарства: Кальция гидрофосфата дигидрат. Химическое соединение входит в состав следующих витаминно-минеральных комплексов: Витатресс, Рост-Норма, Компливит, Остеотон, Глутамевит, Кальцинова, Олиговит, Элевит Пронаталь, Стоп Остеопороз, Супрадин.
Отзывы
Отзывы о препаратах, в составе которых содержится Кальция Фосфат положительные. При соблюдении рекомендаций врача, вещество хорошо усваивается, не вызывает аллергических реакций, благоприятно влияет на процессы роста и развития детей, устраняет дефицит Ca у взрослых пациентов. Его назначают, как в качестве профилактического средства, так и в составе комплексного лечения различных заболеваний опорно-двигательного аппарата.
Цена, где купить
Приобрести препарат Компливит, в составе которого находится фосфат Ca можно по примерной цене 200 рублей за 60 таблеток.
Фосфа́ты ка́льция — неорганические соединения кальция и кислородосодержащих фосфорных кислот. Выглядят как белые или бесцветные кристаллы.
Описание[править | править код]
Известны и широко применяются следующие фосфаты кальция[1]:
Помимо перечисленных, существуют и другие фосфаты кальция, например: суперфосфаты — смеси, использующиеся как удобрения; полифосфаты, применяющиеся при производстве оптического стекла и т. п[1].
Получение[править | править код]
В промышленности получают в основном, путём переработки фосфоросодержащих минералов — фосфорита и апатита[2].
Применение[править | править код]
Основное применение фосфатов кальция — фосфорные удобрения. Помимо этого, используются как пищевые добавки при приготовлении хлеба, для подкормки скота и птиц, как абразивы. Фосфатные минералы применяются также для получения фосфора и ортофосфорной кислоты[2][1].
Примечания[править | править код]
Литература[править | править код]
- Ксензенко В. И., Стасиневич Д. С. Кальция фосфаты // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 299. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Ссылки[править | править код]
- Комиссарова Л. Н., Рюмин М. А. Кальция фосфаты. Большая Российская Энциклопедия. Министерство культуры Российской Федерации. Дата обращения: 8 марта 2019.