Magnesium phosphate, Mg3(PO4)2, is a mineral that can be found in bones, many plant seeds, and a variety of minerals. It’s used to supplement one’s diet with magnesium. The interaction of magnesium chloride or sulfate with the phosphate salt can produce tribasic magnesium phosphate. It’s simple to make the solution by stirring some salt with carbon dioxide-free water for several hours.
Magnesium Phosphate Formula
Magnesium phosphate has the chemical formula Mg3(PO4)2 and comprises the ions magnesium (Mg2+) and phosphate (PO3–4). Magnesium and phosphate ions are linked via an ionic connection. As a result, it is classified as an ionic compound.
Magnesium Phosphate Structure
Physical Properties of Magnesium Phosphate
The following are the physical properties of magnesium phosphate,
- Magnesium phosphate is a crystalline white powder.
- The majority of phosphate salts are water-soluble. Magnesium phosphate, on the other hand, is insoluble in water due to the fact that magnesium salts are normally insoluble in water. Magnesium cations are insoluble in most cases. It can be dissolved in salt solutions.
- Magnesium phosphate has a melting point of 1457K.
Chemical Properties of Magnesium Phosphate
The following are the chemical characteristics of magnesium phosphate,
- The reaction of Magnesium phosphate with Hydrochloric Acid: When magnesium phosphate combines with hydrochloric acid, it produces magnesium chloride salt and phosphoric acid. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
- The reaction of Magnesium phosphate with Sodium Hydroxide: Sodium phosphate and magnesium hydroxide are formed when magnesium phosphate interacts with sodium hydroxide. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Uses of Magnesium Phosphate
- Magnesium phosphate is mostly used in food as an acidity control.
- Fertilizers contain it.
- It’s a polishing agent for dentifrices.
- Cosmetics, shampoos, toothpaste, perfumes, and other products include it.
- It’s utilized as an adsorbent, a plastic stabilizer, and more.
- It’s also utilized in agricultural goods that aren’t pesticides.
- Vitamin E insufficiency is also treated with it.
- Magnesium phosphate is a nutritional supplement that helps people with magnesium insufficiency.
- It’s utilized as an anti-caking agent in cleaning products that contain silicate.
Sample Questions
Question 1: What is magnesium phosphate used for?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 2: What are the physical properties of magnesium phosphate?
Answer:
- Magnesium phosphate is a white powder with a crystalline structure.
- Water is soluble in the majority of phosphate salts. Magnesium phosphate, on the other hand, is water insoluble since magnesium salts are generally water insoluble. In most circumstances, magnesium cations are insoluble. Salt solutions can be used to dissolve it.
- The melting point of magnesium phosphate is 1457K.
Question 3: What will happen when Magnesium phosphate reacts with Sodium Hydroxide?
Answer:
When magnesium phosphate reacts with sodium hydroxide, sodium phosphate and magnesium hydroxide are produced.
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Question 4: What are the uses of Magnesium phosphate?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 5: What will happen when Magnesium phosphate reacts with Hydrochloric Acid?
Answer:
Magnesium phosphate creates magnesium chloride salt and phosphoric acid when it reacts with hydrochloric acid.
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
Question 6: When magnesium phosphate is combined with water, what happens?
Answer:
Magnesium phosphate undergoes a chemical reaction with water, yielding magnesium hydroxide and phosphoric acid as the end products.
Question 7: How many moles of magnesium phosphate Mg3(PO4)2 will contain 0.25 mole of oxygen atoms?
Answer:
There are 8 oxygen atoms in each molecule of magnesium phosphate. As a result, one mole of magnesium phosphate contains 8 moles of oxygen.
As a result, there are 0.25 moles of oxygen atoms in 1/8 × 0.25 = 3.125 × 10−2 moles of magnesium phosphate.
Magnesium phosphate, Mg3(PO4)2, is a mineral that can be found in bones, many plant seeds, and a variety of minerals. It’s used to supplement one’s diet with magnesium. The interaction of magnesium chloride or sulfate with the phosphate salt can produce tribasic magnesium phosphate. It’s simple to make the solution by stirring some salt with carbon dioxide-free water for several hours.
Magnesium Phosphate Formula
Magnesium phosphate has the chemical formula Mg3(PO4)2 and comprises the ions magnesium (Mg2+) and phosphate (PO3–4). Magnesium and phosphate ions are linked via an ionic connection. As a result, it is classified as an ionic compound.
Magnesium Phosphate Structure
Physical Properties of Magnesium Phosphate
The following are the physical properties of magnesium phosphate,
- Magnesium phosphate is a crystalline white powder.
- The majority of phosphate salts are water-soluble. Magnesium phosphate, on the other hand, is insoluble in water due to the fact that magnesium salts are normally insoluble in water. Magnesium cations are insoluble in most cases. It can be dissolved in salt solutions.
- Magnesium phosphate has a melting point of 1457K.
Chemical Properties of Magnesium Phosphate
The following are the chemical characteristics of magnesium phosphate,
- The reaction of Magnesium phosphate with Hydrochloric Acid: When magnesium phosphate combines with hydrochloric acid, it produces magnesium chloride salt and phosphoric acid. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
- The reaction of Magnesium phosphate with Sodium Hydroxide: Sodium phosphate and magnesium hydroxide are formed when magnesium phosphate interacts with sodium hydroxide. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Uses of Magnesium Phosphate
- Magnesium phosphate is mostly used in food as an acidity control.
- Fertilizers contain it.
- It’s a polishing agent for dentifrices.
- Cosmetics, shampoos, toothpaste, perfumes, and other products include it.
- It’s utilized as an adsorbent, a plastic stabilizer, and more.
- It’s also utilized in agricultural goods that aren’t pesticides.
- Vitamin E insufficiency is also treated with it.
- Magnesium phosphate is a nutritional supplement that helps people with magnesium insufficiency.
- It’s utilized as an anti-caking agent in cleaning products that contain silicate.
Sample Questions
Question 1: What is magnesium phosphate used for?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 2: What are the physical properties of magnesium phosphate?
Answer:
- Magnesium phosphate is a white powder with a crystalline structure.
- Water is soluble in the majority of phosphate salts. Magnesium phosphate, on the other hand, is water insoluble since magnesium salts are generally water insoluble. In most circumstances, magnesium cations are insoluble. Salt solutions can be used to dissolve it.
- The melting point of magnesium phosphate is 1457K.
Question 3: What will happen when Magnesium phosphate reacts with Sodium Hydroxide?
Answer:
When magnesium phosphate reacts with sodium hydroxide, sodium phosphate and magnesium hydroxide are produced.
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Question 4: What are the uses of Magnesium phosphate?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 5: What will happen when Magnesium phosphate reacts with Hydrochloric Acid?
Answer:
Magnesium phosphate creates magnesium chloride salt and phosphoric acid when it reacts with hydrochloric acid.
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
Question 6: When magnesium phosphate is combined with water, what happens?
Answer:
Magnesium phosphate undergoes a chemical reaction with water, yielding magnesium hydroxide and phosphoric acid as the end products.
Question 7: How many moles of magnesium phosphate Mg3(PO4)2 will contain 0.25 mole of oxygen atoms?
Answer:
There are 8 oxygen atoms in each molecule of magnesium phosphate. As a result, one mole of magnesium phosphate contains 8 moles of oxygen.
As a result, there are 0.25 moles of oxygen atoms in 1/8 × 0.25 = 3.125 × 10−2 moles of magnesium phosphate.
Формула фосфата магния
Определение и формула фосфата магния
В обычных условиях представляет собой мелкие кристаллы белого цвета. Практически не растворяется в воде. Образует кристаллогидраты различного состава. Температура плавления 1357 o C.
Рис. 1. Фосфат магния. Внешний вид.
Химическая формула фосфата магния
Химическая формула фосфата магния Mg3(PO4)2. Она показывает, что в состав данной молекулы входят три атома магния (Ar = 24 а.е.м.), два атома фосфора (Ar = 31 а.е.м.) и восемь атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу фосфата магния:
Mr(Mg3(PO4)2) = 3×24 + 2×31 + 8×16 = 72 + 62 + 128 = 262.
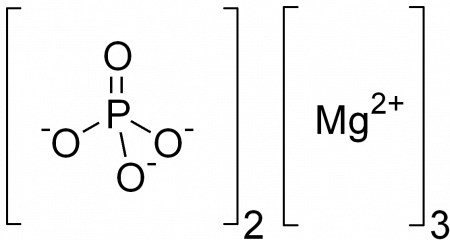
Графическая (структурная) формула фосфата магния
Структурная (графическая) формула фосфата магния является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Фосфат магния представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Примеры решения задач
| Задание | В состав вещества входят 30,7% калия, 25,2% серы, 44% кислорода. Вывести формулу этого соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов калия в молекуле через «х», число атомов серы через «у» и число атомов кислорода через «z».
Найдем соответствующие относительные атомные массы элементов калия, серы и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(K) = 39; Ar(S) = 32; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O);
x:y:z= 30,7/39 : 25,2/32 : 44/16;
x:y:z= 0,787 : 0,787 : 2,75.
Наименьшее число примем за единицу (т.е. все числа разделим на наименьшее число 0,787):
0,787/0,787 : 0,787/0,787 : 2,75/0,787;
Следовательно, простейшая формула соединения калия, серы и кислорода имеет вид K2S2O7.
| Задание | Установите массовую формулу вещества, содержащего 40,0% кальция, 12,0% углерода и 48,0% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (кальций), «у» (углерод) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Ca)/Ar(Ca) : ω(C)/Ar(C) : ω(O)/Ar(O);
x:y:z= 40,0/40 : 12,0/12 : 48,0/16;
Значит формула соединения кальция, углерода и кислорода будет иметь вид CaCO3. Это карбонат кальция.
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-fosfata-magniya/
Ортофосфат магния
Ортофосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Содержание
Получение
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
3 M g S O 4 + 2 N a 2 H P O 4 + 2 N a H C O 3 → <displaystyle <mathsf <3 MgSO_<4>+2 Na_<2>HPO_<4>+2 NaHCO_<3> <xrightarrow < >>>>>
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
3 M g O + N a 4 P 2 O 7 → 900 o C M g 3 ( P O 4 ) 2 + 2 N a 2 O <displaystyle <mathsf <3 MgO+Na_<4>P_<2>O_<7> <xrightarrow <900^C>> Mg_<3>(PO_<4>)_<2>+2 Na_<2>O>>>
Применение
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии [1] .
Ссылки
Примечания
Литература
| Ортофосфат магния | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Физические свойства | |
| Молярная масса | 262,855 г/моль |
| Термические свойства | |
| Т. плав. | 1357 °C |
| Химические свойства | |
| Растворимость в воде | 3,9·10 –26 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
 |
Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
- Азид магния (Mg(N3)2)
- Амид магния (Mg(NH2)2)
- Борид магния (MgB2)
- Бромид магния (MgBr2)
- Гидрид магния (MgH2)
- Гидрокарбонат магния (Mg(HCO3)2)
- Гидроксид магния (Mg(OH)2)
- Гидроортофосфат магния (MgHPO4)
- Дифенилмагний (Mg(C6H5)2)
- Диэтилмагний (Mg(C2H5)2)
- Дигидроортофосфат магния (Mg(H2PO4)2)
- Иодид магния (MgI2)
- Карбид магния (MgC2)
- Карбонат магния (MgCO3)
- Нитрат магния (Mg(NO3)2)
- Нитрид магния (Mg3N2)
- Оксид магния (MgO)
- Ортоарсенат аммония-магния (NH4MgAsO4)
- Ортоарсенат магния (Mg3(AsO4)2)
- Ортофосфат аммония-магния (NH4MgPO4)
- Пероксид магния (MgO2)
- Перхлорат магния (Mg(ClO4)2)
- Силицид магния (Mg2Si)
- Сульфат магния (MgSO4)
- Сульфид магния (MgS)
- Сульфит магния (MgSO3)
- Фосфат магния (Mg3(PO4)2)
- Фосфид магния (Mg3P2)
- Фторид магния (MgF2)
- Хлорид магния (MgCl2)
- Цитрат магния (MgC6H6O7)
Что такое wiki2.info Вики является главным информационным ресурсом в интернете. Она открыта для любого пользователя. Вики это библиотека, которая является общественной и многоязычной.
Основа этой страницы находится в Википедии. Текст доступен по лицензии CC BY-SA 3.0 Unported License.
Wikipedia® — зарегистрированный товарный знак организации Wikimedia Foundation, Inc. wiki2.info является независимой компанией и не аффилирована с Фондом Викимедиа (Wikimedia Foundation).
Источник статьи: http://wiki2.info/%D0%9E%D1%80%D1%82%D0%BE%D1%84%D0%BE%D1%81%D1%84%D0%B0%D1%82_%D0%BC%D0%B0%D0%B3%D0%BD%D0%B8%D1%8F
From Wikipedia, the free encyclopedia
Magnesium phosphate monobasic
Magnesium phosphate dibasic
Magnesium phosphate tribasic
Magnesium phosphate is a general term for salts of magnesium and phosphate appearing in several forms and several hydrates:[1]
- Monomagnesium phosphate (Mg(H2PO4)2).xH2O
- Dimagnesium phosphate (MgHPO4).xH2O
- Trimagnesium phosphate (Mg3(PO4)2).xH2O
Amorphous magnesium phosphate is also claimed.[2]
Trimagnesium phosphate.
Safety[edit]
Magnesium phosphates are listed on the U.S. FDA’s Generally recognized as safe (GRAS) list of substances.[3]
See also[edit]
- Ammonium magnesium phosphate
References[edit]
- ^ Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2012). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ Babaie, Elham; Lin, Boren; Goel, Vijay K; Bhaduri, Sarit B (2016). «Evaluation of amorphous magnesium phosphate (AMP) based non-exothermic orthopedic cements». Biomedical Materials. 11 (5): 055010. Bibcode:2016BioMa..11e5010B. doi:10.1088/1748-6041/11/5/055010. PMID 27716636.
- ^ «Database of Select Committee on GRAS Substances (SCOGS) Reviews». Archived from the original on May 21, 2007. Retrieved 2008-03-22.
External links[edit]
- Magnesium+phosphate at the US National Library of Medicine Medical Subject Headings (MeSH)
- B05XA10 (WHO)
Magnesium compounds |
|---|
|
|
This inorganic compound–related article is a stub. You can help Wikipedia by expanding it. |
- v
- t
- e
Retrieved from «https://en.wikipedia.org/w/index.php?title=Magnesium_phosphate&oldid=976575765»
Categories:
- Magnesium compounds
- Phosphates
- E-number additives
- Inorganic compound stubs
Hidden category:
- All stub articles
From Wikipedia, the free encyclopedia
Magnesium phosphate monobasic
Magnesium phosphate dibasic
Magnesium phosphate tribasic
Magnesium phosphate is a general term for salts of magnesium and phosphate appearing in several forms and several hydrates:[1]
- Monomagnesium phosphate (Mg(H2PO4)2).xH2O
- Dimagnesium phosphate (MgHPO4).xH2O
- Trimagnesium phosphate (Mg3(PO4)2).xH2O
Amorphous magnesium phosphate is also claimed.[2]
Trimagnesium phosphate.
Safety[edit]
Magnesium phosphates are listed on the U.S. FDA’s Generally recognized as safe (GRAS) list of substances.[3]
See also[edit]
- Ammonium magnesium phosphate
References[edit]
- ^ Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2012). «Phosphoric Acid and Phosphates». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.
- ^ Babaie, Elham; Lin, Boren; Goel, Vijay K; Bhaduri, Sarit B (2016). «Evaluation of amorphous magnesium phosphate (AMP) based non-exothermic orthopedic cements». Biomedical Materials. 11 (5): 055010. Bibcode:2016BioMa..11e5010B. doi:10.1088/1748-6041/11/5/055010. PMID 27716636.
- ^ «Database of Select Committee on GRAS Substances (SCOGS) Reviews». Archived from the original on May 21, 2007. Retrieved 2008-03-22.
External links[edit]
- Magnesium+phosphate at the US National Library of Medicine Medical Subject Headings (MeSH)
- B05XA10 (WHO)
Magnesium compounds |
|---|
|
|
This inorganic compound–related article is a stub. You can help Wikipedia by expanding it. |
- v
- t
- e
Retrieved from «https://en.wikipedia.org/w/index.php?title=Magnesium_phosphate&oldid=976575765»
Categories:
- Magnesium compounds
- Phosphates
- E-number additives
- Inorganic compound stubs
Hidden category:
- All stub articles
| Ортофосфат магния | |
|---|---|
 |
|
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Молярная масса | 262,855 г/моль |
| Температура | |
| • плавления | 1357 °C |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Mg+2].[Mg+2].[Mg+2] |
| InChI |
1S/3Mg.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 GVALZJMUIHGIMD-UHFFFAOYSA-H |
| Кодекс Алиментариус | E343 |
| ChemSpider | 22847 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Содержание
- 1 Получение
- 2 Применение
Получение
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
-
- 3 MgSO4 + 2 Na2HPO4 + 2 NaHCO3 → Mg3(PO4)2 + 3 Na2SO4 + 2 CO2 + 2 H2O
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
-
- 3 MgO + Na4P2O7 →900oC Mg3(PO4)2 + 2 Na2O
Применение
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии.
| Ортофосфат магния | |
|---|---|
  |
|
| Общие | |
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Физические свойства | |
| Молярная масса | 262,855 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 1357 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7757-87-1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Ортофосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Получение
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
-
- [math]displaystyle{ mathsf{3 MgSO_4 + 2 Na_2HPO_4 + 2 NaHCO_3 xrightarrow{ } } }[/math]
- [math]displaystyle{ mathsf{ xrightarrow{ } Mg_3(PO_4)_2 + 3 Na_2SO_4 + 2 CO_2 + 2 H_2O } }[/math]
- [math]displaystyle{ mathsf{3 MgSO_4 + 2 Na_2HPO_4 + 2 NaHCO_3 xrightarrow{ } } }[/math]
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
-
- [math]displaystyle{ mathsf{3 MgO + Na_4P_2O_7 xrightarrow{900^oC} Mg_3(PO_4)_2 + 2 Na_2O } }[/math]
Применение
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии[1].
Ссылки
- MeSH Magnesium+phosphate
- B05XA10
- Шаблон:PubChem
- Шаблон:PubChem
Примечания
- ↑ В.Н.Тихонов. Аналитическая химия магния. — Москва: «Наука», 1973. — С. 61-63.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 1. — 560 с.







