From Wikipedia, the free encyclopedia
Oxygen fluorides are compounds of elements oxygen and fluorine with the general formula OnF2, where n = 1 to 6. Many different oxygen fluorides are known:
- oxygen difluoride (OF2)
- dioxygen difluoride (O2F2)
- trioxygen difluoride or ozone difluoride (O3F2)[1][2]
- tetraoxygen difluoride (O4F2)[3]
- pentaoxygen difluoride (O5F2)
- hexaoxygen difluoride (O6F2)[4]
- dioxygen monofluoride or fluoroperoxyl (O2F)
Oxygen fluorides are strong oxidizing agents with high energy and can release their energy either instantaneously or at a controlled rate. Thus, these compounds attracted much attention as potential fuels in jet propulsion systems.[5]
Synthesis[edit]
Here are some synthesis methods and reactions of the three most common oxygen fluorides – oxygen difluoride (OF2), dioxygen difluoride (O2F2) and ozone difluoride (O3F2).
Oxygen difluoride (OF2)[edit]
A common preparative method involves fluorination of sodium hydroxide:
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
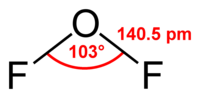
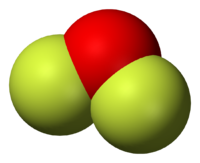
OF2 is a colorless gas at room temperature and a yellow liquid below 128 K. Oxygen difluoride has an irritating odor and is poisonous.[3] It reacts quantitatively with aqueous haloacids to give free halogens:
- OF2 + 4 HCl → 2 Cl2 + 2 HF + 2 H2O
It can also displace halogens from their salts.[3] It is both an effective fluorinating agent and a strong oxidizing agent. When reacted with unsaturated nitrogen fluorides with electrical discharge, it results in the formation of nitrogen trifluoride, oxide fluorides and other oxides.[6][7]
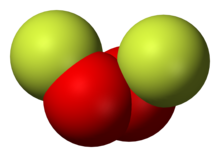
Dioxygen difluoride (O2F2)[edit]
O2F2 precipitates as a brown solid upon the UV irradiation of a mixture of liquid O2 and F2 at −196 °C.[8] It also only appears to be stable below −160 °C.[9] The general method of preparation of many oxygen fluorides is a gas-phase electric discharge in cold containers including O2F2.[10]
- O2 + F2 → O2F2 (electric discharge, 183 °C)
It is typically an orange-yellow solid which rapidly decomposes to O2 and F2 close to its normal boiling point of about 216 K.[3]
O2F2 reacts violently with red phosphorus, even at −196 °C. Explosions can also occur if Freon-13 is used to moderate the reaction.[9]
Trioxygen difluoride or ozone difluoride (O3F2)[edit]
O3F2 is a viscous, blood-red liquid. It remains liquid at 90 K and so can be differentiated from O2F2 which has a melting point of about 109 K.[11][3]
Like the other oxygen fluorides, O3F2 is endothermic and decomposes at about 115 K with the evolution of heat, which is given by the following reaction:
- 2 O3F2 → O2 + 2 O2F2
O3F2 is safer to work with than ozone, and can be evaporated, or thermally decomposed, or exposed to electric sparks, without any explosions. But on contact with organic matter or oxidizable compounds, it can detonate or explode. Thus, the addition of even one drop of ozone difluoride to solid anhydrous ammonia will result in a mild explosion, when they are both at 90 K each.[3]
Fluoroperoxyl[edit]
Fluoroperoxyl is a molecule such as O–O–F, whose chemical formula is O2F and is stable only at low temperature. It has been reported to be produced from atomic fluorine and dioxygen.[12]
- O2 + F → O2F
General preparation of polyoxygen difluorides[edit]
| Reaction equation[6] | O2:F2 by volume | Current | Temperature of bath (°C) |
|---|---|---|---|
| O2 + F2 ⇌ O2F2 | 1:1 | 10 – 50 mA | ~ -196° |
| 3 O2 + 2 F2 ⇌ 2 O3F2 | 3:2 | 25 – 30 mA | ~ -196° |
| 2 O2 + F2 ⇌ O4F2 | 2:1 | 4 – 5 mA | ~ -205° |
Effects on ozone[edit]
Oxygen- and fluorine-containing radicals like O2F and OF occur in the atmosphere. These along with other halogen radicals have been implicated in the destruction of ozone in the atmosphere. However, the oxygen monofluoride radicals are assumed to not play as big a role in the ozone depletion because free fluorine atoms in the atmosphere are believed to react with methane to produce hydrofluoric acid which precipitates in rain. This decreases the availability of free fluorine atoms for oxygen atoms to react with and destroy ozone molecules.[13]
- O3 + F → O2 + OF
- O + OF → O2 + F
Net reaction:
- O3 + O → 2 O2
Hypergolic propellant[edit]
Despite the low solubility of O3F2 in liquid oxygen, it has been shown to be hypergolic with most rocket propellant fuels. The mechanism involves the boiling off oxygen from the solution containing O3F2, making it more reactive to have a spontaneous reaction with the rocket fuel. The degree of reactivity is also dependent on the type of fuel used.[3]
See also[edit]
- Bromine oxide
- Chlorine oxide
- Iodine oxide
- Ozone
References[edit]
- ^ Solomon, I. J. et al. (1968). «Additional Studies Concerning the Existence of O3F2«. Journal of the American Chemical Society. 90 (20): 5408–5411. doi:10.1021/ja01022a014.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Misochko, Eugenii Ya, Alexander V. Akimov, Charles A. Wight (1999). «Infrared spectroscopic observation of the stabilized Intermediate complex FO3 formed by reaction of mobile Fluorine atoms with ozone molecules Trapped in an Argon Matrix». The Journal of Physical Chemistry A. 103 (40): 7972–7977. Bibcode:1999JPCA..103.7972M. doi:10.1021/jp9921194.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b c d e f g Streng, A. G. (1963). «The Oxygen Fluorides». Chemical Reviews. 63 (6): 607–624. doi:10.1021/cr60226a003.
- ^ Streng, A. G., A. V. Grosse (1966). «Two New Fluorides of Oxygen, O5F2 and O6F2«. Journal of the American Chemical Society. 88: 169–170. doi:10.1021/ja00953a035.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Jäger, Susanne et al. (1986). «Fluorine and Oxygen». Fluorine. Berlin, Heidelberg: Springer. pp. 1–161.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ a b Nikitin, Igor Vasil’evich, and V. Ya Rosolovskii (1971). «Oxygen Fluorides and Dioxygenyl Compounds». Russian Chemical Reviews. 40 (11): 889–900. Bibcode:1971RuCRv..40..889N. doi:10.1070/rc1971v040n11abeh001981. S2CID 250903149.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Lawless, Edward W., Ivan C. Smith (1968). Inorganic high-energy oxidizers: synthesis, structure, and properties. M. Dekker.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Marx, Rupert, Konrad Seppelt (2015). «Structure investigations on oxygen fluorides». Dalton Transactions. 44 (45): 19659–19662. doi:10.1039/c5dt02247a. PMID 26351980.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b Solomon, Irvine J. Research on Chemistry of O3F2 and O2F2. No. IITRI-C227-6. IIT RESEARCH INST CHICAGO IL, 1964.
- ^ Goetschel, Charles T. et al. (1969). «Low-Temperature Radiation Chemistry. I. Preparation of Oxygen Fluorides and Dioxygenyl Tetrafluoroborate». Journal of the American Chemical Society. 91 (17): 4702–4707. doi:10.1021/ja01045a020.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ De Marco, Ronald A., and Jean’ne M. Shreeve . «Fluorinated Peroxides.» Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. Academic Press, 1974. 109-176.
- ^ J.L.Lyman and R. Holland, J. Phys. Chem.,1988,92, 7232.
- ^ Francisco J. S. (1993). «An ab initio investigation of the significance of the HOOF intermediate in coupling reactions involving FOO x and HO x species». The Journal of Chemical Physics. 98 (3): 2198–2207. Bibcode:1993JChPh..98.2198F. doi:10.1063/1.464199.
External links[edit]
- National Pollutant Inventory — Fluoride and compounds fact sheet
- Oxygen Fluoride PubChem
- Center for Disease Control and Prevention — Health Hazards of Oxygen Difluoride
From Wikipedia, the free encyclopedia
Oxygen fluorides are compounds of elements oxygen and fluorine with the general formula OnF2, where n = 1 to 6. Many different oxygen fluorides are known:
- oxygen difluoride (OF2)
- dioxygen difluoride (O2F2)
- trioxygen difluoride or ozone difluoride (O3F2)[1][2]
- tetraoxygen difluoride (O4F2)[3]
- pentaoxygen difluoride (O5F2)
- hexaoxygen difluoride (O6F2)[4]
- dioxygen monofluoride or fluoroperoxyl (O2F)
Oxygen fluorides are strong oxidizing agents with high energy and can release their energy either instantaneously or at a controlled rate. Thus, these compounds attracted much attention as potential fuels in jet propulsion systems.[5]
Synthesis[edit]
Here are some synthesis methods and reactions of the three most common oxygen fluorides – oxygen difluoride (OF2), dioxygen difluoride (O2F2) and ozone difluoride (O3F2).
Oxygen difluoride (OF2)[edit]
A common preparative method involves fluorination of sodium hydroxide:
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O
OF2 is a colorless gas at room temperature and a yellow liquid below 128 K. Oxygen difluoride has an irritating odor and is poisonous.[3] It reacts quantitatively with aqueous haloacids to give free halogens:
- OF2 + 4 HCl → 2 Cl2 + 2 HF + 2 H2O
It can also displace halogens from their salts.[3] It is both an effective fluorinating agent and a strong oxidizing agent. When reacted with unsaturated nitrogen fluorides with electrical discharge, it results in the formation of nitrogen trifluoride, oxide fluorides and other oxides.[6][7]
Dioxygen difluoride (O2F2)[edit]
O2F2 precipitates as a brown solid upon the UV irradiation of a mixture of liquid O2 and F2 at −196 °C.[8] It also only appears to be stable below −160 °C.[9] The general method of preparation of many oxygen fluorides is a gas-phase electric discharge in cold containers including O2F2.[10]
- O2 + F2 → O2F2 (electric discharge, 183 °C)
It is typically an orange-yellow solid which rapidly decomposes to O2 and F2 close to its normal boiling point of about 216 K.[3]
O2F2 reacts violently with red phosphorus, even at −196 °C. Explosions can also occur if Freon-13 is used to moderate the reaction.[9]
Trioxygen difluoride or ozone difluoride (O3F2)[edit]
O3F2 is a viscous, blood-red liquid. It remains liquid at 90 K and so can be differentiated from O2F2 which has a melting point of about 109 K.[11][3]
Like the other oxygen fluorides, O3F2 is endothermic and decomposes at about 115 K with the evolution of heat, which is given by the following reaction:
- 2 O3F2 → O2 + 2 O2F2
O3F2 is safer to work with than ozone, and can be evaporated, or thermally decomposed, or exposed to electric sparks, without any explosions. But on contact with organic matter or oxidizable compounds, it can detonate or explode. Thus, the addition of even one drop of ozone difluoride to solid anhydrous ammonia will result in a mild explosion, when they are both at 90 K each.[3]
Fluoroperoxyl[edit]
Fluoroperoxyl is a molecule such as O–O–F, whose chemical formula is O2F and is stable only at low temperature. It has been reported to be produced from atomic fluorine and dioxygen.[12]
- O2 + F → O2F
General preparation of polyoxygen difluorides[edit]
| Reaction equation[6] | O2:F2 by volume | Current | Temperature of bath (°C) |
|---|---|---|---|
| O2 + F2 ⇌ O2F2 | 1:1 | 10 – 50 mA | ~ -196° |
| 3 O2 + 2 F2 ⇌ 2 O3F2 | 3:2 | 25 – 30 mA | ~ -196° |
| 2 O2 + F2 ⇌ O4F2 | 2:1 | 4 – 5 mA | ~ -205° |
Effects on ozone[edit]
Oxygen- and fluorine-containing radicals like O2F and OF occur in the atmosphere. These along with other halogen radicals have been implicated in the destruction of ozone in the atmosphere. However, the oxygen monofluoride radicals are assumed to not play as big a role in the ozone depletion because free fluorine atoms in the atmosphere are believed to react with methane to produce hydrofluoric acid which precipitates in rain. This decreases the availability of free fluorine atoms for oxygen atoms to react with and destroy ozone molecules.[13]
- O3 + F → O2 + OF
- O + OF → O2 + F
Net reaction:
- O3 + O → 2 O2
Hypergolic propellant[edit]
Despite the low solubility of O3F2 in liquid oxygen, it has been shown to be hypergolic with most rocket propellant fuels. The mechanism involves the boiling off oxygen from the solution containing O3F2, making it more reactive to have a spontaneous reaction with the rocket fuel. The degree of reactivity is also dependent on the type of fuel used.[3]
See also[edit]
- Bromine oxide
- Chlorine oxide
- Iodine oxide
- Ozone
References[edit]
- ^ Solomon, I. J. et al. (1968). «Additional Studies Concerning the Existence of O3F2«. Journal of the American Chemical Society. 90 (20): 5408–5411. doi:10.1021/ja01022a014.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Misochko, Eugenii Ya, Alexander V. Akimov, Charles A. Wight (1999). «Infrared spectroscopic observation of the stabilized Intermediate complex FO3 formed by reaction of mobile Fluorine atoms with ozone molecules Trapped in an Argon Matrix». The Journal of Physical Chemistry A. 103 (40): 7972–7977. Bibcode:1999JPCA..103.7972M. doi:10.1021/jp9921194.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b c d e f g Streng, A. G. (1963). «The Oxygen Fluorides». Chemical Reviews. 63 (6): 607–624. doi:10.1021/cr60226a003.
- ^ Streng, A. G., A. V. Grosse (1966). «Two New Fluorides of Oxygen, O5F2 and O6F2«. Journal of the American Chemical Society. 88: 169–170. doi:10.1021/ja00953a035.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Jäger, Susanne et al. (1986). «Fluorine and Oxygen». Fluorine. Berlin, Heidelberg: Springer. pp. 1–161.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ a b Nikitin, Igor Vasil’evich, and V. Ya Rosolovskii (1971). «Oxygen Fluorides and Dioxygenyl Compounds». Russian Chemical Reviews. 40 (11): 889–900. Bibcode:1971RuCRv..40..889N. doi:10.1070/rc1971v040n11abeh001981. S2CID 250903149.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Lawless, Edward W., Ivan C. Smith (1968). Inorganic high-energy oxidizers: synthesis, structure, and properties. M. Dekker.
{{cite book}}: CS1 maint: uses authors parameter (link) - ^ Marx, Rupert, Konrad Seppelt (2015). «Structure investigations on oxygen fluorides». Dalton Transactions. 44 (45): 19659–19662. doi:10.1039/c5dt02247a. PMID 26351980.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ a b Solomon, Irvine J. Research on Chemistry of O3F2 and O2F2. No. IITRI-C227-6. IIT RESEARCH INST CHICAGO IL, 1964.
- ^ Goetschel, Charles T. et al. (1969). «Low-Temperature Radiation Chemistry. I. Preparation of Oxygen Fluorides and Dioxygenyl Tetrafluoroborate». Journal of the American Chemical Society. 91 (17): 4702–4707. doi:10.1021/ja01045a020.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ De Marco, Ronald A., and Jean’ne M. Shreeve . «Fluorinated Peroxides.» Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. Academic Press, 1974. 109-176.
- ^ J.L.Lyman and R. Holland, J. Phys. Chem.,1988,92, 7232.
- ^ Francisco J. S. (1993). «An ab initio investigation of the significance of the HOOF intermediate in coupling reactions involving FOO x and HO x species». The Journal of Chemical Physics. 98 (3): 2198–2207. Bibcode:1993JChPh..98.2198F. doi:10.1063/1.464199.
External links[edit]
- National Pollutant Inventory — Fluoride and compounds fact sheet
- Oxygen Fluoride PubChem
- Center for Disease Control and Prevention — Health Hazards of Oxygen Difluoride
| Фторид кислорода(II) | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Фторид кислорода (II) |
| Химическая формула | OF2 |
| Отн. молек. масса | 54 а. е. м. |
| Физические свойства | |
| Плотность вещества | 1,59 г/см³ |
| Состояние (ст. усл.) | бледно-жёлтый газ |
| Термические свойства | |
| Температура плавления | -224 °C |
| Температура кипения | -145 °C |
| Температура разложения | выше 200 °C |
| Критическая точка | -58°C, 49 атм |
| Энтальпия (ст. усл.) | -25,2 кДж/моль |
| Классификация | |
| номер CAS | 7783-41-7 |
Фторид кислорода(II), дифторид кислорода, OF2. Представляет собой бесцветный газ, конденсирующийся при охлаждении в светло-желтую (в толстых слоях золотисто-желтую) жидкость. Фторид кислорода(II) имеет раздражающий запах несколько отличающийся от запаха фтора (смесь запаха хлорной извести и озона).
Содержание
- 1 Открытие
- 2 Систематическое название
- 3 Физические свойства
- 4 Получение
- 5 Химические свойства
- 5.1 Взаимодействие с металлами
- 6 Применение
- 7 Токсичность
- 8 Упоминания в литературе
- 9 Ссылки
- 10 См. также
- 11 Литература
Открытие
Дифторид кислорода был открыт впервые в 1927 году Лебо и Дамьеном, а спустя некоторое время подробно изучен Руффом и Менцелем.
Систематическое название
В литературе иногда это соединение называют оксидом фтора (F2O). Однако, это неверно, так как атом фтора более электроотрицателен чем кислород, и по правилам IUPAC это соединение должно называться именно фторид кислорода (OF2).
Физические свойства
Жидкий фторид кислорода неограниченно смешивается с жидкими озоном, фтором, кислородом. Плохо растворяется в холодной воде (примерно 7:100 по объёму). При этом достаточно хорошо растворяет воздух.
Молекула обладает слабым дипольным моментом, равным 0,3 Дб
Получение
- Получение фторида кислорода(II) до сих пор проводят по так называемому «щелочному» способу пропусканием газообразного фтора в 2% (0,5 нормальный) водный раствор гидроксида натрия (NaOH). Помимо фторида кислорода(II) в реакции происходит образование перекиси водорода, и озона:
- 2F2 + 2NaOH = OF2 + 2NaF + H2O
- Возможно также получение фторида кислорода(II) электролизом водного раствора HF.
- При горении воды в атмосфере фтора также частично образуется дифторид кислорода и пероксид водорода. Это происходит за счёт протекания радикальных реакций:
- F2 + H2O → 2HF + O· — инициация свободных радикалов
- 2O· → O2 — доминирующий процесс
- O· + H2O → H2O2
- O· + F2 → F2O
Химические свойства
Дифторид кислорода весьма энергичный окислитель, и в этом отношении напоминает фтор, но реакции с участием фторида кислорода(II) требуют более высокой энергии активации, поскольку на первой стадии происходит образование атомарного кислорода. Термическое разложение фторида кислорода(II) представляет собой мономолекулярную реакцию с энергией активации 41 ккал/моль и начинается только при температуре выше 200°C.
При растворении в горячей воде, подвергается гидролизу. В щелочной среде разложение протекает достаточно быстро.
Смесь паров дифторида кислорода и воды взрывоопасна:
- OF2 + H2O → 2HF + O2
Фторид кислорода(II) не действует на сухое стекло и кварц, но действует (интенсивно) на металлическую ртуть — что исключает применение ртути в приборах с фторидом кислорода(II). На смазку для газовых кранов фторид кислорода(II) действует очень медленно.
Взаимодействие с металлами
На меди, платине, золоте, серебре, фторид кислорода(II) образует лишь тончайшие защитные пленки фторидов, что позволяет использовать эти металлы в контакте с фторидом кислорода(II) при комнатной температуре. При повышении температур до 250°C проиходит дальнейшее окисление металлов. Наиболее подходящими металлами для работы с дифторидом кислорода являются алюминий и магний. Нержавеющие стали, никель, монель-металл, магниевомедный сплав (92/8), латунь и медь, также мало изменяются в весе при воздействии фторида кислорода(II) в течение 1-1,5 недели при 100 °C.
Применение
Благодаря высокой энергии активации разложения фторида кислорода(II), последнюю можно сравнительно безопасно смешивать с многими углеводородами, водородом, моноокисью углерода и прочими веществами, что чрезвычайно важно в практическом плане использования фторида кислорода(II) в качестве высокоэффективного окислителя ракетного топлива. Так как фторид кислорода(II) не взрывается при смешивании с горючими материалами и при нагревании (сам по себе) то ее применение вполне безопасно.
Имели значительный успех опыты применения фторида кислорода(II) в газодинамических химических лазерах. Имея лучшие показателе нежели фтор, фторид кислорода(II) способен занять достойное место в качестве компонента для боевого лазерного оружия высокой мощности.
Токсичность
Фторид кислорода(II) весьма токсичен и по силе превышает фосген, с другой стороны он гораздо ядовитей чем фтор, так как вызывает сильнейшее раздражение тканей организма, очень глубоко проникает и растворяется в них (глубже чем фтор), затрудняет дыхание.
Упоминания в литературе
В фантастической новелле Роберта Л. Форварда «Камелот 30К», дифторид кислорода был использован как биохимический растворитель для живых форм Солнечой системы
Ссылки
- Химические свойства фтора и фторида кислорода.
См. также
- Дифторид дикислорода
- Соединения фтора в ракетной технике
Литература
- С.Сарнер. Химия ракетных топлив. изд «Мир», Москва, 1969.г.
- Schmidt E. W.,Harper J. T., Handling and Use of Fluoride and Fluorine-Oxygen Mixtures in Rocket Systems, Lewis Research Center, NASA SP-3037, Cleveland, Ohio, 1967.
Wikimedia Foundation.
2010.
Содержание
- Открытие
- Систематическое название
- Физические свойства
- Получение
- Химические свойства
- Взаимодействие с металлами
- Применение
- Токсичность
- Упоминания в литературе
Фторид кислорода(II), дифторид кислорода, OF2. При нормальных условиях представляет собой бесцветный ядовитый газ, конденсирующийся при охлаждении в светло-жёлтую жидкость. Фторид кислорода(II) имеет раздражающий запах, несколько отличающийся от запаха фтора.
| Фторид кислорода(II) | |
|---|---|
| Общие | |
| Систематическое наименование |
Фторид кислорода(II) |
| Хим. формула | F2O |
| Рац. формула | OF2 |
| Физические свойства | |
| Состояние | бледно-жёлтый газ |
| Молярная масса | 54 г/моль |
| Плотность | 1,59 г/см³ |
| Энергия ионизации | 13,11 ± 0,01 эВ |
| Термические свойства | |
| Температура | |
| • плавления | -224 °C |
| • кипения | -145 °C |
| • разложения | выше 200 °C |
| Критическая точка | -58 °C, 49 атм |
| Энтальпия | |
| • образования | -25,2 кДж/моль |
| Давление пара | 1 ± 1 атм |
| Классификация | |
| Рег. номер CAS | 7783-41-7 |
| PubChem | 24547 |
| Рег. номер EINECS | 231-996-7 |
| SMILES |
O(F)F |
| InChI |
1S/F2O/c1-3-2 UJMWVICAENGCRF-UHFFFAOYSA-N |
| RTECS | RS2100000 |
| ChEBI | 30494 |
| ChemSpider | 22953 |
| Безопасность | |
| ЛД50 | LC50: 1-2 мг/м3*1 час (крысы, ингаляция) |
| Токсичность | Чрезвычайно ядовит, СДЯВ |
| Пиктограммы ECB |   |
| NFPA 704 |
Открытие
Дифторид кислорода был открыт впервые в 1929 году Полем Лебо и Августином Дамьеном, а спустя некоторое время подробно изучен Руффом и Менцелем.
Систематическое название
В литературе иногда это соединение называют оксидом фтора (F2O). Однако это неверно, так как атом фтора более электроотрицателен, чем кислород, и по правилам IUPAC это соединение должно называться именно фторидом кислорода (OF2). Хотя общая электронная пара практически не смещается от атома кислорода в сторону атома фтора.
Физические свойства
Жидкий фторид кислорода неограниченно смешивается с жидкими озоном, фтором, кислородом. Плохо растворяется в холодной воде (примерно 7:100 по объёму). При этом достаточно хорошо растворяет воздух.
Молекула обладает слабым дипольным моментом, равным 0,3 Д.
Получение
- Получение фторида кислорода(II) до сих пор проводят по так называемому «щелочному» способу пропусканием газообразного фтора в 2 % (0,5 нормальный) водный раствор гидроксида натрия (NaOH). Помимо фторида кислорода(II) в реакции происходит образование перекиси водорода и озона:
- Возможно также получение фторида кислорода(II) электролизом водного раствора HF.
- При горении воды в атмосфере фтора также частично образуется дифторид кислорода и пероксид водорода. Это происходит за счёт протекания радикальных реакций:
-
— инициация свободных радикалов с образованием бирадикала O:
— доминирующий процесс
Химические свойства
Дифторид кислорода — весьма энергичный окислитель, и в этом отношении напоминает по силе свободный фтор, а по механизму окисления — озон, но реакции с участием фторида кислорода(II) требуют более высокой энергии активации, так как на первой стадии происходит образование атомарного кислорода (как и у озона). Термическое разложение фторида кислорода(II) представляет собой мономолекулярную реакцию с энергией активации 41 ккал/моль и начинается только при температуре выше 200 °C.
При растворении в горячей воде подвергается гидролизу. При этом образуется фтороводород и обычный кислород. В щелочной среде разложение протекает достаточно быстро.
Смесь паров дифторида кислорода и воды взрывоопасна:
Фторид кислорода(II) не действует на сухое стекло и кварц, но действует (интенсивно) на металлическую ртуть, что исключает применение ртути в приборах с фторидом кислорода(II). На смазку для газовых кранов фторид кислорода(II) действует очень медленно.
Взаимодействие с металлами
На меди, платине, золоте, серебре фторид кислорода(II) образует лишь тончайшие защитные плёнки фторидов, что позволяет использовать эти металлы в контакте с фторидом кислорода(II) при комнатной температуре. При повышении температур до 250°C происходит дальнейшее окисление металлов. Наиболее подходящими металлами для работы с дифторидом кислорода являются алюминий и магний. Нержавеющие стали, никель, монель-металл, магниевомедный сплав (92/8), латунь и медь также мало изменяются в весе при воздействии фторида кислорода(II) в течение 1-1,5 недели при 100 °C.
Применение
Благодаря высокой энергии активации разложения фторида кислорода(II), это соединение можно сравнительно безопасно смешивать с многими углеводородами, водородом, моноокисью углерода и прочими веществами, что чрезвычайно важно в практическом плане использования фторида кислорода(II) в качестве высокоэффективного окислителя ракетного топлива. Так как фторид кислорода(II) не взрывается при смешивании с горючими материалами и при нагревании (сам по себе) то его применение вполне безопасно.
Имели значительный успех опыты применения фторида кислорода(II) в газодинамических химических лазерах. Имея лучшие показатели, нежели фтор, фторид кислорода(II) способен занять достойное место в качестве компонента для боевого лазерного оружия высокой мощности.
Токсичность
Фторид кислорода(II) OF2 (дифторид кислорода) чрезвычайно токсичен (степень токсичности сопоставима с таковой фосгена COCl2), гораздо более ядовит, чем элементарный фтор, так как вызывает сильнейшее раздражение тканей организма, очень глубоко проникает и растворяется в них (глубже чем фтор), затрудняет дыхание. По токсикологии NFPA 704 ему присвоена высшая токсичность.
Смертельная доза (LC50) — 1-2 мг/м3*1 час (даже меньше, чем у синильной кислоты).
Дифторид кислорода опасен для окружающей среды.
Упоминания в литературе
В фантастической новелле Роберта Л. Форварда «Камелот 30К», дифторид кислорода был использован как биохимический растворитель для живых форм, живущих в поясе Койпера Солнечной системы. Хотя, при 30 градусах Кельвина фторид кислорода будет твердым, вымышленные инопланетные организмы являются эндотермическими, и благодаря радиотермическому нагреву могут использовать жидкий фторид кислорода в качестве крови.
Дифторид кислорода
Фториды кислорода соединения элементов кислород и фтор с общей формулой OпF2, где n = от 1 до 6. Известно много различных фторидов кислорода:
- дифторид кислорода (ИЗ2)
- дифторид кислорода (O2F2)
- дифторид триоксигена или дифторид озона (O3F2)[1][2]
- дифторид тетраоксигена (O4F2)[3]
- дифторид пентаоксигена (O5F2)
- гексао дифторид кислорода (O6F2)[4]
- монофторид диоксида (O2F)
тетраоксигендифторид
Фториды кислорода сильные окислители с высокой энергией и могут высвобождать свою энергию мгновенно или с контролируемой скоростью. Таким образом, эти соединения привлекли большое внимание как потенциальные топлива в реактивные двигательные установки.[5]
Синтез
Вот некоторые методы синтеза и реакции трех наиболее распространенных фторидов кислорода — дифторида кислорода (OF2), дифторид кислорода (O2F2) и дифторид озона (O3F2).
Дифторид кислорода (OF2)
Дифторид кислорода
Обычный препаративный метод включает фторирование едкий натр:
ИЗ2 представляет собой бесцветный газ при комнатной температуре и желтую жидкость при температуре ниже 128 К. Дифторид кислорода имеет раздражающий запах и ядовит.[3] Количественно реагирует с водными галогенкислотами, освобождая галогены:
Он также может вытеснять галогены из их солей.[3] Это одновременно эффективный фторирующий агент и сильный окислитель. При реакции с ненасыщенными фториды азота при электрическом разряде приводит к образованию трифторид азота, фториды оксидов и другие оксиды.[6][7]
Дифторид кислорода (O2F2)
Дифторид кислорода
О2F2 выпадает в виде коричневого твердого вещества на УФ-облучение смеси жидкого O2 и F2 при -196 ° C.[8] Он также кажется стабильным только при температуре ниже -160 ° C.[9] Общий метод получения многих фторидов кислорода — это газовый электрический разряд в холодных контейнерах, включая O2F2.[10]
Обычно это оранжево-желтое твердое вещество, которое быстро разлагается до O2 и F2 близко к своей нормальной температуре кипения около 216 К.[3]
О2F2 бурно реагирует с красный фосфор, даже при -196 ° C. Взрывы также могут произойти, если Фреон-13 используется для смягчения реакции.[9]
Дифторид триоксигена (O3F2)
О3F2 представляет собой вязкую жидкость кроваво-красного цвета. Он остается жидким при 90 K и поэтому его можно отличить от O2F2 который имеет температуру плавления около 109 К.[11][3]
Как и другие фториды кислорода, O3F2 является эндотермический и разлагается примерно при 115 K с выделением тепла, которое дается следующей реакцией:
О3F2 безопаснее работать, чем озон, и может испаряться, термически разлагаться или подвергаться воздействию электрических искр без каких-либо взрывов. Но при контакте с органическими веществами или окисляемыми соединениями он может взорваться или взорваться. Таким образом, добавление даже одной капли дифторида озона к твердому безводному аммиак приведет к легкому взрыву, когда оба они будут иметь температуру 90 К.[3]
Монофторид диоксида
Монофторид диоксида такая молекула, как O-O-F, чья химическая формула это O2F и стабилен только при низкой температуре. Сообщается, что он производится из атомарного фтора и дикислорода.[12].
Общее получение дифторидов полиоксида
| Уравнение реакции[6] | F2: O2 по объему | Текущий | Температура ванны (° C) |
|---|---|---|---|
 |
1:1 | 10–50 мА | ~ -196° |
 |
2:3 | 25–30 мА | ~ -196° |
 |
1:2 | 4-5 мА | ~ -205° |
Воздействие на озон
Кислородные и фторсодержащие радикалы, такие как FO2 и FO встречаются в атмосфере. Они вместе с другими галогеновыми радикалами участвовали в разрушение озона в атмосфере. Однако оксид фтора радикалы предполагается, что они не играют такой большой роли в истощении озонового слоя, потому что свободные атомы фтора в атмосфере, как полагают, реагируют с метан производить плавиковая кислота который выпадает в дождь. Это уменьшает доступность свободных атомов фтора для атомов кислорода, чтобы реагировать с молекулами озона и разрушать их.[13]
Гиперголический пропеллент
Несмотря на низкую растворимость O3F2 в жидком кислороде, как было показано, гиперголичный с большинством ракетного топлива. Механизм заключается в выкипании кислорода из раствора, содержащего O3F2, что делает его более реактивным для самопроизвольной реакции с ракетным топливом. Степень реактивности также зависит от типа используемого топлива.[3]
Смотрите также
- Оксид брома
- Оксид хлора
- Оксид йода
- Озон
Рекомендации
- ^ Solomon, I. J. et al. (1968). «Дополнительные исследования о существовании O3F2«. Журнал Американского химического общества. 90 (20): 5408–5411. Дои:10.1021 / ja01022a014.CS1 maint: использует параметр авторов (связь)
- ^ Мисочко, Евгений Я., Александр В. Акимов, Чарльз А. Уайт (1999). «Инфракрасное спектроскопическое наблюдение стабилизированного Промежуточного комплекса ФО.3 образуется в результате реакции подвижных атомов фтора с молекулами озона, заключенными в матрицу аргона ». Журнал физической химии A. 103 (40): 7972–7977. Bibcode:1999JPCA..103.7972M. Дои:10.1021 / jp9921194.CS1 maint: использует параметр авторов (связь)
- ^ а б c d е ж грамм Штренг, А. Г. (1963). «Фториды кислорода». Химические обзоры. 63 (6): 607–624. Дои:10.1021 / cr60226a003.
- ^ Штренг, А.Г., А.В. Гроссе (1966). «Два новых фторида кислорода, O5F2 и O6F2«. Журнал Американского химического общества. 88: 169–170. Дои:10.1021 / ja00953a035.CS1 maint: использует параметр авторов (связь)
- ^ Jager, Susanne et al. (1986). «Фтор и кислород». Фтор. Берлин, Гейдельберг: Springer. С. 1–161.CS1 maint: использует параметр авторов (связь)
- ^ а б Никитин, Игорь Васильевич, В. Я. Росоловский (1971). «Фториды кислорода и диоксигенильные соединения». Российские химические обзоры. 40 (11): 889–900. Bibcode:1971RuCRv..40..889N. Дои:10.1070 / rc1971v040n11abeh001981.CS1 maint: использует параметр авторов (связь)
- ^ Лоулесс, Эдвард В., Иван С. Смит (1968). Неорганические высокоэнергетические окислители: синтез, строение и свойства. М. Деккер.CS1 maint: использует параметр авторов (связь)
- ^ Маркс, Руперт, Конрад Сеппельт (2015). «Структурные исследования фторидов кислорода». Dalton Transactions. 44 (45): 19659–19662. Дои:10.1039 / c5dt02247a. PMID 26351980.CS1 maint: использует параметр авторов (связь)
- ^ а б Соломон, Ирвин Дж. Исследования по химии
и
. № IITRI-C227-6. IIT RESEARCH INST CHICAGO IL, 1964.
- ^ Goetschel, Charles T. et al. (1969). «Низкотемпературная радиационная химия. I. Получение фторидов кислорода и диоксигенилтетрафторбората». Журнал Американского химического общества. 91 (17): 4702–4707. Дои:10.1021 / ja01045a020.CS1 maint: использует параметр авторов (связь)
- ^ Де Марко, Рональд А. и Жанна М. Шрив. «Фторированные пероксиды». Успехи неорганической химии и радиохимии. Vol. 16. Academic Press, 1974. 109–176.
- ^ Дж. Л. Лайман и Р. Холланд, J. Phys. Chem.,1988,92, 7232.
- ^ Франсиско Дж. С. (1993). «Неэмпирическое исследование значения промежуточного соединения HOOF в реакциях сочетания с участием FOO x и HO x». Журнал химической физики. 98 (3): 2198–2207. Bibcode:1993ЖЧФ..98.2198Ф. Дои:10.1063/1.464199.
внешняя ссылка
- Национальный реестр загрязнителей — информационный бюллетень по фторидам и соединениям
- Фторид кислорода PubChem
- Центр по контролю и профилактике заболеваний — опасность для здоровья дифторида кислорода
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1.
Показано записей: 1.
Фторид кислорода(II)
Брутто-формула:
F2O
CAS# 7783-41-7
Названия
Русский:
- Фторид кислорода(II) [Wiki]
- оксид фтора
English:
- Difluorine monoxide
- Fluorine (di-)oxide
- Oxydifluoride
- Oxygen difluoride [Wiki]
- Oxygen fluoride
- difluoridooxygen
- fluoro hypofluorite(IUPAC)
- hypofluorous anhydride
- oxy-fluoride
- oxyfluoride
German:
Ελληνικά:
- Ανυδρίτης του υποφθοριώδους οξέος
- Διφθοριούχο οξυγόνο(IUPAC) [Wiki]
- Φθοριούχο οξυγόνο
Español:
- Difluoruro de oxígeno(IUPAC) [Wiki]
French:
- Difluorure d’oxygène [Wiki]
- Monoxyde de difluor
- Monoxyde de fluor
- fluorure d’oxygène
Italiano:
日本語:
中文:
Варианты формулы:
Реакции, в которых участвует Фторид кислорода(II)
-
2Xe + 2OF2 -> 2XeF2 + O2
-
ClF3 + H2O → HF + HCl + OF2
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.






![{ displaystyle { ce {{O2} + F2 -> [{ text {Электрический разряд}}] [{ text {183 ° C}}] O2F2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a491eb65187fb3fba5dd4edcdb57d29bfe59540)




