From Wikipedia, the free encyclopedia
|
|
| Names | |
|---|---|
| Other names
Sellaite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.086 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgF2 |
| Molar mass | 62.3018 g/mol |
| Appearance | White tetragonal crystals |
| Density | 3.148 g/cm3 |
| Melting point | 1,263 °C (2,305 °F; 1,536 K) |
| Boiling point | 2,260 °C (4,100 °F; 2,530 K) |
|
Solubility in water |
0.013 g/(100 mL) |
|
Solubility product (Ksp) |
5.16⋅10−11 |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−22.7⋅10−6 cm3/mol |
|
Refractive index (nD) |
1.37397 |
| Structure | |
|
Crystal structure |
Rutile (tetragonal), tP6 |
|
Space group |
P42/mnm, No. 136 |
| Thermochemistry | |
|
Heat capacity (C) |
61.6 J⋅mol−1⋅K−1 |
|
Std molar |
57.2 J⋅mol−1⋅K−1 |
|
Std enthalpy of |
−1124.2 kJ⋅mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1071 kJ/mol |
| Hazards[2][3] | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H303, H315, H319, H335 |
|
Precautionary statements |
P261, P304+P340, P305+P351+P338, P405 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
2330[clarification needed] (rat, oral) |
| Safety data sheet (SDS) | ChemicalBook |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium fluoride is an inorganic compound with the formula MgF2. The compound is a white crystalline salt and is transparent over a wide range of wavelengths, with commercial uses in optics that are also used in space telescopes. It occurs naturally as the rare mineral sellaite.
Production[edit]
Magnesium fluoride is prepared from magnesium oxide with sources of hydrogen fluoride such as ammonium bifluoride:
- MgO + [NH4]HF2 → MgF2 + NH3 + H2O
Related metathesis reactions are also feasible.[which?]
Structure[edit]
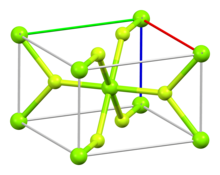
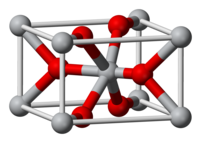
The compound crystallizes as tetragonal birefringent crystals. The structure of the magnesium fluoride is similar to that of rutile,[4][5] featuring octahedral Mg2+ cations and 3-coordinate F− anions.[6]
| Magnesium coordination | Fluorine coordination |
|---|---|

|

|
In the gas phase, monomeric MgF2 molecules adopt a linear molecular geometry.[4][5]
Uses[edit]
Optics[edit]
Magnesium fluoride is transparent over an extremely wide range of wavelengths. Windows, lenses, and prisms made of this material can be used over the entire range of wavelengths from 0.120 μm (vacuum ultraviolet) to 8.0 μm (infrared). High-quality, synthetic magnesium fluoride is one of two materials (the other being lithium fluoride) that will transmit in the vacuum ultraviolet range at 121 nm (Lyman alpha). Lower-grade magnesium fluoride is inferior to calcium fluoride in the infrared range.[citation needed]
Magnesium fluoride is tough and polishes well but is slightly birefringent and should therefore be cut with the optic axis perpendicular to the plane of the window or lens.[6] Due to its suitable refractive index of 1.37, magnesium fluoride is commonly applied in thin layers to the surfaces of optical elements as an inexpensive anti-reflective coating.[citation needed] Its Verdet constant is 0.00810 arcmin⋅G–1⋅cm–1 at 632.8 nm.[8]
Safety[edit]
Chronic exposure to magnesium fluoride may affect the skeleton, kidneys, central nervous system, respiratory system, eyes and skin, and may cause or aggravate attacks of asthma.[9]
References[edit]
- ^
Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, Florida: CRC Press, pp. 4–67, 1363, ISBN 0-8493-0594-2 - ^ «Magnesium Fluoride Material Safety Data Sheet». Science Labs. May 21, 2013. Retrieved October 13, 2017.
- ^ «Magnesium fluoride». CAS DataBase List. ChemicalBook. Retrieved October 13, 2017.
- ^ a b Wells, A. F. (1984). Structural Inorganic Chemistry (5th ed.). Oxford University Press. pp. 413, 441. ISBN 978-0-19-965763-6.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 117–119. ISBN 978-0-08-037941-8.
- ^ a b Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, René; Cuer, Jean Pierre (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_307.
- ^ Haines, J.; Léger, J. M.; Gorelli, F.; Klug, D. D.; Tse, J. S.; Li, Z. Q. (2001). «X-ray diffraction and theoretical studies of the high-pressure structures and phase transitions in magnesium fluoride». Phys. Rev. B. 64: 134110. doi:10.1103/PhysRevB.64.134110.
- ^ J. Chem. Soc., Faraday Trans., 1996, 92, 2753 — 2757. doi:10.1039/FT9969202753
- ^ «Magnesium Fluoride Material Safety Data Sheet». ESPI Metals. August 2004. Archived from the original on 2017-10-28. Retrieved October 13, 2017.
External links[edit]
- A java applet showing the effect of MgF2 on a lens
- Infrared windows at Lawrence Berkeley National Laboratory
- National Pollutant Inventory — Fluoride and compounds fact sheet
- Crystran Data Crystran MSDS[permanent dead link]
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| Other names
Sellaite |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.086 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgF2 |
| Molar mass | 62.3018 g/mol |
| Appearance | White tetragonal crystals |
| Density | 3.148 g/cm3 |
| Melting point | 1,263 °C (2,305 °F; 1,536 K) |
| Boiling point | 2,260 °C (4,100 °F; 2,530 K) |
|
Solubility in water |
0.013 g/(100 mL) |
|
Solubility product (Ksp) |
5.16⋅10−11 |
| Solubility |
|
|
Magnetic susceptibility (χ) |
−22.7⋅10−6 cm3/mol |
|
Refractive index (nD) |
1.37397 |
| Structure | |
|
Crystal structure |
Rutile (tetragonal), tP6 |
|
Space group |
P42/mnm, No. 136 |
| Thermochemistry | |
|
Heat capacity (C) |
61.6 J⋅mol−1⋅K−1 |
|
Std molar |
57.2 J⋅mol−1⋅K−1 |
|
Std enthalpy of |
−1124.2 kJ⋅mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1071 kJ/mol |
| Hazards[2][3] | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H303, H315, H319, H335 |
|
Precautionary statements |
P261, P304+P340, P305+P351+P338, P405 |
| NFPA 704 (fire diamond) |
3 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
2330[clarification needed] (rat, oral) |
| Safety data sheet (SDS) | ChemicalBook |
| Related compounds | |
|
Other anions |
|
|
Other cations |
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium fluoride is an inorganic compound with the formula MgF2. The compound is a white crystalline salt and is transparent over a wide range of wavelengths, with commercial uses in optics that are also used in space telescopes. It occurs naturally as the rare mineral sellaite.
Production[edit]
Magnesium fluoride is prepared from magnesium oxide with sources of hydrogen fluoride such as ammonium bifluoride:
- MgO + [NH4]HF2 → MgF2 + NH3 + H2O
Related metathesis reactions are also feasible.[which?]
Structure[edit]
The compound crystallizes as tetragonal birefringent crystals. The structure of the magnesium fluoride is similar to that of rutile,[4][5] featuring octahedral Mg2+ cations and 3-coordinate F− anions.[6]
| Magnesium coordination | Fluorine coordination |
|---|---|

|

|
In the gas phase, monomeric MgF2 molecules adopt a linear molecular geometry.[4][5]
Uses[edit]
Optics[edit]
Magnesium fluoride is transparent over an extremely wide range of wavelengths. Windows, lenses, and prisms made of this material can be used over the entire range of wavelengths from 0.120 μm (vacuum ultraviolet) to 8.0 μm (infrared). High-quality, synthetic magnesium fluoride is one of two materials (the other being lithium fluoride) that will transmit in the vacuum ultraviolet range at 121 nm (Lyman alpha). Lower-grade magnesium fluoride is inferior to calcium fluoride in the infrared range.[citation needed]
Magnesium fluoride is tough and polishes well but is slightly birefringent and should therefore be cut with the optic axis perpendicular to the plane of the window or lens.[6] Due to its suitable refractive index of 1.37, magnesium fluoride is commonly applied in thin layers to the surfaces of optical elements as an inexpensive anti-reflective coating.[citation needed] Its Verdet constant is 0.00810 arcmin⋅G–1⋅cm–1 at 632.8 nm.[8]
Safety[edit]
Chronic exposure to magnesium fluoride may affect the skeleton, kidneys, central nervous system, respiratory system, eyes and skin, and may cause or aggravate attacks of asthma.[9]
References[edit]
- ^
Lide, David R. (1998), Handbook of Chemistry and Physics (87 ed.), Boca Raton, Florida: CRC Press, pp. 4–67, 1363, ISBN 0-8493-0594-2 - ^ «Magnesium Fluoride Material Safety Data Sheet». Science Labs. May 21, 2013. Retrieved October 13, 2017.
- ^ «Magnesium fluoride». CAS DataBase List. ChemicalBook. Retrieved October 13, 2017.
- ^ a b Wells, A. F. (1984). Structural Inorganic Chemistry (5th ed.). Oxford University Press. pp. 413, 441. ISBN 978-0-19-965763-6.
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 117–119. ISBN 978-0-08-037941-8.
- ^ a b Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, René; Cuer, Jean Pierre (2000). «Fluorine Compounds, Inorganic». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_307.
- ^ Haines, J.; Léger, J. M.; Gorelli, F.; Klug, D. D.; Tse, J. S.; Li, Z. Q. (2001). «X-ray diffraction and theoretical studies of the high-pressure structures and phase transitions in magnesium fluoride». Phys. Rev. B. 64: 134110. doi:10.1103/PhysRevB.64.134110.
- ^ J. Chem. Soc., Faraday Trans., 1996, 92, 2753 — 2757. doi:10.1039/FT9969202753
- ^ «Magnesium Fluoride Material Safety Data Sheet». ESPI Metals. August 2004. Archived from the original on 2017-10-28. Retrieved October 13, 2017.
External links[edit]
- A java applet showing the effect of MgF2 on a lens
- Infrared windows at Lawrence Berkeley National Laboratory
- National Pollutant Inventory — Fluoride and compounds fact sheet
- Crystran Data Crystran MSDS[permanent dead link]
Поиск
Каталог
Фторид магния
ГОСТ 7204-77
MgF2
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы.
Магний фтористый – неорганическое соединение, растворимое в воде. Является источником магния для использования в чувствительных к кислороду средах, например, при производстве металла. В 2013 году соединение использовалось в Институте Макса Планка в квантовой оптике с целью создания новой оптики.
Физические свойства
Фторид магния образует бесцветные диамагнитные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,4625 нм, c = 0,3052 нм, Z = 2. При температуре 857°С переходит в другую тетрагональную фазу.
Флуоресцирует фиолетовым цветом, плохо растворяется в воде и ацетоне.
MgF2 (фтористый магний) встречается в природных месторождениях и известен как минерал Селлаит (Sellaite). Фтористый магний — положительный двулучепреломляющий кристалл, выращивается в вакууме методом Стокбаргера с кристаллической затравкой вдоль оси С. Максимальный размеры изделий из MgF2: диаметр до 100 мм и толщина до 30 мм.
Химические свойства
- Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов с образованием комплексных анионов:
| Общие | |
|---|---|
| Систематическое наименование |
Фторид магния |
| Традиционные названия | Фтористый магний |
| Хим. формула | MgF2 |
| Физические свойства | |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 62,31 г/моль |
| Плотность | 2,9-3,2; 3,148; 3,13 г/см³ |
| Термические свойства | |
| Т. плав. | 1263; 1396 °C |
| Т. кип. | 2239; 2250 °C |
| Мол. теплоёмк. | 61,6 Дж/(моль·К) |
| Энтальпия образования | -1124,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,007618 г/100 мл |
Свойства материала MgF2 (фтористый магний)
| ПАРАМЕТР | ЗНАЧЕНИЕ | |
| ОПТИЧЕСКИЕ СВОЙСТВА MgF2 (фтористый магний) | ||
| Диапазон пропускания | 0.11 — 7.5 мкм | |
| Показатель преломления | no=1.3836, ne=1.3957 (l = 0.405 мкм) | |
| Потери на отражение | 11.2% (l = 0.12 мкм, 2 поверхности) | |
| dn/dT | 2.3 x 10-6/K и 1.7 x 10-6/K (l = 0.4 мкм) | |
| ФИЗИЧЕСКИЕ СВОЙСТВА MgF2 (фтористый магний) | ||
| Плотность | 3.177 г/см3 | |
| Температура плавления | 1255 °C | |
| Коэффициент теплопроводности | 0.3 Вт/(м K) при 27 °C | |
| Коэффициент термического расширения | 13.7 x 10-6/К и 8.48x 10-6/К | |
| Твердость по Кнупу | 415 кг/мм2 | |
| Удельная теплоемкость | 0.24 кал/(г K) при 298 К 0.362 кал/(г K) при 1700 К |
|
| Диэлектрическая постоянная | 4.87 (параллельно оси) 5.45 (перпендикулярно оси) |
|
| Модуль Юнга, E | 138.5 ГПа | |
| Модуль сдвига, G | 54.66 ГПа | |
| Модуль объемной деформации, K | 101.32 ГПа | |
| Упругие коэффициенты | C11=140.2 МПа, C12=89.5 МПа,C44=56.8 МПа, C33=204.7 МПа,C13=62.9 МПа, C66=95.7 МПа, |
|
| Предел упругости | 49.64 МПа | |
| Коэффициент Пуассона | 0.276 | |
| ХИМИЧЕСКИЕ СВОЙСТВА MgF2 (фтористый магний) | ||
| Растворимость | <0.0002 г / 100 г воды при 0 °C | |
| Молекулярный вес | 62.32 | |
| Класс | Тетрагональный, раскалывается по оси С |
Показатель преломления MgF2 (фтористый магний)
| Длина волны, мкм | 0.20 | 0.23 | 0.27 | 0.34 | 0.56 |
| Показатель преломления ne | 1.43 | 1.42 | 1.41 | 1.40 | 1.39 |
| Показатель преломления no | 1.42 | 1.41 | 1.40 | 1.39 | 1.38 |
Применяется магний фтористый для лабораторных исследований и производства. Применяют в оптике и для космических телескопов.
Для хранения магний фтористого подойдет прохладное место с хорошей вентиляцией, контейнер должен быть закрытым и сухим.
Изделия из MgF2 (фтористый магний, фторид магния) используются в спектральном диапазоне: 0.11 мкм — 7.5 мкм. MgF2 (фтористый магний) — износостойкий твердый материал, устойчивый к тепловым и механическим нагрузкам. Из фтористого магния изготавливают оптические компоненты для УФ, видимого и ИК-диапазонов, когда требуется высокая износоустойчивость и долговечность. Воздействие излучения на материал не приводит к появлению в нем центров окраски. Раскалывание материала достигается при значительной механической нагрузке и, когда это происходит, является почти идеальным.
| Фторид магния | |
|---|---|
|
|
|
| Систематическое наименование |
Фторид магния |
| Традиционные названия | Фтористый магний |
| Хим. формула | MgF2 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 62,31 г/моль |
| Плотность | 2,9-3,2; 3,148; 3,13 г/см³ |
| Температура | |
| • плавления | 1263; 1396 °C |
| • кипения | 2239; 2250 °C |
| Мол. теплоёмк. | 61,6 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1124,2 кДж/моль |
| Растворимость | |
| • в воде | 0,007618 г/100 мл |
| Рег. номер CAS | 7783-40-6 |
| PubChem | 24546 |
| Рег. номер EINECS | 231-995-1 |
| SMILES |
[Mg+2].[F-].[F-] |
| InChI |
1S/2FH.Mg/h2*1H;/q;;+2/p-2 ORUIBWPALBXDOA-UHFFFAOYSA-L |
| RTECS | OM3325000 |
| ChemSpider | 22952 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы.
Получение
- Непосредственно из элементов, сжигая магний в атмосфере фтора:
-
- Mg + F2 → MgF2
- Действуя плавиковой кислотой оксид магния, его гидроксид, карбонат или галогенид:
-
- MgO + 2 HF → MgF2 + H2O
- Mg(OH)2 + 2 HF → MgF2 + 2 H2O
- MgCO3 + 2 HF → MgF2 + CO2 ↑ + H2O
- MgCl2 + 2 HF →τoC MgF2 + HCl ↑
- Обменными реакциями, используя плохую растворимость фторида магния:
-
- MgCl2 + 2 NH4F → MgF2 ↓ + 2 NH4Cl
Физические свойства
Фторид магния образует бесцветные диамагнитные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,4625 нм, c = 0,3052 нм, Z = 2. При температуре 857°С переходит в другую тетрагональную фазу.
Флуоресцирует фиолетовым цветом, плохо растворяется в воде и ацетоне.
Химические свойства
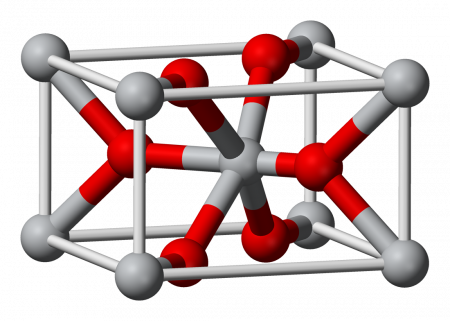
- Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов с образованием комплексных анионов:
-
- MgF2 + 2 NaF → Na2[MgF4]
Магний фтористый — кристаллы.
Применение
- Фторид магния прозрачен в диапазоне длин волн от 0,120 мкм (вакуумный ультрафиолет) до 8,0 мкм (инфракрасное излучение), поэтому его используют для изготовления линз и призм в специальных оптических системах.
- Компонент флюсов, стекол, керамики, эмалей, катализаторов, смесей для получения искусственной слюды и асбеста; оптический и лазерный материал.
Фторид магния
| Фторид магния | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Фторид магния |
| Традиционные названия | Фтористый магний |
| Хим. формула | MgF2 |
| Физические свойства | |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 62,31 г/моль |
| Плотность | 2,9-3,2; 3,148; 3,13 г/см³ |
| Термические свойства | |
| Т. плав. | 1263; 1396 °C |
| Т. кип. | 2239; 2250 °C |
| Мол. теплоёмк. | 61,6 Дж/(моль·К) |
| Энтальпия образования | -1124,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,007618 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7783-40-6 |
| PubChem | 24546 |
| Рег. номер EINECS | 231-995-1 |
| SMILES |
[Mg+2].[F-].[F-] |
| InChI |
1S/2FH.Mg/h2*1H;/q;;+2/p-2 ORUIBWPALBXDOA-UHFFFAOYSA-L |
| RTECS | OM3325000 |
| ChemSpider | 22952 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы.
Получение
- Непосредственно из элементов, сжигая магний в атмосфере фтора:
- Действуя плавиковой кислотой оксид магния, его гидроксид, карбонат или галогенид:
- Обменными реакциями, используя плохую растворимость фторида магния:
Физические свойства
Фторид магния образует бесцветные диамагнитные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,4625 нм, c = 0,3052 нм, Z = 2.
При температуре 857°С переходит в другую тетрагональную фазу.
Флуоресцирует фиолетовым цветом, плохо растворяется в воде и ацетоне.
Химические свойства
- Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов с образованием комплексных анионов:
Применение
- Фторид магния прозрачен в диапазоне длин волн от 0,120 мкм (вакуумный ультрафиолет) до 8,0 мкм (инфракрасное излучение), поэтому его используют для изготовления линз и призм в специальных оптических системах.
- Компонент флюсов, стекол, керамики, эмалей, катализаторов, смесей для получения искусственной слюды и асбеста; оптический и лазерный материал.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
| Фторид магния | |
| Общие | |
|---|---|
| Систематическое наименование | Фторид магния |
| Традиционные названия | Фтористый магний |
| Химическая формула | MgF2 |
| Физические свойства | |
| Состояние (ст. усл.) | Бесцветные кристаллы |
| Молярная масса | 62,31 г/моль |
| Плотность | 2,9-3,2; 3,148; 3,13 г/см³ |
| Термические свойства | |
| Температура плавления | 1263; 1396 °C |
| Температура кипения | 2239; 2250 °C |
| Молярная теплоёмкость (ст. усл.) | 61,6 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -1124,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,007618 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7783-40-6 |
| Рег. номер PubChem | 24546 |
| SMILES | [Mg+2].[F-].[F-] |
| RTECS | OM3325000 |
Фторид магния — бинарное неорганическое соединение магния и фтора с формулой MgF2. Бесцветные диамагнитные тетраэдрические кристаллы.
Получение
- Непосредственно из элементов, сжигая магний в атмосфере фтора:
- Действуя плавиковой кислотой оксид магния, его гидроксид, карбонат или галогенид:
- Обменными реакциями, используя плохую растворимость фторида магния:
Физические свойства
Фторид магния образует бесцветные диамагнитные кристаллы тетрагональной сингонии, пространственная группа P 4/mnm, параметры ячейки a = 0,4625 нм, c = 0,3052 нм, Z = 2. При температуре 857°С переходит в другую тетрагональную фазу.
Флуоресцирует фиолетовым цветом, плохо растворяется в воде и ацетоне.
Химические свойства
- Хорошо растворяется в растворах фторидов и сульфатов щелочных металлов с образованием комплексных анионов:
Применение
- Фторид магния прозрачен в диапазоне длин волн от 0,120 мкм (вакуумный ультрафиолет) до 8,0 мкм (инфракрасное излучение), поэтому его используют для изготовления линз и призм в специальных оптических системах.
- Компонент флюсов, стекол, керамики, эмалей, катализаторов, смесей для получения искусственной слюды и асбеста; оптический и лазерный материал.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
|
Соединения магния |
|---|
|
Борид магния (MgB2) • Бромид магния (MgBr2) • Гидрид магния (MgH2) • Гидрокарбонат магния (Mg(HCO3)2) • Гидроксид магния (Mg(OH)2) • Гидроортофосфат магния (MgHPO4) • Дигидроортофосфат магния (Mg(H2PO4)2) • Иодид магния (MgI2) • Карбид магния (MgC2) • Карбонат магния (MgCO3) • Нитрат магния (Mg(NO3)2) • Нитрид магния (Mg3N2) • Оксид магния (MgO) • Ортоарсенат аммония-магния (NH4MgAsO4) • Ортоарсенат магния (Mg3(AsO4)2) • Ортофосфат аммония-магния (NH4MgPO4) • Пероксид магния (MgO2) • Перхлорат магния (Mg(ClO4)2) • Силицид магния (Mg2Si) • Сульфат магния (MgSO4) • Сульфид магния (MgS) • Сульфит магния (MgSO3) • Фосфат магния (Mg3(PO4)2) • Фосфид магния (Mg3P2) • Фторид магния (MgF2) • Хлорид магния (MgCl2) • Цитрат магния (MgC6H6O7) |
|
Соединения фтора |
|---|
|
Гексафторалюминат натрия (Na3AlF6) • Гексафтороантимонат водорода (HSbF6) • Гексафторид платины (PtF6) • Гексафторид селена (SeF6) • Гексафторид теллура (TeF6) • Гексафторогерманат калия (K2[GeF6]) • Гексафторогерманат рубидия (Rb2[GeF6]) • Гексафторогерманат цезия (Cs2[GeF6]) • Гексафторосиликат(IV) калия (K2[SiF6]) • Гексафторосиликат натрия (Na2SiF6) • Гексафторплатинат ксенона (XePtF6) • Гексафторсиликат аммония ((NH4)2SiF6) • Гептафторид рения (ReF7) • Гептафторониобат(V) калия (K2[NbF7]) • Гидрофторид аммония ([NH4][HF2]) • Гидрофторид калия (HF2K) • Декафторид дисеры (S2F10) • Диоксидифторид (F2O2) • Диоксидифторид молибдена(VI) (MoF2O2) • Дифтордиазин (N2F2) • Дифторид радона (F2Rn) • Кремнефтористоводородная кислота (H2SiF6) • Монофторид алюминия (AlF) • Монофторид углерода (CF) • Оксид-фторид урана (UO2F2) • Окситетрафторид вольфрама(VI) (WOF4) • Окситетрафторид молибдена(VI) (MoOF4) • Оксифторид иттрия (YOF) • Оксифторид лантана(III) (LaOF) • Оксотетрафторид ксенона (XeOF4) • Оксотрифторид ванадия(V) (F3OV) • Пентафторид висмута (BiF5) • Пентафторид мышьяка (AsF5) • Пентафторид сурьмы (SbF5) • Пентафторид урана (UF5) • Пентафторид фосфора (PF5) • Субфторид серебра (Ag2F) • Тетрафторалюминат калия (KAlF4) • Тетрафтороборат лития (LiBF4) • Тетрафтороборат меди(II) (Cu(BF4)2) • Тетрафтороборат натрия (NaBF4) • Тетрафтороборат нитрозила (BF4NO) • Тетрафтороборат нитрония (BNO2F4) • Тетрафтороборат серебра (AgBF4) • Тетрафторборная кислота (HBF4) • Тетрафторид дибора (B2F4) • Тетрафторид кремния (SiF4) • Тетрафторид селена (SeF4) • Тетрафторид теллура (TeF4) • Тетрафторгидразин (N2F4) • Трифторид алюминия (AlF3) • Трифторид бора (BF3) • Трифторид мышьяка (AsF3) • Трифторид висмута (BiF3) • Трифторид сурьмы (SbF3) • Трифторид тиазила (NSF3) • Трифторид фосфора (PF3) • Фторфосфат натрия (Na2PFO3) • Фторамин (NH2F) • Фторид азота(III) (NF3) • Фторид аммония (NH4F) • Фторид бария (BaF2) • Фторид бериллия (BeF2) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Фторид ванадия(III) (VF3) • Фторид ванадия(IV) (VF4) • Фторид ванадия(V) (VF5) • Фторид вольфрама(VI) (WF6) • Фторид галлия(III) (GaF3) • Фторид гафния(IV) (HfF4) • Фторид дейтерия (DF) • Фторид диртути(2+) (Hg2F2) • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Фторид золота(III) (AuF3) • Фторид золота(V) (AuF5) • Фторид индия(III) (InF3) • Фторид иода(I) (IF) • Фторид иода(III) (IF3) • Фторид иода(V) (IF5) • Фторид иода(VII) (IF7) • Фторид иридия(IV) (IrF4) • Фторид иридия(V) (IrF5) • Фторид иридия(VI) (IrF6) • Фторид иттербия(III) (YbF3) • Фторид иттрия (YF3) • Фторид иттрия-лития (LiYF4) • Фторид кадмия (CdF2) • Фторид калия (KF) • Фторид кальция (CaF2) • Фторид кислорода(II) (OF2) • Фторид кобальта(II) (CoF2) • Фторид кобальта(III) (CoF3) • Фторид криптона(II) (KrF2) • Фторид ксенона(II) (XeF2) • Фторид ксенона(IV) (XeF4) • Фторид ксенона(VI) (XeF6) • Фторид лития (LiF) • Фторид магния (MgF2) • Фторид марганца(II) (MnF2) • Фторид марганца(III) (MnF3) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Фторид молибдена(VI) (MoF6) • Фторид натрия (NaF) • Фторид никеля(II) (NiF2) • Фторид ниобия(V) (NbF5) • Фторид нитрозила) (NOF) • Фторид оксида азота(IV) (NO2F) • Фторид оксида серы(IV) (SO2F2) • Фторид олова(II) (SnF2) • Фторид олова(IV) (SnF4) • Фторид плутония(III) (PuF3) • Фторид плутония(IV) (PuF4) • Фторид плутония(VI) (PuF6) • Фторид радия (RaF2) • Фторид рения(IV) (ReF4) • Фторид рения(VI) (ReF6) • Фторид рения(VII) (ReF7) • Фторид ртути(II) (HgF2) • Фторид рубидия (RbF) • Фторид самария(III) (SmF3) • Фторид свинца(II) (PbF2) • Фторид серебра(I) (AgF) • Фторид серебра(II) (AgF2) • Фторид серы(IV) (SF4) • Фторид серы(VI) (SF6) • Фторид скандия(III) (ScF3) • Фторид стронция (SrF2) • Фторид таллия(I) (TlF) • Фторид тантала(V) (TaF5) • Фторид теллура(IV) (TeF4) • Фторид технеция(VI) (TcF6) • Фторид тиазила (NSF) • Фторид тианила (SOF2) • Фторид титана(III) (TiF3) • Фторид титана(IV) (TiF4) • Фторид тория(IV) (ThF4) • Фторид урана(III) (UF3) • Фторид урана(IV) (UF4) • Фторид урана(V) (UF5) • Фторид урана(VI) (UF6) • Фторид хлора(I) (ClF) • Фторид хлора(III) (ClF3) • Фторид хлора(V) (ClF5) • Фторид хрома(III) (CrF3) • Фторид хрома(IV) (CrF4) • Фторид хрома(V) (CrF5) • Фторид цезия (CsF) • Фторид цинка (ZnF2) • Фторид циркония(IV) (ZrF4) • Фторид-хлорид оксида серы(IV) (ClFO2S) • Фторноватистая кислота (HOF) • Фтороводород (HF) • Фторосульфоновая кислота (FSO3H) • Фторид хлорила (ClO2F) • Фторид перхлорила (ClO3F) • Фторид оксиперхлорила (ClO3OF) |
|
Растворимость кислот, оснований и солей в воде |
|---|
|
{| border=»0″ cellpadding=»0″ cellspacing=»1″ style=»background: transparent; table-layout: fixed; text-align: center; margin:0 auto;» |- | style=»width: 4%;» | | style=»width: 4%;» |H+ | style=»width: 4%;» |Li+ | style=»width: 4%;» |K+ | style=»width: 4%;» |Na+ | style=»width: 4%;» |NH4+ | style=»width: 4%;» |Ba2+ | style=»width: 4%;» |Ca2+ | style=»width: 4%;» |Mg2+ | style=»width: 4%;» |Sr2+ | style=»width: 4%;» |Al3+ | style=»width: 4%;» |Cr3+ | style=»width: 4%;» |Fe2+ | style=»width: 4%;» |Fe3+ | style=»width: 4%;» |Ni2+ | style=»width: 4%;» |Co2+ | style=»width: 4%;» |Mn2+ | style=»width: 4%;» |Zn2+ | style=»width: 4%;» |Ag+ | style=»width: 4%;» |Hg2+ | style=»width: 4%;» |Hg22+ | style=»width: 4%;» |Pb2+ | style=»width: 4%;» |Sn2+ | style=»width: 4%;» |Cu+ | style=»width: 4%;» |Cu2+ |- | OH− | | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н |- | style=»width: 4.5%;» |F− | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |- | style=»width: 4.5%;» |Cl− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |- | style=»width: 4.5%;» |Br− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |- | style=»width: 4.5%;» |I− | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |- | style=»width: 4.5%;» |S2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |- | style=»width: 4.5%;» |SO32− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |- | style=»width: 4.5%;» |SO42− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |- | style=»width: 4.5%;» |NO3− | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |- | style=»width: 4.5%;» |NO2− | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |- | style=»width: 4.5%;» |PO43− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |- | style=»width: 4.5%;» |CO32− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |- | style=»width: 6.5%;» |CH3COO− | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |- | style=»width: 4.5%;» |CN− | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |- | style=»width: 4.5%;» |SiO32− | H | Н | P | P | Силикат аммония| ? | Н | Н | Н | Н | Силикат алюминия(III)|? | Силикат хрома(III)|? | Н | Силикат железа(III)|? | Силикат никеля|? | Силикат кобальта(II)|? | Н | Н | Силикат серебра(I)|? | Силикат ртути(II)|? | ? | Н | Силикат олова(II)|? | Силикат меди(I)|? | Силикат меди(II)|? |} |
Фторид магния — Magnesium fluoride
 |
|
| Имена | |
|---|---|
| Другие имена
Селлайт |
|
| Идентификаторы | |
|
Количество CAS |
|
|
3D модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.086 |
| Номер ЕС |
|
|
PubChem CID |
|
| Номер RTECS |
|
| UNII |
|
|
Панель управления CompTox (EPA) |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Характеристики | |
|
Химическая формула |
MgF2 |
| Молярная масса | 62.3018 г / моль |
| Внешность | белый четырехугольный кристаллы |
| Плотность | 3.148 г / см3 |
| Температура плавления | 1263 ° С (2305 ° F, 1536 К) |
| Точка кипения | 2260 ° С (4100 ° F, 2530 К) |
|
Растворимость в воде |
0.013 г / 100 мл |
|
Продукт растворимости (Kзр) |
5.16⋅10−11 |
| Растворимость | Не растворим в этиловый спирт |
|
Магнитная восприимчивость (χ) |
−22.7⋅10−6 см3/ моль |
|
Показатель преломления (пD) |
1.37397 |
| Структура | |
|
Кристальная структура |
Рутил (тетрагональный), tP6 |
|
Космическая группа |
P42/ минм, № 136 |
| Термохимия | |
|
Теплоемкость (C) |
61.6 J⋅mol−1⋅K−1 |
|
Стандартный моляр |
57.2 J⋅mol−1⋅K−1 |
|
Станд. Энтальпия |
−1124.2 кДж⋅моль−1 |
|
Свободная энергия Гиббса (Δжграмм˚) |
−1071 кДж / моль |
| Опасности[2][3] | |
| Паспорт безопасности | Химическая книга |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
|
Формулировки опасности GHS |
H303, H315, H319, H335 |
|
Меры предосторожности GHS |
P261, P304 + 340, P305 + 351 + 338, P405 |
| NFPA 704 (огненный алмаз) |
0 3 0 |
| Смертельная доза или концентрация (LD, LC): | |
|
LD50 (средняя доза ) |
2330 (крыса, перорально) |
| Родственные соединения | |
|
Другой анионы |
Хлорид магния Бромид магния Йодид магния |
|
Другой катионы |
Фторид бериллия Фторид кальция Фторид стронция Фторид бария |
|
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Фторид магния является неорганическое соединение с формула MgF2. Состав представляет собой белый кристаллический соль и прозрачен в широком диапазоне длины волн, с коммерческим использованием в оптика которые также используются в космические телескопы. Встречается в природе как редкий минерал. селлаит.
Производство и структура
Магний фторид готовится из оксид магния с источниками фтороводород Такие как бифторид аммония:
- MgO + (NH4) ВЧ2 → MgF2 + NH3 + H2О
Связанный реакции метатезиса также возможны.
Соединение кристаллизуется как четырехугольный двулучепреломляющий кристаллы. Структура соединения аналогична таковой в рутил, с октаэдрическим Mg2+ центры и 3-х координатные фторид центры.[4]
Использует
Оптика
Фторид магния прозрачный в чрезвычайно широком диапазоне длины волн. Окна, линзы, и призмы изготовленные из этого материала, могут использоваться во всем диапазоне длин волн от 0,120 мкм (вакуум ультрафиолетовый ) до 8,0 мкм (инфракрасный ). Высококачественный синтетический VUV-класс MgF2 довольно дорого, в районе 3 долларов за кг (2007 г.), но реальная стоимость оптики из этого материала объясняется относительно небольшими объемами производства. Однако с фторид лития это один из двух материалов, которые будут пропускать в вакуумном ультрафиолетовом диапазоне 121 нм (альфа Лаймана), и именно здесь он находит свое применение. Низший сорт MgF2 иногда используется в инфракрасный но здесь он уступает фторид кальция. MgF2 жесткий, хорошо работает и полируется, но слегка двулучепреломляющий и должен быть разрезан оптическая ось перпендикулярно плоскости окна или линзы.[4]
Благодаря наличию подходящего показатель преломления 1,37, тонкие слои MgF2 очень часто используются на поверхностях оптических элементов как недорогие антибликовые покрытия.
В Постоянная Верде из (MgF2) при 632,8 нм составляет 0,00810 угл.мин / Гсм.[5]
Безопасность
Хроническое воздействие фторида магния может повлиять на скелет, почки, центральную нервную систему, дыхательную систему, глаза и кожу, а также может вызвать или усугубить приступы астмы.[6]
Рекомендации
- ^ Лиде, Дэвид Р. (1998), Справочник по химии и физике (87-е изд.), Бока-Ратон, Флорида: CRC Press, стр. 4–67, 1363, ISBN 0-8493-0594-2
- ^ «Паспорт безопасности материала фторида магния». Научные лаборатории. 21 мая, 2013. Получено 13 октября, 2017.
- ^ «Фторид магния». Список базы данных CAS. Химическая книга. Получено 13 октября, 2017.
- ^ а б Aigueperse, Жан; Моллард, Поль; Девилье, Дидье; Chemla, Marius; Фарон, Роберт; Романо, Рене; Куэр, Жан-Пьер (2000). «Соединения фтора неорганические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a11_307.
- ^ J. Chem. Soc., Faraday Trans., 1996, 92, 2753 — 2757. Дои:10.1039 / FT9969202753
- ^ «Паспорт безопасности материала фторида магния». ESPI Metals. Август 2004. Архивировано с оригинал на 2017-10-28. Получено 13 октября, 2017.
внешняя ссылка
- Java-апплет, показывающий эффект MgF2 на объектив
- Инфракрасные окна в Национальная лаборатория Лоуренса Беркли
- Национальный реестр загрязнителей — информационный бюллетень по фторидам и соединениям
- Данные Crystran Crystran MSDS[постоянная мертвая ссылка ]


![{mathsf {MgF_{2}+2 NaF {xrightarrow { }} Na_{2}[MgF_{4}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ef2ceae6a11c242b65cde5611d96fb795dedae6)














![mathsf{MgF_2 + 2 NaF xrightarrow{ } Na_2[MgF_4] }](https://dic.academic.ru/dic.nsf/ruwiki/78c79dd6d34516edefd9af73fcd7bb26.png)