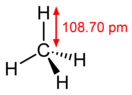Метан
- Метан
-
болотный, или рудничный, газ, CH4, первый член гомологического ряда насыщенных углеводородов; бесцветный газ без запаха; tkип — 164,5 °С; tпл — 182,5 °С; плотность по отношению к воздуху 0,554 (20 °С); горит почти бесцветным пламенем, теплота сгорания 50,08 Мдж/кг (11954 ккал/кг). М. — основной компонент природных (77—99% по объёму), попутных нефтяных (31—90%) и рудничного газов (34—40%); встречается в вулканических газах; непрерывно образуется при гниении органического веществ под действием метанобразующих бактерий (См. Метанобразующие бактерии) в условиях ограниченного доступа воздуха (болотный газ, газы полей орошения). главным образом из М. состоит атмосфера Сатурна и Юпитера. М. образуется при термической переработке нефти и нефтепродуктов (10—57% по объёму), коксовании и гидрировании каменного угля (24—34%). Лабораторные способы получения: сплавление ацетата натрия со щелочью, действие воды на метилмагнийиодид или на карбид алюминия.
С воздухом М. образует взрывоопасные смеси. Особую опасность представляет М., выделяющийся при подземной разработке месторождений полезных ископаемых в горные выработки, а также на угольных обогатительных и брикетных фабриках, на сортировочных установках. Так, при содержании в воздухе до 5—6% М. горит около источника тепла (температура воспламенения 650—750 °С), от 5—6% до 14—16% взрывается, свыше Метан 16% может гореть при притоке кислорода извне; снижение при этом концентрации М. может привести к взрыву. Кроме того, значительное увеличение концентрации М. в воздухе бывает причиной удушья (например, концентрации М. 43% соответствует 12% O2).
Взрывное горение распространяется со скоростью 500—700 м/сек; давление газа при взрыве в замкнутом объёме 1 Мн/м2.
После контакта с источником тепла воспламенение М. происходит с некоторым запаздыванием. На этом свойстве основано создание предохранительных взрывчатых веществ и взрывобезопасного электрооборудования. На объектах, опасных из-за присутствия М. (главным образом угольные шахты), вводится Газовый режим.
М. — наиболее термически устойчивый насыщенный углеводород. Его широко используют как бытовое и промышленное топливо и как сырьё для промышленности. Так, хлорированием М. производят Метилхлорид, Метиленхлорид, Хлороформ, Четырёххлористый углерод. При неполном сгорании М. получают сажу, при каталитическом окислении — Формальдегид, при взаимодействии с серой — Сероуглерод. Термоокислительный крекинг и электрокрекинг М. — важные промышленные методы получения Ацетилена. Каталитическое окисление смеси М. с аммиаком лежит в основе промышленного производства синильной кислоты (См. Синильная кислота). М. используют как источник водорода в производстве аммиака, а также для получения водяного газа (т. н. синтез-газа): CH4 + H2O → CO + 3H2, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др. Важное производное М. — Нитрометан.
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
Синонимы:
Полезное
Смотреть что такое «Метан» в других словарях:
-
Метан — Метан … Википедия
-
МЕТАН — (СН4), УГЛЕВОДОРОД без цвета и запаха, простейший АЛКАН (или парафин). Метан является основным компонентом ПРИРОДНОГО ГАЗА, из которого метан и получают, и РУДНИЧНОГО ГАЗА. Метан взрывается, когда его смешивают с кислородом и поджигают. Этот газ… … Научно-технический энциклопедический словарь
-
МЕТАН — Метиловый водород, болотный газ, состоящий из двух атомов углерода и четырех атомов водорода. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. МЕТАН метиловый водород,… … Словарь иностранных слов русского языка
-
Метан — газообразный углеводород СН4, первый член ряда метановых или парафиновых углеводородов (см Ряды углеводородов гомологические). tкип 161,6°С. Масса 1 л М. при 0°С и давлении 760 мм 0,7168 г. М. главная составная часть большинства природных… … Геологическая энциклопедия
-
метан — а, м. méthane m. англ. methane <гр. вино. Простейшее соединение водорода с углеродом; болотный или рудничный газ. БАС 1. Метановый ая, ое. Лекс. Брокг. метан; Уш. 1938: мета/н; БСЭ 2: мета/новое брожение … Исторический словарь галлицизмов русского языка
-
МЕТАН — CH4, бесцветный газ, tкип 164 .C. Основной компонент природных (77 99%), попутных нефтяных (31 90%), рудничного и болотного газов. Горит бесцветным пламенем. С воздухом образует взрывоопасные смеси. Сырье для получения многих ценных продуктов… … Большой Энциклопедический словарь
-
МЕТАН — МЕТАН, метана, мн. нет, муж. (от греч. methy мед) (хим.). То же, что болотный газ (см. болотный). Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
-
МЕТАН — МЕТАН, а, муж. Горючий болотный или рудничный газ без цвета и запаха, соединение углерода с водородом. | прил. метановый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
-
Метан — CH4, насыщенный углеводород парафинового ряда. В стандартных условиях М. газ без цвета к запаха, относится к пожаро и взрывоопасным веществам. Молекулярная масса 16,04 кг/кмоль, температура плавления 90,66 К, температура кипения 111,67 К,… … Энциклопедия техники
-
метан — сущ., кол во синонимов: 4 • алкан (37) • газ (55) • топливо (48) • … Словарь синонимов
-
МЕТАН — (СН4) простейший углеводород; газ без цвета и запаха; легче воздуха; смесь М. с воздухом взрывоопасна. Образуется в природе при разложении органических веществ без доступа воздуха (напр., на дне болот, в рудниках отсюда названия М.: болотный газ … Российская энциклопедия по охране труда
Значение слова «метан»

-
МЕТА́Н, -а, м. Бесцветный газ, представляющий собой соединение углерода с водородом.
[Франц. méthane]
Источник (печатная версия): Словарь русского языка: В 4-х
т. / РАН,
Ин-т лингвистич.
исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.;
Полиграфресурсы,
1999;
(электронная версия): Фундаментальная
электронная
библиотека
-
Мета́н (лат. Methanum) — простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека. Однако имеются данные, что метан относится к токсическим веществам, действующим на центральную нервную систему.
Накапливаясь в закрытом помещении, метан становится взрывоопасен. Обогащение одорантами делается для того, чтобы человек вовремя заметил утечку газа. На промышленных производствах эту роль выполняют датчики, и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Взрывоопасен при концентрации в воздухе от 4,4 % до 17 %. Наиболее взрывоопасная концентрация 9,5 %. Проявляет наркотические свойства; наркотическое действие ослабляется малой растворимостью в воде и крови. Класс опасности — четвёртый.
Метан — второй по значимости парниковый газ в атмосфере Земли (после углекислого газа).
Источник: Википедия
-
МЕТА’Н, а, мн. нет, м. [от греч. methy — мед] (хим.). То же, что болотный газ (см. болотный).
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940);
(электронная версия): Фундаментальная
электронная
библиотека
Делаем Карту слов лучше вместе
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: патронаж — это что-то нейтральное, положительное или отрицательное?
Ассоциации к слову «метан»
Синонимы к слову «метан»
Предложения со словом «метан»
- Применяется также способ промышленного производства ацетилена из природного газа метана.
- Не температура жидкого метана, конечно, но минус пятьдесят – наверняка.
- Или же антропоцен начался с зарождением сельского хозяйства и рисоводства, а вместе с ними – и экономики, построенной на выбросах больших количеств метана и диоксида углерода?
- (все предложения)
Каким бывает «метан»
Понятия со словом «метан»
-
Мета́н (лат. methanum), CH4 — простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно тиолы) со специфическим «запахом газа». Метан нетоксичен и неопасен для здоровья человека.
-
Гидрат метана — супрамолекулярное соединение метана с водой, устойчив при низких температурах и повышенных давлениях, наиболее широко распространённый в природе газовый гидрат.
-
Анаэробное окисление метана — процесс окисления метана до углекислого газа, производимый некультивируемыми (англ. VBNC) археями групп ANME-1, ANME-2 и ANME-3, близкими к Methanosarcinales при отсутствии в среде молекулярного кислорода. Биохимия и распространённость процесса в природе изучены пока недостаточно.
- (все понятия)
Отправить комментарий
Дополнительно
Смотрите также
-
Применяется также способ промышленного производства ацетилена из природного газа метана.
-
Не температура жидкого метана, конечно, но минус пятьдесят – наверняка.
-
Или же антропоцен начался с зарождением сельского хозяйства и рисоводства, а вместе с ними – и экономики, построенной на выбросах больших количеств метана и диоксида углерода?
- (все предложения)
- газ
- озон
- акселератор
- гидразин
- закись
- (ещё синонимы…)
- углерод
- газ
- азот
- водород
- шахтёр
- (ещё ассоциации…)
- взрыв метана
- гидрат метана
- состоять из метана
- выделять метан
- (полная таблица сочетаемости…)
- жидкий
- (ещё…)
- Склонение
существительного «метан» - Разбор по составу слова «метан»
- Как правильно пишется слово «метан»
| Метан | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
метан | |
| Традиционные названия | метан, рудничный газ | |
| Рац. формула | CH4 | |
| Физические свойства | ||
| Молярная масса | 16,04 г/моль | |
| Плотность |
газ (0 °C) 0,714 (нормальные условия) кг/м³[1] (25 °C) 0,7168 кг/м³; 0,6682 кг/м³ в стандартных условиях по ГОСТ 2939—63; |
|
| Термические свойства | ||
| Температура | ||
| • плавления | −182,49 °C | |
| • кипения | −161,58 °C | |
| • разложения | выше +1000°C | |
| • вспышки | 85,1 K, −188 °C | |
| • самовоспламенения | +537,8 °C | |
| Пределы взрываемости | 4,4—17,0 % | |
| Критическая точка | ||
| • температура | 190,56 K, −82,6 °C | |
| Энтальпия | ||
| • сгорания |
35,9 МДж/м³ 50,2 МДж/кг[1] 803,2 кДж/моль |
|
| Удельная теплота испарения | 460,6 Дж/моль (при 760 мм. рт. ст.)[3] | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 0,02 г/кг[4] | |
| Классификация | ||
| Рег. номер CAS | 74-82-8 | |
| SMILES |
C |
|
| Безопасность | ||
| Предельная концентрация | 7000 мг/м³ | |
| ЛД50 | 13450-36780 мг/кг | |
| Токсичность | Класс опасности по ГОСТ 12.1.007: 4-й | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
4 0 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
У этого термина существуют и другие значения, см. Метан (значения).
Мета́н (лат. methanum; болотный газ), CH4 — простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха.
Малорастворим в воде, почти в два раза легче воздуха.
Метан нетоксичен, но при высокой концентрации в воздухе обладает слабым наркотическим действием (ПДК 7000 мг/м3)[5]. Имеются данные, что метан при хроническом воздействии малых концентраций в воздухе неблагоприятно влияет на центральную нервную систему[6]. Наркотическое действие метана CH4 ослабляется его малой растворимостью в воде и крови и химической инертностью. Класс токсичности — четвёртый[7].
При использовании в быту в метан (природный газ) обычно добавляют одоранты (обычно тиолы) — летучие вещества со специфическим «запахом газа», чтобы человек вовремя заметил аварийную утечку газа по запаху. На промышленных производствах утечки фиксируют датчики и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Накапливаясь в закрытом помещении в смеси с воздухом метан становится взрывоопасен при концентрации его от 4,4 % до 17 %[8]. Наиболее взрывоопасная концентрация в смеси с воздухом 9,5 об.%. В угольных шахтах он выделяется из угольных пластов, что иногда приводит к взрывам, последствия которых могут быть катастрофическими.
Метан — третий по значимости парниковый газ в атмосфере Земли (после водяного пара и углекислого газа, его вклад в парниковый эффект оценивается 4—9 %)[9][10].
История
В ноябре 1776 года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение болотного газа его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. Также он продемонстрировал зажигание газа от электрической искры.
Сэр Гемфри Дэви в 1813 году изучал рудничный газ и показал, что он является смесью метана с небольшими количествами азота N2 и углекислого газа CO2 — то есть, что он качественно тождествен по составу болотному газу.
Современное название «метан» в 1866 году газу дал немецкий химик Август Вильгельм фон Гофман[11][12], оно образовано от слова «метанол».
Нахождение в природе
Основной компонент природного газа (77—99 %), попутных нефтяных газов (31—90 %), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
Большие запасы метана сосредоточены в метаногидратах на дне морей и в зоне вечной мерзлоты[9][10].
Метан также был обнаружен на других планетах, включая Марс, что имеет значение для исследований в области астробиологии[13]. По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан[14].
Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[15]. Велика доля метановых льдов и на поверхности Седны[источник не указан 686 дней].
В промышленности
Образуется при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению
- абиогенный — образован в результате химических реакций неорганических соединений, например, при взаимодействии карбидов металлов с водой;
- биогенный — образован как результат химических превращений органических веществ;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий (микроорганизмов);
- термогенный — образован в ходе термохимических процессов.
Получение
Возможно получение метана за счет реакции Сабатье, за счет взаимодействия углекислого газа и водорода в присутствии катализатора при повышенной температуре и давлении:
- [math]displaystyle{ mathsf{CO_2 + 4H_2 rightarrow CH_4 + 2H_2O} }[/math]
- ∆H = −165.0 кДж/моль
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и гидроксида кальция) или безводного гидроксида натрия с ледяной уксусной кислотой:
- [math]ce{ 2 NaOH + CH3COOH -> Na2CO3 + H2O + CH4 ^ }[/math].
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[16]:
- [math]ce{ CH3COONa + NaOH -> CH4 ^ + Na2CO3 }[/math].
Также для лабораторного получения метана используют гидролиз карбида алюминия:
- [math]ce{ Al4C3 + 12 H2O -> 4 Al(OH)3 + 3CH4 ^ }[/math],
или некоторых металлорганических соединений (например, метилмагнийбромида).
Возможно биологическое получение метана, см. Биогаз.
Физические свойства
Треугольник взрываемости тройной смеси метан-кислород-азот. Синяя прямая соответствует смесям метана с воздухом, красная линия отвечает стехиометрическому составу.
ВПВ — верхний предел взрываемости;
НПВ — нижний предел взрываемости;
ПК — пороговая концентрация взрываемости.
При комнатной температуре и стандартном давлении метан — бесцветный газ без запаха[17]. Знакомый запах бытового природного газа достигается специальным добавлением в газ смеси одорантов, содержащей трет-бутилтиол, в качестве меры безопасности для обнаружения аварийных утечек метана по запаху.
Метан имеет температуру кипения −164 °C при давлении в одну атмосферу[18].
Легко воспламеняется при объёмных концентрациях в воздухе от 4,4 до 17 % об. % при стандартном давлении. Пределы взрываемости (воспламенения) в смесях метана с кислородом при атмосферном давлении от 4,5 до 61 oб. %.
Твёрдый метан при очень высоких давлениях существует в нескольких модификациях. Известно девять таких модификаций[19].
Химические свойства
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения — галогенирования, сульфохлорирования, сульфоокисления, нитрования и других, но обладает меньшей реакционной способностью по сравнению с другими алканами.
Для метана специфична реакция с парами воды — реакция парового риформинга, для которой в промышленности в качестве катализатора применяется никель, нанесённый на оксиде алюминия (Ni/Al2O3) при 800—900 °C или без применения катализатора при 1400—1600 °C. Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов, это основной экономичный способ производства водорода:
- [math]ce{ CH4 + H2O -> CO + 3H2 }[/math].
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³ метана, взятого при нормальных условиях. Реакция горения метана в кислороде или воздухе:
- [math]ce{ CH4 + 2 O2 -> CO2 + 2 H2O }[/math] + 891 кДж.
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму (реакция металепсии)? например, реакции последовательного хлорирования до четырёххлористого углерода:
- [math]ce{ CH4 + Cl2 -> CH3Cl + HCl }[/math],
- [math]ce{ CH3Cl + Cl2 -> CH2Cl2 + HCl }[/math],
- [math]ce{ CH2Cl2 + Cl2 -> CHCl3 + HCl }[/math],
- [math]ce{ CHCl3 + Cl2 -> CCl4 + HCl }[/math].
Выше 1400 °C разлагается по реакции:
- [math]ce{ 2 CH4 -> C2H2 + 3 H2 }[/math].
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
- [math]ce{ CH4 + 3[O] -> HCOOH + H2O }[/math].
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространённые в природе.
Применение
Метан используется в качестве топлива для печей, водонагревателей, автомобилей[20][21], турбин и др. Для хранения метана может использоваться активированный уголь.
Как основной компонент природного газа метан используется для производства электроэнергии при сжигании его в газовых турбинах или парогенераторах. По сравнению с другими видами углеводородного топлива метан производит меньше углекислого газа на единицу выделенного тепла. Теплота сгорания метана около 891 кДж/моль и ниже, чем у любого другого углеводорода. Тем не менее, он производит больше тепла на единицу массы (55,7 кДж/г), чем любое другое органическое вещество из-за относительно большого содержания водорода, что вносит вклад водорода около 55 % в теплоту сгорания[22], но составляет только 25 % молекулярной массы метана.
Во многих городах метан подаётся в дома для отопления и приготовления пищи. При этом его обычно называют природным газом, содержание энергии в котором составляет 39 мДж/м3. Сжиженный природный газ (СПГ) представляет собой преимущественно метан (CH4), сжижаемый для удобства хранения и/или транспортировки.
Жидкий метан, в сочетании с жидким кислородом, рассматривается в качестве перспективного ракетного топлива[23][24] и используется в таких двигателях, как РД-0162, BE-4[25] и Raptor. Метан имеет преимущества перед керосином в том, что он:
- даёт бо́льший удельный импульс[26];
- оставляет меньше продуктов сгорания на внутренних частях ракетных двигателей[25];
- позволяет легче освободить полости двигателя от остатков топлива[27].
Это уменьшает сложность повторного использования ракет[25][28].
Метан используется в качестве сырья в органическом синтезе, в том числе для производства метанола.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе с высокой концентрацией метана можно только от недостатка кислорода в воздухе. Так, при содержании в воздухе 25—30 % метана появляются первые признаки удушья (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому случаи гибели людей от удушья при вдыхании смеси метана с воздухом весьма редки.
Первая помощь при тяжёлом удушье: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазосердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за очень слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
ПДК метана в воздухе рабочей зоны составляет 7000 мг/м³[5].
Биологическая роль
Показано, что эндогенный метан способен вырабатываться не только метаногенной микрофлорой кишечника, но и клетками эукариот, и что его образование значительно возрастает при экспериментальном вызывании клеточной гипоксии, например, при нарушении работы митохондрий при помощи отравления организма экспериментального животного азидом натрия, известным митохондриальным ядом. Высказывается предположение, что образование метана клетками эукариот, в частности животных, может быть внутриклеточным или межклеточным сигналом испытываемой клетками гипоксии[29].
Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс)[30]. Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов.
Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры[31].
Метан и экология
Спектр поглощения метана в ближней и средней ИК-областях. По вертикальной оси отложено сечение поглощения на 1 молекулу[32].
Является парниковым газом, более сильным в этом отношении, чем углекислый газ, из-за наличия глубоких колебательно-вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит 21—25 единиц[33][34]. Однако время жизни метана в атмосфере невелико (от нескольких месяцев до нескольких лет), поскольку он окисляется кислородом до углекислого газа в тропосфере под действием грозовых разрядов и в стратосфере под действием УФ-С излучения Солнца.
С 1750 года концентрация метана в атмосфере Земли увеличилась примерно на 150 %, и на её долю приходится 20 % от общего радиационного воздействия всех долгоживущих и глобально смешанных парниковых газов[35].
Примечания
- ↑ 1,0 1,1 Теплота сгорания метана, бутана и пропана. Авторский блог Алексея Зайцева. Дата обращения: 7 октября 2022.
- ↑ Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — С. 780—781. — 1168 с.
- ↑ Физико-химические свойства индивидуальных углеводородов. Справочник. / Под ред. М. Д. Таличева. — Выпуск 4-й. — М.—Л.: Государственное научно-техническое издательство нефтяной и горно-топливной литературы, 1953.
- ↑ Обзор: Растворимость некоторых газов в воде. Дата обращения: 6 июля 2011. Архивировано 11 ноября 2011 года.
- ↑ 5,0 5,1 Гигиенические нормативы ГН 2.2.5.1313-03 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны»
- ↑ Куценко С. А. Основы токсикологии / С. А. Куценко. — СПб.: Фолиант, 2004.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (Утв. главным государственным санитарным врачом РФ 30.03.2003) (недоступная ссылка)
- ↑ ГОСТ Р 52136-2003. Дата обращения: 8 февраля 2012. Архивировано 18 мая 2015 года.
- ↑ 9,0 9,1 Наталья Ржевская Тепло мерзлоты Архивная копия от 1 февраля 2017 на Wayback Machine // В мире науки. — 2016. — № 12. — С. 67—73.
- ↑ 10,0 10,1 Леонид Юрганов. Метан над Арктикой // Наука и жизнь. — 2017. — № 11. — С. 24.
- ↑ A. W. Hofmann (1866) «On the action of trichloride of phosphorus on the salts of the aromatic monoamines, » Архивная копия от 3 мая 2017 на Wayback Machine Proceedings of the Royal Society of London, 15 : 55—62; see footnote on pp. 57—58.
- ↑ James Michael McBride (1999) «Development of systematic names for the simple alkanes». Available online at Chemistry Department, Yale University (New Haven, Connecticut). Архивная копия от 16 марта 2012 на Wayback Machine
- ↑ Etiope, Giuseppe; Lollar, Barbara Sherwood. Abiotic Methane on Earth (англ.) // Reviews of Geophysics (англ.) (рус. : journal. — 2013. — Vol. 51, no. 2. — P. 276—299. — ISSN 1944-9208. — doi:10.1002/rog.20011. — Bibcode: 2013RvGeo..51..276E.
- ↑ Atreya, S. K.; Mahaffy, P. R.; Niemann, H. B. et al. Composition and origin of the atmosphere of Jupiter—an update, and implications for the extrasolar giant planets (англ.) // Planetary and Space Sciences : journal. — 2003. — Vol. 51. — P. 105—112. — doi:10.1016/S0032-0633(02)00144-7.
- ↑ Tidal effects of disconnected hydrocarbon seas on Titan. Дата обращения: 23 мая 2013. Архивировано 13 ноября 2012 года.
- ↑ Павлов Б. А., Терентьев А. П. Курс органической химии. — Издание шестое, стереотипное. — M.: Химия, 1967. — С. 58.
- ↑ Hensher David A.; Button Kenneth J. Handbook of transport and the environment (англ.). — Emerald Group Publishing (англ.) (рус., 2003. — P. 168. — ISBN 978-0-08-044103-0.
- ↑ Methane Phase change data Архивная копия от 15 апреля 2016 на Wayback Machine // NIST Chemistry Webbook.
- ↑ Bini, R.; Pratesi, G. High-pressure infrared study of solid methane: Phase diagram up to 30 GPa (англ.) // Physical Review B : journal. — 1997. — Vol. 55, no. 22. — P. 14800—14809. — doi:10.1103/physrevb.55.14800. — Bibcode: 1997PhRvB..5514800B.
- ↑ Lumber Company Locates Kilns at Landfill to Use Methane – Energy Manager Today (англ.). Energy Manager Today. Дата обращения: 11 марта 2016. Архивировано 9 июля 2019 года.
- ↑
Cornell, Clayton B.. Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country (англ.) (29 April 2008). Архивировано 20 января 2019 года. «Compressed natural gas is touted as the ‘cleanest burning’ alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline». - ↑
Schmidt-Rohr, Klaus. Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2 (англ.) // Journal of Chemical Education (англ.) (рус. : journal. — 2015. — Vol. 92, no. 12. — P. 2094—2099. — doi:10.1021/acs.jchemed.5b00333. — Bibcode: 2015JChEd..92.2094S. - ↑
Thunnissen, Daniel P.; Guernsey, C. S.; Baker, R. S.; Miyake, R. N. Advanced Space Storable Propellants for Outer Planet Exploration (англ.) // Американский институт аэронавтики и астронавтики[en] : journal. — 2004. — No. 4—0799. — P. 28. - ↑ Чеберко, Иван В России предлагают создать «метановую ракету». Известия (16 мая 2014). Дата обращения: 18 июля 2020. Архивировано 19 июля 2020 года.
- ↑ 25,0 25,1 25,2 Blue Origin BE-4 Engine (англ.). — «We chose LNG because it is highly efficient, low cost and widely available. Unlike kerosene, LNG can be used to self-pressurize its tank. Known as autogenous repressurization, this eliminates the need for costly and complex systems that draw on Earth’s scarce helium reserves. LNG also possesses clean combustion characteristics even at low throttle, simplifying engine reuse compared to kerosene fuels.». Дата обращения: 14 июня 2019. Архивировано 1 октября 2021 года.
- ↑ Известия, 2014: «Удельный импульс у двигателя на СПГ высокий».
- ↑ Известия, 2014: «Чтобы освободить полости двигателя, нужно только пройти цикл испарения — то есть двигатель легче освобождается от остатков продуктов.».
- ↑ Известия, 2014: «За счет этого метановое топливо более приемлемо с точки зрения создания двигателя многоразового использования и летательного аппарата многоразового применения.».
- ↑ Tuboly E. et al. Methane biogenesis during sodium azide-induced chemical hypoxia in rats (англ.) // American Physiological Society (англ.) (рус.. — 15 January 2013. — Vol. 304, no. 2. — P. 207—214. — doi:10.1152/ajpcell.00300.2012. — PMID 23174561.
- ↑ Tuboly E, Szabó A, Erős G, Mohácsi A, Szabó G, Tengölics R, Rákhely G, Boros M. Determination of endogenous methane formation by photoacoustic spectroscopy // J Breath Res.. — Dec 2013. — Т. 7, вып. 7(4), № 4. — doi:10.1088/1752-7155/7/4/046004. — PMID 24185326.
- ↑ Sahakian AB, Jee SR, Pimentel M. Methane and the gastrointestinal tract // Dig Dis Sci. — Aug 2010. — Т. 55, вып. 55(8), № 8. — С. 2135—2143. — doi:10.1007/s10620-009-1012-0. — PMID 19830557.
- ↑ Вовна А. В., Хламов М. Г. Применение оптико-абсорбционного метода для измерения объёмной концентрации метана в условиях угольных шахт.. Дата обращения: 17 апреля 2020. Архивировано 30 января 2020 года.
- ↑ EBRD Methodology for Assessment of Greenhouse Gas Emissions, Version 7, 6 July 2010 Архивная копия от 13 мая 2015 на Wayback Machine (англ.)
- ↑ Non-CO2 Greenhouse Gases: Scientific Understanding, Control and Implementation (ed. J. van Ham, Springer 2000, ISBN 978-0-7923-6199-2): 4. Impact of methane on climate, page 30 «On a molar basis, an additional mole of methane in the current atmosphere is about 24 times more effective at absorbing infrared radiation and affecting climate than an additional mole of carbon dioxide (WMO, 1999)»
- ↑ Technical summary. Climate Change 2001. United Nations Environment Programme. Архивировано 4 июня 2011 года.
Литература
- Львов М. Д. Болотный газ или метан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
- Метан
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
CH4 + HNO3 = CH3NO2 + H2O
2. Реакции разложения метана (дегидрирование, пиролиз)
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
3. Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
Получение метана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
метан
Метан
Мета́н, — простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха. Малорастворим в воде, легче воздуха.
метан
м.Бесцветный газ, представляющий собою соединение углерода с водородом; болотный или рудничный газ.
метан
( фр. methane ( гр. ) болотный, или рудничный, газ — простейшее органическое соединение, насыщенный углеводород алифатического ряда, газ без цвета и запаха, основной компонент природного газа; образуется при гниении органических веществ без доступа воздуха, напр, на дне болот и в рудниках; с воздухом образует взрывоопасные смеси; используется как топливо, а также для синтеза различных органических соединений.
метан
м. Бесцветный газ, представляющий собою соединение углерода с водородом; болотный или рудничный газ.
метан
[фр. methaneболотный, или рудничный, газ — простейшее органическое соединение, насыщенный углеводород алифатического ряда, газ без цвета и запаха, основной компонент природного газа; образуется при гниении органических веществ без доступа воздуха, напр, на дне болот и в рудниках; с воздухом образует взрывоопасные смеси; используется как топливо, а также для синтеза различных органических соединений.
метан
мет`ан, -а
метан
горючий болотный или рудничный газ без цвета и запаха, соединение углерода с водородом
метан
CH4, бесцветный газ, tкип 164 °C. Основной компонент природных (77-99%), попутных нефтяных (31-90%), рудничного и болотного газов. Горит бесцветным пламенем. С воздухом образует взрывоопасные смеси. Сырье для получения многих ценных продуктов химической промышленности — формальдегида, ацетилена, сероуглерода, хлороформа, синильной кислоты, сажи. Применяется как топливо.
метан
метан м. Бесцветный газ, представляющий собою соединение углерода с водородом; болотный или рудничный газ.
метан
метана, мн. нет, м. (от греч. methy – мед) (хим.). То же, что болотный газ (см. болотный).
метан
болотный, или рудничный, газ, CH4, первый член гомологического ряда насыщенных углеводородов; бесцветный газ без запаха; tkип — 164,5 |С; tпл — 182,5 |С; плотность по отношению к воздуху 0,554 (20 |С); горит почти бесцветным пламенем, теплота сгорания 50,08 Мдж/кг (11954 ккал/кг ) . М. — основной компонент природных (77-99% по объёму), попутных нефтяных (31-90%) и рудничного газов (34-40%); встречается в вулканических газах; непрерывно образуется при гниении органического веществ под действием метанобразующих бактерий в условиях ограниченного доступа воздуха (болотный газ, газы полей орошения). главным образом из М. состоит атмосфера Сатурна и Юпитера. М. образуется при термической переработке нефти и нефтепродуктов (10-57% по объёму), коксовании и гидрировании каменного угля (24-34%). Лабораторные способы получения: сплавление ацетата натрия со щелочью, действие воды на метилмагнийиодид или на карбид алюминия. С воздухом М. образует взрывоопасные смеси. Особую опасность представляет М., выделяющийся при подземной разработке месторождений полезных ископаемых в горные выработки, а также на угольных обогатительных и брикетных фабриках, на сортировочных установках. Так, при содержании в воздухе до 5-6% М. горит около источника тепла (температура воспламенения 650-750 |С), от 5-6% до 14-16% взрывается, свыше ~ 16% может гореть при притоке кислорода извне; снижение при этом концентрации М. может привести к взрыву. Кроме того, значительное увеличение концентрации М. в воздухе бывает причиной удушья (например, концентрации М. 43% соответствует 12% O
2). Взрывное горение распространяется со скоростью 500-700 м/сек; давление газа при взрыве в замкнутом объёме 1 Мн/м2.После контакта с источником тепла воспламенение М. происходит с некоторым запаздыванием. На этом свойстве основано создание предохранительных взрывчатых веществ и взрывобезопасного электрооборудования. На объектах, опасных из-за присутствия М. (главным образом угольные шахты), вводится газовый режим .М. — наиболее термически устойчивый насыщенный углеводород. Его широко используют как бытовое и промышленное топливо и как сырьё для промышленности. Так, хлорированием М. производят метилхлорид , метиленхлорид , хлороформ , четырёххлористый углерод . При неполном сгорании М. получают сажу, при каталитическом окислении — формальдегид , при взаимодействии с серой — сероуглерод . Термоокислительный крекинг и электрокрекинг М. — важные промышленные методы получения ацетилена . Каталитическое окисление смеси М. с аммиаком лежит в основе промышленного производства синильной кислоты . М. используют как источник водорода в производстве аммиака, а также для получения водяного газа (т. н. синтез-газа): CH4 + H2O — CO + 3H2, применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и др. Важное производное М. — нитрометан .
метан
метан, -а
метан
намет
метан
простейший предельный углеводород, CH4, горючий бесцветный газ
Например, русло, по которому течет метан, заменено было в переводе словом «река», а сам метан – термином «вода», ибо на планете Тегла, где разыгрывались события, описанные в расшифрованном тексте, роль воды, по-видимому, выполнял метан.
Следует добыть кислород из углекислоты, с его помощью сжечь метан, из образовавшейся окиси вновь выделить кислород и снова сжечь метан — и так далее до самого конца, постепенно включая в процесс живых пожирателей углекислого газа водоросли хлореллы.
До того метан просто горит себе, если зажечь (в былые времена метан факелами открытого огня выжигали).
Из их глубин вырывается метан, который уже превратил колоссальные территории в инопланетные ландшафты: метановые реки в серных берегах.
В каждый забой, причём практически каждую шестичасовую смену, спускались с газоанализаторами специальные люди, бравшие пробы на метан и пыль (повторяю: угольная пыль особо взрывоопасна, она детонирует при выбросе метана и многократно усиливает аварию).
Далее в камере была создана атмосфера из смеси водорода и двуокиси углерода, в которой микроорганизмы, выделяющие метан (метаногены), должны были бы прекрасно себя чувствовать.
В кишечнике живут представители царства археи – одноклеточные организмы, не имеющие ядер; самые распространенные из них – метаногены, которые существуют без кислорода, помогают переваривать пищу и выделяют газ метан (у коров они тоже есть).
насыщенный углеводород с формулой CH4
 |
||
|
||
| Имена | ||
|---|---|---|
| Предпочтительное название IUPAC Метан | ||
| Систематический IUPAC имя Карбан (не рекомендуется) | ||
Другие названия
|
||
| Идентификаторы | ||
| Номер CAS |
|
|
| 3D-модель (JSmol ) |
|
|
| 3DMet |
|
|
| Ссылка Beilstein | 1718732 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.739 |
|
| Номер ЕС |
|
|
| Справочник Gmelin | 59 | |
| KEGG |
|
|
| MeSH | Метан | |
| PubChem CID |
|
|
| номер RTECS |
|
|
| UNII |
|
|
| Номер ООН | 1971 | |
| Панель управления CompTox (EPA ) |
|
|
InChI
|
||
УЛЫБКИ
|
||
| Свойства | ||
| Химическая формула | CH4 | |
| Молярная масса | 16,043 г · моль | |
| Внешний вид | Бесцветный газ | |
| Запах | Без запаха | |
| Плотность |
|
|
| Температура плавления | -182,5 ° C; -296,4 ° F; 90,7 K | |
| Температура кипения | −161,50 ° C; -258,70 ° F; 111,65 K | |
| Критическая точка (T, P) | 190,56 K, 4,5992 МПа | |
| Растворимость в воде | 22,7 мг · л | |
| Растворимость | Растворим в этанол, диэтиловый эфир, бензол, толуол, метанол, ацетон и нерастворимые в воде | |
| log P | 1,09 | |
| Закон Генри. константа (kH) | 14 нмоль · Па · кг | |
| Конъюгированная кислота | Метан | |
| Основание конъюгата | Метиланион | |
| Магнитный восприимчивость (χ) | -12,2 × 10 см · моль | |
| Структура | ||
| Точечная группа | Td | |
| Молекулярная форма | Тетраэдр | |
| Дипольный момент | 0 D | |
| Термохимия | ||
| Теплоемкость (C) | 35,69 Дж · (K · моль) | |
| Стандартная молярная. энтропия (S 298) | 186,25 Дж · (K · моль) | |
| Стандартная энтальпия образования. (ΔfH298) | -74,87 кДж · моль | |
| Стандартная энтальпия. горения (ΔcH298) | от -891,1 до -890,3 кДж · моль | |
| Опасности | ||
| Паспорт безопасности | См.: страница данных | |
| Пиктограммы GHS |  |
|
| Сигнальное слово GHS | Опасно | |
| Формулировки опасности GHS | H220 | |
| Меры предосторожности GHS | P210 | |
| NFPA 704 (огненный алмаз) |  4 2 0 SA 4 2 0 SA |
|
| Температура вспышки | −188 ° C (−306,4 ° F; 85,1 K) | |
| Самовоспламенение. Температура | 537 ° C (999 ° F; 810 K) | |
| Пределы взрываемости | 4,4–17% | |
| Родственные алканы |
|
|
| Страница дополнительных данных | ||
| Структура и. свойства | Показатель преломления (n),. Диэлектрическая проницаемость (εr), и т. д. | |
| Термодинамические. данные | Фазовое поведение. твердое тело – жидкость – газ | |
| Спектральные данные | UV, IR, ЯМР, MS | |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | ||
| Ссылки на информационное окно | ||
Метан (US : или UK : ) — химическое соединение с химической формулой CH4(один атом углерода и четыре атома водорода ). Это гидрид группы 14 и простейший алкан, и он является основным компонентом природного газа. Относительное содержание метана на Земле делает его экономически привлекательным топливом, хотя его улавливание и хранение создает технические проблемы из-за его газообразного состояния при нормальном условия для температуры и давления.
Природный метан находится как под землей, так и под морским дном, и образуется в результате как геологических, так и биологических процессов. Самый большой резервуар метана находится под морским дном в виде клатратов метана. Когда метан достигает поверхности и атмосферы, он известен как атмосферный метан. Концентрация метана в атмосфере Земли увеличилась примерно на 150% с 1750 года, и на нее приходится 20% от общего радиационного воздействия от всех долгоживущих и глобально смешанных парниковые газы. Метан также был обнаружен на других планетах, включая Марс, что имеет значение для астробиологических исследований.
Содержание
- 1 Свойства и связи
- 2 Химические реакции
- 2.1 Селективное окисление
- 2.2 Кислотно-основные реакции
- 2.3 Горение
- 2.4 Метановые радикальные реакции
- 3 Использование
- 3.1 Топливо
- 3.2 Химическое сырье
- 4 Поколение
- 4.1 Геологические маршруты
- 4.2 Биологические маршруты
- 4.2.1 Жвачные животные
- 4.2.2 Отложения на морском дне
- 4.3 Промышленные маршруты
- 4.3.1 Лабораторный синтез
- 5 Возникновение
- 5.1 Атмосферный метан
- 5.2 Клатраты
- 5.3 Внеземной метан
- 5.3.1 Межзвездная среда
- 5.3.2 Марс
- 6 История
- 7 Этимология
- 7.1 Аббревиатуры
- 8 Безопасность
- 9 См. Также
- 10 Примечания
- 11 Источники
- 12 Внешние ссылки
Свойства и связывание
Метан — это тетраэдрическая молекула с четырьмя эквивалентными связями C – H. Его электронная структура описывается четырьмя связывающими молекулярными орбиталями (МО), возникающими в результате перекрытия валентных орбиталей на C и H. MO с наименьшей энергией является результатом перекрытия 2s-орбиталей на углероде с синфазной комбинацией 1s-орбиталей на четырех атомах водорода. Выше этого энергетического уровня находится тройной вырожденный набор МО, который включает перекрытие 2p-орбиталей на углероде с различными линейными комбинациями 1s-орбиталей на водороде. Полученная схема соединения «три на один» согласуется с измерениями фотоэлектронной спектроскопии.
При комнатной температуре и стандартном давлении метан представляет собой бесцветный газ без запаха. Знакомый запах природного газа, который используется в домах, достигается добавлением одоранта, обычно смесей, содержащих трет-бутилтиол, в качестве меры безопасности. Метан имеет точку кипения -164 ° C (-257,8 ° F ) при давлении в одну атмосферу. Как газ он горюч в диапазоне концентраций (5,4–17%) в воздухе при стандартном давлении.
Твердый метан существует в нескольких модификациях. В настоящее время известно девять. Охлаждение метана при нормальном давлении приводит к образованию метана I. Это вещество кристаллизуется в кубической системе (пространственная группа Fm3m). Положение атомов водорода в метане I не фиксировано, т.е. молекулы метана могут свободно вращаться. Следовательно, это пластиковый кристалл.
Химические реакции
Основные химические реакции метана: горение, паровой риформинг в синтез-газ и галогенирование. В общем, реакции с метаном трудно контролировать.
Селективное окисление
Частичное окисление метана до метанола является сложной задачей, потому что реакция обычно протекает полностью до двуокиси углерода и вода даже при недостаточной подаче кислорода. фермент метанмонооксигеназа производит метанол из метана, но не может использоваться для реакций в промышленном масштабе. Были разработаны некоторые системы с гомогенным катализом и гетерогенные системы, но все они имеют существенные недостатки. Обычно они работают, производя защищенные продукты, которые защищены от чрезмерного окисления. Примеры включают систему Catalytica, медные цеолиты и железные цеолиты, стабилизирующие альфа-кислород активный центр.
Одна группа бактерии запускают окисление метана с помощью нитрита в качестве окислителя в отсутствие кислорода, вызывая так называемое анаэробное окисление метана..
Кислотно-основные реакции
Как и другие углеводороды, метан является очень слабой кислотой. Его pKa в ДМСО оценивается в 56. Его нельзя депротонировать в растворе, но конъюгат основания известен в таких формах, как метиллитий.
Было обнаружено множество положительных ионов, полученных из метана, в основном как нестабильные частицы в газовых смесях низкого давления. К ним относятся метений или метил-катион CH. 3, метановый катион CH. 4и метан или протонированный метан CH. 5. Некоторые из них были обнаружены в космическом пространстве. Метан также может быть получен в виде разбавленных растворов из метана с суперкислотами. Катионы с более высоким зарядом, такие как CH. 6и CH. 7, были теоретически изучены и предположительно являются стабильными.
Несмотря на прочность связей C – H, они имеют Большой интерес вызывают катализаторы, которые облегчают активацию связи C – H в метане (и других алканах с меньшими номерами ).
Горение

Теплота сгорания метана составляет 55,5 МДж / кг. Горение метана представляет собой многостадийную реакцию, резюмируемую следующим образом:
- CH4+ 2 O 2 → CO 2 + 2 H 2 O (ΔH = -891 k J /моль, при стандартных условиях)
Четырехступенчатая химия Петерса — это систематически сокращенный четырехступенчатый химический процесс, который объясняет горение метана.
Реакции метановых радикалов
При соответствующих условиях метан реагирует с галогеновыми радикалами следующим образом:
- X • + CH 4 → HX + CH 3•
- CH3• + X 2 → CH 3 X + X •
где X — га logen : фтор (F), хлор (Cl), бром (Br) или йод (I). Этот механизм этого процесса называется свободнорадикальным галогенированием. Он инициируется, когда УФ-свет или какой-либо другой радикальный инициатор (например, пероксиды ) образует атом галогена . Возникает двухстадийная цепная реакция, в которой атом галогена отрывает атом водорода от молекулы метана, что приводит к образованию молекулы галогенида водорода и метильного радикала (CH 3 •). Затем метильный радикал вступает в реакцию с молекулой галогена с образованием молекулы галогенметана с новым атомом галогена в качестве побочного продукта. Подобные реакции могут происходить с галогенированным продуктом, приводя к замене дополнительных атомов водорода атомами галогена структурами дигалогенметана, тригалогенметана и, в конечном итоге, тетрагалометана, в зависимости от условия реакции и отношение галогена к метану.
Использует
Метан используется в промышленных химических процессах и может транспортироваться в виде охлажденной жидкости (сжиженный природный газ или СПГ ). В то время как утечки из охлаждаемого контейнера для жидкости изначально тяжелее воздуха из-за повышенной плотности холодного газа, газ при температуре окружающей среды легче воздуха. Газопроводы транспортируют большие объемы природного газа, основным компонентом которого является метан.
Топливо
Метан используется в качестве топлива для печей, домов, водонагревателей, печей, автомобилей, турбин и прочего. Активированный уголь используется для хранения метана. Очищенный жидкий метан используется в качестве а ракетного топлива в сочетании с жидким кислородом, как в BE-4 и Двигатели Raptor.
Как основной компонент природного газа, метан важен для выработки электроэнергии, поскольку он сжигается в качестве топлива в газе турбина или парогенератор. По сравнению с другими углеводородными видами топлива, метан производит меньше диоксида углерода на каждую единицу выделяемого тепла. При примерно 891 кДж / моль теплота сгорания метана ниже, чем у любого другого углеводорода. Однако он выделяет больше тепла на массу (55,7 кДж / г), чем любая другая органическая молекула, из-за относительно большого содержания водорода, на который приходится 55% теплоты сгорания, но составляет только 25% от молекулярной массы метана. Во многих городах метан подается по трубам в дома для бытового отопления и приготовления пищи. В этом контексте он обычно известен как природный газ, который, как считается, имеет энергетическое содержание 39 мегаджоулей на кубический метр, или 1000 БТЕ на <251.>стандартный кубический фут. Сжиженный природный газ (СПГ) — это преимущественно метан (CH 4), преобразованный в жидкую форму для облегчения хранения или транспортировки.
В качестве ракетного топлива метан имеет преимущество перед керосином в том, что он производит небольшие молекулы выхлопных газов. Благодаря этому на внутренних частях ракетных двигателей остается меньше сажи, что снижает трудность повторного использования ускорителя. Более низкая молекулярная масса выхлопа также увеличивает долю тепловой энергии, которая находится в форме кинетической энергии, доступной для движения, увеличивая удельный импульс ракеты. Жидкий метан также имеет диапазон температур (91–112 К), почти совместимый с жидким кислородом (54–90 К).
Химическое сырье
Природный газ, который в основном состоит из метана, используется для производства газообразного водорода в промышленных масштабах. Паровой риформинг метана (SMR), или просто известный как паровой риформинг, является наиболее распространенным методом производства товарного газообразного водорода в больших объемах. Ежегодно во всем мире (2013 г.) добывается более 50 миллионов метрических тонн, в основном из природного газа SMR. Большая часть этого водорода используется на нефти нефтеперерабатывающих заводах, в производстве химикатов и в пищевой промышленности. В промышленном синтезе аммиака.
используются очень большие количества водорода при высоких температурах (700 — 1100 ° C) и в присутствии катализатора на основе металла (никель ), водяной пар реагирует с метаном с образованием смеси CO и H2, известной как «водяной газ» или «синтез-газ»:
- CH4+ H2O ⇌ CO + 3 H2
Эта реакция является сильно эндотермической (расходуется тепло, ΔH r = 206 кДж / моль). Дополнительный водород получают реакцией CO с водой посредством реакции конверсии водяного газа.
- CO + H 2 O ⇌ CO2 + H 2
Эта реакция является умеренно экзотермической (выделяется тепло, ΔH r = -41 кДж / моль).
Метан также подвергается свободнорадикальному хлорированию при производстве хлорметанов, хотя метанол является более типичным предшественником.
Поколение
Геологические маршруты
Двумя основными маршрутами геологического образования метана являются (i) органический (генерируемый термически или термогенный) и (ii) неорганический (абиотический ). Термогенный метан возникает из-за разрушения органических веществ при повышенных температурах и давлениях в глубоких осадочных слоях . Большая часть метана в осадочных бассейнах термогенная; Следовательно, термогенный метан является наиболее важным источником природного газа. Компоненты термогенного метана обычно считаются реликтовыми (более ранними). Как правило, образование термогенного метана (на глубине) может происходить в результате разрушения органических веществ или органического синтеза. Оба пути могут быть связаны с микроорганизмами (метаногенез ), но могут также происходить неорганически. Соответствующие процессы также могут потреблять метан с микроорганизмами и без них.
Более важный источник метана на глубине (кристаллическая порода) — абиотический. Абиотический означает, что метан создается из неорганических соединений без биологической активности либо в результате магматических процессов, либо в результате реакций вода-порода, которые происходят при низких температурах и давлениях, таких как серпентинизация.
Биологические пути
Большинство Земной метан биогенный и вырабатывается метаногенезом, формой анаэробного дыхания, которое, как известно, осуществляется только некоторыми членами домена архей. Метаногены населяют свалки и другие почвы, жвачные животные (например, коровы или крупный рогатый скот ), кишки термитов и бескислородные отложения под морским дном и дном озер. Рисовые поля также выделяют большое количество метана во время роста растений. Этот многоступенчатый процесс используется этими микроорганизмами для получения энергии. Итоговая реакция метаногенеза:
- CO2+ 4 H 2→ CH 4 + 2 H 2O
Конечная стадия процесса катализируется ферментом метилкофермент М редуктаза (MCR).

Жвачные животные
Жвачные животные, такие как крупный рогатый скот, отрыгивают метан, что составляет ~ 22% годовых выбросов метана в атмосферу в США. Одно исследование показало, что сектор животноводства в целом (в основном крупный рогатый скот, куры и свиньи) производит 37% всего антропогенного метана. Исследование 2013 года показало, что на домашний скот приходится 44% антропогенного метана и ~ 15% антропогенных выбросов парниковых газов. В настоящее время предпринимаются многочисленные усилия по сокращению производства метана домашним скотом, такие как лечение и корректировка рациона питания, а также улавливание газа для использования в качестве энергии.
Отложения морского дна
Большая часть подпольного дна составляет бескислородный, потому что кислород удаляется аэробными микроорганизмами в пределах первых нескольких сантиметров осадка. Ниже насыщенного кислородом морского дна метаногены производят метан, который либо используется другими организмами, либо попадает в ловушку газовых гидратов. Эти другие организмы, которые используют метан для получения энергии, известны как метанотрофы (поедающие метан), и являются основной причиной того, что небольшое количество метана, образующегося на глубине, достигает поверхности моря. Консорциумы архей и бактерий окисляют метан посредством анаэробного окисления метана (AOM); за это ответственны анаэробные метанотрофные археи (ANME) и сульфатредуцирующие бактерии (SRB).
Промышленные пути
Мало стимул для промышленного производства метана. Метан получают путем гидрирования диоксида углерода по процессу Сабатье. Метан также является побочным продуктом гидрирования монооксида углерода в процессе Фишера-Тропша, который практикуется в больших масштабах для получения молекул с более длинной цепью, чем метан.
Примером крупномасштабной газификации угля в метан является установка Great Plains Synfuels, запущенная в 1984 году в Беуле, Северная Дакота, как способ разработки обильных местных ресурсов с низким содержанием бурый уголь, ресурс, который иначе трудно транспортировать из-за его веса, содержания золы, низкой теплотворной способности и склонности к самовозгоранию при хранении и транспортировке.
Получение метана — это технология, в которой электроэнергия используется для производства водорода из воды с помощью электролиза и используется реакция Сабатье для объединения водорода с диоксид углерода для получения метана. По состоянию на 2016 год он в основном находится в стадии разработки и не используется в больших масштабах. Теоретически этот процесс можно использовать в качестве буфера для избыточной и непиковой мощности, генерируемой сильно колеблющимися ветряными генераторами и солнечными батареями. Однако, поскольку в настоящее время на электростанциях используется очень большое количество природного газа (например, CCGT ) для производства электроэнергии, потери в эффективности неприемлемы.
Лабораторный синтез
Метан можно получить путем протонирования метиллития и иодида метилмагния. На практике потребность в чистом метане будет удовлетворяться за счет стального газового баллона от стандартных поставщиков.
Происхождение
Метан был обнаружен и выделен Алессандро Вольта между 1776 и 1778 годами при изучении болотного газа из озера Маджоре. Это основной компонент природного газа, около 87% по объему. Основным источником метана является добыча из геологических залежей, известных как месторождения природного газа, причем газ из угольных пластов становится основным источником (см. Извлечение метана из угольных пластов, способ извлечения метана из месторождения угля, тогда как усиленное извлечение метана из угольных пластов представляет собой способ извлечения метана из недобываемых угольных пластов). Он связан с другими углеводородными видами топлива и иногда сопровождается гелием и азотом. Метан образуется на мелководье (низкое давление) в результате анаэробного распада органического вещества и переработанного метана из глубины под земной поверхностью. Как правило, отложения, образующие природный газ, залегают глубже и при более высоких температурах, чем те, которые содержат нефть.
. Метан обычно транспортируется наливом по трубопроводу в его естественном виде. газовая форма или танкеры для перевозки СПГ в сжиженном виде; немногие страны перевозят его грузовиками.
Атмосферный метан
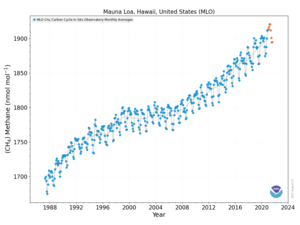
В 2010 году уровень метана в Арктике был измерен на уровне 1850 нмоль / моль. Этот уровень более чем в два раза выше, чем когда-либо за последние 400 000 лет. Исторические концентрации метана в атмосфере мира колебались от 300 до 400 нмоль / моль в ледниковые периоды, обычно известные как ледниковые периоды, и от 600 до 700 нмоль / моль в теплые периоды межледниковые периоды. Океаны Земли являются потенциально важным источником метана в Арктике.
Метан является важным парниковым газом с потенциалом глобального потепления, равным 34 по сравнению с CO 2 (потенциал 1) за 100-летний период и 72 за 20-летний период.
Концентрация метана в атмосфере Земли увеличилась примерно на 150% с 1750 года, и составляет 20% от общего радиационного воздействия от всех долгоживущих и глобально смешанных парниковых газов (эти газы не включают водяной пар, который на сегодняшний день является самым большим компонентом парникового эффекта ).
В 2015–2019 годах было зарегистрировано резкое повышение уровня атмосферного метана. В феврале 2020 года сообщалось, что выбросы метана от отрасли ископаемого топлива могли быть значительно недооценены.
Изменение климата может усилиться. уровни атмосферного метана за счет увеличения производства метана в природных экосистемах, формируя обратную связь об изменении климата.
клатраты
Клатраты метана (также известные как гидраты метана) представляют собой твердые клетки из молекул воды, которые удерживают отдельные молекулы метана. Значительные резервуары клатратов метана были обнаружены в арктической вечной мерзлоте и вдоль континентальных окраин под дном океана в пределах зоны стабильности газовых клатратов, расположенной при высоких давлениях (1 до 100 МПа; нижний предел требует более низкой температуры) и низких температур (< 15 °C; upper end requires higher pressure). Methane clathrates can form from biogenic methane, thermogenic methane, or a mix of the two. These deposits are both a potential source of methane fuel as well as a potential contributor to global warming. The global mass of carbon stored in gas clathrates is still uncertain and has been estimated as high as 12,500 Гт углерода и всего 500 Гт углерода. Оценка со временем снизилась с самой последней оценкой ~ 1800 Гт углерода. Большая часть Эта неопределенность связана с отсутствием наших знаний об источниках и стоках метана и распределении клатратов метана в глобальном масштабе. Например, относительно недавно открытый источник метана был обнаружен в сверхмедленном спрединговом хребте в Некоторые климатические модели предполагают, что нынешний режим эмиссии метана со дна океана потенциально аналогичен режиму в период палеоцен-эоценового теплового максимума (PETM ) около 55,5 миллионов лет. назад, хотя нет данных, указывающих на то, что • метан в результате диссоциации клатратов в настоящее время достигает атмосферы. Выброс метана в Арктике из вечной мерзлоты и клатратов метана на морском дне является потенциальным следствием и дополнительной причиной глобального потепления ; это известно как гипотеза клатратной пушки. Данные за 2016 год показывают, что вечная мерзлота в Арктике тает быстрее, чем предполагалось.
Внеземной метан
Межзвездная среда
Метан широко распространен во многих частях Солнечной системы и потенциально может быть добыт на поверхность другого тела солнечной системы (в частности, с использованием производства метана из местных материалов, обнаруженных на Марсе или Титане ), обеспечивающих топливо для обратного пути.
Марс
Метан обнаружен на всех планетах солнечной системы и на большинстве более крупных лун. За возможным исключением Марса, считается, что он произошел в результате абиотических процессов.

Марсоход Curiosity зарегистрировал сезонные колебания уровней атмосферного метана на Марсе. Эти колебания достигли пика в конце марсианского лета и составили 0,6 частей на миллиард.
Метан был предложен в качестве возможного ракетного топлива в будущих миссиях на Марс частично из-за к возможности его синтеза на планете путем использования ресурсов на месте. Адаптация реакции метанирования Сабатье может быть использована со смешанным слоем катализатора и обратным сдвигом водяного газа в одном реакторе для производства метана из сырья, доступного на Марсе, с использованием вода из марсианских недр и углекислый газ в марсианской атмосфере.
Метан может быть произведен небиологическим процессом, называемым серпентинизацией с участием воды, углекислый газ и минерал оливин, который, как известно, широко распространен на Марсе.
История

В ноябре 1776 года метан был впервые научно идентифицирован Итальянский физик Алессандро Вольта в болотах озера Маджоре, пересекающего Италию и Швейцарию. Вольта был вдохновлен на поиск этого вещества после прочтения статьи, написанной Бенджамином Франклином о «легковоспламеняющемся воздухе». Вольта собирал газ, поднимающийся с болота, и к 1778 году выделил чистый газ. Он также продемонстрировал, что газ можно воспламенить с помощью электрической искры.
Название «метан» было придумано в 1866 году немецким химиком Августом Вильгельмом фон Хофманном. Название произошло от метанола.
Этимологии
Этимологически слово «метан» образовано от химического суффикса «-ан», который обозначает вещества, принадлежащие к семейству алканов; и слово «метил», которое происходит от немецкого «метил» (AD1840) или непосредственно от французского «méthyle», которое является обратным образованием от французского «méthylène» (соответствует английскому «метилен»), корень которого образован от греческого «мети» (родственный английскому «медовуха») и «хиле» (что означает «дерево»). Радикал назван в честь этого, потому что он был впервые обнаружен в метаноле, спирте, впервые выделенном перегонкой древесины. Химический суффикс «-ane» происходит от координирующего химического суффикса «-ine», который происходит от латинского женского суффикса «-ina», который применяется для обозначения абстрактов. Согласование «-ane», «-ene», «-one» и т. Д. Было предложено в 1866 году немецким химиком Августом Вильгельмом фон Хофманном (1818-1892).
Сокращения
Аббревиатура CH 4 -C может означать массу углерода, содержащегося в массе метана, а масса метана всегда в 1,33 раза больше массы CH 4 -C. CH 4 -C также может означать отношение метан-углерод, которое составляет 1,33 по массе. Метан в масштабах атмосферы обычно измеряется в тераграммах (Tg CH 4) или миллионах метрических тонн (MMT CH 4), что означает одно и то же. Также используются другие стандартные единицы измерения, такие как наномоль (нмоль = одна миллиардная моля), моль (моль), килограмм и грамм.
Безопасность <400.>
Метан нетоксичен, но он чрезвычайно огнеопасен и может образовывать взрывоопасные смеси с воздухом. Метан также удушающе, если концентрация кислорода снижается до менее 16% за счет вытеснения, так как большинство людей могут переносить снижение с 21% до 16% без вредных последствий. Концентрация метана, при которой опасность удушья становится значительной, намного выше, чем концентрация 5–15% в легковоспламеняющейся или взрывоопасной смеси. Отходящий метан может проникать внутрь зданий около свалок и подвергать жителей значительному воздействию метана. В некоторых зданиях под подвалом есть специально спроектированные системы рекуперации для активного улавливания этого газа и отвода его от здания.
Взрывы метана стали причиной многих смертельных катастроф на шахтах. Взрыв метана стал причиной аварии на угольной шахте Верхний Биг-Бранч в Западной Вирджинии 5 апреля 2010 года, в результате чего погибли 29.
См. Также
- 2007 г. Катастрофа на шахте Засядко
- Абиогенное происхождение нефти
- Производство аэробного метана
- Анаэробное сбраживание
- Анаэробное дыхание
- Выбросы метана в Арктике
- Биогаз
- Место выхода угольной нефти
- Плотность энергии
- Выбросы летучих газов
- Глобальная инициатива по метану
- Галометан, галогенированные производные метана.
- Водородный цикл
- Промышленный газ
- Озеро Киву (более общий: лимническое извержение )
- Список алканов с прямой цепью
- Метанирование
- Выбросы метана
- Метан на Марсе: атмосфера
- Метан на Марсе: климат
- Метаноген, археи, производящие метан.
- Метаногенез, микробы, производящие метан.
- Метанотроф, бактерии, которые растут вместе с метаном.
- Метильная группа, функциональная группа, связанная с метаном.
- Thomas Gold
Примечания
Ссылки
Внешние ссылки
| На Викискладе есть материалы, связанные с метаном. |
| Найдите метан в Викисловаре, бесплатный словарь. |
- Метан в Периодическая таблица видео (Университет Ноттингема)
- Международная карта химической безопасности 0291
- Газ ( Methane) Hydrates — A New Frontier — United States Geological Survey
- Лансфорд, Джек Х. (2000). «Каталитическая конверсия метана в более полезные химические вещества и топливо: задача 21 века». Катализ сегодня. 63 (2–4): 165–174. doi : 10.1016 / S0920-5861 (00) 00456-9.
- CDC — Справочник по контролю метана в горнодобывающей промышленности
«CH4» перенаправляется сюда. Для использования в других целях см. CH4 (значения).
Протокол службы экстренной помощи см. ЭТАН.
 |
||
|
||
| Имена | ||
|---|---|---|
| Предпочтительное название IUPAC
Метан[1] |
||
| Систематическое название ИЮПАК
Карбон (никогда не рекомендуется[1]) |
||
Другие имена
|
||
| Идентификаторы | ||
|
Количество CAS |
|
|
|
3D модель (JSmol ) |
|
|
| 3DMet |
|
|
|
Ссылка на Beilstein |
1718732 | |
| ЧЭБИ |
|
|
| ЧЭМБЛ |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.739 |
|
| Номер ЕС |
|
|
|
Ссылка на Гмелин |
59 | |
| КЕГГ |
|
|
| MeSH | Метан | |
|
PubChem CID |
|
|
| Номер RTECS |
|
|
| UNII |
|
|
| Номер ООН | 1971 | |
|
Панель управления CompTox (EPA) |
|
|
|
ИнЧИ
|
||
|
Улыбки
|
||
| Характеристики | ||
|
Химическая формула |
CЧАС4 | |
| Молярная масса | 16.043 г · моль−1 | |
| Внешность | Бесцветный газ | |
| Запах | Без запаха | |
| Плотность |
|
|
| Температура плавления | -182,5 ° С; -296,4 ° F; 90,7 тыс. | |
| Точка кипения | -161,50 ° С; -258,70 ° F; 111,65 К[3] | |
| Критическая точка (Т, п) | 190,56 К, 4,5992 МПа | |
|
Растворимость в воде |
22.7 мг · л−1 | |
| Растворимость | Растворим в этиловый спирт, диэтиловый эфир, бензол, толуол, метанол, ацетон и нерастворим в воде | |
| бревно п | 1.09 | |
|
Закон Генри |
14 нмоль · Па−1·кг−1 | |
| Конъюгированная кислота | Метан | |
| Основание конъюгата | Метил анион | |
|
Магнитная восприимчивость (χ) |
−12.2×10−6 см3· Моль−1 | |
| Структура | ||
|
Группа точек |
Тd | |
|
Молекулярная форма |
Тетраэдр | |
|
Дипольный момент |
0 D | |
| Термохимия | ||
|
Теплоемкость (C) |
35.69 Дж · (К · моль)−1 | |
|
Стандартный моляр |
186.25 Дж · (К · моль)−1 | |
|
Станд. Энтальпия |
−74.87 кДж · моль−1 | |
|
Станд. Энтальпия |
От -891,1 до -890,3 кДж · моль−1 | |
| Опасности[4] | ||
| Паспорт безопасности | Видеть: страница данных | |
| Пиктограммы GHS |  |
|
| Сигнальное слово GHS | Опасность | |
|
Формулировки опасности GHS |
H220 | |
|
Меры предосторожности GHS |
P210 | |
| NFPA 704 (огненный алмаз) |
4 2 0 SA |
|
| точка возгорания | -188 ° С (-306,4 ° F, 85,1 К) | |
|
Самовоспламенение |
537 ° С (999 ° F, 810 К) | |
| Пределы взрываемости | 4.4–17% | |
| Родственные соединения | ||
|
Родственные алканы |
|
|
| Страница дополнительных данных | ||
|
Структура и |
Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. |
|
|
Термодинамический |
Фазовое поведение твердое тело – жидкость – газ |
|
|
Спектральные данные |
УФ, ИК, ЯМР, РС | |
|
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
||
| Ссылки на инфобоксы | ||
Метан ( или же ) представляет собой химическое соединение с химическая формула CH4 (один атом углерод и четыре атома водород ). Это группа-14 гидрид и самый простой алкан, и является основным компонентом натуральный газ. Относительное содержание метана на земной шар делает его экономически привлекательным топливо, хотя его захват и хранение создает технические проблемы из-за его газообразный состояние под нормальные условия по температуре и давлению.
Природный метан находится как под землей, так и под землей. морское дно, и формируется как геологическими, так и биологическими процессами. Самый большой резервуар метана находится под морским дном в виде клатраты метана. Когда метан достигает поверхности и атмосфера, он известен как атмосферный метан.[6] Концентрация метана в атмосфере Земли увеличилось примерно на 150% с 1750 г., и составляет 20% от общего радиационное воздействие от всех долгоживущих и глобально смешанных парниковые газы.[7] Метан также был обнаружен на других планетах, в том числе Марс, что имеет значение для астробиология исследование.[8]
Свойства и связь
Метан — это четырехгранный молекула с четырьмя эквивалентами C – H связи. Его электронная структура описывается четырьмя связывающими молекулярными орбиталями (МО) в результате перекрытия валентных орбиталей на C и ЧАС. MO с наименьшей энергией является результатом перекрытия 2s-орбиталей на углероде с синфазной комбинацией 1s-орбиталей на четырех атомах водорода. Выше этого энергетического уровня находится тройной вырожденный набор МО, который включает перекрытие 2p-орбиталей на углероде с различными линейными комбинациями 1s-орбиталей на водороде. Полученная в результате схема соединения «три на один» согласуется с измерениями фотоэлектронной спектроскопии.
В комнатная температура и стандартное давление, метан — бесцветный газ без запаха.[9] Знакомый запах природного газа, который используется в домах, достигается добавлением одорант, обычно смеси, содержащие трет-бутилтиол, в качестве меры безопасности. Метан имеет температуру кипения −164 °C (−257.8 °F ) при давлении в один атмосфера.[10] Как газ это легковоспламеняющийся в диапазоне концентраций (5,4–17%) в воздухе при стандартное давление.
Твердый метан существует в нескольких модификации. В настоящее время известно девять.[11] Охлаждение метана при нормальном давлении приводит к образованию метана I. Это вещество кристаллизуется в кубической системе (космическая группа FM3м). Положение атомов водорода в метане I не фиксировано, т.е. молекулы метана могут свободно вращаться. Следовательно, это пластиковый кристалл.[12]
Химические реакции
Основные химические реакции метана: горение, паровой риформинг к синтез-газ, и галогенирование. В общем, реакции с метаном трудно контролировать.
Селективное окисление
Частичное окисление метана в метанол сложно, потому что реакция обычно прогрессирует до углекислый газ и воды даже при недостаточном количестве кислород. В фермент метанмонооксигеназа производит метанол из метана, но не может использоваться для реакций промышленного масштаба.[13] Некоторые однородно катализированный системы и гетерогенные системы были разработаны, но все они имеют существенные недостатки. Обычно они работают, производя защищенные продукты, защищенные от переокисления. Примеры включают Каталитическая система, медь цеолиты, и железные цеолиты, стабилизирующие альфа-кислород активный сайт.[14]
Одна группа бактерии управлять окислением метана с помощью нитрит как окислитель в отсутствие кислород, вызывая так называемые анаэробное окисление метана.[15]
Кислотно-основные реакции
Как и другие углеводороды, метан очень слабая кислота. Его pKа в ДМСО оценивается в 56.[16] Не может быть депротонированный в растворе, но сопряженное основание известен в таких формах, как метиллитий.
Разнообразие положительные ионы полученные из метана, наблюдались в основном как нестабильные частицы в газовых смесях низкого давления. К ним относятся метений или метильный катион CH+
3, катион метана CH+
4, и метаний или протонированный метан CH+
5. Некоторые из них были обнаружен в космическом пространстве. Метан также может быть получен в виде разбавленных растворов из метана с суперкислоты. Катионы с более высоким зарядом, например CH2+
6 и CH3+
7, были изучены теоретически и предположительно устойчивы.[17]
Несмотря на прочность связей C – H, существует большой интерес к катализаторы что облегчает Активация связи C – H в метане (и других алканы ).[18]
Горение
Пузырьки метана можно сжечь мокрой рукой без травм.
Метана теплота сгорания составляет 55,5 МДж / кг.[19] Горение метана представляет собой многостадийную реакцию, резюмируемую следующим образом:
- CH4 + 2 O2 → CO2 + 2 часа2O (ΔЧАС = −891 kJ /моль, при стандартных условиях)
Четырехступенчатая химия Петерса представляет собой систематически сокращенную четырехступенчатую химию, объясняющую горение метана.
Метановые радикальные реакции
В соответствующих условиях метан реагирует с галоген радикалы следующее:
- X • + CH4 → HX + CH3•
- CH3• + X2 → CH3X + X •
где X — это галоген: фтор (F), хлор (Cl), бром (Br), или йод (Я). Этот механизм для этого процесса называется свободнорадикальное галогенирование. Он инициируется, когда УФ-излучение или какой-то другой радикальный инициатор (подобно перекиси ) производит галоген атом. Двухступенчатый цепная реакция следует, в котором атом галогена отрывает атом водорода от молекулы метана, в результате чего образуется галогенид водорода молекула и метильный радикал (CH3•). Затем метильный радикал вступает в реакцию с молекулой галогена с образованием молекулы галогенметана с новым атомом галогена в качестве побочного продукта.[20] Подобные реакции могут происходить с галогенированным продуктом, приводя к замене дополнительных атомов водорода атомами галогена на дигалогенметан, тригалометан, и в конечном итоге тетрагалогенметан структуры, в зависимости от условий реакции и соотношения галогена и метана.
Использует
Метан используется в промышленных химических процессах и может транспортироваться в виде охлажденной жидкости (сжиженный природный газ или СПГ ). В то время как утечки из охлаждаемого контейнера для жидкости изначально тяжелее воздуха из-за повышенной плотности холодного газа, газ при температуре окружающей среды легче воздуха. Газопроводы распределяют большие объемы природного газа, основным компонентом которого является метан.
Топливо
Метан используется как топливо для печей, домов, водонагревателей, обжиговых печей, автомобилей,[21][22] турбины и прочее. Активированный уголь используется для хранения метана. Очищенный жидкий метан используется как а ракетное горючие,[23] в сочетании с жидкий кислород, как в BE-4 и Raptor двигатели.[24]
В качестве основной составляющей натуральный газ, метан важен для производство электроэнергии сжигая его как топливо в газовая турбина или же парогенератор. По сравнению с другими углеводородное топливо, метан производит меньше углекислый газ на каждую единицу выделяемого тепла. При примерно 891 кДж / моль метан теплота сгорания ниже, чем у любого другого углеводорода. Однако он выделяет больше тепла на массу (55,7 кДж / г), чем любая другая органическая молекула, из-за относительно большого содержания водорода, на который приходится 55% теплоты сгорания.[25] но составляет только 25% молекулярной массы метана. Во многих городах метан подается в дома для бытовых нужд. обогрев и приготовление пищи. В этом контексте он обычно известен как натуральный газ, который, как считается, имеет энергосодержание 39 мегаджоули за кубический метр, или 1000 БТЕ на стандартный кубический фут. Сжиженный природный газ (СПГ) преимущественно метан (CH4) переведены в жидкую форму для удобства хранения или транспортировки.
В качестве ракетного топлива метан имеет преимущество перед керосин производства небольших молекул выхлопных газов. Это вносит меньше сажа на внутренних частях ракетных двигателей, что снижает трудность повторного использования ускорителя. Нижний молекулярный вес выхлопа также увеличивает долю тепловой энергии, которая находится в форме кинетической энергии, доступной для движения, увеличивая удельный импульс ракеты. Жидкий метан также имеет диапазон температур (91–112 К), почти совместимый с жидкий кислород (54–90 К).
Химическое сырье
Натуральный газ, который в основном состоит из метана, используется для производства газообразного водорода в промышленных масштабах. Паровой риформинг метана (SMR), или просто известный как паровой риформинг, является наиболее распространенным методом производства промышленного газообразного водорода. Ежегодно во всем мире (2013 г.) добывается более 50 миллионов метрических тонн, в основном из SMR природного газа.[26] Большая часть этого водорода используется в нефть нефтеперерабатывающие заводы, в производстве химикатов и в пищевой промышленности. Очень большое количество водорода используется в промышленный синтез аммиака.
При высоких температурах (700 — 1100 ° C) и при наличии металл -основан катализатор (никель ), пар реагирует с метаном с образованием смеси CO и ЧАС2, известный как «водяной газ» или «синтетический газ»:
- CH4 + ЧАС2О ⇌ CO + 3 ЧАС2
Эта реакция сильно эндотермический (потребляет тепло, ΔHр= 206 кДж / моль). Дополнительный водород получают по реакции CO с водой через реакция конверсии водяного газа.
- CO + H2O ⇌ CO2 + H2
Эта реакция мягко говоря экзотермический (выделяет тепло, ΔHр= -41 кДж / моль).
Метан также подвержен свободнорадикальному хлорирование в производстве хлорметанов, хотя метанол является более типичным предшественником.[27]
Поколение
Геологические маршруты
Двумя основными путями геологического образования метана являются: (i) органический (генерируемый термически или термогенный) и (ii) неорганический (абиотический ).[8] Термогенный метан возникает из-за разрушения органических веществ при повышенных температурах и давлениях в глубоких осадочных породах. слои. Большая часть метана в осадочных бассейнах термогенная; Следовательно, термогенный метан является наиболее важным источником природного газа. Компоненты термогенного метана обычно считаются реликтовыми (более ранними). Как правило, образование термогенного метана (на глубине) может происходить в результате разрушения органических веществ или органического синтеза. Оба пути могут вовлекать микроорганизмы (метаногенез ), но может встречаться и неорганически. Соответствующие процессы также могут потреблять метан с микроорганизмами и без них.
Более важный источник метана на глубине (кристаллическая порода) — абиотический. Абиотический означает, что метан создается из неорганических соединений без биологической активности либо в результате магматических процессов, либо в результате реакций вода-порода, которые происходят при низких температурах и давлениях, например серпентинизация.[28][29]
Биологические маршруты
Большая часть метана на Земле биогенный и производится метаногенез,[30][31] форма анаэробного дыхания, которую, как известно, проводят только некоторые члены домена Археи.[32] Метаногены занимают свалки и другие почвы,[33] жвачные животные (Например коровы или же крупный рогатый скот ),[34] кишки термитов и аноксический отложения ниже морского дна и дна озер. Рис поля также производят большое количество метана во время роста растений.[35] Этот многоступенчатый процесс используется этими микроорганизмами для получения энергии. Чистая реакция метаногенеза:
- CO2 + 4 часа2→ CH4 + 2 часа2О
Последний этап процесса катализируется ферментом метил-кофермент М редуктаза (MCR).[36]
Тестирование австралийских овец на выработку выдыхаемого метана (2001 г.), CSIRO
Это изображение представляет жвачное животное, а точнее овцу, производящую метан на четырех стадиях гидролиза, ацидогенеза, ацетогенеза и метаногенеза.
Жвачные животные
Жвачные животные, такие как крупный рогатый скот, отрыгивают метан, что составляет ~ 22% годовых выбросов метана в атмосферу в США.[37] Одно исследование показало, что сектор животноводства в целом (в основном крупный рогатый скот, куры и свиньи) производит 37% всего антропогенного метана.[38] Исследование 2013 года показало, что на домашний скот приходится 44% антропогенного метана и ~ 15% антропогенных выбросов парниковых газов.[39] В настоящее время предпринимаются многочисленные усилия по сокращению производства метана в животноводстве, например, лечение и корректировка рациона питания,[40] и улавливать газ для использования в качестве энергии.[41]
Отложения морского дна
Большая часть подпольного этажа аноксический потому что кислород удаляется аэробный микроорганизмы в пределах первых нескольких сантиметров осадка. Ниже насыщенного кислородом морского дна метаногены производят метан, который либо используется другими организмами, либо попадает в ловушку. газовые гидраты.[32] Эти другие организмы, которые используют метан для получения энергии, известны как метанотрофы (поедание метана), и являются основной причиной того, что мало метана, образующегося на глубине, достигает поверхности моря.[32] Консорциумы архей и бактерий окисляют метан через Анаэробное окисление метана (АОМ); организмы, ответственные за это, Анаэробные метанотрофные археи (ANME) и Сульфатредуцирующие бактерии (SRB).[42]
Промышленные маршруты
Стимулы к промышленному производству метана практически отсутствуют. Метан производится гидрогенизация углекислый газ через Сабатье процесс. Метан также является побочным продуктом гидрирования оксида углерода в Процесс Фишера-Тропша, который широко практикуется для производства молекул с более длинной цепью, чем метан.
Примером крупномасштабной газификации угля в метан является Great Plains Synfuels завод, начатый в 1984 году в Беуле, Северная Дакота, как способ разработки обильных местных ресурсов низкосортных лигнит, ресурс, который иначе трудно транспортировать из-за его веса, пепел содержание, низкая теплотворная способность и склонность к случайное возгорание при хранении и транспортировке.
Энергия на метан это технология, которая использует электричество производить водород из воды электролиз и использует Сабатье реакция соединить водород с углекислый газ для производства метана. По состоянию на 2016 год он в основном находится в стадии разработки и не используется в больших масштабах. Теоретически этот процесс может использоваться в качестве буфера для избыточной и непиковой мощности, генерируемой сильно колеблющимся ветряные генераторы и солнечные батареи. Однако, поскольку в настоящее время на электростанциях используется очень большое количество природного газа (например, CCGT ) для производства электроэнергии потери КПД недопустимы.
Лабораторный синтез
Метан может производиться протонирование из метиллитий и метилмагний йодид. На практике потребность в чистом метане будет удовлетворяться за счет стального газового баллона от стандартных поставщиков.
Вхождение
Метан был открыт и выделен Алессандро Вольта между 1776 и 1778 годами при обучении болотный газ из Озеро Маджоре. Это основной компонент природного газа, около 87% по объему. Основным источником метана является добыча из геологических отложений, известных как месторождения природного газа, с газ из угольных пластов добыча становится основным источником (см. Добыча метана из угольных пластов, способ извлечения метана из каменный уголь депозит, пока усиленное извлечение метана из угольных пластов метод добычи метана из недобываемых угольных пластов). Это связано с другими углеводород топлива, а иногда и в сопровождении гелий и азот. Метан производится на мелководье (низкое давление) за счет анаэробный разлагаться из органическая материя и переработал метан из глубин земли. В целом отложения которые производят природный газ, находятся глубже и при более высоких температурах, чем те, которые содержат масло.
Метан обычно перевозится наливом трубопровод в виде природного газа или танкеры для перевозки СПГ в сжиженном виде; немногие страны перевозят его грузовиками.
Атмосферный метан
Эволюция концентрации метана с 1987 г. по сентябрь 2020 г. на Мауна-Лоа (Гавайи).
В 2010 году уровень метана в Арктике составлял 1850 нмоль / моль. Этот уровень более чем в два раза выше, чем когда-либо за последние 400 000 лет. Исторические концентрации метана в атмосфере мира колеблется от 300 до 400 нмоль / моль во время ледниковых периодов, обычно известных как ледниковые периоды, и от 600 до 700 нмоль / моль во время теплого межледниковый периоды. Океаны Земли являются потенциально важным источником метана в Арктике.[43]
Метан важен парниковый газ с потенциал глобального потепления из 34 по сравнению с CO2 (потенциал 1) за 100-летний период и 72 за 20-летний период.[44][45]
Концентрация метана в атмосфере Земли с 1750 года увеличилась примерно на 150%, и на нее приходится 20% от общего количества метана. радиационное воздействие от всех долгоживущих и глобально смешанных парниковых газов (эти газы не включают водяной пар, который на сегодняшний день является самым большим компонентом парниковый эффект ).[7]
С 2015 по 2019 год зафиксировано резкое повышение уровня атмосферного метана.[46][47] В феврале 2020 года сообщалось о выбросах метана из промышленность ископаемого топлива могло быть значительно недооценено.[48]
Изменение климата может повысить уровень метана в атмосфере за счет увеличения производства метана в естественных экосистемах, формируя Обратная связь об изменении климата.[32][49]
Клатраты
Клатраты метана (также известные как гидраты метана) представляют собой твердые клетки из молекул воды, которые удерживают отдельные молекулы метана. Значительные резервуары клатратов метана были обнаружены в арктической вечной мерзлоте и вдоль побережья. континентальные окраины под дно океана в пределах зона устойчивости клатратов газа, расположенных при высоких давлениях (от 1 до 100 МПа; нижний конец требует более низкой температуры) и низких температурах (<15 ° C; верхний конец требует более высокого давления).[50] Клатраты метана могут образовываться из биогенного метана, термогенного метана или их смеси. Эти отложения являются как потенциальным источником метанового топлива, так и потенциальным фактором глобального потепления.[51][52] Глобальная масса углерода, хранящегося в газовых клатратах, все еще остается неопределенной и оценивается в 12500 Gt углерод и всего 500 Гт углерода.[53] Оценка со временем снизилась, и последняя оценка составляет ~ 1800 Гт углерода.[54] Большая часть этой неопределенности связана с недостатком наших знаний об источниках и стоках метана и распределении клатратов метана в глобальном масштабе. Например, относительно недавно обнаруженный источник метана был обнаружен в сверхмедленный гребень разбрасывания в Арктике.[55] Некоторые климатические модели предполагают, что сегодняшний режим эмиссии метана со дна океана потенциально аналогичен режиму в период Палеоцен – эоцен термический максимум (ПЭТМ ) около 55,5 миллионов лет назад, хотя нет данных, указывающих на то, что метан в результате диссоциации клатратов в настоящее время достигает атмосферы.[54] Выброс метана в Арктике из вечная мерзлота и клатраты метана на морском дне являются потенциальным следствием и дополнительной причиной глобальное потепление; это известно как гипотеза клатратной пушки.[56][57][58][59] Данные за 2016 год показывают, что вечная мерзлота в Арктике тает быстрее, чем прогнозировалось.[60]
Межзвездная среда
Метан присутствует в большом количестве во многих частях Солнечной системы и потенциально может собираться на поверхности другого тела Солнечной системы (в частности, с использованием производство метана из местных материалов найти на Марс[61] или же Титан ), обеспечивая топливо для обратного пути.[23][62]
Марс
Метан обнаружен на всех планетах Солнечная система и большинство более крупных лун. За возможным исключением Марс, считается, что он произошел от абиотический процессы.[63][64]
Метан (CH4) на Марсе — потенциальные источники и поглотители.
В Любопытство ровер задокументировал сезонные колебания атмосферный метан уровни на Марсе. Эти колебания достигли пика в конце марсианского лета и составили 0,6 частей на миллиард.[65][66][67][68][69][70][71][72]
Метан был предложен в качестве возможного ракетное топливо на будущее Марсианские миссии отчасти из-за возможности синтезировать его на планете путем использование ресурсов на месте.[73] Адаптация Сабатье реакция метанирования может использоваться со смешанным слоем катализатора и обратная смена водяного газа в одном реакторе для производства метана из сырья, доступного на Марсе, с использованием воды из Марсианские недра и углекислый газ в Марсианская атмосфера.[61]
Метан может быть произведен небиологическим процессом, называемым серпентинизация[а] с участием воды, двуокиси углерода и минералов оливин, который, как известно, обычен на Марсе.[74]
История
В ноябре 1776 года метан был впервые научно идентифицирован Итальянский физик Алессандро Вольта в болотах Озеро Маджоре трансграничный Италия и Швейцария. На поиски этого вещества Вольта был вдохновлен после прочтения статьи, написанной Бенджамин Франклин про «горючий воздух».[75] Вольта собирал газ, поднимающийся с болота, и к 1778 году выделил чистый газ.[76] Он также продемонстрировал, что газ можно зажечь от электрической искры.[76]
Название «метан» было придумано в 1866 году немецким химиком. Август Вильгельм фон Хофманн.[77] Название произошло от метанол.
Этимология
Этимологически слово «метан«образовано от химического суффикса»-ан«, что означает вещества, принадлежащие к семейству алканов; и слово»метил«, которое происходит от немецкого»метил«(1840 г. н.э.) или напрямую от французов»Метил«что является бэк-формацией от французов»Метилен«(соответствует английскому» метилену «), корень которого был придуман Жан-Батистом Дюма и Эженом Пелиго в 1834 году от греческого»мети«(родственный англ. mead») и «Hyle«(что означает» дерево «). Радикал назван в честь этого, потому что он был впервые обнаружен в метанол, спирт, впервые выделенный перегонкой древесины. Химический суффикс «-ан«происходит от координирующего химического суффикса»-ine«от латинского суффикса женского рода»-в«, который применяется для представления абстрактов. Согласование» -ane «,» -ene «,» -one «и т. д. было предложено в 1866 году немецким химиком Августом Вильгельмом фон Хофманном (1818-1892).
Сокращения
Аббревиатура CH4-C может означать массу углерода, содержащегося в массе метана, а масса метана всегда в 1,33 раза больше массы CH4-C.[78][79] CH4-C также может означать соотношение метан-углерод, которое составляет 1,33 по массе.[80]Метан в масштабах атмосферы обычно измеряется в тераграммах (Tg CH4) или миллионы метрических тонн (MMT CH4), что означает одно и то же.[81] Также используются другие стандартные единицы измерения, такие как наномоль (нмоль = одна миллиардная моля), крот (моль), килограмм, и грамм.
Безопасность
Метан нетоксичный, но он чрезвычайно огнеопасен и может образовывать взрывной смеси с воздухом. Метан также удушающий если концентрация кислорода снижается до менее 16% за счет вытеснения, как это может сделать большинство людей переносят снижение с 21% до 16% без побочных эффектов. Концентрация метана, при которой опасность удушья становится значительной, намного выше, чем концентрация 5–15% в легковоспламеняющейся или взрывоопасной смеси. Отходящий метан может проникать внутрь зданий вблизи свалки и подвергать жителей воздействию значительного количества метана. В некоторых зданиях под подвалом есть специально спроектированные системы рекуперации для активного улавливания этого газа и отвода его от здания.
Взрывы метана являются причиной многих смертельных катастроф на шахтах.[82] Взрыв метана стал причиной Катастрофа на угольной шахте Верхнего Биг Бранч в Западная Виргиния 5 апреля 2010 г. погибло 29 человек.[83]
Смотрите также
- 2007 г. катастрофа на шахте Засядько
- Абиогенное происхождение нефти
- Производство аэробного метана
- Анаэробное пищеварение
- Анаэробное дыхание
- Выбросы метана в Арктике
- Биогаз
- Месторождение добычи угля
- Плотность энергии
- Неорганизованные выбросы газа
- Глобальная инициатива по метану
- Галометан, галогенированные производные метана.
- Водородный цикл
- Промышленный газ
- Озеро Киву (более общий: лимническая сыпь )
- Список алканов с прямой цепью
- Метанирование
- Выбросы метана
- Метан на Марсе: атмосфера
- Метан на Марсе: климат
- Метаноген, археи которые производят метан.
- Метаногенез, микробы которые производят метан.
- Метанотроф, бактерии которые растут с метаном.
- Метильная группа, функциональная группа, относящаяся к метану.
- Томас Голд
Примечания
- ^ Есть много серпентинизация реакции. Оливин это Твердый раствор между форстерит и фаялит общая формула которого (Fe, Mg)2SiO4. Реакция получения метана из оливина может быть записана как: Форстерит + фаялит + вода + угольная кислота → серпентин + магнетит + метан , или (в сбалансированной форме): 18 мг2SiO4 + 6 Fe2SiO4 + 26 часов2O + CO2 → 12 мг3Si2О5(ОЙ)4 + 4 Fe3О4 + CH4
Рекомендации
- ^ а б «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 3–4. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Метан — это сохраненное название (см. P-12.3), которое предпочтительнее систематического названия «карбан», имя, которое никогда не рекомендуется для замены метана, но используется для получения названий «карбен» и «карбин» для радикалов H2C2• и HC3•, соответственно.
- ^ «Газовая энциклопедия». Получено 7 ноября, 2013.
- ^ Pubchem. «Метан». pubchem.ncbi.nlm.nih.gov.
- ^ «Паспорт безопасности, название материала: метан» (PDF). США: Metheson Tri-Gas Incorporated. 4 декабря 2009 г. Архивировано с оригинал (PDF) 4 июня 2012 г.. Получено 4 декабря, 2011.
- ^ Управление реагирования и восстановления NOAA, Правительство США. «МЕТАН». noaa.gov.
- ^ Халил, М.А.К. (1999). «Парниковые газы, отличные от СО2, в атмосфере». Ежегодный обзор энергетики и окружающей среды. 24: 645–661. Дои:10.1146 / annurev.energy.24.1.645.
- ^ а б «Техническое резюме». Изменение климата 2001 г.. Программа ООН по окружающей среде. Архивировано из оригинал 4 июня 2011 г.
- ^ а б Этиопа, Джузеппе; Лоллар, Барбара Шервуд (2013). «Абиотический метан на Земле». Обзоры геофизики. 51 (2): 276–299. Bibcode:2013RvGeo..51..276E. Дои:10.1002 / rog.20011. ISSN 1944-9208.
- ^ Хеншер, Дэвид А. и Баттон, Кеннет Дж. (2003). Справочник транспорта и окружающей среды. Издательство «Изумруд Групп». п. 168. ISBN 978-0-08-044103-0.
- ^ Данные об изменении фазы метана. Интернет-книга NIST по химии.
- ^ Bini, R .; Пратеси, Г. (1997). «Инфракрасное исследование твердого метана под высоким давлением. Фазовая диаграмма до 30 ГПа». Физический обзор B. 55 (22): 14800–14809. Bibcode:1997ПхРвБ..5514800Б. Дои:10.1103 / Physrevb.55.14800.
- ^ Венделин Химмельхебер. «Кристаллические структуры». Получено 10 декабря, 2019.
- ^ Байк, Му-Хён; Ньюкомб, Мартин; Фриснер, Ричард А .; Липпард, Стивен Дж. (2003). «Механистические исследования гидроксилирования метана метаномонооксигеназой». Химические обзоры. 103 (6): 2385–419. Дои:10.1021 / cr950244f. PMID 12797835.
- ^ Снайдер, Бенджамин Э. Р .; Bols, Max L .; Schoonheydt, Robert A .; Sels, Bert F .; Соломон, Эдвард I. (19 декабря 2017 г.). «Активные центры железа и меди в цеолитах и их корреляция с металлоферментами». Химические обзоры. 118 (5): 2718–2768. Дои:10.1021 / acs.chemrev.7b00344. ISSN 0009-2665. PMID 29256242.
- ^ Рейманн, Иоахим; Jetten, Mike S.M .; Кельтьенс, Ян Т. (2015). «Глава 7 Металлические ферменты в «невозможных» микроорганизмах, катализирующие анаэробное окисление аммония и метана«В книге Питера М. Х. Кронека и Марты Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 257–313. Дои:10.1007/978-3-319-12415-5_7. ISBN 978-3-319-12414-8. PMID 25707470.
- ^ Бордвелл, Фредерик Г. (1988). «Равновесные кислотности в растворе диметилсульфоксида». Отчеты о химических исследованиях. 21 (12): 456–463. Дои:10.1021 / ar00156a004.
- ^ Расул, Г .; Сурья Пракаш, Г.К .; Олах, Г.А. (2011). «Сравнительное исследование гиперкоординированных ионов карбония и их борных аналогов: задача для спектроскопистов». Письма по химической физике. 517 (1): 1–8. Bibcode:2011CPL … 517 …. 1R. Дои:10.1016 / j.cplett.2011.10.020.
- ^ Bernskoetter, W.H .; Schauer, C.K .; Goldberg, K.I .; Брукхарт, М. (2009). «Характеристика комплекса родия (I) σ-метана в растворе». Наука. 326 (5952): 553–556. Bibcode:2009Sci … 326..553B. Дои:10.1126 / science.1177485. PMID 19900892. S2CID 5597392.
- ^ Энергосодержание некоторых горючих материалов (в МДж / кг) В архиве 9 января 2014 г. Wayback Machine. People.hofstra.edu. Проверено 30 марта, 2014.
- ^ Марш, Джерри (1968). Развитие органической химии: реакции, механизмы и структура. Нью-Йорк: Книжная компания Макгроу-Хилл. С. 533–534.
- ^ «Компания Lumber Company размещает печи на полигоне для использования метана — сегодня менеджер по энергии». Энергоменеджер сегодня. Получено Одиннадцатое марта, 2016.
- ^ Корнелл, Клейтон Б. (29 апреля 2008 г.). «Автомобили, работающие на природном газе: топливо для КПГ почти бесплатно в некоторых частях страны». Архивировано из оригинал 20 января 2019 г.. Получено 25 июля, 2009.
Сжатый природный газ рекламируется как «наиболее чистое горючее» альтернативное топливо, поскольку простота молекулы метана снижает выбросы различных загрязняющих веществ в выхлопные трубы на 35–97%. Не столь драматично сокращение чистых выбросов парниковых газов, которое примерно такое же, как у этанола из кукурузного зерна, примерно на 20% по сравнению с бензином.
- ^ а б Thunnissen, Daniel P .; Guernsey, C. S .; Baker, R. S .; Мияке, Р. Н. (2004). «Продвинутое космическое топливо для исследования внешних планет». Американский институт аэронавтики и астронавтики (4–0799): 28.
- ^ «Двигатель Blue Origin BE-4». Получено 14 июня, 2019.
Мы выбрали СПГ, потому что он очень эффективен, дешев и широко доступен. В отличие от керосина, сжиженный природный газ можно использовать для создания избыточного давления в резервуаре. Это, известное как автогенное восстановление давления, устраняет необходимость в дорогостоящих и сложных системах, которые используют скудные запасы гелия на Земле. СПГ также обладает чистыми характеристиками сгорания даже при малом открытии дроссельной заслонки, что упрощает повторное использование двигателя по сравнению с керосиновым топливом.
- ^ Шмидт-Рор, Клаус (2015). «Почему процессы горения всегда экзотермичны, давая около 418 кДж на моль O2». Журнал химического образования. 92 (12): 2094–2099. Bibcode:2015JChEd..92.2094S. Дои:10.1021 / acs.jchemed.5b00333.
- ^ https://www.hydrogen.energy.gov/pdfs/hpep_report_2013.pdf
- ^ Россберг, М. и другие. (2006) «Хлорированные углеводороды» в Энциклопедия промышленной химии Ульмана, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a06_233.pub2
- ^ Кьетявяйнен и Пуркамо (2015). «Происхождение, источник и круговорот метана в биосфере глубоких кристаллических пород». Передний. Микробиол. 6: 725. Дои:10.3389 / fmicb.2015.00725. ЧВК 4505394. PMID 26236303.
- ^ Крамер и Франке (2005). «Признаки активной нефтегазовой системы в море Лаптевых, северо-восток Сибири». Журнал нефтяной геологии. 28 (4): 369–384. Bibcode:2005JPetG..28..369C. Дои:10.1111 / j.1747-5457.2005.tb00088.x.
- ^ Лесснер, Дэниел Дж. (Декабрь 2009 г.) Биохимия метаногенеза. В: eLS. John Wiley & Sons Ltd, Чичестер. http://www.els.net [DOI: 10.1002 / 9780470015902.a0000573.pub2]
- ^ Тиль, Фолькер (2018), «Цикл углерода метана в прошлом: выводы из биомаркеров углеводородов и липидов», в Wilkes, Heinz (ed.), Углеводороды, масла и липиды: разнообразие, происхождение, химия и судьба, Справочник по углеводородной и липидной микробиологии, Springer International Publishing, стр. 1–30, Дои:10.1007/978-3-319-54529-5_6-1, ISBN 9783319545295
- ^ а б c d Дин, Джошуа Ф .; Мидделбург, Джек Дж .; Рёкманн, Томас; Aerts, Rien; Blauw, Luke G .; Эггер, Матиас; Jetten, Mike S.M .; де Йонг, Анник Э. Э .; Мейзел, Уве Х. (2018). «Метановая обратная связь с глобальной климатической системой в более теплом мире». Обзоры геофизики. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. Дои:10.1002 / 2017RG000559. HDL:1874/366386.
- ^ Серрано-Силва, Н .; Sarria-Guzman, Y .; Dendooven, L .; Луна-Гвидо, М. (2014). «Метаногенез и метанотрофия в почве: обзор». Педосфера. 24 (3): 291–307. Дои:10.1016 / с1002-0160 (14) 60016-3.
- ^ Sirohi, S.K .; Панди, Неха; Singh, B .; Пуния, А. К. (1 сентября 2010 г.). «Метаногены рубца: обзор». Индийский журнал микробиологии. 50 (3): 253–262. Дои:10.1007 / s12088-010-0061-6. ISSN 0973-7715. ЧВК 3450062. PMID 23100838.
- ^ МГЭИК. Изменение климата 2013: основы физических наук В архиве 3 октября 2018 г. Wayback Machine. Программа ООН по окружающей среде, 2013: гл. 6, стр. 507 IPCC.ch
- ^ Лю, Чжэ; Шао, Нана; Акинеми, Тайво; Уитмен, Уильям Б. (2018). «Метаногенез». Текущая биология. 28 (13): R727 – R732. Дои:10.1016 / j.cub.2018.05.021. ISSN 0960-9822. PMID 29990451.
- ^ «Инвентаризация выбросов и стоков парниковых газов в США: 1990–2014 гг.». 2016.
- ^ ФАО (2006). Длинная тень домашнего скота — экологические проблемы и возможности. Рим, Италия: Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО).. Получено 27 октября, 2009.
- ^ Гербер, П.Дж .; Steinfeld, H .; Хендерсон, В .; Mottet, A .; Opio, C .; Dijkman, J .; Фалькуччи А. и Темпио Г. (2013). «Решение проблемы изменения климата с помощью животноводства». Рим: Продовольственная и сельскохозяйственная организация Объединенных Наций (ФАО).
- ^ Плотва, Джон (13 мая 2002 г.). «Новая Зеландия пытается ограничить газообразную отрыжку овец». Национальная география. Получено 2 марта, 2011.
- ^ Сильверман, Джейкоб (16 июля 2007 г.). «Коровы загрязняют столько же, сколько машины?». HowStuffWorks.com.
- ^ Knittel, K .; Wegener, G .; Боэтиус, А. (2019), МакГенити, Терри Дж. (Редактор), «Анаэробные окислители метана», Микробные сообщества, использующие углеводороды и липиды: члены, метагеномика и экофизиология, Справочник по углеводородной и липидной микробиологии, Springer International Publishing, стр. 1–21, Дои:10.1007/978-3-319-60063-5_7-1, ISBN 9783319600635
- ^ «Исследование обнаружило неожиданный источник выбросов метана в Арктике». НАСА. 22 апреля 2012 г.
- ^ МГЭИК Пятый оценочный отчет, Таблица 8.7, гл. 8, стр. 8–58 (PDF; 8,0 МБ)
- ^ Shindell, D.T .; Faluvegi, G .; Koch, D. M .; Schmidt, G.A .; Унгер, Н .; Бауэр, С. Э. (2009). «Улучшенная атрибуция воздействия климата на выбросы». Наука. 326 (5953): 716–718. Bibcode:2009Sci … 326..716S. Дои:10.1126 / science.1174760. PMID 19900930. S2CID 30881469.
- ^ Нисбет, Э. (5 февраля 2019 г.). «Очень сильный рост содержания метана в атмосфере за 4 года 2014–2017 гг .: последствия для Парижского соглашения». Глобальные биогеохимические циклы. 33 (3): 318–342. Bibcode:2019GBioC..33..318N. Дои:10.1029 / 2018GB006009.
- ^ Маккай, Робин (2 февраля 2017 г.). «Резкое повышение уровня метана угрожает мировым климатическим целям». Наблюдатель. ISSN 0029-7712. Получено 14 июля, 2019.
- ^ Челси Харви Выбросы метана от нефти и газа могут быть значительно занижены; Оценки выбросов метана из природных источников были слишком завышены, что перекладывает бремя на деятельность человека. Новости E&E через Scientific American 21 февраля 2020 г.
- ^ Кэррингтон, Дамиан, Первая активная утечка метана с морского дна обнаружена в Антарктиде, The Guardian, 21 июля 2020 г.
- ^ Борманн, Герхард; Торрес, Марта Э. (2006), Шульц, Хорст Д .; Забель, Маттиас (ред.), «Газовые гидраты в морских отложениях», Морская геохимия, Springer Berlin Heidelberg, стр. 481–512, Дои:10.1007/3-540-32144-6_14, ISBN 9783540321446
- ^ Миллер, Дж. Тайлер (2007). Поддержание Земли: комплексный подход. США: Thomson Advantage Books, ISBN 0534496725, п. 160.
- ^ Дин, Дж. Ф. (2018). «Обратная связь метана с глобальной климатической системой в более теплом мире». Обзоры геофизики. 56 (1): 207–250. Bibcode:2018RvGeo..56..207D. Дои:10.1002 / 2017RG000559. HDL:1874/366386.
- ^ Босуэлл, Рэй; Коллетт, Тимоти С. (2011). «Современные перспективы газовых гидратных ресурсов». Energy Environ. Наука. 4 (4): 1206–1215. Дои:10.1039 / c0ee00203h. ISSN 1754-5692.
- ^ а б Руппель и Кесслер (2017). «Взаимодействие изменения климата и гидратов метана». Обзоры геофизики. 55 (1): 126–168. Bibcode:2017RvGeo..55..126R. Дои:10.1002 / 2016RG000534.CS1 maint: использует параметр авторов (связь)
- ^ «В Северном Ледовитом океане обнаружен новый источник метана». Phys.org. 1 мая 2015 г.. Получено 10 апреля, 2019.
- ^ «Выбросы метана с арктического шельфа могут быть намного больше и быстрее, чем предполагалось» (Пресс-релиз). Национальный научный фонд (NSF). 10 марта 2010 г.
- ^ Коннор, Стив (13 декабря 2011 г.). «Огромные метановые« шлейфы »в Северном Ледовитом океане при отступлении морского льда». Независимый.
- ^ «Морской лед в Арктике достигает минимальной протяженности за год и спутниковый рекорд» (Пресс-релиз). Национальный центр данных по снегу и льду (NSIDC). 19 сентября 2012 г.
- ^ «Границы 2018/19: Новые проблемы, вызывающие озабоченность окружающей средой». ООН Окружающая среда. Получено 6 марта, 2019.
- ^ Reuters (18 июня 2019 г.). «Ученые шокированы таянием вечной мерзлоты в Арктике на 70 лет раньше, чем предполагалось». Хранитель. ISSN 0261-3077. Получено 14 июля, 2019.
- ^ а б Зубрин, Р. М .; Muscatello, A.C .; Берггрен, М. (2013). «Интегрированная система производства ракетного топлива Mars in situ». Журнал аэрокосмической техники. 26: 43–56. Дои:10.1061 / (ASCE) AS.1943-5525.0000201.
- ^ «Метановый взрыв». НАСА. 4 мая 2007 г.. Получено 7 июля, 2012.
- ^ Чанг, Кеннет (2 ноября 2012 г.). «Надежда на метан на Марсе угасает». Нью-Йорк Таймс. Получено 3 ноября, 2012.
- ^ Атрея, Сушил К .; Mahaffy, Paul R .; Вонг, Ах-Сан (2007). «Метан и родственные ему микроорганизмы на Марсе: происхождение, потеря, значение для жизни и обитаемости». Планетарная и космическая наука. 55 (3): 358–369. Bibcode:2007P & SS … 55..358A. Дои:10.1016 / j.pss.2006.02.005.CS1 maint: использует параметр авторов (связь)
- ^ Браун, Дуэйн; Вендел, Джоанна; Стейгервальд, Билл; Джонс, Нэнси; Хорошо, Андрей (7 июня 2018 г.). «Выпуск 18-050 — НАСА обнаружило на Марсе древний органический материал, таинственный метан». НАСА. Получено 7 июня, 2018.
- ^ НАСА (7 июня 2018 г.). «На Марсе обнаружена древняя органика — видео (03:17)». НАСА. Получено 7 июня, 2018.
- ^ Уолл, Майк (7 июня 2018 г.). «Марсоход Curiosity находит на Марсе древние« строительные блоки для жизни »». Space.com. Получено 7 июня, 2018.
- ^ Чанг, Кеннет (7 июня 2018 г.). «Жизнь на Марсе? Последнее открытие марсохода ставит ее« на стол »- идентификация органических молекул в породах на красной планете не обязательно указывает на жизнь там, в прошлом или настоящем, но указывает на то, что некоторые из строительных блоков присутствовали. «. Нью-Йорк Таймс. Получено 8 июня, 2018.
- ^ Воозен, Пол (7 июня 2018 г.). «Марсоход НАСА попадает в органическую почву на Марсе». Наука. Дои:10.1126 / science.aau3992. Получено 7 июня, 2018.
- ^ десять Кейт, Инге Лоэс (8 июня 2018 г.). «Органические молекулы на Марсе». Наука. 360 (6393): 1068–1069. Bibcode:2018Научный … 360.1068T. Дои:10.1126 / science.aat2662. PMID 29880670. S2CID 46952468.
- ^ Вебстер, Кристофер Р.; и другие. (8 июня 2018 г.). «Фоновые уровни метана в атмосфере Марса сильно зависят от сезона». Наука. 360 (6393): 1093–1096. Bibcode:2018Sci … 360.1093W. Дои:10.1126 / science.aaq0131. PMID 29880682.
- ^ Eigenbrode, Jennifer L .; и другие. (8 июня 2018 г.). «Органическое вещество сохранилось в аргиллитах возрастом 3 миллиарда лет в кратере Гейла на Марсе». Наука. 360 (6393): 1096–1101. Bibcode:2018Научный … 360.1096E. Дои:10.1126 / science.aas9185. PMID 29880683.
- ^ Ричардсон, Дерек (27 сентября 2016 г.). «Илон Маск демонстрирует межпланетную транспортную систему». Spaceflight Insider. Получено 3 октября, 2016.
- ^ Oze, C .; Шарма, М. (2005). «Есть оливин, будет газ: серпентинизация и абиогенное производство метана на Марсе». Письма о геофизических исследованиях. 32 (10): L10203. Bibcode:2005GeoRL..3210203O. Дои:10.1029 / 2005GL022691.
- ^ Вольта, Алессандро (1777) Lettere del Signor Don Alessandro Volta … Sull ‘Aria Inflammable Nativa Delle Paludi [Письма синьора дона Алессандро Вольта … о горючем родном воздухе болот], Милан, Италия: Джузеппе Марелли.
- ^ а б Метан. Книга. Получено 26 января, 2012.
- ^ Видеть:
- А. В. Хофманн (1866 г.) «О действии трихлорида фосфора на соли ароматических моноаминов», Труды Лондонского королевского общества, 15 : 55–62; см. сноску на стр. 57–58.
- Джеймс Майкл Макбрайд (1999) «Разработка систематических названий простых алканов». Доступно на сайте Химический факультет Йельского университета (Нью-Хейвен, Коннектикут). В архиве 16 марта 2012 г. Wayback Machine
- ^ Джаясундара, Сусанта (3 декабря 2014 г.). «Есть ли разница в выражении парниковых газов в виде CH4 кг / га и CH4-C кг / га?». ResearchGate. Получено 26 августа, 2020.
- ^ «Руководство пользователя по оценке выбросов углекислого газа, метана и оксида азота в сельском хозяйстве с использованием инструмента государственной инвентаризации» (PDF). Агентство по охране окружающей среды США. 26 ноября 2019 г.,. Получено 26 августа, 2020.
- ^ «Что означает CH4-C? — Определение CH4-C — CH4-C означает соотношение метан-углерод». acronymsandslang.com. Получено 26 августа, 2020.
- ^ Управление по воздуху и радиации, Агентство по охране окружающей среды США (7 октября 1999 г.). «Выбросы метана в США с 1990 по 2020 годы: инвентаризация, прогнозы и возможности для сокращения (EPA 430-R-99-013)» (PDF). ourenergypolicy.org. Получено 26 августа, 2020.
- ^ Дозольм, Филипп. «Обычные горные аварии». About.com.
- ^ Лоуренс Мессина и Грег Блюстайн (8 апреля 2010 г.). «Представитель ФРС: еще слишком рано для спасения шахты W.Va.». News.yahoo.com. Получено 8 апреля, 2010.
внешняя ссылка
- Метан в Периодическая таблица видео (Ноттингемский университет)
- Международная карта химической безопасности 0291
- Газ (метан) гидраты — новые рубежи — Геологическая служба США
- Лансфорд, Джек Х. (2000). «Каталитическая конверсия метана в более полезные химические вещества и топливо: задача 21 века». Катализ сегодня. 63 (2–4): 165–174. Дои:10.1016 / S0920-5861 (00) 00456-9.
- CDC — Справочник по контролю за метаном в горнодобывающей промышленности