Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
[▼]
|
Применить к найденному
Гидрид калия
Брутто-формула:
HK
CAS# 7693-26-7
Категории:
Гидриды
PubChem CID: 82127
Названия
Русский:
- Гидрид калия
Варианты формулы:
KH
K(+1)H(-1)
K^+_(x1.4,H)H^-
Химический состав
Реакции, в которых участвует Гидрид калия
-
{M}H + H2O -> {M}OH + H2″|^»
, где M =
Na K Li Rb Cs -
CH3CH2OH + {M}H -> CH3CH2O{M} + H2″|^»
, где M =
Na K -
KH + CO2 -> HCOOK
-
{M}H + CO2 -> HCOO{M}
, где M =
Li Na K Rb Cs -
KH + NH3 «300^oC»—> KNH2 + H2
| Гидрид калия | |
|---|---|
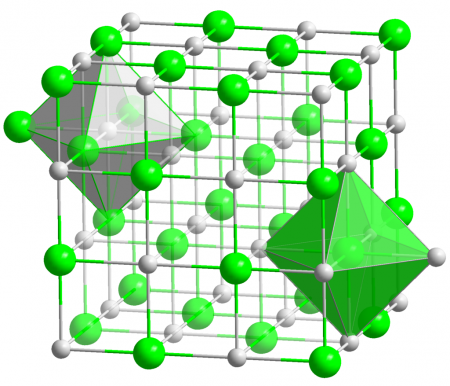 K+ H− K+ H− |
|
| Систематическое наименование |
калия гидрид |
| Хим. формула | KH |
| Рац. формула | HK |
| Состояние | белое твердое вещество |
| Молярная масса | 40.1062 г/моль |
| Плотность | 1.47 г/см³ |
| Температура | |
| • плавления | 400 °C |
| Мол. теплоёмк. | 37,91 Дж/(моль·К) |
| Энтальпия | |
| • образования | -57,82 кДж/моль |
| Растворимость | |
| • в веществах | бензол: не растворим
вода: реагирует диэтиловый эфир: не растворим сероуглерод: не растворим этанол: реагирует |
| Кристаллическая структура | кубическая, пространственная группа Fm3m |
| Рег. номер CAS | 7693-26-7 |
| PubChem | 82127 |
| Рег. номер EINECS | 231-704-8 |
| SMILES |
[H-].[K+] |
| InChI |
1S/K.H/q+1;-1 OCFVSFVLVRNXFJ-UHFFFAOYSA-N |
| ChEBI | 32589 |
| ChemSpider | 74121 |
| Пиктограммы ECB | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH.
Физические свойства
Гидрид калия образует бесцветные ионные кристаллы кубической сингонии с решеткой типа NaCl (a = 0.57 нм). Хорошо растворим в расплавленном калии, не растворяется в органических растворителях. Обладает высокой теплопроводностью.
Химические свойства
Гидрид калия является ионным соединением K+H−. Его расплав проводит электрический ток, при электролизе на аноде выделяется водород.
Вещество нестабильно и при нагревании распадается на компоненты:
- 2KH →400oC,vacuum 2K + H2
Гидрид калия обладает высокой химической активностью, является сильным восстановителем. Окисляется кислородом:
- 2KH + O2 →200oC 2KOH
Взаимодействует с водой:
- KH + H2O → KOH + H2↑
кислотами:
- KH + HCl → KCl + H2↑
спиртами:
- KH + HO−R → KOR + H2↑
и газообразным аммиаком:
- KH + NH3 →300oC KNH2 + H2↑
Взаимодействует с галогенами:
- KH + Cl2 →400oC KCl + HCl↑
С углекислотой образует формиат калия:
- KH + CO2 →150oC,p K(HCOO)
Взаимодействует с оксидом кремния:
- 4KH + 3SiO2 →500oC 2K2SiO3 + Si + 2H2
Получение
Гидрид калия получают прямой реакцией расплавленного калия с водородом под давлением:
- 2K + H2 →200−350oC,p 2KH
Эта реакция была открыта Гемфри Дэви вскоре после его открытия в 1807 году калия, когда он отметил, что металл будет испаряться в токе водорода при нагревании только ниже точки кипения.
Токсичность
Едкое вещество, разъедает органические вещества. Огнеопасно.
Физические свойства
Гидрид калия KH — неорганическое бинарное соединение щелочного металла калия и водорода. Белое кристаллическое вещество. При нагревании разлагается, под избыточным давлением плавится без разложения.
Относительная молекулярная масса Mr = 40,11; относительная плотность для тв. и ж. состояния d = 1,43; tпл ≈ 400º C при избыточном давлении
Способ получения
Гидрид калия получают реакцией взаимодействия калия и водорода при 200–350º C:
2K + H2 = 2KH
Химические свойства
1. Гидрид калия — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами.
1.1. При взаимодействии с кислородом при температуре выше 200º C гидрид калия образует гидроксид калия:
2KH + O2 = 2KOH
1.2. При температуре 400–450º C гидрид калия взаимодействует с хлором, образуя хлорид калия и хлороводород:
KH + Cl2 = KCl + HCl
2. Гидрид калия взаимодействует со сложными веществами:
2.1. При взаимодействии с водой гидрид калия образует гидроксид калия и газ водород:
KH + H2O = KOH + H2↑
2.2. С разбавленной хлороводородной кислотой гидрид калия реагирует с образованием хлорида калия и газа водорода:
KH + HCl = KCl + H2↑
2.3. Гидрид калия реагирует с газом аммиаком при t = 300º C с образованием нитрида калия и водорода:
KH + NH3 = KNH2 + H2
3. Гидрид калия разлагается при температуре 400º C и вакууме, с образованием калия и водорода:
2KH = 2K + H2
Admin2
From Wikipedia, the free encyclopedia
|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.823 |
| EC Number |
|
|
PubChem CID |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KH |
| Molar mass | 40.1062 g/mol |
| Appearance | white to gray crystalline powder |
| Density | 1.43 g/cm3[1] |
| Melting point | decomposes at ~400 °C[2] |
|
Solubility in water |
reacts |
| Solubility | insoluble in benzene, diethyl ether, carbon disulfide |
| Structure | |
|
Crystal structure |
cubic, cF8 |
|
Space group |
Fm3m, No. 225 |
| Thermochemistry | |
|
Heat capacity (C) |
37.91 J/(mol⋅K) |
|
Std enthalpy of |
-57.82 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
very corrosive, pyrophoric in air, and reacts violently with acids |
| NFPA 704 (fire diamond) |
3 3 2
|
| Related compounds | |
|
Other cations |
Lithium hydride Sodium hydride Rubidium hydride Caesium hydride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium hydride, KH, is the inorganic compound of potassium and hydrogen. It is an alkali metal hydride. It is a white solid, although commercial samples appear gray. It is a powerful superbase that is useful in organic synthesis. It is sold commercially as a slurry (~35%) in mineral oil or sometimes paraffin wax to facilitate dispensing.[3]
Preparation[edit]
Potassium hydride is produced by direct combination of the metal and hydrogen:
- 2 K + H2 → 2 KH
This reaction was discovered by Humphry Davy soon after his 1807 discovery of potassium, when he noted that the metal would vaporize in a current of hydrogen when heated just below its boiling point.[4]: p.25
Potassium hydride is soluble in fused hydroxides (such as molten sodium hydroxide) and salt mixtures, but not in organic solvents.[5]
Reactions[edit]
KH reacts with water according to the reaction:
- KH + H2O → KOH + H2
As a superbase, potassium hydride is more basic than sodium hydride. It is used to deprotonate certain carbonyl compounds to give enolates. It also deprotonates amines to give the corresponding amides of the type KNHR and KNR2.[6]
Safety[edit]
KH can be pyrophoric in air, react violently with acids, and can ignite upon contact with oxidants. As a suspension in mineral oil, KH is less dangerous.
See also[edit]
- Sodium hydride
References[edit]
- ^ Robert E. Gawley, Xiaojie Zhang, Qunzhao Wang, «Potassium Hydride» Encyclopedia of Reagents for Organic Synthesis 2007 John Wiley & Sons. doi:10.1002/047084289X.rp223.pub2
- ^ David Arthur Johnson; Open University (12 August 2002). Metals and chemical change. Royal Society of Chemistry. pp. 167–. ISBN 978-0-85404-665-2. Retrieved 1 November 2011.
- ^ Douglass F. Taber, Christopher G. Nelson (2006). «Potassium Hydride in Paraffin: A Useful Base for Organic Synthesis». J. Org. Chem. 71 (23): 8973–8974. doi:10.1021/jo061420v. PMC 3248818. PMID 17081034.
- ^ Humphry Davy (1808), The Bakerian Lecture on some new phenomena of chemical changes produced by electricity, particularly the decomposition of fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies. Philosophical Transactions of the Royal Society, volume 88, pages 1–44. In The Development of Chemistry, 1789–1914: Selected essays, edited by D. Knight, pp. 17–47.
- ^ Pradyot Patnaik (1 July 2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances. John Wiley and Sons. pp. 631–. ISBN 978-0-470-13494-8. Retrieved 1 November 2011.
- ^ Charles A. Brown, Prabhakav K. Jadhav (1925). «(−)-α-Pinene by Isomerization of (−)-β-Pinene». Organic Syntheses. 65: 224.; Collective Volume, vol. 8, p. 553
From Wikipedia, the free encyclopedia

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.823 |
| EC Number |
|
|
PubChem CID |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
KH |
| Molar mass | 40.1062 g/mol |
| Appearance | white to gray crystalline powder |
| Density | 1.43 g/cm3[1] |
| Melting point | decomposes at ~400 °C[2] |
|
Solubility in water |
reacts |
| Solubility | insoluble in benzene, diethyl ether, carbon disulfide |
| Structure | |
|
Crystal structure |
cubic, cF8 |
|
Space group |
Fm3m, No. 225 |
| Thermochemistry | |
|
Heat capacity (C) |
37.91 J/(mol⋅K) |
|
Std enthalpy of |
-57.82 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
very corrosive, pyrophoric in air, and reacts violently with acids |
| NFPA 704 (fire diamond) |
3 3 2
|
| Related compounds | |
|
Other cations |
Lithium hydride Sodium hydride Rubidium hydride Caesium hydride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium hydride, KH, is the inorganic compound of potassium and hydrogen. It is an alkali metal hydride. It is a white solid, although commercial samples appear gray. It is a powerful superbase that is useful in organic synthesis. It is sold commercially as a slurry (~35%) in mineral oil or sometimes paraffin wax to facilitate dispensing.[3]
Preparation[edit]
Potassium hydride is produced by direct combination of the metal and hydrogen:
- 2 K + H2 → 2 KH
This reaction was discovered by Humphry Davy soon after his 1807 discovery of potassium, when he noted that the metal would vaporize in a current of hydrogen when heated just below its boiling point.[4]: p.25
Potassium hydride is soluble in fused hydroxides (such as molten sodium hydroxide) and salt mixtures, but not in organic solvents.[5]
Reactions[edit]
KH reacts with water according to the reaction:
- KH + H2O → KOH + H2
As a superbase, potassium hydride is more basic than sodium hydride. It is used to deprotonate certain carbonyl compounds to give enolates. It also deprotonates amines to give the corresponding amides of the type KNHR and KNR2.[6]
Safety[edit]
KH can be pyrophoric in air, react violently with acids, and can ignite upon contact with oxidants. As a suspension in mineral oil, KH is less dangerous.
See also[edit]
- Sodium hydride
References[edit]
- ^ Robert E. Gawley, Xiaojie Zhang, Qunzhao Wang, «Potassium Hydride» Encyclopedia of Reagents for Organic Synthesis 2007 John Wiley & Sons. doi:10.1002/047084289X.rp223.pub2
- ^ David Arthur Johnson; Open University (12 August 2002). Metals and chemical change. Royal Society of Chemistry. pp. 167–. ISBN 978-0-85404-665-2. Retrieved 1 November 2011.
- ^ Douglass F. Taber, Christopher G. Nelson (2006). «Potassium Hydride in Paraffin: A Useful Base for Organic Synthesis». J. Org. Chem. 71 (23): 8973–8974. doi:10.1021/jo061420v. PMC 3248818. PMID 17081034.
- ^ Humphry Davy (1808), The Bakerian Lecture on some new phenomena of chemical changes produced by electricity, particularly the decomposition of fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies. Philosophical Transactions of the Royal Society, volume 88, pages 1–44. In The Development of Chemistry, 1789–1914: Selected essays, edited by D. Knight, pp. 17–47.
- ^ Pradyot Patnaik (1 July 2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances. John Wiley and Sons. pp. 631–. ISBN 978-0-470-13494-8. Retrieved 1 November 2011.
- ^ Charles A. Brown, Prabhakav K. Jadhav (1925). «(−)-α-Pinene by Isomerization of (−)-β-Pinene». Organic Syntheses. 65: 224.; Collective Volume, vol. 8, p. 553
| Гидрид калия | |
|---|---|
 K+ H− K+ H− |
|
| Общие | |
| Систематическое наименование |
калия гидрид |
| Хим. формула | KH |
| Рац. формула | HK |
| Физические свойства | |
| Состояние | белое твердое вещество |
| Молярная масса | 40.1062 г/моль |
| Плотность | 1.47 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 400 °C |
| Мол. теплоёмк. | 37,91 Дж/(моль·К) |
| Энтальпия | |
| • образования | -57,82 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в веществах |
бензол: не растворим вода: реагирует диэтиловый эфир: не растворим сероуглерод: не растворим этанол: реагирует[1] |
| Структура | |
| Кристаллическая структура | кубическая, пространственная группа Fm3m |
| Классификация | |
| Рег. номер CAS | 7693-26-7 |
| Безопасность | |
| Пиктограммы ECB |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH.
Физические свойства
Гидрид калия образует бесцветные ионные кристаллы кубической сингонии с решеткой типа NaCl (a = 0.57 нм).
Хорошо растворим в расплавленном калии, не растворяется в органических растворителях.
Обладает высокой теплопроводностью.
Химические свойства
Гидрид калия является ионным соединением K+H−.
Его расплав проводит электрический ток, при электролизе на аноде выделяется водород.
Вещество нестабильно и при нагревании распадается на компоненты:
- [math]displaystyle{ mathsf{2KH xrightarrow{400^oC, vacuum} 2K+H_2 } }[/math]
Гидрид калия обладает высокой химической активностью, является сильным восстановителем.
Окисляется кислородом:
- [math]displaystyle{ mathsf{2KH + O_2 xrightarrow{200^oC} 2KOH } }[/math]
Взаимодействует с водой:
- [math]displaystyle{ mathsf{KH + H_2O xrightarrow{} KOH + H_2uparrow } }[/math]
кислотами:
- [math]displaystyle{ mathsf{KH + HCl xrightarrow{} KCl + H_2uparrow } }[/math]
спиртами:
- [math]displaystyle{ mathsf{KH + HO-R xrightarrow{} KOR + H_2uparrow } }[/math]
и газообразным аммиаком:
- [math]displaystyle{ mathsf{KH + NH_3 xrightarrow{300^oC} KNH_2 + H_2uparrow } }[/math]
Взаимодействует с галогенами:
- [math]displaystyle{ mathsf{KH + Cl_2 xrightarrow{400^oC} KCl + HCluparrow } }[/math]
С углекислотой образует формиат калия:
- [math]displaystyle{ mathsf{KH + CO_2 xrightarrow{150^oC, mathit{p}} K(HCOO) } }[/math]
Взаимодействует с оксидом кремния:
- [math]displaystyle{ mathsf{4KH + 3SiO_2 xrightarrow{500^oC} 2K_2SiO_3 + Si + 2H_2 } }[/math]
Получение
Гидрид калия получают прямой реакцией расплавленного калия с водородом под давлением:
- [math]displaystyle{ mathsf{2K+H_2 xrightarrow{200-350^oC, mathit{p}} 2KH} }[/math]
Эта реакция была открыта Гемфри Дэви вскоре после его открытия в 1807 году калия, когда он отметил, что металл будет испаряться в токе водорода при нагревании только ниже точки кипения.
Токсичность
Едкое вещество, разъедает органические вещества. Огнеопасно.
См. также
- Гидрид-ион
- Гидрид натрия
- Калий
Примечания
- ↑ [www.xumuk.ru/spravochnik/507.html Сайт XuMuK.ru]. Дата обращения: 30 марта 2010.
| Гидрид калия | |
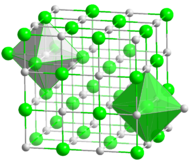 __ K+ __ H− |
|
| Общие | |
|---|---|
| Систематическое наименование | калия гидрид |
| Химическая формула | KH |
| Эмпирическая формула | HK |
| Физические свойства | |
| Состояние (ст. усл.) | белое твердое вещество |
| Молярная масса | 40.1062 г/моль |
| Плотность | 1.47 г/см³ |
| Термические свойства | |
| Температура плавления | 400 °C |
| Молярная теплоёмкость (ст. усл.) | 37,91 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -57,82 кДж/моль |
| Химические свойства | |
| Растворимость в веществах | бензол: не растворим
вода: реагирует диэтиловый эфир: не растворим сероуглерод: не растворим этанол: реагирует[1] г/100 мл |
| Структура | |
| Кристаллическая структура | кубическая, пространственная группа Fm3m |
| Классификация | |
| Рег. номер CAS | 7693-26-7 |
| Регистрационный номер EC | 232-151-5 |
| Безопасность | |
| Токсичность |   |
Гидрид калия — это неорганическое бинарное химическое соединение белого цвета. Химическая формула KH.
Физические свойства
Гидрид калия образует бесцветные ионные кристаллы кубической сингонии с решеткой типа NaCl (a = 0.57 нм). Хорошо растворим в расплавленном калии, не растворяется в органических растворителях. Обладает высокой теплопроводностью.
Химические свойства
Гидрид калия является ионным соединением K+H−. Его расплав проводит электрический ток, при электролизе на аноде выделяется водород. С химической точки зрения гидрид калия это соль несуществующей «водородистой» кислоты.
Вещество нестабильно и при нагревании распадается на компоненты:
Гидрид калия обладает высокой химической активностью, является сильным восстановителем. Окисляется кислородом:
Взаимодействует с водой:
кислотами:
спиртами:
и газообразным аммиаком:
Взаимодействует с галогенами:
С углекислотой образует формиат калия:
Взаимодействует с оксидом кремния:
Получение
Гидрид калия получают прямой реакцией расплавленного калия с водородом под давлением:
Эта реакция была открыта Гемфри Дэви вскоре после его открытия в 1807 году калия, когда он отметил, что металл будет испаряться в токе водорода при нагревании только ниже точки кипения.
См.также
- Гидрид-ион
- Гидрид натрия
- Калий
Примечания
- ↑ Сайт XuMuK.ru. Архивировано из первоисточника 21 апреля 2012. Проверено 30 марта 2010.











