From Wikipedia, the free encyclopedia
|
|
|
|
| Names | |
|---|---|
| IUPAC name
Magnesium hydride |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.824 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgH2 |
| Molar mass | 26.3209 g/mol |
| Appearance | white crystals |
| Density | 1.45 g/cm3 |
| Melting point | 327 °C (621 °F; 600 K) decomposes |
|
Solubility in water |
decomposes |
| Solubility | insoluble in ether |
| Structure | |
|
Crystal structure |
tetragonal |
| Thermochemistry | |
|
Heat capacity (C) |
35.4 J/mol K |
|
Std molar |
31.1 J/mol K |
|
Std enthalpy of |
-75.2 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-35.9 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
pyrophoric[1] |
| Related compounds | |
|
Other cations |
Beryllium hydride Calcium hydride Strontium hydride Barium hydride |
|
Related Magnesium hydrides |
Magnesium monohydride Mg4H6 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium hydride is the chemical compound with the molecular formula MgH2. It contains 7.66% by weight of hydrogen and has been studied as a potential hydrogen storage medium.[2]
Preparation[edit]
In 1951 preparation from the elements was first reported involving direct hydrogenation of Mg metal at high pressure and temperature (200 atmospheres, 500 °C) with MgI2 catalyst:[3]
- Mg + H2 → MgH2
Lower temperature production from Mg and H2 using nano crystalline Mg produced in ball mills has been investigated.[4] Other preparations include:
- the hydrogenation of magnesium anthracene under mild conditions:[5]
- Mg(anthracene) + H2 → MgH2
- the reaction of diethylmagnesium with lithium aluminium hydride[6]
- product of complexed MgH2 e.g. MgH2.THF by the reaction of phenylsilane and dibutyl magnesium in ether or hydrocarbon solvents in the presence of THF or TMEDA as ligand.[1]
Structure and bonding[edit]
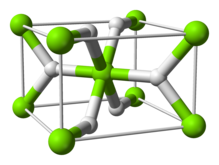
The room temperature form α-MgH2 has a rutile structure.[7] There are at least four high pressure forms: γ-MgH2 with α-PbO2 structure,[8] cubic β-MgH2 with Pa-3 space group,[9] orthorhombic HP1 with Pbc21 space group and orthorhombic HP2 with Pnma space group.[10] Additionally a non stoichiometric MgH(2-δ) has been characterised, but this appears to exist only for very small particles[11]
(bulk MgH2 is essentially stoichiometric, as it can only accommodate very low concentrations of H vacancies[12]).
The bonding in the rutile form is sometimes described as being partially covalent in nature rather than purely ionic;[13] charge density determination by synchrotron x-ray diffraction indicates that the magnesium atom is fully ionised and spherical in shape and the hydride ion is elongated.[14]
Molecular forms of magnesium hydride, MgH, MgH2, Mg2H, Mg2H2, Mg2H3, and Mg2H4 molecules identified by their vibrational spectra have been found in matrix isolated samples at below 10 K, formed following laser ablation of magnesium in the presence of hydrogen.[15] The Mg2H4 molecule has a bridged structure analogous to dimeric aluminium hydride, Al2H6.[15]
Reactions[edit]
MgH2 readily reacts with water to form hydrogen gas:
- MgH2 + 2 H2O → 2 H2 + Mg(OH)2
At 287 °C it decomposes to produce H2 at 1 bar pressure.[16] The high temperature required is seen as a limitation in the use of MgH2 as a reversible hydrogen storage medium:[17]
- MgH2 → Mg + H2
References[edit]
- ^ a b Michalczyk, Michael J (1992). «Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium». Organometallics. 11 (6): 2307–2309. doi:10.1021/om00042a055.
- ^ Bogdanovic, Borislav (1985). «Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides — Applications in Organic Synthesis and Hydrogen Storage». Angewandte Chemie International Edition in English. 24 (4): 262–273. doi:10.1002/anie.198502621.
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). «Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)» (PDF). Zeitschrift für Naturforschung B. 6b: 394.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Zaluska, A; Zaluski, L; Ström–Olsen, J.O (1999). «Nanocrystalline magnesium for hydrogen storage». Journal of Alloys and Compounds. 288 (1–2): 217–225. doi:10.1016/S0925-8388(99)00073-0.
- ^ Bogdanovi?, Borislav; Liao, Shih-Tsien; Schwickardi, Manfred; Sikorsky, Peter; Spliethoff, Bernd (1980). «Catalytic Synthesis of Magnesium Hydride under Mild Conditions». Angewandte Chemie International Edition in English. 19 (10): 818. doi:10.1002/anie.198008181.
- ^ Barbaras, Glenn D; Dillard, Clyde; Finholt, A. E; Wartik, Thomas; Wilzbach, K. E; Schlesinger, H. I (1951). «The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride1». Journal of the American Chemical Society. 73 (10): 4585. doi:10.1021/ja01154a025.
- ^ Zachariasen, W. H; Holley, C. E; Stamper, J. F (1963). «Neutron diffraction study of magnesium deuteride». Acta Crystallographica. 16 (5): 352. doi:10.1107/S0365110X63000967.
- ^ Bortz, M; Bertheville, B; Böttger, G; Yvon, K (1999). «Structure of the high pressure phase γ-MgH2 by neutron powder diffraction». Journal of Alloys and Compounds. 287 (1–2): L4–L6. doi:10.1016/S0925-8388(99)00028-6.
- ^ Vajeeston, P; Ravindran, P; Hauback, B. C; Fjellvåg, H; Kjekshus, A; Furuseth, S; Hanfland, M (2006). «Structural stability and pressure-induced phase transitions inMgH2». Physical Review B. 73 (22): 224102. Bibcode:2006PhRvB..73v4102V. doi:10.1103/PhysRevB.73.224102.
- ^ Moriwaki, Toru; Akahama, Yuichi; Kawamura, Haruki; Nakano, Satoshi; Takemura, Kenichi (2006). «Structural Phase Transition of Rutile-Type MgH2at High Pressures». Journal of the Physical Society of Japan. 75 (7): 074603. Bibcode:2006JPSJ…75g4603M. doi:10.1143/JPSJ.75.074603.
- ^ Schimmel, H. Gijs; Huot, Jacques; Chapon, Laurent C; Tichelaar, Frans D; Mulder, Fokko M (2005). «Hydrogen Cycling of Niobium and Vanadium Catalyzed Nanostructured Magnesium». Journal of the American Chemical Society. 127 (41): 14348–54. doi:10.1021/ja051508a. PMID 16218629.
- ^ Grau-Crespo, R.; K. C. Smith; T. S. Fisher; N. H. de Leeuw; U. V. Waghmare (2009). «Thermodynamics of hydrogen vacancies in MgH2 from first-principles calculations and grand-canonical statistical mechanics». Physical Review B. 80 (17): 174117. arXiv:0910.4331. Bibcode:2009PhRvB..80q4117G. doi:10.1103/PhysRevB.80.174117. S2CID 32342746.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Noritake, T; Towata, S; Aoki, M; Seno, Y; Hirose, Y; Nishibori, E; Takata, M; Sakata, M (2003). «Charge density measurement in MgH2 by synchrotron X-ray diffraction». Journal of Alloys and Compounds. 356–357: 84–86. doi:10.1016/S0925-8388(03)00104-X.
- ^ a b Wang, Xuefeng; Andrews, Lester (2004). «Infrared Spectra of Magnesium Hydride Molecules, Complexes, and Solid Magnesium Dihydride». The Journal of Physical Chemistry A. 108 (52): 11511. Bibcode:2004JPCA..10811511W. doi:10.1021/jp046410h.
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (illustrated ed.). Springer. p. 65. ISBN 978-1-349-02635-7. Extract of page 65
- ^ Schlapbach, Louis; Züttel, Andreas (2001). «Hydrogen-storage materials for mobile applications» (PDF). Nature. 414 (6861): 353–8. Bibcode:2001Natur.414..353S. doi:10.1038/35104634. PMID 11713542. S2CID 3025203.
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Magnesium hydride |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.824 |
| EC Number |
|
|
PubChem CID |
|
| UNII |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
MgH2 |
| Molar mass | 26.3209 g/mol |
| Appearance | white crystals |
| Density | 1.45 g/cm3 |
| Melting point | 327 °C (621 °F; 600 K) decomposes |
|
Solubility in water |
decomposes |
| Solubility | insoluble in ether |
| Structure | |
|
Crystal structure |
tetragonal |
| Thermochemistry | |
|
Heat capacity (C) |
35.4 J/mol K |
|
Std molar |
31.1 J/mol K |
|
Std enthalpy of |
-75.2 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-35.9 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
pyrophoric[1] |
| Related compounds | |
|
Other cations |
Beryllium hydride Calcium hydride Strontium hydride Barium hydride |
|
Related Magnesium hydrides |
Magnesium monohydride Mg4H6 |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Magnesium hydride is the chemical compound with the molecular formula MgH2. It contains 7.66% by weight of hydrogen and has been studied as a potential hydrogen storage medium.[2]
Preparation[edit]
In 1951 preparation from the elements was first reported involving direct hydrogenation of Mg metal at high pressure and temperature (200 atmospheres, 500 °C) with MgI2 catalyst:[3]
- Mg + H2 → MgH2
Lower temperature production from Mg and H2 using nano crystalline Mg produced in ball mills has been investigated.[4] Other preparations include:
- the hydrogenation of magnesium anthracene under mild conditions:[5]
- Mg(anthracene) + H2 → MgH2
- the reaction of diethylmagnesium with lithium aluminium hydride[6]
- product of complexed MgH2 e.g. MgH2.THF by the reaction of phenylsilane and dibutyl magnesium in ether or hydrocarbon solvents in the presence of THF or TMEDA as ligand.[1]
Structure and bonding[edit]
The room temperature form α-MgH2 has a rutile structure.[7] There are at least four high pressure forms: γ-MgH2 with α-PbO2 structure,[8] cubic β-MgH2 with Pa-3 space group,[9] orthorhombic HP1 with Pbc21 space group and orthorhombic HP2 with Pnma space group.[10] Additionally a non stoichiometric MgH(2-δ) has been characterised, but this appears to exist only for very small particles[11]
(bulk MgH2 is essentially stoichiometric, as it can only accommodate very low concentrations of H vacancies[12]).
The bonding in the rutile form is sometimes described as being partially covalent in nature rather than purely ionic;[13] charge density determination by synchrotron x-ray diffraction indicates that the magnesium atom is fully ionised and spherical in shape and the hydride ion is elongated.[14]
Molecular forms of magnesium hydride, MgH, MgH2, Mg2H, Mg2H2, Mg2H3, and Mg2H4 molecules identified by their vibrational spectra have been found in matrix isolated samples at below 10 K, formed following laser ablation of magnesium in the presence of hydrogen.[15] The Mg2H4 molecule has a bridged structure analogous to dimeric aluminium hydride, Al2H6.[15]
Reactions[edit]
MgH2 readily reacts with water to form hydrogen gas:
- MgH2 + 2 H2O → 2 H2 + Mg(OH)2
At 287 °C it decomposes to produce H2 at 1 bar pressure.[16] The high temperature required is seen as a limitation in the use of MgH2 as a reversible hydrogen storage medium:[17]
- MgH2 → Mg + H2
References[edit]
- ^ a b Michalczyk, Michael J (1992). «Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium». Organometallics. 11 (6): 2307–2309. doi:10.1021/om00042a055.
- ^ Bogdanovic, Borislav (1985). «Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides — Applications in Organic Synthesis and Hydrogen Storage». Angewandte Chemie International Edition in English. 24 (4): 262–273. doi:10.1002/anie.198502621.
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). «Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)» (PDF). Zeitschrift für Naturforschung B. 6b: 394.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Zaluska, A; Zaluski, L; Ström–Olsen, J.O (1999). «Nanocrystalline magnesium for hydrogen storage». Journal of Alloys and Compounds. 288 (1–2): 217–225. doi:10.1016/S0925-8388(99)00073-0.
- ^ Bogdanovi?, Borislav; Liao, Shih-Tsien; Schwickardi, Manfred; Sikorsky, Peter; Spliethoff, Bernd (1980). «Catalytic Synthesis of Magnesium Hydride under Mild Conditions». Angewandte Chemie International Edition in English. 19 (10): 818. doi:10.1002/anie.198008181.
- ^ Barbaras, Glenn D; Dillard, Clyde; Finholt, A. E; Wartik, Thomas; Wilzbach, K. E; Schlesinger, H. I (1951). «The Preparation of the Hydrides of Zinc, Cadmium, Beryllium, Magnesium and Lithium by the Use of Lithium Aluminum Hydride1». Journal of the American Chemical Society. 73 (10): 4585. doi:10.1021/ja01154a025.
- ^ Zachariasen, W. H; Holley, C. E; Stamper, J. F (1963). «Neutron diffraction study of magnesium deuteride». Acta Crystallographica. 16 (5): 352. doi:10.1107/S0365110X63000967.
- ^ Bortz, M; Bertheville, B; Böttger, G; Yvon, K (1999). «Structure of the high pressure phase γ-MgH2 by neutron powder diffraction». Journal of Alloys and Compounds. 287 (1–2): L4–L6. doi:10.1016/S0925-8388(99)00028-6.
- ^ Vajeeston, P; Ravindran, P; Hauback, B. C; Fjellvåg, H; Kjekshus, A; Furuseth, S; Hanfland, M (2006). «Structural stability and pressure-induced phase transitions inMgH2». Physical Review B. 73 (22): 224102. Bibcode:2006PhRvB..73v4102V. doi:10.1103/PhysRevB.73.224102.
- ^ Moriwaki, Toru; Akahama, Yuichi; Kawamura, Haruki; Nakano, Satoshi; Takemura, Kenichi (2006). «Structural Phase Transition of Rutile-Type MgH2at High Pressures». Journal of the Physical Society of Japan. 75 (7): 074603. Bibcode:2006JPSJ…75g4603M. doi:10.1143/JPSJ.75.074603.
- ^ Schimmel, H. Gijs; Huot, Jacques; Chapon, Laurent C; Tichelaar, Frans D; Mulder, Fokko M (2005). «Hydrogen Cycling of Niobium and Vanadium Catalyzed Nanostructured Magnesium». Journal of the American Chemical Society. 127 (41): 14348–54. doi:10.1021/ja051508a. PMID 16218629.
- ^ Grau-Crespo, R.; K. C. Smith; T. S. Fisher; N. H. de Leeuw; U. V. Waghmare (2009). «Thermodynamics of hydrogen vacancies in MgH2 from first-principles calculations and grand-canonical statistical mechanics». Physical Review B. 80 (17): 174117. arXiv:0910.4331. Bibcode:2009PhRvB..80q4117G. doi:10.1103/PhysRevB.80.174117. S2CID 32342746.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6th ed.), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Noritake, T; Towata, S; Aoki, M; Seno, Y; Hirose, Y; Nishibori, E; Takata, M; Sakata, M (2003). «Charge density measurement in MgH2 by synchrotron X-ray diffraction». Journal of Alloys and Compounds. 356–357: 84–86. doi:10.1016/S0925-8388(03)00104-X.
- ^ a b Wang, Xuefeng; Andrews, Lester (2004). «Infrared Spectra of Magnesium Hydride Molecules, Complexes, and Solid Magnesium Dihydride». The Journal of Physical Chemistry A. 108 (52): 11511. Bibcode:2004JPCA..10811511W. doi:10.1021/jp046410h.
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (illustrated ed.). Springer. p. 65. ISBN 978-1-349-02635-7. Extract of page 65
- ^ Schlapbach, Louis; Züttel, Andreas (2001). «Hydrogen-storage materials for mobile applications» (PDF). Nature. 414 (6861): 353–8. Bibcode:2001Natur.414..353S. doi:10.1038/35104634. PMID 11713542. S2CID 3025203.
| Гидрид магния | |
|---|---|
 |
|
| Хим. формула | MgH2 |
| Молярная масса | 26,3209 г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 327 °C |
| Рег. номер CAS | 7693-27-8 |
| PubChem | 107663 |
| Рег. номер EINECS | 231-705-3 |
| SMILES |
[MgH2], [H-].[H-].[Mg+2] |
| InChI |
1S/Mg.2H/q+2;2*-1 RHLWKNJTVXDVHU-UHFFFAOYSA-N |
| ChemSpider | 16787263 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидрид магния (Магний водородистый) — бинарное неорганическое химическое соединение с химической формулой MgH2.
Содержит 7,66 % вес. водорода, в связи с чем рассматривается в качестве возможной среды для хранения водорода.
Свойства
Представляет собой твёрдое белое нелетучее вещество. Мало растворим в воде. Взаимодействует со спиртами и водой:
- MgH2 + 2 H2O ⟶ 2 H2 + Mg(OH)2
При нагревании свыше 287 °C при атмосферном давлении распадается на элементы:
- MgH2 ⟶ Mg + H2
Относительно высокая температура разложения рассматривается как некоторый недостаток для применения вещества в качестве обратимого хранилища водорода.
Получение
Гидрид магния получают реакцией магния с водородом при 570 °С и около 200 атмосфер в присутствии катализатора — йодида магния (выход реакции 60 %):
- Mg + H2 ⟶ MgH2
Также возможно получение вещества взаимодействием гидрида лития LiH с магнийалкилами.
| Гидрид магния | |
|---|---|
 |
|
| Общие | |
| Хим. формула | MgH2 |
| Физические свойства | |
| Молярная масса | 26,3209 г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 327 °C |
| Классификация | |
| Рег. номер CAS | 7693-27-8 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидри́д ма́гния — бинарное неорганическое химическое соединение с химической формулой MgH2.
Содержит 7,66 % вес. водорода, в связи с чем рассматривается в качестве возможной среды для его хранения[1].
Свойства
Представляет собой твёрдое белое нелетучее вещество. Малорастворим в воде. Взаимодействует со спиртами и водой:
- [math]ce{ MgH2 + 2H2O -> 2H2 + Mg(OH)2. }[/math]
При нагревании свыше 287 °C при атмосферном давлении разлагается[2]:
- [math]ce{ MgH2 -> Mg + H2. }[/math]
Относительно высокая температура разложения рассматривается как некоторый недостаток для применения вещества в качестве обратимого хранилища водорода[3].
Получение
Гидрид магния получают реакцией магния с водородом при 570 °С и около 200 атмосфер в присутствии катализатора — иодида магния (выход реакции 60 %)[4]:
- [math]ce{ Mg + H2 -> MgH2. }[/math]
Также возможно получение вещества взаимодействием гидрида лития LiH с магнийалкилами.
Примечания
- ↑ Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides — Applications in Organic Synthesis and Hydrogen Storage, Bogdanovic B., Angewandte Chemie International Edition in English, 24, 4, 262-73, doi:10.1002/anie.198502621
- ↑ McAuliffe, T. R. Hydrogen and Energy (неопр.). — illustrated. — Springer, 1980. — С. 65. — ISBN 978-1-349-02635-7. Extract of page 65 Архивная копия от 6 декабря 2021 на Wayback Machine
- ↑ Schlapbach, Louis; Züttel, Andreas. Hydrogen-storage materials for mobile applications (англ.) // Nature. — 2001. — Vol. 414, no. 6861. — P. 353. — doi:10.1038/35104634. — PMID 11713542.
- ↑ Egon Wiberg, Heinz Goeltzer, Richard Bauer. Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements) (англ.) // Zeitschrift für Naturforschung B : journal. — 1951. — Vol. 6b. — P. 394.
Гидри́д ма́гния — бинарное неорганическое химическое соединение с химической формулой MgH2.
Содержит 7,66 % вес. водорода, в связи с чем рассматривается в качестве возможной среды для его хранения[1].
Свойства
Представляет собой твёрдое белое нелетучее вещество. Малорастворим в воде. Взаимодействует со спиртами и водой:
При нагревании свыше 287 °C при атмосферном давлении разлагается[2]:
Относительно высокая температура разложения рассматривается как некоторый недостаток для применения вещества в качестве обратимого хранилища водорода[3].
Получение
Гидрид магния получают реакцией магния с водородом при 570 °С и около 200 атмосфер в присутствии катализатора — иодида магния (выход реакции 60 %)[4]:
Также возможно получение вещества взаимодействием гидрида лития LiH с магнийалкилами.
Примечания
- ↑ Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides — Applications in Organic Synthesis and Hydrogen Storage, Bogdanovic B., Angewandte Chemie International Edition in English, 24, 4, 262-73, doi:10.1002/anie.198502621
- ↑ McAuliffe, T. R. Hydrogen and Energy (неопр.). — illustrated. — Springer, 1980. — С. 65. — ISBN 978-1-349-02635-7. Extract of page 65 Архивная копия от 6 декабря 2021 на Wayback Machine
- ↑ Schlapbach, Louis; Züttel, Andreas. Hydrogen-storage materials for mobile applications (англ.) // Nature. — 2001. — Vol. 414, no. 6861. — P. 353. — doi:10.1038/35104634. — PMID 11713542.
- ↑ Egon Wiberg, Heinz Goeltzer, Richard Bauer. Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements) (англ.) // Zeitschrift für Naturforschung B : journal. — 1951. — Vol. 6b. — P. 394. Архивировано 20 сентября 2020 года.
Эта страница в последний раз была отредактирована 17 декабря 2022 в 06:44.
Как только страница обновилась в Википедии она обновляется в Вики 2.
Обычно почти сразу, изредка в течении часа.
| Гидрид магния | ||

|
||
|
__ Mg 2+ __ H — Кристаллическая структура гидрида магния. |
||
| Идентификация | ||
|---|---|---|
| Н о CAS | 7693-27-8 | |
| N о ИК | 100 028 824 | |
| N о ЕС | 231-705-3 | |
| PubChem | 5486771 | |
| Улыбки | ||
| ИнЧИ | ||
| Химические свойства | ||
| Грубая формула | H 2 мг | |
| Молярная масса | 26,3209 ± 0,0007 г / моль H 7,66%, Mg 92,34%, |
|
| Физические свойства | ||
| Т ° плавления | 327 ° C ( разложение ) | |
| Объемная масса | 1,45 г · см от -3 до 25 ° C | |
| Меры предосторожности | ||
| SGH | ||
|
H260, H315, H319, P223, P231 + P232, P305 + P351 + P338, P370 + P378, P422, |
||
| Транспорт | ||
|
||
|
|
||
| Единицы СИ и STP, если не указано иное. | ||
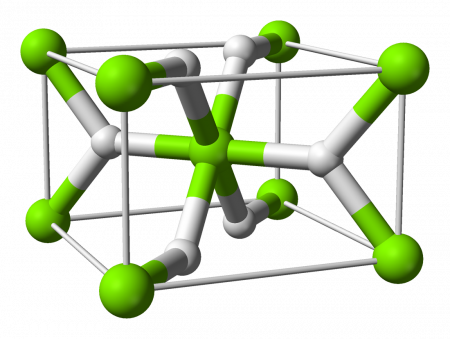
Гидрида магния представляет собой химическое соединение по формуле MgH 2. Он находится в форме порошка , имеющем, при комнатной температуре, в кристаллической структуре из рутила . Мы знаем как минимум четыре формы при высоком давлении: MgH 2β в кубической кристаллической системе с пространственной группой Pa 3 ( n o 205), MgH 2γ со структурой PbO 2α , и ромбическая форма НР1 в ДТЦ 2 1 пространство группы и HP2 в Pnma пространства группы . Нестехиометрический MgH 2-δ разнообразиетакже был охарактеризован, но, по-видимому, существует только в виде очень мелких частиц, в то время как MgH 2Твердые, по существу , стехиометрического до такой степени , что она позволяет только низкая концентрация недостатков из водорода .
Свойства и реакции
Вещество пирофорное , когда тонкодисперсное, однако магний гидрид макрокристаллический не воспламеняется самопроизвольно на воздухе при температуре выше 300 ° C . Как и большинство металлических гидридов , бурно реагирует с водой высвобождающего водород :
- MgH 2+ 2 Н 2 О⟶ Mg (OH) 2+ 2 ч 2.
Гидрид магния содержит 7,66% водорода по массе, поэтому он исследуется как раствор для хранения водорода . Были описаны способы синтеза гидрида магния из элементов магния и водорода , но они требуют либо высоких давлений и температур, либо катализаторов для деликатного обращения, которые иногда бывают токсичными, что делает их экономически и экологически неудовлетворительными. Например, реакцию можно проводить со смесью йодида из алкила , из метила , пропаргил и йод в качестве катализатора.
- Mg + H 2⟶ MgH 2.
Также возможно взаимодействие галогенида магния, такого как йодид магния MgI 2.растворенный в диэтиловом эфире с гидридом натрия NaH:
- MgI 2+ 2 NaH ⟶ MgH 2+ 2 NaI .
Гидрирование магния — это самоподдерживающаяся экзотермическая реакция . Это также автокаталитическая реакция , в которой гидрид магния катализирует собственное образование. Образовавшийся продукт представляет собой серый порошок с небольшим количеством примесей магния. Возможны также другие способы синтеза , такие как диалкилы магния (например, диэтилмагний, дибутилмагний , дифенилмагний) или соответствующие реактивы Гриньяра в высоком вакууме.
Прямой синтез из магния и водорода проводили в 1951 году в 500 ° C при 200 атм в присутствии магния йодида MgI 2. Режимы производства требуют меньшего количества экстремальных условий были изучены, например , как использование нанокристаллов магния , полученных с помощью шаровой мельницы , в гидрогенизации из антрацена-магния при умеренных условиях, реакции диэтилмагний с литий — алюминиевого гидрида LiAlH 4или производство из MgH 2 комплексов, как MgH 2THF взаимодействием фенилсилана и дибутилмагния в диэтиловом эфире или гидрокабонированных растворителях в присутствии THF или TMEDA в качестве лиганда .
Гидрид магния разлагается под давлением 1 бар от 287 ° C с выделением водорода :
- MgH 2⟶ Mg + H 2.
Эта относительно высокая температура является ограничением использования MgH 2.как обратимый материал для хранения водорода. Поэтому были проведены исследования с целью улучшения кинетики реакций гидрирования и дегидрирования. Это может быть достигнуто частично за счет легирования или уменьшения размера частиц в шаровой мельнице.
Примечания и ссылки
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ « Лист соединения гидрида магния, 98% » , на сайте Alfa Aesar (по состоянию на 28 октября 2020 г. ) .
- ↑ a b и c Лист Sigma-Aldrich о соединении гидрида магния , см. 28 октября 2020 г.
-
↑ (in) WH Zachariasen, EC Holley and JF Stamper Jnr , » Нейтронографическое исследование дейтерида магния « , Acta Crystallographica , vol. 16,
1963 г., стр. 352-353 ( DOI 10.1107 / S0365110X63000967 , читать онлайн ) -
↑ (in) П. Ваджистон, П. Равиндран, BC Hauback H. Fjellvåg, Kjekshus A., S. и г-н Furuseth Hanfland , « Структурная стабильность и индуцированные давлением фазовые переходы в MgH 2.
” , Physical Review B , vol. 73,июнь 2006 г.Статья п о 224102 ( DOI 10.1103 / PhysRevB.73.224102 , Bibcode 2006PhRvB..73v4102V , читать онлайн ) -
↑ (ru) М. Борц, Б. Бертвиль, Г. и К. Бёттгер Ивон , « Конструкция ступени высокого давления γ-MgH 2.
методом дифракции нейтронов на порошке » , Journal of Alloys and Compounds , vol. 287, n кость 1-2,Июнь 1999 г., стр. L4-L6 ( DOI 10.1016 / S0925-8388 (99) 00028-6 , читать онлайн ) -
↑ (in) Тору Мориваки Юичи Акахама, Харуки Кавамура Сатоши Накано и Кеничи Такемура , « Структурный фазовый переход MgH 2 рутилового типа.
при высоких давлениях » , Журнал Физического общества Японии , т. 75, п о 7,июль 2006 г., стр. 074603 ( DOI 10.1143 / JPSJ.75.074603 , Bibcode 2006JPSJ … 75g4603M , читать онлайн ) -
↑ (in) Х. Гийс Шиммель, Жак Юот, Лоуренс К. Капон, Франс Д. Тичелаар и Фокко Малдер , « Водородное циклирование наноструктурированного магния , катализируемого ниобием и ванадием » , Журнал Американского химического общества , Vol. 127, п о 41,
19 октября 2005 г., стр. 14348-14354 ( PMID 16218629 , DOI 10.1021 / ja051508a , читать онлайн ) -
↑ (in) Р. Грау-Креспо, К. К. Смит, Т. С. Фишер, Н. де Леу и У. В. Вагмар , « Термодинамика водородных вакансий в MgH 2.
из расчетов из первых принципов и большой канонической статистической механики » , Physical Review B , vol. 80, п о 17,25 ноября 2009 г.Статья п о 174117 ( DOI 10,1103 / PhysRevB.80.174117 , Bibcode 2009PhRvB..80q4117G , Arxiv 0910,4331 , читать онлайн ) -
↑ (in) Борислав Богданович , « Каталитический синтез литийорганических и магниевых соединений и гидридов лития и магния — применение в органическом синтезе и хранении водорода » , Angewandte Chemie International Edition , Vol. 24, п о 4,
Апрель 1985 г., стр. 262-273 ( DOI 10.1002 / anie.198502621 , читать онлайн ) - ↑ a b и c (de) Георг Брауэр в сотрудничестве с Марианной Бодлер, Handbuch der Anorganischen Chemie Präparativen , 3- е изд. переработанное, т. II, Фердинанд Энке, Штутгарт 1978, стр. 902 . ( ISBN 3-432-87813-3 )
-
^ (Де) Эгон Виберг, Хайнц Гёльцер и Рихард Бауэр , « Уведомления: Synthese von Magnesiumhydrid aus den Elementen » , Zeitschrift für Naturforschung B , vol. 6, п о 7,
1951 г., стр. 394 ( DOI 10.1515 / znb-1951-0714 , читать онлайн ) -
↑ (in) А. Залуска, Л. Залуски и О. Дж. Стрём-Ольсен , « Нанокристаллический магний для хранения водорода » , Журнал сплавов и соединений , Vol. 288, н. Кость 1-2,
29 июня 1999 г., стр. 217-225 ( DOI 10.1016 / S0925-8388 (99) 00073-0 , читать онлайн ) -
↑ (in) Борислав Богданович Ши-цзян Ляо, Манфред Швикарди, Питер Сикорский и Бернд Сплитхофф , « Каталитический синтез гидрида магния в мягких условиях » , Angwandte Chemie International Edition , Vol. 19, п о 10,
Октябрь 1980 г., стр. 818-819 ( DOI 10.1002 / anie.198008181 , читать онлайн ) -
↑ (in) Гленн Д. Барбарас, Клайд Диллард, А. Э. Финхольт Томас Вартик, К. Э. Вильцбах и Х. И. Шлезингер , « Получение гидридов цинка, кадмия, бериллия, магния и лития с использованием литий-алюмогидрида » , Журнал Американского химического общества , т. 73, п о 10,
Октябрь 1951 г., стр. 4585-4590 ( DOI 10.1021 / ja01154a025 , читать онлайн ) -
↑ (in) Майкл Дж. Михальчик , « Синтез гидрида магния реакцией фенилсилана и дибутила » , Organometallics , vol. 11, п о 6,
Июнь 1992 г., стр. 2307-2309 ( DOI 10.1021 / om00042a055 , читать онлайн ) - ↑ (in) Т.Р. МакОлифф, Водород и энергия , иллюстрированное издание, Springer, 1980, стр. 65 . ( ISBN 978-1-349-02635-7 )
-
↑ a и b (ru) Луи Шлапбах и Андреас Цюттель , « Материалы для хранения водорода для мобильных приложений » , Nature , vol. 414, п о 6861,
15 ноября 2001 г., стр. 353-358 ( PMID 11713542 , DOI 10.1038 / 35104634 , Bibcode 2001Natur.414..353S , читать онлайн ) - ↑ (in) Дж. Хуот, «Водород в металлах» Новые тенденции в интеркалирующих соединениях для хранения энергии , Кристиан Жюльен, Дж. П. Перейра-Рамос, А. Момчилов, Springer, 2002 г. ( ISBN 1-4020-0594-6 )
-
↑ (in) Биллур Сакинтуна Фарида Ламари-Даркрим и Майкл Хиршер , « Металлогидридные материалы для твердого хранения водорода: обзор » , Международный журнал водородной энергетики , вып. 32, п о 9,
июнь 2007 г., стр. 1121-1140 ( DOI 10.1016 / j.ijhydene.2006.11.022 , читать онлайн ) -
↑ (in) Кайл С. Смит, Тимоти С. Фишер, Умеш В. Вагмаре и Рикардо Грау-Креспо , « Эффекты связывания допинга и вакансии в гидриде магния, легированном Li » , Physical Review B , Vol. 82, п о 13,
октябрь 2010Ст н о 134109 ( DOI 10,1103 / PhysRevB.82.134109 , bibcode 2010PhRvB..82m4109S , читать онлайн ) -
↑ (ru) Дж. Лян, Дж. Хуот, С. Бойли, А. ван Несте и А. Шульц , « Каталитический эффект переходных металлов — сорбция водорода в нанокристаллическом MgH 2, измельченном в шаровой мельнице.
Системы –Tm (Tm = Ti, V, Mn, Fe и Ni) » , Журнал сплавов и соединений , вып. 292, н. Кость 1-2,15 ноября 1999 г., стр. 247-252 ( DOI 10.1016 / S0925-8388 (99) 00442-9 , читать онлайн )
Гидрид магния — Magnesium hydride
«Дигидрид магния» перенаправляется сюда. Не следует путать с моногидрид магния.
 |
|
 |
|
| Имена | |
|---|---|
| Название ИЮПАК
Гидрид магния |
|
| Идентификаторы | |
|
Количество CAS |
|
|
3D модель (JSmol ) |
|
| ЧЭБИ |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.824 |
| Номер ЕС |
|
|
PubChem CID |
|
| UNII |
|
|
ИнЧИ
|
|
|
Улыбки
|
|
| Характеристики | |
|
Химическая формула |
MgH2 |
| Молярная масса | 26,3209 г / моль |
| Внешность | белые кристаллы |
| Плотность | 1,45 г / см3 |
| Температура плавления | 327 ° С (621 ° F, 600 К) разлагается |
|
Растворимость в воде |
разлагается |
| Растворимость | не растворим в эфир |
| Структура | |
|
Кристальная структура |
четырехугольный |
| Термохимия | |
|
Теплоемкость (C) |
35,4 Дж / моль К |
|
Стандартный моляр |
31,1 Дж / моль К |
|
Станд. Энтальпия |
-75,2 кДж / моль |
|
Свободная энергия Гиббса (Δжграмм˚) |
-35,9 кДж / моль |
| Опасности | |
| Главный опасности | пирофорный[1] |
| Родственные соединения | |
|
Другой катионы |
Гидрид бериллия Гидрид кальция Гидрид стронция Гидрид бария |
|
Связанный Магний гидриды |
Моногидрид магния Mg4ЧАС6 |
|
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). |
|
| Ссылки на инфобоксы | |
Гидрид магния химическое соединение с молекулярной формулой MgH2. Он содержит 7,66% по весу водорода и был изучен как потенциальная среда для хранения водорода.[2]
Подготовка
В 1951 г. впервые было сообщено о получении из элементов, включающих прямое гидрирование металлического Mg при высоком давлении и температуре (200 атмосфер, 500 ° C) с MgI2 катализатор:[3]
- Mg + H2 → MgH2
Производство при более низких температурах из Mg и H2 с использованием нанокристаллического Mg, произведенного в шаровые мельницы был исследован.[4] Другие препараты включают:
- гидрирование антрацен магния в мягких условиях:[5]
- Mg (антрацен) + H2 → MgH2
- реакция диэтилмагния с литийалюминийгидрид[6]
- продукт комплексного MgH2 например MgH2.THF по реакции фенилсилан и дибутилмагний в эфирных или углеводородных растворителях в присутствии THF или же TMEDA в качестве лиганда.[1]
Структура и склеивание
При комнатной температуре форма α-MgH2 имеет рутил структура.[7] Существует как минимум четыре формы высокого давления: γ-MgH2 с α-PbO2 структура,[8] кубический β-MgH2 с космической группой Па-3,[9] орторомбический HP1 с Pbc21 пространственная группа и ромбическая HP2 с пространственной группой Pnma.[10] Дополнительно нестехиометрический MgH(2-δ) был охарактеризован, но, по-видимому, существует только для очень маленьких частиц[11]
(в массе MgH2 по существу стехиометрический, так как он может вместить только очень низкие концентрации вакансий H[12]).
Связь в форме рутила иногда описывается как частично ковалентная по природе, а не чисто ионная;[13] Определение плотности заряда с помощью синхротронной дифракции рентгеновских лучей показывает, что атом магния полностью ионизирован и имеет сферическую форму, а ион гидрида — удлиненный.[14]Молекулярные формы гидрида магния, MgH, MgH2, Mg2H, Mg2ЧАС2, Mg2ЧАС3, и Mg2ЧАС4 Молекулы, идентифицированные по их колебательным спектрам, были обнаружены в изолированных образцах матрицы при температуре ниже 10 К, образовавшихся после лазерной абляции магния в присутствии водорода.[15] Mg2ЧАС4 молекула имеет мостиковую структуру, аналогичную димерной гидрид алюминия, Al2ЧАС6.[15]
Реакции
MgH2 легко реагирует с водой с образованием газообразного водорода:
- MgH2 + 2 часа2O → 2 H2 + Mg (OH)2
При 287 ° C он разлагается с образованием H2 при давлении 1 бар,[16] необходимая высокая температура рассматривается как ограничение в использовании MgH2 как обратимый носитель для хранения водорода:[17]
- MgH2 → Mg + H2
Возможное использование для хранения водорода
Его потенциал в качестве обратимой среды «хранения» водорода вызвал интерес к улучшению кинетики реакций гидрирования и дегидрирования.[17][18] Частично этого можно достичь допинг или уменьшив размер частиц с помощью шаровая мельница.[19][20][21] Исследуется альтернативный подход — производство перекачиваемой суспензии MgH.2 который безопасен в обращении и освобождает H2 по реакции с водой, с переработкой Mg (OH)2 в MgH2.[1] Серия патентов США (US9123925B2, US8651268B2, US8651270B2, US9732906B2) и международных патентов была выдана на перезаряжаемую систему хранения водорода низкого давления и низкой температуры, в которой используется наноструктурированный гидрид магния для поглощения водорода высокой плотности и активируемой лазером десорбции. Практическая система использует обработанные полимерные подложки в форме диска или ленты для использования при длительном хранении, транспортировке и стабилизации сетки. Система обладает уникальным преимуществом в способности пассивно улавливать водород из промышленных дымоходов и очистных сооружений до того, как он сможет образовать парниковые газы.
Рекомендации
- ^ а б Михальчик, Майкл Дж (1992). «Синтез гидрида магния по реакции фенилсилана и дибутилмагния». Металлоорганические соединения. 11 (6): 2307–2309. Дои:10.1021 / om00042a055.
- ^ Богданович, Борислав (1985). «Каталитический синтез литийорганических и магниевых соединений и гидридов лития и магния — применение в органическом синтезе и хранении водорода». Angewandte Chemie International Edition на английском языке. 24 (4): 262–273. Дои:10.1002 / anie.198502621.
- ^ Эгон Виберг, Хайнц Гельцер, Рихард Бауэр (1951). «Synthese von Magnesiumhydrid aus den Elementen (Синтез гидрида магния из элементов)» (PDF). Zeitschrift für Naturforschung B. 6b: 394.CS1 maint: использует параметр авторов (связь)
- ^ Залуска, А; Залуский, Л; Стрем – Ольсен, J.O (1999). «Нанокристаллический магний для хранения водорода». Журнал сплавов и соединений. 288 (1–2): 217–225. Дои:10.1016 / S0925-8388 (99) 00073-0.
- ^ Богданович, Борислав; Ляо, Ши-Цзянь; Швикарди, Манфред; Сикорский, Питер; Сплитхофф, Бернд (1980). «Каталитический синтез гидрида магния в мягких условиях». Angewandte Chemie International Edition на английском языке. 19 (10): 818. Дои:10.1002 / anie.198008181.
- ^ Барбарас, Гленн Д.; Диллард, Клайд; Finholt, A.E; Вартик, Томас; Wilzbach, K. E; Шлезингер, Х. I (1951). «Получение гидридов цинка, кадмия, бериллия, магния и лития с использованием литийалюминийгидрида1». Журнал Американского химического общества. 73 (10): 4585. Дои:10.1021 / ja01154a025.
- ^ Захариасен, W.H; Холли, К. Э; Стампер, Дж. Ф (1963). «Нейтронографическое исследование дейтерида магния». Acta Crystallographica. 16 (5): 352. Дои:10.1107 / S0365110X63000967.
- ^ Борц, М; Бертвиль, B; Böttger, G; Ивон, К. (1999). «Структура фазы высокого давления γ-MgH2 по данным порошковой дифракции нейтронов». Журнал сплавов и соединений. 287 (1–2): L4 – L6. Дои:10.1016 / S0925-8388 (99) 00028-6.
- ^ Vajeeston, P; Равиндран, П; Hauback, B.C; Fjellvåg, H; Кекшус, А; Фурусет, S; Ханфланд, М. (2006). «Структурная устойчивость и фазовые переходы под давлением в MgH2». Физический обзор B. 73 (22): 224102. Bibcode:2006PhRvB..73v4102V. Дои:10.1103 / PhysRevB.73.224102.
- ^ Мориваки, Тору; Акахама, Юичи; Кавамура, Харуки; Накано, Сатоши; Такемура, Кеничи (2006). «Структурный фазовый переход MgH2 типа рутила при высоких давлениях». Журнал Физического общества Японии. 75 (7): 074603. Bibcode:2006JPSJ … 75g4603M. Дои:10.1143 / JPSJ.75.074603.
- ^ Шиммель, Х. Гийс; Хуот, Жак; Chapon, Laurent C; Tichelaar, Frans D; Малдер, Фокко М (2005). «Водородный цикл наноструктурированного магния, катализируемого ниобием и ванадием». Журнал Американского химического общества. 127 (41): 14348–54. Дои:10.1021 / ja051508a. PMID 16218629.
- ^ Grau-Crespo, R .; К. С. Смит; Т. С. Фишер; Н. Х. де Леу; У. В. Вагмаре (2009). «Термодинамика водородных вакансий в MgH.2 из первопринципных расчетов и большой канонической статистической механики ». Физический обзор B. 80 (17): 174117. arXiv:0910.4331. Bibcode:2009PhRvB..80q4117G. Дои:10.1103 / PhysRevB.80.174117.
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Noritake, T; Товата, S; Аоки, М; Сено, Y; Hirose, Y; Нисибори, Э; Таката, М; Саката, М. (2003). «Измерение плотности заряда в MgH2 методом синхротронной рентгеновской дифракции». Журнал сплавов и соединений. 356-357: 84–86. Дои:10.1016 / S0925-8388 (03) 00104-X.
- ^ а б Ван, Сюэфэн; Эндрюс, Лестер (2004). «Инфракрасные спектры молекул гидрида магния, комплексов и твердого дигидрида магния». Журнал физической химии A. 108 (52): 11511. Bibcode:2004JPCA..10811511W. Дои:10.1021 / jp046410h.
- ^ МакОлифф Т. Р. (1980). Водород и энергия (иллюстрированный ред.). Springer. п. 65. ISBN 978-1-349-02635-7. Выдержка со страницы 65
- ^ а б Шлапбах, Луи; Цюттель, Андреас (2001). «Материалы для хранения водорода для мобильных приложений» (PDF). Природа. 414 (6861): 353–8. Bibcode:2001Натура.414..353С. Дои:10.1038/35104634. PMID 11713542.
- ^ Дж. Хуот Водород в металлах (2002) в New Trends in Intercalation Compounds for Energy Storage, Christian Julien, J. P. Pereira-Ramos, A. Momchilov, Springer, ISBN 1-4020-0594-6
- ^ Sakintuna, B .; Ф. Ламаридаркрим; М. Хиршер (2007). «Металлогидридные материалы для твердого хранения водорода: обзор». Международный журнал водородной энергетики. 32 (9): 1121–1140. Дои:10.1016 / j.ijhydene.2006.11.022.
- ^ Смит, Кайл; Фишер, Тимоти; Вагмаре, Умеш; Грау-Креспо, Рикардо (2010). «Эффекты связывания допанта и вакансии в гидриде магния, легированном литием». Физический обзор B. 82 (13): 134109. arXiv:1009.4806. Bibcode:2010ПхРвБ..82м4109С. Дои:10.1103 / PhysRevB.82.134109. ISSN 1098-0121.
- ^ Liang, G .; Huot, J .; Бойлы, С .; Ван Несте, А .; Шульц Р. (1999). «Каталитическое действие переходных металлов на сорбцию водорода в нанокристаллических системах MgH2 – Tm (Tm = Ti, V, Mn, Fe и Ni), измельченных в шаровой мельнице». Журнал сплавов и соединений. 292 (1–2): 247–252. Дои:10.1016 / S0925-8388 (99) 00442-9. ISSN 0925-8388.





