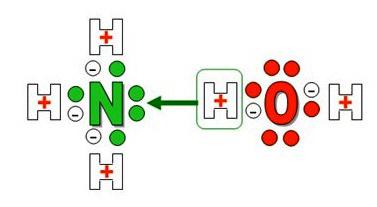
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Гидроксид аммония
Брутто-формула:
H5NO
CAS# 1336-21-6
Названия
Русский:
- Аммония гидрооксид
- Гидрат аммиака(IUPAC) [Wiki]
- Гидроксид аммония
- аммиачная вода
- едкий аммиак
- едкий аммоний
Варианты формулы:
H/N^+<`|H><_(A80,w+)H>_(A15,d+)H`|0O`^-# -H
Реакции, в которых участвует Гидроксид аммония
-
Ag2O + 4NH4OH -> 2[Ag(NH3)2]OH + 3H2O
-
{M}{X}3 + 3{R}OH -> {M}(OH)3″|v» + 3{R}{X}
, где M =
Al Cr Fe Ti La; X =
Cl F Br I; R =
Li Na K Rb Cs NH4 -
Fe(NO3)3 * 9H2O + 3NH4OH -> FeO(OH) + 3NH4NO3 + 10H2O
-
NH4OH + HI -> NH4I + H2O
-
2UO2F2 + 6NH4OH -> (NH4)2U2O7″|v» + 4NH4F + 3H2O
Формула гидроксида аммония
Определение гидроксида аммония и его формула
ОПРЕДЕЛЕНИЕ
Гидроксид аммония (аммиачная вода, гидрат аммиака) представляет собой химическое соединение, принадлежащее классу оснований и образованное взаимодействием аммиака с водой.
Гидроксид аммония
Формула — (
NH_{4}OH
) или (
NH_{3}OH cdot H_{2}O
)
Молярная масса составляет 35.046 г / моль.
Физические свойства — бесцветная жидкость с сильным запахом.
Гидроксид аммония — слабое основание, константа диссоциации (
K_{b}=1,8cdot 10^-5
)
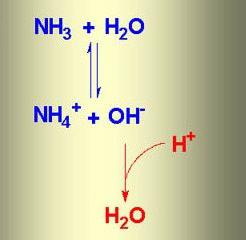
Диссоциация протекает в соответствии с уравнением:
(
N H_{3}+H_{2} O leftrightarrows N H_{4}^{+}+O H^{-}
)
Химические свойства гидроксида аммония
Гидроксид аммония является термически нестабильным, и когда раствор кипятят, выделяется аммиак:
(
NH_{4}OH=NH_{3} uparrow +H_{2}O
)
Относительно реакционноспособный, обладает понижающими свойствами. Вступает в обменные реакции:
(
NH_{4}OH=HNO_{3} rightarrow NH_{4}NO_{3}+H_{2}O
)
Качественная реакция на гидрат аммиака представляет собой образование коричневого осадка с (
4NH_{4}OH=2K_{2}H_{g}I_{4}rightarrow(H_{g2}N)Icdot H_{2}O downarrow+4KI+3NH_{4}I+3H_{2}O
)
Основой метода получения гидроксида аммония является реакция газообразного аммиака и воды:
(
NH_{3}+H_{2}Oleftrightarrows NH_{3}cdot H_{2}Oleftrightarrows NH_{4}OH
)
заявка
Растворенные растворы аммиака 10% (
NH_{3}
) называются аммиаком и используются в медицине, концентрированные растворы 25% (
NH_{3}
) представляют собой аммиачную воду. В пищевой промышленности он зарегистрирован как пищевая добавка E527. В сельском хозяйстве используется как удобрение. Вода аммиака используется для производства аммониевых солей (азотных удобрений), в производстве соды, красителей.
Примеры решения проблем
ПРИМЕР 1
Рассчитать рН раствора аммиака с массовой долей 30% и плотностью 0,882 г / мл.
Напишите выражение для вычисления молярной концентрации раствора:
(
C_{M}=frac{n}{V}=frac{m}{M cdot V}=frac{omega cdot m}{M cdot V}=frac{omega cdot rho cdot V}{M cdot V}=frac{omega cdot rho}{M}
)
где (
C_{M}
) — молярная концентрация раствора; n — количество молей растворенного вещества; V — объем решения; m — масса вещества; M — молярная масса вещества; (
omega
) — массовая доля вещества; (
rho
) — плотность раствора.
Нужно подставить плотность раствора в g / l в формулу, но поскольку в ссылках приведены данные в г / мл, мы умножаем выражение на 1000:
(
C_{M}=frac{omega cdot rho cdot 1000}{M}
)
Замените числовые значения в полученной формуле:
(
C_{M}=frac{0,3 cdot 0,892 cdot 1000}{35}=7,65моль/л
)
Теперь напишем уравнение диссоциации (
NH_{4}OH
)
(
NH_{4}OHleftrightarrows NH_{4}^{+}+OH^{-}
)
Пусть х представляет собой концентрацию гидроксида аммония, которая диссоциирует, то равновесные концентрации ионов аммония и ионного гидроксида будут равны х, т.е.
(
[NH_{4}^{+}]=[ON]-x
)
Запишем выражение для константы диссоциации:
(
K_{d}=frac{[NH_{4}^{+}] cdot [OH^{-}]}{[NH_{4}OH]}=frac{x cdot x}{C_{M}-x}=frac{x^{2}}{C_{M}-x}
)
Численное значение (
K_{d}=1,77cdot 10^{-5}
) (из справочника)
Поскольку (
K_{d} ll 1 Rightarrow C_{M}-x approx C_{M} Rightarrow K_{d}=frac{x^{2}}{C_{M}}
)
Найти концентрацию ионов гидроксида:
(
left[O H^{-}right]=x=sqrt{7,65 cdot 1,77 cdot 10^{-5}}=0,01164моль/л
)
Рассчитайте (
rho OH
) решение:
(
rho OH=-lg[OH^{-}]=-log0,01164=1,934
)
Вычислить (
rho H
) раствор:
(
rho H=14-rho OH=14-1,934=12,07
)
(
rho H
) раствора аммиака составляет 12,07
ПРИМЕР 2
Какова массовая доля гидроксида аммония в растворе, которая образуется при растворении 1 кубического метра (
NH_{3}
) в 2 литрах воды в стандартных условиях.
Стандартными условиями являются Т = 298 К и Р = 1 атм = 101325 Па.
Вычислим число (
NH_{3}
) в 1 кубе в данных условиях с использованием уравнения состояния идеального газа (при данных Т и Р газ можно считать идеальным):
(
Pcdot V=ncdot Rcdot T
)
R — универсальная газовая постоянная, (
R=8,314 Дж/моль cdot K
)
Экспресс и вычислить из этого выражения количество моля аммиака:
(
n=frac{Pcdot V}{Rcdot T}=frac{101325cdot 1}{8,314cdot 298}=41 моль
)
Рассчитайте массу (
NH_{3}
) :
(
m(NH_{3})=M(NH_{3})cdot n(NH_{3})=17cdot41=697г
)
Теперь мы находим массу (
H_{2}O
) :
Нам дано, что (
rho (H_{2}O)=1мл
); (
V=2л=2000 мл
)
Тогда (
m(H_{2}O)=rho cdot V=1 cdot 2000=2000г
)
Найдите массу решения:
(
m=m(NH_{3})+m(H_{2}O)=697+2000=2697г
)
Рассчитайте массовую долю гидроксида аммония:
(
omegaleft(N H_{3}right)=frac{mleft(N H_{3}right)}{m} cdot 100 %=frac{697}{2697} cdot 100 %=25,8 %
)
Массовая доля гидроксида аммония составляет 25,8%.
Аммония гидроокись
- Аммония гидроокись
-
NH4OH, соединение, образующееся при растворении Аммиака в воде. Благодаря отщеплению в водном растворе ионов OH— обладает щелочными свойствами (более слабыми, однако, чем NaOH или KOH). Процесс растворения аммиака в воде может быть представлен уравнением:
А. г. — один из важнейших химических реактивов. Его разбавленные растворы называются нашатырным спиртом; последний применяют в домашнем хозяйстве — при стирке белья и выведении пятен, в медицине — для возбуждения дыхания при обморочном состоянии (осторожно подносят к носу смоченную раствором ватку). Нашатырный спирт, выпускаемый в продажу, содержит обычно около 10% аммиака.
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
Смотреть что такое «Аммония гидроокись» в других словарях:
-
Аммония гидроокись — … Википедия
-
гидроокись аммония — Регулятор кислотности пищевого продукта, получаемый дистилляцией скрубберной аммиачной воды с водяным паром и последующей дефлегмацией и конденсацией, содержащий аммиака не менее 27,0 %, мышьяка не более 3,0 мг/кг, свинца не более 5,0 мг/кг,… … Справочник технического переводчика
-
гидроокись аммония — нашатырный спирт … Cловарь химических синонимов I
-
Щёлочи — растворимые в воде основания. Водные растворы Щ. характеризуются высокой концентрацией гидроксильных ионов OH―. К Щ. относятся гидроокиси щелочных металлов (См. Щелочные металлы), щёлочноземельных металлов (См. Щёлочноземельные металлы) и … Большая советская энциклопедия
-
Аммиак — NH3, простейшее химическое соединение азота с водородом. Один из важнейших продуктов химической промышленности; синтез А. из азота воздуха и водорода основной метод получения т. н. связанного Азота. В природе А. образуется при разложении… … Большая советская энциклопедия
-
Аммоний — ион NH4+ ; входит во многие соединения, где играет роль одновалентного металла; таковы Аммония гидроокись NH4OH и соли А.: Аммония сульфат (NH4)2SO4, Аммония хлорид NH4CI и др. При диссоциации соединений А. в водных растворах А.… … Большая советская энциклопедия
-
E527 — Название: Гидроксид аммония(гидроокись аммония) (AMMONIUM HYDROXIDE) Использование в России: Разрешено Основные функции: Регулятор кислотности Степень опасности: Токсичен Вредное действие, противопоказания: Сильное раздражение глаз, кожи,… … Пищевые добавки
-
нашатырный спирт — гидроокись аммония … Cловарь химических синонимов I
-
определение — 2.7 определение: Процесс выполнения серии операций, регламентированных в документе на метод испытаний, в результате выполнения которых получают единичное значение. Источник … Словарь-справочник терминов нормативно-технической документации
-
Аппаратура, реактивы и растворы — 6.2. Аппаратура, реактивы и растворы Весы по ГОСТ 29329 или ГОСТ 24104. Фотоколориметр ФЭК 56М или спектрофотометр СФ 4, или другие аналогичные приборы. Цилиндры стеклянные вместимостью 250 см3 из прозрачного бесцветного стекла (внутренний… … Словарь-справочник терминов нормативно-технической документации
Это бесцветная, прозрачная жидкость с резким запахом, представляющая собой 10%-ный водный раствор аммиака или гидроксид аммония.
Является единственным основанием, не имеющим кристаллической формы. Название «нашатырный» образовано от древнерусского «нашатырь», которое в свою очередь заимствовано из арабского языка, где словом «нушадир» называли аммиачную соль, хлорид аммония.
Химическая формула
NH3·H2O или NH4OH
Cтруктурная схема
Получение нашатырного спирта
Нашатырный спирт представляет собой водный раствор аммиака:
NH3+H2O ⇌rightleftharpoons NH3·H2O⇌rightleftharpoons NH4 + OH
Искусственные источники получения
Реакция взаимодействия аммиака с водой является обратимой. В промышленных объемах получают насыщением паров воды газообразным аммиаком, полученным синтетически либо в виде побочного продукта при коксовании в каменноугольном производстве.
Естественные источники получения
В природе в чистом виде не встречается ввиду высокой нестабильности. Однако, аммиак, образующийся в некоторых количествах при разложении и гниении в почве, болотистых местностях растительных или животных органических остатков, может быть выделен и растворен в воде без применения промышленных технологий. Следовые количества растворенного аммиака с использованием лабораторных методов можно обнаружить в дождевой, талой воде, в стоячей воде загрязненных водоемов. В большинстве случаев присутствие аммиака в природе обусловлено техногенным фактором и к природному синтезу отношения не имеет.
Представляет собой бесцветный прозрачный водный раствор аммония с резким запахом. Существует только в жидком виде.
Является слабым основанием, при взаимодействии с кислотами дает соль аммония и воду:
NH4OH + HCl = NH4Cl + H2O
При взаимодействии с солями металлов, являющихся производными слабых оснований, дает нерастворимый осадок:
2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2
Водные растворы аммиака используют в традиционном качественном неорганическом анализе как комплексообразователь и основание. Как и многие амины, растворы дают глубокую синюю окраску с медными (II) растворами. Раствор аммиака растворяют остатки оксида серебра. Он часто встречается в растворах, используемых для чистки ювелирных изделий из золота, серебра и платины, но может иметь негативные последствия для пористых камней драгоценных камней, таких как опалы и жемчуг. При смешении раствора аммиака с разбавленной перекисью водорода в присутствии ионов металлов, пероксид подвергается быстрому разложению.
Применение гидроксида аммония
Водный раствор аммиака применяется:
- в медицине в виде 10%-ного водного раствора наружно в качестве антисептика при обработке ссадин, поверхностных неглубоких ранений, укусах насекомых;
- для индукции рвоты внутрь в виде разбавленного водного раствора;
- используется в качестве стабилизатора при производстве косметических препаратов;
- пары наштырного спирта оказывают стимулирующее действие на нервную систему и в этом случае его применяют для выведения человека из обморочного состояния;
- производстве органических красителей, а также при производстве соды;
- в легкой промышленности при обработке различных изделий;
- используется в производстве аммонийных солей и удобрений на их основе;
- в пищевой промышленности как регулятор кислотности добавка Е-527, и т.п.
Тест по теме «Нашатырный спирт»
Ammonium is a cation gained by the protonation of Ammonia. It is symbolically represented as NH4+. Ammonia solution is a solution of ammonia in water, also famously known as ammonia water, ammonium hydroxide, ammoniacal liquor, ammonia liquor, aqua ammonia, aqueous ammonia, or (Inaccurately) ammonia. The letters NH3 are used to represent it (aq).
Ammonium Hydroxide Formula
The formula for ammonium hydroxide is NH4OH. Despite the fact that the name ammonium hydroxide implies an alkali with the composition [NH4+][OH–], it is impossible to isolate NH4OH samples. Except in extremely dilute solutions, the ions NH4+ and OH– do not account for a significant fraction of the overall amount of ammonia.
Structure of Ammonium Hydroxide
The compound structure is formed by an ionic connection between one hydroxide anion (OH–) and one ammonium cation (NH4+).
Physical Properties of Ammonium Hydroxide
- Ammonium hydroxide is a clear liquid with no color.
- It has a fishy, unpleasant odor about it.
- It’s a liquid that mixes easily. Ammonium hydroxide, in other words, is water-soluble.
- In water, it is miscible
- The specific gravity of a solution is usually 0.9, but it varies depending on the strength of the solution.
- -57.5°C is the melting point of NH4OH.
- The boiling point varies between 38°C and 100°C depending on the concentration.
- The temperature of the auto-ignition system is 651°C.
- The molecular weight of this compound is 35.05 g/mol.
- The density of the material is 0.91 g/cm3.
- At 20°C, the vapor pressure is 115 mm.
Chemical Properties of Ammonium Hydroxide
- Sulphuric acid combines with ammonium hydroxide to generate ammonium sulfate and water.
2NH4OH + H2SO4 → (NH4)2SO4 + 2H2O
- When ammonium hydroxide combines with hydrochloric acid, ammonium chloride is produced.
NH4OH + HCl → NH4Cl + H2O
- Copper hydroxide and ammonium sulfate are formed when ammonium hydroxide interacts with copper sulfate.
CuSO4 + 2NH4OH → Cu(OH)2 + (NH4)2SO4
- Ammonium hydroxide interacts with ferric chloride to produce a brown ferric hydroxide precipitate.
FeCl3 + 3NH4OH → Fe(OH)3 + 3NH4Cl
- Ferrous sulfate combines with ammonium hydroxide to form ferrous hydroxide and ammonium sulfate.
FeSO4 + 2NH4OH → Fe(OH)2 + (NH4)2SO4
- Carbonic acid combines with ammonium hydroxide to produce ammonium bicarbonate and water.
NH4OH + H2CO3 → NH4HCO3 + H2O
Uses of Ammonium Hydroxide
- Ammonium hydroxide is utilized for home cleaning. It’s also a component of a number of cleaning products.
- It’s employed as an alkyl amine precursor.
- In the treatment of water, ammonium hydroxide is utilized.
- Some foods include ammonium hydroxide, which is used as an acidity regulator.
- Because of its pH-controlling qualities, it is employed as a potent antibacterial agent.
- Furniture is darkened using ammonium hydroxide. That is, certain tannic acid-containing wood can be stored in an ammonium hydroxide solution to give it a dark color.
- Straw is treated with ammonium hydroxide. For cattle, this makes the straw more palatable.
- Ammonium hydroxide is employed as a base and a complexant in qualitative analysis in the laboratory.
- It’s used to make plastic, fertilizer, rayon, and rubber, among other things.
- It’s also utilized as a sanitizer and a purifying agent.
Sample Questions
Question 1: What is ammonium hydroxide made of?
Answer:
The solution of ammonia gas in water is called ammonium hydroxide. Ammonia solution is another name for it. The chemical formula is NH4OH
Question 2: How to prepare ammonium hydroxide solution?
Answer:
By saturating water with gaseous ammonia, ammonium hydroxide is produced. Without the need of a drying tube, ammonia gas is created and carried straight from the flask into an empty gas cleaning bottle, which collects any solid particles physically transported.
Question 3: What pH is ammonia solution?
Answer:
One ammonia molecule is made up of one negatively charged nitrogen ion and three positively charged hydrogen ions, giving it the chemical formula NH3. The pH of normal ammonia is around 11.
Question 4: Why is ammonium hydroxide utilized in qualitative analysis?
Answer:
When accurate quantity of ammonium hydroxide is introduced drop smart to answers of the metal salts, ppts (colored generally) are formed. They assist us to perceive their metallic ions.
FeSO4 + 2NH4OH → (NH4)2SO4 + Fe(OH)2
Indicates the presence of Fe+2 ion.
Question 5: What will happen when ammonium hydroxide is added to the aqueous solution of lead nitrate?
Answer:
The result is a white ppt. of lead hydroxide that is insoluble in NH4OH,
Pb(NO3)2 + 2NH4OH → 2NH4NO3 + Pb(OH)2
Question 6: What foods are processed with ammonium hydroxide?
Answer:
- Baked goods, cheeses, chocolates, other confectionary (e.g., caramel), and puddings are just a few of the foods that use ammonium hydroxide as a direct food ingredient. Ammonium hydroxide is also utilised in meat products as an antibacterial agent.
- In condiments, relishes, soy protein concentrates/isolates, snack foods, jams and jellies, and non-alcoholic drinks, ammonia in different forms (e.g., ammonium sulphate, ammonium alginate) is employed.
- When employed in compliance with acceptable manufacturing procedures, ammonium hydroxide can be used to process hundreds of different food varieties, according to the World Health Organization. Dairy items, confections, fruits and vegetables, baked goods, morning cereals, eggs, fish, sports drinks and beer, and meats are among them.
Question 7: How does ammonium hydroxide work to kill pathogens in meat?
Answer:
In the intestines of cattle, many food pathogens can be discovered, including hazardous E. coli strains. They may survive and thrive in mammalian tissues with high acidity. Ammonium hydroxide and other chemicals can harm these organisms by lowering the acidity of meats and other meals, making it difficult for pathogens to live.
Ammonium is a cation gained by the protonation of Ammonia. It is symbolically represented as NH4+. Ammonia solution is a solution of ammonia in water, also famously known as ammonia water, ammonium hydroxide, ammoniacal liquor, ammonia liquor, aqua ammonia, aqueous ammonia, or (Inaccurately) ammonia. The letters NH3 are used to represent it (aq).
Ammonium Hydroxide Formula
The formula for ammonium hydroxide is NH4OH. Despite the fact that the name ammonium hydroxide implies an alkali with the composition [NH4+][OH–], it is impossible to isolate NH4OH samples. Except in extremely dilute solutions, the ions NH4+ and OH– do not account for a significant fraction of the overall amount of ammonia.
Structure of Ammonium Hydroxide
The compound structure is formed by an ionic connection between one hydroxide anion (OH–) and one ammonium cation (NH4+).
Physical Properties of Ammonium Hydroxide
- Ammonium hydroxide is a clear liquid with no color.
- It has a fishy, unpleasant odor about it.
- It’s a liquid that mixes easily. Ammonium hydroxide, in other words, is water-soluble.
- In water, it is miscible
- The specific gravity of a solution is usually 0.9, but it varies depending on the strength of the solution.
- -57.5°C is the melting point of NH4OH.
- The boiling point varies between 38°C and 100°C depending on the concentration.
- The temperature of the auto-ignition system is 651°C.
- The molecular weight of this compound is 35.05 g/mol.
- The density of the material is 0.91 g/cm3.
- At 20°C, the vapor pressure is 115 mm.
Chemical Properties of Ammonium Hydroxide
- Sulphuric acid combines with ammonium hydroxide to generate ammonium sulfate and water.
2NH4OH + H2SO4 → (NH4)2SO4 + 2H2O
- When ammonium hydroxide combines with hydrochloric acid, ammonium chloride is produced.
NH4OH + HCl → NH4Cl + H2O
- Copper hydroxide and ammonium sulfate are formed when ammonium hydroxide interacts with copper sulfate.
CuSO4 + 2NH4OH → Cu(OH)2 + (NH4)2SO4
- Ammonium hydroxide interacts with ferric chloride to produce a brown ferric hydroxide precipitate.
FeCl3 + 3NH4OH → Fe(OH)3 + 3NH4Cl
- Ferrous sulfate combines with ammonium hydroxide to form ferrous hydroxide and ammonium sulfate.
FeSO4 + 2NH4OH → Fe(OH)2 + (NH4)2SO4
- Carbonic acid combines with ammonium hydroxide to produce ammonium bicarbonate and water.
NH4OH + H2CO3 → NH4HCO3 + H2O
Uses of Ammonium Hydroxide
- Ammonium hydroxide is utilized for home cleaning. It’s also a component of a number of cleaning products.
- It’s employed as an alkyl amine precursor.
- In the treatment of water, ammonium hydroxide is utilized.
- Some foods include ammonium hydroxide, which is used as an acidity regulator.
- Because of its pH-controlling qualities, it is employed as a potent antibacterial agent.
- Furniture is darkened using ammonium hydroxide. That is, certain tannic acid-containing wood can be stored in an ammonium hydroxide solution to give it a dark color.
- Straw is treated with ammonium hydroxide. For cattle, this makes the straw more palatable.
- Ammonium hydroxide is employed as a base and a complexant in qualitative analysis in the laboratory.
- It’s used to make plastic, fertilizer, rayon, and rubber, among other things.
- It’s also utilized as a sanitizer and a purifying agent.
Sample Questions
Question 1: What is ammonium hydroxide made of?
Answer:
The solution of ammonia gas in water is called ammonium hydroxide. Ammonia solution is another name for it. The chemical formula is NH4OH
Question 2: How to prepare ammonium hydroxide solution?
Answer:
By saturating water with gaseous ammonia, ammonium hydroxide is produced. Without the need of a drying tube, ammonia gas is created and carried straight from the flask into an empty gas cleaning bottle, which collects any solid particles physically transported.
Question 3: What pH is ammonia solution?
Answer:
One ammonia molecule is made up of one negatively charged nitrogen ion and three positively charged hydrogen ions, giving it the chemical formula NH3. The pH of normal ammonia is around 11.
Question 4: Why is ammonium hydroxide utilized in qualitative analysis?
Answer:
When accurate quantity of ammonium hydroxide is introduced drop smart to answers of the metal salts, ppts (colored generally) are formed. They assist us to perceive their metallic ions.
FeSO4 + 2NH4OH → (NH4)2SO4 + Fe(OH)2
Indicates the presence of Fe+2 ion.
Question 5: What will happen when ammonium hydroxide is added to the aqueous solution of lead nitrate?
Answer:
The result is a white ppt. of lead hydroxide that is insoluble in NH4OH,
Pb(NO3)2 + 2NH4OH → 2NH4NO3 + Pb(OH)2
Question 6: What foods are processed with ammonium hydroxide?
Answer:
- Baked goods, cheeses, chocolates, other confectionary (e.g., caramel), and puddings are just a few of the foods that use ammonium hydroxide as a direct food ingredient. Ammonium hydroxide is also utilised in meat products as an antibacterial agent.
- In condiments, relishes, soy protein concentrates/isolates, snack foods, jams and jellies, and non-alcoholic drinks, ammonia in different forms (e.g., ammonium sulphate, ammonium alginate) is employed.
- When employed in compliance with acceptable manufacturing procedures, ammonium hydroxide can be used to process hundreds of different food varieties, according to the World Health Organization. Dairy items, confections, fruits and vegetables, baked goods, morning cereals, eggs, fish, sports drinks and beer, and meats are among them.
Question 7: How does ammonium hydroxide work to kill pathogens in meat?
Answer:
In the intestines of cattle, many food pathogens can be discovered, including hazardous E. coli strains. They may survive and thrive in mammalian tissues with high acidity. Ammonium hydroxide and other chemicals can harm these organisms by lowering the acidity of meats and other meals, making it difficult for pathogens to live.
Структура гидроксида аммония, свойства, номенклатура, применение
гидроксид аммония представляет собой соединение NH молекулярной формулы4ОН или Н5НЕ производится растворением газообразного аммиака (NH3в воде. По этой причине он получает названия аммиачной воды или жидкого аммиака.
Это бесцветная жидкость с очень интенсивным и острым запахом, которая не изолирует. Эти характеристики имеют прямую связь с концентрацией NH3 растворяется в воде; концентрация, которая на самом деле, будучи газом, может покрывать его огромное количество, растворенное в небольшом объеме воды.
Значительно небольшая часть этих водных растворов состоит из катионов NH.4 + и ОН-анионы — . С другой стороны, в очень разбавленных растворах или в замороженных твердых веществах при очень низких температурах аммиак можно найти в форме гидратов, таких как: NH3∙ H2О, 2НХ3∙ H2O и NH3H 2H2О.
Любопытно, что облака Юпитера образованы разбавленными растворами гидроксида аммония. Однако космическому зонду Galileo не удалось обнаружить воду в облаках планеты, что можно было бы ожидать из знания того, что известно образование гидроксида аммония; то есть они кристаллы NH4ОН абсолютно безводный.
Ион аммония (NH4 + ) вырабатывается в просвете почечных канальцев путем соединения аммиака и водорода, секретируемых клетками почечных канальцев. Аналогичным образом, аммоний вырабатывается в клетках почечных канальцев в процессе превращения глютамина в глутамат и, в свою очередь, при превращении глутамата в α-кетоглутарат..
Аммиак производится промышленным способом по методу Хабера-Боша, в котором газы азота и водорода вступают в реакцию; с использованием иона трехвалентного железа, оксида алюминия и оксида калия в качестве катализаторов. Реакцию проводят при высоких давлениях (150-300 атмосфер) и высоких температурах (400-500 ºC) с выходом 10-20%..
В реакции образуется аммиак, который при окислении производит нитриты и нитраты. Они необходимы при получении азотной кислоты и удобрений, таких как аммиачная селитра.
- 1 Химическая структура
- 1.1 Аммиачный лед
- 2 Физические и химические свойства
- 2.1 Молекулярная формула
- 2.2 Молекулярный вес
- 2.3 Внешний вид
- 2.4 Концентрация
- 2.5 Запах
- 2.6 Вкус
- 2.7 Пороговое значение
- 2.8 Точка кипения
- 2.9 Растворимость
- 2.10 Растворимость в воде
- 2.11 Плотность
- 2.12 Плотность пара
- 2.13 Давление пара
- 2.14 Коррозионное действие
- 2,15 рН
- 2.16 Константа диссоциации
- 3 Номенклатура
- 4 Растворимость
- 5 рисков
- 5.1 Реакционная способность
- 6 использует
- 6.1 В еду
- 6.2 Терапия
- 6.3 Промышленное и разное
- 6.4 В сельском хозяйстве
- 7 ссылок
Химическая структура
Как указано в его определении, гидроксид аммония состоит из водного раствора газообразного аммиака. Следовательно, внутри жидкости нет определенной структуры, кроме структуры случайного расположения ионов NH.4 + и ОН — сольватированные молекулами воды.
Ионы аммония и гидроксила являются продуктами равновесного гидролиза аммиака, поэтому для этих растворов характерен резкий запах:
Согласно химическому уравнению, высокое снижение концентрации воды приведет к смещению равновесия с образованием большего количества аммиака; то есть при нагревании гидроксида аммония пары аммиака будут выделяться.
По этой причине ионы NH4 + и ОН — им не удается сформировать кристалл в земных условиях, что приводит к тому, что твердое основание NH4ОН не существует.
Это твердое вещество должно состоять только из ионов, взаимодействующих электростатически (как показано на рисунке).
Аммиачный лед
Однако при температурах значительно ниже 0ºC и в окружении огромных давлений, таких как те, что преобладают в ядрах ледяных лун, аммиак и вода замерзают. При этом они кристаллизуются в твердой смеси с различными стехиометрическими пропорциями, являясь самым простым NH3∙ H2O: моногидрат аммиака.
NH3∙ H2O и NH3H 2H2Или это аммиачный лед, потому что твердое тело состоит из кристаллического расположения молекул воды и аммиака, соединенных водородными связями.
Учитывая изменение T и P, согласно вычислительным исследованиям, которые моделируют все физические переменные и их влияние на этот лед, происходит переход фазы NH3∙ нН2Или в фазу NH4Огайо.
Поэтому только в этих экстремальных условиях NH4ОН может существовать как продукт протонирования во льду между NH3 и Н2O:
Обратите внимание, что на этот раз, в отличие от гидролиза аммиака, участвующие виды находятся в твердой фазе. Аммиачный лед, который становится соленым без выделения аммиака.
Аммиачная вода: получение, формула, применение
Бесцветный газ с резким запахом аммиак NH3 не только хорошо растворяется в воде с выделением тепла. Вещество активно взаимодействует с молекулами H2O с образованием слабой щелочи. Раствор получил несколько названий, одно из них — аммиачная вода. Соединение обладает удивительными свойствами, которые заключаются в способе образования, составе и химических реакциях.
Образование иона аммония
Образуется ион аммония с одним положительным зарядом и особым типом слабой ковалентной связи – донорно-акцепторной. По своим размерам, заряду и некоторым другим особенностям он напоминает катион калия и ведет себя подобно щелочным металлам. Необычное в химическом плане соединение реагирует с кислотами, образует соли, имеющие важное практическое значение. Названия, в которых отражены особенности получения и свойства вещества:
- аммиачная вода;
- гидроксид аммония;
- гидрат аммиака;
- едкий аммоний.
Меры предосторожности
Необходимо соблюдать осторожность при работах с аммиаком и его производными. Важно помнить:
- Аммиачная вода имеет неприятный запах. Выделяющийся газ раздражает слизистую поверхность носовой полости, глаз, вызывает кашель.
- При хранении нашатырного спирта в неплотно закрытых флаконах, ампулах выделяется аммиак.
- Можно обнаружить без приборов, только по запаху даже небольшое количество газа в растворе и воздухе.
- Соотношение между молекулами и катионами в растворе изменяется при разных рН.
- При значении около 7 снижается концентрация токсичного газа NH3, увеличивается количество менее вредных для живых организмов катионов NH4 +
Получение гидроксида аммония. Физические свойства
При растворении аммиака в воде образуется аммиачная вода. Формула этого вещества – NH4OH, но на самом деле одновременно присутствуют ионы
NH4 + , OH – , молекулы NH3 и H2O. В химической реакции ионного обмена между аммиаком и водой устанавливается равновесное состояние. Процесс можно отразить с помощью схемы, на которой противоположно направленные стрелочки указывают на обратимость явлений.
В лаборатории получение аммиачной воды проводят в опытах с азотосодержащими веществами. При смешивании аммиака с водой получается прозрачная бесцветная жидкость. При высоких давлениях растворимость газа увеличивается. Вода больше отдает растворенный в ней аммиак при повышении температуры. Для производственных нужд и сельского хозяйства в промышленных масштабах получают 25-процентное вещество при растворении аммиака. Второй способ предусматривает использование реакции коксового газа с водой.
Химические свойства гидроксида аммония
При соприкосновении две жидкости — аммиачная вода и соляная кислота — покрываются клубами белого дыма. Он состоит из частиц продукта реакции – хлорида аммония. С таким летучим веществом, как соляная кислота, реакция происходит прямо в воздухе.
Слабо-щелочные химические свойства гидрата аммиака:
- Вещество обратимо диссоциирует в воде с образованием катиона аммония и гидроксид-иона.
- В присутствии иона NH4 + бесцветный раствор фенолфталеина окрашивается в малиновый цвет, как в щелочах.
- Химическая реакция нейтрализации с кислотами приводит к образованию солей аммония и воды: NH4OH + HCl = NH4Cl + H2O.
- Аммиачная вода вступает в реакции ионного обмена с солями металлов, которым соответствуют слабые основания, при этом образуется нерастворимый в воде гидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu(OH)2 (синий осадок).
Аммиачная вода: применение в разных отраслях хозяйства
Необычное вещество широко используется в быту, сельском хозяйстве, медицине, промышленности. Технический гидрат аммиака применяется в сельском хозяйстве, производстве кальцинированной соды, красителей и других видов продукции. В жидком удобрении азот содержится в легкоусвояемой растениями форме. Вещество считается наиболее дешевым и эффективным для внесения в предпосевной период под все сельскохозяйственные культуры.
На производство аммиачной воды затрачивается в три раза меньше средств, чем на выпуск твердых гранулированных азотных удобрений. Для хранения и транспортировки жидкости применяются герметически закрытые цистерны из стали. Некоторые виды красок и средств для обесцвечивания волос производятся с использованием едкого аммония. В каждом медицинском учреждении есть препараты с нашатырным спиртом — 10-процентным раствором аммиака.
Соли аммония: свойства и практическое значение
Вещества, которые получают при взаимодействии гидроксида аммония с кислотами, используются в хозяйственной деятельности. Соли разлагаются при нагревании, растворяются в воде, подвергаются гидролизу. Они вступают в химические реакции со щелочами и другими веществами. Наиболее важное практическое значение приобрели хлориды, нитраты, сульфаты, фосфаты и карбонаты аммония.
Очень важно соблюдать правила и меры безопасности, проводя работы с веществами, в составе которых есть ион аммония. При хранении на складах промышленных и сельскохозяйственных предприятий, в подсобных хозяйствах не должно быть соприкосновения таких соединений с известью и щелочами. Если нарушится герметичность упаковок, то начнется химическая реакция с выделением ядовитого газа. Каждый, кому приходится работать с аммиачной водой и ее солями, обязан знать основы химии. При соблюдении требований техники безопасности используемые вещества не принесут вреда людям и окружающей среде.
Соли аммония: получение и химические свойства
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре 250 – 300°C:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
источники:
http://fb.ru/article/135157/ammiachnaya-voda-poluchenie-formula-primenenie
http://chemege.ru/soli-ammoniya/