From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Copper(II) hydroxide |
|
| Other names
Cupric hydroxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.817 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Cu(OH)2 |
| Molar mass | 97.561 g/mol |
| Appearance | Blue or blue-green solid |
| Density | 3.368 g/cm3, solid |
| Melting point | 80 °C (176 °F; 353 K) approximate, decomposes into CuO |
|
Solubility in water |
negligible |
|
Solubility product (Ksp) |
2.20 x 10−20[1] |
| Solubility | insoluble in ethanol; soluble in NH4OH |
|
Magnetic susceptibility (χ) |
+1170.0·10−6 cm3/mol |
| Thermochemistry | |
|
Std molar |
108 J·mol−1·K−1 |
|
Std enthalpy of |
−450 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Skin, Eye, & Respiratory Irritant |
| NFPA 704 (fire diamond) |
2 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1000 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[2] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[2] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[2] |
| Safety data sheet (SDS) | SDS |
| Related compounds | |
|
Other anions |
Copper(II) oxide Copper(II) carbonate Copper(II) sulfate Copper(II) chloride |
|
Other cations |
Nickel(II) hydroxide Zinc hydroxide Iron(II) hydroxide Cobalt hydroxide |
|
Related compounds |
Copper(I) oxide Copper(I) chloride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) hydroxide is the hydroxide of copper with the chemical formula of Cu(OH)2. It is a pale greenish blue or bluish green solid. Some forms of copper(II) hydroxide are sold as «stabilized» copper(II) hydroxide, although they likely consist of a mixture of copper(II) carbonate and hydroxide. Cupric hydroxide is a strong base, although its low solubility in water makes this hard to observe directly.
Occurrence[edit]
Copper(II) hydroxide has been known since copper smelting began around 5000 BC although the alchemists were probably the first to manufacture it by mixing solutions of lye (sodium or potassium hydroxide) and blue vitriol (copper(II) sulfate).[3] Sources of both compounds were available in antiquity.
It was produced on an industrial scale during the 17th and 18th centuries for use in pigments such as blue verditer and Bremen green.[4] These pigments were used in ceramics and painting.[5]
Mineral[edit]
The mineral of the formula Cu(OH)2 is called spertiniite. Copper(II) hydroxide is rarely found as an uncombined mineral because it slowly reacts with carbon dioxide from the atmosphere to form a basic copper(II) carbonate. Thus copper slowly acquires a dull green coating in moist air by the reaction:
- 2 Cu(OH)2 + CO2 → Cu2CO3(OH)2 + H2O
The green material is in principle a 1:1 mole mixture of Cu(OH)2 and CuCO3.[6] This patina forms on bronze and other copper alloy statues such as the Statue of Liberty.
Production[edit]
Copper(II) hydroxide can be produced by adding sodium hydroxide to a solution of a soluble copper(II) salt, such as copper(II) sulfate (CuSO4·5H2O):[7]
- 2NaOH + CuSO4·5H2O → Cu(OH)2 + 6H2O + Na2SO4
The precipitate produced in this manner, however, often contains water and an appreciable amount of sodium-containing impurities. Furthermore, this form of copper hydroxide tends to convert to black copper(II) oxide:[8]
- Cu(OH)2 → CuO + H2O
A purer product can be attained if ammonium chloride is added to the solution beforehand to generate ammonia in situ.[9] Alternatively it can be produced in a two-step procedure from copper(II) sulfate via «basic copper sulfate:»[8]
- 4 CuSO4 + 6 NH3 + 6H2O → Cu4SO4(OH)6 + 3 (NH4)2SO4
- Cu4SO4(OH)6 + 2 NaOH → 4 Cu(OH)2 + Na2SO4
Alternatively, copper hydroxide is readily made by electrolysis of water (containing a little electrolyte such as sodium sulfate or magnesium sulfate) with a copper anode:
- Cu + 2OH− → Cu(OH)2 + 2e−
Structure[edit]
The structure of Cu(OH)2 has been determined by X-ray crystallography The copper center is square pyramidal. Four Cu-O distances in the plane range are 1.96 Å, and the axial Cu-O distance is 2.36 Å. The hydroxide ligands in the plane are either doubly bridging or triply bridging.[10]
Reactions[edit]
It is stable to about 100 °C.[7]
Copper(II) hydroxide reacts with a solution of ammonia to form a deep blue solution of tetramminecopper [Cu(NH3)4]2+ complex ion.
Copper(II) hydroxide catalyzes the oxidation of ammonia solutions in presence of dioxygen, giving rise to copper ammine nitrites, such as Cu(NO2)2(NH3)n.[11][12]
Copper(II) hydroxide is mildly amphoteric. It dissolves slightly in concentrated alkali, forming [Cu(OH)4]2−.[13][7]
Reagent for organic chemistry[edit]
Copper(II) hydroxide has a rather specialized role in organic synthesis. Often, when it is utilized for this purpose, it is prepared in situ by mixing a soluble copper(II) salt and potassium hydroxide.
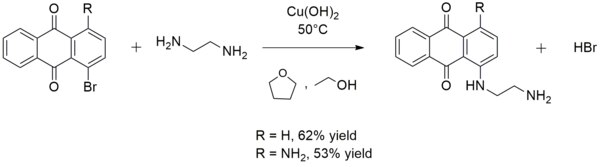
It is sometimes used in the synthesis of aryl amines. For example, copper(II) hydroxide catalyzes the reaction of ethylenediamine with 1-bromoanthraquinone or 1-amino-4-bromoanthraquinone to form 1-((2-aminoethyl)amino)anthraquinone or 1-amino-4-((2-aminoethyl)amino)anthraquinone, respectively:[14]
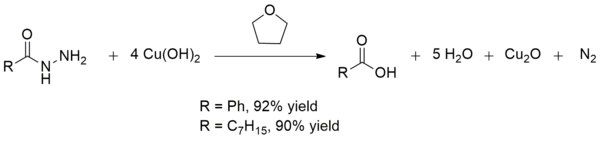
Copper(II) hydroxide also converts acid hydrazides to carboxylic acids at room temperature. This conversion is useful in the synthesis of carboxylic acids in the presence of other fragile functional groups. The yields are generally excellent as is the case with the production of benzoic acid and octanoic acid:[14]
Uses[edit]
Copper(II) hydroxide in ammonia solution, known as Schweizer’s reagent, possesses the interesting ability to dissolve cellulose. This property led to it being used in the production of rayon, a cellulose fiber.
It is also used widely in the aquarium industry for its ability to destroy external parasites in fish, including flukes, marine ich, Brooklynellosis, and marine velvet, without killing the fish. Although other water-soluble copper compounds can be effective in this role, they generally result in high fish mortality.
Copper(II) hydroxide has been used as an alternative to the Bordeaux mixture, a fungicide and nematicide.[15] Such products include Kocide 3000, produced by Kocide L.L.C. Copper(II) hydroxide is also occasionally used as ceramic colorant.
Copper(II) hydroxide has been combined with latex paint, making a product designed to control root growth in potted plants. Secondary and lateral roots thrive and expand, resulting in a dense and healthy root system. It was sold under the name Spin Out, which was first introduced by Griffin L.L.C. The rights are now owned by SePRO Corp.[16] It is now sold as Microkote either in a solution you apply yourself, or as treated pots.
Other copper(II) hydroxides[edit]
Chemical structure of azurite, one of many copper(II) hydroxides (color code: red = O, green = Cu, gray = C, white = H).[17]
Together with other components, copper(II) hydroxides are numerous. Several copper(II)-containing minerals contain hydroxide. Notable examples include azurite, malachite, antlerite, and brochantite. Azurite (2CuCO3·Cu(OH)2) and malachite (CuCO3·Cu(OH)2) are hydroxy-carbonates, whereas antlerite (CuSO4·2Cu(OH)2) and brochantite (CuSO4·3Cu(OH)2) are hydroxy-sulfates.
Many synthetic copper(II) hydroxide derivatives have been investigated.[18]
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Richard Cowen, Essays on Geology, History, and People, Chapter 3: «Fire and Metals: Copper».
- ^ Tony Johansen, Historic Artist’s Pigments Archived 2009-06-09 at the Wayback Machine. PaintMaking.com. 2006.
- ^ Blue verditer Archived 2007-09-27 at the Wayback Machine. Natural Pigments. 2007.
- ^ Masterson, W. L., & Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (p 331)»
- ^ a b c O. Glemser and H. Sauer «Copper(II) Hydroxide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1013.
- ^ a b Solomon, Sally D.; Rutkowsky, Susan A.; Mahon, Megan L.; Halpern, Erica M. (2011). «Synthesis of Copper Pigments, Malachite and Verdigris: Making Tempera Paint». Journal of Chemical Education. 88 (12): 1694–1697. Bibcode:2011JChEd..88.1694S. doi:10.1021/ed200096e.
- ^ Y. Cudennec, A. Lecerf (2003). «The transformation of Cu(OH)2 into CuO, revisited» (PDF). Solid State Sciences. 5 (11–12): 1471–1474. Bibcode:2003SSSci…5.1471C. doi:10.1016/j.solidstatesciences.2003.09.009. S2CID 96363475.
- ^ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). «Structure of Copper(II) Hydroxide, Cu(OH)2«. Acta Crystallogr. C46 (12): 2279–2284. doi:10.1107/S0108270190006230.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Y. Cudennec; et al. (1995). «Etude cinétique de l’oxydation de l’ammoniac en présence d’ions cuivriques». Comptes Rendus de l’Académie des Sciences, Série IIB. 320 (6): 309–316.
- ^ Y. Cudennec; et al. (1993). «Synthesis and study of Cu(NO2)2(NH3)4 and Cu(NO2)2(NH3)2″. European Journal of Solid State and Inorganic Chemistry. 30 (1–2): 77–85.
- ^ Pauling, Linus (1970). General Chemistry. Dover Publications, Inc. (p 702).
- ^ a b Tsuda, T. (2001). «Copper(II) Hydroxide». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc228. ISBN 0471936235.
- ^ Bordeaux Mixture. UC IPM online. 2007.
- ^ «SePRO Corporation».
- ^ Zigan, F.; Schuster, H.D. (1972). «Verfeinerung der Struktur von Azurit, Cu3(OH)2(CO3)2, durch Neutronenbeugung». Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie. 135 (5–6): 416–436. Bibcode:1972ZK….135..416Z. doi:10.1524/zkri.1972.135.5-6.416. S2CID 95738208.
- ^ Kondinski, A.; Monakhov, K. (2017). «Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper(II)–Oxo/Hydroxo Clusters». Chemistry: A European Journal. 23 (33): 7841–7852. doi:10.1002/chem.201605876. PMID 28083988.
External links[edit]
- Material Safety Data Sheet
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| IUPAC name
Copper(II) hydroxide |
|
| Other names
Cupric hydroxide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.817 |
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
Cu(OH)2 |
| Molar mass | 97.561 g/mol |
| Appearance | Blue or blue-green solid |
| Density | 3.368 g/cm3, solid |
| Melting point | 80 °C (176 °F; 353 K) approximate, decomposes into CuO |
|
Solubility in water |
negligible |
|
Solubility product (Ksp) |
2.20 x 10−20[1] |
| Solubility | insoluble in ethanol; soluble in NH4OH |
|
Magnetic susceptibility (χ) |
+1170.0·10−6 cm3/mol |
| Thermochemistry | |
|
Std molar |
108 J·mol−1·K−1 |
|
Std enthalpy of |
−450 kJ·mol−1 |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Skin, Eye, & Respiratory Irritant |
| NFPA 704 (fire diamond) |
2 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1000 mg/kg (oral, rat) |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 1 mg/m3 (as Cu)[2] |
|
REL (Recommended) |
TWA 1 mg/m3 (as Cu)[2] |
|
IDLH (Immediate danger) |
TWA 100 mg/m3 (as Cu)[2] |
| Safety data sheet (SDS) | SDS |
| Related compounds | |
|
Other anions |
Copper(II) oxide Copper(II) carbonate Copper(II) sulfate Copper(II) chloride |
|
Other cations |
Nickel(II) hydroxide Zinc hydroxide Iron(II) hydroxide Cobalt hydroxide |
|
Related compounds |
Copper(I) oxide Copper(I) chloride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Copper(II) hydroxide is the hydroxide of copper with the chemical formula of Cu(OH)2. It is a pale greenish blue or bluish green solid. Some forms of copper(II) hydroxide are sold as «stabilized» copper(II) hydroxide, although they likely consist of a mixture of copper(II) carbonate and hydroxide. Cupric hydroxide is a strong base, although its low solubility in water makes this hard to observe directly.
Occurrence[edit]
Copper(II) hydroxide has been known since copper smelting began around 5000 BC although the alchemists were probably the first to manufacture it by mixing solutions of lye (sodium or potassium hydroxide) and blue vitriol (copper(II) sulfate).[3] Sources of both compounds were available in antiquity.
It was produced on an industrial scale during the 17th and 18th centuries for use in pigments such as blue verditer and Bremen green.[4] These pigments were used in ceramics and painting.[5]
Mineral[edit]
The mineral of the formula Cu(OH)2 is called spertiniite. Copper(II) hydroxide is rarely found as an uncombined mineral because it slowly reacts with carbon dioxide from the atmosphere to form a basic copper(II) carbonate. Thus copper slowly acquires a dull green coating in moist air by the reaction:
- 2 Cu(OH)2 + CO2 → Cu2CO3(OH)2 + H2O
The green material is in principle a 1:1 mole mixture of Cu(OH)2 and CuCO3.[6] This patina forms on bronze and other copper alloy statues such as the Statue of Liberty.
Production[edit]
Copper(II) hydroxide can be produced by adding sodium hydroxide to a solution of a soluble copper(II) salt, such as copper(II) sulfate (CuSO4·5H2O):[7]
- 2NaOH + CuSO4·5H2O → Cu(OH)2 + 6H2O + Na2SO4
The precipitate produced in this manner, however, often contains water and an appreciable amount of sodium-containing impurities. Furthermore, this form of copper hydroxide tends to convert to black copper(II) oxide:[8]
- Cu(OH)2 → CuO + H2O
A purer product can be attained if ammonium chloride is added to the solution beforehand to generate ammonia in situ.[9] Alternatively it can be produced in a two-step procedure from copper(II) sulfate via «basic copper sulfate:»[8]
- 4 CuSO4 + 6 NH3 + 6H2O → Cu4SO4(OH)6 + 3 (NH4)2SO4
- Cu4SO4(OH)6 + 2 NaOH → 4 Cu(OH)2 + Na2SO4
Alternatively, copper hydroxide is readily made by electrolysis of water (containing a little electrolyte such as sodium sulfate or magnesium sulfate) with a copper anode:
- Cu + 2OH− → Cu(OH)2 + 2e−
Structure[edit]
The structure of Cu(OH)2 has been determined by X-ray crystallography The copper center is square pyramidal. Four Cu-O distances in the plane range are 1.96 Å, and the axial Cu-O distance is 2.36 Å. The hydroxide ligands in the plane are either doubly bridging or triply bridging.[10]
Reactions[edit]
It is stable to about 100 °C.[7]
Copper(II) hydroxide reacts with a solution of ammonia to form a deep blue solution of tetramminecopper [Cu(NH3)4]2+ complex ion.
Copper(II) hydroxide catalyzes the oxidation of ammonia solutions in presence of dioxygen, giving rise to copper ammine nitrites, such as Cu(NO2)2(NH3)n.[11][12]
Copper(II) hydroxide is mildly amphoteric. It dissolves slightly in concentrated alkali, forming [Cu(OH)4]2−.[13][7]
Reagent for organic chemistry[edit]
Copper(II) hydroxide has a rather specialized role in organic synthesis. Often, when it is utilized for this purpose, it is prepared in situ by mixing a soluble copper(II) salt and potassium hydroxide.
It is sometimes used in the synthesis of aryl amines. For example, copper(II) hydroxide catalyzes the reaction of ethylenediamine with 1-bromoanthraquinone or 1-amino-4-bromoanthraquinone to form 1-((2-aminoethyl)amino)anthraquinone or 1-amino-4-((2-aminoethyl)amino)anthraquinone, respectively:[14]
Copper(II) hydroxide also converts acid hydrazides to carboxylic acids at room temperature. This conversion is useful in the synthesis of carboxylic acids in the presence of other fragile functional groups. The yields are generally excellent as is the case with the production of benzoic acid and octanoic acid:[14]
Uses[edit]
Copper(II) hydroxide in ammonia solution, known as Schweizer’s reagent, possesses the interesting ability to dissolve cellulose. This property led to it being used in the production of rayon, a cellulose fiber.
It is also used widely in the aquarium industry for its ability to destroy external parasites in fish, including flukes, marine ich, Brooklynellosis, and marine velvet, without killing the fish. Although other water-soluble copper compounds can be effective in this role, they generally result in high fish mortality.
Copper(II) hydroxide has been used as an alternative to the Bordeaux mixture, a fungicide and nematicide.[15] Such products include Kocide 3000, produced by Kocide L.L.C. Copper(II) hydroxide is also occasionally used as ceramic colorant.
Copper(II) hydroxide has been combined with latex paint, making a product designed to control root growth in potted plants. Secondary and lateral roots thrive and expand, resulting in a dense and healthy root system. It was sold under the name Spin Out, which was first introduced by Griffin L.L.C. The rights are now owned by SePRO Corp.[16] It is now sold as Microkote either in a solution you apply yourself, or as treated pots.
Other copper(II) hydroxides[edit]
Chemical structure of azurite, one of many copper(II) hydroxides (color code: red = O, green = Cu, gray = C, white = H).[17]
Together with other components, copper(II) hydroxides are numerous. Several copper(II)-containing minerals contain hydroxide. Notable examples include azurite, malachite, antlerite, and brochantite. Azurite (2CuCO3·Cu(OH)2) and malachite (CuCO3·Cu(OH)2) are hydroxy-carbonates, whereas antlerite (CuSO4·2Cu(OH)2) and brochantite (CuSO4·3Cu(OH)2) are hydroxy-sulfates.
Many synthetic copper(II) hydroxide derivatives have been investigated.[18]
References[edit]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0150». National Institute for Occupational Safety and Health (NIOSH).
- ^ Richard Cowen, Essays on Geology, History, and People, Chapter 3: «Fire and Metals: Copper».
- ^ Tony Johansen, Historic Artist’s Pigments Archived 2009-06-09 at the Wayback Machine. PaintMaking.com. 2006.
- ^ Blue verditer Archived 2007-09-27 at the Wayback Machine. Natural Pigments. 2007.
- ^ Masterson, W. L., & Hurley, C. N. (2004). Chemistry: Principles and Reactions, 5th Ed. Thomson Learning, Inc. (p 331)»
- ^ a b c O. Glemser and H. Sauer «Copper(II) Hydroxide» in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1013.
- ^ a b Solomon, Sally D.; Rutkowsky, Susan A.; Mahon, Megan L.; Halpern, Erica M. (2011). «Synthesis of Copper Pigments, Malachite and Verdigris: Making Tempera Paint». Journal of Chemical Education. 88 (12): 1694–1697. Bibcode:2011JChEd..88.1694S. doi:10.1021/ed200096e.
- ^ Y. Cudennec, A. Lecerf (2003). «The transformation of Cu(OH)2 into CuO, revisited» (PDF). Solid State Sciences. 5 (11–12): 1471–1474. Bibcode:2003SSSci…5.1471C. doi:10.1016/j.solidstatesciences.2003.09.009. S2CID 96363475.
- ^ H. R. Oswald, A. Reller, H. W. Schmalle, E. Dubler (1990). «Structure of Copper(II) Hydroxide, Cu(OH)2«. Acta Crystallogr. C46 (12): 2279–2284. doi:10.1107/S0108270190006230.
{{cite journal}}: CS1 maint: uses authors parameter (link) - ^ Y. Cudennec; et al. (1995). «Etude cinétique de l’oxydation de l’ammoniac en présence d’ions cuivriques». Comptes Rendus de l’Académie des Sciences, Série IIB. 320 (6): 309–316.
- ^ Y. Cudennec; et al. (1993). «Synthesis and study of Cu(NO2)2(NH3)4 and Cu(NO2)2(NH3)2″. European Journal of Solid State and Inorganic Chemistry. 30 (1–2): 77–85.
- ^ Pauling, Linus (1970). General Chemistry. Dover Publications, Inc. (p 702).
- ^ a b Tsuda, T. (2001). «Copper(II) Hydroxide». Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc228. ISBN 0471936235.
- ^ Bordeaux Mixture. UC IPM online. 2007.
- ^ «SePRO Corporation».
- ^ Zigan, F.; Schuster, H.D. (1972). «Verfeinerung der Struktur von Azurit, Cu3(OH)2(CO3)2, durch Neutronenbeugung». Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie. 135 (5–6): 416–436. Bibcode:1972ZK….135..416Z. doi:10.1524/zkri.1972.135.5-6.416. S2CID 95738208.
- ^ Kondinski, A.; Monakhov, K. (2017). «Breaking the Gordian Knot in the Structural Chemistry of Polyoxometalates: Copper(II)–Oxo/Hydroxo Clusters». Chemistry: A European Journal. 23 (33): 7841–7852. doi:10.1002/chem.201605876. PMID 28083988.
External links[edit]
- Material Safety Data Sheet
Гидроксид меди
Полезное
Смотреть что такое «Гидроксид меди» в других словарях:
-
Гидроксид меди(I) — Общие Систематическое наименование Гидроксид меди(I) Традиционные названия гидроокись меди Химическая формула CuOH Физические свойства Состояние ( … Википедия
-
Гидроксид меди(II) — У этого термина существуют и другие значения, см. Гидроксид меди. Гидроксид меди(II) … Википедия
-
Гидроксид калия — Гидроксид калия … Википедия
-
Гидроксид лития — Гидроксид лития … Википедия
-
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
-
МЕДИ ГИДРОКСИДЫ — Гидроксид меди(II) Сu(ОН)2 голубое кристаллич. или аморфное в во; кристаллич. решетка ромбич. (а= 0,2949 нм, b =1,059 нм, с =0,5256 нм, z = 4); плотн. 3,368 г/см 3; C0p 96,2 Дж/(моль.K); DH0 обр 444,4 кДж/моль, DG0 обр 359,4 кДж/моль; S0298 83,7… … Химическая энциклопедия
-
Гидроксид железа(II) — У этого термина существуют и другие значения, см. Гидроксиды железа. Гидроксид железа(II) … Википедия
-
Меди гидроксиды — Гидроксиды меди: Гидроксид меди(I) CuOH Гидроксид меди(II) Cu(OH)2 … Википедия
-
Гидроксид иттрия — Общие Систематическое наименование Гидроксид иттрия Традиционные названия Гидроокись иттрия Химическая формула Y(OH)3 Физические свойства Состояние … Википедия
-
меди(II) гидроксид — vario(II) hidroksidas statusas T sritis chemija formulė Cu(OH)₂ atitikmenys: angl. copper(II) hydroxide; cupric hydroxide rus. меди(II) гидроксид … Chemijos terminų aiškinamasis žodynas
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Гидроксид меди(II)
Брутто-формула:
H2CuO2
CAS# 20427-59-2
Категории:
Гидроксиды
PubChem CID: 164826
| ChemSpider ID: 144498
| CB7455575
Названия
Русский:
- Гидроксид меди(II) [Wiki]
English:
- Bactecide
- Blue Shield
- Blue Shield DF
- Champ
- Champ DP
- Champ Dry Prill
- Champ FormulaII
- Champion 50 WP
- Comac Parasol
- Copper dihydroxide
- Copper monohydroxide
- Copper(2+) hydroxide
- Copper(I) hydroxide
- Copper(II) hydroxide [Wiki]
- Copper(II) hydroxide(Cu(OH)2)
- Copperhydroxide
- Cupravit Blue
- Cupravit blau
- Cupric hydroxide
- Cupric hydroxide(Cu(OH)2)
- Cuprous hydroxide
- Cuzin
- EINECS:243-815-9
- Funguran OH
- GX 306062E
- KOP Hydroxide
- KOP Hydroxide WP
- Kocide
- Kocide 101
- Kocide 101PM
- Kocide 2000
- Kocide 3000
- Kocide Bordeaux
- Kocide DF
- Kocide LF
- Kocide SD
- Kuprablau
- Nu-Cop
- SPU 02310F0OD
- SPU 02540F
- SPU 02690F
- Spin Out FP
- Wetcol
- copper(2+) dihydroxide(IUPAC)
- copper;dihydroxide(IUPAC)
Варианты формулы:
Cu(OH)2
$L(1.2)H/O^-Cu^++/0O`^-H
HO-Cu-OH
Химический состав
Реакции, в которых участвует Гидроксид меди(II)
-
2Cu(OH)2 + K2S2O6(O2) + 2KOH -> Cu2O3 + 2K2SO4 + 3H2O
-
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
Cu(OH)2 «T»-> CuO + H2O
-
{M}{X}2 + 2{R}OH -> {M}(OH)2″|v» + 2{R}{X}
, где M =
Cu Cd Cr; X =
Cl F Br I; R =
Li Na K Rb Cs -
HCOH + 4Cu(OH)2 -> CO2 + 2Cu2O + 5H2O
И ещё 9 реакций…
Содержание
- Получение
- Физические свойства
- Химические свойства
- Токсичность
Гидроксид меди(I) — неорганическое соединение, гидроксид металла меди с формулой CuOH, жёлтое вещество, не растворяется в воде.
| Гидроксид меди(I) | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидроксид меди(I) |
| Традиционные названия | Гидроокись меди |
| Хим. формула | CuOH |
| Физические свойства | |
| Состояние | жёлтое вещество |
| Молярная масса | 80,55 г/моль |
| Плотность | 3,368; 3,37 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 100; 360 °C |
| Классификация | |
| Рег. номер CAS | 12125-21-2 |
| ChemSpider | 8031144 |
Получение
- Обработка хлорида меди(I) щёлочью на холоде:
-
- в некоторых источниках утверждается, что при этом образуется гидратированная форма закиси меди Cu2O•xH2O.
Физические свойства
Гидроксид меди(I) — жёлтое кристаллическое вещество, не растворимое в воде.
Химические свойства
- Разлагается при нагревании или кипячении:
- Растворяется в растворе аммиака:
-
- бесцветный раствор быстро синеет из-за окисления меди. Степень окисления в растворе +2.
Токсичность
Как и большинство соединений меди, гидроксид меди (I) небезопасен.
Гидроксид меди – это неорганическое соединение меди. Существует несколько разновидностей гидроксидов, все они используются в основном в химической промышленности в качестве реагента. Вещество активно используют для получения красителей, оно обладает каталитической активностью, поэтому ускоряет протекание реакций. Его также применяют в сельском хозяйстве как инсектицид, фунгицид.
Содержание
- Что такое гидроксид меди, виды, формулы
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение гидроксида меди II
- Применение
- Применение меди гидроксида в садоводстве
- Применение меди гидроксида в химии и других сферах
- Токсичное воздействие и опасность гидроксидов меди
- Где купить и сколько стоит
- Заключение
Что такое гидроксид меди, виды, формулы
Гидроксид меди представляет собой соединение атома меди с гидроксильной группировкой. Медь существует преимущественно в двух валентностях I и II, редко встречаются III. Валентность означает потенциальную возможность образовать связь с определённым количеством атомов: одним, двумя, тремя. Химическая формула гидроксида меди (I) – CuOH, гидроксида меди (II) – Cu(OH)2.
Гидроксид меди (II) известен с древних времён. Его впервые синтезировали в 5000 годах до н.э. Он встречается в природе в медьсодержащих минералах: в азуритах (2CuCO3 ∙ Cu(OH)2) , малахитах (CuCO3 ∙ Cu(OH)2) , брошантитах (CuSO4 ∙ 3Cu(OH)2). Помимо гидроксида они включают различные примеси, в чистом виде обнаружен в спертините. Спертинит довольно редок, состоит из мельчайших голубоватых таблитчатых кристалликов, покрывающих коркой различные горные породы. Он распространён в США, Германии, Намибии, Казахстане.
Физические свойства, внешний вид
Гидроксид меди (I) – это мелкие кристаллы желтоватого или оранжевого цвета без вкуса и запаха, из-за содержания загрязнителей часто темнеет. Они нестабильны, быстро распадаются, нерастворимы в воде и других полярных растворителях. Термолиз происходит при 100 °С, плотность 3,36 г/см3.
Гидроксид меди (II) – ромбические голубые или ярко-синие кристаллы, их плотность – 3,37 г/см3. Свойство меди гидроксида растворяться в воде не выражено, смешивается с концентрированной кислотой, сильными щелочами, а также аммиаком. Разлагается при нагревании свыше 70 °С. В водной среде при повышении температурного режима образует суспензию, взесь.
Химические свойства, реакции
Гидроксид меди (II) обладает амфотерностью, т.е. способен взаимодействовать как с кислотами, так и со щелочами. Данное свойство меди гидроксида проявляется в реакции с сероводородом:
Cu(OH)2 + H2S → CuS + 2H2O
По схожему механизму протекает реакция с серной кислотой:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Гидроксид меди реагирует с газами: с диоксидом углерода, при этом выделяется гидроксокарбонат:
Cu(OH)2 + CO2 → (CuOH)2CO3 +H2O
Гидроксид меди реагирует с раствором аммиака, в результате чего образуется реактив Швейцара – тетрааммиакат:
Cu(OH)2 + 4NH4 → [Cu(NH3)4](OH)2
Гидроокись меди реагирует с концентрированным едким натром, формируя тетрагидроксокупрат:
Cu(OH)2 + NaOH → Na2[Cu(OH)4]
Гидроксид меди реагирует с кислородом, преобразуясь в оксид:
Cu(OH)2 + O2 → Cu2O3↓ + 2H2O
Во влажной среде возможен переход в трёхвалентное состояние:
Cu(OH)2 + O2 → 4CuO(OH)↓ + H2O
При разогревании вещество распадается, это описывается уравнением реакции:
Cu(OH)2 → CuO + H2O
Гидроксид меди (I) реагирует с меньшим количеством веществ из-за сниженной активности. Он спонтанно разлагается при получении:
2CuOH → Cu2O + H2O
При взаимодействии с аммиаком одновалентный гидроксид даёт иной продукт:
CuOH + 2NH3 → [Cu(NH3)2]OH
Производство и получение гидроксида меди II
Молекула гидроксида меди и структурная формула
В лабораторных условиях гидроксид меди получают путём ионного обмена из сульфатов. Например, при реакции приливания к сульфату меди каустической соды:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Возможен синтез гидроокиси с помощью окисления перманганатом калия медной закиси:
2Сu2O + 2KMnO4 + 7H2O → 6Cu(OH)2↓ + 2MnO + 2KOH
Свойство меди гидроксида выпадать в осадок используется при добыче его из реакции смеси медного купороса и известкового молока:
CuSO4 + Ca(OH)2 → Cu(OH)2↓ + CaSO4
Применение
Гидроксиды меди активно используются в химических отраслях промышленности. Они необходимы как незаменимые звенья в цепочках превращений многих ценных соединений. Наиболее востребован гидроксид меди II, что связано с его большей устойчивостью. Он выполняет функции протравы и красителя, катализатора, реагента в целлюлозно-бумажном производстве.
Применение меди гидроксида в садоводстве
Гидроксид меди – это пестицид, средство, подавляющее патогенные микроорганизмы и замедляющие рост сорняков. Он необходим для нормального роста и развития культурных растений, для защиты их от насекомых-вредителей и опасных вирусных и бактериальных заболеваний.
Механизм действия основан на специфических химических свойствах: гидроксид меди связывается с аминогруппами и сульфгидрильными группами патогенов, блокируя нормальную жизнедеятельность клеток. В связи с этим размножение грибков и штаммов бактерий останавливается и симптомы отступают, растение возвращается в норму.
Вещество применяют для профилактической обработки и лечения плодово-ягодных культур и виноградников, он эффективен против следующих заболеваний:
- монилиоз;
- парша;
- ложная мучнистая роса (милдью);
- паутинный клещ;
- оидиум;
- аспергиллёзная, чёрная и белая гниль;
- вертициллёз.
Обработка проводится путём опрыскивания дважды в день: утром и вечером в сухую погоду при температуре воздуха, не превышающей 25 °С. Препарат не оказывает негативного влияния на сами культуры, не проявляет фитотоксичности.
Применение меди гидроксида в химии и других сферах
Гидроксид меди нужен в органике, неорганике и аналитике. Вещество повышает скорость синтеза ароматических циклов, в том числе антрахинона – важного растворителя и пигмента. Медный гидроксид функционирует как сырьё в производстве карбоновых кислот из гидразидов. Он обеспечивает стабильно высокий выход продукта при попытках выделить бензойную и октановую кислоты.
Применение меди гидроксида усиливает интенсивность цвета красителей и фиксирует окраску стеклянных и керамических изделий. При переработке целлюлозы внесение данного вещества способствует отбеливанию древесной массы и получению идеально белых листов.
Токсичное воздействие и опасность гидроксидов меди
Гидроксид меди относится ко 2 классу опасности (высокоопасные). Они токсичны для человека и многих животных, в том числе для рыб, пчёл и млекопитающих. При проглатывании внутрь большого количества появляется характерный комплекс симптомов:
- рвота;
- внутренние кровотечения;
- низкое давление;
- сильная боль в животе;
- диарея;
- кома.
При отравлении гидроксидом меди следует немедленно обратиться за помощью к врачу, поскольку оно может привести к летальному исходу.
Где купить и сколько стоит
Гидроксид меди продаётся в специализированных магазинах лабораторных реактивов. Стоимость 1 кг составляет 920 рублей.
Заключение
Гидроксид меди – это востребованное в различных отраслях деятельности соединение. Чаще всего оно используется в лабораториях для выделения других веществ, также применяется в сельскохозяйственной сфере для обработки растений от вредителей, дезинфекции аквариумов от патогенных микрофлоры и нематод. Гидроокись опасна для организма, с ней работают в защитной одежде.
Читайте также:
- Медный купорос: описание, применение, польза и вред, инструкция
- Хлорид алюминия: свойства, применение
- Сульфат алюминия: свойства, применение
- Нитрат серебра: свойства, реакции, инструкция, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
Гидроксид меди (II)
Гидроксид меди (II) Сu(OН)2 — голубое аморфное или кристаллическое вещество. Практически нерастворим в воде.
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O