| Гидроксид серебра | |
|---|---|
| Систематическое наименование |
Гидроксид серебра |
| Традиционные названия | Гидроокись серебра |
| Хим. формула | AgOH |
| Рац. формула | AgOH |
| Состояние | белый аморфный осадок |
| Молярная масса | 124,88 г/моль |
| Энтальпия | |
| • образования | -124,36 кДж/моль |
| Рег. номер CAS | 12258-15-0 |
| PubChem | 10129950 |
| SMILES |
[OH-].[Ag+] |
| InChI |
1S/Ag.H2O/h;1H2/q+1;/p-1 UKHWJBVVWVYFEY-UHFFFAOYSA-M |
| ChemSpider | 8305469 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидроксид серебра — неорганическое соединение, гидроксид серебра с формулой AgOH, белый аморфный осадок, разлагается в воде. Проявляет амфотерные свойства. Вещество неустойчиво и при его получении в водной среде при помощи реакций обмена гидролизуется водой до оксида серебра I. Однако в безводном метаноле или этаноле гидроксид серебра устойчив.
Иногда под гидроксидом серебра имеют ввиду смесь оксида с водой: ½Ag2O+½H2O
Получение
- Реакция в безводном этаноле нитрата серебра I и гидроксида калия:
-
- AgNO3 + KOH →−50oC AgOH↓ + KNO3
- Осторожное добавление раствора аммиака к раствору соли серебра I:
-
- AgNO3 + NH3 ⋅ H2O →−50oC AgOH↓ + NH4NO3
Химические свойства
Разлагается в воде:
-
- 2 AgOH → Ag2O↓ + H2O
Проявляет амфотерные свойства:
- реагирует с кислотными оксидами, например, поглощает углекислый газ:
-
- 2 AgOH + CO2 → Ag2CO3↓ + H2O
- реагирует с концентрированным раствором аммиака, образуя аммиачный комплекс:
-
- AgOH + 2 (NH3 ⋅ H2O ) → [Ag(NH3)2]OH + 2 H2O
- реагирует с сульфидами щелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
Гидроксид серебра — неорганическое соединение, гидроксид серебра с формулой AgOH, белый аморфный осадок, разлагается в воде. Вещество неустойчиво и при его получении в водной среде при помощи реакций обмена разлагается водой до оксида серебра. Однако в безводном метаноле или этаноле гидроксид серебра устойчив.
| Гидроксид серебра | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидроксид серебра |
| Традиционные названия | Гидроокись серебра |
| Хим. формула | AgOH |
| Рац. формула | AgOH |
| Физические свойства | |
| Состояние | белый аморфный осадок |
| Молярная масса | 124,88 г/моль |
| Термические свойства | |
| Энтальпия | |
| • образования | -124,36 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12258-15-0 |
| PubChem | 10129950 |
| SMILES |
[OH-].[Ag+] |
| InChI |
1S/Ag.H2O/h;1H2/q+1;/p-1 UKHWJBVVWVYFEY-UHFFFAOYSA-M |
| ChemSpider | 8305469 |
Иногда под гидроксидом серебра имеют ввиду смесь оксида с водой: ½Ag2O+½H2O
Получение
- Реакция в безводном этаноле нитрата серебра(I) и гидроксида калия:
- Осторожное добавление раствора аммиака к раствору соли серебра(I):
Химические свойства
- Разлагается в воде:
- реагирует с кислотными оксидами, например, поглощает углекислый газ:
- реагирует с концентрированным раствором аммиака, образуя аммиачный комплекс:
- реагирует с сульфидами щелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
| Гидроксид серебра | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид серебра |
| Традиционные названия | Гидроокись серебра |
| Химическая формула | AgOH |
| Физические свойства | |
| Состояние (ст. усл.) | белый аморфный осадок |
| Молярная масса | 124,88 г/моль |
| Термические свойства | |
| Энтальпия образования (ст. усл.) | -124,36 кДж/моль |
Гидроксид серебра — неорганическое соединение, гидроокись металла серебра с формулой AgOH, белый аморфный осадок, не растворяется в воде.
Получение
- Реакция в этаноле нитрата серебра(I) и гидроокиси калия:
Физические свойства
Гидроксид серебра образует белый аморфный осадок.
Не растворяется в воде.
Химические свойства
Проявляет амфотерные свойства:
- реагирует с кислотообразующими окислами, например, поглощает углекислый газ:
- реагирует с сульфидами щелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
|
Соединения серебра |
|---|
|
Азид серебра (AgN3) • Амид серебра (AgNH2) • Антимонид серебра(I) (Ag3Sb) • Арсенат серебра(I) (Ag3AsO4) • Арсенид серебра(I) (Ag3As) • Ацетат серебра (AgC2H3O2) • Ацетиленид серебра (Ag2C2) • Бихромат серебра (Ag2Cr2O7) • Бромид серебра(I) (AgBr) • Бромат серебра (AgBrO3) • Гидроксид серебра (AgOH) • Гидрофосфат серебра (Ag2HPO4) • Дигидрофосфат серебра (AgH2PO4) • Дифторид серебра (AgF2) • Иодид серебра(I) (AgI) • Иодат серебра (AgIO3) • Карбонат серебра(I) (Ag2CO3) • Метафосфат серебра (AgPO3)• Молибдат серебра (Ag2MoO4) • Нитрат серебра(I) (AgNO3) • Нитрат серебра(II) (Ag(NO3)2) • Нитрид серебра(I) (Ag3N) • Нитрит серебра(I) (AgNO2) • Оксид серебра(I) (Ag2O) • Оксид серебра(III)-серебра(I) (Ag2O2) • Оксалат серебра (Ag2C2O4) • Ортоарсенит серебра(I) (Ag3AsO3) • Ортофосфат серебра(I) (Ag3PO4) • Периодат серебра (AgIO4) • Перманганат серебра (AgMnO4) • Перхлорат серебра (AgClO4) • Субфторид серебра (Ag2F) • Сульфид серебра(I) (Ag2S) • Сульфид серебра(II) (AgS) • Сульфат серебра (Ag2SO4) • Селенит серебра (Ag2SeO3) • Селенат серебра (Ag2SeO4) • Теллурид серебра(I) (Ag2Te) • Тиосульфат серебра (Ag2S2O3) • Тиоцианат серебра(I) (AgSCN) • Тритиоортоарсенит серебра(I) (Ag3AsS3) • Фосфид серебра (Ag3P) • Фторид серебра(I) (AgF) • Фульминат серебра (AgONC) • Хлорид серебра(I) (AgCl) • Хлорат серебра (AgClO3) • Хромат серебра (Ag2CrO4) • Цианид серебра (AgCN) |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Гидроксид серебра
Брутто-формула:
HAgO
CAS# 12673-77-7
Названия
Русский:
- Гидроксид серебра [Wiki]
- Гидроокись серебра
English:
- Silver hydroxide [Wiki]
- Silver(1+) hydroxide
- silver;hydroxide(IUPAC)
Варианты формулы:
Реакции, в которых участвует Гидроксид серебра
-
2AgOH <-> Ag2O»|v» + H2O
-
AgNO3 + KOH «-45^oC»—> AgOH»|v» + KNO3
-
2AgOH + CO2 -> Ag2CO3 + H2O
-
2AgOH -> Ag2O + H2O
| Гидроксид серебра (I) | |
| Идентификация | |
|---|---|
| Название ИЮПАК | Гидроксид серебра (I) |
| Н о CAS | 12258-15-0 |
| PubChem | 12049100 |
| Улыбки | |
| ИнЧИ | |
| Химические свойства | |
| Грубая формула | Ag OH |
| Молярная масса | 124,8755 ± 0,0006 г / моль H 0,81%, Ag 86,38%, O 12,81%, |
| Диполярный момент | D |
| Молекулярный диаметр | нм |
| Физические свойства | |
| Растворимость | плохо растворим в воде и метаноле |
| Объемная масса | г см −3 |
| Теплопроводность | Вт м −1 К −1 |
| Скорость звука | м с −1 |
| Термохимия | |
| S 0 газ, 1 бар | Дж К −1 моль −1 |
| S 0 жидкость, 1 бар | Дж К −1 моль −1 |
| S 0 твердый | Дж К −1 моль −1 |
| Δ f H 0 газ | кДж моль −1 |
| Δ f H 0 жидкость | кДж моль −1 |
| Δ f H 0 твердый | кДж моль −1 |
| C p | Дж К −1 моль −1 |
|
|
|
| Единицы СИ и STP, если не указано иное. | |
Гидроксида серебра (I) , представляет собой неорганическое соединение по формуле AgOH. Это коричневатое твердое вещество, нестабильное и плохо растворимое.
Синтез
Гидроксид серебра можно получить электролизом .
Его также можно получить реакцией раствора нитрата серебра с раствором, эквимолярным по отношению к гидроксиду натрия . Осадок гидроксида серебра затем формируется, в равновесии с образованием осадка оксида серебра (I).
- 2 Ag + + 2 HO — → 2 AgOH ↓ H 2 O
+ Ag 2 O ↓
Это последнее равновесие между оксидом серебра и гидроксидом серебра имеет константу реакции 1,33 × 10 -3 , зная, что AgOH менее растворим в воде, чем Ag 2 O:
- 2 AgOH H 2 O
+ Ag 2 O ↓ (pKs = 2,875)
Полученный таким образом осадок экстрагируют, затем очищают водой и метанолом .
Также можно проводить эту реакцию в безводном этаноле , предотвращая образование оксида серебра.
Примечания и ссылки
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ^ AF Holleman, E. Wiberg, Неорганическая химия , Academic Press, Сан-Диего, 2001 ( ISBN 0-12-352651-5 ) .
- ↑ Джордж Бидерманн, Ларс Гуннар Силлен: Исследования гидролиза ионов металлов. Часть 30. Критический обзор равновесия растворимости Ag 2 O. In: Acta Chemica Scandinavica. 1960, 14, с. 717, DOI : 10.3891 / acta.chem.scand.14-0717 .
- ^ (De) AF Holleman, E. Wiberg, Nils Wiber, Lehrbuch der Anorganischen Chemie , Walter de Gruyer, Berlin New York 1985, 100. Aufl., Seite 1014.
- (de) Эта статья частично или полностью взята из статьи в Википедии на немецком языке под названием « Silberhydroxid » ( см. список авторов ) .
| Структурная формула | |||||||||
|---|---|---|---|---|---|---|---|---|---|
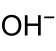
|
|||||||||
| Общий | |||||||||
| Фамилия | Гидроксид серебра | ||||||||
| Другие названия |
Гидроксид серебра (I) |
||||||||
| Молекулярная формула | AgOH | ||||||||
| Внешние идентификаторы / базы данных | |||||||||
|
|||||||||
| характеристики | |||||||||
| Молярная масса | 124,88 г моль -1 | ||||||||
| Физическое состояние |
твердо |
||||||||
| значение pK s |
3,96 (25 ° С) |
||||||||
| растворимость |
плохо растворяется в воде и метаноле |
||||||||
| Инструкции по технике безопасности | |||||||||
|
|||||||||
| Насколько это возможно и обычно, используются единицы СИ . Если не указано иное, приведенные данные относятся к стандартным условиям . |
Гидроксид серебра (гидроксид серебра (I)), химическая формула AgOH , является основанием , как гидроксид из серебра . Нестабильное, коричневатое и труднорастворимое твердое вещество может для. Б. электролитически или из нейтрального водного раствора нитрата серебра с эквимолярной добавкой основания NaOH . Гидроксид серебра находится в равновесии с также плохо растворимым, более стабильным оксидом серебра (I) Ag 2 O, при этом вода отщепляется .
Для равновесной реакции гидроксида серебра с оксидом серебра константа равновесия K составляет 1,33 · 10 -3 , при этом в равновесном растворе содержится значительно меньше Ag 2 O, чем AgOH.
презентация
- Нитрат серебра растворяется в воде. Этот раствор нитрата серебра при перемешивании примешивают к раствору гидроксида натрия . Образовавшийся осадок гидроксида серебра отсасывают, промывают водой, а затем метанолом.
- Гидроксид серебра можно осаждать из безводного спиртового раствора без образования оксида серебра.
Реакции
Суспензия оксида серебра (I) в воде имеет явно щелочную реакцию, поскольку реакция, обратная реакции, указанной выше, для оксида серебра образует основной гидроксид серебра.
Осадков из AgOH из водного раствора начинается при рН 8,3 и завершается при рН 11,3. В виде амфотерного гидроксида AgOH возвращается в раствор при еще более высоких значениях pH; при избытке сильнощелочного раствора гидроксида серебра образуется растворимый анион гидроксида серебра [Ag (OH) 2 ] — :
При добавлении концентрированного раствора аммиака водорастворимый комплекс диамминсеребра (I) [Ag (NH 3 ) 2 ] + образуется из гидроксида серебра .
Использование в препаративной химии
- Соответствующие гидроксиды могут быть легко получены из водорастворимых галогенидов хлорида , бромида и йодида в метанольном растворе с суспензией оксида серебра и без побочных реакций.
- Замещение хлора или йод лиганд (-Cl или -I) с помощью гидроксильной группы (-ОН) возможно в некоторых органических соединениях пути взаимодействия с AgOH (примерами: Реакция chlorosuccinic кислоты с проводами гидроксида серебра к яблочной кислоте с образование AgCl; превращение йодэтана в этанол ).
- Галогениды четвертичного аммония могут быть преобразованы в соответствующие не содержащие галогенидов гидроксиды четвертичного аммония с помощью AgOH.
- Историческая возможность представления коллоидного серебра : в щелочном растворе натриевой соли протальбиновой или лизальбиновой кислоты гидразингидрат восстанавливает AgOH до коллоидного серебра, которое очень устойчиво.
- Тартроновая кислота (гидроксималоновая кислота) производится гидролизом монобромалоновой кислоты гидроксидом серебра.
Смотри тоже
- Отличный образец : доказательства альдегидов или восстановления функциональных групп за счет восстановления ионов серебра (I) до металлического серебра
- Циклопропен : синтез циклопропена с гидроксидом серебра и метилиодидом (CH 3 I)
Индивидуальные доказательства
- ^ Жан Д’Анс, Эллен Лакс: Карманный справочник для химиков и физиков . Springer DE, 1997, ISBN 3-540-60035-3 , стр. 1057 ( ограниченный предварительный просмотр в поиске Google Книг).
- ↑ a b Chemical Abstracts, Volume 95, No. 19 ноября 1981 г., Колумбус, Огайо, США, M. MASSACCESI «Двухфазное титрование некоторых соединений четвертичного аммония в присутствии аминов или других соединений четвертичного аммония», стр. 437.
- ↑ Это вещество либо еще не классифицировано с точки зрения его опасности, либо надежный и цитируемый источник еще не найден.
- ↑ Теория коллоидного серебра
- ↑ а б в А. Ф. Холлеман , Э. Виберг , Н. Виберг : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1460.
- ^ Джордж Бидерманн, Ларс Гуннар Силлен: Исследования по гидролизу ионов металлов. Часть 30. Критический обзор равновесия растворимости Ag 2 O. In: Acta Chemica Scandinavica. 1960, 14, стр. 717, DOI : 10.3891 / acta.chem.scand.14-0717 .
- ↑ Яндер Блазиус, учебник по аналитической и препаративной неорганической химии , Штутгарт-Лейпциг, 1995, 14-е издание
- ↑ Römpp Lexikon Chemie , Vol. 5, 9-е издание, p. 4159.
- ↑ Получение четвертичных аммониевых солей без галогенидов
- ↑ К. Паал, О коллоидном серебре , Бер. Немецкий Chem. Gesellsch. 35 (1902), стр. 2224-2236.
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Гидроксид серебра
| Гидроксид серебра | |
|---|---|
| Систематическое наименование |
Гидроксид серебра |
| Традиционные названия | Гидроокись серебра |
| Хим. формула | AgOH |
| Рац. формула | AgOH |
| Состояние | белый аморфный осадок |
| Молярная масса | 124,88 г/моль |
| Энтальпия | |
| • образования | -124,36 кДж/моль |
| Рег. номер CAS | 12258-15-0 |
| PubChem | 10129950 |
| SMILES | |
| ChemSpider | 8305469 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Гидроксид серебра — неорганическое соединение, гидроксид серебра с формулой AgOH, белый аморфный осадок, разлагается в воде. Проявляет амфотерные свойства. Вещество неустойчиво и при его получении в водной среде при помощи реакций обмена гидролизуется водой до оксида серебра I. Однако в безводном метаноле или этаноле гидроксид серебра устойчив.
Иногда под гидроксидом серебра имеют ввиду смесь оксида с водой: ½Ag2O+½H2O
Содержание
Получение
- Реакция в безводном этаноле нитрата серебра I и гидроксида калия:
AgNO3 + KOH → −50oC AgOH↓ + KNO3
- Осторожное добавление раствора аммиака к раствору соли серебра I:
AgNO3 + NH3 ⋅ H2O → −50oC AgOH↓ + NH4NO3
Химические свойства
Разлагается в воде:
Проявляет амфотерные свойства:
- реагирует с кислотными оксидами, например, поглощает углекислый газ:
2 AgOH + CO2 → Ag2CO3↓ + H2O
- реагирует с концентрированным раствором аммиака, образуя аммиачный комплекс:
AgOH + 2 (NH3 ⋅ H2O ) → [Ag(NH3)2]OH + 2 H2O
- реагирует с сульфидами щелочных металлов с образованием аргенатов Ag2O•3Na2O и Ag2O•2Na2O
Реакция термического разложения оксида серебра (I)
Реакция термического разложения оксида серебра (I)
Уравнение реакции термического разложения оксида серебра (I):
Реакция термического разложения оксида серебра (I).
В результате реакции образуются серебро и кислород.
Реакция протекает при условии: при температуре 160-300 °C.
Формула поиска по сайту: 2Ag2O → 4Ag + O2.
Реакция взаимодействия хлорида скандия (III) и гидроксида натрия
Реакция термического разложения гидроксида галлия
Реакция взаимодействия сероводорода и азотистой кислоты
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
источники:
http://chem.ru/gidroksid-serebra.html
http://chemicalstudy.ru/reaktsiya-termicheskogo-razlozheniya-oksida-serebra-i/







![{ displaystyle mathrm {AgOH + OH ^ {-} longrightarrow [Ag (OH) _ {2}] ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ac5897434a5d89121b744f64797252c41e816b4)
![{ displaystyle mathrm {AgOH + 2 NH_ {3} longrightarrow [Ag (NH_ {3}) _ {2}] ^ {+} + OH ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f2d41e85ee01d7aa591b35bb3cec2fdcb44666b)
